PERUBAHAN KADAR HISTAMIN DAN BAKTERI PENGHASIL
HISTAMIN DARI PINDANG BADENG
TONGKOL (Auxis rochei) SELAMA PENYIMPANAN
YULIAN SYALVIANA FATUNI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Perubahan Kadar Histamin dan Bakteri Penghasil Histamin dari Pindang Badeng Tongkol (Auxis rochei) Selama Penyimpanan adalah benar karya saya dengan arahan dari komisi
pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2014
Yulian Syalviana Fatuni
Kata kunci: Histamin, bakteri, pindang ikan tongkol (Auxis rochei)
RINGKASAN
YULIAN SYALVIANA F. Perubahan Kadar Histamin dan Bakteri Penghasil Histamin dari Pindang Badeng Tongkol (Auxis rochei) Selama Penyimpanan. Dibimbing oleh RUDDY SUWANDI dan AGOES M. JACOEB.
Pindang merupakan produk olahan semi basah yang mudah membusuk jika tidak ditangani dan diolah dengan baik. Kebusukan ikan disebabkan oleh aktivitas mikroba dan enzim yang menghasilkan senyawa biogenik amin. Senyawa tersebut terbentuk dari dekarboksilasi asam amino bebas yang terdapat di dalam tubuh ikan. Salah satu senyawa biogenik amin yang sering terbentuk di dalam tubuh ikan adalah histamin. Akumulasi histamin yang tinggi pada ikan dapat menyebabkan keracunan jika dikonsumsi.
Penelitian ini bertujuan untuk menganalisis pengaruh penyimpanan terhadap kadar histamin dan bakteri penghasil histamin dari pindang badeng tongkol (Auxis rochei). Penelitian dilakukan pada bulan Desember 2013 hingga
April 2014. Ikan tongkol segar (Auxis rochei) diperoleh dari hasil penangkapan kapal satu hari melaut dengan alat mini purse seine di TPI Cisolok Palabuhanratu. Penelitian ini dibagi menjadi dua tahap; tahap pertama penyimpanan ikan tongkol segar pada waktu 0, 8, 16, 24, 32 jam (sebagai kontrol) dan dilakukan pengujian organoleptik, TPC, TVB dan kadar histamin. Penelitian lanjutan terdiri dari tiga tahap. Tahap pertama yaitu pemindangan ikan dengan penambahan garam 25% pada waktu yang berbeda (2, 5, dan 8 jam), kemudian melakukan pengujian histamin dan penentuan jumlah bakteri. Hasil terbaik dari tahap pertama dilanjutkan pada tahap kedua. Tahap kedua, dilakukan penyimpanan ikan pindang pada suhu ruang dalam waktu 0, 8, 16, 24, 32 jam dan menganalisis nilai organoleptik, histamin, TPC dan TVB. Sampel dengan kadar histamin tertinggi dianalisis pada tahap 3, seleksi dan identifikasi bakteri penghasil histamin. Pengaruh pH, suhu dan konsentrasi NaCl terhadap pertumbuhan bakteri, serta menentukan produksi histamin oleh bakteri, kemudian setiap jenis bakteri diinokulasi pada ikan pindang dan dianalisis jumlah bakterinya.
Hasil penelitian menunjukkan bahwa penyimpanan ikan segar pada suhu kamar dapat menyebabkan peningkatan histamin, TVB dan aktivitas mikroba. Kadar histamin tidak akan hilang setelah pemindangan dan kadar histamin akan meningkat selama penyimpanan pada suhu kamar. Kadar histamin meningkat setelah waktu penyimpanan 8 jam berbeda dengan ikan tanpa perlakuan (p<0,05). Jumlah bakteri meningkat secara signifikan setelah 24 jam (p<0,05). Kadar TVB meningkat secara signifikan pada 8 jam sampai 32 jam penyimpanan. Teridentifikasi 6 jenis isolat bakteri pembentuk histamin yang terdapat pada ikan pindang tongkol yang telah disimpan selama 32 jam. Ikan pindang yang disimpan selama 32 jam menghasilkan 6 jenis isolat bakteri dan diduga merupakan P. vulgaris, H. alvei, M. morganii, E. aerogenes, K. oxytoca, K. pneumoniae. Hasil
SUMMARY
YULIAN SYALVIANA F. Changes of Histamine Content and Histamine Forming Bacteria in Boiled Badeng Tuna (Auxis rochei) During Storage. Supervised by RUDDY SUWANDI and AGOES M. JACOEB.
Pindang is an intermediate moisture product which is highly perishable if its handling and processing are not sufficient. The deterioration caused by the activities of microbes and enzyme produce biogenic amine compounds. The compounds creates from decarboxilation of amino acids in fish. One of the biogenic amine compounds is histamine. The high accumulation of histamine in fish is harmfull if consumed.
The objective of this research was to analyze the storage effect of the histamine content and histamine-producing bacteria from the boiled tuna (Auxis rochei). This research was conducted in December 2013 to April 2014. Fresh fish tuna obtained from one day fishing by mini purse seine in TPI Cisolok Palabuhanratu.
This research was devided into two stages; the first stage was keeping fresh tuna in 0, 8, 16, 24, 32 hours as control and test of organoleptic, TPC, TVB and histamine levels. The second stage of the research composed of three steps. The first step was boling fish in 25% salt addition at different time (2, 5, and 8 hours), then histamine test and determination of bacterial count. The best results of the first step continued to the second step. The second step, boiled fish were storaged at room temperature in 0, 8, 16, 24, 32 hours and its organoleptic value, histamine, TPC and TVB were analyzed. Sample with highest histamine content were analyzed in step 3, in which the histamine-producing bacteria were selected and identified. The influence of pH, temperature and NaCl concentration to the bacterial growth, histamine production were determined. Each species of bacteria was inoculated in boiled fish and its bacterial count analyzed.
The results showed that storaging of fresh fish at room temperature caused in increasing of histamine, TVB levels and microbial activity. The histamine level didn’t lose after boiling and its level were increase during storage at room temperature. Histamine level were increase after storage time 8 hours and was haighly different with fish without storage treatment (p<0.05). Its level continued until 32 hours storage time. Bacterial count increased significantly after 24 hours (p<0.05). Its TVB-level increased significantly at 8 hours storage time and continue until 32 hours storage time. Boiled fish at 32 hours storage time shown 6 bacterial isolate and were expected as P. vulgaris, H. alvei, M. morganii, E.aerogenes, K. oxytoca, K. pneumoniae. Test on the abbility of 6 bacterial isolate to form histamine shown that K. pneumoniae produced the highest histamin level (132 mg/kg), while H. Alvei formed the lowest histamine level (78 mg/kg).
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Hasil Perairan
PERUBAHAN KADAR HISTAMIN DAN BAKTERI PENGHASIL
HISTAMIN DARI PINDANG BADENG
TONGKOL (Auxis rochei) SELAMA PENYIMPANAN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Perubahan Kadar Histamin dan Bakteri Penghasil Histamin dari Pindang Badeng Tongkol (Auxis rochei) Selama Penyimpanan Nama : Yulian Syalviana Fatuni
NIM : C351120261
Disetujui oleh Komisi Pembimbing
Dr Ir Ruddy Suwandi, MS MPhil Ketua
Dr Ir Agoes M Jacoeb, Dipl Biol Anggota
Diketahui oleh
Ketua Program Studi Teknologi Hasil Perairan
Dr Ir Wini Trilaksani, MSc
Dekan Sekolah Pascasarjana,
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur kepada Tuhan Yang Maha Esa karena berkat rahmat dan karunianya penulis dapat menyelesaikan tesis dengan judul Perubahan Kadar Histamin dan Bakteri Penghasil Histamin dari Pindang Badeng Tongkol (Auxis rochei) Selama Penyimpanan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada Bapak Dr Ir Ruddy Suwandi MS MPhil dan Bapak Dr Ir Agoes M. Jacoeb Dipl Biol
sebagai dosen pembimbing yang senantiasa memberikan arahan, motivasi serta bimbingan dalam penyusunan tesis ini.
Terima kasih penulis ucapkan kepada Dr Ir Wini Trilaksani MSc selaku ketua Program Studi Teknologi Hasil Perairan, Ibu Dr Ir Iriani Setyaningsih MS dan Bapak Rudy Nitibaskara sebagai dosen penguji luar komisi dan dosen penguji tamu yang telah banyak memberikan saran dan perbaikan dalam penyelesaian tesis ini.
Terima kasih penulis ucapkan kepada keluarga besar Dedi Rustandi SPi dari KBU Pelabuhanratu Jawa Barat, Staf pegawai Laboratorium Palabuhan Perikanan Nusantara Palabuhanratu Jawa Barat, Bapak Agus Somantri dari Laboratorium Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan IPB dan Ibu Ema Masruroh dari Laboratorium Bioteknologi Perikanan dan Ilmu Kelautan IPB yang menyediakan fasilitas untuk penelitian. Terima kasih kepada PT Antam Tbk yang telah memberikan dana beasiswa. Penghargaan yang sebesar-besarnya penulis ucapkan kepada ayahanda Ali Fatuni SPi MSi dan Ibunda Nurianti serta saudaraku tercinta Indah Priana Fatuni SPd, Nila Triwisdayanti Fatuni dan Hans Aris Rompas SH atas segala doa, kasih sayang, motivasi, pikiran serta dukungan dana dan semangat yang diberikan dalam menyelesaikan tesis ini, serta teman-teman S2 THP 2011 dan 2012 atas kerjasama yang baik selama studi dan semua pihak yang tidak bisa disebutkan satu persatu.
Penulis menyadari bahwa tesis ini masih jauh dari sempurna. Semoga penelitian ini membawa manfaat bagi seluruh civitas IPB khususnya dan masyarakat Indonesia umumnya.
Bogor, Desember 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Hipotesis 3
2 METODE 3
Waktu dan Tempat 3
Bahan dan Alat 3
Tahapan Penelitian 4
Prosedur Analisis 4
3 HASIL DAN PEMBAHASAN 12
Karakteristik Ikan Segar 12
Karakteristik Ikan Pindang 15
Seleksi dan Identifikasi Bakteri Pembentuk Histamin 18
Aktivitas Bakteri Pembentuk Histamin 20
Pengaruh Suhu dan pH pada Pertumbuhan Bakteri Histamin 21 Pengaruh Konsentrasi NaCl pada Pertumbuhan Bakteri Histamin 24 Kadar Histamin pada Bakteri yang Teridentifikasi Sebagai
Penghasil Histamin 24
Pengukuran TPC Sampel Pindang yang diinokulasi dengan Beberapa
Jenis Bakteri 25
4 SIMPULAN DAN SARAN 26
Simpulan 26
Saran 26
DAFTAR PUSTAKA 27
LAMPIRAN 32
DAFTAR TABEL
1 Kadar histamin, TPC dan TVB pada ikan tongkol selama penyimpanan
pada suhu ruang 13
2 Kadar histamin dan TPC pada waktu pemindangan yang berbeda 15 3 Kadar histamin, TPC dan TVB pada ikan pindang selama penyimpanan
pada suhu ruang 17
4 Hasil identifikasi bakteri pembentuk histamin 19 5 Kadar histamin yang diproduksi ke enam jenis isolat bakteri uji 25
DAFTAR GAMBAR
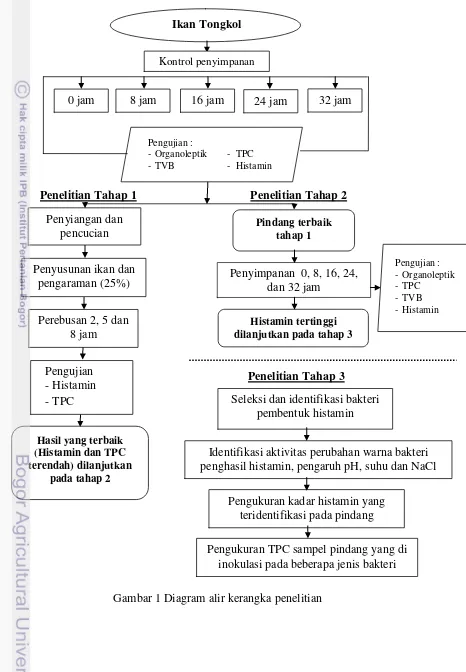
1 Diagram alir kerangka penelitian 5
2 Hasil organoleptik ikan tongkol segar pada penyimpanan suhu ruang 12 3 Hasil organoleptik ikan pindang pada penyimpanan suhu ruang 16 4 Perubahan warna medium dari kuning menjadi merah jambu pada
medium Niven termodifikasi oleh koloni bakteri pembentuk histamin A
(tanpa bakteri) B (adanya bakteri) 18
5 Aktivitas perubahan warna bakteri pembentuk histamin 20 6 Pengaruh suhu dan pH pada pertumbuhan bakteri isolat 1 21 7 Pengaruh suhu dan pH pada pertumbuhan bakteri isolat 2 21 8 Pengaruh suhu dan pH pada pertumbuhan bakteri isolat 3 22 9 Pengaruh suhu dan pH pada pertumbuhan bakteri isolat 4 22 10 Pengaruh suhu dan pH pada pertumbuhan bakteri isolat 5 23 11 Pengaruh suhu dan pH pada pertumbuhan bakteri isolat 6 23 12 Pengaruh konsentrasi NaCl pada pertumbuhan bakteri histamin 24 13 Pengukuran TPC sampel pindang yang di inokulasi pada beberapa jenis
bakteri 26
DAFTAR LAMPIRAN
1 Contoh perhitungan TVB (Total Volatile Base) 32
1
PENDAHULUAN
Latar Belakang
Potensi sumberdaya perikanan di Indonesia cukup besar. Luas wilayah teritorial Indonesia saat ini sekitar 5,8 juta km2 dengan potensi lestari sumberdaya laut Indonesia sebesar 6,5 juta ton/tahun. Potensi yang cukup besar tersebut memerlukan upaya penanganan dan pengolahan produk yang lebih baik. Ikan merupakan salah satu sumber protein yang baik dan mengandung asam amino esensial yang diperlukan oleh tubuh. Mengingat ikan merupakan salah satu bahan pangan yang mudah membusuk, maka perlu dilakukan proses penanganan dan pengolahan yang bertujuan untuk menghambat aktivitas bakteri dan enzim yang dapat menyebabkan kemunduran mutu dan kerusakan (KKP 2013).
Salah satu jenis olahan ikan yang cukup popular di Indonesia adalah ikan pindang. Produk tersebut dalam urutan hasil olahan tradisional menduduki tempat kedua setelah ikan asin. Ikan pindang mempunyai prospek yang lebih baik dari pada ikan asin untuk program peningkatan konsumsi protein masyarakat. Hal ini karena ikan pindang mempunyai cita rasa yang lebih lezat dan tidak begitu asin sehingga dapat dikonsumsi dalam jumlah yang lebih banyak dibandingkan dengan ikan asin, sehingga dapat menjadi sumber protein hewani. Produsen terbesar pindang ikan adalah Jawa (68,43 %), Sumatera (15,34), Bali dan Nusa Tenggara (12,25), Sulawesi (3,39 %), dan Kalimantan (0,04 %) (Anisah dan Susilowati 2007).
Pindang diklasifikasikan sebagai produk olahan semi basah karena pada umumnya daya awet ikan pindang relatif singkat. Kebusukan ikan yang disebabkan oleh aktivitas mikroba dan enzim tersebut menghasilkan senyawa biogenik amin, yang terbentuk dari dekarboksilasi asam amino bebas yang terdapat di dalam tubuh ikan. Senyawa-senyawa biogenik amin tersebut antara lain histamin, kadaverina, putresina, tiramina, triptamina, spermina dan spermidina yang berasal dari asam amino bebas berupa histidin, ornitin, lisin, tirosin, triptofan dan arginin (Visciano et al. 2012).
Senyawa biogenik amin yang paling sering terbentuk pada ikan adalah histamin. Chen et al. (2010) menjelaskan bahwa Histamin terbentuk dari hasil
dekarboksilasi histidin bebas yang banyak terdapat di dalam tubuh ikan terutama jenis ikan yang berasal dari Famili Scombroidae. Veciana et al. (1996)
menjelaskan bahwa ikan-ikan yang termasuk dalam kelompok ini adalah ikan tongkol, kembung, cakalang dan tuna.
Ikan yang mengandung histamin >50 ppm akan dapat mengganggu kesehatan dan dapat menimbulkan keracunan (FDA 2011). Menurut Lehane dan Olley (2000), keracunan histamin dapat dibagi dalam tiga kelompok yaitu keracunan tingkat lemah apabila mengkonsumsi 8-40 ppm, keracunan sedang apabila mengkonsumsi 70-100 ppm dan keracunan kuat apabila mengkonsumsi 150-400 ppm histamin.
Histamin dalam ikan diperoleh dari dekarboksilasi histidin bebas oleh bakteri, antara lain Proteus, Hafnia, Morganella dan Klebsiella terutama pada
jenis ikan yang berasal dari Famili Scombroidae (Ariyani et al. 2004). Jenis-jenis
2
testaceum, Enterobacter spp, Brevibacterium spp, Micrococcus diversus, Staphylococcus sppdan Morganella morgani (Mangunwardoyo et al. 2007).
Masalah yang terjadi di masyarakat pada umumnya adalah ikan pindang dijual dalam keadaan terbuka sehingga mudah tercemar oleh mikroorganisme yang dapat menyebabkan kebusukan. Hal ini diduga karena bahan baku yang digunakan untuk pembuatan pindang bukan bahan baku yang bermutu prima tetapi bahan baku yang tidak segar sehingga tidak jarang terdapat ikan pindang yang dijual sudah berlendir permukaannya bahkan sudah membusuk bagian dalamnya, serta penggunaan wadah yang dapat menurunkan kualitas ikan pindang dan dapat menyebabkan penyakit (Winarto 2013). Djarismawati et al. (2002)
menambahkan hasil olahan ikan laut yang telah mengalami proses pengolahan yang dijual di pasar mengandung histamin 6,56-125,08 ppm. Subaryono et al.
(2004), kadar histamin yang digunakan sebagai bahan baku pindang di Palabuhanratu sebesar 289,7 dan 247,6 pada produk pindangnya.
Kondisi penanganan dan pengolahan ikan yang demikian mengakibatkan mutu dan kualitas olahan ikan pindang menjadi rendah. Menurut Lehane dan Olley (2000), proses penanganan saat penangkapan awal yang buruk dan kegiatan enzim dan bakteri yang cepat akan menyebabkan ikan lebih cepat busuk dan daya simpan ikan akan lebih singkat. Lo (1982) menambahkan bahwa suhu pertumbuhan untuk sebagian besar bakteri berkisar 10o-20oC.
Teknik pemindangan yang diterapkan secara komersial di lapangan dapat dibedakan menjadi dua golongan yaitu pemindangan garam dan pemindangan air garam. Pemindangan garam di Jawa Barat dikenal dengan istilah pindang badeng (Suliantari 1994; Adawyah 2006), pindang paso (paso) (Nitibaskara 1980; Adawyah 2006), dan pemindangan air garam dikenal dengan istilah pindang cue/naya (naya) (Indriati et al. 2008; Ariyani dan Yenni (2008). Penelitian ini
menggunakan cara pemindangan badeng yaitu pemindangan yang dilakukan dengan cara lapisan ikan yang telah digarami dengan garam kering disusun berlapis-lapis di dalam wadah yang terbuat dari pelat logam (badeng).
Penelitian mengenai histamin pada ikan atau mengenai ikan pindang telah banyak dilakukan oleh peneliti terdahulu antara lain Ariyani et al. (2004) yang telah melakukan penelitian mengenai studi perubahan kadar histamin pada pindang tongkol (Euthynnus affinis) selama penyimpanan, Indriati et al. (2008) mengenai isolasi dan identifikasi kapang pada pindang ikan tongkol (Euthynnus affinis), Nitibaskara (1980) tentang pengaruh faktor-faktor pengolahan terhadap ketahanan hasil serta mutu protein dari pindang. Suliantari et al. (1994)
mempelajari metode reduksi kadar histamin dalam pembuatan ikan pindang tongkol (Euthynus affinis). Namun demikian penelitian mengenai perubahan kadar histamin dan bakteri pembentuk histamin pada olahan ikan tongkol jenis Auxis rochei masih sangat terbatas.
Perumusan Masalah
3 ikan pindang. Pengolahan pindang dengan suhu tinggi dapat menghambat bakteri tetapi penanganan setelah pengolahan dapat mengaktivkan kembali bakteri sehingga daya awet ikan menjadi lebih singkat. Penggunaan bahan baku yang hampir busuk, wadah yang tidak higenis dan kondisi penyimpanan yang dapat menurunkan kualitas ikan pindang dan dapat menyebabkan penyakit. Kondisi penanganan dan pengolahan ikan yang demikian mengakibatkan mutu dan kualitas olahan ikan pindang menjadi rendah sehingga menyebabkan ikan lebih cepat busuk dan daya simpan ikan akan lebih singkat. Oleh karena itu perlu dilakukan penelitian untuk mengkaji perubahan mutu ikan pindang selama penyimpanan.
Tujuan Penelitian
Tujuan penelitian yaitu untuk menganalisis pengaruh penyimpanan terhadap kadar histamin dan bakteri penghasil histamin dari pindang badeng tongkol (Auxis rochei).
Hipotesis Penelitian
Penyimpanan akan mempengaruhi kadar histamin pada ikan pindang Penyimpanan akan mempengaruhi kadar TVB pada ikan pindang Penyimpanan akan mempengaruhi total bakteri pada ikan pindang
2
METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada bulan Desember 2013 hingga April 2014. Ikan tongkol segar (Auxis rochei) diperoleh dari hasil penangkapan kapal satu hari melaut dengan alat mini purse seine di TPI Cisolok Palabuhanratu, Jawa Barat. Pengolahan ikan pindang bertempat di Pengolahan ikan Cisolok Palabuhanratu. Pengujian parameter mutu dilakukan di Balai Pengujian Mutu dan Pengolahan Hasil Perikanan dan Kelautan DKI Jakarta (BPMPHPK DKI Jakarta), Laboratorium Pengawasan Perikanan Nusantara Palabuhanratu (PPN Palabuahanratu), Laboratorium Terpadu dan Laboratorium Kesehatan Masyarakat Veteriner Fakultas Kedokteran Hewan dan Bioteknologi II Fakultas Perikanan dan Ilmu Kelautan IPB.
Bahan dan Alat
Bahan baku penelitian adalah ikan tongkol (Auxis rochei) segar
dengan panjang 25–30cm, berat 120–170 gram per ekor dan sampel ikan sebanyak ±205 ekor atau ±35 kg. Bahan-bahan lainnya adalah metanol, resin penukar ion (dowex1-x800-100-mesh), aquades, HCl, NaOH, H3PO4,
ortoptalatdikarboksilaldehide (OPT), larutan TCA, asam borat, K2CO3, indikator
4
niven (0,5% trypton, 0,5% yeast ekstrak, 1% L-histidin, 0,1% CaCO3, 0,5% NaCl,
2% agar, 0,0018% phenol red).
Alat yang digunakan adalah spektrofluorometer tipe Varian Cary Eclipse FL0811M007, cawan conway, kertas saring, botol bening 100 mL laminar, inkubator Dumedpower tipe DIC-104-S, shaker, autoklaf GEA/SMIC Type LSB 35 L.
Tahapan Penelitian
Penelitian ini terdiri dari dua tahap, yaitu tahap pendahuluan ikan tongkol segar disimpan pada waktu penyimpanan 0 jam, 8 jam, 16 jam, 24 jam dan 32 jam (sebagai kontrol) dan dilakukan pengujian organoleptik, TPC, TVB dan histamin.
Penelitian lanjutan terdiri dari tiga tahap. Tahap pertama yaitu pemindangan, ikan tongkol yang tanpa diberi perlakuan waktu penyimpanan dilakukan pemindangan dengan penambahan garam 25% dan waktu pemindangan yang berbeda (2 jam, 5 jam dan 8 jam) dan dilakukan pengujian histamin dan TPC. Hasil yang terbaik (histamin dan TPC terendah) dilanjutkan pada tahap ke-2. Tahap kedua yaitu penyimpanan, ikan hasil pemindangan terbaik (tahap pertama) disimpan pada suhu ruang yakni 0 jam, 8 jam, 16 jam, 24 jam dan 32 jam serta dilakukan pengujian organoleptik, histamin, TPC dan TVB. Sampel dengan histamin tertinggi selanjutnya dianalisis pada tahap ke-3. Tahap tiga terdiri dari seleksi dan identifikasi bakteri pembentuk histamin, aktivitas bakteri pembentuk histamin, pengaruh pH, suhu dan NaCl, serta mengukur kadar histamin yang diproduksi oleh bakteri serta mengukur TPC sampel pindang yang diinokulasi dengan beberapa jenis bakteri. Tahapan penelitian disajikan pada Gambar 1.
Prosedur Analisis
Uji organoleptik
Uji organoleptik yang dilakukan dalam penelitian antara lain organoleptik ikan tongkol segar (SNI 01-2729.1-2006) dan uji hedonik untuk produk olahan pindang (SNI 01-2717.1-2009). Uji ini berfungsi untuk menilai suatu sifat organoleptik yang spesifik. Pada uji skoring diberikan penilaian terhadap mutu sensorik dalam suatu jenjang mutu. Tujuan uji skoring adalah pemberian suatu nilai atau skor tertentu terhadap karakteristik mutu. Pemberian skor dapat dilakukan dengan skala yang jumlah skalanya tergantung pada tingkat kelas yang dikehendaki. Pengujian organoleptik meliputi kenampakan mata, insang, lendir permukaan badan, daging, bau, rasa dan tekstur dengan nilai berkisar 1–9.
Penetapan total volatile base (TVB) Metode Conway (AOAC, 1995)
5
Penelitian Tahap 2 Penelitian Tahap 1
Penelitian Tahap 3
berwarna jernih. Larutan asam borat 1 mL dimasukkan ke dalam inner chamber
cawan conway lalu diletakkan tutup cawan dengan posisi hampir menutupi cawan.
Gambar 1 Diagram alir kerangka penelitian Ikan Tongkol
Pengujian :
-Organoleptik - TPC
-TVB - Histamin
Kontrol penyimpanan
0 jam 8 jam 16 jam 24 jam 32 jam
Penyusunan ikan dan pengaraman (25%)
Perebusan 2, 5 dan 8 jam
Penyimpanan 0, 8, 16, 24, dan 32 jam
Hasil yang terbaik (Histamin dan TPC terendah) dilanjutkan
pada tahap 2 Penyiangan dan
pencucian Pindang terbaik tahap 1
Histamin tertinggi dilanjutkan pada tahap 3
Seleksi dan identifikasi bakteri pembentuk histamin Pengujian
-Histamin -TPC
Pengukuran kadar histamin yang teridentifikasi pada pindang Pengukuran TPC sampel pindang yang di
inokulasi pada beberapa jenis bakteri Identifikasi aktivitas perubahan warna bakteri penghasil histamin, pengaruh pH, suhu dan NaCl
Pengujian : - Organoleptik
- TPC
- TVB
6
Filtrat dimasukkan ke dalam outer chamber disebelah kiri dengan memakai pipet ukuran 1 mL yang lain, kemudian ditambahkan 1 mL larutan K2CO3 jenuh ke dalam outer chamber sebelah kanan sehingga filtrat dan K2CO3
tidak tercampur. Cawan segera ditutup dan digerakkan memutar sehingga kedua cairan di outer chamber tercampur. Pengerjaan blanko dilakukan dengan prosedur yang sama tetapi filtrat diganti dengan larutan TCA 7% (w/v).
Kedua cawan conway tersebut disimpan dalam inkubator pada suhu 37oC selama 2 jam. Larutan asam borat dalam inner chamber cawan conway dititrasi dengan larutan HCl 0,2 N (Vo blanko) menggunakan pipet volume sampai berubah warna menjadi merah muda (V1 sampel). Contoh perhitungan disajikan pada Lampiran 1.
Kadar TVB-N (mg/100g) =
Vol ,titrasi sampel −Vol ,titrasi blanko x N HCl x Ar N x faktor pengenceran x 100 bobot
Bobot sampel
Keterangan :
Ar N : 14
Faktor pengenceran : 60
N HCl : 0,0191
Analisis Kadar Histamin (SNI 2354.10: 2009)
Analisis kadar histamin dilakukan dengan menggunakan spektroflorometri, yang didasarkan pada pengukuran fluorosensi. Prinsip metode tersebut adalah histamin diekstrak dari jaringan daging sampel (BSN 2009a).
Prosedur analisis kadar histamin, yakni sampel diblender hingga homogen, kemudian ditimbang sebanyak 10±0,1 gram dalam beaker glass 250 mL dan
ditambahkan 50 mL metanol. Sampel dalam keadaan tertutup dipanaskan di dalam
waterbath selama 15 menit pada suhu 60 ºC dan didinginkan dalam suhu kamar. Sampel tersebut dituang ke dalam labu takar 100 mL dan ditepatkan hingga tanda tera dengan metanol. Setelah itu dilakukan penyaringan menggunakan kertas saring dan filtrat ditampung dalam botol contoh. Filtrat dapat disimpan dalam refrigerator.
Glass wool yang telah diberi aquades dimasukkan ke dalam kolom resin
setinggi 1,5 cm. Resin netral dalam medium air dimasukkan ke kolom resin setinggi 8 cm dengan volume air di atas resin setinggi 1 cm. Labu takar 50 mL yang berisi 5 mL HCl 1 N diletakkan di bawah kolom resin untuk menampung elusi contoh yang dilewatkan pada kolom resin.
Filtrat contoh sebanyak 1 mL dipipet ke dalam kolom resin, kran kolom resin dalam posisi terbuka dan hasil elusi dibiarkan menetes lalu ditampung dalam labu takar 50 mL. Aquades ditambahkan pada saat tinggi cairan 1 cm di atas resin dan cairan dibiarkan terelusi. Prosedur tersebut diulangi hingga hasil elusi dalam labu takar tepat 50 mL. Hasil elusi dapat disimpan dalam refrigerator.
7 dilakukan terhadap sampel, standar, dan blanko sesegera mungkin dengan alat spektroflorometri pada panjang gelombang eksitasi 350 nm dan emisi 444 nm dalam waktu 90 menit. Contoh perhitungan disajikan pada Lampiran 2.
y = a + bx Keterangan:
y : fluoresensi contoh a : intersep
b : kemiringan
x : konsentrasi contoh
Konsentrasi histamin (mg/kg) = x . (volume akhir (mL). faktor pengenceran) gram sampel
Analisis Total Mikroba (Total Plate Count) (SNI 01-2332.3-2006)
Prinsip kerja analisis TPC adalah pertumbuhan mikroorganisme setelah contoh diinkubasi dalam media agar pada suhu 35°C selama 48 jam, maka mikroorganisme tersebut akan tumbuh berkembang biak dengan membentuk koloni yang dapat langsung dihitung. Prosedur kerja analisis TPC adalah sebagai berikut: sampel ditimbang secara aseptik sebanyak 25 gram dan ditambah 225 mL larutan Butterfield’s Phospate Buffered, kemudian dihomogenkan selama 2 menit. Homogenat ini merupakan larutan hasil pengenceran 10-1. Sebanyak 1 mL homogenat diambil menggunakan pipet steril dan dimasukkan ke dalam botol berisi 9 mL larutan Butterfield’s Phospate Buffered sehingga diperoleh contoh dengan pengenceran 10-2. Pada setiap pengenceran dilakukan pengocokan minimal 25 kali. Hal yang sama dilakukan untuk pengenceran 10-3, 10-4, 10-5, dan seterusnya sesuai kondisi sampel. Selanjutnya untuk metode cawan agar tuang (Pour Plate Method), dipipet sebanyak 1 mL dari setiap pengenceran dan dimasukkan ke dalam cawan petri steril secara duplo menggunakan pipet steril. Masing-masing cawan yang sudah berisi sampel, ditambahkan 12-15mL media
Plate Count Agar (PCA) yang sudah didinginkan hingga mencapai suhu 45 °C. Setelah agar menjadi padat, cawan petri yang telah berisi agar dan larutan sampel tersebut dimasukkan ke dalam inkubator dengan posisi terbalik selama 48 jam pada suhu 35 °C. Selanjutnya dilakukan pengamatan dengan menghitung jumlah koloni bakteri yang ada di dalam cawan petri menggunakan alat penghitung koloni. Jumlah koloni yang dihitung adalah cawan petri yang mempunyai koloni bakteri antara 25-250 koloni.
Isolasi dan Karakterisasi Bakteri Pembentuk Histamin (Niven et al. 1981)
Prinsip analisis bakteri pembentuk histamin adalah enterobactericeae akan mengubah histidin menjadi histamin melalui proses dekarboksilasi yang akan menaikkan pH dan mengubah warna pada media.
Media modifikasi niven agar dipersiapkan dengan cara mencampurkan semua bahan, yaitu 0,5% trypton, 0,5% yeast extract, 1% L-histidin monohydrochlorid monohydrat, 0,1% CaCO3, 0,5% NaCl, 2,5% agar, dan
8
dan diatur pada pH 5,3 kemudian disterilisasi menggunakan otoklaf pada suhu 121 °C selama 10 menit.
Sampel sebanyak 25 gram dimasukkan ke dalam botol yang berisi 225 mL larutan Butterfield’s Phospate Buffered, kemudian dilumatkan dengan blender
hingga larutan homogen. Homogenat ini merupakan larutan pengenceran 10-1. Campuran tersebut diambil 1 mL dan dimasukkan ke dalam botol berisi 9 mL larutan Butterfield’s Phospate Buffered sehingga diperoleh contoh dengan pengenceran 10-2, kemudian dikocok sampai homogen. Pengenceran dilakukan hingga 10-4. Satu mL larutan sampel hasil setiap pengenceran dimasukkan ke dalam cawan petri, lalu 12-15 mL media niven agar cair yang sudah didinginkan hingga mencapai suhu 45°C dituangkan ke dalam masing-masing cawan yang sudah berisi sampel. Setelah agar menjadi padat, cawan petri yang telah berisi agar dan larutan sampel tersebut dimasukkan ke dalam inkubator dengan posisi terbalik selama 48 jam pada suhu 37°C. Selanjutnya dilakukan penghitungan jumlah koloni berwarna merah muda dengan halo pink pada latar belakang awal tanpa bakteri berwarna kuning atau orange setelah ditumbuhkan bakteri latar belakang berubah menjadi warna pink sampai ungu kemerahan. Koloni tersebut merupakan koloni bakteri pembentuk histamin.
Isolasi Bakteri Pembentuk Histamin (modifikasi Niven et al. 1981)
Isolasi bakteri pembentuk histamin dilakukan dengan mengambil 0,1 mL dari larutan pengenceran 10-1 dan dimasukkan ke dalam cawan petri, kemudian niven agar cair dituangkan ke dalam cawan dan dihomogenkan dengan cara cawan digerakkan membentuk angka 8. Setelah agar menjadi padat, cawan petri diinkubasi pada suhu 35oC selama 4 hari (Chen et al. 2009). Koloni yang telah
diinkubasi selama 4 hari berwarna putih, pink atau ungu digoreskan pada agar
miring (Niven’s Agar) dan digoreskan pada media trypticase soy agar (TSA)
untuk memperoleh kultur murni. Penggoresan yang sempurna akan menghasilkan koloni yang terpisah. Isolat bakteri digolongkan murni jika diperoleh bentuk sel dan morfologi koloni yang seragam dan dijadikan sebagai stok kultur untuk diidentifikasi lebih lanjut.
Identifikasi Bakteri Pembentuk Histamin (Cowan and Steel 1982; Holt et al. 1994)
Pewarnaan Gram
Pewarnaan Gram merupakan uji awal untuk identifikasi bakteri. Tahapan ini diawali dengan fiksasi inokulum isolat bakteri yang berasal dari Niven Agar. Preparat yang sudah kering kemudian ditambah pewarna crystal violet-ammonium oxalat dan dicuci pada air mengalir serta dikeringkan. Preparat ditambah iodin
9 Uji motilitas
Uji motilitas dilakukan dengan cara inokulum dari Niven Agar diinokulasikan ke dalam media motility test medium (MTM) dengan kedalaman
2/3 dari ketinggian media MTM dan diinkubasikan pada suhu 37±2°C selama 18-24 jam. Reaksi positif ditunjukkan dengan adanya pertumbuhan bakteri yang berdifusi secara sirkular dari garis tusukan.
Uji Indol
Uji Indol: sebanyak 5,0 mL dari media Trypton (atau Tryptophan) Broth dipindahkan ke tabung uji sucihama. Selanjutnya ditambah 0,2-0,3 mL reagen
Kovacs’, jika bakteri histamin tidak menyebabkan munculnya warna merah bata di permukaan media ini reaksi dianggap negatif.
Uji Katalase
Uji katalase dilakukan dengan cara diambil 1 ose bakteri dan dipindahkan pada kaca objek. Kemudian ditetesi larutan H2O2 3%. Adanya enzim katalase
ditandai dengan terbentuknya gelembung-gelembung oksigen yang terlihat seperti busa (Cowan 1982)
Uji oksidase
Uji oksidase dilakukan dengan cara sebanyak 1ose inokulum dari Niven Agar dan dipindahkan pada kertas oksidasi. Kemudian diberikan 2-3 tetes pereaksi oksidase dan dilakukan pengamatan. Reaksi positif ditunjukkan dengan terbentuknya warna biru tua pada kertas oksidasi.
Pertumbuhan pada media agar triple sugar iron (TSI)
Koloni dari media Niven Agar diinokulasikan pada media agar triple sugar iron (TSI) dengan cara digoreskan pada agar miring dan ditusukkan pada agar tegak kemudian diinkubasikan pada suhu 37±2°C selama 18-24 jam. Pertumbuhan bakteri akan menghasilkan warna merah (alkalin) pada agar miring
dan asam (warna kuning) pada agar tegak serta tidak menghasilkan gas dan H2S.
Simmons Citrate Agar
Simmons Citrate Agar: dengan menggunakan jarum, koloni tersebut dipindahkan dari TSI Agar kemudian digoreskan pada bagian miring dan ditusukkan pada bagian tegak, kemudian diinkubasi pada suhu 37±2 oC selama 24-48 jam. Bakteri histamin akan tumbuh baik pada media ini dan mengubah warna media menjadi biru (hasil positif).
Fermentasi karbohidrat
Tujuan untuk mengetahui jenis bakteri yang memfermentasikan jenis karbohidrat tertentu. Perbenihan gula-gula yang digunakan adalah cair yang mengandung satu jenis karbohidrat (kadar 1%) dengan indikator phenol red. Jika,
terjadi fermentasi, medium terlihat berwarna kuning karena perubahan pH menjadi asam.
Koloni bakteri dari media TSA diambil sedikit dengan ose steril dan diinokulasi pada perbenihan karbohidrat. Inkubasi pada suhu 370C selama 24-48 jam.
10
Pembacaan hasil identifikasi
Hasil dapat dinyatakan positif bakteri histamin,apabila dalam uji tersebut lebih dari 90 % atau dapat dinyatakan negatif apabila hasil uji-uji kurang dari 90%. Sifat-sifat bakteri pembentuk histamin
Masing-masing genus bakteri pembentuk histamin hasil identifikasi, diamati kemampuannya dalam menghasilkan histamin dan pengaruh lingkungan dalam pertumbuhannya yaitu pengaruh pH, suhu dan konsentrasi NaCl.
Uji aktivitas bakteri pembentukan histamin (Tanudjaja 1998)
Isolat bakteri murni dari masing-masing genus yang diperoleh diinokulasikan ke dalam larutan pengencer, kemudian dilakukan penghitungan jumlah bakteri dengan menggunakan Mc Farlan dan Neubauer hingga dicapai jumlah bakteri yang seragam dari masing-masing genus.
Larutan isolat 0,02 mL ditumbuhkan ke dalam medium Niven’s Agar yang
telah dilubangi dengan diameter 0,45. Kemudian inkubasi selama 48 jam pada suhu 37oC. Pengamatan dilakukan dengan mengukur diameter lingkaran kuning yang terbentuk.
Pengaruh pH dan suhu
Isolat bakteri murni yang diperoleh diinokulasikan ke dalam medium Nutrien Broth yang mempunyai pH yang berbeda yaitu 5, 6, 7, 8, dan 9. Kemudian diinkubasi pada suhu yang berbeda yaitu 10, 30, 37 dan 50oC selama 48 jam. Penghitungan pengaruh pH dan suhu dilakukan dengan menggunakan spektrofotometri dengan panjang gelombang 660 nm berdasarkan metode Hardy dan Smith (1976).
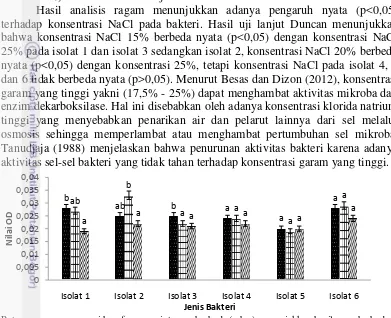
Pengaruh konsentrasi NaCl
Isolat bakteri murni yang diperoleh diinokulasikan ke dalam medium Nutrien Broth yang telah ditambah NaCl dengan konsentrasi yang berbeda yaitu 0, 15%, 20%, 25%. pH dan suhu medium pada konsentrasi NaCl diatur sesuai hasil penelitian pengaruh suhu dan pH sebelumnya. Inkubasi dilakukan selama 48 jam. Penghitungan pengaruh konsentrasi NaCl dilakukan dengan menggunakan spektrofotometri dengan panjang gelombang 660 nm berdasarkan metode Hardy dan Smith (1976).
Pengukuran kadar histamin dari bakteri yang teridentifikasi
Isolat bakteri uji ditumbuhkan pada 5 mL medium (Trypticase soy broth-histidine medium) TSBH (Taylor et al. 1979) dalam tabung, diinkubasikan selama 18 jam pada suhu 37oC, dengan pengocokan menggunakan shaker 125g
(Mangunwardoyo et al. 2007). Analisis kadar histamin menggunakan modifikasi
11 kolom dielusi dengan 25 mL HCl 0,2 N. Setelah itu tambahkan 1 mL eluen dengan 15 mL larutan Na2CO3 5% dan 2 mL larutan diazonium dan dinginkan larutan pada suhu 0oC selama 10 menit. Absorbansi diukur pada panjang gelombang 495 nm dengan menggunakan spektrofotometri UV-VIS. Blanko dibuat dengan prosedur yang sama menggunakan TCA 2,5% netral yang tidak ditambah bakteri.
Pengukuran TPC sampel pindang yang diinokulasi pada beberapa jenis bakteri (SNI 01-2332.3-2006)
Suspensi dibuat pada masing-masing bakteri yang berumur 24 jam (kode H, K.o, M, K.p, E dan P) dengan standar Mc.Farland I atau setara dengan 3,0 x 108. Pindang ikan tongkol disiapkan dan ditimbang sebanyak 20 gram dan dimasukan ke dalam cawan streril dan diberi kode susai dengan kode bakteri. (Catatan konsentrasi bakteri sudah berkurang 10x menjadi 107). Kemudian sebanyak 2 mL suspensi dimasukkan ke dalam pindang ikan tongkol secara merata dan dimasukkan ke dalam pengencer 180 mL untuk pindang ikan tongkol yang sudah diberi suspensi bakteri (Catatan konsentrasi bakteri sudah berkurang 10x menjadi 106). Kemudian dilakukan pengenceran sampai 10-9. Setelah itu, dimasukan masing-masing 1 mL pengencer dari pengencer 10-3 sampai 10-9, secara berulang ke dalam cawan yang steril. Masukan medium PCA ke dalam cawan secara aseptic dan goyang-goyang membentuk angka 8, diamkan sampai membeku dan dimasukan ke dalam inkubator suhu 370C selama 2 x 24 jam, dilakukan perhitung.
Analisis Data (Steel and Torrie 1993)
Data hasil analsis kadar histamin, TVB, TPC, dan jumlah bakteri pembentuk histamin dianalisis menggunakan program Microsoft Excel 2007 dan SPSS.Rancangan percobaan yang digunakan adalah Rancangan Acak Lengkap
(RAL) yaitu waktu penyimpanan yang terdiri dari 5 taraf pengamatan yakni 0 jam, 8 jam, 16 jam, 24 jam dan 32 jam. Rumus umum RAL yaitu :
Yij= µ + αi+ εij
Keterangan :
Yij = Nilai pengamatan pada perbedaan waktu penyimpanan perlakuan ke-i
dan ulangan ke-j µ = Rataan umum
αi = Pengaruh perlakuan ke-i
εij = Galat
Hipotesis :
H0: μt = 0, artinya tidak ada perbedaan di antara semua nilai tengah perlakuan;
H1: μt ≠ 0, artinya minimal ada sepasang nilai tengah perlakuan yang berbeda.
12
ni = banyaknya pengamatan tiap perlakuan atau jumlah panelis n = banyaknya data
Ri = jumlah rata-rata tiap perlakuan ke-i
T = banyaknya pengamatan yang seri dalam tiap ulangan
H’ = H terkoreksi (ki-kuadrat) FK = faktor koreksi
Apabila hasil uji chi-square menunjukkan di antara perlakuan tersebut
memberikan pengaruh yang berbeda terhadap parameter yang diamati maka pengujian dilanjutkan dengan uji lanjut multiple comparison dengan menggunakan Uji Dunn.
3
HASIL DAN PEMBAHASAN
Karakteristik Ikan Segar
Nilai organoleptik ikan segar
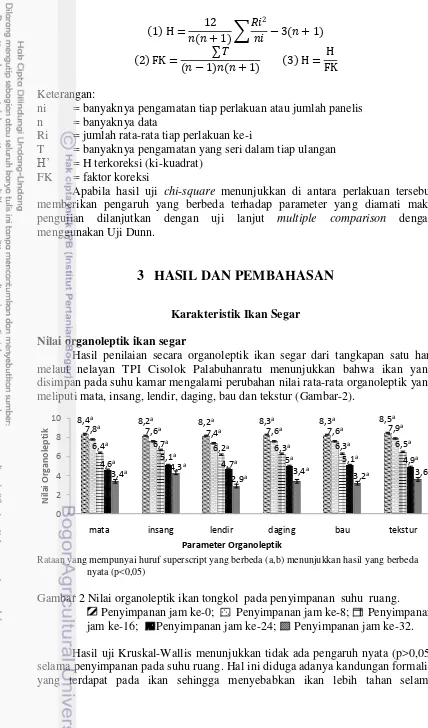
Hasil penilaian secara organoleptik ikan segar dari tangkapan satu hari melaut nelayan TPI Cisolok Palabuhanratu menunjukkan bahwa ikan yang disimpan pada suhu kamar mengalami perubahan nilai rata-rata organoleptik yang meliputi mata, insang, lendir, daging, bau dan tekstur (Gambar-2).
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 2 Nilai organoleptik ikan tongkol pada penyimpanan suhu ruang. Penyimpanan jam ke-0; Penyimpanan jam ke-8; Penyimpanan jam ke-16; Penyimpanan jam ke-24; Penyimpanan jam ke-32. Hasil uji Kruskal-Wallis menunjukkan tidak ada pengaruh nyata (p>0,05) selama penyimpanan pada suhu ruang. Hal ini diduga adanya kandungan formalin yang terdapat pada ikan sehingga menyebabkan ikan lebih tahan selama
mata insang lendir daging bau tekstur
13 penyimpanan. Menurut Riyadi et al. (2007), produk hasil perikanan udang atau ikan yang menggunakan bahan pengawet formalin ditandai dengan warna putih bersih, kenyal, insangnya berwarna merah tua bukan merah segar, serta daya awet meningkat. Salosa (2013) menambahkan bahwa formalin digunakan untuk menghilangkan bakteri yang biasa hidup di sisik ikan. Ikan yang tanpa formalin akan mudah busuk jika tidak dilakukan penanganan dengan baik sehingga semakin lama waktu penyimpanan maka nilai penerimaan semakin menurun (Soekarto dan Hubeis 2000). Ariyani et al. (2007) menjelaskan bahwa perkembangan nilai penerimaan ikan selama penyimpanan berbeda tergantung pada jenis dan cara penanganannya. Ikan lemuru yang disimpan pada suhu kamar ditolak panelis setelah 10 jam (Nasran dan Arifudin 1982). Menurut Ariyani et al. (2007), secara organoleptik setelah 12 jam penyimpanan ikan mas belum ditolak panelis, penolakan oleh panelis terjadi setelah 24 jam tanpa menggunakan formalin.
Faktor-faktor yang dapat mempengaruhi kesegaran ikan adalah cara penangkapan, sortasi, pencucian dan pemberian es, ukuran, jumlah bakteri yang terdapat pada ikan, lingkungan air mempengaruhi penurunan mutu ikan, suhu dan sanitasi (Ilyas 1983; Koohdar et al. 2011).
Kadar histamin, TPC (Total Plate Count), TVB (total volatile base) pada ikan tongkol (Auxis rochei) selama penyimpanan pada suhu ruang
Hasil pengukuran dan pengamatan histamin, TPC dan TVB pada ikan tongkol (Auxis rochei) disajikan pada Tabel 1.
Tabel 1 Kadar histamin, TPC dan TVB pada ikan tongkol (Auxis rochei)
selama penyimpanan pada suhu ruang
Parameter Uji Waktu Pengamatan (jam)
0 8 16 24 32
Keterangan: Huruf superscript yang sama menunjukkan tidak berbeda nyata
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap peningkatan kadar histamin selama penyimpanan pada suhu ruang Tabel 1. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan 0 jam berbeda nyata (p<0,05) dengan penyimpanan 8, 16, 24 dan 32 jam tetapi penyimpanan 8 jam tidak berbeda nyata (p>0,05) dengan penyimpanan 16 jam. Menurut (Chen et al.
2010), pada suhu kamar di daerah tropis (30oC) kerusakan ikan akan terjadi pada penyimpanan 12-24 jam tergantung pada jenis ikan dan metode penangkapan. Ikan di daerah dingin dan yang disimpan pada suhu 20oC akan mengalami kerusakan sebelum dua hari penyimpanan tetapi jika ikan disimpan pada suhu 5oC maka akan terjadi kerusakan sekitar 5-6 hari (Clucas dan Sutcliffe 1981). Hasil penelitian Pandit (2007) menunjukkan bahwa kadar histamin ikan tongkol yang disimpan pada suhu 30oC mengalami kenaikan dari 27,10 mg/100g menjadi 403,20 mg/100g selama 24 jam. Menurut Rinto (2007), pada suhu 38oC histamin terbentuk setelah ikan tuna disimpan selama 6 sampai 12 jam.
14
pada jam ke-24 dan 32 telah melebihi 50 ppm. FDA mengatur tentang kadar maksimum histamin ikan yang dapat dikonsumsi yakni tidak melebihi 50 ppm (FDA 2011). Peningkatan kadar histamin pada penyimpanan suhu ruang berkorelasi dengan peningkatan bakteri.
Total Plate Count (TPC) merupakan jumlah mikroorganisme hidup yang terdapat pada produk uji. Total Plate Count yang dapat diterima atau layak untuk
konsumsi adalah tidak melebihi 5×105 CFU/g atau setara dengan log 5,67 CFU/g (BSN 2006a).
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap jumlah mikroba pada ikan tongkol. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan 0 jam berbeda nyata (p<0,05) dengan penyimpanan 24 dan 32 jam, tetapi jam ke-0 tidak berbeda nyata (p>0,05) dengan 8 dan 16 jam. Penyimpanan jam ke-0 menunjukkan nilai terendah (log 3,83 CFU/g atau log 6,8×103 CFU/g) diduga mikroba baru melakukan adaptasi dengan lingkungannya, sedangkan pada jam ke-32 yakni log 5,43 CFU/g atau 2,7×105 Cfu/g menunjukkan bahwa produk ikan hampir busuk dan menurut SNI 01-2729-2000 batas maksimum nilai TPC untuk ikan segar adalah 5×105 Cfu/g. Yoswati (2012) menambahkan bahwa total bakteri ikan tongkol segar dengan perlakuan penyimpanan selama 32 jam menghasilkan total bakteri antara 1,5×103-2,2×105 Cfu/g. Selama penyimpanan, terjadi peningkatan log total mikroba dari 3,83 CFU/g (6,8×103 CFU/g) menjadi log 5,43 CFU/g (2,7×105 CFU/g). Peningkatan jumlah mikroba disebabkan oleh kesesuaian medium tempat tumbuhnya seperti kandungan nutrisi, pH dan suhu. Hasil analisis log total mikroba selama penyimpanan dicantumkan dalam Tabel 1
Total Volatile Base (TVB) merupakan jumlah dari amonia, dimetilamin (DMA), trimetilamin (TMA) dan komponen basa lainnya berbasis nitrogen yang bersifat volatil (Suwetja 2011). Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap kadar TVB pada ikan tongkol Tabel 1. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan jam ke-0 berbeda nyata (p<0,05) dengan jam ke-8, 16, 24 dan 32 pada suhu ruang. Nilai rata-rata TVB pada ikan tongkol segar (Auxis rochei) yakni 42,34 mgN/100g pada jam ke-32, diduga karena semakin lama ikan disimpan pada suhu ruang maka semakin cepat proses pembusukan ikan. Hasil penelitian Shakila et al. (2003) menunjukkan pada
lama penyimpanan 18 jam dengan suhu penyimpanan 32±2 oC, kadar TVB ikan
mackerel dan ikan sardine telah mencapai lebih dari 30 mgN/100g, dan pada lama penyimpanan 24 jam dengan suhu penyimpanan 32±2 oC, kadar TVB ikan
mackerel dan sardine telah mencapai lebih dari 50 mgN/100g. Hal ini diduga
adanya kandungan formalin yang terdapat pada ikan sehingga pada hasil penelitian ini nilai TVB pada waktu penyimpanan jam ke-32 belum mencapai 50 mgN/100g. Hastuti (2010) menambahkan pemakaian formalin dapat mempercepat proses pengeringan dan membuat tampilan fisik tidak cepat busuk dan dapat menghambat pertumbuhan bakteri. Menurut Susanto et al. (2011), Standar mutu
tidak melebihi tingkat batas penerimaan 30-35 mgN%. Mah et al. (2002)
menambahkan bahwa batas maksimum untuk produk perikanan dan hasil laut yang bermutu baik adalah 30-40 mgN/100g. Hal tersebut berbeda menurut hasil penelitian Kerr et al. (2002); Pandit (2007), menjelaskan bahwa TVB merupakan
15 yang semuanya tergantung pada tipe makanan, musim penangkapan dan ukuran ikan.
Hasil analisis ketiga parameter tersebut memperlihatkan adanya korelasi positif antara histamin, TPC dan TVB yang semakin lama penyimpanan akan menyebabkan kualitas ikan akan semakin menurun. Pembentukan TVB oleh mikroba erat kaitannya dengan enzim yang akan mengurai asam amino menjadi biogenik amin dan TMAO-ase yang mereduksi TMAO menjadi TMA. TMA terbentuk dari penguraian senyawa lipoprotein menjadi kolin lalu diuraikan menjadi TMAO oleh enzim dehidrogenase, kemudian mereduksi menjadi TMA (Rinto 2007). Histamin terbentuk akibat proses dekarboksilasi asam amino histidin yang terdapat di dalam tubuh ikan yaitu histidin bebas (Suliantari et al.
1994). Asam amino bebas yang kemudian menjadi senyawa-senyawa amin (mis: puresin, kadaveri, histamin, indol, skatol) asam disulfida, karbondioksida, asam-asam organik (Suwetja 2011). Menurut pandit (2007), hasil pemecahan protein bersifat volatil dan menimbulkan bau busuk misal amoniak, H2S, phenol, kresol, indol dan skatol.
Karakteristik Ikan Pindang
Kadar histamin dan TPC (Total Plate Count) ikan tongkol (Auxis rochei) selama pemindangan
Hasil pengukuran dan pengamatan histamin dan TPC pada ikan tongkol (Auxis rochei) selama pemindangan disajikan pada Tabel 2.
Tabel 2 Kadar histamin dan TPC pada waktu pemindangan ikan tongkol (Auxis
Keterangan: Huruf superscript yang sama menunjukkan tidak berbeda nyata
Hasil analisis ragam menunjukkan tidak ada pengaruh nyata (p<0,05) terhadap kadar histamin pada ikan tongkol yang direbus selama 2 jam, 5 jam dan 8 jam sebagaimana tercantum pada Tabel 2, hal ini terjadi karena proses pemindangan menggunakan suhu tinggi dalam perebusan sehingga bakteri dan enzim dekarboksilase yang mengubah histidin menjadi histamin tersebut rusak. Susilo et al. (2014) menjelaskan bahwa pengolahan dengan pemanasan dapat
mengakibatkan protein ikan mengalami denaturasi seluruhnya yang disertai dengan terjadinya pengeluaran air dari jaringan otot daging. Protein mengalami denaturasi, konfigurasi molekul-molekulnya berubah dan aktivitas enzim (yang juga merupakan protein) akan hilang bila dipanaskan. Sulthoniyah et al. (2013)
menambahkan, asam amino yang menyusun protein dengan mudah mengalami kerusakan karena panas. Menurut Ariyani et al. (2004), meskipun dilakukan
pengolahan, sekali histamin sudah terbentuk dalam suatu bahan maka histamin tersebut tidak akan hilang/rusak dengan perlakuan pembekuan, perebusan, pengasapan, penggaraman maupun pengalengan. Menurut (Suliantari et al. 1994; Djarismawati et al. 2002), pengukusan, pengeringan dan pengalengan adalah
16
menghambat bakteri dan enzim yang akan menyebabkan terjadinya perubahan warna, cita rasa atau nilai gizi selama penyimpanan.
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap total bakteri setelah pengolahan dicantumkan pada Tabel 2. Hasil uji lanjut Duncan menunjukkan bahwa perebusan selama 8 jam berbeda nyata (p<0,05) dengan perebusan selama 2 dan 5 jam. Nilai rata-rata menunjukkan adanya perubahan jumlah bakteri setelah pengolahan yakni log 3,83 CFU/g atau 6,8×103 CFU/g menjadi log 2,43 CFU/g atau 2,7×102 CFU/g sebelum penyimpanan diduga karena penggunaan suhu tinggi pada saat perebusan dapat menginaktifkan pertumbuhan mikroorganisme hingga dapat membunuh bakteri pembentuk histamin tetapi dalam penelitian ini, setelah melakukan pengolahan masih terdapat bakteri pada pindang ikan tongkol. Menurut Indriati et al. (2006), hal ini diduga terjadinya kontaminasi dari pengolah, karena bakteri ini merupakan bakteri yang terdapat pada bagian anggota tubuh manusia seperti tangan, kuku, hidung dan mulut. Djarismawati et al. (2002) menambahkan bahwa adanya kontaminasi pada proses transportasi dari tempat pengolahan sampai laboratorium pengujian. Bakteri yang toleran terhadap panas memiliki enzim, protein dan DNA bakteri yang stabil dan bekerja optimum pada suhu ekstrim. Senyawa kimia sel bakteri mampu mencegah denaturasi protein pada suhu panas (Fardiaz 1989).
Proses pengolahan dengan cara perebusan telah dilakukan, kemudian dilanjutkan dengan proses penyimpanan menggunakan perebusan jam ke-8 dengan presentase jumlah bakteri terendah. Menurut Ewald et al. (1999), pemanasan pada suhu 60oC selama 2 jam akan menurunkan aktivitas bakteri sebanyak 43%.
Nilai organoleptik penyimpanan ikan pindang
Hasil penilaian secara organoleptik ikan yang disimpan pada waktu yang berbeda (0, 8, 16, 24 dan 32 jam) dicantumkan pada Gambar 3.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
17 membuat tampilan fisik tidak cepat busuk selama penyimpanan serta dapat menghambat pertumbuhan bakteri. Ariyani et al. (2000) menjelaskan bahwa ikan kukus pada penyimpanan 12 jam nilai penerimaan konsumen masih di atas nilai 5 tetapi menurun setelah penyimpanan 24 jam hingga nilai penerimaan dibawah 5. Suliantari et al. (1994) menjelaskan bahwa olahan ikan yang disimpan selama 24 jam telah memungkinkan tumbuh jamur dan bakteri. Menurut Ariyani et al.
(2004), Penurunan nilai pada semua parameter sensoris meliputi penampakan, bau, tekstur, lendir terlihat sangat jelas dan nyata (p<0,05) akan terjadi setelah 4 hari penyimpanan.
Kadar histamin, TPC (Total Plate Count), TVB (total volatile base) pada ikan pindang tongkol (Auxis rochei) selama penyimpanan pada suhu ruang
Hasil pengukuran dan pengamatan histamin, TPC dan TVB pada ikan pindang tongkol (Auxis rochei) disajikan pada Tabel 3.
Tabel 3 Kadar histamin, TPC dan TVB pada pindang ikan tongkol (Auxis rochei)
selama penyimpanan pada suhu ruang
Parameter Uji Waktu Pengamatan (jam)
0 8 16 24 32
Keterangan: Huruf superscript yang sama menunjukkan tidak berbeda nyata
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap peningkatan kadar histamin ikan pindang selama penyimpanan pada suhu ruang Tabel 3. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan 0 dan 8 jam berbeda nyata (p<0,05) dengan penyimpanan 16, 24 dan 32 jam tetapi penyimpanan 0 hingga 8 jam dan penyimpanan 16 hingga 24 jam tidak berbeda nyata (p>0,05). Pembentukan histamin terjadi dengan sangat cepat pada penyimpanan suhu 30ºC, yakni naik hingga 6,6 mg/kg setelah penyimpanan selama 32 jam, meskipun demikian nilai tersebut masih dalam batas aman berdasarkan batas maksimum nilai yang disarankan oleh FDA (2011) bahwa batas maksimum kadar histamin dapat mengganggu kesehatan yaitu >50 ppm. Ariyani
et al. (2004) menjelaskan bahwa penyimpanan pindang pada suhu kamar dapat
menaikkan kadar histamin hingga 32,71 mg/100g selama 24 jam.
Selama penyimpanan terjadi kenaikan kadar histamin pindang tongkol yang kadarnya semakin tinggi dengan bertambahnya waktu penyimpanan diduga oleh aktivitas yang intensif dari bakteri-bakteri pembentuk histamin. Menurut Kerr et al. (2002), terdapat hubungan atau korelasi positif antara jumlah bakteri dan kadar histamin yang dihasilkan.
18
(2004), terkontaminasinya kembali produk oleh bakteri pembentuk histamin merupakan hal yang dapat terjadi dan mengingat bahwa bakteri pembentuk histamin pada umumnya tumbuh dengan cepat pada suhu 32,2 oC. Menurut Suliantari et al. (1994), umumnya pindang merupakan produk yang sangat cepat membusuk terutama menghadapi masalah bakteri dan jamur yang pertumbuhannya sangat cepat. Pertumbuhan bakteri pembentuk histamin pada ikan berlangsung lebih cepat pada temperatur yang tinggi (21,1 ºC) daripada temperatur rendah (7,2 ºC) FDA (2011). Hidayati et al. (2002) menambahkan adanya mikroba pada makanan dapat berasal dari berbagai sumber, misalnya bahan baku, alat yang digunakan selama proses pengolahan, tempat penyimpanan makanan, orang yang terlibat dalam pengolahan serta lingkungan sekitarnya berupa tanah, air dan udara.
Hasil analisis kadar TVB setelah pengolahan berbanding terbalik dengan hasil analisis histamin dan TPC yakni nilai TVB meningkat setelah proses pengolahan yaitu 16,01 mgN/100g menjadi 31,97 sebelum penyimpanan, hal ini diduga karena proses pengolahan yang menggunakan panas sehingga senyawa-senyawa nitrogen menguap saat proses pemindangan.
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap peningkatan kadar TVB pada ikan pindang selama penyimpanan suhu ruang (Tabel 3). Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan pada jam ke-0 dan jam ke-8 berbeda nyata (p<0,05) dengan penyimpanan jam ke-16, 24 dan 32 tetapi penyimpanan sampai jam ke-8 tidak berbeda nyata (p>0,05). Menurut Syah (2004), semakin lama proses penyimpanan maka kadar TVB akan meningkat disebabkan oleh degradasi protein dan mikroba pembusuk yang menghasilkan basa-basa nitrogen yang mudah menguap. Menurut Ariyani dan Yennie (2008), pada umumnya nilai batas penerimaan TVB untuk ikan segar adalah 30 mgN/100g sedangkan untuk ikan olahan dengan proses penggaraman nilai batas penerimaan TVB adalah 200 mgN/100g, meskipun demikian nilai ini juga tergantung pada jenis/spesies ikan dan cara pengolahan.
Seleksi dan Identifikasi Bakteri Pembentuk Histamin
Hasil seleksi dan identifikasi awal menunjukkan bahwa bakteri mempunyai kemampuan membentuk histamin. Hal tersebut dapat diketahui dari perubahan warna medium Niven dari warna kuning menjadi merah jambu atau
pink sebagaimana tercantum pada Gambar 4. Perubahan warna diakibatkan oleh
bakteri pembentuk histamin pada medium Niven termodifikasi sehingga dapat dijadikan acuan sebagai identifikasi awal. Menurut Mangunwardoyo et al. (2007), histamin yang terbentuk pada medium Niven termodifikasi dapat meningkatkan pH medium, sehingga terjadi perubahan warna dari kuning menjadi merah jambu/pink dengan adanya indikator fenol merah.
19 Gambar 4. Perubahan warna medium dari kuning menjadi merah jambu pada medium Niven termodifikasi oleh koloni bakteri pembentuk histamin A (tanpa
bakteri) B (bakteri telah tumbuh)
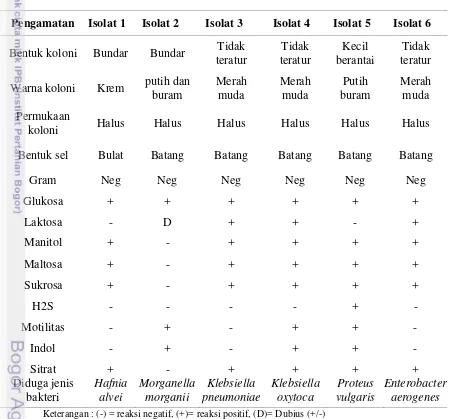
Hasil penelitian ini menunjukkan dari ke-24 isolat yang telah diseleksi dan dimurnikan serta dilakukan identifikasi karakteristik bakteri sehingga diperoleh 6 jenis isolat bakteri dari pindang ikan tongkol yang telah disimpan selama 32 jam.
Hasil Identifikasi ini dilakukan secara konservatif melalui panduan dua buku,
Bergey’s Manual dan Manual for the identification. Hasil identifikasi bakteri dicantumkan pada Tabel 4.
Tabel 4 Hasil identifikasi isolat bakteri pembentuk histamin
Keterangan : (-) = reaksi negatif, (+)= reaksi positif, (D)= Dubius (+/-)
Penelitian NZFSA (2010) menemukan seratus enam puluh delapan strain bakteri tetapi yang berhasil diidentifikasi adalah seratus tiga puluh lima strain bakteri pada ikan asap dengan pemanasan tinggi yakni Pseudomonas (81), Serratia (10), Morganella morganii (9), Hafnia alvei (9), Chryseomonas (8), Staphylococcus (4), Moellerella (4), Acinetobacter (2), Enterobacter (2), Alcaligenes (1), Bacillus (1), Brochothrix (1), Flavobacterium (1), Cellulomonas
Pengamatan Isolat 1 Isolat 2 Isolat 3 Isolat 4 Isolat 5 Isolat 6
20
(1) dan Moraxella (1). Lee et al. (2013) menambahkan saus ikan teri yang difermentasi selama 6 bulan memiliki kadar histamin, hal ini disebabkan oleh bakteri Proteus morganii, Hafnia alvei, dan Klebsiella pneumoniae yang
memproduksi histidin dekarboksilasi. Ariyani dan Faisal (2006) menjelaskan bahwa Klebsiella sp. terdapat pada makanan ataupun minuman namun tidak menimbulkan masalah kesehatan apabila antibodi tubuh seseorang tetap terjaga. Menurut Hidayati et al. (2006), K.pmeuoniae memiliki kapsul yang dapat
meningkatkan pertahanannya terhadap senyawa berbahaya dalam lingkungan dan bakteri patogen yang berhasil diisolasi dari makanan yang telah diolah adalah E. coli, P. vulgaris, K. pneumoniae, K. oxytoca, P. aeruginosa, E. agglomerans, S. aureus, dan S. epidermidis.
Aktivitas bakteri pembentukan histamin
Uji aktivitas perubahan warna pada bakteri dilakukan dengan mengukur diameter area pink/ungu yang terbentuk pada medium Niven’s Agar. Pengujian ini dilakukan untuk melihat bakteri yang mampu merubah warna medium dengan cepat. Perubahan warna ini disebabkan oleh histidin yang terdapat di dalam medium oleh aktivitas bakteri diubah menjadi histamin. Menurut Wei et al.
(1988), adanya histamin dalam medium dapat meningkatkan pH medium sekitar 1,5 unit sehingga indikator fenol red yang mula-mula berwarna kuning akan menjadi pink/merah. Pengukuran bakteri pembentuk histamin dicantumkan dalam Gambar 5.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05) untuk aktivitas bakteri pembentuk histamin
Gambar 5 Aktivitas bakteri pembentuk histamin . Penyimpanan jam ke-8; Penyimpanan jam ke-16; Penyimpanan jam ke-24;
Penyimpanan jam ke-32.
Hasil analisis ragam menunjukkan adanya pengaruh nyata (p<0,05) terhadap aktivitas perubahan warna pada bakteri pembentuk histamin selama penyimpanan 32 jam. Hasil uji lanjut Duncan menunjukkan bahwa penyimpanan selama 16 jam berbeda nyata (p<0,05) dengan penyimpanan 32 jam pada isolat 1, 3, 5 dan 6 sedangkan pada isolat 2 penyimpanan selama 16 jam berbeda nyata dengan penyimpanan 24 dan 32 jam kemudian isolat 4 penyimpanan selama 24 jam berbeda nyata dengan 32 jam penyimpanan. Menurut Mangunwardoyo et al.
(2007), perubahan warna medium merupakan salah satu identifikasi awal yang menunjukkan karakteristik bakteri pembentuk histamin. Semakin lama waktu penyimpanan maka pembentukan histamin akan semakin meningkat berkorelasi
a a
Isolat 1 Isolat 2 Isolat 3 Isolat 4 Isolat 5 Isolat 6
21 dengan peningkatan bakteri. Isolat yang diduga merupakan bakteri penghasil histamin lemah adalah Hafnia alvei. Menurut Kim et al. (2005), Proteus spp dan
Morganella morganii merupakan bakteri yang memberikan kontribusi terbanyak
dalam pembentukan histamin pada suhu kamar. Kung et al. (2009) menjelaskan bahwa Hafnia alvei diidentifikasi sebagai pembentuk histamin yang lemah.
Pengaruh suhu dan pH pada pertumbuhan bakteri pembentuk histamin Setiap mikroorganisme mempunyai respons yang berbeda terhadap faktor lingkungan (suhu, pH, salinitas) tinggi rendahnya suhu mempengaruhi pertumbuhan mikroorganisme. Bakteri dapat tumbuh dalam rentang suhu minus 5oC sampai 80oC, tetapi bagaimanapun juga setiap species mempunyai rentang suhu yang pendek yang ditentukan oleh sensitifitas sistem enzimnya terhadap panas (USDA 2012).
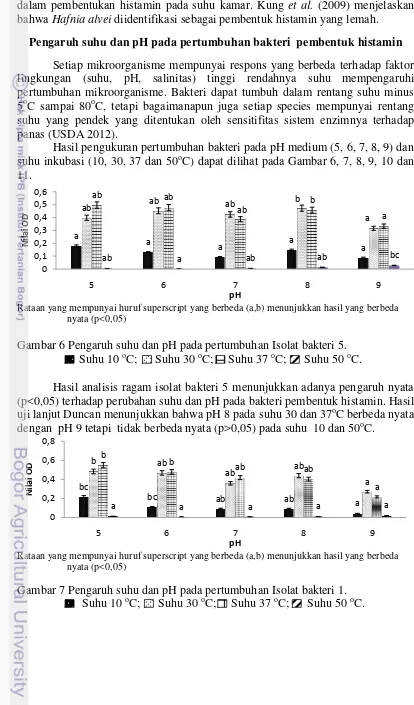
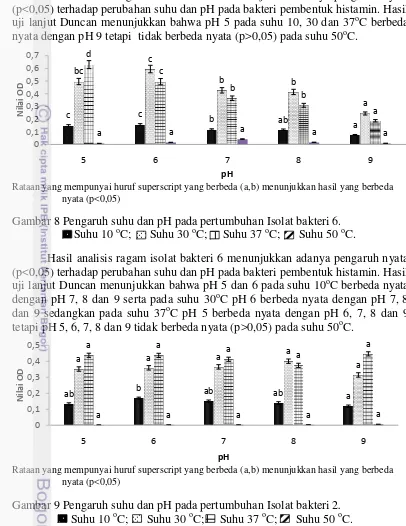
Hasil pengukuran pertumbuhan bakteri pada pH medium (5, 6, 7, 8, 9) dan suhu inkubasi (10, 30, 37 dan 50oC) dapat dilihat pada Gambar 6, 7, 8, 9, 10 dan 11.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 6 Pengaruh suhu dan pH pada pertumbuhan Isolat bakteri 5. Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
Hasil analisis ragam isolat bakteri 5 menunjukkan adanya pengaruh nyata (p<0,05) terhadap perubahan suhu dan pH pada bakteri pembentuk histamin. Hasil uji lanjut Duncan menunjukkan bahwa pH 8 pada suhu 30 dan 37oC berbeda nyata dengan pH 9 tetapi tidak berbeda nyata (p>0,05) pada suhu 10 dan 50oC.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
22
Hasil analisis ragam isolat bakteri 1 menunjukkan adanya pengaruh nyata (p<0,05) terhadap perubahan suhu dan pH pada bakteri pembentuk histamin. Hasil uji lanjut Duncan menunjukkan bahwa pH 5 pada suhu 10, 30 dan 37oC berbeda nyata dengan pH 9 tetapi tidak berbeda nyata (p>0,05) pada suhu 50oC.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 8 Pengaruh suhu dan pH pada pertumbuhan Isolat bakteri 6. Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
Hasil analisis ragam isolat bakteri 6 menunjukkan adanya pengaruh nyata (p<0,05) terhadap perubahan suhu dan pH pada bakteri pembentuk histamin. Hasil uji lanjut Duncan menunjukkan bahwa pH 5 dan 6 pada suhu 10oC berbeda nyata dengan pH 7, 8 dan 9 serta pada suhu 30oC pH 6 berbeda nyata dengan pH 7, 8 dan 9 sedangkan pada suhu 37oC pH 5 berbeda nyata dengan pH 6, 7, 8 dan 9 tetapi pH 5, 6, 7, 8 dan 9 tidak berbeda nyata (p>0,05) pada suhu 50oC.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 9 Pengaruh suhu dan pH pada pertumbuhan Isolat bakteri 2.
Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
23
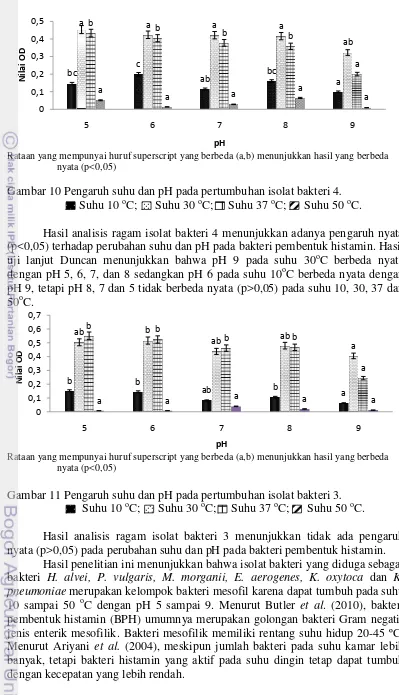
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 10 Pengaruh suhu dan pH pada pertumbuhan isolat bakteri 4. Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
Hasil analisis ragam isolat bakteri 4 menunjukkan adanya pengaruh nyata (p<0,05) terhadap perubahan suhu dan pH pada bakteri pembentuk histamin. Hasil uji lanjut Duncan menunjukkan bahwa pH 9 pada suhu 30oC berbeda nyata dengan pH 5, 6, 7, dan 8 sedangkan pH 6 pada suhu 10oC berbeda nyata dengan pH 9, tetapi pH 8, 7 dan 5 tidak berbeda nyata (p>0,05) pada suhu 10, 30, 37 dan 50oC.
Rataan yang mempunyai huruf superscript yang berbeda (a,b) menunjukkan hasil yang berbeda nyata (p<0,05)
Gambar 11 Pengaruh suhu dan pH pada pertumbuhan isolat bakteri 3. Suhu 10 oC; Suhu 30 oC; Suhu 37 oC; Suhu 50 oC.
Hasil analisis ragam isolat bakteri 3 menunjukkan tidak ada pengaruh nyata (p>0,05) pada perubahan suhu dan pH pada bakteri pembentuk histamin.
Hasil penelitian ini menunjukkan bahwa isolat bakteri yang diduga sebagai bakteri H. alvei, P. vulgaris, M. morganii, E. aerogenes, K. oxytoca dan K. pneumoniae merupakan kelompok bakteri mesofil karena dapat tumbuh pada suhu