PERTUMBUHAN BIBIT
Shorea
s
tenoptera
Burck. F
.
TERHADAP
APLIKASI KOMPOS SERASAH
Shorea
sp. DAN FUNGI
Scleroderma
columnare
PADA TANAH LATOSOL
MOHAMAD SAEFUDIN
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis yang berjudul “Pertumbuhan bibit Shorea stenoptera Burck. F. terhadap Aplikasi Kompos Serasah Shorea sp. dan Fungi Scleroderma columnare pada Tanah Latosol” merupakan gagasan dan karya saya beserta pembimbing yang belum pernah dipublikasikan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulisan lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2014 Mohamad Saefudin NIM E451110151
RINGKASAN
MOHAMAD SAEFUDIN. Pertumbuhan bibit Shorea stenoptera Burck. F. terhadap Aplikasi Kompos Serasah Shorea sp. dan Fungi Scleroderma columnare pada Tanah Latosol. Dibimbing oleh BASUKI WASIS dan ERDY SANTOSO.
Shorea stenoptera Burck. F. memiliki serasah yang lama terdekomposisi. Serasah terdekomposisi secara alami setelah 9 bulan. Serasah yang jatuh dilantai hutan merupakan salah satu siklus produksi hutan. Produksi hara dalam hutan tergantung pada kecepatan dekomposisi dikarenakan tanaman membutuhkan ketersediaan hara yang cukup seimbang. Upaya untuk memaksimalkan siklus hara dengan memanfaatkan mikroorganisme sebagai pengurai (dekomposisi) bahan organik salah satunya dengan aktifator EM4 (Efectivitas Microorganisme). Aktifator ini merupakan formula yang mengandung 13 jenis mikroorganisme, salah satunya adalah bakteri dan fungi. Aktifator EM4 (Efectivitas Microorganisme) dapat mempercepat proses dekomposisi bahan organik dari 3 bulan menjadi 7-14 hari.
Tujuan penelitian ini adalah untuk mengkaji dinamika bakteri N dan P dalam proses pengomposan serasah Shorea stenoptera Burck. F. dan mengamati pemberian inokulasi fungi Scleroderma columnare dan kompos terhadap pertumbuhan bibit Shorea stenoptera Burck. F. Perlakuan dekomposisi serasah dirancang dengan menggunakan rancangan acak lengkap (RAL). Total satu perlakuan dengan pengulangan sebanyak 15 kali ulangan sampel di pertidish. Perlakuan aplikasi kompos dengan fungi dilakukan sebanyak 15 ulangan tanaman. Perlakuan dirancang menggunakan analisis RAL 2 Faktorial, yaitu faktor kompos dan fungi Scleroderma columnare. Faktor kompos terdiri dari 3 taraf yaitu tanpa kompos, kompos utuh, dan kompos cacah, sedangkan faktor fungi Scleroderma columnare terdiri dari 2 taraf, yaitu pemberian Scleroderma columnare dan tanpa Scleroderma columnare. Total satu perlakuan sebanyak 30 kali ulangan. Bahan tanaman yang digunakan adalah benih Shorea stenoptera Burck. F. Serasah yang digunakan adalah serasah dibawah tegakan pohon Shorea stenoptera di kebun percobaan Dramaga.
Hasil penelitian menunjukkan bahwa setiap perlakuan memberikan respon yang berbeda nyata. Perlakuan pengomposan menunjukkan hasil yang berbeda nyata terhadap parameter penyusutan dan total koloni bakteri. Hilangnya bahan organik yang digunakan pada pengomposan sekitar 30%. Respon terbaik oleh tinggi tanaman, jumlah daun, diameter batang, bobot basah daun dan bobot kering batang didapatkan pada perlakuan A1B0 (kompos cacah:tanpa Scleroderma). Respon terbaik oleh bobot basah batang dan presentase koloni didapatkan dengan perlakuan A2B1 (kompos utuh:Scleroderma), sedangkan respon terbaik oleh total bobot akar didapatkan pada perlakuan A0B1 (tanpa kompos:Scleroderma).
SUMMARY
MOHAMAD SAEFUDIN. Growth of Shorea stenoptera Burck. F. seeds to Application Shorea sp. Litter Compost and Fungi Scleroderma columnare on Latosol Soil. Supervised by Dr Ir Basuki Wasis, MS and Dr Ir Erdy Santoso, MSi.
Shorea stenoptera Burck. F. has a long composed litter. Shorea stenoptera Litter naturally decomposes after 9 months. Litter fall to forest floor is one of the production cycle of the forest. Nutrients production the forest depends on the speed of decomposition due to the need of fairly balanced nutrients availability. One of the efforts to maximize the nutrient cycle by utilizing microorganisms as decomposers (decomposition) of organic material is using EM4 activator (effective microorganisms). This activator is a formula that contains 13 kinds of microorganisms, one of which is a bacteria and fungi. EM4 Activator (effective microorganisms) can accelerate the decomposition process of organic matter from 3 months to 7-14 days.
The purpose of this study was to analyze the dynamics of Nitrogen fixing bacterial and P solubling bacteria in the composting process of Shorea stenoptera Burck. F. litter. And to observe the effect of Scleroderma columnare fungi inoculation and compost on Shorea stenoptera Burck.F. seedlings growth. Litter decomposition treatment is designed using a completely randomized design (CRD), a total of one treatment with 15 repetitions samples in petridish. Treatment with fungal compost applications with composting consists of 15 replicates plants. The treatment is designed using 2 Factorial RAL analysis i.e compost and fungi Scleroderma columnare factor. Compost factors consists of three levels i.e without compost, compost intact, compost chopped whereas fungi Scleroderma columnare factor consists of two levels i.e giving Scleroderma columnare and without Scleroderma Scleroderma columnare. A total of 30 repetitions for a treatment. The plant material used is seed Shorea stenoptera Burck. F. Litter used is litter under Shorea stenoptera stands in the Dramaga experiment Garden.
The results showed that each treatment give significantly different responses. Composting treatment showed significantly different results on the shrinkage parameter and total bacterial colonies. The loss of organic materials used in the composting was about 30%. The best response of plant height, number of leaves, stem diameter, leaf fresh weight and dry weight of stem obtained from A1B0 treatment (chopped compost:without Scleroderma). The best response by the wet weight and the percentage of colonies obtained rod from A2B1 treatment (composting intact:Scleroderma), while the best response by the total weight of the roots obtained from treatment A0B1 (without compost:Scleroderma).
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Silvikultur Tropika
PERTUMBUHAN BIBIT
Shorea
stenoptera Burck.F
TERHADAP
APLIKASI KOMPOS SERASAH
Shorea
sp. DAN FUNGI
Scleroderma columnare
PADA TANAH LATOSOL
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Pertumbuhan Bibit Shorea stenoptera Burck. F. terhadap Aplikasi Kompos Serasah Shorea sp. dan Fungi Scleroderma columnare pada Tanah Latosol
Nama : Mohamad Saefudin NIM : E451110151
Disetujui oleh Komisi Pembimbing
Dr Ir Basuki Wasis, MS Ketua
Dr Ir Erdy Santoso, MSi Anggota
Diketahui oleh
Ketua Program Studi Silvikultur Tropika
Prof Dr Ir Sri Wilarso Budi R, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2013 sampai Juni 2014, yang berjudul “Pertumbuhan bibit Shorea stenoptera Burck. F. terhadap Aplikasi Kompos Serasah Shorea sp. dan Fungi Scleroderma columnare pada Tanah Latosol" telah dapat diselesaikan. Tesis ini merupakan salah satu syarat untuk memperoleh gelar Megister Sains Mayor Silvikultur Tropika, Sekolah Pascasarjana, Institut Pertanian Bogor.
Terima kasih penulis ucapkan kepada Bapak Dr Ir Basuki Wasis MS dan Bapak Dr Ir Erdy Santoso MS yang telah banyak memberi saran. Di samping itu, penghargaan penulis sampaikan kepada Bapak Yanto dan Sira dari Laboratorium Mikrobiologi di Pusat Penelitian dan Pengembangan Konservasi dan Rehabilitasi, dan teman-teman di IPB yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayah, ibu, serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Hipotesis 2
2 METODE 2
Bahan 3
Alat 3
Metode Penelitian 3
3 HASIL DAN PEMBAHASAN 9
Hasil 9
Dinamika Pengomposan Serasah 9
Pembahasan 18
4 SIMPULAN DAN SARAN 23
Simpulan 23
DAFTAR PUSTAKA 24
DAFTAR TABEL
1 Dinamika populasi bakteri P dan N 11
2 Analisis kandungan serasah Shorea stenoptera Burck. F. 13 3 Perbandingan pengaruh antar kelompok perlakuan terhadap berbagai
komponen pertumbuhan, biomassa tanaman dan presentasi kolonisasi
mikoriza 15
4 Hasil uji Ducan pengaruh antar perlakuan kompos dan fungi Scleroderma columnare terhadap pertumbuhan, biomassa tanaman dan
presentase koloni mikoriza. 16
DAFTAR GAMBAR
1 Peta pengambilan serasah dan fungi Scleroderma columnare 3
2 Diagram alir kegiatan penelitian 4
3 Kesusutan serasah Shorea stenoptera Burck. F. selama proses
pengomposan. 9
4 Total koloni kompos utuh dan kompos cacah pada media pykovskaya
(PBF) dan carboxy methyl cellulose (CMC). 10
5 Kondisi lingkungan tumpukan serasah selama 5 bulan. K.C (kelembaban di kompos cacah), K.NC (kelembaban dikompos utuh), S.C (Suhu dikompos utuh), S.NC (suhu di kompos utuh), pH.C (pH di
kompos cacah), pH.NC (pH di kompos cacah). 12
6 Hasil aplikasi PCR ITS2 pada media pikovskaya (1) dan carboxy
methyl cellulose (2). 14
7 Pertumbuhan bibit Shorea stenoptera Burck. F. selama 4 bulan setelah tanam (BST). (1) tinggi tanaman: (2) jumlah daun: (3) diameter (4) bobot kering dan bobot basah. A0B0 (tanpa kompos:tanpa Scleroderma), A1B0 (kompos cacah:tanpa Scleroderma), A2B0 (kompos utuh:tanpa Scleroderma), A0B1 (tanpa kompos:Scleroderma), A1B1 (kompos cacah:Scleroderma), A2B1 (kompos utuh:Scleroderma).
Daun BB, Daun BK, Batang BB, Batang BK, 18
8 Penampang akar dengan perbesaran 100 µm: (1) A0B0 (tanpa kompos;tanpa Scleroderma), (2) A1B0 (kompos cacah:tanpa Scleroderma), (3) A2B0 (kompos utuh:tanpa Scleroderma), (4) A0B1 (tanpa kompos:Scleroderma), (5) A1B1 (kompos cacah:Scleroderma), (6) A2B1 (kompos utuh:Scleroderma). (h) hartig net, (m) mantle, (ree)
radial elongation epidermis. 20
9 Pelapukan serasah selama mendapatkan rasio C/N sesuai standar
pengomposan 20
10 Pertumbuhan bibit Shorea stenoptera Burck. F. selama 4 bulan (bulan
setelah tanam). 21
11 Morfologi akar antar perlakuan; (1) A0B0 (tanpa kompos:tanpa Scleroderma), (2) A1B0 (kompos cacah:tanpa Scleroderma), (3) A2B0 (tanpa kompos:Scleroderma), (4) A0B1 (kompos utuh:kompos cacah), (5) A1B1 (kompos cacah:Scleroderma), A2B1 (kompos
DAFTAR LAMPIRAN
1 Runutan sekuen mat-K Alignment runutan nukleotida dan satu species dari GenBank (http://www.ncbi.nlm.nih.gov) kemudian di alignment dari EBL-EBI (http://www.ebi.ac.uk). Media pykovskaya (PBF) 28 2 Runutan sekuen mat-K Alignment runutan nukleotida dan satu species
dari GenBank (http://www.ncbi.nlm.nih.gov) kemudian di alignment dari EBL-EBI (http://www.ebi.ac.uk). Media carboxy methyl cellulose
(CMC) 29
3 Data analisis kadar klorofil 31
4 Data analisis media 32
5 Kondisi Mikroklimat Greenhouse 33
6 Hasil pengamatan pengaruh tanpa kompos, kompos utuh, kompos cacah, fungi Scleroderma columnare dan tanpa Scleroderma columnare terhadap tinggi tanaman, jumlah daun, diameter batang 34 7 Tabel perbandingan antar perlakuan terhadap tinggi tanaman, jumlah
daun dan diameter batang 35
1
1
PENDAHULUAN
Latar Belakang
Shorea stenoptera Burck. F. merupakan pohon yang mendominasi hutan hujan tropis (tropical rain forest). Shorea stenoptera Burck. F. memiliki serasah yang lama terkomposisi. Serasah terdekomposisi secara alami setelah 9 bulan (Osono dan Takeda 2002). Serasah merupakan sisa-sisa tumbuhan yang berada pada lapisan teratas permukaan tanah yang terdiri atas sisa tumbuhan (Millilo et al.1982). Sisa tumbuhan akan terdekomposisi menjadi partikel yang lebih kecil yang mudah diserap oleh tanaman (Vitovsek et al.1994; Sallata et al.1990).
Serasah berjatuhan di lantai hutan salah satu jalur hara dalam siklus produksi hutan (Hindersah dan Simarmarta 2004). Produksi hara dalam hutan tergantung pada kecepatan dekompoisi karena tanaman membutuhkan ketersediaan unsur hara yang cukup dan seimbang. Hara yang seimbang diindikasikan adanya keberadaan mikroba, sehingga dekomposisi bahan organik lebih cepat (Patel et al. 2013).
Usaha untuk memaksimalkan siklus hara dengan memanfaatkan mikroorganisme sebagai pengurai (dekomposisi) bahan organik salah satunya dengan aktifator EM4 (Efectivitas Microorganisme). Higa dan Widadana (1993) mengemukakan bahwa aktifator EM4 dapat mempercepat proses dekomposisi bahan organik dari 3 bulan menjadi 7-14 hari. Aktifator ini merupakan formula yang mengandung 13 jenis mikroorganisme, salah satunya adalah bakteri dan fungi. Mikroorganisme yang terpilih ini bekerja secara sinergik dalam proses dekomposisi sehingga senyawa organik dapat diserap oleh akar tanaman.
Dekomposisi dengan cepat dapat membantu keberadaan fungi di bawah tegakan pohon Shorea stenoptera Burck. F. Selain itu juga dapat membantu proses perkecambahan benih yang berjatuhan di lantai hutan. Siklus unsur hara memiliki hubungan simbiosis dengan fungi (Smith dan Read 2008), keberadaan fungi di area perakaran dapat membantu pertumbuhan pohon Shorea stenoptera Burck. F. (Das dan Patel 2011).
2
Perumusan Masalah
Serasah Shorea sp. merupakan organ tumbuhan yang mati, terdapat di lantai hutan. Serasah Shorea sp. terdekomposisi menjadi partikel lebih kecil membutuhkan waktu yang lama. Semakin bertambahnya waktu, serasah akan menumpuk di lantai hutan. Tumpukan serasah ini dapat mengganggu keberadaannya fungi Scleroderma comunare. Perumusan masalah antara serasah, keberadaan fungi dibawah tegakan pohon Shorea stenoptera Burck. F. terhadap pertumbuhan benih penting untuk dikaji. Penelitian yang diajukan adalah :
1. Bagaimana dinamika bakteri N dan P dalam proses pengomposan Shorea stenoptera Burck. F.
2. Bagaimana peran inokulasi fungi Scleroderma columnare dan pemberian kompos terhadap pertumbuhan bibit Shorea stenoptera Burck. F.
Tujuan Penelitian
Tujuan dari penelitian ini yaitu:
1. Mengkaji dinamika bakteri N dan P dalam proses pengomposan Shorea stenoptera Burck. F.
2. Mengamati pemberian inokulasi fungi Scleroderma columnare dan kompos terhadap pertumbuhan bibit Shorea stenoptera Burck. F.
Hipotesis
Hipotesis pada penelitian ini yaitu:
1. Pada perlakuan pengomposan dengan pencacahan dapat mempercepat pengomposan dan merespon pertumbuhan lebih cepat.
2. Kelompok antar perlakuan A1B0 (kompos cacah:tanpa Scleroderma), A2B1 (kompos utuh:Scleroderma), A0B1 (tanpa kompos:Scleroderma) memberikan respon pertumbuhan dan infeksi lebih baik dibanding dengan A0B0 (tanpa kompos:tanpa Scleroderma).
2
METODE
Waktu dan Tempat Penelitian
3
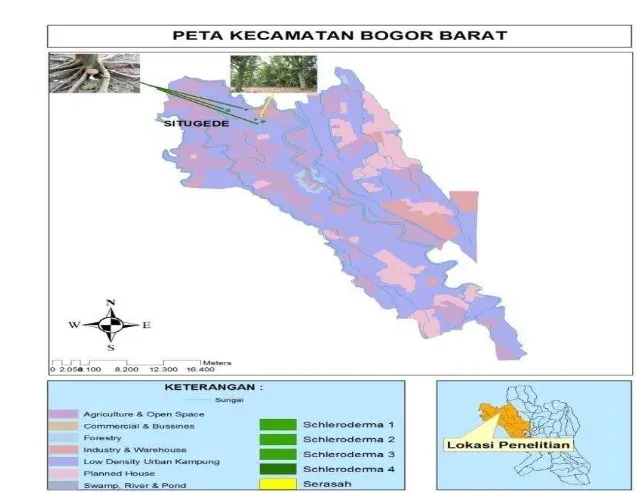
Gambar 1 Peta pengambilan serasah dan fungi Scleroderma columnare
Bahan
Bahan yang digunakan dalam penelitian ini adalah serasah Shorea sp. dan fungi Scleroderma columnare. Bahan kimia yang digunakan untuk identifikasi bakteri N dan P adalah media pikovskoya terdiri atas glukosa, NaCl. Ca (PO ) , (NH ).SO , MgSO , FeSO , MnSO , Yeast Ekstrak, Agar, Aquadest 250 mL, pH 7,2. Media Carboxy methyl Cellulose (CMC) terdiri atas NaNo , K HPO , MgSO , CMC Sodiumsal, Pepton, Agar, Aquades, pH 6,8. 0.5. Pewarnaan gram negatif dan positif adalah Methylen blue, Safranin, Crystal Violet. Elektroforesis adalah aquades, buffer TAE. 0.8 gram agarosa dan larutan etidium bromide (EtBr). PCR (Polymerase Chain Reaction) adalah Go Taq Master Mix, Dd H2O, Primer 27F, Primer 1492 R dan 60 μl aquabidest steril.
Alat
Alat yang digunakan dalam penelitian ini meliputi; laminar air flow cabinet, mikroskop, autoklaf, timbangan analitik, labu erlenmeyer, mikropipet dan tip, colony counter, hot plate stirrer dan stirre bar, pipet ukur, pipet tetes, tabung reaksi, labu erlenmeyer, gelas ukur, beaker glass, pembakar bunsen, jarum inokulum, pinset, pipet filler, motar, pH indikator universal, open, kertas parafilm, UV transluminator, elektroforesis, kamera Bio-red dan Axygen scientific.
Metode Penelitian
4
dan anatomi akar. Tahap penelitian pertama yaitu analisis dekomposisi serasah, media bakteri, isolasi bakteri selulosa dan fosfat, identifikasi molekuler, analisis data. Tahap penelitian kedua adalah pengambilan tanah, penyemaian, penanaman, komposisi fungi Scleroderma columnare, inokulasi fungi Scleroderma columnare, pengamatan pertumbuhan meliputi tinggi tanaman, jumlah daun, diameter batang, bobot kering dan bobot basah tanaman, analisis serapan unsur hara pada daun dan media meliputi C-Organik, N, P, K, KTK, kadar klorofil, analisis data.
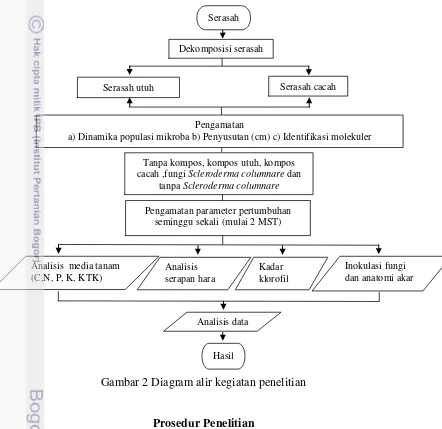
Gambar 2 Diagram alir kegiatan penelitian
Prosedur Penelitian
Penelitian ini dilaksanakan melalui 2 (dua) tahapan yaitu tahap mengamati dinamika bakteri merombak serasah meranti dan identifikasi bakteri. Tahap kedua mengkaji inokulasi fungi Scleroderma columnare dan kompos terhadap pertumbuhan bibit Shorea stenoptera Burck. F.
Pengamatan
a) Dinamika populasi mikroba b) Penyusutan (cm) c) Identifikasi molekuler Dekomposisi serasah
serasah
Serasah cacah Serasah utuh
Tanpa kompos, kompos utuh, kompos cacah ,fungi Scleroderma columnare dan
5
Penelitian Identifikasi Bakteri
Penelitian tahap pertama mengamati dinamika bakteri merombak serasah meranti dan mengetahui jenis bakteri. Tahap penelitian pengomposan serasah meranti yaitu analisis dekomposisi serasah, media tumbuh bakteri, teknik identifikasi molekuler.
Analisis dekomposisi serasah
Analisis dekomposisi serasah Shorea stenoptera Burck. F. bertujuan mengetahui dinamika bakteri selulosa dan fosfat yang merombak bahan organik dan jenis bakteri yang potensial. Yuliarti (2009) menyatakan bahwa tinggi pengomposan dengan tinggi ketebalan 25 cm, sedangkan tinggi ketebalan yang dilakukan penelitian ini adalah 67 cm. Pemotongan serasah pada perlakuan kompos cacah adalah 0.7-1 cm2. Pengomposan dilakukan selama 5 bulan dengan pengukuran temperature dan kesusutan (cm) dilakukan setiap 2 minggu (Higa dan Widana 1993).
Media
Penyediaan media bakteri dalam dekomposisi merupakan proses mengetahui jenis dan dinamika bakteri yang terdapat pada serasah meranti. adapun media yang digunakan dalam proses isolasi bakteri ini terdiri atas media pikovskaya (BPF) dan carboxy methyl cellulose (CMC). Komposisi media sebagai berikut: Media pikovskoya terdiri atas 2.5 gram glukosa, 0.05 g NaCl. Ca (PO ) 1.22 g, (NH ).SO 0.12 g, MgSO .7H O 0.05 g, FeSO 0.03 g, MnSO 0.03 g, Yeast Ekstrak 0.12 g, Agar 5 g, Aquadest 250 mL, pH 7.2. Media Carboxy methyl cellulose (CMC) terdiri atas NaNo 0.25 g, K HPO 0.25 g, MgSO 0.125 g, CMC Sodiumsal 1 g, Pepton 0.5 g, Agar 8.5 g, Aquades 250 mL, pH 6,8 (Rao 2011).
Isolasi bakteri selulosa dan fostat
Bakteri selulosa dan fosfat diambil dari serasah meranti yang terdekomposisi pada proses pengomposan. Sampel serasah diambil sebanyak 1 ml dimasukan ke dalam tabung reaksi pertama yang berisi 9 ml aquades steril, dari tabung reaksi pertama di ambil lagi sebanyak 0,1 ml dan dimasukan ke tabung reaksi kedua. Proses serupa dilakukan sampai tabung ke delapan sehingga terjadi seri pengenceran 10-1-10-8. Setelah seri pengenceran selesai kemudian di masukan ke dalam media pikovskaya (BPF) dan carboxy methyl cellulose (CMC). Pengamatan bakteri dilakukan setiap 24 jam dengan mencatat jumlah bakteri selama 1 minggu. Karakteristik bakteri yang diamati meliputi sel coccus, rod, shortrod. Tahap berikutnya dengan dilanjutkan dengan uji gram positif dan negatif (Dworkin et al. 2006).
Identifikasi bakteri molekuler
6
Isolasi Bakteri. Koloni bakteri dalam medium diremajakan selama 24 jam. koloni di ambil sebanyak 1 ose dimasukan kedalam tabung eppendof steril berisi 40 μl aquabidest steril. DNA yang telah dicairkan tersebut siap digunakan untuk elektroforesis atau disimpan sebagai stock pada suhu 20ºC. Proses Elektorforesis DNA. Larutkan 10x bufer TAE diencerkan menjadi 0.5 bufer TAE. Kemudian dibuat gel agarosa 0.8% yaitu 0.8 gram agarosa. Setelah membeku diletakkan kedalam tangki elektroforesis yang telah berisi 0.5x bufer TAE sehingga gel terendam. Sebanyak 2μl dari masing-masing DNA dicampur dengan 3 μl loading bufer sebagai pembobot. Suspensi larutan DNA dengan loadingbufer diinjeksikan kedalam sumur-sumur pada gel elektroforesis. Setelah semua sumur terisi, power supply perangkat elektroforesis dinyalakan dengan voltase sebesar 110 V selama ± 45 menit. Gel hasil elektroforesis di angkat dan selanjutnya direndam dalam larutan etidium bromide (EtBr) selama 10 menit untuk pewarnaan (staining) dan destaining dalam akuades selama 5 menit. Selanjutnya DNA dapat dilihat dan difoto menggunakan kamera Biored.
Proses Polymerase Chain Reaction (PCR) diawali dengan pembuatan campuran komponen reaksi untuk PCR sebanyak 50 μl komposisi sebagai berikut: Go Taq Master Mix 75 ml , Dd H2O 48 ml, Primer 27F ml, Primer 1492 R 6 μl dan 60 μl aquabidest steril. PCR dilakukan sebanyak 30 siklus dengan kondisi sebagai berikut, denaturasi siklus awal atau pra-denaturasi untuk siklus selanjutnya pada suhu 94ºC selama 5 menit, diikuti denaturasi untuk siklus selanjutnya pada suhu 94ºC selama 30 detik. Penempelan primer (annealing) dilakukan selama 30 detik pada suhu 50ºC. Polimerisasi dilakukan selama 2 menit pada suhu 72ºC dan pada siklus terakhir, yaitu siklus ke-30 dilakukan perpanjangan waktu polimerisasi selama 7 menit. Terakhir dilakukan penurunan suhu ke 4ºC untuk menghentikan reaksi PCR. Produk hasil PCR divisualisasi dengan menggunakan elektroforesis gel agarosa 1.0 % dalam 0.5x bufer TAE dengan voltase 110 volt selama ± 45 menit (Patel et al. 2013).
Pengurutan DNA hasil amplifikasi dilakukan dengan memanfaatkan jasa perusahaan sekuensing 2st Base di Singapura. Sekuensing yang diperoleh dijajarkan dengan data GenBank menggunakan program Basic Local Aligument Search Tool-Aligument Seach Tool Nucleotide 6-frame translation-protein (BLAST) dan Basic local Alignument Search Tool Nucleotide 6-frame translation-protein (BLAST-N) dari situs National Center for biotechnology information (NCBI) melalui http://www.ncbi.nlm.nih.gov untuk mengetahui tingkat kemiripan gen dan 16 rRNA dari isolat yang di analisis.
Analisis data
7
Aplikasi kompos serasah Shorea sp. dan fungi Scleroderma columnare
Setelah identifikasi bakteri pada proses pengomposan daun meranti, selanjutnya dilakukan penelitian tahap kedua, yaitu aplikasi di lapangan dengan menggunakan fungi Scleroderma columnare pada perlakuan fungi Scleroderma columnare yang dikombinasikan dengan kompos dari serasah Shorea sp. terhadap pertumbuhan bibit Shorea stenoptera Burck. F. Tahap pelaksanaan penelitian adalah :
Pengambilan tanah
Pengambilan tanah di IPB Dramaga dengan menggunakan metode Sulaeman dan Evianti (2009), Tanah latosol di ambil dari kampus IPB dengan melakukan pengeboran sedalam 20 cm pada 5 titik. Setiap titik pengambilan tanah dilakukan pengayakan hingga mendapatkan partikel tanah yang seragam (Brady dan Weil 2002). Tanah yang sudah seragam ukuran partikelnya dilakukan sterilisasi dengan menggunakan autoclaf pada suhu 105oC selama 8 jam. Tanah yang steril di analisis kandungan C-organik, N, P, K, KTK.
Penyemaian
Benih Shorea stenoptera Burck.F. diambil di Kebun Percobaan Hourbentes Jasinga Bogor. Benih direndam dengan menggunakan air biasa bertujuan untuk membersihkan kotoran. Tahap selanjutnya menyeleksi benih dengan melihat bentuk fisik masih baik dan ukuran seragam. Penyeleksian selesai, benih disetrilisasi dengan menggunakan fungisida selama 2 jam bertujuan untuk mengeluarkan bahan organik yang menempel pada benih. Benih disemai pada tanah dalam keadaan steril selama 1 bulan.
Penanaman
Benih berumur 1 bulan di seragamkan tinggi tanamannya, perlakuan yang diberikan fungi Scleroderma columnare dengan memberikan 3 tetes kebagian akar Shore stenoptera Burck. F. Penanaman benih dengan menggunakan polybag berukuran 10x15 cm.
Komposisi fungi Scleroderma columnare
Fungi Scleroderma columnare ditimbang 0,15 gram kemudian dicampur dengan air 0,3 liter dengan 3 tetes polyoxthylen sorbitan monolaurat, aduk komposisi fungi sampai rata. Suspensi spora tersebut digunakan pada 150 bibit (SNI 2006). Rumus perhitungan fungi dengan menggunakan metode Brundrett et al (1995), perhitungan fungi Scleroderma columnare :
Persen Kolonisasi = Ʃ PAT
Ʃ PAT + Ʃ PATTX 100%
keterangan: Ʃ = jumlah
8
Analisis Histologi
Analisis anatomi akar dengan menggunakan metode Sass (1985). Metode dimulai dengan merendam akar menggunkan FAA (formaldehid Acetic Acid alcohol) selama 24 jam. Tahap dehidrasi dengan menggunakan alkohol bertingkat 30%, 50%, 70%, 95% dan 100% masing-masing selama 3 menit. Proses ini dilanjutkan parafin, dengan menggunakan alkohol dan xylol secara bergantian, pergantian tahapan dalam perendaman akar selama 5 menit lalu di strectcher (hot plate) suhu 55ºC. Hasil parafin dilakukan tahap pewarnaan akar, proses pewarnaan yaitu preparat direndam dengan asetat 10% selama 5 detik kemudian preparat dicuci dengan pewarna safranin 0,5% dan alcia blue 1% selama 12 jam. Preparat direndam dengan seri pengenceran bertingkat alkohol 30%, 50%, 70%, 95% dan 100% masing-masing selama 3 menit. Setelah diwarnai dengan fast-green dalam alkohol absolut I, alkohol absolut II dan alkohol absolut I lalu carbol-xilol dan carbol-xilol I, carbol-xilol 2 dan carbol-xilol III perendaman selama 3 menit. Hasil parafin kemudian dicetak dan hasil potongan dengan menggunakan mikrotom dengan ukuran 5-10 µm. Perekatan (mounting) pada gelas objek yang berisi preparat ditetesi etellan lalu tutup secara hati-hati. Preparat yang sudah ditetesi ettelan di keringkan pada pemanas (hot plate) suhu 55oC. Pengamatan preparat akar dengan menggunakan mikroskop nikon N-STORM Super Resolution Microscope dengan perbesaran 100 µm.
Pengamatan Pertumbuhan Shorea stenoptera Burck. F.
Parameter yang diamati pada pertumbuhan Shorea stenoptera Burck. F adalah tinggi tanaman, diameter, jumlah daun, bobot kering total dan bobot basah total.
Analisis serapan unsur hara
Analisis kandungan unsur hara pada penelitian ini adalah kadungan unsur hara tanah dan jaringan tanaman. Analisis dilakukan pada awal dan akhir penanaman, yang akan di analisis kandungan meliputi C-Organik, N, P, K, KTK dan pH.
Analisis data
Penelitian dirancang menggunakan analisis RAL 2 Faktorial yaitu faktor kompos dan fungi Scleroderma columnare. Faktor kompos terdiri dari 3 taraf yaitu tanpa kompos, kompos utuh, kompos cacah sedangkan faktor fungi Scleroderma columnare terdiri dari 2 taraf yaitu pemberian Scleroderma columnare dan tanpa Scleroderma columnare. Perlakuan dilakukan pengulangan sebanyak 3 kali ulangan tanaman. Total satu perlakuan sebanyak 30 kali ulangan tanaman.
Analisis uji lanjut
9
3
HASIL DAN PEMBAHASAN
Hasil
Dinamika Pengomposan Serasah
Serasah diambil di kebun percobaan Dramaga Bogor. Kebun percobaan menurut administrasi pemerintahan termasuk ke dalam wilayah Situ Gede dan Bubulak, Kecamatan Bogor Barat, Kota Madya Bogor. Batasan secara Geografis lokasi penelitian terletak pada 6033’8”LS dan 106044’55” sampai 1060105’19” BT. Jarak lokasi 9 meter dari arah barat.
Luas kebun percobaan 60 ha dan statusnya sebagai kebun penelitian Departemen Kehutanan RI Badan Penelitian dan Pengembangan Kehutanan. Iklim curah hujan setahun 3.552 mm, hari hujan 187. Temperatur maksimum sebesar 30,1oC minimum sebesar 20,1oC dengan kelembaban sebesar 88,33%. Kondisi tersebut merupakan tipe A yang merupakan iklim Tropika Basah. Topografi kebun percobaan datar sampai agak berombak dengan kelerengan 0-6% dan terletak pada ketinggian 220 meter atas permukaan laut.
Pengambilan serasah di petak no 178 dengan jenis tanaman Shorea stenoptera Burck. F. dengan kelompok Depterocarpace asal Kalimantan yang ditanam pada tahun 1974 dengan jumlah tanaman sebanyak 8 pohon dengan jarak tanam 5 meter. Dinamika penyusutan tinggi pengomposan serasah ditunjukkan Gambar 3.
Gambar 3 Penyusutan serasah Shorea stenoptera Burck. F. selama proses
pengomposan
Tumpukan serasah yang akan digunakan dalam pengomposan memiliki ketinggian serasah sebesar 67 cm. Gambar 3 menunjukan bahwa laju penyusutan serasah kompos cacah lebih tinggi dibandingkan dengan serasah kompos utuh. Kompos utuh pada hari ke-14 mengalami penurunan sebanyak 1,3 cm, sedangkan kompos cacah penurunannya sebanyak 2,6 cm. Pengamatan yang sama dilakukan pada kompos matang (hari ke-150) tetap mengalami perbedaan dalam banyaknya penyusutan. Pada kompos utuh mengalami penyusutan sebanyak 1,8 cm, sedangkan pada kompos cacah penurunan sebanyak 3,2 cm. Total penyusutan
10
pada perlakuan kompos utuh dengan kompos cacah yaitu kompos utuh sebesar 18 cm sedangkan kompos cacah sebesar 32 cm. Penyusutan dapat terjadi karena penurunan kandungan tanin sehingga menghambat pertumbuhan pathogen yang tidak menguntungkan (Higa dan Wididana 1994).
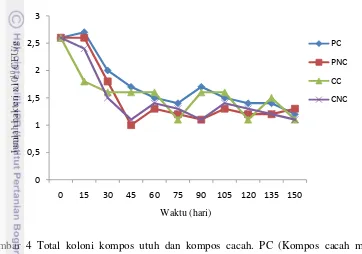
Pertumbuhan bakteri yang menguntungkan telah dilakukan pengamatan setiap 2 minggunya. Hasil pengamatan dinamika populasi bakteri pada pengomposan disajikan pada Gambar 4.
Gambar 4 Total koloni kompos utuh dan kompos cacah. PC (Kompos cacah media pykovskaya), PNC (kompos utuh media pykovskaya), CC (kompos cacah media selulosa), CNC (kompos utuh media selulosa).
11 Tabel 1. Dinamika populasi bakteri P dan N
Hari ke
Ket: BPF (media Pykovskaya), CMC (media carboxy methyl cellulose).
Dinamika populasi selama pengomposan menunjukkan bahwa terjadi penurunan populasi bakteri (Tabel 1). Gambar 3 dan Gambar 4 menunjukkan bahwa total koloni selama 15 hari mengalami peningkatan pada fase stasioner, posisi stasioner tidak terjadi penurunan populasi bakteri. Fase stasioner merupakan fase dimana sel-sel mulai tumbuh tidak tumbuh lagi. Hal ini disebabkan oleh penyusutannya nutrien pada tumpukan serasah, keterbatasan oksigen bagi organisme. Bakteri N dan P merombak bahan organik dengan membentuk kista (Madigan et al. 1997) dan vesikel (Insam et al. 2002).
Populasi bakteri menurun karena bakteri memerlukan sumber karbon bagi pertumbuhan dengan cara mengubah karbon tersebut menjadi material sel melalui proses asimilasi. Bakteri N dan P menggunakan senyawa organik sebagai sumber karbonnya (Lim 1998). Sumber karbon yang digunakan oleh bakteri adalah molases. Molases mengandung kadar gula sekitar 45-58% yang tersusun dari sukrosa, glukosa, fruktosa dan komponen lainnya sehingga masih dapat digunakan sebagai sumber karbon yang baik bagi pertumbuhan bakteri (Novita 2001).
Kemampuan mikroba untuk memperoleh energi pada kondisi lingkungan (Gambar 5) bergantung pada kemampuan metabolisme untuk mengoksidasi senyawa karbon (bahan organik) sebagai sumber energi utama. Karbon dalam metabolismenya berperan penting untuk menghasilkan energi melalui oksidasi senyawa tersebut dan menyediakan unsur C untuk membentuk material sel (Pascott et al. 2000).
12
Bakteri yang tumbuh ditumbukan serasah salah satunya mendapatkan asam amino. Asam amino ini digunakan oleh bakteri sebagai sumber nutirsi. Kebutuhan asam amino dapat disediakan sebagai asam amino bebas yang dapat didegrasi oleh bakteri N dan P sebelum atau setelah masuk kedalam sel. Sel yang didalam menghasilkan asam organik di dalam siklus Tricarboxylic (TCA). Asam amino yang dihasilkan dari diaminasi akan berubah menjadi sumber nitrogen untuk biosintesis (Lim 1998).
Faktor penyebab terjadinya perubahan dinamika pertumbuhan bakteri adalah kandungan nutrisi pada tumpukan kompos, pemberian aerasi, pH, ketersediaan oksigen dan suhu. Faktor ini mempengaruhi populasi mikroba pada tumpukan serasah dan peran mikroba dalam penyusutan serasah Shorea sp. Faktor penyebab terjadinya perubahan dinamika pertumbuhan adalah kandungan nutrisi pada media, pemberian aerasi, pH, ketersediaan oksigen, suhu, dan kelembaban (Guo dan Sim 1999). Faktor ini mempengaruhi populasi mikroba dalam tumpukan serasah dan peran bakteri dalam proses penyusutan.
Kondisi lingkungan yang stabil dapat membantu adaptasi bakteri dalam proses perombakan bahan organik menjadi lebih cepat. Namun suhu yang lebih tinggi dari 60oC dapat menghambat pertumbuhan bakteri. Keterbatasan nutrisi di tumpukan serasah seperti karbohidrat, protein, nitrogen dan oksigen juga dapat mempengaruhi perkembangan bakteri (White1995).
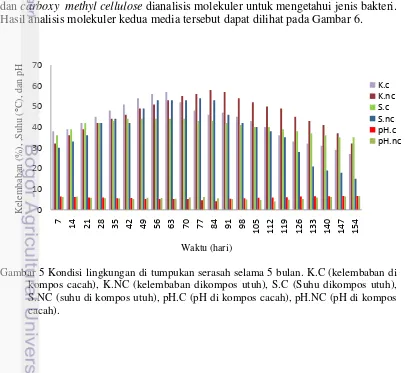
Suhu lingkungan pengomposan dijaga supaya tidak melebihi 60oC dengan menggunakan karung goni. Karung goni ini memiliki lubang pori-pori di semua sisinya yang berfungsi untuk menstabilkan suhu di tumpukan serasah Shorea sp. Stabilisasi kondisi tumpukan serasah dapat membantu adaptasi dan perkembangan bakteri yang disajikan pada Gambar 5 dan Tabel 1. Bakteri dari media pikovskaya dan carboxy methyl cellulose dianalisis molekuler untuk mengetahui jenis bakteri. Hasil analisis molekuler kedua media tersebut dapat dilihat pada Gambar 6.
Gambar 5 Kondisi lingkungan di tumpukan serasah selama 5 bulan. K.C (kelembaban di kompos cacah), K.NC (kelembaban dikompos utuh), S.C (Suhu dikompos utuh), S.NC (suhu di kompos utuh), pH.C (pH di kompos cacah), pH.NC (pH di kompos cacah).
105 112 119 126 133 140 147 154
13
Perubahan kondisi lingkungan yang diamati pada tumpukan serasah selama 5 bulan meliputi perubahan suhu, kelembaban, dan pH (Gambar 5). Semua parameter mengalami peningkatan pada hari ke-7 sampai hari ke-84, selanjutnya mengalami penurunan. Parameter yang tidak mengalami penurunan yaitu pH. Pengukuran pH pada minggu pertama (7 hari) sebesar 6,8 kemudian mengalami penurunan menjadi 5 pada minggu ke 11 dan 12 (77-84 hari).
pH pengombosan mengalami perubahan karena adanya pembentukan asam organik pada proses dekomposisi bahan organik. Kondisi asam akan membantu pertumbuhan bakteri dalam mendekomposisi lignin dan selulosa pada bahan pengomposan. Selama pengomposan berlangsung, asam organik akan berubah menjadi netral. Perubahan dapat terjadi karena kondisi aerobik berkembang selama pengomposan. Kondisi erobik dapat dijaga dengan mengembalikan tumpukan kompos, hak tersebut untuk mengurangi kehilangan nitrogen dan menjaga kondisi asam. Nitrogen yang tersimpan akan digunakan oleh tanaman pada proses pertumbuhan (Higa dan Widadana 1993).
Karakteristik kompos yang sudah matang dapat dilihat dari perubahan warna menjadi hitam, bentuk awal sudah melapuk, tidak bau dan suhu tumpukan kompos mendekati suhu ruang bila di raba (Insam et al. 2002). Hal tersebut dapat dilihat pada Gambar 9. Komposan yang sudah matang, kemudian dianalisis kandungan haranya. Hasil analisis kandungan hara pada kompos serasah Shorea sp. selama 5 bulan disajikan pada Tabel 2.
Tabel 2. Analisis kandungan serasah Shorea stenoptera Burck. F.
Analisis perlakuan kadar air C-organik N C/N P K
1 Kompos cacah 32,55 25,55 1,64 16 0,05 0,08
Kompos utuh 16,7 22,21 1,58 14 0,05 0,11
2 Kompos cacah 29,72 2,04 15 0,02 0,12
Kompos utuh 36,32 2,13 17 0,02 0,11
Ket: N (nitrogen), C/N (C-organik/nitrogen), P (fosfat), K (kalium).
Hasil analisis kandungan kompos menunjukkan bahwa penggunaan karung goni dapat menjaga kestabilan temperatur, kelembaban dan pH dengan baik. Hal ini dapat dilihat dari nilai rasio C/N kompos serasah Shorea sp. yang kurang dari 20 (Tabel 2). Rasio C/N yang kurang dari 20 menunjukkan bahwa serasah terdekomposisi dengan cepat dan mudah diserap oleh tanaman (Setyorini et al. 2006). Rasio C/N kurang dari 20 ini menunjukan kebutuhan N dalam bentuk NO3
danIon NH4 tercukupi sedangkan rasio C/N lebih tinggi dari 20 terjadi persaingan
akan kebutuhan N tersedia.
14
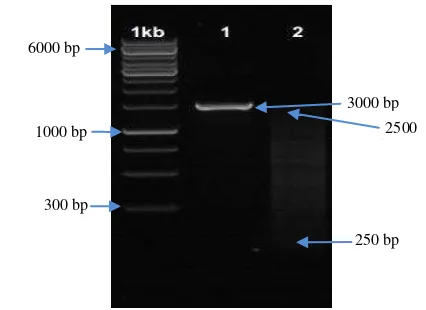
Gambar 6 Hasil aplikasi PCR ITS2 pada bakteri dari media pikovskaya (1) dan carboxy
methyl cellulose (2).
Hasil aplikasi PCR ITS2 pada bakteri yang berasal dari media (1) menunjukan band yang terlihat jelas dengan amplifikasi 3000 bp. Namun band bakteri yang berasal dari media (2) tidak terlihat jelas. Hal ini diduga terjadi karena sampel kurang murni. Upaya untuk memperoleh pita DNA yang utuh dan baik dapat dilakukan dengan ekstraksi DNA secara hati-hati dan pemberian kosentrasi primer dengan tepat (Insam et al. 2002).
Pertumbuhan bibit Shorea Stenoptera Burck. F. terhadap Aplikasi Kompos Serasah Shorea sp. dan Fungi Scleroderma columnare pada Tanah Latosol
Perlakuan pada penelitian ini adalah faktor kompos, terdiri dari 3 taraf yaitu kompos, kompos utuh, dan kompos cacah. Faktor Scleroderma columnare terdiri dari 2 taraf yaitu pemberian Scleroderma columnare dan tanpa Scleroderma columnare. Parameter yang diamati dalam penelitian ini adalah pertumbuhan, jumlah daun, diameter, biomassa tanaman dan presentase koloni mikoriza. Parameter yang diamati dianalisis dengan uji duncan untuk mengetahui pengaruh kompos dan fungi Scleroderma columnare terhadap pertumbuhan, biomasa tanaman dan presentase koloni mikoriza. Hasil pengamatan disajikan pada Tabel 4. Perbandingan pengaruh antar kelompok perlakuan terhadap pertumbuhan, biomassa tanaman dan presentase koloni mikoriza disajikan pada Tabel 3.
Pengomposan pada penelitian ini menggunakan serasah Shorea sp. yang menumpuk di bawah tegakan pohon Shorea stenoptera Burck. F. Kompos merupakan material yang menyediakan sumber nutrien penting dalam mendukung pertumbuhan dan perkembangan mikroorganisme. Ketersediaan kompos dan keberadaan fungi Scleroderma columnare memiliki peran yang berbeda, hubungan antara perlakuan terhadap pertumbuhan dan biomassa tanaman diberikan pada Gambar 7.
1000 bp
3000 bp 6000 bp
250 bp 2500 bp
15
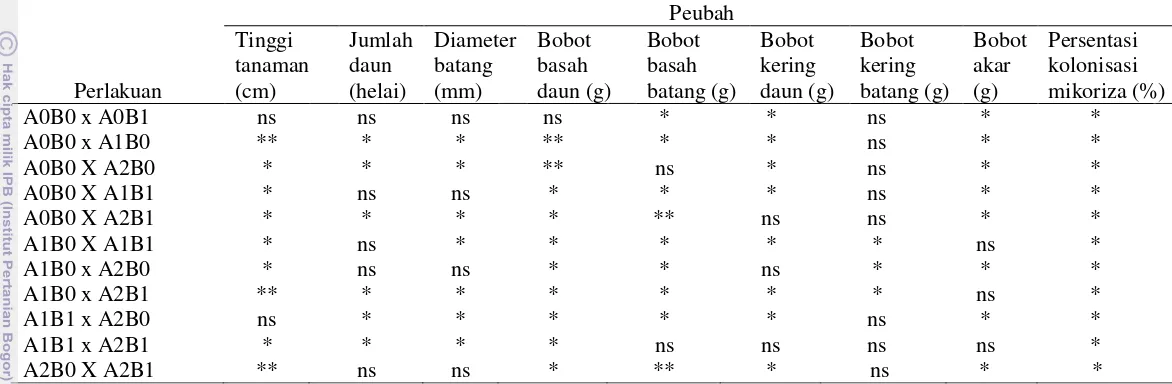
Tabel 3 Perbandingan pengaruh antar kelompok perlakuan terhadap berbagai komponen pertumbuhan, biomassa tanaman dan presentasi kolonisasi mikoriza.
Perlakuan
16
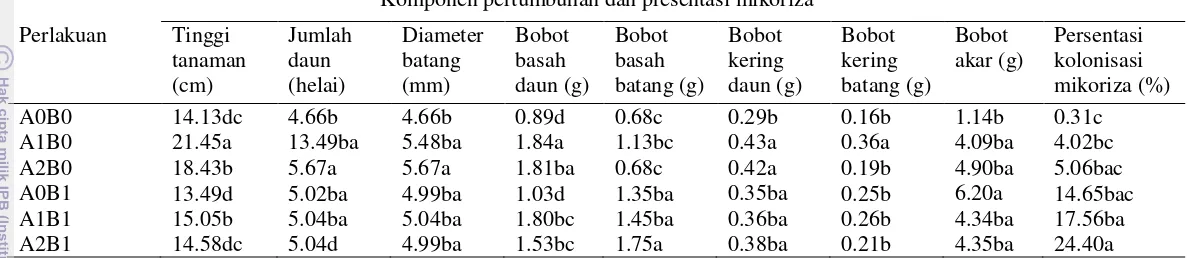
Tabel 4. Hasil uji duncan pengaruh antar perlakuan kompos dan fungi Scleroderma columnare terhadap pertumbuhan, biomassa tanaman dan presentase koloni mikoriza.
Komponen pertumbuhan dan presentasi mikoriza
A0B0 14.13dc 4.66b 4.66b 0.89d 0.68c 0.29b 0.16b 1.14b 0.31c
A1B0 21.45a 13.49ba 5.48ba 1.84a 1.13bc 0.43a 0.36a 4.09ba 4.02bc
A2B0 18.43b 5.67a 5.67a 1.81ba 0.68c 0.42a 0.19b 4.90ba 5.06bac
A0B1 13.49d 5.02ba 4.99ba 1.03d 1.35ba 0.35ba 0.25b 6.20a 14.65bac
A1B1 15.05b 5.04ba 5.04ba 1.80bc 1.45ba 0.36ba 0.26b 4.34ba 17.56ba
A2B1 14.58dc 5.04d 4.99ba 1.53bc 1.75a 0.38ba 0.21b 4.35ba 24.40a
Ket: A0B0 (tanpa kompos:tanpa Scleroderma), A1B0 (kompos cacah:tanpa Scleroderma), A2B0 (kompos utuh:tanpa Scleroderma), A0B1 (tanpa kompos:Scleroderma), A1B1 (kompos cacah:Scleroderma), A2B1 (kompos utuh:Scleroderma). Angka yang diikuti huruf yang sama pada lajur
17
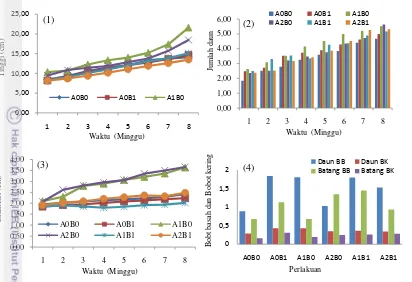
Gambar 7 Kurva pertumbuhan bibit Shorea Stenoptera Burck. F. selama 4 bulan setelah tanam (BST). (1) tinggi tanaman; (2) jumlah daun; (3) diameter (4) Bobot kering dan bobot basah. A0B0 (tanpa kompos:tanpa Scleroderma), A1B0 (kompos cacah:tanpa
Scleroderma), A2B0 (kompos utuh:tanpa Scleroderma), A0B1 (tanpa
kompos;Scleroderma), A1B1 (kompos cacah:Scleroderma), A2B1 (kompos utuh:Scleroderma). Daun BB (daun bobot basah), Daun BK (daun bobot kering), Batang BB (batang bobot basah), Batang BK (batang bobot kering).
Perbedaan perlakuan terhadap pertumbuhan, biomassa tanaman pertumbuhan menunjukkan hasil yang berbeda nyata. Hasil pengamatan menunjukkan bahwa perlakuan A1B0 (kompos cacah:tanpa Scleroderma) memiliki respon terbaik terhadap tinggi tanaman, jumlah daun, diameter batang, bobot basah daun dan bobot kering batang. Perlakuan A2B1 (kompos utuh:Scleroderma) menunjukkan hasil yang berpengaruh nyata terhadap bobot basah batang dan presentase infeksi koloni Scleroderma columnare terbaik di antara perlakuan lainnya (Gambar 7 dan Tabel). Hal ini terjadi dikarenakan saat media tanam diposisi pH 5, fungi Scleroderma columnare membantu awal adaptasi tanaman sehingga hubungan simbiosis mutualisme dalam transportasi hara berjalan dengan baik. Hasil pemberian kompos lebih baik dibanding dengan pemberian Scleroderma columnare, hal ini terjadi dikarenakan unsur hara di kompos mencukupi kebutuhkan tanaman sehingga peran fungi Scleroderma columnare lebih lambat dalam transportasi hara.
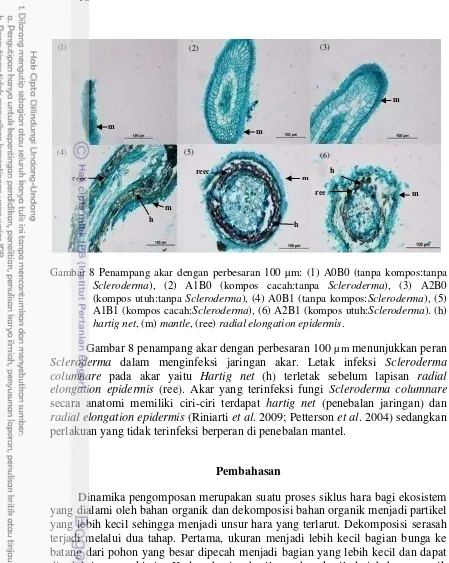
18
Gambar 8 Penampang akar dengan perbesaran 100 µm: (1) A0B0 (tanpa kompos:tanpa Scleroderma), (2) A1B0 (kompos cacah:tanpa Scleroderma), (3) A2B0
(kompos utuh:tanpa Scleroderma), (4) A0B1 (tanpa kompos:Scleroderma), (5)
A1B1 (kompos cacah:Scleroderma), (6) A2B1 (kompos utuh:Scleroderma). (h)
hartig net, (m) mantle, (ree) radial elongation epidermis.
Gambar 8 penampang akar dengan perbesaran 100 µm menunjukkanperan Scleroderma dalam menginfeksi jaringan akar. Letak infeksi Scleroderma columnare pada akar yaitu Hartig net (h) terletak sebelum lapisan radial elongation epidermis (ree). Akar yang terinfeksi fungi Scleroderma columnare secara anatomi memiliki ciri-ciri terdapat hartig net (penebalan jaringan) dan radial elongationepidermis (Riniarti et al. 2009; Petterson et al. 2004) sedangkan perlakuan yang tidak terinfeksi berperan di penebalan mantel.
Pembahasan
Dinamika pengomposan merupakan suatu proses siklus hara bagi ekosistem yang dialami oleh bahan organik dan dekomposisi bahan organik menjadi partikel yang lebih kecil sehingga menjadi unsur hara yang terlarut. Dekomposisi serasah terjadi melalui dua tahap. Pertama, ukuran menjadi lebih kecil bagian bunga ke batang dari pohon yang besar dipecah menjadi bagian yang lebih kecil dan dapat direduksi secara kimia. Kedua, bagian hasil pecahan kecil dari bahan organik direduksi dan mineralisasi untuk melepaskan unsur dasar dari protein, karbohidrat, lipid dan mineral yang dapat diserap oleh mikroorganisme atau dihanyutkan oleh sistem (Vikman et al. 2002). Dinamika dekomposisi ini secara umum melibatkan faktor penyusutan, suhu, kelembaban dan pH (Insam et al.2002).
Total penyusutan pada kompos utuh sebesar 18 cm sedangkan kompos cacah sebesar 32 cm. Penyusutan pada proses pengomposan terjadi terus menerus sampai tercapai suhu ruangan. Menurut lekasi et al. (2003) dan Vlyssides (2010) kelancaran proses dekomposisi tergantung pada pasokan oksigen dalam tumpukan
19 serasah. Karung goni dapat digunakan untuk menjaga kestabilan temperatur dan pasokan oksigen (Steger et al. 2005). Stabilisasi karung goni dikarenakan memiliki lubang pori yang sama pada setiap sisi sehingga kondisi lingkungan di tumpukan serasah Shorea sp. dapat mendorong perombakan bahan organik dari ukuran daun utuh menjadi partikel kecil yang mudah dihanyutkan oleh air dan diserap tanaman (Guo dan Saims 2001).
Bahan organik dapat didekomposisi menjadi molekul yang ukurannya lebih kecil oleh bakteri yang mampu beradaptasi dan berkembang dengan memanfaatkan nutrisi seperti karbohidrat, protein, dan asam sitrat yang berasal dari jaringan daun yang mengalami otolisis dan aktifator EM4 (Efectivitas Microorganisme). Bakteri tidak dapat berkembang apabila mengalami shock osmotik atau toksik (Acmad et al. 1998). Kondisi seperti ini dikarenakan rasio C/N lebih dari 20 (Setyorini et al. 2006). Rasio C/N yang tinggi akan mempengaruhi lama perombakan bahan organik.
Selain temperatur, suhu dan kelembaban, faktor yang mempengaruhi dekomposisi bahan organik adalah pH. Standar pH untuk proses dekomposisi tidak ada. Namun menurut Insam et al (2002), pH pada pengomposan berkisar antara 4-12. Perubahan pH di tumpukan serasah dikarenakan terjadi reaksi kimiawi metabolisme pelepasan gugus amina dari senyawa asam amino. Bahan organik yang telah terdekomposisi dapat meningkatkan aktivitas ion OH- yang bersumber dari gugus karboksil (-COOH) dan gugus hidroksil (OH-). Ion OH- akan menetralisir ion H+ yang berada dalam larutan. Brady dan Weil (2002) menyatakan bahwa penurunan pH merupakan fungsi ion H+ dan Ion OH-. Jika kosentrasi ion H+ dalam larutan meningkat, maka pH akan turun. Jika kosentrasi ion OH- naik, maka pH juga akan mengalami kenaikan. Lebih lanjut dijelaskan pula bahwa bahan organik yang telah terdekomposisi dapat menghasilkan ion OH -yang dapat menetralisir aktivitas ion H+. Peningkatan pH erat hubungannya dengan hasil dekomposisi bahan organik. Hasil penelitian menunjukkan bahwa sampai hari ke 84, pH kompos mencapai 5, kemudian pH meningkat hingga mencapai pH netral sampai proses dekomposisi selesai. Hal ini sesuai dengan laporan Hernando et al (1989) bahwa pada produksi kompos, pH kompos tahap awal asam dan kompos matang dengan pH netral.
Perubahan pH dalam pengomposan erat kaitannya dengan perkembangan bakteri pada tumbukan serasah. Jumlah bakteri pada awal pengambilan sampel sebanyak 2,6x1010 CFU/g, seiring proses dekomposisi populasi bakteri mengalami penurunan rata-rata, yaitu kompos utuh pada media pikovskoya (1) sebesar 1,3 x1010 CFU/g dan media carboxy methyl cellulose (2). 1,2 x1010 CFU/g sedangkan kompos cacah sebesar 1,2 x1010 CFU/g dan media carboxy methyl cellulose (2) sebesar 1,1 x1010 CFU/g. Total populasi bakteri yang menurun mengindikasikan bahwa bakteri lebih memilih fermentasi dan menekan pathogen yang tidak menguntungkan (Higa dan Wididana 1994).
20
tersedia sebesar 0,2%. Bakteri memiliki peran dekomposisi bahan organik sebesar 30 (Guo dan Sim 1999). Pelapukan serasah selama mendapatkan rasio C/N sesuai standar pengomposan dapat disajikan Gambar 9.
Gambar 9 Pelapukan serasah selama mendapatkan rasio C/N sesuai standar pengomposan
Gambar 9 menunjukkan pelapukan serasah selama mendapatkan rasio C/N sesuai standar pengomposan. Menurut Setiyo et al. (2007) dan SNI (2006), karateristik suatu kompos serasah yang sudah matang ditunjukan oleh rasio C/N yang nilainya 10-20, perubahan warna serasah menjadi hitam, tidak berbau dan suhu tumpukan pompos sudah mendekati suhu ruang bila diraba. Hasil analisis kandungan kompos pada penelitian ini dapat dilihat pada Tabel 2.
Pertumbuhan Bibit Shorea Stenoptera Burck. F. Terhadap Aplikasi Kompos Serasah Shorea sp. dan Fungi Scleroderma columnare pada Tanah Latosol
Shorea stenoptera Burck. F. yang berada di Haurbentes Jasinga Bogor dan Kebun Percobaan Dramaga merupakan pohon yang berasal dari Kalimantan. Shorea stenoptera Burck. F. memiliki masa tebang lebih dari 15 tahun karena tergolong tanaman memiliki pertumbuhan lambat (Gunatilleke et al. 1998). Penebangan Shorea sp. membutuhkan waktu yang cukup lama sehingga serasah semakin lama semakin banyak di lantai hutan. Salah satunya di kebun percobaan dramaga IPB. Plot 178 merupakan jenis pohon Shorea stenoptera Burck. F. dengan usia pohon 38 tahun, sekeliling akar primernya terdapat fungi Scleroderma columnare.
Hasil pengamatan memperlihatkan bahwa perlakuan pemberian kompos utuh, kompos cacah, Scleroderma dan tanpa Scleroderma menunjukkan hasil yang berbeda nyata terhadap pertumbuhan tinggi tanaman, biomassa dan presentase koloni mikoriza (Tabel 4). Perlakuan A1B0 (kompos cacah:tanpa Scleroderma) memiliki respon terbaik terhadap tinggi tanaman, jumlah daun, diameter batang, bobot basah daun dan bobot kering batang. Hasil ini didukung analisis kandungan unsur hara N sebesar 0,28 %, P sebesar 3,1%, K sebesar 107%. Selain itu, ketersediaan bahan organik yang dibutuhkan tanaman sudah tercukupi.
21 Bahan organik ini berfungsi membantu proses penggemburan tanah. Bahan yang diserap oleh tanaman memiliki rasio C/N 10-18% (SNI 2006). Berdasarkan hasil analisis kompos pada penelitian ini menunjukkan nilai rasio C/N sebesar 10-13%.
Hasil analisis kandungan unsur hara, menunjukkan bahwa rata-rata N tersedia antar perlakuan sebesar 0,3 ppm/g/tanaman. Nilai rata-rata serapan unsur hara P tersedia sebesar 80 ppm/g/tanaman. Hasil analisis kandungan, mengindikasikan bahwa tanaman dapat menyerap unsur hara dengan baik. Unsur hara diserap ke dalam jaringan kortek untuk perkembangan batang, dan proses pembentukan sumbu daun (tonjolan kerucut) (Srivantava 2002). Selain itu dibantu oleh daun aktif melakukan fotosintesis, suplai energi ini digunakan untuk pertumbuhan tajuk tanaman.
Daun yang aktif melakukan fotosintesis dapat dilihat melalui nilai kadar klorofil yang berada pada daun segar. Hasil analisis kadar klorofil antar perlakuan dapat disajikan pada (Lampiran 3). Hasil analisis menunjukkan bahwa kandungan antosianin tinggi sehingga tidak mempengaruhi kadar klorofil daun segar. Rendahnya kandungan karoten tanaman diduga karena mengalami kesulitan dalam mendapatkan cahaya matahari (Anthon et al. 1996). Pertumbuhan bibit Shorea Stenoptera Burck. F. selama 4 bulan diberikan pada Gambar 10. Pada perlakuan fungi mengalami pertumbuhan lambat karena fungi memperbaiki struktur media tumbuh, apabila lebih dari 4 bulan kemungkinan pertumbuhan Shorea stenoptera Burck. F. dapat mengimbangi pertumbuhan pada perlakuan kompos.
Gambar 10 Pertumbuhan bibit Shorea Stenoptera Burck.F selama 4 bulan (bulan setelah
tanam). (1) A0B0 (tanpa kompos:tanpa Scleroderma), (2) A1B0 (kompos
cacah:tanpa Scleroderma), (3) A2B0 (kompos utuh:tanpa Scleroderma), (4)
A0B1 (tanpa kompos:Scleroderma), (5) A1B1 (kompos cacah:Scleroderma),
(6) A2B1 (kompos utuh:Scleroderma).
22
aktifnya akar dalam menyerap nutrisi dimedia tanam. Selain itu selubung hifa yang tebal berwarna putih dapat mengikat oksigen dan enzim phospatase (Varma 2008). Kompos utuh berperan untuk memperbaiki media tanam menjadi lebih lunak sehingga akar mudah mendapatkan nutrisi dan air. Morfologi akar antar perlakuan disajikan pada Gambar 11.
Gambar 11 Morfologi akar antar perlakuan; (1) A0B0 (tanpa kompos:tanpa Scleroderma),
(2) A1B0 (kompos cacah:tanpa Scleroderma), (3) A2B0 (kompos utuh:tanpa
Scleroderma ), (4) A0B1 (tanpa kompos:Scleroderma), (5) A1B1 (kompos
cacah:Scleroderma), (6) A2B1 (kompos utuh:Scleroderma).
23
4
SIMPULAN DAN SARAN
Simpulan
Dinamika pengomposan dengan perlakuan kompos cacah (PC) dan kompos utuh (PNC) menunjukkan penurunan terhadap parameter penyusutan dan total koloni bakteri, hilangnya bahan organik yang digunakan pengomposan sekitar 30 %.
Perlakuan A1B0 (kompos cacah:tanpa Scleroderma), A2B1 (kompos utuh:Scleroderma), A0B1 (tanpa kompos:Scleroderma) memberikan respon pertumbuhan dan infeksi lebih baik dibanding dengan A0B0 (tanpa kompos:tanpa Scleroderma).
Saran
24
DAFTAR PUSTAKA
Achmad. 1998. Ektomikoriza dan pemanfaatan dalam Hutan. Bogor: Jurusan Manajemen Hutan IPB.
Aston P.M.S, Gunatilleke C.V.S, Gunatilleke L.A.U.N. 1996. Seedling survival and growth of four Shorea spesies in a Sri Lanka rainforest. Journal of Tropical Ecology. 11:263-279.
Brady NC, Weil RR. 2002. The Nature and Properties of Soil. 31th ed. Pretice Hall, Upper Saddle River, New York. 511p.
Brundreet M, Bougher N, Dell B, Dell B, Grove T, Malajczuk N. 1995. Woking with mycorrhizas in forestry and agriculture. ACIAR, Canberra.Australia.
Das A, Patel G.G. 2011. Conversion of farm wastes/by-products into enriched Compost through use of Microbial Consortium. J.An Asian Journal of Soil Science 6 (2):195-199.
Dwoakin M, Falkow S, Rosenberd E, Schleifer K.L, Stackerandt. 2006. The Prokaryotes. Trird Edition Vol 5. Springer
Guo LB, Sims REH. 2001. Eucalpypt Liter Decomposition and Nutrient Release Under A Short Rotation Regime and Effluent Irrigation Treatments in New Zealand I. Extrnal effects. Soil Biology dan Biochemistry. 33:1381-1388.
Guo LB, Sim REH. 1999. Litter Decomposition and Nutrient Release Via Litter Decomposition in New Zealand Eucalypt Short Rotation Forests.Agricultur eco and environ. Spingerlink 75:133-140.
Guantilleke, C.V.S., Guantilleke.I.A.U.N, Aston P.M.S, Asthon P.S. Seedling Growth of Shorea (Dipterocarpaceae) Across an Elevetional Range in Southwest Sri Lanka. J.Stor 14(12):231-245.
Golley FB. 1983. Tropical Rain Forest Ecosystem.Structure and Function. New York:Elseviere Scientific Publishing company.
Hindersah, R dan T. Simarmata. 2004. Potensi Rhizobacter dalam meningkatkan kesehatan hutan. J. Natural Indonesia. 5 (2):127-133.
25 Hernando S, Lobo MC, Polo A. 1989. Effect of the Application of Municipal Refuse Compost on the Physical and Chemical Properties of a Soil. Sci Tot Environ. 81:589-596.
Insam H, Riddech N., Klammer S. 2002. Microbiology of Composting. Springer. (Eds.).
Lin H.H., Chen Y.S., Li Y.C., Tseng I.L., Hsieh T.H., Buu Leh.M. 2012. Burkholderia Multivorans acts as an Antagonist Against the Growth of Burkholderia pseudomallei in Soil. Biotechnology: University kaoslung Taiwan.
Lekasi JK,Tanner JC, Kimani SK, Harris PJC. 2003. Cattle Manure Quality in Maragu District, Central Kenya: Effect of Management Practices and Development of Simple Methods of Assessment. Agr Ecosyst Envron. 94:289-298.
Lim, D. 1998. Microbiology. Ed ke-2 USA:McGraw-Hill Companies.
Madigan MT, Martinko JM. 1997. Block Biology of Microorganisms. Edisi ke-12. New Jersey: Pearson Prentice Hall.
Millilo JM, Aber JD, Muratore JF. 1982. Nitrogen and Lignin Control of Hardwood Leaf Litter Decomposition Dynamics. Ecol. 63:621-626. Novita E. 2001. Optimasi proses koagulasi flokulasi pada limbah cair yang
mengandung melanoidi. J.Ilmu Dasar 2(1):61-67.
Osono T, Takeda H. 2002. Comparison of Litter Decomposing Ability Among Diverse Fungi in Cool Temperate Deciduous Forest in Japan. J.Mycol 94:421-427.
Patel. P.H, Patel J.P dan Bhatt. S.A. 2013. Characterization and Phylogenetic Relatedness of Azotobacter Salinetris. J. Microbiology and Biotechnology.
Petterson R.L., Massicotte H.B and Melvielle L.H. 2004. Mycorrhiza: Anatomy and Cell Biology.Ottawa.NRC Reserch Press.
Prescott, L.M., Harley J.P, Klein D.A. 2000. Microbiology. Ed ke-5 USA:McGraw-Hill Companies.
Rao S. 2011. Soil Microorganisms and Plant Growth, Oxford and IBH Publishing co. India. J.Hemidia 2:14.
26
Smith, S.E and Read D.J. 2008. Mycorrhizal Symbiosis. Third Edition.London:Academic Press.
Setiyo Y, Purwadaria H.K., Yuwono A.S., Subroto M.A. 2007. Pengembangan model simulasi proses pengomposan sampah organik perkotaan dalam bioreaktor. J.Forum pascararjana 30 (1):1-12.
[SNI]. 2006. SNI 01-7226-2006 Produksi Inokulan Cendawan Ektomikoriza untuk Bibit Tanaman Kehutanan.
Setyorini D, Saraswati R, Kosman E. 2006. Kompos dalam pupuk organik dan pupuk hayati. Bogor: Balai Besar Penelitian dan Pengembangan Sumberdaya Lahan Pertanian.
Steger K, Eklind Y, Olsson J, Sundh I. 2005. Microbial Community Growth and Ultilization of Carbon Constituent During Thermophilic Composting at Different Oxygen Levels. J.Springer 50:163-171.
Schloss P.D, Hay A.G, Wilson D.B, Gosset J.M, Walker L.P. 2005.Qualitifying Bacterial Population Dynamics in Compost using 16S rRNA Gene Probes. J.Springer 66:457-463.
Srivantava LM.2002. Plant Growth and Development. Hormones and the Enviroment. Oxford:Academic Press.
Sulaeman, Evianti. 2000. Analisis Kimia Tanah, Tanaman, dan Pupuk. Bogor: Balai Tanah Bogor
Sallata M, Kudeng, Halidah. 1990. Produksi dan Penghancuran Serasah di bawah Hutan Alam Sekunder di Tobo-Tobo Sulawesi Selatan. J.Penelitian Kehutanan 3:9-25.
Sass, J.E. 1958. Botanical Microtechnique. Third Edition. Lowa State Univ.Press. USA.
Vlyssides A, Barampourti E.M. 2010. Effect of Temperature and Aeration rate on Co-composting of olive mill Wastewater with Olive Stone Wooden Residues. J.Springer 21:957-965.
Varma A. 2008. Mycorrhiza genetics and Moleculer biology eco-function biotechnology Eco-Physiology Structure and Systematics. Springer. Thrid Edition.
27 Vitousek P.M, Turner DR, Parton WJ, Sanford RL. 1994. Litter Decomposition on the Mauna Loa Environmental matrix, Hawaii: Patterns, mechanisms and Models. Ecol 75:418-429.
Volk, W.A, Wheeler M.F. 1984. Mikrobiologi Dasar. Ed ke-5 Markham, Penerjemah: Adisoemarto S, editor. USA: Hasrper & Row Publisher Insc. Terjemahan dari:Basic Microbiology.Ed ke-5.
Watling R., Lee S.S. and Turnbull E. 2002. The Occurrence and Distribution of Putative Ectomycorrhizal Basidiomycetes in a Regenerating South East Asian Rain Forest. Di Dalam: Watling R, Frankland JC, Ainsworth AM, Isaac S, Robinson CH, editor. Tropical Mycology Volume 1, Macromycetes. New York: CABI Publishing.
White, D. 1995. The Pysiology and Biochemistry of Procaryotes. Oxford Universuty Press: USA.
Yuliarti N. 2009. 1001 Cara menghasilkan Pupuk Organik. Yogyakarta: Penerbit ANDI.
Yusmandhany ES. 2001. Teknik Pemberian Biofertilizer EMAS pada Tanah podsolik (PMK) Rangkasbitung. Bul Tek Pert 7:30-32