PERBANDINGAN AKTIVITAS ANTIOKSIDASI EKSTRAK
SAMBILOTO (
Andrographis paniculata
Nees.) ASAL CIAMPEA
DAN CIKABAYAN BOGOR
LIDYA AGUSTINA BUDIARTI
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Perbandingan Aktivitas Antioksidasi Ekstrak Sambiloto (Andrographis paniculata Nees.) asal Ciampea dan Cikabayan Bogor sebagai Antioksidan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Lidya Agustina Budiarti
ABSTRAK
LIDYA AGUSTINA BUDIARTI. Perbandingan Aktivitas Antioksidasi Ekstrak Sambiloto (Andrographis paniculata Nees.) asal Ciampea dan Cikabayan Bogor. Dibimbing oleh WARAS NURCHOLIS dan EDY DJAUHARI PURWAKUSUMAH.
Sambiloto (Andrographis paniculata Nees.) secara kimia mengandung flavonoid dan lakton. Pada lakton, komponen utamanya adalah andrografolida, yang juga merupakan zat aktif utama dari tanaman ini. Salah satu efek farmakologi sambiloto adalah sebagai antioksidan. Penelitian ini membandingkan dan menganalisis pengaruh kadar andrografolida yang terkandung dalam sambiloto dan kadar senyawa lain yaitu flavonoid dan fenolik terhadap aktivitas antioksidan pada sambiloto asal Ciampea dan Cikabayan Bogor. Kadar andrografolida ekstrak metanol sambiloto asal kebun Cikabayan memiliki nilai yang lebih tinggi dibandingkan dengan ekstrak lainnya yaitu sebesar 108,4 mg/g. Ekstrak etanol sambiloto asal Ciampea juga memiliki kadar andrografolida yang cukup tinggi yaitu sebesar 101,31 mg/g. Berdasarkan hasil uji korelasi antara kadar andrografolida dengan kadar flavonoid berhubungan positif sangat signifikan. Ekstrak metanol dari sampel asal Ciampea memiliki IC50 lebih rendah
daripada ekstrak lainnya yaitu sebesar 69,93 ppm. Berdasarkan hasil uji korelasi antara kadar IC50 dengan kadar total fenolik berhubungan negatif sangat
signifikan, yang artinya bahwa semakin rendah kadar IC50 maka semakin tinggi
kadar total fenolik, sehingga aktivitas antioksidan semakin tinggi. Kata kunci: antioksidan, andrografolida, sambiloto
ABSTRACT
LIDYA AGUSTINA BUDIARTI. The Comparison of Antioxidative Activity of
Andrographis paniculata Nees. Extract from Ciampea and Cikabayan Bogor.
Supervised by WARAS NURCHOLIS and EDY DJAUHARI
PURWAKUSUMAH.
Andrographis paniculata Nees. contained of flavonoid dan lactone. Andrographolide is the main active lactone compound which shows an antioxidative activity. The aim of this study was to compare and analyze the activity of andrographolide, flavonoid and phenolic compound consisted in A. paniculata Ness. extract from Ciampea and Cikabayan Bogor, West Java. The methanolic extract of A. paniculata Ness. from Cikabayan contained 108.4 mg/g andrographolide, higher than the other extract. The ethanolic extract from Ciampea contained 101.31 mg/g andrographolide. Andrographolide and flavonoid level showed a positively significant correlation result. The methanolic extract from Sample from Ciampea had 69.93 ppm IC50 value, lower than the other
extract. Total phenolic and IC50 value showed a negatively significant correlation, which means that the antioxidative activity will increase as the the IC50 value decreased.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
PERBANDINGAN AKTIVITAS ANTIOKSIDASI EKSTRAK
SAMBILOTO (
Andrographis paniculata
Nees.) ASAL CIAMPEA
DAN CIKABAYAN BOGOR
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Alhamdulillah. Puji syukur kepada Allah SWT atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul Perbandingan Aktivitas Antioksidasi Ekstrak Sambiloto (Andrographis paniculata Nees.). Penelitian ini dilaksanakan mulai dari bulan Maret hingga Oktober 2014 di Laboratorium Pusat Studi Biofarmaka, Bogor.
Penulis mengucapkan terima kasih kepada bapak Waras Nurcholis, S. Si., M. Si . dan bapak Drs. Edy Djauhari Purwakusumah M.Si. atas segala arahan dan bimbingan selama penelitian ataupun penulisan skripsi ini. Penulis juga menyampaikan banyak terimakasih atas dukungan dan motivasi terutama bagi bapak Hilman Karyana ayah penulis dan keluarga penulis yang telah memberikan dukungan spiritual, kepada Fatwa Muhammad Aziz, Mas Hariri, kepada rekan sebimbingan Ajruddin, Gia, Emmy, Ayu, Dita, Sylvia, kepada staff di laboratorium PSB, dan rekan Wisma Pelangi Izmah, Kiky, Dian, Ara, Eka, dan semua rekan biokimia 47 yang telah membantu dan memotivasi dalam proses penelitian dan penulisan dan untuk semua bantuan yang pernah berikan.
Penulis menyadari masih banyak kekurangan dalam penyusunan skripsi ini, maka diharapkan kritik dan saran yang membangun untuk perbaikan dalam penulisan selanjutnya. Akhir kata penulis berharap tulisan ini dapat berguna bagi penulis maupun semua pihak demi kemajuan ilmu pengetahuan.
Bogor, Agustus 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Metode Penelitian (Manurung 2013) 2
Hasil 5
Kadar Air dan Kadar Abu 5
Rendemen pada Setiap Ekstrak Sambiloto 6
Kandungan Alkaloid, Saponin, dan Tanin 7
Kadar Total Fenol 8
Kadar Komponen Bioaktif 8
Aktivitas Antioksidan 9
Pembahasan 10
Kadar Air dan Kadar Abu Ekstrak Sambiloto 10
Rendemen Ekstrak Sambiloto 10
Kandungan Alkaloid, Saponin, dan Tanin 11
Kadar Total Fenol 12
Kadar Flavonoid 13
Kadar Komponen Aktif Sambiloto 13
Aktivitas Antioksidan 14
SIMPULAN 15
SARAN 16
DAFTAR PUSTAKA 16
LAMPIRAN 19
DAFTAR TABEL
1 Keberadaan alkaloid, tanin dan saponin 7
2 Kadar total fenol pada setiap ekstrak sambiloto 8
3 Total flavonoid pada setiap ekstrak sambiloto 8
4 Kadar andrografolida setiap ekstrak sambiloto 9
5 Aktivitas antioksidan dari setiap ekstrak sambiloto 9
6 Hasil uji korelasi aktivitas antioksidan dengan total fenol, flavonoid dan kadar andrografolida
10
DAFTAR GAMBAR
1 Kadar air simplisia 6
2 Kadar abu simplisia 6
3 Rendemen yang dihasilkan pada setiap sampel 7
DAFTAR LAMPIRAN
1 Bagan alir kerja 19
2 Rendemen ekstrak sambiloto 20
3 Kadar air sampel 20
4 Kadar abu sampel 21
5 Kadar total fenolik sampel 22
6 Kurva standar tanin 22
7 Kadar total flavonoid sampel 23
8 Kurva standar kuersetin 23
9 Aktivitas antioksidan ekstrak 24
10 Hasil uji IC50 ekstrak 25
11 Aktivitas inhibisi vitamin C 25
12 Kadar andrografolida ekstrak 26
13 Kromatogram HPLC 27
PENDAHULUAN
Sambiloto (Andrographis paniculata Nees.) merupakan salah satu tumbuhan yang sejak dulu sering digunakan oleh masyarakat, terutama masyarakat di daerah Cina dan India. Daun sambiloto biasanya digunakan dengan cara menghaluskannya dan mengambil air dari daun ini untuk diminum (Chen et al. 2010). Ekstrak daun sambiloto dipercaya dapat mengobati berbagai macam penyakit, seperti menurunkan demam, mengobati diare, disentri, mengobati pembengkakan, dan memperbaiki gangguan pada sistem imun. Hingga saat ini tanaman sambiloto masih terus diteliti khasiatnya yang dipercaya memiliki peran penting dalam dunia kesehatan (Chen et al. 2010). Efek farmakologi sambiloto diantaranya sebagai antioksidan, antidiabetik, antifertilitas, antiHIV–1, antiflu, antiadhesi intraperitoneal, antimalaria, antidiare, hepatoprotektif (Chen et al.
2010).
Sambiloto secara kimia mengandung flavonoid dan lakton. Pada lakton, komponen utamanya adalah andrografolida, yang juga merupakan zat aktif utama dari tanaman ini. Berdasarkan penelitian lain yang telah dilakukan, kandungan yang dijumpai pada tanaman sambiloto diantaranya adalah diterpen lakton dan glikosidanya, seperti andrographolide, deoxyandrographolide, 11, 12-didehydro-14-eoxyandrographolide, dan neoandrographolide. Flavonoid juga dilaporkan ada terdapat pada tanaman ini. Daun dan percabangannya lebih banyak mengandung lakton sedangkan komponen flavonoid dapat diisolasi dari akarnya (Prapanza & Marianto 2003)
Studi ilmiah sudah banyak dilakukan untuk melihat disposisi
andrographolide berbagai organ tubuh. Pemberian sambiloto menunjukkan efek protektif terhadap aktivitas enzim superoksida dismutase, katalase, glutationin peroksidase, dan glutationin yang menurun dengan pemberian hexachloro cyclohexane (BHC). Hasilnya menunjukkan adanya khasiat antioksidan dan hepatoprotektif dari sambiloto (Trivedi & Rawal 2001).
Sumber antioksidan dapat digolongkan menjadi dua golongan, yaitu antioksidan sintetik dan alami. Antioksidan sintetik diperoleh dari hasil sintesa reaksi kimia, seperti butylated hydroxyanisol (BHA) dan butylated hydroxytoluene (BHT) sangat efektif dalam menghambat reaksi oksidasi lemak. Akan tetapi, penggunaan antioksidan sintetik telah diketahui memiliki efek samping yang berbahaya antara lain menyebabkan kerusakan hati. Antioksidan alami diperoleh dari hasil ekstraksi bahan alami (Kikuzaki & Nakatani 1993).
Antioksidan enzimatis meliputi enzim superoksida dismutase (SOD), katalase, dan glutation peroksidase. Antioksidan non-enzimatis masih dibagi dalam 2 kelompok lagi yaitu antioksidan larut lemak seperti tokoferol, karotenoid, flavonoid, quinon, serta antioksidan larut air seperti asam askorbat, asam urat, protein pengikat logam, dan protein pengikat heme. Kedua jenis antioksidan tersebut bekerja sama dalam mencegah kerusakan di dalam tubuh akibat senyawa radikal (Miyazaki 2000).
2
Hal ini berfungsi dalam mencegah efek merusak dari spesies oksigen reaktif yang mencakup peroksidasi lipid, oksidasi sulfidril dan kelompok rentan lainnya dalam protein.
Andrografolida yang sudah diisolasi dalam bentuk murni dapat menunjukkan berbagai aktivitas farmakologi. Zat aktif herba ini dapat ditentukan dengan metode gravimetrik atau dengan high performance liquid chromatography
(HPLC) (Hu & Zhou 1982). Penelitian ini akan menganalisis pengaruh kadar andrografolida yang terkandung dalam sambiloto dan kadar senyawa lain yaitu flavonoid dan fenolik terhadap aktivitas antioksidan pada sambiloto. Pengujian aktivitas antioksidan dalam penelitian ini menggunakan metode DPPH (2,2
diphenyl-1-picryl-hydrazyl), DPPH tersebut dijadikan sebagai radikal bebas yang akan ditangkap oleh senyawa aktif yang berada dalam ekstrak. DPPH merupakan senyawa yang stabil pada suhu ruang. DPPH akan tereduksi dan kehilangan warna violetnya menjadi warna kuning pucat (Molyneux 2004).
Menurut Januwati dan Yusron (2004) tanaman sambiloto dapat dibudidayakan dengan baik di daerah basah (Bogor) pada lahan tanpa naungan sampai naungan sedang (0-30 %). Penelitian ini membandingkan kadar senyawa yang terkandung dan aktivitas antioksidasi antara sambiloto asal Ciampea Bogor dan sambiloto asal Cikabayan Bogor. Penelitian ini diharapkan dapat memberikan informasi mengenai kendali mutu ekstrak daun sambiloto sebagai antioksidan, bahan aktif yang berperan di dalamnya, dan hubungan kandungan bahan aktif dengan aktivitas antioksidan.
METODE
Bahan dan AlatAlat-alat yang digunakan pada penelitian ini adalah alat kaca, tanur, desikator, cawan, rotavapor, spektrofotometer massa, peralatan HPLC, spektrofotometer UV-Vis, labu Erlenmeyer, dan oven. Bahan-bahan yang digunakan pada penelitian ini adalah daun sambiloto dari kebun Cikabayan dan kebun Ciampea Bogor, metanol, n-heksana, etanol, etil asetat, aseton, dietil eter, diklorometana, AlCl3, dan radikal 2,2-difenil-1-pikrilhidrazil (DPPH), pereaksi
Mayer, pereaksi Wagner, pereaksi Dragendorf, FeCl3, akuades, reagen fenol
Folin-Ciocalteu, NaCO3, AlCl3 10%, kalium asetat.
Metode Penelitian (Manurung 2013)
3
Penentuan Kadar Air (AOAC 2007)
Cawan porselen dikeringkan di dalam oven pada suhu 105–110˚C selama 15 menit, kemudian diletakkan di dalam desikator selama 30 menit dan ditimbang hingga diperoleh bobot konstan (A). Sebanyak 2 g sampel ditimbang (B) dan diletakkan ke dalam cawan yang telah dikeringkan tersebut. Cawan yang berisi sampel dipanaskan di dalam oven pada suhu 105–110 ˚C selama 3–4 jam, lalu didinginkan di dalam desikator selama 30 menit kemudian ditimbang lagi. Tahap ini diulangi hingga diperoleh bobot konstan (C). Kadar air dapat dihitung menggunakan rumus sebagai berikut:
Penentuan Kadar Abu (AOAC 2007)
Cawan porselen dikeringkan di dalam oven selama 30 menit pada suhu 100– 105˚C, kemudian dimasukkan ke tanur selama 30 menit dan didinginkan di dalam desikator. Cawan ditimbang hingga diperoleh bobot konstan (A). Sebanyak 2 gram sampel diletakkan ke dalam cawan tersebut dan ditimbang (B), lalu cawan berisi sampel dibakar menggunakan pembakar Bunsen hingga tidak berasap selama ±20 menit dan dilanjutkan dengan pengabuan di dalam tanur pada suhu 550˚C sampai pengabuan sempurna. Sampel yang telah diabukan didinginkan di dalam desikator dan ditimbang (C). Kadar abu dihitung menggunakan rumus sebagai berikut:
Ekstraksi (Depkes RI 2008)
Sampel yang sudah kering dan berbentuk serbuk dimasukkan ke dalam Erlenmeyer sebanyak 50 gram dan ditambahkan pelarut sebanyak 250 mL. Pelarut yang digunakan adalah etanol dan metanol. Ekstrak metanol yang telah diperoleh kemudian diekstraksi lagi menggunakan n-heksana. Ekstrak yang telah didapat dipekatkan hingga didapat ekstrak pekat.
Uji Fitokimia (Harborne 1987)
Uji alkaloid. Sebanyak 1 gram ekstrak ditambahkan 10 mL CHCl3 dan
beberapa tetes NaOH. Larutan tersebut disaring dan filtratnya ditambahkan 10 tetes H2SO4 2 M serta dikocok. Lapisan asam dipisahkan dan masing-masing
ditambahkan dengan pereaksi Mayer (positif jika terbentuk endapan putih), pereaksi Wagner (positif jika terbentuk endapan coklat), dan pereaksi Dragendorf (positif jika terbentuk endapan merah jingga).
Uji saponin. Sebanyak 0.1 gram ekstrak ditambahkan 10 mL air panas kemudian disaring. Sebanyak 10 mL filtrat dikocok selama 10 menit dengan keadaan tertutup. Jika terbentuk buih yang stabil berarti ekstrak mengandung saponin.
Uji tanin. Sebanyak 10 mL ekstrak dipanaskan selama 10 menit. Larutan tersebut kemudian disaring dan filtratnya ditambahkan dengan FeCl3 1%. Jika
4
Analisis Kandungan Fenol Total (Atanassova et al. 2011)
Kandungan Fenol total diukur dengan uji Folin-Ciocalteau. Sebanyak 0,1 gram ekstrak ditimbang dan dilarutkan dalam etanol pada labu takar 10 mL. Kemudian sebanyak 2 mL dipipet ke dalam tabung reaksi dan ditambahkan aqua bidest 5 mL, lalu ditambahkan 0,5 mL Folin-Ciocalteau dan didiamkan 5 menit. Kemudian ditambahkan 1 mL Na2Co3 5 % dan didiamkan selama 1 jam dalam
ruang gelap. Kemudian dianalisis dengan spektrofotometer UV-VIS dengan panjang gelombang 725 nm. Standar yang digunakan adalah asam tanat, dengan konsentrasi 20, 40, 60, 80, dan 100 ppm. Blanko yang digunakan adalah campuran antara 2 mL etanol, 5 mL aqua bidest, 0,5 mL Folin-Ciocalteau, dan 1 mL Na2CO3 5 %.
Analisis Kandungan Flavonoid (Chang et al. 2002)
Total flavonoid diukur dengan uji kolometrik aluminium klorida. Pembuatan larutan induk, ekstrak sebanyak 0,2 gram ditimbang dan ditambahkan 1 mL HMT, 20 mL aseton, 2 mL HCl. Kemudian dihidrolisis dengan cara direfluks selama 30 menit. Lalu disaring menggunakan kertas saring, filtratnya dimasukkan ke dalam labu takar 100 mL, lalu disaring. Campuran filtrat tersebut ditambahkan aseton hingga volume menjadi 100 mL. Lalu filtrat diekstraksi dengan etil asetat. Fase etil asetat ditampung dan ditambahkan etil asetat hingga volume menjadi 50 mL. Larutan sampel merupakan campuran 10 mL larutan induk, 1 mL AlCl3, kemudian ditera dengan asam glasial hingga 25 mL. Larutan
blanko yang digunakan adalah campuran 1 mL AlCl3 ditambahkan dengan asam
glasial hingga volume 25 mL. Larutan standar yang digunakan adalah kuarsetin dengan konsentrasi 0,5 ppm, 1 ppm, 10 ppm, 20 ppm, dan 25 ppm. Pengukuran dilakukan setelah penambahan AlCl3 selama 30 menit kemudian diukur dengan
spektrofotometer pada panjang gelombang 425 nm.
Analisis Kadar Komponen Bioaktif Sambiloto Menggunakan HPLC (Jayaprakasha et al. 2002)
Sebanyak 0,1 gram sampel ditimbang dan dilarutkan ke dalam 10 mL metanol. Larutan disaring dengan kertas saring 0.45 m dan ditempatkan pada vial HPLC. Sebanyak 10 L dari larutan ekstrak sampel diinjeksikan ke dalam HPLC. Senyawa standar dibuat dengan konsentrasi 0.1%. Kondisi HPLC untuk analisis ini digunakan jenis kolom C18 detektor UV-Vis dengan volume injeksi 10 L, elusi gradien dan suhu yang digunakan yaitu 480 C. Kadar komponen bioaktif yang diukur adalah kadar andrografolida. Penentuan kadar andrografolida dilakukan dengan rumus :
Kadar andrografolida =
Uji Aktivitas Antioksidan (Salazar-Aranda et. al. 2009)
Uji aktivitas antioksidan yang digunakan adalah uji penangkapan radikal bebas 2,2-difenil-1-pikrilhidrazil (DPPH). Sampel dilarutkan di dalam etanol hingga diperoleh variasi konsentrasi. Sebanyak 500µL ekstrak dan 500µL larutan DPPH (125µM dalam etanol) ditambahkan ke dalam masing-masing sumur
5 kontrol negatif. Pengukuran absorbans masing-masing sampel dengan berbagai konsentrasi dan kontrol positif dilakukan tiga kali ulangan (triplo). Aktivitas dihitung dengan persamaan:
Inhibisi (%)= [1-(Asampel-Akontrol)/(Ablanko-Akontrol)] x 100%
Nilai absorbansi yang diperoleh selanjutnya digunakan untuk mendapatkan nilai IC50 (Inhibition concentration 50). Nilai IC50 yang paling rendah menunjukkan
bioaktivitas antioksidan yang paling tinggi. Penentuan nilai IC50 berdasarkan
Udenigwe et al. (2009). Nilai IC50 diperoleh dari masing-masing kurva ekstrak
Aktivitas antioksidan setiap ekstrak dihubungkan dengan keberadaan senyawa andrografolid dan flavonoid dengan regresi linear. Hal ini bertujuan untuk mengetahui senyawa yang bertanggung jawab pada aktivitas antioksidan ekstrak.
Analisis Statistik (Mattjik & Sumertajaya 2006)
Analisis data statistik dalam penelitian ini dilakukan dengan menggunakan Analysis of Variance (ANOVA), sedangkan rancangan percobaan yang digunakan adalah model RAL (Rancangan Acak Lengkap). Selanjutnya dilakukan uji lanjut Duncan Test terhadap parameter yang dianalisis meliputi hubungan perlakuan terhadap nilai IC50 serta hubungan perlakuan dengan semua
uji. Adapun model dari RAL tersebut adalah sebagai berikut: Yij= µ + τi +εij
Dengan:
Yij = respon pengamatan ke-i ulangan ke-j
µ = rataan umum
τi = pengaruh rataan ke-i εij = galat atau komponen acak
Selanjutnya akan ditentukan hubungan korelasi bivariate antara nilai IC50 dengan
nilai semua uji.
HASIL DAN PEMBAHASAN
Hasil
Kadar Air dan Kadar Abu6
fisik dapat dihilangkan dengan pemanasan pada suhu 100-1050C (Harjadi 1993). Pada penelitian ini, kandungan air pada sampel sambiloto dihilangkan dengan cara pemanasan fisik menggunakan oven pada suhu 1050C.
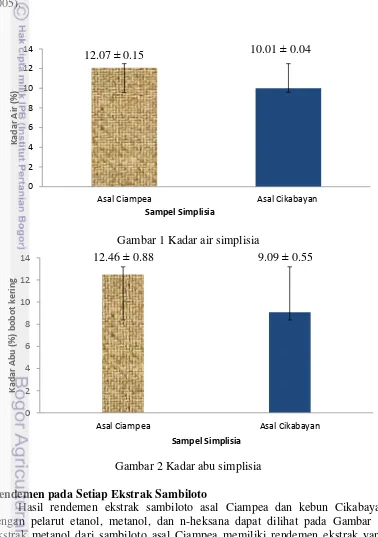
Nilai kadar abu menunjukkan mineral yang terkandung di dalam bahan. Kadar abu yang lebih tinggi adalah pada sampel Ciampea, yaitu sebesar 12,45 %, sedangkan pada sampel Cikabayan sebesar 9,09 % (Gambar 2). Kadar abu yang lebih tinggi dapat disebabkan oleh perbedaan kondisi pertumbuhan, pemupukan, waktu panen, teknik panen, dan perlakuan setelah pemanenan (Bakker & Elbersen 2005).
Gambar 1 Kadar air simplisia
Gambar 2 Kadar abu simplisia
Rendemen pada Setiap Ekstrak Sambiloto
Hasil rendemen ekstrak sambiloto asal Ciampea dan kebun Cikabayan dengan pelarut etanol, metanol, dan n-heksana dapat dilihat pada Gambar 3. Ekstrak metanol dari sambiloto asal Ciampea memiliki rendemen ekstrak yang lebih tinggi dibandingkan ekstrak etanol dan n-heksana. Berdasarkan hasil
7 penelitian, ekstrak etanol dari sambiloto asal Ciampea dan Cikabayan berturut-turut adalah 15,39 % dan 10,24 %, ekstrak metanol sambiloto asal Ciampea dan Cikabayan berturut-turut adalah 22,77 % dan 11,00 %, dan ekstrak n-heksana sambiloto asal Ciampea dan Cikabayan adalah 12.81 % dan 9.04 % (Gambar 3). Nilai rendemen ekstrak yang tinggi menunjukkan semakin banyak senyawa yang terekstrak dalam sampel.
Gambar 3 Rendemen yang dihasilkan pada setiap sampel
Kandungan Alkaloid, Saponin, dan Tanin
Uji fitokimia yang dilakukan meliputi uji alkaloid, uji flavonoid, uji tanin, dan uji flavonoid. Berdasarkan hasil uji fitokimia ekstrak etanol, metanol dan n-heksan dari sambiloto (Tabel 1), setiap ekstrak dari sambiloto mengandung flavonoid dan alkaloid. Keberadaan alkaloid dalam setiap ekstrak hanya terdeteksi dari pereaksi Dragendorf. Hal ini diduga karena keberadaan alkaloid yang sangat sedikit sehingga hanya dapat terdeteksi oleh pereaksi yang paling sensitif. Kandungan tanin hanya terdapat pada ekstrak etanol sambiloto asal Ciampea Bogor dan ekstrak metanol sambiloto asal Cikabayan Bogor. Pada penelitian ini tidak ditemukan kandungan saponin pada setiap sampel. Hal ini dimungkinkan karena keberadaan sanyawaan lain lebih dominan, sehingga keberadaan saponin yang ditandai dengan terbentuknya busa stabil tidak terdeteksi.
Tabel 1 Hasil Pengujian Fitokimia
Uji Sampel Ciampea Sampel Cikabayan
Etanol Metanol N-Heksana Etanol Metanol N-Heksana
Flavonoid + + + + + +
Ciampea Cikabayan Ciampea Cikabayan Ciampea Cikabayan
8
Kadar Total Fenol
Penentuan kadar total fenol dilakukan dengan menggunakan pereaksi Follin-Ciocalteau yang akan mengoksidasi fenolat, mereduksi asam heteropoli menjadi suatu kompleks molybdenum-tungsten (Mo-W) berwarna biru yang diukur pada panjang gelombang 750 nm (Schopield et al. 2001). Total fenol dihitung berdasarkan kurva standar tanin dengan persamaan y = 0.012x + 0.016 dengan R2 = 0.991. Hasil uji menunjukkan kadar senyawaan fenolik tertinggi pada ekstrak metanol dari kedua sampel, baik sampel berasal dari Ciampea maupun sampel berasal dari Cikabayan yaitu masing-masing sebesar 7,63 % dan 6,02 % (Tabel 2).
Tabel 2 Kadar total fenol pada setiap ekstrak sambiloto
Keterangan: Huruf kecil yang berbeda pada kolom yang sama menunjukkan bahwa secara statistik
perlakuan ekstraksi berbeda nyata pada α = 0.05 dengan uji Duncan
Kandungan Total Flavonoid
Total flavonoid dari tiap sampel diukur menggunakan pereaksi AlCl3 dan
kalium asetat. Prinsip metode ini adalah AlCl3 akan membentuk kompleks stabil
tahan-asam dengan gugus keto C-4 dan gugus hidroksil C-3 atau C-5 dari flavon dan flavonol. AlCl3 juga akan membentuk kompleks yang stabil dalam asam
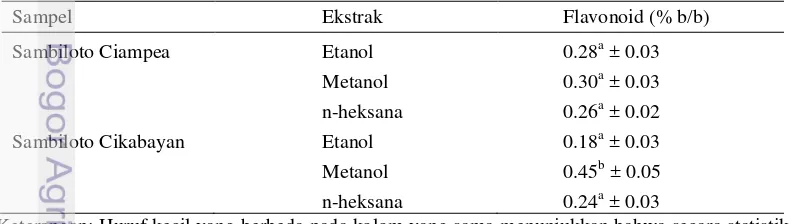
dengan gugus orto-dihidroksil pada cincin A atau B dari flavonoid (Chang et al. 2002). Total flavonoid dihitung berdasarkan kurva standar kuersetin dengan persamaan garis y = 0.070x – 0.017 dengan besar R2 adalah 0.998. Kadar flavonoid pada ekstrak sambiloto ini tidak terlalu tinggi, hanya berkisar 0,18 hingga 0,45 % b/b. Ekstrak yang memiliki kandungan flavonoid paling tinggi adalah ekstrak metanol dari Cikabayan sebesar 0,45 % b/b (Tabel 3).
Tabel 3 Total flavonoid pada setiap ekstrak sambiloto
Sampel Ekstrak Flavonoid (% b/b)
Sambiloto Ciampea Etanol 0.28a ± 0.03
Keterangan: Huruf kecil yang berbeda pada kolom yang sama menunjukkan bahwa secara statistik
perlakuan ekstraksi berbeda nyata pada α = 0.05 dengan uji Duncan
Kadar Komponen Bioaktif
Komponen bioaktif yang dianalisis pada penelitian ini adalah kadar andrografolida. Kadar andrografolida ekstrak etanol, metanol, dan n-heksana sambiloto asal Ciampea dan Cikabayan dapat dilihat pada Tabel 4. Penelitian ini
Sampel Ekstrak Total Fenol (% b/b) Sambiloto asal Ciampea Etanol 4.34a ± 0.23
Metanol 7.63b ± 0.11
n-heksana 4.71a ± 0.72
Sambiloto asal Cikabayan Etanol 4.82a,b ± 0.49
Metanol 6.02b ± 0.84
9 menggunakan ekstrak sambiloto yang dilarutkan dengan metanol dengan 10x pengenceran dan diukur dengan menggunakan HPLC. Berdasarkan hasil penelitian, kadar andrografolida ekstrak metanol sambiloto asal kebun Cikabayan memiliki nilai yang lebih tinggi dibandingkan dengan ekstrak lainnya yaitu sebesar 108,4 mg/g. Selain itu, ekstrak etanol sambiloto asal Ciampea juga memiliki kadar andrografolida yang cukup tinggi yaitu sebesar 101,31 mg/g (Tabel 4).
Tabel 4 Kadar andrografolida setiap ekstrak sambiloto
Sampel Ekstrak Kadar Andrografolida
(mg/g)
Keterangan: Huruf kecil yang berbeda pada kolom yang sama menunjukkan bahwa secara statistik
perlakuan ekstraksi berbeda nyata pada α = 0.05 dengan uji Duncan
Aktivitas Antioksidan
Aktivitas antioksidan dengan metode DPPH dinyatakan dalam nilai IC50
yang menunjukkan konsentrasi ekstrak yang dapat menghambat aktivitas DPPH sebesar 50 %. Hasil uji (Tabel 5) menunjukkan bahwa ekstrak metanol dari sampel Ciampea memiliki IC50 lebih rendah daripada ekstrak lainnya yaitu
sebesar 69,93 ppm. Semakin rendah nilai IC50 suatu bahan, maka semakin tinggi
aktivitas antioksidannya. Hal tersebut disebabkan karena hanya dibutuhkan sejumlah kecil konsentrasi sampel untuk meredam 50 % radikal bebas DPPH. Blois (1958) diacu dalam Hanani et al. (2005) mengatakan bahwa suatu bahan memiliki aktivitas antioksidan yang kuat apabila memiliki nilai IC50 kurang dari
200 ppm (setara dengan 200 µg/mL). Berdasarkan hasil penelitian yang diperoleh menunjukkan bahwa semua ekstrak sambiloto yang telah diuji aktivitas antioksidannya memiliki nilai IC50 kurang dari 200 ppm.
Tabel 5 Aktivitas antioksidan dari setiap ekstrak sambiloto
Sampel
Ekstrak IC50 (ppm)
Sambiloto Ciampea Etanol 129.84b ± 18.56
Metanol 69.93a ± 11.52
n-heksana 142.49a ± 3.28
Sambiloto Cikabayan Etanol 155.00b ± 14.97
Metanol 117.87a ± 23.68
n-heksana 93.11a ± 5.08
Keterangan: Huruf kecil yang berbeda pada kolom yang sama menunjukkan bahwa secara statistik
10
Tabel 6 Hasil uji korelasi aktivitas antioksidan dengan total fenol, flavonoid dan kadar andrografolida
Antioksidan (IC50)
Total Fenol Flavonoid Kadar Andrografolida
Signifikansi (A) 0.000* 0.210 0.670 (B) 0.943 0.524 0.345
Koefisien korelasi (A) -0.938** -0.462 0.166 (B) 0.028 -0.245 -0.358 Keterangan: *Hasil uji signifikan pada taraf 0.05
**Korelasi sangat signifikan pada taraf 0.01 A = Sampel Ciampea
B = Sampel Cikabayan
Pembahasan
Kadar Air dan Kadar Abu Ekstrak SambilotoPenentuan kadar air dalam simplisia bertujuan untuk mengetahui berapa banyak air yang masih terkandung dalam simplisia tersebut. Proses penentuan kadar air sangat penting dilakukan pada tahap awal penelitian karena apabila kadar air dalam sampel yang akan diuji terlalu tinggi dikhawatirkan hasil yang diperoleh tidak terlalu baik karena masih terlalu banyak air dalam sampel tersebut. Rendahnya kadar air dapat mencegah pencemaran mikroorganisme sehingga mutu simplisia terjaga (Harmita 2006).
Penentuan kadar air dilakukan untuk mengetahui ketahanan suatu bahan dalam penyimpanan. Air yang terikat secara fisik dapat dihilangkan dengan pemanasan pada suhu 100-1050C (Harjadi 1993). Pada penelitian ini, kandungan air pada sampel sambiloto dihilangkan dengan cara pemanasan fisik menggunakan oven pada suhu 1050 C. Menurut Winarno (1992) dalam Ichsan (2011), persen kadar air juga digunakan sebagai faktor koreksi perhitungan rendemen suatu sampel, jika sampel yang digunakan memiliki lingkungan agrofisik yang berbeda, sehingga dapat dipakai untuk memperkirakan jumlah bahan yang dibutuhkan jika ingin mengekstraksi bahan dalam keadaan basah. Berdasarkan hasil penelitian (Gambar 1) kadar air ketiga sampel bernilai kurang dari 15%. Kadar air tertinggi dimiliki sampel asal Ciampea, yaitu 12,07 %. Sampel asal Cikabayan memiliki kadar air sebesar 10,01 %. Sampel yang baik untuk disimpan dalam jangka waktu panjang adalah sampel yang memiliki kadar air kurang dari 10 % karena dapat terhindar dari pencemaran mikroorganisme dan jamur (Winarno 1992).
Nilai kadar abu menunjukkan mineral yang terkandung di dalam bahan. Kadar abu yang lebih tinggi adalah pada sampel asal Ciampea, yaitu sebesar 12,45 %, sedangkan pada sampel Cikabayan sebesar 9,09 % (Gambar 2). Kadar abu yang lebih tinggi pada sampel Cikabayan dapat disebabkan oleh perbedaan kondisi pertumbuhan, pemupukan, waktu panen, teknik panen, dan perlakuan setelah pemanenan (Bakker & Elbersen 2005).
Rendemen Ekstrak Sambiloto
11 ekstraksi (ukuran bahan, jenis pelarut, konsentrasi pelarut, nisbah bahan dengan pelarut, suhu, lama ekstraksi, pemurnian, dan pengeringan ekstrak (Vijesekera 1991 dalam Sembiring 2005).
Ekstraksi dilakukan dengan metode maserasi dan partisi. Proses maserasi dilakukan selama 2 x 24 jam. Menurut Nurcholis (2008), rendemen hasil ekstraksi akan meningkat seiring dengan lamanya waktu ekstraksi. Semakin lama waktu ekstraksi maka waktu kontak antara pelarut dengan bahan baku akan semakin lama. Kondisi ini terus berlanjut sampai tercapai keseimbangan antara konsentrasi senyawa dalam sampel dengan konsentrasi pelarut. Hasil rendemen ekstrak sambiloto asal Ciampea dan kebun Cikabayan dengan pelarut etanol, metanol, dan n-heksana dapat dilihat pada Gambar 3. Ekstrak metanol dari sambiloto asal Ciampea memiliki rendemen ekstrak yang lebih tinggi dibandingkan ekstrak etanol dan n-heksana. Berdasarkan hasil penelitian, ekstrak etanol dari sambiloto asal Ciampea dan Cikabayan berturut-turut adalah 15,39 % dan 10,24 %, ekstrak metanol sambiloto asal Ciampea dan Cikabayan berturut-turut adalah 22,77 % dan 11,00 %, dan ekstrak n-heksana sambiloto asal Ciampea dan Cikabayan adalah 12.81 % dan 9.04 % (Gambar 3).
Pemilihan pelarut merupakan faktor penting dalam proses ekstraksi. Jenis pelarut yang digunakan harus memiliki daya larut yang tinggi dan tidak berbahaya atau beracun. Menurut Depkes (1998) dalam Sembiring (2005), pelarut yang dipilih harus menguntungkan artinya dalam jumlah sedikit sudah dapat melarutkan zat aktif suatu bahan dan waktu untuk menguapkan pelarut lebih singkat sehingga kerusakan zat aktif yang tidak tahan panas dapat dikurangi. Menurut Sembiring et al. (2009) jenis pelarut yang optimal untuk mengekstrak sambiloto adalah etanol 70 %.
Kandungan Alkaloid, Saponin, dan Tanin
Analisis senyawa fitokimia merupakan uji pendahuluan yang bersifat kualitatif yang bertujuan untuk mengetahui kandungan metabolit sekunder yang terdapat di dalam sampel yang diduga memiliki bahan bioaktif. Metabolit sekunder yang biasanya terdapat di dalam tanaman antara lain alkaloid, flavonoid, tanin, polifenol, saponin, terpenoid, dan lain-lain.
Hasil uji menunjukkan adanya alkaloid pada seluruh ekstrak baik pada sampel Ciampea maupun sampel Cikabayan (Tabel 1). Namun, keberadaan alkaloid dalam setiap ekstrak hanya terdeteksi dari pereaksi Dragendorf. Hal ini diduga karena keberadaan alkaloid yang sangat sedikit sehingga hanya dapat terdeteksi oleh pereaksi yang paling sensitif.
12
terjadi karena beberapa faktor, yaitu jenis pelarut yang digunakan saat ekstraksi, variasi genetik, umur tanaman, dan lingkungan atau kondisi geografis tempat tanaman tersebut tumbuh.
Kadar Total Fenol
Senyawa antioksidan alami tumbuhan umumnya adalah senyawa fenolik atau polifenolik. Senyawa fenolik tersebut bersifat multifungsional dan berperan sebagai antioksidan karena mempunyai kemampuan sebagai pereduksi, penangkal radikal bebas, pengkelat logam, atau pengubah oksigen singlet, menjadi bentuk triplet (Croft 1999; Estiasih & Andiyas 2006). Oleh sebab itu kadar total fenol dari ekstrak sambiloto dikaitkan dengan mekanisme antioksidan berdasarkan pengkajiannya pada kemampuan penghambatan peroksidasi (aktivitas antioksidan).
Kadar total fenol ekstrak sambiloto pada penelitian ini diukur dengan menggunakan prinsip Folin-Ciocalteau yang didasarkan pada reaksi oksidasi-reduksi. Reagen Folin yang terdiri dari asam fosfomolibdat dan asam fosfotungstat akan tereduksi oleh senyawa polifenol menjadi molybdenum-tungsen (Kusumaningati 2009). Reaksi ini membentuk kompleks warna biru. Semakin tinggi kadar fenolik pada sampel, semakin banyak molekul kromagen (biru) yang terbentuk sehingga semakin tinggi nilai absorbansi pada sampel tersebut. Intensitas dari warna yang dibentuk diukur pada panjang gelombang 725 nm.
Hasil pengukuran kadar fenolik (Tabel 3) menunjukkan bahwa kadar total fenolik pada ekstrak metanol dari kedua sampel (asal Ciampea dan Cikabayan) Kadar total fenol ekstrak etanol (4,34 % b/b) sampel Ciampea dan sampel Cikabayan (4,82 % b/b) dan kadar total fenol ekstrak n-heksana sampel Ciampea (4,71 % b/b) dan sampel Cikabayan (3,50 % b/b) lebih kecil dibandingkan dengan ekstrak metanol sebesar 7,63 % b/b sampel Ciampea dan 6,02 % b/b sampel Cikabayan. Sehingga dapat dikatakan ekstrak metanol lebih baik dalam mengekstrak senyawa fenol dibandingkan dengan etanol dan n-heksana.
Kadar total fenol dipengaruhi oleh jenis pelarut (Mu’nisa et al. 2012). Fenol merupakan senyawa yang bersifat polar sehingga kelarutannya paling tinggi dalam pelarut polar. Pelarut yang bersifat polar mampu melarutkan fenol lebih baik sehingga kadarnya dalam ekstrak menjadi tinggi (Moein dan Mahmood 2010). Menurut Przybylski et al. (2001), metanol merupakan pelarut yang paling baik dalam mengekstrak senyawa fenol. Berdasarkan hasil penelitian ini diduga senyawa fenolik yang terdapat dalam ekstrak sambiloto terdiri dari berbagai jenis dengan kisaran polaritas yang luas karena dapat larut dalam metanol (polar) dan etanol (semipolar).
13 berbeda nyata dengan ekstrak etanol dan ekstrak n-heksana baik pada sambiloto asal Ciampea maupun asal Cikabayan.
Kadar Flavonoid
Pengukuran kadar flavonoid pada penelitian ini dilakukan dengan metode pewarnaan AlCl3. Prinsip dari pewarnaan metode ini adalah AlCl3 membentuk
kompleks asam yang stabil dengan C-4 gugus keto, lalu dengan C-3 atau C-5 gugus hidroksil dari flavon dan flavonol. Selain itu AlCl3 juga membentuk
kompleks asam yang labil dengan gugus orto dihidroksil pada cincin A atau B dari flavonoid (Fesseden & Fesseden 1986) sehingga akan mempunyai serapan maksimum. Pengukuran kadar flavonoid ini dimulai dengan hidrolisis yang bertujuan untuk menguraikan flavonoid dalam bentuk glikosida (flavonoid yang masih terikat dengan gugus gula) menjadi flavonoid dalam bentuk aglikon (flavonoid tunggal) karena flavonoid akan lebih baik dalam bentuk aglikonnya (Harbone 1996).
Total flavonoid dihitung berdasarkan kurva standar kuersetin dengan persamaan garis y = 0.070x – 0.017 dengan besar R2 adalah 0.998. Kadar flavonoid pada ekstrak sambiloto ini tidak terlalu tinggi, hanya berkisar 0,18 hingga 0,45 % b/b. Ekstrak yang memiliki kandungan flavonoid paling tinggi adalah ekstrak metanol dari sampel B (berasal dari Cikabayan) sebesar 0,45 % b/b (Tabel 3).
Hasil uji statistika menunjukkan bahwa pada ekstrak sambiloto asal Cikabayan nilai p faktor perlakuan ekstraksi lebih kecil dari galat 5 % (p < 0.05). Hal ini menunjukkan bahwa jenis pelarut yang digunakan memberikan pengaruh respon terhadap kadar flavonoid pada taraf nyata 95 %. Uji statistika juga dilakukan dengan menggunakan uji Duncan. Berdasarkan hasil uji diketahui bahwa perlakuan ekstraksi dengan metanol memberikan respon yang berbeda nyata dengan ekstrak etanol dan ekstrak n-heksana pada sambiloto asal Cikabayan, sedangkan pada ekstrak sambiloto asal Ciampea, perlakuan ekstraksi tidak memberikan pengaruh respon terhadap kadar flavonoid.
Kadar Komponen Aktif Sambiloto
Kandungan sambiloto secara kimia mengandung flavonoid dan lakton. Pada lakton, komponen utamanya adalah andrographolide, yang juga sudah diisolasi dalam bentuk murni dan menunjukkan berbagai aktivitas farmakologi. Efek farmakologis sambiloto diantaranya sebagai antioksidan, antidiabetik, antifertilitas, anti HIV-I, antiflu, antimalaria, antidiare, hepatoprotektif, koleretik, dan kolekinetik. Berdasarkan uji toksikologi pada hewan percobaan menunjukkan bahwa andrografolida dan senyawa lain yang terdapat pada sambiloto memiliki toksisitas yang sangat rendah. Zat aktif herbal ini (andrografolida) dapat ditentukan dengan metode gravimetrik atau dengan High Performance Liquid Chromatography (HPLC) (Widyawati 2007).
14
eter. Selain komponen lakton dan flavonoid, tanaman sambiloto juga mengandung komponen keton, mineral (kalsium, natrium, kalium), asam kersik dan damar.
Hasil penelitian menunjukkan kadar andrografolida ekstrak metanol sambiloto asal kebun Cikabayan memiliki nilai yang lebih tinggi dibandingkan dengan ekstrak lainnya yaitu sebesar 108,4 mg/g. Selain itu, ekstrak etanol sambiloto asal Ciampea juga memiliki kadar andrografolida yang cukup tinggi yaitu sebesar 101,31 mg/g (Tabel 4).
Hasil uji statistika menunjukkan bahwa pada ekstrak sambiloto asal Cikabayan nilai p faktor perlakuan ekstraksi lebih kecil dari galat 5 % (p < 0.05). Hal ini menunjukkan bahwa jenis pelarut yang digunakan memberikan pengaruh respon terhadap kadar andrografolida pada taraf nyata 95 %. Uji statistika juga dilakukan dengan menggunakan uji Duncan. Berdasarkan hasil uji diketahui bahwa perlakuan ekstraksi dengan metanol memberikan respon yang berbeda nyata dengan ekstrak etanol dan ekstrak n-heksana pada sambiloto asal Cikabayan. Berdasarkan hasil uji korelasi antara kadar andrografolida dengan kadar flavonoid diperoleh angka koefisien korelasi 0.λ00 dengan α < 0.001. Hal ini menunjukkan bahwa 90.0 % data keduanya berhubungan positif sangat signifikan, yang artinya bahwa semakin tinggi kandungan andrografolida maka semakin tinggi kadar flavonoid begitu pula sebaliknya.
Aktivitas Antioksidan
Metode yang digunakan pada penelitian ini adalah metode DPPH (2,2 diphenyl-1-picryl-hydrazyl). Metode DPPH dipilih karena metode ini sederhana, mudah, cepat, dan peka serta memerlukan sedikit sampel. Prinsip penentuan aktivitas antioksidan diukur dengan melihat kemampuan ekstrak etanol, ekstrak metanol, dan ekstrak n-heksana pada kedua sampel sambiloto dalam menangkap radikal bebas DPPH. Secara mekanisme, terdapat dua macam reaksi senyawa DPPH dengan senyawa antioksidan. Mekanisme reaksi pertama merupakan proses transfer secara langsung elektron atau atom H dari senyawa antioksidan ke senyawa DPPH. Mekanisme reaksi kedua adalah proses transfer elektron dengan proton terkonsentrasi, yaitu senyawa DPPH bermuatan negatif. Senyawa antioksidan berubah bermuatan positif dan mentransfer atom hidrogen ke senyawa DPPH (Maisuthisakul et al 2007).
Parameter yang digunakan untuk menerangkan hasil penentuan aktivitas antioksidan adalah Inhibitory concentration 50 % (IC50). Inhibitory concentration
50 % adalah konsentrasi larutan contoh yang menyebabkan berkurangnya aktivitas DPPH (2,2 diphenyl-1-picryl-hydrazyl) sebesar 50 % (Molyneux 2004). IC50 didapat dari kurva hubungan antara persen penangkapan radikal bebas
dengan konsentrasi (ppm) menggunakan regresi linier. Prinsip metode yang digunakan menyatakan bahwa semakin kecil konsentrasi larutan contoh untuk mengurangi aktivitas DPPH sebesar 50 % maka aktivitas antioksidannya semakin kuat.
Hasil uji (Tabel 5) menunjukkan bahwa ekstrak metanol dari sampel Ciampea memiliki IC50 lebih rendah daripada ekstrak lainnya. Semakin rendah
nilai IC50 suatu bahan, maka semakin tinggi aktivitas antioksidannya. Hal tersebut
15 apabila memiliki nilai IC50 kurang dari 200 ppm (setara dengan 200 µg/mL).
Berdasarkan hasil peneliitian yang diperoleh menunjukkan bahwa semua ekstrak sambiloto yang telah diuji aktivitas antioksidannya memiliki nilai IC50 kurang dari
200 ppm. Penelitian ini menggunakan asam askorbat sebagai data pembanding. Diperoleh kadar IC50 sebesar 2.282 ppm yang masih sangat jauh lebih kecil
dibandingkan dengan kadar IC50 ekstrak karena merupakan senyawa yang murni
dibandingkan dengan ekstrak yang masih dalam bentuk campuran dari beberapa senyawa.
Data aktivitas antioksidan ekstrak sambiloto diolah menggunakan uji statistika untuk mengetahui apakah tiap perlakuan ekstraksi memberikan perbedaan yang nyata terhadap aktivitas antioksidan ekstrak. Hasil uji statistika menunjukkan bahwa pada ekstrak sambiloto baik asal Cikabayan maupun asal Ciampea nilai p faktor perlakuan ekstraksi lebih kecil dari galat 5 % (p<0.05). Hal ini menunjukkan bahwa jenis pelarut yang digunakan memberikan pengaruh respon terhadap aktivitas antioksidan pada taraf nyata 95 %. Uji statistika juga dilakukan dengan menggunakan uji Duncan. Berdasarkan hasil uji diketahui bahwa perlakuan ekstraksi dengan etanol memberikan respon yang berbeda nyata dengan ekstrak metanol dan ekstrak n-heksana pada sambiloto asal Cikabayan, sedangkan pada ekstrak sambiloto asal Ciampea, perlakuan ekstraksi dengan metanol memberikan pengaruh respon berbeda nyata dengan ekstrak etanol dan n-heksana.
Uji korelasi dilakukan dengan analisis data secara bivarian, maka korelasi antara kadar IC50 dengan kadar total fenolik adalah berbanding terbalik karena
koefisien korelasi sebesar -0.λ38 dengan α < 0.001. Hal ini menunjukkan bahwa 93.8 % data keduanya berhubungan negatif sangat signifikan, yang artinya bahwa semakin rendah kadar IC50 maka semakin tinggi kadar total fenolik, artinya
aktivitas antioksidan semakin tinggi.
Senyawa fenolik merupakan bagian yang penting karena dapat menunjukkan aktivitas antioksidan dengan menonaktifkan radikal bebas lipid atau mencegah dekomposisi hidroperoksida menjadi radikal bebas (Maisuthisakul et al. 2007). Senyawa ini termasuk senyawa antioksidan karena dapat menyumbangkan atom hidrogen atau elektron untuk radikal bebas (Bandoniene & Murkovic 2002). Oleh karena itu, semakin tinggi kadar total fenolik maka semakin kecil nilai IC50
atau semakin tinggi aktivitas antioksidannya.
SIMPULAN DAN SARAN
SIMPULAN
16
SARAN
Sampel sambiloto perlu ditambahkan dari berbagai asal daerah bukan hanya yang berasal dari Bogor saja, agar lebih terlihat perbandingannya. Selain itu pelarut air dapat ditambahkan sebagai pelarut ekstraksi dan dapat dikaji lebih lanjut dengan pengujian secara in vivo.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemist. 2007. Official Methods of AOAC Intrnational. Revisi ke-2. Volume ke-1. Maryland: AOAC International.
[Depkes RI] Departemen Kesehatan Republik Indonesia. 2008. Farmakope Herbal Indonesia Edisi Ke-1. Jakarta: Departemen kesehatan Republik Indonesia. Atanassova M, Georgieva S, Ivancheva K. 2011. Total phenolic and total
flavonoid contents, antioxidant capacity and biological contaminants in medical herbs. Journal of the University of Chemical Technology and Metallurgy 46 (1): 81-88.
Bakker RR, Elbersen HW. 2005. Managing ash content and quality in herbaceous biomass: an analysis from plant to product.14th European Biomass Conference and Exhibition; 2005 Oct 17; Paris, France (FR)
Bandoniene D, Murkovic M. 2002. The detection of radical scavenging compounds in crude ekstract of Borage (Borago offivialis L.) by using en online HPLC-DPPH method. J Biochem Biophys Methods. 53: 1-3
Blois MS. 1958. Antioxidant determination by the use of stable free radical.
Nature 181: 1191-1200
Chang C, Yang M, Wen H, Chern J. 2002. Estimation of total flavonoid content in propolis bytwo complementary colorimetric methods. Journal of Food and Drug Analysis. 10 (3). Hlo: 178-182.
Chen et al. 2010. Antiproliferative effect of Toona sinensis leaf extract on non-small cell lung cancer.J. trsl 03.002.
Croft KD. 1999. Antioxidant Effects Plant Phenolik Compoounds. In Basu TK (Ed). Antioxidant in Human and Disease. Australia. Cabi Publishing.
Depkes RI. 1986. Sediaan Galenik. Dirjen Pengawasan Obat dan Makanan Jakarta Estiasih T, Andiyas DK. 2006. Aktivitas antioksidan ekstrak umbi akar ginseng spons Callispongia sp dari Kepulauan Seribu. Majalah Ilmu Kefarmasian 3: 127-133
17 Harborne JB. 1996. Metode Fitokimia Ed ke-2. Padmawinata K, Soedira L, penerjemah; Bandung (ID): Penerbit ITB. Terjemahan dari: Phytochemical Method.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar. Jakarta: Gramedia Pustaka Utama Harmita. 2006. Buku Ajar Analisis Fisikokimia. Depok: Departemen Farmasi
FMIPA UI. Hal: 101-108
Hu CQ, Zhou BN. 1992. Isolation and Structure of Two New Diterpenoid Glucosides from Andrographis paniculata Nees. J. Yao Xue Xue Bao 17(6): 435–440.
Ichsan SA. 2011. Aktivitas ekstrak kulit kayu suren (Toona sinensis Merr.) sebagai antioksidan dan antidiabetes secara in vitro [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor Januwati M., Yusron. 2005. Pengaruh tingkat kebutuhan air terhadap mutu dan
produksi sambiloto. Laporan Teknis Penelitian Balitro. Buku 2. hal. 25-7 Jayaprakasha GK, Rao LJ, Sakariah KK. 2002. Improved HPLC method for
determination of curcumin, demethoxycurcumin, and bisdemethoxycurcumin. Food Chemistry. 50: 3668-3672
Kardono LBS. 2003. Kajian kandungan kimia mahkota dewa (Phaleria marcocarpa). Di dalam: Prosiding Pameran Produk Obat Tradisional dan Seminar Sehari Mahkota Dewa. Jakarta: Pusat Penelitian dan Pengembangan Kesehatan, hlm 72-76
Kilkuzaki H, Nakatani. 1993. Antioxidant effects of some ginger constituents. J. Food. Sci: 58 (6): 1407-1410
Kusumaningati RW. 2009. Analisa Kandungan Fenol Total Jahe (Zingiber officinale Rosc.) secara In vitro. Jakarta: Fakultas Kedokteran. Universitas Indonesia
Maisuthisakul P, Suttajit M, Pongsawatmanit R. 2007. Assessment of phenolic content and free radical-scavenging capacity of some Thai indigenous plants.
Food Chemistry. 100:1409-1418.
Manurung Saima. 2013. Kendali Mutu Ekstrak Temu Ireng Berkhasiat sebgai Antioksidan [Skripsi]. Bogor. Fakultas Matematika dan Ilmu Pengetahuan Alam. Institut Pertanian Bogor
Mattjik A dan Sumertajaya I. 2006. Rancangan Percobaan. Bogor: IPB Press Miyazaki H. 2000. Strenuos endurance training in humans reduces oxidative sress
following exhausting exercise. European Journal of Applied Physiology.
84:1-6
Moein S, Mahmood RM. 2010. Relationship between antioxidant properties and phenolics in Zhumeria majdae. Journal of Medicinal Plants Research (7): 517-521
Molyneux P. 2004. The use of the stable free radicals diphenylpicryllhydrazyl (DPPH) for estimating antioxidant activity. Songklanakarin J Sci Technol.
26: 211-219
18
Nurcholis W. 2008. Profil senyawa penciri bioaktivitas tanaman temulawak pada agrobiofisik berbeda [tesis]. Bogor: Fakultas Metematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Prapanza E., Marianto L. M. 2003. Khasiat dan Manfaat Sambiloto. Raja Pahit Penakluk Aneka Penyakit. AgroMedia Pustaka
Prylbylski R, Lee Y, Eskin N. 2001. Antioxidant and Radical Scavenging Activities of Buckwheat Seed Components. in Pokorny J, Yanishlieva, Gordon M. (eds). Antioxidants in Food. Woodhead. England. Publishing Ltd.
Salazar-Aranda R, Perez-Lopez L,Lopez-Arroyo J, Alanis-Garza B, Torres N. 2009. Antimicrobial and antioxidant activities of plants from Northeast of Mexico. Evidence-Based Complementary and Alternative Medicine.2011 : 1-6. doi:10.1093/ecam/nep127.
Satria E. 2005. Potensi antioksidan dari daging buah tua mahkota dewa (Phaleria macrocarpa (Scheff Boerl) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor
Schopield P, Mbugua D, Pell A. 2001. Analysis of condensed tannins :a review.
Animal Feed Science and Technology. 91 : 21-40.
Sembiring B. 2005. Status teknologi pasca panen sambiloto (Andrographis paniculata Nees.). Bul. Littro 20(2): 134-144
Sembiring B. 2009. Pengaruh konsentrasi bahan pengisi dan cara pengeringan terhadap mutu ekstrak kering sambiloto. Bul. Littro 20(2): 173-181.
Trivedi N. P., Rawal U. M. 2001. Hepatoprotective and antioxidant Property of Andrographis Paniculata (Ness) in BHC Induced Liver Damage in Mice.
Indian J Exp Biol. 39 (1): 41-46
Vijesekera. 1991. Plant derived medicines and their role in global health In the medicinal plant industry. CRC press. Florida, USA. P. 1-18
Widyawati. 2007. Aspek farmakologi sambiloto (Andrographis paniculata Nees).
Majalah Kedokteran Nusantara 40 (3): 216-222 Winarno. 2008. Kimia Pangan dan Gizi. Jakarta: Gramedia
19
LAMPIRAN
Lampiran 1 Bagan alir kerja
Penentuan kadar air dan kadar abu Ekstraksi dengan metanol
Ekstraksi dengan n-heksana
Ekstraksi dengan etanol
Serbuk simplisia sambiloto
Kadar air Kadar abu
Ekstrak kasar metanol
Ekstrak etanol
Ekstrak n-heksana Ekstrak metanol
Analisis statistik dengan SPSS 16.0
Analisis komponen fitokimia, kadar total fenol secara kuantitatif, kadar flavonoid secara kuantitatif, kadar andrografolida,
20
Lampiran 2 Rendemen ekstrak sambiloto
Sampel
sampel awal sampel kering
Bobot ekstrak % rendemen
Etanol A 50.01 43.97 6.77 15.40
Keterangan: A = Sambiloto asal Ciampea B = Sambiloto asal Cikabayan
Contoh perhitungan
Bobot sampel kering = bobot sampel awal × kadar air
= 50.01 × 12.07 % Lampiran 3 Kadar air sampel
Sampel Ulangan Keterangan: A = Sambiloto asal Ciampea
B = Sambiloto asal Cikabayan
Contoh perhitungan
21 Lampiran 4 Kadar abu sampel
Sampel
Bobot Cawan Kosong
Bobot sampel
Bobot cawan+abu
Kadar Abu
(%) Rata-rata B 26.9124 2.0042 27.0824 8.48 9.09
28.9097 2.0053 29.1014 9.56 28.7012 2.0049 28.8863 9.23
A 25.5156 2.0055 25.7852 13.44 12.46 27.1386 2.0012 27.3824 12.18
25.9876 2.0046 26.2231 11.75
Contoh perhitungan
Bobot abu = bobot cawan + abu - bobot cawan kosong = 27.0824 g - 26.9124 g
= 0.170 g Kadar abu (%) =
=
22
Lampiran 5 Kadar total fenolik sampel
Sampel
Lampiran 6 Kurva standar asam tanat
23
Lampiran 7 Kadar total flavonoid ekstrak
Sampel
24
Lampiran 9 Aktivitas antioksidan ekstrak
Sampel Konsentrasi (ppm) % Inhibisi
Ulangan 1 Ulangan 2 Ulangan 3
EtOH (A) 100 40.62 43.23 44.86
200 52.53 51.71 58.56
400 66.39 67.54 74.23
600 84.01 85.81 84.34
800 92.82 93.96 89.23
MeOH (A) 100 51.71 55.46 57.10
200 66.72 70.15 69.98
400 91.68 94.29 93.64
600 97.23 99.51 99.35
800 100.65 102.12 96.90
N-Heksana (A) 100 36.96 36.30 37.29
200 62.38 63.04 64.36
400 82.18 75.91 75.58
600 91.75 90.76 93.07
800 93.40 94.06 93.73
EtoH (B) 100 46.66 42.09 42.90
200 58.73 61.17 51.06
400 68.19 67.86 73.57
600 86.46 81.40 78.30
800 84.34 86.30 89.89
MeOH (B) 100 43.56 52.81 42.90
200 65.02 69.64 63.04
400 89.44 88.12 87.13
600 91.75 91.42 91.09
800 94.06 90.10 88.45
N-Heksana (B) 100 54.79 48.84 49.17
200 63.70 68.98 67.99
400 90.43 87.79 91.42
600 93.40 93.07 92.41
800 96.04 95.71 95.71
25 Lampiran 10 Hasil uji IC50 ekstrak
Sampel
Ulangan Persamaan garis Nilai IC50 (ppm) Keterangan: A = Sambiloto asal Ciampea
B = Sambiloto asal Cikabayan
Lampiran 11 Aktivitas inhibisi vitamin C
26
Lampiran 12 Kadar andrografolida ekstrak
27 Lampiran 13 Kromatogram HPLC
Kromatogram Standard Andrografolida
28
Kromatogram Ekstrak Metanol Ciampea
29 Kromatogram Ekstrak Metanol Cikabayan
30
Kromatogram Ekstrak N-heksana Cikabayan
Lampiran `14 Hasil uji statistika dengan program SPSS 16.0
ANAVA
TOTAL FENOL (A)
Jumlah Kuadrat df Kuadrat Tengah F hitung Sig. Perlakuan 19.405 2 9.702 49.807 .000 Galat 1.169 6 .195
Total 20.573 8
TOTAL FENOL (A)
PERLAKUAN N
Subset pada alfa = 0.05 1 2 Duncana EtOH 3 4.3433
N-Heksan 3 4.7133
31
Nilai rata-rata untuk setiap kelompok dalam subset yang homogen ditampilkan. a. Ukuran nilai rata-rata sampel harmonik = 3.000.
ANAVA Nilai rata-rata untuk setiap kelompok dalam subset yang homogen ditampilkan. a. Ukuran nilai rata-rata sampel harmonik = 3.000.
32
KADAR ANDROGRAFOLIDA (A)
PERLAKUAN N
Subset pada alpha = 0.05 1
Duncana N-Heksan 3 68.0500
MeOH 3 82.9433 EtOH 3 101.3133
Sig. .156
Nilai rata-rata untuk setiap kelompok dalam subset yang homogen ditampilkan. a. Ukuran nilai rata-rata sampel harmonik = 3.000.
ANAVA Nilai rata-rata untuk setiap kelompok dalam subset yang homogen ditampilkan. a. Ukuran nilai rata-rata sampel harmonik = 3.000.
ANAVA
FLAVONOID (B)
33 Nilai rata-rata untuk setiap kelompok dalam subset yang homogen ditampilkan. a. Ukuran nilai rata-rata sampel harmonik = 3.000.
ANAVA Nilai rata-rata untuk setiap kelompok dalam subset yang homogen ditampilkan. a. Ukuran nilai rata-rata sampel harmonik = 3.000.
Korelasi
34
Korelasi
KTFB KFB HPLCB IC50B KTFB Korelasi Pearson 1 .494 .292 .028
Sig. (2-sisi) .177 .446 .943
N 9 9 9 9
KFB Korelasi Pearson .494 1 .900** -.245 Sig. (2-sisi) .177 .001 .524
N 9 9 9 9
HPLCB Korelasi Pearson .292 .900** 1 -.358 Sig. (2-sisi) .446 .001 .345
N 9 9 9 9
IC50B Korelasi Pearson .028 -.245 -.358 1 Sig. (2-sisi) .943 .524 .345
N 9 9 9 9
**. Korelasi bersifat signifikan pada tingkat 0.01 (2-sisi). Keterangan: A = Sambiloto asal Ciampea
35
RIWAYAT HIDUP
Lidya Agustina Budiarti, lahir di Bekasi, Jawa Barat pada tanggal 7 Agustus 1992. Merupakan anak kedua dari tiga bersaudara pasangan Bapak Hilman Karyana dan Ibu Ida Mulyani (Alm.). Penulis pernah melaksanakan pendidikan di SMA N 2 Ciamis, Jawa Barat dan sekarang sedang menjalani pendidikan di Departemen Biokimia Institut Pertanian Bogor. Selama kuliah penulis aktif mengikuti organisasi kemahasiswaan dan kepanitiaan sebagai anggota divisi CIC CREBs 2011-2012, panitia divisi Humas Biochemistry Fair 2012, panitia divisi Humas Seminar Kesehatan dan Kehalalan Pangan 2012, panitia divisi keamanan Olimpiade Mahasiswa IPB (OMI) 2013, anggota divisi CIC CREBs IPB 2012-2013, ketua panitia divisi humas Biochemistry Expo 2013 dan panitia Job Fair