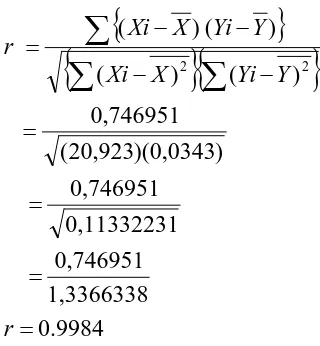PENENTUAN KANDUNGAN BIJIH EMAS DARI BATUAN PENAMBANGAN MASYARAKAT DESA BEUTEUNG-ACEH DENGAN METODE SIANIDASI DAN PEMURNIAN SECARA
ELEKTROLISIS
SKRIPSI
FRANS N. SIMANJUNTAK 050802016
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENENTUAN KANDUNGAN BIJIH EMAS DARI BATUAN SISA PENAMBANGAN
MASYARAKAT DESA BEUTEUNG-ACEH DENGAN METODA SIANIDASI DAN PEMURNIAN SECARA ELEKTROLISIS
Kategori : SKRIPSI
Nama : FRANS N. SIMANJUNTAK
Nomor Induk Mahasiswa : 050802016
Program Studi : SARJANA (S1) KIMIA
Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU
PENGETAHUAN ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Desember 2010 Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dr. Tini Sembiring, MS Prof. Dr. Pina Barus, MS NIP. 194805131971072001 NIP. 194606041980031001
Diketahui/Disetujui oleh :
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PENENTUAN KANDUNGAN BIJIH EMAS DARI BATUAN
PENAMBANGAN MASYARAKAT DESA BEUTEUNG-ACEH DENGAN METODE SIANIDASI DAN PEMURNIAN SECARA ELEKTROLISIS
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa
kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Desember 2010
PENGHARGAAN
Puji dan syukur penulis panjatkan kepada Tuhan Yang Maha Kuasa atas berkat kasih karunia-Nya yang dilimpahkan setiap saat. Dalam masa-masa tersulit maupun masa gembira Tuhan tetap beri kekuatan hingga akhirnya penulis dapat menyelesaikan penelitian dan menyusun skripsi ini.
Dengan rasa hormat, penulis mengucapkan terimakasih kepada :
1. Bapak Prof. Dr. Pina Barus, M.S dan Ibu Dr. Tini Sembiring, M.S selaku pembimbing I dan pembimbing II yang telah banyak meluangkan waktunya untuk membimbing dan mengarahkan serta memberikan motivasi kepada penulis selama melakukan penelitian hingga penyusunan skripsi ini.
2. Bapak Prof. Dr. Harlem Marpaung selaku Kepala Laboratorium Kimia Analitik Departemen Kimia FMIPA-USU yang telah banyak memberikan saran-saran kepada penulis.
3. Ibu Dr.Rumondang Bulan,MS dan Bapak Drs.Firman Sebayang,MS selaku Ketua dan Sekretaris Departemen Kimia FMIPA-USU
4. Ibu Dra. Nurhaida Pasaribu, MSi selaku pembimbing akademik yang selalu memberikan saran-saran kepada penulis semasa kuliah.
5. Seluruh Bapak/Ibu staff dosen Departemen Kimia FMIPA-USU yang telah banyak memberikan pengetahuan dan pengalamannya kepada penulis.
6. Kepada asisten Puslit : B’Lintong Pane, S.Si ; B’Viktor, S.Si; B’Jasmer, S.Si dan Marcel Pasaribu, terimakasih atas pengalaman dan dukungan yang baik kepada penulis.
7. Seluruh teman-teman mahasiswa kimia stambuk 2005 terkhusus kepada sahabat ku Jubel Nainggolan, Gomgom Sinaga, Amos Sianturi, Danny Simanjuntak, Oven, Pak Aji Albinur, Julianto, Donal, Whendy, Mariathie, Eviana yang selalu bersama menghadapi hari-hari nongkrong di amild.
8. Abang/kakak stambuk 2003, 2004 yang telah banyak memberikan informasi ,saran dan dukungan kepada penulis.
9. Adik-adik stambuk 2006-2008 yang telah membantu dan memberikan dukungan kepada penulis.
.
Dan akhirnya, penulis mengucapkan terimakasih kepada keluargaku yang sangat kukasihi dan kucintai : Ayahku S. Simanjuntak dan Ibunda T. Sihotang yang telah banyak memberikan dukungan doa, nasehat, dana kepada penulis ; Seluruh Keluarga besar Op.Sumihardo Sihotang yang selalu mendukung penulis lewat doa dan motivasi; Abangku Binsar Simanjuntak ST. yang telah banyak memberikan dukungan doa, saran/masukan dan pengalaman serta sebagai tempat bertukar pikiran yang indah dan luar biasa bagi penulis; keluarga Kakakku Tetty Herawaty, SP dan P. Marbun SH; kakakku Lisbet Simanjuntak, S.Si atas dukungan doa dan motivasi kepada penulis. Dan buat Anelia Kaban, Intan Sihotang atas doa dan motivasinya.Terkhusus kepada Hilda Sinaga yang memberikan motivasi dan informasi untuk penelitian ini.
ABSTRAK
Telah dilakukan penelitian tentang pemisahan bijih emas dari sampel batuan yang
diperoleh dari Desa Beuteung Daerah Simpang Empat Kabupaten Nagan Raya Aceh.
Batuan dengan ukuran 200 mesh selanjutnya diekstraksi dengan larutan sianida 0,3%
yang akan membentuk senyawa kompleks [Au(CN)2]-. Emas dari larutan tersebut
dipisahkan secara elektrolisis menggunakan katoda besi dan anoda aluminium
dengan arus listrik 6 ampere, tegangan 2 volt selama 6 jam. Emas yang terdeposit
pada katoda besi dipisahkan dengan melarutkannya menggunakan HCl(p). Katoda
besi akan larut sehingga diperoleh deposit emas. Kadar emas yang diperoleh
selanjutnya diuji dengan SSA. Dari 1 kg sampel batuan diperoleh kandungan emas
DETERMINATION OF CONTENT OF GOLD ORE MINING COMMUNITY OF ROCK-ACEH VILLAGE BEUTEUNG SIANIDASI METHOD AND
PURIFICATION BY ELECTROLYSIS
ABSTRACT
Has been studied of the separation of gold ore from rock samples obtained from the village of Simpang Empat Beuteung Region Aceh, Nagan Raya district. Rock with a size of 200 mesh then extracted with 0.3% cyanide solution that will form a complex compound [Au(CN)2] -. Separated gold from the solution by electrolysis using an
DAFTAR ISI
2.1.2 Jenis-jenis Bijih Emas dan Distribusinya di Indonesia 6
2.2. Metalurgi 7 2.3. Sianida 8
2.4. Ekstraksi 10 2.5. Elektrolisis 14 2.5.1. Sel Elektrokimia dengan Elektroda Aluminium 14
2.5.2. Hukum Faraday 16
2.6. Spektrometer Serapan Atom 17
2.6.1. Teori Spektrometer Serapan Atom 18 2.6.2. Cara Kerja Spektrometer Serapan Atom 19 2.6.3. Pemakaian Analitis Spektrometer Serapan Atom 20 2.6.4. Interferensi pada Spektrometer Serapan Atom 20 2.6.5. Keuntungan Spektrometer Serapan Atom 21 2.6.6. Gangguan-gangguan pada Spektrometer Serapan Atom 21 2.6.7. Penentuan Konsentrasi Emas dengan Spektrometer 22 Serapan Atom BAB 3. BAHAN DAN METODE PENELITIAN 23
3.1. Alat-alat 23
3.3. Prosedur Penelitian 24
DAFTAR GAMBAR
Halaman
Gambar 2.1 Alat Spektrometer Serapan Atom 17
Gambar 2.2 Proses saat Atom Menyerap Energi pada 18 Panjang Gelombang tertentu
Gambar 2.3 Sistematis Ringka s dari Alat SSA 19 Gambar 4.1 Kurva Kalibrasi Larutan Standar Emas 39
DAFTAR TABEL
Halama n
Tabel 2.1 Data Sifat Fisik dan Kimia Emas 6
Tabel 4.1 Data Perolehan Emas dan Perak dengan Gravimetri 31
Tabel 4.2 Data Perolehan Emas dengan Gravimetri 31
Tabel 4.3 Hasil Pengukuran Absorbansi Larutan Standar Au 32 untuk Kurva Kalibrasi
Tabel 4.4 Penurunan Persamaan Garis Regresi dengan Metode Least 32 Square Hasil Pengukuran Kadar Au
ABSTRAK
Telah dilakukan penelitian tentang pemisahan bijih emas dari sampel batuan yang
diperoleh dari Desa Beuteung Daerah Simpang Empat Kabupaten Nagan Raya Aceh.
Batuan dengan ukuran 200 mesh selanjutnya diekstraksi dengan larutan sianida 0,3%
yang akan membentuk senyawa kompleks [Au(CN)2]-. Emas dari larutan tersebut
dipisahkan secara elektrolisis menggunakan katoda besi dan anoda aluminium
dengan arus listrik 6 ampere, tegangan 2 volt selama 6 jam. Emas yang terdeposit
pada katoda besi dipisahkan dengan melarutkannya menggunakan HCl(p). Katoda
besi akan larut sehingga diperoleh deposit emas. Kadar emas yang diperoleh
selanjutnya diuji dengan SSA. Dari 1 kg sampel batuan diperoleh kandungan emas
DETERMINATION OF CONTENT OF GOLD ORE MINING COMMUNITY OF ROCK-ACEH VILLAGE BEUTEUNG SIANIDASI METHOD AND
PURIFICATION BY ELECTROLYSIS
ABSTRACT
Has been studied of the separation of gold ore from rock samples obtained from the village of Simpang Empat Beuteung Region Aceh, Nagan Raya district. Rock with a size of 200 mesh then extracted with 0.3% cyanide solution that will form a complex compound [Au(CN)2] -. Separated gold from the solution by electrolysis using an
BAB I PENDAHULUAN
1.1.Latar Belakang
Di bumi, umumnya emas ditemukan dalam bentuk logam yang terdapat dalam
retakan-retakan batuan kuarsa dan dalam bentuk mineral. Emas juga ditemukan
dalam bentuk alluvial yang terbentuk karena proses pelapukan terhadap batu-batuan
yang mengandung emas (gold bearing rocks) (Peters, 2001).
Pada Industri, emas diperoleh dengan cara mengisolasinya dari batuan bijih
emas. Batuan bijih emas yang layak dieksploitasi sebagai industri tambang emas
adalah sekitar 25 g/ton kandungan emasnya. Metode isolasi emas yang saat ini
banyak digunakan untuk keperluan eksploitasi emas skala industri adalah metode
sianida dan metode amalgamasi.
Di Indonesia, masyarakatnya masih melakukan penambangan secara
tradisional. Usaha pertambangan tersebut dilakukan dengan metode amalgamasi
yaitu dengan menggunakan merkuri (Hg) untuk mengikat emas dan menghasilkan
limbah Hg dan logam berat lainnya dari hasil pemurnian emas. Berdasarkan hasil
penelitian menunjukkan bahwa kadar emas yang didapat dari proses amalgamasi
masih rendah yaitu sekitar 40% dan kehilangan air raksa
sebesar 5-10% (Sanusi, 1984).
Pada metode amalgamasi, penggunaan merkuri mempunyai dampak yang
besar terhadap lingkungan karena berbahaya dan mematikan. Oleh karena itu, perlu
dilakukan usaha untuk menciptakan metode pemisahan alternatif yang lebih baik.
Sampai saat ini, reagen sebagai pelarut emas yang banyak digunakan dalam industri
adalah sianida. Hal ini disebabkan oleh perolehan emas yang tinggi (>95%), waktu
proses yang relatif singkat dan lebih ekonomis. Sianida juga dapat mengestrak emas
dalam rentang ukuran bijih dari yang kasar sampai halus. Proses sianidasi juga
terdegradasi, terutama karena terkena sinar ultraviolet dari matahari, dan menjadi bentuk
yang lebih tidak beracun dan terutama membentuk karbondioksida dan nitrat yang tidak
beracun. Selain itu, sianida dapat dinetralkan dengan penambahan sodium
metabisulfat. (Sudarsono, 2003).
Pemisahan logam emas dengan metode sianidasi dapat dilakukan dengan cara
pengendapan menggunakan serbuk Zn (Zinc precipitation) dan penyerapan dengan
karbon aktif. Penggunaan serbuk seng akan mengendapkan emas dalam bentuk
ikatan seng emas berwarna hitam. Selanjutnya ditambahkan asam sulfat untuk
melarutkan seng dan emas sebagai residunya. Emas diperoleh dengan cara
meleburkannya dengan penambahan borax pada suhu 1200oC. Sedangkan emas dari
penyerapan karbon aktif dapat berasal dari arang batok kelapa atau arang kayu
diperoleh dengan membakar karbon sehingga dihasilkan abu dan logam emas.
(Permen-LH No.23 tahun 2008).
Pemisahan logam emas dengan metode sianidasi dapat juga dilakukan
dengan elektrolisis untuk memperoleh emas murni. Elektrolisis adalah peristiwa
penguraian elektrolit oleh arus listrik searah dengan menggunakan katoda dan anoda.
Reaksi yang terjadi adalah oksidasi-reduksi, dimana emas akan terdeposit pada
katoda karena adanya beda potensial reduksi pada masing-masing logam. Oleh
karena itu maka peneliti ingin memisahkan bijih emas dari sampel batuan dengan
metode sianidasi dan dielektrolisis untuk menghasilkan emas murni. (Jackson, 1986).
1.2.Permasalahan
Adapun yang menjadi permasalahan adalah apakah emas dapat dipisahkan
dari ikatan kompleks sianida dengan cara elektrolisis.
1.3.Pembatasan masalah
Dalam penelitian ini penulis membatasi masalah yaitu
- Sampel batuan berupa barang tambang yang mengandung bijih emas diperoleh
dari Desa Beuteung Daerah Simpang Empat Kabupaten Nagan Raya-Aceh yang
- Ekstraksi sampel bijih emas dengan menggunakan metode sianidasi.
- Proses pemurnian bijih emas dilakukan dengan cara elektrolisis.
- Uji kadar emas dengan menggunakan SSA
1.4.Tujuan Penelitian
Adapun tujuan penelitian ini adalah untuk mengetahui banyaknya kandungan
emas yang diperoleh setelah dielektrolisis dari sampel yang sudah diekstraksi dengan
metode sianidasi.
1.5. Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi kepada masyarakat
ataupun pihak-pihak tentang keefektifan metoda elektrolisis untuk memisahkan emas
secara sianidasi.
1.6. Metodologi Penelitian
Penelitian ini bersifat eksperimen Laboratorium dengan metode dan cara
kerja urutan kerja sebagai berikut:
- Sampel batuan berupa barang tambang yang mengandung bijih emas diperoleh
dari Desa Beuteung Daerah Simpang Empat Kabupaten Nagan Raya-Aceh yang
dihaluskan dengan ukuran 200 mesh sehingga diperoleh sampel berupa bubuk.
- Pelarutan sampel dilakukan dengan menggunakan NaCN.
- Pemurnian sampel dilakukan dengan proses elektrolisis.
- Uji kadar emas dengan menggunakan Spektrometer serapan atom.
1.7. Lokasi Penelitian
Penelitian dilakukan di Laboratorium Pusat Penelitian Sumber Daya Alam dan
BAB II
TINJAUAN PUSTAKA
2.1. Defenisi Emas
Emas adalah logam mineral yang merupakan salah satu bahan galian logam yang
bernilai tinggi baik dari sisi harga maupun sisi penggunaan. Emas terbentuk dari
proses magmatisme atau pengkonsentrasian di permukaan. Beberapa endapan
terbentuk karena proses metasomatisme kontak dan larutan hidrotermal, sedangkan
pengkonsentrasian secara mekanis menghasilkan endapan letakan (placer).
Emas terdapat di alam dalam dua tipe deposit, pertama sebagai urat (vein)
dalam batuan beku, kaya besi dan berasosiasi dengan urat kuarsa. Lainnya yaitu
endapan atau placer deposit , dimana emas dari batuan asal yang tererosi terangkut
oleh aliran sungai dan terendapkan karena berat jenis yang tinggi. Emas terbentuk
karena adanya kegiatan vulkanisme, bergerak berdasarkan adanya thermal atau
panas di dalam bumi.
Dalam proses geokimia, emas biasanya dapat diangkut dalam bentuk larutan
komplek sulfida atau klorida. Pengendapan emas sangat tergantung kepada besarnya
perubahan pH, H2S, oksidasi, pendidihan, pendinginan, dan adsorpsi oleh mineral
lain. Sebagai contoh, emas akan mengendap jika suasana menjadi sedikit basa dan
terjadi perubahan dari reduksi menjadi oksidasi. Atau emas akan mengendap jika
terikat mineral lain, seperti pirit. (Nelson, 1990).
Emas merupakan logam yang bersifat lunak dan mudah ditempa. Tingkat
kekerasannya berkisar antara 2,5 – 3 (skala Mohs). Berat jenisnya dipengaruhi oleh
jenis dan kandungan logam lain yang berpadu dengannya. Umumnya emas
didapatkan dalam bentuk bongkahan, tetapi di Indonesia hal tersebut sudah jarang
ditemukan. Batuan berkadar emas rendah merupakan batuan yang mengandung emas
lebih kecil dari 100 mg emas dalam 1 kg batuan. Emas ialah unsur kimia dalam
merupakan logam lembut, berkilat, berwarna kuning, padat, dan tidak banyak
bereaksi dengan kebanyakan bahan kimia, walau dapat bereaksi dengan klorin,
fluorin dan akua regia. Logam ini selalu ada dalam bentuk bongkahan dan butiran
batuan maupun dalam pendaman alluvial. (Esna, 1988).
Kenampakan fisik bijih emas hampir mirip dengan pirit, markasit, dan
kalkopirit dilihat dari warnanya, namun dapat dibedakan dari sifatnya yang lunak
dan berat jenis tinggi. Emas berasosiasi dengan kuarsa, pirit, arsenopirit, dan perak.
Emas terdapat di alam dalam dua tipe deposit. Pertama sebagai urat/vein dalam
batuan beku, kaya besi dan berasosiasi dengan urat kuarsa. Endapan lain adalah
placer deposit, dimana emas dari batuan asal yang tererosi terangkut oleh aliran
sungai dan terendapkan karena berat jenis yang tinggi. Selain itu, emas sering
ditemukan dalam penambangan bijih perak dan tembaga. (Addison, 1980).
2.1.1. Sifat-sifat Fisik dan Kimia Emas
Logam emas merupakan logam yang tahan akan korosi,mudah ditempa dan relatif
stabil di alam karena tidak banyak bereaksi dengan kebanyakan bahan kimia. Oleh
karena itu, logam ini banyak dimanfaatkan di berbagai kehidupan manusia. Pada saat
ini, emas banyak digunakan sebagai perhiasan, cadangan kekayaan negara, medali,
elektroda, dan komponen di dalam komputer. Oleh karena itu, emas memiliki nilai
ekonomi yang tinggi. Pada tabel 2.1 berikut ini ditampilkan sifat-sifat fisik dan kimia
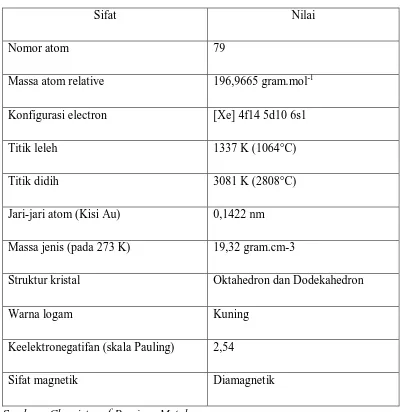
Tabel 2.1 Data Sifat Fisik dan Kimia Emas
Sifat Nilai
Nomor atom 79
Massa atom relative 196,9665 gram.mol-1
Konfigurasi electron [Xe] 4f14 5d10 6s1
Titik leleh 1337 K (1064°C)
Titik didih 3081 K (2808°C)
Jari-jari atom (Kisi Au) 0,1422 nm
Massa jenis (pada 273 K) 19,32 gram.cm-3
Struktur kristal Oktahedron dan Dodekahedron
Warna logam Kuning
Keelektronegatifan (skala Pauling) 2,54
Sifat magnetik Diamagnetik
Sumber : Chemistry of Precious Metals
2.1.2. Jenis-jenis Bijih Emas dan Distribusinya di Indonesia
Emas umumnya didapatkan dari batuan atau mineral. Mineral ikutan umumnya
adalahkuarsa, karbonat, turmalin, flourpar, electrum, emas telurida, dan sejumlah
kecil mineral non logam. Namun, karena sifat kimia dari logam emas yang relatif
tidak reaktif maka emas dapat diemukan dalam bentuk nativ atau bentuk murninya.
Sejumlah paduan dan senyawa emas juga dapat ditemukan dengan unsur-unsur
belerang, antimon, dan selenium. Emas banyak digunakan sebagai barang perhiasan
Indonesia, seperti di Pulau Sumatera, Kepulauan Riau, Pulau Kalimantan, Pulau
Jawa, Pulau Sulawesi, Nusa Tenggara, Maluku, dan Papua. (Setiabudi, 2005).
2.2. Metalurgi
Metalurgi adalah proses pengolahan bahan-bahan alam menjadi logam unsur yang
selanjutnya menjadi logam dengan sifat-sifat yang diinginkan. Bahan anorganik alam
yang ditemukan di kerak bumi disebut mineral, contohnya bauksit dan
aluminosilikat, sedang mineral yang dapat dijadikan sumber untuk memproduksi
bahan secara komersial disebut bijih. Bijih logam yang paling umum adalah berupa
oksida, sulfida, karbonat, silikat, halida dan sulfat. (Rosenqvist, 1974).
Metalurgi melalui tiga tahapan, yaitu:
a. Pemekatan Bijih
Di dalam bijih mengandung batuan tak berharga yang disebut batureja (ganggue).
Pemekatan bijih bertujuan untuk menyingkirkan sebanyak mungkin batureja. Biji
dihancurkan dan digiling sehingga butiran terlepas dari batureja. Pemisahan
selanjutnya dapat dilakukan dengan cara fisis seperti pengapungan (flotasi) atau
penarikan dengan magnet. Pada proses pengapungan, bijih yang telah dihancurkan
diberi minyak tertentu. Mineral akan melekat pada buih sehingga terlepas dari
batureja atau batureja akan melekat pada buih.
b. Peleburan
Peleburan (smelting) adalah proses reduksi bijih sehingga menjadi logam unsur yang
dapat digunakan berbagai macam zat seperti karbid, hidrogen, logam aktif atau
dengan cara elektrolisis. Pemilihan zat pereduksi ini tergantung dari 3 kereaktifan
masing-masing zat. Makin aktif logam makin sukar direduksi, sehingga sehingga
diperlukan pereduksi yang lebih kuat.
Logam yang kurang aktif seperti tembaga dan emas dapat direduksi hanya
dengan pemanasan. Logam dengan kereaktifan sedang seperti besi, nikel dan timah
dapat direduksi dengan karbon, sedang logam aktif seperti magnesium dan
dengan fluks, yaitu suatu bahan yang mengikat pengotor dan membentuk zat yang
mudah mencair, yang disebut terak.
c. Pemurnian
Pemurnian (refining) adalah penyesuaian komposisi kotoran dalam logam kasar.
Beberapa cara pemurnian antara lain elektrolisis, destilasi, peleburan. (Jakson, 1986).
2.3. Sianida
Sianida adalah senyawa yang termasuk B-3 (Bahan Berbahaya dan Beracun),
sehingga pada pemakaiannya sebagai pelarut proses pengambilan logam emas,
konsentrasinya dibatasi sampai 1500 ppm. Proses pemurnian ini didasarkan pada
proses yang terdiri dari bijih dengan suatu larutan natrium sianida atau suatu
ekivalen sianida lalu setelah memisahkan larutan dari pengotor, presipitasi emas,
biasanya dilakukan dengan zink atau aluminium dan kadang-kadang dengan logam
lain.
Senyawa asam sianida stabil pada pH < 7 karenanya, senyawa NaCN mudah
berubah bentuk menjadi asam sianida yang sangat beracun pada suasana asam. Agar
senyawa sianida tetap sebagai NaCN maka, pH larutan harus dijaga agar tetap dalam
suasana basa. Pembentukan HCN dari NaCN dapat terjadi karena adanya absorpsi
CO2 dari udara, menurut reaksi berikut:
CO2 + H2O → H2CO3
H2CO3 + CN- → HCN + (HCO3)
-Kebasaan larutan harus dijaga pada pH 10-11 biasanya dengan cara menambahkan
kapur, tetapi kebasaan yang terlalu tinggi (pH>11) akan menurunkan kelarutan emas
di dalam larutan sianida.
Oksigen dan sianida sangat diperlukan pada proses sianidasi bijih emas,
karena kecepatan reaksi dipengaruhi oleh konsentrasi kedua senyawa ini. Penelitian
menunjukkan bahwa kecepatan pelindian Au akan meningkat dengan naiknya
tergantung pada konsentrasi sianida (konsentrasi oksigen tidak mempengaruhi),
tetapi pada konsentrasi tinggi, kecepatan pelindian hanya tergantung pada
konsentrasi oksigen.
Proses sianidasi dikontrol oleh konsentrasi oksigen dan konsentrasi sianida di
dalam larutan, agar dicapai persen ekstraksi yang tinggi maka keberadaan kedua
senyawa ini di dalam larutan harus diamati dengan baik, artinya tidak ada
manfaatnya meningkatkan konsentrasi sianida tetapi ternyata konsentrasi oksigen di
dalam larutan rendah.
Di dalam bijih emas biasanya terdapat berbagai mineral sulfida seperti pirit,
galena, arsenopirit, kalkopirit, kovelit, kalkosit. Mineral-mineral logam ini umumnya
akan ikut terlarut ke dalam larutan sianida, sedang mineral pengotor kuarsa tidak
larut ke dalam larutan sianida.
Cu2S + 6 CN- → 2[Cu(CN)3]2- + S
2-Zn2S + 4 CN- → 2[Zn(CN)4]2- + S
2-FeS + 6 CN- + 2O2 → [Fe(CN)6]4- + [SO4]
2-Ion sulfida yang terbentuk akan bereaksi dengan oksigen membentuk tiosianat yang
tidak mempengaruhi kelarutan emas:
S2- + CN- + 0,5 O2 + H2O → CNS- + 2 OH
-Juga akan teroksidasi menjadi tiosulfat:
S2- + 2 O2 + H2O → [S2O3]- + 2 OH-
Reaksi-reaksi di atas menunjukkan bahwa adanya mineral pengotor dapat
memperlambat kecepatan pelarutan. Apabila terbentuk ion sulfida maka dapat
ditambahkan garam Pb seperti Pb oksida, Pb nitrat, atau Pb asetat sebelum proses
sianidasi yang akan mengendapkanion sulfida dalam bentuk Pb sulfida yang tidak
juga sebelum proses sianidasi, sehingga mineral sulfida akan terdekomposisi dan
akhirnya mengendap seabagai CaSO4 sesuai reaksi:
FeS + 2OH- → Fe(OH)2 + S
2-2Fe(OH)2 + 0,5 O2 + H2O → 2Fe(OH)3
S2- + 2O2 → [SO4]2-
[SO4]2- + Ca2+ → CaSO4 (Sudarsono, 2003).
2.4. Ekstraksi
Ekstraksi adalah proses pemisahan berdasarkan pada distribusi zat terlarut dengan
perbandingan tertentu antara dua pelarut yang tidak saling bercampur. Terdapat dua
metoda pilihan yang dapat diterapkan dalam ekstraksi emas yaitu sianidasi dan
amalgamasi. Dalam mengekstraksi logam dari bijihnya, tidak semua tahapan proses
harus dilakukan. Apabila suatu bijih secara teknologi dapat diolah langsung dengan
proses hidrometalurgi, maka faktor selanjutnya yang mempengaruhi pemilihan
proses adalah faktor ekonomis.
Dalam skala industri, pelindian sianidasi merupakan suatu proses
hidrometalurgi yang paling ekonomis dan hingga kini telah diterapkan pada berbagai
pabrik pengolahan emas di dunia. Istilah proses pelindian yang selektif dipakai
dengan tujuan agar dapat memilih pelarut tertentu yang dapat melarutkan logam
berharga tanpa melarutkan pengotornya. Logam emas sangat mudah larut dalam
KCN, NaCN, dan Hg, sehingga emas dapat diambil dari mineral pengikatnya
melalui amalgamasi (Hg) atau dengan menggunakan larutan sianida (biasanya
NaCN). Selain itu emas dapat larut pada aquaregia, dengan persamaan reaksi :
Au(s) + 4HCl(aq) + HNO3(aq) → HAuCl4(aq) + NO (g) + 2H2O(l)
Untuk keperluan ekstraksi dari bijihnya, proses dengan melibatkan senyawa
sianida dapat diterapkan pada ekstraksi logam emas. Emas membentuk berbagai
senyawa kompleks. Emas (I) oksida, Au2O adalah salah satu senyawa yang stabil
stabil dalam senyawa padatan, karena semua larutan garam emas (I) mengalami
disproporsionasi menjadi logam emas dan ion emas (III) menurut persamaan reaksi :
3Au+(aq) → 2Au (s) + Au3+(aq) (Bertrand, 1895).
Pada pelindian sianidasi para peneliti sepakat bahwa sebelum membentuk
senyawa kompleks dengan ion sianida, logam emas harus teroksidasi dahulu menjadi
ion emas. Prosesnya merupakan proses redoks (reduksi-oksidasi) dimana ion sianida
membentuk senyawa kompleks kuat dengan ion Au+ dan diiringi dengan reduksi
oksigen di permukaan logam menjadi hidrogen peroksida atau menjadi hidroksil
seperti reaksi berikut ini :
Oksidasi : Au → Au+ + e
Pembentukan kompleks : Au+ + 2CN- → [Au(CN)2]
-Reduksi : O2 + 2H2O + 2e → H2O2 + 2OH
O2 + 2H2O + 4e → 4OH-
Persamaan reaksi yang umum digunakan untuk pemisahan emas dalam larutan alkali
sianida adalah :
2Au + 4CN- + ½O2 + 2H2O → 2(Au(CN)2- + 2OH
-Mekanisme reaksi ini adalah mekanisme elektrokimia. Hidrogen peroksida telah
dideteksi dalam larutan sianida dimana emas telah terpisah secara cepat, dan
observasi ini menunjukkan bahwa beberapa emas kemungkinan terpisah melalui
sepasang reaksi yang melibatkan pembentukan pertama hidrogen peroksida.
2Au + 4CN- + O2 + H2O → 2(Au(CN)2- + 2OH- + H2O2
Lalu hidrogen peroksida bereaksi dengan beberapa emas dan sianida.
2Au + 4CN- + H2O2→ 2(Au(CN)2- + 2OH- (Chirstie, 1986).
a) Metode heap leaching (pelindian tumpukan) yaitu pelindian emas dengan cara
menyiramkan larutan sianida pada tumpukan bijih emas (diameter bijih < 10 cm)
yang sudah dicampur dengan batu kapur. Air lindian yang mengalir di dasar
tumpukkan yang kedap kemudian di kumpulkan untuk kemudian dilakukan proses
berikutnya. Kemampuan ekstraksi emas berkisar 35 – 65 %.
b) VAT leaching : pelindian emas yang dilakukan dengan cara merendam bijih emas
(diameter bijih < 5 cm) yang sudah dicampur dengan batu kapur dengan larutan
sianida pada bak kedap. Air lindian yang dihasilkan kemudian dikumpulkan untuk
dilakukan proses berikutnya. Proses pelindian berlangsung antara 3 – 7 hari dan
setelah itu tangki dikosongkan untuk pengolahan bijih yang baru. Kemampuan
ekstraksi emas berkisar 40 – 70 %.
c) Agitated tank leached : pelindian emas yang dilakukan dengan cara merendam
bijih emas (diameter < 0.15 cm) yang sudah dicampur dengan batu kapur dengan
larutan sianida pada suatu tangki dan selalu diaduk atau diaerasi dengan gelembung
udara. Lamanya pengadukan biasanya selama 24 jam untuk menghasilkan pelindian
yang optimal. Air lindian yang dihasilkan kemudian dikumpulkan untuk kemudian
dilakukan proses berikutnya. Kemampuan ekstraksi emas dapat mencapai lebih dari
90 %.
Pemisahan logam emas dari larutannya, dilakukan dengan cara:
a) Pengendapan dengan menggunakan serbuk Zn (Zinc precipitation/ Process Merill
Crowe). Penggunaan serbuk seng (Zn) merupakan salah satu cara yang efektif untuk
larutan yang mengandung konsentrasi emas kecil. Serbuk seng yang ditambahkan ke
dalam larutan kaya, akan mengendapkan logam emas dan perak dalam bentuk ikatan
seng emas yang berwarna hitam. Proses selanjutnya dilakukan penambahan asam
sulfat pada endapan tersebut yang akan melarutkan Seng dan meninggalkan emas
sebagai residunya. Untuk meningkatkan perolehan emas dari proses merill crowe
dilakukan dengan cara melebur emas yang dicampur dengan borax dan siliceous
b) Penyerapan dengan menggunakan karbon aktif. Penyerapan dengan menggunakan
karbon aktif saat ini banyak digunakan dalam proses sianidasi pada skala industri
pertambangan besar maupun pertambangan rakyat di Indonesia. Karbon aktif yang
dipergunakan dapat berasal dari arang batok kelapa,maupun arang kayu yang lain
dengan ukuran pallet yang dipergunakan umumnya berdiameter antara 1- 2 mm.
Kemampuan penyerapan emas dari arang batok kelapa ini mencapai 10 – 15 g emas
untuk setiap nya, namun umumnya hanya berkisar 2 – 5 g emas untuk setiap
kg-nya. Karbon aktif dapat digunakan pada larutan kaya yang sudah jernih melalui
kolom maupun pada tangki pelindian, baik itu dengan cara menggantungkan karbon
yang terletak pada kantong permeable (carbon in leach-CIL) maupun dengan
mencampurkan karbon aktif langsung pada bubur campuran bijih (carbon in
pulp-CIP).
Proses selanjutnya dilakukan pemisahan emas dari karbon yang dapat dilakukan
dengan beberapa cara:
(1) Membakar karbon yang mengandung emas sehingga yang akan tertinggal berupa
abu dan logam emas. Cara ini paling sederhana namun sulit dikontrol apabila
dilakukan di tempat terbuka. Jika terdapat kandungan merkuri dalam karbon tersebut
akan menghasilkan asap merkuri yang beracun yang akan membayakan penambang
dan lingkungan.
(2) Merendam karbon (carbon stripping) tersebut pada larutan yang mengandung 2 g
sianida per liter larutan dan dipanaskan sampai mendekati temperatur didih air (80 –
90 ºC) pada tangki baja (stainless steel) selama paling tidak 2 hari. Larutan hasil
proses ini kemudian diolah dengan proses merill crowe di atas atau dengan cara
2.5. Elektrolisis
Elektrolisis adalah peristiwa penguraian elektrolit oleh arus listrik searah
dengan menggunakan dua macam elektroda. Pada sel elektrolisis energi listrik
menyebabkan terjadinya reaksi kimia. Dalam larutan elektrolit, zat terlarut
mengalami ionisasi. Kation (ion positif) akan bergerak ke katoda, dan anion (ion
negatif) akan bergerak ke anoda. Elektroda tersebut adalah katoda (elektroda yang
dihubungkan dengan kutub negatif) dan anoda (elektroda yang dihubungkan dengan
kutub positif). Pada anoda terjadi reaksi oksidasi, yaitu anion (ion negatif) ditarik
oleh anoda dan jumlah elektronnya berkurang sehingga bilangan oksidasinya
bertambah, sedangkan pada katoda terjadi reaksi reduksi.
Pada elektrolisis, potensial sel ditentukan untuk mengetahui elektroda mana
yang akan berperan sebagai elektroda positif dan negatif. Harga potensial
oksidasi-reduksi biasanya dinyatakan sebagai potensial oksidasi-reduksi standar, yaitu potensial
reduksi bila pereaksi dan hasil reaksi mempunyai aktivitas satu (a=1) dan reaksinya
reduksi. Jika potensial reduksi positif berarti mudah tereduksi, tetapi jika negatif
berarti sukar tereduksi (mudah teroksidasi).
Emas biasanya juga dimurnikan dari larutan sianida melalui elektrolisis.
Proses ini melibatkan penggunaan larutan alkali sianida sebagai elektrolit dalam
suatu sel dimana besi merupakan suatu katoda dengan harga potensial reduksi +0,77
volt dan aluminium sebagai anoda dengan potensial reduksi -1,66 volt. Reaksi sel
yang terjadi adalah sebagai berikut :
2(Au(CN)2)- + 2OH-→ 2Au + 4CN- + H2O + ½O2
2.5.1. Sel Elektrokimia dengan Elektroda Aluminium Reaksi Pada Katoda
Reaksi pada katoda adalah reduksi terhadap kation. Jadi yang diperhatikan hanya
kation saja.
1. Jika larutan mengandung ion-ion logam alkali, ion-ion logam alkali tanah, ion
larutan. Yang akan mengalami reduksi adalah pelarut (air) dan terbentuk gas
Hidrogen ( H2 ) pada katoda.
2 H2O + 2 e → 2 OH- + H2
2. Jika larutan mengandung asam, maka ion H+ dari asam akan direduksi menjadi
gas hidrogen pada katoda
2H+ + 2 e → H2
3. Jika larutan mengandung ion-ion lain, maka ion-ion logam ini akan direduksi
menjadi masing-masing logamnya dan logam yang terbentuk itu diendapkan
pada permukaan batang katoda.
Au2+ + 2 e → Au
Reaksi Pada Anoda
Elektroda pada anoda, elektrodanya dioksidasi menjadi ionnya.
Contoh : Au → Au2+ + 2 e
Al → Al3+ + 3 e
Dalam sistem elektrokimia dengan anoda terbuat dari aluminium, beberapa
kemungkinan reaksi elektroda dapat terjadi sebagai berikut :
Anoda : Au → Au2+ + 2 e
Katoda : 2 H2O + 2 e → H2 + 2 OH-
2 H+ + 2 e → H2
2.5.2 Hukum Faraday
Akibat aliran arus listrik searah ke dalam larutan elektrolit akan terjadi perubahan
kimia dalam larutan tersebut. Menurut Michael Faraday (1834) lewatnya arus 1 F
mengakibatkan oksidasi 1 massa ekivalen suatu zat pada suatu elektroda (anoda) dan
reduksi 1 massa ekivalen suatu zat pada elektroda yang lain (katoda).
Hukum Faraday I: Massa zat yang timbul pada elektroda karena elektrolisis
berbanding lurus dengan jumlah listrik yang mengalir melalui larutan, disimbolkan
dengan :
Hukum Faraday II : Massa dari macam-macam zat yang diendapkan pada
masing-masing elektroda oleh sejumlah arus listrik yang sama banyaknya akan
sebanding dengan berat ekivalen masing-masing zat tersebut.
Rumus:
m1 : m2 = e1 : e2
m = massa zat (gram)
e = beret ekivalen = Ar/Valensi = Mr/Valensi
2.6. Spektrometri Serapan Atom
Peristiwa serapan atom pertama kali diamati oleh Fraunhofer ketika mengamati
garis-garis hitam pada spectrum sinar matahari. Sedangkan yang memanfaatkan
prinsip serapan atom pada bidang analisis adalah seorang warga Negara Australia
bernama alan walsh di tahun 1955. Sebelumnya ahli kimia banyak tergantung pada
cara-cara spektrofometri atau metoda analisis spektrografik. Beberapa cara ini sulit
dilakukan dan memakan waktu. Oleh karena itu, cara spektrografik tersebut segera
digantikan dengan spektrometri serapan atom. Pada Gambar diperlihatkan bentuk
instrument spektrometer serapan atom.
Gambar 2.1. Spektrometri Serapan Atom
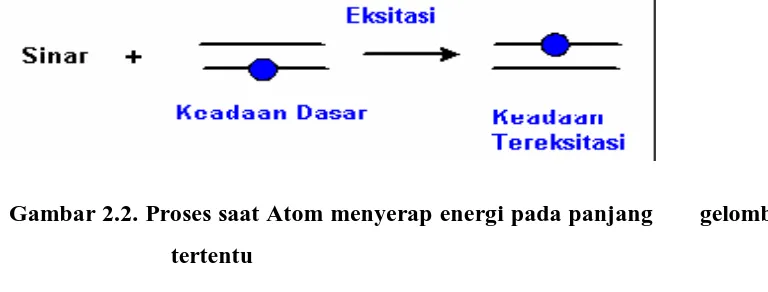
Jika cahaya dengan panjang gelombang tertentu yang sesuai mengenai atom yang
berada dalam keadaan dasar, maka atom dapat menyerap energi cahaya tersebut
untuk berpindah ke keadaan dasar tereksitasi seperti yang ditunjukkan pada gambar
2.2. Proses ini disebut sebagai serapan atom dan menjadi dasar untuk
Gambar 2.2. Proses saat Atom menyerap energi pada panjang gelombang tertentu
Panjang gelombang sinar yang diserap bergantung pada konfigurasi elektron dari
atom sedangkan intensitasnya bergantung pada jumlah atom dalam keadaan dasar.
Kedua fenomena ini menjadi dasar untuk analisis kualitatif dan analisis kuantitatif.
Keberadaan unsur logam lain dalam cuplikan tidak akan mengganggu proses analisis
sehingga tidak perlu dilakukan pemisahan terlebih dahulu.
2.6.1. Teori Spektrometri Serapan Atom
Metode spektrometri serapan atom berprinsip pada absorpsi cahaya oleh atom.
Atom-atom menyerap cahaya tersebut pada panjang gelombang tertentu, tergantung
pada sifat unsurnya. Cahaya pada panjang gelombang tertentu mempunyai energi
yang cukup untuk mengubah tingkat elektronik suatu atom tertentu. Transisi
elektronik suatu unsur bersifat spesifik. Dengan absorpsi energi, suatu atom pada
keadaan dasar dinaikkan tingkat energinya ke tingkat eksitasi. Panjang gelombang
yang dipilih harus menghasilkan garis spektrum yang tajam dan dengan intensitas
maksimum. Inilah yang dikenal dengan garis resonansi. Garis-garis lain yang bukan
garis resonansi dapat berupa spektrum yang berasosiasi dengan tingkat energi
molekul, biasanya berupa pita-pita lebar ataupun garis tidak berasal dari eksitasi
tingkat dasar yang disebabkan proses atomisasi. Keberhasilan analisis ini tergantung
2.6.2. Cara Kerja Spektrometri Serapan Atom
Setiap alat spektrometri serapan atom terdiri atas tiga komponen berikut:
a) Unit atomisasi;
b) Sumber radiasi; dan
c) Sistem pengukur fotometrik.
Atomisasi dapat dilakukan baik dengan nyala maupun dengan tungku.untuk
mengubah unsur metalik menjadi uap atau hasil disosiasi diperlukan energi yang
tinggi. Skema alat spektrometri serapan atom ditunjukkan pada gambar 2.3.
A B C D E F
Gambar 2.3. Sistematis ringkas dari alat SSA
A. Lampu katoda berongga
Lampu katoda berongga merupakan sumber sinar yang
memancarkan spektrum dari unsur logam yang akan dianalisa (setiap logam yang
memiliki lampu khusus untuk logam tersebut).
B. Chopper
Mengatur sinar yang dipancarkan.
C. Tungku
Tempat pembakaran (untuk memecahkan larutan sampel pada tetesan halus
dan meleburkannya ke dalam nyala untuk diatomkan).
D. Monokromator
Mendispersi sinar yang ditransmisikan oleh atom.
Mengukur sinar yang ditransmisikan dan memberikan signal sebagai respon
terhadap sinar yang diterima.
F. Rekorder
Untuk membaca nilai absorbansi. (Khopkar, S.M. 2002)
2.6.3. Pemakaian Analitis Spektrometri Serapan Atom
Teknik spektrometri serapan atom menjadi alat yang canggih dalam analisis. Ini
disebabkan di antaranya adalah kecepatan analisisnya, ketelitiannya sampai tingkat
renik, dan tidak memerlukan pemisahan. Kelebihan kedua adalah kemungkinannya
untuk menentukan konsentrasi semua unsur pada konsentrasi renik. Ketiga, sebelum
pengukuran tidak selalu perlu memisahkan unsur yang ditentukan karena penentuan
satu unsur dengan kehadiran unsur lain dapat dilakukan jika katode berongga yang
diperlukan tersedia. Spektrometri serapan atom dapat digunakan hingga 61 logam.
Zat non-logam yang dapat dianalisis adalah fosfor dan boron. Logam alkali dan
alkali tanah paling baik ditentukan dengan metoda emisi secara spektrofotometri
nyala.
2.6.4. Interferensi pada Spektrometri Serapan Atom
Interferensi dapat dikategorikan menjadi dua kelompok yaitu interferensi spektral
dan interferensi kimia. Interferensi spektral disebabkan karena tumpang tindih
absorpsi antara spesi pengganggu dan spesi yang diukur, karena rendahnya resolusi
monokromator. Interferensi kimia disebabkan adanya reaksi kimia selama atomisasi,
sehingga mengubah sifat-sifat absorpsi. Karena sempitnya garis emisi pada sumber
lampu pijar maka interferensi garis spektral atom jarang terjadi.
Adanya hasil-hasil pembakaran pada nyala dapat menyebabkan interferensi
spektral. Interferensi spektral ini dapat diamati dengan menggunakan blanko yang
mengandung zat hasil pembakaran tersebut. Gangguan yang disebabkan
penghamburan oleh produk atomisasi yang mengandung oksida refraktori Ti, Zr, W
Koreksi sinar latar belakang biasanya juga dilakukan dengan dua metoda pilihan
yaitu metoda koreksi sumber sinar kontinu dan metoda koreksi efek Zeeman.
Untuk menghindari interferensi, baik standar maupun sampel harus
ditambahkan larutan buffer dengan unsur yang mudah terionisasi. Senyawa yang
dapat digunakan sebagai buffer ionisasi adalah unsur-unsur dengan potensial ionisasi
rendah seperti Na, K dan Cs. (Chakrapani, 2001).
2.6.5. Keuntungan Spektrofotometer Serapan Atom
1. Karena absorpsi bergantung pada populasi keadaan dasar, maka
kepekaan mungkin lebih tinggi khususnya untuk unsur-unsur yang sukar
dieksitasikan (misalnya seng yang dapat ditentukan kurang dari 0,5 ppm,
sedang batas terendah pada emisi mungkin sama dengan 500 ppm).
2. Populasi keadaan dasar jauh kurang peka terhadap suhu nyala daripada
populasi yang tereksitasi.
3. Interferensi dari garis-garis spektrum dari unsur-unsur lain dan emisi latar
belakang nyala dapat diperkecil. (Day, R.A, 1994)
2.6.6. Gangguan-gangguan pada Spektrofotometer Serapan Atom
Yang dimaksud dengan gangguan-gangguan (interferensi) pada SSA
adalah peristiwa-peristiwa yang menyebabkan pembacaan absorbansi unsur yang
dianalisis menjadi lebih kecil atau lebih besar dari nilai yang sebenarnya.
Gangguan-gangguan yang dapat terjadi dalam SSA adalah sebagai berikut:
1. Gangguan yang berasal dari matriks sampel yang mana dapat mempengaruhi
banyaknya sampel yang mencapai nyala.
Sifat-sifat tertentu matriks sampel dapat mengganggu analisis yakni matriks
terhadap laju aliran bahan bakar/gas pengoksidasi. Sifat-sifat tersebut adalah :
Gangguan matriks yang lain adalah pengendapan unsur yang dianalisis
sehingga jumlah atom yang mencapai nyala menjadi lebih sedikit dari konsentrasi
yang seharusnya yang terdapat dalam sampel.
2. Gangguan kimia yang dapat mempengaruhi jumlah / banyaknya atom yang
terjadi di dalam nyala.
Terbentuknya atom - atom netral yang masih dalam keadaan azas di
dalam nyala sering terganggu oleh dua peristiwa kimia yaitu: (a) disosiasi
senyawa-senyawa yang tidak sempurna yang terjadi jika terbentuk senyawa-senyawa-senyawa-senyawa yang
sukar diuraikan di dalam nyala api; (b) ionisasi atom-atom di dalam nyala yang
terjadi jika suhu yang digunakan untuk atomisasi terlalu tinggi.
3. Gangguan oleh absorbansi yang disebabkan bukan oleh absorbansi atom yang
dianalisis yaitu absorbansi oleh molekul-molekul yang tidak terdisosiasi di
dalam nyala.
4. Gangguan oleh penyerapan non-atomik.
Gangguan ini terjadi karena terjadinya penyerapan cahaya dari sumber sinar
yang bukan berasal dari atom-atom yang akan dianalisis, juga disebabkan adanya
penyerapan cahaya oleh partikel-partikel padat yang berada di dalam nyala.
(Gandjar,G.I. 2007).
2.6.7. Penentuan Konsentrasi Emas dengan Spektrometri Serapan Atom
Penentuan konsentrasi emas dengan spektometri serapan atom dilakukan dengan cara
membuat beberapa seri larutan standar emas yang diketahui konsentrasinya. Lalu
mengukur serapannya pada panjang gelombang 242,8 nm dengan menggunakan
lampu pijar (Hollow Cathode Lamp) emas. Kurva kalibrasi dibuat dengan
mengalurkan absorbansi terhadap konsentrasi dan menentukan persamaan garisnya.
Absorbansi dari larutan sampel yang diukur kemudian dihitung konsentrasi emas
BAB III
BAHAN DAN METODE
3.1. Alat-alat
Adapun alat-alat yang digunakan adalah sebagai berikut :
- Neraca analitik Chyo
- Buret Pyrex
- Pemanas Listrik Fisher
- Termometer
- Pipet volumetric Pyrex
- PH meter Hanna Instrument
- Corong Pyrex
- Erlenmeyer Pyrex
- Oven Fisher
- Adaptor Sinyoku
- Pompa vakum
- Botol Aquadest -
- Gelas Ukur Pyrex
- Spektrometer Serapan Atom GBC Avanta
Bahan-bahan yang digunakan dalam penelitian ini adalah
- Kertas saring Whatman
- NaOH p.a (E.Merck)
- HCl (p) p.a (E Merck)
- HNO3(p) p.a (E Merck)
- NaCN p.a (E Merck)
- Akuades -
- Pb(NO3)2 p.a (E.Merck)
- Sampel Batuan -
- H2SO4(p) p.a (E.Merck)
3.3. Prosedur Penelitian 3.3.1. Pengambilan Sampel
Sampel batuan berupa barang tambang yang mengandung bijih emas diperoleh dari
Desa Beuteung Daerah Simpang Empat Kabupaten Nagan Raya-Aceh yang
dihaluskan dengan ukuran 200 mesh sehingga diperoleh ample berupa bubuk.
3.3.2. Penyediaan Pereaksi
Larutan-larutan yang disediakan sebagai berikut:
Larutan NaCN 0,3%(b/v)
Ditimbang 3 gram NaCN dan dilarutkan dengan akuades di dalam labu takar 1000
Larutan Pb(NO3)2 0,05%(b/v)
Ditimbang 0,05 gram Pb(NO3)2 secara seksama dan dilarutkan dengan aquades lalu
dimasukkan ke dalam labu takar 100 ml dan dipaskan sampai garis tanda.
3.3.3. Preparasi Sampel
Sampel emas yang diperoleh ditimbang secara teliti dengan mengunakan neraca
analitis. Sampel didestruksi dengan menggunakan aqua regia (campuran HCl pekat
dan HNO3 pekat berturut-turut 3:1) sebanyak 50 mL. Campuran dipanaskan sampai
mendidih selama 30 menit. Campuran kemudian disaring dan dimasukkan ke dalam
labu takar 100 mL dan ditandabataskan dengan aquades. Larutan ini siap untuk
diukur kadar emasnya dengan AAS.
3.3.4. Pengukuran Kadar Emas dengan AAS
Penentuan kadar emas dimulai dengan pembuatan kurva kalibrasi. Larutan standar
emas dibuat beberapa seri konsentrasi 0.5 ppm; 1 ppm; 2 ppm; 3 ppm; 4 ppm; 5 ppm
kemudian diukur serapannya pada λ = 242,8 nm dengan menggunakan Spektrometer Serapan Atom (AAS). Kurva kalibrasi dibuat dengan cara mengalurkan nilai
absorbansi terhadap konsentrasi standar.
3.3.5. Pemisahan bijih emas dari batuan secara ekstraksi menggunakan natrium Sianida 0,3 % (b/v)
- Sampel sebanyak 1 kg dimasukkan ke dalam Bejana volume 5 L lalu dilarutkan
dengan 1000 mL natrium sianida.
- Diaduk selama 5 menit
- Ditambahkan NaOH sampai pH mencapai 10-10,5.
- Ditambahkan 10 mL Pb(NO3)2 0,05 % .
- Diaerasi dengan aerator selama 24 jam.
- Ekstrak Emas di dalam larutan sianida yang diperoleh selanjutnya dielektrolisis.
3.3.6. Perolehan Emas dan Perak Dengan Elektrolisis
- Ekstrak emas di dalam larutan sianida yang diperoleh dimasukkan kedalam gelas
Beaker 2000 mL.
- Dirangkai alat elektrolisis dengan katoda besi dan anoda aluminium
- Ekstrak emas dielektrolisis dengan menggunakan arus listrik I = 6 A dan
tegangan V = 2 volt, Selama 6 jam.
- Di katoda , logam emas akan terdeposit.
- Katoda yang telah terlapisi emas dipindahakan ke dalam gelas Beaker 500 mL.
- Selanjutnya ditambah HCl pekat dan dipanaskan sehingga katoda larut.
- Didinginkan
- Disaring pada kertas saring whatman No. 41.
- Kertas saring dicuci dengan akuadest
- Kertas saring dikeringkan di dalam oven pada suhu 105oC,
- Ditimbang
3.3.7. Pemurnian Logam Emas dari Perak
- Kertas saring hasil penimbangan pada 3.3.4 dicuci dengan HNO3 10 % sebanyak
5 kali.
- Kertas saring dicuci dengan akuades
- Kertas saring dikeringkan pada suhu 105oC selama 2 jam.
- Selisih penimbangan 3.3.5 dengan penimbangan 3.3.4 merupakan massa emas
yang diperoleh dari ekstraksi dengan NaCN.
3.3.8. Pengukuran sampel dengan AAS
- Emas yang diperoleh sebanyak 0,0715 gram dimasukkan ke dalam gelas beaker 1 L lalu ditambahkan 50 ml Aquaregia.
- diaduk selama 5 menit
- didestruksi dengan pemanasan 200oC selama + 20 menit
- Larutan emas tersebut dimasukkan kedalam labu takar 100 ml lalu dipaskan sampai tanda batas dengan aquades.
3.4.Bagan Penelitian
3.4.2. Perolehan Emas Dan Perak Dengan Elektrolisis
3.4.4. Pengukuran Sampel dengan AAS
BAB IV
HASIL DAN PEMBAHASAN
4.1. Hasil
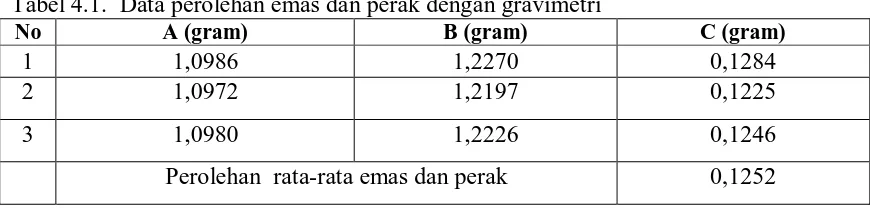
4.1.1. Hasil Perolehan Emas dan Perak dari Ekstraksi Tabel 4.1. Data perolehan emas dan perak dengan gravimetri
No A (gram) B (gram) C (gram)
1 1,0986 1,2270 0,1284
2 1,0972 1,2197 0,1225
3 1,0980 1,2226 0,1246
Perolehan rata-rata emas dan perak 0,1252
Keterangan :
A : Berat awal kertas saring setelah pengeringan pada suhu 105oC (gram)
B : Berat akhir kertas saring setelah penyaringan dan setelah pengeringan pada suhu 105oC (gram)
C : Berat perolehan emas dan perak (gram)
Perhitungan
Berat Perolehan Emas dan Perak = Berat akhir kertas saring – Berat awal kertas
4.1.2. Hasil Perolehan Emas Setelah Pemisahan Perak
Tabel 4.2. Data perolehan emas dengan gravimetri
No A (gram) B (gram) C (gram)
1 1,2270 1,1538 0,0732
2 1,2197 1,1488 0,0709
3 1,2226 1,1522 0,0704
Perolehan rata-rata emas 0,0715
Keterangan :
A : Berat awal kertas saring setelah pengeringan pada suhu 105oC (gram)
B : Berat akhir kertas saring setelah penyaringan dan setelah pengeringan pada suhu 105oC (gram)
Perhitungan
Berat Perolehan Emas = Berat awal kertas saring – Berat akhir kertas saring
4.1.3. Pengukuran Kadar Emas (Au) dari Sampel
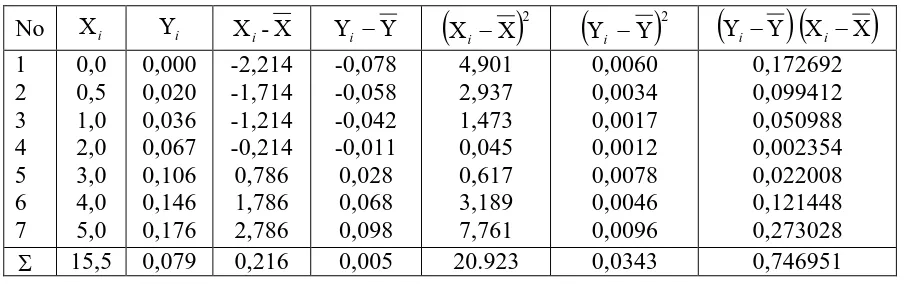
Tabel 4.3. Hasil Pengukuran Absorbansi Larutan Standar Au untuk
4.1.3.1. Penurunan Persamaan Garis Regresi.
Hasil pengukuran absorbansi seri larutan standar emas pada tabel 4.3
diplotkan terhadap konsentrasi larutan standar sehingga diperoleh suatu kurva
kalibrasi berupa garis linear yang diturunkan dengan metode Least Square dengan
perhitungan seperti tabel di bawah ini :
Tabel 4.4. Penurunan Persamaan Garis Regresi dengan Metode Least Square
2,214
Persamaan garis regresi untuk kurva kalibrasi dapat diturunkan dari persamaan
garis:
y = ax + b
Di mana, a = slope
b = intersep
Selanjutnya harga slope dapat ditentukan dengan menggunakan metode Least Square
sebagai berikut :
Sedangkan harga intersep (b) dapat diperoleh melalui persamaan :
4.1.3.2. Perhitungan Koefisien Korelasi
Koefisien korelasi (r) dapat ditentukan sebagai berikut :
4.1.3.3. Penentuan Kadar Emas
Kadar Au dapat ditentukan dengan menggunakan metode kurva kalibrasi
dengan mensubtitusi nilai Y (absorbansi) yang diperoleh dari hasil pengukuran
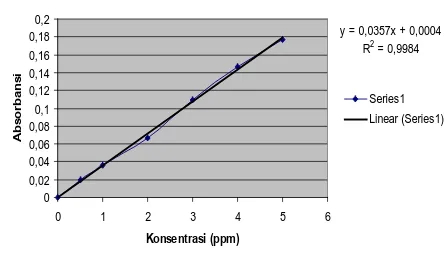
terhadap garis regresi dan kurva kalibrasinya Y = 0,0357X + 0,0004 sehingga
diperoleh konsentrasi Au.
Tabel 4.5. Kadar Emas Sampel
Sampel Absorbansi (A) Konsentrasi sampel (mg/l)
4.2. Pembahasan
Pemisahan bijih emas dari sisa batuan tambang dari masyarakat Desa Nagan Raya
dilakukan dengan melarutkan sampel dengan natrium sianida 0,3 % dan pengaturan
pH 10-10,5 dengan menambahkan natrium oksida. Hal ini dilakukan agar tidak
dihasilkan asam sianida (HCN) maupun hidrogen peroksida (H2O2) yang dapat
mengurangi perolehan Emas (Au). Prosesnya merupakan proses redoks dimana bijih
emas yang terdapat dalam sampel akan membentuk senyawa kompleks dengan ion
sianida menghasilkan Au(CN)2- ,dengan reaksi :
2Au + 4CN- + ½O2 + 2H2O → 2(Au(CN)2- + 2OH
-Larutan sampel tersebut juga mengandung mineral-mineral pengotor yang dapat
memperlambat kecepatan pelarutan sehingga perlu dilakukan penambahan Pb nitrat.
Mineral pengotor tersebut akan terdekomposisi dengan penambahan natrium oksida
sebelumnya dan akhirnya membentuk endapan.
Agar dicapai persen ekstraksi yang tinggi, proses sianidasi juga dipengaruhi
oleh konsentrasi oksigen di dalam larutan yang bertujuan untuk mempercepat reaksi.
Larutan sampel diaerasi selama + 24 jam untuk mengalirkan oksigen ke dalam
larutan tersebut sehingga diharapkan dengan penyaringan selanjutnya akan didapat
ekstrak emas murni yang bebas dari mineral-mineral pengotor. Ekstrak emas yang
diperoleh, selanjutnya dielektrolisis dengan menggunakan katoda besi dan anoda
aluminium.
Besi digunakan sebagai katoda karena memiliki potensial reduksi yang
bernilai positif (0,77 volt) sedangkan aluminium memiliki potensial reduksi yang
bernilai negatif (-1,66 volt). Sehingga katoda akan dihubungkan pada kutub negatif
dan anoda pada kutub positif . Penggunaan katoda besi juga dilakukan agar lebih
mudah memisahkan emas yang telah terdeposit pada katoda dengan penambahan
asam klorida pekat dan dipanaskan sampai katoda larut. Emas tersebut disaring dan
dicuci dengan asam nitrat 10 % untuk mendapatkan emas murni.
Tahap analisa kuantitatif dilanjutkan dengan penimbangan emas yang
spektrometer serapan atom pada panjang gelombang 242,8 nm dimana pada panjang
gelombang tersebut cahaya memiliki nilai absorbansi maksimum. Kurva kalibrasi
larutan standar emas dibuat dengan memvariasikan konsentrasi larutan standar emas,
dan dihitung dengan metode least square sehingga diperoleh persamaan garis linier Y
= 0,0357X + 0,0004. Persamaan garis linier ini digunakan untuk menghitung kadar
emas dalam konsentrat tersebut. Dari data yang diperoleh bahwa kandungan emas
dalam sampel adalah sebanyak 71,5 mg/L atau 0,715 gram dari 10 kg sample
batuan.
Dari informasi yang diperoleh dari masyarakat Desa Nagan Raya yang
melakukan pemisahan emas dengan menggunakan merkuri (amalgamasi) bahwa
konsentrasi emas yang diperoleh dengan cara ini adalah 0,5 gram emas dari 10 kg
batuan yang sama dengan contoh batuan yang dipakai dalam penelitian ini.
Penggunaaan merkuri pada pemisahan secara amalgamasi ini adalah 200 gram per 10
kg batuan dan perolehan Merkuri kembali sebesar ± 175 gram dan selebihnya terikut
bersama dengan sisa material batuan dan terbuang ke lingkungan tanpa proses lebih
lanjut yang dikhawatirkan akan mencemari lingkungan.
Dari hasil penelitian menunjukkan bahwa perolehan emas dengan metode
sianidasi dan pemurnian secara elektrolisis yang dilanjutkan dengan analisis
kuantitatif dengan spektrometer serapan atom dihasilkan 2,15 % lebih tinggi
daripada perolehan emas dengan metode amalgamasi. Disamping perolehan yang
lebih tinggi juga biaya operasional yang lebih murah serta tidak menimbulkan
BAB V
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari hasil penelitian ini yaitu ekstraksi bijih emas dengan metode sianidasi dan
pemurnian secara elektrolisis yang dilanjutkan dengan analisis secara spektrometer
serapan atom dari 1 kg sampel batuan diperoleh kandungan emas sebesar 0,0715
gram atau 7,15 mg/L.
5.2. Saran
Pada penelitian selanjutnya disarankan untuk melakukan ekstraksi emas secara
DAFTAR PUSTAKA
Addison, R. 1980. Gold and Silver Extraction From Sulfide Ores. Mining Congress.
Bertrand, C. 1895. Process of Extracting Gold from Ores. New York.
Chirstie, S. Geankopolis. Transport Processes and Unit Operation. Second Edition.
Massachusetts:Allyn and Bacon.Inc.
Chakrapani, G., Mahanta, P., Murty, D.S.R., Gomaty, B. 2001. Preconcentration of
Traces of Gold, Silver and Palladium on Activated Carbon and Its
Determination on Geological Samples by Flame AAS after Wet Ashing.
Atalanta.
Day, R.A. Underwood, A.L. Analisa Kimia Kuantitatif. Jakarta: Erlangga.
Esna, Ashari. 1988. Method and Installation for Extracting Gold From Gold Ores.
Germany: Klockner Humboldt AG.
Gandjar, G.I., Rohman, A. 2008. Kimia Farmasi Analisis. Yogyakarta:Pustaka
Pelajar.
Hoang,T.A., Mullings,L.R., Phillips,D.N., Silis,I.D. 1998. Journal of Atomic
Spectrosc
Jakson, E. 1986. Hydrometallurgical Extraxtion and Reclamation. England: Ellis
Horwood Limitwd.
Keenan, Kleinfelter. 1986. Ilmu Kimia Untuk Universitas. Jakarta:Erlangga.
Khopkar, S.M. 2002. Konsep Dasar Kimia Analitik. Jakarta: UI Press.
Nelson, C.E. 1990. Comparative Geochemistry of Jasperoids from Carlin Type Gold
Deposits of The Western United States. Journal of Geochemical Exploration.
Peraturan Menteri Lingkungan Hidup Nomor 23 Tahun 2008.
Sanusi, B. 1984. Mengenal Hasil Tambang Indonesia. Jakarta: Penerbit Bina Aksara.
Setiabudi, Bambang Tjahjono. 2005. Penyebaran Merkuri Akibat Usaha
Pertambangan Di Daerah Sangon, Kabupaten Kulo Progo, D.I. Yogyakarta.
Center For Geological Resources.
Suaib B.S.1994. Pengaruh Rapat Arus Listrik, Jumlah Dan Jenis Elektroda
Terhadap Efektivitas Penurunan Warna Pada Air Gambut Dengan
Sudarsono, Arief S. 2003. Pengantar Pengolahan dan Ekstraksi Bijih Emas.
Bandung: Departemen Teknik Pertambangan ITB.
Rosenqvist, T. 1974. Principle of Extraxtive Metallurgy. New York: McGraw- Hill,
y = 0,0357x + 0,0004 R2 = 0,9984
0 0,02 0,04 0,06 0,08 0,1 0,12 0,14 0,16 0,18 0,2
0 1 2 3 4 5 6
Konsentrasi (ppm)
A
b
s
o
rb
a
n
s
i
Series1
Linear (Series1)