ABSTRACT
MODIFICATION OF BIOMASS Nitzschia sp. WITH SILICA-MAGNETITE AS ADSORBENT ION Cd(II), Cu(II), AND Pb(II)
IN SOLUTION
By
Dia Tamara
In this study, Nitzschia sp. algae biomass was modified with silica-magnetite using sol-gel method, and subsequently tested as adsorbent for Cd(II), Cu(II) and Pb(II) ions dissolved in water. Two adsorbents were prepared and specified as hybrid silica algae (HAS) and the hybrid algae silica-magnetite (HAS-M). The adsorbents were characterized using several techniques, include Infrared (IR) Spectroscopy for functionality analysis, X-ray diffraction (XRD) for structural analysis, Scanning Electron Microscope (SEM) for surface morphology analysis, and Energy Dispersive X-ray (EDX) Spectroscopy for elemental composition analysis. To investigate the adsorption capacity of the adsorbents, a series of adsorption experiments was conducted and the concentrations of the metal ions was determied using atomic absorption spectrophotometer (AAS). The results obtained revealed that the adsorbents were able to adsorb the metal ions up to 90%. In addition, it was found that the optimum conditions for the best results are pH 5 for Cu(II) and Pb(II), and pH 7 for Cd(II). The adsorption isotherm indicate that adsorption follows the Langmuir isotherm, with the R2 = 0.86 - 0.99. The adsorption energies are in the range of 25,86 - 33,90, suggesting that the adsorption took place through chemical interaction between the metal ions and the adsorbents.
ABSTRAK
MODIFIKASI BIOMASSA Nitzschia sp. DENGAN SILIKA-MAGNETIT SEBAGAI ADSORBEN ION Cd(II), Cu(II), DAN Pb(II)
DALAM LARUTAN
Oleh
Dia Tamara
Pada penelitian ini, biomassa alga Nitzschia sp. telah dimodifikasi dengan silika-magnetit menggunakan metode sol-gel, dan kemudian diuji sebagai adsorben ion Cd(II), Cu(II), dan Pb(II) dalam larutan. Kedua adsorben disiapkan dan dispesifikasikan sebagai hibrida alga silika (HAS) dan hibrida alga silika-magnetit (HAS-M). Adsorben dikarakterisasi menggunakan beberapa teknik, antara lain Infrared (IR) Spectroscopy untuk analisis gugus fungsi, X-ray diffraction (XRD) untuk analisis struktur, Scanning Electron Microscope (SEM) untuk analisis morfologi permukaan dan Energy Dispersive X-ray (EDX) Spectroscopy untuk analisis komposisi unsur. Untuk mengetahui kapasitas adsorpsi dari adsorben, serangkaian percobaan adsorpsi telah dilakukan dan konsentrasi ion logam ditentukan dengan menggunakan spektrofotometer serapan atom (SSA). Hasil yang diperoleh menunjukkan bahwa adsorben mampu menyerap ion logam hingga 90%. Selain itu, diperoleh kondisi optimum untuk hasil terbaik adalah pH 5 untuk Cu(II) dan Pb(II), dan pH 7 untuk Cd(II). Isoterm adsorpsi menunjukkan bahwa adsorpsi mengikuti isoterm Langmuir, dengan R2 = 0,86 -0,99. Energi adsorpsi berada dikisaran 25,86 - 33,90, menunjukkan bahwa adsorpsi berlangsung melalui interaksi kimia antara ion logam dan adsorben.
MODIFIKASI BIOMASSA Nitzschia sp. DENGAN SILIKA-MAGNETIT SEBAGAI ADSORBEN ION Cd(II), Cu(II), DAN Pb(II)
DALAM LARUTAN
Oleh
DIA TAMARA
Skripsi
Sebagai Salah Satu Syarat Untuk Mencapai Gelar
SARJANA SAINS
Pada
Jurusan Kimia
Fakultas Matematika dan Ilmu Pengetahuan Alam
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
MODIFIKASI BIOMASSA Nitzschia sp. DENGAN SILIKA-MAGNETIT SEBAGAI ADSORBEN ION Cd(II), Cu(II), DAN Pb(II)
DALAM LARUTAN
(Skripsi)
Oleh
DIA TAMARA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS LAMPUNG
DAFTAR GAMBAR 9. Adsorpsi ion logam Cd(II) pada HAS dan HAS-M dengan pH yang bervariasi dari pH 3-9 pada konsentrasi ion logam 100 ppm dan waktu kontak 60 menit ... 36
10. Adsorpsi ion logam Cu(II) pada HAS dan HAS-M dengan pH yang bervariasi dari pH 3-9 pada konsentrasi ion logam 100 ppm dan waktu kontak 60 menit ... 37
11. Adsorpsi ion logam Pb(II) pada HAS dan HAS-M dengan pH yang bervariasi dari pH 3-9 pada konsentrasi ion logam 100 ppm dan waktu kontak 60 menit ... 37
12. Adsorpsi ion Cd(II), Cu(II), dan Pb(II) dengan konsentrasi ion logam yang bervariasi pada HAS dengan waktu kontak 60 menit ... 39
vi
14. Kurva isoterm Langmuir (a) ion Cd(II) oleh HAS, (b) ion Cd(II) oleh HAS-M, (c) ion Cu(II) oleh HAS, (d) ion Cu(II) oleh HAS-M, (e) ion
Pb(II) oleh HAS, dan (f) ion Pb(II) oleh HAS-M ... 42
15. Kurva isoterm Freundlich (a) ion Cd(II) oleh HAS, (b) ion Cd(II) oleh HAS-M, (c) ion Cu(II) oleh HAS, (d) ion Cu(II) oleh HAS-M, (e) ion Pb(II) oleh HAS, dan (f) ion Pb(II) oleh HAS-M ... 43
16. Kurva isoterm adsorpsi Langmuir HAS terhadap ion Cd(II) ... 55
17. Kurva isoterm adsorpsi Langmuir HAS-M terhadap ion Cd(II) ... 56
18. Kurva isoterm adsorpsi Langmuir HAS terhadap ion Cu(II) ... 58
19. Kurva isoterm adsorpsi Langmuir HAS-M terhadap ion Cu(II) ... 59
20. Kurva isoterm adsorpsi Langmuir HAS terhadap ion Pb(II) ... 60
21. Kurva isoterm adsorpsi Langmuir HAS-M terhadap ion Pb(II) ... 62
22. Kurva isoterm adsorpsi Freundlich HAS terhadap ion Cd(II) ... 63
23. Kurva isoterm adsorpsi Freundlich HAS-M terhadap ion Cd(II) ... 64
24. Kurva isoterm adsorpsi Freundlich HAS terhadap ion Cu(II) ... 66
25. Kurva isoterm adsorpsi Freundlich HAS-M terhadap ion Cu(II) ... 67
26. Kurva isoterm adsorpsi Freundlich HAS terhadap ion Pb(II) ... 68
ii
1. Sintesis ... 24
2. Karakterisasi ... 25
3. Uji adsorpsi ... 26
IV. HASIL DAN PEMBAHASAN ... 27
A. Sintesis ... 27
B. Karakterisasi ... 28
1. Karakterisasi Spektrofotometer Infra Merah IR ... 28
2. Karakterisasi dengan XRD ... 31
3. Karakterisasi dengan SEM ... 34
C.Uji Adsorpsi ... 36
1. Penentuan pH optimum ... 36
2. Variasi konsentrasi ... 39
V. SIMPULAN DAN SARAN ... 45
A. Simpulan ... 45
B. Saran ... 46
DAFTAR PUSTAKA ... 47
iii
DAFTAR TABEL
Tabel Halaman
1. Hasil analisis gugus fungsi pada adsorben ... 31
2. Hasil analisis struktur kristal ... 33
3. Parameter isoterm adsorpsi ion Cd(II), Cu(II), dan Pb(II) pada HAS 41
4. Adsorpsi ion Cd(II), Cu(II), dan Pb(II) oleh HAS dengan variasi pH ... 53
5. Adsorpsi ion Cd(II), Cu(II), dan Pb(II) oleh HAS-M dengan variasi pH ... 53
6. Adsorpsi ion Cd(II) pada HAS dan HAS-M dengan variasi
konsentrasi ion logam ... 53
7. Adsorpsi ion Cu(II) pada HAS dan HAS-M dengan variasi
konsentrasi ion logam ... 54
8. Adsorpsi ion Pb(II) pada HAS dan HAS-M dengan variasi
konsentrasi ion logam ... 54
9. Data perhitungan persamaan Langmuir ion Cd(II) terhadap HAS .. 54
10.Data perhitungan persamaan Langmuir ion Cd(II) terhadap HAS-M 56
11.Data perhitungan persamaan Langmuir ion Cu(II) terhadap HAS .. 57
12.Data perhitungan persamaan Langmuir ion Cu(II) terhadap HAS-M 59
13.Data perhitungan persamaan Langmuir ion Pb(II) terhadap HAS .. 60
14.Data perhitungan persamaan Langmuir ion Pb(II) terhadap HAS-M 61
iv
16.Data perhitungan persamaan Freundlich ion Cd(II) terhadap
HAS-M ... 64
17.Data perhitungan persamaan Freundlich ion Cu(II) terhadap HAS 65
18.Data perhitungan persamaan Freundlich ion Cu(II) terhadap
HAS-M ... 66
19.Data perhitungan persamaan Freundlich ion Pb(II) terhadap HAS . 67
20.Data perhitungan persamaan Freundlich ion Pb(II) terhadap
“
Kejujuran membuat hidup menjadi lebih tenang
”
(Dia Tamara)
“
Hidup memang membutuhkan orang lain, tapi
tidak bergantung pada orang lain
”
(Ali Yusuf)
“Perubahan memang tidak menjamin tercapainya
perbaikan, tapi tidak ada perbaikan yang bisa
dicapai tanpa perubahan”
(Mario Teguh)
“
Jika ingin hidup berkah bahagiakan orangtuamu,
dan orang yang berada disampingmu disaat kau
susah”
Dengan penuh rasa syukur kepada Allah SWT, atas segala kekuatan,
kesabaran, kemudahan dan kelancaran dalam menyelesaikan karya
ini, wahai Engkau Maha Memudahkan, Tuhan Semesta Alam ...
Ku persembahkan karya ini sebagai tanda cinta, kasih sayang, wujud
bakti dan tanggung jawabku kepada kalian :
Kedua orang tuaku tersayang...
Papa Ali Yusuf dan Mama Sri Ratu Nonliza
Yang menjadi sumber kekuatanku dikala suka maupun duka, yang tak hentinya
memanjatkan doa untuk putri tercintanya, yang selalu sabar mendidik dan memberikan
kasih sayang tak terhingga. Terimakasihku tak akan mampu membalas, semoga Allah
menggantikannya dengan yang lebih pantas. Aamiin ...
Adik-adikku...
Prabu Aji dan M. Alifiya
Pembimbing Penelitianku
Ibu Prof. Dr. Buhani, M.Si.
Saudara, sahabat dan kerabat
RIWAYAT HIDUP
Penulis bernama lengkap Dia Tamara, lahir di Bandar Lampung,
pada tanggal 18 juni 1993 merupakan anak pertama dari tiga
bersaudara. Penulis lahir dari pasangan Bapak Ali Yusuf dan
Ibu Sri Ratu Nonliza. Penulis telah menyelesaikan pendidikan
mulai dari Taman Kanak-Kanak Yayasan Pendidikan Warga Krakatau Steel
(YPWKS) Pulomerak - Cilegon pada tahun 1999, pendidikan sekolah dasar di SD
Negeri 2 Tiuh Balak Pasar - Baradatu pada tahun 2005, pendidikan menengah
pertama di SMP Negeri 1 Baradatu pada tahun 2008, dan pendidikan menengah
atas di SMA Negeri 1 Baradatu pada tahun 2011, dan mulai tahun 2011 sampai
penulisan skripsi ini, penulis melanjutkan ke pendidikan tinggi di Jurusan S1
Kimia FMIPA Universitas Lampung.
Selama Belajar dibangku kuliah, penulis pernah menjadi asisten praktikum Sains
Dasar untuk Jurusan Ilmu Komputer Fakultas MIPA dan Kimia Anorganik II
untuk Jurusan Kimia Fakultas MIPA pada tahun 2014, juga menjadi asisten Kimia
Anorganik I untuk Jurusan Kimia Fakultas MIPA, Kimia Dalam Kehidupan untuk
Jurusan Kimia Fakultas MIPA dan Kimia Dasar untuk Jurusan Agroteknologi dan
Teknologi Hasil Pertanian Fakultas Pertanian pada tahun 2015. Penulis juga
terdaftar sebagai Kader Muda Himaki (KAMI) periode 2011-2012. Aktif sebagai
Departemen Hubungan Luar Pengabdian Masyarakat (HLPM) BEM FMIPA
periode 2012-2013. Mengemban amanah menjadi Bendahara Umum Himaki
periode 2013-2014.
Pada tahun 2014 penulis melaksanakan Kuliah Kerja Nyata (KKN) Tematik di
Dusun Wonorejo 1 Desa Pesawaran Indah Kecamatan Padang Cermin Kabupaten
SANWACANA
Puji syukur penulis ucapkan kehadirat Allah SWT, atas limpahan rahmat, karunia
dan kasih sayang-Nya yang tak terhingga, sehingga penulis dapat menyelesaikan
skripsi yang berjudul :
MODIFIKASI BIOMASSA Nitzschia sp. DENGAN SILIKA-MAGNETIT
SEBAGAI ADSORBEN ION Cd(II), Cu(II), DAN Pb(II)
DALAM LARUTAN
Shalawat serta salam semoga selalu tercurah kepada Nabi Muhammad SAW
beserta keluarga, sahabat, dan para pengikutnya, semoga kita mendapatkan
Syafaatnya di yaumil qiyamah nanti. Aamiin ya robbal a’lamin.
Penulis menyadari bahwa terselesaikannya penulisan skripsi ini tidak terlepas dari
bantuan berbagai pihak. Oleh karena itu, dalam kesempatan ini penulis
mengucapkan terimakasih kepada :
1. Bapak Prof. Suharso, Ph.D., selaku dekan FMIPA Universitas Lampung,
sekaligus pembimbing kedua penelitian atas bimbingan, nasihat, dan saran
sehingga penulis dapat menyelesaikan penulisan skripsi ini.
2. Bapak Dr. Eng. Suripto Dwi Yuwono, M.T., selaku Ketua Jurusan Kimia
FMIPA Universitas Lampung yang telah memberikan bantuan kepada
3. Ibu Prof. Dr. Buhani, M.Si., selaku pembimbing pertama penelitian atas
segala bimbingan, bantuan, saran, nasihat, dan motivasi sehingga penulis
dapat menyelesaikan penulisan skripsi ini.
4. Bapak Prof. Wasinton Simanjuntak, Ph.D., selaku pembahas atas bantuan,
saran, dan kritik yang sangat membangun dalam penulisan skripsi ini.
5. Bapak Dr. Hardoko Insan Qudus, M.S. selaku pembimbing akademik yang
telah memberi bimbingan, saran, dan nasihat kepada penulis.
6. Bapak dan Ibu Dosen Jurusan Kimia FMIPA Universitas Lampung yang
telah memberikan ilmu pengetahuan kepada penulis.
7. Mba Liza Apriliya S, S.Si selaku Laboran Laboratorium Kimia Anorganik
Fisik yang telah banyak membantu penulis di laboratorium.
8. Segenap karyawan Jurusan Kimia FMIPA Universitas Lampung atas
bantuannya.
9. Mba Widyastuti, M.Si. atas bantuan, bimbingan, dan sarannya kepada
penulis.
10.Ibu Valetina di Balai Besar Perikanan Budidaya Laut Lampung (BBPBL)
yang telah membantu membudidayakan alga sebagai bahan penelitian
penulis.
11.Mama, Papa dan kedua adikku tercinta yang telah memberikan kasih
sayang, doa, nasihat, motivasi, serta dukungan kepada penulis.
12.Teruntuk keluarga besar kakek Mad. Nur (Alm) - nenek Masyuti dan
keluarga besar kakek Hi. A. Syarifuddin (Alm) – nenek Zubaidah (Alm)
13.Buhani’s Research Group (Grup alga) 2011; Rina Wijayanti, Rio
Wicaksono, dan Yunia Hartina. Terimakasih untuk kerjasama, bantuan,
kritik dan sarannya.
14.Sahabat yang selalu menyemangatiku, memberi saran, serta berbagi suka
dan duka; Ajeng, Ayu F., Daniar, Fany, Fatma dan Mila.
15.Teman-teman peer group Kimia Anorganik; Melli N., Dewi, Asti, Nopi,
Mely A., Niko, Irkham.
16.Teman-teman angkatan 2011 (Cheven); Endah, Ayu B., Yulia, Eva, Tata,
Vevi, Lusi, Umi, Nira, Ana, April, Uswa, Windi, Cindy, Lewi, Mega, Lili,
Mirfat, Yusry, Rio F., Junet, Yudha, Jeje, Ramos, Ivan, Ridho, Miftah,
Wagiran, Arik, Aziz, Gani, Andri, Mardian, Anggino, dan Ari.
17.Sahabat terbaikku “kepompong kecil”; Wenda, Evi, Siska, Devi, Yanti,
Ulan, dan Febri yang telah menemani perjalanan ini sejak dibangku SMP.
18.Lia Amitha yang selalu menemaniku, terimakasih untuk kasih sayang,
semangat, doa, dan kebersamaannya.
19. Adik-adik satu bimbingan penelitian; Rifki, Indry, Indah, dan Imah,
terimakasih atas semangat dan bantuannya.
20.Pimpinan Himaki FMIPA Unila periode kepengurusan 2013-2014
terimakasih atas kerjasama, pengalaman, pembelajaran, serta suka dan
duka selama 1 tahun periode kepengurusan.
21.Teman-teman KKN Tematik di Desa Pesawaran Indah Kecamatan Padang
Cermin Kabupaten Pesawaran.
23. Kakak dan adik tingkat penulis kimia angkatan 2005, 2006, 2007, 2008,
2009, 2010, 2012, 2013, 2014, dan 2015.
Semoga segala bentuk bantuan dan dukungan yang telah diberikan mendapat
balasan pahala dari Allah SWT, Aamiin. Penulis menyadari bahwa skripsi ini
masih terdapat kekurangan, namun penulis berharap semoga skripsi ini dapat
bermanfaat dan berguna bagi rekan-rekan khususnya mahasiswa kimia dan
pembaca pada umumnya.
Bandar Lampung, November 2015
Penulis
1
I. PENDAHULUAN
A. Latar Belakang
Pencemaran logam berat terus meningkat seiring dengan meningkatnya aktivitas
manusia terutama dari limbah industri. Logam berat merupakan zat yang
berbahaya karena dapat mengganggu kesehatan manusia, walaupun dalam jangka
waktu yang cukup lama. Biasanya, logam berat merupakan limbah utama yang
dihasilkan dari berbagai macam industri seperti tekstil, plastik, pewarnaan,
elektroplating, proses metaluragi, pertambangan, dan lain-lain (Han et al., 2006;
Lyer et al., 2005).
Logam berat dapat berpengaruh langsung maupun terakumulasi pada rantai
makanan walaupun konsentrasinya sangat rendah. Beberapa logam berat yang
dapat mencemari lingkungan dan bersifat toksik adalah krom (Cr), perak (Ag),
kadmium (Cd), timbal (Pb), seng (Zn), merkuri (Hg), tembaga (Cu), besi (Fe),
molibdat (Mo), nikel (Ni), timah (Sn), kobalt (Co) dan unsur-unsur logam yang
termasuk ke dalam logam ringan seperti arsen (As), alumunium (Al) dan selenium
(Se) (Purwaningsih, 2009).
Beberapa cara telah dilakukan untuk mengatasi pencemaran logam berat salah
satunya dengan menggunakan proses adsorpsi. Proses ini lebih menguntungkan
2
(Blais et al., 2000). Beberapa adsorben yang banyak digunakan dalam proses
adsorpsi adalah alumina, karbon aktif, silika gel, dan zeolit. Saat ini mulai
dikembangkan penelitian menggunaan adsorben alternatif yang berasal dari alam
karena memiliki daya adsorpsi yang baik serta lebih ekonomis. Salah satu contoh
adsorben tersebut adalah alga (Kriswiyanti and Danarto, 2007).
Dari hasil penelitian terdahulu, telah diketahui bahwa alga dapat digunakan
sebagai adsorben logam berat, alga mempunyai gugus fungsional karboksilat
(-COOH) dan hidroksil (-OH), kedua gugus fungsi inilah yang berperan dalam
proses adsorpsi logam berat (Ronaldo et al., 2013). Nitzschia sp. merupakan
mikroalga yang termasuk alga bersel tunggal dan berwarna biru kehijauan.
Mikroalga ini mempunyai kecepatan pertumbuhan yang tinggi, mudah
dibudidayakan, dan memiliki kadar lipid yang cukup tinggi (Chisti, 2007).
Namun alga ini belum banyak digunakan sebagai adsorben logam berat, sehingga
dalam penelitian ini akan dipelajari kemampuan adsorpsinya.
Kemampuan adsorpsi biomassa alga dalam menyerap ion-ion logam masih sangat
terbatas oleh beberapa kelemahan seperti ukurannya yang sangat kecil, berat
jenisnya yang rendah dan mudah rusak karena terdegradasi oleh mikroorganisme
lain. Untuk mengatasi kelemahan tersebut, maka dilakukan immobilisasi pada
biomassa alga untuk menghasilkan material yang stabil (Harris and
Ramelow,1990). Salah satu material yang sering digunakan sebagai matriks
untuk imobilisasi biomassa alga adalah silika gel. Imobilisasi biomassa alga
dengan silika gel dapat mempertahankan dan meningkatkan keefektifan gugus
3
dalam menyerap ion logam berat. Lebih lanjut untuk meningkatkan efektifitas
adsorpsi material biomassa alga-silika dalam menyerap logam berat maka
dilakukan peningkatan laju adsorpsi dengan cara memodifikasi biomassa alga
melalui teknik pelapisan silika dengan partikel Fe3O4 (magnetit).
Teknik pelapisan silika dengan pelapisan partikel magnetit merupakan teknik
yang ramah lingkungan karena tidak mengandung kontaminasi seperti padatan
tersuspensi, selain itu akan mempercepat proses pemisahan logam dari larutan
karena adsorben bersifat magnet (Lin et al., 2011; Chang and Chen, 2005; Hu et
al., 2004) dengan menggunakan teknik tersebut, maka akan diperoleh adsorben
yang memiliki kapasitas dan selektivitas besar terhadap ion logam target serta
dapat memisahkan logam target dengan cepat (Peng et al., 2010).
Pada penelitian ini telah dipelajari faktor-faktor yang mempengaruhi kemampuan
adsropsi ion-ion logam berat oleh biomassa alga Nitzschia sp. yang diimobilisasi
dengan pelapisan silika magnet yaitu derajat keasaman (pH), dan konsentrasi ion
logam berat. Adsorben hibrida alga silika (HAS) dan hibrida alga silika-magnetit
(HAS-M) dikarakterisasi menggunakan spektrofotometer inframerah (IR) untuk
mengidentifikasi gugus-gugus fungsi, X-ray difraction (XRD) untuk menentukan
tingkat kekristalan dari material tersebut dan menggunakan scanning electron
microscope (SEM) untuk menganalisis morfologi permukaan adsorben, serta
energy dispersive X-ray (EDX) spectroscopy untuk analisis komposisi unsur.
Analisis kadar ion logam Cd(II), Cu(II), dan Pb(II) yang teradsorpsi dilakukan
4
B. Tujuan Penelitian
Berdasarkan latar belakang masalah yang telah dijelaskan di atas, maka penelitian
ini dilakukan dengan tujuan sebagai berikut :
1. Mempelajari cara sintesis dan karakterisasi HAS dan HAS-M dari biomassa
alga Nitzschia sp.
2. Menentukan pH optimum dan kapasitas adsorpsi ion Cd(II), Cu(II), dan Pb(II)
pada material HAS dan HAS-M.
C. Manfaat Penelitian
Adapun manfaat penelitian ini adalah untuk memberikan informasi tentang
karakteristik biomassa yang dilapisi magnet sehingga dapat digunakan untuk
5
II. TINJAUAN PUSTAKA
A. Biomassa Alga
Alga merupakan mikroorganisme yang hidup di daerah perairan dan merupakan
salah satu sumberdaya alam hayati laut yang bernilai ekonomis dan memiliki
peranan ekologis sebagai produsen yang tinggi dalam rantai makanan dan tempat
pemijahan biota-biota laut (Bold and Wyne, 1985). Mikroorganisme ini memiliki
bentuk dan ukuran yang beranekaragam, ada yang mikroskopis, bersel satu,
berbentuk benang/pita atau berbentuk lembaran.
Adapun alga yang digunakan pada penelitian ini adalah Nitzschia sp. Dalam
ekosistem perairan, Nitzschia sp. memiliki peran yang penting yakni sebagai
produsen primer. Mikroalga ini banyak digunakan sebagai pakan alami bagi larva
organisme laut seperti krustacea, bivalvia, dan ikan (Isnansetyo and Kurniastuty,
1995). Selain sebagai pakan alami bagi organisme laut, mikroalga Nitzschia juga
salah satu jenis organisme penghasil lipid yang potensial untuk dikembangkan
sebagai bahan dasar pembuatan biodiesel (Campbell, 2008). Mikroalga ini
mempunyai kecepatan pertumbuhan yang tinggi, mudah dibudidayakan, dan
memiliki kadar lipid yang cukup tinggi (Chisti, 2007).
Klasifikasi Nitzschia sp. menurut Newel, 1977 adalah sebagai berikut :
6
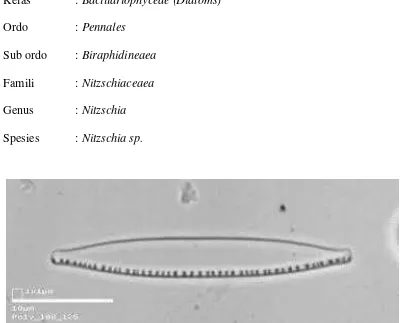
Kelas : Bacillariophyceae (Diatoms)
Ordo : Pennales
Sub ordo : Biraphidineaea
Famili : Nitzschiaceaea
Genus : Nitzschia
Spesies : Nitzschia sp.
Gambar 1. Nitzschia sp.
Nitzschia sp. merupakan diatom yang termasuk alga bentik, mempunyai ciri-ciri
antara lain bentuk sel memanjang dengan satu setae yang panjang disetiap
ujungnya, mempunyai dinding sel yang tipis dan ukuran sel berkisar antara 10-40
μm (Valentinaet al., 2007). Nitzschia memiliki kandungan protein 33%, lemak
21%, dan karbohidrat (serat kasar) 28% (Isnansetyo and Kurniastuty, 1995)
B. Silika Gel
Silika gel adalah butiran seperti kaca dengan bentuk yang sangat berpori. Silika
gel merupakan mineral alami yang dimurnikan dan diolah menjadi salah satu
7
industri farmasi, keramik, cat, dan aplikasi khusus pada bidang kimia. Silika gel
adalah polimer asam silikat dengan berat molekul besar dan banyak menyerap air
sehingga berbentuk padat kenyal. Definisi lain dari silika gel adalah silika amorf
yang terdiri atas globula-globula SiO4 tetrahedral yang tidak teratur dan
beragregat membentuk kerangka tiga dimensi (Oscik, 1982).
Ketidakteraturan susunan permukaan tetrahedral SiO4 pada silika gel
menyebabkan jumlah distribusi satuan luas bukan menjadi ukuran kemampuan
adsorpsi silika gel walaupun gugus silanol dan siloksan terdapat pada permukaan
silika gel. Kemampuan adsorpsi silika gel ternyata tidak sebanding dengan
jumlah gugus silanol dan siloksan yang ada pada permukaan silika gel, namun
bergantung pada distribusi gugus –OH per satuan luas adsorben (Oscik, 1982).
Silika gel sangat mudah dibuat dengan ukuran-ukuran mesh tertentu dan berfungsi
sebagai adsorben yang baik serta penggunaan kembali setelah disimpan dalam
keadaan kering selama beberapa tahun (Tong and Ramelow 1994). Pembuatan
silika gel dilakukan melalui proses sol-gel karena berlangsung pada temperatur
rendah. Melalui proses ini, bahan oksida anorganik dengan sifat yang
dikehendaki seperti kekerasan, ketahanan termal, transparansi optik, porositas,
dapat dilakukan pada temperatur rendah (Brinker and Scherer, 1990).
C. Proses Sol Gel
Proses sol gel dapat didefinisikan sebagai proses pembentukan senyawa anorganik
8
tersebut terjadi perubahan fasa dari suspensi koloid (sol) membentuk fasa cair
kontinyu (gel).
Metode sol gel merupakan metode yang sering digunakan karena beberapa
keunggulannya, antara lain: proses berlangsung pada temperatur rendah,
prosesnya relatif lebih mudah, bisa diaplikasikan dalam segala kondisi (versatile),
menghasilkan produk dengan kemurnian dan kehomogenan yang tinggi. Bisa
dilakukan kontrol terhadap ukuran dan distribusi pori dengan mengubah rasio
molar air/prekursor, tipe katalis atau prekursor, suhu gelasi, pengeringan, dan
proses stabilisasi. Selain itu, yang paling mengesankan dari proses sol-gel adalah
biayanya relatif murah dan produk berupa xerogel silika yang dihasilkan tidak
beracun (Zawrah et al., 2009).
Tahapan-tahapan dari proses sol gel adalah sebagai berikut :
1. Larutan kimia (membentuk gel)
2. Aging (mendiamkan gel untuk mengubah sifat)
3. Drying (pengeringan)
4. Kalsinasi (mengubah sifat-sifat fisik dan kimia padatan)
Beberapa keuntungan menggunakan metode sol gel yaitu :
1. Metodenya sederhana dan mudah
2. Homogenitasnya baik
3. Dapat bekerja pada temperatur rendah, dan hemat energi (Widodo, 2010).
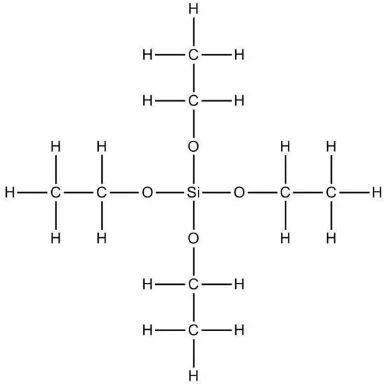
Bahan dasar yang digunakan untuk membuat sol dapat berupa logam alkoksida
9
terhidrolisis oleh air dan mudah digantikan oleh gugus OH. Selanjutnya silanol
(Si-OH) direaksikan antara keduanya atau direaksikan dengan gugus alkoksida
non-hidrolisis untuk membentuk ikatan siloksan(Si-O-Si) dan mulailah terbentuk
jaringan silika. Sehingga TEOS baik digunakan dalam proses sol-gel.
Gambar 2. Struktur TEOS (tetraetilortosilikat).
Proses sol gel mengalami reaksi hidrolisis dan reaksi polikondensasi untuk
membentuk koloid, yaitu suatu sistem yang terdiri dari partikel-partikel padat
(ukuran partikel antara 1 nm sampai 1 μm) yang terdispersi dalam suatu pelarut
(Widodo, 2010). Reaksi pada proses sol-gel dapat dilihat pada persamaan berikut:
Reaksi Hidrolisis
≡Si-OR + H-O-H → ≡Si-OH + ROH
Reaksi Polikondensasi
≡Si-OH + HO-Si → ≡Si-O-Si≡ + H2O
10
D. Magnetit (Fe3O4)
Fe3O4 (magnetit) adalah salah satu jenis mineral bumi. Di Indonesia, magnetit
diperoleh dari hasil pertambangan pasir besi yang berada di sungai atau tambang
pasir pegunungan. Magnetit (Fe3O4) merupakan salah satu oksida besi selain
maghemit (γ-Fe2O3) dan hematit (α-Fe2O3) yang menunjukkan kemagnetan paling
kuat di antara oksida-oksida besi yang lain sehingga banyak dimanfaatkan di
berbagai bidang (Teja and Koh, 2009). Magnetit menunjukkan manfaat yang
semakin luas dengan sifat kemagnetan yang kuat, salah satunya adalah sebagai
pengikat logam berat yang terkandung dalam air limbah.
Nanopartikel magnetit kini banyak dikembangkan karena sifat fisik dan kimianya
yang dimilikinya menarik yang berbeda dengan sifat material bulknya. Perbedaan
sifat ini dikarenakan keberadaan efek ukuran kuantum (quantum size effects) pada
materialnya. Sifat fisik yang unik dari nanopartikel magnetit adalah sifat
kemagnetan yang dimilikinya. Magnetisasi (peratom) dan anisotropi magnetit
nanopartikel berbeda dengan sifat material bulk, serta memiliki perbedaan suhu
Curie (Tc) dan suhu Neel (Tn). Selain itu pada nanopartikel ditemukan sifat yang
menarik seperti giant magnetoresistance (GMR), efek magnetokalorik yang besar,
dan sebagainya (Gubin et al., 2005).
Nanopartikel magnetit banyak diaplikasikan dalam berbagai bidang, seperti fluida
dan gel magnetit, katalis, pigmen pewarna, dan diagnosa medik. Beberapa sifat
nanopartikel magnetit ini bergantung pada ukurannya. Sebagai contoh, ketika
11
pada suhu ruang, ini berarti bahwa energi termal dapat menghalangi anisotropi
energi penghalang dari sebuah nanopartikel tunggal (Aiguo, 2008).
E. Logam Berat
Logam secara khas menggambarkan suatu unsur yang merupakan konduktor
listrik yang baik dan mempunyai konduktivitas panas, rapatan, kemudahan
ditempa, kekerasan dan keelektropositifan yang tinggi (Connell and Miller 1995).
Secara umum, logam berat memiliki kriteria-kriteria yang sama dengan
logam-logam lain, hanya saja perbedaannya terletak pada pengaruh yang dihasilkan bila
logam berat berikatan dan atau masuk ke dalam tubuh organisme hidup (Palar
1994). Logam berat didefinisikan sebagai unsur-unsur kimia dengan densitas
lebih dari 5 g/cm3 dan biasanya bernomor atom 22 sampai 92 dan terletak pada periode 4 sampai 7 dalam sistem periodik unsur. Logam berat biasanya
menimbulkan efek-efek tertentu pada makhluk hidup. Dapat dikatakan bahwa
semua logam berat dapat menjadi racun bagi tubuh makhluk hidup
(Suhendrayatna, 2001).
Menurut Sasongko (2002), logam berat memiliki sifat-sifat di antaranya:
1. Sulit didegradasi, sehingga mudah terakumulasi dalam lingkungan perairan
dan keberadaannya secara alami sulit terurai atau berubah.
2. Dapat terakumulasi dalam organisme termasuk kerang dan ikan, yang
nantinya dapat membahayakan kesehatan manusia yang mengkonsumsinya.
3. Mudah terakumulasi di sedimen, sehingga konsentrasinya selalu lebih tinggi
12
Adapun logam berat yang digunakan pada penelitian ini adalah :
1. Kadmium (Cd)
Kadmium adalah unsur kimia dengan lambang Cd bernomor atom 48, merupakan
logam putih keperakan yang dapat ditempa, liat, dan memiliki titik lebur 321°C.
Kadmium merupakan logam berat yang sangat toksik setelah merkuri (Hg)
(Connel and Miller 1995). Kadmium dapat digunakan sebagai pigmen pada
keramik, penyepuhan listrik, pembuatan alloy, dan baterai alkali (Susilawati,
2009). Kadmium berpengaruh terhadap manusia dalam jangka waktu yang
panjang dan dapat terakumulasi pada tubuh khususnya hati dan ginjal. Menurut
teori, pada konsentrasi rendah berefek pada gangguan pada paru-paru, emphysema
dan reanal turbural disease acodosis yang kronis (Susilawati, 2009).
2. Tembaga (Cu)
Tembaga (Cu) adalah salah satu unsur mineral mikro (essensial) yang memiliki
peran dalam proses metabolisme tubuh. Kekurangan tembaga dapat
menyebabkan sistem enzim tidak berfungsi, sehingga sistem metabolisme dan
fisiologi tubuh tidak bekerja secara normal dan menyebabkan gangguan dalam
pembentukan darah. Namun sebaliknya, bila kelebihan tembaga akan
mengakibatkan kerusakan jaringan tubuh (Tumin et al., 2008). Logam Cu
merupakan salah satu logam berat yang bersifat toksik terhadap organisme air dan
manusia pada batas konsentrasi tertentu. (Halang, 2007).
Tembaga merupakan zat yang esensial bagi metabolisme hewan, tetapi kandungan
tembaga yang berlebihan dapat menimbulkan gangguan dan penyakit pada otak,
13
usus, kerusakan ginjal, dan anemia (Al-Rub et al.,2006). Selain itu, tembaga juga
dapat menyebabkan keracunan, seperti muntah, kejang, tegang, bahkan kematian
(Paulino et al., 2006). Logam Cu merupakan logam berat essensial, jadi
meskipun beracun tetapi sangat dibutuhkan manusia dalam jumlah yang kecil.
Toksisitas yang dimiliki Cu baru akan bekerja bila telah masuk ke dalam tubuh
organisme dalam jumlah yang besar atau melebihi nilai toleransi organisme terkait
(Palar, 1994).
3. Timbal (Pb)
Timbal sebagai logam berat merupakan unsur yang terbanyak di alam. Istilah
logam berat digunakan karena timbal mempunyai densitas (rapatan) yang sangat
tinggi (11,34 g cm-3), jauh melebihi densitas tertinggi logam transisi pertama (yaitu 8,92 g cm-3 untuk tembaga) (Sugiyarto and Suyanti, 2010)
Timbal dengan berat atom 207,21 g/mol dan berat jenis 11,34 dan nomor atom 82
memiliki warna kelabu kebiruan dan lunak dengan titik leleh sebesar 327oC dan titik didih 1620oC. Timbal dan persenyawaannya banyak digunakan dalam industri baterai sebagai bahan aktif dalam pengaliran arus elektron. Timbal dapat
terakumulasi dalam organ tubuh seperti otak, yang dapat menyebabkan keracunan
(plumbism) atau bahkan kematian. Timbal juga dapat mempengaruhi saluran
gastrointestinal, ginjal, dan sistem syaraf (Siregar, 2005).
Logam Pb merupakan logam berat yang terdapat secara alami di dalam kerak
bumi. Karena aktivitas manusia, keberadaan timbal dapat meningkat jumlahnya
300 kali lebih banyak dibandingkan Pb alami yang terdapat pada kerak bumi. Pb
14
industri modern sebagai bahan pembuatan pipa air yang tahan korosi, bahan
pembuat cat, baterai, dan campuran bahan bakar bensin (Herman, 2006).
F. Adsorpsi
Adsorpsi adalah suatu perubahan yang terjadi pada permukaan, merupakan
akumulasi sejumlah molekul, ion atau atom yang terjadi pada batas antara dua
fasa (Alberty and Daniel, 1987). Adsorben sebagai fasa menyerap, sedangkan
fasa terserap disebut adsorbat. Adsorpsi merupakan peristiwa terkonsentrasinya
suatu zat pada permukaan zat lain. Sistem adsorpsi adalah sistem yang
memanfaatkan kemampuan zat padat untuk menyerap suatu zat dan penyerapan
tersebut hanya berlangsung pada permukaannya saja. Adsorpsi telah banyak
digunakan karena kemampuannya dalam menghilangkan polutan dari suatu aliran
cairan maupun gas (Kriswiyanti and Danarto, 2007).
Biasanya partikel-partikel kecil zat penyerap dilepaskan pada adsorpsi kimia yang
merupakan ikatan kuat antara penyerap dan zat yang diserap sehingga tidak
mungkin terjadi proses yang bolak-balik. Sistem adsorpsi adalah suatu sistem
yang memanfaatkan kemampuan zat padat untuk menyerap suatu zat dan
penyerapan tersebut hanya berlangsung pada permukaan saja.
Adsorpsi terbagi atas dua tipe (Treyball, 1981), yaitu :
1. Physical adsorption atau van der waals adsorption yaitu adsorpsi terjadi
karena adanya gaya tarik menarik antar gaya inter molekular antara
15
2. Chemisorption yaitu adsorpsi terjadi akibat adanya interaksi proses kimia
antara padatan dengan material yang terserap.
Dalam keadaan nyata, fenomena adsorpsi merupakan kombinasi dari adsorpsi
kimia dan fisika. Kecepatan adsorpsi tidak hanya tergantung pada perbedaan
konsentrasi dan pada luas permukaan adsorben, melainkan juga pada suhu,
tekanan (untuk gas), ukuran partikel dan porositas adsorben, juga tergantung pada
ukuran molekul bahan yang akan diadsorpsi dan pada viskositas campuran yang
akan dipisahkan (Alberty and Daniels, 1992).
Faktor-faktor yang mempengaruhi pada proses adsorpsi diantaranya yaitu:
a. Sifat logam dan ligan
Sifat ion logam yakni: (1) ukuran ion logam, makin kecil ukuran ion logam maka
kompleks yang terbentuk semakin stabil, (2) polarisabilitas ion logam, makin
tinggi polarisabilitas ion logam maka kompleks yang terbentuk semakin stabil, (3)
energi ionisasi, makin tinggi energi ionisasi suatu logam maka kompleks yang
terbentuk semakin stabil.
Sifat ligan yakni : (1) kebasaan, makin kuat basa Lewis suatu ligan maka semakin
stabil kompleks yang terbentuk, (2) polarisabilitas dan momen dipol, makin tinggi
polaritas dan polarisabilitas suatu ligan makin stabil kompleks yang terbentuk dan
(3) faktor sterik, tingginya rintangan sterik yang dimiliki oleh ligan akan
menurunkan stabilitas kompleks (Huheey et al., 1993).
b. Pelarut
Proses adsorpsi dapat ditinjau melalui sifat kepolaran baik dari adsorben,
16
adsorpsi bergantung pada gaya interaksi antara molekul dari komponen larutan
dengan lapisan permukaan adsorben dengan pori-porinya. Pelarut dapat ikut
teradsorpsi atau sebaliknya dapat mendorong proses adsorpsi. Di dalam pelarut
air umumnya zat-zat yang hidrofob dari larutan encer atau cenderung teradsorpsi
lebih banyak pada adsorben dibanding zat hidrofil (Oscik, 1982).
c. Pengaruh pH
pH berpengaruh pada proses adsorpsi, pada pH tinggi maka silika gel akan
bermuatan netto negatif (kondisi larutan basa) sedangkan pada pH rendah (kondisi
larutan asam) akan bermuatan netto positif sampai netral (Spiakov, 2006).
d. Konsentrasi adsorbat
Pada umumnya adsorpsi akan meningkat dengan kenaikan konsentrasi adsorbat
tetapi tidak berbanding lurus. Adsorpsi akan konstan jika terjadi kesetimbangan
antara konsentrasi adsorbat yang diserap dengan konsentrasi yang tersisa dalam
larutan (Oscik, 1982).
e. Temperatur
Pada temperatur rendah adsorpsi biasanya terjadi secara eksotermis (Oscik, 1982).
f. Waktu kontak dan pengocokan
Waktu kontak yang cukup diperlukan untuk mencapai kesetimbangan adsorpsi.
Jika fase cairan yang berisi adsorben diam, maka difusi adsorbat melalui
permukaan adsorben akan lambat. Oleh karena itu diperlukan pengocokan untuk
17
1. Model Kesetimbangan Adsorpsi
Kualitas material adsorben dipertimbangkan sesuai dengan berapa banyak
adsorbat (logam berat) yang dapat ditarik dan yang tersisa (Yang and Volesky,
1999). Model kesetimbangan adsorpsi yang sering digunakan untuk menentukan
kesetimbangan adsorpsi adalah isotermal Langmuir dan Freundlich.
a. Model isoterm adsorpsi Langmuir
Model isoterm Langmuir menggunakan pendekatan kinetika, yaitu kesetimbangan
terjadi jika kecepatan adsorpsi sama dengan kecepatan desorpsi (Al-Duri, 1995).
Bagian yang terpenting dalam proses adsorpsi yaitu situs yang dimiliki oleh
adsorben yang terletak pada permukaan, akan tetapi jumlah situs-situs ini akan
berkurang jika permukaan yang tertutup semakin bertambah (Husin dan Rosnelly,
2005). Persamaan isoterm adsorpsi Langmuir tersebut ditulis dalam bentuk
persamaan linier yaitu sebagai berikut:
(1)
Dengan C adalah konsentrasi kesetimbangan (mol L-1), m adalah jumlah logam
yang teradsorpsi per gram adsorben pada konsentrasi C (mol g-1), b adalah jumlah
ion logam yang teradsorpsi saat keadaan jenuh (kapasitas adsorpsi)(mol g-1) dan K
adalah konstanta kesetimbangan adsorpsi (L mol-1). Dari kurva linier hubungan antara C/m versus C maka dapat ditentukan nilai b dari kemiringan (slop) dan K
dari intersep kurva (Buhani and Suharso, 2009).
Energi adsorpsi (Eads) yang didefinisikan sebagai energi yang dihasilkan apabila
18
nilai negatif dari perubahan energi bebas Gibbs standar, ∆G0, dapat dihitung
menggunakan persamaan:
(2)
Dengan R adalah tetapan gas umum (8,314 J mol-1 K-1), T temperatur (K) dan K
adalah tetapan kesetimbangan adsorpsi yang diperoleh dari persamaan Langmuir
dan energi total adsorpsi adalah sama dengan energi bebas Gibbs (Oscik, 1982).
∆G sistem negatif artinya adsorpsi berlangsung spontan.
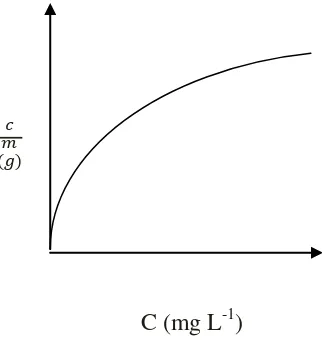
Adapun grafik isoterm adsorpsi Langmuir dapat diperlihatkan pada Gambar 3.
C (mg L-1)
Gambar 3. Isoterm adsorpsi Langmuir (Husin and Rosnelly, 2005)
b.Model isoterm Freundlich
Model isoterm Freundlich menggunakan asumsi bahwa adsorpsi berjalan secara
fisika. Model isotherm Freundlich (Al-Duri, 1995) merupakan persamaan empirik
yang dinyatakan dengan persamaan:
(3)
Dimana:
19
n = Kapasitas adsorpsi maksimum (mol g-1)
Kf = Konstanta freundlich (L mol-1)
Persamaan di atas dapat diubah kedalam bentuk linier dengan mengambil bentuk
logaritmanya:
(4)
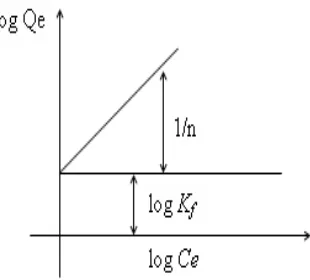
Sehingga dapat dibuat Gafik sebagai berikut:
Gambar 4. Model Isoterm Adsorpsi Freundlich
Bentuk linear dapat digunakan untuk menentukan kelinearan data percobaan
dengan cara mengeplotkan C/Q terhadap Ce. Konstanta Freundlich Kf dapat
diperoleh dari kemiringan garis lurusnya dan 1/n merupakan harga slop. Bila n
diketahui Kf dapat dicari, semakin besar harga Kf maka daya adsorpsi akan
semakin baik dan dari harga Kf yang diperoleh, maka energi adsorpsi akan dapat
dihitung (Rousseau, 1987).
Selain itu, untuk menentukan jumlah logam teradsorpsi, rasio distribusi dan
koefisien selektivitas pada proses adsorpsi ion logam terhadap adsorben biomassa
alga, (HAS) dan HAS-M dapat digunakan persamaan berikut:
20
Dimana Q menyatakan jumlah logam teradsorpsi (mg g-1), Co dan Ca menyatakan
konsentrasi awal dan kesetimbangan dari ion logam (mmol L-1), W adalah massa adsorben (g), V adalah volume larutan ion logam (L) (Buhani et al., 2009).
G. Karakterisasi
1. Spektrofotometer IR
Spektrofotometer IR merupakan alat untuk mendeteksi gugus fungsional,
mengidentifikasi senyawa, dan menganalisis campuran (Day and Underwood,
2002). Spektrofotometeri IR adalah spektrofotometer yang memanfaatkan sinar
IR dekat, yakni sinar yang berada pada jangkauan panjang gelombang 2,5 - 25 m
atau jangkauan frekuensi 400 - 4000 cm-1. Sinar ini muncul akibat vibrasi
atom-atom pada posisi kesetimbangan dalam molekul dan kombinasi vibrasi dengan
rotasi menghasilkan spektrum vibrasi-rotasi (Khopkar, 2001).
Spektrum inframerah suatu molekul adalah hasil transisi antara tingkat energi
getaran (vibrasi) atau osilasi (oscillation). Bila molekul menyerap radiasi
inframerah, energi yang diserap menyebabkan kenaikan dalam amplitudo getaran
atom-atom yang terikat itu. Jadi molekul ini berada pada keadaan vibrasi
tereksitasi (excited vibrational state); energi yang diserap ini akan dibuang dalam
bentuk panas bila molekul itu kembali ke keadaan dasar. Panjang gelombang
eksak dari absorpsi oleh suatu tipe ikatan, bergantung pada macam getaran dari
ikatan tersebut. Oleh karena itu, tipe ikatan yang berlainan menyerap radiasi
21
spektrometri inframerah dapat digunakan untuk mengidentifikasi adanya gugus
fungsi dalam suatu molekul (Supratman, 2010).
2. Spektrofotometer Serapan Atom (SSA)
Dalam proses adsorpsi, keberhasilan adsorben mengikat ion dapat dilihat
menggunakan SSA. SSA juga dapat digunakan untuk mengetahui kadar ion
logam yang teradsorpsi maupun yang terdapat dalam adsorben. Ion logam yang
teradsorpsi dihitung secara kuantitatif berdasarkan selisih konsentrasi ion logam
sebelum dan sesudah adsorpsi (Yuliasari, 2003).
Metode analisis dengan SSA didasarkan pada penyerapan energi cahaya oleh
atom-atom netral suatu unsur yang berada dalam keadaan gas. Penyerapan cahaya
oleh atom bersifat karakteristik karena tiap atom hanya menyerap cahaya pada
panjang gelombang tertentu yang energinya sesuai dengan energi yang diperlukan
untuk transisi elektron-elektron dari atom yang bersangkutan ditingkat yang lebih
tinggi, sedangkan energi transisi untuk masing-masing unsur adalah sangat khas.
Metode ini sangat tepat untuk analisis zat pada konsentrasi rendah. Teknik ini
mempunyai beberapa kelebihan dibandingkan dengan metode spektroskopi emisi
konvensional. Pada metode konvensional emisi tergantung pada sumber eksitasi,
bila eksitasi dilakukan secara termal maka akan tergantung pada temperatur
sumber (Khopkar, 2001).
3. Difraktometer Sinar-X (XRD)
X-Ray Diffraction (XRD) adalah metode yang secara umum digunakan untuk
22
ini adalah interaksi antara sinar X dengan elektron dalam materi. Saat sinar X
ditembakkan ke materi, sinar tersebut akan dipantulkan ke beberapa arah oleh
awan elektron yang ada dalam atom. Setiap kisi kristal akan memberikan arah
pantulan yang berbeda. Semakin seragam suatu kristal, maka arah pantulannya
akan semakin seragam pula. Panjang gelombang sinar X yang digunakan dalam
XRD adalah antara 0,6 – 1,9 Å (Dann, 2000).
4. Scanning Electron Microscope (SEM)
SEM adalah salah satu jenis mikroskop elektron yang menggunakan berkas
elektron untuk menggambar profil permukaan benda. Prinsip kerja SEM adalah
menembakkan permukaan benda dengan berkas elektron bernergi tinggi.
Permukaan benda yang dikenai berkas akan memantulkan kembali berkas tersebut
atau menghasilkan elektron sekunder ke segala arah. Tetapi ada satu arah di mana
berkas dipantulkan dengan intensitas tertinggi. Detektor di dalam SEM
mendeteksi elektron yang dipantulkan dan menentukan lokasi berkas yang
dipantulkan dengan intensitas tertinggi. Arah tersebut memberi informasi profil
permukaan benda seperti seberapa landai dan ke mana arah kemiringan.
Syarat agar SEM dapat menghasilkan citra yang tajam adalah permukaan benda
harus bersifat sebagai pemantul elektron atau dapat melepaskan elektron sekunder
ketika ditembak dengan berkas elektron. Material yang memiliki sifat demikian
adalah logam. Jika permukaan logam diamati di bawah SEM maka profil
permukaan akan tampak dengan jelas. Sedangkan untuk material bukan logam
maka permukaan material tersebut harus dilapisi dengan logam (Mikrajuddin and
23
III. METODE PENELITIAN
A.Waktu dan Tempat
Penelitian ini telah dilaksanakan pada bulan Mei sampai Juli 2015 di
Laboratorium Kimia Anorganik/Fisik FMIPA Universitas Lampung. Penyiapan
alga nitzschia sp di Balai Besar Perikanan Budidaya Laut Lampung (BBPBL).
Identifikasi gugus fungsional menggunakan alat spektrofotometer IR di
Laboratorium Kimia Organik FMIPA Universitas Gajah Mada. Uji adsorpsi
menggunakan alat spektrofotometer serapan atom (SSA), untuk menentukan
struktur kristal menggunakan alat X-ray diffraction (XRD) di Laboratorium Kimia
Analitik FMIPA Universitas Gajah Mada, dan analisis morfologi permukaan
adsorben menggunakan scanning electron microscope (SEM), serta energy
dispersive X-ray (EDX) spectroscopy untuk analisis komposisi unsur di
Laboratorium Biomassa Universitas Lampung.
B.Alat dan Bahan
Peralatan yang digunakan pada penelitian ini antara lain alat-alat gelas yang biasa
digunakan di laboratorium, gelas plastik, neraca analitik, oven, labu ukur, pH
indikator universal, magnetic stirrer, kertas saring Whatman No. 42, sentrifius,
24
Bahan-bahan yang digunakan pada penelitian ini adalah, biomassa alga Nitzschia
sp, TEOS (tetraetilortosilikat), akuades, larutan HCl 1M, FeCl3.6H2O,
FeSO4.5H2O, NH4OH, larutan CuSO4.5H2O, larutan CdSO4.8H2O, larutan
Pb(NO3)2, larutan CH3COONa dan etanol p.a.
C.Prosedur Penelitian
1. Sintesis
a. Magnetit (Fe3O4)
Sebanyak 5,41 gram FeCl3.6H2O dilarutkan dalam 10 ml akuades (larutan A) dan
5,56 gram FeSO4.5H2O dilarutkan dalam 10 ml akuades (larutan B). Selanjutnya
(larutan A) dicampur dengan (larutan B) disertai pengadukkan hingga larutan
menjadi homogen. Setelah larutannya homogen ditambahkan NH4OH 1 M tetes
demi tetes (kurang lebih sampai pH > 10,5) sampai terbentuk endapan hitam.
Kemudian endapan hitam yang terbentuk disaring dengan kertas saring Whatman
No.42, lalu didiamkan selama 24 jam. Setelah itu endapan tersebut dibilas dengan
akuades dan etanol (60:40) hingga pH ≈ 7. Endapan kemudian dioven pada suhu
40oC selama 2-3 jam hingga berat konstan, selanjutnya digerus hingga halus.
b. Hibrida Alga Silika (HAS)
Sebanyak 5 mL TEOS dicampurkan dalam 5 mL akuades ke dalam gelas plastik.
Kemudian ditambahkan HCl 1M hingga pH larutan mencapai pH 2 dan diaduk
dengan pengaduk magnet selama 30 menit (Larutan A). Di tempat lain, sebanyak
0,8 g biomassa Nitzschia sp dicampur dengan etanol sebanyak 5 mL, campuran
25
magnet selama 30 menit (Larutan B). Setelah larutan A homogen, Larutan B
ditambahkan ke dalam larutan A disertai pengadukan menggunakan pengaduk
magnet sampai larutan tersebut menjadi gel. Gel yang terbentuk disaring dengan
kertas saring Whatmann No. 42, lalu didiamkan selama 24 jam. Gel kemudian
dibilas dengan menggunakan akuades dan etanol (60:40) hingga pH ≈ 7.
Selanjutnya dikeringkan di dalam oven pada suhu 40⁰C selama 2-3 jam dan
digerus hingga halus.
c. Hibrida Alga Silika–Magnetit (HAS-M)
Sebanyak 5 mL TEOS dimasukkan ke dalam 5 mL akuades, kemudian
ditambahkan magnetit sebanyak 0,1 g, dimasukkan ke dalam wadah plastik,
diaduk selama 30 menit. Saat pengadukan, ditambahkan HCl tetes demi tetes
hingga pH larutan mencapai pH 2 (Larutan C). Di wadah lain, biomassa Nitzschia
sp sebanyak 0,8 g dicampur dengan 5 mL etanol, kemudian diaduk selama 30
menit (Larutan D). Selanjutnya (larutan C) dicampur dengan (Larutan D) disertai
pengadukan hingga larutan menjadi homogen dan membentuk suatu gel. Gel
yang terbentuk kemudian didiamkan selama 24 jam. Gel dicuci menggunakan
akuades dan etanol (60:40) hingga pH filtrat mendekati pH 7. Lalu dikeringkan di
dalam oven pada suhu 40 ⁰C selama 2-3 jam dan digerus hingga halus.
2. Karakterisasi
Biomassa alga Nitzschia sp, HAS dan HAS-M dikarakterisasi dengan IR untuk
mengetahui gugus-gugus fungsional utama yang terkandung dalam alga tersebut.
Material magnetit, HAS dan HAS-M dilakukan analisis menggunakan X-ray
26
menggunakan scanning electron microscope (SEM) untuk menganalisis morfologi
permukaan serta energy dispersive X-ray (EDX) spectroscopy untuk analisis
komposisi unsur.
3. Uji Adsorpsi
a. Penentuan pH optimum
Sebanyak 50 mg adsorben (HAS dan HAS-M) dimasukkan masing-masing ke
dalam 7 buah labu erlenmeyer. Kemudian sebanyak 20 mL larutan ion logam
Cu(II) 100 ppm ditambahkan ke dalam masing-masing labu erlenmeyer.
Masing-masing labu erlenmeyer diatur pH yang berbeda dengan menggunakan larutan
penyangga (CH3COONa). pH yang digunakan yaitu, 3, 4, 5, 6, 7, 8, dan 9.
Kemudian larutan diaduk dengan pengaduk selama 1 jam (Mersiana, 2013).
Setelah itu larutan disentrifius dan filtrat yang diperoleh dianalisis dengan
menggunakan SSA. Prosedur ini juga diterapkan dengan menggunakan larutan
ion logam Cd(II) dan Pb(II) dengan konsentrasi masing-masing 100 ppm.
b. Penentuan variasi konsentrasi logam
Sebanyak 50 mg material alga (HAS dan HAS-M) dimasukkan masing-masing ke
dalam 6 buah labu erlenmeyer. Kemudian sebanyak 20 mL larutan ion logam
Cu(II) dengan konsentrasi yang berbeda yakni, 0, 25, 50, 100, 200, dan 300 ppm.
Masing-masing labu erlenmeyer dibuat kondisi pH optimum sesuai hasil
percobaan (b). Kemudian larutan diaduk dengan pengaduk selama 1 jam
(Mersiana, 2013). Setelah itu larutan disentrifius dan filtrat yang diperoleh
dianalisis dengan menggunakan SSA. Prosedur ini juga diterapkan dengan
45
V. SIMPULAN DAN SARAN
A. Simpulan
Berdasarkan hasil yang diperoleh dari penelitian yang telah dilakukan maka dapat
disimpulkan bahwa:
1. Sintesis adsorben HAS dan HAS-M telah berhasil dilakukan yang ditunjukkan
dengan karakterisasi menggunakan spektrofotometer IR, X-Ray Diffraction
(XRD), dan Scanning Electron Microscope (SEM)- Energy Dispersive X-Ray
(EDX) Spectroscopy.
2. Adsorpsi optimum dengan biomassa alga Nitzschia sp. terjadi pada dosis
biomassa alga sebesar 0,8 g; pH 5 dan 7 dan konsentrasi ion logam 300 mg L-1.
3. Isoterm adsorpsi ion Cd(II), Cu(II), dan Pb(II) oleh biomassa Nitzschia sp.
cenderung mengikuti model isoterm Langmuir dengan nilai kapasitas adsorpsi
masing-masing untuk HAS adalah 119,38; 42,57; dan 118,31 mg g-1, dan untuk
HAS-M masing-masing yaitu 81,19; 53,49; dan 117,22 mg g-1.
4. Energi adsorpsi ion Cd(II), Cu(II) dan Pb(II) masing-masing untuk HAS adalah
33,902; 25,865; dan 31,447 kJ mol-1, dan untuk HAS-M masing-masing yaitu sebesar 27,187; 30,053; dan 30,276 kJ mol-1. Energi adsorpsi yang diperoleh menunjukkan bahwa interaksi yang terjadi antara ion logam dan adsorben
46
B. Saran
Pada penelitian selanjutnya disarankan untuk melakukan pengujian lebih lanjut
terhadap adsorpsi ion logam lain oleh biomassa algaNitzschia sp, HAS, dan
47
DAFTAR PUSTAKA
Adamson, A. W. And A. P. Gast. 1990. Pyscal Chemistry of Surface. 6th edition.
John Wiley and Sons. Inc. New York.
Aiguo, Y. 2008. Journal Alloys and Compound 458-487
Alberty, R.A. and F. Daniel. 1987. Physical Chemistry. Fifth edition. SI Version.
John Willey and Sons Inc. New York.
Alberty, R.A. and F. Daniel. 1992.Kimia Fisika. Fifth edition. Erlangga. Jakarta
Al-Duri, B. 1995. A Riview in Equilibrium in Single and Multicomponent Liquid Adsorption System. Review in Chemical Engineering. 11, 101-143.
Al-Rub, F.A.A., M.H. El-Naas, I. Ashour, and M. Al-Marzouqi. 2006.
Biosorption of copper on chlorella vulgaris from single, binary and ternarymetal aqueous solutions. Process Biochem. 41 (2): 457–464.
Atkins, P. W. 1999. Kimia Fisik Edisi Ke-2. Penerjemah Indarto Purnomo Wahyu.
Erlangga. Jakarta
Blais, J.F., B. Dufresne, and G. Mercier. 2000. State of The Art of Technologies for Metal Removal From Industrial Effluents. Revue des Sciences de l’Eau.
12 (4): 687-711.
Bold, H.C. and M.J. Wyne. 1985. Introduction to The Algae: Structure and Reproduction. 2nd ed. Prentice Hall, Inc., Englewood Cliffs.
Brinker, C.J. and Scherer, G.W., 1990, Sol-Gel Science: The Physics and Chemistry of Sol-Gel Processing, Academic Press Inc., New York.
Buhani, Narsito, Nuryono and E.S. Kunarti. 2009. Amino and mercapto-silica hybrid for cd(ii) adsorption in aqueous solution. Indonesian Journal of
Chemistry. 9(2): 170-176.
Buhani and Suharso. 2009. Immobilization of nannochloropsis sp biomass by sol-gel technique as adsorbat of metal ion cu(ii) from aqueous solution. Asian
48
Campbell, M, N. 2008. Biodiesel: Algae as renewable source for liquid fuel.
Guelph Engineering Journal., (1): 2-7
Chang, Y.C. and Chen, D.H. 2005. Preparation and adsorption properties of monodisperse chitosan-bound fe3o4 magnetic nanoparticles for removal of
cu(ii) ions. Journal of Colloid and Interface Science. 283,446-451.
Chisti, Y. 2007. Biodiesel from Microalgae. Biotechnology Advances, 25:
294-306.
Connell, D.W. and G.J. Miller. 1995. Kimia dan Ekotoksikologi Pencemaran. UI
Press, Jakarta
Dann, 2000, Reaction and Characterization of Solids, RSC, Cambridge.
Day, R. A. and Underwood, A. L. 2002. Analisis Kimia Kuantitatif. Erlangga.
Jakarta
Drbohlavova, J., R. Hrdy, V. Adam, R. Kizek, O. Schneesweiss, J. Hubalek. 2009. Preparation and Properties of Various Magnetic Nanoparticles. Sensors.
Vol. 9, p.2352 – 2362.
Elizabeth, I.R. 2011. Biosintesis dan Karakterisasi Nanopartikel Silika (SiO2) dari
Sekam Oleh Fusarium Oxyporum. (Skripsi). Fakultas MIPA. ITB. Bogor.
Gubin, S.P., Koksharov, Y.A., Khomutov, G.B. and Yurkov, G.Y. 2005.
Magnetic nanoparticles: Preparation, structure and properties. Russian
Chemical Reviews, 6, 489-520.
Halang, Bunda. 2007. Kandungan Cu dan Pb pada Air dan Ikan Payau di
Bendungan Sungai Tabaniao Desa Bajuin Kecamatan Palaihari Kabupaten Tanah Laut Banjarmasin. Banjarmasin :Bioscientiae Volume 4, Nomor 1,
Hal 43-52.
Han, R., H. Li, J. Zhang, H. Xiao, and J. Shi. 2006. Biosorption of copper and lead ions by waste beer yeast. Journal of Hazardous Material. 137 (3):
1569-1576.
Harris, P.O. and G. J. Ramelow. 1990. Binding of Metal Ions by Particulate Quadricaudia. EnvironmentalScience andtechnology. 24, 220-228.
Herman, D.Z. 2006. Tinjauan terhadap tailing mengandung unsur pencemar As, Hg, Pb, dan Cd. J Geol Indonesia 1: 31-36.
Hu, P.Y., Hsieh, Y.H., Chen, J.C., and Chang, C.Y. 2004. Characteristics of manganese-coated sand using SEM and EDAX analysis. J. Colloid Interface
49
Huheey, J.E., E.A. Keiter. and R.L. Keiter. 1993. Inorganic Chemistry :
Principles of Structure and Reactivity. Fourth edition. Harpelcolling College
Publisher. New York.
Husin, G. dan C. M. Rosnelly. 2005. Studi Kinetika Adsorpsi Larutan Logam Timbal Menggunakan Karbon Aktif dari Batang Pisang. (Tesis). Fakultas
Teknik Universitas Syiah Kuala Darrusalam. Banda Aceh.
Isnansetyo, A dan Kurniastuty. 1995. Teknik Kultur Phytoplankton dan
Zooplankton; Pakan Alami untuk Pembenihan Organisme Laut. Penerbit
Kanisius,Yogyakarta, 106 hal.
Khopkar, S.M. 2001. Konsep Dasar Kimia Analitik. UI Press. Jakarta.
Kriswiyanti, Enny A. and Danarto, Y. C. 2007. Model Kesetimbangan Adsorpsi Cr dengan Rumput Laut. Ekuilibrium Vol. 6 No. 2 juli 2007: 47-52.
Lin, Y., H. Chen, K. Lin, B. Chen and C. Chiou. 2011. Application of magnetic particles modified with amino groups to adsorb cooper ions in aqueous solution. Journal Environmental Scient. 23:44-50.
Lodeiro P., R. Herrero and S.M.E. Vicente. 2006. The use of protonated Sargassum Multicum as biosorbent to eleminate Cadmium in fixed-bed coloumn. Journal of Hazardous Materials. 137 (1). 244-253.
Lyer, A., K. Mody, and B. Jha. 2005. Biosorption of heavy metals by a marine bacterium. Marine Pollution. 50 (3): 175-179.
Mersiana, 2013. Adsorpsi Ion Ni(II), Cu(II), Zn(II), Cd(II), dan Pn(II) Dalam Larutan Oleh Alga Tetraselmis sp Dengan Pelapisan Silika Magnetit.
(Skripsi). Universitas Lampung. Bandar Lampung
Oscik, J. 1982. Adsorption. John Wiley & Sons Inc. Chichester.
Palar, H. 1994. Pencemaran dan Toksikologi Logam Berat. Rineka Cipta. Jakarta.
hal 10, 61-71, 116-131
Paulino, A.T., F.A.S. Minasse, M.R. Guilherme, A.V. Reis, E.C. Muniz, and J. Nozaki. 2006. Novel adsorbent based on silkworm chrysalides for removal of heavy metal from wastewaters. Journal of Colloid Interface Science. 301
(2): 479-487.
Peng, Q., Liu, Y., Zeng, G., and Xu, W. 2010. Biosorption of Copper(II) by Immobilizing Saccharomyces Cereviceae on the Surface of Chitosan-Coated Magnetic Nanoparticles from Aqueous Solution. Journal of Hazardous
Materialsr. 177, 676-682.
50
Purwaningsih, D. 2009. Adsorpsi Multi Logam Ag(I), Pb(II), Cr(II), Cu(II) dan Ni(II) Pada Hibrida Etilendiamino-Silika dari Abu Sekam Padi. Jurnal
Penelitian Saintek. 14 (1): 59-76.
Ronaldo. Silalahi, I. H. dan Wahyuni, N. 2013. Adsorpsi Ion Logam Cu(II) menggunakan Biomassa Alga Coklat (Sargassum Crassifolium) yang
Terenkapsulasi Aqua-Gel Silika. JKK. 2 (3): 148-152
Rousseau, R. W. 1987. Handbook Of Separation Process Technology. John Wiley
and Sons Inc. United States.
Sasongko, A. 2002. Studi Adsorpsi Ion Logam Kadmium (Cd) pada Biomassa Alga Chlorella sp Yang Terimmobilisasi Silika Gel. Skripsi Universitas
Lampung. Bandar Lampung.
Siregar, E. B. M. 2005. Pencemaran Udara, Respon Tanaman dan Pengaruhnya pada Manusia. Karya Ilmiah. Universitas Sumatera Utara. Medan.
Spiakov, B.Y. 2006. Solid Phase Extraction on Alkyl Bonded Silica Gels in Inorganics Analysis. Anal. Chim. Acta. 22 (4): 45-60.
Sugiarto, K.H. and Suyanti, R. D. 2010. Kimia Anorganik Logam. Edisi pertama.
Graha Ilmu. Yogyakarta.
Suhendrayatna. 2001. Bioremoval Logam Berat Dengan Menggunakan
Mikroorganisme: Suatu Kajian Kepustakaan. Seminar On-Air Bioteknologi
untuk Indonesia Abad 21, 1-14 Februari 2001.
Supratman, U. 2010. Equilibrium Penentuan Senyawa Organik. Padjajaran.
Bandung.
Susilawati. 2009. Studi Biosorpsi Ion Logam Cd(II) Oleh Biomassa Alga Hijau yang Diimobilisasi pada Silika Gel. (Skripsi). FMIPA UI. Depok.
Teja, A.S. and Koh, P. 2009. Synthesis, Properties, and Application of Magnetic Iron Oxide Nanoparticles. Progress in Crystal Growth and Characterization
of Materials. 2009 (55): 22-45.
Tong, C., U.S. Ramellow., and G.J. Ramellow. 1994. Evaluation of polymeric support for immobilizing biomass to prepare sorben material for metal intern. J. Anal. Chem. Vol :56:175-171.
Treyball, R.E. 1981. Mass Transfer Operations. Third edition. McGraw-Hill.
Singapore.
51
Journal of Engineering Science and Technology, Vol. 3, No. 2 (2008) 180-189.
Valentina, M. Thariq, Suci A. dan Lydia E. 2007. Biologi Fitoplankton dalam dan Zooplankton. Balai Budidaya Laut Lampung Dirjen Perikanan Budidaya
Departemen Kelautan dan Perikanan. Bandar Lampung
Vijayaraghavan, K., K. Palanivelu, and M. Velan. 2006. Biosorption of copper(II) and cobalt(II)from aqueous solutions by crab shell particles. Bioresource Technol. 97 (12): 1411–1419.
Widodo, S. 2010. Teknologi Sol Gel pada Pembuatan Nano Kristalin Metal Oksida untuk Aplikasi Sensor Gas. Seminar Rekayasa Kimia dan Proses
2010.
Yang, J. and B. Volesky. 1999. Cadmium biosorption rate in protonated Sargassum biomass. Environmental Science and Technology. 33 (5):
751-757.
Yuliasari, L. 2003. Studi Penentuan Logam Berat Timbal (Pb) dan Kadmium (Cd) dalam Organ Tubuh Ayam Broiler Secara Spektrofotometri Serapan Atom.
(Skripsi). FMIPA Unila. Bandar Lampung.
Zawrah, M. F., El-Kheshen, A. A., Abd-El-All, H., Facile and Economic
Synthesis of Silica Nanoparticles, Journal of Ovonic Reasearch, vol.5, No.5,