UJI EFEKTIFITAS INSEKTISIDA BIOLOGI TERHADAP HAMA PENGGEREK POLONG (Maruca testulalis Geyer.) (Lepidoptera;Pyralidae) PADA
TANAMAN KACANG PANJANG DI LAPANGAN
SKRIPSI
OLEH :
EKA SUNDARI SARAGIH 090301021
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
UJI EFEKTIFITAS INSEKTISIDA BIOLOGI TERHADAP HAMA PENGGEREK POLONG (Maruca testulalis Geyer.) (Lepidoptera;Pyralidae) PADA
TANAMAN KACANG PANJANG DI LAPANGAN
SKRIPSI
OLEH :
EKA SUNDARI SARAGIH 090301021
Skripsi Sebagai Salah Satu Syarat Untuk Dapat Memperoleh Gelar Sarjana
Program Studi Agroekoteknologi Fakultas Pertanian
Universitas Sumatera Utara, Medan
Disetujui Oleh : Komisi Pembimbing
(Ir. Yuswani Pangestiningsih, MS) (Dr. Lisnawita, SP, M.Si) Ketua Anggota
PROGRAM STUDI AGROEKOTEKNOLOGI FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA MEDAN
ABSTRACT
Eka Sundari Saragih. 2014. “Efectiviness test of bioinsecticide againts the pod borer (Maruca testulalis Geyer.) (Lepidoptera;pyralidae) on Chickpea in the field”. 2014. Under supervised Yuswani Pangestiningsih & Lisnawita. The objective of this research was to get bioinsecticides that efective againts the borer on chickpea in the field. The research used complete block design nonfactorial with eight treatments and three replications. The treatments were A0 (control), A1 (Leaf extract of betelvine 100 g/l), A2 (leaf extract of soursop 250 g/l), A3 (Extract of Derris 50 g/l), A4 (Leaf extract of papaya 100 g/l),A5 (Bacillus thuringiensis 1ml/l), A6 (Beauveria bassiana (10 gr/l) and A7 (klorantraniliprol 1 ml/liter). The result showed that kind of bioinsecticide gave different effect to all of parameters. Bioinsecticides that efective to control the percentage of flower attack were A2 (0.00 %), A4 (3.03 %) and A7 (0.00 %), bioinsecticides that efective to control the percentage of fruit attack were A2 (0.00 %), A4 (17.86 %), A5 (16.67 %) dan A7 (0.00 %), bioinsecticides that efective to control the number of larvae Maruca testulalis were A2 (0.00 %) dan A7 (0.00 %) and bioinsecticides that efective to production was A2 (4.49 kg). The best bioinsecticide to control M. testulalis was leaf extract of sirsak 250 gram/liter.
Key words: M. testulalis, chickpea, bioinsecticide.
ABSTRAK
Eka Sundari Saragih. 2014. “Uji Efektifitas Insektisida Biologi terhadap Hama Penggerek Polong (Maruca testulalis Geyer.) pada Tanaman Kacang Panjang di Lapangan”. 2014. Di bawah bimbingan Yuswani Pangestiningsih dan Lisnawita. Penelitian ini bertujuan untuk mendapatkan insektisida biologi yang efektif terhadap hama penggerek polong pada tanaman kacang panjang di lapangan. Penelitian menggunakan RAK nonfaktorial yang terdiri dari 8 perlakuan dan 3 ulangan yaitu A0 (kontrol), A1 (larutan daun sirih 100 g/l), A2 (larutan daun sirsak 250 g/l), A3 (larutan akar tuba 50 g/l), A2 (larutan daun pepaya 100 g/l), A5 (Bacillus thuringiensis 1 ml/l), A6 (Beauveria bassiana 10 g/l) dan A7 (klorantraniliprol 1 ml/liter/sebagai pembanding). Hasil penelitian menunjukkan insektisida biologi memberikan pengaruh yang berbeda terhadap semua parameter. insektisida biologi yang efektif untuk menekan persentase polong terserang adalah A2 (0,00%), A4 (3,03 %) dan A7 (0,00 %), insektisida biologi yang yang efektif menekan persentase bunga terserang adalah A1 (12,04 %), A2 (0,00 %), A4 (17,86 %), A5 (16,67 %) dan A7 (0,00 %), insektisida biologi yang efektif menekan jumlah larva M. testulalis adalah A2 (0,00 %) dan A7 (0,00 %) dan insektisida biologi yang efektif terhadap produksi adalah A2 (4,49 kg/plot). Insektisida biologi yang terbaik untuk mengendalikan M. testulalis adalah larutan daun sirsak 250 gram/liter.
RIWAYAT HIDUP
Penulis dilahirkan di Dolok Masihul pada tanggal 12 September 1990, dari
bapak ABD. Roni Saragih dan Ibu Sapariah, anak pertama dari 3 bersaudara.
Pendidikan yang pernah ditempuh penulis adalah lulus dari SD Negeri
106224 Dolok Masihul tahun 2003, tahun 2006 lulus dari SMP Negeri 1 Dolok
Masihul, 2009 lulus dari SMA Negeri 1 Dolok Masihul dan tahun 2009 diterima
di Fakultas Pertanian Universitas Sumatera Utara Medan melalui jalur PMP.
Kegiatan akademis selama perkuliahan yang pernah diikuti penulis :
1. Menjadi anggota HIMAGROTEK tahun 2009-2014
2. Menjadi anggota IMAPTAN tahun 2012-1014
3. Menjadi anggota Komus HPT tahun 2012-2014
4. Menjadi asisten di Laboratorium Penyakit Tumbuhan tahun ajaran 2012-2013
5. Mengikuti praktek kerja lapangan (PKL) di Perkebunan London Sumatera
(Lonsum) di Kabupaten Langkat bulan Juni-Juli 2012.
6. Melaksanakan penelitian di Desa Kerapuh Kabupaten Serdang Bedagai pada
KATA PENGANTAR
Puji dan syukur penulis ucapkan kepada Tuhan Yang Maha Esa karena
atas berkat dan rahmat-Nya lah penulis dapat menyelesaikan skripsi ini tepat pada
waktunya.
Adapun judul skripsi ini adalah Uji Efektifitas Insektisida Biologi terhadap
Hama Penggerek Polong (Maruca testulalis) (Lepidoptera;pyralidae) pada Tanaman Kacang Panjang di Lapangan yang merupakan salah satu syarat untuk
dapat memperoleh gelar sarjana di Fakultas Pertanian Program Studi
Agroekoteknologi Universitas Sumatera Utara Medan.
Penulis tidak lupa mengucapkan terima kasih kepada komisi
pembimbing, yaitu ibu Ir. Yuswani Pangestiningsih, MS selaku Ketua dan
ibu Dr. Lisnawita, SP, M.Si selaku Anggota yang telah banyak memberikan saran
dan arahan sehingga penulis dapat menulis skirpsi ini dengan baik.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Oleh
karena itu, penulis mengharapkan kritik dan saran demi kesempurnaan skripsi ini.
Akhir kata penulis mengucapkan banyak terima kasih. Semoga skripsi ini
dapat bermanfaat bagi pembaca dan pihak yang membutuhkan.
Medan, November 2014
DAFTAR ISI
Insektisida klorantraniliprol ... 15
Pemeliharaan ... 19
Pembuatan Insektisida Nabati ... 19
Larutan sirih ... 19
Larutan daun sirsak ... 19
Larutan daun pepaya ... 20
Larutan akar tuba ... 20
Insektisida B. thuringiensis dan B. bassiana ... 20
Aplikasi penyemprotan ... 20
Parameter pengamatan ... 20
Persentase bunga terserang ... 20
Persentase polong terserang ... 21
Jumlah larva M. testulalis Geyer. ... 21
Produksi ... 22
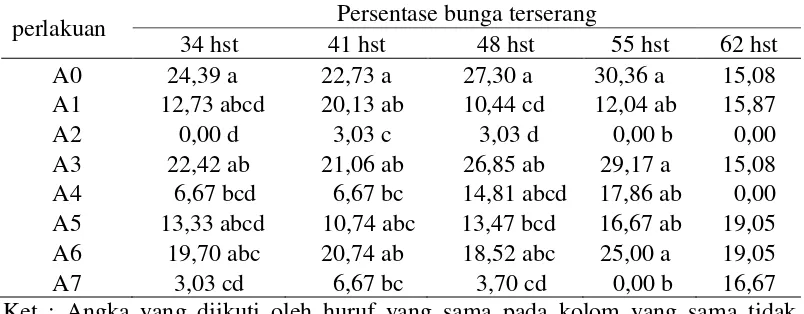
HASIL DAN PEMBAHASAN Persentase bunga terserang ... 23
Persentase polong terserang ... 25
Jumlah larva M. testulalis Geyer... 27
Produksi ... 30
KESIMPULAN DAN SARAN Kesimpulan ... 32
Saran ... 32
DAFTAR PUSTAKA LAMPIRAN
DAFTAR TABEL
NO Judul Halaman
1. Pengaruh insektisida biologi terhadap persentase bunga terserang
M. testulalis pada tanaman kacang panjang ... 23 2. Pengaruh insektisida biologi terhadap persentase polong terserang
M. testulalis pada tanaman kacang panjang. ... 26 3. Pengaruh insektisida biologi terhadap jumlah larva M. testulalis /plot
pada tanaman kacang panjang ... 28
DAFTAR GAMBAR
NO Judul Halaman
1. Larva Maruca testulalis Geyer ... 4
2. Pupa Maruca testulalis Geyer ... 5
3. Imago Maruca testulalis Geyer... 6
4. Gejala serangan pada polong dan bunga ... 6
5. Sirih (Piper bettle) ... 9
6. Akar tuba (Derris eliptca) ... 9
7. Sirsak (Annona muricata) ... 10
DAFTAR LAMPIRAN
No Judul Halaman
1. Bagan Penelitian ... 37
2. Data Persentase bunga terserang 34 hst ... 38
3. Data Persentase bunga terserang 41 hst ... 39
4. Data persentase bunga terserang 48 hst ... 40
5. Data persentase bunga terserang 55 hst ... 42
6. Data persentase bunga terserang 62 hst ... 43
7. Data persentase polong terserang 34 hst ... 45
8. Data persentase polong terserang 41 hst ... 46
9. Data persentase polong terserang 48 hst ... 47
10.Data persentase polong terserang 55 hst ... 48
11.Data persentase polong terserang 62 hst ... 49
12.Data jumlah larva 34 hst ... 51
13.Data jumlah larva 41 hst ... 52
14.Data jumlah larva 48 hst ... 53
15.Data jumlah larva 55 hst ... 54
16.Data jumlah larva 62 hst ... 56
17.Data produksi ... 57
18.Foto penelitian ... 59
ABSTRACT
Eka Sundari Saragih. 2014. “Efectiviness test of bioinsecticide againts the pod borer (Maruca testulalis Geyer.) (Lepidoptera;pyralidae) on Chickpea in the field”. 2014. Under supervised Yuswani Pangestiningsih & Lisnawita. The objective of this research was to get bioinsecticides that efective againts the borer on chickpea in the field. The research used complete block design nonfactorial with eight treatments and three replications. The treatments were A0 (control), A1 (Leaf extract of betelvine 100 g/l), A2 (leaf extract of soursop 250 g/l), A3 (Extract of Derris 50 g/l), A4 (Leaf extract of papaya 100 g/l),A5 (Bacillus thuringiensis 1ml/l), A6 (Beauveria bassiana (10 gr/l) and A7 (klorantraniliprol 1 ml/liter). The result showed that kind of bioinsecticide gave different effect to all of parameters. Bioinsecticides that efective to control the percentage of flower attack were A2 (0.00 %), A4 (3.03 %) and A7 (0.00 %), bioinsecticides that efective to control the percentage of fruit attack were A2 (0.00 %), A4 (17.86 %), A5 (16.67 %) dan A7 (0.00 %), bioinsecticides that efective to control the number of larvae Maruca testulalis were A2 (0.00 %) dan A7 (0.00 %) and bioinsecticides that efective to production was A2 (4.49 kg). The best bioinsecticide to control M. testulalis was leaf extract of sirsak 250 gram/liter.
Key words: M. testulalis, chickpea, bioinsecticide.
ABSTRAK
Eka Sundari Saragih. 2014. “Uji Efektifitas Insektisida Biologi terhadap Hama Penggerek Polong (Maruca testulalis Geyer.) pada Tanaman Kacang Panjang di Lapangan”. 2014. Di bawah bimbingan Yuswani Pangestiningsih dan Lisnawita. Penelitian ini bertujuan untuk mendapatkan insektisida biologi yang efektif terhadap hama penggerek polong pada tanaman kacang panjang di lapangan. Penelitian menggunakan RAK nonfaktorial yang terdiri dari 8 perlakuan dan 3 ulangan yaitu A0 (kontrol), A1 (larutan daun sirih 100 g/l), A2 (larutan daun sirsak 250 g/l), A3 (larutan akar tuba 50 g/l), A2 (larutan daun pepaya 100 g/l), A5 (Bacillus thuringiensis 1 ml/l), A6 (Beauveria bassiana 10 g/l) dan A7 (klorantraniliprol 1 ml/liter/sebagai pembanding). Hasil penelitian menunjukkan insektisida biologi memberikan pengaruh yang berbeda terhadap semua parameter. insektisida biologi yang efektif untuk menekan persentase polong terserang adalah A2 (0,00%), A4 (3,03 %) dan A7 (0,00 %), insektisida biologi yang yang efektif menekan persentase bunga terserang adalah A1 (12,04 %), A2 (0,00 %), A4 (17,86 %), A5 (16,67 %) dan A7 (0,00 %), insektisida biologi yang efektif menekan jumlah larva M. testulalis adalah A2 (0,00 %) dan A7 (0,00 %) dan insektisida biologi yang efektif terhadap produksi adalah A2 (4,49 kg/plot). Insektisida biologi yang terbaik untuk mengendalikan M. testulalis adalah larutan daun sirsak 250 gram/liter.
Kata kunci: M. testulalis, kacang panjang, bioinsektisida.
PENDAHULUAN Latar Belakang
Bertambahnya jumlah penduduk disertai dengan meningkatnya
pendapatan mempengaruhi jumlah konsumsi pangan. Kebutuhan pangan tidak
terbatas hanya pada komoditas pangan seperti beras atau jagung, tetapi juga
sayur-sayuran. Kacang panjang (Vigna sinensis) merupakan jenis sayuran yang banyak diusahakan petani Indonesia serta mengandung banyak vitamin dan protein nabati
(Afiat, 2009).
Kacang panjang adalah tanaman yang telah di kenal sejak lama sebagai
tanaman yang menyehatkan serta tumbuh baik di dataran rendah maupun dataran
tinggi di Asia (Kuswanto et al. 2006). Apabila kontribusi kacang panjang dalam komposisi sayuran mencapai 10%, maka diperlukan sekitar 763.200 ton/tahun
polong segar. Menurut Departemen Pertanian produksi kacang panjang tahun
2000 baru mencapai 313.526 ton polong segar atau sekitar 41% dari total
kebutuhan penduduk, sehingga produksi kacang panjang belum dapat memenuhi
kebutuhan gizi ideal pendudukIndonesia (Kuswanto et al. 2006).
Penurunan produksi kacang panjang dapat disebabkan oleh beberapa
faktor salah satunya adalah serangan hama. Salah satu hama penting pada
tanaman kacang panjang adalah hama penggerek polong (Maruca testulalis) (Sureja et al. 2010).
M. testulalis adalah hama penting pada tanaman kacang-kacangan di daerah tropis dan subtropis. Hama ini mengakibatkan kerusakan karena
menyerang tunas, bunga dan polong. Kerusakan yang disebabkan hama ini
Dewasa ini cara pengendalian hama yang dianjurkan oleh pemerintah
adalah pengendalian hama secara terpadu (PHT), yang bertujuan untuk
memanfaatkan metode-metode yang memenuhi syarat -syarat ekonomi,
toksikologi dan ketentuan lingkungan. Pengendalian hayati, cara bercocok tanam
dan penggunaan varietas yang tahan merupakan teknik pengendalian yang
bekerjanya tidak bertentangan dengan fungsi faktor ekologi alami yakni dengan
memanfaatkan bahan tanaman dan pemanfaatan berupa bakteri, jamur dan virus
sebagai agen pengendali yang bisa disebut sebagai pestisida biologi
(Sostromarsono, 1990).
Penggunaan pestisida dengan dosis besar dan dilakukan secara terus
menerus akan menimbulkan beberapa kerugian, antara lain residu pestisida akan
terakumulasi pada produk-produk pertanian, pencemaran pada lingkungan
pertanian, penurunan produktivitas, keracunan pada hewan, keracunan pada
manusia yang berdampak buruk terhadap kesehatan. Manusia akan
mengalami keracunan baik akut maupun kronis yang berdampak pada kematian
(Runia, 2008).
Berdasarkan literatur di atas pengendalian secara kimia memberikan efek
yang kurang baik baik bagi tanaman, manusia maupun lingkungan. Oleh karena
itu penelitian ini penting dilakukan untuk mencari alternatif pengendali lain yang
lebih ramah lingkungan yaitu menggunakan insektisida biologi.
Tujuan Penelitian
Untuk mendapatkan insektisida biologi yang efektif terhadap hama
Hipotesis Penelitian
1. Insektisida biologi mampu menekan serangan hama penggerek polong pada
tanaman kacang panjang di lapangan.
2. Larutan daun sirsak adalah insektisida yang paling efektif diantara insektisida
biologi yang diuji.
Kegunaan Penelitian
Penelitian ini dapat digunakan sebagai alternatif baru dalam pengendalian
hama penggerek polong pada tanaman kacang panjang yang lebih ramah
TINJAUAN PUSTAKA Maruca testulalis Geyer.
Klasifikasi hama Maruca testulalis Geyer. menurut Borror dan Dwight (1970) adalah sebagai berikut:
Kingdom : Animalia
Kelas : Insecta
Ordo : Lepidoptera
Famili : Pyralidae
Genus : Maruca
Spesies : Maruca testulalis Geyer.
Maruca testulalis meletakkan telur secara berkelompok pada daun, bunga atau polong 2-4 butir/kelompok. Telur berbentuk lonjong agak pipih dan berwarna
putih kekuningan. Stadia telur berlangsung 2- 3 hari (Aldywaridha, 2010). Imago
betina lebih banyak meletakkan telurnya dipermukaan bunga karena tertarik pada
bunga yang berwarna cerah dan permukaan tanaman yang berbulu lebat sebagai
tempat meletakkan telur (Wijayanti dan Zaky, 2009).
Panjang telur ini berkisar 0,015 sampai 0,58 mm dan memiliki lebar 0,15
sampai 0,38 mm. Larva melalui lima instar sebelum memasuki masa pupa
(Sonune et al., 2010).
Larva berwarna hijau terang dengan kepala berwarna coklat gelap, dan
terdapat bintik-bintik coklat pada bagian punggung dan bulu-bulu halus
(Gambar 1). Panjang larva instar terakhir 16 – 18,5 mm. Larva M. testualis terdiri atas lima instar dengan masing-masing instar 2-4 hari. Masa stadia larva
berlangsung 10-15 hari. Pupa berkembang di dalam tanah, berbentuk kokon.
Panjang pupa 13,5 mm, dengan stadia pupa berlangsung 7 – 10 hari
(Aldywaridha, 2010).
Pupa M. testulalis yang baru terbentuk berwarna kehijauan atau kuning pucat kemudian berwarna coklat keabuan (Gambar 2). Pupa terdapat dalam kokon
dan terbungkus oleh benang-benang halus (Wijayanti dan Zaky, 2009).
Gambar 2:Pupa Maruca testulalis Geyer. Sumber:Koleksi pribadi
Imago berupa ngengat berukuran kecil dan sayap depan berwarna coklat
terang atau kuning kemerah-merahan. Terdapat bercak putih ditengah sayap,
sedangkan sayap belakang berwarna putih keabu-abuan dengan tepi berwarna
coklat terang (Gambar 3). Panjang tubuh 11,2 mm dengan rentangan sayap
berukuran 20-28 mm. Masa imago jantan dapat mencapai 12 hari dan betina 22
Gambar 3: Imago Maruca testulalis Geyer. Sumber :
Gejala Serangan
Gejala serangan penggerek polong pada bunga menyebabkan bunga akan
mengalami kerusakan dan berwarna pucat (Gambar 4b). Bunga tidak berproduksi
dengan baik. Polong juga mengalami penurunan produksi. Polong kacang hijau
berlubang dan bebercak kecil berwarna gelap (Parker et al.1995). Maruca testulalis pada stadia muda lebih menyukai bagian bunga dan jumlah larva yang masih hidup lebih banyak menempati bagian bunga dibanding pada bagian daun
dan polong (Aldywaridha, 2010).
(b)
(a)
Maruca testulalis menyerang bagian bunga dan polong. Polong yang diserang akan tampak lubang-lubang bundar kecil dan bijinya habis dimakan
(Gambar 4a). Serangan pada bagian bunga dan polong ini berpengaruh langsung
terhadap kualitas dan kuantitas produksi (Afiat, 2009).
Kerusakan yang paling serius akibat serangan hama M. testulalis pada tanaman kacang panjang adalah dengan cara larva memakan tunas, bunga, daun
muda dan polong muda, terkadang larva juga memakan daun dan batang yang
lembut (Kalshoven, 1981).
Insektisida Biologi
Penggunaan insektisida kimia telah memberikan banyak dampak negatif
bagi lingkungan karena itu diperlukan metode pengendalian lain seperti penerapan
pengendalian hama terpadu (PHT). PHT melibatkan pengendalian secara kimiawi,
biologis, kultur teknis dan penggunaan varietas resisten. Penggunaan insektisida
biologi dapat dijadikan salah satu alternatif dalam menanggulangi organisme
pengganggu tanaman (Dewi, 2007).
Berdasarkan asalnya pestisida biologi dapat dibedakan menjadi dua yakni
pestisida hayati dan pestisida nabati. Pestisida nabati merupakan hasil ekstraksi
bagian tertentu dari tanaman yang senyawa atau metabolit sekundernya memiliki
sifat racun terhadap hama dan penyakit. Pestisida hayati merupakan formulasi
yang mengandung mikroba tertentu baik berupa bakteri, jamur maupun virus yang
bersifat antagonis terhadap organisme pengganggu tanaman (Djunaedy, 2009)
Pestisida nabati dapat berfungsi sebagai : (1) penghambat nafsu makan
perkembangan; (5) menurunkan keperidian; (6) pengaruh langsung sebagai racun
dan (7) mencegah peletakkan telur (Setiawati et al., 2008).
Penggunaan pestisida sintetis yang dinilai praktis untuk mengendalikan
serangan hama, ternyata membawa dampak negatif bagi lingkungan sekitar
bahkan bagi penggunanya sendiri. Namun dibutuhkan suatu alternatif lain yang
tidak berdampak negatif seperti pestisida nabati yang ramah lingkungan. Pestisida
nabati selain ramah lingkungan, pestisida nabati ini merupakan pestisida yang
relatif aman dalam penggunaannya dan ekonomis (Nechiyana et al., 2011).
Kelebihan utama penggunaan insektisida alami adalah mudah teurai atau
terdegradasi secara cepat. Proses penguraiannya dibantu oleh komponen alam,
seperti sinar matahari, udara dan kelembaban. Dengan demikian insektisida alami
yang disemprotkan beberapa hari sebelum panen tidak meninggalkan residu
(Sukrasno, 2003).
Sirih (Piper betle)
Tanaman sirih (Piper betle) di berbagai daerah di Indonesia disebut juga dengan ranub, belo, demban, cambai, sedah, dan suruh, termasuk dalam famili
Piperaceae. Tanaman sirih mengandung minyak atsiri seperti kadinen, kavikol,
sineol, eugenol, karofilen, karvakol, terpinen dan seskuiterpen
(Aldywaridha, 2010).
Sirih merupakan tanaman merambat dan dapat mencapai tinggi 15 m.
Batang sirih berwarna coklat kehijauan, berbentuk bulat, beruas dan merupakan
tempat keluarnya akar. Daun tunggal berbentuk jantung, berujung runcing,
dalam sirih antara lain karoten, tiamin, riboflavin, asam nikotinat, vitamin C,
tanin, gula, pati, dan asam amino. (Setiawati et al., 2008).
Gambar 5: Sirih (Piper betle) Sumber : Koleksi pribadi
Akar Tuba (Derris eliptica)
Akar tuba selama ini dikenal sebagai bahan untuk meracuni ikan di sungai
ternyata juga bersifat toksik pada hama. Akar tuba memiliki senyawa toksis
rotenoid yang dapat mempengarugi enzim respirasi serangga organisme
pengganggu tanaman seperti Spodoptera litura, Crocidolomia binotalis dan nematoda Meloidogyne incognita (Direktorat Bina Tanaman Perkebunan, 1994).
Akar tuba merupakan tumbuhan merambat yang membelit dengan tinggi
kurang lebih 15 meter (Gambar 6). Akar tuba berperan sebagai moluskisida,
insektisida, akarisida, nematisida. Akar tuba bekerja sebagai racun perut dan
kontak, menyebabkan serangga untuk berhenti makan (Setiawati et al., 2008). Akar tuba mengandung senyawa rotenon, deguelin, elipton, toxicarol.
Rotenon adalah racun kontak yang memiliki daya kerja lambat dan mudah
terdegradasi oleh sinar matahari dan udara (Patty, 2011).
Sirsak (Annona muricata)
Sirsak adalah sejenis tanaman berkayu dan dapat hidup menahun.Daging
buah bertekstur empuk dan berwarna putih (Gambar 6). Senyawa yang
terkandung dalam sirsak antara lain senyawa tanin, fitosterol, Ca-oksalat dan
alkaloid murisine. Cara kerjanya bersifat sebagai insektisida, racun kontak,
penolak (repellent) dan penghambat makan (antifeedant). Bagian tanaman yang
digunakan adalah daun dan biji (Setiawati et al., 2008).
Gambar 7: Sirsak (Annona muricata) Sumber : Koleksi pribadi
Daun sirsak diketahui dapat meningkatkan mortalitas hama misalnya
tersebut (Ningsih et al., 2012). Reaksi serangga terhadap senyawa alelokimia tertentu tergantung pada dosisnya. Penghambatan total oleh suatu senyawa anti
makan (feeding detterent atau antifeedant) terjadi pada kisaran dosis efektif tertentu (Hasio, 1985).
Berdasarkan penelitian Ningsih et al. (2013) tanin mempengaruhi pertunbuhan dan perkembangan larva dengan dua cara yaitu rasa sepat tanin dapat
menurunkan tingkat konsumsi pakan serta kemampuan tanin untuk mengikat
protein di intesium yang menyebabkan penurunan daya cerna dan absorbs protein.
Biopestisida daun sirsak juga mengandung tanin dalam kadar tinggi. senyawa
tanin merupakan suatu senyawa yang dapat memblokir ketersediaan protein
dengan membentuk kompleks yang kurang bisa dicerna oleh serangga. Senyawa
tersebut dapat menghambat enzim pada saluran pencernaan sehingga akan
merobek pencernaan serangga dan akhirnya menimbulkan kematian (Pabbage dan
Tenrirawe, 2007).
Insektisida yang berasal dari daun sirsak diketahui dapat mengendalikan
hama rayap dengan perlakuan umpan yang dicampur dengan daun sirsak.
Konsentrasi tertinggi yaitu 6 gram/toples memiliki mortalitas tertinggi pada rayap
Akibat adanya senyawa acetogenin, antara lain asimisin, bulatacin dan squamosin
(Simanjuntak et al., 2007).
Dari hasi penelitian diperoleh bahwa semakin tinggi konsentrasi ekstrak
maka luas daun yang dimakan semakin sedikit. Konsentrasi ekstrak yang terlalu
rendah menyebabkan keberadaan ekstrak tidak dikenali oleh reseptor yang
terdapat pada membran dendrite dari sensila yang mampu mengenali keberadaan
kandungan senyawa alelokimia yang terdapat dalam ekstrak daun sirsak seperti
acetogenin. Pada konsentrasi yang tinggi acetogenin akan bersifat anti makan
pada serangga, sedangkan pada konsentrasi rendah bersifat sebagai racun perut
dan dapat menyebabkan kematian (Ambarningrum et al., 2012).
Daun Pepaya (Carica papaya)
Pepaya (C. papaya) merupakan tumbuhan yang berbatang tegak dan basah. Tinggi pohon pepaya dapat mencapai 8 sampai 10 m. Helaian daunya
menyerupai telapak tangan manusia (Gambar 7). Pepaya dapat digunakan untuk
obat malaria dan menambah nafsu makan. Pepaya juga bersifat sebagai
insektisida, fungisida, dan rodentisida dan juga sebagai zat penolak (repellent).
Pepaya mengandung betakarotene, pectine, d-galaktosa, I-arabinosa, papain,
papayotimin papain, vitokinose, glucodise cacirin, karpain, papain, kemokapain,
lisosim, lipase, glutamin, dan siklotransferase (Setiawati et al., 2008).
Gambar 7: Pepaya (Carica papaya) Sumber : Koleksi pribadi
Daun pepaya mengandung enzim alkaloid karpain, pseudo karpain,
glikosida, karposid, dan saponin. Alkaloid pada daun pepaya dapat berfungsi
Konsentrasi ekstrak daun pepaya 100 g/l air telah mampu mengendalikan
kutu daun Aphis gossypii dengan mortalitas total sebesar 91,99%. Konsentrasi yang mampu untuk mematikan serangga uji pada LC50 adalah 0,33% dan
konsentrasi yang tepat untuk mengendalikan serangga uji pada LC95 adalah 2,70
(Nechiyana et al., 2011).
Bacillus thuringiensis
Seperti halnya pengendalian hayati lainnya (parasitoid dan predator),
pemanfaatan patogen di lapangan dapat dilakukan dengan cara mengintroduksikan
patogen ke dalam populasi hama dengan harapan dapat menekan secara lebih
permanen. Penggunaan patogen B. thuringiensis mempunyai harapan untuk dikembangkan di masa mendatang, karena mudah dan murah serta
pengaplikasiannya yang efektif dan berwawasan lingkungan (Salaki, 2009).
Bacillus thuringiensis menghasilkan kristal protein yang bersifat insektisidal disebut dengan δ-endotoksin. Kristal ini sebenarnya hanya merupakan
protoksin yang jika larut dalam usus serangga akan berubah menjadi polipeptida
yang lebih pendek. Pada umumnya kristal B. thuringiensis di alam bersifat protoksin, karena adanya aktivitas proteolisis dalam sistem pencernaan serangga
dapat mengubah kristal protoksin menjadi polipeptida yang lebih pendek dan
bersifat toksin. Bukti-bukti telah menunjukkan bahwa toksin ini menyebabkan
terbentuknya pori-pori pada sel membran di saluran pencernaan dan mengganggu
keseimbangan osmotik dari sel-sel tersebut. Terganggunya keseimbangan osmotik
ini menyebabkan sel menjadi bengkak dan pecah. Sel yang telah pecah akan
Viabilitas entomopatogen dipengaruhi oleh beberapa faktor seperti suhu,
kelembapan, pH, radiasi sinar matahari, nutrisi dan zat kimia seperti pestisida.
Semakin tinggi viabilitas jamur entomopatogen semakin efektif dalam
mengendalikan hama (Susanto, 2007).
Bacillus thuringiensis merupakan bakteri gram-positif berbentuk batang. Jika nutrien di mana dia hidup sangat kaya, maka bakteri ini hanya tumbuh pada
fase vegetatif, namun bila suplai makanannya menurun maka akan membentuk
spora dorman yang mengandung satu atau lebih jenis kristal protein. Kristal ini
mengandung protein yang bersifat lethal jika dimakan oleh serangga yang peka
(Bahagiawati, 2002).
Beauveria bassiana
Salah satu teknik pengendalian yang berprinsip ramah lingkungan adalah
pemanfaatan agens hayati seperti jamur entomopatogenik Beauveria bassiana. Jamur ini bersifat saprofit dan parasit pada serangga, keberadaan jamur ini tidak
mengganggu ekosistem dalam tanaman budidaya. Sekarang teknik pengendalian
ini lebih dikenal dengan istilah pengendalian menggunakan bio-insektisida
(BBP2TP, 2013).
Beauveria bassiana diaplikasikan dalam bentuk konidia yang dapat menginfeksi serangga melalui kulit kutikula, mulut, dan ruas-ruas yang terdapat
pada tubuh serangga. Jamur ini juga memiliki spektrum yang luas dan dapat
mengendalikan banyak spesies serangga sebagai hama tanaman (Susanto, 2007).
konidia sehingga cendawan kehabisan cadangan nutrisi. Pada bioinsektisida ini
kerapatan konidia dan viabilitas konidia juga akan menurun (Thalib et al., 2012).
Insektisida kimia klorantraniliprol
Berdasarkan penelitian yang dilakukan di Desa Dolat Rakyat Kabupaten
Karo insektisida sangat penting bagi petani. Berdasarkan hasil wawancara, petani
menggunakan insektisida sejak pertama sekali petani bertani. Petani mendapatkan
pengetahuan mengenai insektisida dan penggunaan insektisida melalui tetangga
atau masyararakat sekitar. Mereka menganggap bahwa insektisida merupakan
bahan kimia atau racun yang digunakan untuk membasmi dan mengendalikan
serangga penggangu (Maruli et al., 2012).
Klorantraniliprol mempunyai nama kimia 3- bromo - N- [4 - kloro- 2– metil - 6 - [(metilamino) karbonilfenil ]- 1- (3 – kloro - 2- piridinil - 1 H – pirazo
l – 5- karboksamida. Insektisida tersebut termasuk golongan senyawa antranilik
diamida yang bersifat racun perut dan racun kontak (Djojosumarto,2008).
Salah satu formulasi insektisida berbahan aktif klorantraniliprol yang
terdaftar di Indonesia adalah Prevathon 50 SC. Insektisida tersebut terdaftar untuk
mengendalikan hama S. exigua pada bawang merah; S. litura pada cabai;
M. testulalis dan L. huidobrensis pada kacang panjang; Conopomorpha cramerella pada kakao; S. litura pada kedelai; Metisa plana, C. curvignathus, dan
Setora nitens pada kelapa sawit; Phthorimaea opercutella dan L. huidobrensis
pada kentang; P. xylostella dan C. pavonana pada kubis; Scirpophaga incertulas
dan Cnaphalocrosis medinalis pada padi; S. excerptalis pada tebu; S. litura,
Heliothis assulta, dan Helicoverpa armigera pada tembakau; dan H. armigera
BAHAN DAN METODE Tempat dan Waktu Penelitian
Percobaan ini dilakukan di Desa Kerapuh Kecamatan Dolok Masihul
Kabupaten Serdang Bedagai. Penelitian ini dilaksanakan pada bulan
November 2013 sampai dengan Januari 2014.
Bahan dan Alat
Bahan yang digunakan adalah benih kacang panjang (Parade),
daun sirih, daun sirsak, akar tuba, daun pepaya, B. thuringiensis (Bite) di peroleh dari toko insektisida, B. bassiana (Beauverin) di peroleh dari balai penelitian Perkebunan dan Proteksi Tanaman Sumatera Utara Medan, insektisida kimia
dengan bahan aktif klorantraniliprol (Prevathon 50 SC), air dan pupuk.
Alat yang digunakan adalah meteran,cangkul, beaker glass, saringan,
gembor, mesin gilingan, pacak, timbangan, label, plank nama, papan sampel,
buku data, alat tulis dan kamera.
Metode Penelitian
Adapun metode yang digunakan adalah Rancangan Acak Kelompok
(RAK) non faktorial dengan perlakuan adalah :
A0 = Tanaman kacang panjang tanpa perlakuan
A1 = Larutan daun sirih 100 gram/liter
A2 = Larutan daun sirsak 250 gram/liter
A3 = Larutan akar tuba 50 gram/liter
A4 = Larutan daun pepaya 100 gram/liter
A7 = Insektisida kimia berbahan aktif klorantraniliprol 1 ml/liter
Dimana rumus mencari ulangan rancangan acak kelompok adalah sebagai berikut:
(t-1)(r-1) ≥ 15
(8-1)(r-1) ≥ 15
8r-8 ≥ 15
8r ≥ 23
r ≥ 23/8 = 2,875
r = 3
Dari hasil penelitian dianalisis dengan menggunakan sidik ragam
berdasarkan model linear sebagai berikut:
Yijk : µ + �i + βj +Eij
Dimana:
Yij : Respon atau nilai pengamatan dari blok ke-i dan ulangan ke-j
µ : Nilai tengah umun
�i : Pengaruh perlakuan ke-i
βj : Pengaruh blok ke-j
Eij : Pengaruh galat dari perlakuan ke-i dan ulangan ke-j
Terhadap faktor yang berpengaruh nyata dilakukan rataan perlakuan
dengan uji Duncan.
Ulangan dilakukan = 3 kali
Jumlah plot = 24
Ukuran plot/ petak percobaan = 2 x2 m
Luas lahan = 8,5 m x 21,5 m
Lebar parit keliling = 75 cm
Jarak tanam kacang panjang = 30 x 35 cm
Jumlah populasi kacang panjang/plot = 36/plot
Jumlah tanaman seluruhnya = 864 tanaman
Jumlah tanaman sampel/pengamatan = 2 tanaman/plot
Total tanaman sampel/5 kali pengamatan = 10 tanaman/plot
Jumlah sampel produksi/5kali pengamatan = 6 tanaman/plot
Jumlah tanaman sampel/plot = 16 tanaman/plot
Jumlah tanaman sampel seluruhnya = 384 tanaman
Pelaksanaan Penelitian Persiapan lahan
Pengolahan lahan dimulai dengan membersihkan lahan dari gulma dengan
menggunakan cangkul. Kemudian dilakukan penggemburan dengan membolak
balikkan tanah. Setelah itu dibuat petakan sebagai plot dengan ukuran 2 m x 2m
dengan jarak antar plot 50 cm. Jumlah plot sebanyak 24 plot dan terdiri dari 3
ulangan.
Penanaman benih
Penanaman benih dimulai dengan membuat lubang tanam dengan jarak
tanam 30 x 35 cm. Penanaman dilakukan dengan menanam dua benih perlubang
tanam.
Pemupukan
Satu minggu sebelum tanam tiap lubang diberi pupuk kandang sebanyak
250 g/lubang. Pemupukan menggunakan pupuk Urea, TSP, dan KCl sebanyak
dan pada saat tanaman setelah berumur tiga minggu sedangkan TSP dan KCl
diberikan pada saat penanaman saja (Aldywaridha, 2010).
Penjarangan
Penjarangan dilakukan saat benih telah tumbuh dengan membuang atau
memotong tanaman yang kurang baik pertumbuhannya dan meninggalkan satu
tanaman perlubang tanam.
Pemasangan turus
Pemasangan turus dilakukan setelah tanaman berumur 2 minggu atau
mencapai tinggi 25 cm . Jarak antara turus dan tanaman sekitar 10 cm.
Pemeliharaan
Penyiangan dilakukan paling sedikit dua kali yakni pada saat tanaman
berumur 14 hari setelah tanam dan 40 hari setelah tanam dengan cara
membersihkan sekitar tanaman menggunakan sabit.
Pembuatan Insektisida Biologi
- Larutan Sirih
Daun sirih dikumpulkan sebanyak mungkin, kemudian dicuci hingga
bersih dari kotoran-kotoran. Daun ditimbang sebanyak 100 gram diblender
dengan air sebanyak 1 liter, kemudian disaring dengan menggunakan kertas saring
(Aldywaridha, 2010).
- Larutan daun Sirsak
Daun sirsak ditimbang sebanyak 250 gram kemudian ditumbuk sampai
halus dan ditambah 1 liter air didiamkan selama 24 jam kemudian disaring
- Larutan Daun Pepaya
Daun pepaya dihancurkan menggunakan blender dan ditimbang sebanyak
100 gram dan ditambah 1 liter air kemudian di saring (Nechiyana et al., 2011). - Larutan Akar tuba
Hancurkan 50 gram akar tuba ditambah 1 liter air kemudian didiamkan
selam 3 hari kemudian disaring (Setiawati et al., 2008). - Insektisida B. thuringiensis dan B. bassiana
Ditakar 1 ml B. thuringiensis lalu tambah 1 liter air. Ditimbang 10 gram
B. bassiana lalu tambah 1 liter air.
Aplikasi penyemprotan
Aplikasi insektisida dilakukan dengan penyemprotan ke tanaman dengan
menggunakan hand sprayer/knapsack hingga tanaman sampel basah. Interval
aplikasi larutan 7 hari sekali. Aplikasi masing-masing insektisida dimulai pada
saat tanaman berumur 28 hst hingga 56 hst. Penyemprotan dilakukan pada sore
hari.
Parameter pengamatan
1. Persentase bunga terserang
Pengamatan dilakukan dengan mengutip bunga pada tanaman sampel
kemudian dilihat gejala serangan dengan melihat isi kelopak bunga. Bunga yang
terserang ditandai dengan warna bunga pucat, terdapat lubang-lubang pada
helaian kelopak bunga, terdapat kotoran larva atau terdapat larva di dalamnya.
Pengamatan dilakukan mulai 5 minggu setelah tanam (mst) yang dilakukan sekali
seminggu sebanyak lima kali pengamatan dan dihitung dengan mengunakan
P = x 100%
P = Persentase bunga terserang ( % )
N = a + b
a = Jumlah buga yang terserang/plot
b = Jumlah bunga yang diamati/plot
(Sastrosiswojo et al. 1993 dalam Tobing et al., 2011).
2. Persentase polong terserang
Pengamatan dilakukan mulai 5 minggu setelah tanam (mst) yang dilakukan
sekali seminggu sebanyak lima kali pengamatan dengan mengutip polong yang
terdapat pada tanaman sampel kemudian melihat bagian polong yang terserang
ditandai dengan adanya bekas gerekan larva berupa lubang-lubang hitam di
permukan polong. Dan dihitung dengan mengunakan rumus sebagai berikut :
P = x 100%
P = Persentase polong terserang ( % )
N = a + b
a = Jumlah polong yang terserang/plot
b = Jumlah polong yang diamati/plot
(Sastrosiswojo et al. 1993 dalam Tobing et al., 2011).
3. Jumlah larva Maruca testulalis Geyer.
Pengamatan dilakukan sekali seminggu mulai 5 minggu setelah tanam
(mst) dilakukan sekali seminggu sebanyak lima kali pengamatan. Pengambilan
sampel menggunakan sampel random sederhana yaitu sampel diambil secara acak
(Nazir, 1983). Sampel yang diamati berupa polong dan bunganya. Bunga dan
a N
polong yang ada pada tanaman sampel dibelah untuk melihat larva kemudian
dicatat jumlah larva yang ditemukan.
4. Produksi
Hasil produksi diperoleh dengan cara menimbang bobot atau hasil panen
setiap plot perlakuan kemudian dirata-ratakan untuk memperoleh hasil produksi
perplot. Hasil rataan produksi perplot kemudian dikonversikan dalam satuan
ton/ha dengan menggunakan rumus:
Y = x
Dimana:
Y = Produksi (ton/ha)
X = Produksi (kg)
L = Luas plot (m2)
(Sudarsono dan Sujarman, 1981)
X L
HASIL DAN PEMBAHASAN 1. Persentase bunga terserang
Dari analisis sidik ragam persentase bunga terserang didapat pada 34, 41,
48 dan 55 hst berpengaruh nyata sedangkan pada 62 hst tidak berpengaruh nyata
(Tabel 1; Lampiran 2-6).
Tabel 1. Pengaruh insektisida biologi terhadap persentase bunga terserang
M. testulalis pada tanaman kacang panjang.
perlakuan Persentase bunga terserang
34 hst 41 hst 48 hst 55 hst 62 hst Ket : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak
berbeda nyata pada taraf 5% menurut uji jarak Duncan.
A0: kontrol, A1: daun sirih, A2: daun sirsak, A3: akar tuba, A4: daun pepaya, A5: B. thuringiensis, A6: B. bassiana, A7: Klorantraniliprol. Dari Tabel 1 terihat pada pengamatan 34 hst – 55 hst terjadi perbedaan
yang nyata antar perlakuan. Data ini menunjukkan insektisida biologi mampu
menekan serangan hama M. testulalis. Hal ini disebabkan insektisida yang diaplikasikan ke tubuh larva mengandung senyawa toksik. Senyawa toksik
tersebut akan terdistribusi ke seluruh sel-sel tubuh melalui sistem peredaran darah
serangga (haemolimfa) dan menyebabkan kematian. Mekanisme membunuh M. testulalis ini berbeda-beda tergantung jenis senyawa aktif yang terkandung dalam insektisida.
Pengamatan 34 dan 41 hst menunjukkan perlakuan A2 (daun sirsak) tidak
48 hst perlakuan A2 (daun sirsak) tidak berbeda nyata dengan
A5 (B. thuringiensis) dan A7 (klorantraniliprol). Sedangkan pada pengamtan 55 hst perlakuan A2 (daun sirsak) tidak berbeda nyata dengan A7 (klorantraniliprol).
Data ini menunjukkan daun sirsak, daun pepaya, B. thuringiensis dan korantraniliprol efektif mengendalikan M. testulalis. Kandungan senyawa squamosin dan asimisin yang terkandung dalam daun sirsak serta senyawa
alkaloid dalam daun pepaya efektif mengendalikan M. testulalis. Pada entomopatogen B. thuringiensis menghasilkan kristal protein bersifat insektisidal yang dapat mengganggu keseimbangan osmotik sel pada larva. Sedangkan
insektisida kimia klorantraniliprol efektif mengendalikan M. tetuslalis karena bersifat sebagai racun perut dan racun kontak. Hal ini sejalan dengan Ningsih et al. (2012) daun sirsak diketahui dapat meningkatkan mortalitas hama karena memiliki senyawa squamosin dan asimisin. Kurnia et al. (2012) menyatakan daun pepaya mengandung alkaloid karpain, pseudo karpain, glikosid dan saponin.
Hofte dan Whiteley (1989) meyatakan B. thuringiensis mengandung kristal protein bersifat protoksin yang jika larut dalam pencernaan serangga akan menjadi
polipeptida pendek yang bersifat toksin. Djojosumarto (2008) yang menyatakan
insektisida klorantraniliprol masuk ke dalam senyawa antranilik diamida yang
bersifat sebagai racun perut dan racun kontak.
Dari pengamatan pertama (34 hst) pada perlakuan daun sirsak (A2) tidak
menunjukkan adanya serangan M. testulalis dengan perentase bunga terserang 0,00 % kemudian serangan meningkat pada pengamatan 41 dan 48 hst menjadi
3,03 % dan kembali turun hingga akhir pengamatan (62 hst) menjadi 0,00 %.
nyata dengan klorantraniliprol (A7) namun persentasenya lebih rendah dibanding
perlakuan insektisida kimia klorantraniliprol (A7). Hal ini menunjukkan daun
sirsak dapat digunakan sebagai alternatif pegganti insektisida pengendali hama M. testulalis yang memiliki kelebihan diantaranya lebih ramah lingkungan dibanding insektisida kimia. Seperti kita ketahui insektisida kimia mengakibatkan dampak
negatif baik terhadap perkembangan hama, hewan, manusia dan lingkungan.
Runia (2008) yang menyatakan penggunaan insektisida kimia menyebabkan
kerugian antara lain residu pestisida akan terakumulasi pada produk-produk
pertanian, pencemaran pada lingkungan, penurunan produktivitas, dan keracunan
pada hewan dan manusia
2. Persentase polong terserang
Dari hasil analisis sidik ragam pengaruh insektisida biologi terhadap
persentase polong terserang pada 34 hst, 41 hst, 48 hst dan 62 hst tidak
berpengaruh nyata. Hanya pada 55 hst terdapat pengaruh yang nyata (Tabel 2;
Lampiran 7-11). Hal ini dapat di sebabkan persentase serangan 34, 41, 48 dan 62
hst masih sangat kecil yaitu 0,00 %-13,40 % sedangkan persentase serangan pada
55 hst mencapai 19,83%. Rendahnya serangan dapat disebabkan polong yang
terbentuk masih sedikit atau larva lebih banyak menyerang bagian bunga daripada
polong.
Dari tabel 2 pengamatan 55 hst terlihat insektisida biologi yang paling
efektif adalah daun sirsak (A2) (0,00 %) tidak berbeda nyata dengan daun pepaya
(A4) (3,03 %) dan Klorantraniliprol (A7) (0,00 %). Selain squamosin dan asimisin
daun sirsak juga mengandung tanin yang dapat memblokir ketersediaan protein
penolak (repellent) dapat menekan serangan M. testulalis.Pabbage dan Tenrirawe (2007) mengatakan daun sirsak mengandung tanin yang dapat memblokir
ketersediaan protein dengan membentuk suatu senyawa yang dapat menghambat
enzim pada saluran pencernaan sehingga akan merobek pencernaan serangga dan
menimbulkan kematian. Setiawati et al. (2008) menyatakan pepaya bersifat sebagai insektisida, rodentisida dan zat penolak (reppelent).
Tabel 2. Pengaruh insektisida biologi terhadap persentase polong terserang
M. testulalis Geyer. pada tanaman kacang panjang.
Perlakuan Persentase polong terserang
34 hst 41 hst 48 hst 55 hst 62 hst Ket : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak
berbeda nyata pada taraf 5% menurut uji jarak Duncan.
A0:kontrol, A1:daun sirih, A2:daun sirsak,A3:akar tuba, A4:daun pepaya, A5: B. thuringiensis, A6: B. bassiana, A7: Klorantraniliprol.
Perlakuan A3 (akar tuba 50 g/l) dan A6 (B. bassiana 10 g/l) tidak berbeda nyata dengan A0 (kontrol). Hal ini menunjukkan bahwa penggunaan akar tuba
dan B. bassiana kurang efektif untuk mengendalikan hama M. testulalis. Hal ini disebabkan akar tuba mengandung rotenon dan bersifat sebagai racun kontak yang
memiliki daya kerja lambat dan mudah terdegradasi. Sedangkan kemampuan
B. bassiana untuk mengendalikan M. testulalis telah menurun terlihat dari persentase serangan yang cukup tinggi. Penurunan ini dapat disebabkan oleh
(2011) menyatakan akar tuba mengandung rotenon yang memiliki daya kerja
lambat dan mudah terdegradasi oleh sinar matahari dan udara. Thalib et al. (2012) menyatakan virulensi bioinsektisida B. bassiana yang disimpan lebih dari 2 bulan akan menurun karena nutrisi dalam media banyak digunakan untuk memproduksi
konidia sehingga cendawan kehabisan cadangan nutrisi.
Dilihat dari Tabel 1 dan 2 persentase bunga terserang lebih tinggi
dibanding persentase polong terserang. Hal ini membuktikan larva lebih banyak
ditemukan pada bunga sehingga persentase serangannya lebih tinggi daripada
persentase serangan pada polong. Aldywaridha (2010) menyatakan larva
M. testulalis pada stadia muda lebih menyukai bagian bunga dan jumlah larva yang masih hidup lebih banyak menempati bagian bunga dibanding pada bagian
daun dan polong.
Larva lebih banyak yang ditemukan pada bunga disebabkan imago
M. testulalis Geyer lebih suka melakukan peletakan telur dipermukaan bunga karena warnanya lebih mencolok sehingga larva muda banyak ditemukan pada
bunga biarpun imago juga meletakkan telur di daun, tunas muda dan polong. Hal
ini sesuai dengan pernyataan Wijayanti et al. (2009) yang menyatakan imago betina lebih banyak meletakkan telurnya dipermukaan bunga karena tertarik pada
bunga yang berwarna cerah dan permukaan tanaman yang berbulu lebat sebagai
tempat meletakkan telur.
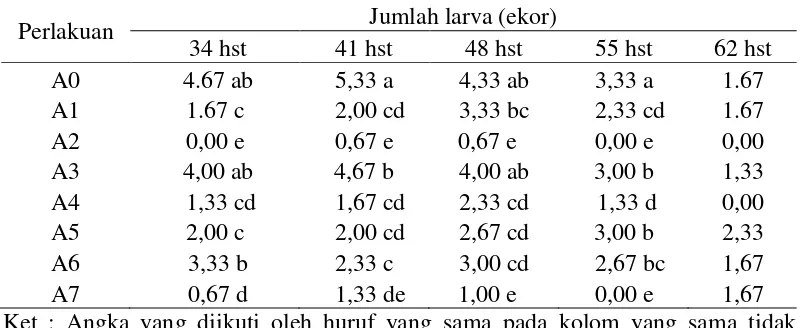
3. Jumlah Larva
Dari hasil sidik ragam parameter jumlah larva didapat pada 34, 41, 48 dan
55 hst berpengaruh nyata sedangkan pada 62 hst tidak berpengaruh nyata
Tabel 3. Pengaruh insektisida biologi terhadap jumlah larva plot M. testulalis /plot pada tanaman kacang panjang.
Perlakuan Jumlah larva (ekor)
34 hst 41 hst 48 hst 55 hst 62 hst Ket : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak
berbeda nyata pada taraf 5% menurut uji jarak Duncan.
A0: kontrol, A1: daun sirih, A2: daun sirsak, A3: akar tuba, A4: daun pepaya, A5: B. thuringiensis, A6: B. bassiana, A7: Klorantraniliprol. Pada pengamatan 34 hst perlakuan A2 (daun sirsak) berbeda nyata terhadap
seluruh perlakuan. Sedangkan pada pengamatan 41 dan 48 hst perlakuan A2 (daun
sirsak) tidak berbeda nyata dengan A7 (klorantraniliprol) dan berbeda nyata
dengan perakuan lainnya (A0, A1, A3, A4, A5 dan A6). Dari data ini
menunjukkan daun sirsak efektif mengurangi populasi larva M. testulalis. Hal ini disebabkan senyawa alelokimia yang terkandung dalam daun sirsak mampu
mempengaruhi pertumbuhan dan perkembangan larva karena bersifat sebagai
racun kontak, repellent dan antifeedant. Hal ini sesuai dengan pernyataan
Setiawati et al. (2008) larutan daun sirsak bersifat sebagai insektisida, racun kontak, penolak (repellent) dan penghambat makan (antifeedant).
Pada pengamatan 55 hst semua perlakuan berbeda nyata dengan kontrol.
Hal ini menunjukkan semua jenis insektisida mampu mengurangi jumlah larva
M. testulalis. Perlakuan yang paling efektif adalah A2 (daun sirsak 250 g/l) tidak berbeda nyata dengan A7 (klorantraniliprol) dengan rataan jumlah larva 0,00.
berbeda nyata dengan A5 (B. thuringiensis 1 ml/l) (3,00) dan A6 (B. bassiana 10 gram/l) (2,67). Hal ini dapat disebabkan karena konsentrasi yang digunakan pada
perlakuan daun sirsak paling tinggi sedangkan konsentrasi yang digunakan pada
akar tuba paling rendah diantara pestisida nabati lainnya. Semakin tinggi
konsentrasi yang digunakan pada pestisida nabati maka senyawa toksik di dalam
bahan insektisida juga semakin tinggi. Sebaliknya konsentrasi yang terlalu rendah
menyebabkan senyawa toksik yang terkandung dalam insektisida tidak dapat
dikenali hama sehingga efektifitasnya menjadi rendah. Sedangkan keefektifan dari
entomopatogen B. thuringiensis dan B. bassiana telah menurun sehingga kematian larva M. testulalis rendah. Penurunan ini dapat dipengaruhi oleh faktor eksternal seperti suhu, kelembaban dan cahaya matahari. Ningsih et al. (2010) menyatakan semakin tinggi konsentrasi senyawa bahan biopestisida maka
semakin tinggi pula mortalitas hama. Dari hasil penelitian Ambarningrum et al.
(2012) konsentrasi ekstrak yang terlalu rendah menyebabkan keberadaan ekstrak
tidak dikenali oleh reseptor yang terdapat pada membran dendrite dari sensila
yang mampu mengenali keberadaan senyawa di dalamya. Susanto (2007)
menyatakan viabilitas entomopatogen dipengaruhi oleh beberapa faktor seperti
suhu, kelembapan, pH, radiasi sinar matahari, nutrisi dan zat kimia seperti
pestisida.
Insektisida nabati larutan daun sirsak ternyata mampu menekan polulasi
larva selain penggunaan insektisida kimia klorantraniliprol. Insektisida nabati
dapat dimanfaatkan sebagai insektisida pengendali hama karena memiliki banyak
kelebihan diantaranya mudah diperoleh, murah dan ramah lingkungan. Nechiyana
aman dalam penggunaannya dan ekonomis. Serta menurut Sukrasno (2003)
kelebihan utama penggunaan insektisida alami adalah mudah terurai atau atau
tergradasi secara cepat.
4. Produksi
Berdasarkan hasil sidik ragam pengaruh insektisida biologi terhadap
produksi berpengaruh sangat nyata terhadap produksi (lampiran 17). Data
selengkapnya dapat dilihat pada Tabel 4.
Tabel 4. Pengaruh insektisida biologi terhadap produksi polong/plot Perlakuan Produksi
Ket : Angka yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf 5% menurut uji jarak Duncan.
A0:kontrol, A1:daun sirih, A2:daun sirsak,A3:akar tuba, A4:daun pepaya, A5: B. thuringiensis, A6: B. bassiana, A7: Klorantraniliprol
Dari tabel 4 dilihat bahwa perlakuan yang paling efektif terhadap produksi
terdapat pada perlakuan A2 yaitu sebesar 4,49 kg/plot tidak berbeda nyata
terhadap A7 (klorantraniliprol) yaitu 4,09 kg/plot. Tingginya produksi ini sejalan
dengan persentase serangan bunga, polong dan jumlah larva yang rendah.
Semakin rendah persentase serangan maka produksi semakin tinggi. Hal ini
disebabkan larva yang menyerang pada bunga akan mengganggu penyerbukan
bahkan menyebabkan bunga menjadi gugur. Sementara itu larva yang menyerang
gerekan larva. Hal ini sesuai dengan literatur dari Parker et al. (1995) yang menyatakan gejala serangan penggerek polong pada bunga menyebabkan bunga
akan mengalami kerusakan, bunga tidak berproduksi dengan baik dan polong juga
mengalami penurunan produksi. Polong berlubang dan bebercak kecil berwarna
gelap.
Perlakuan A3 tidak berbeda nyata terhadap A1 (daun sirih), A4 (daun
pepaya), A5 (B. thuringiensis) dan A6 (B. bassiana). Perlakuan A3 menunjukkan perlakuan yang kurang efektif terhadap produksi karena memiliki produksi paling
rendah dari seluruh perlakuan. Rendahnya produksi ini bisa disebabkan
konsentrasi yang digunakan pada perlakuan A3 lebih sedikit daripada perlakuan
nabati lainya, sehingga senyawa toksik di dalamnya kurang mampu membunuh
hama apalagi senyawa rotenon yang terdapat di dalam akar tuba bekerja lambat
dan mudah terdegradasi oleh sinar matahari. Akibatnya jumlah larva cukup tinggi
dan menyebabkan perentase serangan meningkat dan menghasilkan produksi
cukup rendah.
Perlakuan larutan A2 (daun sirsak) mampu melebihi produksi A7
(klorantraniliprol). Hal ini kembali membuktikan bahwa insektisida nabati dapat
dipertimbangkan sebagai alternatif insektisida pengendali hama selain insektisida
kimia. Dimana kita ketahui penggunaan insektisida kimia telah memberikan
dampak negatif terutama bagi lingkungan oleh karena itu dperlukan bahan
pembasmi hama lain yang tidak berbahaya bagi lingkungan, tidak berpengaruh
terhadap fotosintesis pertumbuhan ataupun aspek fisiologis tanaman lainnya dan
aman bagi manusia salah satunya dengan menggunakan pestisida yang berasal
KESIMPULAN DAN SARAN Kesimpulan
1. Larutan daun sirsak adalah insektisida yang paling efektif untuk
mengendalikan M. testulalis Geyer.
2. Persentase bunga terserang lebih tinggi daripada persentase polong terserang.
3. Produksi tertinggi terdapat pada perlakuan daun sirsak yaitu 4,49 kg/ton
disusul dengan klorantraniliprol 4,09 kg/plot, daun sirih 2,93 kg/plot, B. thuringiensis 2,89 kg/plot, daun pepaya 2,79 kg/plot, B. bassiana 2,78 kg/plot, akar tuba 2,44 kg/plot dan kontrol 2,22 kg/plot.
Saran
Sebaiknya petani mengurangi penggunaan insektisida kimia dan beralih
menggunakan insektisida yang lebih alami dan aman bagi lingkungan seperti
DAFTAR PUSTAKA
Afiat M. 2009. Pengaruh Tanaman Penutup Tanah terhadap Serangan Penggerek Polong Maruca vitrata (F) (Lepidoptera;Pyralidae) serta Hasil Panen pada Pertanaman Kacang Panjang. Institut Pertanian Bogor, Bogor. Skripsi.
Aldywaridha. 2010. Uji Efektifitas Insektisida Botani terhadap Hama
Maruca testulalis (Geyer) (Lepidoptera;Pyralidae) pada Tanaman Kacang Panjang (Vigna sinensis). Universitas Islam Sumatera Utara, Medan. Vol.3 No.2 ISSN : 1979 – 5408.
Ambarningrum T B E A Setiyowati & P Susatyo. 2012. Aktivitas Anti Makan Ekstrak Daun Sirsak (Annona Muricata L.) dan Pengaruhnya terhadap Indeks Nutrisi serta Terhadap Struktur Membran Peritrofik Larva Instar
V Spodoptera Litura F. Universitas Jenderal Soedirman, Purwokerto. J. HPT Tropika. ISSN 1411-7525Vol. 12. No. 2: 169 – 176.
Baghwat V R T G Shanower & M A Ghaffar. 1998. Ovipotional Preference of
Maruca (testulalis) vitrata (Geyer) (Lepidoptera:Pyralidae) in- Short duration of Pigeonpea. International Crops Research for Semi-Arid Tropics (ICRSAT). Paradesh, India.
Bahagiawati. 2002. Penggunaan Bacillus thuringiensis sebagai Bioinsektisida. Balai Penelitian Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor. Buletin Agrobio 5(1): 21- 28.
BB2TP. 2013. Teknik yang Tepat Menentukan Keberhasilan Bio-Insektisida Dalam Pengendalian Pbko (Penggerek Buah Kopi). Ambon.
Dewi I R. 2007. Prospek Insektisida yang berasal dari Tumbuhan untuk Menanggulangi Organisme Pengganggu Tanaman. Program Pasca SarjanaUniversitas Padjadjaran. Bandung. Tesis.
Direktorat Bina Perlindungan Tanaman Perkebunan. 1994. Pedoman Pengenalan Pestisida Botani. Direktorat Jendral Tanaman Perkebunan, Departemen Pertanian jakarta. 85 hlm.
Djojosumarto P. 2008. Pestisida dan Aplikasinya. PT. Agromedia Pustaka. Jakarta.
Djunaedy A. 2009. Biopestisida sebagai Pengendali Organisme Pengganggu
Hasio T H. 1985. Feeding behavior. Comprehensive Insect Physiology Biochemistry and Pharmacology. Pergamon Press, Oxford.
Hofte H & H R Whiteley. 1989. Insecticidal Crystal Proteins of Bacillus thuringiensis. Microbiol. Rev. 53:42-255.
Kalshoven L G E.1981. Pest of Crop in Indonesia. Revised and Translate by P. A. V. D. Laan. PT Ichtiar Baru Van Heve. Jakarta.
Kurnia S I Kismiayati & Kusnoto. 2012. Lama Perendaman Ikan Komet (Cassius auratusauratus) dalam Perasan Daun Pepaya (Carica papaya) sebagai Pengendali Argullus Control, Universitas Airlangga. Skripsi.
Kuswanto N E Basuki & Rejeki. 2006. Uji Adaptasi Kacang panjang (Vigna sesquopedalis L. Friwith) Galur UNIBRAW. Universitas
Brawijaya Gresik. Vol. XVIII (2): 103-117.
Maruli A D N., Santi & E Naria. 2012. Analisa Kadar Residu Insektisida Golongan Organofosfat pada Kubis (Brassica oleracea) setelah Pencucian dan Pemasakan di Desa Dolat Rakyat Kabupaten Karo Tahun 2012. Universitas Sumatera Utara, Medan. Skripsi.
Nazir M. 1983. Metode Penelitian, Bogor: Ghalia Indonesia.
Nechiyana A Sutiko & D Salbiah. 2011. Penggunaan Ekstrak Daun Pepaya
(Carica papaya L.) untuk Mengendalikan Hama Kutu Daun (Aphis gossypi Glover.) pada Tanaman cabai (Capsicum annum L.).
Universitas Riau. Riau. Skripsi.
Ningsih D H Sucipto & C Wasonowati. 2012. Efektifitas Daun Sirsak (Annona muricta L) Sebagai Biopestisida Terhadap Hama Thrips pada Tanaman Kacang Hijau (Vigna radiata L). Fakultas Trunojoyo, Madura.
Pabbage dan Tenrirawe. 2007. Pengendalian Penggerek Batang Jagung (Ostrinia furnacalis G.) dengan Ekstrak Daun Sirsak (Annona muricata L.). Prosiding Seminar Ilmiah dan Pertemuan Tahunan PEI dan PFI VXIII Komda Sul-Sel 2007.
Parker B L N S Talekar & M Skinner. 1995. Bean Pod Borer. Insect Pest of Seected Vegetables in Tropical and Subtropical Asia.
Patty J A. 2011. Pengujian Beberapa Jenis Insektisida Nabati terhadap Kumbang Sitophylus Oryzae L pada Beras. Universitas Pattimura, Ambon. Jurnal Agroforestri Volume VI Nomor 1.
Di Desa Tejosari Kecamatan Ngablak Kabupaten Magelang. Universitas Diponegoro Semarang, Semarang. Skripsi.
Salaki C L. 2009. Eksplorasi Isolat Bacillus Thuringiensis Endogen Indonesia yang Bersifat Patogen terhadap Hama Crocidolomia Binotalis Zell. Universitas Gajah Mada. Yogyakarta. Skripsi.
Sostromarsono S. 1990. Peranan sumber hayati dan pengelolaan serangga dan tungau hama.Seminar Pengelolaan Hama dan Tungau dengan sumber hayati. Bandung. 20 hal.
Setiawati W R Murtiningsih N Gunaeni & T Rubiati. 2008. Tumbuhan Bahan Pestsida Nabati Cara Pembuatannya untuk Mengendalikan Organisme Pengganngu Tanaman. Balai Sayuran Lembang, Bandung Barat.
Simanjuntak F Maimunah Z Noer & H Zahara. 2007. Pemanfaatan Daun Sirsak dan Berbagai Jenis Umpan untuk Mengendalikan Hama Rayap di Laboratorium. Balai Besar Karantina, Belawan.
Sudarsono T & T Sujarman. 1981. Pedoman Manajemen Usaha Tani. Dinas Pendidikan Penyuluhan Pertanian, Jakarta.
Sukrasno. 2003. Mimba Tanaman Obat Multi Fungsi, Agromedia Pustaka, 67 halaman.
Sonune V R R K Bharodia D M Jethva & S E Gaikwad. 2010. Life Cycle of Spotted Pod Borer, Maruca testulalis (Geyer) on Blackgram. Department
of Entomology. Junagadh Agricultural University, India. Vol : 33, Issue : 1
Sureja B V B G Pachani & A V Khanpara. 2010. Biology of Spotted Pod Borer, (Maruca testulalis Geyer) on Cowpea. University of Junagadh. Gujrat, India. Research Journal of Agricultural Sciences1(4): 477-478.
Susanto H. 2007. Pengaruh Insektisida Nabati terhadap Viabilitas Jamur Entomopatogen. Beauveria Bassiana Bals. Universitas Islam Negeri Malang. Malang. Skripsi.
Thalib R E H Salamah Khodijah D Meidalima T Thamrin C Irsan & S Herlinda. 2012. Lama Penyimpanan dan Keefektifan Bioinsektisida dari Jamur Entomopatogen terhadap Larva Penggerek Batang Padi Kuning (Scirpophaga Incertulas). Universitas Sriwijaya, Palembang. Prosiding Insinas: 282.
Bunga. USU, Medan. Seminar Nasional Perhimpunan Entomologi Indonesia Universitas Padjajaran. Prosiding.
Widyawati A. 2012. Kepekaan Larva Crocidolomia Pavonana Asal Cianjur, Jawa Barat, terhadap Tiga Jenis Insektisida. Institut Pertanian Bogor. Bogor. Skripsi.
Wijayanti R Y V & E L R Zaky. 2009. Kemampuan Hidup penggerek Polong
Lampiran 2. Data persentase bunga terserang 34 hst
Perlakuan Ulangan Total Rataan I II III
Data Transformasi Arc Sin √serangan
Uji Jarak Duncan
Lampiran 8. Data persentase bunga terserang 41 hst
Perlakuan Ulangan Total Rataan I II III
Data Transformasi Arc Sin √serangan
Daftar sidik ragam data transformasi
Lampiran 9. Data persentase serangan bunga terserang 48 hst
Data Transformasi Arc Sin √serangan
Lampiran 10. Data persentase bunga terserang 55 hst
Perlakuan Ulangan Total Rataan I II III
Data Transformasi Arc Sin √serangan
Perlakuan Ulangan Total Rataan I II III Daftar sidik ragam data transformasi
Uji Jarak Duncan
Lampiran 11. Data persentase bunga terserang 62 hst
Perlakuan Ulangan Total Rataan I II III
Data Transformasi Arc Sin √serangan
Daftar sidik ragam data transformasi
SK Db JK KT F.hit F.0,05 F.0,01 Blok 2.00 388.15 194.07 0.78 3.74 6.51 tn Perlakuan 7.00 644.95 92.14 0.37 2.77 4.28 tn Galat 14.00 3471.29 247.95
Total 23.00 4504.39
FK = 7663.99 tn = Tidak Nyata KK = 88.12 * = Nyata
Lampiran 7. Data persentase polong terserang 34 hst
Perlakuan Ulangan Total Rataan I II III
Data Transformasi Arc Sin √serangan
Perlakuan Ulangan Total Rataan I II III
Daftar sidik ragam data transformasi
Lampiran 3. Data persentase polong terserang 41hst
Perlakuan Ulangan Total Rataan I II III
Data Transformasi Arc Sin √serangan
Perlakuan Ulangan Total Rataan I II III
Daftar sidik ragam data transformasi
Lampiran 4. Data persentase polong terserang 48 hst
Perlakuan Ulangan Total Rataan I II III
Data Transformasi Arc Sin √serangan
Perlakuan Ulangan Total Rataan I II III
Daftar sidik ragam data transformasi
Lampiran 5. Data persentase polong terserang 55 hst
Perlakuan Ulangan Total Rataan
I II III
Data Transformasi Arc Sin √serangan
Perlakuan Ulangan Total Rataan I II III
Daftar sidik ragam data transformasi
Sy 2,60 -7,88 -8,27 -5,47 0,74 0,94 3,61 3,86 10,94
Lampiran 6. Data persentase polong terserang 62 hst
Perlakuan Ulangan Total Rataan I II III
Data Transformasi Arc Sin √serangan
Daftar sidik ragam data transformasi
SK Db JK KT F.hit F.0,05 F.0,01
Blok 2,00 25,68 12,84 0,12 3,74 6,51 tn Perlakuan 7,00 528,40 75,49 0,72 2,77 4,28 tn Galat 14,00 1466,59 104,76
Total 23,00 2020,67
FK = 2838,74 tn = Tidak Nyata KK = 0,94 * = Nyata
Lampiran 12. Data jumlah larva 34 hst
Perlakuan Ulangan Total Rataan I II III
Lampiran 13. Data jumlah larva 41 hst
Perlakuan Ulangan Total Rataan I II III
Uji Jarak Duncan
Lampiran 14. Data jumlah larva 48 hst
Perlakuan Ulangan Total Rataan
I II III
Perlakuan Ulangan Total Rataan
I II III
Uji Jarak Duncan
Lampiran 15. Data jumlah larva 55 hst
Data Transformasi √x +0,5
Perlakuan Ulangan Total Rataan I II III
Daftar sidik ragam data transformasi
Lampiran 16. Data jumlah larva 62 hst
Perlakuan Ulangan Total Rataan I II III
Perlakuan Ulangan Total Rataan I II III
Daftar sidik ragam data transformasi
Lampiran 17. Data produksi
Perlakuan Ulangan Total Rataan I II III
Perlakuan Ulangan Total Rataan I II III
Daftar sidik ragam data transformasi
Uji Jarak Duncan
Sy 0,21 1,57 1,77 2,08 2,09 2,18 2,21 3,37 3,77 I 2,00 3,00 4,00 5,00 6,00 7,00 8,00 9,00 SSR 3,03 3,18 3,27 3,33 3,37 3,39 3,41 3,42 LSR 0,64 0,67 0,69 0,71 0,71 0,72 0,72 0,72
Perlakuan A0 A3 A6 A4 A5 A1 A7 A2 Rataan 2,22 2,44 2,78 2,79 2,89 2,93 4,09 4,49
a
b
c
Lampiran 18
a. Polong sehat b. Polong terserang
DESKRIPSI KACANG PANJANG VARIETAS
: tahan terhadap Gemini virus / Mungbean Yellow Mosaic India Virus (MYMIV)
Daya simpan polong pada
Penciri utama : warna kelopak bunga ungu kehijauan, warna paruh polong hijau, biji coklat dengan ujung putih
Yellow Mosaic India Virus (MYMIV) Wilayah adaptasi : beradaptasi dengan baik di dataran rendah