SKRIPSI
SCREENING AWAL
ENZIM ENDONUKLEASE RESTRIKSI SPESIFIK DARI BAKTERI
Oleh: FENNI RUSLI
F24102090
2006
FAKULTAS TEKNOLOGI PERTANIAN INSTITUT PERTANIAN BOGOR
INSTITUT PERTANIAN BOGOR FAKULTAS TEKNOLOGI PERTANIAN
SCREENING AWAL
ENZIM ENDONUKLEASE RESTRIKSI SPESIFIK DARI BAKTERI
Oleh: FENNI RUSLI
F24102090
SKRIPSI
Sebagai salah satu syarat untuk memperoleh gelar SARJANA TEKNOLOGI PERTANIAN
pada Jurusan Ilmu dan Teknologi Pangan Fakultas Teknologi Pertanian
Institut Pertanian Bogor
Dilahirkan pada tanggal 1 Februari 1984 Di Jakarta
Tanggal lulus: September 2006
Menyetujui, Bogor, September 2006
Fenni Rusli. F24102090. Screening Awal Enzim Endonuklease Restriksi Spesifik dari Bakteri. Di bawah bimbingan: Prof. Dr. Ir. Maggy T. Suhartono.
RINGKASAN
Enzim endonuklease restriksi tipe II adalah enzim yang mampu mengenali dan memotong sekuens nukleotida tertentu. Kerja enzim yang spesifik ini berperan penting dalam perkembangan bioteknologi, termasuk di dalamnya bioteknologi pangan yang telah memberikan hasil nyata, seperti varietas pangan yang dimodifikasi secara genetik. Enzim ini dihasilkan oleh setiap bakteri yang tersebar luas di alam, dan dalam penelitian ini isolat bakteri tongkol jagung diteliti potensinya dalam menghasilkan enzim restriksi. Penelitian bertujuan untuk screening keberadaan enzim restriksi yang memiliki situs spesifik.
Penelitian dimulai dengan screening bakteri dari tongkol jagung busuk. Dari 16 macam isolat bakteri mesofilik, diambil 10 macam isolat kemudian masing-masing isolat ditumbuhkan untuk kemudian diambil pelet selnya dan diekstrak enzim restriksinya. Selain bakteri isolat tongkol jagung, juga diambil ekstrak enzim dari beberapa bakteri koleksi Laboratorium Mikrobiologi dan Biokimia, yaitu Bacillus pumillus Y1, B. licheniformis MB2, Pseudomonas
syringae, P. fluorescens, dan beberapa strain dari Xanthomonas axonopodis pv.
glycines (Xag R8, Xag YR58, Xag YR63, dan Xag YR69).
Tahap ekstraksi enzim restriksi meliputi pemecahan sel bakteri dan ekstraksi enzim dengan metode sistem dua fase. Pemecahan sel menggunakan metode sonikasi diskontinu (4 dan 6 × 30 detik). Ekstraksi enzim dua fase menggunakan polimer PEG 8000 28,4% dan dekstran T500 7,1% yang akan memisahkan enzim resktriksi dari asam nukleat bakteri.
Ekstrak enzim restriksi yang diperoleh diujikan aktivitasnya dengan mereaksikannya dengan substrat DNA plasmid dan DNA fage lambda. Plasmid yang digunakan adalah plasmid pBR322 dan plasmid pRK415 yang diperoleh dari penumbuhan kultur E. coli pembawa plasmid dan isolasi plasmid dari sel dengan metode lisis alkali. Hasil reaksi kemudian ditambahkan blue juice dan diamati dengan elektroforesis gel agarosa dengan konsentrasi 1% dan 0,8%.
Pada pengujian dengan DNA plasmid sebagai substrat, ditunjukkan bahwa terdapat beberapa isolat yang memiliki potensi sebagai enzim endonuklease restriksi, yaitu bakteri MBXi K1, MBXi K2, MBXi P1, bakteri A, dan B. pumillus
Y1. Namun setelah pengujian lebih lanjut dengan DNA fage lambda sebagai substrat, tidak terbentuk pita DNA dengan ukuran yang lebih kecil. Bakteri A menunjukkan terbentuknya pita dengan ukuran yang lebih kecil, namun masih terdapat kontaminan nuklease non-spesifik yang menimbulkan smear pada gel. Terbentuknya smear juga dihasilkan pada pengujian ekstrak enzim P. fluorescens,
KATA PENGANTAR
Puji syukur pada Tuhan Yang Maha Pengasih, hanya karena berkat dan perlindungan-Nya kepada penulis, skripsi ini dapat diselesaikan. Pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih kepada:
1. Ibu Prof. Dr. Ir. Maggy T. Suhartono, sebagai dosen pembimbing akademik penulis atas inspirasi, waktu, dukungan, kesabaran, fasilitas dan pengetahuan yang diberikan sejak kuliah hingga penelitian dan penyusunan skripsi ini.
2. Ibu Prof. Dr. Ir. Fransiska Zakaria-Rungkat, MSc., sebagai dosen penguji saat sidang dan moderator saat seminar, atas kesediaannya meluangkan waktu dan masukan-masukan yang membangun.
3. Bapak Dr. Ir. Budiatman Satiawihardja, MSc., sebagai dosen penguji, atas kesediaannya meluangkan waktu dan masukan-masukan yang membangun selama sidang.
4. Keluarga tercinta: Papi, Mami, dan Cici, terima kasih atas kasih sayang, perhatian, doa, dan dukungan yang diberikan kepada penulis. Penulis merasa sangat beruntung dan terberkati memiliki kalian sebagai keluarga terdekat.
5. Teman-teman terdekat: Ledyana, Cecile, Theresia, Sylvia, dan Paul, atas persahabatan, cerita di saat suka dan duka, serta perhatian dan pengertiannya.
6. Teman-teman seperjuangan: Karen dan Steisi, atas segala suka dan duka dalam persahabatan dan perjuangan yang dialami bersama sejak awal kuliah hingga kini, serta doa, dukungan, kritik, dan saran untuk penulis. Juga kepada rekan seperjuangan selama penelitian: Inda, terimakasih atas kerjasama, dukungan, dan canda tawa, hingga penelitian yang diawali bersama dapat diselesaikan bersama pula. 7. Rekan-rekan di Laboratorium Mikrobiologi dan Biokimia dan
bimbingan, bantuan, canda tawa, dan dorongan semangat selama penulis melakukan penelitian.
8. Teman-teman TPG 39: Pretty, Inggrid, Shinta, Nanda, Hanna, Ribka, anak-anak Pubi, Randy, Inal, terimakasih atas kebersamaan dan dukungan yang diberikan kepada penulis. Masa kuliah bersama kalian tidak akan terlupakan.
9. Teman-teman Buddhis 39: Nia, Vivi, Lisa, Delly, Robin, Inan, Pocil, Leo, dan Andi, atas kebersamaan dan bimbingan yang sangat berharga untuk penulis.
10.Semua pihak yang telah banyak membantu dan tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa masih terdapat banyak kekurangan dalam pelaksanaan penelitian dan penyusunan skripsi ini. Oleh karena itu kritik dan saran yang membangun sangat diharapkan. Penulis berharap agar skripsi ini dapat bermanfaat bagi semua pihak yang membutuhkannya.
DAFTAR ISI
Halaman
KATA PENGANTAR ... i
DAFTAR ISI ... iii
DAFTAR TABEL ... v
DAFTAR GAMBAR ... vi
DAFTAR LAMPIRAN ... vii
I. PENDAHULUAN A. LATAR BELAKANG ... 1
B. TUJUAN ... 2
C. MANFAAT ... 2
II. TINJAUAN PUSTAKA A. DEFINISI ENZIM ENDONUKLEASE RESTRIKSI ... 3
B. SUMBER ENZIM ENDONUKLEASE RESTRIKSI ... 4
C. KLASIFIKASI ENZIM ENDONUKLEASE RESTRIKSI ... 7
D. KARAKTERISTIK ENZIM ENDONUKLEASE RESTRIKSI. ... 12
1. Suhu ... 12
2. pH ... 12
3. Kekuatan Ionik ... 13
4. Kofaktor ... 14
5. Waktu Reaksi ... 14
6. Aditif Penstabil ... 14
E. DETEKSI AKTIVITAS ENZIM ENDONUKLEASE RESTRIKSI. ... 15
1. Digesti ... 15
a. Plasmid sebagai substrat ... 15
b. DNA fage lambda sebagai substrat ... 16
III. METODOLOGI PENELITIAN A. BAHAN DAN ALAT
1. Bahan ... 20
2. Alat ... 21
B. METODE PENELITIAN 1. Isolasi Bakteri dari Tongkol Jagung Busuk ... 21
2. Kultivasi Sel ... 21
3. Pemecahan Membran Sel ... 22
4. Ekstraksi Enzim Restriksi ... 22
5. Isolasi Plasmid ... 23
6. Digesti dengan Ekstrak Enzim Endonuklease Restriksi ... 24
7. Elektroforesis Gel Agarosa ... 24
IV. HASIL DAN PEMBAHASAN A. SCREENING BAKTERI DARI TONGKOL JAGUNG ... 25
B. EKSTRAKSI ENZIM ENDONUKLEASE RESTRIKSI ... 27
1. Pemecahan Membran Sel ... 27
2. Pemisahan dari Materi Genetik Bakteri ... 30
C. PENGUJIAN AKTIVITAS EKSTRAK ENZIM ENDONUKLEASE RESTRIKSI ... 34
a. DNA Plasmid sebagai Substrat ... 35
b. DNA Fage Lambda sebagai Substrat ... 42
V. KESIMPULAN DAN SARAN A. KESIMPULAN ... 52
B. SARAN ... 52
DAFTAR PUSTAKA ... 54
DAFTAR TABEL
Halaman
Tabel 1. Endonuklease restriksi dari berbagai bakteri ... 5
Tabel 2. Klasifikasi endonuklease restriksi ... 8
Tabel 3. Buffer reaksi optimum enzim restriksi ... 13
Tabel 4. Metode lisis sel dalam ekstraksi enzim endonuklease restriksi ... 29
DAFTAR GAMBAR
Halaman
Gambar 1. Mekanisme pemotongan DNA oleh enzim restriksi ... 3
Gambar 2. Berbagai hasil pemotongan dengan enzim restriksi ... 9
Gambar 3. Struktur enzim PvuI yang mengikat DNA ... 9
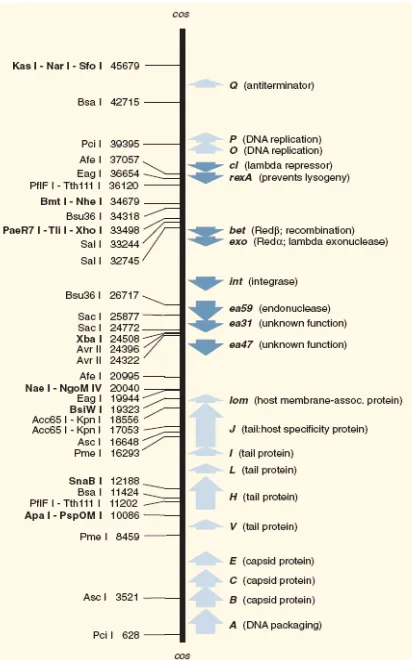
Gambar 4. Peta restriksi DNA fage lambda ... 17
Gambar 5. Hasil uji aktivitas ekstrak enzim K1, K2, dan K7 dengan substrat plasmid pBR322 dan pRK415 ... 36
Gambar 6. Hasil uji aktivitas ekstrak enzim A, P1, P2, P3, 7B, P.syringae, dan B. licheniformis MB2 dengan substrat plasmid pRK415 ... 38
Gambar 7. Hasil uji aktivitas ekstrak enzim P1, P2, P3 dengan substrat plasmid pBR322 dan ekstrak enzim K8, K9, dan B. pumillus Y1 dengan substrat plasmid pRK415 ... 39
Gambar 8. Hasil uji aktivitas ekstrak enzim K1 dan A dengan substrat plasmid pRK415 ... 41
Gambar 9. Hasil uji aktivitas ekstrak enzim A dengan substrat DNA fage lambda ... 42
Gambar 10. Hasil uji aktivitas enzim A yang diekstrak ulang dengan substrat DNA fage lambda ... 44
Gambar 11. Hasil uji aktivitas enzim A ekstrak baru dengan substrat DNA fage lambda ... 45
Gambar 12. Hasil uji aktivitas enzim P1 ekstrak baru dengan substrat DNA fage lambda ... 46
Gambar 13. Hasil uji aktivitas ekstrak enzim Xag R8, Xag YR58, Xag YR63, Xag YR69, dan P. fluorescens ekstraksi polimer konsentrat 1× ... 48
Gambar 14. Hasil uji aktivitas ekstrak enzim Xag R8, Xag YR58, Xag YR63, Xag YR69, dan P. fluorescens ekstraksi polimer konsentrat 2× ... 49
DAFTAR LAMPIRAN
Halaman Lampiran 1. Komposisi media Luria Bertani (LB), Dung et al. (1993),
I. PENDAHULUAN
A. Latar Belakang
Dewasa ini perkembangan bioteknologi pangan sudah demikian pesat dan menunjukkan hasil-hasil yang menarik perhatian dunia. Salah satu keberhasilan dari aplikasi bioteknologi pangan yang nyata adalah pangan transgenik, antara lain pengembangan varietas kedelai hasil rekayasa genetika yang tahan terhadap pestisida, varietas kentang yang tahan terhadap virus, hama koleoptera dan lepidoptera; mengandung lemak lebih sedikit; dan memiliki rasa yang lebih manis. Produk-produk hasil bioteknologi pangan tersebut kini telah dikenal dan banyak dimanfaatkan baik di luar negeri maupun di Indonesia.
Perkembangan bioteknologi pangan berakar dari ilmu bioteknologi molekuler. Penelitian di bidang ini memungkinkan dilakukannya modifikasi materi genetik (asam deoksiribonukleat atau DNA) suatu organisme, sehingga organisme tersebut dapat memiliki karakteristik yang lebih baik. Penelitian yang melibatkan modifikasi DNA ini membutuhkan peranan enzim endonuklease restriksi yang dapat mengenal dan memotong DNA pada sekuens spesifik tertentu, yaitu enzim endonuklease restriksi tipe II. Enzim ini dimanfaatkan dalam penelitian kloning gen, pemetaan DNA, karakterisasi gangguan genetik menurun pada tingkat DNA, analisis proses degenerasi sel, dan analisis keterkaitan filogenetik. Sedangkan secara luas, enzim endonuklease restriksi juga digunakan dalam bidang pertanian, industri, dan kesehatan.
dengan situs pemotongan baru. Selain itu penelitian dan pendidikan bioteknologi di Indonesia yang kini telah mendapat dukungan nyata juga mendorong upaya produksi enzim restriksi lokal secara optimal.
Keberadaan enzim endonuklease restriksi yang khas pada semua makhluk hidup berimplikasi bahwa pelacakan pada organisme prokariot berpotensi menghasilkan penemuan enzim endonuklease restriksi baru, terutama dengan dukungan keanekaragaman hayati di Indonesia. Pelacakan enzim endonuklease restriksi pada penelitian ini akan dilakukan terhadap sejumlah bakteri yang diisolasi dari tongkol jagung, serta Bacillus,
Pseudomonas, dan Xanthomonas yang merupakan koleksi dari Laboratorium
Mikrobiologi dan Biokimia. Diharapkan penelitian ini dapat menghasilkan enzim restriksi baru dengan spesifisitas baru atau enzim restriksi yang merupakan isoschizomer atau neoschizomer dari enzim komersial yang telah ada.
B. Tujuan
Penelitian ini bertujuan untuk mencari enzim endonuklease restriksi yang spesifik dan mudah dihasilkan dengan melakukan screening terhadap bakteri-bakteri yang diisolasi dari tongkol jagung dan bakteri-bakteri koleksi Laboratorium Mikrobiologi dan Biokimia Pusat Riset Biologi dan Bioteknologi.
C. Manfaat
II. TINJAUAN PUSTAKA
A. Definisi Enzim Endonuklease Restriksi
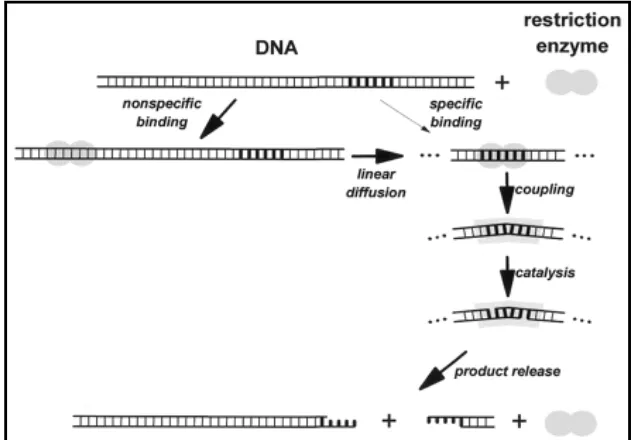
Enzim endonuklease restriksi adalah enzim yang mengenali dan memotong kedua utas dari asam deoksiribonukleat (DNA) pada urutan pasang basa (sekuens) tertentu. Enzim ini mencari sekuens spesifiknya dengan cara menempel pada DNA baik secara spesifik maupun secara non-spesifik, kemudian berdifusi secara linear dengan kecepatan tertentu hingga ditemukannya sekuens spesifik yang dikenalinya. Proses ini dipengaruhi oleh konsentrasi ion Mg2+. Setelah sekuens spesifik dikenali, akan terjadi perubahan konformasi enzim dan DNA (Anonimf, 2006). Mekanisme pemotongan DNA oleh enzim endonuklease restriksi dapat dilihat pada Gambar 1 berikut ini.
Gambar 1. Mekanisme pemotongan DNA oleh enzim restriksi (Pingoud dan Jelstch, 2001)
Kini telah ditemukan lebih dari 3000 jenis enzim restriksi dan banyak di antaranya yang merupakan isoschizomer atau neoschizomer. Isoschizomer
suatu enzim adalah enzim lain memiliki sekuens pengenalan dan pemotongan DNA yang sama dengan enzim tersebut (Pingoud et al., 1993). Sedangkan
neoschizomer suatu enzim adalah enzim lain yang mengenal sekuens DNA
yang sama tapi memotong pada situs yang berbeda dengan enzim tersebut (Roberts dan Halford, 1993).
B. Sumber Enzim Endonuklease Restriksi
Endonuklease restriksi tipe II tersebar luas di alam. Sebagian besar enzim ini ditemukan pada bakteri, namun enzim ini juga dapat diisolasi dari virus, archaea, dan eukariota (Anonimd, 2006). Keberadaan enzim ini pada organisme merupakan suatu mekanisme pertahanan dari DNA asing. Bagi bakteri, endonuklease restriksi berfungsi untuk menghancurkan DNA dari sumber-sumber asing, seperti infeksi bakteriofage, dengan cara memotong DNA asing tersebut pada sekuens yang dikenalinya. Sedangkan sekuens pada genom bakteri yang serupa dilindungi dengan metilasi oleh enzim metiltransferase. Dengan demikian kemampuan fage untuk tumbuh di dalam sel bakteri dibatasi, meskipun terdapat kemungkinan termetilasinya DNA asing sebelum dipotong oleh enzim endonuklease restriksi, sehingga DNA tersebut dapat bertahan (Alberts et al., 1983).
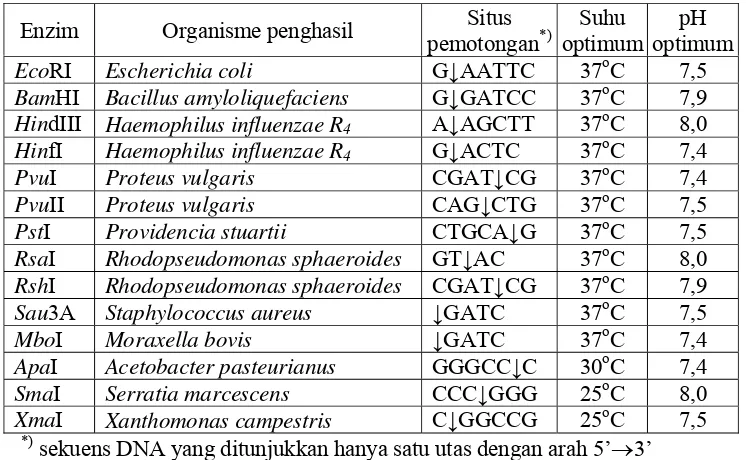
Tabel 1. Endonuklease restriksi dari berbagai bakteri (Pingoud et al., 1993) Enzim Organisme penghasil Situs
pemotongan*)
Suhu optimum
pH optimum
EcoRI Escherichia coli G↓AATTC 37oC 7,5
BamHI Bacillus amyloliquefaciens G↓GATCC 37oC 7,9
HindIII Haemophilus influenzae R4 A↓AGCTT 37oC 8,0
HinfI Haemophilus influenzae R4 G↓ACTC 37oC 7,4
PvuI Proteus vulgaris CGAT↓CG 37oC 7,4
PvuII Proteus vulgaris CAG↓CTG 37oC 7,5
PstI Providencia stuartii CTGCA↓G 37oC 7,5
RsaI Rhodopseudomonas sphaeroides GT↓AC 37oC 8,0
RshI Rhodopseudomonas sphaeroides CGAT↓CG 37oC 7,9
Sau3A Staphylococcus aureus ↓GATC 37oC 7,5
MboI Moraxella bovis ↓GATC 37oC 7,4
ApaI Acetobacter pasteurianus GGGCC↓C 30oC 7,4
SmaI Serratia marcescens CCC↓GGG 25oC 8,0
XmaI Xanthomonas campestris C↓GGCCG 25oC 7,5
*) sekuens DNA yang ditunjukkan hanya satu utas dengan arah 5’→3’
Asal kultur bakteri yang digunakan dalam pelacakan enzim restriksi sangat beragam. Hingga kini lebih dari 10.000 bakteri dan archaebakteria yang berasal dari kultur koleksi, rumah sakit, tanah, dan air telah di-screening untuk melacak keberadaan enzim endonuklease restriksi (Sharma et al., 2003). Sebagai contoh, Stephens (1981) mengisolasi enzim SciNI dari Spiroplasma
citri yang merupakan patogen tanaman. Sedangkan Yun et al. (1995) melacak
keberadaan enzim restriksi pada mikroba yang tumbuh pada limbah kompos dan melaporkan dihasilkannya enzim SviI dari Streptomyces
violochromogenes D1-5 yang bersifat termostabil.
bakteri fotosintetik anoksigenik Rhodobacter sphaeroides MW5 asal pantai Ancol, Jakarta. Karakterisasi enzim tersebut dilakukan oleh Setiawan (1998).
Penelitian dilakukan terus menerus untuk menemukan dan mengembangkan enzim endonuklease restriksi. Dalam penelitian ini, dilakukan screening terhadap beberapa bakteri, yaitu bakteri hasil isolasi dari tongkol jagung busuk, serta beberapa bakteri dari genus Bacillus (B. pumilus
Y1 dan B. licheniformis MB2), Pseudomonas (P. syringae dan P.
fluorescens), dan Xanthomonas axonopodis pv. glycines (Xag R8, Xag YR58,
Xag YR63, dan Xag YR69).
Tongkol jagung adalah tempat pembentukan lembaga dan gudang penyimpanan makanan untuk pertumbuhan biji serta merupakan modifikasi dari cabang dan mulai berkembang pada ruas-ruas batang. Jagung mengandung kurang lebih 30% tongkol jagung, sedangkan sisanya adalah kulit dan biji (Koswara, 1991). Irawadi (1992) menyatakan bahwa tongkol jagung mengandung selulosa (40%), hemiselulosa (36%), lignin (16%), serta zat-zat lainnya sebesar 6%.
Bacillus sp. merupakan bakteri batang pembentuk spora yang bersifat
aerobik sampai anaerobik fakultatif, katalase positif dan Gram positif. Terdapat beberapa spesies dari genus Bacillus, diantaranya B. subtilis, B.
licheniformis dan B. pumilus (Gordon, 1973). B. pumilus Y1 yang digunakan
dalam penelitian ini merupakan galur lokal dari Bacillus sp. yang diisolasi dari limbah cair tahu oleh Likumahwa (1993). B. pumilus Y1 berbentuk batang dalam rantai yang panjang (streptobacilli). B. licheniformis MB2 merupakan bakteri termofilik yang diisolasi dari sumber air panas Tompaso, Sulawesi Utara. Temperatur alami di Tompaso berkisar antara 50-90oC dengan pH antara 4,0-6,0. Suhu optimum untuk pertumbuhan B. licheniformis MB2 adalah pada suhu 55oC, dengan range suhu pertumbuhan 37-60oC. Bakteri ini bersifat anaerob fakultatif.
Pseudomonas adalah salah satu bakteri patogen tanaman yang penting.
(fluorescein) seperti P. aeruginosa, P. fluorescens, P. cichorii, dan P. syringae
(Todar, 2004). Pseudomonas fluorescens adalah bakteri saprofit yang dapat ditemukan di tanah, air, dan permukaan tanaman. Bakteri ini mudah ditumbuhkan di media yang mengandung senyawa organik, memiliki pH netral, pada range suhu mesofilik (Palleroni, 1984). P. syringae merupakan patogen yang menyerang berbagai tanaman. Beberapa patovar P. syringae
memproduksi fitotoksin, seperti syringotoksin dan syringomicin (Todar, 2004).
Xanthomonas campestris merupakan salah satu spesies utama dari
Xanthomonas, yaitu bakteri Gram negatif berbentuk batang yang pada
umumnya merupakan patogen tanaman. Xanthomonas campestris sendiri terbagi atas beberapa patovar, yaitu subgroup berdasarkan kespesifikan tanaman inang yang terinfeksi asal bakteri tersebut diisolasi (Moffet dan Croft, 1983). Xanthomonas campestris pv. glycines dikenal sebagai penyebab penyakit bisul pada tanaman kedelai. Bakteri dalam spesies ini menghasilkan pigmen lipid terlarut berwarna kuning, yaitu xanthomonadin (Palleroni, 1984).
C. Klasifikasi Enzim Endonuklease Restriksi
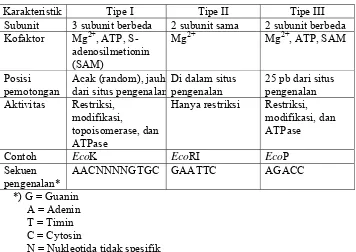
Enzim endonuklease restriksi dibagi menjadi tiga tipe berdasarkan perbedaan dalam komposisi subunit, kofaktor yang diperlukan, dan cara pemotongannya. Terdapat tiga tipe endonuklease restriksi yaitu tipe I (EC 3.1.21.3), tipe II (EC. 3.1.21.4), dan tipe III (EC 3.1.21.5) (Pingoud et al., 1993). Perbandingan karakteristik masing-masing tipe enzim tersebut dapat dilihat pada Tabel 2.
Endonuklease restriksi tipe I membutuhkan ion Mg dan ATP untuk aktivitas endonuklease dan S-adenosilmetionin (SAM) untuk aktivitas metilasinya. Enzim ini dikenal akan karakteristik pemotongannya yang acak dan berada di luar situs pengenalannya. Karakteristik ini menyebabkan enzim endonuklease tipe I tidak digunakan secara luas (Anonime, 2006).
membutuhkan dua sekuens yang letaknya berlawanan untuk memberikan hasil pemotongan yang sempurna. Hal ini menyebabkan pemotongan oleh enzim endonuklease restriksi tipe III jarang memberikan hasil pemotongan yang sempurna. Enzim ini tidak digunakan secara luas di laboratorium dan tidak tersedia secara komersial (Anonime, 2006).
Tabel 2. Klasifikasi endonuklease restriksi (Pingoud et al., 1993)
Karakteristik Tipe I Tipe II Tipe III
Subunit 3 subunit berbeda 2 subunit sama 2 subunit berbeda Kofaktor Mg2+, ATP,
S-adenosilmetionin (SAM)
Mg2+ Mg2+, ATP, SAM
Posisi pemotongan
Acak (random), jauh dari situs pengenalan
Di dalam situs pengenalan
25 pb dari situs pengenalan Aktivitas Restriksi,
modifikasi,
topoisomerase, dan ATPase
Hanya restriksi Restriksi, modifikasi, dan ATPase
Contoh EcoK EcoRI EcoP
Sekuen pengenalan*
AACNNNNGTGC GAATTC AGACC
*) G = Guanin A = Adenin T = Timin C = Cytosin
N = Nukleotida tidak spesifik
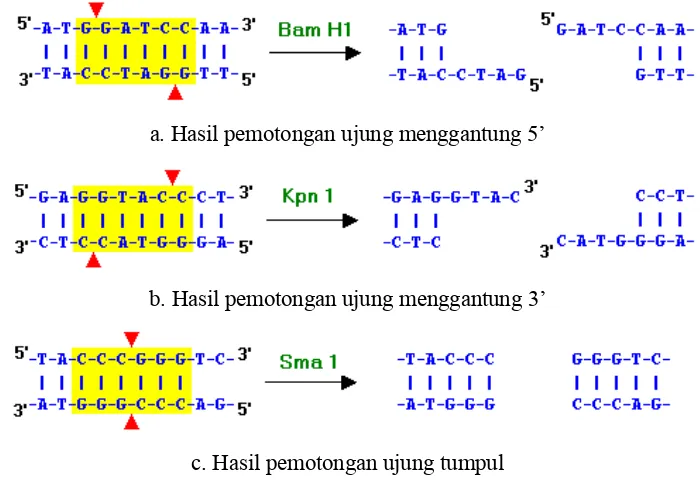
Endonuklease restriksi tipe II adalah enzim yang dapat mengenali sekuens DNA tertentu yang berukuran 4-8 pasang basa (bp) dan memotong DNA di dalam atau di dekat sekuens pengenalan tersebut (Pingoud et al., 1993). Sebagian besar enzim restriksi yang telah diidentifikasi membutuhkan 6 bp (Brown, 1990).
a. Hasil pemotongan ujung menggantung 5’
b. Hasil pemotongan ujung menggantung 3’
c. Hasil pemotongan ujung tumpul
Gambar 2. Berbagai hasil pemotongan dengan enzim restriksi (Owen, 1999)
Sekuens DNA yang dikenali enzim seringkali berupa sekuens palindromik. Sekuens palindromik merupakan sekuens yang pembacaan dari arah 5’ ke 3’ sama untuk kedua utas DNA. Hal ini berkaitan dengan struktur enzim yang terdiri dari dua subunit yang identik (homodimer) (Pingoud et al., 1993). Bentuk struktur homodimer ini dapat dilihat pada Gambar 3, yaitu enzim PvuI yang memiliki sekuens pengenalan CGATCG.
Gambar 3. Struktur enzim PvuI yang mengikat DNA (Owen, 1999)
N5↓N8GAGN5CTCN13↓ ↑N13CTCN5GAGN8↑N5 asam amino menunjukkan pada tingkat molekuler, enzim endonuklease restriksi tidak hanya terdiri dari tiga tipe saja. Hal ini menyebabkan berkembangnya klasifikasi modern yang membagi enzim endonuklease restriksi tipe II menjadi delapan subtipe enzim. Perbedaan kedelapan tipe enzim ini terdapat pada karakteristiknya, seperti sekuens pengenalan, subunit, kofaktor, dan posisi pemotongan (Pingoud dan Jeltsch, 2001).
Enzim yang paling umum dalam tipe II adalah enzim dengan karakteristik yang telah dijelaskan di atas. Sekuens pengenalan enzim bersifat palindromik, subunitnya merupakan homodimer, dan membutuhkan ion Mg2+. Posisi pemotongannya tertentu, berada di dalam situs pengenalan, dan memiliki hasil pemotongan berupa ujung menggantung 5’, ujung menggantung 3’, atau ujung tumpul. Enzim tipe ini tersedia secara komersial (Anonime, 2006).
Enzim restriksi tipe IIb (juga sering disebut tipe IV) merupakan enzim restriksi tipe II yang memiliki aktivitas metilasi. Adanya SAM dibutuhkan untuk aktivitas restriksinya. Subunitnya dapat berupa heterotrimer (contoh
BcgI) ataupun heterodimer (BplI). Sekuens pengenalannya dapat berupa sekuens yang simetrik maupun asimetrik. Contoh enzim dengan sekuens simetrik adalah BplI, dengan sekuens pengenalan
(Pingoud dan Jeltsch, 2001). Kedua utas DNA pada kedua sisi situs pengenalan akan dipotong secara simetris. Letak pemotongannya agak jauh dari situs pengenalan dan selalu menghasilkan ujung menggantung 3’ (Anonimg, 2006). Enzim ini berukuran sekitar 850-1250 asam amino. Tipe enzim lain yang menyerupai enzim IIb adalah enzim IIg. Enzim ini juga membutuhkan SAM untuk aktivitasnya. Perbedaannya dengan enzim IIb adalah aktivitas restriksi dan modifikasi enzim ini terletak pada rantai polipeptida tunggal. Contohnya adalah Eco57I.
GGATG(N)9↓ CCTAC(N)13↓
G↓CCGGC CGGCC↑G
CC↓TNAGC GGANT↑CG
Pemotongan dapat terletak di dalam atau di dekat situs pengenalan. Subunit enzim ini dapat berupa homodimer atau monomer. Contohnya adalah enzim
NaeI yang memiliki situs pengenalan GCCGGC (Anonimg, 2006).
Seperti halnya enzim subtipe IIe, enzim IIf membutuhkan dua situs pengenalan untuk memotong. Perbedaannya adalah enzim IIf akan memotong kedua situs tersebut. Enzim IIf merupakan enzim homotetramer. Contohnya adalah NgoMIV yang memiliki sekuens pengenalan (Pingoud dan Jeltsch, 2001).
Subtipe enzim berikutnya adalah enzim IIt. Enzim ini terdiri dari subunit yang berbeda dan memiliki aktivitas restriksi dan modifikasi. Contohnya adalah enzim Bpu10I dan BslI. Bpu10I mengenali sekuens yang asimetrik, yaitu dan berfungsi sebagai heterodimer dimana kedua subunit diduga memiliki sebuah sisi aktif. Sedangkan BslI mengenali sekuens yang palindromik dan merupakan suatu heterotetramer.
Enzim subtipe IIs merupakan enzim restriksi yang berukuran sedang, yaitu 400-650 asam amino. Sekuens pengenalannya bersifat non-palindromik, kontinu, dan asimetrik. Struktur subunitnya berupa suatu monomer yang memiliki dua buah domain, yaitu domain pengikatan DNA dan domain
pemotongan DNA. Contohnya adalah enzim FokI dengan sekuens pengenalan (Anonime, 2006; Anonimg, 2006).
Subtipe enzim restriksi II yang berbeda dengan yang lainnya adalah subtipe IIm. Keunikannya terletak pada substratnya, dimana enzim ini mengenali DNA yang termetilasi. Aktivitas ini dimiliki oleh enzim BisI yang diteliti oleh Chmusz et al. (2005) dan GlaI yang diteliti oleh Chernukin et al. (2005). Kedua enzim ini memotong sekuens spesifik pada DNA yang termetilasi, yaitu sekuens 5’-G(5mc) NGC-3’ untuk BisI dan 5’-G(m5C) GC-3’ untuk GlaI. Sebelumnya, tipe enzim yang hanya memotong pada DNA yang termetilasi ini sangat langka. Sejak tahun 1975 hanya satu enzim, yaitu
D. Karakteristik Enzim Endonuklease Restriksi
Bagi enzim endonuklease restriksi, satu unit (U) aktivitas didefinisikan sebagai jumlah enzim yang dapat memotong 1 g DNA dari fage selama 1 jam dalam kondisi buffer yang optimum pada suhu 37oC (Pingoud et al., 1993). Seperti sifat enzim pada umumnya, enzim restriksi juga membutuhkan kondisi tertentu untuk menghasilkan aktivitas pemotongan yang optimum, seperti suhu, pH, kekuatan ionik, ion Mg2+, waktu reaksi, dan aditif penstabil (Pingoud et al., 1993).
1. Suhu
Suhu optimum enzim adalah suhu dimana aktivitas enzim optimum. Peningkatan suhu hingga suhu tertentu akan menyebabkan kenaikan kecepatan reaksi enzim karena bertambahnya energi kinetik yang mempercepat gerak vibrasi, translasi, dan rotasi enzim dengan substrat, sehingga memperbesar peluang keduanya untuk bereaksi (Suhartono, 1989). Namun suhu yang terlalu tinggi juga dapat mempercepat pemecahan atau kerusakan enzim.
Suhu merupakan parameter kritis bagi penggunaan endonuklease restriksi secara optimum. Sebagian besar endonuklease restriksi memiliki suhu optimum sekitar 37oC. Beberapa enzim terutama yang diisolasi dari bakteri cryofilik atau termofilik membutuhkan suhu yang lebih rendah atau suhu yang lebih tinggi untuk aktivitasnya (Pingoud et al., 1993). Hal ini berkaitan dengan suhu optimum yang erat hubungannya dengan suhu optimum pertumbuhan mikroba asal enzim. Parameter lingkungan ini harus diperhatikan dalam digesti oleh enzim restriksi agar reaksi berjalan optimum.
2. pH
reaksi. Pada umumnya, enzim aktif pada pH netral, yaitu pH cairan makhluk hidup, namun kisaran kereaktifan enzim dapat mencapai pH 5-9 (Suhartono, 1989). Menurut Pingoud et al. (1993), hampir semua enzim restriksi bekerja dengan baik pada range pH 7,2-8,0, meskipun beberapa enzim memiliki kisaran yang lebih sempit.
3. Kekuatan Ionik
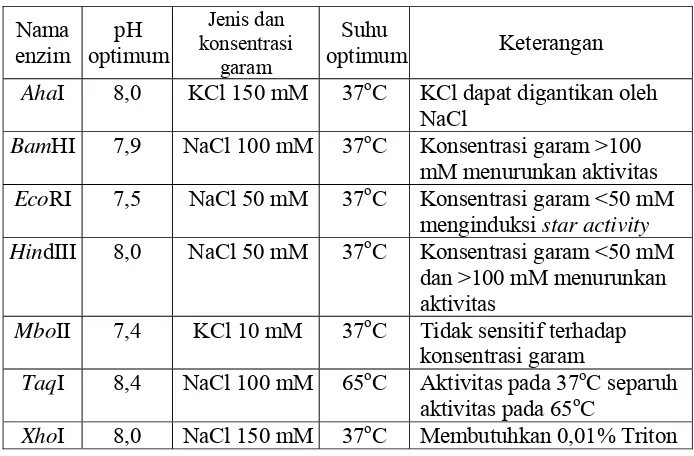
Keakuratan dan aktivitas enzim restriksi sangat dipengaruhi oleh kekuatan ionik. Kekuatan ionik yang diperlukan dapat diperoleh dengan penambahan garam NaCl atau KCl ke dalam buffer Tris-HCl. Konsentrasi dan jenis kekuatan ionik yang tepat sangat diperlukan karena kekuatan ionik yang terlalu rendah akan menginduksi aktivitas bintang dan kekuatan ionik yang terlalu tinggi dapat mengaktivasi endonuklease non-spesifik kontaminan atau menghambat enzim restriksi itu sendiri. Hampir semua enzim restriksi dapat menerima kekuatan ionik dari NaCl ataupun KCl, namun beberapa enzim restriksi hanya aktif pada kekuatan ionik yang diberikan oleh KCl, seperti enzim SmaI (Pingoud et al., 1993). Tabel 3 berikut ini adalah contoh preferensi beberapa enzim terhadap suhu, pH, dan kekuatan ionik tertentu.
Tabel 3. Buffer reaksi optimum enzim restriksi (Pingoud et al., 1993) Nama
enzim
pH optimum
Jenis dan konsentrasi
garam
Suhu
optimum Keterangan
AhaI 8,0 KCl 150 mM 37oC KCl dapat digantikan oleh NaCl
BamHI 7,9 NaCl 100 mM 37oC Konsentrasi garam >100 mM menurunkan aktivitas
EcoRI 7,5 NaCl 50 mM 37oC Konsentrasi garam <50 mM menginduksi star activity HindIII 8,0 NaCl 50 mM 37oC Konsentrasi garam <50 mM
dan >100 mM menurunkan aktivitas
MboII 7,4 KCl 10 mM 37oC Tidak sensitif terhadap konsentrasi garam
TaqI 8,4 NaCl 100 mM 65oC Aktivitas pada 37oC separuh aktivitas pada 65oC
4. Ion Mg2+
Dalam reaksinya, enzim endonuklease restriksi membutuhkan ion Mg2+, meskipun beberapa enzim seperti NlaIII dan NlaIV memerlukan tambahan 50 mM (NH4)2SO4 untuk aktivasi enzim. Konsentrasi yang optimum berkisar antara 5-10mM MgCl2. Peranan Mg2+ diduga untuk menyebabkan polarisasi ikatan fosfodiester yang akan dipotong atau untuk mengaktivasi molekul air untuk membentuk nukleofil yang dibutuhkan (Pingoud et al., 1993). Dengan demikian, adanya pengkelat ion seperti EDTA dapat mengganggu aktivitas pemotongan DNA.
5. Waktu Reaksi
Lamanya waktu reaksi pada umumnya ditentukan berdasarkan unit aktivitas enzim. Penggunaan enzim dalam jumlah yang lebih sedikit dimungkinkan dengan memperpanjang waktu reaksi. Hal ini tidak akan menimbulkan masalah kecuali jika terdapat kontaminasi nuklease lainnya (Anonimd, 2006).
6. Aditif Penstabil
Enzim restriksi juga memiliki kebutuhan akan aditif penstabil untuk mencegah terjadinya oksidasi residu sistein. Pada umumnya, aditif yang digunakan adalah 1,4-dithiothreitol, 1,4-dithioerithritol, atau β-merkaptoetanol. Aditif juga diperlukan untuk mencegah terjadinya agregasi dan presipitasi. Dalam hal ini, aditif yang umum digunakan adalah Triton X-100, Tween, Lubrol, deterjen lainnya, atau Bovine Serum
Albumin (BSA) (Pingoud et al., 1993).
tinggi (di atas 8,5), substitusi ion Mg2+ dengan kation divalen lainnya, waktu inkubasi yang terlalu lama atau jumlah enzim yang terlalu banyak, konsentrasi gliserol yang terlalu tinggi, dan adanya pelarut organik (etanol, dimetilsulfoksida) (Anonimb, 2006).
Menurut Davis et al. (1986), faktor-faktor lain yang berhubungan dengan kondisi-kondisi reaksi seperti kemurnian DNA dan keadaan enzim itu sendiri juga mempengaruhi aktivitasnya. Metilasi DNA, ikatan dengan protein atau kekentalan yang berlebihan dari DNA berberat molekul tinggi dalam larutan yang pekat dapat menurunkan efisiensi pemotongan oleh enzim. Pada umumnya DNA yang akan dipotong harus bebas dari pengotor. Adanya RNA dan DNA utas tunggal tidak berpengaruh buruk terhadap aktivitas sebagian enzim restriksi.
E. Deteksi Aktivitas Enzim Endonuklease Restriksi 1. Digesti
Kemampuan enzim endonuklease restriksi untuk mengenali dan memotong pada situs tertentu dapat dibuktikan dengan mereaksikannya dengan substrat DNA (digesti). Substrat DNA tersebut akan mengalami pemotongan bila terdapat sekuens yang sesuai dengan sekuens spesifik enzim restriksi. Pemotongan akan menyebabkan terbentuknya fragmen-fragmen DNA yang berukuran lebih kecil. Pengujian aktivitas ekstrak enzim dilakukan dengan mereaksikannya dengan dua macam substrat DNA, yaitu DNA plasmid dan DNA fage lambda, dalam kondisi reaksi yang dioptimalkan dengan buffer reaksi.
a. Plasmid sebagai substrat
kompleks, produksi kolisin dan enterotoksin, dan modifikasi atau restriksi oleh enzim (Old dan Primrose, 1989).
Plasmid dapat dipotong oleh enzim restriksi karena adanya bermacam situs pengenalan dalam suatu plasmid. Dalam perkembangannya, plasmid direkayasa secara genetik agar memiliki berbagai situs pengenalan oleh enzim restriksi untuk menfasilitasi kebutuhan kloning (Brown, 1990). Terdapatnya berbagai situs pengenalan dalam plasmid dapat digunakan untuk mendeteksi aktivitas pemotongan dari ekstrak enzim restriksi.
Umumnya plasmid berbentuk molekul DNA sirkuler berutas ganda. Apabila kedua utas berupa lingkaran utuh, molekulnya digambarkan sebagai CCC (Covalently Closed Circular) DNA yang berarti lingkaran tertutup kovalen. Apabila hanya satu utas yang utuh molekulnya digambarkan sebagai OC DNA atau lingkaran terbuka
(Open Circular). Ketika diisolasi dari sel, CCC memiliki defisiensi
lengkungan pada heliks rangkap, sehingga terbentuk konfigurasi kumparan terpilin (superkoil) (Old dan Primrose, 1989).
Perbedaan konfigurasi struktural menyebabkan DNA superkoil dan OC DNA terpisah pada elektroforesis dengan gel agarosa. Bentuk DNA superkoil memiliki pergerakan yang tercepat. Plasmid yang mempunyai satu situs pemotongan akan mengalami perubahan bentuk menjadi linier jika terpotong. Jika pemotongan berjalan kurang sempurna, dapat pula dihasilkan bentuk OC yang menyertai bentuk linier (Roberts dan Halford, 1993). Pada hasil elektroforesis, plasmid OC memiliki pergerakan yang lebih lambat dibandingkan plasmid linier, sehingga bila ketiga konfigurasi plasmid dielektroforesis bersama, plasmid superkoil memiliki pergerakan tercepat, diikuti plasmid linier dan plasmid OC (Brown, 1990).
b. DNA fage lambda sebagai substrat
yang tidak analog dengan DNA kromosomal. DNA ini memiliki banyak situs yang dapat dikenali dan dipotong oleh banyak enzim restriksi seperti terlihat pada Gambar 4. Enzim-enzim tersebut dapat memotong DNA fage lambda pada satu situs atau lebih, sehingga terbentuk beberapa potongan (fragmen) DNA. Ukuran DNA fage lambda cukup besar, yaitu 48.502 pb. Ujung-ujung utas ganda liniernya merupakan ujung menggantung 5’ sebanyak 12 pb yang bersifat komplementer (Old dan Primrose, 1989).
Gambar 4. Peta restriksi DNA fage lambda (Anonimc, 2006)
2. Elektroforesis Agarosa
dibawah pengaruh medan listrik. Elektroforesis digunakan untuk menganalisis virus, asam nukleat, enzim, protein, dan molekul-molekul organik berberat molekul rendah seperti asam amino (Suhartono, 1989). Untuk pemisahan fragmen DNA utas ganda, DNA akan bermuatan negatif pada pH netral (pH 7,0-8,0), sehingga dengan adanya aliran listrik, sampel DNA dalam sumur gel akan bergerak dari kutub negatif (katoda) ke kutub positif (anoda) (Suwanto, 1993).
Elektroforesis memisahkan fragmen-fragmen DNA dengan panjang yang berbeda dan konfigurasi molekul DNA yang berbeda. Jarak pergerakan dalam gel tergantung dari ukuran makromolekul, dimana makromolekul yang berukuran lebih kecil memiliki pergerakan yang lebih jauh daripada makromolekul besar (Glick dan Pasternak, 2003). Konfigurasi molekul DNA yang berbeda seperti konfigurasi plasmid dapat dipisahkan dengan urutan kecepatan pergerakan dari yang paling tinggi adalah superkoil, linier, dan terakhir lingkar terbuka (Old dan Primrose, 1989).
Gel agarosa merupakan salah satu gel elektroforesis yang dapat digunakan dalam pengujian ukuran, keutuhan, homogenitas, dan kemurnian DNA. Agarosa merupakan suatu polimer linear yang diperoleh dari ekstrak rumput laut. Gel agarosa dibuat dengan mencampurkan agarosa dengan larutan buffer yang sesuai dan dipanaskan sampai larutan menjadi bening. Larutan yang encer tersebut kemudian dituang ke dalam cetakan dan dibiarkan sampai membeku (Sambrook et al., 1989). Agarosa membentuk gel pada kondisi dingin akibat adanya ikatan hidrogen. Ukuran pori yang terbentuk ditentukan oleh konsentrasi agarosa. Semakin tinggi konsentrasi maka ukuran pori akan semakin kecil, sehingga kemampuan untuk memisahkan fragmen-fragmen berukuran kecil lebih baik (Sambrook et al., 1989).
amat baik, dan fragmen DNA yang berbeda sampai 1 pb dapat dipisahkan satu sama lain. Walaupun metode ini dapat dilakukan dalam waktu yang sangat singkat, gel poliakrilamida lebih sulit dalam penanganan dan penyiapannya daripada gel agarosa (Sambrook et al., 1989). Keuntungan elektroforesis gel agarosa ini adalah cepat, sederhana, memberikan hasil dengan resolusi tinggi, dan sangat peka karena dalam analisis hanya dibutuhkan sampel dengan jumlah yang sedikit. Jumlah DNA sekecil 10 ng dapat terdeteksi dengan baik sebagai suatu pita (Anonima, 2006).
Perlengkapan utama yang diperlukan pada proses elektroforesis adalah sumber arus listrik dan sistem buffer reservoir. Sistem buffer dalam elektroforesis berfungsi untuk mempertahankan pH konstan di dalam reservoir dan di dalam gel serta bertindak sebagai elektrolit penghantar arus listrik dalam medan listrik. Cara penggunaan buffer untuk gel agarosa dapat dilakukan karena lebih cepat dan sederhana. Pada cara ini gel direndam satu milimeter di bawah permukaan buffer dan DNA biasanya dicampur dengan bahan yang mempunyai densitas tinggi seperti sukrosa, ficoll, atau gliserol sebelum dimasukkan ke dalam sumur gel. Bahan pemberat ini dicampur dengan bahan pewarna bromfenol biru
dan xylene cyanol di dalam larutan penghenti reaksi atau blue juice
(Suwanto, 1993). Penambahan blue juice (gel loading buffer), bertujuan untuk meningkatkan densitas sampel dan memberikan warna pada sampel untuk mempermudah pengamatan jalannya elektroforesis (Sambrook et al., 1989).
III. METODOLOGI PENELITIAN
A. Bahan
Tongkol jagung hibrida CP 2 yang dibusukkan digunakan sebagai sumber mikroba yang diisolasi. Selain itu juga digunakan beberapa kultur koleksi Laboratorium Mikrobiologi dan Biokimia yaitu Bacillus pumilus Y1,
B. licheniformis MB2, Pseudomonas syringae, P. fluorescens, dan beberapa
strain Xanthomonas axonopodis (campestris) pv. glycines (Xag R8, Xag
YR58, Xag YR63 dan Xag YR69). Untuk mendapatkan plasmid, juga digunakan isolat Escherichia coli DH5α carrier plasmid pRK415 dan E. coli
DH5α carrier plasmid pBR322.
Media yang digunakan dalam screening adalah media Dung et al. (1993) yang terdiri dari ekstrak khamir, oat spelt xylan, garam-garam NaCl, K2HPO4, MgSO4.7H2O, NH4Cl, Na2HPO4 dengan pH 7,0. Media pertumbuhan yang digunakan adalah media Luria Bertani (LB) yang terdiri dari tripton, ekstrak khamir, dan garam NaCl dengan pH 7,0. Untuk media pertumbuhan E. coli
pembawa plasmid dilakukan penambahan antibiotik tetrasiklin. Media penyegaran kultur X. axonopodis (campestris)pv. glycines adalah media Yeast
Dextrose Carbonate, yang terdiri dari ekstrak khamir, dekstrosa, CaCO3, dan
agar. Komposisi media dan cara pembuatannya dapat dilihat pada Lampiran 1. Buffer dalam tahap sonikasi terdiri dari Tris-HCl 10 mM pH 7,5, Na2EDTA 1 mM, dan β-merkaptoetanol 7 mM. Enzim restriksi diekstrak dengan akuabides steril, NaCl 2 M, dan polimer konsentrat. Polimer konsentrat terdiri dari polietilen glikol (PEG) 8000 28,4% (w/w), dekstran T500 7,1% (w/w). Cara pembuatan polimer konsentrat dapat dilihat pada Lampiran 2.
Ekstrak enzim restriksi diujikan aktivitasnya dengan bahan-bahan seperti buffer reaksi yang dibuat menjadi stok 10×, DNA fage lambda komersial dari
New England Biolabs (NEB), enzim restriksi komersial PstI dan HindIII dari
100 mM dengan konsentrasi MgCl2 yang dibuat bervariasi, yaitu 70 mM, 100 mM, 120 mM, dan 170 mM, serta β-merkaptoetanol 70 mM. Juga dilakukan penambahan Bovine Serum Albumin (BSA) dengan konsentrasi 1 mg/ml. Untuk melihat pengaruh kekuatan ion digunakan buffer 10× yang mengandung Tris-HCl 100 mM, MgCl2 70 mM, β-merkaptoetanol 70 mM, dan garam NaCl atau KCl dengan konsentrasi 50 mM atau 100 mM.
Bahan-bahan dalam elektroforesis gel agarosa terdiri dari gel loading
buffer, gel agarosa, buffer TAE 10×, dan ethidium bromida. Komposisi gel
loading buffer dan buffer TAE dapat dilihat pada Lampiran 3.
B. Alat
Alat-alat yang digunakan adalah eppendorf, tips, pipet mikro, sentrifus mikro berpendingin, sonikator Soniprep-150, shaker, neraca analitik, pH meter, otoklaf, refrigerator, freezer -20oC, vorteks, perangkat elektroforesis, UV-transiluminator, pengering vakum, dan alat-alat gelas.
C. Metode Penelitian
1. Isolasi Bakteri dari Tongkol Jagung
Tongkol jagung busuk yang dihancurkan dimasukkan ke dalam air akuades steril. Kemudian 1,0 ml suspensi mikroba diinokulasikan ke media cair Dung et al. (1993), kemudian diinkubasi dengan shaker. Setelah 24, 36, dan 72 jam dilakukan inokulasi ke media padat dan diinkubasi pada suhu kamar dan suhu 70oC. Setelah tiga hari dipilih koloni yang terpisah dan digoreskan ke media padat yang baru. Seleksi koloni dilakukan secara bertahap dimana galur-galur yang mampu menghasilkan xylanase menghasilkan zona bening di sekeliling koloni dengan luas lebih dari 3 mm. Kemudian dipisahkan antara koloni yang membentuk zona bening dan yang tidak membentuk zona bening untuk ditumbuhkan pada media LB cair.
2. Kultivasi Sel
selama 10 menit. Pelet sel pada bagian bawah tabung dikumpulkan, sedangkan cairan supernatan dibuang.
3. Pemecahan Membran Sel (Setiawan, 1998)
Pelet sel yang terkumpul disuspensikan dengan buffer sonikasi yang terdiri dari Tris-HCl 10 mM pH 7,5, Na2EDTA 1 mM, dan β-merkaptoetanol 7 mM. Suspensi bakteri tersebut disonikasi secara diskontinu, yaitu sonikasi selama 30 detik sebanyak empat kali yang diselingi istirahat selama 2 menit di antara setiap ulangan dengan amplitudo 15-16 m. Selama sonikasi, tabung yang berisi suspensi bakteri direndam dalam wadah berisi es untuk menjaga agar suhu suspensi tetap di bawah 10oC.
Suspensi bakteri yang telah disonikasi dipindahkan ke dalam beberapa tabung mikro steril dan disentrifugasi dengan kecepatan 12.000 rpm pada suhu 4oC selama 30 menit untuk mengendapkan sel-sel debris. Supernatan yang terbentuk mengandung enzim restriksi dan selanjutnya digunakan dalam proses ekstraksi.
4. Ekstraksi Enzim Restriksi (Setiawan, 1998)
Ke dalam tabung mikro steril diisikan 255 l akuabides steril, 45 l NaCl 2 M, dan 300 l polimer konsentrat. Tabung mikro yang berisi campuran tersebut dimasukkan ke dalam wadah yang berisi es agar suhunya menjadi sekitar 4oC. Sebanyak 600 l supernatan hasil sentrifugasi ditambahkan ke dalam campuran dan divorteks secara diskontinu, yaitu divorteks selama 1-2 detik sebanyak 10 kali. Di antara setiap ulangan, tabung dimasukkan ke dalam es, sehingga suhunya dapat dipertahankan sekitar 4oC. Selanjutnya campuran disentrifugasi dengan kecepatan 12.000 rpm pada suhu 4oC selama 15 menit untuk mengendapkan asam nukleat. Enzim restriksi yang diinginkan berada pada bagian supernatan.
secara diskontinu dan disentrifugasi pada kondisi yang sama dengan ekstraksi tahap pertama. Tahap ekstraksi dengan polimer konsentrat dapat diulangi dengan cara yang sama. Enzim restriksi pada bagian supernatan selanjutnya dapat diuji aktivitasnya.
5. Isolasi plasmid (Sambrook et al., 1989)
Kultur E. coli DH5α pBR322 dan E. coli DH5α pRK415 ditumbuhkan
selama semalam dalam 50 ml LB yang telah ditambahkan antibiotik yang sesuai. Kultur dipelet dalam eppendorf dengan sentrifus mikro berkecepatan 12.000 rpm suhu 4oC. Perlakuan tersebut diulangi hingga kultur habis. Pelet sel diresuspensi dengan 120 l Larutan 1 (Tris-HCl 25 mM, glukosa 50 mM, Na2EDTA 10 mM) dingin, kemudian divorteks.
Kemudian ke dalam campuran ditambahkan 200 l Larutan 2 (0.2 N NaOH, 1% SDS) yang dibuat segar. Eppendorf dibalik-balik 5 kali secara cepat, tidak divorteks, lalu diinkubasi selama 10 menit di atas es. Lisis sel ditandai dengan terbentuknya cairan yang kental dan jernih. Lalu ke dalam campuran ditambahkan 150 l Larutan 3 (KAc/HAc) dingin, dan diinkubasi selama 10 menit di atas es. Selanjutnya disentrifugasi dengan kecepatan 12.000 rpm selama 10 menit pada suhu 4oC, dan bagian supernatannya dipisahkan ke dalam eppendorf lain.
6. Digesti dengan Ekstrak Enzim Endonuklease Restriksi
Digesti DNA plasmid dilakukan dengan mereaksikan 15 l ekstrak enzim dengan 5 l substrat DNA dan 2 l buffer reaksi 10×. Reaksi dilakukan selama semalam pada suhu 37oC. Sebagai pembanding digunakan plasmid utuh yang tidak direaksikan dengan ekstrak enzim. Digesti DNA fage lambda dilakukan dengan cara yang sama, namun dalam jumlah yang berbeda, yaitu 4
l DNA fage lambda, 16 l ekstrak enzim dan 2 l buffer reaksi 10×.
7. Elektroforesis Gel Agarosa (Suwanto, 1993)
Aktivitas pemotongan oleh enzim restriksi dihentikan dengan cara memindahkan campuran enzim restriksi-substrat-buffer ke dalam freezer. Hasil reaksi diuji dengan elektroforesis gel agarosa 1% atau 0,8%. Sebanyak 0,25 g agarosa dicampur dengan 25 ml buffer TAE 1× untuk membuat gel kecil 1% atau 0,4 g agarosa dengan 40 ml buffer TAE 1× untuk membuat gel besar.
Campuran agarosa dan buffer TAE dipanaskan hingga mendidih dan didinginkan sampai suhu 55-60oC, kemudian dituang ke dalam cetakan yang telah diberi sisir. Setelah gel membeku, sisirnya diambil dan gel diletakkan dalam wadah elektroforesis. Wadah elektroforesis diisi dengan buffer TAE 1× sampai gel berada sekitar 1 mm di bawah permukaan cairan buffer.
Sampel yang akan dianalisis ditambah dengan 1,5 l blue juice. Sebanyak 20 l sampel dimasukkan ke dalam sumur gel. Untuk menentukan ukuran fragmen, sebanyak 3 l marker DNA 1 kb juga dimasukkan ke dalam salah satu sumur gel. Pelindung ditutup dan alat elektroforesis dijalankan pada arus 110 mA, tegangan 50 V selama 75-90 menit untuk gel kecil.
Setelah proses elektroforesis selesai, gel direndam dalam larutan ethidium bromida selama 15-20 menit untuk proses staining. Proses
destaining dilakukan dengan cara merendam gel dalam akuades selama 10-15
IV. HASIL DAN PEMBAHASAN
A. Screening Bakteri dari Isolat Tongkol Jagung
Media yang digunakan dalam screening adalah komposisi media oleh Dung et al. (1993). Media oleh Dung et al. terdiri dari beberapa macam garam, ekstrak khamir, dan oat spelt xylan. Oat spelt xylan merupakan sumber karbon dalam bentuk xylan. Xylan memberikan kekeruhan pada media padat, sehingga bila xylan dimanfaatkan bakteri sebagai sumber karbonnya, aktivitas ini akan terdeteksi dengan adanya zona bening. Bakteri penghasil enzim xylanase didapatkan dengan mengambil koloni terpisah yang dikelilingi zona bening dengan luas lebih dari 3 mm.
Sampel screening adalah tongkol jagung busuk. Xylan merupakan salah satu komponen yang terkandung dalam tongkol jagung, sehingga
screening terhadap mikroorganisme pembusuknya berpotensi untuk
mendapatkan bakteri memiliki aktivitas xylanolitik. Metode pengambilan sampel adalah metode pencelupan (dipping method). Permukaan tongkol jagung busuk tidak rata, sehingga pengambilan sampel dengan metode swab
sulit untuk mendapatkan sampel yang representatif. Tekstur tongkol jagung juga masih terlalu keras untuk dihancurkan, sehingga untuk mendapatkan sampel yang mewakili, metode pencelupan dianggap paling sesuai.
Inkubasi dilakukan pada suhu 37oC dan 70oC. Inkubasi pada suhu 37oC bertujuan untuk mendapatkan bakteri mesofilik, sedangkan inkubasi pada suhu 70oC bertujuan untuk mendapatkan bakteri termofilik. Namun dari inkubasi pada suhu 70oC ini tidak terdapat bakteri yang tumbuh, sehingga keseluruhan isolat bakteri yang diperoleh merupakan bakteri mesofilik. Hal ini mungkin disebabkan pembusukan tongkol jagung yang dilakukan pada suhu ruang, sehingga tidak menunjang pertumbuhan bakteri termofilik.
Screening terhadap bakteri termofilik dilakukan karena bakteri
termofilik dapat menghasilkan enzim restriksi termostabil. Menurut Sharma
et al. (2003), enzim restriksi termostabil memiliki beberapa keuntungan,
yang lebih baik, dan hasil purifikasi yang lebih banyak karena stabilitas termal yang lebih baik.
Screening menghasilkan 16 koloni terpisah, yaitu 12 koloni penghasil
enzim xylanase dan 4 koloni yang tidak dapat menghasilkan xylanase. Dari 16 koloni terpisah, dipilih 8 penghasil xylanase, yaitu MBXi P1, MBXi P2, MBXi P3, MBXi K1, MBXi K2, MBXi K7, MBXi K8, dan MBXi K9; dan 2 yang tidak menghasilkan xylanase, yaitu 7B dan A, untuk diujikan aktivitas enzim endonuklease restriksinya. Pada pembahasan selanjutnya ekstrak enzim restriksi dari isolat bakteri MBXi P1 akan disebut ekstrak enzim P1 dan begitu pula dengan ekstrak enzim dari isolat lainnya. Bakteri-bakteri hasil isolasi tongkol jagung busuk tersebut diharapkan dapat menghasilkan enzim endonuklease restriksi yang spesifik karena penelitian Yun et al. (1995) menunjukkan bakteri yang diisolasi dari limbah, yaitu limbah kompos, dapat menghasilkan enzim endonuklease restriksi spesifik SviI.
Selain 10 isolat bakteri tongkol jagung, akan diujikan pula beberapa koleksi kultur dari Laboratorium Mikrobiologi dan Biokimia Pusat Riset Biologi dan Bioteknologi, yaitu Bacillus pumilus Y1, B. licheniformis MB2,
Pseudomonas syringae, Pseudomonas fluorescens, dan empat macam strain
dari Xanthomonas axonopodis (campestris) pv. glycines (Xag). Bacillus
pumilus Y1 dipilih untuk mewakili sampel yang berasal dari limbah karena
diisolasi dari limbah tahu cair, sedangkan B. licheniformis MB2 sebagai sampel yang diisolasi dari sumber air panas. P. syringae, P. fluorescens, dan beberapa strain dari Xanthomonas axonopodis (campestris) pv. glycines yang merupakan patogen tanaman juga diharapkan dapat menghasilkan enzim endonuklease restriksi spesifik. Dengan keberadaannya sebagai patogen diperkirakan bakteri tersebut memiliki pertahanan yang baik terhadap DNA asing yang dapat menginfeksi, sehingga mungkin terdapat endonuklease spesifik sebagai bentuk pertahanan terhadap DNA asing tersebut. Hal ini juga didukung dengan adanya penelitian yang menunjukkan dihasilkannya enzim endonuklease spesifik dari bakteri patogen tanaman, seperti SciNI dari
Penumbuhan isolat dilakukan selama 48-72 jam pada media cair LB. Bakteri pada umumnya dipanen pada saat pertumbuhannya mencapai fase logaritmik. Endow dan Roberts (1977) melakukan kultivasi sel saat
Xanthomonas malvacearum memasuki fase logaritmik akhir untuk
mendapatkan XmaI dan XmaII. Namun menurut Pirrota dan Bickle (1990), jumlah enzim restriksi yang dihasilkan per sel bakteri tidak banyak berbeda selama siklus pertumbuhannya. Bakteri dapat ditumbuhkan sampai mencapai fase stationer sebelum dipanen. Hal ini dilakukan pada banyak penelitian, seperti pada purifikasi parsial enzim MboI dan MboII (Gelinas et al., 1977) dan enzim HhaI (Roberts et al., 1976). Hal ini menguntungkan karena pertumbuhan kultur bakteri tidak perlu dimonitor secara teliti.
B. Ekstraksi Enzim Endonuklease Restriksi 1. Pemecahan Membran Sel
Ekstraksi enzim diawali dengan pemecahan sel bakteri karena enzim ini merupakan enzim intraseluler. Terdapat berbagai metode yang dapat digunakan untuk memecah dinding sel. Menurut Suhartono (1989) pemecahan membran sel dapat dilakukan secara fisik atau secara kimiawi. Pemecahan secara fisik dilakukan dengan metode sonikasi,
French pressure, homogenasi, hammer-mill, freeze-thaw, dan kejutan
osmotik. Untuk membantu pemecahan ini sering pula ditambahkan bubuk alumina, pasir, atau silika. Dalam pemecahan secara kimiawi sering digunakan detergen dan enzim lisozim terutama untuk bakteri Gram positif.
Beberapa penelitian dalam isolasi enzim restriksi menggunakan berbagai metode yang bervariasi. Lynn et al. (1980) menggunakan
French pressure untuk mengisolasi RsaI. Sel yang diresuspensi buffer
dengan perbandingan 1:2 (w/v) dihancurkan dengan sel French pressure
yang kecil. Hal ini menguntungkan karena murah, tidak membutuhkan alat tertentu, dan DNA yang dihasilkan oleh lisis sel dapat terpisah secara efektif karena menempel pada permukaan manik-manik gelas. Namun cara ini tidak efektif untuk volume besar. Cara yang serupa digunakan oleh Yun et al. (1995) dengan menggunakan alat bead beater.
Metode pemecahan sel yang digunakan dalam penelitian adalah metode sonikasi dengan alat sonikator. Metode ini merupakan metode yang paling umum dan memuaskan dalam pemecahan sel dengan jumlah tidak lebih dari 20 gram berat basah. Alat sonikator akan memberikan getaran (vibrasi) pada frekuensi tinggi, sehingga timbul gesekan mekanis pada membran sel dan membran sel akan hancur (Bollag dan Edelstein, 1991). Amplitudo yang digunakan adalah sebesar 15-16 m.
Panas yang ditimbulkan dari energi mekanis dapat merusak enzim restriksi, maka selama sonikasi suspensi sel direndam dalam es untuk mempertahankan suhu rendah. Untuk mencegah kenaikan suhu, sonikasi juga diselingi istirahat selama dua menit di antara setiap ulangan sonikasi selama 30 detik (sonikasi diskontinu). Sonikasi yang berlebihan dapat menyebabkan terbentuknya debris seluler yang terlalu halus, yang dapat menyulitkan proses pemisahan enzim dari debris dengan cara sentrifugasi. Oleh karena itu sonikasi dilakukan dalam waktu seminimal mungkin dengan hasil pemecahan sel yang maksimal.
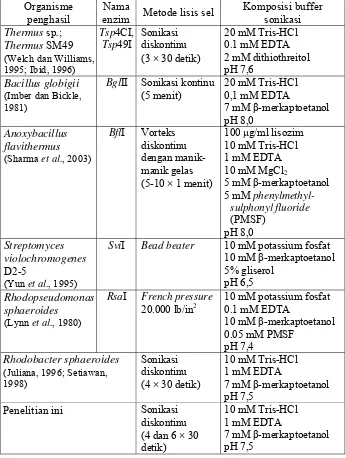
Berdasarkan penelitian Juliana (1996) dan Setiawan (1998), pengulangan sonikasi dilakukan sebanyak 4 kali untuk semua bakteri, kecuali untuk bakteri P. fluorescens, Xag R8, Xag YR58, Xag YR63, dan
globigii dengan sonikasi membutuhkan waktu selama 5 menit untuk pelet sel sebanyak 250 gram (Imber dan Bickle, 1981). Sedangkan pelet sel
Thermus sp. sebanyak 3 gram hanya membutuhkan sonikasi diskontinu 3
× 30 detik (Welch dan Williams, 1995). Tabel 4 berikut ini
[image:39.612.166.512.238.696.2]membandingkan metode-metode yang digunakan untuk melisis sel dalam ekstraksi enzim endonuklease restriksi pada berbagai penelitian.
Tabel 4. Metode lisis sel dalam ekstraksi enzim endonuklease restriksi Organisme
penghasil
Nama
enzim Metode lisis sel
Komposisi buffer sonikasi
Thermus sp.;
Thermus SM49
(Welch dan Williams, 1995; Ibid, 1996)
Tsp4CI,
Tsp49I
Sonikasi diskontinu (3 × 30 detik)
20 mM Tris-HCl 0.1 mM EDTA 2 mM dithiothreitol pH 7,6
Bacillus globigii
(Imber dan Bickle, 1981)
BglII Sonikasi kontinu (5 menit)
20 mM Tris-HCl 0,1 mM EDTA
7 mM β-merkaptoetanol pH 8,0
Anoxybacillus flavithermus
(Sharma et al., 2003)
BflI Vorteks diskontinu dengan manik-manik gelas (5-10 × 1 menit)
100 g/ml lisozim 10 mM Tris-HCl 1 mM EDTA 10 mM MgCl2
5 mM β-merkaptoetanol 5 mM
phenylmethyl-sulphonyl fluoride (PMSF) pH 8,0 Streptomyces violochromogenes D2-5
(Yun et al., 1995)
SviI Bead beater 10 mM potassium fosfat
10 mM β-merkaptoetanol 5% gliserol
pH 6,5
Rhodopseudomonas sphaeroides
(Lynn et al., 1980)
RsaI French pressure
20.000 lb/in2
10 mM potassium fosfat 0.1 mM EDTA
10 mM β-merkaptoetanol 0.05 mM PMSF
pH 7,4
Rhodobacter sphaeroides
(Juliana, 1996; Setiawan, 1998)
Sonikasi diskontinu (4 × 30 detik)
10 mM Tris-HCl 1 mM EDTA
7 mM β-merkaptoetanol pH 7,5
Penelitian ini Sonikasi diskontinu (4 dan 6 × 30 detik)
10 mM Tris-HCl 1 mM EDTA
Pemecahan membran sel setelah sonikasi menyebabkan komponen intraseluler sel tidak terlindungi lagi. Protein-protein intraseluler seperti enzim restriksi dapat teroksidasi dan terdegradasi akibat aktivitas protease ekstraseluler. Gugus sulfhidril pada residu sistein yang terdapat pada sisi aktif enzim mudah teroksidasi dan membentuk ikatan disulfida (-S-S-) dengan gugus sulfhidril lain. Proses ini dimungkinkan dengan adanya ion-ion logam berat atau ion divalen yang dapat mengaktifkan molekul oksigen dan membentuk kompleks dengan gugus sulfhidril.
Oleh karena itu dalam buffer sonikasi ditambahkan EDTA dan β-merkaptoetanol yang dapat mencegah kerusakan enzim. EDTA merupakan pengkelat ion logam, sehingga ion logam tidak membentuk kompleks dengan gugus sulfhidril pada sisi aktif enzim dan menyebabkan oksidasi. Selain itu EDTA juga dapat mengikat ion divalen yang diperlukan untuk aktivitas protease ekstraseluler, sehingga mencegah degradasi proteolitik enzim restriksi oleh protease tersebut.
β-merkaptoetanol berfungsi sebagai antioksidan yang dapat melindungi gugus sulfhidril pada sisi aktif enzim dari oksidasi. β-merkaptoetanol mempunyai gugus sulfhidril yang mudah teroksidasi. Konsentrasi β-merkaptoetanol dalam buffer berkisar antara 5-20 mM. Konsentrasi yang lebih rendah akan menyebabkan senyawa ini teroksidasi dalam waktu singkat, sehingga tidak mampu memberikan perlindungan lebih lama, bahkan dapat berikatan dengan sisi aktif enzim yang dapat mempercepat inaktivasi enzim yang akan diekstrak. Senyawa antioksidan lain seperti dithiothreitol dan dithioeritritol juga dapat digunakan untuk melindungi gugus sulfhidril.
2. Pemisahan dari Materi Genetik Bakteri
berikatan dengan enzim restriksi dan menjadi inhibitor yang mengganggu kerja enzim terhadap substrat. DNA bakteri yang tidak dipisahkan akan muncul sebagai fragmen-fragmen pada proses elektroforesis, sehingga menyebabkan kesalahan analisis hasil pemotongan enzim restriksi.
Salah satu metode yang dapat digunakan untuk memisahkan protein adalah dengan metode pemisahan dua fase (aqueous two-phase
system). Dalam sistem ini makromolekul seperti protein dan asam nukleat
akan memisah berdasarkan struktur dan komposisi ionik dalam sistem fase (Franks, 1993). Cara ini banyak diterapkan untuk pemisahan biomolekul seperti protein, lemak, asam nukleat, toksin, virus, dan sel utuh. Sistem dua fase diperoleh dengan mencampur dua polimer di dalam air. Polimer yang banyak digunakan dan dipelajari dalam sistem dua fase adalah polietilen glikol (PEG) dengan dekstran, atau PEG dengan garam, seperti potasium fosfat. Menurut Pingoud et al. (1993), polietilen imin (PEI) juga umum digunakan sebagai pengganti PEG. Penambahan polimer konsentrat yang dilanjutkan dengan sentrifugasi akan membentuk dua fase, yaitu fase atas (PEG atau PEI) yang merupakan fase yang lebih ringan dan melarutkan enzim restriksi dan protein-protein lainnya, dan fase bawah (dekstran atau garam) yang melarutkan asam nukleat. Fase atas merupakan ekstrak enzim restriksi.
Sementara itu, beberapa peneliti lainnya menggunakan streptomisin sulfat dalam presipitasi asam nukleat. Gelinas et al. (1977), dalam penelitiannya tentang enzim restriksi MboI dan MboII, menambahkan streptomisin sulfat dengan stirring selama 30 menit. Sedangkan Yun et al. (1995) menggunakan streptomisin sulfat konsentrasi akhir 2% dengan stirring selama 1 jam. Setelah sentrifugasi, enzim juga dipresipitasi dengan amonium sulfat. Presipitasi asam nukleat terkadang tidak dilanjutkan dengan presipitasi amonium sulfat, seperti yang ditunjukkan Gelinas et al. (1977) dalam penelitiannya tentang enzim endonuklease restriksi BalI.
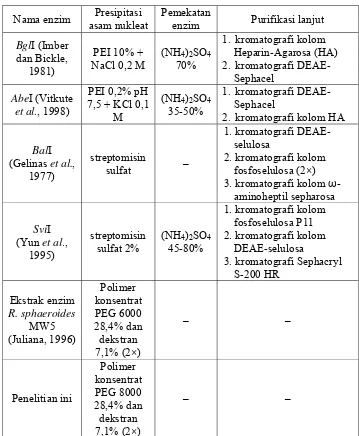
Juliana (1996) memperlihatkan penggunaan polimer konsentrat PEG 6000 28,4% dan dekstran 7,1% dalam presipitasi asam nukleat memberikan hasil yang baik. Pengulangan ekstraksi dengan polimer konsentrat sebanyak 2 kali menghasilkan enzim restriksi dengan aktivitas yang baik dalam pemotongan substrat DNA fage lambda. Ekstraksi sebanyak satu kali menghasilkan enzim restriksi yang tidak dapat memotong DNA fage lambda. Hal ini disebabkan masih banyaknya senyawa pengotor dalam ekstrak enzim. Enzim restriksi hasil ekstraksi sebanyak tiga kali juga tidak mempunyai aktivitas yang baik karena mungkin ikut mengendap bersama polimer konsentrat atau mengalami kerusakan akibat ekstraksi berlebihan.
Tabel 5. Metode ekstraksi enzim endonuklease pada berbagai penelitian Nama enzim Presipitasi
asam nukleat
Pemekatan
enzim Purifikasi lanjut
BglI (Imber dan Bickle,
1981)
PEI 10% + NaCl 0,2 M
(NH4)2SO4 70%
1. kromatografi kolom Heparin-Agarosa (HA) 2. kromatografi
DEAE-Sephacel
AbeI (Vitkute
et al., 1998)
PEI 0,2% pH 7,5 + KCl 0,1
M
(NH4)2SO4 35-50%
1. kromatografi DEAE-Sephacel
2. kromatografi kolom HA
BalI (Gelinas et al.,
1977)
streptomisin
sulfat –
1.kromatografi DEAE-selulosa
2.kromatografi kolom fosfoselulosa (2×) 3.kromatografi kolom ω
-aminoheptil sepharosa
SviI (Yun et al.,
1995)
streptomisin sulfat 2%
(NH4)2SO4 45-80%
1.kromatografi kolom fosfoselulosa P11 2.kromatografi kolom
DEAE-selulosa
3.kromatografi Sephacryl S-200 HR Ekstrak enzim R. sphaeroides MW5 (Juliana, 1996) Polimer konsentrat PEG 6000 28,4% dan dekstran 7,1% (2×) – – Penelitian ini Polimer konsentrat PEG 8000 28,4% dan dekstran 7,1% (2×) – –
menghidrasi protein. Kondisi demikian dapat meningkatkan partisi protein. Namun bila PEG terlalu besar, protein dapat keluar dari fase PEG karena kondisi yang terlalu hidrofobik dan rendahnya available
water dalam fase.
Pada umumnya ekstraksi enzim endonuklease restriksi dilanjutkan dengan purifikasi atau purifikasi parsial dengan kromatografi. Menurut Pingoud et al. (1993), pada umumnya 2-3 tahap kromatografi cukup untuk menghilangkan nuklease non-spesifik. Tahap kromatografi juga dapat memisahkan beberapa enzim restriksi yang terdapat dalam satu ekstrak kasar. Kromatografi yang umum digunakan adalah kromatografi fosfoselulosa, hydroxyapatite, dan heparin-agarosa. Tabel 6 juga menunjukkan tahap purifikasi enzim restriksi yang digunakan dalam beberapa penelitian.
Hasil penelitian Juliana (1996) menunjukkan bahwa ekstraksi enzim endonuklease restriksi dengan tahap presipitasi asam nukleat saja telah dapat menghasilkan ekstrak enzim restriksi yang memiliki aktivitas baik. Hasil ekstrak enzim restriksi tersebut dapat memotong substrat DNA fage lambda dengan pola yang hampir serupa dengan enzim komersial PstI dan hasil elektroforesis menghasilkan pita yang jelas. Dengan demikian, dalam penelitian screening awal enzim endonuklease restriksi ini, tahap ekstraksi hanya dilakukan hingga tahap presipitasi asam nukleat.
C. Pengujian Aktivitas Ekstrak Enzim Restriksi
harapan didapatkannya substrat yang mempunyai situs pemotongan lebih dari satu.
Pengujian aktivitas ekstrak enzim dilakukan dengan mereaksikannya dengan dua macam substrat DNA, yaitu DNA plasmid dan DNA fage lambda, dalam kondisi reaksi yang dioptimalkan dengan buffer reaksi. Setelah digesti berlangsung semalam, hasil reaksi diamati dengan elektroforesis gel agarosa.
1. Plasmid sebagai Substrat
Pada percobaan ini digunakan DNA plasmid utuh (tidak direaksikan dengan enzim restriksi) sebagai kontrol. Plasmid utuh dapat memiliki dua macam konfigurasi, yaitu superkoil dan OC (Brown, 1991). Superkoil memiliki pergerakan tercepat dan OC memiliki pergerakan terlambat. Plasmid yang direaksikan dengan ekstrak enzim restriksi diharapkan menghasilkan plasmid linier, berupa pita yang terletak di antara pita plasmid superkoil dan pita plasmid OC. Namun bila pemotongan berjalan kurang sempurna, dapat pula dihasilkan bentuk OC yang menyertai bentuk linier (Roberts dan Halford, 1993).
Reaksi antara ekstrak enzim restriksi dengan substrat plasmid difasilitasi dengan kondisi optimum dengan menambahkan buffer reaksi. Setelah pencampuran dengan enzim dan substrat, buffer reaksi terdiri dari 10 mM Tris-HCl pH 7,5, 7 mM MgCl2, dan 7 mM β-merkaptoetanol. Komposisi ini ditentukan berdasarkan kondisi yang dibutuhkan oleh kebanyakan enzim restriksi. Tris-HCl merupakan buffer yang umum dibutuhkan dalam reaksi enzim restriksi untuk mempertahankan pH dan pH 7,5 merupakan pH optimum yang umum dimiliki oleh enzim-enzim restriksi komersial.
MgCl2 berfungsi untuk memberikan sejumlah ion Mg2+ ke dalam buffer, dimana ion Mg2+ dibutuhkan oleh enzim restriksi tipe II dalam
scanning sekuens sepanjang rantai DNA dan sebagai kofaktor pengikatan
2001). β-merkaptoetanol berfungsi sebagai antioksidan yang mencegah oksidasi gugus sulfhidril pada enzim, terutama bagian sisi aktifnya.
Inkubasi dilakukan pada suhu 37oC selama semalam. Suhu 37oC merupakan suhu optimum enzim restriksi pada umumnya. Waktu inkubasi yang cukup lama diberikan agar enzim dapat bereaksi sempurna. Ekstrak enzim yang didapatkan masih mengandung kontaminan-kontaminan, sehingga diperkirakan aktivitasnya tidak dapat menyamai aktivitas enzim restriksi komersial. Bila aktivitas enzim sangat kecil, diharapkan waktu inkubasi selama semalam dapat memberikan kesempatan pada enzim untuk bereaksi sempurna.
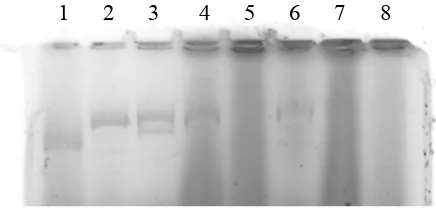
[image:46.612.250.442.289.385.2]1 2 3 4 5 6 7 8
Gambar 5. Hasil uji aktivitas ekstrak enzim K1, K2, dan K7 dengan substrat plasmid pBR322 dan pRK415, digesti semalam (37oC),
agarosa 1%.
1. Plasmid pBR322 utuh
2. Plasmid pBR322 dengan ekstrak enzim K1 3. Plasmid pBR322 dengan ekstrak enzim K2 4. Plasmid pBR322 dengan ekstrak enzim K7 5. Plasmid pRK415 utuh
6. Plasmid pRK415 dengan ekstrak enzim K1 7. Plasmid pRK415 dengan ekstrak enzim K2 8. Plasmid pRK415 dengan ekstrak enzim K7
konformasi plasmid seperti proses pelinieran akibat perlakuan fisik seperti memipet dan menggoyang. Untuk mengetahui seberapa jauh kerusakan karena perlakuan fisik, digunakan kontrol negatif, yaitu DNA substrat utuh dengan jumlah volume dan perlakuan fisik yang sama.
Pita pada sumur keenam dan ketujuh kemungkinan menunjukkan plasmid yang telah terpotong menjadi bentuk linier karena letak pergerakannya di antara kedua pita plasmid utuh, yaitu pita yang menunjukkan letak OC dan superkoil. Namun pemotongannya yang kurang sempurna karena masih terdapat sedikit bagian plasmid superkoil. Dengan demikian ekstrak enzim restriksi dari bakteri K1 dan K2 berpotensi memiliki aktivitas pemotongan pada plasmid pRK415 dan diperlukan pengujian lebih lanjut.
Sumur ketiga, keempat, dan kedelapan memperlihatkan adanya
smear yang menunjukkan bahwa masih terdapat sisa RNA dari isolasi
plasmid. Selain terdapatnya smear, penggunaan DNA plasmid hasil isolasi miniprep sebagai substrat memiliki beberapa kelemahan, yaitu kemungkinan tinggi terkontaminasi oleh garam dalam buffer lisis, serta fenol dan kloroform dari presipitasi alkohol. Bila plasmid disimpan terlebih dahulu, EDTA dalam buffer TE dapat menghambat aktivitas nukleolitik dengan mengkelat ion Mg2+. Kandungan kontaminan tersebut dapat menghambat aktivitas enzim secara parsial ataupun keseluruhan (Pingoud et al., 1993).
Kontaminasi garam dapat diatasi dengan pencucian DNA berulang kali setelah presipitasi ethanol 70% pada suhu ruang. Kontaminasi protein, terutama nuklease nonspesifik dapat dihilangkan dengan ekstraksi fenol dan kloroform setelah inkubasi dengan proteinase K. Sedangkan RNA seluler dapat dihilangkan dengan penambahan
DNase-free RNase (Pingoud et al., 1993). Bila plasmid harus disimpan dalam
Uji aktivitas ekstrak enzim restriksi dari bakteri lainnya, yaitu A, P1, P2, P3, 7B, Pseudomonas syringae, dan B. licheniformis MB2 ditunjukkan pada Gambar 6. Substrat yang digunakan adalah plasmid pRK415 dan digesti dilakukan selama semalam.
[image:48.612.227.445.178.282.2]1 2 3 4 5 6 7 8
Gambar 6. Hasil uji aktivitas ekstrak enzim A, P1, P2, P3, 7B,
Pseudomonas syringae, dan B. licheniformis MB2 dengan
substrat plasmid pRK415, digesti semalam (37oC), agarosa 1%.
1. Plasmid pRK415 utuh
2. Plasmid pRK415 dengan ekstrak enzim A 3. Plasmid pRK415 dengan ekstrak enzim P1 4. Plasmid pRK415 dengan ekstrak enzim P2 5. Plasmid pRK415 dengan ekstrak enzim P3 6. Plasmid pRK415 dengan ekstrak enzim 7B
7. Plasmid pRK415 dengan ekstrak enzim P. syringae
8. Plasmid pRK415 dengan ekstrak enzim B. licheniformis
MB2
aktivitas restriksi. Pita pada sumur keenam, yaitu ekstrak enzim 7B terlalu tipis untuk pendugaan apakah memiliki aktivitas restriksi.
Uji aktivitas ekstrak enzim restriksi dari bakteri lainnya, yaitu K8, K9, dan B. pumillus Y1 ditunjukkan pada Gambar 7. Substrat yang digunakan adalah plasmid pRK415 dan digesti dilakukan selama semalam. Pada elektroforesis ini juga dilakukan pengujian aktivitas ekstrak enzim restriksi P1, P2, dan P3 dengan substrat plasmid pBR322.
[image:49.612.217.459.237.361.2]1 2 3 4 5 6 7 8
Gambar 7. Hasil uji aktivitas ekstrak enzim P1, P2, P3 dengan substrat plasmid pBR322 dan ekstrak enzim K8, K9, dan B. pumillus
Y1 dengan substrat plasmid pRK415, digesti semalam (37oC), agarosa 1%.
1. Plasmid pBR322 utuh
2. Plasmid pBR322 dengan ekstrak enzim P1 3. Plasmid pBR322 dengan ekstrak enzim P2 4. Plasmid pBR322 dengan ekstrak enzim P3 5. Plasmid pRK415 utuh
6. Plasmid pRK415 dengan ekstrak enzim K8 7. Plasmid pRK415 dengan ekstrak enzim P9
8. Plasmid pRK415 dengan ekstrak enzim B. pumillus Y1
Pengujian lebih lanjut menggunakan dua buah kontrol, yaitu kontrol plasmid utuh (kontrol negatif) dan kontrol plasmid yang telah dipotong oleh enzim restriksi komersial (kontrol positif). Plasmid yang dipotong pada salah satu situs restriksinya digunakan sebagai penunjuk letak pita linier.
Selain penggunaan kontrol negatif, upaya lain yang dapat dilakukan untuk memberikan hasil elektroforesis yang lebih baik adalah dengan memberikan kondisi reaksi optimum pada tahap digesti. Kekuatan ionik merupakan salah satu faktor yang mempengaruh