OPTIMASI PRODUKSI ENZIM MANANASE DARI
BAKTERI LAUT
Bacillus subtilis
DENGAN
SUBSTRAT BIOMASSA MANAN
IRFAN PEBI NUGRAHA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Optimasi Produksi Enzim Mananase dari Bakteri Laut Bacillus subtilis dengan Substrat Biomassa Manan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Penelitian ini didanai oleh DIPA Biorefinary, Puslit Bioteknologi LIPI, tahun anggaran 2014. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Juni 2014
Irfan Pebi Nugraha NIM G84100064
iv
ABSTRAK
IRFAN PEBI NUGRAHA. Optimasi Produksi Enzim Mananase dari Bakteri Laut Bacillus subtilis dengan Substrat Biomassa Manan. Dibimbing oleh EDY DJAUHARI PURWAKUSUMAH dan NANIK RAHMANI.
Enzim mananase dapat diaplikasikan secara luas di dunia industri khususnya industri kertas, pakan, pangan, tekstil, detergen, ataupun farmasi. Proses produksi mananase dari Bacillus subtilis dipengaruhi oleh jenis substrat, konsentrasi substrat, pH media produksi, serta suhu fermentasi. Substrat manan murni tidak direkomendasikan untuk produksi karena harganya yang terlalu mahal. Tujuan penelitian ini adalah menentukan jenis substrat alternatif terbaik dari berbagai biomassa manan untuk optimasi produksi mananase dari Bacillus subtilis yang diisolasi dari Laut Bali. Berdasarkan penelitian ini, porang merupakan substrat alternatif terbaik untuk produksi mananase dari Bacillus subtilis dengan nilai aktivitas enzim sebesar 11.29 U/mL. Aktivitas mananase optimum 37,70 U/mL diperoleh dalam 24 jam fermentasi dengan konsentrasi substrat, pH dan suhu masing-masing 1%, pH 8 dan 50oC.
Kata kunci: Bacillus subtilis, manan, mananase
ABSTRACT
IRFAN PEBI NUGRAHA. Optimization Production of Mannanase from Marine Bacterium Bacillus subtilis with Mannan Biomass Subrate. Supervised by EDY DJAUHARI PURWAKUSUMAH and NANIK RAHMANI.
Mananase can be applied widely in the industrial world, such as paper, feed, food, textiles, detergent, or pharmaceutical industries. Mannanase production process is influenced by the type of substrate, substrate concentration, pH of the media production and fermentation temperature. Mannan pure substrate is not recommended because it is too expensive. The aim of this research was to determine alternative substrates of various mannan biomass and the optimum conditions for production of mananase by Bacillus subtilis isolated from Bali sea. Based on this research, porang was the best alternative substrate for production of mananase by Bacillus subtilis with enzyme acitivities of 11.29 U/mL. The maksimum mannanase activity of 37.70 U/mL was achieved following 24 hours of fermentation when substrat concentration, pH and temperature were controlled at 1%, pH 8 and 50◦C respectively.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
OPTIMASI PRODUKSI ENZIM MANANASE DARI
BAKTERI LAUT
Bacillus subtilis
DENGAN
SUBSTRAT BIOMASSA MANAN
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
viii
PRAKATA
Alhamdulillah. Terima kasih, terima kasih, terima kasih. Penulis menghaturkan segala puji bersanding syukur kepada Allah yang telah memberikan karunia-Nya untuk membantu menyelesaikan penulisan skripsi yang berjudul Optimasi Produksi Enzim Mananase dari Bakteri Laut Bacillus subtilis pada Biomassa Manan. Penelitian ini dilaksanakan mulai dari bulan November 2013 sampai dengan Juni 2014 di Laboratorium Biokatalis dan Fermentasi, Bidang Bioproses, Pusat Penelitian Bioteknologi-LIPI Cibinong.
Selesainya proses penelitian dan penulisan skripsi ini penulis hanya bisa mengucapkan banyak terima kasih kepada ibu Nanik rahmani M.Si. dan bapak Drs. Edy Djauhari Purwakusumah M.Si. atas segala arahan dan bimbingan selama penelitian ataupun penulisan skripsi ini. Penulis juga mengucapkan banyak terimakasih terutama bagi kedua orang tua penulis (Ibu dan Bapak) yang telah memberikan dukungan dan motivasi spiritual, kepada Lisnawati yang selalu membantu saya dan memotivasi dalam proses kegiatan penelitian dan penulisan. Terimakasih juga penulis ucapkan kepada bapak Dr. Yopi selaku kepala Laboratorium Biokatalis dan Fermentasi (LBF) Puslit Bioteknologi LIPI. Tidak terkecuali kepada teman-teman di laboratorium (Yuli, Rony, Nadia, Fatia, Mona, Muti, Ajeng, Azizah, Gading, Wida, Kholis, Ari, dkk.), selain itu khususnya kepada Ibu Lia, Pak Diki dan untuk semua civitas LBF yang tidak bisa saya sebutkan namanya satu-persatu penulis mengucapkan terima kasih untuk semua bantuan yang pernah diberikan. Sekali lagi, terima kasih.
Atas segala kekurangan dan ketidaksempurnaan baik dari segi isi ataupun cara penyampaian materi pada skripsi ini penulis memohon maaf, karena penulis menyadari bahwa tulisan ini dibuat sebatas pengetahuan dan pemikiran penulis yang masih dalam tahap pembelajaran. Terakhir, penulis berharap bahwa barisan kata-kata yang terangkai dalam skripsi ini bisa bermanfaat bagi siapapun yang membacanya.
Bogor, Juni 2014
DAFTAR ISI
DAFTAR GAMBAR viii
DAFTAR LAMPIRAN viii
PENDAHULUAN 1
METODE 2
Bahan dan Alat 2
Metode Penelitian 3
HASIL 6
PEMBAHASAN 9
SIMPULAN DAN SARAN 13
Simpulan 13
Saran 13
DAFTAR PUSTAKA 13
LAMPIRAN 16
x
DAFTAR GAMBAR
1 Hasil peremajaan Bacillus subtilis pada media LBG 0.5% 6 2 Hasil analisis pertumbuhan sel pada berbagai biomassa manan 6 3 Hasil analisis aktivitas mananase pada berbagai biomassa manan 7 4 Hasil analisis pertumbuhan sel pada konsentrasi substrat porang 7 5 Hasil analisis aktivitas mananase pada konsentrasi substrat porang 7 6 Hasil analisis pertumbuhan sel pada berbagai kondisi pH 8 7 Hasil analisis aktivitas mananase pada berbagai kondisi pH 8 8 Hasil analisis pertumbuhan sel berbagai variasi suhu 9 9 Hasil analisis aktivitas mananase berbagai variasi suhu 9
DAFTAR LAMPIRAN
1 Alur penelitian 18
2 Kurva standar D-(+)-Manosa 19
3 Hasil perhitungan aktivitas mananase dari Bacillus subtilis pada berbagai jenis biomassa
20 4 Hasil perhitungan aktivitas mananase dari Bacillus subtilis pada
berbagai konsentrasi porang
22 5 Hasil perhitungan aktivitas mananase dari Bacillus subtilis pada
ragam pH media produksi
24 6 Hasil perhitungan aktivitas mananase dari Bacillus subtilis pada
ragam suhu produksi
26 7 Contoh perhitungan aktivitas enzim mananase dari Bacillus subtilis
laut menggunakan substrat porang 0.5% pada jam ke-0 ulangan 1
28 8 Hasil pembacaan spektrofotometer λ = 660 nm kultur bakteri laut
Bacillus subtilis pada berbagai substrat biomassa
29 9 Hasil pembacaan spektrofotometer λ = 660 nm kultur bakteri laut
Bacillus subtilis pada berbagai konsentrasi substrat porang
30 10 Hasil pembacaan spektrofotometer λ = 660 nm kultur bakteri laut
Bacillus subtilis pada beragam pH media produksi
31 11 Hasil pembacaan spektrofotometer λ = 660 nm kultur bakteri laut
Bacillus subtilis pada beragam suhu produksi
PENDAHULUAN
Mananase merupakan enzim penghidrolisis kompleks polisakarida (manan) menjadi bentuk yang lebih sederhana seperti oligosakarida (mano-oligosakarida) dan monosakarida (manosa). Aplikasi mananase untuk saat ini sudah sangat luas terutama untuk bidang bioteknologi dan dunia industri. Hasil hidrolisis manan berupa mano-oligosakarida dapat dimanfaatkan sebagai bahan pangan fungsional pada industri pangan. Industri kertas memanfaatkan mananase dalam tahapan proses bleaching bahan baku kertas, yaitu untuk menggantikan fungsi hidrogen peroksida yang bermanfaat dalam proses ekstraksi lignin pada pulp. Industri kopi instan memerlukan mananase dalam proses pengeringan produk, yaitu untuk menurunkan tingkat viskositas ekstrak kopi dengan memecah kandungan manan pada biji kopi. Mananase juga dibutuhkan pada industri detergen sebagai penghilang kotoran pada pakaian yang terkena noda makanan yang mengandung manan, galaktomanan, guar gum yang biasanya digunakan untuk zat penstabil es krim, saus, gel rambut, dan pasta gigi. Aplikasi lain dari mananase yaitu pada dunia industri pakan ternak, untuk meningkatkan nilai kandungan nutrisi pakan (Dhawan dan Kaur 2007).
Aplikasi enzim mananase yang cukup luas pada berbagai industri tersebut khususnya, memberikan peluang besar untuk memproduksi enzim pendegradasi manan ini dalam skala industri. Dalam proses produksi mananase dibutuhkan suatu sumber yang baik. Salah satu sumber penghasil mananase yang telah banyak diketahui selain hewan dan tumbuhan adalah bakteri (Dhawan dan Kaur 2007). Bakteri dengan kemampuan memproduksi enzim mananase dinamakan sebagai bakteri manolitik, yang dapat ditemukan pada ekosistem daratan ataupun daerah perairan. Penelitian ini difokuskan pada jenis mananase yang dihasilkan oleh bakteri manolitik laut. Pemilihan bakteri laut dikarenakan jenis bakteri dari perairan laut Indonesia belum banyak diteliti dan dikembangkan, selain itu pemilihan jenis bakteri laut juga didasarkan pada sifat dan karakteristik yang unik pada bakteri ataupun enzim yang dihasilkannya. Enzim yang diproduksi oleh mikroba laut memiliki karakter yang lebih stabil dan lebih aktif dibanding enzim sejenis yang bersumber dari hewan atau tumbuhan (Bull et al. 2000). Selain itu diketahui bahwa enzim yang berasal dari mikroba laut memiliki sifat unik yaitu toleran terhadap kadar garam tinggi serta tahan terhadap suhu dan tekanan tinggi serta bersifat adaptif terhadap suhu dingin (Tricone 2011). Bacillus subtilis yang berasaldari perairan pantai Sanur Bali dipilih sebagai sumber penghasil mananase pada penelitian ini.
2 tingkat efisiensi penyerapan yang rendah (Yopi et al. 2006). Biomassa pertanian diketahui memiliki kandungan hemiselulosa yang tinggi dan manan merupakan salah satu koponen penyusun hemiselulosa. Beberapa jenis biomassa yang digunakan sebagai substrat pada penelitian ini yaitu tepung umbi porang, bungkil kelapa sawit, tandan kosong kelapa sawit dan juga bagasse. Biomassa porang dijadikan sebagai kandidat substrat untuk produksi mananase karena umbi porang diketahui mengandung 30.56% glukomanan (Akbar et al. 2013). Sekitar 20-40% komposisi serat dari bungkil kelapa sawit adalah manan (Yopi et al. 2006). Hasil penelitian Samsuri et al. (2007) menyatakan bahwa kandungan lignoselulosa pada bagasse sekitar 52.7% selulosa, 20% hemiselulosa, dan 24.2% lignin. Sebagai hasil samping produksi minyak kelapa sawit, tandan kosong kelapa sawit mengadung 46.77% selulosa, 17.92% hemiselulosa, dan 4.15% lignin (Piarpuzan et al. 2011).
Selain jenis substrat yang tepat, kondisi fermentasi juga perlu diperhatikan agar enzim yang didapat lebih optimum. Kondisi produksi mananase dari bakteri dapat dioptimalkan dengan memperhatikan beberapa faktor diantaranya konsentrasi substrat, pH media serta suhu ketika fermentasi (Sumardi 2005). Proses produksi enzim juga dipengaruhi oleh kondisi aerasi, volume media tumbuh mikroba, serta kecepatan agitasi pada proses fermentasinya (Dan et al. 2012).
Tujuan penelitian ini adalah menentukan substrat biomassa mannan terbaik sebagai substrat alternatif untuk produksi enzim mananase dari bakteri laut Bacillus subtilis. Penelitian ini juga bertujuan menentukan kondisi optimum fermentasinya (konsentrasi substrat media, pH media kultur, suhu fermentasi). Penelitian ini dilaksanakan mulai bulan November 2014 hingga bulan Juni 2014 di Laboratorium Biokatalis dan Fermentasi, Puslit Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia, Cibinong, Bogor.
METODE
Bahan dan Alat
Penelitian ini menggunakan bahan LBG (Locust bean gum), tepung porang, serbuk bagasse, serbuk tandan kosong kelapa sawit (TKKS), serbuk bungkil kelapa sawit (BKS), bakteri laut Bacillus subtilis dari Pantai Sanur, Bali, Artificial Sea Water (ASW), ekstrak khamir, bacto peptone, larutan bufer fosfat pH 6 0.05 M, larutan NaOH 2%, larutan HCl 10%, larutan DNS, larutan bufer standar pH 4, larutan bufer standar pH 7, larutan bufer standar pH 10, akuades, es, alkohol 96%, D-manosa, dan agar.
3
19 300 mL, gelas piala, botol scott, pipet tetes, sudip, cawan petri, ose, botol semprot, termometer, bunsen, gelas ukur, labu takar 10 mL, rak tabung, dan kuvet.
Metode Penelitian
Penelitian ini terbagi atas empat tahap utama yaitu seleksi substrat manan dari berbagai jenis biomassa, optimasi konsentrasi substrat terpilih, optimasi pH media produksi dan optimasi suhu fermentasi.
Peremajaan Bakteri Laut Bacillus Subtilis (Yopi et al. 2006)
Pembuatan Media Peremajaan. Komposisi media yang terdiri dari 3.8% (b/v) Artificial Sea Water (ASW), 0.5% (b/v) substrat Locust Bean Gum (LBG), 0.5% (b/v) agar, 0.1% (b/v) yeast extract dan 0.5% (b/v) bacto peptone dilarutkan dengan akuades, dihomogenkan dengan pengaduk magnetik kemudian disterilisasi dengan autoklaf pada tekanan 1 atm dengan suhu 121oC selama 15 menit. Media kemudian dituang ke dalam cawan petri secara aseptik dalam laminar air flow, dibiarkan dingin dan memadat.
Peremajaan bakteri laut Bacillus subtilis. Bakteri dari stok secara aseptik digoreskan pada media padat dengan ose steril di dalam laminar air flow. Media yang telah ditanami bakteri diinkubasi selama 24-48 jam pada suhu ruang. Sebelum melakukan penanaman, laminar tempat kerja disinari sinar UV terlebih dahulu selama 15 menit untuk membunuh mikroorganisme yang tidak diinginkan sehingga dapat menurunkan risiko kontaminasi sebelum penanaman.
Seleksi Substrat Manan Alternatif dari Berbagai Jenis Biomassa
Media cair untuk proses produksi dibuat dua bagian yaitu untuk proses prekultur sebanyak 10 mL (Erlenmeyer 100 mL) dan kultur sebanyak 30 mL (Erlenmeyer 300 mL). Komposisi media yang terdiri dari 3.8% (b/v) Artificial Sea Water (ASW), 0.1% (b/v) yeast extract dan 0.5% (b/v) bacto peptone dilarutkan dengan akuades, dengan terlebih dahulu ditambahkan substrat porang, LBG, BKS, TKKS dan bagasse sebanyak 0.5% (b/v) pada masing-masing Erlenmeyer, kemudian dihomogenkan dengan pengaduk magnetik kemudian disterilisasi dengan autoklaf pada tekanan 1 atm dengan suhu 121oC selama 15 menit. Bakteri yang telah berhasil diremajakan secara aseptik diinokulasikan pada media prekultur sebanyak satu ose, kemudian diinkubasi dalam inkubator bergoyang pada kecepatan 150 rpm dan suhu 30oC selama satu malam. Prekultur dimasukkan ke dalam media kultur secara aseptik dan diinkubasi selama 120 jam. Pemanenan sel dilakukan setiap 24 jam sebanyak 2 mL. Masing-masing sebanyak 1 mL untuk pengukuran pertumbuhan sel dan preparasi enzim ekstrak kasar.
Optimasi Konsentrasi Substrat Terpilih
4 (b/v), 1% (b/v), 1.5% (b/v) 2% (b/v) dan 2.5% (b/v) pada masing-masing Erlenmeyer, kemudian dihomogenkan dengan pengaduk magnetik kemudian disterilisasi dengan autoklaf pada tekanan 1 atm dengan suhu 121oC selama 15 menit. Bakteri yang telah berhasil diremajakan secara aseptik diinokulasikan pada media prekultur sebanyak satu ose, kemudian diinkubasi dalam shaker pada kecepatan 150 rpm dan suhu 30oC selama satu malam. Prekultur dimasukkan ke dalam media kultur secara aseptik dan diinkubasi selama 120 jam dengan suhu dan kecepatan yang sama dengan prekultur. Pemanenan dilakukan setiap 24 jam sebanyak 2 mL. Masing-masing sebanyak 1 mL untuk pengukuran pertumbuhan sel dan 1 mL lainnya untuk preparasi enzim ekstrak kasar.
Optimasi pH Media Produksi
Optimasi pH media terdiri dari lima variasi pH yaitu 5, 6, 7, 8 dan 9. Media cair untuk proses produksi dibuat dua bagian yaitu untuk proses prekultur sebanyak 10 mL (Erlenmeyer 100 mL) dan kultur sebanyak 30 mL (Erlenmeyer 300 mL) masing-masing 2 ulangan untuk setiap parameter. Komposisi media yang terdiri dari 3.8% (b/v) Artificial Sea Water (ASW), 0.1% (b/v) yeast extract dan 0.5% (b/v) bacto peptone dilarutkan dengan akuades, pH media untuk masing-masing Erlenmeyer diukur dengan menggunakan pH meter, tingkat keasaman media ditepatkan dengan penambahan sedikit asam (larutan HCl 10%) atau sedikit basa (larutan NaOH 2%) dengan pipet tetes. Setelah diukur pH kemudian media ditambahkan substrat terpilih pada masing-masing Erlenmeyer dengan konsentrasi yang telah diperoleh pada optimasi konsentrasi substrat. Media dihomogenkan dengan pengaduk magnetik kemudian disterilisasi dengan autoklaf pada tekanan 1 atm dengan suhu 121oC selama 15 menit. Bakteri yang
5
19 diinkubasi dalam inkubator bergoyang pada kecepatan 150 rpm dan suhu sesuai variasi yang ada yaitu masing-masing 20oC, 30oC, 40oC dan 50oC selama satu malam. Prekultur dimasukkan ke dalam media kultur secara aseptik dan diinkubasi selama 120 jam pada suhu dan kecepatan yang sama dengan prekultur. Pemanenan sel dilakukan setiap 24 jam sebanyak 2 mL. Masing-masing sebanyak 1 mL untuk pengukuran pertumbuhan sel dan 1 mL lainnya untuk preparasi ekstrak kasar enzim mananase.
Pembuatan Kurva Pertumbuhan Sel Bakteri laut Bacillus subtilis (Yopi et al. 2006)
Kurva pertumbuhan sel dibuat dengan cara melakukan pengukuran optical density (OD) 1 mL hasil pemanenan sel setiap 24 jam, mulai dari jam ke-0 sampai jam ke 120. Pengukuran OD dilkukan dengan spektrofotometer UV-Vis pada panjang gelombang 660 nm.
Preparasi Ekstrak Kasar Mananase (Yopi et al. 2006)
Enzim mananase ekstrak kasar didapatkan dari ekstraksi kultur sel dengan cara sentrifugasi pada kecepatan 12000 rpm selama 15 menit pada suhu 4oC,
kemudian supernatan dipindahkan pada microtube ependorf baru dan disentrifugasi pada kecepatan, suhu dan waktu yang sama. Ekstrak enzim mananase dipertahankan pada suhu dingin yaitu minimal 4°C untuk menjaga aktifitas enzimnya (Liu et al. 2011). Hasil ekstraksi enzim (supernatan) yang diperoleh merupakan enzim ekstrak kasar mananase yang siap digunakan untuk proses pengujian.
Analisis Aktivitas Ekstrak Kasar Mananase (Miller 1959)
Aktivitas enzim mananase ditentukan dengan menggunakan metode DNS yang telah dimodifikasi, yaitu mereaksikan 0.25 mL enzim yang telah diencerkan dengan 0.25 mLsubstrat LBG 0.5% (b/v) dalam bufer fosfat pH 6 (0.05 M) dan ditambahkan reagen DNS sebanyak 0.75 mL dalam tabung reaksi, kemudian diinkubasi pada suhu 50°C selama 15 menit. Reaksi dihentikan dengan merendam tabung reaksi berisi sampel dalam air mendidih 100°C selama 15 menit. Gula pereduksi yang dibebaskan ditentukan dengan menggunakan metode DNS (Miller 1959). Warna yang terbentuk diukur dengan spektrofotometer dengan panjang gelombang 540 nm. Nilai absorbansi yang diperoleh dikonversi menjadi konsentrasi gula pereduksi (ppm) menggunakan persamaan yang didapat dari kurva standar manosa. Kurva standar manosa dibuat dengan cara melarutkan 0.01 g D-manosa ke dalam 10 mL bufer fosfat 0.05 M (1000 ppm), kemudian diencerkan secara bertingkat pada konsentrasi 100 ppm sampai 900 ppm. Setiap hasil pengenceran direaksikan sebanyak 0.5 mL dengan 0.75 mL reagen DNS, dipanaskan 15 menit dalam water bath 100oC, didinginkan dalam es selama 10
menit, kemudian diukur nilai absorbansinya dengan spektrofotometer UV-Vis pada panjang gelombang 540 nm. Satu unit aktivitas enzim (U) yaitu jumlah mikromol gula pereduksi yang terbentuk per mL enzim per menit (Kanti 2005).
6 Penambahan NaOH ke dalam komposisi larutan reagen DNS bertujuan untuk memberikan suasana basa ketika reaksi. Reaksi DNS ini merupakan reaksi redoks, gugus aldehid gula pereduksi akan teroksidasi menjadi gugus karboksil, sedangkan DNS (kuning) sebagai oksidator akan tereduksi membentuk 3-amino -5-nitrosalicylic acid (jingga-merah kecolatan) (Sastrohamidjojo 2005).
HASIL
Peremajaan Bakteri Laut Bacillus Subtilis pada Media Padat
Bakteri laut Bacillus subtilis berhasil diremajakan pada media padat mengandung substrat LBG 0.5% (b/v). Pertumbuhan Bacillus subtilis ditandai dengan adanya koloni berwarna putih kecoklatan, sedikit berlendir dan tumbuh pada permukaan media padat (Gambar 1) Bakteri yang diremajakan digunakan untuk perlakuan selanjutnya.
Gambar 1 Peremajaan bakteri laut Bacillus subtilis pada media LBG 0.5% Seleksi Substrat Manan Alternatif dari Berbagai Jenis Biomassa
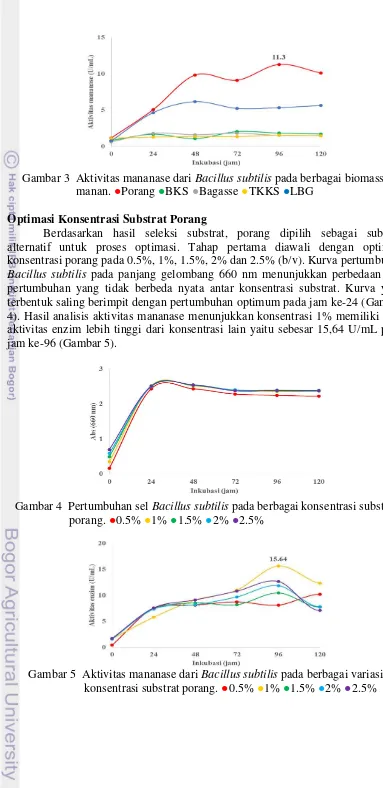
Kurva pertumbuhan sel Bacillus subtilis dengan substrat biomassa manan menunjukkan bahwa porang memiliki nilai pertumbuhan lebih tinggi dibandingkan biomassa lain. Pertumbuhan Bacillus subtilis pada media TKKS dan bagasse memliliki laju yang lambat (Gambar 2). Hasil ananisis aktivitas mananase menunjukkan bahwa tepung porang memiliki nilai aktivitas enzim paling tinggi yaitu 11.3 U/mL pada jam ke-96, nilai ini lebih tinggi dibanding aktivitas enzim pada biomassa BKS, TKKS dan bagasse dengan LBG sebagai pembanding (Gambar 3).
7
19 Gambar 3 Aktivitas mananase dari Bacillus subtilis pada berbagai biomassa
manan. ●Porang ●BKS ●Bagasse ●TKKS ●LBG Optimasi Konsentrasi Substrat Porang
Berdasarkan hasil seleksi substrat, porang dipilih sebagai substrat alternatif untuk proses optimasi. Tahap pertama diawali dengan optimasi konsentrasi porang pada 0.5%, 1%, 1.5%, 2% dan 2.5% (b/v). Kurva pertumbuhan Bacillus subtilis pada panjang gelombang 660 nm menunjukkan perbedaan laju pertumbuhan yang tidak berbeda nyata antar konsentrasi substrat. Kurva yang terbentuk saling berimpit dengan pertumbuhan optimum pada jam ke-24 (Gambar 4). Hasil analisis aktivitas mananase menunjukkan konsentrasi 1% memiliki nilai aktivitas enzim lebih tinggi dari konsentrasi lain yaitu sebesar 15,64 U/mL pada jam ke-96 (Gambar 5).
Gambar 4 Pertumbuhan sel Bacillus subtilis pada berbagai konsentrasi substrat porang. ●0.5% ●1% ●1.5% ●2% ●2.5%
8 Optimasi pH Media Produksi
Proses optimasi produksi mananase dari Bacillus subtilis laut dilanjutkan dengan proses optimasi pH media produksi. Optimasi dilakukan dengan mengggunakan substrat porang 1% pada ragam pH 5, 6, 7, 8, dan 9. Pertumbuhan optimum dari Bacillus subtilis terjadi pada jam ke-96 (gambar 6). Berdasarkan analilisi aktivitas enzim, aktivitas mananase dari Bacillus subtilis laut optimum pada pH 8 dengan waktu inkubasi selama 72 jam, dengan nilai aktivitas enzim mencapai 19,31 U/mL (Gambar 7).
Gambar 6 Pertumbuhan sel Bacillus subtilis dengan substrat porang 1% pada berbagai kondisi pH media produksi. ●5 ●6 ●7 ●8 ●9
Gambar 7 Aktivitas mananase dari Bacillus subtilis dengan substrat porang 1% pada berbagai kondisi pH media produksi.●5 ●6 ●7 ●8 ●9
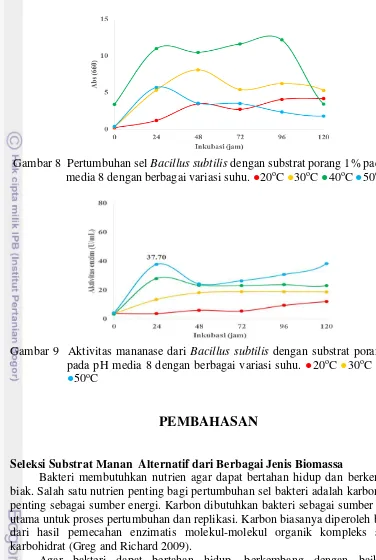
Optimasi Suhu Produksi
9
19 Gambar 8 Pertumbuhan sel Bacillus subtilis dengan substrat porang 1% pada pH
media 8 dengan berbagai variasi suhu. ●20oC ●30oC ●40oC ●50oC
Gambar 9 Aktivitas mananase dari Bacillus subtilis dengan substrat porang 1% pada pH media 8 dengan berbagai variasi suhu. ●20oC ●30oC ●40oC
●50oC
PEMBAHASAN
Seleksi Substrat Manan Alternatif dari Berbagai Jenis Biomassa
Bakteri membutuhkan nutrien agar dapat bertahan hidup dan berkembang biak. Salah satu nutrien penting bagi pertumbuhan sel bakteri adalah karbon yang penting sebagai sumber energi. Karbon dibutuhkan bakteri sebagai sumber energi utama untuk proses pertumbuhan dan replikasi. Karbon biasanya diperoleh bakteri dari hasil pemecahan enzimatis molekul-molekul organik kompleks seperti karbohidrat (Greg and Richard 2009).
10 Manan yang merupakan polisakarida adalah satu-satunya sumber karbon yang ada dalam media, sehingga akan didegradasi menjadi gula yang lebih sederhana seperti monosakarida atau oligosakarida oleh sel bakteri. Polisakarida manan hanya akan terdegradasi menjadi gula sederhana jika sel mensekresikan enzim pendegradasi manan berupa enzim mananase. Mananase akan mendegradasi manan, glukomanan, galaktomanan, galaktoglukomanan menjadi manosa dan gula-gula sederhana lain sehingga karbohidrat yang ada dapat dicerna oleh sel bakteri. Oleh karena itu pemilihan jenis substrat harus tepat agar enzim mananase yang dihasilkan oleh bakteri lebih optimum.
Biomassa yang dihasilkan dari berbagai macam limbah pertanian diketahui memiliki kandungan hemiselulosa yang tinggi. Hemiselulosa diketahui sebagai polisakarida kedua terbanyak di alam yang sangat melimpah setelah selulosa. Hemiselulosa memiliki komponen penyusun utama yang terdiri atas hetero-1,4-β -D-xilan dan hetero-1,4-β-D-manan (galaktoglukomanan, galaktomanan, dan glukomanan). (Sumadi 2005). Fakta ini memungkinkan bahwa biomassa dari limbah pertanian dapat dijadikan substrat manan alternatif.
Kurva pertumbuhan Bacillus subtilis pada berbagai macam substrat menunjukkan laju yang berbeda. Bacillus subtilis yang dikulturkan pada media yang ditambahkan substrat porang memiliki laju pertumbuhan paling tinggi jika dibandingkan pertumbuhan Bacillus subtilis pada media yang ditambahkan substrat dari biomassa lain seperti TKKS, bagasse ataupun BKS. Berdasarkan kurva dapat diketahui bahwa Bacillus subtilis pada media kultur telah tumbuh dengan baik (gambar 2).
Diketahui terdapat 4 fase pertumbuhan bakteri ketika ditumbuhkan pada kultur curah (batch culture), yaitu fase adaptasi (lag phase), fase perbanyakkan (exponential phase), fase statis (stationer phase), dan fase kematian (death phase) (Purwoko, 2007). Berdasarkan analisa pertumbuhan Bacillus subtilis pada media substrat porang, fase lag atau fase penyesuaian bakteri terhadap lingkungannya yang baru terjadi pada jam ke-0 hingga jam ke-24, ditunjukkan dengan garis yang cenderung mendatar dan hanya sedikit naik di awal kurva. Fase log dimulai pada jam ke-24 sampai jam ke-72 di mana bakteri mulai tumbuh dan berkembang secara cepat seiring berjalannya waktu fermentasi, garis kurva cenderung meningkat tajam. Fase stasioner terjadi ketika sel bakteri yang mati dan yang berkembang biak kurang lebih seimbang sehingga membuat garis kurva sedikit mendatar seperti yang terlihat pada kurva sekitar jam ke-72 dan jam ke-96, pada jam ini terjadi aktivitas mananase optimum pada media dengan substrat porang.
Biasanya kurva pertumbuhan diakhiri dengan fase kematian dengan garis kurva yang semakin menurun, hal ini disebabkan habisnya kandungan zat makanan pada media sehingga bakteri tidak mampu berkembang biak dan melakukan metabolisme, keadaan ini menyebabkan jumlah sel yang hidup semakin berkurang (Yuwono 2005). Bentuk kurva yang cenderung mendatar pada jam ke-96 sampai jam ke-120 diperkirakan karena adanya fase adaptasi kembali Bacillus subtilis terhadap suber karbon lain selain manan yang terkandung dalam biomassa, hal ini bersifat wajar karena biomassa tersusun atas berbagai macam karbohidrat (Chuan et al. 2006).
11
19 ekstrak kasar enzim mananase (Gambar 3). Nilai aktivitas enzim mananase menunjukkan banyaknya unit enzim yang diproduksi oleh Bacillus sbutilis laut pada saat fermentasi. Nilai aktivitas mananase pada media yang ditambahkan porang 0.5% sebagai substrat menunjukkan nilai aktivitas enzim sebesar 11.3 U/mL, nilai ini lebih tinggi dibanding nilai aktivitas mananase dengan substrat biomassa lain seperti TKKS, bagasse, dan BKS pada konsentrasi yang sama. Aktivitas enzim tertinggi terjadi pada jam ke-96, ini dapat diartikan bahwa produksi enzim mananase oleh Bacillus subtilis laut paling banyak terjadi pada jam ke-96. Secara analitik, aktivitas enzim mananase pada media substrat porang lebih tinggi dibanding yang lain, antara lain disebabkan karena komposisi tepung porang mengandung persentase manan yang tinggi yaitu sekitar 30.56% glukomanan (Akbar et al. 2013). Konsentrasi manan tersebut lebih tinggi dibanding bungkil kelapa sawit (BKS) yang mengandung sekitar 20-40% manan (Yopi et al. 2010). Biomassa lain seperti bagasse diketahui hanya mengadung 20% hemiselulosa (mengandung manan) dan substansi TKKS terdiri atas 17.92% hemiselulosa (mengandung manan) (Samsuri et al. 2007, Piarpuzan et al. 2011). Penelitian sebelumnya oleh Chuan et al. (2006) pada Bacillus subtilis ATCC3366 menunjukkan aktivitas mananase optimum sebesar 8 U/mL setelah diinkubasi selama 36 jam pada substrat biomassa PKC (palm kernel cake).
Berdasarkan hasil seleksi substrat manan, tepung porang dipilih sebagai substrat terbaik dan digunakan sebagai sumber karbon utama dalam tahap optimasi produksi mananase dari bakteri laut Bacillus subtilis. Media dengan substrat tepung porang memiliki nilai aktivitas mananase lebih tinggi dibanding biomassa lain yang digunakan pada pengujian ini.
Optimasi Konsentrasi Substrat Porang
Pertumbuhan Bacillus subtilis pada proses optimasi konsentrasi substrat porang diamati dari kurva pertumbuhannya (Gambar 4). Berdasarkan kurva, laju pertumbuhan bakteri optimum pada jam ke-24, pertumbuhan meningkat drastis pada rentang jam ke-0 sampai jam ke-24 kemudian menurun di jam selanjutnya hingga hari terakhir pemanenan. Kurva pertumbuhan bakteri laut Bacillus subtilis pada beberapa konsentrasi tidak menunjukkan perbedaan yang signifikan, sehingga garis kurva cenderung saling berimpit. Tidak adanya pengenceran menyebabkan konsentrasi sel yang diukur terlalu tinggi sehingga menyebabkan ketidaktepatan dalam pengukuran nilai absorbansi sampel oleh spektrofotometer. Konsentrasi sampel yang terlalu pekat sangat mempengaruhi nilai OD (optical density)sampel yang terbaca oleh spektrofotometer (Assidqi et al. 2012).
12 memproduksi enzim secara maksimal, namun konsentrasi substrat yang terlalu tinggi (>1%) juga bersifat tidak efektif untuk proses produksi. Konsentrasi substrat yang tinggi membuat molekul mananase berinteraksi dengan substratnya membentuk kompleks enzim dengan dobel substrat yang sifatnya tidak produktif, sehingga aktivitas enzim menjadi rendah (Sumardi 2005). Konsentrasi substrat yang terlalu tinggi pada proses kultur dapat menyebabkan penurunan laju transfer oksigen yang penting bagi proses metabolisme mikroba, karena konsentrasi substrat yang tinggi dapat membatasi gerak pencampuran media oleh shaker (Purwadaria et al. 2003).
Optimasi pH media Produksi
Berdasarkan kurva pertumbuhan Bacillus subtilis memiliki pH optimum 6 untuk pertumbuhannya (Gambar 6), namun berbeda dengan pH optimum untuk produksi enzimnya yang optimum pada pH 8 (Gambar 7). Produksi mananase pada pH 5 dan pH 9 sangat rendah jika dilihat dari nilai aktivitas enzimnya, hal ini dikarenakan kondisi media yang terlalu asam atau terlalu basa yang menyebabkan penghambatan proses produksi enzim. Nilai pH diketahui dapat mempengaruhi konformasi enzim mananase (Sumardi 2005). Konformasi enzim akan berubah jika berada pada kondisi pH terlalu asam atau terlalu basa (Agustini 2009).
Sejalan dengan penelitian sebelumnya oleh Dan et al. (2012) yang menyatakan bahwa bakteri jenis Bacillus sp. HDYM-05 optimum memproduksi mananase pada pH 8. Namun Jiang et al. (2006) menyatakan bahwa pH optimum untuk Bacillus subtilis adalah pH 6. Selain itu Bacillus sp. memiliki pH optimum untuk proses produksi mananase pada pH 6.5 (Meenakshi et al. 2010). Berbeda dengan Bacillus subtilis IE dan Bacillus pumilus S5 pada penelitian Adebayo et al. (2013) yang yang menyatakan bahwa enzim mananase diproduksi secara optimum pada kondisi media pH 5.
Berdasarkan kurva, nilai aktivitas enzim optimum untuk pH 8 terjadi sekitar jam ke-72. Hasil ini menunjukkan bahwa perubahan pH media mempengaruhi waktu optimum produksi mananase oleh Bacillus subtilis. Waktu optimum produksi enzim mananase berubah dari jam ke-96 menjadi jam ke-72 setelah dilakukan proses optimasi pada pH medianya. Sejalan dengan Gupta et al. (2003) yang menyatakan bahwa induksi perubahan morfologi bakteri dan sekresi enzim dipengaruhi oleh kondisi pH media tumbuh bakteri.
Optimasi Suhu Produksi
Metabolisme suatu organisme tidak terlepas dari kondisi lingkungannya, termasuk pengaruh suhu. Suhu diketahui mampu mengendalikan pertumbuhan bakteri dan mempengaruhi laju pertumbuhannya, selain itu suhu juga mempengaruhi jumlah total pertumbuhan dari suatu organisme (Pelczar dan Chan 2008). Suhu merupakan faktor penting yang dapat mempercepat atau bahkan memperlambat laju metabolisme suatu organisme termasuk bakteri yang dikulturkan pada media fermentasi. Oleh sebab itu perlu dilakukan optimasi suhu pada proses produksi mananase dari Bacillus subtilis laut.
13
19 pada temperatur 50oC, dengan nilai aktivitas mananase sebesar 37.70 U/mL pada
jam ke-24 (Gambar 9). Pertumbuhan Bacillus subtilis meningkat sejalan dengan bertambahnya suhu. Dapat dilihat dari kurva pertumbuhannya ketika suhu dinaikan hingga 40oC pertumbuhannya meningkat drastis namun kembali menurun pada suhu 50oC. Terlihat bahwa pertumbuhan Bacillus subtilis sangat
dipengaruhi oleh perubahan suhu dengan perubahan temperatur pada rentang 10oC (Prescott et al. 2008). Berdasarkan pertumbuhannya bakteri ini digolongkan ke dalam kelompok mesofilik, yang tumbuh optimum pada temperatur 30oC-45oC
(Tang et al. 2009), namun optimum memproduksi mananase pada suhu 50oC. Penelitian sebelumnya oleh Younis et al. (2010) menyatakan bahwa Bacillus subtilis KO strain tubuh dengan baik pada temperatur 45oC dengan waktu
optimum pertumbuhan 24 jam pada substrat mollase. Sedangkan Jiang et al. (2006) menyatakan kondisi optimum untuk produksi mananase dari Bacillus subtilis WY34 adalah 50oC, dengan substrat porang 2% dan pH optimum 6.
SIMPULAN DAN SARAN
Simpulan
Porang merupakan substrat alternatif terbaik untuk proses produksi enzim mananase dari bakteri laut Bacillus subtilis karena memiliki nilai aktivitas enzim mananase yang lebih tinggi dibanding biomassa lain seperti TKKS, BKS dan bagasse yaitu sebesar 11.29 U/mL. Proses optimasi produksi enzim mananase telah berhasil dilakukan dengan menggunakan substrat porang pada konsentrasi 1% dan pH media 8 dengan suhu 50oC. Produksi enzim mananase mengalami peningkatan setelah tahap optimasi berdasarkan nilai aktivitas enzimnya, dari 11.29 U/mL pada jam ke-96 menjadi 37.70 U/mL pada jam ke-24.
Saran
Proses optimasi dilengkapi dengan parameter-parameter lain seperti aerasi, kecepatan agitasi, dan penambahan garam-garam mineral yang dibutuhkan untuk pertumbuhan Bacillus subtilis agar proses produksi dapat lebih dioptimalkan. Enzim dapat dipurifikasi agar lebih murni dan dapat diaplikasikan secara luas.
DAFTAR PUSTAKA
Adebayo-tayo B, Elelu T, Akinola G, Oyinloye I. 2013. Screening and production of mannanase by Bacillus strains isolated from fermented food condiments. IRFB 13: 53-62.
14 Assidqi K, Tjahjaningsih W, Sigit S. 2012. The potentials of leaves extracts of patikan kebo (Euphorbia hirta) as antibacterial against Aeromonas hydrophila in vitro. Journal of Marine and Coastal Science.1(2), 113-124. Akbar H, Supriyanto A, Haryani K. 2013. Karakterisasi tepung konjak dari
tanaman iles-iles (Amorphallus oncophyllus) di Daerah Guning Kreo Semarang Jawa Tengah. J Chem Tech Ind 2 (4): 4-47.
Arisman. 2009. Buku Ajar Ilmu Gizi. Jakarta: Penerbit buku kedokteran EGC. Bull AT, Ward AC, Goodfellow M. 2000. Search and discovery strategies for
biotechnology: The Paradim Shift. Microbiol. Mol. Biol. Rev. 64 (3): 573. Chuan CH, Krishnaiah K, Wong CM, Janaun J. 2006. Palm Kernel Cake as
Substrate for β-Mannanase production by Bacillus subtilis ATCC336 under Submerged and Solid State Fermentation. Proceedings of the 1st International Conference on Natural Resource Engineering & Technology 182-185.
Dan Z, Wenxiang P, Gang S, hongzhi L, Xue L, Jingping G. 2012. Optimization of mannanase production by Bacillus sp. hdym-05 through factorial method and response surface methodology. Afr. J. Microbiol. Res. 6 (1): 176-182.
Dhawan S, Kaur J. 2007. Microbial mannanases: An overview of production and applications. Critical Reviews in Biotechnology 27: 197–216.
Greg A. Somerville dan Richard A. Proctor. 2009. At the crossroads of bacterial metabolism and virulence factor synthesis in Staphylococci. Microbiol. Mol. Biol. Rev. 73(2): 233.
Gupta R, Gigras P, Mohapatra H, Goswami VK, Chauhan B. 2003. Microbial-amylases: a biotechnological perspective. Journal of Process. Biochem. 38: 1599-1616.
Jiang Z, Wei Y, Li D, Li L, Chai P, dan Kusakabe I. 2006. High-level production, purification, and characterization of a thermostable β-mannanase from the newly isolated Bacillus subtilis WY34. J. Carbo Polys. 66:89-96.
Kanti Atit. 2005. Cellulolytic actinomycetes isolated from soil in Bukit Duabelas National Park, Jambi. J. Biol Diversity. 6(2): 85-89.
Liu J, Zhang Z, Zhu H, Dang H, Lu J, Cui Z. 2011. Isolation and characterization of α-amilase from marine Pseudomonas sp. K6-28-040. J Biotech 10 (14): 2733 -2740.
Meenakshi M, Singh G, Bhalla A, Hoondal GS. 2010. Solid State fermentation and characterization of partially purified thermostable mannanase krom Bacillus sp. MG-33. Bioresource. 5(3):1689-1701.
Miller GL. 1959. Use of dinitrosalisylic acid reagent for determination of reducing sugar. Anal Chem 31(3):426–428.
15
19 Piarpuzan D, Quintero JA, Cardona CA. 2011. Empty fruit bunches from palm as a potential raw material for fuel ethanol production. Biomass and Bioenergy 35: 1130-1137.
Purwadaria T, Haryati T, Frederick E, Tangendjaja B. 2003. Optimation of β-mannanase production on submerged culture of Eupenicillium javanicum as well as pH and temperature enzyme characterization. JITV 8 (1).
Samsuri M, Gozan M, Mardias R, Baiquni M, Hermansyah H, Wijanarko A, Prasetya B, Nasikin M. 2007. Pemanfaatan selulosa bagas untuk produksi etanol melalui sakarifikasi dan fermentasi serentak dengan enzim xilanase. Makara Teknologi 11 (1): 17-24.
Sastrohamidjojo. 2005. Kimia Organik, Sterokimia, Lemak, dan Protein. Yogyakarta: Gadjah Mada University Press.
Sumardi. 2005. Optimasi produksi enzim β-mananase ekstraseluler dari bakteri Geobacillus Stearothermophilus L-07. J. Sains Tek. 11: 2.
Tricone A. 2011. Marine biocatalyst: enzymatic features and apllication. Mar. Drugs. 9: 478-499.
Yopi, Purnawan A, Thontowi A, Hermansyah H, Wijanarko A. 2006. Preparasi manan dan mananase kasar dari bungkil kelapa sawit. Jurnal Teknologi 4: 312-319.
Yopi, Susilaningsih D, Purnawan A, Hermansyah H, Thontowi A, Djohan AC, Praharyawan S, Lisdiyanti. 2010. Palm kernel cake biomass fermentation using stirrer fermentor for mananase and saccharides production. Prosiding Asean-Korea Symposium and Workshop on Biorefinery Technology 455-459.
Younis Magdi AM, Hezayen Francis F, Nour-Eiden MA, Shabeb MSA. 2010. Optimization of cultivation medium and growth condition for Bacillus subtilis KO strain isolated from sugar cane molasses. American-Eurasian J. Agric. And Envviron. Sci. 7(1): 31-37.
Yuliana Neti. 2008. Kinetika pertumbuhan bakteri asam laktat isolat T5 yang berasal dari tempoyak. Industrial Tech J and Agric. 13(2).
17
Lampiran 1 Alur Penelitian
Proses yang dilakukan pada tahap seleksi substrat dan optimasi: 1. Prekultur
2. Kultur
3. Pengukuran pertumbuhan sel 4. Preparasi enzim ekstrak kasar 5. Analisis aktivitas enzim
PEREMAJAAN Bacillus subtilis
SELEKSI SUBSTRAT ALTERNATIF (BKS, TKKS, Bagasse, Porang)
OPTIMASI PRODUKSI ENZIM MANANASE
Optimasi konsentrasi substrat
Optimasi pH media produksi
21
19 Lampiran 3 Hasil perhitungan aktivitas mananase dari Bacillus subtilis pada berbagai jenis biomassa
Jenis
biomassa Inkubasi
Sample Kontrol S-K ppm (mg/L) mg/mL U/mL Aktivitas
mananase (U/mL)
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2
Porang
0 0.063 0.066 0.023 0.023 0.040 0.043 31.345 32.379 0.031 0.032 1.161 1.199 1.180 24 0.340 0.397 0.022 0.022 0.318 0.375 127.207 146.862 0.127 0.147 4.711 5.439 5.075 48 0.816 0.663 0.020 0.020 0.796 0.643 292.034 239.276 0.292 0.239 10.816 8.862 9.839 72 0.736 0.631 0.020 0.020 0.716 0.611 264.448 228.241 0.264 0.228 9.794 8.453 9.123 96 0.870 0.842 0.023 0.023 0.847 0.819 309.621 299.966 0.310 0.300 11.467 11.110 11.288 120 0.827 0.690 0.018 0.018 0.809 0.672 296.517 249.276 0.297 0.249 10.982 9.232 10.107
BKS
0 0.030 0.040 0.020 0.023 0.012 0.017 21.690 23.414 0.022 0.023 0.803 0.867 0.835 24 0.082 0.161 0.029 0.021 0.024 0.140 25.828 65.828 0.026 0.066 0.957 2.438 1.697 48 0.092 0.077 0.017 0.029 0.020 0.048 24.448 34.103 0.024 0.034 0.905 1.263 1.084 72 0.123 0.225 0.016 0.038 0.033 0.187 28.931 82.034 0.029 0.082 1.072 3.038 2.055 96 0.112 0.189 0.015 0.032 0.030 0.157 27.897 71.690 0.028 0.072 1.033 2.655 1.844 120 0.113 0.182 0.024 0.035 0.022 0.147 25.138 68.241 0.025 0.068 0.931 2.527 1.729
Bagasse
0 0.020 0.071 0.033 0.061 -0.013 0.010 13.069 21.000 0.013 0.021 0.484 0.778 0.636 24 0.086 0.148 0.019 0.030 0.067 0.118 40.655 58.241 0.041 0.058 1.506 2.157 1.831 48 0.065 0.149 0.028 0.034 0.037 0.115 30.310 57.207 0.030 0.057 1.123 2.119 1.621 72 0.072 0.175 0.023 0.039 0.049 0.136 34.448 64.448 0.034 0.064 1.276 2.387 1.831 96 0.058 0.140 0.015 0.045 0.043 0.095 32.379 50.310 0.032 0.050 1.199 1.863 1.531 120 0.058 0.133 0.020 0.034 0.038 0.099 30.655 51.690 0.031 0.052 1.135 1.914 1.524
22 Lanjutan
Jenis
biomassa Inkubasi
Sample Kontrol S-K ppm (mg/L) mg/mL U/mL Aktivitas
mananase (U/mL)
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2
TKKS
0 0.041 0.069 0.016 0.014 0.025 0.055 26.172 36.517 0.026 0.037 0.969 1.352 1.147 24 0.049 0.084 0.017 0.013 0.032 0.071 28.586 42.034 0.029 0.042 1.059 1.557 1.308 48 0.060 0.085 0.021 0.009 0.039 0.076 31.000 43.759 0.031 0.044 1.148 1.621 1.384 72 0.077 0.088 0.027 0.026 0.050 0.062 34.793 38.931 0.035 0.039 1.289 1.442 1.365 96 0.083 0.091 0.018 0.012 0.065 0.079 39.966 44.793 0.040 0.045 1.480 1.659 1.569 120 0.097 0.071 0.015 0.022 0.082 0.049 45.828 34.448 0.046 0.034 1.697 1.276 1.486
LBG
23
19 Lampiran 4 Hasil perhitungan aktivitas mananase dari Bacillus subtilis pada berbagai konsentrasi substrat
Konsentrasi
porang Inkubasi
Sample Kontrol S-K ppm (mg/L) mg/mL U/mL Aktivitas
mananase (U/mL)
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2
0.5%
0 0.102 0.099 0.056 0.038 0.046 0.061 33.414 38.586 0.033 0.039 1.238 1.429 0.429 24 0.106 0.111 0.047 0.036 0.059 0.075 37.897 43.414 0.038 0.043 7.018 8.040 7.529 48 0.113 0.141 0.035 0.066 0.078 0.075 44.448 43.414 0.044 0.043 8.231 8.040 8.135 72 0.062 0.173 0.031 0.032 0.031 0.141 28.241 66.172 0.028 0.066 5.230 12.254 8.742 96 0.087 0.126 0.034 0.026 0.053 0.100 35.828 52.034 0.036 0.052 6.635 9.636 8.135 120 0.123 0.149 0.026 0.028 0.097 0.121 51.000 59.276 0.051 0.059 9.444 10.977 10.210
1%
0 0.140 0.128 0.049 0.061 0.091 0.067 48.931 40.655 0.049 0.041 1.812 1.506 1.659 24 0.099 0.078 0.047 0.050 0.052 0.028 35.483 27.207 0.035 0.027 6.571 5.038 5.804 48 0.168 0.106 0.047 0.044 0.121 0.062 59.276 38.931 0.059 0.039 10.977 7.209 9.093 72 0.167 0.125 0.021 0.028 0.146 0.097 67.897 51.000 0.068 0.051 12.573 9.444 11.008 96 0.234 0.212 0.023 0.035 0.211 0.177 90.310 78.586 0.090 0.079 16.724 14.553 15.638 120 0.186 0.148 0.026 0.024 0.160 0.124 72.724 60.310 0.073 0.060 13.467 11.169 12.318
1.5%
0 0.147 0.111 0.056 0.050 0.091 0.061 48.931 38.586 0.049 0.039 1.812 1.429 1.620 24 0.087 0.108 0.039 0.026 0.048 0.082 34.103 45.828 0.034 0.046 6.315 8.487 7.401 48 0.124 0.112 0.030 0.040 0.094 0.072 49.966 42.379 0.050 0.042 9.253 7.848 8.550 72 0.117 0.101 0.029 0.034 0.088 0.067 47.897 40.655 0.048 0.041 8.870 7.529 8.199 96 0.123 0.163 0.032 0.028 0.091 0.135 48.931 64.103 0.049 0.064 9.061 11.871 10.466 120 0.076 0.128 0.026 0.037 0.050 0.091 34.793 48.931 0.035 0.049 6.443 9.061 7.752
24 Lanjutan
Konsentrasi
Prang Inkubasi
Sample Kontrol S-K ppm (mg/L) mg/mL U/mL Aktivitas
mananase (U/mL)
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2
2%
0 0.132 0.116 0.042 0.055 0.090 0.061 48.586 38.586 0.049 0.039 1.799 1.429 1.614 24 0.118 0.096 0.039 0.046 0.079 0.050 44.793 34.793 0.045 0.035 8.295 6.443 7.351 48 0.136 0.107 0.040 0.048 0.096 0.059 50.655 37.897 0.051 0.038 9.381 7.018 8.199 72 0.131 0.118 0.023 0.024 0.108 0.094 54.793 49.966 0.055 0.050 10.147 9.253 9.700 96 0.165 0.153 0.023 0.025 0.142 0.128 66.517 61.690 0.067 0.062 12.318 11.424 11.871 120 0.122 0.089 0.038 0.029 0.084 0.060 46.517 38.241 0.047 0.038 8.614 7.082 7.848
2.5%
0 0.131 0.135 0.044 0.053 0.087 0.082 47.552 45.828 0.048 0.046 1.761 1.697 1.729 24 0.125 0.085 0.047 0.027 0.078 0.058 44.448 37.552 0.044 0.038 8.231 6.954 7.592 48 0.156 0.126 0.045 0.053 0.111 0.073 55.828 42.724 0.056 0.043 10.338 7.912 9.125 72 0.174 0.114 0.024 0.027 0.150 0.087 69.276 47.552 0.069 0.048 12.829 8.806 10.817 96 0.169 0.179 0.027 0.026 0.142 0.153 66.517 70.310 0.067 0.070 12.318 13.020 12.669 120 0.087 0.103 0.039 0.030 0.048 0.073 34.103 42.724 0.034 0.043 6.315 7.912 7.113
25
19 Lampiran 5 Hasil perhitungan aktivitas mananase dari Bacillus subtilis pada ragam pH media produksi
pH media Inkubasi
Sample Kontrol S-K ppm (mg/L) mg/mL U/mL Aktivitas
mananase (U/mL)
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2
5
0 0.050 0.051 0.028 0.028 0.022 0.023 25.138 25.483 0.025 0.025 4.655 4.719 4.687 24 0.122 0.074 0.024 0.025 0.098 0.049 51.345 34.448 0.051 0.034 9.508 6.379 7.943 48 0.164 0.080 0.023 0.021 0.141 0.059 66.172 37.897 0.066 0.038 12.254 7.018 9.636 72 0.196 0.071 0.026 0.023 0.170 0.048 76.172 34.103 0.076 0.034 14.106 6.315 10.210 96 0.198 0.070 0.017 0.020 0.181 0.050 79.966 34.793 0.080 0.035 14.808 6.443 10.625 120 0.206 0.073 0.023 0.017 0.183 0.056 80.655 36.862 0.081 0.037 14.936 6.826 10.881
6
0 0.104 0.122 0.043 0.040 0.061 0.082 38.586 45.828 0.039 0.046 7.146 8.487 7.816 24 0.099 0.122 0.045 0.045 0.054 0.077 36.172 44.103 0.036 0.044 6.699 8.167 7.583 48 0.196 0.173 0.050 0.046 0.146 0.127 67.897 61.345 0.068 0.061 12.573 11.360 11.965 72 0.209 0.192 0.046 0.055 0.163 0.137 73.759 64.793 0.074 0.065 13.659 11.999 12.829 96 0.181 0.185 0.031 0.055 0.150 0.130 69.276 62.379 0.069 0.062 12.829 11.552 12.190 120 0.162 0.183 0.050 0.039 0.112 0.144 56.172 67.207 0.056 0.067 10.402 12.446 11.424
7
0 0.047 0.044 0.029 0.028 0.018 0.016 23.759 23.069 0.024 0.023 4.400 4.272 4.336 24 0.133 0.122 0.028 0.025 0.105 0.097 53.759 51.000 0.054 0.051 9.955 9.444 9.6995 48 0.233 0.231 0.023 0.020 0.210 0.211 89.966 90.310 0.090 0.090 16.660 16.724 16.692 72 0.155 0.198 0.026 0.023 0.129 0.175 62.034 77.897 0.062 0.078 11.488 14.425 12.955 96 0.241 0.201 0.023 0.026 0.218 0.175 92.724 77.897 0.093 0.078 17.171 14.425 15.798 120 0.270 0.261 0.025 0.023 0.245 0.238 102.03 99.621 0.102 0.100 18.895 18.448 18.671
26 Lanjutan
pH media Inkubasi
Sample Kontrol S-K ppm (mg/L) mg/mL U/mL Aktivitas
mananase (U/mL)
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2
8
0 0.067 0.045 0.049 0.042 0.018 0.003 23.759 18.586 0.024 0.019 4.400 3.442 3.921 24 0.184 0.222 0.042 0.042 0.142 0.180 66.517 79.621 0.067 0.080 12.318 14.745 13.536 48 0.267 0.287 0.046 0.040 0.221 0.247 93.759 102.724 0.094 0.103 17.363 19.023 18.193 72 0.298 0.286 0.040 0.041 0.258 0.245 106.517 102.034 0.107 0.102 19.725 18.895 19.31 96 0.303 0.260 0.051 0.039 0.252 0.221 104.448 93.759 0.104 0.094 19.342 17.363 18.352 120 0.294 0.279 0.042 0.043 0.252 0.236 104.448 98.931 0.104 0.099 19.342 18.321 18.831
9
27
19 Lampiran 6 Hasil perhitungan aktivitas mananase dari Bacillus subtilis pada ragam suhu produksi
Suhu
fermentasi Inkubasi
Sample Kontrol S-K ppm (mg/L) mg/mL U/mL Aktivitas
mananase (U/mL)
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2
20oC
0 0.090 0.084 0.076 0.076 0.014 0.008 22.379 20.310 0.022 0.020 4.144 3.761 3.9525 24 0.096 0.090 0.082 0.085 0.014 0.005 22.379 19.276 0.022 0.019 4.144 3.570 3.857 48 0.061 0.055 0.010 0.016 0.051 0.039 35.138 31.000 0.035 0.031 6.507 5.741 6.124 72 0.090 0.107 0.062 0.063 0.028 0.044 27.207 32.724 0.027 0.033 5.038 6.060 5.549 96 0.159 0.155 0.064 0.055 0.095 0.100 50.310 52.034 0.050 0.052 9.317 9.636 9.476 120 0.197 0.183 0.049 0.054 0.148 0.129 68.586 62.034 0.069 0.062 12.701 11.488 12.094
30oC
0 0.067 0.045 0.049 0.047 0.018 -0.002 23.759 16.862 0.024 0.017 4.400 3.123 3.7615 24 0.184 0.222 0.042 0.042 0.142 0.180 66.517 79.621 0.067 0.080 12.318 14.745 13.535 48 0.267 0.287 0.046 0.040 0.221 0.247 93.759 102.724 0.094 0.103 17.363 19.023 18.193 72 0.298 0.286 0.051 0.041 0.247 0.245 102.74 102.034 0.103 0.102 19.023 18.895 18.959 96 0.310 0.260 0.040 0.039 0.270 0.221 110.65 93.759 0.111 0.094 20.492 17.363 18.927 120 0.294 0.279 0.042 0.043 0.252 0.236 104.44 98.931 0.104 0.099 19.342 18.321 18.831
40oC
0 0.078 0.082 0.074 0.078 0.004 0.004 18.931 18.931 0.019 0.019 3.506 3.506 3.506 24 0.440 0.517 0.090 0.089 0.350 0.428 138.21 165.138 0.138 0.165 25.600 30.581 28.090 48 0.350 0.312 0.015 0.018 0.335 0.294 133.06 118.931 0.133 0.119 24.642 22.024 23.333 72 0.396 0.339 0.056 0.057 0.340 0.282 134.79 114.793 0.135 0.115 24.962 21.258 23.110 96 0.411 0.343 0.059 0.051 0.352 0.292 138.93 118.241 0.139 0.118 25.728 21.897 23.812 120 0.377 0.340 0.048 0.047 0.329 0.293 131.00 118.586 0.131 0.119 24.259 21.960 23.109
28 Lanjutan
Suhu
fermentasi Inkubasi
Sample Kontrol S-K ppm (mg/L) mg/mL U/mL Aktivitas
mananase (U/mL)
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2
50oC
27
Lampiran 7 Contoh perhitungan aktivitas enzim mananase dari Bacillus subtilis laut menggunakan substrat porang 0.5% pada jam ke-0 ulangan 1 Sampel – kontrol = 0.102 – 0.056 = 0.0046
y = 0.046
Persamaan garis yang diperoleh adalah y=0.0029x - 0.0509, maka y = 0.0029x - 0.0509 x = y + 0.0509
0.0029 Sehingga
x = y + 0.0509 = 0.046 + 0.0509 = 33.414 ppm
0.0029 0.0029
Karena 1 ppm setara dengan 1 mg/L, maka 33.414 ppm = 33.414 = 0.0334 mg/mL
1000
Aktivitas Enzim = C x fp x 1000 t x BM
= [0.0334] x 100x 1000 = 1.238 U/mL 15x 180
Ket : C = konsentrasi (mg/mL) fp =faktor pengenceran t = waktu reaksi (menit)
30 Lampiran 8 Hasil pembacaan spektrofotometer λ = 660 nm kultur bakteri laut
Bacillus subtilis pada berbagai substrat biomassa
Jenis substrat Inkubasi Sampel Rata-rata (S)
30
19 Lampiran 10 Hasil pembacaan spektrofotometer λ = 660 nm kultur bakteri laut
Bacillus subtilis pada beragam pH media produksi
pH media Inkubasi Sampel Rata-rata (S)
Lampiran 11 Hasil pembacaan spektrofotometer λ = 660 nm kultur bakteri laut Bacillus subtilis pada beragam suhu produksi
32
19