KONDISI OPTIMUM UNTUK PRODUKSI ENZIM
MANANASE EKSTRASELULER DARI Bacillus
subtilis YANG DIISOLASI DARI AIR LAUT BALI
RONY MASRI RAMADANA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Kondisi Optimum untuk Produksi Enzim Mananase Ekstraseluler dari Bacillus subtilis yang diisolasi dari Air Laut Bali adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Mei 2014 Rony Masri Ramadana G84100032
ABSTRAK
RONY MASRI RAMADANA. Kondisi Optimum untuk Produksi Enzim Mananase Ekstraseluler dari Bacillus subtilis yang diisolasi dari Air Laut Bali. Dibimbing oleh SURYANI dan NANIK RAHMANI.
Enzim mananase banyak digunakan pada industri makanan, pakan, farmasi, kertas, maupun gas, namun enzim mananase dari bakteri laut masih sedikit diteliti. Tujuan dari penelitian ini adalah untuk memperoleh kondisi optimum produksi enzim mananase dari isolat bakteri Bacillus subtilis yang diisolasi dari Laut Bali. Kondisi yang diamati berupa konsentrasi substrat locust bean gum (LBG) optimum, pH optimum, dan suhu inkubasi optimum. Kondisi optimum untuk produksi enzim tersebut ditentukan berdasarkan nilai aktivitas enzim yang dihasilkan. Pengujian aktivitas enzim dilakukan dengan menggunakan metode Dinitrosalicylic Acid (DNS). Berdasarkan hasil penelitian, diperoleh nilai aktivitas enzim tertinggi sebesar 20.978 U/mL pada jam ke-48. Bacillus subtilis dapat menghasilkan enzim mananase ekstraseluler pada kondisi optimum dengan konsentrasi substrat LBG 1%, pH media 6, dan suhu inkubasi 400C.
Kata kunci: mananase, manan, optimasi, Bacillus subtilis, bakteri laut
ABSTRACT
RONY MASRI RAMADANA. Optimum Condition for Production Extracellular Mannanase from Bacillus subtilis isolated from Bali’s Sea Water. Supervised by SURYANI and NANIK RAHMANI.
Mannanase widely used in food, feed, pharmaceutical, paper, and gas industries, but mannanase from marine bacteria has been researched just in a few number. The objective of this research was to obtain the optimum condition for production extracellular mannanase enzyme from Bacillus subtilis isolated from Bali Sea. Conditions which have seen are optimum concentration locust bean gum (LBG) substrate, optimum pH, and optimum incubation temperature. The optimum condition for production of enzyme was determined by the value of enzyme activity. Enzime activity assays performed using the Dinitrosalicylic Acid (DNS) method. Result showed that the highest enzyme activity was 20.978 U/mL at 48 hours. Bacillus subtilis produced extracellular mannanase in optimum condition with LBG substrate concentration 1%, pH 6, and incubation temperature 400C.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biokimia
KONDISI OPTIMUM UNTUK PRODUKSI ENZIM
MANANASE EKSTRASELULER DARI Bacillus
subtilis YANG DIISOLASI DARI AIR LAUT BALI
RONY MASRI RAMADANA
DEPARTEMEN BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Skripsi : Kondisi Optimum untuk Produksi Enzim Mananase Ekstraseluler dari Bacillus Subtilis yang diisolasi dari Air Laut Bali
Nama : Rony Masri Ramadana NIM : G84100032
Disetujui oleh
Dr. Suryani, S.P, M.Sc
Pembimbing I
Nanik Rahmani, M.Si
Pembimbing II
Diketahui oleh
Dr. Ir. I Made Artika, M.App.Sc Ketua Departemen
PRAKATA
Puji syukur kepada Allah subhanahu wa ta’ala atas rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan penyusunan karya ilmiah yang berjudul Kondisi Optimum untuk Produksi Enzim Mananase Ekstraseluler dari Bacillus subtilis yang diisolasi dari Air Laut Bali. Penelitian ini merupakan proyek penelitian dari LIPI Cibinong atas nama Nanik Rahmani, M.Si pada laboratorium Biokatalis dan Fermentasi, Bidang Bioproses, Bioteknologi.
Penulis menyadari bahwa kelancaran selama penyusunan karya ilmiah ini tidak lepas dari kontribusi beberapa pihak. Ucapan terima kasih terutama ditujukan kepada Dr. Suryani, S.P, M.Sc dan Nanik Rahmani, M.Si selaku dosen pembimbing yang telah membimbing serta memberi saran dan kritik yang membangun. Ucapan terima kasih penulis sampaikan kepada Ibu Nanik Rahmani, M.Si yang telah membantu untuk mendanai penelitian ini. Ucapan terima kasih juga penulis sampaikan kepada Pak Yopi, Mbak Lia, Mbak Kia, Mas Diki, dan Pak Awan, di Laboratorium Biorekayasa Lingkungan, Bioproses, Pusat Penelitian Biotekologi LIPI Cibinong, Bogor. Penulis juga mengucapkan terima kasih kepada Ama, Apa, Uda, Kak Ija, Nindy, Bakhri, Nita, Nazul, Mbak Nisa dan teman-teman atas dukungan yang selalu diberikan.
Penulis mengharapkan kritik dan saran yang membangun untuk memperbaiki isi karya ilmiah ini. Semoga tulisan ini bermanfaat dalam bidang ilmu pengetahuan khususnya biokimia serta memberikan kemaslahatan bagi masyarakat.
Bogor, Mei 2014 Rony Masri Ramadana
DAFTAR ISI
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN ... 1
METODE ... 2
Bahan dan Alat ... 2
Prosedur Analisis Data ... 2
HASIL ... 5
Hasil Peremajaan Isolat Bacillus subtilis ... 5
Konsentrasi Optimum Substrat LBG untuk Produksi Enzim Mananase ... 5
Kondisi pH Media Optimum untuk Produksi Enzim Mananase ... 6
Suhu Inkubasi Optimum untuk Produksi Enzim Mananase ... 8
PEMBAHASAN ... 9
Konsentrasi Optimum Substrat LBG untuk Produksi Enzim Mananase ... 9
Kondisi pH Optimum Media untuk Produksi Enzim Mananase ... 10
Suhu Inkubasi Optimum untuk Produksi Enzim Mananase ... 10
SIMPULAN DAN SARAN... 11
Simpulan ... 11
Saran ... 11
DAFTAR PUSTAKA ... 11
LAMPIRAN ... 14
DAFTAR GAMBAR
1 Hasil peremajaan Bacillus subtilis pada media padat setelah 2 hari 5 2 Kurva pertumbuhan Bacillus subtilis pada konsentrasi substrat LBG
0,5%, 1%, 1,5%, 2%, dan 2,5% 5
3 Aktivitas enzim mananase dari Bacillus subtilis pada konsentrasi
substrat 0,5%, 1%, 1,5%, 2%, dan 2,5% 6
4 Kurva pertumbuhan Bacillus subtilis pada konsentrasi substrat LBG
1% dengan variasi pH media 5, 6, 7, 8, dan 9 7
5 Aktivitas enzim mananase dari Bacillus subtilis pada konsentrasi substrat LBG 1% dengan variasi pH media 5, 6, 7, 8, dan 9 7 6 Kurva pertumbuhan Bacillus subtilis pada konsentrasi substrat 1%,
pH media 6, dengan variasi suhu 200C, 300C, 400C, dan 500C 8 7 Aktivitas enzim mananase dari Bacillus subtilis pada konsentrasi
substrat 1%, pH media 6, dengan variasi suhu 200C, 300C, 400C, dan
500C 9
8 Kurva standar manosa untuk optimasi konsentrasi substrat LBG 17 9 Kurva standar manosa untuk optimasi pH media dan suhu inkubasi 17
DAFTAR LAMPIRAN
1 Bagan Alir Penelitian 15
2 Hasil pembacaan spektrofotometer λ = 660 nm isolat bakteri laut Bacillus subtilis variasi konsentrasi substrat LBG 16 3 Hasil pembacaan spektrofotometer λ = 540 nm menggunakan larutan
D-(+)-Manosa dengan konsentrasi yang berbeda 17 4 Hasil pembacaan spektrofotometer λ = 540 nm menggunakan larutan
D-(+)-Manosa dengan konsentrasi yang berbeda 17 5 Hasil pembacaan spektrofotometer λ = 540 nm enzim mananase
isolat Bacillus subtilis variasi konsentrasi substrat LBG 18 6 Hasil pembacaan spektrofotometer λ = 660 nm isolat bakteri laut
Bacillus subtilis variasi pH media 20 7 Hasil pembacaan spektrofotometer λ = 540 nm enzim mananase
isolat bakteri laut Bacillus subtilis variasi pH media 21 8 Hasil pembacaan spektrofotometer λ = 660 nm isolat bakteri laut
Bacillus subtilis variasi suhu inkubasi 23 9 Hasil pembacaan spektrofotometer λ = 540 nm enzim mananase
isolat bakteri laut Bacillus subtilis variasi suhu inkubasi 24 10 Contoh perhitungan aktivitas enzim mananase isolat bakteri laut
Bacillus subtilis menggunakan konsentrasi substrat LBG 1% pada
jam ke-0 ulangan 1 26
PENDAHULUAN
Enzim mananase merupakan enzim yang dapat mengatalisis reaksi hidrolisis dari ikatan β-1,4-manosidik dari rantai manan, glukomanan, dan galaktomanan. Enzim mananase dapat digunakan dalam aplikasi teknologi enzim pada industri yang beragam seperti makanan, pakan, farmasi, kertas, maupun industri gas sebagai stimulasi maupun perlakuan awal terhadap biomassa lignoselulosa sebagai bahan untuk biofuel (Songsiriritthigul et al. 2010). Enzim mananase juga dapat digunakan untuk memecah kandungan manan yang terdapat pada limbah pertanian seperti limbah bungkil kelapa, kelapa sawit, umbi porang, dan lainnya, sehingga dapat dihasilkan manosa dan oligosakarida yang dimanfaatkan sebagai agen prebiotik, dan komponen pangan fungsional yang tinggi nilai ekonomisnya (Yopi et al. 2006).
Enzim mananase bisa berasal dari mikrob, tanaman, maupun hewan. Enzim mananase yang dihasilkan dari mikrob memiliki beberapa keunggulan, diantaranya yaitu bersifat lebih ekonomis, mudah dan efisien dalam memproduksinya. Karakterisasi dan fermentasi enzim mananase dari mikrob mempunyai waktu proses yang lebih cepat dibandingkan dengan enzim dari tanaman dan hewan (Yopi et al. 2006).
Mikrob yang menghasilkan enzim mananase dikenal dengan sebutan mikrob manolitik. Mikrob manolitik dapat menghidrolisis polisakarida kompleks menjadi molekul sederhana seperti mano-oligosakarida dan manosa. Enzim mananase yang berasal dari mikrob mempunyai kemampuan untuk mengikat β-manan dan aktivitas katalitik yang tinggi dalam mendepolimerisasi substrat polisakarida. Umumnya enzim mananase yang sering diteliti berasal dari mikrob darat, sedangkan enzim mananase yang berasal dari laut masih sedikit diteliti (Tanaka et al. 2009).
Eksplorasi mikrob laut untuk memperkaya sumber dan lokasi dihasilkannya enzim mananase belum banyak dilakukan karena selama ini eksplorasi lebih banyak dilakukan dari mikrob darat. Karakteristik mikrob laut adalah dapat tumbuh pada konsentrasi garam yang tinggi (halofil). Penelitian yang dilakukan sebelumnya telah menghasilkan enzim mananase termofilik laut dari bakteri Rhodothermus marinus, mikrob ini diisolasi dari perairan laut yang mempunyai suhu tinggi sehingga mempunyai aktivitas enzim mananase yang cukup unik dalam mendegradasi sumber manan seperti galaktomanan pada substrat locust bean gum (LBG). Mikrob manolitik laut ini telah diketahui menghasilkan enzim mananase glikosidasi famili 26 yang bersifat termofilik yaitu tahan hingga suhu 85ºC dan optimum pada pH 5,4 (Politz et al. 2000). Beberapa penelitian lainnya mengenai enzim mananase juga telah dipublikasikan. Bakteri Bacillus sp. optimum pada pH 7,0 dan suhu 70°C (Sumardi 2005), dan Bacillus subtilis B36 optimum pada pH 6,4 dan suhu 50°C (Li et al. 2006).
Optimasi untuk produksi enzim mananase yang dihasilkan dari bakteri Bacillus subtilis yang diisolasi dari Laut Bali masih belum dilakukan. Adapun tujuan dari penelitian ini adalah untuk memperoleh kondisi optimum produksi enzim mananase berupa konsentrasi substrat LBG optimum, pH media optimum, dan suhu inkubasi optimum dari isolat Bacillus subtilis tersebut. Optimasi ini perlu dilakukan agar dapat diketahui kondisi optimal untuk memproduksi enzim
2
mananase, sehingga nantinya dapat dihasilkan enzim mananase dengan kualitas dan kuantitas optimum dalam mendegradasi substratnya. Hipotesis dari penelitian ini yaitu produksi enzim mananase dari Bacillus subtilis dipengaruhi oleh berbagai faktor antara lain konsentrasi substrat LBG, pH media, dan suhu inkubasi. Manfaat dari penelitian ini adalah diperolehnya kondisi optimum produksi enzim mananase sehingga dapat digunakan dalam berbagai bidang, salah satunya dalam bidang pemanfaatan limbah biomassa dari industri pertanian sebagai bahan untuk biofuel.
METODE
Bahan dan AlatBahan-bahan yang digunakan adalah isolat Bacillus subtilis asal Laut Bali yang diisolasi pada tahun 2013 oleh Dr Yopi, peneliti dari LIPI Bioteknologi Cibinong, media kultur yang terdiri dari locust bean gum (LBG) Sigma, akuades, pepton Sigma, yeast extract (YE) Sigma, artificial sea water (ASW) Sigma, buffer fosfat Sigma, alkohol 70%, standar manosa Sigma, dan pereaksi asam dinitrosalisilat (DNS) yang terdiri atas DNS Sigma, NaOH, dan K-Na-Tartrat Sigma. Adapun alat-alat yang digunakan adalah alat-alat gelas, neraca analitik Boeco Germany, spektrofotometer Hitachi U-3900H, laminar horizontal Sanyo, pipet mikro, tabung mikro, penangas air Julabo TW20, magnetic stirrer MSH-300N, vortex Bionex, incubator shaker Jica BR-43FL, dan autoklaf Tomy SX-500.
Prosedur Analisis Data
Peremajaan Bacillus subtilis dalam Media Padat (Yopi et al. 2006)
Isolat Bacillus subtilis dari Laut Bali ditumbuhkan pada media padat yang mengandung sumber manan. Komposisi media yang digunakan ialah artificial sea water (ASW) Sigma 3.8%, yeast extract (YE) Sigma 0.1%, Pepton Sigma 0.5%, agar 1.5%, dan substrat manan locust bean gum (LBG) Sigma 0.5% dalam 100 mL aquades. Komposisi media tersebut diaduk menggunakan magnetic stirrer sampai homogen dan disterilisasi pada suhu 121ºC selama 15 menit, kemudian media tersebut dituang ke dalam cawan Petri di dalam laminar hingga memadat. Isolat Bacillus subtilis diinokulasikan ke dalam media padat dan diinkubasi selama 1 sampai 2 hari.
Optimasi Konsentrasi Substrat LBG untuk Produksi Enzim Mananase
Variasi konsentrasi substrat LBG yang diamati dalam optimasi untuk produksi enzim mananase ini antara lain 0.5%, 1%, 1.5%, 2% dan 2.5% yang dilarutkan dalam akuades. Setiap perlakuan dilakukan dengan 2 ulangan dan diinkubasi selama 6 hari. Optimasi untuk produksi enzim mananase dilakukan dengan mengamati parameter pertumbuhan sel (kurva pertumbuhan) dan aktivitas enzim mananase (kurva produksi enzim mananase).
3 Pembuatan Kurva Pertumbuhan (Analisis Pertumbuhan Sel) (Yopi et al. 2006)
Pembuatan kurva pertumbuhan terdiri atas dua tahap, yaitu pra-kultivasi dan kultivasi. Komposisi media cair terdiri atas artificial sea water (ASW) 3.8%, yeast extract (YE) 0.1%, dan pepton 0.5% dalam 500 mL aquades. Media tersebut kemudian dibagi ke dalam dua tabung, yaitu untuk pra-kultivasi dan kultivasi yang kemudian ditambahkan substrat LBG dengan variasi konsentrasi 0.5%, 1%, 1.5%, 2% dan 2.5%. Media pra-kultivasi sebanyak 10 mL dalam labu Erlenmeyer 100 mL, sedangkan media kultivasi sebanyak 30 mL dalam labu Erlenmeyer 300 mL. Setelah disterilisasi dan didinginkan, biakan dimasukkan ke dalam media secara aseptik, kemudian isolat Bacillus subtilis pada tahap pra-kultivasi diinkubasi pada incubator shaker semalam dengan kecepatan 150 rpm pada suhu 300C.
Setelah tahap pra-kultivasi maka dilanjutkan dengan tahap kultivasi isolat Bacillus subtilis selama 6 hari pada incubator shaker 150 rpm pada suhu ruang. Pengambilan sampel dilakukan sebanyak 7 kali yaitu pada jam ke 0, 24, 48, 72, 96, 120, dan 144. Setiap hasil pengambilan sampel tersebut dipindahkan ke dalam 1.5 ml tabung mikro dan disimpan dalam lemari pendingin. Setelah itu dilakukan analisis pertumbuhan sel dengan pembacaan pada spektrofotometer pada panjang gelombang 660 nm.
Pembuatan Kurva Produksi Enzim Mananase (Analisis Aktivitas Enzim Mananase) (Yopi et al. 2006)
Setelah diperoleh kurva pertumbuhan, selanjutnya dilakukan uji aktivitas enzim mananase untuk mendapatkan kurva produksi enzim mananase. Enzim diperoleh dengan cara disentrifugasi kultur dengan kecepatan 12.000 rpm selama 15 menit pada suhu 4ºC. Supernatan yang diperoleh disimpan pada suhu 4ºC. Supernatan yang diperoleh digunakan sebagai sediaan enzim untuk analisis aktivitas enzim mananase.
Pengukuran aktivitas enzim mananase menggunakan metode DNS (asam dinitrosalisilat). Larutan DNS sebanyak 50 ml dibuat dengan melarutkan DNS (asam dinitrosalisilat) sebanyak 0.5 gram, NaOH, 0.8 gram, dan K-Na-Tartat 15 gram ke dalam 50 ml akuades. Larutan substrat manan (LBG) dibuat sebanyak 0.5% di dalam buffer fosfat 0.05 M pH 6.
Perlakuan untuk sampel adalah dengan cara menambahkan larutan enzim sebanyak 250 μL ke dalam 250 μL larutan substrat LBG 0.5%, kemudian diinkubasi pada suhu ruang selama 15 menit. Setelah reaksi enzim substrat selesai, kemudian ditambahkan 750 μL DNS dan divortex agar homogen, kemudian dipanaskan dalam penangas air pada suhu 100ºC selama 15 menit, dilanjutkan dengan merendam di dalam es selama 10 menit.
Perlakuan untuk kontrol adalah sebanyak 250 μL larutan buffer 0.05 M pH 6 ditambahkan ke dalam 250 μL larutan substrat LBG 0.5%, selanjutnya ditambahkan 750 μL DNS, kemudian diinkubasi selama 15 menit pada suhu ruang. Setelah itu divortex agar homogen, kemudian dipanaskan dalam penangas air pada suhu 100ºC selama 15 menit dan dilanjutkan dengan merendam di dalam es selama 10 menit. Perlakuan untuk blanko adalah sebanyak 750 μL DNS ditambahkan ke dalam 500 μL buffer fosfat 0.05 M pH 6 dan divortex agar homogen, kemudian dipanaskan dalam penangas air pada suhu 100ºC selama 15
4
menit. Blanko, sampel, dan kontrol dibaca dengan spektrofotometer pada panjang gelombang 540 nm. Berdasarkan kurva produksi yang diperoleh, dapat diketahui konsentrasi substrat yang paling optimum yaitu yang menghasilkan aktivitas enzim mananase tertinggi.
Satu unit aktivitas enzim mananase adalah banyaknya enzim yang dapat memproduksi 1 μmol manosa dalam satu menit, maka digunakan larutan D-(+)-Manosa sebagai standar sehingga diperoleh kurva standar manosa, dari kurva tersebut dapat diperoleh persamaan sehingga selanjutnya dapat dilakukan perhitungan nilai aktivitas enzim. Pembuatan standar dilakukan dengan menambahkan 750 μL larutan DNS ke dalam 500 μL standar manosa, kemudian dipanaskan pada suhu 100°C selama 15 menit, dan didinginkan dalam es selama 15 menit.
Optimasi pH Media dan Suhu Inkubasi untuk Produksi Enzim Mananase Variasi pH yang digunakan untuk optimasi pH media adalah 5, 6, 7, 8, dan 9. Optimasi ini dilakukan pada konsentrasi substrat optimum yang telah diperoleh sebelumnya. Pengaturan pH media dilakukan dengan cara menambahkan larutan NaOH atau HCl ke dalam media. Penentuan kondisi optimum pH media dilakukan dengan mengamati parameter pertumbuhan sel (kurva pertumbuhan) dan aktivitas enzim mananase (kurva produksi enzim mananase) seperti pada tahapan sebelumnya. Setelah diperoleh pH media optimum, selanjutnya dilakukan optimasi suhu inkubasi dengan variasi suhu 20, 30, 40, dan 500C. Optimasi suhu inkubasi untuk produksi enzim dilakukan pada konsentrasi substrat dan pH media optimum yang telah diperoleh pada tahap sebelumnya. Penentuan kondisi optimum suhu inkubasi juga dilakukan dengan mengamati parameter pertumbuhan sel dan aktivitas enzimnya.
Analisis Statistik
Hasil yang diperoleh dianalisis menggunakan software SAS 9.1.3. Analisis statistik yang digunakan adalah rancangan faktorial dalam Rancangan Acak Lengkap (RAL). Model rancangannya:
Yijk =μ+αi+βj+(αβ)ij+εijk
Yijk = nilai pengamatan pada faktor ke A (optimasi konsentrasi substrat/pH media/suhu inkubasi) taraf ke-i faktor B (lamanya inkubasi) taraf ke-j dan ulangan ke-k.
µ = Rataan umum
αi = pengaruh utama faktor A (optimasi konsentrasi substrat/pH media/suhu inkubasi)
βj (αβ)ij εijk
= pengaruh utama faktor B (lamanya inkubasi) = pengaruh interaksi faktor A dan faktor B = pengaruh acak yang menyebar normal
Data yang diperoleh dianalisis dengan ANOVA (analysis of variance) pada tingkat kepercayaan 95 % dan taraf α 5%, dan dilakukan uji Duncan sebagai uji lanjut.
5
HASIL
Hasil Peremajaan Isolat Bacillus subtilis
Isolat Bacillus subtilis diremajakan dalam media padat substrat locust bean gum (LBG). Bakteri yang berhasil tumbuh ditandai dengan terlihatnya koloni bakteri pada media tersebut. Koloni Bacillus subtilis terlihat berwarna kuning kecoklatan, sedikit berlendir dan tumbuh pada permukaan media padat. Hasil peremajaan isolat Bacillus subtilis dapat dilihat pada Gambar 1.
Gambar 1 Hasil peremajaan Bacillus subtilis pada media padat setelah 2 hari Konsentrasi Optimum Substrat LBG untuk Produksi Enzim Mananase
Kurva pertumbuhan dari Bacillus subtilis pada variasi konsentrasi substrat LBG 0.5%, 1%, 1.5%, 2%, dan 2.5% disajikan pada Gambar 2. Berdasarkan kurva pertumbuhan yang diperoleh, terlihat bahwa nilai kerapatan optik (OD) isolat Bacillus subtilis pada konsentrasi substrat LBG 0.5% dan 1% mengalami peningkatan seriring dengan bertambahnya waktu kultivasi dan kemudian mengalami penurunan pada jam ke 96 sampai jam 144. Nilai kerapatan optik tertinggi dari Bacillus subtilis pada konsentrasi tersebut adalah pada jam ke-72. Nilai kerapatan optik isolat Bacillus subtilis pada konsentrasi substrat LBG 1.5%, 2%, dan 2.5% juga mengalami peningkatan seiring bertambahnya waktu, akan tetapi mengalami penurunan pada jam 72 sampai jam 144. Nilai kerapatan optik tertinggi dari Bacillus subtilis pada konsentrasi tersebut adalah pada jam ke-48. Secara umum terlihat bahwa nilai kerapatan optik tertinggi dari isolat Bacillus subtilis diperoleh pada konsentrasi 2.5% karena memiliki nilai absorban yang lebih tinggi dibandingkan dengan nilai absorban pada konsentrasi substrat lainnya.
Gambar 2 Kurva pertumbuhan Bacillus subtilis pada konsentrasi substrat LBG 0.5%, 1%, 1.5%, 2%, dan 2.5% 0.00 0.50 1.00 1.50 2.00 2.50 3.00 0 24 48 72 96 120 144 Nilai OD ( 660 nm)
Waktu Kultivasi (Jam)
0,5% 1% 1.50 %
6
Berdasarkan kurva tersebut dapat diketahui fase pertumbuhan bakteri. Isolat Bacillus subtilis yang ditumbuhkan pada media LBG 1%, fase adaptasinya terjadi sekitar jam ke-0 hingga jam ke-24. Fase adaptasi dari kultivasi ini tidak terlalu jelas terlihat dalam kurva, hal ini disebabkan karena isolat tersebut telah beradaptasi dengan media cair pada proses pra-kultivasi. Jam ke-24 sampai dengan jam ke-72 merupakan fase log. Sekitar jam ke-72 sampai jam ke-96 menunjukkan fase stasioner. Sedangkan jam ke-96 sampai jam ke-144 menunjukkan fase kematian.
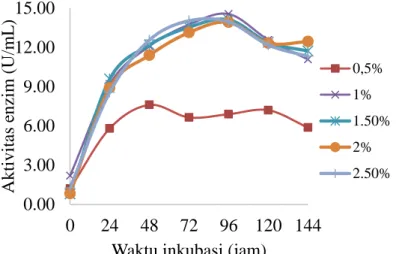
Pengukuran aktivitas enzim mananase menggunakan kurva standar dengan persamaan garis y=0.0023x - 0.0872 (Lampiran 3). Aktivitas enzim mananase dari
Bacillus subtilis pada berbagai konsentrasi substrat LBG ditunjukkan pada Gambar 3.
Nilai aktivitas enzim pada konsentrasi 0.5% lebih kecil dan berbeda nyata (P<0.05) dibandingkan dengan aktivitas enzim pada konsentrasi substrat 1%, 1.5%, 2%, dan 2.5%. Nilai aktivitas enzim tertinggi pada umumnya diperoleh pada jam ke-96, pada jam ke-96 ini pertumbuhan sel memasuki fase stasioner. Nilai aktivitas enzim tertinggi diperoleh pada konsentrasi substrat 1% yaitu sebesar 14.549 U/mL, akan tetapi nilai ini tidak berbeda nyata (P>0.05) dibandingkan dengan aktivitas enzim pada konsentrasi substrat 1.5%, 2% dan 2.5%. Berdasarkan hal tersebut, konsentrasi substrat LBG yang paling optimum untuk produksi enzim mananase adalah pada konsentrasi substrat LBG 1%.
Gambar 3 Aktivitas enzim mananase dari Bacillus subtilis pada konsentrasi substrat 0.5%, 1%, 1.5%, 2%, dan 2.5%
Kondisi pH Media Optimum untuk Produksi Enzim Mananase
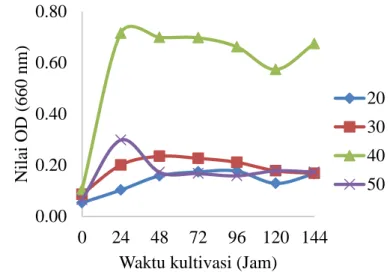
Optimasi pH media dilakukan pada konsentrasi substrat optimum yang telah diperoleh pada tahapan penelitian sebelumnya, yaitu konsentrasi substrat LBG 1%. Variasi pH media yang digunakan pada penelitian ini adalah 5, 6, 7, 8, dan 9. Dasar dari penentuan rentang variasi pH tersebut adalah karena pada umumnya mikroorganisme jenis bakteri dapat tumbuh pada rentang tersebut. Berdasarkan nilai absorban pada panjang gelombang 660 nm (Lampiran 7), diperoleh hasil yang disajikan melalui kurva pertumbuhan pada Gambar 4.
0.00 3.00 6.00 9.00 12.00 15.00 0 24 48 72 96 120 144 Aktivi tas e nz im ( U/mL )
Waktu inkubasi (jam)
0,5% 1% 1.50% 2% 2.50%
7
Gambar 4 Kurva pertumbuhan Bacillus subtilis pada konsentrasi substrat LBG 1% dengan variasi pH media 5, 6, 7, 8, dan 9
Terlihat bahwa nilai kerapatan optik Bacillus subtilis pada pH 9 lebih rendah dibandingkan dengan pH lainnya, sedangkan nilai kerapatan optik pada pH media 5, 6, 7, dan 8 tidak berbeda nyata (P<0.05). Bacillus subtilis pada pH media 5 dan 6 mencapai nilai kerapatan optik tertinggi pada jam ke-48, sedangkan pada pH media 7, 8, dan 9 mencapai nilai kerapatan optik tertinggi pada waktu yang lebih lama, yaitu pada jam ke-72. Berdasarkan kurva pertumbuhan ini dapat diketahui bahwa pertumbuhan sel isolat Bacillus subtilis lebih cepat pada pH media 5 dan 6 dibandingkan dengan pH media 7, 8, dan 9. Nilai kerapatan optik tertinggi diperoleh pada pH media 6.
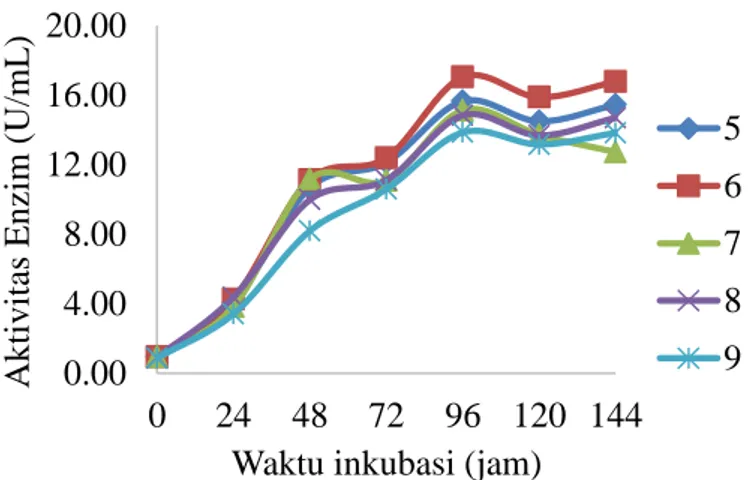
Perhitungan aktivitas enzim mananase menggunakan kurva standar dengan
persamaan garis y=0.0032x - 0.072 (Lampiran 3). Hasil pengukuran aktivitas enzim mananase dengan variasi pH media 5, 6, 7, 8, dan 9 disajikan pada Gambar 5. Berdasarkan hasil tersebut diperoleh bahwa aktivitas enzim pada pH 6 berbeda nyata (P<0.05) dibandingkan dengan aktivitas enzim pada pH 5, 7, 8 dan 9. Nilai aktivitas enzim tertinggi diperoleh pada pH 6 dengan nilai sebesar 17.043 U/ml. Oleh karena itu, pH 6 merupakan pH optimum untuk produksi enzim mananase.
Gambar 5 Aktivitas enzim mananase dari Bacillus subtilis pada konsentrasi substrat LBG 1% dengan variasi pH media 5, 6, 7, 8, dan 9
0.00 0.50 1.00 1.50 2.00 2.50 0 24 48 72 96 120 144 Nilai OD ( 660 nm)
Waktu kultivasi (jam)
5 6 7 8 9 0.00 4.00 8.00 12.00 16.00 20.00 0 24 48 72 96 120 144 Aktivi tas Enz im ( U/mL )
Waktu inkubasi (jam)
5 6 7 8 9
8
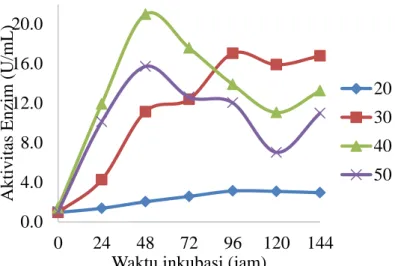
Suhu Inkubasi Optimum untuk Produksi Enzim Mananase
Setelah diperoleh kondisi optimum konsentrasi substrat sebesar 1% dan kondisi pH media optimum adalah 6, selanjutnya dilakukan optimasi suhu pada konsentrasi substrat dan pH optimum yang diperoleh tersebut. Suhu yang divariasikan adalah 200C, 300C, 400C dan, 500C. Berdasarkan hasil yang diperoleh, terlihat bahwa Bacillus subtilis memiliki nilai kerapatan optik tertinggi pada suhu 400C (Gambar 6). Nilai kerapatan optik pada suhu 400C berbeda nyata (P<50) dibandingkan dengan suhu 200C, 300C dan 500C. Hal ini menunjukkan bahwa Bacillus subtilis merupakan bakteri yang tergolong mesofilik karena berada pada selang 30-450C. Tang et al. (2009) menyebutkan bahwa mikroorganisme yang tahan terhadap asam hidup pada suhu mesofilik yang berkisar antara 30 - 45oC.
Perbedaan suhu ini juga menyebabkan terjadinya perbedaan waktu optimum pertumbuhan bakteri. Pada suhu produksi 200C terlihat bahwa pertumbuhan Bacillus subtilis sangat lambat, karena pertumbuhan bakteri yang sangat lambat ini sehingga waktu optimum dari pertumbuhan baru diperoleh pada jam ke-96. Selanjutnya pada suhu 300C pertumbuhan isolat juga lambat, akan tetapi lebih cepat jika dibandingkan dengan pertumbuhan isolat pada suhu 200C. Pada suhu tersebut Bacillus subtilis mencapai waktu optimum pertumbuhan pada jam ke-48. Sedangkan pada suhu 400C dan 500C diperoleh waktu optimum pertumbuhan pada jam ke-24. Hal ini menunjukkan bahwa suhu inkubasi akan sangat mempengaruhi pertumbuhan isolat Bacillus subtilis tersebut. Hal ini sesuai dengan Knob dan Carmona (2008) yang menyebutkan bahwa suhu merupakan faktor lingkungan yang sangat vital dalam pertumbuhan mikroorganisme.
Gambar 6 Kurva pertumbuhan Bacillus subtilis pada konsentrasi substrat 1%, pH media 6, dengan variasi suhu 200C, 300C, 400C, dan 500C
Selanjutnya dilakukan analisis aktivitas enzim menggunakan kurva standar dengan persamaan y=0.0032x-0.072 (Lampiran 3). Nilai aktivitas enzim pada suhu 200C, 300C, 400C dan 500C berbeda nyata satu sama lain (P<0.05). Nilai aktivitas enzim pada suhu 200C terlihat sangat rendah dibandingkan dengan suhu . 0.00 0.20 0.40 0.60 0.80 0 24 48 72 96 120 144 Nilai OD ( 660 nm)
Waktu kultivasi (Jam)
20 30 40 50
9 lainnya. Nilai aktivitas enzim tertinggi pada suhu 200C dan 30 0C diperoleh pada jam ke-96, sedangkan pada suhu 400C dan 500C nilai aktivitas enzim tertinggi diperoleh pada jam ke-48. Aktivitas enzim tertinggi diperoleh pada suhu 400C pada jam ke-48 dengan nilai sebesar 20.978 U/mL. Oleh karena itu, suhu 400C merupakan suhu inkubasi optimum untuk produksi enzim mananase.
Gambar 7 Aktivitas enzim mananase dari Bacillus subtilis pada konsentrasi substrat 1%, pH media 6, dengan variasi suhu 200C, 300C, 400C, dan 500C
PEMBAHASAN
Konsentrasi Optimum Substrat LBG untuk Produksi Enzim Mananase Berdasarkan kurva pertumbuhan yang telah diperoleh sebelumnya (Gambar 2), terlihat bahwa waktu optimum pertumbuhan sel berbeda dengan waktu optimum aktivitas enzim (Gambar 3). Hasil ini menunjukkan bahwa waktu optimum enzim mananase yang dihasilkan dari Bacillus subtilis berada disekitar fase stasioner. Menurut Akando dan Ibrahim (2011), pada umumnya bakteri dari species Bacillus menghasilkan enzim pada fase eksponensial, beberapa jenis pada fase stasioner. Rahmiati (2004) juga menyatakan bahwa produksi enzim dihasilkan mulai dari fase eksponensial sampai fase stasioner.
Konsentrasi substrat LBG 1% dipilih sebagai konsentrasi substrat yang paling optimum untuk produksi enzim mananase, karena pada konsentrasi tersebut diperoleh nilai aktivitas enzim tertinggi pada jam ke-96 sebesar 14,549 U/mL. Nilai aktivitas enzim mananase ini lebih tinggi dibandingkan dengan nilai aktivitas enzim yang diperoleh Sumardi (2005), yaitu sebesar 0,69 U/mL. Selain itu, alasan pemilihan konsentrasi substrat 1% sebagai konsentrasi yang paling optimum adalah karena tidak terlihat perbedaan nilai aktivitas enzim yang signifikan diantara konsentrasi lainnya (1,5%, 2% dan 2,5%). Semakin banyak molekul substrat yang tersedia, semakin sering molekul-molekul tersebut memasuki tempat aktif molekul enzim. Pada suatu keadaan tertentu, konsentrasi substrat yang banyak akan menempati semua tempat aktif pada molekul enzim. Setelah produk dilepaskan dari enzim, maka substrat yang baru akan segera
0.0 4.0 8.0 12.0 16.0 20.0 0 24 48 72 96 120 144 Aktivi tas Enz im ( U/mL )
Waktu inkubasi (jam)
20 30 40 50
10
menempati tempat aktif enzim. Pada kondisi inilah enzim telah mengalami kejenuhan, sebanyak apapun substrat yang ditambahkan maka laju reaksi enzim tidak akan ditentukan lagi oleh jumlah substrat tersebut, akan tetapi ditentukan oleh kecepatan tempat aktif enzim tersebut mengubah substrat menjadi produk (Campbell 2002). Walaupun digunakan konsentrasi substrat yang lebih besar aktivitas enzim yang diperoleh cenderung sama. Oleh karena itulah dipilih konsentrasi substrat 1% sebagai konsentrasi substrat yang paling optimum, dan hal ini juga dapat menghemat penggunaan substrat sehingga menjadi lebih efisien.
Kondisi pH Optimum Media untuk Produksi Enzim Mananase
Salah satu parameter fisik yang mempengaruhi pertumbuhan mikroba adalah pH media. Pengaruh pH media terhadap mikroba adalah menginduksi perubahan morfologi pada mikroba dan juga menginduksi sekresi enzim yang dihasilkan oleh mikroba tersebut (Gupta et al. 2003). Berdasarkan hasil pengujian aktivitas enzim (Gambar 5) terlihat bahwa aktivitas enzim pada pH 9 lebih kecil dibandingkan dengan aktivitas enzim pada variasi pH lainnya. Hal ini juga sejalan dengan kurva pertumbuhan yang diperoleh sebelumnya (Gambar 4). Aktivitas enzim tertinggi diperoleh pada pH 6 jam ke-96, sebesar 17,043 U/ml. Nilai aktivitas enzim tersebut lebih tinggi dibandingkan dengan nilai aktivitas enzim dari Bacillus subtilis yang diperoleh Chuan et al. (2006), yaitu sebesar 8 U/mL.
Nilai aktivitas enzim tertinggi yang diperoleh pada penelitian ini berada pada kisaran fase stasioner dari pertumbuhan isolat Bacillus subtilis tersebut. Hal ini sesuai dengan Hidayat (2005) yang menyatakan bahwa pH dapat mempengaruhi aktivitas enzim yang dihasilkan. Hasil ini sejalan dengan hasil yang diperoleh oleh Kurakake et al. (2006) yang menyebutkan bahwa pH optimum dari enzim mananase berkisar pada kondisi asam yaitu sekitar pH 3 sampai pH 6. Jiang et al. (2006) memperoleh enzim mananase dari Bacillus subtilis optimum pada pH 6. Mudau et al. (2008) memperoleh enzim mananase dari Scopulariopsis candida optimum pada pH 6. Sumardi (2007) menyebutkan bahwa enzim mananase yang dihasilkan oleh bakteri rata-rata memiliki aktivitas optimum pada pH netral atau sedikit asam. Hal ini juga sesuai dengan Puchart et al (2004) yang menyebutkan bahwa enzim mananase memiliki pH optimum pada kondisi pH sedikit asam sampai netral. Oleh karena itulah semakin basa medianya menyebabkan pertumbuhan Bacillus subtilis juga semakin rendah dan juga menghasilkan enzim dengan aktivitas yang juga rendah.
Suhu Inkubasi Optimum untuk Produksi Enzim Mananase
Suhu sangat mempengaruhi kecepatan pertumbuhan mikrob, kecepatan sintesis enzim, dan kecepatan inaktivasi enzim (Knob dan Carmona 2008). Setiap mikrob termasuk bakteri mempunyai suhu optimum, maksimum dan minimum untuk pertumbuhannya. Jika suhu lingkungan lebih kecil dari suhu minimum atau lebih besar dari suhu maksimum pertumbuhannya maka aktivitas enzim akan terhenti bahkan pada suhu yang terlalu tinggi akan terjadi denaturasi enzim (Sumardjo 2006).
11 Berdasarkan hasil pengujian aktivitas enzim (Gambar 7), produksi enzim semakin meningkat dengan meningkatnya suhu, akan tetapi mengalami penurunan pada suhu 500C. Aktivitas enzim tertinggi diperoleh pada suhu 400C pada jam ke-48 sebesar 20,978 U/mL. Nilai aktivitas enzim mananase ini lebih tinggi dibandingkan dengan nilai aktivitas enzim yang diperoleh Chuan et al. (2006), yaitu sebesar 8 U/mL, dan Sumardi (2005) yang hanya sebesar 0,69 U/mL. Sebelumnya telah dipublikasikan bahwa enzim mananase memiliki suhu optimum sekitar 400C (Puchart et al. 2004). Kenaikan suhu akan meningkatkan kecepatan reaksi yang dikatalisis oleh enzim, tetapi peningkatan kecepatan reaksi hanya pada kisaran suhu tertentu (Murray et al. 2003). Peningkatan kecepatan reaksi ini disebabkan oleh peningkatan energi kinetik molekul-molekul yang bereaksi. Peningkatan suhu yang lebih jauh dapat mengakibatkan energi kinetik semakin besar, sehingga dapat menyebabkan putusnya ikatan hidrogen dan hidrofobik lemah yang mempertahankan struktur sekunder-tersier dari enzim tersebut. Kenaikan temperatur melewati temperatur optimum akan menyebabkan enzim terdenaturasi dan menurunkan kecepatan reaksi enzimatis (Wuryanti, 2004).
SIMPULAN DAN SARAN
SimpulanBerdasarkan hasil penelitian, diperoleh informasi bahwa isolat bakteri laut Bacillus subtilis memiliki nilai aktivitas enzim mananase yang cukup tinggi. Nilai aktivitas enzim tertinggi diperoleh sebesar 20.978 U/mL pada jam ke-48. Bacillus subtilis dapat menghasilkan enzim mananase ekstraseluler pada kondisi optimum dengan konsentrasi substrat LBG 1%, pH media 6, dan suhu inkubasi 400C.
Saran
Perlu dilakukan permurnian dengan cara pengendapan, dilanjutkan dialisis dan kromatografi untuk memperoleh enzim mananase murni. Selain itu, juga perlu dilakukan karakterisasi enzim berupa pH, suhu, kofaktor dan inhibitor untuk mengetahui sifat enzim mananase dari Bacillus subtilis yang diisolasi dari Laut Bali tersebut.
DAFTAR PUSTAKA
Akando A, Ibrahim. 2011. A potential new isolate for production of a thermostable extracellular α-amylase. Journal of Bacteriology Research. 3(8):129-137.
Campbell NA et al. 2002. Biology 5th Ed. New York: Mc Graw Hill.
Chuan CH, Krishnaiah K, Wong CM, Jidon Janaun. 2006. Palm kernel cake as substrate for β-mannanase production by Bacillus subtilis ATCC3366 under
12
submerged and solid state fermentations. Di dalam: Jidon, editor. Proceedings of the 1st International Conference on Natural Resources Engineering & Technology 2006; 24-25 Juli 2006; Putrajaya, Malaysia. 2073. 182-185.
Gupta R, Gigras P, Mohapatra H, Goswami VK, Chauhan B. 2003. Microbial-amylases: a biotechnological perspective. Journal of Process. Biochemistry. 38:1599-1616.
Hidayat I. 2005. Pengaruh pH terhadap aktivitas endo-1,4-β-glucanase Bacillus sp. AR 009. Jurnal Biodiversitas. 6:242-244.
Jiang Z, Wei Y, Li D, Li L, Chai P, Kusakabe I. 2006. High-level production, purification and characterization of a thermostable β-mannanase from the newly isolated Bacillus subtilis WY34. Journal Carbohydrate Polymers. 66:89-96.
Knob A, Carmona E. 2008. Xylanase production by Penicillium sclerotiorum and its characterization. Journal World Applied Sciences. 4(2): 277-283.
Kurakake M, Sumida T, Masuda D, Oonishi S, Komaki T. 2006. Production of galacto-manno-oligosaccharides from guar gum by and β-mannanase from Penicillium oxalicum SO. Journal Agric Food Chem. 54:7885-7889. Li et al. 2006. A mannanase from Bacillus subtilis B36: purification, properties,
sequencing, gene cloning and expression in Escherichia coli. Journal Naturforsch. 61c:840-846.
Mudau, Maria M, Setati, Evodia M. 2008. Partial purification and characterization of endo-β-1,4-mannanases from Scopulariopsis candida strains isolated from solar salterns. Journal of Biotechnol. 7:2283-2284.
Murray RK, Granner DK, Mayes PA, Rodwel VW. 2003. Biokimia Harper. Penerjemah Hartono A. Jakarta: ECG. Terjemahan dari: Harper’s Biochemistry.
Politz et al. 2000. A highly thermostable endo-(1.4)-b-mannanase from the marine bacterium Rhodothermus marinus. Journal Appl Microbiol Biotechnol. 53(28):715-721.
Puchart V, Vrsanska M, Svoboda P, Pohl J, Ogel ZB, Biely P. 2004. Purification and characteritation of two forms of endo-β-1,4-mannanase from a thermotolerant fungus, Aspergilus fumigatus IMI 385709 (formerly Thermomyces lanuginosus IMI 158749). Journal Biochem Biophys Acta. 1674:239-250.
Rahmiati R. 2004. Identifikasi dan isolasi kolagenase dari Vibrio sp B-30 yang ditumbuhkan dengan media TSB-YE-Salt. Jurnal Widya Agrika. 2:211-217.
Songsiriritthigul et al. 2010. Efficient recombinant expression and secretion of a thermostable gh26 mannan endo-1.4-β-mannosidase from Bacillus licheniformis in Escherichia coli. Journal Microbial Cell Factories. 9:20.
13 Sumardi. 2005. Isolation and characterization of mannanolytic thermophilic bacteria from palm oil shell and their mannanase enzyme production properties. Journal Biotropia. 25:1-10.
Sumardi. 2005. Optimasi produksi enzim β-mananase ekstraseluler dari bakteri Geobacillus Stearothermophilus L-07. Journal Sains Tek. 11:68.
Sumardi. 2007. Isolasi dan karakterisasi mananase ekstraseluler dari Fusarium oxysporum. Jurnal Sains MIPA. 13:43-48.
Sumardjo D. 2006. Pengantar Kimia. Jakarta: Buku Kedokteran EGC.
Tanaka et al. 2009. Cloning and characterization of a β-1.4-mannanase 5c possessing family 27 carbohydrate-binding module from marine bacterium Vibrio Sp. strain MA-138. Journal Biosci Biotech Biochem. 7(1):109-116. Tang, Chun J, Shibata A, Zhou Q, Katayama A. Effect of temperature on reaction
rate and microbial community in composting of cattle manure with rice straw. Journal Of Bioscience And Bioengineering. 104(4):321-328.
Wuryanti. 2004. Isolasi dan penentuan aktivasi spesifik enzim bromelin dari buah nanas (Ananas comosus L.). Jurnal KSA. 7:83-87.
Yopi, Purnawan A, Thontowi A, Hermansyah H, Wijanarko A. 2006. Preparasi mannan dan mannanase kasar dari bungkil kelapa sawit. Jurnal Teknologi. 20(4):312-319.
14
15 Lampiran 1 Bagan Alir Penelitian
Peremajaan isolat
Optimasi Produksi Enzim Mananase (Konsentrasi substrat, pH media,
suhu inkubasi) Bacillus subtilis Kultivasi Pra-kultivasi Pengambilan sampel Uji kuantitatif Aktivitas Enzim (Kurva Produksi) Kurva Pertumbuhan
16
Lampiran 2 Hasil pembacaan spektrofotometer λ = 660 nm isolat bakteri laut Bacillus subtilis variasi konsentrasi substrat LBG
Konsentrasi Substrat LBG Inkubasi Sampel Rata-rata (S) Deviasi S1 S2 0.50% 0 0.006 0.004 0.005 0.001 24 0.011 0.008 0.010 0.002 48 0.062 0.089 0.075 0.019 72 0.192 0.186 0.189 0.005 96 0.176 0.179 0.178 0.002 120 0.176 0.178 0.177 0.001 144 0.175 0.172 0.174 0.002 1% 0 0.008 0.008 0.008 0.000 24 0.031 0.053 0.042 0.015 48 0.104 0.096 0.100 0.006 72 0.201 0.222 0.212 0.015 96 0.206 0.224 0.215 0.013 120 0.177 0.220 0.199 0.031 144 0.157 0.214 0.185 0.040 1.50% 0 0.145 0.134 0.139 0.008 24 0.237 0.232 0.234 0.004 48 0.253 0.243 0.248 0.007 72 0.223 0.234 0.228 0.008 96 0.210 0.177 0.194 0.023 120 0.197 0.150 0.174 0.033 144 0.176 0.150 0.163 0.018 2% 0 0.160 0.156 0.158 0.002 24 0.236 0.238 0.237 0.001 48 0.259 0.251 0.255 0.006 72 0.234 0.227 0.231 0.005 96 0.221 0.216 0.218 0.004 120 0.199 0.208 0.203 0.007 144 0.179 0.195 0.187 0.011 2.50% 0 0.161 0.177 0.169 0.011 24 0.239 0.237 0.238 0.001 48 0.253 0.260 0.257 0.005 72 0.237 0.240 0.238 0.003 96 0.235 0.233 0.234 0.001 120 0.232 0.230 0.231 0.001 144 0.232 0.229 0.230 0.002
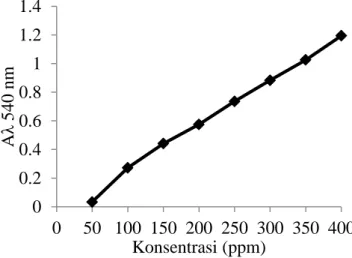
17 Lampiran 3 Hasil pembacaan spektrofotometer λ = 540 nm menggunakan larutan
D-(+)-Manosa dengan konsentrasi yang berbeda Konsentrasi
(ppm)
50 100 150 200 250 300 350 400
Aλ 540 nm 0.033 0.139 0.258 0.369 0.505 0.595 0.726 0.836
Gambar 8 Kurva standar manosa untuk optimasi konsentrasi substrat LBG Lampiran 4 Hasil pembacaan spektrofotometer λ = 540 nm menggunakan larutan
D-(+)-Manosa dengan konsentrasi yang berbeda Konsentrasi
(ppm)
50 100 150 200 250 300 350 400
Aλ 540 nm 0.033 0.272 0.441 0.575 0.736 0.883 1.026 1.194
Gambar 9 Kurva standar manosa untuk optimasi pH media dan suhu inkubasi 0 0.1 0.2 0.3 0.4 0.5 0.6 0.7 0.8 0.9 0 50 100 150 200 250 300 350 400 A λ 540 nm Konsentrasi (ppm) 0 0.2 0.4 0.6 0.8 1 1.2 1.4 0 50 100 150 200 250 300 350 400 A λ 540 nm Konsentrasi (ppm)
18
Lampiran 5 Hasil pembacaan spektrofotometer λ = 540 nm enzim mananase isolat Bacillus subtilis variasi konsentrasi substrat LBG Konsentrasi
Inkubasi
Sample Kontrol S-K ppm (mg/L) mg/mL U/mL
U/mL Deviasi Substrat LBG S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2 0.50% 0 0.036 0.037 0.050 0.048 -0.014 -0.011 31.826 33.130 0.032 0.033 1.179 1.227 1.203 0.034 24 0.314 0.312 0.047 0.032 0.267 0.280 154.000 159.652 0.154 0.160 5.704 5.913 5.808 0.148 48 0.434 0.440 0.050 0.054 0.384 0.386 204.870 205.739 0.205 0.206 7.588 7.620 7.604 0.023 72 0.368 0.389 0.054 0.052 0.314 0.337 174.435 184.435 0.174 0.184 6.461 6.831 6.646 0.262 96 0.430 0.357 0.054 0.051 0.376 0.306 201.391 170.957 0.201 0.171 7.459 6.332 6.895 0.797 120 0.397 0.435 0.052 0.06 0.345 0.375 187.913 200.957 0.188 0.201 6.960 7.443 7.201 0.342 144 0.239 0.414 0.051 0.047 0.188 0.367 119.652 197.478 0.120 0.197 4.432 7.314 5.873 2.038 1% 0 0.082 0.096 0.032 0.048 0.050 0.048 59.652 58.783 0.060 0.059 2.209 2.177 2.193 0.023 24 0.058 0.060 0.032 0.032 0.026 0.028 49.217 50.087 0.049 0.050 9.114 9.275 9.195 0.114 48 0.094 0.092 0.029 0.031 0.065 0.061 66.174 64.435 0.066 0.064 12.254 11.932 12.093 0.228 72 0.119 0.122 0.034 0.040 0.085 0.082 74.870 73.565 0.075 0.074 13.865 13.623 13.744 0.171 96 0.130 0.137 0.040 0.040 0.090 0.097 77.043 80.087 0.077 0.080 14.267 14.831 14.549 0.399 120 0.102 0.116 0.041 0.039 0.061 0.077 64.435 71.391 0.064 0.071 11.932 13.221 12.576 0.911 144 0.102 0.099 0.051 0.029 0.031 0.070 51.391 68.348 0.051 0.068 9.517 12.657 11.087 2.220 1.50% 0 0.049 0.046 0.048 0.056 0.001 -0.010 22.813 19.375 0.023 0.019 0.845 0.718 0.781 0.090 24 0.144 0.132 0.047 0.042 0.097 0.090 52.813 50.625 0.053 0.051 9.780 9.375 9.578 0.286 48 0.176 0.197 0.040 0.056 0.136 0.141 65.000 66.563 0.065 0.067 12.037 12.326 12.182 0.205 72 0.221 0.201 0.054 0.044 0.167 0.157 74.688 71.563 0.075 0.072 13.831 13.252 13.542 0.409 96 0.227 0.219 0.051 0.051 0.176 0.168 77.500 75.000 0.078 0.075 14.352 13.889 14.120 0.327 120 0.200 0.189 0.052 0.053 0.148 0.136 68.750 65.000 0.069 0.065 12.731 12.037 12.384 0.491 144 0.180 0.172 0.051 0.040 0.129 0.132 62.813 63.750 0.063 0.064 11.632 11.806 11.719 0.123 18
19 Lanjutan
Konsentrasi
Inkubasi
Sample Kontrol S-K ppm (mg/L) mg/mL U/mL
U/mL Deviasi Substrat LBG S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2 2% 0 0.047 0.056 0.048 0.055 -0.001 0.001 22.188 22.813 0.022 0.023 0.822 0.845 0.833 0.016 24 0.129 0.137 0.047 0.055 0.082 0.082 48.125 48.125 0.048 0.048 8.912 8.912 8.912 0.000 48 0.187 0.173 0.050 0.060 0.137 0.113 65.313 57.813 0.065 0.058 12.095 10.706 11.400 0.982 72 0.219 0.200 0.054 0.055 0.165 0.145 74.063 67.813 0.074 0.068 13.715 12.558 13.137 0.818 96 0.229 0.215 0.051 0.056 0.178 0.159 78.125 72.188 0.078 0.072 14.468 13.368 13.918 0.777 120 0.190 0.186 0.052 0.042 0.138 0.144 65.625 67.500 0.066 0.068 12.153 12.500 12.326 0.246 144 0.182 0.192 0.051 0.037 0.131 0.155 63.438 70.938 0.063 0.071 11.748 13.137 12.442 0.982 2.50% 0 0.066 0.050 0.021 0.022 0.045 0.028 36.563 31.250 0.037 0.031 1.354 1.157 1.256 0.139 24 0.123 0.121 0.047 0.045 0.076 0.076 46.250 46.250 0.046 0.046 8.565 8.565 8.565 0.000 48 0.189 0.200 0.050 0.049 0.139 0.151 65.938 69.688 0.066 0.070 12.211 12.905 12.558 0.491 72 0.227 0.221 0.054 0.053 0.173 0.168 76.563 75.000 0.077 0.075 14.178 13.889 14.034 0.205 96 0.227 0.218 0.051 0.056 0.176 0.162 77.500 73.125 0.078 0.073 14.352 13.542 13.947 0.573 120 0.192 0.180 0.052 0.043 0.140 0.137 66.250 65.313 0.066 0.065 12.269 12.095 12.182 0.123 144 0.183 0.177 0.051 0.062 0.132 0.115 63.750 58.438 0.064 0.058 11.806 10.822 11.314 0.696 19
20
Lampiran 6 Hasil pembacaan spektrofotometer λ = 660 nm isolat bakteri laut Bacillus subtilis variasi pH media
pH Media Inkubasi Sampel Rata-rata (S) Deviasi
S1 S2 5 0 0.108 0.090 0.099 0.012 24 0.211 0.209 0.210 0.001 48 0.228 0.227 0.227 0.001 72 0.226 0.227 0.226 0.001 96 0.200 0.207 0.204 0.005 120 0.195 0.183 0.189 0.009 144 0.188 0.192 0.190 0.003 6 0 0.083 0.090 0.086 0.005 24 0.207 0.196 0.201 0.008 48 0.236 0.234 0.235 0.001 72 0.229 0.225 0.227 0.003 96 0.220 0.203 0.211 0.012 120 0.189 0.167 0.178 0.016 144 0.173 0.164 0.168 0.007 7 0 0.074 0.096 0.085 0.016 24 0.198 0.192 0.195 0.004 48 0.226 0.209 0.217 0.012 72 0.224 0.214 0.219 0.007 96 0.222 0.199 0.211 0.016 120 0.193 0.178 0.185 0.010 144 0.198 0.165 0.181 0.023 8 0 0.049 0.080 0.065 0.022 24 0.191 0.191 0.191 0.000 48 0.222 0.225 0.223 0.002 72 0.234 0.229 0.232 0.004 96 0.208 0.197 0.203 0.007 120 0.200 0.181 0.191 0.014 144 0.192 0.184 0.188 0.006 9 0 0.064 0.057 0.061 0.005 24 0.177 0.173 0.175 0.003 48 0.205 0.201 0.203 0.003 72 0.215 0.218 0.216 0.002 96 0.167 0.184 0.176 0.011 120 0.148 0.160 0.154 0.008 144 0.143 0.157 0.150 0.010
21 Lampiran 7 Hasil pembacaan spektrofotometer λ = 540 nm enzim mananase isolat bakteri laut Bacillus subtilis variasi pH media
pH Media Inkubasi Sample Kontrol S-K ppm (mg/L) mg/mL U/mL U/mL Deviasi
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2 5 0 0.027 0.025 0.015 0.015 0.012 0.010 26.250 25.625 0.026 0.026 0.972 0.949 0.961 0.016 24 0.319 0.278 0.024 0.018 0.295 0.260 114.688 103.750 0.115 0.104 4.248 3.843 4.045 0.286 48 0.137 0.131 0.024 0.019 0.113 0.112 57.813 57.500 0.058 0.058 10.706 10.648 10.677 0.041 72 0.182 0.164 0.034 0.037 0.148 0.127 68.750 62.188 0.069 0.062 12.731 11.516 12.124 0.859 96 0.214 0.246 0.026 0.037 0.188 0.209 81.250 87.813 0.081 0.088 15.046 16.262 15.654 0.859 120 0.200 0.214 0.021 0.036 0.179 0.178 78.438 78.125 0.078 0.078 14.525 14.468 14.497 0.041 144 0.234 0.213 0.030 0.027 0.204 0.186 86.250 80.625 0.086 0.081 15.972 14.931 15.451 0.737 6 0 0.026 0.030 0.018 0.018 0.008 0.012 25.000 26.250 0.025 0.026 0.926 0.972 0.949 0.033 24 0.285 0.349 0.022 0.020 0.263 0.329 104.688 125.313 0.105 0.125 3.877 4.641 4.259 0.540 48 0.138 0.125 0.011 0.011 0.127 0.114 62.188 58.125 0.062 0.058 11.516 10.764 11.140 0.532 72 0.142 0.176 0.014 0.020 0.128 0.156 62.500 71.250 0.063 0.071 11.574 13.194 12.384 1.146 96 0.235 0.248 0.018 0.020 0.217 0.228 90.313 93.750 0.090 0.094 16.725 17.361 17.043 0.450 120 0.229 0.218 0.021 0.021 0.208 0.197 87.500 84.063 0.088 0.084 16.204 15.567 15.885 0.450 144 0.240 0.253 0.030 0.027 0.210 0.226 88.125 93.125 0.088 0.093 16.319 17.245 16.782 0.655 7 0 0.024 0.022 0.015 0.013 0.009 0.009 25.313 25.313 0.025 0.025 0.938 0.938 0.938 0.000 24 0.269 0.288 0.021 0.019 0.248 0.269 100.000 106.563 0.100 0.107 3.704 3.947 3.825 0.172 48 0.130 0.170 0.021 0.037 0.109 0.133 56.563 64.063 0.057 0.064 10.475 11.863 11.169 0.982 72 0.136 0.153 0.022 0.028 0.114 0.125 58.125 61.563 0.058 0.062 10.764 11.400 11.082 0.450 96 0.215 0.205 0.024 0.017 0.191 0.188 82.188 81.250 0.082 0.081 15.220 15.046 15.133 0.123 120 0.209 0.170 0.034 0.015 0.175 0.155 77.188 70.938 0.077 0.071 14.294 13.137 13.715 0.818 144 0.199 0.148 0.030 0.021 0.169 0.127 75.313 62.188 0.075 0.062 13.947 11.516 12.731 1.719 21
22 Lanjutan
pH Media Inkubasi Sample Kontrol S-K ppm (mg/L) mg/mL U/mL U/mL Deviasi
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2 8 0 0.014 0.019 0.013 0.011 0.001 0.008 22.813 25.000 0.023 0.025 0.845 0.926 0.885 0.057 24 0.320 0.337 0.026 0.020 0.294 0.317 114.375 121.563 0.114 0.122 4.236 4.502 4.369 0.188 48 0.107 0.144 0.013 0.037 0.094 0.107 51.875 55.938 0.052 0.056 9.606 10.359 9.983 0.532 72 0.138 0.146 0.022 0.022 0.116 0.124 58.750 61.250 0.059 0.061 10.880 11.343 11.111 0.327 96 0.202 0.196 0.014 0.015 0.188 0.181 81.250 79.063 0.081 0.079 15.046 14.641 14.844 0.286 120 0.152 0.227 0.016 0.034 0.136 0.193 65.000 82.813 0.065 0.083 12.037 15.336 13.686 2.332 144 0.235 0.182 0.032 0.021 0.203 0.161 85.938 72.813 0.086 0.073 15.914 13.484 14.699 1.719 9 0 0.016 0.021 0.012 0.019 0.004 0.002 23.750 23.125 0.024 0.023 0.880 0.856 0.868 0.016 24 0.276 0.208 0.020 0.019 0.256 0.189 102.500 81.563 0.103 0.082 3.796 3.021 3.409 0.548 48 0.097 0.107 0.028 0.037 0.069 0.070 44.063 44.375 0.044 0.044 8.160 8.218 8.189 0.041 72 0.129 0.141 0.022 0.026 0.107 0.115 55.938 58.438 0.056 0.058 10.359 10.822 10.590 0.327 96 0.199 0.174 0.019 0.019 0.180 0.155 78.750 70.938 0.079 0.071 14.583 13.137 13.860 1.023 120 0.160 0.211 0.023 0.037 0.137 0.174 65.313 76.875 0.065 0.077 12.095 14.236 13.166 1.514 144 0.186 0.194 0.026 0.020 0.160 0.174 72.500 76.875 0.073 0.077 13.426 14.236 13.831 0.573 22
23 Lampiran 8 Hasil pembacaan spektrofotometer λ = 660 nm isolat bakteri laut
Bacillus subtilis variasi suhu inkubasi
Suhu (0C) Inkubasi Sampel Rata-rata (S) Deviasi
S1 S2 20 0 0.053 0.053 0.053 0.000 24 0.075 0.130 0.103 0.039 48 0.154 0.162 0.158 0.006 72 0.159 0.188 0.174 0.021 96 0.170 0.183 0.177 0.009 120 0.123 0.134 0.129 0.008 144 0.197 0.135 0.166 0.044 30 0 0.082 0.090 0.086 0.006 24 0.206 0.195 0.201 0.008 48 0.235 0.234 0.235 0.001 72 0.229 0.224 0.227 0.004 96 0.219 0.203 0.211 0.011 120 0.189 0.166 0.178 0.016 144 0.173 0.163 0.168 0.007 40 0 0.102 0.106 0.104 0.003 24 0.715 0.716 0.716 0.001 48 0.712 0.686 0.699 0.018 72 0.758 0.637 0.698 0.086 96 0.724 0.600 0.662 0.088 120 0.630 0.517 0.574 0.080 144 0.713 0.637 0.675 0.054 50 0 0.064 0.065 0.065 0.001 24 0.298 0.298 0.298 0.000 48 0.164 0.180 0.172 0.011 72 0.152 0.182 0.167 0.021 96 0.122 0.194 0.158 0.051 120 0.151 0.204 0.178 0.037 144 0.140 0.206 0.173 0.047
24
Lampiran 9 Hasil pembacaan spektrofotometer λ = 540 nm enzim mananase isolat bakteri laut Bacillus subtilis variasi suhu inkubasi
Suhu (0C) Inkubasi Sample Kontrol S-K ppm (mg/L) mg/mL U/mL U/mL Deviasi
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2 20 0 0.036 0.035 0.021 0.029 0.015 0.006 27.188 24.375 0.027 0.024 1.007 0.903 0.955 0.074 24 0.024 0.114 0.019 0.025 0.005 0.089 24.063 50.313 0.024 0.050 0.891 1.863 1.377 0.687 48 0.092 0.154 0.018 0.020 0.074 0.134 45.625 64.375 0.046 0.064 1.690 2.384 2.037 0.491 72 0.104 0.249 0.023 0.029 0.081 0.220 47.813 91.250 0.048 0.091 1.771 3.380 2.575 1.138 96 0.214 0.228 0.025 0.021 0.189 0.207 81.563 87.188 0.082 0.087 3.021 3.229 3.125 0.147 120 0.178 0.274 0.035 0.028 0.143 0.246 67.188 99.375 0.067 0.099 2.488 3.681 3.084 0.843 144 0.162 0.256 0.023 0.029 0.139 0.227 65.938 93.438 0.066 0.093 2.442 3.461 2.951 0.720 30 0 0.026 0.030 0.018 0.018 0.008 0.012 25.000 26.250 0.025 0.026 0.926 0.972 0.949 0.033 24 0.285 0.349 0.022 0.020 0.263 0.329 104.688 125.313 0.105 0.125 3.877 4.641 4.259 0.540 48 0.138 0.125 0.011 0.011 0.127 0.114 62.188 58.125 0.062 0.058 11.516 10.764 11.140 0.532 72 0.142 0.176 0.014 0.020 0.128 0.156 62.500 71.250 0.063 0.071 11.574 13.194 12.384 1.146 96 0.235 0.248 0.018 0.020 0.217 0.228 90.313 93.750 0.090 0.094 16.725 17.361 17.043 0.450 120 0.229 0.218 0.021 0.021 0.208 0.197 87.500 84.063 0.088 0.084 16.204 15.567 15.885 0.450 144 0.240 0.253 0.030 0.027 0.210 0.226 88.125 93.125 0.088 0.093 16.319 17.245 16.782 0.655 40 0 0.074 0.055 0.013 0.015 0.061 0.040 41.563 35.000 0.042 0.035 1.539 1.296 1.418 0.172 24 0.156 0.138 0.015 0.011 0.141 0.127 66.563 62.188 0.067 0.062 12.326 11.516 11.921 0.573 48 0.326 0.290 0.025 0.010 0.301 0.280 116.563 110.000 0.117 0.110 21.586 20.370 20.978 0.859 72 0.280 0.219 0.025 0.010 0.255 0.209 102.188 87.813 0.102 0.088 18.924 16.262 17.593 1.882 96 0.184 0.193 0.019 0.022 0.165 0.171 74.063 75.938 0.074 0.076 13.715 14.063 13.889 0.246 120 0.144 0.128 0.020 0.014 0.124 0.114 61.250 58.125 0.061 0.058 11.343 10.764 11.053 0.409 24
25 Lanjutan
Suhu Inkubasi Sample Kontrol S-K ppm (mg/L) mg/mL U/mL U/mL Deviasi
S1 S2 K1 K2 S1 S2 S1 S2 S1 S2 S1 S2 50 0 0.040 0.036 0.018 0.025 0.022 0.011 29.375 25.938 0.029 0.026 1.088 0.961 1.024 0.090 24 0.108 0.140 0.015 0.027 0.093 0.113 51.563 57.813 0.052 0.058 9.549 10.706 10.127 0.818 48 0.220 0.229 0.027 0.023 0.193 0.206 82.813 86.875 0.083 0.087 15.336 16.088 15.712 0.532 72 0.169 0.156 0.016 0.017 0.153 0.139 70.313 65.938 0.070 0.066 13.021 12.211 12.616 0.573 96 0.148 0.179 0.020 0.035 0.128 0.144 62.500 67.500 0.063 0.068 11.574 12.500 12.037 0.655 120 0.072 0.070 0.018 0.025 0.054 0.045 39.375 36.563 0.039 0.037 7.292 6.771 7.031 0.368 144 0.157 0.134 0.027 0.028 0.130 0.106 63.125 55.625 0.063 0.056 11.690 10.301 10.995 0.982 25
26
Lampiran 10 Contoh perhitungan aktivitas enzim mananase isolat bakteri laut Bacillus subtilis menggunakan konsentrasi substrat LBG 1% pada jam ke-0 ulangan 1
Diketahui sampel – kontrol = 0.082 – 0.032 = 0.032 y = 0.050
Persamaan garis yang diperoleh adalah y=0.0023x - 0.0872, maka y = 0.0023x - 0.0872 x = y + 0.0872
0.0023 Sehingga
x = y + 0.0872 = 0.050 + 0.0872 = 59.652 ppm
0.0023 0.0023
Karena 1 ppm setara dengan 1 mg/L, maka
59.652 ppm = 59.652 = 0.05962 mg/mL 1000 Aktivitas Enzim = C x fp x 1000 t x BM = [0.0592] x 100 x 1000 = 2.209 U/mL 15 x 180 Ket : C = konsentrasi (mg/mL) fp = faktor pengenceran t = waktu reaksi (menit)
27 Lampiran 11 Hasil analisis statistik uji lanjut menggunakan duncan test
Optimasi konsentrasi substrat LBG
Duncan Grouping Mean N Substrat A 10.7767 14 1 A 10.6151 14 1.5 A 10.5507 14 2.5 A 10.4242 14 2 B 5.8902 14 0.5 Interpretasi:
Hanya perlakuan optimasi substrat konsentrasi 0.5 % yang berbeda nyata dengan taraf faktor yang lain pada taraf nyata 5%.
Optimasi pH media
Duncan Grouping Mean N pH A 11.2061 14 6 B 10.4869 14 5 C B 9.9396 14 8 C 9.7992 14 7 D 9.1304 14 9 Interpretasi:
Perlakuan optimasi pH 6 berbeda nyata dengan pH 5,8,7,9 pada taraf nyata 5%, perlakuan optimasi pH 5, 8, 7 tidak berbeda nyata pada taraf nyata 5%, dan perlakuan optimasi pH 9 berbeda nyata dg pH lainnya pada taraf nyata 5%. Optimasi suhu inkubasi
Duncan Grouping Mean N Suhu A 12.8720 14 40 B 11.2061 14 30 C 9.9349 14 50 D 2.3008 14 20 Interpretasi:
Semua perlakuan optimasi suhu berbeda nyata satu sama lain pada taraf nyata 5%.
28
RIWAYAT HIDUP
Penulis dilahirkan di Kota Bukittinggi, Sumatera Barat, pada tanggal 23 Maret 1992 dari ayah Masrizal dan ibu Rosliana. Penulis adalah putra bungsu dari tiga bersaudara. Tahun 2010 penulis lulus dari SMAN 2 Lubuk Basung Kabupaten Agam, dan pada tahun yang sama penulis lulus seleksi masuk Institut Pertanian Bogor program studi Biokimia Fakultas Matematika dan Ilmu Pengetahuan Alam (FMIPA) melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama masa perkuliahan, penulis pernah menjadi Ketua Divisi Bidang Keilmuan Metabolisme pada Community of Research and Education in Biochemistry (Crebs) periode 2012/2013. Penulis juga pernah aktif sebagai anggota Serambi Ruhiyah Mahasiswa FMIPA (Serum-G) periode 2011/2012 dan 2012/2013. Bulan Juli-Agustus 2013 penulis melaksanakan Praktik Lapangan di Laboratorium Biorekayasa Lingkungan, Bioproses, Pusat Penelitian Biotekologi LIPI Cibinong, Bogor. dengan judul Aktivitas Enzim Mananase dari Isolat Bakteri Laut P20.