Salmonella Typhimurium SELAMA FERMENTASI
BIJI KAKAO (Theobroma cacao L.)
TRI NOPSAGIARTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Pengaruh Aplikasi Lactobacillus coryneformis To8 Terhadap Cemaran Aspergillus flavus dan Salmonella Typhimurium Selama Fermentasi Biji Kakao (Theobroma cacao L.) adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan penulis lain, telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Cemaran Aspergillus flavus dan Salmonella Typhimurium Selama Fermentasi Biji Kakao (Theobroma cacao L.). Dibimbing oleh BETTY SRI LAKSMI JENIE dan HARSI D. KUSUMANINGRUM.
Biji kakao sering terkontaminasi Salmonella Typhimurium dan Aspergillus flavus selama fermentasi, sehingga mutunya menjadi rendah. Beberapa bakteri asam laktat (BAL) telah diketahui mempunyai sifat antibakteri dan antimikotik. Tujuan penelitian ini adalah untuk meningkatkan mutu biji kakao kering yang bebas dari S. Typhimurium dan A. flavus.
Pada penelitian ini dilakukan fermentasi biji kakao dengan empat isolat BAL, untuk menghambat pertumbuhan S. Typhimurium dan A. flavus. Kemampuan BAL menghambat pertumbuhan S. Typhimurium dan pertumbuhan A. flavus diamati selama 24 jam. Aplikasi BAL dilakukan pada saat fermentasi setelah biji kakao diinfeksi dengan S. Typhimurium dan A. flavus. Pengamatan pertumbuhan S. Typhimurium, A. flavus, dan BAL serta perubahan pH pulp biji kakao dilakukan pada 0 (2 jam), 3, 5 dan 7 hari fermentasi. Nilai pH, kadar air, total kapang, dan perubahan warna bubuk kakao diamati setelah biji dikeringkan selama 2 hari pada suhu 550 C.
Hasil yang diperoleh menunjukkan bahwa ke empat isolat BAL yaitu Lactobacillus coryneformis To8, Lactobacillus plantarum kik, Lactobacillus
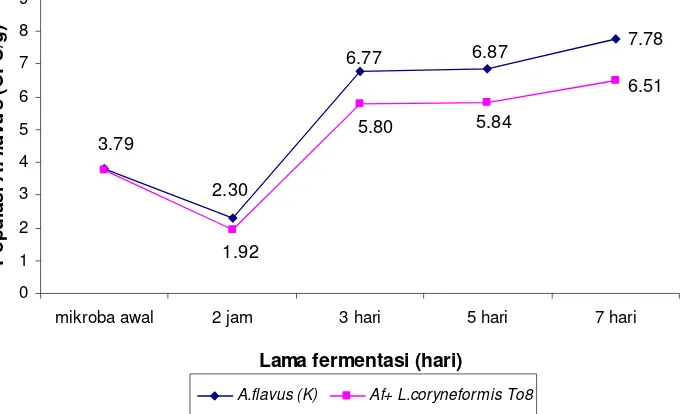
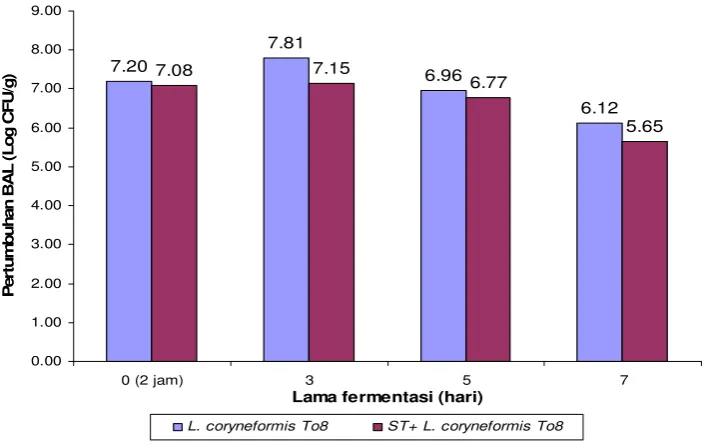
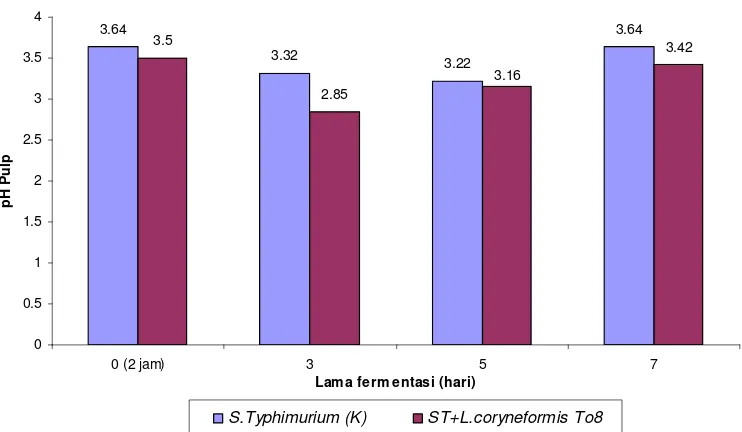
plantarum pi28a, dan Lactobacillus brevis, mempunyai aktivitas penghambatan terhadap S. Typhimurium. L. coryneformis To8 menunjukkan aktivitas antimikotik yang lebih baik terhadap A. flavus dibandingkan BAL lainnya. Hal ini terlihat dari penurunan jumlah A. flavus pada fermentasi biji kakao dengan suspensi BAL selama 24 jam sebesar 1.4 unit log. Aplikasi L. coryneformis To8 selama fermentasi biji kakao dapat menghentikan pertumbuhan S. Typhimurium selama fermentasi hingga 7 hari, biji kakao yang difermentasi dengan suspensi L. coryneformis To8 dapat menurunkan pertumbuhan A. flavus sebesar 1.27 unit log dibandingkan kontrol setelah 7 hari fermentasi. Penurunan pertumbuhan S. Typhimurium dan A. flavus terjadi seiring dengan peningkatan pertumbuhan BAL dan penurunan pH pulp. BAL dapat tumbuh baik pada pulp biji kakao, pertumbuhan tertinggi terjadi setelah 3 hari fermentasi. Sementara itu nilai pH pulp akan mengalami penurunan sampai 3 hari fermentasi, dan jika fermentasi dilanjutkan hingga 7 hari terjadi peningkatan pH pulp. Untuk biji kakao kering, nilai pH (5.44), kadar air (6.54%) dan kadar biji berkapang (dibawah 4 %), serta warna bubuk memenuhi standar setelah difermentasi selama 5 hari.
the Waste of Aspergillus flavus and Salmonella Typhimurium during the Fermentation of Cocoa Beans (Theobroma cacao L). Under the direction of BETTY SRI LAKSMI JENIE and HARSI D. KUSUMANINGRUM.
Cocoa beans are often contaminated by Salmonella Typhimurium and Aspergillus flavus during their fermentation period, resulting in low quality. A number of lactic acid bacteria (LAB) have been identified to possess the characteristics of antibacterial and antifungal. The objective of this research is to improve dried cocoa beans which are free from S. Typhimurium and A. flavus.
In this research the fermentation of cocoa beans was conducted by using four isolat LAB to prevent the growth of S. Typhimurium and A. flavus. LAB ability to prevent the growth of S. Typhimurium and A. flavus was observed for 24 hours. LAB application was carried out during fermentation after the cocoa beans had been infected by S. Typhimurium and A. flavus. Observation on the growth of S. Typhimurium and A. flavus, LAB, and changes in pH of cocoa beans pulp was done on 0 (2 hours), 3rd, 5th and 7th day of fermentation. The value of pH, water content, beans content with mould, and changes in color of cocoa powder were observed after the beans had been dried for 2 days at 55º C.
The result showed that the four BAL isolats -- Lactobacillus coryneformis To8, Lactobacillus plantarum kik, Lactobacillus plantirum pi28a, and Lactobacillus bravis – had an inhibiting activity toward S. Typhimurium. L coryneformis To8 indicated a better antifungal ability toward A. flavus
compared to other LABs. It was seen in the decreasing number of A. flavus in fermented cocoa beans with LAB suspension of 1.4 log units for 24 hours. The application of L. coryneformis To8 during cocoa beans fermentation inhibited the growth of S. Typhimurium during 7 days of fermentation, fermentation of cocoa beans with L. coryneformis To8 could lower the growth of A. flavus by 1.27 log units compared to control after 7 days of fermentation. The decrease of the growth of S Typhimurium and A. flavus occured in line with the increase of LAB growth and the decrease of pulp pH. LAB grew well in cocoa bean pulp; the highest growth took place after 3 days of fermentation. In the mean time, the value of pulp pH decreased after 3 days of fermentation, and if the fermentation proceeds until 7 days, pulp pH will go up. Dried cocoa beans, the value of pH (5.44), water content (6.54%), beans content with mould (below 4%), and color of powder can meet the standard after 5 days fermentation.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007 Hak Cipta dilindungi
Salmonella Typhimurium SELAMA FERMENTASI
BIJI KAKAO (Theobroma cacao L.)
TRI NOPSAGIARTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Tri Nopsagiarti NRP : F251030171
Disetujui Komisi Pembimbing
Prof.Dr.Ir. Betty Sri Laksmi Jenie, MS. Dr.Ir. Harsi D. Kusumaningrum
Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof.Dr.Ir. Betty Sri Laksmi Jenie, MS Dr.Ir. Khairil Anwar Notodiputro, MS.
Puji syukur penulis panjatkan ke hadirat Allah Subhanahuta’ala atas limpahan rahmat dan ridho-Nya sehingga penulis dapat menyelesaikan tesis ini sebagai salah satu syarat untuk mendapatkan gelar Magister Sains pada Program Studi Ilmu Pangan Sekolah Pascasarjana IPB.
Pada kesempatan ini penulis penyampaikan terima kasih yang sebesar-besarnya kepada:
1. Prof.Dr.Ir. Betty Sri Laksmi Jenie, M.S. dan Dr.Ir. Harsi D. Kusumaningrum sebagai komisi pembimbing atas bimbingan dan arahannya sejak awal penelitian hingga akhir penulisan tesis ini.
2. Dr. Ir. Feri Kusnandar, MSc. sebagai dosen penguji luar komisis. Atas saran, komentar dan masukan yang diberikan, saya pahami sebagai bentuk lain dari pembimbingan menuju kesempurnaan tesis ini.
3. Kepada rekan-rekan IPN 2003, karyawan dan teknisi Lab. Mutu dan Keamanan Pangan Seafast Center IPB atas segala bantuan dan kerjasamanya. Tarima kasih juga kepada teknisi di lingkungan laboratorium Ilmu dan Teknologi Pangan Fateta IPB atas segala bantuan fasilitas selama pelaksanaan penelitian.
Doa dan terimakasih yang tiada terhingga penulis sampaikan untuk kedua orang tua. Terimakasih atas doa dan dorongan semangatnya.
Akhir kata penulis berharap semoga tesis ini dapat bermanfaat bagi yang memerlukannya.
Bogor, Februari 2007
Penulis dilahirkan pada tanggal 27 November 1978 sebagai anak ke tiga dari tiga bersaudara dari orang tua bapak Sudirman dan ibu Mariani di Riau.
Tahun 1997 penulis lulus dari SMU Negeri 1 Taluk Kuantan dan pada tahun yang sama lulus seleksi masuk UNRI melalui jalur UMPTN. Penulis memilih Program Studi Agronomi dengan Bidang Ilmu Teknologi Industri Pertanian Fakultas Pertanian Universitas Riau.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah Biokimia pada tahun ajaran 2001/2002. Pada tahun 2002, penulis memperoleh gelar Sarjana Pertanian. Terdaftar sebagai mahasiswa Magister Sains Program Studi Ilmu Pangan, Sekolah Pascasarjana IPB pada tahun 2003.
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 4
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA ... 5
Kakao ... 5
Botani Tanaman Kakao ... 5
Pengolahan Biji Kakao ... 5
Fermentasi Kakao ... 6
Pengeringan Biji kakao ... 9
Mutu Biji Kakao ... 10
Mikroorganisme Patogen dan Pembusuk pada Kakao ... 11
Bakteri Asam laktat ... 12
Sifat BAL ... 12
Aktivitas Antibakteri dan Antimikotik dari BAL ... 14
BAHAN DAN METODE ... 16
Waktu dan Tempat ... 16
Bahan dan Alat ... 16
Metode Penelitian ... 17
Analisis ... 21
HASIL DAN PEMBAHASAN... 25
Seleksi isolat BAL ... 25
Aktivitas Antibakteri Isolat BAL terhadap Salmonella Typhimurium pada Biji Kakao ... 25
Aktivitas Antimikotik Isolat BAL terhadap Aspergillus flavus pada biji kakao ... 27
Aplikasi BAL selama fermentasi biji kakao ... 29
Pengaruh Aplikasi L. coryneformis To8 terhadap Pertumbuhan Salmonella Typhimuriumselama Fermentasi Biji Kakao ... 29
Pengaruh Aplikasi L. coryneformis To8 terhadap Pertumbuhan Aspergillus flavus selama Fermentasi Biji Kakao ... 31
Pertumbuhan L. coryneformis To8 dan Perubahan pH Pulp Biji Kakao yang Diinfeksi dengan Salmonella Typhimurium ... 34
Salmonella Typhimurium SELAMA FERMENTASI
BIJI KAKAO (Theobroma cacao L.)
TRI NOPSAGIARTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Dengan ini saya menyatakan bahwa tesis Pengaruh Aplikasi Lactobacillus coryneformis To8 Terhadap Cemaran Aspergillus flavus dan Salmonella Typhimurium Selama Fermentasi Biji Kakao (Theobroma cacao L.) adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan penulis lain, telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Cemaran Aspergillus flavus dan Salmonella Typhimurium Selama Fermentasi Biji Kakao (Theobroma cacao L.). Dibimbing oleh BETTY SRI LAKSMI JENIE dan HARSI D. KUSUMANINGRUM.
Biji kakao sering terkontaminasi Salmonella Typhimurium dan Aspergillus flavus selama fermentasi, sehingga mutunya menjadi rendah. Beberapa bakteri asam laktat (BAL) telah diketahui mempunyai sifat antibakteri dan antimikotik. Tujuan penelitian ini adalah untuk meningkatkan mutu biji kakao kering yang bebas dari S. Typhimurium dan A. flavus.
Pada penelitian ini dilakukan fermentasi biji kakao dengan empat isolat BAL, untuk menghambat pertumbuhan S. Typhimurium dan A. flavus. Kemampuan BAL menghambat pertumbuhan S. Typhimurium dan pertumbuhan A. flavus diamati selama 24 jam. Aplikasi BAL dilakukan pada saat fermentasi setelah biji kakao diinfeksi dengan S. Typhimurium dan A. flavus. Pengamatan pertumbuhan S. Typhimurium, A. flavus, dan BAL serta perubahan pH pulp biji kakao dilakukan pada 0 (2 jam), 3, 5 dan 7 hari fermentasi. Nilai pH, kadar air, total kapang, dan perubahan warna bubuk kakao diamati setelah biji dikeringkan selama 2 hari pada suhu 550 C.
Hasil yang diperoleh menunjukkan bahwa ke empat isolat BAL yaitu Lactobacillus coryneformis To8, Lactobacillus plantarum kik, Lactobacillus
plantarum pi28a, dan Lactobacillus brevis, mempunyai aktivitas penghambatan terhadap S. Typhimurium. L. coryneformis To8 menunjukkan aktivitas antimikotik yang lebih baik terhadap A. flavus dibandingkan BAL lainnya. Hal ini terlihat dari penurunan jumlah A. flavus pada fermentasi biji kakao dengan suspensi BAL selama 24 jam sebesar 1.4 unit log. Aplikasi L. coryneformis To8 selama fermentasi biji kakao dapat menghentikan pertumbuhan S. Typhimurium selama fermentasi hingga 7 hari, biji kakao yang difermentasi dengan suspensi L. coryneformis To8 dapat menurunkan pertumbuhan A. flavus sebesar 1.27 unit log dibandingkan kontrol setelah 7 hari fermentasi. Penurunan pertumbuhan S. Typhimurium dan A. flavus terjadi seiring dengan peningkatan pertumbuhan BAL dan penurunan pH pulp. BAL dapat tumbuh baik pada pulp biji kakao, pertumbuhan tertinggi terjadi setelah 3 hari fermentasi. Sementara itu nilai pH pulp akan mengalami penurunan sampai 3 hari fermentasi, dan jika fermentasi dilanjutkan hingga 7 hari terjadi peningkatan pH pulp. Untuk biji kakao kering, nilai pH (5.44), kadar air (6.54%) dan kadar biji berkapang (dibawah 4 %), serta warna bubuk memenuhi standar setelah difermentasi selama 5 hari.
the Waste of Aspergillus flavus and Salmonella Typhimurium during the Fermentation of Cocoa Beans (Theobroma cacao L). Under the direction of BETTY SRI LAKSMI JENIE and HARSI D. KUSUMANINGRUM.
Cocoa beans are often contaminated by Salmonella Typhimurium and Aspergillus flavus during their fermentation period, resulting in low quality. A number of lactic acid bacteria (LAB) have been identified to possess the characteristics of antibacterial and antifungal. The objective of this research is to improve dried cocoa beans which are free from S. Typhimurium and A. flavus.
In this research the fermentation of cocoa beans was conducted by using four isolat LAB to prevent the growth of S. Typhimurium and A. flavus. LAB ability to prevent the growth of S. Typhimurium and A. flavus was observed for 24 hours. LAB application was carried out during fermentation after the cocoa beans had been infected by S. Typhimurium and A. flavus. Observation on the growth of S. Typhimurium and A. flavus, LAB, and changes in pH of cocoa beans pulp was done on 0 (2 hours), 3rd, 5th and 7th day of fermentation. The value of pH, water content, beans content with mould, and changes in color of cocoa powder were observed after the beans had been dried for 2 days at 55º C.
The result showed that the four BAL isolats -- Lactobacillus coryneformis To8, Lactobacillus plantarum kik, Lactobacillus plantirum pi28a, and Lactobacillus bravis – had an inhibiting activity toward S. Typhimurium. L coryneformis To8 indicated a better antifungal ability toward A. flavus
compared to other LABs. It was seen in the decreasing number of A. flavus in fermented cocoa beans with LAB suspension of 1.4 log units for 24 hours. The application of L. coryneformis To8 during cocoa beans fermentation inhibited the growth of S. Typhimurium during 7 days of fermentation, fermentation of cocoa beans with L. coryneformis To8 could lower the growth of A. flavus by 1.27 log units compared to control after 7 days of fermentation. The decrease of the growth of S Typhimurium and A. flavus occured in line with the increase of LAB growth and the decrease of pulp pH. LAB grew well in cocoa bean pulp; the highest growth took place after 3 days of fermentation. In the mean time, the value of pulp pH decreased after 3 days of fermentation, and if the fermentation proceeds until 7 days, pulp pH will go up. Dried cocoa beans, the value of pH (5.44), water content (6.54%), beans content with mould (below 4%), and color of powder can meet the standard after 5 days fermentation.
© Hak cipta milik Institut Pertanian Bogor, tahun 2007 Hak Cipta dilindungi
Salmonella Typhimurium SELAMA FERMENTASI
BIJI KAKAO (Theobroma cacao L.)
TRI NOPSAGIARTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Ilmu Pangan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Nama : Tri Nopsagiarti NRP : F251030171
Disetujui Komisi Pembimbing
Prof.Dr.Ir. Betty Sri Laksmi Jenie, MS. Dr.Ir. Harsi D. Kusumaningrum
Ketua Anggota
Diketahui
Ketua Program Studi Ilmu Pangan Dekan Sekolah Pascasarjana
Prof.Dr.Ir. Betty Sri Laksmi Jenie, MS Dr.Ir. Khairil Anwar Notodiputro, MS.
Puji syukur penulis panjatkan ke hadirat Allah Subhanahuta’ala atas limpahan rahmat dan ridho-Nya sehingga penulis dapat menyelesaikan tesis ini sebagai salah satu syarat untuk mendapatkan gelar Magister Sains pada Program Studi Ilmu Pangan Sekolah Pascasarjana IPB.
Pada kesempatan ini penulis penyampaikan terima kasih yang sebesar-besarnya kepada:
1. Prof.Dr.Ir. Betty Sri Laksmi Jenie, M.S. dan Dr.Ir. Harsi D. Kusumaningrum sebagai komisi pembimbing atas bimbingan dan arahannya sejak awal penelitian hingga akhir penulisan tesis ini.
2. Dr. Ir. Feri Kusnandar, MSc. sebagai dosen penguji luar komisis. Atas saran, komentar dan masukan yang diberikan, saya pahami sebagai bentuk lain dari pembimbingan menuju kesempurnaan tesis ini.
3. Kepada rekan-rekan IPN 2003, karyawan dan teknisi Lab. Mutu dan Keamanan Pangan Seafast Center IPB atas segala bantuan dan kerjasamanya. Tarima kasih juga kepada teknisi di lingkungan laboratorium Ilmu dan Teknologi Pangan Fateta IPB atas segala bantuan fasilitas selama pelaksanaan penelitian.
Doa dan terimakasih yang tiada terhingga penulis sampaikan untuk kedua orang tua. Terimakasih atas doa dan dorongan semangatnya.
Akhir kata penulis berharap semoga tesis ini dapat bermanfaat bagi yang memerlukannya.
Bogor, Februari 2007
Penulis dilahirkan pada tanggal 27 November 1978 sebagai anak ke tiga dari tiga bersaudara dari orang tua bapak Sudirman dan ibu Mariani di Riau.
Tahun 1997 penulis lulus dari SMU Negeri 1 Taluk Kuantan dan pada tahun yang sama lulus seleksi masuk UNRI melalui jalur UMPTN. Penulis memilih Program Studi Agronomi dengan Bidang Ilmu Teknologi Industri Pertanian Fakultas Pertanian Universitas Riau.
Selama mengikuti perkuliahan, penulis menjadi asisten mata kuliah Biokimia pada tahun ajaran 2001/2002. Pada tahun 2002, penulis memperoleh gelar Sarjana Pertanian. Terdaftar sebagai mahasiswa Magister Sains Program Studi Ilmu Pangan, Sekolah Pascasarjana IPB pada tahun 2003.
DAFTAR TABEL ... x
DAFTAR GAMBAR ... xi
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 4
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA ... 5
Kakao ... 5
Botani Tanaman Kakao ... 5
Pengolahan Biji Kakao ... 5
Fermentasi Kakao ... 6
Pengeringan Biji kakao ... 9
Mutu Biji Kakao ... 10
Mikroorganisme Patogen dan Pembusuk pada Kakao ... 11
Bakteri Asam laktat ... 12
Sifat BAL ... 12
Aktivitas Antibakteri dan Antimikotik dari BAL ... 14
BAHAN DAN METODE ... 16
Waktu dan Tempat ... 16
Bahan dan Alat ... 16
Metode Penelitian ... 17
Analisis ... 21
HASIL DAN PEMBAHASAN... 25
Seleksi isolat BAL ... 25
Aktivitas Antibakteri Isolat BAL terhadap Salmonella Typhimurium pada Biji Kakao ... 25
Aktivitas Antimikotik Isolat BAL terhadap Aspergillus flavus pada biji kakao ... 27
Aplikasi BAL selama fermentasi biji kakao ... 29
Pengaruh Aplikasi L. coryneformis To8 terhadap Pertumbuhan Salmonella Typhimuriumselama Fermentasi Biji Kakao ... 29
Pengaruh Aplikasi L. coryneformis To8 terhadap Pertumbuhan Aspergillus flavus selama Fermentasi Biji Kakao ... 31
Pertumbuhan L. coryneformis To8 dan Perubahan pH Pulp Biji Kakao yang Diinfeksi dengan Salmonella Typhimurium ... 34
Pengeringan biji kakao setelah difermentasi dengan BAL ... 41
Nilai pH Biji Kakao ... 41
Kadar Air ... 43
Kadar Biji Berkapang ... 45
Warna Bubuk Biji Kakao ... 46
Lama fermentasi Biji kakao ... 48
SIMPULAN DAN SARAN Simpulan ... 50
Saran ... 50
DAFTAR PUSTAKA ... 51
LAMPIRAN ... 58
1 Syarat umum mutu biji kakao ... 10 3 Spesifikasi persyaratan mutu biji kakao... 11 4 Aktivitas antibakteri beberapa jenis BAL terhadap Salmonellla
Typhimurium selama fermentasi biji kakao... 25 5 Pengaruh aplikasi L. coryneformis To8 terhadap pertumbuhan
Salmonella Typhimurium selama fermentasi biji kakao... 30
1. Pembentukan asam asetat dan asam laktat selama fermentasi kakao .. 7 2. Tahap-tahap Penelitian ... 18 3. Aktivitas antimikotik beberapa jenis BAL selama 24 jam fermentasi
terhadap populasi A. flavus pada biji kakao ... 28 4. Biji kakao yang di aplikasi dengan L. coryneformis To8
selama 24 jam ... 29 5. Pengaruh aplikasi L. coryneformis To8 selama fermentasi biji kakao
terhadap pertumbuhan A flavus... 32 6. Pertumbuhan L. coryneformis To8 selama fermentasi biji kakao setelah diinfeksi dengan Salmonella Typhimurium ... 36 7. Perubahan pH pulp biji kakao selama fermentasi setelah diinfeksi
dengan Salmonella Typhimurium ... 37 8. Pertumbuhan L.coryneformis To8 selama fermentasi biji kakao setelah
diinfeksi dengan Aspergillus flavus ... 38 9. Perubahan pH pulp biji kakao selama fermentasi setelah diinfeksi
dengan Aspergillus flavus... 40 10.Nilai pH biji kakao kering setelah disemprot dengan L. coryneformis
To8 dan dikeringkan selama 2 hari pada suhu 550 C ... 42 11.Perubahan kadar air biji kakao kering setelah difermentasi dengan
L. coryneformis To8 dan dikeringkan selama 2 hari pada suhu 550 C 44 12.Jumlah biji kakao kering yang ditumbuhi kapang (biji/100 g) ... 46 13.Nilai L bubuk kakao setelah difermentasi dengan L. coryneformis
To8 ... 48
1 Diameter penghambatan isolat BAL terhadap S. Typhimurium ... 58 2 Pengaruh penyemprotan biji kakao dengan suspensi BAL
terhadap pertumbuhan Aspergillus flavus selama 24 jam ... 59 3 Hasil sidik ragam pengaruh penyemprotan biji kakao dengan suspensi
BAL terhadap penurunan populasi Aspergillus flavus selama 24 jam... 59 4 Hasil uji beda Duncan penyemprotan biji kakao dengan suspensi
BAL terhadap penurunan populasi Aspergillus flavus selama 24 jam ... 59 5 Pertumbuhan Aspergillus flavus selama 7 hari fermentasi
setelah penyemprotan dengan suspensi L. coryneformis To8 ... 60 6 Hasil sidik ragam pengaruh penyemprotan biji kakao dengan
suspensi L. coryneformis To8 terhadap pertumbuhan Aspergillus flavus . 60 7 Hasil sidik ragam pengaruh lama fermentasi terhadap pertumbuhan
Aspergillus flavus setelah disemprot dengan suspensi
L. coryneformis To8 ...61 8 Hasil uji beda Duncan pengaruh lama fermentasi terhadap pertumbuhan
Aspergillus flavus setelah disemprot dengan suspensi
L. coryneformis To8 ... 61 9 Pertumbuhan L. coryneformis To8 setelah diinfeksi dengan
Salmonella Typhimurium ... 61 10 Hasil sidik ragam pengaruh infeksi Salmonella Typhimurium pada biji kakao
terhadap pertumbuhan L. coryneformis To8 selama fermentasi 7 hari ... 62 11 Hasil sidik ragam pengaruh lama fermentasi terhadap pertumbuhan
L. coryneformis To8 selama fermentasi 7 hari pada biji kakao yang
diinfeksi dengan Salmonella Typhimurium ... 63 12 Hasil uji beda Duncan pengaruh lama fermentasi terhadap
pertumbuhan L. coryneformis To8 selama fermentasi 7 hari pada
biji kakao yang diinfeksi dengan Salmonella Typhimurium ... 63 13 Perubahan pH pulp biji kakao selama fermentasi setelah diinfeksi
dengan Salmonella Typhimurium ... 64
Typhimurium ... 64 15 Hasil sidik ragam pengaruh lama fermentasi terhadap perubahan pH pulp biji
kakao yang disemprot dengan L. coryneformis To8 dan diinfeksi dengan Salmonella Typhimurium ... 64 16 Pertumbuhan L. coryneformis To8 pada fermentasi biji kakao setelah diinfeksi
dengan Aspergillus flavus ...65 17 Hasil sidik ragam pengaruh infeksi Aspergillus flavus pada biji kakao terhadap
pertumbuhan L. coryneformis To8 selama fermentasi 7 hari ... 65
18 Hasil sidik ragam pengaruh lama fermentasi terhadap pertumbuhan L. coryneformis To8 selama fermentasi 7 hari pada biji kakao yang diinfeksi
dengan Aspergillus flavus ...66 19 Hasil uji beda Duncan pengaruh lama fermentasi terhadap pertumbuhan L.
coryneformis To8 selama fermentasi 7 hari pada biji kakao yang diinfeksi dengan Aspergillus flavus ...66 20 Perubahan pH pulp biji kakao selama fermentasi setelah diinfeksi dengan
Aspergillus flavus ...67 21 Hasil sidik ragam pengaruh penyemprotan L. coryneformis To8 terhadap
perubahan pH pulp biji kakao yang diinfeksi dengan Aspergillus flavus 67 22 Hasil sidik ragam pengaruh lama fermentasi terhadap perubahan pH pulp biji
kakao yang disemprot dengan L. coryneformis To8 dan diinfeksi dengan Aspergillus flavus ...67 23 Nilai pH biji kakao kering setelah diaplikasi dengan L. coryneformis To8 68 24 Hasil sidik ragam pengaruh aplikasi L. coryneformis To8 selama fermentasi 7
hari terhadap nilai pH biji kakao kering ... 68 25 Hasil sidik ragam pengaruh lama fermentasi terhadap perubahan pH biji kakao
kering yang diaplikasi dengan L. coryneformis To8 ... 68
26 Perubahan kadar air biji kakao kering setelah diaplikasi dengan L. coryneformis To8 ... 69
27 Hasil sidik ragam pengaruh aplikasi L. coryneformis To8 selama fermentasi 7 hari terhadap kadar air biji kakao kering ... 69
29 Hasil uji beda Duncan pengaruh lama fermentasi terhadap kadar air biji kakao kering yang diaplikasi dengan L. coryneformis To8 ... 70 30 Persentase kadar biji berkapang setelah diaplikasi dengan ...L. coryneformis To8 ... 71 31 Hasil sidik ragam pengaruh aplikasi L. coryneformis To8 selama
fermentasi 7 hari terhadap kadar biji berkapang ... 71 32 Hasil sidik ragam pengaruh lama fermentasi terhadap kadar biji
berkapang yang diaplikasi dengan L. coryneformis To8 ... 72 33 Hasil uji beda Duncan pengaruh lama fermentasi terhadap kadar
biji berkapang yang diaplikasi dengan L. coryneformis To8 ... 72 34 Hasil pengukuran warna bubuk kakao setelah diaplikasi dengan
L. coryneformis To8 ... 73 35 Hasil sidik ragam pengaruh aplikasi L. coryneformis To8 selama
fermentasi 7 hari terhadap nilai L bubuk kakao ... 73 36 Hasil sidik ragam pengaruh lama fermentasi terhadap nilai L bubuk
kakao yang diaplikasi dengan L. coryneformis To8 ... 73 37 Hasil uji beda Duncan pengaruh lama fermentasi terhadap nilai L
bubuk kakao kering yang diaplikasi dengan L. coryneformis To8 ... 73 38 Syarat mutu kakao bubuk ... 74
PENDAHULUAN
Latar Belakang
Salah satu komoditas perkebunan yang sangat penting dalam menyumbang perolehan devisa negara adalah kakao. Selama tahun 2000 jumlah ekspor kakao sebesar 424.088 ton, sedangkan pada tahun 2001 ekspor kakao Indonesia sedikit menurun yaitu sebesar 393.224 ton dengan nilai US$ 391.086.033 (BPS 2002). ITC (2001) melaporkan bahwa pada tahun 1999/2000, Indonesia merupakan produsen kakao ketiga dunia dengan pangsa 14 %. Posisi pertama ditempati Cote d’Ivoire (Pantai Gading) 44 %, dan menyusul Ghana 15 %.
Selain untuk konsumsi dalam negeri terutama untuk industri kosmetik, farmasi dan industri makanan, komoditi kakao juga merupakan komoditas ekspor. Ekspor kakao terbesar adalah dalam bentuk biji kering (cacao beans). Tujuan utama ekspor kakao Indonesia adalah Amerika Serikat sekitar 40% dari total ekspor, Singapura 17%, Malaysia 14 %, Brazil 8% dan Cina 5% (Haryadi 2005). Penurunan jumlah ekspor kakao Indonesia salah satunya karena mutu biji kakao yang sangat rendah, akibatnya diberlakukan automatic detention yang akan berpengaruh terhadap harga jual.
Berdasarkan kelompok komoditi pangan yang mengalami penahanan dari FDA pada periode Januari hingga Juni 2000, kakao menempati urutan kedua yaitu sebesar 22% setelah udang beku (Raharjo 2001). Biji kakao Indonesia mempunyai kelemahan dalam hal kurang terfermentasi, tidak cukup kering, ukuran biji yang tidak seragam, kadar asam lemak rendah, citarasa yang beragam dan tidak konsisten dari segi mutu (Sigg dan Effendi 1989), serta derajat keasaman biji kakao Indonesia cenderung masih tinggi, yaitu kurang dari 5.
Ada sekitar 80 % produksi kakao rakyat tidak difermentasi (unfermented), sehingga biji kakao tidak dapat diekspor secara keseluruhan karena mutunya rendah (Arsyad 2004). Padahal biji kakao yang difermentasi mutunya lebih baik, sehingga harganya juga lebih baik. Fermentasi merupakan salah satu upaya yang dapat dilakukan untuk meningkatkan mutu biji kakao (Purwaningsih et al. 2004).
Mikroorganisme yang terlibat dalam proses fermentasi biji kakao ini, berasal dari lingkungan yang mengkontaminasi daging buah (pulp) dan biji kakao. Daging buah dan biji kakao terkontaminasi oleh mikroorganisme selama dan setelah pengupasan, yang sumbernya berasal dari tangan, alat–alat yang digunakan selama panen, tanah, daun, wadah yang digunakan maupun dari insekta (Minifie 1999; Lund 2000).
Biji kakao asal Indonesia masih sering terkontaminasi dengan serangga, kapang dan kotoran lainnya, sehingga produk kakao ekspor dikenakan penahanan otomatis (automatic detention). Dengan tidak terpenuhinya persyaratan higienis, maka diperlukan biaya tambahan dan diperhitungkan langsung pada harga pembelian. Kerugian Indonesia akibat penahanan secara otomatis tersebut berkisar US$ 45-90 juta atau 10-20 % dari ekspor setiap tahunnya (Tjatjo 2004).
Bakteri pembusuk yang dapat tumbuh di permukaan biji kakao akibat dari pengadukan yang kurang baik selama fermentasi adalah Aerobacter spp dan Pseudomonas spp, sedangkan patogen yang juga ditemukan pada biji kakao adalah Salmonellla (Lund 2000). Keberadaan kapang dari famili Aspergillus (A.glaucus, A.niger, A. flavus, A.tamarii), Penicillium dan Mucor memungkinkan terdapatnya mikotoksin di dalam biji kakao (Christensen 1987; Harrison 2000). Dampak negatif lain dari keberadaan kapang pada biji kakao selain mikotoksin adalah timbulnya off-flavor akibat aktivitas enzim lipolitik (Lund 2000). Disamping itu kapang merupakan masalah yang berkaitan dengan belum sempurnanya pengeringan biji. Petani yang mengeringkan biji kakao dengan cara dijemur, akan mengalami kesulitan jika kebetulan turun hujan. Akibatnya, tumbuhnya kapang tidak dapat dicegah. Demikian pula jika kadar air setelah pengeringan dalam bahan masih diatas 7 %. Kebanyakan petani tidak mau mengeringkan sampai kering, dengan alasan bahwa bobotnya menjadi berkurang (Amin 2002a).
yang dilakukan oleh Schwan (1998), dengan menggunakan campuran kultur mikroba pada fermentasi biji kakao, kultur mikroba tersebut diisolasi dari biji kakao yang difermentasi secara spontan. Penelitian yang dilakukan Cahyaningsih (2006) dengan menggunakan BAL yang diaplikasikan selama perendaman biji kakao sebelum pengeringan, mampu mereduksi pertumbuhan S. Typhimurium dan A. flavus.
Fermentasi yang terlalu lama akan mengakibatkan tumbuhnya bakteri pembusuk, akibatnya akan merusak cita rasa biji kakao pada akhir fermentasi (Minifie 1999). Untuk itu agar biji kakao yang dihasilkan tidak mengalami kebusukan, maka lama fermentasi harus diatur sebaik mungkin.
Telah diketahui bahwa BAL menghasilkan senyawa- senyawa penghambat lain selain asam laktat dan asam asetat, diantaranya adalah H2O2, diasetil, CO2, bakteriosin dan reuterin (De Vuyst & Vandame 1994). Menurut Jenie (1996) sebagian dari senyawa-senyawa tersebut memperlihatkan aktivitas antagonistik terhadap banyak mikroorganisme perusak dan patogen makanan.
Berbagai isolat BAL yang bersifat antibakteri dan antimikotik telah berhasil diisolasi dari pangan tradisional seperti Lactobacillus coryneformis To8 yang diisolasi dari tempoyak (Ismail 2002) mampu menghambat pertumbuhan Aspergillus flavus, Lactobacillus plantarum kik yang diisolasi dari kecap ikan (Handayani 2001) mampu menghambat pertumbuhan A. flavus, Lactobacillus plantarum pi28a yang diisolasi dari pikel ketimun (Lie 1995) terutama terhadap bakteri pembusuk dan patogen seperti Escherichia coli, Salmonella Typhimurium, Staphylococcus aureus, Vibrio parahaemoliticus dan Listeria monocytogenes. BAL lain yaitu Lactobacillus brevis yang diisolasi dari dadih (Elida 2002) juga mempunyai aktivitas antibakteri.
Penelitian ini ditujukan untuk memperoleh bakteri asam laktat yang potensial yang dapat digunakan pada fermentasi biji kakao, dengan harapan dapat meningkatkan mutu biji kakao, serta dapat menghambat pertumbuhan mikroorganisme bakteri patogen dan kapang, terutama selama fermentasi biji kakao, sehingga dengan demikian diharapkan mutu biji kakao kering akan lebih baik dan akan meningkatkan nilai jual untuk ekspor.
Tujuan Penelitian Tujuan khusus dari penelitian ini adalah:
1. Memperoleh isolat bakteri asam laktat indigenus yang potensial sebagai antibakteri dan antimikotik pada fermentasi biji kakao.
2. Memperoleh biji kakao terfermentasi yang bebas dari Salmonella dan A. flavus dengan menggunakan bakteri asam laktat dalam proses fermentasi.
3. Mengetahui lama fermentasi yang optimum untuk menghasilkan biji kakao yang memenuhi standar.
Manfaat Penelitian
TINJAUAN PUSTAKA
Kakao
Botani Tanaman Kakao
Tanaman kakao (Theobroma cacao), termasuk dalam famili Sterculiaceae yang merupakan tanaman asli Amerika utara, namun sekarang tanaman kakao telah dibudi dayakan di daerah tropis. Tinggi tanaman kakao berkisar antara 4-8 m. Biji kakao ini diolah menjadi coklat. Klasifikasi kakao terdiri dari:
kingdom : Plantae
divisi : Magnoliophyta kelas : Magnoliopsida ordo : Malvales famili : Stercul iaceae genus : Theobroma
spesies : Theobroma cacao (Minifie 1999).
Buah kakao berbentuk lonjong dengan panjang 15-30 cm dan lebar 8-10 cm, buah yang matang berwarna kuning-oranye dengan berat sekitar 500 g ketika matang. Polong buah kakao mengandung 20-60 biji terletak dalam pulp yang berwarna putih. Setiap butir biji kakao mengandung lemak sekitar 40-50 %. Biji kakao mengandung komponen aktif yaitu theobromin, yang merupakan suatu komponen senyawa yang mirip dengan kafein (Sunanto 1992).
Pengolahan Biji Kakao
pertumbuhan mikroorganisme selama fermentasi. Pulp juga mengandung asam sitrat sekitar 1-3% , protein dan pH pulp sekitar 3.5 sebelum terjadi proses fermentasi (Minifie 1989).
Pulp memiliki pH sekitar 3.6–4.0. Biji kakao terdiri dari dua kotiledon, sebuah bakal akar dan pembungkus biji yang terdiri dari 30 % air, 30 % protein, karbohidrat, gula, fenol dan komponen organik lainnya (Nasution et al. 1985; Lund 2000).
Keping biji merupakan bagian terbesar dari biji kakao yaitu 86-90 % dari berat keping biji, sedangkan kulit biji hanya mencapai 10-14 %. Bagian inilah yang nantinya diolah menjadi coklat dan diambil lemaknya. Bagian yang berguna dalam pengolahan biji kakao segar menjadi biji kering adalah pulp dan biji basah, sedangkan bagian plasenta serta kulit buah dibuang.
Fermentasi kakao
Proses fermentasi akan membentuk rasa dan aroma coklat juga membantu membersihkan sisa pulp. Fermentasi dilakukan dengan menempatkan biji buah kakao di dalam kotak atau ditimbun, selanjutnya ditutup dengan daun pisang. Penggunaan daun pisang sebagai penutup bertujuan untuk menjaga suhu selama proses fermentasi berlangsung juga untuk menciptakan kondisi yang anaerob. Proses fermentasi merupakan proses yang paling penting pada pengolahan biji kakao, karena proses ini akan menghasilkan rasa dan aroma yang khas dari kakao (Syarief et al. 1988). Selama proses fermentasi akan terjadi beberapa perubahan fisik, kimia dan biologi pada biji kakao dan perubahan tersebut akan mempengaruhi mutu biji kakao yang dihasilkan.
Proses fermentasi dapat dibedakan menjadi dua yakni fermentasi eksternal dan internal. Fermentasi eksternal adalah fermentasi yang terjadi karena adanya aktivitas mikroorganisme. Mikroorganisme yang dapat tumbuh pada biji kakao diantaranya meliputi jamur seperti Mucor, Aspergillus, Penicillium, Rhizopus, bakteri asam laktat, bakteri asam asetat (Roelofsen 1958).
mikroorganisme pada fermentasi eksternal. Perubahan kimia dalam biji yang membutuhkan enzim meliputi browning, proteolysis, dan prekursor untuk flavor. Fermentasi internal berlangsung pada saat biji dalam wadah fermentasi setelah biji mati, dan masih berlangsung pada saat pengeringan (Roelofsen 1958).
Peranan utama mikroba seperti khamir dan bakteri asam laktat selama fermentasi biji kakao adalah untuk memproduksi asam dan alkohol, yang selanjutnya akan berpenetrasi kedalam biji dan memulai reaksi kimia sehingga terbentuk prekursor flavor coklat (Schwan & Wheals 2004).
Kegiatan enzimatik terjadi setelah biji mati, karena kematian biji menyebabkan disintegrasi pada sistem sel sehingga enzim dan substrat dapat bereaksi. Kematian biji disebabkan oleh panas dan asam yang dihasilkan oleh kerja mikroba di dalam pulp sebagai media pertumbuhan (Biehl et al. 1982).
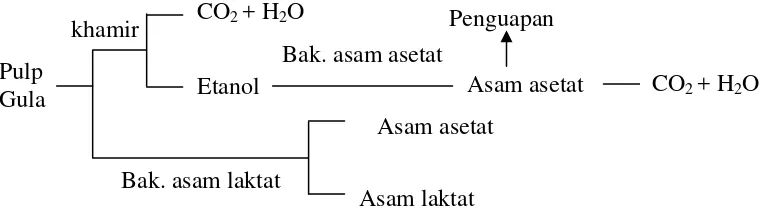
Menurut Chong et al. dalam Sulistyowati (1998) pada pulp kegiatan mikroba yang terjadi adalah pembentukan etanol dan asam laktat dari gula yang terdapat dalam pulp, kemudian diikuti pembentukan asam asetat dari etanol.
Pulp Gula
Bak. asam laktat
Asam laktat Asam asetat
Asam asetat Bak. asam asetat
Etanol CO2 + H2O
CO2 + H2O Penguapan khamir
Gambar 1 Pembentukan asam asetat dan asam laktat selama fermentasi kakao (Chong et al. 1978)
Fermentasi kakao berlangsung secara spontan, yaitu tanpa penambahan starter mikroba. Mikroorganisme yang terlibat dalam proses fermentasi biji kakao berasal dari lingkungan yang mengkontaminasi pulp dan biji kakao. Selama proses fermentasi, pertumbuhan mikroorganisme yang terlibat mengikuti pola suksesi yang dapat dibagi menjadi tiga tahap.
Tahap awal berlangsung pada hari pertama sampai kedua fermentasi, pada
pektinolitik yang merombak pulp sehingga menjadi cair. Perombakan asam sitrat yang terdapat pada pulp akan meningkatkan pH dari 3.6 -3.7 menjadi 4.0.
Pada tahap dua daging buah yang telah hancur dan keberadaan khamir masih ada hingga hari ketiga. Selama fase ini konsentrasi oksigen yang rendah dan karbon dioksida yang tinggi akan memacu pertumbuhan bakteri asam laktat. Tipe bakteri asam laktat yang berperan bisa homofermentatif maupun heterofermentatif, yang akan menghasilkan asam laktat total sekitar 50 %. Aerasi akan memacu pertumbuhan bakteri asam asetat, dimana akan mengubah etanol menjadi asam asetat dan karbon dioksida. Proses oksidasi akan meningkatkan suhu dari 450 C menjadi 500 C.
Pada tahap tiga, peningkatan nilai pH akan memacu pertumbuhan bakteri termofilik pembentuk spora. Tetrametilpirazin adalah komponen yang berperan penting dalam pembentukan flavor coklat disintesa oleh Bacillus subtilis. Bakteri ini juga mendegradasi pektin dan selulosa pada pulp (Lund 2000).
Semua jenis mikroorganisme yang terlibat dalam proses fermentasi kakao menggunakan pulp yang kaya energi sebagai sumber nutrisi. Akibat dari aktivitas mikroorganisme tersebut, warna daging buah kakao akan berubah menjadi coklat dan akan terbentuk alkohol.
Selama fermentasi, polifenol pada biji akan diubah menjadi komponen kimia yang membentuk flavor coklat. Tanin dengan adanya aktivitas enzimatik akan diubah dan membentuk warna coklat. Komponen lain seperti theobromin, gula reduksi dan kafein akan mengalami penurunan selama fermentasi berlangsung, sementara kandungan asam semakin meningkat. Fermentasi juga akan mematikan embrio biji kakao.
Kematian biji merupakan faktor penyebab untuk berlangsungnya proses perubahan secara enzimatik di dalam keping biji. Selama fermentasi ditemukan enzim invertase, raffinase, glicerofosfatase, fhytase, oksidase dan peroksidase (Rohan 1963).
selesai apabila pulp masih berwarna putih, kulit biji belum berwarna coklat dan berbau alkohol (Effendi 1991).
Perubahan warna merupakan cara untuk mengindikasikan fermentasi telah berjalan sempurna. Ketika fermentasi berakhir, biji akan berubah warnanya menjadi coklat-keunguan. Setelah proses fermentasi berjalan sempurna, biji kakao harus dikeringkan sebelum diolah lebih lanjut. Proses pengeringan dengan menggunakan sinar matahari membutuhkan waktu sekitar 1 minggu, selanjutnya biji kakao disangrai dan digiling (Sunanto 1992).
Pembentukan cita rasa atau flavor selalu diikuti dengan penurunan pH biji, karena itu biji yang tidak difermentasi memiliki flavor yang kurang baik dengan pH biji yang tinggi (Purwaningsih et al. 2004).
Banyaknya asam asetat pada biji kakao menyebabkan rasa asam yang kuat sehingga dapat mengurangi rasa dan aroma yang dihasilkan. Oleh karena itu, penurunan asam asetat dalam biji kakao pada proses pengeringan sangat diharapkan. Hal ini ditandai dengan terjadinya kenaikan pH setelah proses pengeringan (Amin 2002b).
Pengeringan Biji kakao
Pengeringan bertujuan untuk mengurangi kandungan air dalam bahan sampai mencapai batas aman untuk penyimpanan. Batas aman kandungan air dalam bahan berbeda-beda antara satu komoditas dengan komoditas lainnya. Untuk penyimpanan buah-buahan, kandungan air yang aman adalah sekitar 10%, sedang untuk komoditas biji-bijian 14% dan sayuran 18% (Amin 2002b).
Suhu 500 C hingga 600 C merupakan suhu pengeringan yang baik bila dibandingkan dengan suhu yang lain. Suhu ini mempunyai efisiensi pengeringan yang tinggi, mutu biji menjadi lebih baik. Bila menggunakan suhu yang lebih tinggi akan menurunkan mutu, karena biji yang dihasilkan akan cenderung asam, aroma coklat rendah, biji menjadi keriput dan mudah pecah ((Prihanani 2001).
mengakibatkan biji kering yang dihasilkan mempunyai keasaman yang tinggi, karena asam-asam yang terbentuk selama fermentasi akan terjebak sebagai akibat proses pengeringan yang terlalu cepat.
Pengeringan yang terlalu cepat atau menggunakan suhu tinggi akan menyebabkan terjadinya kerusakan pada kulit luar biji kakao. Dari kebiasaan selama ini, temperatur pengeringan yang cukup aman bagi komponen cita rasa dan kondisi kulit luar biji kakao adalah 600 C. Untuk mengatasi hal ini, dapat dilakukan pengeringan dua tahap. Pengeringan pertama menggunakan suhu udara pengering yang rendah, kemudian dilanjutkan dengan suhu udara pengering yang tinggi (Setianto 1997).
Mutu Biji Kakao
Klasifikasi mutu biji kakao didasarkan pada aspek-aspek yang ditentukan oleh faktor prapanen seperti bahan tanam, lingkungan fisik dan budidaya, serta faktor pascapanen seperti pemanenan, fermentasi, pengeringan, penyimpanan dan transportasi (Wardojo 1991).
Persyaratan mutu paling dominan yang diminta konsumen adalah mutu fisik yang berhubungan dengan rendemen biji seperti kadar air, berat biji, kadar kulit dan kadar lemak (Wood 1985).
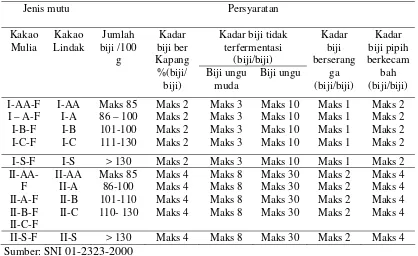
Mutu biji kakao hasil fermentasi sangat dipengaruhi oleh kondisi pengolahan yang diterapkan. Konsumen menghendaki biji kakao yang dapat memberikan cita-rasa yang baik. Syarat mutu umum biji kakao dapat dilihat pada tabel 1, sedangkan syarat spesifik mutu biji kakao khususnya untuk kadar biji berkapang dapat dilihat pada tabel 2.
Tabel 1 Syarat umum mutu biji kakao
Jenis Uji Satuan Persyaratan
Kadar air (b/b)
Biji berbau asap dan atau abnormal dan atau berbau asing Serangga hidup
Kadar biji pecah dan atau pecahan biji dan atau pecahan kulit (b/b)
Kadar benda-benda asing (b/b)
Tabel 2 Spesifikasi persyaratan mutu biji kakao
Jenis mutu Persyaratan
Kadar biji tidak Sumber: SNI 01-2323-2000
Syarat mikrobiologi untuk biji kakao secara khusus tidak dicantumkan dalam SNI. Namun syarat mutu mikrobiologi untuk bubuk kakao dicantumkan pada SNI 01-3747-1995 (Lampiran 38).
Mikroorganisme Patogen dan Pembusuk pada Kakao
Proses fermentasi secara spontan akan mengakibatkan mutu kakao tidak konsisten, karena jenis dan jumlah mikroorganisme yang terlibat sangat beragam. Selain mikroorganisme yang diinginkan dalam proses fermentasi, mikroorganisme pembusuk dan patogen juga dapat tumbuh pada biji kakao, baik selama fermentasi, pengeringan, dan maupun saat transportasi serta penyimpanan. Kontaminasi mikroba selama fermentasi menyebabkan mutu biji kakao menjadi rendah karena akan mengganggu aktivitas mikroba yang berperan selama fermentasi serta merusak cita rasa biji kakao pada akhir fermentasi (Minifie 1999).
Mikroorganisme pembusuk yang tumbuh selama fermentasi biji kakao adalah Aerobacter spp dan Pseudomonas spp, yang dapat terdeteksi pada kisaran pH di atas 5. Bakteri patogen yang umumnya terdapat pada biji kakao dan produk olahannya yang menimbulkan penyakit adalah Salmon+ella (Gabis 1970; Lund 2000). Keberadaan Salmonella pada biji kakao maupun produk olahannya menyebabkan penyakit salmonellosis yang berdampak pada kerugian secara ekonomi dibanyak negara (Craven et al. 1975; IOCCC 1991; Todd 1985; Torres-Vitela 1995).
Kapang yang dapat tumbuh pada permukaan biji kakao, antara lain adalah Aspergillus niger, Aspergillus flavus, Penicillium dan Mucor yang akan menghidrolisa lemak menjadi asam lemak berantai pendek. Pada saat pH mendekati 7, Pseuodomonas, Enterobacter dan E.coli mulai tumbuh serta menghasilkan off-taste dan bau (Case 2005).
Kapang patogen yang tumbuh pada polong masak dan permukaan biji kakao adalah Phytophthora spp dan Crinipella perniciosa yang mengakibatkan penyakit Witches. Namun penyakit yang diakibatkan karena mengkonsumsi coklat pada umumnya disebabkan oleh Salmonella (Case 2005). Salmonella ini dapat menginfeksi biji kakao maupun coklat dan mengakibatkan kerugian secara ekonomis yang sangat besar (Lund 2000).
Kapang dapat tumbuh pada biji kakao, baik selama fermentasi dan pengeringan. Kapang yang biasanya terdapat selama proses fermentasi biji kakao adalah dari famili Aspergillus (A. glaucus, A. niger, A. flavus, A .tamarii) Penicillin dan Mucor. Aflatoksin dihasilkan oleh A. flavus (Probert 2003).
Bakteri Asam Laktat
Sifat BAL
Bakteri asam laktat merupakan kelompok bakteri yang dicirikan dari hasil metabolisme karbohidratnya dalam membentuk asam laktat, baik sebagai satu- satunya produk maupun sebagai produk utama.
Bakteri asam laktat ini merupakan bakteri Gram-positif, tidak membentuk spora, berbentuk batang atau bulat, katalase dan oksidase negatif, non motil atau sedikit motil, mikroaerofilik sampai anaerob, toleran terhadap asam, kemoorganotrofik dan mesofilik (Salminen & von Wright 1998).
Kultur bakteri asam laktat telah lama digunakan secara tradisional untuk mengawetkan pangan fermentasi seperti pikel sayuran, sosis fermentasi, dadih, yogurt, susu asam dan sebagainya. Dewasa ini penggunaan kultur BAL semakin banyak diminati, karena komponen antimikroba yang dihasilkan oleh kultur BAL merupakan pengawet alami yang aman bagi kesehatan manusia (Salminen & von Wright 1998).
Bakteri asam laktat dibagi dalam dua kelompok berdasarkan pada kemampuannya dalam memetabolisme glukosa dan produk akhir yang dihasilkan, yaitu homofermentatif dan heterofermentatif. Kelompok homofermentatif memfermentasi glukosa sebagian besar menjadi asam laktat. Sedangkan bakteri asam laktat yang heterofermentatif memfermentasi glukosa menjadi asam laktat, asam asetat, etanol dan CO2 (Sharpe 1979).
Glukosa yang diubah menjadi asam laktat oleh bakteri golongan homofermentatif mencapai 95% dan ATP yang dihasilkan juga lebih banyak. Hal inilah yang menyebabkan golongan homofermentatif mampu menghasilkan asam laktat dalam jumlah yang lebih besar dibandingkan dengan golongan heterofermentatif (Jay 1996).
diperoleh 14 isolat yaitu 8 isolat L.plantarum, 3 isolat L. heterofermentatif, 1 isolat Streptococcus, 1 isolat Leuconostoc dan 1 isolat L. fermentum (Lie 1995), bakteri asam laktat yang diisolasi dari ikan peda dan kecap ikan diperoleh Pediococcus, Lactobacillus, Leuconostoc dan Streptococcus (Idawati 1996).
Dari tempoyak diperoleh 42 isolat bakteri asam laktat yang termasuk dalam genus Lactobacillus (Wirawati 2002). L. plantarum pi28a yang diisolasi dari pikel (Kusumawati 2000). Bakteri asam laktat yang diisolasi dari dadih terdapat 27 isolat yang mempunyai aktivitas antimikroba (Elida 2002).
Aktivitas Antibakteri dan Antimikotik dari BAL
Bakteri asam laktat memiliki aktivitas antimikroba karena memproduksi asam organik yaitu asam laktat, asam format dan asam asetat, diasetil, H2O2, CO2 serta bakteriosin (Larsen et al. 1993).
Menurut Vandenberg (1993), senyawa-senyawa lain yang juga diproduksi oleh BAL dalam jumlah yang lebih kecil dari pada asam laktat dan asetat adalah asam format, asam lemak bebas, amonia etanol, H2O2, diasetil, asetoin, 2-3 butanadiol, asetaldehida, enzim bakteriolitik, bakteriosin, antibiotik dan beberapa senyawa penghambat lain yang belum ditetapkan atau belum teridentifikasi sama sekali. Akumulasi produk akhir berupa asam akan menyebabkan penurunan pH yang akan menghasilkan penghambatan yang luas terhadap mikroorganisme, termasuk bakteri Gram-positif dan bakteri Gram-negatif (Wooldford 1975 dalam Doores 1993). Diasetil dapat menghambat baik mikroba patogen maupun pembusuk dan paling efektif terhadap bakteri gram-negatif (Gilliland 1986).
Bakteriosin merupakan protein atau kompleks protein yang terdiri dari agregat protein, protein lipokarbohidrat, glikoprotein dan lain-lain, yang aktif secara hayati memperagakan sifat bakterisidal eksklusif terhadap bakteri Gram-positif, terutama terhadap spesies yang berkerabat dekat (De Vuyst & Vandame 1994).
Klaenhammer (1988) membedakan dua kelompok bakteriosin berdasarkan spektrum penghambatannya, yaitu (1) bakteriosin dengan spektrum penghambatan sempit, baik hanya terhadap bakteri yang berkerabat dekat yang termasuk dalam genus yang sama (misalnya diplokokin, laktosin 27, laktasin B, helvetisin J) atau terhadap genera bakteri lain, seperti BAL, Clostridium dan lain-lain (misalnya laktasin F), dan (2) bakteriosin dengan spektrum aktivitas yang relatif luas, tetapi juga hanya terhadap bakteri Gram-positif, misalnya nisin, pediosin dan leukonosin S.
Beberapa bakteri asam laktat mampu menghambat pertumbuhan kapang tertentu dan produksi mikotoksin. Produksi bahan-bahan intraseluler dari bakteri asam laktat selama sel bakteri lisis mungkin menghambat pertumbuhan kapang dan produksi mikotoksin. Bakteri asam laktat dapat juga memproduksi beberapa metabolit selama fase pertumbuhan (Gourama 1991).
BAHAN DAN METODE PENELITIAN
Waktu danTempat
Penelitian dilakukan pada bulan Mei 2005 sampai dengan bulan Juni 2006 di Laboratorium Mutu dan Keamanan Pangan SEAFAST (Southeast Asian Food and Agricultural Science and Technology) Center, IPB, Laboratorium Kimia Departemen Ilmu dan Teknologi Pangan , IPB.
Bahan dan Alat
Bahan yang digunakan untuk fermentasi adalah biji kakao segar jenis Lindak (Theobroma cacao L.) yang diperoleh dari Dinas Perkebunan Bogor, Jawa Barat.
Isolat yang digunakan terdiri dari empat jenis BAL yaitu L. coryneformis
To8 yang diisolasi dari tempoyak (Wirawati 2002), L. plantarum kik yang diisolasi dari kecap ikan (Idawati 1995), L. plantarum pi28a yang diisolasi dari pikel ketimun (Lie 1995), dan L. brevis dari hasil isolasi dadih (Elida 2002). Isolat BAL merupakan koleksi dari Laboratorium Mikrobiologi Pangan, Departemen Ilmu dan Teknologi Pangan, Institut Pertanian Bogor.
Mikroorganisme uji yang digunakan adalah Salmonella Typhimurium (FNCC 050) dan Aspergillus flavus (FNCC 6109) diperoleh dari PAU, UGM.
Media yang digunakan dalam penelitian ini adalah MRS (de Mann Rogosa Sharpe) Broth dan Agar, PDA (Potato Dextrose Agar), NA (Nutrien Agar) dan NB (Nutrien broth), LB (Lactose broth), SCB (Selenite Cystine Broth), XLD
(Xylose Lysine Deoxycholate) Agar dan TSI (Triple Sugar Iron) Agar. Bahan kimia yang digunakan antara lainnya NaCl 0.85%, akuades, alkohol 70%, asam tartarat 10% dan CaCO3.
colony counter, inkubator, gelas obyek Petroff-Hausser, penangas air, tabung reaksi steril, dan beberapa alat gelas lainnya.
Metode Penelitian
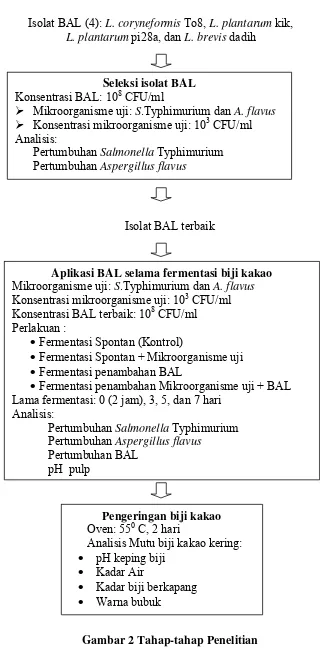
Pelaksanaan penelitian terbagi menjadi beberapa tahap, yaitu: (1) Seleksi isolat BAL (2) Aplikasi BAL selama fermentasi biji kakao, (3) Pengeringan biji kakao (Gambar 2).
Seleksi Isolat BAL
Tujuan tahap ini adalah untuk menyeleksi 4 isolat BAL yang berpotensi untuk menghambat pertumbuhan Salmonellla Typhimurium dan Aspergillus flavus. Keempat isolat BAL diseleksi berdasarkan kemampuan penghambatannya terhadap pertumbuhan Salmonella Typhimurium dan Aspergillus flavus pada biji kakao selama 24 jam fermentasi. Masing-masing BAL ditumbuhkan dalam de Mann Rogosa Sharpe Broth (MRSB) dan diinkubasi selama 48 jam pada suhu 370 C.
Salmonella Typhimurium ditumbuhkan dalam Nutrient Broth (NB) dan diinkubasi pada suhu 370 C selama 24 jam. Selanjutnya dilakukan pengenceran dengan menggunakan larutan NaCl 0.85 % hingga diperoleh konsentrasi 103 CFU/ml.
Kapang A. flavus dari kultur stok ditumbuhkan pada Potato Dextrose Agar
(PDA) miring selama 10 hari pada suhu 250 C, selanjutnya spora kapang diambil dari permukaan PDA miring dan dimasukkan ke dalam 10 ml larutan NaCl 0.85% dan dilakukan pengenceran hingga diperoleh konsentrasi 103 CFU/ml.
Isolat BAL (4): L. coryneformis To8, L. plantarum kik,
L. plantarum pi28a, dan L. brevis dadih
Seleksi isolat BAL
Konsentrasi BAL: 108 CFU/ml
¾ Mikroorganisme uji: S.Typhimurium dan A. flavus ¾ Konsentrasi mikroorganisme uji: 103 CFU/ml Analisis:
Pertumbuhan Salmonella Typhimurium Pertumbuhan Aspergillus flavus
Isolat BAL terbaik
Aplikasi BAL selama fermentasi biji kakao
Mikroorganisme uji: S.Typhimurium dan A. flavus
Konsentrasi mikroorganisme uji: 103 CFU/ml Konsentrasi BAL terbaik: 108 CFU/ml
Perlakuan :
• Fermentasi Spontan (Kontrol)
• Fermentasi Spontan + Mikroorganisme uji • Fermentasi penambahan BAL
• Fermentasi penambahan Mikroorganisme uji + BAL Lama fermentasi: 0 (2 jam), 3, 5, dan 7 hari
Analisis:
Pertumbuhan Salmonella Typhimurium Pertumbuhan Aspergillus flavus
Pertumbuhan BAL pH pulp
Pengeringan biji kakao
Oven: 550 C, 2 hari
Analisis Mutu biji kakao kering: • pH keping biji
• Kadar Air
• Kadar biji berkapang • Warna bubuk
Persiapan Kultur BAL dan Aplikasi Selama Fermentasi Biji Kakao
Isolat BAL terbaik dari tahap seleksi selanjutnya digunakan untuk fermentasi biji kakao. Buah kakao yang baru dipanen dipisahkan antara yang utuh dan yang rusak, buah dikupas lalu bijinya dimasukkan ke dalam wadah, salanjutnya diaduk hingga merata. Secara acak, biji kakao diambil sebanyak 300 g dan dimasukkan ke dalam wadah fermentasi, selanjutnya disesuaikan dengan perlakuan.
Kultur BAL terbaik dari tahap seleksi dipindahkan ke dalam tabung reaksi yang berisi media MRS Broth sebagai kultur induk. Penyimpanan kultur dapat dilakukan dengan menggunakan media MRS Agar dengan metode tusuk yang ditambahkan 0.1% (b/v) CaCO3. Kultur tersebut diinkubasi pada suhu 370 C
selama 48 jam. Kultur stok selanjutnya disimpan dalam refrigerator pada suhu 50C dan disegarkan kembali minimal sebulan sekali. Starter yang akan diinokulasi pada fermentasi biji kakao segar dibuat dalam bentuk kultur kerja.
Kultur kerja dibuat dengan cara sebagai berikut, isolat BAL dibiakkan dalam media MRS Broth selama 48 jam pada suhu 370 C. Pertumbuhan positif ditandai dengan adanya kekeruhan pada media setelah diinkubasi. Jumlah koloni BAL dihitung dengan menggunakan metode Plate Count pada media MRS Agar
dan konsentrasi sel bakteri yang digunakan untuk fermentasi adalah 108 CFU/ml. Mikroba uji pada tahap seleksi juga digunakan pada fermentasi biji kakao, dengan konsentrasi yang sama.
Fermentasi biji kakao (Modifikasi Schwan 1998)
Fermentasi bertujuan untuk menghilangkan pulpdan mengubah sifat kimia keping biji sehingga diperoleh kakao yang berkualitas baik, proses fermentasi sangat menentukan mutu biji kakao yang dihasilkan terutama dari segi warna, aroma, rasa dan konsistensi biji (Saleh 2004).
jam fermentasi dengan menggunakan pengaduk steril, selanjutnya fermentasi dilanjutkan hingga 7 hari fermentasi.
Untuk fermentasi spontan dengan infeksi mikroorganisme uji (S.Typhimurium dan A.flavus) tanpa penambahan suspensi BAL, biji kakao segar dimasukkan ke dalam wadah fermentasi, lalu disemprot dengan mikroorganisme uji (103 CFU/ml), selanjutnya wadah ditutup dan difermentasi. Pengadukan dilakukan setelah 48 jam fermentasi dengan menggunakan pengaduk steril, selanjutnya fermentasi dilanjutkan hingga 7 hari fermentasi. Mikroorganisme uji digunakan secara terpisah dengan menggunakan wadah fermentasi yang berbeda.
Untuk fermentasi dengan penambahan suspensi BAL tanpa infeksi mikroorganisme uji (S.Typhimurium dan A.flavus), biji kakao segar sebanyak 300 g dimasukkan ke dalam wadah fermentasi, lalu disemprot langsung dengan suspensi BAL (108 CFU/ml) sebanyak 1 ml per 25 g biji, selanjutnya wadah ditutup dan difermentasi. Setelah 48 jam fermentasi dilakukan pengadukan dengan mengaduk tumpukan biji perlahan-lahan dengan pengaduk sama seperti fermentasi spontan
Untuk fermentasi penambahan suspensi BAL dan infeksi mikroorganisme uji (S.Typhimurium dan A.flavus), biji kakao segar sebanyak 300 g dimasukkan ke dalam wadah fermentasi, lalu disemprot dengan mikroorganisme uji (103 CFU/ml) dan biarkan selama 30 menit, setelah 30 menit disemprot dengan suspensi BAL (108 CFU/ml), selanjutnya wadah ditutup dan difermentasi. Setelah 48 jam fermentasi dilakukan pengadukan, dengan mengaduk tumpukan biji perlahan-lahan dengan pengaduk, sama seperti fermentasi spontan. Mikroorganisme uji digunakan secara terpisah antara S.Typhimurium dengan A. flavus atau dengan wadah fermentasi yang berbeda.
Pengeringan Biji Kakao
Setelah difermentasi dengan supensi BAL terpilih, selanjutnya biji kakao dikeringkan dengan menggunakan oven suhu 550 C selama 2 hari sampai diperoleh kadar air maksimal 7.5%. Setelah dikeringkan dilakukan analisis mutu yang terdiri dari pengukuran pH, kadar air biji kering, kadar biji berkapang dan warna bubuk kakao.
Analisis
Pertumbuhan Salmonella Typhimurium (SNI 01-2323-2000)
Untuk mengetahui keberadaan Salmonella Typhimurium dalam biji kakao yang telah difermentasi, maka dilakukan identifikasi melalui beberapa tahap. Secara aseptis ditimbang 5 g sampel ke dalam tabung blender steril, ditambahkan 45 ml larutan lactose broth (Pre-enrichment media) dan diblender selama 2 menit, selanjutnya dipindahkan ke dalam botol steril dan dibiarkan selama 60 menit pada suhu ruang, kocok dan diukur pH. Selanjutnya diinkubasi pada suhu 370 C selama 24 jam.
Sampel dari lactose broth diambil sebanyak 1 ml dan dimasukkan ke dalam 10 ml SCB (Selective enrichment media), dan diinkubasi selama 24 jam pada suhu 420 C. Selanjutnya dari media SCB diambil 1 ose sampel lalu digoreskan pada media XLD Agar (Selective media)dan diinkubasi selama 24 jam pada suhu 350 C. Koloni tipikal pada XLD Agar yang ditandai dengan koloni berwarna merah muda pucat, kedap cahaya atau bening, atau dengan inti hitam. Untuk setiap deret pengenceran, tuangkan pula agar dengan larutan pengencer sebagai inokulum ke dalam cawan petri untuk digunakan sebagai kontrol.
Dua koloni tipikal dipilih dari media XLD Agar untuk ditanam pada media
Pertumbuhan Kapang Aspergillus flavus (Fardiaz 1992b)
Untuk mengetahui keberadaan A. favus dalam biji kakao yang telah difermentasi, maka dilakukan identifikasi melalui beberapa tahap. Secara aseptis ditimbang 5 g sampel ke dalam tabung blender steril, ditambahkan 45 ml larutan
peptone water 0.1% dan diblender selama 2 menit, selanjutnya dipindahkan ke dalam botol steril (pengenceran 10-1) da dibuat deret pengenceran hingga 10-6, tiap tingkat pengenceran dikocok selama 7 menit.
Sebanyak 1 ml sampel dipipet dari tiap pengenceran untuk dimasukkan ke dalam cawan petri. Tiap cawan petri diisi dengan 12 ml sampai 15 ml PDA
dengan suhu sekitar 400 C. Untuk setiap deret pengenceran, dituangkan pula agar dengan larutan pengencer sebagai inokulum ke dalam cawan petri untuk digunakan sebagai kontrol. Inokulum dan medium agar dicampur merata dengan menggerakkan cawan petri kebelakang, ke depan dan memutar pada permukaan datar, dibiarkan hingga Agar membeku, lalu cawan petri disusun secara terbalik dan disimpan pada suhu 250 C selama 5 hari.
Setelah diinkubasi, dengan menggunakan alat penghitung koloni bakteri, koloni dihitung per cawan petri pada semua cawan yang mengandung 25 koloni sampai 250 koloni dan dicatat hasil untuk tiap tingat pengenceran. Rata-rata jumlah kapang per g sampel uji dihitung dengan cara menghitung rata-rata koloni per cawan dikalikan dengan faktor pengenceran. Populasi kapang per ml sampel dihitung sebagai rata-rata jumlah koloni pada cawan petri (duplo) dikalikan dengan 1 per faktor pengencer.
Pertumbuhan BAL (Fardiaz 1992b)
Selanjutnya cawan petri diinkubasi dengan posisi terbalik pada suhu 370 C selama 48 jam. Jumlah BAL dihitung dan dinyatakan dalam CFU/ml. Populasi BAL per ml sampel dihitung sebagai rata-rata jumlah koloni pada cawan petri (duplo) dikalikan dengan 1 per faktor pengencer.
Nilai pH Keping Biji (SNI 01-2323-2000)
Alat pH meter sebelum digunakan distandarisasi terlebih dahulu dengan menggunakan larutan penyangga baku pH 4.0 dan pH 7.0. Sebanyak 50 g biji kakao kering dikupas kulit luarnya dan diblender. Selanjutnya sebanyak 10 g bubuk kakao dimasukkan ke dalam gelas piala dan ditambahkan dengan 90 ml aquades (700 C), diaduk selama 15 menit dengan pengaduk magnet, larutan selanjutnya disaring dan filtratnya didinginkan sampai suhu kamar (270 C), lalu diukur pH nya dengan menggunakan pH meter.
Penentuan Kadar Air Biji Kakao (SNI 01-2323-2000)
Sampel sebanyak 10 g ditimbang dan dimasukkan ke dalam cawan yang telah diketahui bobotnya, selanjutnya cawan beserta isinya dimasukkan ke dalam oven pada suhu (103 + 2) 0C selama 16 jam. Setelah 16 jam dikeluarkan dari oven dan ditempatkan dalam desikator dan didinginkan, setelah dingin cawan ditimbang, kadar air dinyatakan dalam persentase bobot per bobot dengan rumus:
(M1 –M2) x 100
(M1 –M0)
M0 = bobot cawan (g)
M1 = bobot cawan dan contoh sebelum pengeringan (g)
M2 = bobot cawan dan contoh sesudah dikeringkan (g)
Pengukuran Warna
dengan membandingkan dengan suatu warna standar yang dinyatakan dalam angka-angka.
Sistem notasi warna adalah suatu cara sistematik dan obyektif untuk menyatakan atau mendeskripsikan suatu jenis warna. Diantara sistem warna terdapat 3 jenis sistem warna yaitu ICI (International Comission on Illumination), Munsel dan Hunter.
Sistem notasi ICI didasarkan pada konsep bahwa semua jenis warna dapat dibentuk dari 3 warna dasar yaitu merah (λ= 720 nm), hijau (λ= 520) dan biru (λ=380). Masing-masing warna dinyatakan dengan nilai X untuk merah, Y untuk hijau dan Z untuk biru. Jadi tiap warna dapat dinilai dari 3 parameter yang berkaitan dengan nilai X, Y dan Z (Soekarto 1985).
Cara pengukuran warna dengan sistem Munsel dilakukan dengan mengukur komponen warna dalam besaran value, hue dan chroma. Nilai value
menunjukkan gelap terangnya warna, nilai hue mewakili panjang gelombang dominan yang akan menentukan apakah warna tersebut merah, hijau atau kuning, sedangkan chroma menunjukkan intensitas warna. Ketiga komponen ini diukur dengan menggunakan alat khusus yang mengukur nilai kromatisitas permukaan suatu bahan. Angka-angka yang diperoleh berbeda untuk setiap warna, kemudian angka-angka tersebut diplotkan kedalam diagram kromatisitas (Winarno 1995).
Sistem notasi warna yang paling banyak digunakan adalah sisten notasi Hunter yang mempunyai 3 parameter untuk mendeskripsikan warna yaitu : L, a dan b (Soekarto 1985). Nilai L menyatakan parameter kecerahan yang dimiliki nilai 0 (hitam) sampai 100 (putih).
Nilai a menyatakan warna kromatik campuran merah sampai hijau dengan nilai +a (positif) dari 0 sampai +100 untuk warna merah, dan –a (negatif) dari 0 samapai -80 untuk warna hijau.
HASIL DAN PEMBAHASAN
Seleksi Isolat BAL
Aktivitas Antibakteri Isolat BAL terhadap Salmonella Typhimurium pada Biji Kakao
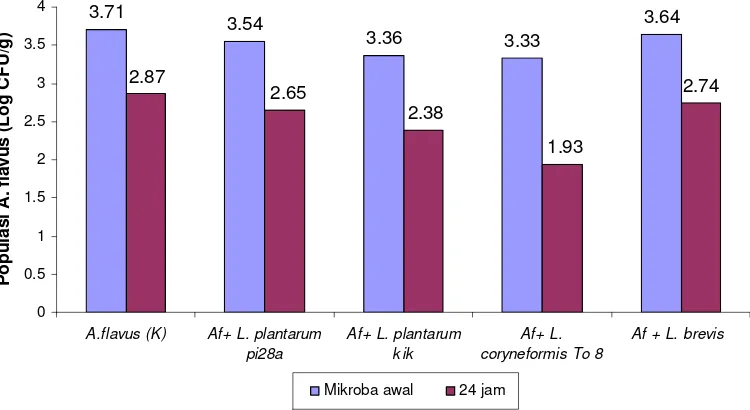
Dari empat isolat BAL yang diuji aktivitas antibakterinya, yaitu L. coryneformis To8, L. plantarum kik, L. plantarum pi28a, dan L. brevis dadih,
ternyata semua isolat BAL menunjukkan aktivitas penghambatan terhadap S. Typhimurium selama 2 jam fermentasi pulp biji kakao (Tabel 4).
Pada pulp biji kakao yang telah disemprot dengan suspensi BAL, dan difermentasi selama 2 jam, pertumbuhan S. Typhimurium tidak terdeteksi. Hal ini diduga karena adanya kompetisi dengan BAL. Asam laktat dan metabolit lain
yang diproduksi oleh BAL diduga menghambat pertumbuhan S. Typhimurium (Doores 1993).
Tabel 3 Aktivitas antibakteri beberapa jenis BAL terhadap Salmonella
Typhimurium selama fermentasi biji kakao
PertumbuhanS. Typhimurium Setelah 2 jam fermentasi Perlakuan
ST = Salmonella Typhimurium
LB = Lactose Broth
SCB = Selenite Cystine Broth
Pada kont kakao (ST) yaitu tanpa difermentasi dengan suspensi BAL, S. Typhim asih mampu tumbuh pada biji kakao selama 2 jam fermentasi. Hal ini terlihat dengan adanya pertumbuhan positif pada media LB dan SCB (media e t) yang ditandai dengan kekeruhan.
Pada medi media selektif), biji kakao kontrol masih menunjukkan pertumbuhan S. Typhimurium, ditandai dengan adanya koloni yang berwarna merah muda dan i p cahaya. Pertumbuhan positif S.Typhimurium pada biji kakao kontrol (ST) juga terlihat pada media TSIA (media identifikasi), terlihat adanya perubahan warna media, pada bagian agar miring yang digores berwarna merah (basa) dan bagian tegak yang ditusuk berwarna kuning (asam). Hal ini berarti S. Typhimurium mampu tumbuh pada biji kakao yang tidak ditambahkan dengan BAL. Namun setelah 24 jam fermentasi, S. Typhimurium tidak mampu lagi untuk tumbuh pada biji kakao, baik pada kontrol (ST) maupun yang disemprot dengan suspensi BAL.
Pada biji ng ditambahkan dengan BAL terjadi penurunan pH yang mungkin disebabkan oleh produksi asam laktat yang dihasilkan selama pertumbuhan BAL, sehingga menghambat pertumbuhan S. Typhimurium. Untuk tumbuh optimum himurium memerlukan pH media 6.5 hingga 7 (Lund 2000), sedangkan pH pulp biji kakao setelah 24 jam fermentasi rata-rata 3.5, penurunan pH pulp disebabkan oleh aktivitas BAL yang menghasilkan asam dari hasil metabolism am memfermentasi gula (glukosa) yang terdapat di dalam pulp.BAL dapat tumbuh dengan baik pada pulp biji kakao, karena glukosa yang terdapat di erupakan sumber nutrisi yang dibutuhkan untuk pertumbuhan BAL. Bakteri asam laktat akan memfermentasi glukosa melalui jalur E mofermentatif) untuk menghasilkan asam laktat, ATP, dan jalur fosfoketolase (heterofermentatif) untuk menghasilkan asam la anol sa, dan manitol (Surono 2004).
ikroba sehingga akan mengganggu metabolisme sel. Hasil pengujian yang dilakukan dengan
rol biji
mbden Meyerhof yaitu glikolisis (ho
ktat, et , CO2, asam asetat, senyawa citara