PENINGKATAN KEMAMPUAN ANTAGONIS Ralstonia
pickettii TERHADAP Rhizoctonia solani DENGAN METODE
TRANSPOSON MUTAGENESIS
IMAM KHOIRI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
IMAM KHOIRI. Peningkatan Kemampuan Antagonis Ralstonia pickettii terhadap Rhizoctonia solani dengan Metode Transposon Mutagenesis. Dibimbing oleh GIYANTO.
Padi (Oryza sativa Linn.) merupakan tanaman pangan penting di Indonesia, tetapi tingkat produksinya terus mengalami fluktuatif. Saat ini, hama dan penyakit menjadi permasalahan utama pada pertanaman padi. Hawar pelepah padi adalah penyakit yang disebabkan oleh Rhizoctonia solani, yang merupakan salah satu penyakit penting pada pertanaman padi. Ralstonia pickettii dapat digunakan sebagai agen hayati dari penyakit hawar pelepah padi saat ini. Tujuan dari penelitian ini adalah untuk meningkatkan potensial dari R. pickettii sebagai agen hayati dari R. solani dengan menggunakan metode transposon mutagenesis pUT Mini-Tn5Km1. Transposon mutagenesis pUT Mini-Tn5Km1 merupakan salah satu teknologi dari mutagenesis untuk membentuk mikroorganisme yang memiliki kekuatan melebihi mikroorganisme tipe liarnya. Penyisipan transposon mutagenesis ini mengekspresikan perbedaan perubahan bentuk dari bakteri transkonjugan jika dibandingkan dengan R. pickettii tipe liar. Perubahan bentuk ini meliputi perubahan pada warna, bentuk, tepian, dan elevasi koloni. Ada sekitar 10 transkonjugan R. pickettii melebihi kemampuan persentase penghambatan dari R. pickettii tipe liar, berkisar antara 7.51% hingga 62.32%. RPM 38 memiliki persentase penghambatan tertinggi sekitar 62.32%. Konfirmasi penyisipan sekuens Tn5Km1 pada genom transkonjugan R. pickettii belum dapat dibuktikan menggunakan PCR reguler.
ABSTRACT
IMAM KHOIRI. Increasing Antagonist Ability of Ralstonia pickettii to Rhizoctonia solani Use Transposon Mutagenesis Methods. Supervised by GIYANTO.
Rice (Oryza sativa Linn.) is important food crop in Indonesia, but the production levels are still fluctuated. Pests and diseases are one of the main problems in rice cultivation. Rice sheath blights (RSB) disease caused by Rhizoctonia solani, is one of important disease in rice cultivation. Now, Ralstonia pickettii can be used as biocontrol agent of RSB. The objective of this study is to improve the potential of R. pickettii as biocontrol agent of R. solani by transposon mutagenesis pUT mini-Tn5Km1. The transposon mutagenesis pUT mini-Tn5Km1 is one of technology for mutagenesis to construct microorganisms that have more power than wild type microorganisms. Insertion of transposon mutagenesis expressed different morphological changes transconjugant bacteria than wild type R. pickettii. Morphological changes are includes changes in color, form, edge, and elevation of colony. There are about 10 transconjugants R. pickettii had exceeded the percentages inhibition of R. pickettii wild type, ranged from 7.51% up to 62.32%. Rpm 38 was the highest percentages of inhibition about 62.32%. Confirmation of insertion Tn5Km1 sequence to the chromosome of transconjugants R. pickettii had not been proven by regular PCR.
© Hak Cipta Milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan
yang wajar IPB.
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh karya dalam
PENINGKATAN KEMAMPUAN ANTAGONIS Ralstonia
pickettii TERHADAP Rhizoctonia solani DENGAN METODE
TRANSPOSON MUTAGENESIS
IMAM KHOIRI
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
terhadap Rhizoctonia solani dengan Metode Transposon Mutagenesis
Nama Mahasiswa : Imam Khoiri
NIM : A34080034
Tanggal lulus:
Disetujui, Dosen Pembimbing
Dr. Ir. Giyanto, MSi. NIP 19670709 199303 1 002
Mengetahui,
Ketua Departemen Proteksi Tanaman
RIWAYAT HIDUP
Penulis dilahirkan di Kabupaten Lampung Selatan pada tanggal 21 Mei 1990. Penulis merupakan anak pertama dari dua bersaudara, pasangan Bapak Maryudi dan Ibu Inayah.
Penulis menyelesaikan pendidikan dasar di SD Negeri 2 Sukadamai, Kecamatan Natar, Kabupaten Lampung Selatan, pada tahun 2002 kemudian melanjutkan ke SMP Negeri 1 Metro Kibang, Kecamatan Metro Kibang, Kabupaten Lampung Timur selesai pada tahun 2005. Penulis menamatkan pendidikan SLTA di SMA Negeri 1 Kota Metro tahun 2008. Penulis diterima sebagai mahasiswa program studi Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor pada tahun 2008.
Selama menempuh pendidikan di IPB, penulis pernah aktif dalam kegiatan kemahasiswaan, di antaranya sebagai anggota Klub Cinta Lingkungan Tingkat Persiapan Bersama (TPB) pada masa periode 2008-2009, anggota PPSDM Unit Kegiatan Mahasiswa (UKM) Badan Kerohanian Islam Mahasiswa (BKIM) pada tahun 2008-2009, anggota sosialisasi penggunaan tungku sekam Departemen Fisika IPB tahun 2009, anggota kepanitian BEM KM IPB seperti IPB International Scholarship Education Expo tahun 2009. Selain itu, penulis juga menjadi anggota UKM Persatuan Tenis Meja (PTM) IPB tahun 2008-2012, Koordinator Divisi Eksternal 2011 Himpunan Mahasiswa Proteksi Tanaman (HIMASITA) 2011, Klub Saintis Muda Proteksi Tanaman pada tahun 2011-2012, dan anggota Klub Fotografi Proteksi Tanaman “Capung” tahun 2012.
Segala puji bagi Allah Subhanahuu Wata’ala dan atas kehendaknya penulis dapat menyelesaikan penelitian yang berjudul “Peningkatan Kemampuan Antagonis Ralstonia pickettii terhadap Rhizoctonia solani dengan Metode
Transposon Mutagenesis” sebagai salah satu syarat untuk memperoleh gelar sarjana pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian ini dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor dari Desember 2011 hingga September 2012.
Penulis menyampaian terima kasih kepada:
1. Dr. Ir. Giyanto, MSi., selaku dosen pembimbing dalam penelitian dan penyusunan skripsi
2. Dr. Ir. Ruly Anwar, MSi., selaku dosen penguji tamu pada tugas akhir 3. Kedua orang tua yang selalu senantiasa memberikan dukungan dan doanya 4. Rekan-rekan mahasiswa DPT angkatan 45 atas bantuan dan persahabatannya
selama menempuh pendidikan di DPT
5. Semua staf di Laboratorium Bakteriologi Tumbuhan DPT
6. Yugih Tiadi Halala, Tatit Sastrini, SP. dan Ida Farida, SP. yang membantu dalam kelacaran penelitian dan skripsi
7. Keluarga Wisma Dolphin atas segala saran, kritik, kebersamaan, dan kenangan indah selama penulis menempuh pendidikan di IPB.
Penulis juga menyadari bahwa skripsi ini masih terdapat banyak kekurangan, untuk itu penulis mengharapkan kritik dan saran yang membangun. Semoga skripsi ini dapat bermanfaat bagi perkembangan ilmu pengetahuan.
Bogor, November 2012
DAFTAR ISI
DAFTAR TABEL……….
DAFTAR GAMBAR………...
DAFTAR LAMPIRAN……….
PENDAHULUAN………... Latar Belakang………... Tujuan Penelitian………...
Manfaat Penelitian……….
TINJAUAN PUSTAKA………....
Potensi Ralstonia pickettii………. Penyakit Hawar Pelepah Padi………... Transposon Mutagenesis pUT Mini-Tn5Km1……….. BAHAN DAN METODE………...
Tempat dan Waktu Penelitian………... Peremajaan Isolat………... Pengujian Antagonisme R. pickettii terhadap R. solani……… Uji Sensitivitas R. pickettii terhadap Antibiotik Kanamisin………. Mutagenesis R. pickettii dengan Transposon pUT Mini-Tn5Km1……... Pengujian Antagonisme antara Transkonjugan R. pickettii dengan
R. solani………..
Konfirmasi Penyisipan Tn5Km1 pada Genom Transkonjugan R. pickettii dengan Teknik Polymerase Chain Reaction (PCR)…………....
Isolasi DNA Genom Transkonjugan R. pickettii Tn5Km1……... Amplifikasi Sisipan Tn5Km1 pada Genom R. pickettii dengan PCR……….. HASIL DAN PEMBAHASAN………... R. picketii sebagai Agen Hayati R. solani……….. Peningkatan Kemampuan Antagonisme R. pickettii melalui transposon Mutagenesis…...
Uji Sensitivitas R. pickettii terhadap Antibiotik Kanamisin…….. Mutagenesis R. picketii dengan Transposon………...
Uji Potensi Antagonime Transkonjugan R. pickettii terhadap R. solani……... Konfirmasi Penyisipan Tn5Km1 pada Genom Transkonjugan R. pickettii dengan Teknik PCR…………... KESIMPULAN DAN SARAN………... Kesimpulan………..………...
Saran………...
DAFTAR PUSTAKA………...
LAMPIRAN………..
DAFTAR TABEL
Ciri-ciri koloni isolat transkonjugan transposon mutagenesis pUT Mini-Tn5Km1………...
Halaman 1
DAFTAR GAMBAR
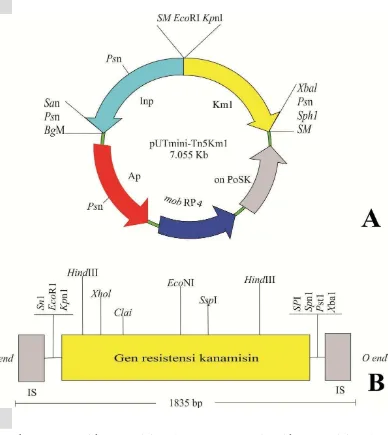
Plasmid pUT Mini-Tn5Km1………. Uji antibiosis R. pickettii terhadap R. solani dengan metode dual culture…... Uji sensitivitas R. pickettii terhadap antibiotik kanamisin……… Koloni R. solani pada media PDA penyebab hawar pelepah padi (A); koloni R. pickettii (B) dan koloni E. coli S17-1λpir (C)pada media LA……. Reaksi antagonisme R. pickettii (A) terhadap R. solani (B). Reaksi ini ditunjukkan oleh adanya zona penghambatan pertumbuhan R. solani
(C)……… Zona bening penghambatan pertumbuhan R. pickettii (ditunjukkan oleh panah biru) oleh kanamisin 50 µg/ml (ditunjukkan oleh panah merah)…….. Isolat transonjugan R. pickettii hasil transposon mutagenesis yang
dapat tumbuh pada media LA ditambah kanamisin (A); seleksi potensi penghambatan transkonjugan R. pickettii (B)……….. Reaksi antagonisme R. pickettii tipe liar terhadap R. solani (A); Reaksi antagonisme transkonjugan R. pickettii RPM 36 (B) menghambat
pertumbuhan R. solani yang ditunjukkan oleh perubahan miselia berubah warna jadi kuning kecokelatan ini menunjukkan matinya miselia…………. Penampakan fenotipe transkojugan 10 isolat yang tumbuh pada media LA ditambah kanamisin………... Persentase penghambatan pertumbuhan R. solani oleh 10 isolat
transkonjugan potensial………... Kemampuan menghambat pertumbuhan R. solani oleh R. pickettii (A); RPM 38 (B); dan RPM 148 (C)………... Pita isolasi DNA (A) dan hasil PCR (B) pada gel agarose elektroforesis dari 11 isolat transkonjugan uji hasil ekstraksi DNA………..
DAFTAR LAMPIRAN
Persentase penghambatan R. solani oleh 35 bakteri transkonjugan R.
pickettii………... Persentase penghambatan R. solani oleh 10 bakteri transkonjugan R.
pickettii potensial………
Skema proses mutagenesis dengan transposon………..
Halaman 1
2
3
27
Latar Belakang
Padi (O. sativa Linn.) merupakan salah satu komoditas pertanian pangan penting dan banyak diusahakan secara komersial di Indonesia. Salah satu kendala dalam produksi padi adalah permasalahan hama dan penyakit yang dapat menyebabkan kerusakan dan kehilangan produktivitas padi secara signifikan. Penyakit hawar pelepah padi adalah penyakit penting pada padi yang disebabkan oleh R. solani. Penyakit ini menyebabkan tanaman padi mengalami bercak-bercak pada pelepah daun (Ou 1985).
Penyakit ini menyebabkan tanaman menjadi mudah rebah. Semakin awal terjadi kerebahan maka semakin besar kehilangan yang diakibatkannya. Penyakit ini juga menyebabkan gabah kurang terisi penuh atau bahkan hampa. Umumnya, hawar pelepah padi terjadi saat tanaman mulai membentuk anakan hingga menjelang panen. Saat ini, kerusakan yang disebabkan oleh penyakit ini belum terhitung besarnya kerugian (Puslitbang TP 2007). Oleh karena itu, perlu pengendalian yang tepat untuk menurunkan kejadian dan intensitas penyakit secara signifikan.
Cara-cara pengendalian hawar pelepah padi yang umum digunakan adalah dengan penggunaan varietas unggul, kultur teknis (budidaya yang baik, sanitasi, dan rotasi tanaman), mekanis, dan secara kimiawi. Akan tetapi, teknik pengendalian ini kurang efektif dan efisien, kemudian didukung dengan belum tersedianya varietas yang tahan terhadap serangan penyakit ini. Hal ini didukung oleh penelitian Rustam (2012) yang menunjukkan bahwa sekitar 14 varietas padi rentan terserang penyakit ini. Oleh sebab itu, perlu dicari pengendalian alternatif yang dapat mengendalikan hawar pelepah padi secara optimal dan efektif tanpa menyebabkan terjadinya kerusakan lingkungan. Pengendalian alternatif yang sekarang banyak dikembangkan adalah pengendalian hayati yang menggunakan agen hayati.
Mekanisme penghambatan agen hayati terhadap patogen tanaman meliputi antibiosis, kompetisi, parasitisme, enzim pendegradasi dinding sel, dan induksi ketahanan (resistensi) terhadap patogen. Agen hayati yang dapat digunakan sebagai alternatif pengendalian adalah R. pickettii. R. pickettii adalah bakteri yang sering digunakan untuk bioremediasi daerah pertambangan dan beberapa polutan pada tanah (Park et al. 2003). Menurut Rustam (2012), R. pickettii dapat mengendalikan pertumbuhan R. solani.
Kemampuan suatu agen hayati dalam penghambatan pertumbuhan patogen dapat ditingkatkan dengan berbagai macam cara. Salah satu cara adalah dengan menggunakan transposon mutagenesis. Transposon mutagenesis adalah suatu proses perpindahan elemen genetik dari satu lokus dalam suatu kromosom, plasmid, atau genom virus, ke bagian lain dari kromosom yang sama atau bahkan ke suatu lokus dalam kromosom lain yang menyebabkan perubahan dalam organisme tersebut (Yuwono 2005). Transposon mutagenesis ini belum banyak digunakan dalam dunia pertanian. Transposon pUT Mini-Tn5Km1 adalah salah satu jenis transposon pada prokariot khusus Escherichia coli yang digunakan dalam penelitian. Transposon mutagenesis pUT Mini-Tn5Km1 pada R. pickettii belum banyak diketahui potensinya. Oleh karena itu, perlu dilakukan penelitian tentang hal ini.
Tujuan Penelitian
Penelitian ini bertujuan untuk meningkatkan kemampuan antagonis R. pickettii terhadap R. solani dengan teknik transposon mutagenesis.
Manfaat Penelitian
Penelitian ini diharapkan dapat memperoleh transkonjugan R. pickettii yang dapat digunakan sebagai agen hayati R. solani. Selain itu, Penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan khususnya pada bidang pertanian.
Potensi Ralstonia pickettii
Berdasarkan klasifikasinya, R. pickettii berasal dari Kingdom Bakteria dengan Filum Proteobakteria, Kelas Beta Proteobakteria, Ordo Burkholderiales, Famili Ralstoniaceae, dan Genus Ralstonia. Beberapa strain bakteri jenis ini banyak berperan sebagai pendegradasi bahan-bahan berbahaya pada daerah pertambangan (bioremediasi tambang) yang mengalami pencemaran bahan berbahaya tersebut (Fishman et al. 2004).
Beberapa peneliti telah melaporkan bahwa bakteri ini dapat melakukan proses degradasi beberapa senyawa beracun meliputi benzena, meta-cresol, ortho-cresol, para-ortho-cresol, nitrobenzena, trikloroetilen, dan lain-lain (Ryan et al. 2007). Penelitian sebelumnya yang dilakukan oleh Fishman et al. (2004), menyebutkan bahwa R. pickettii dapat menghidroksilasi toluena dengan menggunakan enzim yang dimilikinya yaitu Toluena para-monooksigenase.
Dalam dunia pertanian, penelitian bakteri R. pickettii mulai banyak diaplikasikan. Burkholderia pickettii (sekarang R. pickettiii) telah diisolasi dari perakaran Melon. Kemudian, bakteri ini diuji coba dengan menggunakan metode Tn5-mutagenesis. Trankonjugan B. pickettii terhambat dalam produksi pektinase ekstraseluler. Akan tetapi, transkonjugan ini memiliki ketahanan lebih tinggi jika dibandingkan dengan perlakuan gabungan tipe liarnya dan transkonjugannya pada tanah liat yang ditumbuhi oleh Melon (Ikeda et al. 1998).
R. pickettii dapat mendegradasi bahan herbisida Sulfentrazon, menurut laporan adalah salah satu jenis herbisida sistemik dan persisten pada beberapa tanah yang ada di Negara Brazil khusus pada tanah jenis Hapludoks (Martinez et al. 2008). Selain itu, berdasarkan penelitian Rustam (2012), R. pickettii adalah salah satu jenis bakteri yang dapat mengendalikan R. solani.
Penyakit Hawar Pelepah Padi
Penyakit ini disebabkan oleh R. solani. R. solani memiliki bentuk telomorf Tanatephorus cucumeris. T. cucumeris diklasifikasikan ke dalam kelompok cendawan Filum Basidiomycota; Kelas basidiomysetes; Ordo Ceratobasidiales; dan Genus Tanatephorus (Agrios 2005).
R. solani adalah spesies yang paling banyak diketahui dan dipelajari di seluruh dunia dari genus Rhizoctonia. Pada awalnya, cendawan jenis ini dideskripsikan oleh Julius Kuhn pada pertanaman kentang pada tahun 1858. R. solani adalah basidiomiset tular tanah yang tersebar luas dengan biologi yang kompleks. Cendawan jenis ini memiliki cara yang sangat merusak sebagai parasit nonobligat karena dapat menyebabkan nekrosis dan mati rebah pada banyak spesies yang menjadi inangnya. Selain itu, ketiadaan konidia dan kelangkaan dari spora seksual, R. solani hidup sebagai hifa dan sklerotia di alam (Lehtonen 2009).
Hawar pelepah merupakan penyakit penting pada tanaman padi. Penyakit ini merusak pelepah, sehingga untuk menemukan dan mengenali penyakit, perlu dibuka kanopi pertanaman. Penyakit ini menyebabkan tanaman menjadi mudah rebah, semakin awal terjadi kerebahan, semakin besar kehilangan yang diakibatkannya. Selain itu, penyakit ini menyebabkan gabah kurang terisi penuh atau bahkan hampa. Hawar pelepah terjadi umumnya pada saat tanaman mulai membentuk anakan sampai menjelang panen. Namun demikian, penyakit ini juga dapat terjadi pada tanaman muda (Puslitbang TP 2007).
Menurut Ou (1985), gejala yang muncul ketika tanaman padi terserang oleh hawar pelepah daun yaitu berupa bercak-bercak pada pelepah daun. Pada mulanya, bercak berbentuk elips atau oval, bentuk tidak beraturan, berwarna abu-abu kehijauan, dan berukuran sekitar 1-3 cm. Pada bagian tengah, gejala berwarna putih keabu-abuan, dengan tepi berwarna cokelat. Semakin tua usia penyakit pada gejala tersebut akan terbentuk sklerotia yang ketika disentuh akan mudah lepas dan jatuh ke sekitar pertanaman padi. Pertumbuhan dan perkembangan penyakit ini tergantung kondisi lingkungan. Kondisi lingkungan yang lembab akan semakin meningkatkan pertumbuhan miselia pada pertanaman padi yang terserang patogen ini.
panas dan lembab. Penyakit ini juga dapat berkembang dengan baik jika pada lahan mengandung pupuk fosfat yang tinggi, tetapi perkembangan penyakit dapat dihambat dengan pemberian pupuk kalium. Terdapat sekitar 14 varietas padi yang telah diujikan ternyata rentan terhadap serangan penyakit hawar pelepah padi (Rustam 2012).
Transposon Mutagenesis pUT Mini-Tn5Km1
Transposisi adalah suatu proses perpindahan elemen genetik dari satu lokus dalam suatu kromosom, plasmid, atau genom virus, ke bagian lain kromosom yang sama, atau bahkan ke suatu lokus dalam kromosom lain. Elemen genetik yang berpindah tersebut dapat berupa satu gen atau beberapa gen bertautan (linkage) dan dikenal sebagai elemen genetik yang dapat bertransposisi (transposable genetic element), atau sering juga disebut transposon (Yuwono 2005).
Transposon mutagenesis pUT Mini-Tn5Km1 adalah salah satu jenis transposon pada prokariot khususnya Escherichia coli. Ini merupakan salah satu dari empat kelompok elemen genetik yang dapat bertransposisi, yaitu: transposon komposit (diberi symbol Tn), yaitu suatu transposon yang selain membawa fungsi transposisi, juga membawa gen lain, misalnya gen ketahanan terhadap antibiotik (Watson et al. 1987; Yuwono 2005).
Transposon mutagenesis telah digunakan dalam dunia bioteknologi pertanian saat ini, contohnya adalah, Bradyrhizobium japonicum adalah bakteri yang diberi perlakuan transposon mutagenesis dan dapat toleran terhadap tanah yang memiliki kadar asam dan beraluminium tinggi (Astuti et al. 2006). Pada pengujian di rumah kaca, transkonjugan B. japonicum memiliki viabilitas dan 6
efektivitas simbiotik dengan varietas kedelai uji yang lebih baik jika dibandingkan tipe liarnya. Bj 11(9) merupakan transkonjugan pilihan untuk dijadikan untuk pupuk hayati karena memiliki viabilitas dan efektivitas simbiotik tertinggi setelah penyimpanan (Handayani 2009).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Waktu pelaksanaan pada bulan Desember 2011 hingga September 2012.
Peremajaan Isolat
Isolat bakteri R. pickettii TT47 (isolat koleksi Laboratorium Bakteriologi Tumbuhan, Proteksi Tanaman, IPB) dibiakkan pada media Luria Agar (LA) (Pancreatic Digest of Casein 10 g, NaCl 5 g, Yeast Extract 5 g, agar 15 g, aquades 1 L) pada pH 7 dalam kondisi suhu ruangan. Isolat E. coli S17-1λpir (koleksi dari Laboratorium Mikrobiologi, Departemen Biologi, IPB) dibiakkan juga pada media LA yang ditambahkan antibiotik kanamisin dan ampisilin dengan konsenterasi masing-masing 50 µg/ml. Selanjutnya, isolat R. solani (isolat koleksi Laboratorium Bakteriologi Tumbuhan, Proteksi Tanaman, IPB) ditumbuhkan pada media Potato Dextrose Agar (PDA) (dextrose 20 g, kentang 200 g, agar 15 g, aquades 1 L). Baik E. coli S17-1λpir dan R. solani ditumbuhkan pada suhu ruangan dengan pH 7.
Pengujian Antagonisme R. pickettii terhadap R. solani
Keterangan: R1= panjang pertumbuhan miselium cendawan ke arah bakteri; R2= panjang
pertumbuhan miselium cendawan ke arah berlawanan bakteri menuju tepi cawan.
Uji Sensitivitas R. pickettii terhadap Antibiotik Kanamisin
Satu loop koloni R. pickettii ditumbuhkan pada Luria Broth (LA tanpa agar) dengan pH 7 dan diinkubasi pada mesin shaker dengan kecepatan 100 rpm selama 24 jam. Sebanyak 100 µl R. pickettii disebar secara merata pada LA. Kertas saring steril direndam selama 15 menit di dalam kanamisin dengan konsenterasi 50 µg/ml. Selanjutnya, kertas saring diangkat dengan pinset dan dikeringanginkan beberapa saat, kemudian diletakkan di LA. Biakan diinkubasi pada suhu ruangan selama 24 jam dan diamati zona penghambatan yang ditunjukkan dengan terbentuknya zona bening.
Keterangan:
A = koloni R. solani
B = koloni R. pickettii
R1 = panjang pertubuhan miselium ke arah bakteri
R2 = panjang miselium ke arah
berlawanan dengan bakteri menuju
ke tepi cawan.
A
B
C Keterangan:
A ( ) = hamparan koloni R. pickettii pada media LA
B ( ) = cakram yang telah direndam kanamisin C ( ) = zona bening yang terbentuk
Gambar 2 Uji antibiosis R. pickettii terhadap R. solani dengan metode dual culture.
Gambar 3 Uji sensitivitas R. pickettii terhadap antibiotik kanamisin. A
B
Mutagenesis R. pickettii dengan Transposon pUT Mini-Tn5Km1
Transposon mutagenesis dilakukan dengan metode konjugasi antara bakteri antagonis R. pickettii sebagai resipien (penerima) dengan E. coli S17-1λpir yang merupakan pembawa plasmid pUT Mini-Tn5Km1 sebagai donor (Wahyudi et al. 1998). Bakteri R. pickettii ditumbuhkan selama 24 jam (pH 7, suhu ruangan, 100 rpm) pada LB hingga konsentrasi sel menjadi 1.5 × 108 cfu/ml. Sel R. pickettii dipanen dengan cara disentrifugasi selama 8 menit, kecepatan 10 000 rpm dengan suhu 20ᴼC. Setelah itu, supernatan dibuang dan dicuci dengan NaCl 0.85% sebanyak 3 kali. E. coli S17-1λpir ditumbuhkan pada LB yang telah ditambahkan kanamisin dan ampisilin dengan konsenterasi 50 µg/ml selama 24 jam hingga diperoleh konsentrasi sel 4.08 × 1010 cfu/ml (pH 7, suhu ruangan, 100 rpm). Pemanenan dan pencucian sel dilakukan sama seperti metode pada R. pickettii di atas (Ratdiana 2011).
Kedua pelet bakteri diresuspensikan dengan 40 µl LB, suspensi bakteri dicampurkan dan diteteskan pada membran steril yang diletakkan di atas LA dan selanjutnya diinkubasi selama 24 jam. Membran dimasukkan ke dalam tabung yang telah terisi 1 ml NaCl 0.85% dan kemudian dikocok dengan vorteks. Setelah selesai, suspensi bakteri pada tabung dimasukkan ke dalam tabung ependorf steril.
Sebanyak 100 µl suspensi bakteri dari ependorf diencerkan berseri dari pengenceran 10-1 hingga 10-10 pada tabung ependorf steril dan 100 µl kultur bakteri pengenceran berseri tersebut disebar secara merata pada LA yang telah ditambahkan kanamisin dengan konsenterasi 50 µg/ml. Transkonjugan R. pickettii ditunjukkan dengan adanya pertumbuhan koloni pada media tersebut. Seluruh koloni transkonjugan R. picketii dimurnikan pada LA yang telah ditambahkan kanamisin dengan konsenterasi 50 µg/ml. Koloni transkonjugan selanjutnya dapat diuji sifat antagonismenya untuk melihat peran aktivitas penghambatan pertumbuhan R. solani.
dengan jarak 3 cm dari koloni R. solani. Perlakuan juga dibandingkan dengan pertumbuhan dan penghambatan R. pickettii kontrol. Perlakuan yang sama dilakukan untuk jenis transkonjugan R. pickettii yang lainnya. Zona penghambatan pertumbuhan miselium R. solani dibentuk oleh jenis transkonjugan R. pickettii yang memiliki sifat antagonis tinggi. Isolat transkojugan yang memiliki potensi penghambatan kemudian digunakan kembali untuk uji antagonisme dual culture terhadap R. solani pada PDA yang telah ditambahkan kanamisin berkonsenterasi 50 µg/ml. Seleksi dipilih berdasarkan kemampuan dalam menghambat pertumbuhan R. solani yang ditunjukkan dengan adanya proses kerusakan pada jaringan miselia cendawan yang tumbuh di dekat isolat transkonjugan, perubahan warna pada miselia cendawan, dan yang terakhir adalah tebal dan tipis perkembangan miselia cendawan.
Pengujian Antagonisme antara Transkonjugan R. pickettii dengan R. solani
Transkonjugan R. pickettii terpilih digores terlebih dahulu pada PDA dengan pH 7 yang telah ditambahkan kanamisin berkonsenterasi 50 µg/ml dengan jarak 3 cm dari tepi petri. Setelah biakan transkonjugan R. pickettii berumur 3 hari, 1 bulatan yang ditumbuhi R. solani dengan diameter 0.5 cm berumur 3 hari diletakkan berseberangan terhadap transkonjugan pada PDA dengan jarak 3 cm dari tepi petri. Posisi keduanya sejajar satu sama lain. Hal yang sama ini juga dilakukan pada transkonjugan R. pickettii lain. R. pickettii tipe liar digunakan sebagai perlakuan pembanding (kontrol). Jenis transkonjugan yang memiliki persentase penghambatan pertumbuhan miselia R. solani yang besar dapat digunakan untuk uji selanjutnya.
Konfirmasi Penyisipan Plasmid pUT Mini-Tn5Km1 pada Genom Transkonjugan R. pickettii dengan Teknik Polymerase Chain Reaction (PCR)
berulang kali untuk mempercepat lisis sel. Selanjutnya, suspensi diinkubasi pada 37ᴼC selama 30 menit menggunakan water shaker bath. Proses lisis bakteri dilanjutkan dengan penambahan 50 µl Sodium Dodecyl Sulfate (SDS) 10%, kemudian ependorf dikocok kembali berulang-ulang. Selanjutnya, suspensi diinkubasi pada suhu 37ᴼC selama 1 jam dengan water shaker bath. Sebanyak 65 µl NaCl 5 M dan 80 µl CTAB-NaCl ditambahkan ke dalam suspensi, kemudian diinkubasi lagi pada suhu 65ᴼC selama 20 menit, tabung kembali dikocok berulang-ulang secara perlahan-lahan.
Purifikasi DNA dan pemisahan debris sel dilakukan dengan ditambah kloroform isoamil (24:1) sebanyak equal volume sebelumnya (450 µl), kemudian dikocok kuat selama 30 menit. DNA dipisahkan dari debris sel dengan cara disentrifugasi pada suhu 20ᴼC selama 15 menit dengan kecepatan 11 000 rpm. Untuk mengendapkan DNA, supernatan sebanyak 450 µl yang didapatkan kemudian ditambahkan 450 µl isopropanol dingin dan dibantu dengan disentrifugasi selama 20 menit dengan suhu 4ᴼC dengan kecepatan 12 000 rpm. Kemudian, pelet dicuci dengan 70% ETOH, supernatan dibuang. Pelet dikeringkan dengan membuka penutup dan ditutup dengan kertas tisu selama satu malam. DNA pelet dilarutkan dengan buffer TE 100 µl dan dapat disimpan pada mesin freezer dengan suhu -20ᴼC.
Ampilifikasi Sisipan Tn5Km1 pada Genom R. pickettii dengan PCR. Sebanyak 1 µl larutan DNA dimasukkan ke dalam ependorf steril. Selanjutnya,
HASIL DAN PEMBAHASAN
R. pickettii sebagai Agen Hayati R. solani
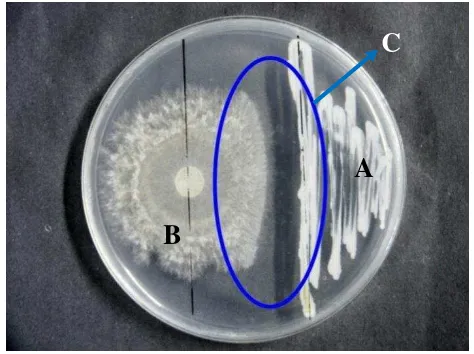
Isolat yang digunakan adalah R. pickettii yang memiliki ciri-ciri koloni berwarna kuning dengan bentuk bundar dengan tepian licin dan elevasi seperti tetesan. R. solani memiliki miselia berwarna putih kemudian ketika umur menjadi tua berubah menjadi cokelat dan selanjutnya membentuk sklerotia ketika nutrisi tempat tumbuhnya habis. E. coli S17-1λpir memiliki warna koloni putih dengan bentuk bundar, tepian licin, dan elevasinya cembung (Gambar 4).
Persentase rata-rata penghambatan pertumbuhan R. solani oleh R. pickettii adalah sebesar 39.37%. Pada PDA, pertumbuhan R. pickettii baik dan warna koloni menjadi putih pada bagian tepian, tetapi pada bagian tengah terlihat ada semburat berwarna kuning. Hal ini menunjukan bahwa R. pickettii memiliki potensi dalam mengendalikan R. solani pada uji in vitro (Gambar 5). Menurut Rustam (2012), R. pickettii memiliki kemampuan dalam menghambat pertumbuhan R. solani. Selain itu, R. pickettii tidak bersifat fitotoksik, menghasilkan siderofor, enzim kitinase, dan memiliki kemampuan dalam pelarutan fosfat.
Gambar 4 Koloni R. solani pada media PDA penyebab hawar pelepah padi (A); koloni R. pickettii (B) dan koloni E. coli S17-1λpir (C) pada media LA.
Proses antagonisme R. pickettii menggunakan mekanisme antibiosis. Menurut Rustam (2012), R. pickettii tidak memiliki kemampuan fitotoksis pada tanaman uji sehingga bakteri ini dapat dilakukan untuk seed treatment agar melindungi benih dari serangan patogen dan memperbaiki vigor benih. Selain itu, bakteri R. pickettii memiliki kemampuan dalam menghasilkan siderofor. Siderofor adalah senyawa pengelat besi yang disekresikan oleh suatu mikrooganisme pada kondisi tempat munculnya kekurangan besi. Senyawa ini berperan penting dalam menekan penyakit tanaman melalui mekanisme persaingan zat besi.
R. pickettii juga menghasilkan enzim kitinase. Enzim kitinase merupakan
suatu enzim yang mampu mendegradasi polimer kitin menjadi kitin oligosakarida atau monomer N-asetilglukosamin. Bakteri yang menghasilkan enzim kitinase berpotensi sebagai agens hayati pada cendawan. Bakteri R. pickettii juga memiliki kemampuan dalam pelarutan fosfat. Fosfat adalah senyawa penting kedua setelah nitrogen dalam proses fotosintesis dan perkembangan akar tanaman (Rustam 2012).
Peningkatan Kemampuan Antagonisme R. pickettii Melalui Transposon Mutagenesis
Uji Sensitivitas R. pickettii terhadap Antibiotik Kanamisin
Uji sensitivitas R. pickettii terhadap kanamisin ini bertujuan untuk mengetahui bakteri yang menjadi penerima (resipien) plamid pUT Mini-Tn5Km1
A
B
C
sensitif kanamisin. Selain itu, proses pengujian mutagenesis menggunakan teknik transposon dapat lebih mudah mengenali bakteri hasil transposon transkonjugan yang resisten terhadap kanamisin. Berdasarkan uji sensitivitas antibiotik yang telah dilakukan, terbentuk zona bening pada media. Hal ini menunjukkan bahwa R. pickettii sensitif terhadap kanamisin, sehingga R. pickettii dapat digunakan untuk mutagenesis dengan transposon pUT Mini-Tn5Km1 (Gambar 6).
Berdasarkan penelitian yang telah dilakukan oleh Park et al. (2003), R. pickettii dapat digunakan transposon mutagenesis menggunakan E. coli DH5α. Salah satu sifat rentan yang dimiliki oleh R. pickettii adalah rentan terhadap Kanamisin dan Tetrasiklin. Sifat yang sensitif antibiotik kanamisin dan tetrasiklin mempermudah pengamatan dalam mutagenesis dengan metode transposon.
Mutagenesis R. pickettii dengan Transposon
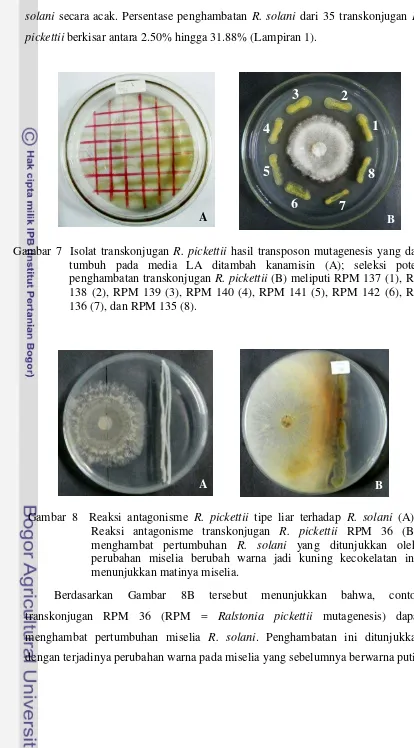
Transposon mutagenesis pUT Mini-Tn5Km1 ini menghasilkan transkonjugan R. pickettii yang memiliki variasi bentuk yang berbeda-beda setiap individu koloni yang telah terbentuk. Perubahan bentuk koloni meliputi perubahan koloni, bentuk elevasi, bentuk tepian, warna, dan lain-lain. Koloni yang dipilih dan digunakan adalah semua koloni yang dapat tumbuh pada media LA yang ditambahkan kanamisin berkonsenterasi 50 µg/ml. Hasil seleksi bakteri yang dikumpulkan sebanyak 175 koloni transkonjugan berbeda (Gambar 7). Kumpulan koloni transkonjugan tersebut diseleksi kembali menjadi 35 koloni transkonjugan yang berbeda dengan pengujian kemampuan penghambatan pertumbuhan R. Gambar 6 Zona bening penghambatan pertumbuhan R. pickettii (ditunjukkan oleh panah biru) oleh kanamisin 50 µg/ml (ditunjukkan oleh panah merah).
solani secara acak. Persentase penghambatan R. solani dari 35 transkonjugan R. pickettii berkisar antara 2.50% hingga 31.88% (Lampiran 1).
Berdasarkan Gambar 8B tersebut menunjukkan bahwa, contoh transkonjugan RPM 36 (RPM = Ralstonia pickettii mutagenesis) dapat menghambat pertumbuhan miselia R. solani. Penghambatan ini ditunjukkan dengan terjadinya perubahan warna pada miselia yang sebelumnya berwarna putih
A B
1
2
3
4
Gambar 7 Isolat transkonjugan R. pickettii hasil transposon mutagenesis yang dapat tumbuh pada media LA ditambah kanamisin (A); seleksi potensi penghambatan transkonjugan R. pickettii (B) meliputi RPM 137 (1), RPM 138 (2), RPM 139 (3), RPM 140 (4), RPM 141 (5), RPM 142 (6), RPM 136 (7), dan RPM 135 (8).
Gambar 8 Reaksi antagonisme R. pickettii tipe liar terhadap R. solani (A); Reaksi antagonisme transkonjugan R. pickettii RPM 36 (B) menghambat pertumbuhan R. solani yang ditunjukkan oleh perubahan miselia berubah warna jadi kuning kecokelatan ini menunjukkan matinya miselia.
5
6
7
8
[image:30.595.88.502.76.824.2]pada posisi dekat dengan koloni RPM 36 kemudian berubah menjadi warna kuning, jingga hingga jingga kecokelatan. Pertumbuhan miselia R. solani terlihat lebih tipis jika dibandingkan dengan sampel uji lain. Perubahan warna ini terjadi diduga karena pengaruh senyawa anticendawan yang dihasilkan oleh RPM 36 bekerja menghambat pertumbuhan R. solani, sehingga pada miselia yang berada di dekat RPM 36 mati.
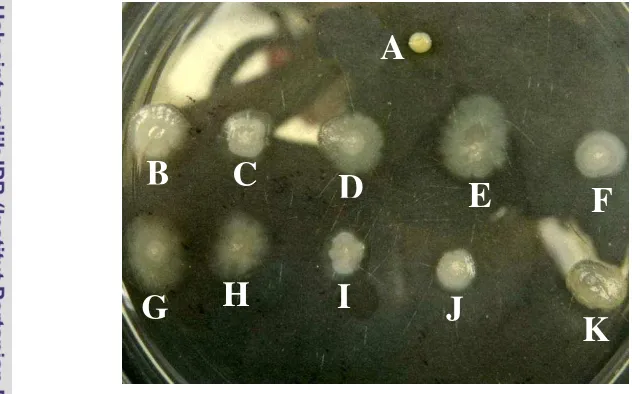
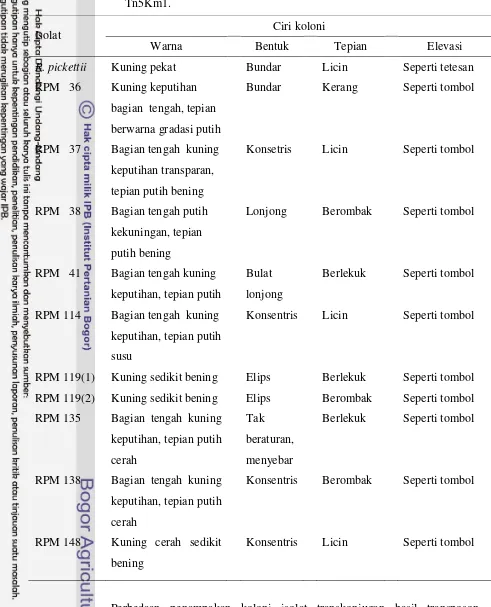
Dari sekitar 35 transkonjugan terpilih 10 transkonjugan potensial dalam penghambatan R. solani. Kesepuluh isolat koloni transkonjugan itu meliputi RPM 36, RPM 37, RPM 38, RPM 41, RPM 114, RPM 119(1), RPM 119(2), RPM 135, RPM 138, dan RPM 148. Kesepuluh isolat transkonjugan ini memiliki bentu koloni yang berbeda-beda berdasarkan hasil transposon mutagenesis. Bentuk dan ukuran yang berbeda ini adalah salah satu indikator dalam ekspresi isolat transkonjugan hasil transposon mutagenesis. Ciri-ciri koloni dapat dilihat pada Tabel 1 dan penampakan fenotipe pada Gambar 9.
A
B
C
D
E
F
G
H
I
J
[image:31.595.120.436.224.421.2]K
Gambar 9 Penampakan fenotipe 10 isolat transkonjugan uji yang tumbuh pada media LA ditambah kanamisin; R. pickettii (A), RPM 36 (B), RPM 37 (C), RPM 38 (D), RPM 41 (E), RPM 114 (F), RPM 119(1) (G), RPM 119(2) (H), RPM 135 (I), RPM 138 (J), RPM 148 (K).
Tabel 1 Ciri-ciri koloni isolat transkonjugan transposon mutagenesis pUT Mini-Tn5Km1.
Isolat Ciri koloni
Warna Bentuk Tepian Elevasi
R. pickettii Kuning pekat Bundar Licin Seperti tetesan RPM 36 Kuning keputihan
bagian tengah, tepian berwarna gradasi putih
Bundar Kerang Seperti tombol
RPM 37 Bagian tengah kuning keputihan transparan, tepian putih bening
Konsetris Licin Seperti tombol
RPM 38 Bagian tengah putih kekuningan, tepian putih bening
Lonjong Berombak Seperti tombol
RPM 41 Bagian tengah kuning keputihan, tepian putih
Bulat lonjong
Berlekuk Seperti tombol
RPM 114 Bagian tengah kuning keputihan, tepian putih susu
Konsentris Licin Seperti tombol
RPM 119(1) Kuning sedikit bening Elips Berlekuk Seperti tombol RPM 119(2) Kuning sedikit bening Elips Berombak Seperti tombol RPM 135 Bagian tengah kuning
keputihan, tepian putih cerah
Tak beraturan, menyebar
Berlekuk Seperti tombol
RPM 138 Bagian tengah kuning keputihan, tepian putih cerah
Konsentris Berombak Seperti tombol
RPM 148 Kuning cerah sedikit bening
Konsentris Licin Seperti tombol
bakteri secara acak. Penyusupan sekuens ini ke bakteri penerima (resipien) bersifat stabil ketika menyusup ke dalam genom bakteri target pada Bakteri Gram negatif (Herrero et al. 1990).
Beberapa isolat transkonjugan, koloni mengalami perubahan. Perubahan itu meliputi bagian pembentukan warna koloni, bentuk, tepian, dan elevasi koloni, jika kita bandingkan dengan bentuk koloni R. pickettii tipe liar sangat jauh berbeda. Sekuens Tn5Km1 yang menyusup pada genom transkonjugan ini diduga menonaktifkan (knockdown) sekuen genom pengode gen pembentuk koloni berwarna kuning pekat, bentuknya bundar, tepian licin, dan elevasi seperti tetesan sehingga ekspresi koloni transkonjugan menjadi berbeda.
Perubahan warna koloni pada bakteri transkonjugan hasil transposon mutagenesis E. coli S17-1λpir juga pernah terjadi pada penelitian Wahyudi (2006). Wahyudi (2006) menyatakan bahwa, transkonjugan magnetospirillum magneticum AMB-1 memiliki warna koloni putih dan memiliki respons magnetik. Hal ini sangat berbeda dengan koloni tipe liarnya yang berwarna hitam cokelat. Kemudian, terdapat juga transkonjugan NMA 40 nonmagnetik yang berwarna putih dan memiliki kemampuan sintesis magnetosom yang tidak sempurna.
Uji Potensi Antagonisme R. pickettii Transkonjugan terhadap R. solani
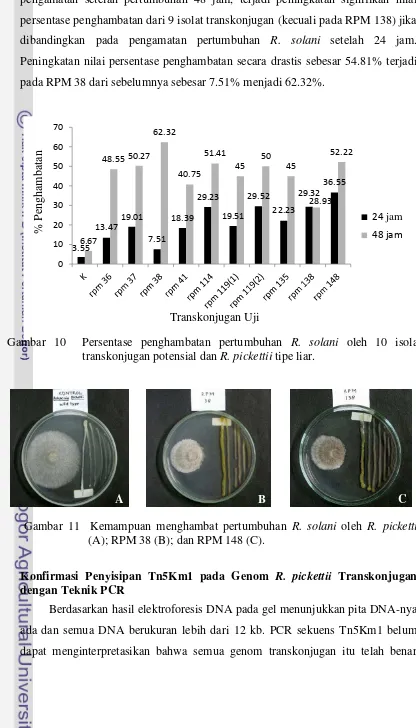
Uji potensi antagonisme transkonjugan R. pickettii terhadap R. solani menunjukkan bahwa 10 isolat transkonjugan R. pickettii akhir yang terpilih memiliki daya hambat pertumbuhan R. solani yang ditunjukkan oleh persentase penghambatan lebih tinggi dari perlakuan pada kontrol (R. pickettii tipe liar). Hal ini menunjukkan bahwa 10 isolat transkonjugan R. pickettii terpilih memiliki potensi dalam penghambatan R. solani yang kemampuannya lebih tinggi dari R. pickettii tipe liar (Gambar 10).
pengamatan setelah pertumbuhan 48 jam, terjadi peningkatan signifikan nilai persentase penghambatan dari 9 isolat transkonjugan (kecuali pada RPM 138) jika dibandingkan pada pengamatan pertumbuhan R. solani setelah 24 jam. Peningkatan nilai persentase penghambatan secara drastis sebesar 54.81% terjadi pada RPM 38 dari sebelumnya sebesar 7.51% menjadi 62.32%.
Konfirmasi Penyisipan Tn5Km1 pada Genom R. pickettii Transkonjugan dengan Teknik PCR
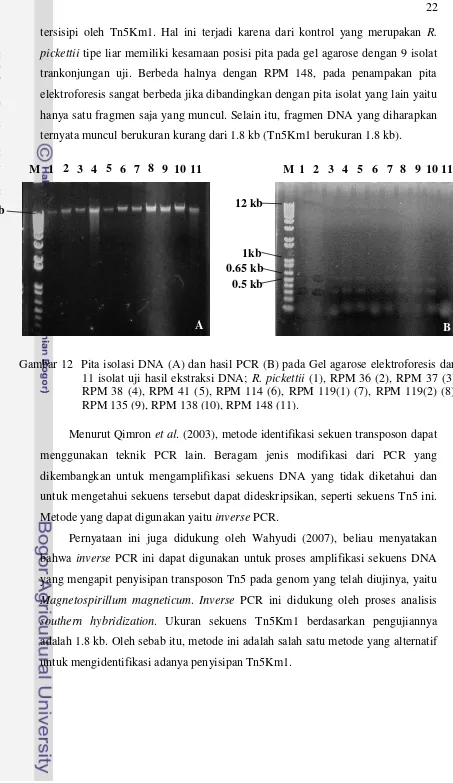
Berdasarkan hasil elektroforesis DNA pada gel menunjukkan pita DNA-nya ada dan semua DNA berukuran lebih dari 12 kb. PCR sekuens Tn5Km1 belum dapat menginterpretasikan bahwa semua genom transkonjugan itu telah benar
3.55 13.47 19.01 7.51 18.39 29.23 19.51 29.52 22.23 29.32 36.55 6.67 48.55 50.27 62.32 40.75 51.41 45 50 45 28.93 52.22 0 10 20 30 40 50 60 70 % P eng ha mbata n Transkonjugan Uji Series1 Series2
24 jam 48 jam
Gambar 10 Persentase penghambatan pertumbuhan R. solani oleh 10 isolat transkonjugan potensial dan R. pickettii tipe liar.
Gambar 11 Kemampuan menghambat pertumbuhan R. solani oleh R. pickettii (A); RPM 38 (B); dan RPM 148 (C).
[image:34.595.93.509.93.821.2] [image:34.595.105.504.214.441.2]tersisipi oleh Tn5Km1. Hal ini terjadi karena dari kontrol yang merupakan R. pickettii tipe liar memiliki kesamaan posisi pita pada gel agarose dengan 9 isolat trankonjungan uji. Berbeda halnya dengan RPM 148, pada penampakan pita elektroforesis sangat berbeda jika dibandingkan dengan pita isolat yang lain yaitu hanya satu fragmen saja yang muncul. Selain itu, fragmen DNA yang diharapkan ternyata muncul berukuran kurang dari 1.8 kb (Tn5Km1 berukuran 1.8 kb).
Menurut Qimron et al. (2003), metode identifikasi sekuen transposon dapat menggunakan teknik PCR lain. Beragam jenis modifikasi dari PCR yang dikembangkan untuk mengamplifikasi sekuens DNA yang tidak diketahui dan untuk mengetahui sekuens tersebut dapat dideskripsikan, seperti sekuens Tn5 ini. Metode yang dapat digunakan yaitu inverse PCR.
[image:35.595.73.526.60.843.2]Pernyataan ini juga didukung oleh Wahyudi (2007), beliau menyatakan bahwa inverse PCR ini dapat digunakan untuk proses amplifikasi sekuens DNA yang mengapit penyisipan transposon Tn5 pada genom yang telah diujinya, yaitu Magnetospirillum magneticum. Inverse PCR ini didukung oleh proses analisis southern hybridization. Ukuran sekuens Tn5Km1 berdasarkan pengujiannya adalah 1.8 kb. Oleh sebab itu, metode ini adalah salah satu metode yang alternatif untuk mengidentifikasi adanya penyisipan Tn5Km1.
Gambar 12 Pita isolasi DNA (A) dan hasil PCR (B) pada Gel agarose elektroforesis dari 11 isolat uji hasil ekstraksi DNA; R. pickettii (1), RPM 36 (2), RPM 37 (3), RPM 38 (4), RPM 41 (5), RPM 114 (6), RPM 119(1) (7), RPM 119(2) (8), RPM 135 (9), RPM 138 (10), RPM 148 (11).
M 1 2 3 4 5 6 7 8 9 10 11
12 kb
M 1 2 3 4 5 6 7 8 9 10 11
12 kb
1kb 0.65 kb
0.5 kb
A B
Kesimpulan
R. pickettii memiliki potensi antagonisme dalam penghambatan pertumbuhan R. solani. Teknik transposon mutagenesis dapat dilakukan pada R. pickettii. Transkonjugan R. pickettii telah terjadi perubahan fenotipe pada warna, bentuk, tepian, dan elevasi koloni setiap isolatnya. Selain itu, transkonjugan ini memiliki kemampuan penghambatan pertumbuhan R. solani. Sebanyak 10 transkonjugan R. pickettii ini memiliki persentase penghambatan pertumbuhan R. solani berkisar antara 7.51% hingga 62.32% lebih besar daripada R. pickettii tipe liarnya. RPM 38 memiliki persentase penghambatan R. solani terbesar pada pengamatan pertumbuhan setelah 48 jam jika dibandingkan dengan transkonjugan lain sebesar 62.32% (peningkatan sebesar 54.81%). Konfirmasi penyisipan sekuens Tn5Km1 pada genom transkonjugan R. pickettii belum dapat dibuktikan dengan Metode PCR reguler.
Saran
DAFTAR PUSTAKA
[Pusat Penelitian dan Pengembangan Tanaman Pangan]. 2007. Masalah Lapang (Hama, Penyakit, dan Hara) pada Padi. Ed. Ke-3. Bogor (ID): Puslitbang Tanaman Pangan.
Agrios GN. 2005. Plant Pathology. 5th Ed. California (US): Elsevier Academic Press.
Astuti RI, Wahyudi AT, Mubarik NR. 2006. Cloning of genomic DNA fragment involved in acid-aluminium tolerance in Bradyrhizobium japonicum 38 through transposon mutagenesis. Jurnal Mikrobiologi Indonesia 11(1):35-39.
Astuti RI. 2006. Kloning fragmen DNA genom yang terlibat dalam toleransi asam-aluminium pada Bradyrhizobium japonicum melalui mutagenesis dengan transposon [Skripsi]. Bogor (ID): Departemen Biologi, FMIPA, Institut Pertanian Bogor.
Fishman A, Tao Y, Wood TK. 2004. Physiological relevance of successive hydroxylations of toluene para-monooxygenase of Ralstonia pickettii PKO1. Biocatalysis & Biotransformation 22(4):283-289.
Handayani L. 2009. Inokulan Bradyrhizobium japonicum toleran asam-Al: uji viabilitas dan efektivitas simbiotik terhadap tanaman kedelai [Tesis]. Bogor (ID): Institut Pertanian Bogor.
Herrero M, De Lorenzo V, Timmis KN. 1990. Transposon vectors containing non-antibiotic resistance selection markers for cloning and stable chromosomal insertion of foreign genes in gram negative bacteria. J Bacteriol 172:6557-6567.
Ikeda K, Toyota K, Kimura M. 1998. Role of extracellular pectinases in the rhizoplane competence of rhizobacterium Burkholderia pickettii MSP2RIF. Soil Biol. Biochem. 30(3):323-329.
Lehtonen MJ. 2009. Rhizoctonia solani as potato pathogen-variation of isolates in Finland and host response [Dissertation]. Helsinki (FI): University of Helsinki.
Lo C-T. 1998. General mechanisms of action of microbial biocontrol agents. Plant pathology Bulletin 7(4):155-166.
Martinez CO, Silva CMMS, Fay EF, Maia AHN, Abakerli RB, Durrant LR. 2008. Degradation of the herbicide sulfentrazone in a Brazilian typic hapludox soil. Soil Biology & Chemistry 40:879-886.
Ou SH. 1985. Rice Disease. 2nd ed. Kew, Surrey (CN): Commonwealth Mycological Institute.
transcriptional activators from aromatic oxidizing bacteria. FEMS Microobiology Letters 224:45-52.
Qimron U, Madar N, Ascarelli-Goell R, Elgrably-Weiss M, Altuvia S, Porgador A. 2003. Reliable determination of transposon insertion site in proceryoter by direct sequencing. J of Mocrobiological Methods 54:137-140.
Ratdiana. 2011. Aktivitas biokontrol bakteri kitinolitik terhadap penyakit karat daun krisan . Bogor (ID): Institut Pertanian Bogor.
Rustam. 2012. Potensi bakteri penghasil senyawa bioaktif anticendawan untuk pengendalian penyakit hawar pelepah padi [Disertasi]. Bogor (ID): Institut Pertanian Bogor.
Ryan MP, Pembroke JT, Adley CC. 2007. Ralstonia pickettii in environmental biotechnology: potential and applications. A review. J of Appl. Microbiology 103:754-764.
Wahyudi AT, Suwanto A, Imas T, Tjahjoleksono A. 1998. Screening of acid-aluminium tolerant Bradyrhizobium japonicum strains: analysis of marker genes and competition in planta. Aspac J Mol Biol Biotechnol 91-93:147-154.
Wahyudi AT. 2006. Involvement of gene encoding putative acetate kinase in magnetosome synthesis in Magnetospirillum magneticum AMB-1. Hayati 13(1):26-30.
Wahyudi AT. 2007. Rapid and simple amplification of genomic DNA sequences flanking transposon. Microbiology Indonesia 1(1):1-4.
Watson JD, Hopkins NH, Roberts JW, Steitz JA, Weiner AM. 1987. Molecular Biology of the Gene vol 1. 4th ed. California (US): The Benjamin/Cummings Publishing Company.
Lampiran 1 Persentase penghambatan R. solani oleh 35 bakteri transkonjugan R. pickettii
Waktu Pengamatan (Jam)
% Penghambatan bakteri uji
ulangan kontrol Rpm35 Rpm36 Rpm37 Rpm38 Rpm40 Rpm41 Rpm50 Rpm51 Rpm 114
Rpm 115 24
1 13.95 29.17 8.33 19.04 6.81 18.42 19.15 27.66 7.89 2.63 25.53 2 16.28 23.40 2.94 7.50 41.86 2.63 17.07 10.26 7.31 19.04 20.41 Rataan 15.12 26.29 5.64 13.27 24.34 10.53 18.11 18.96 7.60 10.84 22.97
48
Lampiran 1 Persentase penghambatan R. solani oleh 35 bakteri transkonjugan R. pickettii (Lanjutan)
Waktu Pengamatan (Jam)
% Penghambatan bakteri uji ulangan Rpm
116
Rpm 117
Rpm 118
Rpm 119
Rpm 120
Rpm 135
Rpm 136
Rpm 137
Rpm 138
Rpm 139
Rpm 140 24
1 7.14 2.22 26.67 5.71 22.22 2.78 11.63 7.14 2.94 21.95 13.04 2 16.67 3.18 2.32 17.50 17.78 2.63 9.76 7.14 2.94 23.81 19.57 Rataan 11.91 2.70 14.50 11.61 20.00 2.71 10.70 7.14 2.94 22.88 16.31
48
1 10.00 3.33 20.00 13.33 15.00 10.00 6.67 0.00 18.33 13.33 10.00 2 16.67 0.00 6.67 15.00 8.33 13.33 13.33 6.67 16.67 10.00 5.00 rataan 13.00 1.67 13.34 14.17 11.67 11.67 10.00 3.34 17.50 11.67 7.50
Lampiran 1 Persentase penghambatan R. solani oleh 35 bakteri transkonjugan R. pickettii (Lanjutan)
Waktu Pengamatan (Jam)
% Penghambatan bakteri uji ulangan Rpm
141
Rpm 142
Rpm 145
Rpm 146
Rpm 147
Rpm 148
Rpm 149
Rpm 150
Rpm 151
Rpm 152
Rpm 161 24
1 15.21 4.54 18.37 13.04 18.00 7.32 15.00 33.33 40.38 23.40 25.00 2 19.51 9.52 7.14 13.04 16.00 7.14 9.52 30.43 14.63 28.00 17.02 Rataan 17.18 7.03 12.76 13.04 17.00 7.23 12.00 31.88 27.51 25.70 21.01
48
Lampiran 1 Persentase penghambatan R. solani oleh 35 bakteri transkonjugan R. pickettii (Lanjutan)
Waktu Pengamatan (Jam)
% Penghambatan bakteri uji ulangan Rpm
162
Rpm 163
Rpm 166 24
1 13.64 0.00 13.33
2 7.14 2.78 6.25
Rataan 10.39 1.00 9.79
48
1 8.33 10.00 5.00
2 0.00 3.00 0.00
rataan 4.17 7.00 2.50
Lampiran 2 Persentase penghambatan R. solani oleh 10 bakteri transkonjugan R. pickettii potensial
Waktu Pengamatan (jam)
% Penghambatan Bakteri Transkonjugan ulangan Control Rpm36 Rpm37 Rpm38 Rpm41 Rpm
114
Rpm 119(1)
Rpm 119(2)
Rpm 135
Rpm 138
Rpm 148 24 1 3.23 4.00 8.00 7.14 9.09 33.33 15.38 35.71 7.41 33.33 32.35
2 3.57 23.08 21.43 15.39 29.41 32.14 36.00 26.92 20.00 25.00 40.63 3 3.85 13.33 27.59 0.00 16.67 22.22 7.14 25.93 39.29 29.63 36.67 Rataan 3.55 13.47 19.01 7.51 18.39 29.23 19.51 29.52 22.23 29.32 36.55
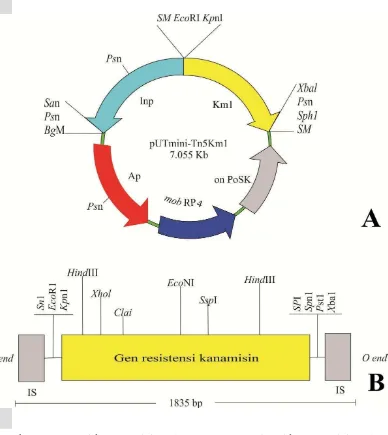
Lampiran 3 Skema proses mutagenesis dengan transposon (Astuti 2006).
Keterangan:
Proses mutagenesis dengan transposon. Konjugasi dilakukan di atas membran 0.40 µm pada media LA modifikasi. Suspensi campuran donor dengan resipien akan terjadi serangkaian proses transfer dan penyisipan transposon. Sel E. coli
S17-1λpir dapat membentuk fili (mating pair formation) terhadap sel R. pickettii
TT47 sebagai jalur transfer plasmid pUT Mini-Tn5Km1. Pada sel R. pickettii
TT47, segera akan terinduksi kerja enzim transposase yang berperan dalam proses eksisi transposon Mini-Tn5Km1 yang terdapat dalam pUT Mini-Tn5Km1 yang menyisipkannya ke dalam genom R. pickettii TT47. Plasmid pUT Mini-Tn5Km1 merupakan tipe plasmid bunuh diri (suicide plasmid) (Herrero et al.1990) yang akan terdegradasi jika pada sel inang tidak ada aktivitas gen pir. Serangkaian proses tersebut maka didapatkan sel R. pickettii TT47 yang memiliki sifat resisten terhadap kanamisin (Kmr) yang telah tersusupi sekuens Tn5Km1.
32
IMAM KHOIRI. Peningkatan Kemampuan Antagonis Ralstonia pickettii terhadap Rhizoctonia solani dengan Metode Transposon Mutagenesis. Dibimbing oleh GIYANTO.
Padi (Oryza sativa Linn.) merupakan tanaman pangan penting di Indonesia, tetapi tingkat produksinya terus mengalami fluktuatif. Saat ini, hama dan penyakit menjadi permasalahan utama pada pertanaman padi. Hawar pelepah padi adalah penyakit yang disebabkan oleh Rhizoctonia solani, yang merupakan salah satu penyakit penting pada pertanaman padi. Ralstonia pickettii dapat digunakan sebagai agen hayati dari penyakit hawar pelepah padi saat ini. Tujuan dari penelitian ini adalah untuk meningkatkan potensial dari R. pickettii sebagai agen hayati dari R. solani dengan menggunakan metode transposon mutagenesis pUT Mini-Tn5Km1. Transposon mutagenesis pUT Mini-Tn5Km1 merupakan salah satu teknologi dari mutagenesis untuk membentuk mikroorganisme yang memiliki kekuatan melebihi mikroorganisme tipe liarnya. Penyisipan transposon mutagenesis ini mengekspresikan perbedaan perubahan bentuk dari bakteri transkonjugan jika dibandingkan dengan R. pickettii tipe liar. Perubahan bentuk ini meliputi perubahan pada warna, bentuk, tepian, dan elevasi koloni. Ada sekitar 10 transkonjugan R. pickettii melebihi kemampuan persentase penghambatan dari R. pickettii tipe liar, berkisar antara 7.51% hingga 62.32%. RPM 38 memiliki persentase penghambatan tertinggi sekitar 62.32%. Konfirmasi penyisipan sekuens Tn5Km1 pada genom transkonjugan R. pickettii belum dapat dibuktikan menggunakan PCR reguler.
ABSTRACT
IMAM KHOIRI. Increasing Antagonist Ability of Ralstonia pickettii to Rhizoctonia solani Use Transposon Mutagenesis Methods. Supervised by GIYANTO.
Rice (Oryza sativa Linn.) is important food crop in Indonesia, but the production levels are still fluctuated. Pests and diseases are one of the main problems in rice cultivation. Rice sheath blights (RSB) disease caused by Rhizoctonia solani, is one of important disease in rice cultivation. Now, Ralstonia pickettii can be used as biocontrol agent of RSB. The objective of this study is to improve the potential of R. pickettii as biocontrol agent of R. solani by transposon mutagenesis pUT mini-Tn5Km1. The transposon mutagenesis pUT mini-Tn5Km1 is one of technology for mutagenesis to construct microorganisms that have more power than wild type microorganisms. Insertion of transposon mutagenesis expressed different morphological changes transconjugant bacteria than wild type R. pickettii. Morphological changes are includes changes in color, form, edge, and elevation of colony. There are about 10 transconjugants R. pickettii had exceeded the percentages inhibition of R. pickettii wild type, ranged from 7.51% up to 62.32%. Rpm 38 was the highest percentages of inhibition about 62.32%. Confirmation of insertion Tn5Km1 sequence to the chromosome of transconjugants R. pickettii had not been proven by regular PCR.
Latar Belakang
Padi (O. sativa Linn.) merupakan salah satu komoditas pertanian pangan penting dan banyak diusahakan secara komersial di Indonesia. Salah satu kendala dalam produksi padi adalah permasalahan hama dan penyakit yang dapat menyebabkan kerusakan dan kehilangan produktivitas padi secara signifikan. Penyakit hawar pelepah padi adalah penyakit penting pada padi yang disebabkan oleh R. solani. Penyakit ini menyebabkan tanaman padi mengalami bercak-bercak pada pelepah daun (Ou 1985).
Penyakit ini menyebabkan tanaman menjadi mudah rebah. Semakin awal terjadi kerebahan maka semakin besar kehilangan yang diakibatkannya. Penyakit ini juga menyebabkan gabah kurang terisi penuh atau bahkan hampa. Umumnya, hawar pelepah padi terjadi saat tanaman mulai membentuk anakan hingga menjelang panen. Saat ini, kerusakan yang disebabkan oleh penyakit ini belum terhitung besarnya kerugian (Puslitbang TP 2007). Oleh karena itu, perlu pengendalian yang tepat untuk menurunkan kejadian dan intensitas penyakit secara signifikan.
Cara-cara pengendalian hawar pelepah padi yang umum digunakan adalah dengan penggunaan varietas unggul, kultur teknis (budidaya yang baik, sanitasi, dan rotasi tanaman), mekanis, dan secara kimiawi. Akan tetapi, teknik pengendalian ini kurang efektif dan efisien, kemudian didukung dengan belum tersedianya varietas yang tahan terhadap serangan penyakit ini. Hal ini didukung oleh penelitian Rustam (2012) yang menunjukkan bahwa sekitar 14 varietas padi rentan terserang penyakit ini. Oleh sebab itu, perlu dicari pengendalian alternatif yang dapat mengendalikan hawar pelepah padi secara optimal dan efektif tanpa menyebabkan terjadinya kerusakan lingkungan. Pengendalian alternatif yang sekarang banyak dikembangkan adalah pengendalian hayati yang menggunakan agen hayati.
Mekanisme penghambatan agen hayati terhadap patogen tanaman meliputi antibiosis, kompetisi, parasitisme, enzim pendegradasi dinding sel, dan induksi ketahanan (resistensi) terhadap patogen. Agen hayati yang dapat digunakan sebagai alternatif pengendalian adalah R. pickettii. R. pickettii adalah bakteri yang sering digunakan untuk bioremediasi daerah pertambangan dan beberapa polutan pada tanah (Park et al. 2003). Menurut Rustam (2012), R. pickettii dapat mengendalikan pertumbuhan R. solani.
Kemampuan suatu agen hayati dalam penghambatan pertumbuhan patogen dapat ditingkatkan dengan berbagai macam cara. Salah satu cara adalah dengan menggunakan transposon mutagenesis. Transposon mutagenesis adalah suatu proses perpindahan elemen genetik dari satu lokus dalam suatu kromosom, plasmid, atau genom virus, ke bagian lain dari kromosom yang sama atau bahkan ke suatu lokus dalam kromosom lain yang menyebabkan perubahan dalam organisme tersebut (Yuwono 2005). Transposon mutagenesis ini belum banyak digunakan dalam dunia pertanian. Transposon pUT Mini-Tn5Km1 adalah salah satu jenis transposon pada prokariot khusus Escherichia coli yang digunakan dalam penelitian. Transposon mutagenesis pUT Mini-Tn5Km1 pada R. pickettii belum banyak diketahui potensinya. Oleh karena itu, perlu dilakukan penelitian tentang hal ini.
Tujuan Penelitian
Penelitian ini bertujuan untuk meningkatkan kemampuan antagonis R. pickettii terhadap R. solani dengan teknik transposon mutagenesis.
Manfaat Penelitian
Penelitian ini diharapkan dapat memperoleh transkonjugan R. pickettii yang dapat digunakan sebagai agen hayati R. solani. Selain itu, Penelitian ini dapat bermanfaat bagi perkembangan ilmu pengetahuan khususnya pada bidang pertanian.
Potensi Ralstonia pickettii
Berdasarkan klasifikasinya, R. pickettii berasal dari Kingdom Bakteria dengan Filum Proteobakteria, Kelas Beta Proteobakteria, Ordo Burkholderiales, Famili Ralstoniaceae, dan Genus Ralstonia. Beberapa strain bakteri jenis ini banyak berperan sebagai pendegradasi bahan-bahan berbahaya pada daerah pertambangan (bioremediasi tambang) yang mengalami pencemaran bahan berbahaya tersebut (Fishman et al. 2004).
Beberapa peneliti telah melaporkan bahwa bakteri ini dapat melakukan proses degradasi beberapa senyawa beracun meliputi benzena, meta-cresol, ortho-cresol, para-ortho-cresol, nitrobenzena, trikloroetilen, dan lain-lain (Ryan et al. 2007). Penelitian sebelumnya yang dilakukan oleh Fishman et al. (2004), menyebutkan bahwa R. pickettii dapat menghidroksilasi toluena dengan menggunakan enzim yang dimilikinya yaitu Toluena para-monooksigenase.
Dalam dunia pertanian, penelitian bakteri R. pickettii mulai banyak diaplikasikan. Burkholderia pickettii (sekarang R. pickettiii) telah diisolasi dari perakaran Melon. Kemudian, bakteri ini diuji coba dengan menggunakan metode Tn5-mutagenesis. Trankonjugan B. pickettii terhambat dalam produksi pektinase ekstraseluler. Akan tetapi, transkonjugan ini memiliki ketahanan lebih tinggi jika dibandingkan dengan perlakuan gabungan tipe liarnya dan transkonjugannya pada tanah liat yang ditumbuhi oleh Melon (Ikeda et al. 1998).
R. pickettii dapat mendegradasi bahan herbisida Sulfentrazon, menurut laporan adalah salah satu jenis herbisida sistemik dan persisten pada beberapa tanah yang ada di Negara Brazil khusus pada tanah jenis Hapludoks (Martinez et al. 2008). Selain itu, berdasarkan penelitian Rustam (2012), R. pickettii adalah salah satu jenis bakteri yang dapat mengendalikan R. solani.
Penyakit Hawar Pelepah Padi
Penyakit ini disebabkan oleh R. solani. R. solani memiliki bentuk telomorf Tanatephorus cucumeris. T. cucumeris diklasifikasikan ke dalam kelompok cendawan Filum Basidiomycota; Kelas basidiomysetes; Ordo Ceratobasidiales; dan Genus Tanatephorus (Agrios 2005).
R. solani adalah spesies yang paling banyak diketahui dan dipelajari di seluruh dunia dari genus Rhizoctonia. Pada awalnya, cendawan jenis ini dideskripsikan oleh Julius Kuhn pada pertanaman kentang pada tahun 1858. R. solani adalah basidiomiset tular tanah yang tersebar luas dengan biologi yang kompleks. Cendawan jenis ini memiliki cara yang sangat merusak sebagai parasit nonobligat karena dapat menyebabkan nekrosis dan mati rebah pada banyak spesies yang menjadi inangnya. Selain itu, ketiadaan konidia dan kelangkaan dari spora seksual, R. solani hidup sebagai hifa dan sklerotia di alam (Lehtonen 2009).
Hawar pelepah merupakan penyakit penting pada tanaman padi. Penyakit ini merusak pelepah, sehingga untuk menemukan dan mengenali penyakit, perlu dibuka kanopi pertanaman. Penyakit ini menyebabkan tanaman menjadi mudah rebah, semakin awal terjadi kerebahan, semakin besar kehilangan yang diakibatkannya. Selain itu, penyakit ini menyebabkan gabah kurang terisi penuh atau bahkan hampa. Hawar pelepah terjadi umumnya pada saat tanaman mulai membentuk anakan sampai menjelang panen. Namun demikian, penyakit ini juga dapat terjadi pada tanaman muda (Puslitbang TP 2007).
Menurut Ou (1985), gejala yang muncul ketika tanaman padi terserang oleh hawar pelepah daun yaitu berupa bercak-bercak pada pelepah daun. Pada mulanya, bercak berbentuk elips atau oval, bentuk tidak beraturan, berwarna abu-abu kehijauan, dan berukuran sekitar 1-3 cm. Pada bagian tengah, gejala berwarna putih keabu-abuan, dengan tepi berwarna cokelat. Semakin tua usia penyakit pada gejala tersebut akan terbentuk sklerotia yang ketika disentuh akan mudah lepas dan jatuh ke sekitar pertanaman padi. Pertumbuhan dan perkembangan penyakit ini tergantung kondisi lingkungan. Kondisi lingkungan yang lembab akan semakin meningkatkan pertumbuhan miselia pada pertanaman padi yang terserang patogen ini.
panas dan lembab. Penyakit ini juga dapat berkembang dengan baik jika pada lahan mengandung pupuk fosfat yang tinggi, tetapi perkembangan penyakit dapat dihambat dengan pemberian pupuk kalium. Terdapat sekitar 14 varietas padi yang telah diujikan ternyata rentan terhadap serangan penyakit hawar pelepah padi (Rustam 2012).
Transposon Mutagenesis pUT Mini-Tn5Km1
Transposisi adalah suatu proses perpindahan elemen genetik dari satu lokus dalam suatu kromosom, plasmid, atau genom virus, ke bagian lain kromosom yang sama, atau bahkan ke suatu lokus dalam kromosom lain. Elemen genetik yang berpindah tersebut dapat berupa satu gen atau beberapa gen bertautan (linkage) dan dikenal sebagai elemen genetik yang dapat bertransposisi (transposable genetic element), atau sering juga disebut transposon (Yuwono 2005).
Transposon mutagenesis pUT Mini-Tn5Km1 adalah salah satu jenis transposon pada prokariot khususnya Escherichia coli. Ini merupakan salah satu dari empat kelompok elemen genetik yang dapat bertransposisi, yaitu: transposon komposit (diberi symbol Tn), yaitu suatu transposon yang selain membawa fungsi transposisi, juga membawa gen lain, misalnya gen ketahanan terhadap antibiotik (Watson et al. 1987; Yuwono 2005).
Transposon mutagenesis telah digunakan dalam dunia bioteknologi pertanian saat ini, contohnya adalah, Bradyrhizobium japonicum adalah bakteri yang diberi perlakuan transposon mutagenesis dan dapat toleran terhadap tanah yang memiliki kadar asam dan beraluminium tinggi (Astuti et al. 2006). Pada pengujian di rumah kaca, transkonjugan B. japonicum memiliki viabilitas dan 6
[image:53.595.114.502.80.515.2]efektivitas simbiotik dengan varietas kedelai uji yang lebih baik jika dibandingkan tipe liarnya. Bj 11(9) merupakan transkonjugan pilihan untuk dijadikan untuk pupuk hayati karena memiliki viabilitas dan efektivitas simbiotik tertinggi setelah penyimpanan (Handayani 2009).
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Bakteriologi Tumbuhan Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Waktu pelaksanaan pada bulan Desember 2011 hingga September 2012.
Peremajaan Isolat
Isolat bakteri R. pickettii TT47 (isolat koleksi Laboratorium Bakteriologi Tumbuhan, Proteksi Tanaman, IPB) dibiakkan pada media Luria Agar (LA) (Pancreatic Digest of Casein 10 g, NaCl 5 g, Yeast Extract 5 g, agar 15 g, aquades 1 L) pada pH 7 dalam kondisi suhu ruangan. Isolat E. coli S17-1λpir (koleksi dari Laboratorium Mikrobiologi, Departemen Biologi, IPB) dibiakkan juga pada media LA yang ditambahkan antibiotik kanamisin dan ampisilin dengan konsenterasi masing-masing 50 µg/ml. Selanjutnya, isolat R. solani (isolat koleksi Laboratorium Bakteriologi Tumbuhan, Proteksi Tanaman, IPB) ditumbuhkan pada media Potato Dextrose Agar (PDA) (dextrose 20 g, kentang 200 g, agar 15 g, aquades 1 L). Baik E. coli S17-1λpir dan R. solani ditumbuhkan pada suhu ruangan dengan pH 7.
Pengujian Antagonisme R. pickettii terhadap R. solani
Keterangan: R1= panjang pertumbuhan miselium cendawan ke arah bakteri; R2= panjang
pertumbuhan miselium cendawan ke arah berlawanan bakteri menuju tepi cawan.
Uji Sensitivitas R. pickettii terhadap Antibiotik Kanamisin
Satu loop koloni R. pickettii ditumbuhkan pada Luria Broth (LA tanpa agar) dengan pH 7 dan diinkubasi pada mesin shaker dengan kecepatan 100 rpm selama 24 jam. Sebanyak 100 µl R. pickettii disebar secara merata pada LA. Kertas saring steril direndam selama 15 menit di dalam kanamisin dengan konsenterasi 50 µg/ml. Selanjutnya, kertas saring diangkat dengan pinset dan dikeringanginkan beberapa saat, kemudian diletakkan di LA. Biakan diinkubasi pada suhu ruangan selama 24 jam dan diamati zona penghambatan yang ditunjukkan dengan terbentuknya zona bening.
Keterangan:
A = koloni R. solani
B = koloni R. pickettii
R1 = panjang pertubuhan miselium ke arah bakteri
R2 = panjang miselium ke arah
berlawanan dengan bakteri menuju
ke tepi cawan.
A
B
C Keterangan:
A ( ) = hamparan koloni R. pickettii pada media LA
[image:56.595.94.521.105.827.2]B ( ) = cakram yang telah direndam kanamisin C ( ) = zona bening yang terbentuk
Gambar 2 Uji antibiosis R. pickettii terhadap R. solani dengan metode dual culture.
Gambar 3 Uji sensitivitas R. pickettii terhadap antibiotik kanamisin. A
B
Mutagenesis R. pickettii dengan Transposon pUT Mini-Tn5Km1
Transposon mutagenesis dilakukan dengan metode konjugasi antara bakteri antagonis R. pickettii sebagai resipien (penerima) dengan E. coli S17-1λpir yang merupakan pembawa plasmid pUT Mini-Tn5Km1 sebagai donor (Wahyudi et al. 1998). Bakteri R. pickettii ditumbuhkan selama 24 jam (pH 7, suhu ruangan, 100 rpm) pada LB hingga konsentrasi sel menjadi 1.5 × 108 cfu/ml. Sel R. pickettii dipanen dengan cara disentrifugasi selama 8 menit, kecepatan 10 000 rpm dengan suhu 20ᴼC. Setelah itu, supernatan dibuang dan dicuci dengan NaCl 0.85% sebanyak 3 kali. E. coli S17-1λpir ditumbuhkan pada LB yang telah ditambahkan kanamisin dan ampisilin dengan konsenterasi 50 µg/ml selama 24 jam hingga diperoleh konsentrasi sel 4.08 × 1010 cfu/ml (pH 7, suhu ruangan, 100 rpm). Pemanenan dan pencucian sel dilakukan sama seper