HUBUNGAN ANTARA INHIBITOR ENZIM PADA SENGON
DENGAN PERTUMBUHAN LARVA BOKTOR DALAM
ARTIFICIAL DIET
LAURA FLOWRENSIA
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
HUBUNGAN ANTARA INHIBITOR ENZIM PADA SENGON
DENGAN PERTUMBUHAN LARVA BOKTOR DALAM
ARTIFICIAL DIET
LAURA FLOWRENSIA
Skripsi
Sebagai salah satu syarat untuk memperoleh
gelar Sarjana Kehutanan pada Fakultas Kehutanan
Institut Pertanian Bogor
DEPARTEMEN SILVIKULTUR
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
RINGKASAN
LAURA FLOWRENSIA. E 44062426. Hubungan antara Inhibitor Enzim pada Sengon dengan Pertumbuhan Larva Boktor dalam Artificial Diet.
Dibimbing oleh Dr. Ir. ULFAH JUNIARTI SIREGAR, M. Agr. Dan Dr. Ir. NOOR FARIKHAH HANEDA, M.Sc
PENDAHULUAN. Sengon (Paraserianthes falcataria (L) Nielsen) merupakan jenis tanaman yang banyak digunakan dalam program penghijauan maupun pembangunan Hutan Rakyat sebagai kayu pertukangan, peti kemas, korek api serta bahan baku industri pulp dan kertas. Salah satu masalah terbesar dalam pengusahaan hutan sengon adalah adanya serangan boktor (Xystrocera festiva Pascoe). Dalam pencernaan boktor terdapat enzim trypsin dan alfa-amylase. Sementara itu dalam pohon sengon juga terdapat senyawa yang bersifat inhibitor terhadap enzim trypsin dan alfa-amylase yang terdapat pada penceranaan boktor. Aktivitas inhibitor tersebut diduga menjadi sarana tanaman sengon untuk bertahan dan resisten terhadap serangan hama boktor. Untuk memastikan hal itu diperlukan penelitian tentang hubungan antara trypsin inhibitor dan alfa-amylase inhibitor sengon terhadap perkembangan larva boktor pada artificial diet. Penelitian ini bertujuan untuk mengetahui hubungan aktivitas trypsin inhibitor dan aktivitas alfa-amylase inhibitor sengon dengan pertumbuhan larva boktor berukuran kecil (±1,5 cm) dan besar (±3 cm) dalam artificial diet.
METODOLOGI. Bahan penelitian berupa serbuk batang dan kulit pohon sengon provenan Kediri dan Solomon dengan kondisi sehat dan sakit, yang sudah melalui proses freeze dry. Larva boktor berukuran kecil (±1,5 cm) dan besar (±3 cm) dimasukkan ke dalam tabung reaksi yang telah berisi makanan buatan (artificial diet) yang mengandung serbuk batang dan kulit sengon untuk mempertahankan hidup dari larva di luar habitat alaminya. Parameter pertumbuhan larva (berat, diameter kepala, panjang dan konsumsi pakan larva) diamati dua minggu sekali. Data aktivitas trypsin inhibitor dan alfa-amylase inhibitor didapatkan dari analisis biokimia serbuk kulit dan serbuk batang sengon menggunakan spektrofotometer. Dua macam data, yaitu pertumbuhan larva boktor pada artificial diet dikorelasikan dengan aktivitas kedua enzim inhibitor dengan korelasi Pearson menggunakan software Microsoft Excel 2007.
HASIL DAN PEMBAHASAN. Hasil percobaan menunjukkan bahwa tidak semua korelasi enzim inhibitor pada bagian dan kondisi pohon dengan parameter pertumbuhan larva selalu negatif. Total korelasi pada bagian dan kondisi pohon ditemukan 35 korelasi positif dan 29 korelasi negatif. Pada kondisi pohon sehat dengan aktivitas trypsin inhibitor yang tinggi sehingga tidak diminati larva boktor ukuran kecil dan berlaku hal yang sebaliknya pada kondisi pohon sakit. Sedangkan kondisi pohon sehat mempunyai aktivitas alfa–amylase inhibitor tinggi tidak diminati larva boktor ukuran besar, dan berlaku hal yang sebaliknya pada kondisi pohon sakit. Korelasi negatif antara aktivitas trypsin inhibitor dengan perkembangan larva boktor lebih baik diamati dengan menggunakan larva ukuran kecil, sedangkan untuk alfa–amylase inhibitor lebih baik diamati dengan menggunakan larva ukuran besar.
SUMMARY
LAURA FLOWRENSIA. E 44062426. Correlation of Enzyme Inhibitor Activity in Sengon with Boktor Larval Growth on Artificial Diet.Supervised by Dr. Ir. ULFAH JUNIARTI SIREGAR, M. Agr. and Dr. Ir. NOOR FARIKHAH HANEDA, M.Sc
INTRODUCTION. Sengon (Paraserianthes falcataria (L) Nielsen) is widely planted for reforestation programs, especially in establishment of community forest as its timber is utilized for constrction, package box, lighter as well as raw material of pulp and paper. However, there is main problem in sengon plantation, which is boktor (Xystrocera festiva Pascoe) pest attact. In the midgut of boktor larvae it was detected trypsin and α-amylase enzymes activity. Whereas on sengon tree it was reported contains inhibitory substance against trypsin and α-amylase enzymes of boktor larvae. The inhibitory activity was assumed as defense mechanism of sengon tree against the pest attack. In order to clarify the assumption an investigation on the correlation between trypsin and α-amylase inhibitor of sengon with larval growth on an artificial diet is necessary. The experiments aimed at obtaining correlations between the activities of trypsin and α-amylase inhibitors of sengon tree with the growth of boktor larvae, with small (±1,5 cm) and big sizes (±3 cm) on an artificial diet containing respective sengon tree materials.
METHODOLOGY. Plant material used was the wood and the bark of sengon trees made into powder by freeze drying. Two provenances were selected, i.e Kediri and Solomon, consisted of two conditions each i.e. healthy and heavily infested. Both small (±1,5 cm) and big sizes (±3 cm) of boktor larvae were put in a big test tubes filled with artificial diet, which contained powder of sengon wood and bark, as their main feed outside their natural habitat. Larvae growth parameters (weight, head diamaters, length and diet consumption) were observed and measured every two weeks. Data on trypsin
and α-amylase inhibitors was obtained from biochemical analysis of wood and bark powders using a spectrophotometer. Two kinds of data, larval growth parameters and inhibitors activities, were then correlated using Pearson correlation in Microsoft Excel 2007.
RESULTS AND CONCLUSION. Result of the experiments showed that correlation obtained between inhibitor activities of each tissue of each condition and corresponding larvae growth parameters was not all negative, as espected. Out of 64 observations about 35 are positive and about 29 are negatively correlated. In a healthy tree with high trypsin inhibitor activity small size boktor larvae do not prefer attacking. On the contrary similar larvae prefer heavily infested tree with low inhibitor activity. Healthy tree with high α -amylase inhibitor activity will be saved from big size boktor larvae preferences. The opposite accurs on heavily infested tree with low inhibitor activity, which is preferred by big size larvae. In order to obtain negative correlation for trypsin inhibitor it was suggested to do similar experiments using small size larvae, while for α-amylase inhibitor it was suggested using big size larvae.
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi berjudul “Hubungan antara Inhibitor Enzim pada Sengon dengan Pertumbuhan Larva Boktor dalam Artificial
Diet” adalah benar-benar hasil karya saya sendiri dengan bimbingan dosen
pembimbing dan belum pernah digunakan sebagai karya ilmiah pada perguruan
tinggi atau lembaga manapun. Sumber informasi atau kutipan yang berasal dari
karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan
dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor, Maret 2011
Laura Flowrensia
Judul Skripsi : Hubungan antara Inhibitor Enzim pada Sengon dengan
Pertumbuhan Larva Boktor dalam Artificial Diet
Nama : Laura Flowrensia
NRP : E 44062426
Menyetujui
Pembimbing
Ketua, Anggota,
Dr. Ir. Ulfah Juniarti Siregar, M.Agr Dr. Ir. Noor Farikhah Haneda, M.Sc
NIP. 19580606 198303 2 001 NIP. 19660921 199003 2 001
Mengetahui
Ketua Departemen Silvikultur Fakultas Kehutanan Institut Pertanian Bogor
Prof. Dr. Ir. Bambang Hero Saharjo, M. Agr
NIP. 19641110 199002 1 001
RIWAYAT HIDUP
Penulis dilahirkan di Padang, Sumatra Barat pada
tanggal 29 Oktober 1988 ebagai anak pertama dari dua
bersaudara, dari pasangan Azwir Zen dan Asmiati. Penulis
memulai jenjang pendidikan formal di Taman Kanak-Kanak
Pertiwi III Padang, Sekolah Dasar Negeri No. 01 dan Sekolah
Dasar Negeri No. 23 Padang. Kemudian dilanjutkan di SLTP
N 7 Padang dan melanjutkan pendidikan menengah atas di
SMU Negeri 2 Padang (2003-2006).
Pada tahun 2006 penulis lulus Undangan Seleksi Masuk IPB (USMI) di
Institut Pertanian Bogor dan mendapatkan kesempatan untuk menekuni mayor
Departemen Silvikultur Fakultas Kehutanan.
Selama menuntut ilmu di Fakultas Kehutanan,Institut Pertanian Bogor,
penulis aktif di organisasi mahasiswa, sebagai anggota divisi Infokom TGC (Tree
Grower Community) Fakultas Kehutanan untuk periode 2009-2010.
Penulis juga mengikuti Praktek Pengenalan Ekosistem Hutan (PPEH) di
Cilacap dan Baturaden pada tahun 2008, Praktek Pengelolaan Hutan (PPH) di
Hutan Pendidikan Gunung Walat (HPGW) tahun 2009 serta Praktek Kerja Lapang
di Dinas Kehutanan dan Perkebunan Provinsi Aceh tahun 2010.
Untuk memperoleh gelar sarjana Kehutanan IPB, penulis menyelesaikan
skripsi dengan judul Hubungan antara Inhibitor Enzim pada Sengon dengan
KATA PENGANTAR
Syukur yang tak hingga penulis ucapkan kepada Allah SWT atas berkah
dan hidayahNya serta shalawat dan salam kepada Nabi Muhammad SAW
sehingga penulis dapat menyelesaikan karya ilmiah.Tema yang dipilih dalam
penelitian yang dilaksanakan pada bulan Agustus 2009 hingga Juni 2010 adalah
trypsin inhibitor dan alfa-amylase inhibitor pohon sengon terhadap artificial diet
boktor, dengan judul Hubungan antara Inhibitor Enzim pada Sengon dengan
Pertumbuhan Larva Boktor dalam Artificial Diet.
Dalam penyusunan karya ilmiah ini penulis memperoleh begitu banyak
bantuan dan dukungan berbagai pihak. Untuk itu dalam kesempatan ini penulis
penulis menyampaikan penghargaan dan rasa terimakasih kepada :
1. Mama, Papa, Dipo dan om Zal atas doa dan kasih sayang yang selalu
mengalir, memberi semangat dan nasehat membangun yang tiada henti
mengisi hari-hari dalam kehidupan penulis.
2. Ibu Dr. Ir. Ulfah Juniarti Siregar, M.Agr dan Dr. Ir. Noor Farikhah Haneda,
M.Sc selaku dosen pembimbing untuk kesempatan yang diberikan serta
bimbingan, arahan, dan kesabarannya mulai dari perencanaan penelitian,
hingga penyusunan tugas akhir ini sehingga penulis dapat menyelesaikannya
dengan baik.
3. Seluruh dosen dan staff Departemen Silvikultur untuk ilmu yang telah
diberikan serta kerjasama selama penyusunan tugas akhir ini.
4. Bundo, Puti, Ayu, Ega kak Tuti, teh Lia dan bu Elly atas dukungan dan
kerjasamanya selama penelitian berlangsung.
5. Sahabat terbaikku Rina, Puti, Fini, Yaya, Widya, Zaky, Nunu, Emon, Dita,
Riri, Anna, Dewi, kak Rifa, Asep, Surya dan Lana yang selalu siap membantu
dan keluarga besar Silvikultur 43 yang telah memberi semangat, dan keceriaan
serta tawa dalam setiap langkah penulis.
6. Teman-teman dan adik-adik pengobat stres : Mezi, Ria, Wandi, bg Aan,
Satelit 2 atas dan IPMM atas keceriaan yang telah memberi semangat selama
penyusunan tugas akhir ini.
7. Serta semua pihak yang tidak bisa disebutkan satu persatu yang telah
membantu penulis dalam pelaksanaan dan penyusunan tugas akhir ini.
Penulis menyadari bahwa masih banyak terdapat kekurangan dalam
penulisan skripsi ini, oleh karena itu saran dan kritik yang membangun sangat
penulis harapkan. Semoga skripsi ini dapat digunakan sebagai referensi untuk
kepentingan ilmu pengetahuan dan bermanfaat dalam pelaksanaan penelitian
berikutnya.
Bogor, Maret 2011
DAFTAR ISI
2.1 Tinjauan Umum Tentang Botani Sengon (Paraserianthes falcataria) ... 32.1.1 Taksonomi ... 3
2.1.2 Sifat Botani ... 3
2.1.3 Daerah Penyebaran dan Persyaratan Tempat Tumbuh... 4
2.1.4 Penanaman dan Pemeliharaan ... 4
2.1.5 Kegunaan Kayu Sengon ... 5
2.2 Hama Penggerek Batang Boktor (Xystrocera festiva Pascoe)... 5
2.2.1 Taksonomi ... 5
2.2.2 Morfologi ... 5
2.2.3 Perilaku, cara penyerangan dan bentuk kerusakan ... 6
2.2.4 Sistem pencernaan boktor ... 6
BAB III METODOLOGI PENELITIAN 3.1 Waktu dan Tempat ... 14 4.1 Korelasi Antara Aktivitas Trypsin Inhibitor Pada Sengon Dengan Pertumbuhan Larva Boktor Ukuran Kecil Dalam Artificial Diet ... 18
4.3 Korelasi Antara Aktivitas alfa-amylase Inhibitor Pada Sengon Dengan Pertumbuhan Larva Boktor Ukuran Kecil Dalam
Artificial Diet ... 25
4.4 Korelasi Antara Aktivitas alfa-amylase Inhibitor Pada Sengon Dengan Pertumbuhan Larva Boktor Ukuran Besar Dalam Artificial Diet ... 28
4.5 Rekapitulasi Korelasi Antara Enzim Inhibitor Pada Sengon Dengan Pertumbuhan Larva Dalam Arificial Diet ... 32
BAB V KESIMPULAN DAN SARAN 5.1 Kesimpulan ... 37
5.2 Saran ... 37
DAFTAR PUSTAKA ... 38
DAFTAR TABEL
No. Halaman
1. Komposisi Artificial Diet ... 15 2. Sampel yang digunakan dalam artificial diet ... 16 3. Rata-rata pengukuran larva boktor pada akhir pengamatan dalam
artificial diet ... 17 4. Rataan nilai aktivitas enzim inhibitor Trypsin Unit Inhibited dan
Alfa-amylase Unit Inhibited ... 18 5. Korelasi antara aktivitas Trypsin inhibitor dengan
parameter pertumbuhan larva kecil dalam artificial diet ... 19 6. Korelasi antara aktivitas Trypsin inhibitor pada bagian dan
kondisi pohon sengon dengan parameter pertumbuhan larva
besar dalam artificial diet ... 22 7. Korelasi antara aktivitas Alfa-amylase dengan parameter
pertumbuhan larva kecil dalam artificial diet ... 25 8. Korelasi antara aktivitas Alfa-amylase Unit Inhibited
DAFTAR GAMBAR
No. Halaman
1. Histogram korelasi antara aktivitas Trypsin inhibitor pada batang sehat dengan parameter pertumbuhan larva ukuran kecil pada
batang sehat ... 19 2. Histogram korelasi antara aktivitas Trypsin inhibitor pada batang
sakit dengan parameter pertumbuhan larva ukuran kecil pada
batang sakit ... 20 3. Histogram korelasi antara aktivitas Trypsin inhibitor pada kulit
sehat dengan parameter pertumbuhan larva ukuran kecil pada
kulit sehat. ... 20 4. Histogram korelasi antara aktivitas Trypsin inhibitor pada kulit
sakit dengan parameter pertumbuhan larva ukuran kecil pada
kulit sakit. ... 21 5. Histogram korelasi antara aktivitas Trypsin inhibitor pada batang
sehat dengan parameter pertumbuhan larva ukuran besar pada
batang sehat. ... 23 6. Histogram korelasi antara aktivitas Trypsin inhibitor pada batang
sakit dengan parameter pertumbuhan larva ukuran besar pada
batang sakit. ... 23 7. Histogram korelasi antara aktivitas Trypsin inhibitor pada batang
sehat dengan parameter pertumbuhan larva ukuran besar pada
kulit sehat. ... 24 8. Histogram korelasi antara aktivitas Trypsin inhibitor pada kulit
sakit dengan parameter pertumbuhan larva ukuran besar pada
kulit sakit. ... 25 9. Histogram korelasi antara aktivitas alfa-amylase inhibitor pada
batang sehat dengan parameter pertumbuhan larva ukuran kecil
pada batang ... 26 10. Histogram korelasi antara aktivitas alfa-amylase inhibitor pada
batang sakit dengan parameter pertumbuhan larva ukuran kecil
pada batang sehat ... 27 11. Histogram korelasi antara aktivitas alfa-amylase inhibitor pada
kulit sehat dengan parameter pertumbuhan larva ukuran kecil
pada kulit sehat ... 27 12. Histogram korelasi antara aktivitas alfa-amylase inhibitor pada
kulit sakit dengan parameter pertumbuhan larva ukuran kecil
pada kulit sakit ... 28 13. Histogram korelasi antara aktivitas alfa-amylase inhibitor pada
batang sehat dengan parameter pertumbuhan larva ukuran besar
pada batang sehat ... 29 14. Histogram korelasi antara aktivitas alfa-amylase inhibitor pada
batang sakit dengan parameter pertumbuhan larva ukuran besar
pada batang sakit ... 30 15. Histogram korelasi antara aktivitas alfa-amylase inhibitor pada
pada kulit sehat. ... 31 16. Histogram korelasi antara aktivitas alfa-amylase inhibitor pada
kulit sakit dengan parameter pertumbuhan larva ukuran besar
pada kulit sakit. ... 31 17. Rekapitulasi korelasi trypsin inhibitor pada pertumbuhan larva
ukuran kecil. ... 33 18. Rekapitulasi korelasi trypsin inhibitor pada pertumbuhan larva
ukuran besar. ... 34 19. Rekapitulasi korelasi alfa-amylase inhibitor pada pertumbuhan
larva ukuran kecil. ... 34 20. Rekapitulasi korelasi alfa-amylase inhibitor pada pertumbuhan
DAFTAR LAMPIRAN
No. Halaman
1. Rataan nilai inhibitor dan parameter perkembangan larva boktor pada masing-masing sampel. ... 42 2. Korelasi antara aktivitas Trypsin inhibitor pada bagian dan kondisi
pohon sengon dengan parameter pertumbuhan larva kecil dalam
artificial diet ... 45 3. Korelasi antara aktivitas Trypsin inhibitor pada bagian dan kondisi
pohon sengon dengan parameter pertumbuhan larva besar dalam
artificial diet ... 45 4. Korelasi antara aktivitas Alfa-amylase inhibitor pada bagian dan
kondisi pohon sengon dengan parameter pertumbuhan larva kecil dalam artificial diet ... 45 5. Korelasi antara aktivitas Alfa-amylase inhibitor pada bagian dan
BAB I
PENDAHULUAN
1.1 Latar Belakang
Sengon (Paraserianthes falcataria (L) Nielsen) merupakan jenis tanaman yang banyak digunakan dalam program penghijauan maupun pembangunan Hutan
Rakyat. Jenis kayu ini banyak digunakan sebagai bahan baku korek api, kayu
pertukangan, peti kemas bahkan industri pulp dan kertas. Penanaman jenis ini
banyak diminati karena daur tidak terlalu panjang, harga kayu sengon relatif
membaik dan tanaman tidak terlalu menuntut persyaratan tempat tumbuh yang
sulit.
Bertambahnya luasan tanaman sengon dalam bentuk tegakan monokultur
memancing berkembangnya permasalahan hama dan penyakit, akibat ketersediaan
inang yang cukup dan adanya perubahan iklim mikro setempat. Populasi hama
menjadi sangat tinggi karena terdorong oleh tersedianya makanan yang sesuai,
yang ditanam oleh manusia dalam areal yang luas dan dilakukan secara
terus-menerus. Salah satu masalah terbesar dalam pengusahaan hutan sengon adalah
adanya seragan hama boktor (Xystrocera festiva Pascoe, Cerambycidae, Coleoptera). Hama ini menyerang batang sengon sejak tegakan berumur 3 ‒ 4 tahun, yang terjadi di Indonesia baik di pulau Jawa, Sumatra dan Kalimantan
ataupun di luar Indonesia yaitu Malaysia, Filipina dan Thailand (Ahmadi 2008).
Larva boktor (X. festiva Pascoe) yang baru menetas akan segera memakan kulit bagian dalam dan bagian luar dari kayu gubal (Ahmadi 2008).
Prasetya (2007) menyebutkan bahwa dalam pencernaan boktor
terdapattenzim trypsin dan alfa-amylase. Enzim trypsin berperan dalam memecah protein menjadi molekul yang lebih sederhana, kemudian diserap oleh sel. Enzim
alfa-amylase berperan dalam proses degradasi pati, sejenis makromolekul karbohidrat (Djati 2009). Enzim trypsin sangat aktif pada saat larva masih berukuran kecil (ukuran ± 1,5 cm) dimana pada masa ini larva sedang aktif
memakan kulit batang (Marta 2005). Aktivitas tertinggi enzim alfa-amylase
terdapat pada larva boktor yang berukuran ± 3,5 cm, pada saat larva bergerak dari
mengandung pati. Sementara dalam pohon sengon juga terdapat senyawa yang
bersifat inhibitor terhadap enzim trypsin dan alfa-amylase yang terdapat pada penceranaan boktor (Winarni 2003). Senyawa inhibitor memiliki aktivitas yang
berbeda-beda pada setiap bagian pohon sengon (Djati 2009).
Aktivitas senyawa inhibitor trypsin dan alfa-amylase menghasilkan nilai yang berbeda, bergantung pada kondisi pohon, bagian pohon, enzim yang
digunakan, dan faktor lainnya. Aktivitas inhibitor tersebut diduga menjadi sarana
tanaman sengon untuk bertahan dan resisten terhadap serangan hama boktor.
Untuk itu perlu dilakukan penelitian tentang hubungan trypsin inhibitor dan alfa-amylase inhibitor pada sengon dengan pertumbuhan dan perkembangan larva boktor dalam artificial diet. Pengaruh inhibitor terhadap kesukaan larva boktor perlu diuji langsung terhadap larva. Penelitian seperti ini sulit dilakukan di lapang,
karena sulitnya melakukan pengamatan, maka dalam penelitian ini digunakan
artificial diet. Artificial diet merupakan makanan buatan yang terdiri dari bahan alami dan bahan kimia dengan dosis tertentu yang dibuat untuk mempertahankan
hidup dari larva boktor di luar habitat alaminya. Informasi yang diperoleh dari
penelitian ini dapat membantu program pemuliaan untuk mendapatkan sengon
unggulan, yaitu yang mempunyai kandungan aktivitas trypsin inhibitor dan alfa-amylase inhibitor tinggi, yaitu sengon yang resisten terhadap serangan hama boktor.
1.2 Tujuan Penelitian
1. Mengetahui hubungan aktivitas trypsin inhibitor sengon dengan pertumbuhan larva boktor berukuran kecil dan besar dalam artificial diet. 2. Mengetahui hubungan aktivitas alfa-amylase inhibitor sengon dengan
pertumbuhan larva boktor berukuran kecil dan besar dalam artificial diet. 1.3 Manfaat Penelitian
Manfaat dari penelitian ini adalah memberi informasi tentang hubungan
trypsin inhibitor dan alfa-amylase inhibitor pohon sengon terhadap pertumbuhan dan perkembangan larva boktor dalam artificial diet. Informasi ini dapat digunakan dalam pemuliaan pohon untuk mendapatkan pohon sengon yang
resisten terhadap hama boktor, serta bahan referensi bagi dunia Entomologi,
BAB II
TINJAUAN PUSTAKA
2.1 Tinjauan Umum Tentang Botani Sengon (Paraserianthes falcataria)
2.1.1 Taksonomi
Divisi : Spermatophyta
Subdivisi : Angiospermae
Klas : Dicotyledoneae
Ordo : Rosales
Famili : Fabaceae
Subfamili : Mimosoideae
Genus : Paraserianthes
Nama Ilmiah : Paraserianthes falcataria (L) Nielsen
Nama Daerah : albasia, jeunjing (Jawa Barat), sengon laut (Jawa Tengah), sengon
sebrang (Jawa Timur), jing laut (Madura), tedehu pute (Sulawesi), rawe,
selawoku, merah, seka, sekah, tawasela (Maluku), bae, wahogon, wai, wikie (Irian
Jaya) (Atmosuseno 1998).
2.1.2 Sifat Botani
Pohon sengon memiliki ciri-ciri berbatang lurus, tidak berbanir, kulit
berwarna kelabu keputih-putihan, licin, tidak mengelupas dan memiliki tinggi
bebas cabang mencapai 20 m. Pertumbuhan sengon sangat cepat.
Pertumbuhannya selama 25 tahun dapat mencapai tinggi 45 m dengan diameter
batang mencapai 100 cm. Sengon memiliki tata daun mejemuk menyirip ganda
dengan anak daun yang kecil-kecil dan mudah rontok. Tajuk berbentuk perisai,
agak jarang dan selalu hijau. Tajuk yang agak jarang ini memungkinkan beberapa
jenis tanaman perdu tumbuh baik dibawahnya (Alrasjid 1973).
Pohon sengon berbunga sepanjang tahun dan berbuah pada bulan Juni -
November. Bunga tersusun dalam bulir atau sebagian besar bercabang malai,
sekitar 40.000 biji/kg atau 36.000 biji/liter, dan daya kecambahnya 80% dengan
perlakuan perendaman pada air mendidih selama 24 jam (Alrasjid 1973).
Sistem perakaran sengon banyak mengandung nodul akar sebagai hasil
simbiosis dengan bakteri Rhizobium. Hal ini sangat menguntungkan bagi tanah
disekitarnya. Keberadaan nodul akar dapat membantu porositas tanah dan
penyediaan unsur nitrogen dalam tanah. Sehingga pohon sengon dapat
menyebabkan tanaman disekitarnya lebih subur. Tanaman sengon digunakan
untuk penghijauan dan reboisasi, penyubur tanah dan daunnya sebagai pakan
ternak (Kwatrina et al. 2008).
2.1.3 Daerah Penyebaran dan Persyaratan Tempat Tumbuh
Pohon sengon ditemukan tumbuh secara alami di Kepulauan Maluku,
Toampala (Sulawesi Selatan) dan Irian Jaya dan pada tahun 1871 mulai ditanam
di Pulau Jawa. Di luar Indonesia, pohon sengon telah ditanam di Serawak,
Brunai, Kepong, Sri Lanka, dan India (Alrasjid 1973).
Sengon tumbuh baik di daerah yang terletak antara 100 LS ‒ 30 LU yang memiliki 15 hari hujan dalam 4 bulan kering. Suhu udara yang diperlukan untuk
pertumbuhan optimum berkisar 22 ‒ 29 0C. Tempat tumbuh terbaik adalah pada ketinggian 10 ‒ 800 mdpl. Curah hujan tahunan yang diinginkan pohon ini adalah 2.000 ‒ 2.700 mm, kelembaban udara yang dibutuhkan untuk tumbuh berkisar 50 ‒ 75%. Pohon ini dapat tumbuh pada tanah yang kurang subur (bonita 1) dengan drainase yang kurang baik. Sengon lebih menyukai topografi yang relatif datar,
namun pada keadaan tertentu sengon dapat ditanam pada areal bergelombang dan
miring dengan kemiringan lereng mencapai 25% (Primantoro 1991).
2.1.4 Penanaman dan Pemeliharaan
Penanaman sengon dilakukan setelah hujan lebat turun pada awal musim
penghujan, pada umumnya dalam bulan Oktober-Januari. Pengamatan mulainya
hujan lebat sangat perlu, karena bibit yang baru ditanam menghendaki banyak air
dan udara lembab. Kegiatan pemeliharaan terdiri dari penyulaman dan
penyiangan. Penyiangan dilakukan 2 ‒ 3 kali setahun sampai tanaman berumur 2 tahun. Pada tanaman yang berumur 3 ‒ 4 tahun, penyiangan dapat dilakukan 1 kali tiap tahun (Pradjadinata dan Masano 1989). Karena pertumbuhan pohon yang
berumur 2 tahun. Penjarangan dilakukan setiap tahun dan sesudah umur 10 tahun
penjarangan dilakukan 3 tahun sekali (Husaeni 2010).
2.1.5 Kegunaan Kayu Sengon
Kayu sengon banyak digunakan oleh penduduk Jawa Barat untuk bahan
perumahan (papan, balok dan tiang). Selain itu dapat juga dipakai untuk
pembuatan peti, vener, pulp, papan serat, papan partikel, korek api, dan kayu
bakar. Dahulu di Maluku kayu sengon biasa dipakai untuk perisai karena ringan
dan liat serta sukar ditembus (Martawijaya et al. 1989). 2.2 Hama Penggerek Batang Boktor (X. festiva Pascoe) 2.2.1 Taksonomi
X. festiva sering disebut uter-uter, boktor, wowolan kumbang serendang atau engkes-engkes, yang lebih umum adalah kumbang boktor. Hama ini adalah
hama yang paling merugikan pada tegakan pohon, yaitu menyerang jenis pohon
daun lebar dan daun jarum (konifer). Hama kulit pohon yang memakan bagian
dalam kulit pohon sering juga merusak kambium dan bagian luar kayu gubal.
Apabila kerusakan pada pohon sampai melingkar batang, maka aliran nutrisi dari
daun ke akar terganggu dan pohon akan mati (Puspitarini 2006).
Survei yang dilakukan pada awal tahun 60 ‒ an menunjukkan bahwa hama ini telah tersebar ke seluruh tegakan pohon di Pulau Jawa, mulai dari dataran
rendah sampai ketinggian ±1.000 mdpl, didaerah beriklim basah maupun kering.
Hama ini menyerang hampir di seluruh wilayah Indonesia. Hama ini juga
menyerang wilayah Malaysia dan Filipina (Notoatmodjo 1963).
2.2.2 Morfologi
Telur berbentuk lonjong dengan ukuran 2x1 mm, berwarna hijau
kekuning-kuningan sampai kuning, dilekatkan dengan zat perekat yang tak berwarna. Lama stadium telur adalah 15 ‒ 20 hari (Suratmo 1974). Larva berwarna kekuning-kuningan dan tidak bertungkai jelas. Larva yang baru keluar
dari telur berukuran 2x1 mm dan sewaktu akan menjadi pupa, larva tadi berukuran 50×9 mm (Notoatmodjo 1963). Lama stadium larva adalah 5 ‒ 6 bulan. Pupa berwarna putih kekuning-kuningan dengan ukuran 30×10 mm dan
dan lebar 7 ‒ 9 mm. Lama stadium imago jantan 2 ‒ 13 hari sedangkan betina 2 ‒ 7 hari (Suratmo 1974).
Seekor imago dapat meletakkan telurnya sampai 400 butir, telur diletakkan
saling melekat, karena direkatkan oleh semacam zat perekat tak berwarna yang
dihasilkan serangga betinanya, sehingga membentuk kelompok-kelompok telur.
Siklus hidup X. festiva pada makanan adalah 159 hari untuk kumbang jantan dan 193 hari untuk kumbang betina. Pada kondisi alami siklus hidup kumbang jantan
253 hari dan kumbang betina 250 hari (Husaeni 2010).
2.2.3 Perilaku, cara penyerangan dan bentuk kerusakan
Larva instar pertama berwarna kuning gading yang keluar mulai
menggerek kulit bagian dalam dan kayu muda secara bergerombolan ke arah
bawah. Bagian pohon yang digerek akan mengeluarkan cairan, sehingga akan
terlihat berwarna hitam atau coklat. Larva-larva yang baru menetas akan segera
memakan kulit bagian dalam dan bagian luar dari kayu gubal, membentuk saluran
sedalam 0,5 mm kearah bawah batang (Ahmadi 2008).
Serangan X. festiva pada tegakan sengon sudah terjadi sejak tegakan berumur 3 tahun, yaitu pada saat diameter batang 10 ‒ 12 cm dan tinggi pohon mencapai 16 m. Letak serangan (lubang gerek) pada pohon adalah mulai dari
pangkal batang sampai ketinggian lebih dari 10 m (Ahmadi 2008).
Tingkat serangan pada pohon ditandai dengan banyaknya lubang gerek,
lama kelamaan tajuk menguning dan pohon mati. Kerusakan pohon sengon
sebagai akibat gerekan larva sehingga kulit batang berlubang-lubang. Adanya
lubang gerek pada batang menyebabkan pohon menjadi lemah sehingga mudah
patah apabila ada tiupan angin yang kencang (Hawiati 1994).
Bubuk-bubuk gerekan tertinggal dalam lubang gerek dan sebagian keluar
dari lubang-lubang kulit atau kulit-kulit yang pecah. Saluran-saluran gerek ini
biasanya saling berhubungan (kontinyu) dan arahnya tidak beraturan (biasanya
vertikal). Semakin ke arah bawah saluran gerek ini semakin melebar, karena
ukuran larva yang memakannya semakin besar (Ahmadi 2008).
2.2.4 Sistem pencernaan boktor
Saluran pencernaan serangga terdiri dari tiga saluran pokok, yaitu : usus
proktodaeum. Usus belakang dan usus depan berasal dari jaringan ektoderm dan
dilapisi sebelah dalamnya oleh lapisan tipis kutikula yang disebut intima. Pada
saat pergantian kulit kutikula ini dikelupaskan bersama dengan bagian luar
eksoskeleton, sedangkan usus tengah tidak punya intima, maka tidak terjadi
pergantian kulit (Pasaribu 2008).
Pencernaan alami dari makanan terjadi di usus tengah dimana lapisan epitel
usus tengah terlibat dua fungsi, sekresi enzim-enzim pencernaan ke dalam
lumen-lumen dan penyerapan produk-produk penernaan ke dalam tubuh serangga. Usus
tengah merupakan tempat utama pencernaan dan penyerapan dalam saluran
pencernaan. Proses pencernaan makanan pada serangga terutama terjadi di dalam
midgut di mana sel-sel epitelium menghasilkan enzim-enzim pencernaan dan juga
menyerap makanan yang sudah dicerna (Pasaribu 2008).
2.2.5 Pengendalian Hama
Dalam Ahmadi (2008) pengendalian hama boktor dapat dilakukan secara
fisik, mekanik, hayati, kimiawi dan pengendalian terpadu.
A.Pengendalian secara fisik
1. Penangkapan kumbang dengan perangkap lampu terutama cahaya yang
berwarna hijau dan biru. Ketertarikan ini dapat dimanfaatkan untuk
pengendalian hama. Penangkapan dimulai dari jam 6 sore hari sampai jam
12 malam, pada hari cerah.
2. Pemusnahan kelompok telur boktor dilakukan dengan cara memeriksa
setiap larikan tanaman pada tegakan mulai berumur 3 tahun. Peletakan telur
boktor oleh kumbang betinanya dapat ditemukan pada celah-celah kulit atau
bagian-bagian batang pohon yang luka. Kesulitan utama dalam pemeriksaan
dan pemusnahan telur boktor ini adalah kelompok telur yang dapat diperiksa
terletak paling tinggi 2 m dari permukaan tanah.
3. Penyesetan kulit batang sengon yang terserang hama boktor dilakukan
setiap 3 bulan sekali. Suatu keuntungan bagi pengendalian hama ini adalah
larva-larva tadi tidak mempunyai kaki (tungkai). Bila kulit batang sengon
yang terserang diseset (dikelupas) maka kumpulan larva boktor tadi akan
B. Pengendalian secara mekanik
1. Penanaman pohon sengon resisten yaitu pohon sengon yang mempunyai
ketahanan yang tinggi terhadap serangan hama boktor, atau pohon itu tidak
(kurang) disukai oleh hama boktor, yang diharapkan dapat mencegah
serangan hama boktor, atau kalau diserang, tingkat serangannya cukup
rendah sehingga kerugian ekonomis dapat dihindarkan.
2. Pengaturan jarak tanam yang dapat dilakukan pada saat penanaman atau
dengan cara penjarangan. Untuk mencegah persaingan yang terlalu awal
pada tanaman muda, maka jarak tanamnya perlu diperlebar, misalnya 3×3 m
atau 4×3 m. Dari segi pengendalian hama boktor, jarak tanam yang lebih
lebar ini mempunyai keuntungan yaitu jumlah batang per hektar (berarti
jumlah makanan) menjadi sedikit, dan peluang kumbang untuk memperoleh
tempat peletakan telur lebih kecil.
3. Pembuatan tanaman campuran dengan memenuhi persyaratan jenis tanaman
tersebut pertumbuhannya sama cepat dengan sengon, atau jenis pohon yang
tahan naungan dan bertajuk rimbun. Sedangkan jenis pohon pencampur
mempunyai daur, kegunaan kayu yang sama dengan sengon, dan berperan
sebagai penghalang mekanis bagi penerbangan kumbang boktor (Ahmadi
2008). Kumbang boktor hanya mampu mencapai 3 ‒ 4 m dalam sekali
terbang dengan ketinggian terbang 0,5 ‒ 1 m, kadang-kadang juga mencapai
2 m dari permukaan tanah (Husaeni 2001).
4. Penjarangan tegakan pohon sengon yang terserang hama boktor harus
ditebang. Baik yang mengalami serangan awal (larva masih berada di antara
kulit dan kayu) maupun serangan lanjut (larva sudah menggerek ke dalam
kayu gubal atau larva telah berkepompong di dalam lubang gerek).
Bila penjarangan tegakan sengon dilaksanakan secara periodik sesuai
dengan jadwal penjarangannya, maka tingkat serangan hama boktor akan
dapat ditekan (Ahmadi 2008).
C. Pengendalian secara hayati
Musuh-musuh alami hama boktor ada yang menyerang telur, larva, pupa
patogen. Dua cara pengendalian hayati hama boktor telah dikaji keampuhannya
adalah dengan menggunakan parasit telur boktor dan jamur patogen larva.
1. Pelepasan parasit telur
Serangga parasit yang menyerang telur boktor adalah Anagyrus sp. yang tergolong famili Encyrtidae, ordo Hymenoptera. Anagyrus sp. telah terbukti cukup efektif dalam menekan serangan hama boktor. Secara alami
Anagyrus sp. ini biasa memparasit kelompok telur boktor dengan tingkat serangan (tingkat parasitasi) rata-rata 20% (Kasno dan Haneda 2010).
2. Penyemprotan dengan jamur pathogen Beauveria bassiana yaitu salah satu jamur patogen serangga yang dapat digunakan untuk pengendalian hama
yang tergolong bangsa kumbang, misalnya hama boktor (Husaeni 2001).
Pengendalian larva bokor dengan menggunakan B. bassiana sebaiknya dilakukan saat serangan hama tahap awal (gejala serangan awal). Pada saat
itu larva boktor masih muda dan masih berukuran kecil (Ahmadi 2008).
D. Pengendalian kimiawi
Pengendalian dengan menggunakan insektisida yang pertama kali dilakukan
oleh De Yong pada tahun 1931, yaitu dengan cara menyemprotkan
paradikhlorbensol (diencerkan dalam petroleum dengan perbandingan 1 : 10) pada permukaan kulit batang sengon yang diserang, insektisida ini dapat
mematikan larva yang masih berada di permukaan kayu gubal, tetapi tidak dapat
membunuh larva yang telah membuat lubang gerek pada kayu gubal. Walau
hasilnya memuaskan namun penggunaan insektisida ini dapat mematikan
kambium pohon (Ahmadi 2008).
E. Pengendalian secara terpadu
Strategi pengendalian hama secara terpadu adalah dengan memanfaatkan
cara-cara yang paling cocok dari semua metode pengendalian hama dalam suatu
kombinasi yang dapat diterapkan untuk mengatasi masalah hama. Pengendalian
hama terpadu tidak melarang atau meminimumkan penggunaan insektisida tetapi
hanya merubah cara, yaitu dari pemakaian untuk pencegahan atau penggunaan
2.3 Enzim dan Inhibitor
Enzim adalah satu atau beberapa gugus polipeptida (protein) yang
berfungsi sebagai katalis (senyawa yang mempercepat proses reaksi tanpa habis
bereaksi) dalam suatu reaksi kimia. Enzim bekerja dengan cara menempel pada
permukaan molekul zat-zat yang bereaksi dan dengan demikian mempercepat
proses reaksi. Percepatan terjadi karena enzim menurunkan energi pengaktifan
yang dengan sendirinya akan mempermudah terjadinya reaksi (Anonim 2010).
Kerja enzim dipengaruhi oleh beberapa faktor, terutama adalah substrat,
suhu, keasaman, kofaktor dan inhibitor. Tiap enzim memerlukan suhu dan pH
(tingkat keasaman) optimum yang berbeda-beda karena enzim adalah protein,
yang dapat mengalami perubahan bentuk jika suhu dan keasaman berubah. Di
luar suhu atau pH yang sesuai, enzim tidak dapat bekerja secara optimal atau
strukturnya akan mengalami kerusakan. Hal ini akan menyebabkan enzim
kehilangan fungsinya sama sekali. Kerja enzim juga dipengaruhi oleh molekul
lain (Anonim 2010).
Inhibitor adalah molekul yang menurunkan aktivitas enzim, sedangkan
aktivator adalah yang meningkatkan aktivitas enzim. Banyak obat dan racun
adalah inihibitor enzim. Berdasarkan cara kerjanya, inhibitor terbagi dua,
inhibitor kompetitif dan inhibitor nonkompetitif. Inhibitor kompetitif adalah
inhibitor yang bersaing aktif dengan substrat untuk mendapatkan situs aktif
enzim, contohnya sianida bersaing dengan oksigen dalam pengikatan Hb.
Sementara itu, inhibitor nonkompetitif adalah inhibitor yang melekat pada sisi
lain selain situs aktif pada enzim, yang lama kelamaan dapat mengubah sisi aktif
enzim. Semakin tinggi konsentrasi enzim akan semakin mempercepat terjadinya
reaksi. Dan konsentrasi enzim berbanding lurus dengan kecepatan reaksi. Jika
sudah mencapai titik jenuhnya, maka konsentrasi substrat berbanding terbalik
dengan kecepatan reaksi (Anonim 2009).
2.4 Trypsin Inhibitor
Trypsin inhibitor adalah suatu jenis protein yang dapat menghambat kerja enzim trypsin didalam tubuh, yang umumnya terdapat pada kedelai dan beberapa
ikatan kompleks antara kedua senyawa tersebut (interaksi potein-protein).
Interaksi tersebut menyangkut pemutusan ikatan antara arginin-isoleusin sehingga
menghambat bekerjanya enzim trypsin (Muchtadi 1993). Akibatnya mempersulit pelepasan asam-asam amino dari ikatan proteinnya sehingga tidak dapat diserap
(Prasetya 2007).
Faktor yang menentukan daya hambat dari inhibitor trypsin adalah konsentrasi enzim trypsin bebas yang terdapat dalam usus. Penurunan jumlah
trypsin bebas dalam usus (karena adanya interaksi dengan anti trypsin akan menstimulir aktivitas pangkreas untuk memproduksi lebih banyak enzim) untuk
mencapai tujuan ini maka akan terjadi pembesaran. Sebaliknya bila konsentrasi
enzim dalam usus kembali normal, aktivitas pangkreas tersebut akan dihambat.
Faktor yang menentukan daya hambat dari inhibitor trypsin adalah konsentrasinya. Dinyatakan bahwa daya hambat suatu inhibitor terhadap aktivitas
enzim typsin adalah berbanding lurus dengan jumlah inhibitor yang terdapat (Prasetya 2007).
2.5 Alfa-amylase Inhibitor
Inhibitor alfa-amylase adalah protein yang menghambat enzim amylase di dalam saluran pencernaan (midgut) serangga. Enzim amilase diperlukan
serangga, terutama serangga pemakan biji-bijian dan ubi yang kaya akan pati.
Pati ini harus dihidrolisis menjadi molekul karbohidrat yang lebih sederhana
(kecil) seperti disakarida dan monosakarida, agar dapat digunakan dalam sistem
metabolisme serangga. Dengan dihambatnya pemecahan pati oleh inhibitor alfa-amylase maka serangga tidak mendapatkan kebutuhan karbohidratnya, sehingga berakibat fatal bagi serangga tersebut (Bahagiawati 2005).
2.6 Artificial Diet
Artificial diet adalah suatu makanan yang asing bagi serangga dimana proses pembuatannya mengacu pada pendekatan kimia. Di dalam makanan buatan
ini terdapat komponen kimia dan komponen alami. Komponen alami dapat
dipenuhi oleh bagian tanaman seperti serbuk kayu, ekstrak biji, ekstrak daun dan
Awal perkembangan makanan buatan yaitu pada tahun 1976 dimana
Sande dan Knoke adalah orang pertama yang berhasil menakarkan hama kayu
Xyloborus ferrugineus dalam makanan buatan. Didalam makanan buatan tersebut terdapat berbagai macam bahan kimia maupun bahan alami, seperti serbuk kayu.
Komposisi bahan makanan yang dipakai terdiri dari sucrose (15 g), yeast extract
(10 g), casein (10 g), wheat (15 g), salt (1,3 g), agar (40 g), sawdust (150 g), air destilasi (1000 ml), ascorbic acid/vitamin C (2 g) dan streptomycin (0,7 g).
Ascorbic acid merupakan sumber vitamin C yang sangat dibutuhkan serangga dalam pertumbuhannya. Sedangkan yeast extract merupakan sumber protein untuk melengkapi kebutuhan nutrisinya dan meningkatkan aktivitas pembelahan
sel (Listyorini 2007).
Pada stadium larva, protein lebih dibutuhkan dalam pertumbuhannya.
Protein berguna bagi serangga untuk memproduksi sel jaringan dan pembentukan
enzim yang berarti bagi pertumbuhan serangga dan juga merangsang metabolisme
dalam tubuh serangga (Puspito 2002).
Singh (1977) mengatakan bahwa agar dan selulosa mutlak diperlukan
dalam pembuatan artificial diet. Agar dipergunakan sebagai pembentuk tekstur ransum untuk menyesuaikan dengan kebutuhan larva dan mampu mengikat
zat-zat aditif secara sempurna. Selanjutnya ditambahkan zat-zat gula (sukrosa) yang merupakan zat pembentuk tenaga dan proses kimia dalam serangga. Sementara
itu, zat pokok yang dibutuhkan adalah karbohidrat dan air. Karbohidrat diperoleh
dari selulosa dan kebutuhan air diperoleh dari aquades.
Soediaoetama (1987) menguraikan fungsi bahan-bahan kimia sebagai
nutrisi. Fungsi vitamin adalah sebagai zat pengatur proses fisiologis dan biokomia
tubuh melalui perannya sebagai koenzim dan kofaktor. Asam askorbik (vitamin
C) mudah larut dalam air dan juga berfungsi sebagai penangkal racun. Fungsi
karbohidrat sebagai sumber utama energi, pengatur metabolisme lemak dan
penghemat fungsi protein. Lemak berfungsi sebagai penghasil energi yang
dibutuhkan pembentuk struktur tubuh. Protein sebagai zat pembangun dan
pertumbuhan jaringan tubuh, serta pengatur fisiologis dan biologis tubuh. Natrium
(Na) berfungsi sebagai pengatur volume darah dan 30-40% berada di dalm tulang.
mineral makro yang sangat dibutuhkan makhluk hidup. Mg berfungsi untuk
struktur tulang, transmisi impuls saraf dan regulasi enzim.
Streptomycin dalam artificial diet berfungsi untuk mencegah timbulnya jamur dan mikroorganisme lain yang dapat merusak makanan. Keberhasilan suatu
makanan buatan dipengaruhi oleh beberapa faktor yaitu pengetahuan akan nutrisi,
komposisi kimia dan makanan alami, pengetahuan akan habitat dan perilaku
makanan (feeding behavior) dari spesies yang diamati (Singh 1977).
Menurut Singh (1977), ada empat prinsip yang harus diperhatikan untuk
mendapatkan artificial diet yang sempurna, yaitu:
1. Faktor fisik: tekstur, kekerasan, kandungan air,dan ukuran artificial diet
2. Faktor kimia: nutrisi dan kandungan bahan organik.
3. Keseimbangan nutrisi: nutrisi-nutrisi dalam artificial diet harus mempunyai peran masing-masing dan mempunyai hubungan antar nutrisi.
4. Kontaminasi mikroba: adanya kontaminasi dapat memerusak artificial diet
dan mikroba tersebut akan menjadi parasit bagi serangga.
Keuntungan dalam memelihara serangga dengan menggunakan makanan
buatan (artificial diet), yaitu bisa mendapatkan gambaran yang jelas akan perilaku dan asal-usul serangga. Adanya artificial diet memungkinkan dan memudahkan untuk menguji produk-produk serta bahan aktif tanaman yang bersifat
BAB III
METODOLOGI PENELITIAN
3.1 Tempat dan Waktu
Penelitian dilakukan di Laboratorium Entomologi Hutan, Departemen
Silvikultur, Fakultas Kehutanan, Institut Pertanian Bogor. Pelaksanaan penelitian
ini terhitung mulai dari Agustus 2009 ‒ Desember 2009. Penelitian Tripsin
Inhibitor dan Alfa-amylase inhibitor dimulai dari Agustus 2009 - Juni 2010 di Laboratorium PAU Institut Pertanian Bogor.
3.2 Bahan dan Alat
3.2.1 Bahan
Bahan dasar yang digunakan dalam penelitian artificial diet yaitu serbuk kulit dan batang kayu sengon dari provenan Solomon dan Kediri. Serbuk batang
dan serbuk kulit provenan Solomon diperoleh dari Persemaian Permanen, di
Pongpoklandak, KPH Cianjur. Sedangkan serbuk sengon provenan Kediri diambil
dari daerah Ngancar KPH Kediri, dengan kondisi masing-masing serbuk sengon
sehat dan sengon sakit yang telah diproses freeze dry. Bahan campuran lain yang digunakan adalah yeast extract, streptomycin, ascorbic acid (vitamin C), natrium benzoat, agar, sukrosa dan aquades. Larva yang digunakan ada 2 macam, yaitu larva boktor berukuran kecil (1 ‒ 1,5 cm) dan larva boktor berukuran besar (1,5 ‒ 3 cm). Data aktivitas enzim trypsin inhibitor dan alfa-amylase inhibitor didapatkan berupa data sekunder dari penelitian sebelumnya (Saimima 2010 dan
Yauvina 2010).
3.2.2 Alat
Alat yang digunakan dalam penelitian ini yaitu timbangan digital, kompor
listrik, kaliper digital, tabung reaksi dengan diameter 3×3 cm, gelas ukur,
refrigerator, oven, sendok pengaduk, sudip, cawan petri, toples, pinset, gunting, kain kasa, tisu, label, karet, piring, alat tulis dan kamera digital.
3.3. Metodologi Penelitian
3.3.1 Persiapan dan Pembuatan Artificial Diet
Persiapan penelitian ini meliputi pengambilan serbuk kayu sengon yang
buatan (artificial diet) dan persiapan alat-alat yang akan digunakan, pembuatan stand penempatan tabung yang sesuai dengan tabung reaksi sebagai tempat
ransum yang dilindungi dengan penutupan oleh kain kasa. Kemudian dilanjutkan
dengan pencarian larva X. festiva, yang diasumsikan larvanya berasal dari satu induk.
Adapun komposisi makanan buatan untuk larva boktor dapat dilihat pada
Tabel 1.
Serbuk sengon dengan proses freeze dry
Bahan II :
Komposisi artificial diet ini mengacu pada penelitian-penelitian sebelumnya (Carvallo 2009), namun ada beberapa perubahan seperti penambahan
dosis pada beberapa bahan dan pengurangan pada beberapa bahan. Komposisi kali
ini tidak menggunakan NaCl, dolomit, minyak zaitun, vitamin B kompleks dan
tambahan selulosa, hanya menggunakan serbuk sengon sebagai sumber selulosa
utamanya sehinggga jumlah komposisinya dijadikan 2 kali lipat. Umumnya dosis
pada masing-masing bahan yang digunakan lebih ditingkatkan.
Pembuatan artificial diet ini dengan cara mencampurkan bahan I ke dalam bahan II dari komposisi artificial diet di atas. Bahan I dibuat dengan memasukkan
yeast extract terlebih dahulu ke dalam aquades dan diaduk hingga terlarut sempurna. Kemudian menambahkan streptomycin, natrium benzoat, dan vitamin C dengan melarutkan unsur-unsur sebelumnya terlebih dahulu. Sebelum
menambahakan serbuk sengon kedalam bahan I sebaiknya menyiapkan bahan II
terlebih dahulu, yaitu dengan melarutkan sukrosa ke dalam aquades yang diikuti
dengan melarutkan agar hingga tercampur sempurna. Kemudian bahan II tersebut
ditambahkan dengan serbuk sengon dan diaduk sempurna agar bahan kimianya
dapat diserap oleh serbuk sengon tersebut. Setelah kedua bahan siap, bahan II
(campuran sengon dan bahan kimia) dituangkan ke dalam bahan I.
3.3.2 Percobaan dan Parameter Artificial Diet
Percobaan dilakukan dengan memasukkan satu persatu larva boktor ke
dalam tabung yang berisi makanan buatan (artificial diet), kemudian ditutup kain kasa. Tabung-tabung ini disimpan di rak dengan suhu kamar dan memperoleh
sirkulasi udara yang baik. Parameter yang akan diamati selama 6 minggu yaitu
berat larva, panjang larva, diameter kepala larva, berat makanan dan sisa makanan
yang telah dikonsumsi oleh larva boktor. Pengukuran dan penggantian makanan
dilakukan setiap 2 minggu.
3.4 Analisis Data
Jumlah sampel pohon yang digunakan sebagai unit percobaan disajikan
dalam Tabel 2. Analisis korelasi Pearson digunakan untuk melihat hubungan
antara parameter pertumbuhan larva pada setiap unit percobaan tersebut dengan
aktivitas enzim inhibitor. Software yang digunakan adalah Microsoft Excel 2007.
Dalam penelitian artificial diet ini setiap sampel pohon diulang sebanyak 3 kali pada masing-masing ukuran larva boktor. Banyaknya unit percobaan artificial diet adalah 79 (masing-masing sampel) × 3 ulangan = 237 unit percobaan untuk setiap ukuran boktor. Setiap sampel pohon (unit percobaan) yang dipakai untuk
artificial diet, adalah sama dengan sampel yang digunakan untuk uji aktivitas inhibitor enzim trypsin dan enzim alfa-amylase.
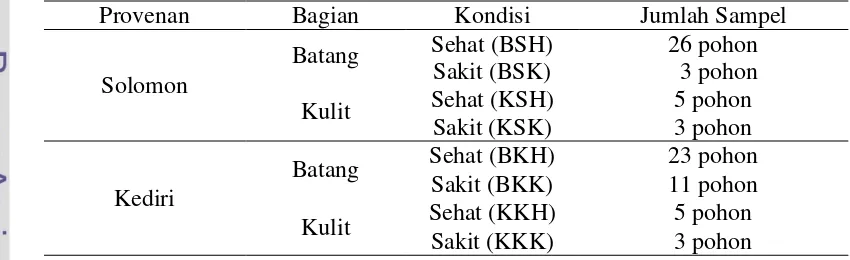
Tabel 2 Sampel yang digunakan dalam artificial diet
Provenan Bagian Kondisi Jumlah Sampel
BAB IV
HASIL DAN PEMBAHASAN
Hubungan aktivitas inhibitor dengan pertumbuhan artificial diet larva boktor diamati pada dua provenan, yaitu Solomon dan Kediri. Namun dalam
pengolahan data ini, indikator yang digunakan adalah bagian dan kondisi pohon
sedangkan provenan tidak dicantumkan. Hal ini didasarkan pada penelitian
sebelumnya, bahwa faktor provenan tidak berpengaruh nyata terhadap aktivitas
trypsin inhibitor dan alfa-amylase inhibior (Djati 2009).
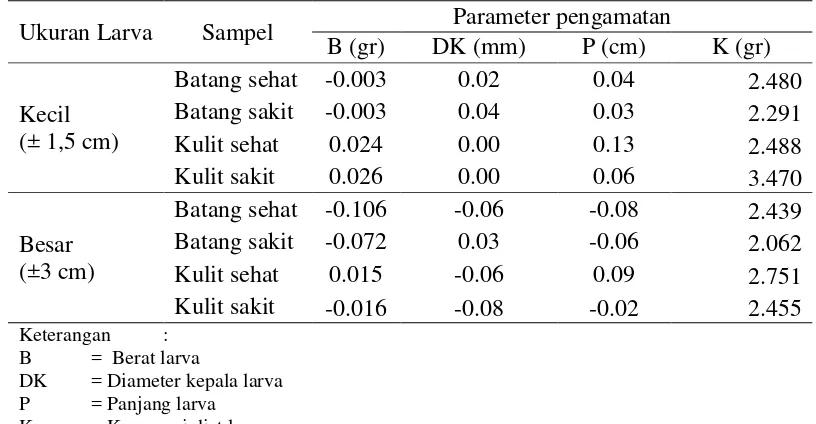
Tabel 3 Rata-rata pertumbuhan larva boktor dalam artificial diet
Ukuran Larva Sampel Parameter pengamatan
B (gr) DK (mm) P (cm) K (gr)
DK = Diameter kepala larva P = Panjang larva
K = Konsumsi diet larva
Hasil rataan pengukuran pengamatan pada Tabel 3 menunjukkan bahwa
perkembangan larva boktor yang berbeda-beda pada masing-masing kondisi dan
bagian pohon. Artificial diet dengan menggunakan serbuk kondisi sehat umumnya memberikan hasil pertumbuhan kurang baik dibandingkan penggunaan serbuk
batang sakit, ada juga beberapa parameter yang memperlihatkan pertumbuhan
yang meningkat. Pertumbuhan larva dilihat dari semakin tingginya (positif) selisih
berat larva, diameter kepala larva, panjang larva dan konsumsi diet. Rata-rata
pertumbuhan larva pada sengon sehat lebih menderita (kecil) dibandingkan
pertumbuhan larva pada sengon sakit. Hal ini mengindikasikan bahwa, pada
sengon sehat memiliki ketahanan lebih besar terhadap serangan hama boktor.
-amylase inhibitor yang lebih tinggi pada pohon kondisi sehat dan Yauvina (2010) rata-rata aktivitas trypsin inhibitor pada pohon sehat lebih tinggi daripada aktivitas
trypsin inhibitor pada pohon sakit.
Hasil rataan nilai aktivitas enzim inhibitor pada Tabel 4 menunjukkan
tingginya aktivitas inhibitor pada kondisi pohon sehat dibandingkan pada pohon
kondisi sakit. Jika dilihat dari bagian pohon, nilai aktivitas trypsin inhibitor lebih besar pada bagian kulit, sedangkan pada bagian batang memiliki nilai alfa-amylase inhibitor yang lebih tinggi.
Tabel 4 Rataan nilai aktivitas enzim inhibitor Trypsin Unit Inhibited dan
alfa-Sumber : Saimima 2010 dan Yauvina 2010.
Perkembangan larva pada masing-masing parameter dikorelasikan dengan
nilai aktivitas enzim inhibitor (Trypsin Unit Inhibited dan alfa-amylase Unit Inhibited) pada tiap sampel pohon. Dari hasil penelitian ini, diharapkan setiap
korelasi antara inhibitor dengan semua parameter perkembangan larva pada
artificial diet selalu negatif. Karena semakin tinggi aktivitas inhibitor akan menurunkan kesukaan larva boktor untuk menyerang pohon sengon.
4.1 Korelasi Antara Aktivitas Trypsin Inhibitor Pada Sengon Dengan Pertumbuhan Larva Boktor Ukuran Kecil Dalam Artificial Diet
Berdasarkan Tabel 5 dilihat dari bagian pohon, antara aktivitas trypsin
inhibitor (TUI/ Trypsin Unit Inhibited) dengan parameter perkembangan larva kecil bagian batang dan kulit memiliki jumlah korelasi negatif dan positif yang
sebanding/sama. Batang dan kulit sama-sama memiliki 4 korelasi negatif,
sehingga tidak memperlihatkan pengaruh besar antara TUI dengan pertumbuhan
larva. Jika dilihat dari kondisi pohon, pada sengon kondisi sehat memiliki jumlah
korelasi negatif lebih banyak dibandingkan dengan kondisi sakit. Sengon kondisi
sehat terdapat 5 parameter yang menunjukkan korelasi negatif, sedangkan pada
Tabel 5 Korelasi antara aktivitas Trypsin inhibitor dengan parameter pertumbuhan larva kecil dalam artificial diet
Bagian Kondisi
sama-sama memiliki TUI yang tinggi yang menyebabkan larva boktor kecil tidak
menyukai pohon sengon sehat tersebut. Parameter yang memperlihatkan korelasi
negatif pada sengon sehat adalah perbandingan TUI dengan diameter kepala larva
dan panjang larva serta konsumsi diet.
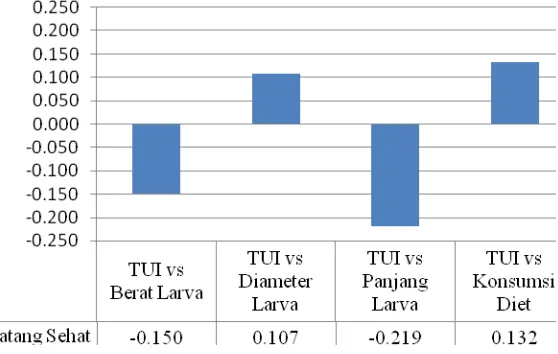
Gambar 1 Histogram korelasi antara aktivitas Trypsin inhibitor pada batang sehat dengan parameter pertumbuhan larva ukuran kecil pada batang sehat.
Pada batang sengon sehat (Gambar 1) terdapat 2 perbandingan korelasi
yang memperlihatkan hubungan negatif, yaitu pada korelasi antara TUI dengan
berat (-0,150) dan TUI dengan panjang (-0,219). Sedangkan pada 2 parameter
pertumbuhan larva lainnya berkorelasi positif, yaitu korelasi pada TUI dengan
diameter kepala larva dan TUI dengan konsumsi diet. Walaupun perbandingan
kedua histogram parameter sama, namun pada parameter yang berkorelasi negatif
Gambar 2 Histogram korelasi antara aktivitas Trypsin inhibitor pada batang sakit dengan parameter pertumbuhan larva ukuran kecil pada batang sakit.
Bagian batang sakit yang diperlihatkan pada Gambar 2, juga terjadi hal
yang sama seperti histogram pada batang sehat. Namun perbandingan korelasi
negatifnya berlaku berat larva (-0,123) dan dengan diameter kepala larva TUI
(0,213) dan korelasi posotinya berlaku pada parameter panjang (0,023) dan
konsumsi larva (0,218). Berdasarkan data ini, trypsin inhibitor pada batang berkorelasi negatif dengan pertumbuhan larva kecil dalam artificial diet.
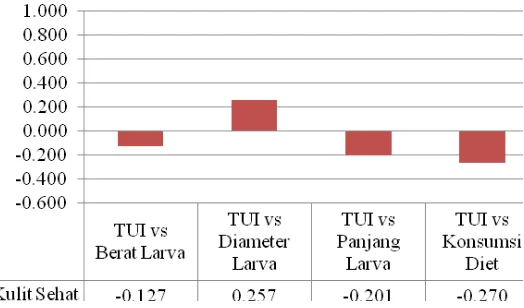
Gambar 3 Histogram korelasi antara aktivitas Trypsin inhibitor pada kulit sehat dengan parameter pertumbuhan larva ukuran kecil pada kulit sehat.
Pada kulit sehat (Gambar 3), korelasi TUI dengan 3 parameter
perkembangan larva (berat sebesar -0,127, panjang sebesar -0,201 dan konsumsi
diet sebesar -0,270) menunjukkan TUI berkorelasi negatif pada pertumbuhan
larva kecil. Pada parameter diameter kepala larva histogramnya menunjukkan
semakin tingginya aktivitas trypsin inhibitor pada kulit sehat akan berbanding terbalik dengan 3 parameter pertumbuhan artificial diet larva tersebut.
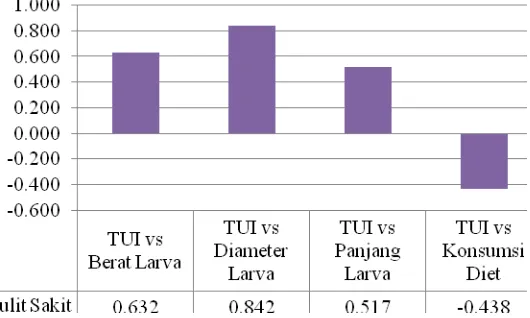
Pada kulit sakit (Gambar 4) memiliki bentuk histrogram yang sangat
berbeda dari histogram sebelumnya, yaitu ada 3 parameter yang memperlihatkan
korelasi positif dan 1 parameter berkorelasi positif . Korelasi positif diperlihatkan
pada parameter berat larva (0,632), diameter kepala larva (0,842) dan panjang
larva (0,517), sedangkan pada konsumsi larva nilai korelasinya negatif sebesar
-0,438. Histogram ini membuktikan tidak ada hubungan yang antara trypsin
inhibitor dengan pertumbuhan larva kecil pada kulit sehat.
Gambar 4 Histogram korelasi antara aktivitas Trypsin inhibitor pada kulit sakit dengan parameter pertumbuhan larva ukuran kecil pada kulit sakit.
Dari keempat histogram korelasi pada bagian kulit sehat yang paling kuat
menunjukkan hubungan aktivitas trypsin inhibitor dengan perkembangan larva kecil. Hal ini membuktikan bahwa pada pohon sehat, aktivitas trypsin inhibitor yang tinggi akan meningkatkan kemampuan pohon untuk menghambat serangan
hama boktor lebih besar. Dengan hasil ini, kulit sengon sehat dapat dijadikan
indikator tingginya aktivitas trypsin inhibitor pada pohon sengon. Aktivitas
4.2 Korelasi Antara Aktivitas Trypsin Inhibitor Pada Sengon Dengan Pertumbuhan Larva Boktor Ukuran Besar Dalam Artificial Diet
Berdasarkan Tabel 6, korelasi antara TUI dengan parameter pertumbuhan
larva besar banyak yang berkorelasi negatif pada bagian kulit yaitu sebanyak 6
korelasi sedangkan pada bagian batang hanya memiliki 2 korelasi negatif. Hasil
ini membuktikan bahwa pada pengukuran pertumbuhan larva besar dengan
aktivitas trypsin inhibitor lebih signifikan pada bagian kulit. Tabel 2 juga menunjukkan bahwa pohon sengon sakit lebih banyak yang berkorelasi negatif
daripada pohon sehat. Seperti yang dikutip dari Djati (2009), kandungan trypsin
inhibitor yang lebih besar pada kulit mengindikasikan bahwa kulit adalah
perlindungan utama pada sengon dari serangan boktor.
Tabel 6 Korelasi antara aktivitas Trypsin inhibitor pada bagian dan kondisi pohon sengon dengan parameter pertumbuhan larva besar dalam artificial diet
Bagian Kondisi
Tingginya aktivitas trypsin inhibitor pada kulit dikarenakan kulit banyak mengandung sel-sel hidup yang memiliki mitokondria yang mengandung anti
protein enzim trypsin yang bekerja pada boktor (Winarni 2003). Hal ini menyebabkan larva besar tidak suka menyerang pohon sakit, karena dalam
pertumbuhannya larva besar lebih membutuhkan karbohidrat yang umumnya
terdapat pada bagian batang.
Gambar 5 memperlihatkan korelasi antara TUI dengan parameter
pertumbuhan larva kecil lebih banyak berpengaruh/korelasi positif, baik pada
berat larva sebesar 0,122, diameter kepala larva 0,218 dan konsumsi larva sebesar
0,256. Pada batang sehat, hanya pada parameter panjang larva yang memiliki
Gambar 5 Histogram korelasi antara aktivitas Trypsin inhibitor pada batang sehat dengan parameter pertumbuhan larva ukuran besar pada batang sehat.
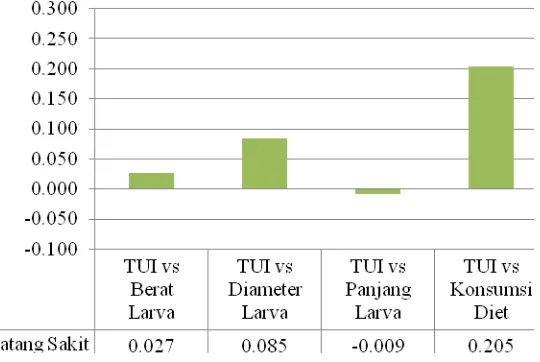
Sama halnya dengan batang sehat, Gambar 6 yang memperlihatkan
korelasi antara TUI dengan pertumbuhan larva besar pada batang sakit juga
banyak yang berkorelasi positif. Korelasi positif paling besar ditemukan pada
parameter konsumsi larva sebesar (0,205), sedangkan parameter yang
memperlihatkan korelasi negatif hanya ditemukan pada panjang larva yaitu
sebesar -0,009.
Gambar 6 Histogram korelasi antara aktivitas Trypsin inhibitor pada batang sakit dengan parameter pertumbuhan larva ukuran besar pada batang sakit.
dengan Prasetya (2007) rendahnya enzim trypsin pada larva ukuran besar disebabkan karena dalam masa transisi antara stadium larva dan stadium pupa
sehingga makanan yang dimakan sedikit.
Gambar 7 Histogram korelasi antara aktivitas Trypsin inhibitor pada batang sehat dengan parameter pertumbuhan larva ukuran besar pada kulit sehat.
Pengamatan pada bagian kulit sehat, antara TUI dengan parameter
pertumbuhan larva ukuran besar terdapat 2 pengamatan yang berkorelasi negatif,
yaitu diameter kepala larva sebesar -0,034 dan panjang larva sebesar -0,106
seperti histogram pada Gambar 7. Pada parameter berat larva dan konsumsi larva
dengan TUI memperlihatkan korelasi positif, masing-masing sebesar 0,154 dan
0,110.
Pada Gambar 8 yang memperlihatkan korelasi pada bagian kulit sakit,
keempat parameter pertumbuhan larva besar bernilai negatif. Korelasi tersebut
ditemukan pada parameter berat larva sebesar -0,123, diameter kepala larva
sebesar -0,266, panjang larva sebesar -0,168 dan konsumsi larva sebesar -0,299.
Hasil ini membuktikan bahwa pada bagian kulit banyak mengandung trypsin
inhibitor yang menyebabkan pengaruh negatif terhadap pertumbuhan larva
seperti: menurunnya berat, ukuran diameter kepala, panjang larva dan jumlah
Gambar 8 Histogram korelasi antara aktivitas Trypsin inhibitor pada kulit sakit dengan parameter pertumbuhan larva ukuran besar pada kulit sakit.
Parameter yang paling konsisten digunakan dalam menguji korelasi
trypsin inhibitor pada larva besar adalah panjang larva, karena baik dari batang maupun kulit, panjang larva panjang larva banyak berkorelasi negatif.
4.3 Korelasi Antara Aktivitas alfa-amylase Inhibitor Pada Sengon Dengan Pertumbuhan Larva Boktor Ukuran Kecil Dalam Artificial Diet
Berdasarkan Tabel 7 korelasi antara aktivitas alfa-amylase inhibitor (AUI /
Alfa-amylase Unit Inhibited) dengan pertumbuhan larva boktor kecil, bagian batang lebih banyak memperlihatkan korelasi negatif dibandingkan dengan bagian
kulit yaitu sebanyak 6 korelasi. Parameter yang kuat memperlihatkan korelasi ini
adalah berat larva dan panjang, yang selalu bernilai negatif pada batang sehat dan
batang sakit.
Pada bagian kulit, hanya pada diameter larva yang memperlihatkan
tingginya aktivitas alfa-amylase inhibitor sehingga berpengaruh buruk pada perkembangan larva kecil. Banyaknya parameter yang berkorelasi negatif
terhadap alfa-amylase inhibitor paling baik pada kondisi sehat maupun sakit. menunjukkan bahwa itu sebanyak 6 korelasi. Untuk sengon kondisi sehat hanya
ditemukan 4 korelasi negatif, yang berarti aktivitas alfa-amylase inhibitor tinggi pada pohon sakit kurang disukai larva kecil.
Gambar 9 Histogram korelasi antara aktivitas alfa-amylase inhibitor pada batang sehat dengan parameter pertumbuhan larva ukuran kecil pada batang sehat.
Pada histogram batang sehat pada Gambar 9 menunjukkan 3 parameter
pertumbuhan larva kecil berkorelasi negatif terhadap AUI. Parameter tersebut
adalah berat larva 0,184), diameter kepala larva 0,075), dan panjang larva
(-0,287) sedangkan pada konsumsi larva berkorelasi positif sebesar (0,096).
Histogram ini membuktikan menurunnya pertumbuhan larva kecil pada batang
sengon sehat, hal ini disebabkan oleh tingginya kandungan alfa-amylase inhibitor pada batang.
Korelasi antara aktivitas alfa-amylase inhibitor dengan pertumbuhan larva kecil yang ditampilkan Gambar 10, memperlihatkan 3 parameter pertumbuhan
larva berkorelasi negatif. Bedasarkan histogram tersebut, semakin tinggi
kandungan alfa-amylase inhibitor pada batang sakit akan mengurangi berat sebanyak -0,043, panjang sebanyak -0,041 dan jumlah konsumsi larva kecil
Gambar 10 Histogram korelasi antara aktivitas alfa-amylase inhibitor pada batang sakit dengan parameter pertumbuhan larva ukuran kecil pada batang sehat.
Berbeda dengan bagian batang, pada bagian kulit (Gambar 11) umumya
histogram menunjukkan hubungan positif antara AUI dengan pertumbuhan larva
kecil. Pada kulit sehat hanya ditemukan satu parameter yang berkorelasi negatif
dengan AUI, yaitu diameter kepala larva sebesar -0,746. Sedangkan parameter
pertumbuhan larva kecil lainnya berkorelasi negatif. Dari data ini terlihat bahwa
aktivitas alfa-amylase inhibitor pada kulit sehat dapat diatasi oleh larva kecil.
Gambar 11 Histogram korelasi antara aktivitas alfa-amylase inhibitor pada kulit sehat dengan parameter pertumbuhan larva ukuran kecil pada kulit sehat.
Pada kulit sakit (Gambar 12) ditemukan 3 parameter yang berkorelasi
alfa-amylase relatif rendah, dimana dalam kondisi tersebut larva sedang tidak banyak memakan atau mencerna pati yang terdapat pada tanaman sengon
(Prasetya 2007), sehingga aktivitas alfa-amylase yang terlalu tinggi cukup berakibat buruk untuk larva ukuran kecil.
Gambar 12 Histogram korelasi antara aktivitas alfa-amylase inhibitor pada kulit sakit dengan parameter pertumbuhan larva ukuran kecil pada kulit sakit.
Rendahnya rata-rata memakan dapat menyebabkan rendahnya aktivitas
enzim. Untuk bagian pohon, yang memberi respon negatif paling banyak
ditemukan pada bagian batang. Data ini sesuai dengan (Djati 2009) dimana
aktivitas alfa-amylase inhibitor pada batang lebih tinggi dibandingkan dengan bagian kulit. Selain itu bagian batang mengandung banyak karbohidrat sehingga
boktor mensintesa enzim amylase untuk mencerna karbohidrat tersebut.
4.4 Korelasi Antara Aktivitas alfa-amylase Inhibitor Pada Sengon Dengan Pertumbuhan Larva Boktor Ukuran Besar Dalam Artificial Diet
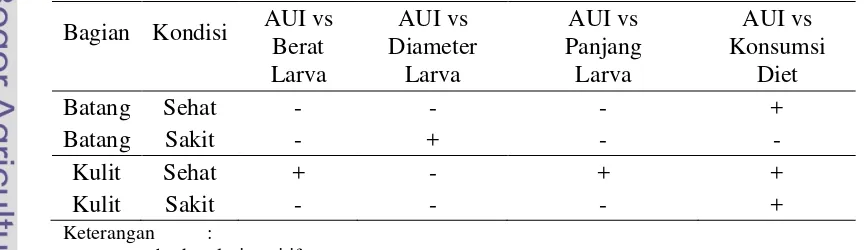
Hubungan pertumbuhan larva besar dengan alfa-amylase inhibitor dengan seluruh perlakuan pada umumnya berkorelasi positif sebanyak 13 korelasi, dapat
dilihat pada Tabel 8. Korelasi negatif antara AUI dengan pertumbuhan larva
boktor besar hanya ditemukan pada parameter berat dan diameter larva. Seluruh
unit percobaan, yaitu kondisi pohon sehat maupun pohon sakit hubungan AUI