PEMANFAATAN GANGGANG MIKRO SEBAGAI BIOINDIKATOR
PERAIRAN YANG TERCEMAR
MASDIANTO
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI
DISERTASI DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi dengan judul “Pemanfaatan Ganggang Mikro Sebagai Bioindikator Perairan yang Tercemar” adalah karya saya dengan arahan dari komisi pembimbing dan belum pernah diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal dan dikutif dari karya tulis yang diterbitkan atau tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
© Hak Cipta Milik Institut Pertanian Bogor, Tahun 2013 Hak Cipta Dilindungi Undang-Undang
1. Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumber
a. pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah
b. pengutipan tersebut tidak merugikan kepentingan IPB
Judul Disertasi : Pemanfaatan Ganggang Mikro sebagai Bioindikator Perairan yang Tercemar.
Nama : Masdianto
NRP : P062080111
Disetujui: Komisi Pembimbing
Dr. Ir. Dwi Andreas Santosa, MS. Ketua
Prof. Dr. Ir. Surjono H. Sutjahjo, MS. Dr. Ir. Mohamad Yani, M.Eng.
Anggota Anggota
Diketahui:
Ketua Program Studi Pengelolaan Dekan Sekolah Pascasarjana Sumberdaya Alam dan Lingkungan
Prof. Dr. Ir. Cecep Kusmana, MS. Dr. Ir. Dahrul Syah, M.Sc. Agr. NIP.1961102121985011001 NIP. 196508141990021001
ABSTRAK
MASDIANTO. Pemanfaatan Ganggang Mikro sebagai Bioindikator Perairan yang Tercemar. Dibimbing oleh DWI ANDREAS SANTOSA, SURJONO H. SUTJAHJO dan MOHAMAD YANI.
Penelitian ini bertujuan untuk mengetahui sensitivitas beberapa ganggang mikro perairan air tawar asal Indonesia terhadap pencemar logam berat (Hg, Cd, As dan Pb) dan pestisida. Hasil seleksi sepuluh isolat ganggang mikro yang ditumbuhkan dalam media BG 11 diperoleh tiga strain yang memiliki laju pertumbuhan tercepat yaitu: ICBB 9111, ICBB 9113 dan ICBB 9114. Ketiga strain ganggang mikro terseleksi tersebut berhasil diidentifikasi sebagai : Synechoccus sp. ICBB 9111 (asal situ di Gunung Salak, Bogor), Chlamydomonas sp. ICBB 9113 (asal persawahan Ciomas – Bogor) dan Chlorella vulgaris ICBB 9114 (asal Telaga Warna, Puncak, Bogor). Untuk menguji sensitivitas ganggang mikro terhadap logam berat, tiga isolat terpilih tersebut ditumbuhkan dalam media mengandung logam berat Cd, Hg, As dan Pb pada konsentrasi 1,25 ppm, 2,50 ppm, 5,00 ppm dan 10,00 ppm. Pengamatan terhadap kerapatan optik (Optical Density) dilakukan pada 30 menit pertama hingga 96 jam. Berdasarkan hasil pengamatan visual selama periode tersebut diperoleh bahwa 2 strain ganggang mikro terhenti pertumbuhannya. Kedua strain ganggang mikro tersebut adalah Synechococcus sp. ICBB 9111 dan Chlamydomonas sp. ICBB 9113. Sebaliknya untuk Chlorella vulgaris ICBB 9114 masih bertahan hidup terutama pada medium yang mengandung ion logam Cd dan Pb, sedangkan dalam medium mengandung Hg dan As strain tersebut tidak mampu bertahan hidup. Tahap penelitian berikutnya adalah analisis kadar logam yang tidak terserap oleh biomassa ganggang mikro. Dari hasil analisis diperoleh bahwa Hg dan As hampir seluruhnya diabsorpsi oleh ganggang mikro dan kandungan di dalam media masing-masing tersisa <0,001ppm dan <0,002ppm. Sedangkan untuk Cd dan Pb hanya sebagian kecil yang diabsorpsi oleh ganggang mikro. Berdasarkan hasil tersebut daya tahan masing-masing ganggang mikro di dalam media mengandung logam berat berbeda-beda. Strain Chlorella vulgaris ICBB 9114 mempunyai daya tahan dan adaptasi yang lebih tinggi terhadap logam berat dibanding strain Chlamydomonas sp. ICBB 9113. Sedangkan Synechococcussp. ICBB 9111 memiliki kepekaan yang paling tinggi terhadap keempat logam yang diujikan. Selain diuji terhadap logam berat, tiga strain tersebut juga diuji sensitivitasnya terhadap herbisida isoprofilamina glifosat dan paraquat diklorida serta insektisida butilfenilmetilkarbamat (BPMC) dan deltametrin dengan variasi konsentrasi sebagai berikut : 5ppm, 10ppm, 20ppm dan 40ppm. Hasil pengamatan pertumbuhan ganggang mikro menunjukkan bahwa ketiga strain tersebut mampu bertahan hingga 24 jam dalam media yang mengandung pestisida yang diujikan. Setelah 24 jam ketiganya mulai menunjukan tanda-tanda penurunan populasi. Pada pengamatan 96 jam semua ganggang mikro mati. Besaran konsentrasi pestisida berkisar antara 10-20ppm yang merupakan konsentrasi kritis bagi daya tahan dan adaptasi ganggang mikro.
Dari keseluruhan perlakuan dan pengamatan dapat ditarik suatu kesimpulan bahwa beberapa ganggang mikro memiliki batas toleransi terhadap polutan (logam berat atau pestisida) yang masuk ke lingkungan perairan. Kemampuan adsorpsi dan adaptasi ganggang mikro tersebut dapat dimanfaatkan sebagai bioindikator dalam monitoring dan evaluasi kondisi lingkungan perairan terhadap bahan pencemar logam berat dan pestisida.
ABSTRACT
MASDIANTO. Utilization of Microalgae as bio-indicators of Contaminated Water. Supervised by DWI ANDREAS SANTOSA, SURJONO H. SUTJAHJO and MOHAMAD YANI.
This study aimed to determine the sensitivity of some freshwater microalgae from Indonesia to the heavy metal contaminants (Hg, Cd, As and Pb) and pesticides. Result of the selection of ten isolates of microalgae grown in BG 11 medium obtained three strains which have the fastest growth rate: ICBB 9111, ICBB ICBB 9113 and 9114. Third is selected microalgae strains were identified as: Synechoccus sp. ICBB 9111 (originally there in Mt Salak, Bogor), Chlamydomonas sp. ICBB 9113 (paddy field of Ciomas - Bogor) and Chlorella vulgaris ICBB 9114 (origin Telaga Warna, Puncak, Bogor). To test the sensitivity of microalgae to heavy metals, three selected bacteria are grown in a medium containing heavy metals Cd, Hg, As and Pb at a concentration of 1.25 ppm, 2.50 ppm, 5.00 ppm and 10.00 ppm. Observation of the optical density (OD) performed on the first 30 minutes up to 96 hours. Based on visual observations obtained during this period that two strains of micro-algae growth stalled. Both strains of microalgae are Synechococcussp. ICBB 9111 andChlamydomonassp. ICBB 9113. In contrast to Chlorella vulgaris ICBB 9114 still survive, especially in the medium containing metal ions Cd and Pb, whereas in medium containing Hg and As these strains are not able to survive. The next stage of research is the analysis of metal content, which is not absorbed by the micro algae biomass. From the analysis found that Hg and As are almost entirely absorbed by algae and micro-media content in each of the remaining <0.001 ppm and <0,002 ppm. Whereas for Cd and Pb only a small portion is absorbed by microalgae. Based on the results of the durability of each micro algae in media containing different heavy metals. ICBBChlorella vulgarisstrain 9114 has the durability and adaptability to heavy metals higher than the strain Chlamydomonassp. ICBB 9113. WhileSynechococcussp. ICBB 9111 had the highest sensitivity of all four metals tested. In addition to heavy metals tested, three strains were also tested sensitivity to the herbicide; isoprophylamine glyphosate and paraquat dichloride and insecticide ; buthylphenylmethylcarbamate (BPMC) and deltamethrin with variations of the following concentrations: 5ppm, 10ppm, 20ppm and 40ppm. Microalgae growth observations showed that all three strains are able to survive up to 24 hours in media containing pesticides tested. After 24 hours, the three began to show signs of decline. At the 96-hour observation of all micro algae die. The amount of pesticide concentrations ranged from 10-20ppm concentration which is critical to the durability and adaptability of microalgae.
Of the overall treatment and observation can be drawn a conclusion that some micro algae have tolerance to pollutants (heavy metals or pesticides) that enter the aquatic environment. Adsorption capacity and adaptation of micro algae can be used as bio-indicators in monitoring and evaluation of marine environmental impacts of the heavy metal pollutants and pesticides.
I.
PENDAHULUAN
1.1 Latar BelakangAir merupakan komponen yang penting bagi manusia dan makhluk hidup lainnya. Air diperlukan untuk proses hidup dalam tubuh manusia, tumbuhan, dan hewan. Sebagian tubuh manusia, tumbuhan dan hewan terdiri dari air. Disamping itu air juga diperlukan untuk berbagai keperluan untuk berbagai keperluan rumah tangga, pengairan, pertanian, industri, rekreasi, dan lain-lain. Kebutuhan akan air bersih menjadi tema penting di berbagai belahan dunia. Apalagi kebutuhan air bersih untuk minum dan mengolah bahan makanan kian mengundang perhatian lebih ketimbang kebutuhan air bersih untuk mandi dan cuci. Artinya keperluan akan air bersih memiliki standar sesuai peruntukannya. Air dikatakan bersih secara fisik setidaknya jika terlihat jernih, tidak berwarna, tawar, dan tidak berbau. Secara kimiawi air yang kualitasnya baik adalah yang memiliki pH netral dan tidak mengandung bahan berbahaya dan beracun (B3) dan ion-ion logam, serta bahan organik. Sedangkan bersih secara biologis dalam arti tidak mengandung mikroorganisme seperti bakteri baik yang patogen atau menyebabkan penyakit atau yang apatogen.
lingkungan terutama perairan banyak disumbangkan oleh usaha-usaha seperti pertambangan, pertanian, perkebunan, industri dan kegiatan domestik yang menghasilkan limbah dan buangan industri yang mengandung bahan- bahan organik, logam berat, pestisida dan bahan mikro polutan lainnya.
Keberadaan logam berat tersebut telah diketahui dapat memberikan dampak negatif bagi kesehatan manusia dan kehidupan biota akuatik membentuk senyawa toksik dan mengganggu sistem metabolisme makhluk hidup (Shakla dan Srivastava 1992). Berbagai logam berat yang sering terdapat dalam pencemaran air antara lain raksa (Hg), timbal (Pb), cadmium (Cd), krom (Cr), arsen (As), nikel (Ni), dan seng (Zn). (Whitton 1984). Berbagai kasus pencemaran logam berat di perairan seperti kasus tailing logam berat di Newmont - Minahasa dan pencemaran oleh tailing tambang Freeport, Papua.
Di bidang pertanian, penggunaan pestisida telah dirasakan manfaatnya untuk meningkatkan produksi. Sebab dengan bantuan pestisida, petani meyakini dapat terhindar dari kerugian akibat serangan jasad pengganggu tanaman yang terdiri dari kelompok hama, penyakit maupun gulma. Keyakinan tersebut, cenderung memicu pengunaan pestisida dari waktu ke waktu meningkat dengan pesat yang menyebabkan kebutuhan akan pestisida bertambah banyak, baik jumlah maupun jenisnya. Secara ekonomi penggunaan pestisida relatif menguntungkan, tetapi dibalik manfaat dan keuntungannya dampak yang ditimbulkan cukup besar terhadap kesehatan manusia serta kualitas lingkungan. Selain itu penggunaan pestisida yang berlebihan dan terus menerus dapat mengakibatkan resistensi hama, terbunuhnya musuh alami sehingga pada akhirnya justru meningkatkan populasi jasad penganggu tanaman tersebut.
Keberadaan logam berat dan pestisida dalam perairan menjadi salah satu parameter penurunan kualitas air, karena bersifat toksik pada biota seperti ikan, tumbuhan air, binatang dan manusia yang menggunakannya. Polutan tersebut juga akan mempengaruhi mikroorganisme lainnya seperti ganggang mikro. Polutan yang masuk kedalam perairan dapat mengakibatkan kematian berbagai organisme. Meskipun demikian beberapa jenis ganggang mikro mampu melakukan metabolisme terhadap polutan tersebut dan menjadikannya sumber nutrien / mineral.
sekitarnya, waktu hidup yang pendek, keberadaannya di berbagai ekosistem perairan, kemampuannya menumpuk logam-logam serta relatif mudah diidentifikasi (Whitton 1984).
Pengukuran logam-logam berat yang diserap ataupun dijerap oleh organisme bioindikator lebih menggambarkan tingkat pencemaran lingkungan yang terjadi dibandingkan dengan pengukuran konsentrasi logam dalam sampel air atau sedimen. Secara umum, keuntungan pemanfaatan ganggang mikro sebagai bioindikator adalah :
a. Ganggang mempunyai kemampuan yang cukup tinggi dalam mengabsorpsi logam berat karena di dalam ganggang terdapat gugus fungsional yang dapat melakukan pengikatan dengan ion logam. Gugus fungsional tersebut terutama adalah gugus karboksil, hidroksil, amina, sulfudril, imadazol, sulfat dan sulfonat yang terdapat dalam dinding sel dalam sitoplasma,
b. Kepekaan terhadap logam berat dan senyawa-senyawa pencemar perairan lainnya,
c. Populasinya mudah dikuantifikasi sehingga bisa menggambarkan dampak pencemaran secara kuantitatif,
d. Perubahan morfologis yang terjadi juga mudah diamati.
Selain sebagai bioindikator, ganggang mikro di sisi lainnya dapat juga digunakan sebagai agen bioremediasi karena memiliki beberapa keunggulan sebagai berikut:
a. Bahan bakunya mudah didapat dan tersedia dalam jumlah banyak, b. Biaya operasional yang rendah,
c. Sludge yang dihasilkan sangat minim, d. Tidak perlu nutrisi tambahan.
Ganggang mikro merupakan salah satu komponen biota yang berada dalam perairan baik tawar maupun laut memiliki banyak potensi yang belum terkuak. Ganggang mikro merupakan makhluk hidup yang digolongkan sebagai tumbuhan tingkat rendah yang berklorofil dan membentuk koloni serta strukturnya jauh lebih sederhana, seperti tidak mempunyai akar, daun, dan batang. Sel ganggang mikro tumbuh dan tersebar di dalam air dan mempunyai akses yang efisien untuk mengasimilasi air, nutrien seperti nitrogen, fosfor, kalium, dan karbon dioksida termasuk polutan yang ada.
lingkungan air tawar dan laut (Maeda dan Sakaguchi 1990; Haritonidis dan Malea 1999).
Beberapa spesies ganggang hijau seperti Enteromorpha atau Cladophora telah dimanfaatkan untuk mengukur tingkat kontaminasi perairan oleh logam berat di beberapa negara seperti Kroasia (Chmielewska dan Medved 2001), Italia (Storelliet al. 2001), dan Polandia (Zbikowski et al. 2007). Beberapa studi juga telah dilakukan di Saudi Arabia dengan mengukur tingkat akumulasi logam berat dalam ganggang hijau, coklat dan merah yang hidup di perairan pantai Laut Merah Saudi ( El-Naggar dan Al-Amoudi 1989). Studi lain (Al-Homaidan 2007) menggunakan ganggang hijau Chaetomorpha aerea, Enteromorpha clathrata dan Ulva lactuca untuk mengukur tingkat pencemaran logam besi (Fe), nikel (Ni), tembaga (Cu) seng (Zn), kadmium (Cd) dan timbal (Pb) pada tiga lokasi di pantai Teluk Arab. Studi lain mengukur tingkat kandungan Nikel (Ni) dari 12 spesies ganggang hijau, coklat dan merah yang dikoleksi dari pantai Teluk Arab di Dammam (Al-Homaidan 2008).
Indonesia sebagai negara yang mempunyai wilayah perairan yang luas, memiliki kekayaan hayati yang berlimpah termasuk ganggang mikro. Ekplorasi dan ekploitasi ganggang mikro menjadi sesuatu yang menarik dan menjanjikan. Dalam berbagai penelitian ganggang mikro mempunyai potensi sebagai bahan bakar nabati (BBN) baik sebagai bioetanol maupun biodiesel. Selain itu ganggang mikro ternyata berpotensi untuk dimanfaatkan sebagai agen bioremediasi dan bioindikator.
Penelitian ini bertujuan untuk mengetahui kemampuan beberapa ganggang mikro perairan air tawar sebagai bioindikator pencemaran logam berat (Hg, Cd, As dan Pb) dan pestisida. Diharapkan hasil yang diperoleh dapat menjadi sumbangsih pengembangan pemanfaatan ganggang mikro sebagai bioindikator untuk lingkungan perairan.
1.2 Rumusan Masalah
Berkaitan dengan pencemaran terhadap wilayah perairan, limbah yang dihasilkan dari industri sangat bervariasi tergantung dari jenis dan ukuran industri, pengawasan pada proses industri, derajat penggunaan air, dan derajat pengolahan air limbah yang ada. Menurut Palar (1994), pada limbah industri seringkali terdapat bahan pencemar yang sangat membahayakan seperti logam berat. Dampak negatif dari terpapar logam berat bisa berupa: terganggunya proses fisiologis, kecacatan, hingga menyebabkan kematian (Luoma dan Carter 1991). Dalam perspektif yang lebih luas, adanya kematian dari biota tersebut dapat secara langsung berpengaruh pada menurunnya keanekaragaman biota dan integritas biologi perairan. Sensitifitas dari masing-masing organisme dalam merespon bahan polutan toksik mempunyai potensi untuk dikembangkan sebagai indikator biologi perairan guna mendeteksi adanya stress yang ditimbulkan oleh kontaminasi logam dan polutan lainnya (Meregalliet al.2004).
Logam berat yang masuk ke dalam perairan akan mencemari laut. Selain mencemari air, logam berat juga akan mengendap di dasar perairan yang mempunyai waktu tinggal (residence time) sampai ribuan tahun dan logam berat akan terkonsentrasi ke dalam tubuh makhluk hidup dengan proses bioakumulasi dan biomagnifikasi melalui beberapa jalan yaitu: melalui saluran pernapasan, saluran makanan dan kulit (Darmono 2001).
Selain logam berat, residu pestisida salah satu polutan yang cukup signifikan dalam menyumbangkan dampak negatif bagi lingkungan. Pestisida merupakan racun yang dibuat oleh manusia untuk membunuh organisme pengganggu tanaman, termasuk serangga (Soemirat 2003). Penggunaan pestisida di Indonesia cukup tinggi mengingat Indonesia adalah negara agraris yang mengandalkan sektor pertanian. Penggunaan pestisida bermanfaat untuk meningkatkan produksi pertanian dengan melindungi tanaman dan hasil tanaman, ternak maupun ikan, dari kerugian yang ditimbulkan oleh berbagai jasad pengganggu. Dengan menggunakan pestisida, petani yakin dapat terhindar dari kerugian akibat serangan jasad pengganggu tanaman yang terdiri dari kelompok hama, penyakit maupun gulma (Girsang 2009).
metode penilaian kualitas lingkungan lainnya dengan menggunakan organisme sebagai bioindikator. Ganggang mikro sangat potensial untuk dapat dimanfaatkan sebagai bioindikator dalam menilai kualitas lingkungan. Berkaitan dengan hal tersebut permasalahan yang akan dikaji dalam penelitian ini adalah :
a. Seberapa tinggi tingkat kepekaan ganggang mikro terhadap berbagai jenis logam berat dan pestisida?
b. Seberapa besar kemampuan berbagai jenis ganggang mikro air tawar dalam menyerap pencemar / polutan logam berat (Hg, Pb, As dan Cd) dan pestisida?
1.3 Tujuan Penelitian
Berdasarkan rumusan masalah di atas, penelitian ini dilakukan dengan tujuan untuk :
a. Mengukur kepekaan ganggang mikro terhadap logam berat dan pestisida pada lingkungan perairan yang tercemar.
b. Mengetahui kemampuan beberapa ganggang mikro perairan tawar sebagai bioindikator yang dapat dimanfaatkan dalam monitoring dan evaluasi kondisi lingkungan perairan.
1.4 Kerangka Pemikiran
Pencemaran air permukaan telah menjadi permasalah utama bagi lingkungan, pencemaran tersebut telah merusak ekosistem perairan. Masuknya bahan organik dan anorganik kedalam ekosistem (sungai, danau, situ dan laut serta air tanah) mengakibatkan penurunan kualitas perairan / badan air yang akan dimanfaatkan untuk berbagai kepentingan manusia serta mahluk hidup lainnya.
membutuhkan suatu perlakuan dan instrument khusus untuk dilakukan analisis. Hal lain yang tidak menguntungkan bagi lingkungan karena parameter fisika / kimia hanya dapat dipantau dan diidentifikasi setelah terjadi pencemaran. Berdasarkan lama waktu yang dibutuhkan dalam menganalisis parameter kimia/fisika, sangat bervariasi.
Parameter biologi merupakan alternatif dalam pemantauan pencemaran perairan, dengan mengamati keberadaan biota / organisme yang berada di lingkungan tersebut, dapat diperkirakan apakah lingkungan tersebut telah mengalami kerusakan/ pencemaran. Misalnya dengan memperhatikan pertumbuhan beberapa spesies tanaman air serta mikrobaE. coli. Keberadaan spesies tersebut dapat memberikan indikasi bahwa perairan tersebut tidak dapat digunakan untuk keperluan masak atau sebagai sumber air minum. Ganggang mikro merupakan mikroorganisme berukuran renik yang dapat menyebabkan pencemaran perairan (kasus blomming) yang menyebabkan kematian ikan serta beberapa biota akuatik lainnya.
Di sisi lainnya, ganggang mikro peka terhadap berbagai agen pencemar perairan. Semakin tinggi konsentrasi beberapa pencemar tertentu maka pertumbuhan ganggang mikro tertekan dan populasi menurun. Dengan demikian ganggang mikro dapat juga digunakan sebagai bioindikator kualitas lingkungan.
Ganggang mikro merupakan kelompok tumbuhan berukuran renik, baik sel tunggal maupun koloni yang hidup di seluruh wilayah perairan air tawar dan laut. Ganggang mikro lazim disebut fitoplankton. Sistem reproduksi utama ganggang mikro secara vegetatif (asexual), walaupun beberapa spesies bereproduksi secara seksual. Seperti halnya tumbuhan tingkat tinggi, ganggang mikro mempunyai kemampuan melakukan fotosintesa dengan bantuan cahaya matahari merubah karbondioksida menjadi hidrokarbon dan melepaskan oksigen dalam air dan merupakan dasar mata rantai pada siklus makanan di perairan baik laut maupun tawar dimana fitoplankton merupakan pakan alami bagi zooplankton dan ikan – ikan kecil.
mikro yang terpilih memiliki kriteria-kriteria sebagai berikut: (1) laju pertumbuhan yang cukup tinggi, (2) kepekaannya yang tinggi terhadap logam berat (Hg, Cd, As dan Pb) dan pestisida.
Penelitian ini dilakukan sebagai tindak lanjut pemanfaatan ganggang mikro air tawar sebagai salah satu indikator ekosistem lingkungan perairan akibat masuknya berbagai bahan pencemar, sebagai dampak pesatnya pertumbuhan ekonomi dan industri yang menimbulkan efek samping seperti pembuangan logam berat sebagai sisa proses kimia dari industri, limbah rumah tangga dan pemakaian pestisida dari pertanian ke lingkungan.
Berdasarkan data dariUnited State Environmetal Agency(EPA 1973), logam berat yang merupakan polutan perairan yang berbahaya diantaranya adalah antimon (Sb), arsenik (As), berilium (Be), kadmium (Cd), kromium (Cr), tembaga (Cu), timbal (Pb), merkuri (Hg), nikel (Ni), selenium (Se), kobalt (Co), dan seng (Zn). Logam berat ini berbahaya karena tidak dapat didegradasi oleh tubuh, memiliki sifat toksisitas (racun) pada mahluk hidup walaupun pada konsentrasi yang rendah, dan dapat terakumulasi dalam jangka waktu tertentu.
Gambar 1. Kerangka pemikiran penelitian
1.5 Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberikan manfaat antara lain sebagai berikut :
1. Memberikan sumbangan pengetahuan tentang kepekaan beberapa ganggang mikro terhadap logam berat tertentu ( Hg, As, Cd dan Pb) serta beberapa pestisida.
1.6 Novelty(Kebaruan)
Dalam penelitian ini diperoleh sumbangan kebaruan ilmu pengetahuan (novelty) yaitu :
1. Ditemukannya strain ganggang mikro indigeneous sebagai bioindikator terhadap polutan logam berat dan pestisida yang masuk ke lingkungan perairan.
II. TINJAUAN PUSTAKA
2.1 Ganggang Mikro.Ganggang mikro merupakan kelompok tumbuhan berukuran renik, baik sel tunggal maupun koloni yang hidup di seluruh wilayah perairan air tawar dan laut. Ganggang mikro lazim disebut fitoplankton. Sistem reproduksi utama ganggang mikro secara vegetatif (asexual), walaupun beberapa spesies bereproduksi secara seksual. Seperti halnya tumbuhan tingkat tinggi, ganggang mikro mempunyai kemampuan melakukan fotosintesis dengan bantuan cahaya matahari merubah karbondioksida menjadi hidrokarbon dan melepaskan oksigen dalam air. Gangang mikro merupakan dasar mata rantai pada siklus makanan di perairan baik laut maupun tawar karena merupakan pakan alami bagi zooplankton dan ikan - ikan kecil.
nCO2 + nH2O Cn(H2O)n + nO2
Sumber karbon utama ganggang mikro ialah karbondioksida. Sumber karbon tersebut diperoleh dari udara bebas yang dapat berupa hasil respirasi mahluk hidup ataupun dari penggunaan bahan bakar fosil. Ganggang mikro mengandung minyak, karbohidrat dan senyawa bioaktif lainnya yang digunakan untuk produk-produk komersil. Hingga saat ini perhatian khusus ditujukan untuk mengembangkan ganggang mikro sebagai penghasil bahan bakar nabati.
Ganggang mikro juga memiliki beberapa potensi yang menguntungkan bagi lingkungan, seperti mitigasi gas rumah kaca dengan fiksasi gas CO2 di atmosfir (fotosintesis gas CO2 menjadi sumber energi), agen bioremediasi limbah cair dengan menyerap nitrogen, fosfor dan logam berat.
Selain itu, ganggang mikro juga dapat digunakan sebagai indikator kesuburan suatu perairan dimana semakin tinggi bahan organik di suatu perairan, maka pertumbuhan ganggang mikro juga semakin tinggi. Namun ganggang mikro tertentu dapat juga berperan menurunkan kualitas perairan apabila jumlahnya berlebihan. Sebagai contoh, kelas Dinoflgellata bagian tubuhnya memiliki chromatophora yang menghasilkan toksin (racun) yang apabila dalam keadaan blooming dapat mengganggu aktivitas metabolisme ikan dan biota perairan lainnya yang pada akhirnya dapat menyebabkan kematian pada ikan dan biota perairan tersebut.
2.2 Morfologi dan Klasifikasi Ganggang Mikro.
Ganggang mikro adalah mikroorganisme fotosintetik dengan morfologi sel yang bervariasi, baik uniselular maupun multiselular (membentuk koloni kecil). Sebagian besar ganggang mikro tumbuh secara fototrofik, meskipun tidak sedikit jenis yang mampu tumbuh secara heterotrofik. Ganggang mikro merupakan kelompok organisme yang sangat beragam dengan mampu menghasilkan senyawa kimia yang besar dan masih banyak yang belum diketahui. Produk yang dihasilkan antara lain karoten, fikobilin, asam lemak, polisakarida, vitamin, sterol, enzim dan senyawa bioaktif lainnya.
Ganggang mikro umumnya bersel satu atau berbentuk benang, sebagai tumbuhan dan dikenal sebagai fitoplankton. Fitoplankton memiliki zat hijau daun (klorofil) yang berperan dalam fotosintesis untuk menghasilkan bahan organik dan oksigen dalam air. Sebagai dasar mata rantai pada siklus makanan di laut, fitoplankton menjadi makanan alami bagi zooplankton baik masih kecil maupun yang dewasa. Selain itu ganggang mikro juga dapat digunakan sebagai indikator kesuburan suatu perairan.
Ganggang mikro merupakan kelompok tumbuhan berukuran renik dengan diameternya
antara 3-30 m, baik sel tunggal maupun koloni yang hidup di seluruh wilayah perairan
tawar maupun laut. Organisme ini mengandung pigmen hijau (klorofil) serta pigmen-pigmen lain seperti: pigmen-pigmen coklat (fikosantin), biru kehijauan (fikobilin), dan merah (fikoeritrin) untuk melangsungkan proses fotosintesis. Morfologi ganggang mikro berbentuk uniseluler atau multiseluler tetapi belum ada pembagian tugas yang jelas pada sel-sel komponennya. Hal itulah yang membedakan ganggang mikro dari tumbuhan tingkat tinggi (Romimohtarto 2004).
Menurut Barianti dan Gualtieri (2006), ganggang mikro merupakan tanaman yang paling efisien dalam menangkap dan memanfaatkan energi matahari dan CO2 untuk keperluan fotosintesis. Fotosintesis didefinisikan sebagai suatu proses di mana terjadi sintesa karbohidrat tertentu dari karbon dioksida dan air yang dilakukan oleh sel-sel yang berklorofil dengan bantuan cahaya matahari.
Ganggang mikro termasuk tumbuhan talus (Thallophyta). Secara umum ada beberapa divisi ganggang yang diklasifikasi berdasarkan pigmennya, yaitu: Divisi Chlorophyta, Chrysophyta, Rhodophyta, Cyanophyta, EuglenophytadanPhaeophyta.
Ordo : Volvocales, Tetrasporales, Chlorococcales, Chlorosarcinales, Ulotrichales, Sphaeropleales, Chaetophorales, Trentepohliales, Oedogoniales, Ulvales,
Cladophorales, Acrosiphoniales, Caulerpales, Siphonocladales,
Dasycladales,danZygnematales
Chlorophyta berukuran antara 3-30 m, memiliki alat gerak (flagela) dan motil kecuali
selama fase reproduksi. Pada reproduksi aseksual, individu yang berenang bebas menjadi nonmotil karena flagela menghilang. Dalam beberapa kasus, sel-sel anak tidak membentuk flagela melainkan sel-sel terus saja memperbanyak diri. Masa sel yang terbentuk dinamakan stadia palmeloid. Stadia ini terdapat pada banyak ganggang sebagai fase perkembangan predominan (Pelczar dan Chan 1986). Setiap sel mempunyai satu nukleus dan satu kloroplas besar yang berbentuk mangkuk. Spesies Chlorophytayang bersel tunggal ada yang dapat berpindah tempat, tetapi ada pula yang menetap. Chlorophyta merupakan golongan terbesar dari ganggang dan merupakan kelompok ganggang yang paling beragam, karena ada yang bersel tunggal, berkoloni, dan bersel banyak. Ganggang ini banyak terdapat di danau, kolam, laut dan kebanyakan hidup di air tawar (Bold dan Wynne 1985).
Chlorophyta atau yang lebih umum disebut ganggang hijau pada selnya mempunyai kloroplas yang berwarna hijau dan mengandung selulosa, mengandung klorofil a dan b serta karotenoid. Chlorophyta pada kloroplasnya terdapat butiran padat yang disebut pirenoid yang berfungsi untuk pembentukan tepung dan minyak. Perkembangbiakannya secara aseksual dan seksual. Secara seksual dengan anisogami dan secara aseksual dengan zoospora dengan 3-4 flagela dan mempunyai 2 vakuola kontraktil yang berguna untuk memaksa kelebihan air keluar dari selnya. Suatu bintik mata merah (stigma) yang merupakan situs persepsi cahaya dan mengendalikan respon fototaktik (gerak menuju cahaya) ganggang ini (Tjitrosoepomo 2005).
2.2.2 Divisi Chrysophyta.
Klas :ChrysophyceaedanBacillariophyceae
Ordo :Ochromonadales, Chrysamoebidales, Chrysocapsales, Chrysosphaerales, Phaeothamniales, Sarcinochrysidales, Pedinellales, Dictyochales.
beberapa membentuk koloni. Ganggang ini memiliki warna khas krisofit yang disebabkan karena klorofilnya tertutup pigmen-pigmen berwarna coklat. Reproduksi Chlorophyta pada umumnya dengan cara pembelahan biner tetapi dapat juga secara seksual dengan isogami (Pelczar dan Chan 1986).
Diatom adalah ganggang pada klas Bacillariophyceae yang bersifat uniseluler, diatom
memiliki ukuran bervariasi antara 5 m hingga 5 mm, beberapa diatom merupakan
koloni dengan bentuk yang bermacam-macam. Sel diatom mempunyai inti dan kromatofora yang berwarna kuning coklat, dalam kromatofora terkandung beberapa macam zat warna, klorofil a, karoten, santofil dan fikosantin dan ada yang tidak memiliki zat warna. Diatom memproduksi vitamin A dan D. Kerangka diatom tersusun atas molekul SiO2. Organisme diatom semasa hidupnya aktif melakukan metabolisme silikon. Unsur Si bersifat esensial bagi pertumbuhan dan perkembangan mahluk hidup. Pada makhluk hidup, kandungan silikon di kulit, tulang dan jaringan pengikat mencapai (0.01-0.04)% (Angka dan Suhartono 2000).
Diatom adalah autotrof, hanya yang tidak mempunyai zat warna yang bersifat heterotrof dan hidup sebagai saprofit. Diatom berkembang biak dengan tiga cara yaitu dengan vegetatif melalui pembelahan sel, vegetatif melalui auksospora (zigot) dan secara generatif melalui oogami. Diatom mendominasi fitoplakton dalam lautan serta perairan air tawar. Lapisan-lapisan tanah yang banyak mengandung sisa-sisa diatom dinamakan tanah diatom (terra silicea). Diatom memiliki anggota sekitar 100.000 spesies diseluruh dunia. Sel-sel diatom menyimpan karbon dalam berbagai bentuk. Diatom menyimpan karbon dalam bentuk minyak alamiah atau sebagai polimer karbohidrat yang dikenal sebagai chrysolaminarin. Beberapa spesies lain kaya akan minyak (Tjitrosoepomo 2005).
2.2.3 DivisiRhodophyta. Klas :Bangiophycidae
Ordo :Porphyridiales, Compsopogonales,danBangiales.
tidak terdapat pada kromatofora tetapi pada permukaannya. Selain tepung florida terdapat juga floridosida yaitu persenyawaan gliserin dan galaktosa serta minyak. Dinding sel dari ganggang merah ini juga terdiri atas dua lapis, di dalam terdiri atas selulosa dan dinding luar terdiri atas pektin yang berlendir. Habitat hidup ganggang merah adalah laut atau ekosistem payau (Atlas dan Bartha 1981).
2.2.4 DivisiCyanophyta. Klas :Cyanophyceae
Ordo :Chroococcales, Chamaesiphonales,danOscillatoriales
Cyanophyta bersel tunggal atau berbentuk benang dengan struktur tubuh yang masih sederhana. Bersifat autotrof dimana kromatofora dan inti tidak ditemukan. Dinding sel mengandung pektin, hemiselulosa dan selulosa yang kadang-kadang berupa lendir, di tengah-tengah sel terdapat bagian yang tidak berwarna yang mengandung asam deoksi-ribonukleat dan asam deoksi-ribonukleat. Sel-sel yang telah tua tampak vakuola. Ganggang ini tidak memiliki flagela sebagai alat geraknya. Umumnya gerakan ganggang ini karena adanya kontraksi tubuh dan dibantu dengan pembentukan lendir. Setelah pembelahan sel-sel tetap bergandengan dengan perantara lendir tadi, dan dengan demikian terbentuk kelompok kelompok atau koloni. Sebagai zat makanan ditemukan glikogen dan butir-butir sianofisin (Tjitrosoepomo 1994).
Hingga saat ini diperkirakan terdapat 2000 spesiesCyanophytayang dapat ditemukan di berbagai habitat yang mengandung air, maupun di dalam tanah serta di bebatuan. Secara umumCyanophytalebih mendominasi pada habitat dengan keasaman netral atau sedikit alkali. Ganggang ini hidup sebagai plakton dan bentos (Bold dan Wynne 1985).
2.2.5 DivisiEuglenophyta. Klas :Euglenophyceae
Ordo :Eutreptiales, Euglenales, danHeteronematales
2.2.6 DivisiPhaeophyta. Klas :Phaeophyceae
Ordo :Ectocarpales, Chordariales, Sporochnales, Desmarestiales, Cutleriales, Sphacelariales, Tilopteridales, Dictyotales, Dictyosiphonales,
Scytosiphonales, Laminariales, Fucales,danDurvillaeales.
Phaeophyta dalam kromatoforanya terkandung fikosantin. Sebagai hasil asimilasi dan sebagai zat makanan cadangannnya tidak pernah ditemukan zat tepung, tetapi sampai 50% dari berat keringnya terdiri atas minyak dan laminarin yaitu sejenis karbohidrat yang lebih dekat dengan selulosa dari pada tepung. Dinding selnya terdiri atas selulosa di bagian dalam dan bagian luar pektin. Sel-selnya hanya memiliki satu inti. Kebanyakan jenis ganggang ini hidup dalam air laut, sebagian lainnya di air tawar (Tjitrosoepomo 1994).
2.3 Komposisi Kimia Sel Ganggang Mikro.
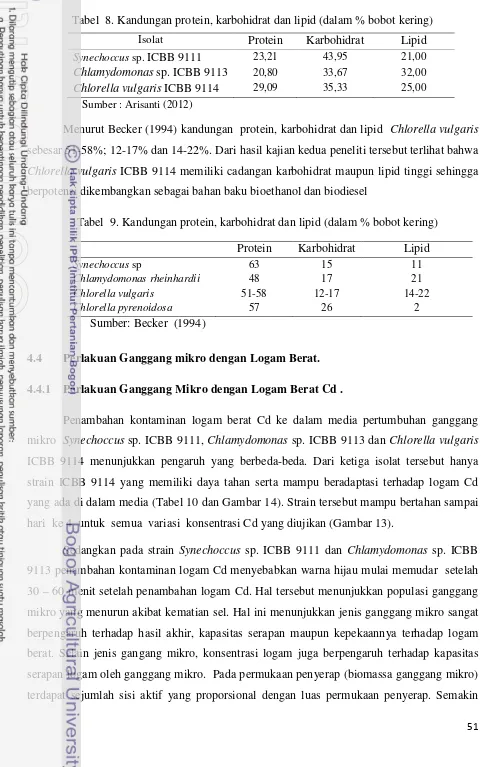
Komposisi kimia sel semua jenis ganggang umumnya terdiri dari protein, karbohidrat, lemak (fatty acids) atau lipid dan asam nukleat. Perbedaan komposisi lipid pada ganggang seringkali memperlihatkan sebagai hasil dari variasi pada lingkungan atau kondisi media biakan. Komposisi kimia ganggang dalam persen bobot kering disajikan pada Tabel 1.
Tabel 1. Komposisi kimia ganggang dalam persen bobot kering
Ganggang Komposisi Kimia (% bobot kering)
Protein Karbohidrat Lemak Asam nukleat Scenedesmus obliquus
adalah salah satu bentuk lipid yang merupakan bentuk simpanan dari karbon, hidrogen dan oksigen. Angka dan Suhartono (2000), menemukan bahwa pada ganggang hijau biru Spirulina kaya akan asam lemak tak jenuh. Salah satu jenis yang utama adalah asam linolenat yang mencapai 20% dari total lipid. Jenis gula yang menyusun karbohidratSpirulinatermasuk ramnosa (19%), glukan (1.5%), silitol berfosfat (2.5%), glukosamin dan asam muramat (2%), glikogen (0.5%), serta asam sialat (0.5%). Bold dan Wynne (1985), menambahkan bahwa 1.7% dari berat dinding sel Pleurotaenium adalah lipid, 0.32% adalah nitrogen dan selebihnya adalah glukosa, galaktosa, xylosa dan arabinosa. Ganggang adalah tumbuhan yang dapat berfotosintesis. Gula merupakan karbohidrat paling sederhana yang dihasilkan dari fotosintesis.
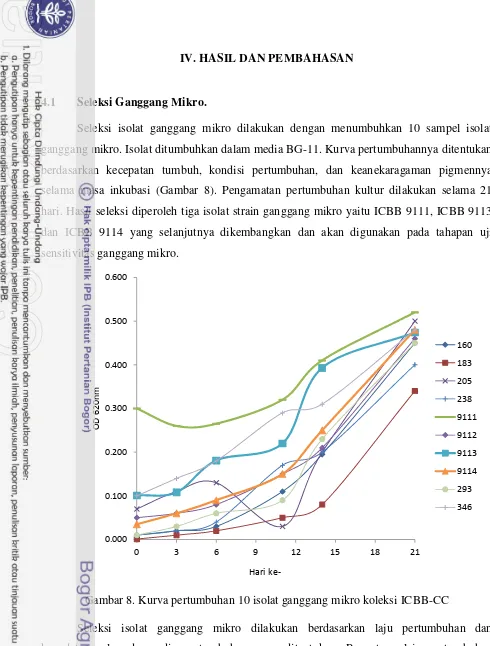
Pertumbuhan ganggang mikro sendiri terdiri dari tiga fase utama, yaitu fase lag, eksponensial dan stasioner. Budidaya ganggang mikro memiliki berbagai keuntungan diantaranya adalah siklus hidup yang pendek, beberapa spesies hanya membutuhkan waktu beberapa jam untuk menyelesaikan siklusnya, seluruh organ dapat dipanen dan dimanfaatkan, diperbanyak sesuai target, serta biaya pemeliharaan yang rendah (Poelmanet al. 1997).
2.4 Pendekatan Identifikasi Ganggang Mikro
Pendekatan identifikasi ganggang mikro dilakukan dengan mengacu pada Bold dan Wynne (1985). Identifikasi ganggang mikro yang utama didasarkan pada karakteristik morfologi serta sifat-sifat selular seperti: sifat pigmen fotosintetik; struktur sel dan flagela yang dibentuk oleh sel-sel yang bergerak, serta lipid sebagai bahan cadangan organik yang dihasilkan sel.
2.4.1 Karakteristik Morfologi.
berisikan klorofil dan pigmen-pigmen pelengkap yang merupakan situs reaksi cahaya fotosintesis.
2.4.2 Sistem pigmen.
Pigmen terdapat dalam kloroplas. Kloroplas di dalam sel letaknya mengikuti bentuk dinding sel (parietal). Kloroplas kerap berisi masa protein cadangan, yang disebut pirenoid.
Tubuh ganggang terdapat zat warna (pigmen), yaitu: - Fikosianin : warna biru
- Klorofil : warna hijau - Fikosantin : warna coklat - Fikoeritrin : warna merah - Karoten : warna keemasan - Xantofil : warna kuning 2.4.3 Sifat Bahan Cadangan.
Cadangan makanan ganggang umumnya merupakan amilum yang tersusun sebagai rantai glukosa tidak bercabang yaitu amilosa dan rantai yang bercabang amilopektin. Seringkali amilum tersebut terbentuk dalam granula bersama dengan badan protein dalam plastida disebut pirenoid. Pirenoid umumnya diliputi oleh butiran-butiran pati, pirenoid ini berasal dari hasil asimilasi berupa tepung dan lemak (lipid) tetapi beberapa jenis tidak mempunyai pirenoid.
2.4.4 Struktur Sel dan Flagela.
Struktur tubuh ganggang sangat bervariasi. Beberapa spesies yang bersel tunggal dapat bergerak atas kekuatan sendiri (motil), sedangkan sebagian lagi non motil. Koloni ganggang dapat berupa benang-benang (filamen). Koloni yang tidak membentuk filamen biasanya merupakan kumpulan sel berbentuk bundar atau pipih tanpa alat lekat (holdfast).
Dua tipe pergerakan fototaksis pada gangang yaitu: a. Pergerakan dengan flagela.
Pada umumnya sel ganggang dijumpai adanya flagela. Flagela dihubungkan dengan struktur yang sangat luas disebut aparatus neuromotor, merupakan granula pada pangkal dari tiap flagela disebut blepharoplas. Flagela tersebut dikelilingi oleh selubung plasma.
Beberapa divisi ganggang juga terdiri dari anggota bersel satu yang tidak mempunyai flagela atau tidak mempunyai alat gerak yang lain. Mekanisme daya penggerak disebabkan adanya stimulus cahaya yang diduga oleh adanya sekresi lendir melalui porus dinding sel pada bagian apikal dari sel. Daya penggerak lain oleh modifikasi khusus gerak ameboid. Gerakan ditimbulkan oleh arus sitoplasmik yang terarah di dalam kanal rafe, yang mendorong sel diatas substrat (Stanieret al. 1982).
Berdasarkan uraian diatas maka divisi taksonomi ganggang utama berdasarkan sifat-sifat seluler disajikan pada Tabel 2.
Tabel 2. Divisi taksonomi ganggang utama berdasarkan sifat-sifat seluler
Nama Umum
Pati, minyak Kebanyakan non motil (kecuali satu ordo), tetapi beberapa sel reproduktif dapat berflagela
Ganggang Keemasan dan Diatom (Chrysophyta)
Karoten Karbohidrat seperti pati; minyak
Flagela: 1 atau 2 sama atau tidak sama; pada beberapa
Flagela: 1, 2, atau 3 yang sama, agak apikal ; ada kerongkongan ; tidak ada dinding sel tetapi mempunyai pelikel elastik Ganggang Coklat
(Phaeophyta)
Fikosantin Laminarin dan lipid Flagela: 2 lateral, tak sama; asam alginat dalam dinding sel. Sumber : Pelczar dan Chan (1986)
2.5 Fisiologis Ganggang Mikro.
Secara umum komunitas ganggang baik di perairan maupun darat dipengaruhi oleh kondisi lingkungan yang ada seperti intensitas cahaya, suhu, salinitas, pH, konsentrasi zat hara organik dan anorganik.
2.5.1 Intensitas Cahaya dan Suhu.
dalam sel juga dapat mengontrol laju fotosintesis secara keseluruhan. Keadaan jenuh cahaya kemungkinan dicapai karena CO2 menjadi faktor pembatas. Jika intensitas cahaya atau konsentrasi CO2 menjadi faktor pembatas fotosintesis, maka suhu akan sangat kecil pengaruhnya. Laju fotosintesis baru bersifat tanggap terhadap suhu pada keadaan dimana cahaya bukan merupakan faktor pembatas. Nilai maksimum kecepatan proses fotosintesis terjadi pada kisaran suhu 25-400C (Reynolds 1990). Ganggang memiliki berbagai jenis pigmen dalam kloroplasnya, maka panjang gelombang cahaya yang diserapnya menjadi lebih bervariasi.
Laju pertumbuhan Chaetoceros gracilis naik pada intensitas penyinaran 500-10.000 klux. Skeletonema costatum banyak dipengaruhi oleh periode penyinaran dengan 10-12 jam gelap merupakan periode penyinaran yang optimum untuk pertumbuhannya. Sehingga dengan peningkatan intensitas sinar dari 500-12.000 klux dapat meningkatkan pertumbuhan jenis ganggang ini, akan tetapi akan menurun jika intensitas melebihi 12.000 klux. Intensitas sinar sebesar 4000-5000 klux merupakan kisaran intensitas sinar optimal untuk pembentukan auksospora diatom (Isnansetyo dan Kurniastuty 1995).
Menurut Borowitzka dan Borowitzka (1988), Dunaliella spp. memiliki toleransi yang tinggi terhadap suhu. Hal ini dimungkinkan oleh adanya dinding sel yang terdiri atas protein. Pada suhu diatas 400CDunaliella tertiolecta mulai mengeluarkan gliserol pada komponen plasma membran sebagai bentuk penyesuaian terhadap perubahan lingkungan.
Setiap jenis ganggang membutuhkan cahaya dan suhu tertentu untuk pertumbuhan maksimumnya. Welch (1980), menyatakan bahwa diatom akan mendominasi perairan pada saat intensitas cahaya tinggi dan suhu rendah. Chlorohyta melimpah pada kondisi intensitas cahaya tinggi dan suhu tinggi, sedangkanCyanophyta akan mendominasi perairan apabila intensitas cahaya rendah dan suhu tinggi.
2.5.2 Salinitas dan pH.
untuk pertumbuhannya. Sedangkan pada Skletonema costatum salinitas yang optimal untuk pembentukan auksospora adalah 20-350/00. Menurut Takagi et al. (2005), penambahan 0,5 M NaCl selama kultivasi ganggang mikro lautDunaliellamemberikan peningkatan pertumbuhan dan kandungan lipid.
Konsentrasi ion hidrogen (H+) dalam cairan sel dan protoplasma sangat penting bagi fisiologis ganggang. Ganggang umumnya hidup dengan baik pada pH netral ( pH 7). Colman dan Gehl (1983), menyatakan bahwa aktivitas fotosintesis akan turun menjadi maximum 33% ketika pH turun pada 5. Pertumbuhan ganggang laut jenisChlorellasp. sangat baik pada kisaran pH 6- 8 dan kisaran salinitas 20-40ppt (Sutomo 1990). Perairan yang berkondisi asam dengan pH kurang dari 6 dapat menyebabkan ganggang tidak dapat hidup dengan baik. Perairan dengan nilai pH lebih kecil dari 4 merupakan perairan yang sangat asam dan dapat menyebabkan kematian organisme air, sedangkan pH lebih dari 9,5 merupakan perairan yang sangat basa dan dapat mengurangi produktivitas organisme air termasuk ganggang (Wardoyo 1982). Air yang bersifat basa dan netral menjadikan organisme yang hidup di dalamnya lebih produktif untuk tumbuh dan berkembang dibandingkan dengan air yang bersifat asam (Hickling 1971).
2.5.3 Unsur Hara.
Unsur hara anorganik utama yang dibutuhkan ganggang mikro untuk tumbuh dan berproduksi adalah N dan P. Gas nitrogen, nitrat, nitrit, ammonium, dan bentuk nitrogen organik adalah bentuk nitrogen dalam air (Boyd 1992). Gas nitrogen (N2) tidak dapat dimanfaatkan secara langsung oleh tumbuhan akuatik dan harus mengalami fiksasi terlebih dahulu menjadi amonia (NH3), amonium (NH4+) dan nitrat (NO3-). Namun beberapa jenis Cyanophyta dapat memanfaatkan gas N2 secara langsung dari udara (Effendi 2003).
Fosfor (P) merupakan unsur esensial bagi pertumbuhan ganggang, sehingga menjadi faktor pembatas bagi pertumbuhan ganggang akuatik. Fosfor ditemukan dalam bentuk senyawa anorganik yang terlarut (ortofosfat dan polifosfat) dan senyawa organik yang berupa partikulat di perairan. Ortofosfat merupakan produk ionisasi dari asam ortofosfat yang paling sederhana dan dapat dimanfaatkan secara langsung oleh ganggang (Boyd 1992). Ganggang tidak dapat memanfaatkan fosfor yang berikatan dengan ion besi dan kalsium pada kondisi aerob karena bersifat mengendap (Jeffries dan Mills 1996).
Menurut Musa (1992), perairan dengan kandungan fosfat rendah 0,00 - 0,02ppm akan didominasi oleh diatom, pada 0,02 – 0,05ppm didominasi oleh Chlorophyta dan pada konsentrasi tinggi yaitu > 0,10ppm akan didominasi oleh Cyanophyta. Selain hara anorganik utama, hara lainnya juga dibutuhkan untuk pengkayaan sejumlah ganggang tertentu seperti Si, Zn, Mn, Mo, Na, Cl, Cu, Co, dan B. Unsur hara mikro berperan dalam sistem enzim, proses oksidasi dan reduksi dalam metabolisme ganggang mikro serta digunakan untuk memproduksi klorofil (Garcia dan Garcia 1985). Walaupun unsur hara anorganik dan organik hanya dibutuhkan dalam jumlah kecil tetapi harus dipenuhi untuk melengkapi daur hidup ganggang (Nybakken 1993).
2.6 Logam Berat.
Logam berasal dari kerak bumi berupa bahan-bahan murni organik dan anorganik. Secara alami siklus perputaran logam adalah dari kerak bumi ke lapisan tanah, ke mahluk hidup, ke dalam air, selanjutnya mengendap dan akhirnya kembali ke kerak bumi (Darmono 1995).
batu-batuan dan mineral lainnya, maka dari itu logam berat secara normal merupakan unsur dari tanah, sedimen, air dan organisme hidup serta akan menyebabkan pencemaran bila konsentrasinya telah melebihi batas normal. Jadi konsentrasi relatif logam dalam media adalah hal yang paling penting (Alloway dan Ayres 1993).
2.7 Pencemaran Logam Berat.
Menurut keputusan Menteri Negara Kependudukan dan Lingkungan Hidup No.02/MENKLH/I/1988 yang dimaksud dengan polusi atau pencemaran air dan udara adalah masuk dan dimasukkannya mahluk hidup, zat, energi dan atau komponen lain ke dalam air/udara dan atau berubahnya tatanan (komposisi) air/udara oleh kegiatan manusia atau proses alam, sehingga kualitas air/udara turun sampai ke tingkat tertentu yang menyebabkan air/udara menjadi kurang atau tidak berfungsi lagi sesuai dengan peruntukannya. Bahan pencemar (polutan) adalah material atau energi yang dibuang ke lingkungan yang mengakibatkan kerusakan lingkungan baik abiotik maupun biotik (Quano 1993). Berdasarkan sumber pencemaran dapat dibagi menjadi dua kelompok (Soegiharto 1976), yakni :
a. Dari laut, misalnya tumpahan minyak baik dari sumbernya langsung maupun hasil pembuangan kegiatan pertambangan di laut, sampah dan airballastdari kapal tanker.
b. Kegiatan darat melalui udara dan terbawa oleh arus sungai yang akhirnya bermuara ke laut.
bahan yang dihasilkan oleh erosi gletser di daerah kutub dan diangkut oleh es yang mengambang.
Logam berat termasuk sebagai zat pencemar karena sifatnya yang tidak dapat diuraikan secara biologis dan stabil, sehingga dapat tersebar jauh dari tempatnya semula (Dewi 1996). Selanjutnya dikatakan bahwa ada dua hal yang menyebabkan logam berat digolongkan sebagai pencemar yang berbahaya, yaitu (1) tidak dihancurkan oleh mikroorganisme yang hidup di lingkungan dan (2) terakumulasi dalam komponen-komponen lingkungan, terutama air dengan membentuk senyawa kompleks bersama bahan organik dan anorganik secara adsorpsi dan kombinasi.
2.7.1 Logam berat dalam perairan.
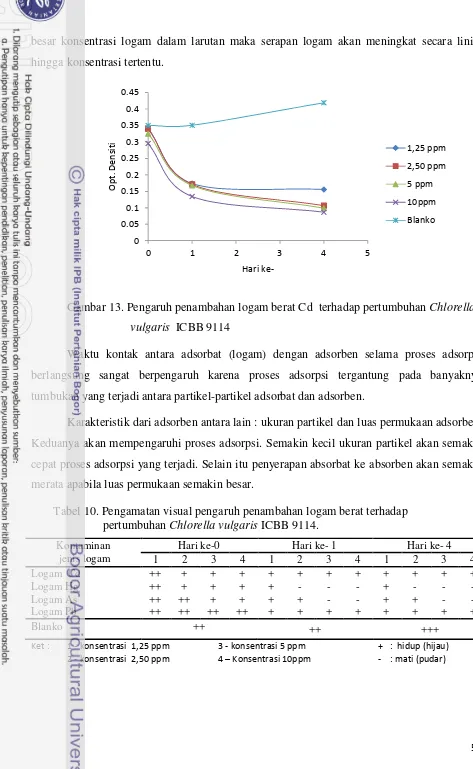
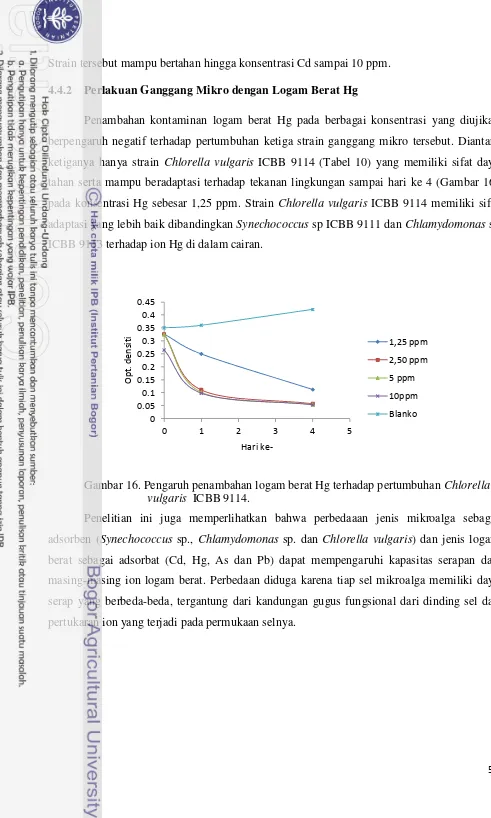
Banyak logam berat yang bersifat toksik maupun esensial terlarut dalam air dan mencemari air tawar maupun air laut. Sumber pencemaran ini banyak berasal dari pertambangan, peleburan logam dan jenis industri lainnya, dan juga dapat berasal dari lahan pertanian yang menggunakan pupuk atau anti hama yang mengandung logam (Darmono 2001). Pencemaran logam berat dapat merusak lingkungan perairan dalam hal stabilitas, keanekaragaman dan kematangan ekosistem. Dari aspek ekologis, kerusakan ekosistem perairan akibat pencemaran logam berat dapat ditentukan oleh faktor kadar dan kesinambungan zat pencemar yang masuk dalam perairan, sifat toksisitas dan bioakumulasi. Pencemaran logam berat dapat menyebabkan terjadinya perubahan struktur komunitas perairan, jaringan makanan, tingkah laku, efek fisiologi, genetik dan resistensi (Racmansyah et al. 1998). Logam-logam berat yang terlarut dalam badan perairan pada konsentrasi tertentu akan berubah fungsi menjadi sumber racun bagi kehidupan. Pada tingkat lanjutan, keadaan tersebut tentu saja dapat menghancurkan satu tatanan ekosistem perairan (Palar 1994).
Secara alamiah, beberapa unsur logam berat terdapat di seluruh alam (Tabel 3), namun dalam kadar yang sangat rendah (Hutagalung 1984). Kadar logam dapat meningkat bila limbah perkotaan, pertambangan, pertanian dan perindustrian yang banyak mengandung logam berat masuk ke dalam perairan alami melalui saluran pembuangan. Logam berat yang sangat beracun ini tahan lama dan sangat banyak terdapat di lingkungan. Logam berat tersebut adalah raksa (Hg), timah hitam (Pb), arsen (As), kadmium (Cd), kromium (Cr) dan nikel (Ni).
Tabel 3. Konsentrasi logam berat di dalam hidrosfer. Logam Air Tawar (µg/l) Air laut (µg/l)
Pb 0,02 – 27 0,13 – 13
Cr 0,1 – 6 0,2 – 50
As 0,001 – 3,5 0,03 – 2,7
Cd 0,01 – 3 0,01 – 4
Ni 0,03 - 10 4 – 10
Sumber : Alloway dan Ayres (1993). 2.7.2 Logam Berat dalam Sedimen.
Sedimen berasal dari kerak bumi yang diangkut melalui proses hidrologi dari suatu tempat ke tempat lain, baik secara vertikal ataupun horizontal (Friedman dan Sanders 1978). Sedimen terdiri dari beberapa komponen dan banyak sedimen merupakan pencampuran dari komponen-komponen tersebut. Komponen tersebut bervariasi, tergantung dari lokasi, kedalaman dan geologi dasar (Forstner dan Wittman 1983). Sedimen terdiri dari bahan organik dan bahan anorganik yang berpengaruh negatif terhadap kualitas air. Bahan organik berasal dari biota atau tumbuhan yang membusuk lalu tenggelam ke dasar dan bercampur dengan lumpur. Bahan anorganik umumnya berasal dari pelapukan batuan. Sedimen hasil pelapukan batuan terbagi atas: kerikil, pasir, lumpur dan liat. Butiran kasar banyak dijumpai dekat pantai, sedangkan butiran halus banyak di perairan dalam atau perairan yang relatif tenang.
Hutabarat dan Evans (1985), telah membagi sedimen berdasarkan ukuran diameter butiran, yaitu batuan (boulders), kerikil (gravel), pasir sangat kasar (very coarse sand), pasir kasar (coarse sand), pasir halus (fine sand), pasir sangat halus (very fine sand), pasir (medium sand), lumpur (silt), liat (clay) dan bahan terlarut (dissolved material).
Bahan partikel yang tidak terlarut seperti pasir, lumpur, tanah dan bahan kimia anorganik dan organik menjadi bahan yang tersuspensi di dalam air, sehingga bahan tersebut menjadi penyebab pencemaran tertinggi dalam air. Keberadaan sedimen pada badan air mengakibatkan peningkatan kekeruhan perairan yang selanjutnya menghambat penetrasi cahaya yang dapat menghambat daya lihat (visibilitas) organisme air, sehingga mengurangi kemampuan ikan dan organisme air lainnya untuk memperoleh makanan, pakan ikan menjadi tertutup oleh lumpur. Kekeruhan yang tinggi dapat mengakibatkan terganggunya kerja organ pernapasan seperti insang pada organisme air dan akan mengakumulasi bahan beracun seperti pestisida dan senyawa logam.
sedimen sungai sangat krusial. Kandunganlogam berat dalam sedimen akan mempengaruhi organisme yang tinggal di dasar air, benthos. Hasil penelitian (Tabel 4). menemukan beberapa elemen logam terkonsentrasi pada sedimen di beberapa lokasi pengambilan sampel daerah aliran sungai Citarum. Konsentrasi yang lebih tinggi dari unsur Cr, Cu dan Pb menunjukkan input yang berasal dari area industri, khususnya industri tekstil. Telah diketahui bahwa industri tekstil menggunakan berbagai macam logam berat dalam prosesnya, terutama dalam proses “dyeing” dan “printing”. Akibatnya, mereka membuang sejumlah logam berat ke lingkungan. Sunardi dan Ariyanti (2009) telah menunjukkan bahwa sedimen yang terkontaminasi logam akan bersifat toksik terhadap organisme benthos.
Tabel 4. Kandungan logam berat pada sedimen sungai Citarum
Lokasi Hg
Cisanti 133 1,35 117 43 12
Majalaya 118,92 0,990 99,3 49,2 26,8
Rancaekek 140,54 1,005 58,8 42,0 11,8
Cisirung 978 1,95 324 131 29
Margaasih 356,76 0,765 51,4 62,7 79,3
Batu Jajar 172,97 0,765 30,6 159,5 40,7
Cihaur 118,92 0,900 48,6 30,2 13,9
Jatiluhur 140,54 0,885 35,1 20,6 25,7
Bekasi 140,54 0,960 48,4 156,2 18,2
Sumber : Sunardi dan Ariyanti (2009).
Pada sedimen terdapat hubungan antara ukuran partikel sedimen dengan kandungan bahan organik. Pada sedimen yang halus, persentase bahan organik lebih tinggi dari pada sedimen yang kasar. Hal ini berhubungan dengan kondisi lingkungan yang tenang, sehingga memungkinkan pengendapan sedimen lumpur yang diikuti oleh akumulasi bahan organik ke dasar perairan. Sedangkan pada sedimen yang kasar, kandungan bahan organiknya lebih rendah karena partikel yang lebih halus tidak mengendap. Demikian pula dengan bahan pencemar, kandungan bahan pencemar yang tinggi biasanya terdapat pada partikel sedimen yang halus. Hal ini diakibatkan adanya daya tarik elektrokimia antara partikel sedimen dengan partikel mineral.
2.7.3 Logam Berat dalam Organisme Air.
mengakumulasi logam berat dapat melalui beberapa cara, yaitu melalui saluran pernapasan (insang), saluran pencernaan dan difusi permukaan kulit (Hutagalung 1991; Darmono 2001). Namun sebagian besar logam berat masuk ke dalam tubuh organisme air melalui rantai makanan dan hanya sedikit yang diambil dari air (Waldichuck 1974). Akumulasi dalam tubuh organisme air dipengaruhi oleh konsentrasi bahan pencemar dalam air, kemampuan akumulasi, sifat organisme (jenis, umur dan ukuran) dan lamanya pernapasan.
2.7.4 Raksa (Hg).
Logam merkuri bernomor atom 80, berat atom 200,59, titik didih 356,9oC, dan massa jenis 13,6 g/ml (Reilly 1991). Merkuri dalam perairan dapat berasal dari buangan limbah industri kelistrikan dan elektronik, baterai, pabrik bahan peledak, fotografi, pelapisan cermin, pelengkap pengukur, industri bahan pengawet, pestisida, industri kimia, petrokimia, limbah kegiatan laboratorium dan pembangkit tenaga listrik yang menggunakan bahan baku bakar fosil (Suryadiputra 1995).
Merkuri terdapat dalam bentuk Hg (murni), Hg anorganik dan Hg organik (Darmono 1995). Merkuri di alam umumnya terdapat sebagai metil merkuri yaitu bentuk senyawa organik (alkil merkuri atau metil merkuri) dengan daya racun tinggi dan sukar terurai dibandingkan zat asalnya. Bila terakumulasi metil merkuri dalam tubuh, akan mengakibatkan keracunan yang bersifat akut maupun kronis (Darmono 1995). Akibat dari keracunan akut antara lain adalah mual, muntah-muntah, diare, kerusakan ginjal, bahkan dapat mengakibatkan kematian. Keracunan kronis ditandai oleh peradangan mulut dan gusi, pembengkakan kelenjar ludah dan pengeluaran ludah secara berlebihan, gigi menjadi longgar dan kerusakan pada ginjal. Kadar maksimum merkuri untuk keperluan air baku air minum kurang dari 0,001 mg/L dan untuk kegiatan perikanan yang diperbolehkan kurang dari 0,002 mg/L (Peraturan Pemerintah No. 82 Tahun 2001).
manusia cenderung terkonsentrasi di dalam hati dan ginjal, karena di dalam organ tersebut terdapat protein yang terdiri dari asam amino sistein (Fardiaz 1992).
Logam berat Hg berbahaya karena bersifat biomagnifikasi sehingga dapat terakumulasi dalam jaringan tubuh organisme melalui rantai makanan. Organisme yang berada pada rantai yang paling tinggi (top carnivora) memiliki kadar merkuri yang lebih tinggi dibanding organisme di bawahnya. Logam berat dalam jumlah berlebihan dapat bersifat racun. Hal ini disebabkan karena terbentuknya senyawa merkaptida antara logam berat dengan gugus –SH yang terdapat dalam enzim. Akibatnya aktifitas enzim tidak berlangsung. Toksisitas merkuri terhadap organisme perairan tergantung pada jenis, kadar efek sinergis-antagonis dan bentuk fisika kimianya (Hutagalung 1989).
Merkuri yang paling toksik adalah bentuk alkil merkuri yaitu metil dan etil merkuri yang paling banyak digunakan untuk mencegah timbulnya jamur. Alkil merkuri, terakumulasi dalam hati dan ginjal yang dikeluarkan melalui cairan empedu.
2.7.5 Timbal (Pb).
Timbal atau timah hitam adalah sejenis logam lunak berwarna cokelat dengan nomor atom 82, berat atom 207,19, titik cair 327,5º C, titik didih 1725º C, dan berat jenis 11,4 gr/ml (Reilly 1991). Logam ini mudah dimurnikan sehingga banyak digunakan oleh manusia pada berbagai kegiatan misalnya pertambangan, industri dan rumah tangga. Pada pertambangan timbal berbentuk senyawa sulfida (PbS).
Timbal (Pb) secara alami banyak ditemukan dan tersebar luas pada bebatuan dan lapisan kerak bumi. Di perairan logam Pb ditemukan dalam bentuk Pb2+, PbOH+, PbHCO3+, PbSO4dan PbCO+(Rohilan 1992). Pb2+ di perairan bersifat stabil dan lebih mendominasi dibandingkan dengan Pb4+. Masuknya logam Pb ke dalam perairan melalui proses pengendapan yang berasal dari aktivitas di darat seperti industri, rumah tangga dan erosi, jatuhan partikel-partikel dari sisa proses pembakaran yang mengandung tetraetil Pb, air buangan dari pertambangan bijih timah hitam dan buangan sisa industri baterai (Palar 1994).
ion-ion Pb2+ dengan gugus sulfur di dalam asam-asam amino. Untuk menjaga keamanan dari keracunan logam ini, batas maksimum timbal dalam makanan laut yang ditetapkan oleh Departemen Kesehatan RI dan FAO adalah sebesar 2,0 ppm. Pada organisme air kadar maksimum Pb yang aman dalam air adalah sebesar 50 ppb (EPA 1973).
2.7.6 Kadmium (Cd).
Kadmium adalah logam yang berwarna putih keperakan, lunak dan tahan korosi. Kadmium didapat pula pada limbah berbagai jenis pertambangan logam yang tercampur kadmium seperti timah hitam dan seng. Dengan demikian, kadmium dapat ditemukan di dalam perairan, baik di dalam sedimen maupun di dalam penyediaan air minum (Soemirati 1994). Logam kadmium sangat banyak digunakan dalam kehidupan sehari-hari manusia. Antara lain sebagai bahan stabilisasi, bahan pewarna dalam industri plastik dan pada elekrtoplating dan juga digunakan untuk solder dan baterai (Palar 1994).
Senyawa kadmium juga digunakan sebagai bahan fotografi, pembuatan tabung TV, cat, karet, kembang api, percetakan tekstil dan pigmen untuk gelas dan email gigi. Kadmium dalam tubuh terakumulasi dalam hati dan terutama terikat sebagai metalotionein mengandung unsur sistein, dimana Cd terikat dalam gugus sufhidril (-SH) dalam enzim seperti karboksil sisteinil, histidil, hidroksil, dan fosfatil dari protein purin. Kemungkinan besar pengaruh toksisitas Cd disebabkan oleh interaksi antara Cd dan protein tersebut, sehingga menimbulkan hambatan terhadap aktivitas kerja enzim dalam tubuh ( Darmono 2001).
2.7.7 Arsen (As).
Arsen, adalah bahan metaloid yang terkenal beracun dan memiliki tiga bentuk alotropik; kuning, abu-abu dan hitam (Norman 1998). Senyawa arsenik digunakan
sebagai pestisida dan dalam alloy. Arsenik secara kimiawi memiliki karakteristik yang serupa dengan fosfor dan sering dapat digunakan sebagai pengganti dalam berbagai reaksi biokimia dan juga beracun. Ketika dipanaskan, arsenik akan cepat teroksidasi menjadi oksida arsenik, yang berbau seperti bau bawang putih. Arsenik dan beberapa senyawa arsenik juga dapat langsung tersublimasi, berubah dari padat menjadi gas tanpa menjadi cairan terlebih dahulu. Zat dasar arsenik ditemukan dalam dua bentuk padat yang berwarna kuning dan metalik, dengan berat jenis 1,97 g/cm3dan 5,73 g/cm3 (Hollemanet al.1985).
oksida As2O3(arsen putih) dan As2O5. Oksida ini bersifat higroskopis dan mudah larut dalam air membentuk asam. Asam yang terbentuk dari arsen (V) merupakan asam lemah, dalam bentuk garamnya arsenik dapat mencemari air tanah. Senyawa arsen inorganik terpapar pada manusia melalui kontak langsung dengan air atau gas yang mengandung arsenik. Beberapa tempat di bumi mengandung arsen yang cukup tinggi sehingga dapat merembes ke air tanah. Arsenik dalam air tanah bersifat alami, dan dilepaskan dari sedimen ke dalam air tanah karena tidak adanya oksigen pada lapisan di bawah permukaan tanah. Arsenat sintetik seperti Paris Green [tembaga (II) asetoarsenik], kalsium arsenat, dan timbal hidrogenarsenat digunakan sebagai insektisida dan racun hama (Rahman et al. 2004). Timbal hydrogen arsenat digunakan sebagai insektisida umum pada tanaman buah (Peryea 1998). Penelitian Stolz et al. (2006) menemukan beberapa spesies bakteri menggunakan arsenic bebagai bahan bahan mendapatkan energi metabolism, bakteri tersebut mereduksi arsenat menjadi arsenik, dengan memanfaatkan enzim arsenat reduktase (ArrE).
2.8 Pestisida
2.8.1 Pengertian Pestisida.
Pestisida (Inggris: pesticide) berasal dari katapest yang berarti hama dan cide yang berarti mematikan/racun. Jadi pestisida adalah racun hama. Secara umum pestisida dapat didefenisikan sebagai bahan yang digunakan untuk mengendalikan populasi jasad yang dianggap sebagai pest (hama) yang secara langsung maupun tidak langsung merugikan kepentingan manusia.
Menurut Peraturan Pemerintah No. 7 tahun 1973 (PP No. 7 tahun 1973) tentang pengawasan atas peredaran, penyimpanan dan penggunaan pestisida, pestisida adalah semua zat kimia dan bahan lain serta jasad renik dan virus yang dipergunakan untuk :
a. Memberantas atau mencegah hama-hama dan penyakit-penyakit yang merusak tanaman, bagian-bagian tanaman atau hasil-hasil pertanian. b. Memberantas rerumputan.
c. Mematikan daun dan mencegah pertumbuhan yang tidak diinginkan. d. Mengatur atau merangsang pertumbuhan tanaman atau bagian-bagian
tanaman tidak termasuk pupuk.
e. Memberantas atau mencegah hama-hama luar pada hewan-hewan piaraan atau ternak.
g. Memberantas atau mencegah binatang-binatang dan jasad-jasad renik dalam rumah tangga, bangunan dan dalam alat-alat pengangkutan.
h. Memberantas atau mencegah binatang-binatang yang dapat menyebabkan penyakit pada manusia atau binatang yang perlu dilindungi dengan penggunaan pada tanaman, tanah atau air.
Menurut The United States Federal Insecticide, Fungicide, and Rodenticide Act (FIFRA), pestisida adalah sebagai berikut :
a. Semua zat atau campuran zat yang khusus digunakan untuk mengendalikan, mencegah, atau menangkis gangguan serangga, binatang pengerat, nematoda, gulma, virus, bakteri, jasad renik yang dianggap hama, kecuali virus, bakteri atau jasad renik lainnya yang terdapat pada manusia dan binatang.
b. Semua zat atau campuran zat yang digunakan untuk mengatur pertumbuhan tanaman atau pengering tanaman (Djojosumarto 2004). 2.8.2 Penggolongan Pestisida.
Pestisida mempunyai sifat-sifat fisik, kimia dan daya kerja yang berbeda-beda, karena itu dikenal banyak macam pestisida. Pestisida dapat digolongkan menurut berbagai cara tergantung pada kepentingannya, antara lain: berdasarkan sasaran yang akan dikendalikan, berdasarkan cara kerja, berdasarkan struktur kimianya dan berdasarkan bentuknya. Penggolongan pestisida berdasarkan sasaran yang akan dikendalikan yaitu :
a. Insektisida adalah bahan yang mengandung senyawa kimia beracun yang bisa mematikan semua jenis serangga.
b. Fungisida adalah bahan yang mengandung senyawa kimia beracun dan bisa digunakan untuk memberantas dan mencegah fungi/cendawan. c. Bakterisida, disebut bakterisida karena senyawa ini mengandung bahan
aktif beracun yang bisa membunuh bakteri.
d. Nematisida, digunakan untuk mengendalikan nematoda/cacing.
e. Akarisida atau sering juga disebut dengan mitisida adalah bahan yang mengandung senyawa kimia beracun yang digunakan untuk membunuh tungau, caplak, dan laba-laba.
g. Moluskisida adalah pestisida untuk membunuh moluska, yaitu siput telanjang, siput setengah telanjang, sumpil, bekicot, serta trisipan yang banyak terdapat di tambak.
h. Herbisida adalah bahan senyawa beracun yang dapat dimanfaatkan untuk membunuh tumbuhan pengganggu yang disebut gulma.
2.8.3 Herbisida.
Herbisida merupakan suatu bahan atau senyawa kimia yang digunakan untuk menghambat pertumbuhan atau mematikan tumbuhan. Herbisida ini dapat mempengaruhi satu atau lebih proses-proses (seperti pada proses pembelahan sel, perkembangan jaringan, pembentukan klorofil, fotosintesis, respirasi, metabolisme nitrogen, aktivitas enzim dan sebagainya) yang sangat diperlukan tumbuhan untuk mempertahankan kelangsungan hidupnya. Pengertian tersebut mengandung arti bahwa herbisida berasal dari metabolit, hasil ekstraksi, atau bagian dari suatu organisme. Di samping itu herbisida bersifat racun terhadap gulma atau tumbuhan penganggu juga terhadap tanaman. Herbisida yang diaplikasikan dengan dosis tinggi akan mematikan seluruh bagian yang dan jenis tumbuhan. Pada dosis yang lebih rendah, herbisida akan membunuh tumbuhan sasaran dan tidak merusak tumbuhan yang lainnya.
Dari cara kerjanya herbisida ada 2 macam, herbisida kontak dan herbisida sistemik. Herbisida kontak adalah herbisida yang berguna untuk menyiang gulma dengan cara langsung mengganggu tanaman untuk berfotositensis, gulma yang secara langsung terkena herbisida kontak akan mati. Herbisida sistemik adalah herbisida yang cara kerjanya dengan mengganggu enzim yang berperan dalam membentuk asam amino yang dibutuhkan tanaman, dan mudah menyerap ke seluruh jaringan tanaman, gulma akan mati sampai akar-akarnya.
Berdasarkan mekanisme kerjanya herbisida pada tanaman di antaranya: a. menghambat proses fotosintesis, seperti anilides, uracils, benzimidazoles, biscarmabates, pyridazinones, triazines, quinones, dan triazinones. b. menghambat sintesis asam amino, sepertiglyphosate, sulfonilures, bialaphos,dan imidazolinones. c. mengganggu membran sel, seperti p-nitrodiphenyl eter, N-phenylamides, dan oxadiazoles. d. menghambat sintesis lipid, seperti asam alkali aryloxyphenoxy e. mengambat sintesis selulosa, sepertidichlobenilf. menghambat pembelahan sel, seperti fosfor amida dan dinitroanilin g. menghambat sintesis klorofil, sepertiphiridazinones, fluoridon, dan difluninon h. menghambat sintesis folat, seperti metilkarbamat i. menghambat pertumbuhan tunas, seperti metachlor j. mengatur perkembangan, seperti asam pikolinat dan asam benzoat.
2.8.3.1 Paraquat.
Herbisida paraquat merupakan herbisida kontak dari golongan bipiridilium yang digunakan untuk mengendalikan gulma yang diaplikasikan pasca-tumbuh. Herbisida tersebut digunakan secara luas untuk mengendalikan gulma musiman khususnya rerumputan (Tjitrosoedirdjo et al. 1984). Paraquat (C12H14N2Cl2) adalah nama dagang untuk 1,1'-dimethyl-4,4'-bipyridinium dichloride, salah satu yang paling banyak digunakan di dunia herbisida. Paraquat, yang viologen, bersifat cepat bereaksi dan non-selektif, membunuh tanaman hijau pada jaringan kontak. Paraquat juga bersifat racun bagi mahluk hidup bila terakumulasi didalam tubuh. Herbisida paraquat bekerja dalam kloroplas. Kloroplas merupakan bagian dalam proses fotosintesis, yang mengabsorbsi cahaya matahari yang digunakan untuk menghasilkan gula.
Gambar 2. Senyawa paraquatdiklorida
2.8.3.2 Glifosat.
Glifosat (Gambar 3) dengan rumus kimia C3H8NO5P adalah herbisida berspektrum luas dapat mematikan sebagian besar tipe tanaman. Glifosat dapat mengendalikan gulma semusim maupun tahunan di daerah tropis pada waktu pasca-tumbuh (Woodburn 2000).Cara kerja herbisida ini adalah dengan menghambat enzim 5-enolpiruvil-shikimat-3-fosfat sintase (EPSPS) yang berperan dalam pembentukan asam amino aromatik, seperti triptofan, tirosin, dan fenilalanin. Tumbuhan akan mati karena kekurangan asam amino yang penting untuk melakukan berbagai proses hidupnya. Glifosat dapat masuk ke dalam tumbuhan karena penyerapan yang dilakukan tanaman dan kemudian diangkut ke pembuluh floem.
Gambar 3. Senyawa Glifosat
Paparan glifosat pada manusia akan menyebabkan beberapa gejala, seperti iritasi mata, penglihatan menjadi kabur, kulit terbakar atau gatal, mual, sakit tenggorokan, asma, kesulitan bernapas, sakit kepala, mimisan, dan pusing. Sedangkan pada tanaman gejala keracunan terlihat agak lambat, dimana daun akan terlihat layu menjadi coklat dan akhirnya mati. Gejala akan terlihat 1-3 minggu setelah aplikasi (Djojosumarto 2008).
2.8.4 Insektisida.
Insektisida merupakan pestisida yang cukup besar diproduksi dan digunakan pada sektor pertanian di Indonesia selain herbisida dan fungisida. Ada tiga golongan insektisida yang terkenal sebelum dan selama ini, yaitu 1) golongan organoklorin, 2) golongan organofosfat, dan 3) golongan karbamat. Golongan pestisida organoklorin ini mempunyai tiga sifat utama, yaitu merupakan racun yang universal, degradasinya berlangsung sangat lambat, dan larut dalam lemak. Pestisida ini merupakan senyawa yang tidak reaktif, bersifat stabil, dan persisten, serta terkenal sebagai ’broad spectrum insectisides’, yaitu jenis pestisida yang paling banyak menimbulkan masalah. Oleh karena itu pestisida golongan organokhlorin di Indonesia tidak diperkenankan lagi untuk dipergunakan pada sektor pertanian. Jenis organoklorin yang dikenal sebelum ini yaitu DDT, endrin, dieldrin, lindane, aldrin, chlondane.
2.8.4.1 Karbamat.
organofosfat, tidak berakumulasi dalam sistem kehidupan, serta agak cepat menurun konsentrasinya di alam. Karbamat merupakan insektisida yang bersifat sistemik dan berspektrum luas sebagai nematosida dan akarisida (Bonner et al. 2005; Tejada et al. 1990; Cogger et al. 1998). Golongan karbamat pertama kali disintesis pada tahun 1967 di Amerika Serikat dengan nama dagang Furadan (Cornell University 2001). Umumnya karbamat digunakan untuk membasmi hama tanaman pangan dan buah-buahan pada padi, jagung, jeruk, alfalfa, ubi jalar, kacang-kacangan dan tembakau (Bonner et al. 2005. Tejada et al. 1990). Dengan dilarangnya sebagian besar pestisida golongan organoklorin (OC) di Indonesia (Mentan 2001), maka pestisida golongan organofosfat (OP) dan karbamat menjadi alternatif bagi petani di dalam mengendalikan hama penyakit tanaman di lapangan.
Penggunaan pestisida ini sudah cukup luas, baik pada bidang pertanian maupun bidang kesehatan masyarakat. Jenis golongan karbamat antara lain furadan, ferban, baygon, carbaryl. Sadjusi dan Lukman (2004) melaporkan bahwa insektisida golongan karbamat yang banyak digunakan di lapangan terdiri dari jenis karbofuran, karbaril dan aldikarb. Sementara itu, beberapa jenis pestisida golongan karbamat yang umum digunakan pada lahan sawah irigasi dan tadah hujan di Jawa Tengah antara lain karbaril (Sevin™), karbofuran (Furadan™ dan Curater™), tiodikarb (Larvin™) dan BPMC/Butyl Phenyl-n-Methyl Carbamate (Bassa™, Dharmabas™ dan Baycarb™) (Jatmiko et al. 1999).
Gambar 4. Senyawa karbamat (R= aril / alkil)
merupakan insektisida antikolinestrase. Inhibisi antikolinestrasi karbamat (Gambar 5) melalui tahapan : interaksi active site asetilkolinetrase membentuk ikatan kompleks yang tidak stabil, kemudian terjadi hidrolisis senyawa kompleks dengan melepaskan ikatan Z atau R substitusi yang menghasilkanCarbamylated(ester karbamat) terinhibisi dan menjadi non reaktif, selanjutnya terjadi dekarbamilasi menghasilkan AchE bebas, sehingga kembali mampu memutuskan asetilkolin (Ach) sebagai transmitter (Soemirat 2009)
Gambar 5. Skema interaksi karbamat dengan enzim Asetikolinestrase. 2.8.4.2 Deltametrin.
Deltamethrin (Gambar 6) adalah insektisida pyrethroids yang mematikan bagi serangga terutama bila masuk ke dalam saluran pencernaan dan bekerja dengan cara melumpuhkan system saraf serangga (ETN 1995). Pyrethroids memiliki bahan aktif yang dapat menyebabkan iritasi dan alergi. Deltamethrin merupakan racun saraf yang menyerang akson pada saraf pusat dan juga saraf tepi dengan menghambat pompa natrium di mamalia atau serangga (WHO 1999).
Gambar 6. Senyawa deltametrin (WHO 1999).