i
POTENSI EKSTRAK UMBI DAN DAUN UBI JALAR UNGU
SEBAGAI INHIBITOR
α
-GLUKOSIDASE
DIAH DARU ASIH PAMUNGKAS
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
i
ABSTRAK
DIAH DARU ASIH PAMUNGKAS. Potensi Ekstrak Umbi dan Daun Ubi Jalar
Ungu
s
ebagai Inhibitor α
-Glukosidase.
Dibimbing
oleh
IRMANIDA
BATUBARA dan IRMA HERAWATI SUPARTO.
Ubi jalar ungu dilaporkan dapat membantu diet harian bagi penderita
diabetes melitus tipe 2 karena memiliki kadar glikemik yang rendah. Salah satu
mekanisme menurunkan kadar gula darah pada penderita diabetes adalah dengan
menghambat enzim
α
-glukosidase. Pada penelitian ini, potensi ekstrak alkaloid
dari daun dan ekstrak antosianin dari umbi ubi jalar ungu dievaluasi sebagai
inhibitor enzim
α
-glukosidase. Penelitian menggunakan ubi jalar ungu dari
Ciampea, Bogor. Ekstrak alkaloid 2000 ppm ditunjukkan aktif menghambat kerja
enzim sebesar 61.88%, sedangkan ekstrak antosianin tidak aktif (hanya
menghambat 0.25%). Ekstrak alkaloid selanjutnya difraksionasi menggunakan
kromatografi kolom dengan fase diam silika gel
dan kloroform sebagai eluen.
Fraksi yang mengandung alkaloid dengan semprotan Dragendorf, yakni F10,
kemudian dipisahkan lebih lanjut dengan kromatografi lapis tipis preparatif.
Fraksi F10.15 positif mengandung alkaloid dan dapat menghambat enzim
-glukosidase sebesar 18.07% pada konsentrasi 1250 ppm. Spektrum inframerah
transformasi Fourier fraksi ini memperlihatkan gugus fungsi
–NH−, –
OH, dan
–
CH
2–
dan diduga mengandung alkaloid polihidroksi alisiklik dengan kerangka
mirip gula.
ABSTRACT
DIAH DARU ASIH PAMUNGKAS. Potency of Leaves and Tuberous Extract of
Purple Sweet Potatoes
as α
-Glucosidase Inhibitor. Supervised by IRMANIDA
BATUBARA and IRMA HERAWATI SUPARTO.
Purple sweet potato has been reported as a component of daily diet for
type 2 diabetes mellitus patient because of its low glycemic index. A mechanism
for decreasing blood’s sugar
content in diabetic patients is by inhibiting
α
-glucosidase enzyme. In this study, the potencies of alkaloid extract from leaves
and anthocyanin extract from tuberous of purple sweet potato were investigated as
an inhibitor of
α
-glucosidase. The sample used was purple sweet potato from
Ciampea, Bogor. The 2000 ppm alkaloid extract could inhibit
α
-glucosidase
activity (61.88%), whereas anthocyanin extract was inactive (only inhibited
0.25%). The alkaloid extract was then fractionated by column chromatography
with silica gel stationary phase and chloroform as eluent. Fraction containing
alkaloid with Dragendorf spraying was F10, which was further separated by
preparative thin layers chromatography. F10.15 fraction contained alkaloid and
had inhibition activity of 18.07% at 1250 ppm. Fourier transform infrared
spectrum of this fraction showed
–NH−, –
OH, and
–
CH
2–
functional groups and
ii
POTENSI EKSTRAK UMBI DAN DAUN UBI JALAR UNGU
SEBAGAI INHIBITOR
α
-GLUKOSIDASE
DIAH DARU ASIH PAMUNGKAS
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
iii
Judul Skripsi : Potensi Ekstrak Umbi dan Daun Ubi Jalar Ungu sebagai
Inhibitor
α
-Glukosidase
Nama
: Diah Daru Asih Pamungkas
NIM
: G44096020
Diketahui
Ketua Departemen Kimia
Prof Dr Ir Tun Tedja Irawadi, MS
NIP 195012271976032002
Tanggal Lulus:
Diketahui
Pembimbing I,
Pembimbing II,
Dr Irmanida Batubara, SSi MSi
NIP 19750807 200501 2 001
iv
PRAKATA
Puji dan syukur ke hadirat Allah SWT yang telah melimpahkan rahmat dan
karunia-Nya sehingga penulis dapat menyelesaikan skripsi yang berjudul
“Potensi
Ekstrak Umbi dan Daun Ubi Jalar Ungu sebagai Inhibitor
α
-Glukosidase
”
.
Penelitian ini dilaksanakan pada bulan September 2011 sampai bulan April 2012
di Laboratorium Kimia Analitik, Fakultas Matematika dan Ilmu Pengetahuan
Alam (FMIPA), Institut Pertanian Bogor (IPB) dan Laboratorium Pusat Studi
Biofarmaka Institut Pertanian Bogor (PSB IPB). Skripsi ini disusun sebagai salah
satu syarat kelulusan Program Sarjana Alih Jenis di Departemen Kimia FMIPA
IPB.
Penulis mengucapkan terima kasih kepada Dr Irmanida Batubara, SSi, MSi
selaku pembimbing pertama dan Dr dr Irma H Suparto, MS sebagai pembimbing
kedua yang selalu memberikan motivasi, kritik, dan saran untuk kelancaran
penelitian dan penulisan. Apresiasi kepada Bapak Eman, Ibu Nunung, Bapak
Engkos, dan Bapak Dede yang telah menyediakan alat dan bahan selama
penelitian serta staf PSB IPB (
mba
Salina, Ibu Nunuk,
mas
Endi,
mas
Nio,
mas
Jaim, dan
mba
Wiwi) yang telah membantu penulis dalam melakukan penelitian.
Penghargaan yang setingi-tingginya juga dihaturkan untuk Bapak,
Mamah
,
Mba
Dian, dan
Mas
Marten yang selalu memberikan dukungan dan kasih
sayangnya. Ucapan terima kasih kepada Fitriyani, Meysianna, Irma, Pita, Wina,
Zurida, Niati, Ichsan, Debby, dan Cahya serta rekan-rekan Program S1 Alih Jenis
Angkatan 3 yang selalu memberikan semangat selama penelitian. Terima kasih
juga diucapkan kepada Lina, Intan, dan kostan
Pondok Ratna
(Lilis, Fina, Resty,
Age, Aisyah, Sarah, Idah, Suhe, dan Yunika). Semoga tulisan ini dapat
memberikan manfaat dalam perkembangan ilmu pengetahuan.
Bogor, September 2012
v
RIWAYAT HIDUP
Penulis dilahirkan di Ciamis pada tanggal 28 Oktober 1988 dari pasangan
Muhammad Suwardi dan Ngatirah. Penulis merupakan anak keempat dari empat
bersaudara. Penulis menyelesaikan pendidikan di Sekolah Menengah Atas Negeri
1 Ciamis tahun 2006, lalu melanjutkan di Program Diploma 3 Analisis Kimia IPB
tahun 2006
−
2009 dan di Program Sarjana Alih Jenis Departemen Kimia IPB
tahun 2009−2012
.
vi
DAFTAR ISI
Halaman
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... vii
DAFTAR LAMPIRAN ... viii
PENDAHULUAN ... 1
METODE ... 1
Alat dan Bahan ... 1
Lingkup Kerja ... 1
HASIL DAN PEMBAHASAN ... 3
Kadar Air dan Abu ... 3
Ekstrak ... 4
Kandungan Fitokimia ... 4
Aktivitas Inhibisi α
-Glukosidase Ekstrak ... 4
Eluen Terbaik KLT ... 5
Hasil Fraksionasi dengan Kromatografi Kolom (KK) ... 5
Hasil Fraksionasi dengan KLT Preparatif (KLTP) ... 6
Identitas Senyawa ... 6
SIMPULAN DAN SARAN ... 7
Simpulan ... 7
Saran ... 7
DAFTAR PUSTAKA ... 7
vii
DAFTAR TABEL
Halaman
1 Kadar abu ubi jalar ungu berdasarkan bobot basah dan kering ... 4
2 Rendemen ekstrak ubi jalar ungu ... 4
3 Fitokimia ekstrak kasar ... 4
4 Absorpsi inframerah fraksi 10.15 ... 6
DAFTAR GAMBAR
Halaman
1 Foto umbi dan daun ubi jalar ungu ... 1
2 Kromatogram ekstrak alkaloid dengan eluen metanol, aseton, kloroform, ...
n
-heksana dan etil asetat pada UV 366 nm ... 5
3 Kromatogram ekstrak alkaloid dengan eluen kloroform-aseton 1:1, 2:1, 1:2, ...
3:1, dan 1:3 pada UV 366 nm ... 5
4 Kromatogram
ekstrak alkaloid, F1−F12, dan ekstrak alkaloid pada UV
...
366 nm . ... 6
5
Kromatogram ekstrak alkaloid, F1−F9, F10 (positif alkaloid), F11, F12, dan
..
ekstrak alkaloid yang disemprot pereaksi Dragendorf ... 6
viii
DAFTAR LAMPIRAN
Halaman
1 Diagram alir penelitian ... 10
2 Kadar air daun ubi jalar ungu ... 11
3 Kadar abu daun ubi jalar ungu ... 12
4 Rendemen ekstrak alkaloid ... 13
5
Aktivitas inhibisi enzim α
-glukosidase oleh ekstrak alkaloid ... 14
6 Fraksi hasil kromatografi kolom (
F1−F12)
... 15
7 Fraksi F10.15 dan F10.16 hasil KLTP fraksi F10 ... 15
1
PENDAHULUAN
Diabetes melitus (DM) tipe 2 dapat diobati
dengan cara menghambat kerja enzim
α-glukosidase. Enzim ini berada di permukaan membran sel usus dan merupakan enzim kunci dalam metabolisme karbohidrat. Inhibitor α-glukosidase akan menghalangi aktivitas enzim tersebut sehingga membatasi perubahan oligosakarida dan disakarida menjadi monosakarida, terutama untuk serapan gastrointestinal (Malathi et al. 2010).
Ubi jalar ungu (Ipomoea batatas) memiliki kadar glikemik yang rendah, yakni 40 per 100 g saji (Foster et al. 2002) sehingga digunakan sebagai diet harian bagi penderita DM tipe 2. Secara empiris, potensi antidiabetes ubi jalar belum banyak diketahui, namun Ludvic et al.
(2004) melaporkan kemanjuran diet I. batatas
(Caiapo) dalam mengontrol DM tipe 2. Selain itu, Royhan et al. (2009) menyatakan bahwa ubi jalar kulit putih (I. batatas L.) memiliki aktivitas menurunkan kadar gula darah dengan cara meregenerasi sel beta pankreas dan meningkatkan sensitivitas insulin. Ubi jalar ungu yang digunakan pada penelitian ini (Gambar 1) merupakan varietas I. batatas
yang memiliki kandungan antosianin (turunan flavonoid) tertinggi. Ubi jalar ungu telah dilaporkan memiliki aktivitas antihiperglisemik (Suda et al. 2003). Kandungan antosianin pada umbi ubi jalar antara lain telah dilaporkan oleh Fan et al. (2007).
(a) (b)
Gambar 1 Foto umbi (a) dan daun (b) ubi jalar ungu.
Menurut Lien et al. (2010), fraksi ekstrak etil asetat daun ubi jalar dapat mempercepat aktivitas heksokinase, merangsang sekresi insulin, dan menghambat glukoneogenesis sehingga dapat memberikan efek hipoglisemia. Pochapski et al. (2011) menyatakan bahwa ekstrak kasar daun ubi jalar mengandung senyawa alkaloid. Ekstrak alkaloid 1% (b/v) dari buah mahkota dewa dapat menghambat α-glukosidase sebesar 36.80% (Samson 2010), demikian pula ekstrak flavonoidnya memiliki daya inhibisi
enzim α-glukosidase (Hartika 2009). Menurut Takikawa et al. (2010), pemberian asupan ekstrak kasar antosianin dari buah bilberry
pada tikus juga dapat menurunkan kadar glukosa darah dan meningkatkan sensitivitas insulin. Oleh karena itu, diharapkan pada penelitian ini dapat diperoleh ekstrak alkaloid daun dan ekstrak antosianin umbi ubi jalar ungu sebagai inhibitor enzim α-glukosidase. Bagian daun dan umbi diteliti karena bagian ini lazim dikonsumsi oleh masyarakat.
METODE
Alat dan Bahan
Alat yang digunakan ialah peralatan kaca, penguap putar, neraca analitik, oven, mikropipet, mortar agate, cawan aluminium, cawan porselen, hot plate, inkubator, spektrofotometer ultraviolet-tampak (UV−Vis) Shimadzu Pharmaspec 1700 berkas ganda (microplate reader), dan spektrofotometer inframerah transformasi Fourier (FTIR) Brucker. Bahan yang digunakan adalah daun dan umbi ubi jalar ungu dari daerah Ciampea (Bogor), metanol, etanol, etil asetat, aseton, amil alkohol, kloroform, n-heksana, dimetil sulfoksida (DMSO), serbuk Mg, HCl, dietil eter, H2SO4,
NH4OH, KBr, pereaksi Wagner, Dragendorf,
KCl, natrium asetat, bufer fosfat 100 mM, pelat silika gel G60F254-Merck, albumin serum
sapi (BSA) Sigma-Aldrich, p-nitrofenil α-D -glukopiranosa (pNG) Sigma-Aldrich, Na2CO3,
enzim α-glukosidase Sigma-Aldrich, dan tablet akarbosa (GlucobayTM).
Lingkup Kerja
Penelitian terdiri atas beberapa tahap. Pertama dilakukan preparasi daun dan umbi ubi jalar ungu, kemudian alkaloid diekstraksi dari daun dan antosianin dari umbi. Ekstrak yang diperoleh diuji fitokimia dan inhibisi
α-glukosidase, lalu ekstrak aktif difraksionasi dengan kromatografi kolom dilanjutkan dengan kromatografi lapis tipis (KLT) preparatif. Fraksi teraktif diidentifikasi dengan spektrofotometer FTIR. Diagram alir penelitian dapat dilihat pada Lampiran 1.
Preparasi Daun dan Umbi Ubi Jalar Ungu
2
sampai menjadi serbuk dan potongan kecil umbi dihaluskan dengan mesin penggiling.
Penetapan Kadar Air (AOAC 2006)
Cawan aluminium dikeringkan pada suhu 105 oC selama 30 menit lalu didinginkan dalam desikator dan ditimbang. Sebanyak 2 g sampel daun dan umbi dimasukkan masing-masing dalam cawan dan dipanaskan pada suhu 105 oC selama 5 jam hingga diperoleh bobot konstan. Setelah didinginkan dalam desikator, cawan berisi sampel ditimbang. Kadar air ditentukan dengan persamaan sebagai berikut:
Kadar air (%) = A−B × 100%
A
Keterangan:
A adalah bobot sampel (g)
B adalah bobot sampel setelah dikeringkan (g)
Penetapan Kadar Abu (AOAC 2006)
Cawan porselen dipanaskan pada suhu 600 oC selama 30 menit lalu didinginkan dalam desikator dan ditimbang. Sebanyak 2 g sampel daun dan umbi ubi jalar dimasukkan dalam cawan dan dipanaskan pada suhu 600 oC selama 2 jam hingga diperoleh bobot konstan. Cawan dengan abu yang didapat kemudian didinginkan dalam desikator dan ditimbang. Kadar abu ditentukan dengan persamaan sebagai berikut:
Kadar abu (%) = A × 100%
B
Keterangan:
A adalah bobot abu (g)
B adalah bobot sampel (g)
Ekstraksi Alkaloid (Berkov et al. 2007)
Serbuk daun (29 g) diekstraksi dengan cara maserasi dengan etanol 95% (1:10) sampai filtrat tidak berwarna. Residu dibuang, ekstrak etanol diuapkan pelarutnya di bawah kondisi vakum. Ekstrak pekat etanol dilarutkan kembali dalam H2SO4 2%
kemudian ditambahkan Et2O untuk
menghilangkan lemak. Fraksi Et2O dibuang,
fraksi asam (air) dibasakan dengan NH4OH
25% sampai pH 9−10 dan alkaloid diekstraksi dengan kloroform sampai tidak berwarna. Ekstrak alkaloid kasar dipekatkan dan rendemen dihitung:
Rendemen (%) = A × 100%
B
Keterangan:
A adalah bobot ekstrak alkaloid (g)
B adalah bobot sampel (g)
Ekstraksi Antosianin (Fan et al. 2007)
Serbuk umbi dimasukkan ke dalam Erlenmeyer kemudian ditambahkan campuran pelarut etanol-asam (HCl 1.5 M) dengan nisbah 1:32. Suspensi dipanaskan dalam penangas air dengan suhu 80 oC selama 1 jam, kemudian disentrifugasi selama 50 menit dengan kecepatan 2500 g. Supernatan dikumpulkan, dipindahkan ke wadah lain, dan dihitung rendemen antosianinnya:
Rendemen (%) = A × 100%
B
Keterangan:
A adalah bobot ekstrak antosianin (g)
B adalah bobot sampel (g)
Uji Fitokimia (Harborne 1987)
Uji Alkaloid. Satu gram ekstrak dilarutkan dengan 10 mL kloroform dan beberapa tetes NH4OH kemudian disaring ke tabung reaksi
tertutup. Filtrat dikocok dengan penambahan 10 tetes H2SO4 2 M, lapisan asamnya
dipindahkan ke tabung reaksi lain. Lapisan asam ini diteteskan pada pelat tetes dan ditambahkan pereaksi Wagner dan Dragendorf yang berturut-turut akan menimbulkan endapan cokelat dan merah jingga jika ekstrak positif mengandung alkaloid.
Fraksi dan ekstrak alkaloid dielusi pada KLT dengan eluen terbaik (kloroform). Setelah noda kering, pelat disemprot dengan pereaksi Dragendorf yang akan menyebabkan noda berwarna cokelat jingga bila mengandung alkaloid.
Uji Flavonoid. Satu gram ekstrak ditambahkan 10 mL air panas kemudian dididihkan selama 5 menit dan disaring. Sebanyak 10 mL filtrat ditambahkan 0.05 g serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol. Campuran dikocok kuat, dan hasil positif ditunjukkan dengan terbentuknya warna merah, kuning, atau jingga pada lapisan amil alkohol.
Uji Antosianin/Antosianidin. Sebanyak 0.5 g ekstrak antosianin ditambahkan 10 mL metanol-HCl 1 N (1:1) kemudian dipanaskan 95 oC selama 1 jam. Setelah didinginkan, larutan disaring dan filtrat dipartisi dengan etil asetat. Fase asam diekstraksi dengan amil alkohol. Sebanyak 1 mL ekstrak amil alkohol ditambahkan 3 tetes CH3COONa 1 M, 3 tetes
FeCl3 1 M dan 3 tetes Na2CO3 1 M pada
tabung reaksi berbeda. Uji positif berturut-turut ditandai dengan warna merah/ungu, biru dan ungu, biru/hijau.
3
selama 1 jam. Campuran disaring dan residu ditambahkan eter. Ekstrak eter ditambahkan 3 tetes anhidrida asetat dan 1 tetes asam sulfat pekat secara berurutan. Larutan dikocok perlahan dan dibiarkan beberapa menit. Uji positif ditandai dengan terbentuknya warna merah atau ungu untuk triterpenoid serta hijau atau biru untuk steroid.
Uji Saponin. Satu gram ekstrak ditambahkan 10 mL air panas dan dididihkan selama 5 menit lalu disaring. Sebanyak 10 mL filtrat dikocok dalam tabung reaksi tertutup selama 10 menit. Adanya saponin ditandai dengan terbentuknya buih stabil.
Uji Tanin. Satu gram ekstrak ditambahkan 10 mL air panas dan dididihkan selama 5 menit lalu disaring. Filtrat ditambahkan 10 mL FeCl3 1%. Hasil positif
ditandai dengan munculnya warna hijau kehitaman/biru tua.
Pencarian Eluen Terbaik pada KLT
Pelat KLT yang digunakan adalah pelat aluminium jenis silika gel G60F254dari Merck.
Eluen awal yang digunakan adalah metanol, aseton, etil asetat, kloroform, dan n-heksana. Variasi komposisi diujikan apabila pemisahan belum baik (tidak menghasilkan noda yang banyak dan terpisah). Noda hasil elusi ekstrak pekat alkaloid diamati di bawah lampu UV pada panjang gelombang 254 dan 366 nm.
Fraksionasi dengan Kromatografi Kolom
Sebanyak 0.5 g ekstrak pekat aktif dilarutkan dalam eluen terbaik kemudian dipisahkan komponen-komponennya dalam kolom dengan elusi gradien di antara kedua komponen eluen terbaik. Eluat ditampung setiap 3 mL dalam tabung reaksi. Eluat dengan warna dan pola KLT yang sama digabungkan menjadi satu fraksi dan diuji aktivitas α-glukosidase hingga diperoleh fraksi teraktif.
Uji Inhibisi α-Glukosidase (Sugiwati et al. 2009)
Sebanyak 1.0 mg α-glukosidase dilarutkan dalam 10 mL bufer fosfat 100 mM (pH 7.0) kemudian ditambahkan 200 mg BSA yang juga telah dilarutkan dalam bufer fosfat. Sebelum digunakan, 10 mL larutan enzim tersebut diencerkan 25 kali dengan bufer fosfat. Campuran reaksi terdiri atas 25 μL pNG 20 mM sebagai substrat, 50 μL bufer fosfat, dan 50 μL larutan sampel dengan konsentrasi 2000 ppm dalam DMSO. Campuran diinkubasi selama 5 menit pada
suhu 37 ºC, ditambahkan 25 μL larutan
α-glukosidase, kemudian diinkubasi kembali selama 15 menit. Reaksi enzim dihentikan dengan penambahan 100 μL Na2CO3 200 mM.
Hasil reaksi adalah senyawa p-nitrofenol yang kemudian dibaca absorbansnya dengan spektrofotometer UV-Vis pada panjang gelombang 400 nm.
Larutan blangko (tanpa sampel) dibuat dengan perlakuan sama seperti sampel. Tablet akarbosa (Glucobay) dilarutkan dalam bufer fosfat dan HCl 2 N (1:1) dengan konsentrasi 1% (b/v) digunakan sebagai kontrol positif (larutan stok). Pengenceran dilakukan bila diperlukan. Endapan dikumpulkan dengan sentrifus dan supernatan sebanyak 50 μL dimasukkan ke dalam campuran reaksi seperti pada sampel. Hasil reaksi diukur dengan spektrofotometer UV pada panjang gelombang 400 nm. Data kontrol positif (akarbosa) digunakan sebagai pembanding sampel yang diuji.
Inhibisi (%) = K−S × 100%
K
Keterangan:
K : absorbans blangko (enzim+substrat)
S : absorbans sampel (sampel+substrat+enzim)
Identifikasi Senyawa dengan FTIR
Sebanyak 0.8 mg sampel (fraksi teraktif yang telah dikeringkan) dihaluskan bersama 0.2004 g KBr dalam mortar agate. Setelah halus dan bercampur, dimasukkan ke dalam alat pencetak pelat KBr dan ditekan hingga diperoleh lempeng transparan. Lempeng dimasukkan ke dalam spektrofotometer FTIR, dan spektrum digambarkan dalam bentuk kurva transmitans pada bilangan gelombang 4000−400 cm-1.
HASIL DAN PEMBAHASAN
Kadar Air dan Abu
4
menjaga kondisi sampel dari pertumbuhan mikrob. Harjadi (1986) menyatakan bahwa kadar air dapat menentukan ketahanan bahan pangan dalam penyimpanan. Kadar air minimum agar bakteri tidak tumbuh adalah kurang dari 10%. Pada kadar air ini bahan dapat disimpan dalam jangka waktu yang lama dan risiko terkena jamur kecil (Winarno 1992). Contoh perhitungan kadar air dapat dilihat pada Lampiran 2.
Kadar abu rerata sampel (Tabel 1) menunjukkan bahwa mineral lebih banyak terkumpul pada daun daripada umbi. Hal ini dimungkinkan karena fotosintesis pada daun berlangsung dengan bantuan mineral sebagai kofaktor. Selain itu, mineral penyusun klorofil adalah Mg (Harborne 1987). Mineral yang terkandung dalam daun ubi jalar menurut Antia et al. (2006) ialah Ca, Mg, Fe, Zn, Na K, P dan Mn. Contoh perhitungan kadar abu dapat dilihat pada Lampiran 3.
Tabel 1 Kadar abu ubi jalar ungu berdasarkan bobot basah dan kering
Bagian Tanaman
Kadar Abu (% b/b) Bobot
Basah
Bobot Kering Daun 5.95±0.01 6.68±0.01 Umbi 2.33±0.05 2.68±0.07
Ekstrak
Ekstrak alkaloid diperoleh dari hasil maserasi yang digabungkan dengan partisi, sedangkan ekstrak antosianin diperoleh dari maserasi saja. Rendemen antosianin diperoleh lebih besar daripada alkaloid (Tabel 2).
Tabel 2 Rendemen ekstrak ubi jalar ungu
Ekstrak Rendemen (%b/b) Basah Kering Alkaloid (*) 0.15±0.03 0.16±0.03 Antosianin (**) 48.19±2.59 55.30±2.97
Ket : * = ekstraksi daun ** = ekstraksi umbi
Ekstraksi diawali dengan pelarut etanol, lalu dilanjutkan dengan tahap pemisahan yang berbeda sesuai dengan komponen yang akan diambil, yakni alkaloid dan antosianin. Warna ekstrak alkaloid hijau kecokelatan dengan bau seperti teh. Warna ekstrak antosianin merah kehitaman dengan aroma menyengat yang berasal dari pelarut HCl. Contoh perhitungan rendemen ekstrak diberikan pada Lampiran 4.
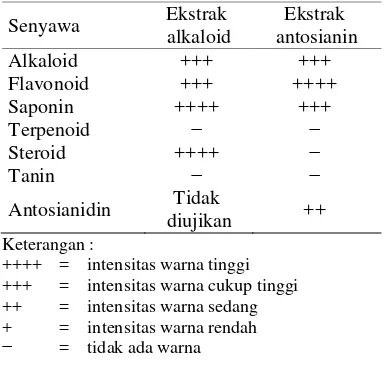
Kandungan Fitokimia
Ekstrak alkaloid daun mengandung alkaloid, flavonoid, saponin, dan steroid (Tabel 3). Pochapski et al. (2011) menyatakan
bahwa fraksi alkaloid daun ubi jalar dalam kloroform memberikan warna positif alkaloid dengan pereaksi Dragendorf, yang menunjukkan keberadaan alkaloid pada sampel. Flavonoid juga telah dilaporkan terdapat pada ekstrak daun ubi jalar ungu (Ghasemzadeh 2012).
Ekstrak antosianin umbi mengandung alkaloid, flavonoid, saponin, dan antosianidin (Tabel 3). Uji antosianidin tidak dilakukan pada ekstrak alkaloid karena tidak memperlihatkan warna antosianin, yakni merah, ungu, dan biru. Antosianidin adalah aglikon antosianin yang terbentuk jika antosianin dihidrolisis dengan asam (Harborne 1987) dan antosianidin merupakan pemberi warna antosianin.
Tabel 3 Fitokimia ekstrak kasar
Senyawa Ekstrak alkaloid
Ekstrak antosianin
Alkaloid +++ +++
Flavonoid +++ ++++
Saponin ++++ +++
Terpenoid − −
Steroid ++++ −
Tanin − −
Antosianidin Tidak
diujikan ++
Keterangan :
++++ = intensitas warna tinggi +++ = intensitas warna cukup tinggi ++ = intensitas warna sedang + = intensitas warna rendah − = tidak ada warna
Menurut Fan et al. (2007), umbi ubi jalar ungu mengandung flavonoid paling tinggi di antara umbi lain. Hal ini juga dapat dikaitkan dengan keberadaan antosianin yang termasuk golongan flavonoid. Hal ini diperjelas oleh Chen et al. (2012) bahwa pada umbi ubi jalar ungu terkandung antosianin.
Adanya saponin dan flavonoid pada kedua ekstrak diduga karena masing-masing pelarut pengekstraksi mengandung air, yakni dari HCl 1.5 M dalam ekstraksi antosianin dan dari H2SO4 2% (partisi) pada ekstraksi alkaloid.
Senyawa flavonoid terdapat pada daun dan umbi ubi jalar ungu, dan antosianidin merupakan kandungan flavonoid pada umbi (USDA 2007).
Aktivitas Inhibisi α-Glukosidase Ekstrak
5
ekstrak antosianin pada konsentrasi yang sama hanya menghambat 0.25% (tidak aktif). Oleh karena itu, untuk tahap selanjutnya digunakan ekstrak alkaloid. Contoh perhitungan persen inhibisi ditunjukkan pada Lampiran 5.
Eluen Terbaik KLT
Pelat silika gel G60F254 dikeringkan pada
suhu 105 oC sebelum digunakan. Hal ini bertujuan menghilangkan air yang terikat pada silika yang dapat mengaburkan pemisahan noda. Eluen pengembang yang digunakan ialah metanol, aseton, etil asetat, kloroform, dan n-heksana (polar ke nonpolar). Sebagaimana ditunjukkan pada Gambar 2, eluen metanol menghasilkan 5 noda berekor mencapai dekat garis finis (F) yang menunjukkan sampel kurang bersifat polar. Aseton menghasilkan 4 noda bulat dan mulai terpisah, namun masih muncul pada akhir elusi, maka sampel juga kurang polar untuk aseton. Etil asetat menghasilkan 2 noda agak bulat dengan keterpisahan sedikit lebih baik dibandingkan dengan metanol, namun jumlah dan keterpisahan noda belum sebaik aseton. Kloroform menghasilkan 11 noda dan terpisah baik. Adanya noda di awal dan akhir elusi menunjukkan bahwa sampel bersifat semipolar dan cocok terelusi oleh eluen kloroform. Hasil ini lebih baik dibandingkan eluen metanol, aseton, dan etil asetat.
n-Heksana tidak menghasilkan noda, artinya sampel tidak bersifat nonpolar. Partisi sampel (ekstrak alkaloid) dengan kloroform diduga menyebabkan sampel bersifat semipolar sehingga terelusi paling baik dengan kloroform.
(a) (b) (c) (d) (e) Gambar 2 Kromatogram ekstrak alkaloid
dengan eluen metanol (a), aseton (b), kloroform (c), n-heksana (d), dan etil asetat (e) pada UV 366 nm.
Elusi selanjutnya dilakukan dengan eluen campuran untuk melihat keterpisahan yang mungkin lebih baik daripada eluen tunggal. Aseton dan kloroform dipilih sebagai komponen eluen campuran karena noda yang dihasilkan lebih banyak dan terpisah. Komposisi eluen ini berbeda dengan eluen terbaik yang diperoleh oleh Minarti et al.
(2002), yakni kloroform-metanol.
Noda yang dihasilkan pada semua nisbah eluen kloroform-aseton kurang terpisah dan lebih membentuk noda berekor panjang, (Gambar 3). Oleh karena itu, eluen terbaik yang digunakan selanjutnya adalah kloroform.
(a) (b) (c) (d) (e) Gambar 3 Kromatogram ekstrak alkaloid
dengan eluen kloroform-aseton 1:1 (a), 2:1 (b), 12 (c), 3:1 (d), dan 1:3 (e) pada UV 366 nm. Noda akan bergerak sesuai dengan polaritas eluen pembawa. Jika noda memiliki kepolaran mirip dengan silika (fase diam), maka noda lebih tertahan dan akan bergerak lebih lambat atau tidak bergerak sama sekali. Hal ini terlihat pada elusi dengan n-heksana. Pemisahan noda yang sangat baik pada elusi dengan kloroform menunjukkan bahwa ekstrak alkaloid bersifat semipolar. Noda pada penyinaran dengan UV 366 nm akan berfluoresens menjadi lebih gelap atau lebih terang dibandingkan dengan warna lempeng KLT yang akan berwarna ungu terang.
Hasil Fraksionasi dengan Kromatografi Kolom (KK)
6
tabung kemudian dikelompokkan berdasarkan pola KLT kesamaan warna, bentuk, jumlah dan nilai Rf menjadi fraksi-fraksi. Diperoleh
12 fraksi (F1−F12) yang selanjutnya dielusi dengan eluen terbaik kloroform untuk melihat pola pemisahannya (Gambar 4).
E F1 F2 F3 F4 F5 F6 F7 F8 F9 F10 F11 F12 E
Gambar 4 Kromatogram (kiri ke kanan) ekstrak alkaloid, F1−F12, dan ekstrak alkaloid pada UV 366 nm.
Pewarnaan fraksi alkaloid (F1−F12) dengan pereaksi Dragendorf memperlihatkan noda yang positif mengandung alkaloid pada
F10 dan F1−F4. Terbentuk endapan cokelat jingga berlatar belakang kuning atau bercak cokelat jingga (Gambar 5). Sampel F10 yang digunakan untuk uji lanjut karena noda alkaloidnya secara kualitatif lebih tebal sehingga rendemen alkaloid diperkirakan lebih banyak. Perhitungan rendemen F1−F12 dapat dilihat pada Lampiran 6.
E F1 F2 F3 F4 F5 F6 F7 F8 F9 F10 F11 F12 E
Gambar 5 Kromatogram (kiri ke kanan)
ekstrak alkaloid, F1−F9, F10 (positif alkaloid), F11, F12, dan ekstrak alkaloid yang disemprot pereaksi Dragendorf.
Hasil Fraksionasi dengan KLT Preparatif (KLTP)
Fraksionasi preparatif F10 (fraksi positif alkaloid) menghasilkan 2 noda yang memiliki bentuk berbeda dan diberi nama F10.16 (noda teratas) dan F10.15 (noda di bawahnya)
(Lampiran 7). Rendemen masing-masing sebesar 14.24% dan 7.75%.
Aktivitas inhibisi enzim α-glukosidase F10 dengan konsentrasi 1250 ppm sebesar 48.64%. Fraksi F10.16 memberikan hasil negatif (tidak aktif), sedangkan fraksi F10.15 memiliki aktivitas inhibisi 18.07%. Aktivitas F10 yang lebih besar daripada F10.16 dan F10.15 diduga karena kandungan senyawa selain alkaloid pada F10.
Kemampuan inhibisi sampel sebelum dan setelah preparatif masih jauh lebih kecil dibandingkan dengan akarbosa yang dengan konsentrasi 0.0383 ppm sudah mampu menghambat 50% populasi (IC50). Akarbosa
digunakan sebagai kontrol positif inhibitor
enzim α-glukosidase. Fraksi yang memberikan potensi inhibisi positif (F10.15) selanjutnya diidentifikasi dengan FTIR.
Identitas Senyawa
Spektrum FTIR fraksi F10.15 (Lampiran 8) menunjukkan gugus –NH2−,
–OH−, dan −CH2− berdasarkan perbandingan
dengan rujukan (Tabel 4). Karena itu, F10.15 dapat diduga mengandung alkaloid.
Tabel 4 Absorpsi inframerah fraksi 10.15 Bilangan
gelombang (cm−1)
Literatur *
Gugus fungsi
3433.44 3500−3200 –NH− 3700−3000 –OH− 2924.16 3000−2800 –CH2–
Sumber: Pavia et al. (2001)
Alkaloid secara umum mengandung sedikitnya 1 atom N yang bersifat basa dan merupakan bagian dari cincin heterosiklik (Harborne 1987). F10.15 diduga mengandung gugus amina (–NH−) yang memberikan serapan bertumpang tindih dengan gugus –OH pada bilangan gelombang 3433.44 cm-1.
Intensitas puncak yang kurang tajam diduga menggambarkan kandungan alkaloid yang sedikit pada fraksi F10.15. Cincin heterosiklik diduga ditunjukkan oleh serapan ulur kuat –CH2− pada 2924.16 cm
-1
, meskipun terdapat dugaan –CH2− alifatik. Tidak adanya
serapan aromatik –CH− pada 3100−3000 cm-1
dan C=C pada 1650−1430 cm-1
menunjukkan bahwa F10.15 bukan jenis alkaloid aromatik, melainkan alkaloid alisiklik seperti cincin pirolidina (C4H9N), piperidina (C5H11N), dan
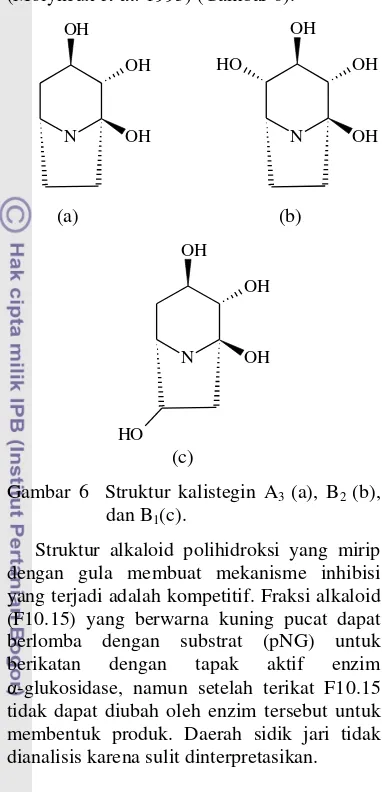
pirolizidina (C7H13N). Alkaloid alisiklik
polihidroksi Convolvuceae (famili I. batatas) seperti kalistegin telah dilaporkan dapat Noda
alkaloid
7
digunakan sebagai inhibitor α-glukosidase(Molyneux et al. 1993) (Gambar 6).
N OH OH OH N OH OH OH HO (a) (b)
N OH OH OH HO (c)
Gambar 6 Struktur kalistegin A3 (a), B2 (b),
dan B1(c).
Struktur alkaloid polihidroksi yang mirip dengan gula membuat mekanisme inhibisi yang terjadi adalah kompetitif. Fraksi alkaloid (F10.15) yang berwarna kuning pucat dapat berlomba dengan substrat (pNG) untuk
berikatan dengan tapak aktif enzim
α-glukosidase, namun setelah terikat F10.15 tidak dapat diubah oleh enzim tersebut untuk membentuk produk. Daerah sidik jari tidak dianalisis karena sulit dinterpretasikan.
SIMPULAN DAN SARAN
Simpulan
Ekstrak alkaloid dapat menginhibisi enzim
α-glukosidase sebesar 61.88%, sedangkan ekstrak antosianin hanya sebesar 0.25% pada konsentrasi 2000 ppm. Fraksionasi ekstrak alkaloid menghasilkan 12 fraksi (F1−F12) dengan fraksi F10 mengandung alkaloid. Nilai aktivitas inhibisi fraksi F10 dan F10.15 hasil fraksionasi F10 masing-masing sebesar 48.64% dan 18.07% pada konsentrasi 1250 ppm. Fraksi F10.15 diduga mengandung alkaloid mirip senyawaan gula dan berpotensi sebagai inhibitor enzim α-glukosidase.
Saran
Fraksionasi ekstrak dilakukan dengan kisaran eluen nonpolar, semipolar, dan polar agar pemisahan lebih baik. Penelitian lanjutan
mengenai penentuan struktur senyawa alkaloid yang aktif sebagai inhibitor
α-glukosidase perlu dilakukan. Uji metabolit sekunder dan primer dilakukan pada F1−F12 agar dapat menduga kandungan kimiawi pada fraksi lebih kuat. Sisa partisi ekstrak alkaloid, yaitu fase selain kloroform, perlu diuji fitokimia dan inhibisi untuk membandingkan aktivitasnya dengan fase kloroform.
DAFTAR PUSTAKA
[AOAC] Association of Official Analytical Chemists. 2006. Official Methods of Analysis of AOAC International. Ed ke-18. Washington DC: AOAC International.
[USDA] United States Department of Agriculture. 2007. USDA Database for The Flavonoid Content of Selected Foods. Release 2.1. Beltsville: USDA.
Antia BS, Akpan EJ, Okon PA, Umoren IU. 2006. Nutritive and anti-nutritive evaluation of sweet potatoes (Ipomoea batatas) leaves. Pakistan J Nutr 5(2):166-168.
Berkov S, Chilpa R, Codina C, Viladomat F, Bastida J. 2007. Revised NMR data for incartine: an alkaloid from Galanthus elwesii. Molecules 12:1430-1435.
Chen SY, Wai SY, Wilson TLY. 2012. Comparison of anthocyanin and phenolic contents between tuber and callus of
Ipomoea batatas L. [komunikasi singkat].
Pertanika J Trop Agric Sci 35(1):9-14.
Fan G, Han Y, Gu Z, Chen D. 2007. Optimizing conditions for anthocyanins extraction from purple sweet potato using response surface methodology (RSM).
Swiss Soc Food Sci Technol 41:155-160.
Foster K, Powell, Holt SHA, Brand JC, Miller. 2002. Revised International Table of Glycemic Index (GI) and Glycemic Load (GL) Values-2002. Am J Clin Nutr
7:5-56.
Ghasemzadeh A. 2012. Polyphenolic content and their antioxidant activity in leaf extract of sweet potato (Ipomoea batatas). J Med Plants Res 6(15):2971-2976.
8
Harjadi W. 1986. Ilmu Kimia Analitik Dasar.
Jakarta: Gramedia.
Hartika R. 2009. Aktivitas inhibisi
α-glukosidase ekstrak senyawa golongan flavonoid buah mahkota dewa [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Lien DN, Phuc DV, Lien PQ, Trang NT, Kien TT, Lien TTP, Tien KD. 2010. Effect of sweet potato (Ipomoea batatas (L.) Lam) leaf extract on hypoglycemia, blood insulin secretion, and key carbohydrate metabolic enzymes in experimentaly obese
and STZ−inuced diabetic mice. VNU J Sci,
Nat Sci Technol 27:118-124.
Ludvic B, Neuffer B, Pacini G. 2004. Efficacy of Ipomoea batatas (Caiapo) on diabetes control in type 2 diabetic subjects treated with diet. Emerging Treatment Technol Diabetes Care 27(2):436-440.
Malathi V, Devi SS, Revathi K. 2010. Anti diabetic activity by the in vitro alpha amylase and alpha-glucosydase inhibitory activity of Catharanthus roseus. Int Quarterly J Life Sci The Bioscan 5(4):655-659.
Minarti, Dewi P, Kardono LBS, Wahyudi B. 2002. Penapisan kimia senyawa alkaloid dalam ekstrak daun johar (Cassia siamea
Lamk). Di dalam: Prosiding Seminar
Tantangan Penelitian Kimia. Cassia
siamea, Alkaloids. Serpong: Pusat Penelitian Kimia LIPI. hlm 199-205.
Molyneux RJ, Pan YT, Goldmann A, Tepfer DA, Elbein AD. 1993. Calystegins, a novel class of alkaloid glycosidase inhibitors. Arch Biochem Biophys
304(1):81-88.
Pavia, DL, Lampman GM, Kris GS, Vyvyan JR. 2001. Introduction to Spectroscopy: A
Guide for Student of Organic Chemistry. Ed ke-3. Philadelphia: Saunders Coll.
Pochapski MT, Fosquiera EC, Esmerino LA, dos Santos EB, Farago PV, Santos FA, Groppo FC. 2011. Phytochemical screening, antioxidant, and antimicrobial activities of the crude leaves extract from
Ipomoea batatas (L.) Lam.
Pharmacognosy Magazine 26:165-190.
Royhan A, Susilwati R, Sunarti. 2009. Effects of white-skinned sweet potato (Ipomoea batatas L.) on pancreatic beta cells and insulin expression in streptozocin induced diabetic rats. Maj Kesehatan Pharma Medikan 1(2):45-49.
Samson ZM. 2010. Senyawa golongan alkaloid ekstrak buah mahkota dewa
sebagai inhibitor α-glukosidase [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Suda I, Oki T, Masuda M, Kobayashi M, Nishiba Y, Furuta S. 2003. Physiological functionality of purple-fleshed sweet potatoes containing anthocyanins and their utilization in foods [ulas balik]. Japan Agric Res Quarterly 37(3):167-173.
Sugiwati S, Setiasih S, Afifah E. 2009. Antihyperglycemic activity of the mahkota dewa [Phaleria macrocarpa (scheff.)
Boerl.] leaf extracts as an alpha-glucosidase inhibitor. Makara
Kesehatan13:74-78.
Takikawa M, Inoue S, Horio F, Tsuda T. 2010. Dietary anthocyanin-rich bilberry extract ameliorates hyperglycemia and insulin sensitivity via activation of AMP-activated protein kinase in diabetic mice. J Nutr Dis 140:527-533.
9
10
Lampiran 1 Diagram alir penelitian
Maserasi etanol, H2SO4
2%, eter, NH4OH,
kloroform
Maserasi HCl-etanol (1:32); 80 ºC; 1 jam
Ekstrak alkaloid Ekstrak antosianin Flavonoid (+) Antosianidin
(+)
Tidak diteruskan Alkaloid (+)
Eluen terbaik (kloroform) KLT
Inhibisi
α-glukosidase (-)
KK Inhibisi
α-glukosidase (+)
F1 F2 F3 F4 F5 F6 F7 F8 F9 F10 F11 F12
F10.15 KLTP
Inhibisi α-glukosidase
F10.16
Fraksi teraktif
Gugus fungsi Identifikasi FTIR
Diblender tanpa air
Serbuk daun Serbuk umbi Ubi jalar ungu
Umbi Daun
Dipotong kecil dan dikeringkan
Dipotong kecil dan dikeringkan
Daun kering Umbi kering
11
Lampiran 2 Kadar air daun ubi jalar ungu
Ulangan Bobot awal sampel (g)
Bobot kosong cawan (g)
Bobot akhir (g)
Bobot akhir sampel (g)
Kadar air (%)
1 2.0045 1.9774 3.7603 1.7829 11.06
2 2.0053 1.9319 3.7241 1.7922 10.63
3 2.0003 1.9316 3.7086 1.7770 11.16
Rerata 10.95±0.28
Contoh perhitungan: Ulangan 1
Kadar air (%) = Bobot awal sampel (g) – Bobot akhir sampel (g) × 100% Bobot awal sampel (g)
= (2.0045 − 1.7829) g × 100% 2.0045 g
= 11.06%
Rerata % = (11.06 + 10.63 + 11.16) % = 10.95% 3
12
Lampiran 3 Kadar abu daun ubi jalar ungu
Ulangan Bobot awal sampel (g)
Bobot kosong cawan (g)
Bobot akhir (g)
Bobot akhir sampel (g)
Kadar abu basah (%)
Kadar abu kering
(%) 1 2.0045 22.0990 22.2177 0.1187 5.93 6.66 2 2.0053 28.1087 28.2283 0.1196 5.96 6.69 3 2.0003 26.7754 26.8951 0.1197 5.96 6.69
Rerata 5.95±0.01 6.68±0.01
Contoh Perhitungan: Ulangan 1
Kadar abu basah (%) = Bobot akhir sampel (g) × 100% Bobot awal sampel (g)
= 0.1187 g × 100% 2.0045 g
= 5.93%
Rerata (%) = (5.93 + 5.96 + 5.96) % 3
= 5.95 %
Standar Deviasi (S)
Kadar abu kering (%) = Bobot akhir sampel (g) × 100% Bobot akhir sampel (g) × (1− kadar air)
= 0.1187 g × 100%
2.0045 g × (1− 0.1095)
= 6.66%
Rerata (%) = (6.66 + 6.69+ 6.69) % 3
= 6.68 %
13
Lampiran 4 Rendemen ekstrak alkaloid
Ulangan
Bobot awal sampel
(g)
Bobot kosong vial (g)
Bobot akhir (g)
Bobot akhir sampel
(g)
Rendemen berdasarkan bobot basah
(%)
Rendemen berdasarkan bobot kering
(%) 1 29.0081 37.8748 37.9131 0.0383 0.13 0.15 2 29.0049 35.3217 35.3597 0.0380 0.13 0.15 3 29.0060 37.1383 37.1898 0.0515 0.18 0.20
Rerata 0.15±0.03 0.16±0.03
Contoh Perhitungan: Ulangan 1
Rendemen bobot basah (%) = Bobot akhir sampel (g) × 100% Bobot awal sampel (g)
= 0.0383 g × 100% 29.0081
= 0.13%
Rerata (%) = (0.13 + 0.13 + 0.18) % 3
= 0.15 %
Standar Deviasi (S)
Rendemen bobot kering (%)
= Bobot akhir sampel (g) × 100% Bobot awal sampel (g) × (1− kadar air)
= 0.0383 g × 100% 29.0081 × (1− 0.1095)
= 0.15%
Rerata (%) = (0.15 + 0.15 + 0.20) % 3
= 0.16 %
14
Lampiran 5 Aktivitas inhibisi enzim α-glukosidase oleh ekstrak alkaloid
Konsentrasi [ppm]
Absorbans Daya
inhibisi (%)
S1 S2 terkoreksi
2000 2.413 1.063 1.350 61.88
1000 3.765 0.414 3.351 5.37
500 3.766 0.358 3.408 3.76
250 3.616 0.188 3.428 3.19
125 3.383 0.149 3.234 8.67
62.5 3.561 0.135 3.426 3.25
31.25 3.616 0.101 3.515 0.73
blangko 3.613 0.072 3.541 0
Keterangan : S1 = Sampel + substrat + enzim S2 = Sampel + substrat
Contoh perhitungan: [sampel] 2000 ppm
A terkoreksi = S1 – S2 = 2.413 – 1.063 = 1.350
Daya inhibisi (%) = (A blangko − A sampel) terkoreksi × 100%
A blangko terkoreksi
= 3.541 – 1.350 × 100% 3.541
15
Lampiran 6 Fraksi hasil kromatografi kolom (F1−F12)
Kode Isi Pelarut Warna Bobot
fraksi (g) Rendemen (%)
F1 1−6 K kuning keemasan 0.0295 5.90
F2 7−11 K cokelat kehitaman 0.0597 11.94 F3 12−20 K cokelat kehitaman 0.1178 23.56 F4 21−33 K kuning keemasan 0.0433 8.66 F5 34−37 K kuning kehijauan 0.0335 6.70 F6 48−54 K kuning kehijauan 0.0250 5.00 F7 55−79 K kuning kehijauan 0.0126 2.52 F8 80−84 K:M (9:1) cokelat kehitaman 0.1285 25.7 F9 85−115 K:M (9:1) kuning kehijauan 0.0478 9.56 F10 116−140 K:M (8:2) kuning keemasan 0.0794 15.88
F11 141−190
K:M (7:3)
kuning kehijauan 0.1827 36.54 K:M (6:4)
K:M (5:5)
F12 191−227
K:M (4:6)
kuning 0.0261 5.22
K:M (3:7) K:M (2:8) K:M (1:9)
M Keterangan:
Bobot ekstrak alkaloid = 0.5000 g
K = kloroform
M = metanol
Contoh perhitungan : F1
Rendemen (%) = Bobot fraksi (g) ×100% Bobot ekstrak alkaloid (g)
= 0.0295 g ×100% 0.5000 g
= 5.90%
Lampiran 7 Fraksi F10.15 dan F10.16 hasil KLTP fraksi F10
16
Lampiran 8 Spektrum FTIR F10.15
−
−–NH− –OH−
–NH−
–CH2–