1
ANALISIS MUTASI GEN
EGFR
DAN
KRAS
BERBASIS
PCR-HRM (
High Resolution Melting
) DAN RFLP (
Restriction
Fragment Length Polymorphisme
) TERHADAP CAIRAN
PLEURA PASIEN KANKER PARU YANG DISIMPAN PADA
KERTAS SARING
ASEP MUHAMAD RIDWANULOH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa Tesis yang berjudul Analisis Mutasi Gen EGFR dan KRAS Berbasis PCR-HRM (High Resolution Melting) dan RFLP (Restriction Fragment Length Polymorphisme) terhadap Cairan Pleura Pasien Kanker Paru yang Disimpan pada Kertas Saring adalah karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2013
RINGKASAN
ASEP MUHAMAD RIDWANULOH. Analisis Mutasi Gen EGFR dan KRAS
Berbasis PCR-HRM (High Resolution Melting) dan RFLP (Restriction Fragment Length Polymorphisme) terhadap Cairan Pleura Pasien Kanker Paru yang Disimpan pada Kertas Saring. Dibimbing oleh SUHARSONO, AHMAD R.H. UTOMO dan JUDHI RACHMAT.
Penyakit kanker paru merupakan penyakit yang paling banyak menyebabkan kematian akibat kanker di dunia, termasuk di Indonesia. Saat ini pengobatan pasien kanker paru seperti terapi target telah banyak dikembangkan untuk menurunkan angka kematian. Teknik pengobatan ini membutuhkan hasil diagnosa yang cepat dan akurat berbasis analisis molekuler terhadap gen yang mengalami mutasi seperti KRAS dan EGFR. Penelitian ini mengembangkan teknik analisis PCR-HRM dan PCR-RFLP untuk mengetahui terjadinya mutasi gen
EGFR dan KRAS pada sampel efusi pleura pasien kanker paru. Hasil uji sensitivitas menggunakan metode dilusi menunjukkan bahwa PCR-HRM mampu mendeteksi mutasi gen KRAS dan EGFR pada konsentrasi 12,5% DNA mutan dalam campuran DNA wild type, sedangkan metode PCR-RFLP mampu mendeteksi adanya mutasi hingga konsentrasi DNA mutan dalam campuran DNA
wild type sebesar 3,125%. Penelitian ini menggunakan 63 sampel cairan pleura pasien kanker paru yang disimpan dalam kertas saring. Hasil analisis menunjukkan bahwa 1,6% (1/63) memiliki mutasi gen KRAS dan 15,9% (10/63) memiliki mutasi gen EGFR. Mutasi EGFR yang terjadi pada pasien pria adalah 21,43% (6/28) dan pada wanita sebesar 15,3% (4/26). Hasil penelitian ini menunjukkan bahwa HRM dan RFLP merupakan metode yang sensitif untuk mendeteksi mutasi gen KRAS dan EGFR pada sampel pasien kanker paru. Kertas saring memiliki potensi yang besar digunakan dalam analisis molekuler kanker paru, khususnya sebagai media penyimpanan dan pengiriman sampel yang berasal dari efusi pleura.
SUMMARY
ASEP MUHAMAD RIDWANULOH. EGFR and KRAS Genes Mutation Analysis Based on PCR-HRM (High Resolution Melting) and RFLP (Restriction Fragment Length Polymorphisme) of Pleural Liquid from Lung Cancer Patients that Collected at Filter Paper. Supervised by SUHARSONO, AHMAD R.H. UTOMO and JUDHI RACHMAT.
Lung cancer is the most frequent cause of cancer-related mortality worldwide, including in Indonesia. Today, a medical treatment for lung cancer patient, such as targeted therapies, has been developed to decrease the mortality. The methods need a rapid and a robust molecular characterisation technique to diagnose any gene mutations such as the KRAS and the EGFR. We developed a PCR-HRM and a PCR-RFLP for screening the EGFR and the KRAS mutations in pleural effusion of lung cancer patients. Sensitivity studies using the dilution assay revealed that the PCR-HRM was able to detect KRAS and EGFR mutations as little as 12.5% of mutant DNA in wild type DNA, while the PCR-RPLF was able to detect as little as 3.125 % of DNA mutant in wild type DNA. We analysed 63 of pleural effusion from lung cancer patient that were collected in filter paper. From our sample, we found that 1.6% (1/63) of them had the KRAS mutation; meanwhile 15.9 % (10/63) of them had the EGFR mutations. We also found that the EGFR mutation was more prevalent in men 21.43% (6/28) compared to women 15.3% (4/26). These results showed that the HRM and the RFLP are useful methods to detect the KRAS and the EGFR mutations in the clinical samples of lung cancer. The filter paper was also very potential material to be used in molecular analysis of lung cancer, especially for collecting and transferring the pleural effusion samples.
© Hak Cipta milik IPB, tahun 2013
Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan
atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau
tinjauan suatu masalah; pengutipan tersebut tidak merugikan kepentingan yang
wajar IPB
Dilarang mengumumkan dan memperbanyak sebagian atau seluruh Karya Tulis
ANALISIS MUTASI GEN
EGFR
DAN
KRAS
BERBASIS
PCR-HRM (
High Resolution Melting
) DAN RFLP (
Restriction
Fragment Length Polymorphisme
) TERHADAP CAIRAN
PLEURA PASIEN KANKER PARU YANG DISIMPAN PADA
KERTAS SARING
ASEP MUHAMAD RIDWANULOH
Tesis
Sebagai salahsatu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN
Judul Penelitian : Analisis Mutasi Gen EGFR dan KRAS Berbasis PCR-HRM (High Resolution Melting) dan RFLP (Restriction Fragment Length Polymorphisme) terhadap Cairan Pleura Pasien Kanker Paru yang Disimpan pada Kertas Saring
Nama : Asep M. Ridwanuloh
NIM : P051100081
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Suharsono, DEA Ketua
Ahmad R. H. Utomo, PhD Judhi Rachmat, PhD
Anggota Anggota
Diketahui oleh,
Ketua Program Studi Dekan Sekolah Pascasarjana
Bioteknologi
Prof Dr Ir Suharsono, DEA Dr Ir Dahrul Syah, MScAgr
Tanggal Ujian: 10 Januari 2013 Tanggal Lulus: 20 Maret 2013
PRAKATA
Puji serta syukur penulis ucapkan kehadirat Alloh SWT karena berkat Rahmat dan Hidayah-Nya penulis dapat menyelesaikan penelitian dengan judul “Analisis Mutasi Gen EGFR dan KRAS Berbasis PCR-HRM (High Resolution Melting) dan RFLP (Restriction Fragment Length Polymorphisme) terhadap Cairan Pleura Pasien Kanker Paru yang Disimpan pada Kertas Saring”.
Ucapan terimakasih penulis sampaikan kepada:
1. Prof Dr Ir Suharsono, DEA sebagai ketua komisi pembimbing, Ahmad R.H. Utomo, PhD dan Judhi Rachmat, PhD sebagai anggota komisi pembimbing yang telah memberikan bimbingan, arahan dan ilmunya kepada penulis. 2. Prof drh Dondin Sajuthi, MST PhD selaku dosen penguji luar komisi yang
telah memberikan saran dan masukan yang sangat berguna demi kesempurnaan tesis ini.
3. Kementerian Riset dan Teknologi yang telah memberikan beasiswa pendidikan, hingga penulis bisa menyelesaikan studi pada program Pascasarjana Bioteknologi IPB.
4. dr Achmad Hudoyo, SpP(K) beserta tim dokter spesialis paru RS Persahabatan Jakarta yang telah memberikan kesempatan kepada penulis untuk melaksanakan sebagian dari proyek penelitian besarnya.
5. Keluarga besar laboratorium Kalbe Genomic-SCI, PT Kalbe Farma, Tbk., dan keluarga besar laboratorium Diagnostik Kesehatan Pusat Penelitian Bioteknologi LIPI yang telah banyak memberikan bantuan atas kelancaran penelitian ini.
6. Kedua orangtua beserta adik-adik yang telah memberikan begitu banyak perhatian, dukungan dan do’anya kepada penulis.
7. Segenap sahabat mahasiswa S2 Bioteknologi IPB angkatan 2010 yang telah banyak memberikan motivasi dan bantuannya. Terimakasih atas kebersamaan kita selama ini.
8. Segenap karyawan serta staff administrasi Program Studi Bioteknologi IPB, yang telah banyak membantu penulis dalam proses administrasi.
Serta semua pihak yang telah banyak memberikan motivasi, dan dukungannya serta menjadi inspirasi bagi penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, Maret 2013
DAFTAR ISI
Halaman
DAFTAR ISI x
DAFTAR TABEL xi
DAFTAR GAMBAR xi
DAFTAR LAMPIRAN xiii
PENDAHULUAN 1
Latar Belakang 1
Tujuan 3
TINJAUAN PUSTAKA 4
Kanker Paru 4
Biomarker Kanker Paru 6
High Resolution Melting Analysis (HRM) 11
Restriction Fragment Length Polymorphism (RFLP) 13
METODOLOGI 16
Waktu dan Tempat Penelitian 16
Bahan 16
Prosedur Kerja 16
HASIL DAN PEMBAHASAN 18
Analisis Mutasi Gen KRAS Menggunakan Metode HRM dan RFLP
pada DNA Standar Sel Kultur 18
Uji Sensitivitas Metode HRM dan RFLP dalam Analisis Mutasi Gen
KRAS 21
Analisis Mutasi Gen EGFR menggunakan Metode HRM dan RFLP
pada DNA Standar 23
Uji Sensitivitas Metode HRM dan RFLP dalam Analisis Mutasi Gen
EGFR 24
Isolasi DNA dari Sampel yang Disimpan dalam Kertas Saring 26 Analisis HRM dan RFLP Cairan Pleura Pasien Kanker Paru yang
Disimpan dalam Kertas Saring 26
Prevalensi mutasi gen KRAS dan EGFR 29
Potensi pengembangan kertas saring sebagai media pengiriman
sampel 32
SIMPULAN DAN SARAN 34
Simpulan 34
Saran 34
DAFTAR PUSTAKA 35
LAMPIRAN 42
DAFTAR TABEL
Halaman 1 Data prevalensi mutasi gen EGFR pada pasien kanker paru 7 2 Data prevalensi mutasi gen EGFR pada pasien kanker paru di beberapa
negara 31
3 Prevalensi mutasi gen EGFR dan KRAS berdasarkan jenis kelamin 31
DAFTAR GAMBAR
Halaman 1 Fase pertumbuhan kanker pada pasien perokok dan non-perokok 4
2 Anatomi pleura paru 5
3 Grafik prevalensi mutasi gen pada pasien kanker paru 7
4 Skema jalur transduksi sinyal EGFR 8
5 Mutasi EGFR exon 19 dan 21 9
6 Perubahan struktur asam amino pada mutasi gen EGFR exon 21 10
7 Siklus aktivasi protein Ras 11
8 Proses PCR-HRM yang diamati penurunan sinyal fluoresen 12 9 Pola pita DNA mutan dan DNA wild type pada analisis mutasi gen
KRAS dan EGFR menggunakan metode RFLP 14
10 Hasil analisis mutasi gen KRAS DNA standar sel kultur menggunakan
metode HRM 19
11 Hasil analisis mutasi gen KRAS menggunakan metode RFLP 20 12 Hasil uji sensitivitas analisis mutasi gen KRAS menggunakan metode
HRM. 21
13 Hasil uji sensitivitas metode RFLP dalam analisis mutasi gen KRAS 22 14 Hasil analisis mutasi gen EGFR menggunakan metode HRM 23 15 Hasil analisis mutasi gen EGFR menggunakan metode RFLP 24 16 Hasil uji sensitivitas analisis mutasi gen EGFR menggunakan metode
HRM 25
17 Hasil uji sensitivitas metode RFLP pada analisis mutasi gen EGFR 25 18 Grafik analisis mutasi gen KRAS pada sampel pasien kanker paru 27 19 Hasil analisis mutasi gen KRAS sampel pasien kanker paru mengguna-
kan metode RFLP 27
20 Grafik analisis mutasi gen EGFR exon 19 pada sampel pasien kanker
paru 28
21 Grafik analisis mutasi gen EGFR exon 21 pada sampel pasien kanker
paru 29
DAFTAR LAMPIRAN
Halaman
1 Ethical Clearance 41
PENDAHULUAN
Latar Belakang
Kanker paru merupakan jenis penyakit kanker yang sulit disembuhkan, sehingga telah menjadi penyebab kematian dengan frekuensi yang tinggi di dunia (Dienstmann et al. 2011). Angka tahan hidup lima tahun penderita kanker paru hanya sekitar 16%, jauh dibawah kanker kolon, kanker prostat, kanker payudara dan kanker serviks yang rata-rata bisa mencapai lebih dari 70% (American Cancer Society 2012). Di Indonesia, angka kematian akibat kanker paru juga cukup tinggi. Rata-rata tercatat 1.000 pasien kanker paru setiap tahun dengan angka tahan hidup rata-rata hanya sekitar 6 bulan (Hudoyo 2012).
Berbagai upaya pengobatan seperti pembedahan, radioterapi, dan kemoterapi dilakukan untuk meningkatkan angka tahan hidup pasien kanker paru (Spira & Ettinger 2004). Namun demikian, pasien kanker paru 80–90% diketahui telah berada pada stadium III dan IV ketika diagnosa pertama dilakukan (Sone et al. 2007). Tindakan pembedahan dan radioterapi pada stadium ini sudah tidak efektif dilakukan karena sel kanker telah menyebar, sehingga pengobatan berbasis kemoterapi merupakan pilihan utama yang saat ini dilakukan (Hudoyo 2012).
Dalam perkembangannya, target terapi dari jenis obat kemoterapi yang ada terus dikembangkan untuk mengurangi terjadinya dampak negatif terhadap pasien. Pengobatan berbasis sistem terapi target terhadap protein spesifik pada sel kanker dalam berbagai bentuk seperti senyawa kimia sederhana dan antibodi menjadi solusi yang saat ini telah dikembangkan (Shawver et al. 2002; Kim et al. 2005). Dua jenis protein yang menjadi target terapi pada kasus kanker paru diantaranya adalah EGFR (Epidermal Growth Factor Reseptor) dan KRAS (Kirsten Rat Sarcoma) (Mok et al.2009).
Protein EGFR dan KRAS merupakan dua jenis protein yang berperan penting dalam mengendalikan pertumbuhan dan kematian sel (Sakurada et al.
2006; Ronen et al. 2006). Pada sel normal protein ini berperan mengatur jalannya sinyal pertumbuhan sel secara teratur. Namun, pada sel kanker kedua protein ini mengalami perubahan karakteristik akibat adanya perubahan struktur asam amino penyusunnya (Rosell et al. 2006). Susunan asam amino protein tersebut disandikan oleh gen EGFR dan gen KRAS (Sakurada et al. 2006; Ronen et al.
2006). Mutasi pada gen EGFR dapat menyebabkan perubahan karakteristik enzim tirosin kinase, bagian dari protein EGFR, yang memicu proliferasi sel secara terus menerus dan menghambat apoptosis (Sakurada et al. 2006). Mutasi pada gen
KRAS juga dapat menyebabkan dampak yang sama dengan mutasi pada gen
EGFR (Ronen et al. 2006).
analisis lebih lanjut penggunaan obat berbasis terapi target pada pasien yang tepat dapat memperlama tingkat kekambuhan. Pengobatan kemoterapi pada pasien yang mengalami mutasi gen EGFR hanya memberikan dampak peningkatan ketahanan terhadap kekambuhan sekitar 5,4 bulan, sedangkan dengan menggunakan obat terapi inhibitor tirosin kinase dapat meningkat hingga 10,4 bulan. Dampak sebaliknya terjadi jika obat inhibitor tirosin kinase diberikan kepada pasien yang tidak mengalami mutasi gen EGFR, pasien dapat mengalami penurunan ketahanan terhadap kekambuhan hingga dibawah 3 bulan (Mok et al.
2009).
Metode standar analisis mutasi gen yang digunakan saat ini adalah DNA sekuensing. Teknik ini paling akurat untuk mendeteksi adanya perubahan nukleotida pada sekuen DNA. Namun demikian, untuk aplikasi medis metode ini memiliki kekurangan diantaranya limit deteksi mutasi yang rendah, sehingga kurang cocok digunakan untuk sampel dengan frekuensi mutasi yang rendah (Krypuy et al. 2006). Beberapa peneliti telah melakukan pengembangan teknik deteksi yang cepat, dan memiliki sensitivitas serta akurasi yang tinggi, namun sederhana dan mudah dilakukan sebagai alternatif dari teknik sekuensing seperti teknik pyrosequensing (Ogino et al. 2005), mutant enrichment-PCR (Kawada et al. 2008), Denaturing Gradient Gel Electrophoresis (DGGE) (Siegfried et al. 1997), dan Denaturing High Performance Liquid Chromatography (DHPLC) (Karim et al. 2011).
Teknik High Resolution Melting (HRM) dan Restriction Fragment Length Polymorphisme (RFLP) merupakan teknik deteksi mutasi gen lainnya yang telah dikembangkan. Teknik ini lebih sederhana, cepat dan memiliki akurasi serta sensitivitas yang tinggi jika dibandingkan dengan teknik DNA sekuensing (Krypuy et al. 2006; Kawada et al. 2008). Aplikasi kedua metode ini dalam analisis sampel pasien kanker telah dikembangkan secara terpisah. Krypuy et al. (2006) telah melakukan deteksi mutasi gen KRAS pada 30 sampel kanker paru dari hasil biopsi menggunakan teknik HRM, dan berhasil mendeteksi mutasi gen
KRAS kodon 12 dan 13 dengan performa dan sensitivitas yang baik. Namoto et al.
(2006) telah melakukan analisis mutasi gen EGFR dari sampel sitologi kanker paru menggunakan teknik HRM. Teknik RFLP telah dilakukan oleh Kawada et al.
(2008) untuk mengetahui terjadinya mutasi pada gen EGFR pada kasus kanker paru menggunakan enzim restriksi spesifik untuk membedakan antara jenis gen mutan dan wild type. Teknik RFLP juga telah dilakukan untuk mendeteksi mutasi gen KRAS pada kanker kolon (Nollau et al. 1996).
Di Indonesia, analisis mutasi gen EGFR dan KRAS berbasis biologi molekuler sebagai diagnosa utama untuk menentukan tindakan pengobatan belum banyak dilakukan. Keterbatasan fasilitas pengujian sel kanker berbasis mutasi gen merupakan kendala utama. Penyediaan sampel berbasis histologi yang saat ini digunakan sebagai sampel standar untuk pengujian mutasi gen juga hanya dapat dilakukan melalui proses operasi yang cenderung terbatas pada rumah sakit tertentu, tersedia dalam jumlah sedikit dan bersifat invasif (melukai pasien) (Pang
mengirimkan sampel pada laboratorium rujukan yang telah memiliki fasilitas lengkap. Penggunaan cairan pleura yang disimpan dalam kertas saring sebagai media pengiriman sampel untuk analisis mutasi gen merupakan harapan solusi yang belum pernah dilakukan.
Analisis mutasi gen sebagai diagnosa utama untuk menentukan tindakan pengobatan yang tepat merupakan hal yang sangat penting, maka pengembangan kombinasi metode analisis PCR-HRM dan RFLP untuk mengetahui adanya mutasi gen pada sampel cairan pleura pasien kanker paru yang disimpan dalam kertas saring sebagai media penyimpanan sementara dan pengiriman sampel dilakukan dalam penelitian ini. Selain itu, penelitian ini diarahkan untuk mengetahui profil mutasi gen pada pasien kanker paru di Indonesia, sehingga dapat dijadikan sebagai data awal untuk mengetahui karakteristik pola mutasi gen pada pasien kanker paru di Indonesia.
Adapun analisis mutasi gen yang menjadi fokus utama pada penelitian ini adalah analisis mutasi gen EGFR pada ekson 19 dan 21 serta mutasi gen KRAS
pada kodon 12 dan 13. Pemilihan jenis dan posisi gen ini didasarkan pada hasil penelitian di beberapa negara yang menunjukkan bahwa kedua jenis mutasi ini memiliki prevalensi yang dominan (Lynch et al. 2004). Mutasi gen EGFR sering terjadi pada ekson 18, 19, 20 dan 21, namun menurut Lynch et al. (2004) mutasi yang paling banyak ditemukan adalah delesi pada ekson 19 dan mutasi titik pada ekson 21. Mutasi gen KRAS ditemukan pada ekson 2 kodon 12 dan 13 (sering) dan ekson 3 kodon 59 dan 61 (jarang) (Cox & Der 2003; Molina & Adjei 2006).
Tujuan
TINJAUAN PUSTAKA
Kanker Paru
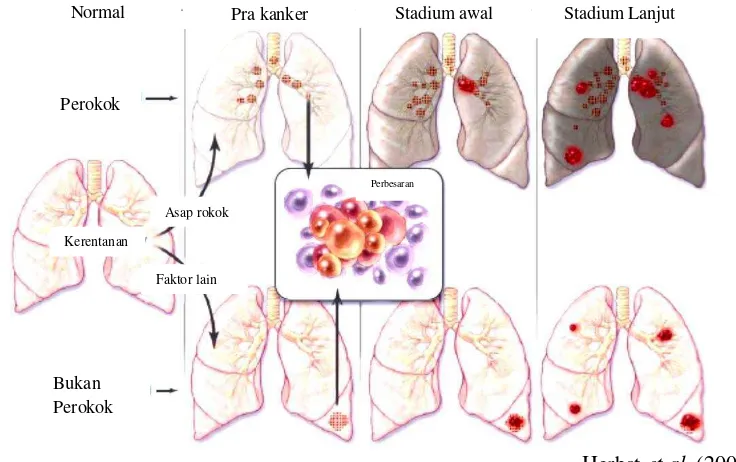
Kanker paru merupakan tumor ganas pada organ paru, dan terletak pada daerah saluran nafas atau epitel bronkus. Terjadinya kanker paru ditandai dengan pertumbuhan sel yang tidak normal, tidak terbatas dan cenderung merusak jaringan normal (Herbst et al. 2008). Masa pertumbuhan kanker mulai dari fase prakanker, stadium awal dan stadium lanjut dapat dilihat pada Gambar 1.
Herbst et al. (2008) Gambar 1 Fase pertumbuhan kanker pada pasien perokok dan non-perokok
Kanker paru terbagi menjadi dua kelompok besar yaitu Small-Cell Lung Cancer (SCLC) dan Non-Small Cell Lung Cancer (NSCLC). Kasus kanker paru jenis NSCLC lebih banyak terjadi (85%) jika dibandingkan dengan jenis SCLC (15%) (Herbst et al. 2008). NSCLC dapat dibagi menjadi tiga subtipe utama yaitu
squamous-cell carcinoma, adenocarcinoma, dan large cell lung cancer. Jenis
squamous-cell carcinoma dan small-cell lung cancer banyak ditemukan pada pasien perokok, sedangkan jenis sel adenocarcinoma banyak ditemukan pada pasien non-perokok .
Asap rokok dan polusi lingkungan lainnya dapat memicu terjadinya karsinogenesis. Disamping itu, faktor lain seperti keturunan, hormonal dan virus juga dapat menjadi pemicu karsinogenesis pada paru (Sun et al. 2007). Kerusakan jaringan paru diawali dengan perubahan genetik dan epigenetik, seperti mutasi gen dan metilasi yang tidak normal, dan perubahan transkriptomik, seperti inflamasi dan apoptosis. Perubahan ini terjadi dalam jangka waktu yang cukup lama dan mengarah kepada terjadinya perubahan pada jalur regulasi sel, seperti ketidakteraturan proses proliferasi dan apoptosis, sehingga sel berubah menjadi ganas (Spira et al. 2004). Perubahan karakteristik molekuler juga menyebabkan terjadinya angiogenesis, invasi dan metastasis sel (Sato et al. 2007).
Perokok
Bukan Perokok
Asap rokok
Faktor lain
Normal Pra kanker Stadium awal Stadium Lanjut
Kerentanan
Perubahan karakteristik molekuler pada setiap pasien kanker paru berbeda-beda (Gambar 1). Pasien kanker paru yang memiliki riwayat merokok misalnya, memiliki perbedaan karakteristik pola mutasi gen dengan pasien yang tidak memiliki riwayat perokok. Mutasi gen KRAS banyak ditemukan pada pasien perokok, sedangkan mutasi gen EGFR banyak ditemukan pada pasien non-perokok. Sel kanker pada pasien perokok umumnya terbentuk pada bagian saluran utama sistem pertukaran udara, sedangkan pada kasus pasien non-perokok umumnya terbentuk pada daerah perifer (Mao et al. 1997; Wistuba et al. 2000; Zudaire et al. 2008)
Pasien kanker paru memiliki harapan kesembuhan lebih besar jika pada saat dilakukan diagnosa pertama kali masih berada pada stadium awal (I dan II). Pada kondisi ini sel kanker paru masih dapat diangkat melalui pembedahan. Namun demikian, 80–90% pasien penderita kanker paru sudah diketahui berada pada stadium III dan IV ketika diagnosa pertama kali dilakukan (Sone et al. 2007). Pada stadium ini sel kanker sudah menyebar menuju organ lain, dan pada beberapa pasien umumnya disertai pembengkakan dan penumpukan cairan pada rongga pleura, yang sering disebut efusi pleura.
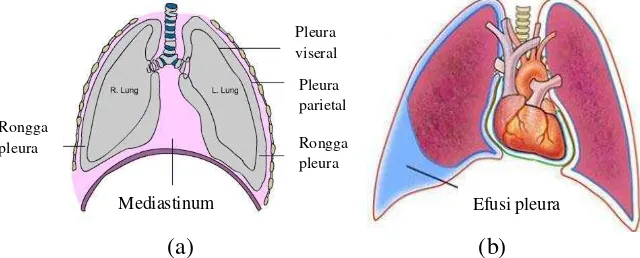
Pleura adalah membran serosa yang licin, mengkilat, tipis dan transparan. Membran ini menutupi jaringan paru dan terdiri atas 2 lapisan yaitu pleura viseralis yang terletak pada bagian dalam, langsung menutupi permukaan paru, dan pleura parietalis yang terletak pada bagian luar dan berhubungan dengan dinding dada (Gambar 2a). Pada rongga pleura terdapat cairan yang keluar dari pembuluh darah melalui pleura parietal dan kemudian diserap oleh pleura viseralis, dialirkan ke pembuluh limfe dan kembali ke darah (Gambar 2b). Rongga pleura dalam keadaan normal memiliki ukuran tebal 20 µ m, berisi sekitar 10-20 mL cairan jernih yang tidak berwarna, mengandung protein <1,5 gr/dl dan ± 1500 sel/µ L. Sel cairan pleura didominasi oleh sel monosit, sejumlah kecil sel limfosit, makrofag, sel darah merah dalam jumlah yang sangat kecil dan sel mesotel (Light 2000).
(a) (b)
Gambar 2 Anatomi pleura paru. (a) pleura normal; (b) efusi pleura
Efusi pleura adalah penumpukan cairan pada rongga pleura, yang terjadi akibat produksi cairan melebihi kemampuan normal penyerapan sehingga terjadi akumulasi cairan melebihi volume normal. Umumnya efusi pleura disebabkan oleh infeksi dan kasus keganasan/kanker pada paru atau organ lainnya (Sato 2006). Efusi pleura yang disebabkan oleh kanker sering disebut sebagai efusi pleura ganas (EPG). EPG dibuktikan dengan adanya penemuan sel tumor pada
Efusi pleura
Pleura parietal Pleura viseral
Rongga pleura Rongga
pleura
pemeriksaan sitologi cairan pleura atau biopsi cairan pleura. Efusi pleura ganas bersifat metastatik berasal dari penyebaran langsung sel-sel ganas dari tempat sekitar (seperti pada keganasan paru, payudara, dan dinding dada) (Heffner & Klein 2008).
Pada umumnya hanya sekitar 25% dari effusi pleura ganas yang disertai penemuan sel tumor pada pemeriksaan sitologi. Meskipun tidak ditemukan sel tumor pada cairan pleura, akan tetapi ditemukan kanker primer pada paru dan cairan pada pleura timbul berulang, masif dan pasien tidak respon terhadap obat antiinfeksi maka pasien tetap dikategorikan menderita EPG (Syahruddin et al. 2009). Terjadinya EPG pada penderita kanker paru sangat menyulitkan pengambilan tindakan yang tepat. Penderita pada kondisi ini sudah dikategorikan berada pada stadium IIIB yang prognosisnya tidak dapat disamakan dengan stadium IIIB tanpa EPG. Penderita juga memiliki prognosis yang buruk, namun demikian penanganan yang tepat dapat meningkatkan kualitas kesehatan penderita (Burrows et al. 2000).
Penelitian-penelitian terakhir berusaha untuk mengungkapkan patogenesis EPG pada tingkat molekuler untuk dapat menjawab tantangan dalam hal diagnosis dan penetalaksanaannya yang sangat kompleks. Penelitian-penelitian tersebut banyak melihat peranan protein inflamasi dan penanda tumor lainnya dalam hubungannya dengan EPG (Ngurah Rai 2009). Optimasi analisis kanker paru berdasarkan penanda protein CEA pada efusi pleura telah dilakukan Arbaningsih (2010). Analisis karakteristik molekuler yang memanfaatkan cairan pleura dari pasien kanker paru juga telah banyak dilakukan (Krypuy et al. 2006; Kimura et al. 2006).
Biomarker Kanker Paru
Pengembangan teknologi pengobatan berbasis sistem terapi target dan aplikasinya kepada pasien kanker telah mendorong dikembangkannya jenis biomarker spesifik yang dapat digunakan sebagai acuan dalam diagnosa untuk pengambilan tindakan pengobatan yang tepat. Biomarker prediktif dikembangkan, divalidasi dan diaplikasikan dalam diagnosa pasien untuk meningkatkan ketepatan dalam pemberian obat terapi target, serta melihat kemungkinan adanya resistensi yang terjadi. Adanya biomarker spesifik ini dapat membantu pasien menerima tindakan pengobatan yang tepat dan mengurangi biaya pengobatan (Tappenden et al. 2006; Simon 2010).
Pengembangan penelitian untuk menemukan dan memvalidasi biomarker spesifik kanker paru telah dilakukan beberapa tahun ini. Salahsatu jenis biomarker yang dikembangkan, diarahkan pada pengobatan berbasis inhibitor enzim tirosin kinase pada reseptor faktor pertumbuhan/EGFR. Dua jenis obat terapi target gefitinib (IRESSATM) dan erlotinib (TARCEVATM) telah menunjukkan respon pengobatan yang lebih baik terhadap pasien yang mengalami mutasi gen EGFR, sehingga menunjukkan pentingnya analisis mutasi gen EGFR sebagai biomarker kanker paru pada pasien (Dassonville et al. 2007; Hirsch & Bunn 2005; Dahabreh
et al. 2010). Hasil penelitian sejak tahun 2004 menunjukkan bahwa penggunaan obat terapi target gefitinib pada pasien yang mengalami mutasi gen EGFR
Tabel 1 Data prevalensi mutasi gen EGFR pada pasien kanker paru Penelitian Etnis
pasien
Prevalensi mutasi
Respon gefitinib terhadap pasien dengan EGFR wild type
Respon gefitinib terhadap pasien yang mengalami mutasi gen EGFR Huang et al. (2004) Cina 8/16 (50%) 0/8 (0%) 6/8 (75%)
Tokumo et al. (2005) Jepang 10/21 (48%) 2/12 (17%) 7/9 (78%) Zhang et al. (2005) Cina 12/30 (40%) 1/18 (6%) 8/12 (67%)
Han et al. (2005) Korea 17/90 (19%) 10/73 (14%) 11/17 (65%)
Kim et al. (2005 Korea 6/27 (22%) 2/21 (10%) 6/6 (100%)
Pengembangan penemuan biomarker spesifik lain dalam rangka menemukan obat terapi target yang lebih spesifik untuk setiap pasien terus dikembangkan. Penemuan jenis mutasi pada gen-gen lain yang mengatur regulasi sel terus berkembang. Menurut Crystal & Alice (2011) beberapa jenis mutasi gen yang ditemukan pada pasien kanker paru selain gen EGFR adalah KRAS, ALK, PIK3CA, HER2, BRAF, AKT, MET dan sebagian besar mutasi gen masih belum diketahui (Gambar 3). Mutasi gen KRAS dan EGFR memiliki prevalensi cukup besar jika dibandingkan dengan gen yang lain.
Gambar 3 Grafik prevalensi mutasi gen pada pasien kanker paru
Mutasi Gen EGFR
Gen EGFR (Epidermal Growth Factor Receptor) terletak pada lengan pendek kromosom 7 dan berfungsi untuk mengkode protein reseptor faktor pertumbuhan. EGFR terletak pada bagian transmembran sel epitel dan memiliki aktivitas tirosin kinase (Yarden & Sliwkowski 2001). Menurut Carpenter (1987)
EGFR merupakan glikoprotein membran plasma yang berukuran 170 kDa, dan tersusun dari bagian ekstraseluler, daerah transmembran dan daerah intraseluler. Daerah ekstraseluler merupakan bagian yang berikatan dengan ligan, sedangkan daerah intraseluler merupakan bagian aktivitas enzim trosin kinase. Ikatan ligan dengan reseptor menginduksi terjadinya dimerisasi antara dua reseptor EGFR. Proses dimerisasi tidak hanya terjadi antara reseptor yang sama (homo-dimerisasi) namun dapat terjadi antara dua reseptor yang berbeda (hetero-dimerisasi) (Riese & Stern 1998). Heterodimerisasi terjadi antara sesama kelompok reseptor tirosin kinase/ErbB seperti ErbB2, ErbB3 dan ErbB4.
EGFR berfungsi sebagai penyampai sinyal transduksi dari luar sel menuju inti sel melalui protein-protein di dalam sitoplasma, dan mengarah kepada proses
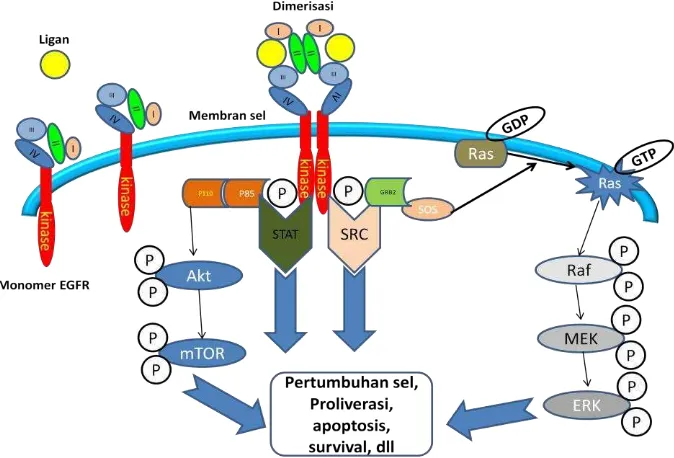
pengendalian pertumbuhan dan kematian sel, diferensiasi dan migrasi sel, angiogenesis, serta invasi sel (Santos et al. 2011). Sinyal ini terjadi setelah proses pengikatan ligan oleh reseptor EGFR yang dilanjutkan dengan adanya proses dimerisasi dan autofosforilasi (Ogiso et al. 2002; Schlessinger 2002). Proses ini memicu aktivasi jalur transduksi sinyal dibawah protein EGFR seperti jalur Akt, STAT dan RAS. Jalur sinyal Akt berkaitan erat dengan proses ketahanan (survival) sel (Goswami et al. 2006). Proses autofosforilasi jalur Akt melalui proses docking protein Gab1 pada protein PI3K yang selanjutnya akan mengaktivasi protein Akt, mTOR dan akhirnya menyampaikan sinyal ke inti sel (Matton et al. 2004). Menurut Sordella et al. (2004) jalur Akt dan STAT memiliki peran penting dalam proses antiapoptosis untuk ketahanan sel. Pada jalur lain terjadi proses aktivasi sinyal Raf/MEK/Erk melalui aktivasi protein RAS. Protein Grb2 SH2 yang terikat pada EGFR menghasilkan sinyal yang mengaktivasi protein RAS dan terjadi fosforilasi pada protein dibawahnya (Katz et al. 2007). Jalur RAS terutama berperan terhadap proses proliferasi sel (Katz et al. 2007; Robets & Der 2007).
Yoshida et al. 2010 Gambar 4 Skema jalur transduksi sinyal EGFR
Ket: ERK= extracytoplasmic-regulated kinase, Grb-2= Growth factor receptor-bound protein 2, MAPK= mitogen-activated protein kinase, MEK= MAPK kinase, mTOR= mammalian target rapamycin, PI3K=
phosphoinositide 3-kinase, PTEN= phospatase and tensin homolog, RAF= v-raf murine leukimia viral oncogene homolog, RAS= rat sarcoma viral oncogene homolog, SOS= sister of sevenless, STAT=
signal transducer and activator of transcription.
mutasi gen, EGFR memberikan sinyal pertumbuhan sel yang secara konstitutif melakukan proliferasi dan menghambat aktivasi protein yang berperan dalam proses apoptosis, sehingga sel berubah menjadi kanker (Sakurada et al. 2006). Mutasi gen EGFR menyebabkan aktivasi tirosin kinase secara terus menerus akibat adanya perusakan pada sistem autoinhibitor (Yun et al. 2007) dan induksi terjadinya proses fosforilasi lebih tinggi jika dibandingkan dengan keadaan normal (Lynch et al. 2004; Mulloy et al. 2007). Selain itu, pada sel kanker paru NSCLC mutasi EGFR menyebabkan terjadinya dimerisasi reseptor tanpa membutuhkan bantuan ligan, sehingga aktivasi EGFR dan jalur tranduksi sinyal dibawahnya terjadi secara konstitutif (Okabe et al. 2007; Choi et al. 2007).
Mutasi gen EGFR meliputi jenis mutasi titik, delesi dan insersi yang terjadi pada ekson 18, 19, 20, 21 dan 24 (Shigematsu et al. 2005; Paez et al. 2004; Lynch
et al. 2004). Delesi yang terjadi merupakan jenis delesi in-frame akibat kehilangan 4-6 asam amino (kodon 746–kodon 752) pada ekson 19 (Sakurada et al. 2006; Kawada et al. 2008). Jenis mutasi berikutnya yang terjadi adalah substitusi satu nukleotida yang dapat terjadi pada ekson 18 dan 21, serta duplikasi
in-frame dan atau insersi yang banyak terjadi pada ekson 20 (Shigematsu & Gazdar 2006). Pada umumnya mutasi yang paling sering terjadi (85-90%) adalah mutasi pada ekson 19 dan 21 kodon 858 (Gambar 5) (Shigematsu et al. 2005; Paez et al. 2004; Lynch et al. 2004).
(Santos et al. 2011) Gambar 5 Mutasi EGFR ekson 19 dan 21
Mutasi EGFR pada ekson 21 kodon 858 menyebabkan terjadinya perubahan konformasi struktur enzim tirosin kinase. Substitusi basa Timin menjadi Guanin (CTG>CGG) menyebabkan perubahan translasi asam amino leusin menjadi arginin. Asam amino arginin bersifat hidrofil dan polar, sedangkan leusin bersifat hidrofob dan cenderung nonpolar. Asam amino hidrofil lebih banyak berada di bagian permukaan protein, sedangkan asam amino hidrofob memiliki struktur berlipat dan hampir selalu ada di bagian dalam protein (Yun el al. 2007)
Substitusi pada mutan
dua nukleotida terdeteksi Substitusi
Gambar 6 Perubahan struktur asam amino pada mutasi EGFR exon 21. (a) EGFR dengan asam amino Leusin; (b) EGFR dengan asam amino Arginin
Mutasi Gen KRAS
Penelitian mengenai gen RAS bukanlah hal yang baru dilakukan akhir-akhir ini. Edward Scolnick dan tim risetnya sejak 30 tahun yang lalu telah mengidentifikasi gen RAS (Rat Sarcoma Virus) sebagai suatu gen virus dengan karakteristik yang bersifat onkogenik/memicu terjadinya tumor, dan kemudian diidentifikasi merupakan gen yang terkait dengan karsinogenesis (Linordau et al. 2011). Gen RAS pada awalnya ditemukan dari virus penginduksi leukimia pada tikus. Gen tersebut kemudian diidentifikasi sebagai HRAS (Harvey RAS) dan
KRAS (Kirsten RAS) setelah ditemukan dari turunan sekuen genom tikus. Pada tahun 1982, penelitian mengenai kloning gen dari sel kultur manusia menemukan adanya homologi gen manusia dengan gen HRAS dan KRAS. Satu tahun kemudian jenis gen RAS yang lain, NRAS (Neuroblastoma RAS), ditemukan (Rielly et al.
2008).
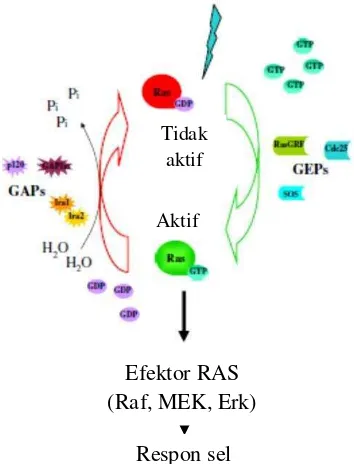
(Linardou et al. 2011) Gambar 7 Siklus aktivasi protein RAS
Menurut Linordau et al. (2011) proses aktivasi RAS dibantu protein GRB2 dan SHC, protein adaptor yang mengikat RAS pada fosfotirosin spesifik. Interaksi ini menjadi mediasi masuknya SOS ke dalam membran plasma yang akan mendorong konversi RAS dari GDP menjadi bentuk GTP. Reseptor-reseptor lain yang tidak secara langsung terintegrasi dengan tirosin kinase seperti Src-like tirosin kinase juga mengaktivasi protein RAS. Proses inaktivasi RAS terjadi melalui proses perubahan GTP menjadi GDP oleh GAPs, suatu proses yang belum diketahui secara detail. Ada suatu pendapat yang menyatakan bahwa fosforilasi SOS oleh jalur Raf/MAP kinase dapat menginduksi disosiasi SOS dari GRB2 sebagai hasil peralihan menjadi bentuk GDP. Protein GAP p120 bertindak sebagai regulator negatif RAS dan diatur oleh fosporilasi tirosin. Aktivasi RAS menyebabkan fungsinya sebagai adaptor untuk mengaktifkan jalur-jalur sinyal transduksi berikutnya berlangsung dan pada akhirnya menyampaikan sinyal ke inti sel.
Mutasi gen RAS merupakan perubahan onkogen yang paling banyak terjadi pada kasus kanker manusia. Mutasi gen RAS yang umum terjadi disebabkan adanya substitusi satu basa nukleotida pada daerah kodon 12, 13 dan kodon 61 (Bos 1989). Letak mutasi KRAS yang jarang terjadi adalah pada kodon 11, 18 dan 59 (Cox & Der 2003; Molina & Adjei 2006; Krypuy et al. 2006) dan kodon 22 (Miyakura et al. 2002).
High Resolution Melting Analysis (HRM)
Analisis HRM adalah suatu metode yang dikembangkan untuk mengetahui adanya mutasi atau variasi pada susunan basa nukleotida secara tepat dan cepat. Metode ini mampu mendeteksi dan mengidentifikasi mutasi gen secara cepat, mengidentifikasi variasi genetik tanpa sekuensing dan atau membedakan adanya variasi genetik pada suatu populasi (Kapa Biosystem 2007). HRM banyak
Efektor RAS (Raf, MEK, Erk)
Respon sel
Aktif Tidak
digunakan untuk SNP (Single nucleotide polymorphisme) genotyping, analisis DNA metilasi, fingerprint DNA, identifikasi spesies, dan penemuan adanya mutasi DNA (Corbett Research 2006).
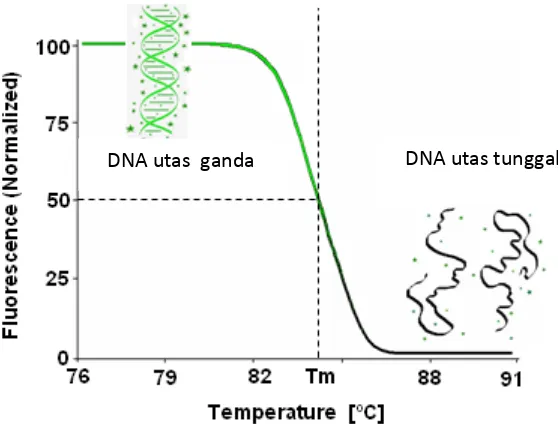
HRM merupakan teknik yang sederhana, tidak memerlukan proses pemisahan DNA atau proses rumit lainnya. Teknik ini menjadi solusi yang tepat untuk diagnostik setelah teknik HRM ini dikombinasikan dengan rapid cycle PCR (Reed et al. 2007). Proses HRM diawali dengan amplifikasi sekuen DNA target menggunakan teknik PCR. Senyawa dye ditambahkan agar dapat terikat pada DNA utas ganda hasil PCR secara spesifik dan menghasilkan fluoresen yang jelas.
Dye tidak terikat dan memancarkan fluoresen pada DNA utas tunggal. Perbedaan sinyal fluoresen ini digunakan untuk mengamati proses amplifikasi DNA dan proses selama HRM. Analisis HRM dimulai setelah proses PCR selesai, DNA yang dihasilkan didenaturasi secara bertahap dengan cara menaikkan temperatur secara perlahan dengan tujuan untuk mendapatkan profil pola melting point DNA. Pola ini dapat diamati dari penurunan fluoresen senyawa dye akibat perubahan DNA dari utas ganda menjadi utas tunggal (Kapa Biosystem 2007).
Gambar 8 Proses PCR-HRM yang diamati penurunan sinyal fluoresen
HRM menggunakan mesin PCR yang dilengkapi dengan instrumen beresolusi tinggi untuk menentukan pola melting DNA, sehingga tidak semua mesin PCR dapat digunakan. Pola melting yang terbentuk menunjukkan karakteristik DNA yang terbentuk. Karakterisasi DNA dengan HRM dilakukan berdasarkan pada panjang sekuen, kandungan basa guanin dan sitosin, serta komplementaritas sekuen DNA. HRM sangat sensitif untuk mendeteksi adanya perubahan satu basa nukleotida. Dengan demikian, adanya mutasi titik pada basa DNA akan menghasilkan pola melting yang berbeda (Wittwer 2009).
HRM terjadi setelah proses PCR, sehingga sangat bergantung kepada keberhasilan proses PCR. Tingkat sensitivitas yang tinggi sangat dipengaruhi oleh kondisi PCR yang digunakan. Faktor-faktor yang dapat mempengaruhi keberhasilan analisis seperti faktor mesin dan faktor proses PCR yang meliputi desain primer, reagen PCR, senyawa dye dan kondisi siklus PCR perlu
diperhatikan. Sedikit perbedaan pada kondisi mesin dan kondisi campuran reagen PCR dapat menyebabkan perubahan pada hasil analisis (Reed et al. 2007). Kualitas DNA cetakan, primer, konsentrasi MgCl2, dan keberadan inhibitor dapat mempengaruhi pola melting DNA. Selain itu keberadaan senyawa dye sebagai indikator melalui sinyal fluoresen yang dihasilkan juga sangat penting. Beberapa jenis dye yang telah dikembangkan diantaranya adalah SYBR green, LCGreen, dan Syto9 (White & Potts 2006).
Penggunaan SYBR Green dapat menghambat proses PCR ketika konsentrasi DNA utas ganda yang terbentuk telah mencapai jumlah yang hampir
jenuh. Hal ini dapat menyebabkan “dye jumping” selama proses melting amplikon
sehingga dapat menurunkan sensitivitas deteksi HRM (Wittwer et al. 2003). LCGreen digunakan untuk menyempurnakan fungsi dye SYBR green. Dye ini tidak menghambat proses amplifikasi selama PCR sehingga sensitivitas dan spesifitas analisis lebih baik jika dibandingkan dengan SYBR Green (Wittwer et
al. 2003; Herrmann et al. 2006). Jenis dye berikutnya adalah SYTO9 yang
memiliki tingkat sensitivitas dan spesifisitas deteksi yang lebih tinggi daripada LCGreen. SYTO9 menunjukkan hasil analisis melting curve yang lebih reprodusibel, tidak menghambat proses PCR dan tidak bersifat selektif terhadap amplikon tertentu (Monis et al. 2004).
Restriction Fragment Lenght Polymorphisme (RFLP)
Metode RFLP merupakan salah satu metode yang umum digunakan untuk mengetahui adanya variasi pada susunan basa DNA suatu organisme. Analisis dilakukan pada DNA atau cDNA hasil amplifikasi, kemudian dipotong menggunakan enzim restriksi dan dipisahkan menggunakan elektroforesis gel. Meskipun teknik ini merupakan teknik yang sangat sensitif dan sangat mudah digunakan untuk mengetahui variasi pada sekuen DNA, akan tetapi banyak polimorfisme terjadi akibat adanya perubahan pada satu pasang basa nukleotida, sehingga dibutuhkan enzim restriksi yang secara spesifik mengenali daerah tempat terjadinya perubahan tersebut (Nakashima et al. 2003).
Teknik RFLP relatif sederhana, tidak membutuhkan peralatan yang rumit dan mahal, namun dapat digunakan untuk analisis genotyping (Zhang et al. 2005). Enzim restriksi endonuklease yang dapat memutuskan molekul DNA pada daerah yang spesifik digunakan pada suhu dan jumlah tertentu. Daerah pengenalan enzim restriksi umumnya berjumlah 4-6 basa. Semakin pendek daerah yang dikenali maka semakin besar jumlah fragmen yang dihasilkan. Besar kecilnya ukuran fragmen yang dihasilkan dapat dianalisis menggunakan gel elektroforesis (Lodish
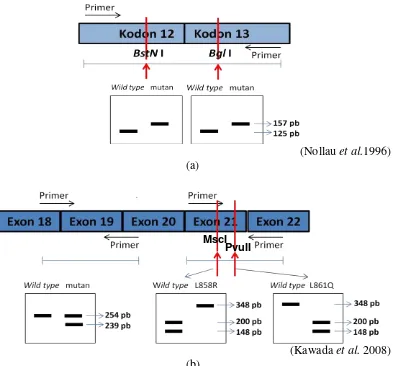
(Nollau et al.1996) (a)
(Kawada et al. 2008) (b)
Gambar 9 Pola pita DNA mutan dan DNA wild type pada analisis mutasi gen
KRAS dan EGFR menggunakan metode RFLP. (a) KRAS; (b) EGFR
Penggunaan metode RFLP dalam analisis mutasi gen KRAS dan EGFR telah dilakukan oleh Nollau et al. (1996) dan Kawada et al. (2008). Analisis mutasi gen
KRAS dan EGFR menggunakan metode RFLP secara jelas dapat membedakan DNA mutan dengan DNA Wild type (Gambar 9). Enzim BstN 1 memotong
susunan basa 5’-CC WGG-3’ (W= A atau T) pada kodon 12, sedangkan enzim
BglI memiliki situs pemotongan 5’-GCCNNNN NGGC-3’ (N= A, T, G, atau C).
Mutasi gen KRAS kodon 12 dapat diketahui dengan adanya pita tunggal berukuran sekitar 157 pb setelah dipotong menggunakan enzim BstNI dan mutasi kodon 13 ditunjukkan dengan adanya pita berukuran sekitar 157 pb setelah dipotong menggunakan enzim BglI. Kedua jenis enzim tersebut memotong DNA yang tidak mengalami mutasi wild type (Nollau et al. 1996).
Analisis mutasi gen EGFR ekson 21 dapat dibedakan pada dua kodon yaitu 858 dan 861. Mutasi titik L858R ditunjukkan dengan adanya pita tunggal berukuran sekitar 348 pb setelah dipotong menggunakan enzim MscI, dan mutasi titik L861Q ditunjukkan dengan adanya dua pita berukuran sekitar 200 pb dan 148 pb setelah dipotong menggunakan enzim PvuII. Enzim MscI memotong daerah 5’-TGG CCA-3’ pada exon 21 kodon 858 dan enzim PvuII memotong daerah 5’ -CAG CTG-3’ pada ekson 21 kodon 861. Analisis mutasi EGFR ekson 19 tidak
METODOLOGI
Waktu dan Tempat Penelitian
Penelitian ini dilakukan mulai Bulan September 2011 sampai dengan Bulan September 2012 di Laboratorium Kalbe Genomic, Stem cell and Cancer Institute
(SCI), PT Kalbe Farma, Tbk. Jakarta.
Bahan
Sel kultur yang digunakan sebagai kontrol adalah sel HCT-116 (Human Colon Tumour), BT-549 (Human Breast Carcinoma), dan A-549 (Human Lung Carcinoma), yang diperoleh dari koleksi sel kultur Laboratorium Kalbe Genomic, SCI. DNA standar EGFR ekson 21 diperoleh dari IDT DNA (Iowa, USA) yang telah memiliki sertifikat kemurnian dan ketepatan susunan basa yang teruji. Sampel cairan pleura pasien kanker paru diperoleh dari Departemen Pulmonologi dan Respirasi FKUI/SMF Paru Rumah Sakit Persahabatan Jakarta melalui prosedur dan etika pengambilan sampel yang telah disetujui Komisi Etika Penelitian Kesehatan Fakultas Kedokteran Universitas Indonesia (Lampiran 1). Sampel yang diperoleh dalam bentuk kertas saring. Koleksi sampel cairan pleura dan pengeringan pada kertas saring dilakukan oleh dokter ahli dan secara selektif dipilih dari pasien kanker paru, bukan dari penderita penyakit Tuberkulosis atau infeksi lainnya.
Prosedur Kerja
1) Pengembangan metode HRM dan RFLP untuk mengenali mutasi gen KRAS
dan EGFR pada DNA standar
Dalam tahapan ini dilakukan penentuan pola grafik standar DNA wild type
dan DNA mutan pada hasil analisis HRM dan pola pita hasil pemotongan enzim pada analisis metode RFLP. DNA yang digunakan sebagai DNA cetakan diperoleh dari DNA sel kultur standar yang diketahui memiliki mutasi gen KRAS
dan sekuen DNA yang memiliki mutasi gen EGFR.
Analisis PCR-HRM KRAS dan EGFR
Analisis HRM dilakukan menggunakan alat Real Time-PCR Rotor-Gene 6000TM (Corbett Research, Sydney, Australia). Analisis PCR-HRM KRAS dilakukan sesuai dengan metode yang telah dilakukan Krypuy et al. (2006). Reagen PCR terdiri atas: 1x PCR buffer, 2,5 mM MgCl2, 200 nM primer, 200 µ M
Analisis PCR-HRM EGFR dilakukan menurut Hongdo et al. (2008). Reagen PCR terdiri atas: 1x PCR buffer, 2,5 nM MgCl2, 200-400 nM primer, 200
µM dNTPs, 5µM SYTO9, 0,5 U enzim Taq Polymerase dan air PCR grade hingga volume 20 µL. Kondisi PCR yang digunakan adalah pra-PCR pada suhu 950C selama 15 menit, 50 siklus PCR dengan tahapan denaturasi pada suhu 950C selama 10 detik, annealing pada suhu 650C selama 10 detik, dan polimerisasi pada suhu 720C selama 30 detik, dan post-PCR pada suhu 970C selama 1 detik, dilanjutkan dengan melting DNA pada suhu 70–950C dengan kecepatan kenaikan temperatur sebesar 0,20C/detik.
Analisis RFLP KRAS kodon 12 dan 13
Produk PCR gen KRAS diperoleh melalui 2 kali proses PCR, first PCR dan
nested PCR. Mix PCR terdiri atas 500 nM primer, 1 x PCR buffer+MgCl2, 200
nM dNTP, 1,25 U enzim TaqPolymerase, H2O dan DNA cetakan. Kondisi PCR
yang digunakan adalah 1 siklus pra-PCR pada suhu 950C selama 5 menit, 18-20 siklus PCR dengan tahapan denaturasi pada suhu 950C selama 1 menit, annealing
pada suhu 50 - 550C selama 1 menit, dan polimerisasi pada suhu 720C selama 2 menit, dan satu siklus post-PCR pada suhu 720C selama 2 menit. Untuk suhu penempelan primer pada first PCR KRAS kodon 13 dilakukan pada suhu 630C selama 1 menit. Suhu annealing PCR KRAS 12 dan 13 dilakukan secara gradien pada suhu 50 – 630C. First PCR dilakukan selama 18 – 20 siklus dan nested PCR dilakukan selama 30 – 35 siklus.
Analisis RFLP produk PCR KRAS kodon 12 menggunakan produk PCR sebanyak 15 µL yang dipotong dengan 20 U enzim BstNI. Analisis RFLP hasil
nested PCR KRAS kodon 13 menggunakan produk PCR sebanyak 15 µL yang dipotong dengan 20 U enzim Bgl I. Hasil RFLP dimigrasikan dengan elektroforesis pada gel agarosa dengan konsentrasi agarosa 2,5%. Elektroforesis dilakukan selama 60 menit pada tegangan 100 volt. Gel diwarnai dengan 0,5 µg/mL EtBr dan dilihat pita yang terbentuk menggunkan transiluminator UV.
Analisis RFLP EGFR ekson 21
Produk PCR gen EGFR ekson 21 diperoleh melalui 2 kali proses PCR, first
PCR dan nested PCR menurut prosedur Kawada et al. (2008). Larutan mix PCR terdiri atas 0,2 µM primer, 1 x PCR buffer+MgCl2, 0,2 µM dNTP, 0,5 U enzim
taq polymerase, H2O dan DNA cetakan. Kondisi PCR yang digunakan adalah 1
siklus pra-PCR pada suhu 950C selama 15 menit, 18-20 siklus PCR dengan tahapan denaturasi pada suhu 950C selama 30 detik, annealing pada suhu 630C selama 30 detik, polimerisasi pada suhu 720C selama 1 menit, dan satu siklus post-PCR pada suhu 720C selama 3 menit. First PCR dan nested PCR masing-masing dilakukan selama 30 – 40 siklus.
2) Uji sensitivitas Metode HRM dan RFLP
Uji sensitivitas dilakukan untuk mengetahui jumlah minimum sel kanker pada sampel sehingga analisis mutasi gen menghasilkan data yang akurat. Dalam hal ini digunakan perbandingan komposisi DNA yang diisolasi dari sel kultur yang sudah diketahui merupakan sel yang mengalami mutasi gen dengan DNA dari sel yang tidak mengalami mutasi/wild type.
Uji sensitivitas metode HRM dan RFLP dalam analisis mutasi gen KRAS
dilakukan dengan mencampurkan DNA kultur sel HCT116 (kontrol mutan heterozigot) dengan DNA kultur sel BT549 (kontrol wild type) dan DNA kultur sel A549 (kontrol mutan homozigot) dengan DNA kultur sel BT (kontrol wild type). DNA yang digunakan memiliki konsentrasi 25 ng/µ L dengan perbandingan konsentrasi DNA sel mutan dan DNA sel wild type sebesar 100%:0%, 50%:50%, 25%:75%, 12,5%:87,5%, 6,25%:93,75%, 3,125%:96,875%, dan 0%:100%.
Uji sensitivitas metode HRM dan RFLP dalam analisis muatsi gen EGFR
dilakukan dengan mencampurkan sekuen DNA yang memiliki mutasi titik L858R pada ekson 21 dengan sekuen DNA yang tidak memiliki mutasi (kontrol wild type). DNA yang digunakan memiliki konsentrasi 1 ng/µ L dengan perbandingan komposisi DNA mutan dan DNA wild type sebesar 100%:0%, 50%:50%, 25%:75%, 12,5%:87,5%, 6,25%:93,75%, 3,125%:96,875%, dan 0%:100%.
3) Isolasi DNA dari Cairan Pleura pada Kertas Saring
Kertas saring yang mengandung cairan pleura kering dipotong dengan ukuran 0,5 cm x 0,5 cm. Isolasi DNA dilakukan dengan menggunakan reagen
High Pure PCR Template IsolationKit (Rosche). Prosedur isolasi DNA dilakukan sesuai dengan protokol yang terdapat pada manual instruction kit, kemudian disimpan pada suhu -200C sebelum digunakan. DNA yang telah diisolasi ditentukan konsentrasinya menggunakan alat nanodrop.
4) Analisis mutasi gen KRAS dan EGFR pada sampel kertas saring yang mengandung cairan pleura
DNA hasil isolasi dari kertas saring sebanyak 1 µL kemudian dijadikan sebagai DNA cetakan pada proses analisis menggunakan metode PCR-HRM dan RFLP sesuai dengan prosedur yang telah dilakukan pada pada analisis DNA standar.
5) Analisis Data
HASIL DAN PEMBAHASAN
Analisis Mutasi Gen KRAS Menggunakan Metode HRM dan RFLP pada DNA Standar Sel Kultur
Analisis mutasi gen KRAS menggunakan metode HRM telah dilakukan terhadap DNA standar untuk mengetahui bentuk standar kurva DNA yang tidak mengalami mutasi/wild type dan DNA mutan. DNA wild type diisolasi dari sel kultur BT549 (Breast Tumor), DNA standar mutan diperoleh dari sel kultur A549 (Human Lung Carcinoma) yang diketahui memiliki mutasi homozigot pada kodon 12 (GGT>AGT), dan sel kultur HCT 116 (Human Colon Tumor) yang diketahui memiliki mutasi heterozigot pada kodon 13 (GGC>GAC) (Krypuy et al. 2006).
(a)
Gambar 10 Hasil analisis mutasi gen KRAS DNA standar menggunakan metode HRM. Ket (a) normalized graph dan (b) differential graph
BT549: Kontrol wild type
A549: Kontrol mutan homozigot kodon 12 HCT116: Kontrol mutan heterozigot kodon 13
Hasil analisis HRM DNA standar menunjukkan perbedaan bentuk kurva DNA wild type dan DNA mutan dalam bentuk normalized graph (Gambar 10a) dan differential graph (Gambar 10b). Bentuk kurva yang diperoleh pada analisis HRM menurut (Reed et al. 2007) berasal dari kurva penurunan intensitas fluoresen yang terjadi seiring dengan kenaikan suhu, akibat adanya perubahan dari bentuk DNA utas ganda menjadi DNA utas tunggal. Nilai fluoresen dalam kurva
0 20 40 60 80 100
78 80 82 84
N o rm a li ze d F lu o re sc e n
Temperatur (0C)
-20 -15 -10 -5 0 5
78 80 82 84
N o rm a li ze d m in u s w il d t y p e
Temperatur (0C)
[image:32.595.181.387.285.577.2]tersebut kemudian dinormalisasi dalam skala 0 – 100 menjadi bentuk kurva
normalized graph. Krypuy et al. (2006) menggunakan kurva differential graph
untuk menunjukkan perbedaan bentuk kurva yang lebih jelas antara DNA yang mengalami mutasi dengan DNA wild type. Kurva differential graph diperoleh dengan cara menjadikan kurva standar wild type sebagai kurva acuan yang bernilai 0. Nilai kurva standar mutan diperoleh dari hasil pengurangan nilai-nilai
normalized fluorescence yang diperoleh terhadap normalized fluorescence kurva standar DNA wild type. Transformasi nilai fluoresen menjadi bentuk normalized graph dan differential graph dilakukan secara terintegrasi di dalam software
HRM, sehingga bisa diperoleh data secara langsung dalam bentuk grafik. Untuk memudahkan interpretasi hasil analisis HRM selanjutnya hanya digunakan bentuk kurva differential graph.
Analisis HRM gen KRAS dilakukan terhadap produk hasil amplifikasi yang memiliki ukuran sekitar 92 pb. Ukuran panjang basa ini dipilih sesuai dengan hasil penelitian Krypuy et al. (2006) yang telah melakukan analisa HRM terhadap gen KRAS dengan menggunakan produk PCR sebesar 189 pb dan 92 pb. Hasil analisis HRM yang terbaik dengan tingkat sensitivitas data yang lebih tinggi diperoleh pada produk PCR dengan ukuran 92 pb. Hal ini diduga karena adanya perbedaan jumlah basa Guanin dan Sitosin pada kedua produk PCR tersebut. Produk PCR yang memiliki ukuran yang lebih besar, memiliki jumlah basa Guanin dan Sitosin yang lebih banyak, sehingga menyebabkan tingginya energi yang dibutuhkan untuk merubah DNA utas ganda menjadi utas tunggal akibat banyaknya ikatan rangkap tiga yang dimilikinya. Hal ini didukung pula oleh Liew
et al. (2004) yang menyatakan bahwa analisis genotyping untuk melihat perbedaan pola mutasi akibat terjadinya perubahan satu basa menggunakan metode HRM diperoleh dengan menggunakan produk PCR yang berukuran kecil. Namun demikian, ukuran amplikon untuk mendapatkan bentuk kurva yang optimal sebaiknya diperoleh berdasarkan hasil optimasi.
Hasil analisis mutasi gen KRAS menggunakan metode RFLP pada DNA standar menunjukkan perbedaan pita yang jelas (Gambar 11). Hasil analisis mutasi kodon 12 (Gambar 11a) menunjukkan bahwa DNA mutan kodon 12 (A549) memiliki ukuran sekitar 157 pb, sedangkan DNA wild type BT549 dan DNA mutan kodon 13 memiliki ukuran sekitar 128 pb. Hasil analisis mutasi kodon 13 (Gambar 11b) menunjukkan bahwa DNA mutan kodon 13 (HCT116) memiliki ukuran sekitar 157 pb, sedangkan DNA wild type BT549 memiliki ukuran sekitar 125 pb dan DNA mutan kodon 12 memiliki ukuran yang beragam.
(a) (b)
Gambar 11 Hasil analisis mutasi gen KRAS menggunakan metode RFLP. (a) kodon 12; (b) kodon 13
M A549 BT HCT M A549 BT HCT
1000 pb
500 pb
200 pb
100 pb
3000 pb
1000 pb
500 pb
200 pb
100 pb
Mutan
Wild type
Mutan
[image:33.595.131.508.593.732.2]Analisis RFLP gen KRAS kodon 12 dan 13 menggunakan enzim yang memiliki daerah pemotongan pada DNA wild type, sehingga DNA yang mengalami mutasi tidak terpotong. Analisis RFLP pada kodon 13 menggunakan primer forward yang dimodifikasi agar terjadi perubahan basa pada kodon 10 dan 11 (GGA GCA > GGC CCA) sehingga diperoleh sekuen yang dikenali oleh enzim restriksi BglI pada tipe wild type (Kimura et al. 2007). DNA yang mengalami mutasi pada kodon 13 tidak akan terpotong oleh enzim tersebut, sedangkan DNA yang mengalami mutasi pada kodon 12 terpotong pada beberapa titik oleh enzim BglI, sehingga menghasilkan beberapa pita pada hasil analisis gel elektroforesis.
Uji Sensitivitas Metode HRM dan RFLP dalam Analisis Mutasi Gen KRAS
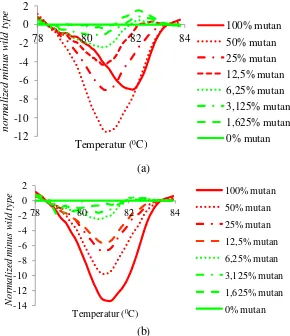
Hasil uji sensitivitas metode HRM terhadap analisis mutasi gen KRAS pada kodon 12 dan 13 (Gambar 12) menunjukkan bahwa pada komposisi DNA mutan sebesar 6,25% kurva DNA mutan sudah mendekati garis kurva wild type. Sehingga batas sensitivitas yang menunjukkan kurva DNA mutan yang masih dapat diamati dengan jelas diperoleh pada konsentrasi DNA mutan sebesar 12,5%.
(a)
[image:34.595.140.430.358.694.2](b)
Gambar 12 Hasil uji sensitivitas analisis mutasi gen KRAS menggunakan metode HRM. (a) kodon 12; (b) kodon 13.
-12 -10 -8 -6 -4 -2 0 2
78 80 82 84
normali ze d m inus w il d ty pe
Temperatur (0C)
100% mutan 50% mutan 25% mutan 12,5% mutan 6,25% mutan 3,125% mutan 1,625% mutan 0% mutan -14 -12 -10 -8 -6 -4 -2 0 2
78 80 82 84
Nor m al iz ed m inus w il d ty pe
Temperatur (0C)
Hasi uji sensitivitas mutasi gen KRAS kodon 12 menunjukkan bahwa pada konsentrasi 100% DNA mutan nampak secara jelas kurva yang terbentuk mencapai suhu melting DNA optimum sekitar 82 0C. Ketika komposisi DNA mutan diturunkan dengan penambahan DNA wild type sebesar 50%, kurva
melting DNA bergeser ke sebelah kiri yang mirip dengan jenis mutasi heterozigot pada analisis mutasi gen KRAS kodon 13. Hal ini menunjukkan bahwa dalam analisis mutasi gen menggunakan metode HRM keberadaan DNA wild type akan membentuk pola hasil analisa seperti bentuk mutasi jenis heterozigot. Oleh karena itu, hasil analisis HRM hanya dapat menunjukkan kemungkinan terjadinya variasi/mutasi pada sekuen DNA, tanpa diketahui letak terjadinya mutasi. Metode lain yang digunakan untuk mengetahui terjadinya mutasi umumnya adalah metode RFLP dan sekuensing DNA.
Hasil uji sensitivitas teknik RFLP menunjukkan bahwa terdapat perbedaan pita yang jelas antara DNA mutan dan DNA wild type. Hasil analisis gel elektroforesis pada produk pemotongan menggunakan enzim restriksi menunjukkan bahwa adanya perbedaan antara pita DNA mutan dan DNA wild type masih nampak jelas pada komposisi DNA mutan sebesar 3,125%. Pita DNA yang tipis dan cenderung tidak jelas nampak pada komposisi DNA mutan dibawah 3,125% (Gambar 13). Dengan demikian, dapat diketahui bahwa komposisi DNA mutan minimal yang terdapat dalam sampel sebesar 3,125%.
(a)
[image:35.595.163.432.377.605.2](b)
Gambar 13 Hasil uji sensitivitas metode RFLP dalam analisis mutasi gen KRAS. (a) kodon 12 dan (b) kodon 13. Ket A= 100% mutan, B= 50%:50%, C= 25%:75%, D= 12,5%:87,5%, E= 6,25%:93,75%, F= 3,125%: 96,875%, G= 1,625%: 98,375% dan H= 100% wild type.
300 pb 200 pb
100 pb
300 pb 200 pb
100 pb
A B C D E F G H
Analisis Mutasi Gen EGFR menggunakan Metode HRM dan RFLP pada DNA Standar
Analisis mutasi gen EGFR dilakukan terhadap ekson 19 dan ekson 21. Mutasi ekson 19 terjadi akibat adanya delesi pada posisi kodon 746 sampai kodon 752. Jumlah kodon yang mengalami mutasi bervariasi pada setiap sampel, sehingga ukuran panjang basa pada produk amplifikasi akan bervariasi (Kawada
et al. 2008). Analisis HRM EGFR exon 19 menghasilkan data perbedaan pola kurva yang nampak jelas antara DNA mutan dengan DNA wild type (Gambar 14a). Bentuk kurva DNA mutan menunjukkan adanya satu puncak dan satu lembah, sebagai akibat dari keberadaan alel mutan yang mempengaruhi produk hasil amplifikasi.
(a)
(b)
Gambar 14 Hasil analisis mutasi gen EGFR menggunakan metode HRM. (a) ekson 19 dan (b) ekson 21
HCT116: DNA standar wild type 55b : DNA standar mutan ekson 19
DNA standar 100% mutan ekson 21 L858R DNA standar 50% mutan ekson 21 L858R
Mutasi yang terjadi pada ekson 21 adalah susbtitusi satu pasang basa. Perubahan jenis basa pada sekuen DNA wild type menyebabkan terjadinya pergeseran kurva yang dihasilkan sesuai dengan jenis perubahan basa. DNA standar mutan yang digunakan memiliki mutasi kodon 858 T>G, sehingga akan menghasilkan melting DNA pada suhu yang lebih besar dibandingkan dengan
-8 -6 -4 -2 0 2 4 6 8
84 85 86 87
Nor m al ize d m inus nor m al
Temperatur (0C)
-10 -5 0 5 10 15
86,5 87,5 88,5 89,5
Nor m al ize d m inus nor m al
[image:36.595.196.384.267.570.2]DNA wild type (Gambar 14b). Kurva yang muncul pada DNA mutan 100% berbentuk satu puncak, sedangkan pada DNA mutan yang dicampur dengan 50% DNA wild type nampak terdapat kurva yang berbentuk satu lembah dan satu puncak. Hal ini terjadi karena pada DNA standar 100% mutan produk PCR yang terbentuk adalah 100% DNA yang mengalami mutasi, sedangkan pada komposisi DNA mutan 50% terdapat DNA wild type ikut teramplifikasi dan memepengaruhi kurva yang terbentuk.
Hasil analisis RFLP gen EGFR ekson 21 menunjukkan adanya pola yang jelas antara DNA mutan dengan DNA wild type. Mutasi kodon 858 ditandai dengan adanya pita yang berukuran sekitar 348 pb (Gambar 15b), sedangkan mutasi pada kodon 861 ditandai dengan adanya dua pita berukuran sekitar 200 pb dan 148 pb (Gambar 15c). Hasil ini sesuai dengan penelitian Kawada, et al. (2008).
(a) (b) (c)
Gambar 15 Hasil analisis mutasi gen EGFR menggunakan metode RFLP. (a) ekson 19, (b) ekson 21 kodon 858 dan (c) ekson 21 kodon 861. Ket: WT = wild type, Mu = mutan , M = marker
Analisis RFLP untuk mengetahui mutasi pada ekson 19 tidak dilakukan karena analisis elektroforesis gel terhadap produk hasil amplifikasi menghasilkan dua pita yang berukuran sekitar 254 pb dan 239 pb (Gambar 15a), sehingga DNA
wild type dan DNA yang mengalami mutasi dapat dibedakan dengan jelas. Menurut Kawada et al. (2008) delesi yang terjadi pada gen EGFR ekson 19 dapat bervariasi sesuai dengan jumlah basa yang hilang, sehingga ukuran dua pita yang terbentuk akan bervariasi.
Uji Sensitivitas Metode HRM dan RFLP dalam Analisis Mutasi Gen EGFR
Hasil uji sensitivitas analisis mutasi gen EGFR menunjukkan bahwa pada komposisi DNA mutan sebesar 6,25%, bentuk kurva yang dihasilkan sudah mendekati bentuk kurva DNA wild type. Bentuk kurva DNA mutan yang masih dapat jelas berbeda dengan DNA wild type diperoleh pada komposisi DNA mutan sebesar 12,5%, sehingga batas sensitivitas metode HRM dalam analisis mutasi gen EGFR adalah 12,5% DNA mutan (Gambar 16). Bentuk kurva pada DNA
1000 pb
500 pb
300 pb
200 pb
100 pb
WT Mu M WT Mu M
3000 pb
1000 pb
500 pb
300 pb
200 pb
100 pb
WT Mu M
3000 pb
1000 pb
500 pb
300 pb
200 pb
[image:37.595.115.526.274.498.2]cetakan yang memiliki komposisi 100% DNA mutan berupa satu puncak dominan yang berbeda dengan DNA wild type. Bentuk kurva yang muncul ketika komposisi DNA mutan dikombinasikan dengan DNA wild type berubah menjadi berbentuk satu lembah dan satu puncak yang sama dengan bentuk hasil HRM exon 19.
Gambar 16 Hasil uji sensitivitas analisis mutasi gen EGFR menggunakan metode HRM.
Hasil uji sensitivitas teknik RFLP terhadap produk nested PCR exon 21 menggunakan enzim MscI menunjukkan adanya perbedaan pita yang jelas antara DNA mutan dan DNA wild type (Gambar 17). Pita DNA dengan komposisi 3,125% mutan masih menunjukkan pita berukuran sekitar 348 pb yang merupakan penanda adanya mutasi. DNA yang memiliki komposisi DNA mutan lebih rendah dari 3,125% DNA mutan sudah tidak menghasilkan pita yang berukuran sekitar 348 pb. Dengan demikian, batas sensitivitas metode RFLP dalam menganalisis mutasi gen EGFR adalah 3,125% DNA mutan.
Gambar 17 Hasil uji sensitivitas metode RFLP pada analisis mutasi gen EGFR. Ket: perbandingan DNA mutan dengan DNA wild type A= 100% mutan, B= 50%:50%, C= 25%:75%, D= 12,5%:87,5%, E= 6,25%: 93,75%, F= 3,125%:96,875%, dan H= 100% wild type. M= DNA marker.
Hasil uji sensitivitas metode HRM dan RFLP terhadap gen KRAS dan EGFR
menunjukkan nilai sensitivitas yang sama. Metode HRM memiliki nilai
-8 -4 0 4 8 12
86,5 87,5 88,5 89,5
Nor m al iz ed m inuw w il d ty pe
Temperatur (0C)
100% mutan 50% mutan 25% mutan 12,50% mutan 6,25% mutan 3,125% mutan 1,625% mutan 0% mutan
A B C D E F G H M A B C D E F G H M
A B C D E F G H
[image:38.595.131.463.505.634.2]sensitivitas sebesar 12,5% dan metode RFLP memiliki nilai sensitivitas sebesar 3,125%. Batas sensitivitas kedua metode ini lebih tinggi dibandingkan dengan metode DNA sekuensing. DNA sekuensing membutuhkan minimal 30% DNA mutan di dalam sampel agar dapat menghasilkan data analisis yang jelas (Bosari
et al. 1995). Metode HRM dan RFLP dapat digunakan sebagai metode alternatif yang lebih sensitif untuk menganalisis mutasi gen pada sampel yang memiliki banyak pengotor dari DNA wild type, DNA sel normal dan serat jaringan sel.
Isolasi DNA dari Sampel yang Disimpan dalam Kertas Saring
Hasil isolasi DNA dari setiap sampel kertas saring menunjukkan variasi yang sangat beragam (Lampiran 1). Konsentrasi DNA yang diperoleh berkisar antara 5,7 ng/µL - 369,2 ng/µL. Konsentrasi ini relatif sedikit, namun cukup untuk digunakan sebagai DNA cetakan dalam proses PCR. Semua sampel kertas saring menghasilkan DNA yang dapat diamplifikasi dengan primer gen KRAS dan gen
EGFR sehingga dapat diketahui termasuk jenis mutan atau wild type. Menurut Hong Do et al. (2008) jumlah sampel DNA yang diperlukan sebagai DNA cetakan untuk terjadinya amplifikasi menggunakan metode HRM tidak harus besar. Konsentrasi DNA sebesar 1 ng/µL masih dapat menghasilkan pola analisis HRM yang masih bisa terbaca dengan baik. Hal ini didukung pula oleh hasil penelitian Pang et al. (2012) yang menyatakan bahwa kuantitas DNA tidak memiliki pengaruh yang signifikan terhadap hasil analisis genotyping. Hasil penelitian ini membuktikan bahwa kertas saring dapat dijadikan sebagai media penyimpanan sementara sampel cairan pleura sebelum digunakan dalam analisis molekuler.
Analisis HRM dan RFLP Cairan Pleura Pasien Kanker Paru yang Disimpan dalam Kertas Saring
Analisis mutasi gen KRAS
Hasil analisis mutasi gen KRAS terhadap 63 sampel pasien kanker paru menunjukkan hasil yang cukup signifikan. Satu pasien mengalami mutasi pada kodon 12. Sebanyak 62 sampel lainnya memiliki profil mutasi gen KRAS wild type. Mutasi gen KRAS pada kodon 13 tidak ditemukan. Hasil analisis ini diperoleh berdasarkan kemiripan bentuk kurva pada DNA sampel dengan bentuk kurva DNA standar pada analisis HRM dan keberadaan pita penanda adanya mutasi pada analisis RFLP.
Hasil analisis HRM menunjukkan terdapat kemiripan bentuk kurva pada pasien P07 dengan bentuk kurva standar mutan (Gambar 18).