PENGARUHNYA TERHADAP PERTUMBUHAN TANAMAN
NURUL RIKMAWATI
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
NURUL RIKMAWATI. Eksplorasi Cendawan Endofit pada Kacang Panjang
(Vigna Sinensis (L) Savi Ex Has dan Pengaruhnya terhadap Pertumbuhan
Tanaman. Dibimbing oleh WIDODO.
PENGARUHNYA TERHADAP PERTUMBUHAN TANAMAN
NURUL RIKMAWATI
Skripsi
sebagai salah satu syarat untuk memperoleh
gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
Menyetujui
Dosen Pembimbing,
Mengetahui
Ketua Departemen,
Tanggal lulus: ... Nama Mahasiswa : Nurul Rikmawati
NIM : A34051837
Dr. Ir. Widodo, M.S NIP. 19591115 198503 1003
Penulis lahir pada tanggal 02 November 1987 di Sukabumi, Jawa Barat sebagai putri keempat dari enam bersaudara dari Ayah bernama H. Eman Sulaeman dan Ibu bernama Hj. Iis Aisyah.
Pada tahun 2002 penulis diterima di SMA Negeri 1 Kota Sukabumi. Setelah lulus SMA pada tahun 2005, penulis melanjutkan pendidikkan di IPB melalui Undangan Seleksi Masuk IPB (USMI) dan satu tahun berikutnya penulis diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, IPB.
Selama menempuh pendidikkan di IPB, penulis berkesempatan menjadi Asisten Praktikum Dasar-Dasar Proteksi Tanaman pada tahun 2009, serta Asisten Pendidikkan Agama Islam pada tahun 2008 sampai dengan 2009. Selain itu, penulis terlibat dalam beberapa organisasi yaitu menjadi pengurus di Himpunan Mahasiswa Proteksi Tanaman (HIMASITA), Badan Pengawas HIMASITA, Forum Komunikasi Rohis Departemen (FKRD), Ikatan KeluargaMuslim TPB (IKMT). Beberapa kepanitiaan yang penulis ikuti antara lain Insect Conference 2007, Seminar Nasional dan Musyawarah Nasional HMPTI, Masa Pengenalan Kampus Mahasisa Baru (MPKMB), Masa Pengenalan Fakultas Saung Tani, dan lain-lain.
Penulis berkesempatan mengikuti Program Kreativitas Mahasiswa dengan
predikat “didanai” untuk PKM Penelitian dengan judul “Pemanfaatan Cabai Jawa
(Piper retrofractum) dan Kacang Babi (Tephrosia vogelli) untuk Penanggulangan
Spodoptera litura pada Tanaman Cabai (Capsicum annum L.)” serta PKM
Puji syukur kehadirat Allah SWT yang telah memberikan limpahan rahmat dan hidayah sehingga skripsi dengan judul “Eksplorasi Cendawan Endofit pada Kacang Panjang (Vigna sinensis) dan Pengaruhnya terhadap Pertumbuhan Tanaman” dapat diselesaikan dengan baik. Skripsi ini disusun sesuai hasil penelitian yang dilakukan pada bulan Maret 2009 sampai bulan Maret 2010 di Laboraturium Mikologi Departemen Proteksi Tanaman Fakultas Pertanian Institut Pertanian Bogor. Skripsi ini disusun untuk memenuhi sebagian persyaratan guna memperoleh gelar Sarjana Pertanian di Fakultas Pertanian Institut Pertanian Bogor.
Penulisan laporan ini tidak lepas dari bantuan Dr.Ir. Widodo MS. selaku pembimbing yang telah memberikan saran, sumbangan pemikiran serta motivasi sejak awal jalannya penelitian sampai dengan akhir penulisan skripsi ini. Dra. Dewi Sartiami, M.Si selaku dosen penguji yang telah memberikan arahan, bimbingan dan saran. Dr. Ir. Giyanto, M.Sc dan Dr. Ir. Tri Asmira Damayanti, M.Agr selaku dosen komisi pendidikkan yang telah memberi dorongan kepada penulis untuk menyelesaikan tugas akhir. Apa dan Mamah, saudara-saudaraku
Teh Ina, Teh Eel, a’Uman, Asti, Maul, Ahmad Alam dan keluarga besar Garut
yang dengan penuh harap mengiringi penulis dengan do’a, kasih sayang serta
motivasi yang tidak pernah putus. Pak Dadang Surachman, Mba Ita, Kak Weni, Mba Nazly, Kak Dian, Pak Topiq, Pak Fajar, dan seluruh crew lab mikologi 42, 43, 44, 45 atas bantuan, kebersamaan, motivasi serta keceriaan yang mengiringi penulis dalam menyelesaikan tugas akhir.
Penulis menyadari dalam penyusunan skripsi ini masih terdapat banyak kekurangan, maka saran dan kritik sangat diharapkan dari pembaca agar laporan ini menjadi lebih baik. Demikian, semoga skripsi ini dapat bermanfaat menambah ilmu dan wacana bagi penulis serta pembaca.
Bogor, November 2011
DAFTAR ISI ... vii
Perkembangan Aplikasi Cendawan Endofit sebagai Agen Pengendali Hayati ...
Seleksi Cendawan Endofit pada Benih Kacang Panjang ... 9
Uji Pengaruh Cendawan Endofit terhadap Pertumbuhan Kacang Panjang ... Eksplorasi Cendawan Endofit ... 13
Seleksi Cendawan Endofit ... 14
Viabilitas Benih Persentase Perkecambahan (Daya Berkecambah) ≤ 7 HST... 17
Persentase Pertumbuhan Benih ... 18
1. Pemberian kode cendawan endofit hasil eksplorasi ... 10
2. Jumlah isolat cendawan patogenik dan non-patogenik pada
kacang panjang dari berbagai sumber ... 13
3. Pengaruh perlakuan cendawan endofit terhadap tinggi tanaman ... 23
4. Pengaruh perlakuan cendawan endofit terhadap diameter
batang tanaman ... 26
5. Pengaruh perlakuan cendawan endofit terhadap
Halaman
1. Perendaman benih dalam suspensi isolat cendawan endofit ... 10
2. Seleksi cendawan endofit pada benih kacang panjang ... 15
3. Isolat-isolat cendawan endofit non-patogenik ... 16
4. Daya berkecambah kacang panjang ≤ 7 HST ... 17
5. Persentase pertumbuhan benih kacang panjang sampai umur 21 HST ………. 19 6. Tinggi tanaman kacang panjang ……….. 21
7. Diameter batang tanaman kacang panjang ... 24
8. Jumlah daun kacang panjang ………... 25
9. Trichoderma sp. ... 30
10. Hifa steril hitam ... 30
11. Phoma sp. ... 31
PENDAHULUAN
Latar Belakang
Kacang panjang (Vigna sinensis (L.) Savi Ex Has) merupakan salah satu
tanaman yang dibudidayakan di Indonesia sebagai tanaman sayuran. Kacang
panjang memiliki beberapa keunggulan yaitu harganya terjangkau, dapat dimakan
mentah maupun matang, mudah dibudidayakan, serta memiliki kandungan gizi
yang cukup lengkap seperti protein, lemak, mineral, karbohidrat, kalsium, fosfor,
besi, vitamin B1, B2, B3, dan air (Pitojo 2006; Haryanto et al. 2010).
Keunggulan diatas menjadikan kacang panjang menjadi salah satu tanaman
sayuran yang dikonsumsi masyarakat, akan tetapi pada kenyataannya tingkat
produksi kacang panjang mengalami penurunan. Hal ini sebagaimana yang
diungkapkan Kariada et al. (2003) bahwa produktivitas kacang panjang di tingkat
petani sangat rendah yaitu 2-3 ton/ha. Hal ini diperkuat data BPS pada tahun
2009, yang menunjukan bahwa produksi kacang panjang di Indonesia dari tahun
2006 ke tahun 2007 hanya mengalami kenaikan sebesar 5,91%, sedangkan pada
tahun 2008 mengalami penurunan sebesar 6,75%.
Salah satu penyebab rendahnya produksi kacang panjang adalah serangan
Organisme Pengganggu Tumbuhan (OPT), salah satunya dari golongan penyakit.
Beberapa penyakit yang dominan menyerang kacang panjang yaitu virus mosaik
kacang panjang yang disebabkan oleh bean common mosaic virus (Hidayah et al.
2010), layu yang disebabkan oleh Sclerotium roflsii, karat daun yang disebabkan
oleh Uromyces phaseoli, penyakit sapu yang disebabkan oleh mikoplasma
(Haryanto et al. 2010). Penyebab penyakit utama pada kacang panjang berasal
dari golongan virus. Serangan virus dapat menyebabkan penurunan kualitas dan
kuantitas kacang panjang. Virus mosaik kacang panjang (VMKP) merupakan
salah satu virus yang menginfeksi tanaman kacang panjang dan menyebabkan
kerugian sebesar 65,87% (Prabaningrum 1996 dalam Kuswanto 2007).
Beberapa upaya pengendalian VMKP yaitu pengendalian vektor virus,
penggunaan benih yang sehat dan penggunaan bahan-bahan antiviral.
Pengendalian vektor virus dapat dilakukan dengan kultur teknis yaitu dengan
vektor serta penggunaan insektisida. Sedangkan untuk mendapatkan benih yang
sehat, dilakukan dengan perlakuan benih yaitu perlakuan panas, sinar UV dan
lain-lain (CABI 2005). Upaya pengendalian virus tanaman yang umum dilakukan
adalah dengan menggunakan varietas yang tahan. Namun tidak banyak tersedia
kultivar yang tahan dengan VMKP. Setyastuti (2008) melaporkan bahwa dari 9
kultivar kacang panjang (Bogor Hijau I, asparagus, KP 888, Asri II, Sakura, KP
777, Dondot, Iguma dan Landung) yang banyak ditanam oleh petani rentan
terhadap VMKP.
Pengendalian lain yang menjadi alternatif yaitu pengendalian hayati dengan
penggunaan agens pengendali hayati. Teknik pengendalian hayati akhir-akhir ini
berkembang dengan pesat karena memiliki kelebihan dibandingkan dengan teknik
pengendalian yang lainnya yaitu berbasis sumber daya hayati dan ramah
lingkungan. Salah satu agen yang dapat menginduksi ketahanan tanaman adalah
cendawan endofit yang berperan sebagai pemacu pertumbuhan tanaman. Potensi
penggunaan cendawan endofit cukup besar untuk dikembangkan sebagai agens
pengendali hayati, karena cendawan ini hidup dalam jaringan tanaman sehingga
dapat berperan langsung dalam menghambat perkembangan patogen tanaman
(Niere 2002).
Cendawan endofit merupakan salah satu bagian yang terintegrasi dalam
pengendalian hayati. Secara harfiah, endofit berarti suatu organisme yang hidup
dalam tubuh organisme lain (Doss & Welty 1995). Menurut Faeth (2002),
keberadaan endofit sangat melimpah dan beragam, serta dapat ditemukan di
seluruh famili tanaman pertanian maupun rumput-rumputan. Cendawan endofit
adalah cendawan yang dapat menginfeksi jaringan tanaman tanpa menyebabkan
penyakit (Durham 2004). Cendawan endofit hidup di antar jaringan dan tidak
hidup pada jaringan angkut. Selain itu, cendawan endofit dapat bersimbiosis
mutualisme dengan tanaman inang (Caroll 1988; Clay 1988) dan dapat
menghasilkan berbagai hormon yang berperan dalam menginduksi ketahanan
tanaman seperti IAA, sitokinin, etilen, giberelin (Obura 2010).
Dari penelitian yang telah dilaporkan di atas, maka dapat dijadikan acuan
dari tanaman kacang panjang sebagai bahan induksi ketahanan untuk
pengendalian penyakit pada tanaman kacang panjang.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui jenis-jenis cendawan endofit yang
mampu memacu pertumbuhan tanaman yang berasal dari kacang panjang (Vigna
sinensis) di 3 lokasi serta mempelajari pengaruhnya terhadap pertumbuhan
tanaman kacang panjang.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi masukan dalam pengendalian
TINJAUAN PUSTAKA
Kacang Panjang (Vigna sinensis (L.) Savi Ex Has)
Kacang panjang termasuk kingdom Plantae, subkingdom Tracheobionta,
super divisi Spermatophyta, divisi Magnoliophyta, kelas Magnoliopsida, sub kelas
Rosidae, ordo Fabales, famili Fabaceae, genus Vigna, species Vigna sinensis (L.)
Savi Ex Has (Plantamor 2008).
Kacang panjang merupakan salah satu tanaman hortikultura yang
dikonsumsi oleh masyarakat dan lebih sering dipanen polongnya secara
keseluruhan sebagai sayur. Habitat kacang panjang adalah tanaman semak,
menjalar, semusim, dan tingginya ± 2,5 m (Pitojo 2006). Batang tanaman
berukuran panjang, bertekstur liat, dan sedikit berbulu. Daun tanaman merupakan
daun majemuk yang tersusun atas tiga helai dan berwarna hijau muda sampai
hijau tua. Bunga berbentuk kupu-kupu, terletak pada ujung tangkai yang panjang.
Warna bunga bervariasi yakni putih, kuning, atau biru. Bunga muncul dari ketiak
daun dan setiap tangkai bunga mempunyai tiga sampai lima bunga. Buah kacang
panjang berbentuk polong, bulat, ramping, dengan ukuran panjang sekitar 10-80
cm. Polong muda berwarna hijau sampai hijau keputih-putihan, sedangkan polong
yang telah tua berwarna putih kekuning-kuningan. Setiap polong berisi 8-20 biji
(Samadi 2003).
Kacang panjang tumbuh baik pada tanah latosol ataupun lempung berpasir,
subur, gembur, banyak mengandung bahan organik. Bila tidak, ketika diolah dapat
ditambahkan pupuk kandang. Kacang panjang dapat tumbuh pada drainase yang
baik, pH sekitar 5,5-6,5 serta suhu antara 20-30 ˚C, iklimnya kering, curah hujan
antara 600-1500 mm/tahun dan ketinggian optimum kurang dari 800 m dpl.
Sebaiknya kacang panjang ditanam di awal atau di akhir musim hujan. Lahan
terbuka di dataran rendah sangat disukai tanaman panjang.
Benih kacang panjang diperbanyak dengan biji. Biji hendaknya diambil dari
buah yang masak di pohon hingga kulit luarnya mengering. Polong yang diambil
adalah polong yang sehat dan mulus dari tanaman yang tumbuh sehat. Untuk satu
Potensi Cendawan Endofit Sebagai Agen Pengendali Hayati
Penelitian terhadap cendawan endofit sudah dimulai sejak awal 1980-an.
Hal ini terjadi karena keberadaan cendawan endofit mudah ditemukan pada
tanaman (Dighton 2003). Sebagaimana yang diungkapkan Faeth (2002) bahwa
cendawan endofit mendapat perhatian besar antara lain karena keberadaannya
melimpah dan beragam, serta ditemukan dalam seluruh famili tanaman, baik
tanaman budidaya maupun rumput-rumputan.
Cendawan endofit adalah cendawan yang menginfeksi jaringan tanaman
tanpa menyebabkan penyakit (Durham 2004). Secara harfiah endofit berarti suatu
organisme yang hidup dalam tubuh organisme lain (Doss & Welty 1995). Endofit
terdapat dalam substrat jaringan tanaman yang mungkin bersifat parasitik atau
simbiotik, asimtomatik dan mutualistik (Clay 2004)
Cendawan endofit masuk ke dalam jaringan tanaman melalui 2 cara yaitu,
secara vertikal dan horizontal (Doss & Welty 1995). Cendawan endofit yang
masuk secara transmisi vertikal, masuk dari generasi ke generasi tanaman melalui
benih. Menurut Clay (2004) umumnya cendawan berada pada tanaman yang
termasuk golongan rumput-rumputan dimana terjadi interaksi simbiosis
mutualisme karena persistensi yang tinggi. Spora cendawan endofit yang ada di
udara masuk ke dalam jaringan tanaman dan hidup di antara sel secara transmisi
horizontal pada tanaman berkayu (Durham 2004). Menurut Clay (2004), transmisi
ini juga dapat terjadi melalui air.
Petrini et al. (1992) menggolongkan cendawan endofit dalam divisi
Ascomycotina dan Deuteromycotina. Keragaman cukup besar pada
Loculoascomycetes, Discomycetes, dan Pyrenomycetes. Strobell et al. (1996)
mengemukakan bahwa cendawan endofit meliputi genus Pestalotia,
Pestalotiopsis, Monochaetia, dan lain-lain. Clay (1988) melaporkan, cendawan
endofit rumput dimasukkan ke dalam family Balansie yang terdiri dari 5 genus
yaitu Atkinsonella, Balansiae, Balansiopsis, Epichloe dan Myriogenospora.
Genus Balansiae umumnya dapat menginfeksi tumbuhan tahunan dan hidup
secara simbiosis mutualistik dengan inang. Hubungan simbiosis mutualisme
cendawan endofit dengan inang yaitu membantu inang dalam proses penyerapan
melindungi inang dari serangan penyakit, dan hasil fotosintatnya dapat digunakan
cendawan untuk mempertahankan kelangsungan hidupnya (Petrini et al. 1992).
Cendawan endofit menghasilkan mikotoksin atau metabolit lainnya yang
menyebabkan perubahan fisiologi dan biokimia inang (Clay 1988), sehingga
keberadaan endofit dalam jaringan tanaman dapat berperan langsung dalam
menghambat perkembangan patogen dalam tanaman (Niere et al. 2002). Di
samping itu, cendawan endofit berpotensi melindungi inang terhadap patogen
maupun hama melalui mekanisme kompetisi, induksi resistensi, antagonisme, dan
mikoparasitisasi (CABI 2004).
Perkembangan Aplikasi Cendawan Endofit sebagai Agen Pengendali Hayati
Menurut Dingle & McGee (2003) menyebutkan bahwa Genus
Neotyphodium (Balansiae, Clavicipitacea) melindungi inang dengan melawan
patogen, hama dan kekeringan, menstimulasi perkecambahan benih, pertumbuhan
tanaman, dan meningkatkan ketahanan tanaman dalam berkompetisi. Selain itu,
Chaetomium globosum mampu melawan patogen kudis apel Venturia inaequalis.
C. globosum harus mengkolonisasi bagian dalam daun agar efektif bertahan
dalam periode panjang. Hasil penelitian McGee et al. (2006) cendawan endofit
mengkolonisasi tanaman sejak perkecambahan sampai fase matang.
Pengaplikasian Phomopsis sp pada tanaman kapas telah menjadikan ukuran dan
jumlah larva Heliothis armigera menjadi lebih kecil, sehingga efek kerusakan
dapat ditekan. Selain itu, pada tanaman gandum, ekskresi metabolit Chaetomium
sp. dapat menghambat pertumbuhan cendawan karat Puccinia triticina.
Penelitian FAO (2009) cendawan Gliocladium catenulatum mengurangi
kejadian penyakit sapu pada tanaman kakao dengan menekan pertumbuhan
patogen Crinipellis perniciosa. Asniah (2009) berhasil mengisolasi Nigrospora
sp. dari akar tanaman brokoli, rumput dan teki, dimana cendawan ini terbukti
dapat menekan penyakit akar gada. Menurut Obura (2010) Nigrospora sp,
Chrysosporium sp, Fusarium oxysporum, Fusarium chlamydosporum,
Trichoderma hamatum, Trichoderma pseudokoningii efektif untuk menekan
penyakit akar gada pada tanaman tomat. Sedangkan Wilia (2010) mengatakan
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian dilaksanakan pada bulan Maret 2009 sampai Maret 2010 di
Laboratorium Mikologi Tumbuhan, Departemen Proteksi Tanaman, Fakultas
Pertanian, Institut Pertanian Bogor.
Bahan dan Alat
Bahan
Bahan tanaman yang digunakan adalah tanaman kacang panjang yang
berasal dari kebun dengan serangan berat penyakit virus mosaik kacang panjang
(VMKP), tanaman kacang panjang dari kebun tanpa serangan VMKP, serta bibit
kacang panjang yang ditumbuhkan dari benih kacang panjang dengan merk
dagang Long Silk. Bahan lain yang digunakan dalam penelitian ini antara lain
kentang, agar-agar, alkohol 70%, asam laktat 20%, NaOCl komersial 5,25%,
aquades, serta media tanam.
Alat
Alat yang digunakan adalah cawan petri, tabung reaksi, pinset, spatula, labu
Erlenmeyer, gelas ukur, jarum okulasi, kompor gas, laminar air flow, microwave,
boiling bath, autoclave, dan pot plastik berdiameter 12 cm.
Metode
Pengambilan Sampel
Sampel tanaman kacang panjang diperoleh dari tiga sumber, yaitu dari
kebun dengan serangan berat penyakit VMKP, kebun sehat dan bibit kacang
panjang yang ditumbuhkan dari benih komersial. Sampel diambil sebanyak 10
Sampel yang berasal dari lahan yang terkena serangan berat VMKP dan
lahan sehat diambil dari pucuk daunnya serta tangkai daun yang muda. Sedangkan
yang berasal dari bibit yang ditumbuhkan sendiri diambil dari daun trifoliat
pertama dan kedua.
Isolasi Cendawan Endofit
Sampel dari lapang. Cendawan endofit diisolasi dari bagian daun dan
tangkai daun kacang panjang. Bagian daun dipotong berbentuk persegi dengan
ukuran 0.5 cm x 0.5 cm, sedangkan tangkai daun dipotong dengan ukuran 0.5 cm.
Masing-masing bagian kemudian didisinfeksi permukaan menggunakan alkohol
70 % selama 1 menit dan dibilas dengan aquades steril. Sterilisasi kedua
dilakukan dengan merendam sampel pada NaOCl 1 % selama 1 menit dan dibilas
menggunakan aquades steril sebanyak 3 kali. Sampel kemudian diletakkan pada
media Potato Dextrose Agar (PDA) dan diinkubasi selama 7 hari pada suhu
± 27 ˚C
Hasil isolasi cendawan endofit tidak dapat digunakan jika pada media uji
kesterilan tumbuh cendawan. Uji kesterilan menggunakan air bilasan terakhir
pencucian daun dan dioleskan pada media PDA. Jika pada cawan uji kesterilan
tumbuh cendawan maka hasil isolasi cendawan endofit tidak dapat digunakan
karena dapat diasumsikan cendawan yang tumbuh adalah berasal dari permukaan
daun. Jika pada cawan uji kesterilan tidak tumbuh apa pun, maka cendawan yang
tumbuh pada isolasi tersebut berasal dari jaringan tanaman. Cendawan yang
tumbuh dari dalam jaringan tanaman dan telah melalui uji kesterilan dimurnikan
pada PDA dan dibuat koleksi biakan dalam agar miring.
Sampel dari bibit. Sampel tanaman diambil setelah daun trifoliat pertama
dan kedua kacang panjang tumbuh. Metode pengambilan sampel sama seperti
Pemurnian
Setelah tumbuh berbagai cendawan pada media PDA, cendawan
dimurnikan dan yang memiliki bentuk dan warna yang sama dianggap satu jenis.
Masing-masing jenis cendawan disimpan pada media agar miring untuk
menumbuhkan sebagai bahan stok.
Seleksi Cendawan Endofit pada Benih Kacang Panjang
Seleksi ini dilakukan sebagai skrining (penapisan) untuk memilih isolat
cendawan endofit yang akan digunakan untuk uji pertumbuhan. Benih kacang
panjang disterilisasi permukaannya dengan air hangat pada suhu 50 ˚C selama 20
menit selanjutnya dikecambahkan pada biakan murni isolat cendawan endofit
yang pertumbuhannya telah memenuhi botol kultur jaringan (kira-kira berumur
7 - 14 hari). Jika benih yang ditanam tidak mampu berkecambah berarti cendawan
tersebut bersifat patogen dan tidak digunakan dalam uji lanjutan, sedangkan benih
yang berkecambah menandakan isolat cendawan endofit yang digunakan bersifat
tidak membahayakan bagi tanaman serta berpotensi sebagai agens antagonis.
Cendawan endofit yang dihasilkan pada tahap ini digunakan sebagai perlakuan
pada pengamatan terhadap uji pertumbuhan vegetatif dari tanaman kacang
panjang.
Cendawan endofit yang didapatkan, dinamai dengan kode yang disesuaikan
dengan sumber isolatnya. Cendawan endofit yang berasal dari benih komersial
diberi kode I, cendawan endofit yang berasal dari lahan serangan berat virus
kuning kacang panjang dinamai dengan kode II, sedangkan yang berasal dari
lahan sehat dinamai dengan kode III. Cendawan endofit diambil dari 2 bagian
tanaman, yaitu daun dan tangkai daun. Cendawan endofit yang berasal dari bagian
daun diberi kode a, sedangkan yang berasal dari tangkai daun diberi kode b (Tabel
Tabel 1 Pemberian kode cendawan endofit hasil eksplorasi
Sumber isolat Bagian tanaman
Daun (a) Tangkai bunga (b)
Benih komersial (I) I a I b
Lahan serangan berat (II) II a II b
Lahan sehat (III) III a III b
Uji Pengaruh Cendawan Endofit terhadap Pertumbuhan Kacang Panjang
Benih yang akan diuji disterilisasi permukaan dengan melakukan
perendaman menggunakan air panas selama 20 menit pada suhu 50˚C untuk
menghilangkan mikroba terbawa benih. Benih kemudian direndam dalam larutan
NaOCl 3% selama 1 menit. Benih yang telah disterilisasi permukaan direndam
dalam suspensi cendawan endofit selama 15-20 menit. Suspensi cendawan dibuat
dari cendawan endofit yang telah direisolasi dan memenuhi permukaan cawan
kemudian ditambahkan aquades sebanyak 100 ml (Gambar 1). Benih kacang
panjang kemudian ditanam pada media tanam yang berisi campuran tanah dan
pupuk kandang perbandingan 1 : 1 (b/b).
Parameter Pengamatan
Viabilitas Benih
Persentase perkecambahan (daya berkecambah) ≤ 7 HST. Daya
berkecambah adalah pengamatan benih yang berkecambah pada jangka waktu
tertentu, pengamatan dilakukan setiap hari hingga 7 HST.
Persentase perkecambahan ≤ 7 HST diperoleh dari rumus sebagai berikut :
Persentase pertumbuhan benih. Pengamatan persentase pertumbuhan
benih juga dilakukan terhadap seluruh benih yang berkecambah dan tumbuh baik.
Pengamatan dilakukan setiap hari sejak 1 HST sampai dengan 21 HST.
Persentase pertumbuhan benih diperoleh dari rumus sebagai berikut :
jumlah benih yang tumbuh x 100%
jumlah benih yang ditumbuhkan
Pertumbuhan Tanaman
Pengamatan terhadap pertumbuhan vegetatif tanaman kacang panjang
dilakukan 1 minggu sekali pada umur 1 hingga 5 minggu setelah tanam (MST).
Parameter yang diamati adalah sebagai berikut,
1. Tinggi tanaman
Kacang panjang uji diamati tingginya setiap minggu. Pengamatan tinggi
dilakukan menggunakan penggaris, yang dimulai dari minggu pertama hingga
minggu ke-lima. Tinggi tanaman dihitung dari permukaan tanah dalam polybag
hingga daun tertinggi dari kacang panjang uji.
2.Diameter batang
Kacang panjang uji diamati diameternya setiap minggu. Pengamatan diameter
dilakukan menggunakan penggaris, yang dimulai dari minggu pertama hingga DB ≤ 7 HST = Jumlah benih yang berkecambah ≤ 7 HST x 100%
minggu ke-lima. Diameter batang tanaman dihitung pada diameter kacang
panjang uji yang terbesar.
3. Jumlah daun.
Kacang panjang uji diamati jumlah daunnya setiap minggu hingga minggu
ke-lima. Setiap 1 daun yang berbentuk trifoliat dihitung sebagai 1 daun.
Analisis Data
Percobaan disusun dalam rancangan acak lengkap (RAL) satu faktor. Faktor
tersebut adalah jenis isolat cendawan non-patogenik dengan 12 perlakuan, yaitu
IIa5, Penicillium sp. IIIa2, Ia8, Ia7, Fusarium sp. IIIa19, kontrol, IIa1, IIa12, Ia3,
Fusarium sp. IIb8, Trichoderma sp. IIb1 serta hifa steril IIIa3. Penamaan
perlakuan didasarkan pada ketentuan Tabel 1.
Masing-masing perlakuan diulang sebanyak 5 kali sehingga menghasilkan
60 satuan percobaan. Model rancangan yang digunakan adalah :
Yij = µ + αi +βj + εij
dimana :
Yij : nilai pengamatan pada perlakuan
µ : nilai rataan umum
αi : pengaruh perlakuan ke-i
βj : pengaruh ulangan
εij : pengaruh galat percobaan
i = 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12 j = 1, 2, 3, 4, 5
Data yang diperoleh dianalisis dengan menggunakan Statistical Analisys
System (SAS) versi 9.13. Pengaruh perlakuan dianalisis dengan sidik ragam.
Apabila terdapat beda nyata antar perlakuan dilakukan uji lanjut dengan Beda
HASIL DAN PEMBAHASAN
Eksplorasi Cendawan Endofit
Cendawan endofit dapat diisolasi dari semua bagian dari tumbuhan, baik
akar, batang, cabang, tangkai, daun bahkan bunga. Pada penelitian ini tangkai
daun dan daun yang menjadi objek pengamatan dan eksplorasi cendawan endofit.
Tiga lokasi yang digunakan sebagai tempat pengambilan sampel, masing-masing
menghasilkan jumlah dan isolat yang beragam (Tabel 2).
Tabel 2 Jumlah isolat cendawan patogenik dan non-patogenik pada kacang
Cendawan endofit hasil eksplorasi memberikan hasil yang beragam jumlah
dan jenisnya. Cendawan endofit yang didapatkan dari lahan serangan berat
menempati peringkat tertinggi sebanyak 24 isolat dengan presentase 79,17%
cendawan patogenik dan 20,83% cendawan non-patogenik. Cendawan endofit
dari benih komersial didapatkan sebanyak 7 isolat dengan presentase cendawan
patogenik sebanyak 57,14% dan presentase cendawan non-patogenik 42,86%.
Sedangkan pada lahan sehat, mendapatkan hasil ekplorasi yang terkecil yakni
sebanyak 5 isolat, dengan komposisi 40% cendawan patogenik dan 60%
cendawan non-patogenik.
Isolat cendawan endofit yang ditemukan dari eksplorasi ini sejumlah 36
isolat cendawan yang bersifat patogenik serta non-patogenik. Hasil eksplorasi
yang beragam jenis dan jumlahnya diduga karena perbedaan varietas yang
digunakan serta terdapat perbedaan usia tanaman sampel. Usia sampel yang
diambil dari lahan yang berpenyakit virus mosaik kacang panjang (VMKP) lebih
tua dibandingkan dengan sampel yang diambil dari lahan sehat maupun yang
ditumbuhkan dari benih komersial. Hal ini sesuai dengan yang dilaporkan Stone et
al. (2004) bahwa frekuensi infeksi serta keragaman cendawan endofit meningkat
seiring dengan bertambahnya usia organ atau jaringan tanaman inang. Selain itu
diduga karena perbedaan kondisi lingkungan serta pengolahan lahan. Pada lahan
yang berpenyakit VMKP, kondisi lingkungan serta interaksi dengan tanaman lain
lebih heterogen dibandingkan dengan lahan sehat serta benih komersial.
Data hasil ekplorasi cendawan endofit juga memperlihatkan bahwa
kelimpahan cendawan endofit patogenik pada lahan yang terkena serangan berat
VMKP lebih besar dibandingkan dengan kelimpahan cendawan endofit patogenik
pada lahan sehat. Hal ini dapat menjadi petunjuk awal bahwa terdapat korelasi
antara kelimpahan cendawan endofit patogenik dengan kejadian penyakit VMKP
di lapang.
Seleksi Cendawan Endofit
Seleksi cendawan endofit hasil eksplorasi bertujuan memilih isolat
cendawan yang berpotensi sebagai agen hayati atau bermanfaat bagi pertumbuhan
tanaman. Pada tahap ini dipilih isolat-isolat yang tidak menyebabkan kematian
atau penghambatan pertumbuhan benih kacang panjang, hal ini menunjukkan
bahwa isolat tersebut tidak berpotensi sebagai cendawan patogenik yang pada
umumnya mematikan pertumbuhan benih.
Karakteristik cendawan patogenik pada seleksi cendawan endofit ini
antara lain benih tidak berkembang; pertumbuhan benih lambat jika dibandingkan
dengan isolat cendawan lainnya; benih mampu berkecambah dan tumbuh namun
pada akhirnya mengalami kematian, sedangkan karakteristik cendawan
non-patogenik antara lain benih mampu berkecambah dengan baik serta akar dan
batang kacang panjang tumbuh dengan baik (Gambar 2). Sedangkan yang
digunakan sebagai pembanding adalah kontrol, yaitu media PDA yang
ditanamkan benih kacang panjang tanpa ditumbuhkan isolat cendawan terlebih
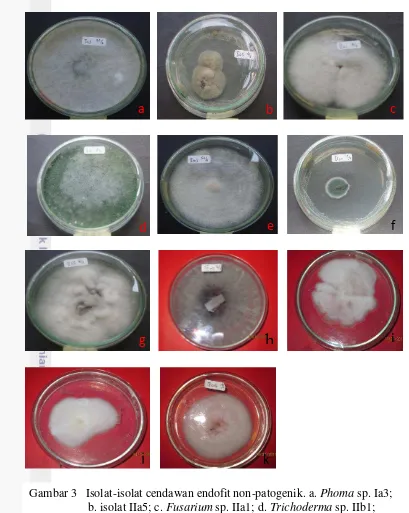
Isolat cendawan endofit non-patogenik yang dihasilkan dari eksplorasi ini
antara lain Phoma sp. Ia3, Fusarium sp. Ia7, isolat Ia8, Fusarium sp. IIa1, isolat
IIa5, Fusarium sp. IIa12, Trichoderma sp. IIb1, Fusarium sp. IIb8, Penicillium sp.
IIIa2, hifa steril IIIa3, Fusarium sp. IIIa19 (Domsch et al. 1980; Watanabe 1994)
koloni cendawan tertera pada Gambar 3. Untuk bahan stok, isolat yang diperoleh
disimpan pada tabung reaksi. Isolat cendawan yang telah didapatkan digunakan
untuk pengamatan viabilitas benih serta pengujian pertumbuhannya pada media
tanam dengan menggunakan benih kacang panjang.
Cendawan endofit non-patogenik yang didapatkan sejalan dengan cendawan
endofit yang didapatkan pula oleh Niere et al. (2002) bahwa hasil eksplorasi
cendawan endofit dari tanaman Pisang Awak di Uganda didapatkan genus
Fusarium non-patogenik, Penicillium, serta Trichoderma. Pada isolat IIIa3
diidentifikasi sebagai hifa steril karena hasil identifikasi mikroskopik hanya
terdapat hifa steril, tanpa adanya struktur reproduktif, seperti spora atau
sporangium. Hal ini umum terjadi pada cendawan, karena tidak semua cendawan
memiliki struktur reproduktif (Anonim 2011). Macarthur & McGee (2000)
menyebutkan bahwa hasil eksplorasi cendawan endofit pada Banksia integrifolia
di 3 tempat, beberapa diantaranya ditemukan hifa miselium steril.
Gambar 3 Isolat-isolat cendawan endofit non-patogenik. a. Phoma sp. Ia3; b. isolat IIa5; c. Fusarium sp. IIa1; d. Trichoderma sp. IIb1;
e. Fusarium sp. IIa12; f. Penicillium sp. IIIa2; g. Fusarium sp.IIb8; h. hifa steril IIIa3; i. Fusarium sp. Ia7; j. isolat Ia8;
k. Fusarium sp. IIIa19
c
b
d
e
f
g
h
a
i
Viabilitas Benih
Persentase Perkecambahan (Daya Berkecambah) ≤ 7 HST
Viabilitas benih adalah daya hidup benih yang ditunjukkan oleh gejala
pertumbuhan dan atau gejala metabolismenya. Umumnya sebagai parameter
viabilitas benih digunakan persentase perkecambahan. Persentase perkecambahan
menunjukkan jumlah kecambah normal yang dapat dihasilkan oleh benih murni
pada kondisi lingkungan tertentu dalam jangka waktu yang telah ditetapkan
(Sutopo 2004). Pada penelitian ini jangka waktu yang dibatasi pada pengamatan
persentase perkecambahan adalah ≤7 HST.
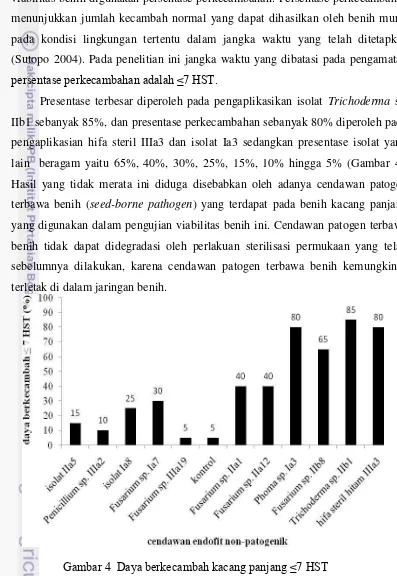
Presentase terbesar diperoleh pada pengaplikasikan isolat Trichoderma sp.
IIb1 sebanyak 85%, dan presentase perkecambahan sebanyak 80% diperoleh pada
pengaplikasian hifa steril IIIa3 dan isolat Ia3 sedangkan presentase isolat yang
lain beragam yaitu 65%, 40%, 30%, 25%, 15%, 10% hingga 5% (Gambar 4).
Hasil yang tidak merata ini diduga disebabkan oleh adanya cendawan patogen
terbawa benih (seed-borne pathogen) yang terdapat pada benih kacang panjang
yang digunakan dalam pengujian viabilitas benih ini. Cendawan patogen terbawa
benih tidak dapat didegradasi oleh perlakuan sterilisasi permukaan yang telah
sebelumnya dilakukan, karena cendawan patogen terbawa benih kemungkinan
terletak di dalam jaringan benih.
j
Perlakuan isolat Trichoderma sp. IIb1, hifa steril IIIa3 dan Phoma sp. Ia3
mendapatkan hasil yang tinggi, hal ini diduga karena isolat-isolat tersebut bersifat
antagonistik yang tinggi sehingga mampu menekan dengan efektif pertumbuhan
cendawan patogenik terbawa benih yang ada dalam benih kacang panjang uji.
Sedangkan cendawan endofit lainnya kemampuan antagonistiknya rendah,
sehingga kemampuan menghambat cendawan patogenik terbawa benih ada dalam
benih kacang panjang tidak terlalu efektif.
Selain itu, isolat Trichoderma sp. IIb1, hifa steril IIIa3 dan Phoma sp. Ia3
diduga menghasilkan hormon yang memacu perkecambahan benih serta mampu
melakukan penetrasi yang baik ke dalam benih, sehingga perkecambahan benih
dapat terjadi lebih cepat dibandingkan benih-benih dengan perlakuan isolat
lainnya. Dighton (2003) melaporkan bahwa cendawan menginfeksi benih ketika
perikarpnya hilang atau rusak dan kebugaran tanaman inang meningkat dengan
adanya cendawan endofit di benih inang. Selain itu cendawan endofit dapat
mengkolonisasi daun, tangkai daun serta akar jaringan rumput-rumputan pada
musim dingin dan menyebar pada benih inang. Pada fase perkecambahan, inang
dan cendawan endofit saling bekerja sama menjadi satu kesatuan yang saling
mendukung pertumbuhan masing-masing (Stone et al. 2004).
Persentase Pertumbuhan Benih
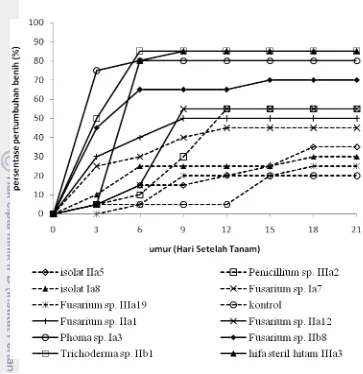
Berdasarkan pengamatan persentase pertumbuhan benih kacang panjang,
dengan penanaman 20 tanaman pada setiap isolat, menghasilkan persentase
pertumbuhan benih yang beragam. Isolat yang memiliki persentase pertumbuhan
paling tinggi dicapai oleh isolat hifa steril IIIa3 dan Trichoderma sp. IIb1 sebesar
85% dan diikuti oleh Phoma sp. Ia3 sebesar 80%. Benih tanpa perlakuan
perendaman suspensi cendawan memiliki persentase pertumbuhan benih sebesar
Pemberian aplikasi perendaman suspensi cendawan memberikan pengaruh
yang signifikan terhadap pertumbuhan benih. Meskipun hasilnya beragam, namun
seluruh perlakuan yang diberikan aplikasi perendaman suspensi cendawan
memiliki persentase perkecambahan yang lebih besar dibandingkan dengan
kontrol.
Benih kacang panjang yang baik dan bermutu memiliki penampilan
bernas/kusam, daya kecambah tinggi di atas 85%, tidak rusak/cacat, tidak
mengandung hama dan patogen (Haryanto et al. 2010). Presentase daya tumbuh
benih kontrol memiliki nilai yang rendah yaitu sebesar 20%. Hal ini diduga
dikarenakan cendawan patogen terbawa benih yang ada pada kacang panjang uji
menghambat pertumbuhan sehingga benih tidak mampu tumbuh dengan normal.
hasil ekplorasi, mampu menekan pengaruh cendawan patogen terbawa benih,
meskipun hasilnya beragam sesuai dengan pengaruh antagonistiknya terhadap
cendawan patogen terbawa benih. Hal ini sejalan dengan yang diungkapkan Clay
(1990) dalam Dighton (2003) dalam bahwa adanya cendawan endofit berada
dalam benih, maka level perkecambahan akan normal.
Tingkat perkembangan cendawan endofit pada tanaman inang dan proporsi
benih yang terinfeksi cendawan endofit dapat menjadi aspek yang penting dalam
kemampuan kompetisi tanaman. Lebih lanjut Purwanti (2004) menyebutkan
bahwa faktor-faktor yang mempengaruhi viabilitas benih selama penyimpanan
dibagi menjadi faktor internal dan eksternal. Faktor internal mencakup sifat
genetik, daya tumbuh dan vigor, kondisi kulit dan kadar air benih awal. Faktor
eksternal antara lain kemasan benih, komposisi gas, suhu dan kelembaban ruang
simpan.
Pertumbuhan Tanaman
Tinggi Tanaman
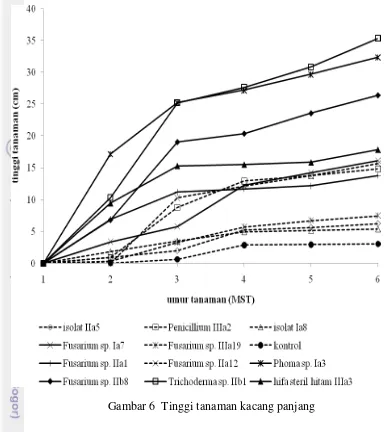
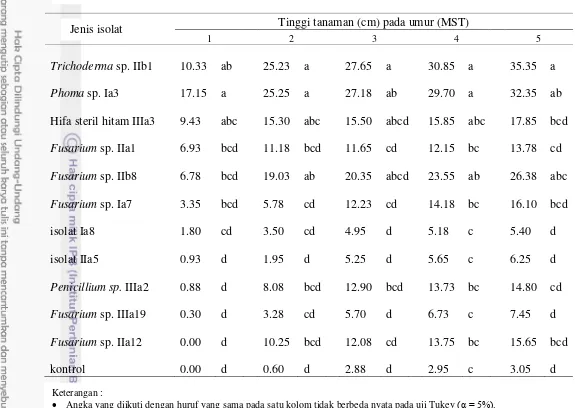
Pengaplikasian Trichoderma sp. IIb1 mengalami pertumbuhan tinggi
tanaman tercepat, sejak minggu ke-dua hingga minggu ke-lima, pertumbuhannya
lebih cepat dibandingkan isolat yang lainnya, pada minggu ke-lima tingginya
mencapai 35,35 cm. Berbeda sedikit dengan tinggi dari Phoma sp. Ia3 yang
mencapai 32,35 cm. Sedangkan isolat yang paling rendah pertumbuhannya adalah
kacang panjang tanpa pengaplikasian cendawan endofit (kontrol) hanya mencapai
Tinggi tanaman kacang panjang pada minggu pertama, benih yang
diaplikasikan Phoma sp. Ia3 mencapai nilai paling tinggi sebesar 17,15 cm,
namun secara statistik perlakuan ini tidak berbeda nyata dengan perlakuan isolat
Trichoderma sp. IIb1, hifa steril hitam IIIa3, Fusarium sp. IIb8. Pada minggu
kedua, Phoma sp. Ia3 dan Trichoderma sp. IIb1 memiliki nilai yang tinggi
dibanding isolat lainnya sebesar 25,25 cm dan 25,23 cm, namun tidak berbeda
nyata dengan isolat Fusarium sp. IIb8 dan hifa steril hitam IIIa3, sedangkan
dengan isolat lain berbeda nyata. Pada minggu ke-tiga, meski secara statistik tidak
berbeda nyata dengan Phoma sp. Ia3 dan Fusarium sp. IIb8, namun
Pada minggu ke-empat pengaplikasian Trichoderma sp. IIb1 dan Phoma sp. Ia3
meraih nilai yang tinggi, masing-masing 30,85 cm dan 29,70 cm, meski keduanya
secara statistik tidak berbeda nyata. Sedangkan pada minggu ke-lima isolat
Trichoderma sp. IIb1 memiliki nilai tertinggi dan berbeda nyata dengan perlakuan
lainnya (Tabel 3).
Aplikasi perendaman benih dengan suspensi isolat cendawan endofit pada
minggu ke-1 sampai dengan minggu ke-5 menunjukkan tinggi tanaman yang lebih
baik dibandingkan dengan kontrol. Isolat Trichoderma sp IIb1 dan Phoma sp. Ia3
secara keseluruhan memperlihatkan nilai tinggi tanaman lebih baik. Hal ini diduga
karena Trichoderma sp. IIb1 dan Phoma sp. Ia3 menghasilkan hormon tumbuh
dan berperan sebagai plant growth promoting fungi (cendawan pemacu
pertumbuhan tanaman). Hasil penelitian lain menyebutkan bahwa cendawan
endofit dapat berperan sebagai hormon tanaman sehingga pertumbuhan tanaman
lebih bugar (Obura 2010).
Hormon adalah zat kimia yang dalam kadar sangat rendah menunjukkan
pengaruh pengaturan terhadap proses pertumbuhan dan perkembangan pada suatu
jarak tertentu dari tempat sintesisnya. Pembelahan, pembesaran dan diferensiasi
sel bergantung pada hormon (Hanafiah et al. 2005). Hormon yang dihasilkan oleh
Trichoderma sp.dan Phoma sp. Ia3 diduga adalah hormon auksin. Auksin adalah
hormon yang berperan pada fase vegetatif, memacu pertumbuhan dan bergerak
dengan polaritas yang nyata secara basipetal dalam tunas dan akropetal dalam
akar (Hanafiah et al. 2005). Selain itu, terdapat hormon pertumbuhan lain
diantaranya giberelin yang berperan pada daun muda yang sedang berkembang
dan bergerak ke seluruh tubuh tanaman, berperan dalam pemanjangan batang dan
perluasan daun. Asam absisat yaitu hormon penghambat ketika terkena cekaman
lingkungan. Selain itu, hormon lainnya yaitu sitokinin yang merangsang
pembelahan sel dan berperan dalam proses metabolisme yang berkaitan dengan
Tinggi tanaman (cm) pada umur (MST) Tabel 3 Pengaruh perlakuan cendawan endofit terhadap tinggi tanaman
Keterangan :
Angka yang diikuti dengan huruf yang sama pada satu kolom tidak berbeda nyata pada uji Tukey (α = 5%).
MST = minggu setelah tanam
Stone et al. (2004) menyatakan bahwa cendawan endofit memproduksi
senyawa metabolit sekunder, antibiotik, dan antifungi patogen. Mekanisme kerja
cendawan endofit dalam memberikan keuntungan untuk inangnya adalah dengan
meningkatkan resistensi tanaman dengan menghasilkan toksin dan mikotoksin,
meningkatkan pertumbuhan tanaman dengan menghasilkan hormon pertumbuhan,
serta merangsang tanaman untuk mampu hidup di tempat kering dengan mengatur
membuka dan menutup stomata.
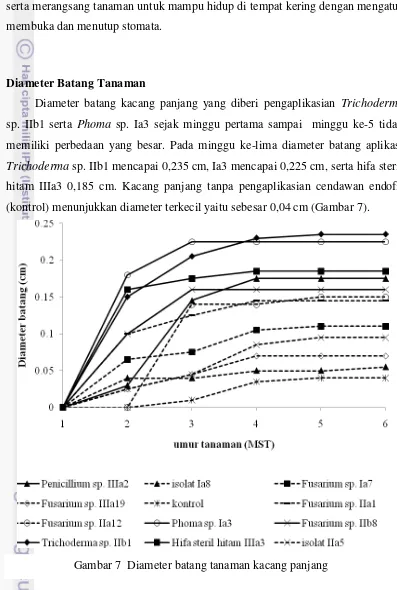
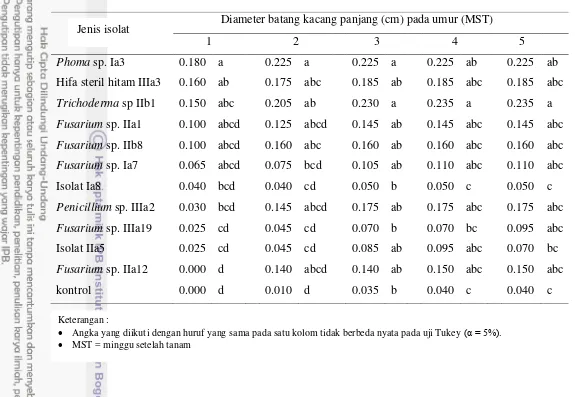
Diameter Batang Tanaman
Diameter batang kacang panjang yang diberi pengaplikasian Trichoderma
sp. IIb1 serta Phoma sp. Ia3 sejak minggu pertama sampai minggu ke-5 tidak
memiliki perbedaan yang besar. Pada minggu ke-lima diameter batang aplikasi
Trichoderma sp. IIb1 mencapai 0,235 cm, Ia3 mencapai 0,225 cm, serta hifa steril
hitam IIIa3 0,185 cm. Kacang panjang tanpa pengaplikasian cendawan endofit
(kontrol) menunjukkan diameter terkecil yaitu sebesar 0,04 cm (Gambar 7).
Aplikasi perendaman benih dengan isolat Trichoderma sp. IIb1 dan
Phoma sp. Ia3 memiliki nilai diameter batang yang paling besar, namun secara
keseluruhan pada minggu ke-1 sampai dengan minggu ke-5 nilai diameter batang
ada dalam kondisi yang homogen. Hal ini diduga karena umur tanaman yang
masih muda, belum memungkinkan adanya pertumbuhan dan perkembangan sel
batang yang sempurna. Sehingga perngaruh aplikasi cendawan endofit tidak
terlihat secara nyata terhadap diameter batang (Tabel 4).
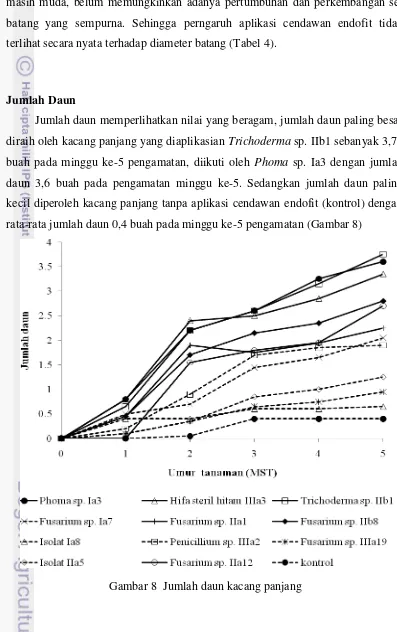
Jumlah Daun
Jumlah daun memperlihatkan nilai yang beragam, jumlah daun paling besar
diraih oleh kacang panjang yang diaplikasian Trichoderma sp. IIb1 sebanyak 3,75
buah pada minggu ke-5 pengamatan, diikuti oleh Phoma sp. Ia3 dengan jumlah
daun 3,6 buah pada pengamatan minggu ke-5. Sedangkan jumlah daun paling
kecil diperoleh kacang panjang tanpa aplikasi cendawan endofit (kontrol) dengan
rata-rata jumlah daun 0,4 buah pada minggu ke-5 pengamatan (Gambar 8)
Tabel 4 Pengaruh perlakuan cendawan endofit terhadap diameter batang tanaman
Diameter batang kacang panjang (cm) pada umur (MST)
1 2 3 4 5
Phoma sp. Ia3 0.180 a 0.225 a 0.225 a 0.225 ab 0.225 ab
Hifa steril hitam IIIa3 0.160 ab 0.175 abc 0.185 ab 0.185 abc 0.185 abc
Trichoderma sp IIb1 0.150 abc 0.205 ab 0.230 a 0.235 a 0.235 a
Fusarium sp. IIa1 0.100 abcd 0.125 abcd 0.145 ab 0.145 abc 0.145 abc
Fusarium sp. IIb8 0.100 abcd 0.160 abc 0.160 ab 0.160 abc 0.160 abc
Fusarium sp. Ia7 0.065 abcd 0.075 bcd 0.105 ab 0.110 abc 0.110 abc
Isolat Ia8 0.040 bcd 0.040 cd 0.050 b 0.050 c 0.050 c
Penicillium sp. IIIa2 0.030 bcd 0.145 abcd 0.175 ab 0.175 abc 0.175 abc
Fusarium sp. IIIa19 0.025 cd 0.045 cd 0.070 b 0.070 bc 0.095 abc
Isolat IIa5 0.025 cd 0.045 cd 0.085 ab 0.095 abc 0.070 bc
Fusarium sp. IIa12 0.000 d 0.140 abcd 0.140 ab 0.150 abc 0.150 abc
kontrol 0.000 d 0.010 d 0.035 b 0.040 c 0.040 c
Keterangan :
Angka yang diikuti dengan huruf yang sama pada satu kolom tidak berbeda nyata pada uji Tukey (α = 5%).
MST = minggu setelah tanam
Nilai rataan tertinggi jumlah daun kacang panjang pada minggu ke-4 dan
minggu ke-5 ditunjukkan oleh aplikasi Trichoderma sp. IIb1 dan Phoma sp. Ia3.
Aplikasi Trichoderma sp. IIb1 pada minggu ke-4 dan minggu ke-5 memperoleh
rataan 3,15 dan 3,75 sedangkan untuk isolat Ia3 memperoleh rataan sebesar 3,25
dan 3,60. Hifa steril hitam IIIa3 pada minggu ke-5 memiliki rataan 3,35. Namun
jika dibandingkan dengan perlakuan isolat lain, selang keragamannnya homogen
serta secara statistik tidak berbeda nyata (Tabel 5).
Aplikasi perendaman benih dengan suspensi cendawan endofit tidak
berbeda nyata secara statistik diantara perlakuan satu isolat dengan isolat lainnya.
Hal ini diduga karena umur kacang panjang pada saat pengamatan berlangsung
masih muda. Sehingga pertumbuhan dan perkembangan sel daun belum tumbuh
dengan sempurna. Oleh karena itu, pada penelitian ini aplikasi perendaman benih
dengan cendawan endofit tidak memperlihatkan perbedaan nyata terhadap
banyaknya jumlah daun.
Jumlah daun terutama pada fase bibit (vegetatif) sangat berpengaruh pada
kecepatan tumbuh tanaman. Karena selain sebagai tempat asimilasi unsur hara,
daun juga berperan sebagai tempat menyerap bahan asimilasi yang ada di udara
antara lain CO2. Disamping itu, daun juga menjadi salah satu tempat hilangnya
hara dari dalam tanaman. Kehilangan hara tersebut dapat terjadi karena pencucian,
gutasi, ekskresi garam dan gugur daun (Sopandie 1993), sehingga tanaman pada
fase bibit (vegetatif) dengan pengembangan jumlah daun yang kurang optimal
akan memberikan pengaruh pada pertumbuhan organ lain yang kurang optimal
pula (Tjitrosoetomo 2007).
Pada tiga parameter pertumbuhan tanaman, yaitu tinggi tanaman, diameter
batang, dan jumlah daun, pertumbuhan kacang panjang yang paling konsisten
adalah pengaplikasian Trichoderma sp. IIb1. Hal ini diduga karena Trichoderma
sp. dapat memproduksi senyawa penting bagi pertumbuhan tanaman. Widyastuti
(2007) menyatakan bahwa Trichoderma spp memiliki pengaruh positif terhadap
pertumbuhan tanaman. Isolat Trichoderma telah digunakan untuk mengendalikan
penyakit pada berbagai jenis tanaman pertanian, perkebunan maupun kehutanan
yang disebabkan oleh patogen seperti Phytium, Phythopthora, Rhizoctonia,
Jumlah daun kacang panjang pada umur (MST)
1 2 3 4 5
Phoma sp. Ia3 0.80 a 2.20 ab 2.60 a 3.25 a 3.60 a
Hifa steril hitam IIIa3 0.80 a 2.40 a 2.50 a 2.85 ab 3.35 ab
Trichoderma sp. IIb1 0.65 ab 2.20 ab 2.60 a 3.15 a 3.75 a
Fusarium sp. Ia7 0.50 ab 0.70 bcde 1.45 ab 1.65 abc 2.05 abc
Fusarium sp. IIa1 0.45 ab 1.90 abc 1.75 ab 1.95 abc 2.25 abc
Fusarium sp. IIb8 0.45 ab 1.70 abcd 2.15 ab 2.35 abc 2.80 abc
Isolat Ia8 0.40 ab 0.40 cde 0.60 b 0.60 c 0.65 c
Penicillium sp. IIIa2 0.20 ab 0.90 abcde 1.70 ab 1.85 abc 1.90 abc
Fusarium sp. IIIa19 0.10 ab 0.35 de 0.65 b 0.75 bc 0.95 bc
Isolat IIa5 0.10 ab 0.35 de 0.85 ab 1.00 bc 1.25 abc
Fusarium sp. IIa12 0.00 b 1.55 abcde 1.80 ab 1.95 abc 2.70 abc
kontrol 0.00 b 0.05 e 0.40 b 0.40 c 0.40 c
Keterangan :
Angka yang diikuti dengan huruf yang sama pada satu kolom tidak berbeda nyata pada uji Tukey (α = 5%).
MST = minggu setelah tanam
Tabel 5 Pengaruh perlakuan cendawan endofit terhadap jumlah daun kacang panjang
Pemacu pertumbuhan tanaman yang dihasilkan oleh Trichoderma
harzianum akan membuat persentase perkecambahan benih bertambah, tanaman
cepat berbunga, jumlah bunga bertambah, berat basah dan berat kering tanaman
bertambah. Mekanisme Trichoderma spp dalam memproduksi pemacu
petumbuhan tanaman diantaranya (1) Pengaruh tidak langsung dengan cara
mengendalikan patogen minor, (2) Pengaruh langsung dengan memacu
pertumbuhan tanaman, (3) Pengaruh langsung dengan ketahanan terimbas.
Ketahanan terimbas merupakan perangsangan sistem pertahanan tanaman dari
patogen atau pengganggu lain (Widyastuti 2007).
Deskripsi Cendawan Endofit
Trichoderma sp.
Trichoderma sp. merupakan salah satu cendawan yang masuk pada divisi
Deuteromycota, secara makroskopis koloninya berwarna hijau, dengan warna
putih kekuningan pada bagian bawahnya jika ditumbuhkan pada media PDA,
cendawan ini tumbuh dengan cepat yang pada awalnya berwarna hyalin kemudian
berubah menjadi hijau, fialidnya bercabang tiga, konidiofor hyalin berseptat,
konidia hyalin atau berwarna hijau dengan bentuk silindris, khlamidospora
biasanya terbentuk pada miselium yang sudah tua (Domsch et al. 1980).
Penelitian tentang induksi ketahanan serta agens antagonis yang berasal
dari Trichoderma sp. telah lama ditemukan baik di Indonesia maupun di luar
negeri, Istikorini (2008) menyatakan bahwa cendawan Trichoderma sp. dan
Gliocladium sp. mampu menghambat cendawan secara langsung. Kemampuan
dan mekanisme Trichoderma dalam menghambat pertumbuhan patogen secara
rinci bervariasi pada setiap spesiesnya. Perbedaan kemampuan ini disebabkan
oleh faktor ekologi yang membuat produksi bahan metabolit yang bervariasi pula.
Trichoderma spp. memproduksi bermacam-macam bahan aktif yaitu
glioviridin, sesquiterpenoids, trichothenes (trichodermin), cyclic peptides, dan
kandungan metabolit isocyanide (trichoviridin). Trichoderma spp. memproduksi
tanah. Trichoderma spp. memproduksi bermacam-macam metabolit sekunder,
termasuk pigmen anthroquinone (pachybasin-(1,8-dihydroxy-3-methyl
-9,10-antharoquinone)); emodin-(1,6,8-trihydroxy-3-methyl-9,10-anthra-quinone)),
cardinanes (avocettin), dan dihydrocoumarins (Widyastuti 2007).
Hifa Steril Hitam
Pada umumnya cendawan memiliki struktur penyusun yang bersifat fertil
dan steril. Namun tidak semua jenis cendawan memiliki struktur fertil atau
struktur reproduktif, seperti spora, konidia, kotak spora, dan lain-lain. Cendawan
jenis ini sulit untuk diidentifikasi, karena hanya tersedia hifa yang steril. Gambar 9 Trichoderma sp. a. Koloni pada media PDA, b. fialid bercabang
tiga a
b
Gambar 10 Hifa steril hitam a. Koloni pada media PDA hifa steril hitam, b. miselia yang membengkak
a
Phoma sp.
Phoma sp. merupakan cendawan yang termasuk pada divisi Deuteromycota,
koloni makroskopisnya berwarna putih, permukaannya halus, dan pada umur yang
sudah tua muncul lingkaran berwarna hitam yang merupakan tubuh buah dari
cendawan. Spora Phoma sp. sangat kecil dengan ukuran berkisar 4,8–6,1x 2,1-2,7
µm. Piknidiumnya berbentuk globose, subglobose, atau tidak beraturan, berwarna
hitam (Watanabe 1994). Piknidum adalah tubuh buah aseksual berbentuk kantung
(bulat atau seperti labu) yang menghasilkan konidia (Gandjar et al. 2006).
Fusarium sp.
Fusarium sp. merupakan salah satu cendawan yang masuk pada divisi
Deuteromycota. Fusarium sp. tumbuh dengan cepat. Biasanya koloni berwarna
putih, kekuningan, jingga, ungu, dapat terlihat berwarna pucat maupun terang.
Fusarium sp. memiliki dua jenis spora yaitu makrokonidia dan mikrokonidia,
makrokonidia adalah spora yang berukuran besar biasanya berbentuk bulan sabit,
seperti kurva, seperti perahu dan silindris yang memiliki 2-6 sekat, ukuran
makrokonidia yaitu 29,1-45 x 2,9-4,7 µ m. Sedangkan mikrokonidia berukuran
lebih kecil berbentuk silindris atau elips yang memiliki 1-2 sekat, ukuran
mikrokonidia yaitu 6-15,8 x 1,9-3,7 µm. Spora bertahan yang disebut
khlamidospora bisa terbentuk namun bisa juga tidak terbentuk. Permukaan
miselium ada yang membentuk miselium udara (aerial mycelium) yang Gambar 11 Phoma sp. a. koloni pada media PDA, b. konidia dalam perbesaran
100x a
menyebabkan permukaan terlihat lebih tebal (Domsch et al. 1980; Watanabe
1994).
Gambar 12 Fusarium sp. a. koloni pada media PDA, b. makrokonidia, c. mikrokonidia, d. konidiofora dikotomi, e. pembengkakan hifa
d
e a
b
KESIMPULAN DAN SARAN
Kesimpulan
Isolasi cendawan endofit dari tiga lokasi menghasilkan jumlah dan jenis
yang beragam. Cendawan endofit paling banyak didapatkan dari lahan yang
terserang virus mosaik kacang panjang yaitu sejumlah 24 isolat dengan persentase
cendawan patogenik 79,17% dan cendawan non-patogenik 20,83%. Aplikasi
perendaman benih kacang panjang dengan cendawan endofit non-patogenik
memberikan pengaruh lebih baik pada perkecambahan benih dibandingkan
dengan kontrol. Aplikasi Trichoderma sp. IIb1 dan Phoma sp. Ia3 memberikan
nilai yang konsisten untuk semua parameter pertumbuhan tanaman sehingga
berpotensi sebagai cendawan agens hayati.
Saran
Perlu penelitian lebih mendalam mengenai pengaruh Trichoderma sp. IIb1
dan Phoma sp. Ia3 di lapangan untuk induksi ketahanan tanaman terhadap
organisme pengganggu tanaman (OPT) tertentu. Selain itu, diperlukan penelitian
DAFTAR PUSTAKA
[CABI] Central for Agricultural and Bioscience International. 2004. Crop Protection Compendium [CD-ROM]. Wallingford: CAB International.
[CABI] Central for Agricultural and Bioscience International. 2005. Crop Protection Compendium [CD-ROM]. Wallingford: CAB International.
Anonim. 2011. Sterile mycelium. Sporometrics Inc. http://www.sporometrics.com resources/fungal-descriptions/sterile-mycelium/ [20 Agustus 2011].
Asniah. 2009. Potensi cendawan asal akar rumput, teki dan tanah perakaran bambu untuk pengendalian penyakit akar gada pada tanaman brokoli [tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
BPS. 2009. Produksi hortikultura di Indonesia. Badan Pusat Statistik Republik Indonesia. http://www.bps.go.id/tab_sub/view.php?tabel=1&daftar=1&id_ subyek=55¬ab=15 [10 Februari 2011].
Carroll GC. 1988. Fungal endophytes in stems and leaves: From latent pathogen to mutualistic symbiont. Ecology 69:2–9.
Clay K. 1988. Fungal endophytes on grasses: a defensive mutualism between plants and fungi. Ecology 69:10-16.
Clay K. 2004. Fungi and the food of the gods. Nature 427:401-402.
Dighton J. 2003. Endophyte and antiherbivore action. Di dalam: Bennet JW, editor. Fungi in Ecosystem Processes. USA: Marcel Dekker. hlm 274-281.
Dingle J, McGee PA. 2003. Some endophytic fungi reduce the density of pustules of Puccinia recondita f. sp. tritici in wheat. Mycol. Res. 107(3): 310–316.
Domsch KH, Gams W, Anderson TH. 1980. Compendium of Soil Fungi Vol 1. New York: Academic Press.
Doss RP, Welty RE. 1995. A PCR-based procedure for detection of Acremonium coenophilum in tall fescue. Phytopathology 85:913-914.
Durham NC. 2004. Armies of fighting fungi project chocolate trees. www.rpi.edu/ajayan/locker/publications/natureajayanjan202004.pdf- [02 Februari 2011] .
Faeth SH. 2002. Are endophytic fungi defensive plant mutualists? –Oikos 98:25– 36.
FAO. 2009. Main functions and services provided by microorganism relevant to food and agriculture. Roma: Commission On Genetic Resources For Food And Agriculture.
Hanafiah KA, Napoleon A, Ghofar N. 2005. Biologi Tanah: Ekologi &
Makrobiologi Tanah. Jakarta: PT Rajagrafindo Persada.
Haryanto E, Suhartini T, Rahayu E. 2010. Budi Daya Kacang Panjang. Jakarta: Penebar Swadaya.
Hidayah N, Nurulita S, Putra MC, Israhayu R. 2010. Potensi beberapa ekstrak gulma untuk mengendalikan penyakit mosaik pada kacang [PKM]. Fakultas Pertanian, Institut Pertanian Bogor.
Istikorini Y. 2008. Potensi cendawan endofit untuk mengendalikan penyakit antraknosa pada cabai [disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Kariada IK, Kartini NL, Aribawa IB. 2003. Pengaruh pupuk organik kascing (POK) dan NPK terhadap sifat kimia tanah dan hasil kacang panjang di lahan kering Desa Pegok Kabupaten Badung. Balai Pengkajian Teknologi Pertanian Bali.
Macarthur D, McGee P. 2000. A comparison of the endophytic fungi from leaves of Banksia integrifolia at three sites on the east coast of Australia.
Australasian Mycol. 19(3):80-83.
McGee P, Dingle J, Macarthur D, Creighton N, Istifadah N. 2006. Endophytic fungi add to plant defences. Microb. Australia 24(3):42-43.
Niere B, Gold C, Coyne D. 2002. Banana endophytes: Potential for pest biocontrol. Biocontrol News and Information 23:4.
Obura BO. 2010. Root endophytic fungi of tomato and their role as biocontrol agents of root-knot nematodes Meloidogyne incognita (Kofoid and White) Chitwood and growth promotion in tomato plants (Lycopersicon esculentum
Mill) [thesis]. Bogor: Graduate School, Bogor Agricultural University.
Petrini O, Sieber TN, Toti L, Viret O. 1992. Ecology metabolite production and substrate utilization in endophytic fungi. Natur Toxins 1:185-196.
Pitojo S. 2006. Penangkaran Benih Kacang Panjang. Yogyakarta: Kanisius.
Plantamor. 2008. Kacang panjang (Vigna sinensis). http://www.plantamor.com/ /index.php?plant=1281 [01 Februari 2011].
Prabaningrum L. 1996. Kehilangan hasil panen kacang panjang (Vigna sinensis
Stikm) akibat serangan kutu kacang panjang, Aphis craccivora Koch. Di dalam: Kuswanto, Waluyo B, Soetopo L, Afandi A. 2007. Evaluasi keragaman genetik toleransi kacang panjang (Vigna sesquipedalis (L). Fruwirth) terhadap hama aphid. Jurnal Akta Agrosia Edisi Khusus (1):19-25.
Prabowo AY. 2007. Budidaya kacang panjang. http://www.teknis-budidaya.blogspot.com [01 Februari 2011].
Purwanti S. 2004. Kajian suhu ruang simpan terhadap kualitas benih kedelai hitam dan kedelai kuning. Ilmu Pertanian 11(1):22-31.
Setyastuti L. 2008. Tingkat ketahanan sembilan kultivar kacang panjang terhadap infeksi Bean Common Mosaic Virus (BCMV) [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Sopandie D. 1993. Penyerapan Hara, Angkutan Jarak dekat dan Jarak Jauh dalam Xilem dan Floem. Diktat Kuliah AGR 639 Interaksi antara Hara dan Tanaman. Bogor: Program Pasca Sarjana, Institut Pertanian Bogor.
Stone JK, Polishook JD, White JF. 2004. Endophytic Fungi. Di dalam: Mueller GM, Bills GF, Foster MS, editor. Biodiversity of Fungi: Inventory and
Monitoring Methods. California: Elsevier Academic Press. hlm 241-270.
Strobel GA, Hess WM, Ford E, Sidhu RS, Yang X. 1996. Taxol from fungal endophytes and the issue of biodiversity. J. Aquat Plant Manag. 40:76-78.
Sutopo L. 2004. Teknologi Benih. Jakarta: PT Rajagrafindo Persada.
Tjitrosoetomo G. 2007. Morfologi Tumbuhan. Yogyakarta: Gadjah Mada University Press.
Watanabe T. 1994. Pictorial Atlas of Soil and Seed Fungi: Morphologies of
Cultured Fungi and Key to Species. Tokyo: Lewis Publishers.
Widyastuti SM. 2007. Peran Trichoderma spp. dalam Revitalisasi Kehutanan di
Indonesia. Yogyakarta: Gadjah Mada University Press.
NURUL RIKMAWATI. Eksplorasi Cendawan Endofit pada Kacang Panjang
(Vigna Sinensis (L) Savi Ex Has dan Pengaruhnya terhadap Pertumbuhan
Tanaman. Dibimbing oleh WIDODO.
PENDAHULUAN
Latar Belakang
Kacang panjang (Vigna sinensis (L.) Savi Ex Has) merupakan salah satu
tanaman yang dibudidayakan di Indonesia sebagai tanaman sayuran. Kacang
panjang memiliki beberapa keunggulan yaitu harganya terjangkau, dapat dimakan
mentah maupun matang, mudah dibudidayakan, serta memiliki kandungan gizi
yang cukup lengkap seperti protein, lemak, mineral, karbohidrat, kalsium, fosfor,
besi, vitamin B1, B2, B3, dan air (Pitojo 2006; Haryanto et al. 2010).
Keunggulan diatas menjadikan kacang panjang menjadi salah satu tanaman
sayuran yang dikonsumsi masyarakat, akan tetapi pada kenyataannya tingkat
produksi kacang panjang mengalami penurunan. Hal ini sebagaimana yang
diungkapkan Kariada et al. (2003) bahwa produktivitas kacang panjang di tingkat
petani sangat rendah yaitu 2-3 ton/ha. Hal ini diperkuat data BPS pada tahun
2009, yang menunjukan bahwa produksi kacang panjang di Indonesia dari tahun
2006 ke tahun 2007 hanya mengalami kenaikan sebesar 5,91%, sedangkan pada
tahun 2008 mengalami penurunan sebesar 6,75%.
Salah satu penyebab rendahnya produksi kacang panjang adalah serangan
Organisme Pengganggu Tumbuhan (OPT), salah satunya dari golongan penyakit.
Beberapa penyakit yang dominan menyerang kacang panjang yaitu virus mosaik
kacang panjang yang disebabkan oleh bean common mosaic virus (Hidayah et al.
2010), layu yang disebabkan oleh Sclerotium roflsii, karat daun yang disebabkan
oleh Uromyces phaseoli, penyakit sapu yang disebabkan oleh mikoplasma
(Haryanto et al. 2010). Penyebab penyakit utama pada kacang panjang berasal
dari golongan virus. Serangan virus dapat menyebabkan penurunan kualitas dan
kuantitas kacang panjang. Virus mosaik kacang panjang (VMKP) merupakan
salah satu virus yang menginfeksi tanaman kacang panjang dan menyebabkan
kerugian sebesar 65,87% (Prabaningrum 1996 dalam Kuswanto 2007).
Beberapa upaya pengendalian VMKP yaitu pengendalian vektor virus,
penggunaan benih yang sehat dan penggunaan bahan-bahan antiviral.
Pengendalian vektor virus dapat dilakukan dengan kultur teknis yaitu dengan
vektor serta penggunaan insektisida. Sedangkan untuk mendapatkan benih yang
sehat, dilakukan dengan perlakuan benih yaitu perlakuan panas, sinar UV dan
lain-lain (CABI 2005). Upaya pengendalian virus tanaman yang umum dilakukan
adalah dengan menggunakan varietas yang tahan. Namun tidak banyak tersedia
kultivar yang tahan dengan VMKP. Setyastuti (2008) melaporkan bahwa dari 9
kultivar kacang panjang (Bogor Hijau I, asparagus, KP 888, Asri II, Sakura, KP
777, Dondot, Iguma dan Landung) yang banyak ditanam oleh petani rentan
terhadap VMKP.
Pengendalian lain yang menjadi alternatif yaitu pengendalian hayati dengan
penggunaan agens pengendali hayati. Teknik pengendalian hayati akhir-akhir ini
berkembang dengan pesat karena memiliki kelebihan dibandingkan dengan teknik
pengendalian yang lainnya yaitu berbasis sumber daya hayati dan ramah
lingkungan. Salah satu agen yang dapat menginduksi ketahanan tanaman adalah
cendawan endofit yang berperan sebagai pemacu pertumbuhan tanaman. Potensi
penggunaan cendawan endofit cukup besar untuk dikembangkan sebagai agens
pengendali hayati, karena cendawan ini hidup dalam jaringan tanaman sehingga
dapat berperan langsung dalam menghambat perkembangan patogen tanaman
(Niere 2002).
Cendawan endofit merupakan salah satu bagian yang terintegrasi dalam
pengendalian hayati. Secara harfiah, endofit berarti suatu organisme yang hidup
dalam tubuh organisme lain (Doss & Welty 1995). Menurut Faeth (2002),
keberadaan endofit sangat melimpah dan beragam, serta dapat ditemukan di
seluruh famili tanaman pertanian maupun rumput-rumputan. Cendawan endofit
adalah cendawan yang dapat menginfeksi jaringan tanaman tanpa menyebabkan
penyakit (Durham 2004). Cendawan endofit hidup di antar jaringan dan tidak
hidup pada jaringan angkut. Selain itu, cendawan endofit dapat bersimbiosis
mutualisme dengan tanaman inang (Caroll 1988; Clay 1988) dan dapat
menghasilkan berbagai hormon yang berperan dalam menginduksi ketahanan
tanaman seperti IAA, sitokinin, etilen, giberelin (Obura 2010).
Dari penelitian yang telah dilaporkan di atas, maka dapat dijadikan acuan
dari tanaman kacang panjang sebagai bahan induksi ketahanan untuk
pengendalian penyakit pada tanaman kacang panjang.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui jenis-jenis cendawan endofit yang
mampu memacu pertumbuhan tanaman yang berasal dari kacang panjang (Vigna
sinensis) di 3 lokasi serta mempelajari pengaruhnya terhadap pertumbuhan
tanaman kacang panjang.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat menjadi masukan dalam pengendalian