APLIKASI ENZIM LIGNINASE DAN SELULASE UNTUK
MENINGKATKAN PERKECAMBAHAN BENIH KELAPA
SAWIT (
Elaeis guineensis
Jacq.)
PUTRA KUSUMA HADI
A24061538
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
RINGKASAN
PUTRA KUSUMA HADI. Aplikasi Enzim Ligninase dan Selulase untuk
Meningkatkan Perkecambahan Benih Kelapa Sawit (Elaeis guineensis Jacq.). (Dibimbing oleh ENY WIDAJATI dan SELLY SALMA).
Penelitian bertujuan untuk mengetahui pengaruh aplikasi enzim ligninase dan selulase terhadap perkecambahan benih kelapa sawit. Penelitian dilaksanakan di Pusat Penelitian Kelapa Sawit (PPKS) Unit Marihat, Pematang Siantar, Sumatera Utara. Penelitian dimulai pada bulan Maret hingga Juli 2010.
Percobaan disusun menggunakan rancangan kelompok lengkap teracak (RKLT) dengan dua faktor. Faktor pertama adalah varietas benih yaitu Langkat dan Yangambi. Faktor ke dua adalah aplikasi enzim ligninase dan selulase dengan lima teknik aplikasi, yaitu (1) kontrol (sesuai metode pemecahan dormansi benih kelapa sawit di PPKS) dengan pemanasan benih selama 60 hari dan perendaman dalam air selama 3 hari; (2) Pemanasan benih selama 40 hari, perendaman dalam air selama 3 hari, perendaman dalam enzim ligninase selama 1 hari, dan perendaman benih dalam enzim selulase selama 2 hari; (3) Pemanasan benih selama 40 hari, perendaman dalam enzim ligninase 1 hari, perendaman dalam enzim selulase 2 hari dan perendaman dengan air selama 3 hari; (4) Pemanasan benih selama 40 hari, perendaman dengan campuran enzim ligninase dan selulase selama 3 hari dan perendaman dengan air selama 3 hari; dan (5) Pemanasan benih selama 50 hari, perendaman dengan campuran enzim ligninase dan selulase selama 10 hari dan perendaman dengan air selama 3 hari. Enzim ligninase dan selulase didapatkan dari Laboratorium Mikrobiologi Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, sedangkan benih kelapa sawit varietas Langkat dan Yangambi didapat dari PPKS.
adalah 1) Pemanasan selama 40 hari, perendaman dengan air selama 3 hari, perendaman dengan enzim ligninase 1 hari, dan perendaman dengan enzim selulase 2 hari; 2) Pemanasan selama 40 hari, perendaman dengan enzim ligninase 1 hari, perendaman dengan enzim selulase 2 hari, dan perendaman dengan air selama 3 hari; dan 3) Pemanasan selama 40 hari, perendaman dengan campuran enzim ligninase dan selulase 3 hari, dan perendaman dengan air 3 hari.
Pada benih varietas Langkat, aplikasi enzim ligninase dan selulase efektif dengan nyata meningkatkan KCT benih, yaitu dengan pemanasan selama 40 hari, perendaman dengan enzim ligninase 1 hari, perendaman dengan enzim selulase selama 2 hari dan perendaman dengan air 3 hari.
APLIKASI ENZIM LIGNINASE DAN SELULASE UNTUK
MENINGKATKAN PERKECAMBAHAN BENIH KELAPA SAWIT
(Elaeis guineensis Jacq.)
Skripsi sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Fakultas Pertanian Institut Pertanian Bogor
PUTRA KUSUMA HADI
A24061538
DEPARTEMEN AGRONOMI DAN HORTIKULTURA
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
Judul : APLIKASI ENZIM LIGNINASE DAN SELULASE UNTUK MENINGKATKAN PERKECAMBAHAN BENIH KELAPA SAWIT (Elaeis guineensis Jacq.)
Nama : PUTRA KUSUMA HADI NIM : A24061538
Menyetujui, Dosen Pembimbing
Pembimbing I
Dr. Ir. Eny Widajati, MS NIP: 19610106 198503 2002
Pembimbing II
Dra. Selly Salma, MSi NIP: 19630714 199003 2 001
Mengetahui
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian
Dr. Ir. Agus Purwito, MSc. Agr NIP: 19611101 198703 1 003
RIWAYAT HIDUP
KATA PENGANTAR
Puji syukur penulis panjatkan kepada Allah SWT yang telah memberikan kekuatan, semangat, rahmat dan karunia-Nya, sehingga penulis dapat menyelesaikan penelitian untuk skripsi ini yang berjudul “Aplikasi Enzim Ligninase dan Selulase untuk Meningkatkan Perkecambahan Benih Kelapa
Sawit (Elaeis Guineensis Jacq.)”.
Penelitian ini dilakukan dengan tujuan untuk mengetahui pengaruh aplikasi enzim ligninase dan selulase terhadap perkecambahan benih kelapa sawit.
Pada kesempatan kali ini penulis mengucapkan terima kasih dan penghargaan kepada seluruh pihak yang membantu dalam penyusunan skripsi ini, terutama :
1. Ayah dan ibu serta adik-adik saya tercinta yang telah memberikan doa, semangat, dan dorongan secara lahir dan batin.
2. Dr. Ir. Eny Widajati, MS. dan Dra. Selly Salma, Msi. selaku pembimbing skripsi yang telah memberikan masukan dan saran untuk penyusunan skripsi ini.
3. Ir. Jan Barlian, MSc. selaku pembimbing akademik yang telah membimbing penulis selama menjalani studi.
4. Staf pengajar dan staf komisi pendidikan Departemen Agronomi dan Hortikultura, Fakultas Pertanian, IPB.
5. Direktorat Jenderal Perkebunan yang telah memberikan bantuan dana penelitian sehingga penelitian ini dapat dilaksanakan dengan lancar
6. Para staf dan pegawai di PPKS Marihat yang telah memberikan bantuan selama pelaksanaan penelitian.
7. Teman-teman AGH 43 dan teman-teman yang telah memberikan motivasi dan masukan.
Semoga skripsi ini bermanfaat bagi dunia pendidikan khususnya perkembangan ilmu pengetahuan dan teknologi (IPTEK) dan bagi yang memerlukan.
DAFTAR ISI
Proses Perkecambahan Benih hingga Menjadi Bibit ... 11
Dormansi Benih ... 15
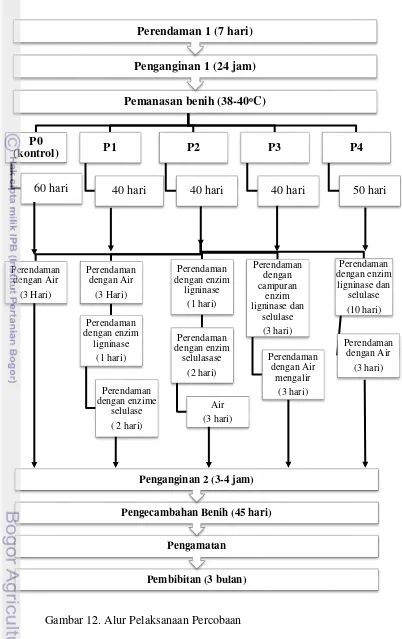
Skema pelaksanaan percobaan dapat dilihat pada Gambar 12. ... 26
DAFTAR TABEL
Nomor
Halaman
1. Rekapitulasi Hasil Sidik Ragam Pengaruh Aplikasi Enzim
dan Varietas terhadap Perkecambahan Benih Kelapa Sawit ... 35
2. Pengaruh Perlakuan Aplikasi Enzim dan Varietas terhadap
Daya Berkecambah Benih ... 36
3. Pengaruh Perlakuan Aplikasi Enzim dan Varietas terhadap
Potensi Tumbuh Maksimum Benih ... 39
4. Pengaruh Perlakuan Aplikasi Enzim dan Varietas terhadap
Kecepatan Tumbuh Benih ... 40
5. Pengaruh Perlakuan Aplikasi Enzim dan Varietas terhadap
DAFTAR GAMBAR
Nomor Halaman
1. Distribusi Akar pada Satu Akar Primer Tanaman Kelapa Sawit
yang Berumur 10 Tahun ... 5
2. Inflorescent Bunga Jantan dan Betina serta Bunga Abnormal ... 6
3. Struktur Buah Kelapa Sawit (Corley dan Tinker, 2003) ... 9
4. Buah Kelapa Sawit yang Memiliki (A) Satu Kernel, (B) Dua Kernel, dan (C) Tiga Kernel ... 9
5. Benih kelapa sawit dan pertumbuhan awalnya ... 10
6. Bagian kernel benih tenera yang dipotong secara melintang ... 12
7. Bibit kelapa sawit yang berumur 2 bulan ... 14
8. Irisan melintang bagian tengah apeks pada kelapa sawit yang ... 15
9. Konfigurasi Dinding Sel Tanaman (Lynd et al., 2002) ... 20
10. Skema Pembentukan Karbon Diokasida dari Struktur ... 23
11. Skema Hidrolisis Selulosa Menjadi Glukosa ... 24
12. Alur Pelaksanaan Percobaan ... 27
13. Perendaman I Di Dalam Bak Perendaman ... 28
14. Penganginan Benih Di Rak Pengeringan ... 28
15. Perendaman Benih dengan Larutan Fungisida 0.2% ... 28
16. Pemanasan Benih Dalam Tray Palstik Di Ruang Pemanas ... 29
17. Alat dan Bahan yang digunakan pada Tahap Aplikasi Enzim ... 30
18. Perendaman Benih dengan Enzim Ligninase dan Selulase ... 30
19. Pengecambahan Benih Di Ruang Perkecambahan ... 31
20. Benih Kelapa Sawit dan Tray Plastik yang Disekat Sterofom... 31
21. Kecambah Hasil Seleksi ... 32
23. Benih Kelapa Sawit Varietas Yangambi dan Langkat ... 36
24. Ketebalan Cangkang Benih Varietas Yangambi dan Langkat ... 36
25. Bibit Normal pada Minggu Ke-5 ... 43
DAFTAR LAMPIRAN
Nomor Halaman
1. Tabel Data Benih yang Diambil untuk Percobaan ... 50 2. Tabel Penggunaan Ekstrak Kasar Enzim Ligninase dan Selulase ... 50 3. Tabel Analisis Ragam Pengaruh Aplikasi Enzim dan Varietas
terhadap Daya Berkecambah Benih ... 51
4. Tabel Analisis Ragam Pengaruh Aplikasi Enzim dan Varietas
terhadap Potensi Tumbuh Maksimum Benih ... 51
5. Tabel Analisis Ragam Pengaruh Aplikasi Enzim dan Varietas
terhadap KCT Benih ... 51
6. Tabel Analisis Ragam Pengaruh Aplikasi Enzim dan Varietas
PENDAHULUAN
Latar Belakang
Beberapa isu nasional seperti angka pengangguran yang tinggi, jumlah angka kemiskinan yang terus meningkat dari tahun ke tahun, kelangkaan energi, adanya kerusakan lingkungan dan melemahnya sektor riil di Indoneria menjadikan kebijakan pembangunan pertanian yang berfokus pada komoditas perkebunan diharapkan dapat berperan besar dibidang ekonomi, sosial, dan lingkungan. Tanaman kelapa sawit merupakan komoditas yang dijadikan sebagai salah satu prioritas utama yang diunggulkan oleh pemerintah Indonesia.
Ditinjau dari aspek ekonomi, perkebunan kelapa sawit dapat mendukung industri dalam negeri berbasis produk berbahan dasar kelapa sawit. Dengan terbangunnya banyak sentra industri ekonomi di wilayah baru, secara otomatis akan medukung pembangunan ekonomi di daerah. Bila ditinjau dari aspek sosial, dengan adanya perkembangan perkebunan kelapa sawit akan terjadi penyerapan tenaga kerja dalam jumlah besar (Sunarko, 2009). Pada bulan April-September 2007, investasi pada sektor perkebunan kelapa sawit telah mencapai 7.7 triliun rupiah dengan potensi menyerap 93 000 tenaga kerja yang tentu saja dapat menggerakkan perekonomian di daerah (Pardean, 2008).
Permintaan terhadap miyak kelapa sawit CPO (Crude Palm Oil) dan produk turunannya baik di dalam maupun di luar negeri dari tahun ke tahun sangat tinggi, sehingga memiliki prospek pasar yang sangat menjanjikan. Hal inilah yang membuat perkebunan kelapa sawit di Indonesia sekarang diperluas secara besar-besaran, baik oleh perusahaan perkebunan negara, perusahaan besar swasta maupun mayarakat secara umum (Pardean, 2008).
Menurut data Direktorat Jenderal Perkebunan (2012), pada tahun 2008 luas areal perkebunan kelapa sawit di Indonesia mencapai 6 363 847 ha. Pada tahun 2009, luas areal perkebunan kelapa sawit di Indonesia meningkat 18 % menjadi 7 508 023 ha. Diperkirakan luas area perkebunan kelapa sawit tahun 2010 meningkat 4.22% mencapai luas 7 824 623 ha.
di Indonesia pada tahun 2006 mampu menyuplai 141 000 000 kecambah.
Produksi kecambah kelapa sawit pada tahun 2008 meningkat menjadi 151 000 000 kecambah, tetapi jumlah ini belum cukup untuk memenuhi
kebutuhan kecambah kelapa sawit dalam negeri yang diperkirakan mencapai 230 000 000 kecambah. Hal inilah yang membuat pemerintah melalui Departemen Pertanian membuka keran impor benih kelapa sawit dari luar negeri yang berasal dari DAMI Papua Nugini, ASD Kostarika, dan Malaysia (Pahan, 2008).
Upaya untuk meningkatkan produksi benih kelapa sawit secara generatif tidaklah mudah karena memiliki beberapa masalah, salah satunya dikarenakan benih kelapa sawit termasuk benih yang sulit dikecambahkan. Hal ini disebabkan oleh dormansi benih kelapa sawit yang lama (Brahmana dan Chairani, 1997). Lamanya dormansi benih kelapa sawit salah satunya disebabkan oleh struktur benih yang diselimuti cangkang yang keras dan impermeabel terhadap air dan udara. Hal ini mengakibatkan terhambatnya proses imbibisi air dan masuknya udara ke dalam benih sehingga perkecambahan benih juga menjadi terhambat.
Untuk dapat berkecambah, benih kelapa sawit memerlukan waktu yang sangat lama. Secara alami, dibutuhkan waktu ± 1 tahun untuk perkecambahan dengan daya berkecambah hanya 40%. Teknik pematahan dormansi dengan perlakuan pemanasan 60 hari dan perendaman benih selama 10 hari, perkecambahan benih kelapa sawit dapat dipercepat sehinga hanya memerlukan waktu 4 bulan dengan persentase perkecambahan mencapai 75-80% (Brahmana dan Chairani, 1997). Walaupun demikian, hal ini masih dirasa belum cukup karena masih memerlukan waktu yang lama yaitu 4 bulan.
Tujuan
Mengetahui pengaruh aplikasi enzim ligninase dan selulase terhadap perkecambahan benih kelapa sawit.
Hipotesis
Hipotesis yang diajukan dalam penelitian ini adalah:
1. Aplikasi enzim ligninase dan selulase dapat mempercepat dan meningkatkan persentase daya berkecambah benih kelapa sawit.
TINJAUAN PUSTAKA
Botani Kelapa Sawit
Kelapa sawit bukanlah tanaman asli Indonesia, diperkirakan kelapa sawit berasal dari Afrika Barat dan Amerika Selatan. Secara taksonomi, kelapa sawit dapat diklasifikasikan sebagai berikut :
Divisi : Tracheophyta
Subdivisi : Pteropsida
Kelas : Angiospermae
Subkelas : Monocotyledoneae
Ordo : Spadiciflorae (Arecales) Famili : Palmae
Subfamili : Cocoideae
Genus : Elaeis
Spesies : Elais guineensis Jacq.
“Elaeis” berasal dari bahasa Yunani “Elaion” yang berarti “minyak”, “guineensis”berasal dari kata “Guinea” yaitu suatu wilayah di pantai barat Afrika dan “Jacq.” berasal dari “Jacquin” nama seorang botanis dari Amerika Serikat (Lubis, 2008).
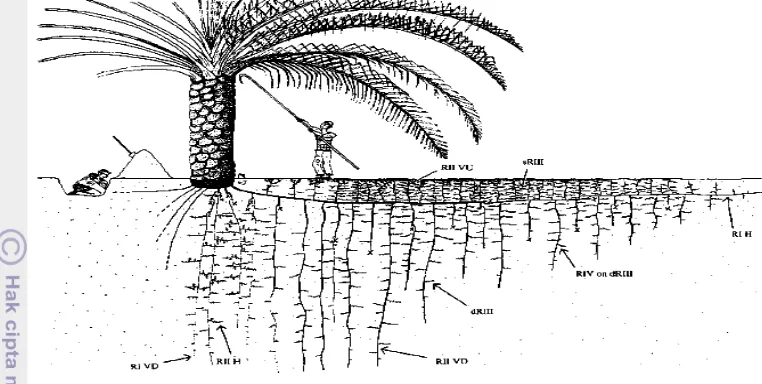
Keterangan:
Distribusi akar utama kelapa sawit berumur 10 tahun. RI = akar primer; RII = akar sekunder; sRIII= akar tersier dekat permukaan tanah, biasanya sangat bercabang; dRIII = akar tersier yang mendalam di tanah, biasanya kurang bercabang; RIV = akar kuarterner; VD = akar vertikal dengan arah menurun; VU = akar vertikal dengan arah naik ke atas, H = akar horizontal .
Gambar 1. Distribusi Akar pada Satu Akar Primer Tanaman Kelapa Sawit yang Berumur 10 Tahun
(Jourdan dan Rey dalam Corley dan Tinker, 2003)
Menurut Lubis (2008) daun kelapa sawit yang pertama kali muncul pada stadia bibit berbentuk lanceolate, kemudian muncul bifurcate dan meyusul
pinnate. Daun dihasilkan dalam urutan-urutan yang teratur dan memiliki rumus daun 1/8. Lingkaran atau spiralnya ada yang berputar ke kiri atau ke kanan, tetapi kebanyakan berputar ke kanan. Pengenalan arah putaran penting dilakukan untuk mengetahui letak daun ke-17 yang digunakan untuk pengambilan contoh daun untuk analisis perhitungan dosis pemupukan. Selama setahun, pelepah daun yang dihasilkan berkisar antara 20 – 30 pelepah, kemudian semakin berkurang sesuai dengan umurnya menjadi 18 – 25 pelepah. Jumlah anak daun yang dihasilkan oleh setiap pelepah dapat mencapai 150 – 200 helai.
Daun kelapa sawit terdiri atas beberapa bagian, yaitu:
a. Kumpulan anak daun (leaflets) yang mempunyai helaian (lamina) dan tulang anak (midrib).
b. Rachis yang merupakan tempat anak daun melekat.
c. Tangkai daun (petiole) yang merupakan bagian antara daun dan batang. d. Seludang daun (sheath) yang berfungsi sebagai perlindungan dari kuncup
Luas permukaan daun tanaman kelapa sawit dapat mencapai 10 - 15 m2 pada tanaman dewasa yang berumur 10 tahun atau lebih. Perbedaan umur akan mempengaruhi luas permukaan daun demikian pula jenis pohon induk yang dipakai dalam persilangan. Pada umumnya daun akan mencapai luas maksimum pada umur 10 - 13 tahun. Penanaman rapat akan lebih mempercepat tercapainya angka maksimum tersebut (Lubis, 2008).
Batang kelapa sawit tumbuh tegak lurus dan dapat mencapai ketinggian antara 15 - 20 m. Batang berbentuk silindris dengan diameter 0.5 m pada tanaman dewasa. Batang bagian bawah umumnya lebih besar dari batang bagian atas yang disebut bongkol batang atau bowl. Kelapa sawit ada yang tumbuh secara cepat dan ada pula yang lambat. Sifat-sifat tersebut dapat digunakan dalam pemilihan pohon induk karena keterkaitannya dengan masalah panen (Lubis, 2008).
Pembungaan kelapa sawit disebut monocious karena bunga jantan dan bunga betina terdapat pada satu pohon. Risza (1994) menyatakan bunga jantan dan bunga betina keluar pada ketiak pelepah daun. Satu tandan bunga jantan terdiri dari ± 200 spikelet. Dalam satu spikelet terdapat 700 – 1 000 bunga jantan. Dalam satu tandan bunga jantan dapat mencapai ± 50 gram tepung sari. Bunga bunga masih dalam seludang (A1) dan tandan bunga setelah seludangnya dibuang (A2). (B) Saat bunga anthesis. (Bk) Tandan bunga betina yang abnormal, karena terdapat bunga jantan pada spikelet di tandan bunga betina.
Proses pembentukan buah sejak saat penyerbukan sampai buah matang ± 6 bulan. Dalam satu tandan dewasa dapat mencapai 2 000 buah. Buah kelapa sawit termasuk buah batu terdiri dari 3 bagian yaitu : lapisan luar (Epicarpium) disebut kulit luar, lapisan tengah (Mesocarpium) disebut daging buah dan lapisan dalam (Endocarpium).
Syarat Tumbuh Kelapa Sawit
Tanaman kelapa sawit dapat tumbuh pada suhu 27oC dengan suhu maksimum 33oC dan suhu minimum 22oC. Curah hujan rata-rata tahunan yang memungkinkan untuk pertumbuhan kelapa sawit adalah 1 250 – 3 000 mm yang merata sepanjang tahun, curah hujan optimal sekitar 1 750 – 2 500 mm. Lama penyinaran matahari yang optimal adalah 6 jam per hari dan kelembapan nisbi untuk kelapa sawit pada kisaran 50 – 90% (optimal 80%) (Buana, Siahaan dan Adipura, 2003). Ketinggian (elevasi) dari permukaan laut yang optimal adalah dari 0 – 500 m dpl. Pada elevasi yang lebih tinggi pertumbuhan akan terhambat dan produksi cenderung rendah, namun berkaitan dengan konteks perubahan iklim maka sampai dengan 850 m dpl tanaman kelapa sawit pada kondisi tertentu sudah sesuai dan layak dibudidayakan. Kecepatan angin 5 – 6 km/jam sangat baik untuk membantu proses penyerbukan. Angin yang terlalu kencang akan menyebabkan tanaman baru menjadi doyong atau miring (Lubis, 2008).
Menurut Lubis (2008) kelapa sawit dapat tumbuh pada berbagai jenis tanah seperti podsolik, latosol, hidromorfik kelabu (HK), regosol, dan osol, organosol dan alluvial. Sifat fisik tanah yang baik untuk kelapa sawit adalah :
1. Solum tebal 80 cm. Solum tebal baik bagi perkembangan akar sehingga efisiensi penyerapan hara tanaman akan lebih baik.
2. Tekstur ringan, dikehendaki memiliki pasir 20 – 60%, debu 10 – 40%, dan liat 20 – 25%.
3. Perkembangan srtuktur baik, konsistensi gembur sampai agak teguh dan permeabilitas sedang.
5. Kandungan unsur hara tinggi. Daya tukar K = 0,15 – 0,20 me/100 gram. C/N mendekati 10 dimana C 1% dan N 0,1%. Daya tukar Mg = 0,4-1,0 me/100 gram. Perbandingan daya tukar Mg dan K berada pada batas normal.
Jenis Tanaman Kelapa Sawit
Tanaman kelapa sawit memiliki berbagai jenis varietas. Vaughan (1970) membagi jenis kelapa sawit tersebut dalam beberapa macam, yaitu: (1) varietas
Macrocarya dengan ketebalan cangkang 40 – 60 %, (2) varietas Dura dengan ketebalan cangkang 20 – 40 %, (3) varietas Tenera dengan ketebalan cangkang antara 5 – 20 %, dan (4) varietas Pisifera dengan cangkang tipis. Menurut Pahan (2008) varietas Tenera lebih disukai untuk penanaman komersial karena kandungan minyak di dalam mesocarp-nya lebih tinggi daripada Dura. Varietas
Macrocarya akhir-akhir ini sudah tidak dipakai lagi karena tidak memiliki sifat genetik yang signifikan.
Jenis tanaman kelapa sawit juga dapat dibedakan dari warna buah. Varietas yang dibedakan dari warna buah (Lubis, 2008) antara lain:
1. Nigrescens, yaitu buahnya berwarna violet sampai hitam waktu muda dan menjadi merah-kuning (orange) setelah matang.
2. Virescens, yaitu buahnya berwarna hijau waktu muda dan setelah matang berwarna merah kuning (orange).
3. Albescens, yaitu buahnya muda berwarna kuning pucat dan tembus cahaya karena mengandung sedikit karoten.
Benih Kelapa Sawit
Morfologi Benih
a. Cangkang adalah bagian yang keras dan berwarna hitam yang mengelilingi inti (kernel).
b. Inti (kernel) adalah bagian berwarna putih keabu-abuan dan mengandung minyak.
c. Embrio adalah bagian yang berwarna putih berukuran ± 3 mm, berada di dalam inti dekat lubang kecambah (germ pore).
Gambar 3. Struktur Buah Kelapa Sawit (Corley dan Tinker, 2003)
Pada umumnya benih kelapa sawit terdiri dari hanya satu kernel saja, karena dua dari tiga ovul dalam ovary tricarpellate benih biasanya tidak berkembang (abort). Kadang-kadang pada benih dengan ovary yang abnormal dapat terdiri dari 4-5 kernel, tetapi hal ini jarang ditemui (Gambar 4).
Gambar 4. Buah Kelapa Sawit yang Memiliki (A) Satu Kernel, (B) Dua Kernel, dan (C) Tiga Kernel
Ukuran benih kelapa sawit bermacam-macam, tergantung ketebalan cangkang dan ukuran kernelnya. Untuk tipe Dura afrika, benih mempunyai panjang 2-3 cm dan mempunyai rata-rata berat 4 gram. Benih untuk tipe Deli Dura mempunyai berat 5-6 gram hingga mencapai 13 gram. Benih Tenera biasanya mempunyai panjang ± 2 cm dan berat 2 gram, tetapi benih dengan berat ± 1 gram tidaklah umum.
C
Struktur benih dan kecambah kelapa sawit dapat dilihat pada Gambar 5. Pada bagian cangkang (Gambar 5B), terdapat serat (fibre) yang melekat secara membujur. Cangkang memiliki tiga buah lubang kecambah yang berhubungan dengan tiga bagian dari ovary tricarpelate. Setiap lubang kecambah yang berfungsi secara normal berhubungan dengan kernel yang berkembang baik. Pada setiap lubang kecambah terdapat sebuah fiber plug yang menutup lubang kecambah (Gambar 5B). Fiber plug ini melekat dengan lubang kecambah dan pemukaan cangkang bagian dalam sampai pada bagian testa, membentuk struktur seperti plate (Hussey dalam Corley dan Tinker, 2003).
Keterangan :
(A) tampilan benih yang dipotong membujur, (B) benih yang baru berkecambah, (C) tampilan bagian tengah embrio yang dipotong membujur, (D, E, F, G) tahapan pertumbuhan secara berurutan pada benih yang baru berkecambah, (H) tumbuh
adventitious root pada kecambah, (I) kecambah yang telah berumur 4 minggu, (J)
tampilan pada benih untuk memperlihatkan bagian haustorium, (c) cap of testa, (e) embrio, (en) endosperma, (f) fibre plug, (g) germ pore (lubang kecambah), (h) haustorium, (l): ligule, (p) petiole, (pl) plumula, (r) radikula, (r’) adventitious root, (s) cangkang (shell), (I–III) plumular leaves.
Bagian kernel berada di dalam cangkang (Gambar 5A dan 5B). Kernel terdiri dari lapisan-lapisan endosperma yang berminyak dan keras, berwarna putih keabu-abuan dikelilingi oleh testa yang berwarna coklat gelap dengan jaringan penghubung berupa serat (with a network of fibres). Di dalam endosperma terdapat embrio (Gambar 5C dan 5e). Letak embrio pada endosperma berhadapan dengan germ pore, jaraknya ± 3 mm. Embrio bagian ujung distal berhadapan dengan lubang kecambah tetapi terpisah oleh lapisan tipis endosperma. Testa dan struktur seperti plate berhubungan hingga kepermukaan benih. Ke tiga struktur ini secara bersamaan disebut operculum (Gambar 5A).
Proses Perkecambahan Benih hingga Menjadi Bibit
Pada dinding embrio, terdapat daerah yang membelah secara membujur. Saat terjadi perkecambahan, bagian pada embrio ini akan terpisah oleh desakan kecil dari kotiledon yang akan berkembang hingga ke haustorium. Endosperma yang berada di atas embrio akan ikut terpisah. Bagian yang terpisah ini berbentuk lingkaran dengan ukuran yang kecil, terlihat seperti disc. Disc yang terdiri dari endosperma, testa dan germ pore plate akan menekan fibre plug yang menutup lubang kecambah.
Proses perkecambahan dijelaskan oleh Gambar 5 dan 6. Embrio yang muncul berbentuk seperti sebuah tombol kecil (button) yang biasanya disebut hipokotil (dipertimbangkan oleh Hendry untuk mewakili petiol dari kotiledon) (Hendry dalam Corley dan Tinker, 2003). Plumula dan radikula keduanya muncul berbentuk silinder, dengan ligule yang terdapat diantaranya yang menutup lubang kecambah. Pada bagian dalam benih, houstorium juga terus berkembang. Houstorium berwarna kekuning-kuningan dan menjalar sepanjang poros benih, hingga memberikan permukaan yang lebih luas untuk absopsi endosperma. Sampai 3 bulan setelah perkecambahan dimulai, bagian yang menyerupai spons pada haustorium bisa menyerap cadangan makanan pada endosperma dan mengisi penuh ruangan yang ada di dalam benih (Anon dalam Corley dan Tinker, 2003).
sebagai sumber makanan sebelum ia menggunakan lemak (Alang et al. dalam Corley dan Tinker, 2003). Bibit menggunakan sebanyak 80% lemak dalam endosperma selama 3 bulan setelah perkcambahan dan 98% setelah 5 bulan. Sebagian lemak yang ada digunakan untuk respirasi, dan berat total dari benih hingga menjadi bibit turun 20% setelah 3 minggu benih berkecambah (Boatman dan Crombie dalam Corley dan Tinker, 2003). Indeks luas daun pada pre nursery secara signifikan berbanding lurus dengan berat kernel. Hal ini menunjukkan pentingnya cadangan makanan dalam kernel pada pertumbuhan tahap awal bibit, tetapi setelah 6 bulan di main nursery pengaruh yang ditunjukkan tidak signifikan (Tan dan Hardon dalam Corley dan Tinker, 2003).
Keterangan :
Gambar di atas memperlihatkan bagian ujung distal embrio yang diwakili oleh endosperma dan testa dengan warna yang gelap. Catatan, endosperma terdapat hingga ke bagian atas embrio. Bagian endosperma yang terpisah akan terdapat pada bagian kecil yang berada di sudut.
Gambar 6. Bagian kernel benih tenera yang dipotong secara melintang (Hussey dalam Corley dan Tinker, 2003)
Hormon yang berpengaruh terhadap pemanjangan plumula dan radikula adalah hormon auksin (Indole-3 acetic acid). Pada akar, auksin disintesis pada pangkal jaringan meristem apikal yang kemudian didistribusikan ke tudung akar melalui stele. Setelah itu auksin didistribusikan kembali ke bagian terbawah dari tudung akar. Hal ini menyebabkan akar cenderung berkembang ke bawah (Copeland dan Mc Donald, 1985).
Bibit yang telah berumur 2 bulan dapat dilihat pada Gambar 7. Dua pelepah dauh dari plumula akan terbentuk sebelum daun hijau muncul. Daun hijau ini disebut daun bendera (lamina) yang akan muncul setelah ± 1 bulan setelah perkecambahan, setelah itu satu daun akan muncul setiap bulannya sampai bibit berumur 6 bulan. Setelah daun pertama berkembang, dimulailah kegiatan fotosintesis oleh bibit dan bobot dari bibit mulai bertambah. Pemindahan bibit selama 7 minggu pertama akan mengurangi pertumbuhan rata-rata indeks area daun (Corley dalam Corley dan Tinker, 2003). Setelah tahap ini, setiap minggunya berat dari endosperma akan berkurang. Berkurangnya berat pada endosperma ini lebih besar dari pada pertambahan berat bibit. Segera setelah daun pertama berkembang secara penuh, kontribusi dari fotosintesis mulai melebihi kehilangan yang disebabkan oleh respirasi. Pemindahan setelah tahap ini tidak memberikan efek yang berpengaruh nyata pada bibit, hal ini menunjukkan bahwa bibit tidak lagi bergantung pada cadangan makanan di endosperma.
Keterangan :
(SL) permukaan tanah (soil level); (S) cangkang (shell), (Co) kotiledon (haustorium); (P) plumula; (R) radikula,( Pr) akar primer, (Ad) akar adventif
Keterangan :
Perhatikan bagian seperti cekungan yang berisi meristem apikal dan daun muda yang masih belum memanjang. Penebalan meristem primer terletak tepat di atas skala indikator 5 cm.
Gambar 8. Irisan melintang bagian tengah apeks pada kelapa sawit yang masih muda (Rees dalam Corley dan Tinker, 2003).
Dormansi Benih
Sadjad (1993) menyatakan bahwa dormansi benih adalah keadaan benih yang mengalami istirahat total sehingga meskipun dalam keadaan media tumbuh benih optimum, benih tidak menunjukkan gejala atau fenomena hidup. Menurut Sutopo (2002), benih dikatakan dorman apabila benih tersebut sebenarnya hidup tetapi tidak berkecambah walaupun diletakkan pada keadaan yang secara umum dianggap telah memenuhi syarat bagi suatu perkecambahan.
Ada dua tipe dormansi benih, yaitu dormansi primer dan dormansi sekunder. Dormansi primer ada dua jenis, yaitu:
1. Dormansi eksogeneous, yaitu kegagalan perkecambahan yang disebabkan oleh tidak tersedianya komponen penting perkecambahan. Tipe dormansi ini berhubungan dengan sifat fisik kulit benih dan faktor lingkungan selama perkecambahan.
Dormansi primer adalah jenis dormansi pada benih yang sering terjadi. Tipe dormansi lainnya adalah dormansi sekunder yang terjadi karena dihilangkannya satu atau lebih faktor penting perkecambahan (Copeland , 1980).
Di alam, dormansi benih dipatahkan secara perlahan-lahan atau pada suatu kejadian lingkungan yang khas. Tipe dari kejadian lingkungan yang dapat mematahkan dormansi benih tergantung pada tipe dormansi benih itu sendiri. Secara alami, dibutuhkan waktu ± 1 tahun agar benih kelapa sawit dapat berkecambahan dengan persentase daya berkecambah yang rendah (± 40 %) (Brahmana dan Chairani, 1997).
Benih yang dorman dapat menguntungkan atau merugikan dalam penanganan benih. Keuntungan benih yang dorman adalah dapat mencegah agar benih tidak berkecambah selama penyimpanan. Di sisi lain, kerugian dari dormansi benih adalah apabila tipe dormansi yang terjadi termasuk tipe yang sulit untuk pematahan dormansinya, maka benih membutuhkan perlakuan awal yang khusus. Kegagalan dalam mengatasi masalah ini dapat mengakibatkan kegagalan perkecambahan. Dengan diterapkannya teknik perkecambahan dengan fermentasi, pemanasan, dan perendaman, proses perkecambahan benih kelapa sawit hanya menjadi ± 4 bulan dengan persentase daya berkecambah mencapai 75-80 % (Brahmana dan Chairani, 1997).
Menurut Copeland (1980), dormansi eksogeneous yang diakibatkan oleh struktur fisik kulit benih terjadi karena:
a. Impermeabilitas kulit benih terhadap air dan udara.
Benih-benih yang menunjukkan tipe dormansi ini disebut benih keras. Selain pada kelapa sawit, contoh lainnya seperti pada tumbuhan famili
Leguminoceae. Imbibisi air pada benih tumbuhan famili Leguminoceae terhalang kulit biji yang mempunyai struktur terdiri dari lapisan sel-sel berupa palisade yang berdinding tebal, terutama dipermukaan paling luar dan bagian dalamnya mempunyai lapisan lilin.
b. Resistensi mekanis kulit benih terhadap pertumbuhan embrio.
segera. Pada tipe dormansi ini juga didapati tipe kulit biji yang bisa dilalui oleh air dan oksigen, tetapi perkembangan embrio terhalang oleh kekuatan mekanis dari kulit biji tersebut. Hambatan mekanis terhadap pertumbuhan embrio dapat diatasi dengan cara mengekstrasi benih dari pericarp atau kulit benih.
c. Adanya zat penghambat.
Sejumlah jenis tanaman mengandung zat-zat penghambat dalam buah atau benih yang mencegah perkecambahan. Zat penghambat paling sering dijumpai di dalam daging buah, untuk itu benih tersebut harus diekstrasi dan dicuci untuk menghilangkan zat-zat penghambat.
Pematahan Dormansi Benih
Berbagai macam metode telah dikembangkan untuk mengatasi tipe dormansi yang diakibatkan oleh struktur kulit benih. Semua metode menggunakan perinsip yang sama, yakni bagaimana caranya agar air dan udara dapat masuk sehingga benih dapat berkecambah. Berbagai teknik untuk mematahkan dormansi fisik antara lain seperti:
a. Perlakuan mekanis (skarifikasi)
Perlakuan mekanis (skarifikasi) pada kulit benih dilakukan dengan cara penusukan, pengoresan, pemecahan, pengikiran atau pembakaran dengan bantuan pisau, jarum, kikir, atau kertas gosok. Cara ini efektif untuk mengatasi dormansi fisik, karena setiap benih ditangani secara manual sehingga dapat memberikan perlakuan kepada individu sesuai dengan ketebalan kulit benih. Pada hakekatnya semua benih dibuat permeabel dengan resiko kerusakan yang kecil (Schmidt, 2002). Seluruh permukaan kulit benih dapat dijadikan titik penyerapan air.
b. Air Panas
Menurut Schmidt (2002) air panas dapat mematahkan dormansi fisik pada
leguminosae melalui tegangan yang menyebabkan pecahnya lapisan
macrosclereids. Metode ini paling efektif bila benih direndam dengan air panas. Pencelupan sesaat juga lebih baik untuk mencegah kerusakan pada embrio karena bila dilakukan perendaman yang lama, panas yang diteruskan kedalam embrio dapat menyebabkan kerusakan. Suhu tinggi dapat merusak benih yang kulitnya tipis. Kepekaan terhadap suhu bervariasi pada tiap jenis benih, umumnya benih kering yang masak atau benih dengan kulit biji yang relatif tebal toleran terhadap perendaman sesaat dalam air mendidih.
c. Perlakuan kimia
Perlakuan kimia dengan bahan-bahan kimia sering dilakukan untuk memecahkan dormansi pada benih. Tujuan utamanya adalah menjadikan agar kulit biji lebih mudah dimasuki oleh air pada waktu proses imbibisi. Penggunaan larutan asam kuat seperti asam sulfat dengan konsentrasi pekat juga terbukti dapat membuat kulit benih menjadi lunak sehingga dapat dilalui air dengan mudah. Larutan asam untuk perlakuan ini adalah asam sulfat pekat (H2SO4) yang dapat menyebabkan kerusakan pada kulit biji. Metode ini dapat diterapkan pada legum dan non-legum (Copeland, 1980). Metode ini tidak sesuai untuk benih yang mudah sekali menjadi permeabel karena asam akan merusak embrio. Lamanya perlakuan larutan asam harus memperhatikan dua hal, yaitu : (1) kulit biji atau pericarp yang dapat diretakkan untuk memungkinkan imbibisi, (2) larutan asam tidak mengenai embrio.
Struktur Dinding Sel Tanaman
Lignoselulosa terdiri dari selulosa, hemiselulosa, lignin dan beberapa bahan ekstraktif lain. Semua komponen lignoselulosa terdapat pada dinding sel tanaman. Dinding sel tanaman muda terdiri dari selulosa, hemiselulosa dan pektin. Seiring dengan perkembangannya lignin menjadi bagian dari dinding sel. Lignin berikatan dengan hemiselulosa dan senyawa fenol lainnya melalui ikatan kovalen, tetapi ikatan yang terjadi antara selulosa dengan lignin belum diketahui secara lengkap. Struktur berkristal serta adanya lignin dan hemiselulosa disekeliling selulosa merupakan hambatan utama dalam menghidrolisis selulosa. Kristalisasi selulosa dan pengerasan fibril selulosa oleh lignin membentuk suatu senyawa lignoselulosa yang keras (Lynd et al., 2002).
Selulosa dan hemiselulosa pada lignoselulosa tidak dapat dihidrolisis oleh enzim selulase dan hemiselulase kecuali lignin yang ada pada substrat dilarutkan, dihilangkan atau dikembangkan terlebih dahulu. Lignin merupakan senyawa yang heterogen dengan berbagai tipe ikatan sehingga tidak dapat diuraikan oleh enzim hidrolisis (Hofrichter, 2002). Menurut Aurora et al., (1992), lignin yang merupakan salah satu komponen dari lignoselulosa dapat didegradasi oleh Jamur Pelapuk Putih atau Phanerochaete chrysosporium yang dapat memproduksi ligninase.
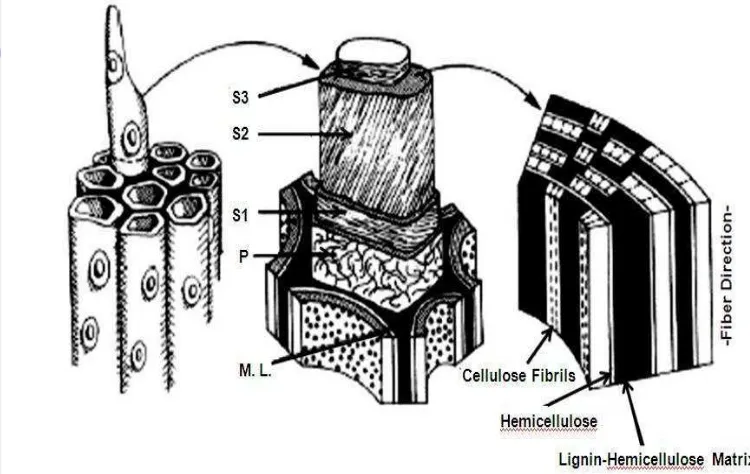
Susunan dinding sel tanaman (Gambar 9) terdiri dari lamella tengah (M), dinding primer (P) serta dinding sekunder (S) yang terbentuk selama pertumbuhan dan pendewasaan sel yang terdiri dari lamela transisi (S1), dinding sekunder utama (S2), dan dinding sekunder bagian dalam (S3). Dinding primer mempunyai ketebalam 0.1-0.2 μm dan mengandung jaringan mikrofibril selulosa yang mengelilingi dinding sekunder yang relatif lebih tebal (Chahal dan Chahal 1998). Selulosa pada setiap lapisan dinding sekunder terbentuk sebagai lembaran tipis
yang tersusun oleh rantai panjang residu β-D-glukopiranosa yang berikatan
Mikrofibril dikelilingi oleh hemiselulosa dan lignin. Bagian antara dua dinding sel disebut lamela tengan (M) dan diisi dengan hemiselulosa dan lignin. Hemiselulosa dihubungkan oleh ikatan kovalen dengan lignin. Selulosa secara alami terproteksi dari degradasi dengan adanya hemiselulosa dan lignin.
Gambar 9. Konfigurasi Dinding Sel Tanaman (Lynd et al., 2002) Selulosa
Selulosa merupakan komponen utama penyusun dinding sel tanaman. Kandungan selulosa pada dinding sel tanaman tingkat tinggi sekitar 35-50 % dari berat kering tanaman (Lynd et al., 2002). Selulosa merupakan polimer glukosa
dengan ikatan β-1,4 glukosida dalam rantai lurus. Bangun dasar selulosa berupa suatu selobiosa yaitu dimer dari glukosa. Rantai panjang selulosa terhubung
secara bersama melalui ikatan hidrogen dan gaya van der Waals (Perez et al., 2002). Selulosa mengandung sekitar 50-90 % bagian berkristal dan
Hemiselulosa
Hemiselulosa merupakan kelompok polisakarida heterogen dengan berat molekul rendah. Jumlah hemiselulosa biasanya antara 15-30 % dari berat kering bahan lignoselulosa. Hemiselulosa relatif lebih mudah dihidrolisis dengan asam menjadi monomer yang mengandung glukosa, mannosa, galaktosa, xilosa dan arabinosa. Hemiselulosa mengikat lembaran serat selulosa membentuk mikrofibril yang meningkatkan stabilitas dinding sel. Hemiselulosa juga berikatan silang dengan lignin membentuk jaringan kompleks dan memberikan struktur yang kuat (Perez et al., 2002).
Lignin
Lignin merupakan polimer dengan struktur aromatik yang terbentuk melalui unit-unit penilpropan yang berhubungan secara bersama oleh beberapa jenis ikatan yang berbeda (Perez et al., 2002). Lignin sulit didegradasi karena strukturnya yang kompleks dan heterogen yang berikatan dengan selulosa dan hemiselulosa dalam jaringan tanaman. Lebih dari 30% tanaman tersusun atas lignin yang memberikan bentuk yang kokoh dan memberikan proteksi terhadap serangga dan patogen (Orth, Royse dan Tien, 1993). Disamping memberikan bentuk yang kokoh terhadap tanaman, lignin juga membentuk ikatan yang kuat dengan polisakarida yang melindungi polisakarida dari degradasi mikroba dan membentuk struktur lignoselulosa. Lignin tidak hanya mengeraskan mikrofibril selulosa, tetapi juga berikatan secara fisik dan kimia dengan hemiselulosa. Lignin terbentuk melalui polimerasi tiga dimensi derivate dari sinamil alkohol terutama
ρ-kumaril, koniferil dan sinafil alkohol (Perez et al., 2002). Lignin yang melindungi selulosa bersifat tahan terhadap hidrolisis karena adanya ikatan arilalkil dan ikatan eter.
Enzim Ligninase dan Selulase
Enzim Ligninase
Ligninase secara umum terdiri dari dua kelompok utama yaitu laccase
(Lac) dan peroksidase (Perez et al., 2002) yang terdiri dari lignin peroksidase (LiP) dan manganese peroksidase (MnP) (Chahal dan Chahal, 1998). Lignin Peroksidase (EC 1.11.1.14, LiP, ligninase) atau LiP adalah enzim peroksidase ekstraseluler yang mengandung heme yang aktivitasnya bergantung pada H2O2, mempunyai potensial redoks yang luar biasa besar dan pH optimum yang rendah (Gold dan Alic, 1993). LiP mengoksidasi inti aromatik (fenolik dan non-fenolik) menghasilkan radikal kation dan fenoksil melalui pelepasan satu elektron (Akhtar, Blanchette dan Kirk, 1997).
Manganese peroksidase (EC 1.11.1.13, MnP) atau MnP merupakan heme
peroksidase ekstraseluler yang membutuhkan Mn2+ sebagai substrat pereduksinya. MnP mengoksidasi Mn2+ menjadi Mn3+, yang kemudian mengoksidasi struktur fenolik menjadi radikal fenoksil. Mn3+ yang terbentuk sangat reaktif dan membentuk kompleks dengan mengkelat asam organik seperti asam oksalat atau malat (Cui dan Dolphin, 1990; Kishi et al., 1994). Radikal fenoksil yang dihasilkan lebih lanjut bereaksi yang pada akhirnya melepaskan CO2. Ilustrasi reaksi ini dapat dilihat pada Gambar 10. MnP merupakan salah satu peroksida pendegradasi lignin yang dihasilkan oleh beberapa kapang pelapuk kayu dan pengurai serasah. Enzim ekstraseluler ini biasanya mempunyai berat 40-50 Kda dan aktif berkisar pada pH antara 3-4 (Hofrichter, 2002).
Laccase (EC 1.10.3.2, benzenediol:oxygen oxidoreductase) merupakan fenol oksidasi yang mengandung tembaga yang tidak membutuhkan H2O2 tetapi menggunakan molekul oksigen (Thurston, 1994). Laccase mereduksi O2 menjadi H2O dalam substrat fenolik melalui reaksi melepas esatu elektron membentuk radikal bebas yang dapat disamakan dengan radikal kation yang terbentuk pada reaksi MnP (Kersten et al., 1990). Dengan adanya mediator seperti ABTS (2,2- azinobis(3-ethylbenzthiazoline-6-sulphonate)) atau HBT (hydroxybenzo triazole),
Gambar 10. Skema Pembentukan Karbon Diokasida dari Struktur Aromatik Lignin oleh MnP (Hofrichter, 2002) Enzim Selulase
Enzim selulase adalah enzim yang dapat mendegradasi selulosa. Umumnya enzim hanya aktif pada kisaran pH yang terbatas, pH optimum aktivitas enzim selulase berkiasar pada pH 4.5 – 6.5. Enzim selulase terdiri dari tiga kelompok utama yaitu (a) endoglucanases atau 1,4-β -D-glucan-4-glucanohydrolases (EC 3.2.1.4); (b) exoglucanases, yang meliputi 1,4-β-D-glucan glucanohydrolases atau cellodextrinases (EC 3.2.1.74) dan 1,4-β-D-glucan cellobiohydrolases atau cellobiohydrolases (EC 3.2.1.91) dan (c) β-glucosidases
atau β- glucoside glucohydrolases (EC 3.2.1.21) (Lymar et al., 1995; Lynd et al., 2002; Perez et al., 2002; Howard et al., 2003).
Mekanisme kerja enzim selulase dimulai dari kerja enzim endoglucanases
yang menghidrolisis secara acak bagian amorf serat selulosa (Howard et al., 2003) menghasilkan oligosakarida dengan panjang yang berbeda dan terbentuknya unjung rantai baru (Lynd et al., 2002). Enzim Exoglucanases bekerja terhadap ujung pereduksi dan non-pereduksi rantai polisakarida selulosa dan membebaskan glukosa yang dilakukan oleh enzim glucanohydrolases dan cellobiohydrolases
(Lynd et al., 2002). Hidrolisis bagian berkristal selulosa hanya dapat dilakukan secara efiesien oleh enzim exoglucanases (Perez et al., 2002; Lynd et al., 2002). Hasil kerja sinergis endoglucanases dan exoglucanases menghasilkan molekul selobiosa. Hidrolisis selulosa secara efektif memerlukan enzim β-glucosidases
Gambar 11. Skema Hidrolisis Selulosa Menjadi Glukosa (Lynd et al., 2002)
Menurut Enari (1983), dalam proses hidrolisis selulosa terdapat tiga macam enzim selulase yang terlibat, yaitu cellobiohydrolases, endoglucanases
dan β-glucosidases. Enzim-enzim ini merupakan enzim hidrolitik yang bekerja secara bertahap atau bersamaan. Menurut Montenecourt dan Eveleigh (1979),
endoglucanases merupakan pembatas bagi aktivitas enzim selulase. Mekanisme kerja enzim selulase yang terjadi adalah sebagai berikut :
1. Enzim endoglucanases menyerang bagian yang amorf dari serat selulosa sehingga membuka jalan bagi enzim cellobiohydrolases.
2. Enzim cellobiohydrolases membebaskan unit selobiosa dari ujung-ujung non-reduksi rantai selulosa.
3. Kerjasama di antara ke dua enzim tersebut, disebabkan karena substrat baru dari cellobiohydrolases terbentuk akibat kerja enzim endoglucanases.
4.
Enzim β-glucosidases menghidrolisis selooligosakarida dan selobiosaBAHAN DAN METODE
Tempat dan Waktu
Kegiatan penelitian dilaksanakan di PPKS Marihat, Pematang Siantar, Sumatera Utara. Penelitian dilakukan selama 5 bulan, dimulai tanggal 1 Maret hingga 24 Juli 2010.
Bahan dan Alat
Bahan yang digunakan adalah ekstrak kasar enzim ligninase dan selulase yang diperoleh dari Laboratorium Mikrobiologi, Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumberdaya Genetik Pertanian, Bogor. Benih kelapa sawit DxP varietas Langkat dan Yangambi yang diperoleh dari PPKS. Tabel data benih dapat dilihat pada Lampiran 1. Selain itu, juga digunakan fungisida (Dithane M-45), sterofom, label plastik, plastik PE, polibag (14x22 cm),
top soil, dan insektisida. Alat yang digunakan adalah gelas ukur, jaring plastik (30x15 cm), tali, aerator, wadah plastik (30x25 cm), bak perendaman, ember, rak pengering, heater ruangan, kipas angin, tray plastik, mikroskop dan alat-alat tulis.
Metode Percobaan
Percobaan ini disusun menggunakan rancangan kelompok lengkap teracak (RKLT) dengan dua faktor. Faktor pertama adalah varietas benih yaitu Langkat (V1) dan Yangambi (V2). Faktor ke dua adalah aplikasi enzim dengan 5 teknik aplikasi, yaitu :
P0 : (P60A3) Kontrol
Pemanasan selama 60 hari, perendaman dengan air (3 hari) P1 : (P40A3Lg1Sl2)
Pemanasan selama 40 hari, perendaman dengan air (3 hari), perendaman dengan enzim ligninase (1 hari) dan perendaman dengan enzim selulase (2 hari)
P2 : (P40Lg1Sl2A3)
Pemanasan selama 40 hari, perendaman dengan enzim ligninase (1 hari), perendaman dengan enzim selulase (2 hari) dan perendaman dengan air (3 hari). P3 : (P40LgSl3A3)
P4 : (P50LgSl10A3)
Pemanasan selama 50 hari, perendaman dengan campuran 1:1 enzim ligninase dan selulase (10 hari), perendaman dengan air (3 hari).
Model linear dari RKLT yang digunakan adalah: Yij = µ + τi + ßJ + εij Keterangan:
i = 1, 2, 3, 4, 5, 6 j = 1, 2, 3
Yij = pengamatan pada perlakuan ke-i dan kelompok ke-j µ = rataan umum
τi = pengaruh perlakuan ke-i ßJ = pengaruh kelompok ke-j
εij = pengaruh acak pada perlakuan ke-i dan kelompok ke-j
Metode analisis yang digunakan adalah analisis ragam yang dilanjutkan dengan uji lanjut Duncan Multipel Range Test (DMRT) pada taraf 5 %.
Pelaksanaan Percobaan
Skema pelaksanaan percobaan dapat dilihat pada Gambar 12. Perendaman 1
Benih dari ruang penyimpanan yang masih dalam plastik dipindah ke dalam jaring untuk kemudian direndam dengan air yang mengalir. Perendaman dilakukan di dalam bak perendaman selama 7 hari (Gambar 13). Di dalam bak perendaman diberi udara dengan aerator yang bertujuan memberikan udara untuk menghindari kondisi anaerob pada benih.
Penganginan 1
Gambar 13. Perendaman I Di Dalam Bak Perendaman
Gambar 14. Penganginan Benih Di Rak Pengeringan
Gambar 15. Perendaman Benih dengan Larutan Fungisida 0.2%
Untuk memastikan kadar air (KA) benih maka dilakukan penghitungan KA yang prosedurnya adalah sebagai berikut :
1. Ambil sampel acak sebanyak 10 benih dari tiap persilangan, yang diambil adalah nomor genap dari jumlah seluruh persilangan (contoh, dari 129 persilangan diambil nomor 1, 10, 20,..120).
2. Timbang wadah (berat A). 3. Timbang wadah+benih (berat B). 4. Masukkan ke oven (48 jam, 105oC) 5. Timbang berat kering benih (berat C)
Pemanasan benih
Setelah dianginkan, proses selanjutnya benih dimasukkan ke dalam ruang pemanas selama 40, 50 dan 60 hari tergantung pada perlakuan percobaan yang diaplikasikan. Benih yang akan dimasukkan ke ruang pemanas terlebih dahulu dimasukkan ke tray plastik berukuran 57.5 cm x 39 cm x 7 cm (Gambar 16A).
Suhu diruang pemanas dikontrol agar suhu tetap antara 38-40oC dengan mengunakan heater dan kipas angin agar panas di ruang pemanas menyebar merata ke seluruh ruangan. Proses pemanasan ini bertujuan untuk mematahkan dormansi benih kelapa sawit dan mempercepat perkecambahan (Corley dan
Tinker, 2003; Kim dan Luan, 1977; Kushairi dan Rajanaidu, 2000). Selain itu, pemanasan juga dilakukan untuk memperkecil serangan cendawan. Menurut Sukarman dan Hasanah (2003) selain kadar air benih, suhu penyimpanan juga berpengaruh terhadap perkembangan cendawan gudang. Selama benih diruang pemanas, setiap seminggu sekali tray plastik dikeluarkan dari ruang pemanas dan dibuka yang bertujuan untuk aerasi benih selama 3-5 menit dan menyortir benih-benih yang terkena cendawan (Gambar 16B).
Gambar 16. Pemanasan Benih Dalam Tray Palstik Di Ruang Pemanas Perendaman 2
Setelah proses penyimpanan benih di ruang pemanas, benih pada tray plastik tersebut dimasukkan ke dalam jaring untuk dilakukan perendaman 2. Proses perendaman 2 sama dengan perendaman 1, tetapi pada perendaman 2 ini perendaman benih disesuaikan dengan perlakuan percobaan yang diaplikasikan.
Perendaman benih dalam air mengalir dilakukan di bak perendaman, sedangkan perendaman benih dengan aplikasi enzim ligninase dan selulase dilakukan pada wadah plastik yang dipasang aerator yang berfungsi untuk memberikan oksigen supaya terhindar dari kondisi anaerob dan agar enzim terus
mengalir di dalam wadah (Gambar 17 dan 18). Kebutuhan pengunaan enzim dapat dilihat pada Lampiran 2.
Keterangan :
(A) Wadah Plastik (B) Aerator (C) Bjenih
Gambar 17. Alat dan Bahan yang digunakan pada Tahap Aplikasi Enzim
Gambar 18. Perendaman Benih dengan Enzim Ligninase dan Selulase Penganginan 2
Proses penganginan ke-II sama dengan proses penganginan 1. Setelah diangkat dari perendaman, benih direndam pada larutan fugisida selama 3 menit. Kemudian, benih dianginkan pada rak-rak penganginan selama 3-4 jam sampai benih mencapai kadar air 22-23%. Untuk memastikan KA benih, maka dilakukan lagi penghitungan KA. Lama pengeringan tergantung pada jumlah benih yang dikeringkan di rak pengeringan. Pada kelompok benih yang diaplikasikan perlakuan perendaman dengan enzim, tidak dilakukan perendaman ke dalam fungisida. Hal ini tidak dilakukan karena dikhawatirkan fungisida akan mempengaruhi kerja enzim yang telah meresap ke dalam cangkang benih. Perendaman pada larutan fungisida baru dilakukan setelah benih dikecambahkan selama 1 minggu.
A
B
C
Pengecambahan Benih
Benih dari rak pengeringan dimasukkkan ke dalam tray plastik yang kemudian dikirim ke ruang perkecambahan (Gambar 19). Ruang perkecambahan memiliki suhu yang dipertahankan antara 28-32oC dengan RH 63-64%. Jumlah benih setiap perlakuan adalah 100 butir, sehingga total digunakan 3 000 benih. Sebelum benih dipindah ke tray plastik, tiap tray untuk yang digunakan untuk percobaan dibagi dengan disekat menggunakan sterofom (Gambar 20).
Sebelum benih dipindah ke tray plastik, tiap tray untuk yang digunakan untuk percobaan dibagi dengan disekat menggunakan sterofom. Tray yang berukuran 57.5 cm x 39 cm x 7 cm dibagi menjadi 8-10 bagian (Gambar 19). Pembagian tray yang berbeda menjadi 8-10 bagian disesuaikan dengan volume 100 benih agar benih yang dikecambahkan tidak cepat keringUntuk menjaga kebersihan dan kelembapan benih agar tetap memiliki kadar KA 22-23%, dilakukan pengamatan setiap hari (kecuali hari Minggu) dan penggantian tray plastik setiap 5 hari. Pengamatan dilakukan untuk mengetahui keadaan benih. Bila benih kering, optimalisasi dilakukan dengan menyemprot benih dalam tray plastik menggunakan larutan fungisida (dithane M-45) 0.1% dan benih yang terserang cendawan dicatat jumlahnya kemudian diafkir.
Gambar 19. Pengecambahan Benih Di Ruang Perkecambahan
Pengamatan
Pengamatan dilakukan terhadap: 1) Daya Berkecambah (DB), 2) Potensi Tumbuh Maksimum (PTM), 3) Kecepatan Tumbuh (KCT), 4) Indeks Dormansi (ID), dan 5) Keragaan Tumbuh Bibit.
Pengamatan DB, PTM, KCT dan ID dilakukan 5 hari sekali. Pengamatan pertama dilakukan pada hari ke-5 setelah benih dimasukkan ke dalam ruang kecambah sampai hari ke-45. Pengamatan ini dilakukan untuk memisahkan kecambah normal, abnormal dan terserang cendawan. Kecambah (Gambar 21) diseleksi berdasarkan standar kecambah normal PPKS (Lubis, 1993), yaitu:
1. Kecambah tumbuh sempurna dan secara jelas dapat dibedakan antara radikula dan plumula
2. Plumula dan radikula tumbuh berlawanan arah 3. Panjang antara plumula dengan radikula 0.5 – 2 cm
4. Kecambah segar, tidak patah atau cacat dan tidak terserang cendawan
Dalam setiap penyeleksian kecambah, benih yang sudah berkecambah dan termasuk ke dalam kriteria kecambah normal dikelurkan dan ditaruh ke dalam tempat penyimpanan. Benih abnormal dan benih yang terserang cendawan dicatat jumlahnya dan diafkir. Hal ini dilakukan untuk optimalisasi media tumbuh benih. Benih yang belum berkecambah atau benih yang sudah berkecambah tetapi belum termasuk sebagai kecambah normal dimasukkan lagi ke dalam tray plastik dan disemprot dengan larutan fungisida (dithane M-45) 0.1 %. Tray plastik yang berisi benih yang belum berkecambah tersebut dimasukkan lagi ke dalam ruang perkecambahan untuk dilakukan penyeleksian pada tahap seleksi selanjutnya.
A. Kecambah Normal B. Kecambah Abnormal Gambar 21. Kecambah Hasil Seleksi
Pembibitan Kecambah Normal Hasil Seleksi
Pembibitan dilakukan terhadap kecambah normal hasil seleksi percobaan untuk melihat pengaruh enzim (ligninase dan selulase) yang diaplikasikan (Gambar 22). Setiap ulangan perlakuan diambil 10 kecambah secara acak, sehingga total ada 300 kecambah yang dibibitkan. Pengamatan dilakukan terhadap keragaan tumbuh bibit untuk dilihat apakah ada ciri-ciri abnormal yang muncul. Bibit abnormal yang muncul dicatat ciri-cirinya dan dihitung jumlahnya.
Gambar 22. Pembibitan Kecambah Normal Hasil Seleksi
Pengamatan
1. Daya Berkecambah (DB)
Daya berkecambah diamati untuk mengidentifikasi viabilitas potensial benih. Daya berkecambah diukur dengan menghitung persentase total kecambah normal (KN) dari setiap pengamatan. Pengamatan daya berkecambah dilakukan setiap 5 hari sekali pada hari ke-5, ke-10, ke-15, ke- 20, ke-25, ke-30, ke-35, ke-40, dan ke-45 HSI.
Daya berkecambah benih dihitung dengan rumus: DB (%)=
2. Potensi Tumbuh Maksimum (PTM)
Potensi tumbuh maksimum (PTM) dilihat dari persentase total benih yang berkecambah sampai akhir pengamatan terhadap jumlah benih yang dikecambahkan. Pengamatan PTM ini digunakan untuk mengidentifikasi viabilitas total dari benih sawit yang diuji.
PTM =
3. Kecepatan Tumbuh (KCT)
Kecepatan tumbuh diamati untuk mengukur kekuatan vigor potensial benih. Kecepatan tumbuh diamati setiap 5 hari sekali pada hari ke-5, ke-10, ke-15, ke- 20, ke-25, ke-30, ke-35, ke-40, dan ke-45 HSI.
KCT benih dihitung dengan rumus: KCT =
Keterangan:
t = waktu pengamatan
N = persentase kecambah normal tiap waktu pengamatan tn = waktu akhir pengamatan
KCT = % KN/Etmal 4. Indeks Dormansi (ID)
Indeks dormansi (ID) benih adalah persentase benih yang tidak tumbuh sampai akhir pengamatan. Benih yang tidak tumbuh dalam perhitungan ID mencakup benih yang tidak tumbuh sampai akhir pengamatan dan benih yang terserang cendawan pada pengamatan sebelumnya.
ID =
5. Keragaan Tumbuh Bibit
HASIL DAN PEMBAHASAN
Berdasarkan hasil sidik ragam (Lampiran 3, 4, 5 dan 6) yang hasil rekapitulasinya dapat dilihat pada Tabel 1 menunjukkan bahwa faktor tunggal aplikasi enzim berpengaruh sangat nyata terhadap semua tolok ukur yang diamati yaitu DB, PTM, KCT, dan ID. Faktor tunggal varietas tidak berpengaruh nyata terhadap semua tolok ukur yang diamati. Interaksi aplikasi enzim dengan varietas menunjukkan pengaruh yang sangat nyata terhadap tolok ukur daya berkecambah (DB), potensi tumbuh maksimum (PTM), kecepatan tumbuh (KCT), dan indeks dormansi (ID).
Tabel 1. Rekapitulasi Hasil Sidik Ragam Pengaruh Aplikasi Enzim dan Varietas terhadap Perkecambahan Benih Kelapa Sawit
Parameter
Pengaruh
KK Aplikasi Enzim (E) Varietas (V) Interaksi
Tabel 2. Pengaruh Perlakuan Aplikasi Enzim dan Varietas terhadap Daya Berkecambah Benih
Perlakuan Varietas
Langkat Yangambi
……....…...…..%...
P0 70.3cd 39.0f
P1 59.3e 81.7a
P2 75.3abc 78.0ab
P3 72.3bc 80.7a
P4 64.7de 69.7cd
Keterangan: Angka yang diikuti huruf yang sama tidak berbeda nyata pada uji DMRT 5%
A. Benih varietas Yangambi dengan diameter rata-rata 18.44 mm. B. Benih varietas Langkat dengan diameter rata-rata 12.62 mm. Gambar 23. Benih Kelapa Sawit Varietas Yangambi dan Langkat
A. Benih varietas Yangambi B.Benih varietas Langkat
Gambar 24. Ketebalan Cangkang Benih Varietas Yangambi dan Langkat
Pada varietas langkat perlakuan P1 (P40A3Lg1Sl2) memiliki persentase DB paling rendah (54.7%) dikarenakan terdapat 10.3% kecambah yang terserang cendawan. Hal ini diduga karena pada perlakuan P1 sewaktu diruang perkecambahan, posisi tray plastik berada pada susunan tray yang paling atas dan tray plastik tidak tertutup rapat sehingga banyak inokulan dari cendawan yang masuk ke dalam tray. Tray plastik harus tertutup rapat karena benih kelapa sawit saat pengecambahan sangat rentan terhadap serangan cendawan karena kadar air benih dijaga antara 22-23%. Jika benih memiliki kadar air 5-17% maka tidak mungkin cendawan untuk berkembang pada benih tetapi jika benih memiliki kadar air lebih dari 17 maka benih rentan terserang cendawan. Selain itu juga didapat bahwa sebagian besar benih yang terserang cendawan adalah benih yang terdapat luka pada bagian cangkangnya, dan dari bagian cangkang yang terluka ini biasanya banyak ditemukan cendawan yang tumbuh. Infeksi cendawan kemungkinan dipicu oleh kadar air yang relatif tinggi dan benih yang kurang bersih. Selain itu, kondisi ruang stok dan lama penyimpanan benih sebelum proses perkecambahan adalah penting (Turner, 1981).
Pada varietas Yangambi, DB tertinggi didapat pada perlakuan P1, P2 dan P3. Perlakuan P1, P2 danP3 menghasilkan DB yang sama yaitu 78.0%-81.7% serta nyata lebih tinggi dibanding kontrol. Hasil ini menunjukkan bahwa aplikasi enzim pada benih varietas Yangambi dapat meningkatkan DB benih secara nyata. Peningkatan DB ini diduga karena degradasi lignin oleh enzim ligninase dan selulase oleh enzim selulose pada cangkang. Hasil penelitian Irawadi (1991) pada sabut dan tandan kosong kelapa sawit menyatakan bahwa aplikasi enzim selulase selama 2 hari dapat mendegradasi 180 mg/g substrat selulosa atau 0,18%. Aurora
Tabel 2 menunjukkan bahwa teknik aplikasi enzim terbaik pada benih varietas Yangambi yang dapat meningkatkan DB benih secara nyata adalah pada perlakuan P1 dengan pemanasan selama 40 hari; perendaman dengan air (3 hari), perendaman dengan enzim ligninase (1 hari) dan perendaman dengan enzim selulase (2 hari); P2 dengan Pemanasan selama 40 hari, perendaman dengan enzim ligninase (1 hari), perendaman dengan enzim selulase (2 hari) dan perendaman dengan air (3 hari); dan P3 dengan Pemanasan selama 40 hari, perendaman dengan campuran enzim ligninase dan selulase (3 hari), perendaman dengan air (3 hari).
Hasil DB pada kontrol varietas Yangambi yang rendah diduga akibat keadaan benih yang digunakan yaitu bagian intinya (kernel) sudah tidak menempel lagi dengan permukaan cangkang bagian dalam. Hal ini dapat diketahui dari ketika benih di goyang-goyangkan maka terdengar suara. Hal ini membuat benih menjadi sulit berkecambah karena imbibisi air hingga mencapai bagian embrio yang terdapat di dalam kernel akan menjadi lebih sulit dan memerlukan waktu yang lebih lama sehingga sampai akhir pengamatan banyak benih yang belum berkecambah.
Potensi Tumbuh Maksimum (PTM)
PTM digunakan sebagai tolok ukur Viabilitas Total benih. Viabilitas Total benih adalah kemampuan benih untuk menunjukkan gejala hidup baik langsung oleh fenomena pertumbuhan maupun gejala metabolismenya. Jumlah kecambah yang dihitung pada PTM ini adalah semua kecambah normal dan abnormal.
Hasil uji lanjut pada Tabel 3 menunjukkan PTM tertinggi pada benih varietas Langkat didapat pada perlakuan P2 dan P3. Perlakuan P2 dan P3 menghasilkan PTM yang sama yaitu 79.7%-81.0% tetapi tidak berbeda secara nyata dibanding kontrol. Hasil ini menunjukkan aplikasi enzim pada benih varietas Langkat tidak efektif, diduga karena benih varietas Langkat memiliki ukuran yang dengan susunan cangkang yang lebih kompak, keras dan lebih tebal.
nyata. Peningkatan PTM ini diduga karena degradasi lignin dan selulosa pada cangkang benih oleh enzim ligninase dan selulase.
Tabel 3. Pengaruh Perlakuan Aplikasi Enzim dan Varietas terhadap Potensi Tumbuh Maksimum Benih
Keterangan: Angka yang diikuti huruf yang sama tidak berbeda nyata pada uji DMRT 5%
Tabel 3 menunjukkan bahwa teknik aplikasi enzim terbaik pada benih varietas Yangambi yang dapat meningkatkan PTM benih secara nyata adalah pada perlakuan P1 dengan pemanasan selama 40 hari; perendaman dengan air (3 hari), perendaman dengan enzim ligninase (1 hari) dan perendaman dengan enzim selulase (2 hari); P2 dengan Pemanasan selama 40 hari, perendaman dengan enzim ligninase (1 hari), perendaman dengan enzim selulase (2 hari) dan perendaman dengan air (3 hari); dan P3 dengan Pemanasan selama 40 hari, perendaman dengan campuran enzim ligninase dan selulase (3 hari), perendaman dengan air (3 hari).
Perbandingan PTM antar varietas memperlihatkan varietas Yangambi memiliki PTM rata-rata yang lebih besar dari pada PTM varietas Langkat pada perlakuan yang sama kecuali pada kontrol. Hal ini diduga karena tiga faktor, yaitu perbedaan varietas, ukuran benih dan keadaan benih varietas Yangambi yang sudah jelek yaitu bagian inti (kernel) sudah tidak menempel dengan bagian dalam cangkang benih.
Kecepatan Tumbuh (KCT)
perendaman dengan air (3 hari). Perlakuan P2 memiliki hasil KCT yang nyata lebih tinggi dibanding kontrol. Peningkatan KCT ini diduga karena degradasi lignin dan selulosa pada cangkang benih oleh enzim ligninase dan selulase. Rendahnya nilai KCT pada P1 disebabkan sebanyak 10.3% benih terserang cendawan.
Tabel 4. Pengaruh Perlakuan Aplikasi Enzim dan Varietas terhadap
Keterangan: Angka yang diikuti huruf yang sama tidak berbeda nyata pada uji DMRT 5%
Pada varietas Yangambi, KCT tertinggi didapat pada perlakuan P1 yaitu pemanasan selama 40 hari, perendaman dengan air (3 hari), perendaman dengan enzim ligninase (1 hari) dan perendaman dengan enzim selulase (2 hari).
Perlakuan P1, P2 dan P3 menghasilkan nilai KCT yang sama yaitu 2.7%-3.0% KN/hari serta nyata lebih tinggi dibanding kontrol.
Indeks Dormansi (ID)
Indeks Dormansi (ID) digunakan sebagai tolok ukur Viabilitas Dormansi benih. ID benih adalah persentase benih yang tidak tumbuh sampai akhir pengamatan. Semakin kecil nilai ID, maka semakin baik karena semakin tinggi nilai perkecambahan benih.
Hasil uji lanjut pada Tabel 5 menunjukkan nilai ID terendah pada benih varietas Langkat didapat pada perlakuan P2 dan P3. Perlakuan P2 dan P3 menghasilkan nilai ID yang sama yaitu 19.0%-20.3% tetapi tidak berbeda secara nyata dibanding kontrol. Hasil ini menunjukkan aplikasi enzim pada benih varietas Langkat tidak efektif.
Pada varietas Yangambi, ID terendah didapat pada perlakuan P1, P2 danP3. Perlakuan P1, P2 dan P3 menghasilkan ID yang sama yaitu 12.3%-15.3% serta nyata lebih rendah dibanding kontrol. Hasil ini menunjukkan bahwa aplikasi enzim pada benih varietas Yangambi efektif menurunkan ID benih secara nyata. Penurunan ID ini diduga karena degradasi lignin dan selulosa pada cangkang benih oleh enzim ligninase dan selulose. Adanya degradasi lignin dan selulosa pada cangkang benih meningkatkan proses imbibisi air dan masuknya udara ke dalam benih sehingga meningkatkan perkecambahan benih.
Tabel 5. Pengaruh Perlakuan Aplikasi Enzim dan Varietas terhadap Indeks Dormansi Benih
Keterangan: Angka yang diikuti huruf yang sama tidak berbeda nyata pada uji DMRT 5%
perbandingan antar varietas, varietas Yangambi memiliki DB, PTM dan KCT yang lebih besar serta nilai ID yang lebih kecil dari varietas Langkat pada semua perlakuan kecuali pada kontrol. Hal ini diduga dapat terjadi karena tiga faktor, yaitu :
1. Perbedaan varietas yang memiliki sifat genotip dan fenotip yang berbeda. 2. Benih varietas Yangambi berasal dari pohon induk yang lebih tua sehingga
memiliki ukuran benih yang lebih besar dari pada benih varietas Langkat. Diketahui bahwa benih pada tamanan kelapa sawit yang ukurannya lebih besar memiliki DB yang lebih tinggi bila dibanding benih yang kecil.
Pada benih varietas Yangambi aplikasi enzim pada perlakuan P1, P2, P3 yaitu dengan lama pemanasan 40 hari dan P4 dengan pemanasan 50 hari dapat meningkatkan perkecambahan benih secara nyata dilihat dari parameter DB, PTM, KCT yang meningkat nyata serta nilai ID yang menurun secara nyata. Hal ini menunjukkan waktu pemanasan yang lebih singkat dibanding kontrolnya yaitu 60 hari.
Keragaan Tumbuh Bibit
Pengamatan dilakukan terhadap keragaan tumbuh bibit untuk dilihat apakah ada ciri-ciri abnormal yang muncul akibat perlakuan aplikasi enzim ligninase dan selulase. Bibit abnormal yang muncul dicatat ciri-cirinya dan dihitung jumlahnya. Setiap ulangan perlakuan diambil 10 kecambah secara acak, sehingga total ada 300 kecambah yang dibibitkan (Gambar 25).
Gambar 25. Bibit Normal pada Minggu Ke-5
Gambar 26. Bibit Abnormal pada Minggu Ke-4 (A) dan Minggu Ke-5 (B)
A B
KESIMPULAN DAN SARAN
Kesimpulan
1. Pada benih varietas Yangambi, terdapat tiga teknik aplikasi enzim ligninase dan selulase yang memberikan hasil efektif nyata meningkatkan DB, PTM, KCT serta menurunkan ID benih. Ke tiga teknik aplikasi enzim tersebut adalah 1) Pemanasan selama 40 hari, perendaman dengan air selama 3 hari, perendaman dengan enzim ligninase 1 hari, dan perendaman dengan enzim selulase 2 hari; 2) Pemanasan selama 40 hari, perendaman dengan enzim ligninase 1 hari, perendaman dengan enzim selulase 2 hari, dan perendaman dengan air selama 3 hari; dan 3) Pemanasan selama 40 hari, perendaman dengan campuran enzim ligninase dan selulase 3 hari, dan perendaman dengan air 3 hari.
2. Pada benih varietas Langkat, aplikasi enzim ligninase dan selulase efektif dengan nyata meningkatkan KCT benih, yaitudengan pemanasan selama 40 hari, perendaman dengan enzim ligninase 1 hari, perendaman dengan enzim selulase 2 hari dan perendaman dengan air 3 hari.
Saran
1. Perlu adanya penelitian lebih lanjut terhadap pengaruh aplikasi enzim ligninase dan selulase untuk pematahan dormansi dan perkecambahan benih kelapa sawit.
2. Untuk penelitian selanjutnya mengenai aplikasi enzim ligninase dan selulase terhadap perkecambahan benih kelapa sawit, disarankan (a) menggunakan lebih dari dua varieatas benih sebagai pembanding antar varietas, (b) mengambil perlakuan seperti mencari cara aplikasi dan dosis yang paling optimal.
3. Untuk penelitian selanjutnya atau penelitian sejenis disarankan menggunakan rancangan acak lengkap (RAL) karena lebih efisien dan lebih mudah dari pada menggunakan rancangan lengkap kelompok teracak (RKLT).