KARAKTERISASI FAGE LITIK Salmonella sp. FR38, FR19,
dan FR84
SANG AYU PUTU LISTYA ASTRININGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
KARAKTERISASI FAGE LITIK Salmonella sp. FR38, FR19,
dan FR84
SANG AYU PUTU LISTYA ASTRININGSIH
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Karakterisasi Fage Litik Salmonella sp. FR38, FR19, dan FR84 Nama : Sang Ayu Putu Listya Astriningsih
NIM : G351100061
Disetujui Komisi Pembimbing
Dr. dr. Sri Budiarti Dr. Ir. Iman Rusmana Ketua komisi Anggota
Diketahui
Ketua Program Studi Dekan Sekolah pascasarjana
Mikrobiologi
Dr. Ir. Gayuh Rahayu Dr. Ir. Dahrul Syah M.Sc. Agr.
ABSTRACT
SANG AYU PUTU LISTYA. Characterization lytic Phage of Salmonella sp.
FR38, FR19, and FR84. Under direction of SRI BUDIARTI and IMAN RUSMANA.
The ability of bacteriophage to survive under unfavorable conditions is different depend on the strains. Various external physical and chemical factors such as pH, temperature, and buffer can inactivate a phage. The aim of this research was to characterized lytic phage Salmonella FR38, such as: analyze the stability of lytic phage of Salmonella sp. FR38, FR19, and FR84 i.e: stability of lytic activity of phage on different conditions of pH, temperature, buffers, and morphological structure. Phage FR38, FR19, and FR84 could survive at various pH conditions.A temperature above 60°C was found to be deleterious for survival of the phages. Phage FR38 had the highest stability in various conditions. The best performance buffer for storage of phage was SM buffer at pH 7 and temperature of 27°C. Phage stored in buffer at low temperatures (4°C) showed that the number of plaque was not different to that of at room temperature. Transmission electron microscopy analysis showed that phage FR38 had an icosahedral head 73.3 ± 0.21 nm in diameter and noncontractile tail of 93.7 ± 0.21 nm in length and 17.3 ± 0.07 nm in diameter. Phage FR19 had an icosahedral head with 68.96 ± 0.014 nm in diameter and noncontractile tail of 52.41 ± 0,014 nm in length and 16.55 ± 0.02 nm in diameter. While phage FR84 had an icosahedral head 47,53 ± 0.028 nm in diameter and noncontractile tail of 15.69 ± 0.06 nm in length and 9.64 ± 0.042 nm in diameter. The proteins of FR38, FR19, and FR84 had molecular weights of 16.48 – 120.49 kDa, 16.48 – 42.28 kDa, and 12.68 – 57.88 kDa respectively.
RINGKASAN
SANG AYU PUTU LISTYA. Karakterisasi Fage Litik Salmonella sp. FR38, FR19, dan FR84. Dibimbing oleh SRI BUDIARTI dan IMAN RUSMANA.
Penyakit infeksi di Indonesia masih menduduki peringkat pertama. Infeksi ini tidak hanya terjadi di negara berkembang, akan tetapi terjadi pula di negara maju. Sebagai contoh yang sering terjadi di Eropa dan Amerika Serikat adalah kasus penyakit yang disebabkan oleh Salmonella enteritidis yang ditularkan melalui daging ayam, telur, dan produk olahannya. Beberapa bakteri patogen seperti E. coli, Salmonella, Shigella, Staphylococcus aureus, dan Campylobacter
sp. juga dapat mencemari makanan. Dari 18 kasus keracunan makanan yang terjadi pada tahun 2003, sebesar 83,30% disebabkan oleh bakteri patogen, dan pada tahun 2004 dan 2005 masing-masing 60% dari 41 kasus dan 72,20% dari 53 kasus. Antibiotik telah digunakan untuk terapi akibat infeksi bakteri patogen tersebut, akan tetapi pada saat ini penggunaan antibiotik menjadi tidak efektif karena munculnya resistensi dan akumulasi residu bagi pengkonsumsinya.
Fage litik Salmonella sp FR38, FR19, dan FR84 adalah fage yang diisolasi dari limbah cair rumah tangga (LCRT) di daerah Babakan, Darmaga. Pada penelitian tersebut dilaporkan fage litik ini dapat melisiskan Salmonella sp. resisten antibiotik yang diisolasi dari feses penderita diare di Puskesmas Sindang Barang Bogor.
pada pH 5 dan pH 4 sebesar 27.7% dan 48.8%, sedangkan dalam kondisi basa, yaitu pH 9 dan pH 11 terjadi penurunan jumlah plak yang lebih besar yaitu 52.3% dan 73.3%. Fage FR 19 memiliki kestabilan terendah dibandingkan dengan FR38 dan FR19. Pada FR84 terjadi penurunan jumlah plak pada pH 5 dan pH 4 sebesar 42.7% dan 62.7%, serta dalam pH 9 dan pH 11 terjadi penurunan jumlah plak yang lebih besar yaitu 46.7% dan 77.3%.
Fage FR38, FR19, dan FR84 cenderung stabil pada suhu 27°C dan 37°C. Pada Fage FR38 yang diinkubasi selama 30 menit pada suhu 27°C jumlah plak lebih kecil dibandingkan dengan fage yang diinkubasi selama 30 menit pada suhu 37°C, tetapi jumlah plak tetap stabil setelah diinkubasi selama 60 dan 90 menit. Jumlah plak tertinggi terjadi pada suhu 37°C setelah inkubasi 30 menit, akan tetapi jumlah plak tidak stabil setelah inkubasi 60 dan 90 menit. Terjadi penurunan plak sebesar 7.5% setelah inkubasi 90 menit. Fage FR38 tidak stabil pada suhu 45°C, dan 55°C, dan 60°C. Ketidakstabilan fage terlihat dari penurunan jumlah plak atau sama sekali tidak terbentuk plak. Fage FR19 dan FR84 memiliki karakteristik yang sama dengan fage FR38 yaitu tidak stabil pada suhu 45°C, 55°C, dan 60°C.
Pengujian efek bufer terhadap stabilitas bakteriofage bertujuan untuk mengetahui bufer terbaik untuk penyimpanan bakteriofage. Perlakuan penyimpanan fage dilakukan pada tiga bufer yang berbeda, yaitu: SM (NaCl, MgSO4.7H2O, Gelatin, Tris-Cl), Ringer (NaCl, KCl, CaCl2, MgCl2.6H2O, NaH2PO4, dan glukosa), dan PBS (NaCl, KCl, NaH2PO4, dan KH2PO4) pada dua suhu yang berbeda, yaitu: suhu ruang (27°C) dan suhu dingin (4°C). Penyimpanan fage di dalam Nutrient Broth (NB) dijadikan sebagai kontrol. Kestabilan terbaik terdapat pada fage yang disimpan dalam bufer SM ( 275×107 pfu/ml ) dan diikuti secara berturut-turut pada bufer Ringer ( 120×107 pfu/ml ), dan PBS ( 100×107 pfu/ml ).
Analisis morfologi dengan menggunakan TEM pada Fage FR 38
menunjukkan kepala fage yang berbentuk heksagonal ikosahedral. Diameter kepala fage sebesar 73.3 ± 0.21 nm dengan panjang ekor sebesar 93.7 ±
± 0.014 nm dengan panjang ekor sebesar 52.41 ± 0.014 nm dan lebar ekor sebesar 16.55 ± 0.02 nm. Fage FR84 menunjukkan diameter kepala fage sebesar 47.53 ± 0.028 nm dengan panjang ekor sebesar 15.69 ± 0.06 nm dan lebar ekor sebesar 9.64 ± 0.042 nm.
Kadar protein masing-masing fage berbeda satu sama lain. Fage FR38 memiliki konsentrasi protein yang paling tinggi, yaitu sebesar 305 µg/ml dan dikuti secara berturut-turut oleh FR19, dan FR84 yaitu sebesar 268 µg/ml dan 230 µg/ml. Setelah dilihat dengan SDS-PAGE, hasil analisis fage FR38 memperlihatkan ada 5 pita protein, dengan berat molekul 120; 105.6; 60.99; 27.82; dan 16.48 kDa. Fage FR19 memperlihatkan ada 3 pita protein, dengan berat molekul 42.28; 30.88; dan 16.48 kDa. Fage FR84 memperlihatkan ada 2 pita protein 57.88 dan 12.68.
PERNYATAAN MENGENAI TESIS DAN SUMBER
INFORMASI
Dengan ini saya menyatakan bahwa tesis Karakterisasi Fage Litik Salmonella sp.
FR38, FR19, dan FR84 adalah karya saya dengan arahan dari komisi pembimbing
dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, 28 Agustus 2012
Sang Ayu Putu Listya A
© Hak Cipta milik IPB, tahun 2012 Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan YME atas segala karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan Agustus 2011 hingga Maret 2012 ini ialah Karakterisasi Fage Litik Salmonella sp. FR38, FR19, dan FR84. Judul ini dipilih karena untuk memproduksi fage litik perlu diketahui kondisi optimal untuk pertumbuhan dan karakteristik morfologinya. Faktor lingkungan seperti pH, suhu, dan bufer diduga berpengaruh terhadap kerusakan struktur elemen seperti kepala, ekor, protein, dan perubahan struktur DNA sehingga mempengaruhi produksi bakteriofage.
Ucapan terima kasih penulis sampaikan kepada:
1. Ibu Dr. dr. Sri Budiarti; selaku ketua komisi pembimbing, yang telah banyak memberikan bimbingan, saran, nasihat, masukan, arahan, dan dana penelitian.
2. Bapak Dr. Ir. Iman Rusmana; selaku anggota komisi pembimbing, yang telah memberikan bimbingan, arahan, masukan.
3. Kementrian Pendidikan Nasional Republik Indonesia melalui Program Desentralisasi Hibah Penelitian TIM Pascasarjana Institut Pertanian Bogor, proyek nomor 41/13.24.4/SPP/PHPS/2011 tanggal 28 Maret 2011; atas dana penelitian yang diberikan kepada penulis melalui koordinator Dr. dr. Sri Budiarti.
4. Ibu Dr. drh. Sri Murtiningsih M.Si. selaku penguji luar komisi pada ujian tesis.
5. Ibu Dr. Nisa Rachmania Mubarik selaku perwakilan dari Program Studi Mikrobiologi Pascasarjana.
6. Mbak Dewi; selaku teknisi di laboratorium Bioteknologi Hewan dan Biomedis, PPSHB IPB Darmaga.
7. Mbak Ita; selaku asisten peneliti di laboratorium TEM dan Histologi, Lembaga Eijkman.
8. Teman-teman satu program studi, beda program studi, dan satu tempat penelitian yang tidak bisa disebutkan satu-persatu.
Selaksa cinta dan terima kasih penulis persembahkan untuk Aji, Ibu, Wedana, adik atas perhatian, dukungan, dan doa yang senantiasa diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2012
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR TABEL………... vi
DAFTAR GAMBAR... vii
DAFTAR LAMPIRAN……….. viii
PENDAHULUAN Latar Belakang... 1
Tujuan... 3
Manfaat Penelitian……….. 3
TINJAUAN PUSTAKA Bakteriofage……… 4
Bakteriofage Sebagai Agen Biokontrol Biologi………. 6
Kestabilan Bakteriofage………. 8
METODE Metode Penelitian……… 9
Waktu dan Tempat……….. 10
Bahan dan Alat……… 10
Peremajaan Isolat Bakteri……… 11
Perbanyakan Bakteriofage……… 11
Kuantifikasi Bakteriofage dengan Plaque Forming Units (PFU/ml).. 11 Pemurnian Bakteriofage……… 11
Efek pH terhadap Kestabilan Bakteriofage……….. 12
Efek Suhu terhadap Kestabilan Bakteriofage……….. 12
Efek Bufer terhadap Kestabilan Bakteriofage……….. 12
Pengamatan Morfologi Fage dengan Transmission Electron Microscope (TEM)………... 13
Karakterisasi Protein………. 13
HASIL Efek pH terhadap Kestabilan Bakteriofage……….. 15
Efek Suhu terhadap Kestabilan Bakteriofage……….. 16
Efek Bufer terhadap Kestabilan Bakteriofage………. 17
Hasil Pengamatan Morfologi Fage dengan Transmission Electron Microscope(TEM)……….. 20
Karakteristik Protein……… 21
PEMBAHASAN……… 23
SIMPULAN DAN SARAN………... 28
DAFTARPUSTAKA……….. 29
LAMPIRAN……….... 32
DAFTAR GAMBAR
Halaman
1. Diagram alir tahapan metode penelitian………. 3
2. Kestabilan fage FR38, FR19, dan FR84 terhadap pH inkubasi 4, 5, 7, 9, dan 11………. 15
3. Kestabilan fage FR38, FR19, dan FR84 terhadap suhu 27, 37, 45, 55, dan 60°C masing-masing diinkubasi selama 30, 60, dan 90 menit…. 16 4. Efek bufer terhadap kestabilan bakteriofage FR38………... 18
5. Efek bufer terhadap kestabilan bakteriofage FR19………... 18
6. Efek bufer terhapat kestabilan bakteriofage FR84…………... 19
7. Morfologi fage FR39, FR19, dan FR84……… 21
8. Kisaran berat molekul protein fage pada SDS-PAGE……….. 22
DAFTAR LAMPIRAN
Halaman
1. Komposisi bufer………. 33
2. Pembuatan pereaksi Bradford untuk pengukuran konsentrasi
protein……… 34
3. Komposisi bahan untuk membuat gel pengumpul dan gel pemisah… 34
4. Prosedur pewarnaan silver stain……… 35
DAFTAR TABEL
Halaman
1. Diameter kepala, panjang ekor, dan diameter ekor fage
FR38, FR19, dan FR84………. 20
2. Konsentrasi protein dari hasil ekstrasi kultur fage……… 21 3. Berat molekul fage FR19, FR38, dan FR84…….………... 22 4. Perbandingan morfologi fage FR38, FR19, dan FR84 dengan
PENDAHULUAN
Latar Belakang
Penyakit infeksi di Indonesia masih menduduki peringkat pertama. Infeksi ini tidak hanya terjadi di negara berkembang, akan tetapi terjadi pula di negara maju. Sebagai contoh yang sering terjadi di Eropa dan Amerika Serikat adalah kasus penyakit yang disebabkan oleh Salmonella enteritidis yang ditularkan melalui daging ayam, telur, dan produk olahannya (Higgins et al. 2005). Beberapa bakteri patogen seperti E. coli, Salmonella, Shigella, Staphylococcus aureus, dan
Campylobacter sp. juga dapat mencemari makanan. Dari 18 kasus keracunan makanan yang terjadi pada tahun 2003, sebesar 83,30% disebabkan oleh bakteri patogen, dan pada tahun 2004 dan 2005 masing-masing 60% dari 41 kasus dan 72,20% dari 53 kasus (Djaafar et al. 2007).
Bakteri patogen tidak hanya menyerang manusia, akan tetapi dapat juga menginfeksi hewan, produk peternakan, dan tanaman penting lainnya. Serangan ini mengakibatkan berkurangnya nilai ekonomis. Penggunaaan antibiotik pada saat ini menjadi tidak efektif dikarenakan munculnya mekanisme resisten. Berdasarkan penelitian Oliveira et al. (2006) menunjukkan beberapa isolat
Salmonella yang berasal dari isolasi karkas ayam multiresisten terhadap enam jenis antibiotik secara invitro yakni: kanamisin, enrofloxacin, neomisin, fosfomisin, sulphonamides dan nitrofurantoin. Tingkat resistensinya sebesar 1.25% terhadap kanamisin, 3.75% terhadap enrofloxacin, 20% terhadap fosfomisin, 86.25% terhadap sulphonamides, dan 90% terhadap nitrofurantoin. Munculnya bakteri-bakteri resisten terhadap antibiotik mendorong para ilmuan untuk mencari biokontrol alami yang ramah lingkungan untuk mengatasi bakteri patogen ini.
(LCRT) di daerah Babakan, Darmaga (Sunarti 2011). Pada penelitian tersebut dilaporkan fage litik ini dapat melisiskan Salmonella sp. resisten antibiotik yang diisolasi dari feses penderita diare di Puskesmas Sindang Barang Bogor.
Bakteriofage telah digunakan sebagai biokontrol pencemaran makanan oleh Bielke et al. (2007). Pada penelitian tersebut dilaporkan bakteriofage memiliki kemampuan untuk mereduksi Salmonella pada produk pakan ayam.
Atterbury et al. (2003) telah melaporkan bahwa bakteriofage dapat mereduksi
Campylobacter jejuni pada permukaan kulit ayam. Ronnest et al. (2008) melakukan isolasi bakteriofage yang berasal dari perairan Scandinavia. Fage tersebut dapat dijadikan sebagai biokontrol terhadap Flavobacterium psychrophilum yang merupakan patogen terhadap ikan salmon dan dapat menyebabkan kematian.
Tujuan
Tujuan dari penelitian ini adalah untuk mengkarakterisasi fage litik
Salmonella sp. FR38, FR19, dan FR84 dengan cara menganalisis kestabilan fage FR38, FR19, dan FR84 pada berbagai pH, suhu, dan bufer, serta karakteristik morfologinya.
Manfaat Penelitian
TINJAUAN PUSTAKA
Bakteriofage
Bakteriofage merupakan virus yang menginfeksi bakteri, ditemukan secara terpisah oleh Frederick W. Twort di Inggris pada tahun 1915 dan oleh Felix d’Herelle di Institut Pasteur di Paris pada tahun 1917. Twort mengamati bahwa koloni-koloni bakteri kadang-kadang mengalami lisis (menjadi larut dan lenyap) dan bahwa efek litik ini dapat ditularkan dari satu koloni ke koloni lainnya. Filtrat koloni yang diencerkan dan difiltrasi dengan membran filter tetap saja dapat melisiskan koloni, akan tetapi bila filtrat ini dipanaskan maka sifat litiknya rusak. Twort berkesimpulan bahwa agen penyebab lisis ialah virus. D’Herelle menemukan hal yang sama pada tahun 1917, sehingga diberi nama fenomena
Twort-d’Herella (Pelczar et al. 2006).
lainnya. Pada tahap adsorpsi, ujung ekor fage melekat pada dinding sel melalui reseptor khusus pada permukaan sel. Proses pelekatan ini bersifat spesifik yang berarti bahwa reseptor dan fage bersifat seperti pasangan. Reseptor dapat berupa lipopolisakarida, flagella, pili, karbohidrat, atau protein membran dinding sel. Tanpa reseptor spesifik, virus tidak dapat mangadsorpsi dan menginfeksi, apabila situs reseptor berubah karena mutasi maka inang menjadi resisten terhadap infeksi virus namun mutan virus dapat melekat pada inang yang resisten. Pelekatan virus pada sel dapat mengakibatkan perubahan pada virus dan atau sel inang yang mengakibatkan terjadinya penetrasi. Penetrasi fage ke dalam sel inang bersifat mekanis. Proses ini dimudahkan oleh adanya suatu enzim yaitu lisozim, yang dibawa pada ekor fage. Aktivitas enzim ini dapat membuat lubang kecil pada peptidoglikan (Madigan et al. 2000). Pada tahap penetrasi asam nukleat virus masuk ke dalam sel inang. Tahap transkripsi fage terjadi dalam beberapa tahap melalui gen yang disebut sebagai: 1) protein awal, 2) protein tengah, dan 3) protein akhir. Protein awal dan protein tengah merupakan enzim primer yang terlibat dalam replikasi DNA dan transkripsi, sedangkan protein akhir merupakan protein kepala dan ekor serta enzim yang terlibat dalam pelepasan partikel fage matang (Snyder et al. 2003).
Beberapa menit setelah menginfeksi, virus memasuki fase eklips, yaitu periode asam nukleat terpisah dari selubung protein dan virion bukan merupakan komponen yang utuh. Pada periode pematangan diawali dengan pengemasan asam nukleat yang baru diseintesis di dalam selubung protein. Pada fase ini titer virus yang aktif di dalam sel meningkat secara drastis meskipun virion belum terlihat berada di luar sel. Fase antara eklips dan pematangan disebut periode laten. Pada akhir fase pematangan, virion matang keluar dengan mengakibatkan lisis sel inang. Jumlah virion yang dilepaskan disebut ukuran ledakan (burn size). Siklus replikasi pada fage dapat berlangsung selama 20-60 menit (Madigan et al. 2000).
2) Tipe B serupa dengan tipe A, tipe ini mempunyai kepala heksagonal, tetapi tidak mempunyai seludang kontraktil, ekornya kaku, dan mengenai serabut ekor, ada yang mempunyai dan ada yang tidak. 3) Tipe C adalah tipe yang dicirikan dengan sebuah kepala heksagonal dan sebuah ekor yang lebih pendek dari kepalanya. Ekornya ini tidak mempunyai seludang kontraktil dan mengenai serabut ekor, ada yang mempunya dan ada yang tidak, 4) Tipe D adalah tipe yang memiliki sebuah kepala tanpa ekor, dan kepalanya tersusun dari kapsomer-kapsomer besar. 5) Tipe E adalah tipe fage yang memiliki sebuah kepala tanpa ekor, dan kepalanya tersusun dari kapsomer-kapsomer kecil, dan 6) Tipe F adalah tipe yang berbentuk filamen (Pelczar et al. 2006).
Bakteriofage Sebagai Agen Biokontrol Biologi
Pada tahun 1980-an, Smith melakukan berbagai percobaan terapi fage. Berdasarkan hasil penelitian Smith et al. (1987) menunjukkan bahwa fage memiliki potensi yang cukup potensial untuk mengendalikan penyakit infeksi E. coli pada ternak. Bielke et al. (2007) meneliti bahwa bakteriofage dapat mengendalikan Salmonella dan Klebsiella oxytoca pada produk peternakan. Penelitian ini didasari oleh keprihatinan para peneliti di Amerika bahwa produk peternakan tercemar oleh Salmonella yang membahayakan bagi kesehatan manusia apabila produk peternakan tersebut dikonsumsi. Penelitian diawali dengan mengisolasi bakteriofage dari limbah buangan air, kemudian dilanjutkan dengan uji kisaran inang dengan menggunakan beberapa bakteri seperti:
penggunaanya telah diizinkan oleh Food Drug Association (FDA) adalah LISTEXTM P100. Produk ini telah diaplikasikan di Netherland, Eropa, dan Amerika Serikat pada produk makanan keju, daging unggas, ikan, sayuran, mentega, serta produk lainnya. Soni et al. (2010) menggunakan LISTEXTM P100 untuk mereduksi Listeria monocytogenes pada ikan salmon.
Kestabilan Bakteriofage
Beberapa faktor fisik dan kimia seperti, suhu, pH, dan ion diduga berpengaruh terhadap kestabilan bakteriofage. Berdasarkan penelitian Olson et al. (2004), Yates et al. (1985) suhu merupakan faktor penting yang berperan terhadap kestabilan bakteriofage. Penelitian kestabilan fage terhadap suhu telah banyak dilakukan oleh beberapa peneliti. Beberapa peneliti tersebut diantaranya adalah Atamer et al. (2008). Pada penelitian tersebut, sebanyak 40% fage Lactococcus lactic dapat bertahan selama pemanasan pada suhu 80°C dalam suspensi susu, akan tetapi hampir semua fage menjadi tidak aktif ketika suhu dinaikkan menjadi 95°C. Suhu selama penyimpanan merupakan faktor penting yang mempengaruhi kestabilan fage. Jepson et al.(2004) meneliti pengaruh waktu penyimpanan fage λ
terhadap suhu yang berbeda. Mereka melihat tidak aktifnya fage yang disimpan dalam bufer SM pada suhu 42°C setelah 84 hari. Fage tersebut lebih stabil pada suhu penyimpanan 4°C selama 6 bulan.
Faktor lainnya yang ikut berpengaruh terhadap kestabilan bakteriofage adalah pH lingkungan. Beberapa penelitian efek pH terhadap kestabilan fage sudah banyak dilakukan. Berdasarkan penelitian Yang et al. (2010) fage litik AB1 yang menginfeksi Acinetobacter baumannii dapat stabil pada kisaran pH 5-9. Fage tersebut lebih stabil pada suasana pH asam dibandingkan dengan pH basa. Verthe et al. (2004) melakukan penelitian terhadap fage litik yang menginfeksi
METODE
Metode Penelitian
Alur penelitian dan metode yang digunakan dalam penelitian ini terdapat pada gambar 1. Metode tersebut terdiri atas 9 tahapan.
Gambar 1 Diagram alir tahapan metode penelitian.
Peremajaan Isolat Salmonella sp. 38, 19, dan 84
Perbanyakan Fage Litik Salmonella sp. FR38, FR19, dan FR84
Kuantifikasi Bakteriofage dengan Plaque Forming Units
(PFU/ml)
Pemurnian Bakteriofage
Efek Kondisi pH terhadap Kestabilan Bakteriofage
Efek Kondisi Suhu terhadap Kestabilan Bakteriofage
Efek Bufer terhadap Kestabilan Bakteriofage
Pengamatan Morfologi Fage dengan Transmission Electron Microscope (TEM)
Waktu dan Tempat
Penelitian dilakukan pada bulan Agustus 2011 sampai dengan bulan April 2012, bertempat di Laboratorium Bioteknologi Hewan, IPB Darmaga dan Laboratorium TEM Eijkman Jakarta.
Bahan
Bakteri yang digunakan ialah Salmonella sp. 38, 19, dan 84 yang merupakan koleksi Dr. dr. Sri Budiarti. Bakteriofage yang digunakan ialah fage litik Salmonella sp FR38, FR19, dan FR84 yang diisolasi dari limbah cair rumah tangga (LCRT) di daerah Babakan, Darmaga (Sunarti 2011).
Peremajaan Isolat Bakteri
Bakteri Salmonella nomer 38, 19, dan 84 resisten antibiotik hasil isolasi dari feses penderita diare di Puskesmas Sindang Barang Bogor ditumbuhkan dengan metode kuadran pada media Salmonella Shigella Agar (SSA) dan diinkubasi pada suhu 37°C selama 24 jam. Koloni tunggal yang terbentuk diambil dan ditumbuhkan pada media agar-agar miring SSA lalu diinkubasi pada suhu 37°C selama 12 jam. Hasil biakan disimpan untuk digunakan sebagai stok bakteri.
Perbanyakan Bakteriofage
Kuantifikasi Bakteriofage dengan Plaque Forming Units (PFU/ml).
Plaque Forming Units (PFU) ditentukan berdasarkan metode Foschino et al. (1995), yaitu 100 µl larutan fage ditambahkan dengan 100 µl kultur
Salmonella yang telah diinkubasi selama 4-5 jam pada media Nutrient Broth
(NB). Suspensi diinkubasi selama 30 menit pada suhu ruang kemudian dicampurkan dengan 6 ml molten top agar yang masih bersuhu 45°C, setelah itu suspensi dituang ke atas permukaan media cawan agar-agar. Inkubasi dilakukan pada suhu 37°C, plak-plak yang terbentuk dihitung setelah diinkubasi semalam.
Pemurnian Bakteriofage
Pemurnian fage dilakukan dengan memindahkan plak yang terisolasi dengan baik menggunakan pipet Pasteur, kemudian plak tersebut dicampurkan dengan 2-3 ml 25% pelarut Ringers. Suspensi fage dikocok dengan vortex dan dibiarkan selama 5-10 menit pada suhu ruang kemudian disentrifugasi pada kecepatan 1052 × g suhu 4°C sebanyak 3 kali ulangan. Suspensi tersebut kemudian difiltrasi menggunakan membran filter milipore 0,45 µl. Supernatan hasil sentrifugasi yang mengandung fage disaring kembali dengan filter milipore
0,22 µl. Filtrat diambil dan disimpan untuk bahan produksi (Goodridge et al.
2003).
Efek Kondisi pH terhadap Kestabilan Bakteriofage
Efek Kondisi Suhu terhadap Kestabilan Bakteriofage
Filtrat fage (106 pfu/ml) diinkubasi masing-masing pada suhu 27°C, 37°C, 45°C, 55°C, dan 60°C pada media NB. Setelah diinkubasi masing-masing selama 30, 60, dan 90 menit sebanyak 100 µl fage diambil dan diinfeksikan dengan 100 µl bakteri Salmonella dan diinkubasi selama 30 menit pada suhu ruang, kemudian diperiksa PFU (Plaque Forming Units) menggunakan Double Layer Plaque Technique.
Efek Bufer terhadap Kestabilan Bakteriofage
Plak fage yang terbentuk dimurnikan dengan cara memindahkan plak yang terisolasi dengan baik menggunakan pipet Pasteur, kemudian plak tersebut dicampurkan dengan 2-3 ml 25% bufer Ringer. Hal yang sama pun dilakukan dengan menggunakan bufer SM dan Phosphate Buffer Saline (PBS). Media
Nutrient Broth (NB) digunakan sebagai kontrol. Suspensi fage divortex dan dibiarkan selama 5-10 menit pada suhu ruang. Suspensi tersebut kemudian disentrifugasi pada kecepatan 1052 × g suhu 4°C, kemudian difiltrasi menggunakan membran filter milipore 0,45 µl (Phumkhachorn et al 2010). Supernatan hasil sentrifugasi yang mengandung fage (106 pfu/ml) diambil dan difiltrasi kembali menggunakan membran filter milipore 0,22 µl. Stabilitas Fage terhadap bufer dilihat tiap minggunya menggunakan Double Layer Plaque Technique.
Pengamatan Morfologi Fage dengan Transmission Electron Microscope
(TEM)
Grid-grid EM diletakkan pada holder, dibiarkan kering selama beberapa jam, setelah spesimen kering, diperiksa dengan menggunakan Mikroskop Elektron Transmisi model JEOL JEM-1010 yang dioperasikan 80kV pada perbesaran 80000x-100000x.
Karakterisasi Protein
Stok fage diukur kadar proteinnya dengan menggunakan metode Bradford (1976). Langkah awal untuk menentukan konsentrasi protein sampel ialah membuat serial konsentrasi standar Bovine Serum Albumin (BSA) dari 0.1 hingga 1.0 mg/ml. Masing-masing konsentrasi standar protein dan sampel diambil sebanyak 200 µl dan ditempatkan pada tabung reaksi. Masing-masing tabung ditambahkan 2 ml pereaksi Bradford (Lampiran 2). Campuran dihomogenkan dan diinkubasi pada suhu 37°C selama 15 menit kemudian diukur absorbansinya dengan spektrofotometer pada λ 595 nm.
Nilai absorbansi dan konsentrasi protein dari standard BSA diplotkan pada grafik cartesius dengan konsentrasi protein sebagai absis (sumbu x) dan absorbansi sebagai ordinat (sumbu y), kemudian ditentukan persamaan garis regresinya. Kurva yang terbentuk dijadikan sebagai kurva standar untuk menentukan konsentrasi protein sampel (Lampiran 5).
Berat molekul protein fage yang diperoleh dianalisis dengan Sodium Sulphate-Poly Acrilamide Gel Electrophoresis (SDS-PAGE) (Laemmli 1970). Marker yang digunakan adalah Spectra TM Multicolor Broad Range Protein Ladder dengan berat molekul berurut-turut adalah 10, 15, 25, 35, 40, 50, 70,100, 140, dan 260 kDa.
Konsentrasi gel pemisah sebesar 12% poliakrilamida yang ditempatkan pada bagian bawah. Konsentrasi gel pengumpul sebesar 7.5% poliakrilamida yang diletakkan di bagian atas setelah gel pemisah sudah menjadi benar-benar padat. Komposisi bahan untuk membuat gel pemisah maupun gel pengumpul tertera pada Lampiran 3.
HASIL DAN PEMBAHASAN
Hasil
Efek pH terhadap Kestabilan Bakteriofage
Kestabilan fage terhadap pH ditentukan dengan cara memeriksa fage pada berbagai kondisi pH (4-11). Ketiga fage FR38, FR19, dan FR84 memiliki kondisi optimum pada pH 7 (Gambar 2), hal ini dapat dilihat dari jumlah plak. Fage FR38 memiliki kestabilan terbaik terhadap pH dibandingkan dengan fage FR19 dan FR84. Fage FR38 cenderung stabil pada kondisi asam, hal ini dapat terlihat dari penurunan jumlah plak pada pH 5 dan pH 4 sebesar 24.23% dan 32.7%. Pada kondisi basa, yaitu pH 9 dan pH 11 terjadi penurunan jumlah plak yang lebih besar yaitu sebesar 35% dan 64.6%.
Fage FR19 dan FR84 memiliki karakteristik yang sama dengan fage FR 38. Kedua fage tersebut cenderung stabil pada kondisi asam. Pada FR19 terjadi penurunan jumlah plak pada pH 5 dan pH 4 sebesar 27.7% dan 48.8%, sedangkan pada kondisi basa, yaitu pH 9 dan pH 11 terjadi penurunan jumlah plak yang lebih besar yaitu 52.3% dan 73.3%.
(a) (b) (c)
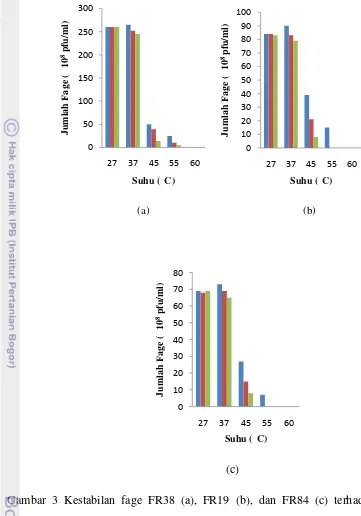
Gambar 2 Kestabilan fage FR38 (a), FR19 (b), dan FR84 (c) terhadap pH inkubasi 4, 5, 7, 9, dan 11.
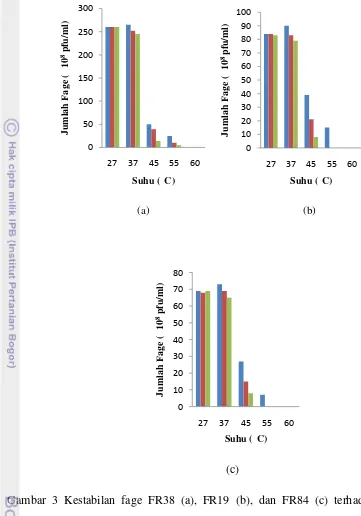
Efek Suhu terhadap Kestabilan Bakteriofage
Fage FR38, FR19, dan FR84 cenderung stabil pada suhu 27°C dan 37°C. Pada Fage FR38 yang diinkubasi selama 30 menit pada suhu 27°C jumlah plak lebih kecil dibandingkan dengan fage yang diinkubasi selama 30 menit pada suhu 37°C, akan tetapi jumlah plak tetap stabil setelah diinkubasi selama 60 dan 90 menit. Jumlah plak tertinggi terjadi pada suhu 37°C setelah inkubasi 30 menit, tetapi jumlah plak tidak stabil setelah inkubasi 60 dan 90 menit. Terjadi penurunan plak sebesar 7.5% setelah inkubasi 90 menit. Fage FR38 tidak stabil pada suhu 45°C, dan 55°C, dan 60°C. Ketidakstabilan fage terlihat dari penurunan jumlah plak atau sama sekali tidak terbentuk plak. Fage FR19 dan FR84 memiliki karakteristik yang sama dengan fage FR38 yaitu tidak stabil pada suhu 45°C, 55°C, dan 60°C (Gambar 3).
0 50 100 150 200 250 300
4 5 7 9 11
Ju m lah Fage ( 10
8 p
fu/ m l) pH 0 10 20 30 40 50 60 70 80 90 100
4 5 7 9 11
Ju m lah Fage ( 10 8p fu/ m l) pH 0 10 20 30 40 50 60 70 80
4 5 7 9 11
Ju m lah Fage ( 10
8 p
fu/
m
l)
(a) (b)
(c)
Gambar 3 Kestabilan fage FR38 (a), FR19 (b), dan FR84 (c) terhadap suhu inkubasi 27, 37, 45, 55, dan 60°C, masing-masing diinkubasi selama 30 (■), 60 (■), dan 90 (■) menit.
Efek Bufer terhadap Kestabilan Bakteriofage
Pengujian efek bufer terhadap stabilitas bakteriofage bertujuan untuk mengetahui bufer terbaik untuk penyimpanan bakteriofage. Perlakuan penyimpanan fage dilakukan pada tiga bufer yang berbeda, yaitu: SM (NaCl,
0 50 100 150 200 250 300
27 37 45 55 60
J u m la h F a g e ( 10 8pfu/ m l)
Suhu ( C)
0 10 20 30 40 50 60 70 80 90 100
27 37 45 55 60
J u m la h F a g e ( 10
8 pfu/
m
l)
Suhu ( C)
0 10 20 30 40 50 60 70 80
27 37 45 55 60
J u m la h F a g e ( 10 8pfu/ m l)
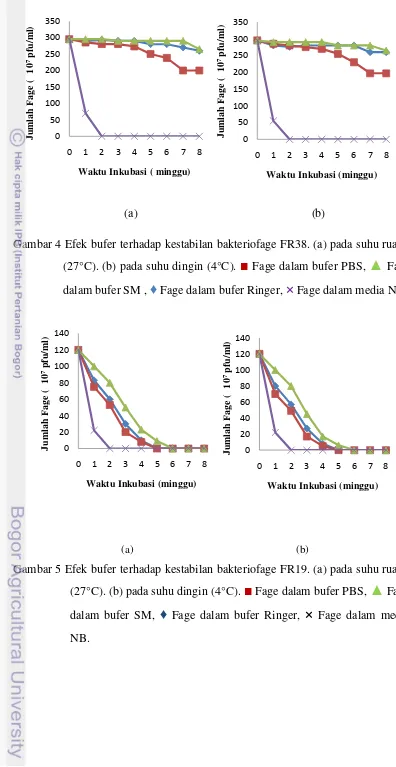
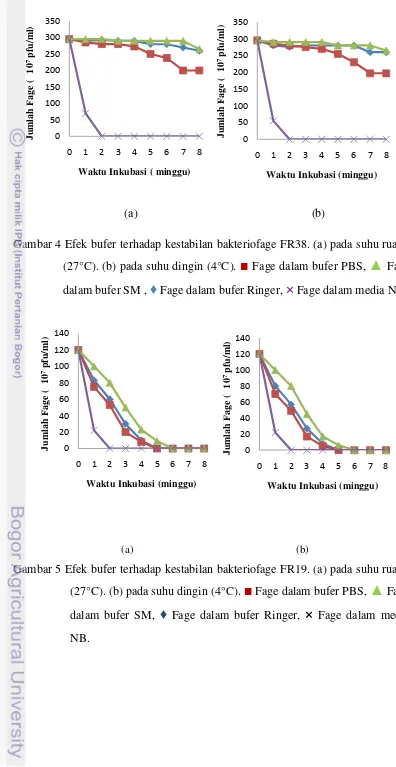
[image:33.595.106.467.85.601.2]MgSO4.7H2O, Gelatin, Tris-Cl), Ringer (NaCl, KCl, CaCl2, MgCl2.6H2O, NaH2PO4, dan glukosa), dan PBS (NaCl, KCl, NaH2PO4, dan KH2PO4) pada dua suhu yang berbeda, yaitu: suhu ruang (27°C) dan suhu dingin (4°C). Penyimpanan fage di dalam Nutrient Broth (NB) dijadikan sebagai kontrol. Kestabilan terbaik terdapat pada fage yang disimpan dalam bufer SM dan diikuti secara berturut-turut pada bufer Ringer, dan PBS.
Fage FR38 menunjukkan kestabilan terbaik dalam penyimpanan bufer SM pada suhu 27°C maupun 4°C, hal ini terlihat dari hanya terjadi penurunan jumlah plak masing-masing sebesar 10,2% setelah penyimpanan selama 8 minggu (Gambar 4). Pada Fage FR38 yang disimpan di dalam bufer Ringer pada suhu 27°C maupun suhu 4°C menunjukkan penurunan plak yang sama, yaitu sebesar 11,9% pada minggu ke 8. Penurunan jumlah plak pada penyimpanan bufer Ringer masih relatif kecil dibandingkan pada penyimpanan dalam bufer PBS. Fage FR38 yang disimpan di dalam bufer PBS pada suhu 27°C maupun suhu 4°C selama 8 minggu terjadi penurunan jumlah plak sebesar 32,2%. Pada Fage FR38 yang disimpan di dalam NB pada suhu 27°C, terjadi penurunan jumlah plak sebesar 76,3% pada minggu pertama, sedangkan fage FR38 yang disimpan dalam media NB pada suhu 4°C terjadi penurunan jumlah plak yang lebih tinggi, yaitu sebesar 81,3%.
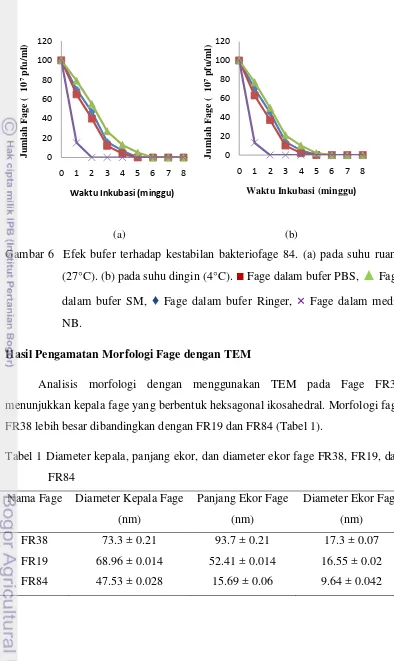
Fage FR19 dan FR84 memiliki kestabilan yang lebih rendah dibandingkan dengan fage FR38. Hal ini dapat dilihat dari tidak adanya plak setelah penyimpanan selama 6 minggu. Fage FR 19 dan 84 menunjukkan kestabilan terbaik dalam penyimpanan dengan bufer SM pada suhu ruang dan diikuti secara berturut-turut pada penyimpanan di dalam bufer Ringer, dan PBS (Gambar 5,6).
[image:35.595.100.496.75.842.2]
(a) (b)
Gambar 4 Efek bufer terhadap kestabilan bakteriofage FR38. (a) pada suhu ruang (27°C). (b) pada suhu dingin (4°C).
■
Fage dalam bufer PBS,▲
Fage dalam bufer SM ,♦
Fage dalam bufer Ringer,×
Fage dalam media NB.[image:35.595.107.499.91.317.2]
(a) (b)
Gambar 5 Efek bufer terhadap kestabilan bakteriofage FR19. (a) pada suhu ruang (27°C). (b) pada suhu dingin (4°C).
■
Fage dalam bufer PBS,▲
Fage dalam bufer SM,♦
Fage dalam bufer Ringer,×
Fage dalam media NB. 0 50 100 150 200 250 300 3500 1 2 3 4 5 6 7 8
J u m la h F a g e ( 10 7pfu/ m l)
Waktu Inkubasi ( minggu)
0 50 100 150 200 250 300 350
0 1 2 3 4 5 6 7 8
J u m la h F a g e ( 10
7 pfu/
m
l)
Waktu Inkubasi (minggu)
0 20 40 60 80 100 120 140
0 1 2 3 4 5 6 7 8
J u m la h F a g e ( 10 7pfu/ m l)
Waktu Inkubasi (minggu)
0 20 40 60 80 100 120 140
0 1 2 3 4 5 6 7 8
J u m la h F a g e ( 10 7pfu/ m l)
(a) (b)
Gambar 6 Efek bufer terhadap kestabilan bakteriofage 84. (a) pada suhu ruang (27°C). (b) pada suhu dingin (4°C).
■
Fage dalam bufer PBS,▲
Fage dalam bufer SM,♦
Fage dalam bufer Ringer,×
Fage dalam media NB.Hasil Pengamatan Morfologi Fage dengan TEM
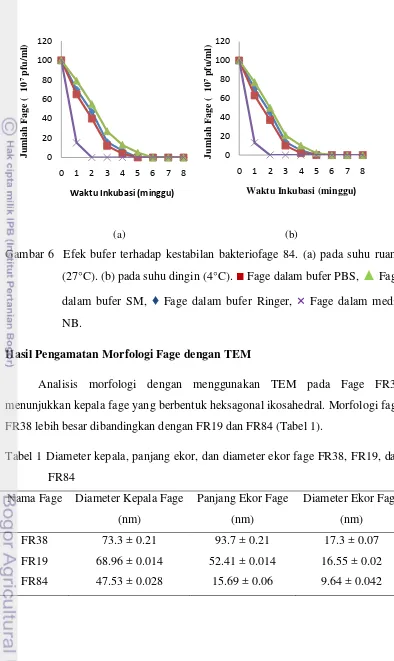
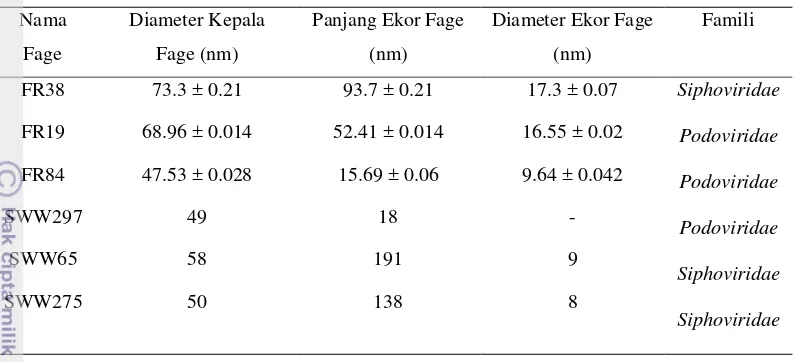
Analisis morfologi dengan menggunakan TEM pada Fage FR38 menunjukkan kepala fage yang berbentuk heksagonal ikosahedral. Morfologi fage FR38 lebih besar dibandingkan dengan FR19 dan FR84 (Tabel 1).
Tabel 1 Diameter kepala, panjang ekor, dan diameter ekor fage FR38, FR19, dan FR84
Nama Fage Diameter Kepala Fage (nm)
Panjang Ekor Fage (nm)
Diameter Ekor Fage (nm)
FR38 73.3 ± 0.21 93.7 ± 0.21 17.3 ± 0.07
FR19 68.96 ± 0.014 52.41 ± 0.014 16.55 ± 0.02
FR84 47.53 ± 0.028 15.69 ± 0.06 9.64 ± 0.042
0 20 40 60 80 100 120
0 1 2 3 4 5 6 7 8
J u m la h F a g e ( 10 7pfu/ m l)
Waktu Inkubasi (minggu)
0 20 40 60 80 100 120
0 1 2 3 4 5 6 7 8
J u m la h F a g e ( 10 7pfu/ m l)
[image:36.595.108.502.86.747.2]Dengan menggunakan dua perbesaran yang berbeda pada TEM yaitu 80000 dan 100000 dapat terlihat morfologi fage FR38, FR19, dan FR84. Fage FR38 (Gambar 7a) dan FR19 (Gambar 7b) dapat dilihat dengan perbesaran 80000, sedangkan FR84 dapat terlihat jelas dengan menggunakkan perbesaran 100000 (Gambar 7c).
Gambar7Morfologi (a) fage FR38 perbesaran 80000×, (b) fage FR19 perbesaran 80000×, (c) fage FR84 perbesaran 100000× (c). Tanda ({) menunjukkan kepala fage. Tanda (←) menunjukkan ekor fage.
Karakteristik Protein
Kadar protein masing-masing fage berbeda satu sama lain. Fage FR38 memiliki konsentrasi protein yang paling tinggi dan dikuti secara berturut-turut oleh FR19, dan FR84 (Tabel 2).
Tabel 2 Konsentrasi protein dari hasil ekstrasi kultur fage Fage Litik Konsentrasi Protein (µg/ml)
FR38 305
FR19 268
FR84 230
100 nm 100 nm (c) 50 nm
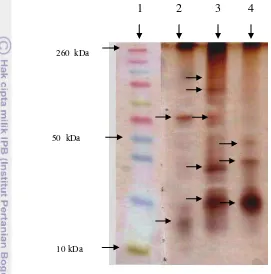
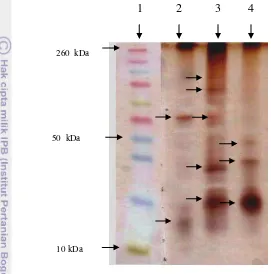
Hasil analisis bobot molekul protein fage dengan menggunakan Sodium Dodecyl Sulphate-Poly Acrilamide Gel Electrophoresis (SDS-PAGE) terlihat pada (Gambar 8).
1 2 3 4
Gambar 8 Kisaran berat molekul protein fage pada SDS-PAGE. 1) Marker. 2) fage FR84. 3) fage FR38. 4) fage FR19.
Hasil analisis Fage FR84 memperlihatkan ada 2 pita protein, fage FR19 memperlihatkan ada 3 pita protein, dan fage FR38 memperlihatkan ada 5 pita protein (Tabel 3).
Tabel 3 Berat molekul fage FR19, FR38, dan FR84
Nama Fage Berat Molekul
(kDa)
FR84 57.88; dan 12.68
FR19 42.28; 30.88; dan 16.48
FR38 120; 105.6; 60.99; 27.82; dan 16.48 10 kDa
[image:38.595.114.385.167.441.2]Pembahasan
Faktor lingkungan seperti pH berpengaruh terhadap kestabilan bakteriofage. Berdasarkan penelitian Chandra et al. (2011) bakteriofage spesifik
Salmonella dublin dapat stabil pada berbagai kisaran pH 4-10. Terdapat penurunan jumlah plak pada kondisi diluar pH optimum 7, akan tetapi fage tidak kehilangan aktivitasnya. Kestabilan fage dapat dilihat dari jumlah plak. Cara perhitungan ini adalah yang paling mudah dan dapat disamakan dengan perhitungan bakteri hidup. Plak yang terbentuk dari suatu kultur bakteri yang ditumbuhkan di cawan petri dapat dijadikan suatu parameter penting dari adanya fage pada siklus litik. Plak tersebut terlihat bening yang menandakan adanya zona kerusakan sel. Setiap plak berasal dari satu partikel fage. Satu plak berasal dari satu partikel virus sehingga partikel virus yang terdapat pada plak tersebut seharusnya juga memiliki sifat genetik yang sama. Pada saat terbentuknya plak, bakteri yang tidak terkena infeksi tersebar di tempat lain di dalam agar cawan dan menghasilkan suatu background yang keruh. Proses isolasi plak fage dilakukan secara hati-hati sampai dengan pemurnian untuk memastikan suatu populasi fage yang murni tanpa adanya beberapa bakteri termasuk inang bakteri yang tahan fage.
Pertumbuhan fage dapat dibagi dalam tiga periode, yaitu absorbsi fage terhadap bakteri; pertumbuhan ketika atau di dalam bakteri (periode laten); dan pelepasan fage (terjadi proses lisis) (Madigan et al. 2000). Pada penelitian Yoon
et al. (2007), yang meneliti fage litik yang menginfeksi Pediococcus diperoleh periode eclipse dan latent terjadi pada 29 menit dan 34 menit secara berturut-turut. Hal ini menunjukkan bahwa perkembangan intraselular dimulai tidak lama setelah infeksi terjadi. Pada fage litik AB1 yang menginfeksi Acinetobacter baumannii diperoleh satu tahap kurva pertumbuhan fage yang memperlihatkan periode latent pada menit ke 18 dan periode rise pada 30 menit (Yang et al. 2010). Berdasarkan hasil penelitian-penelitian tersebut, pertumbuhan fage litik
Salmonella sp. FR38, FR19, dan FR84 juga diperkirakan memiliki suatu periode
latent pada kisaran waktu antara 18-30 menit.
Salmonella sp. diinfeksikan dengan 100 µl fage yang diinkubasi pada pH 4-10) menunjukkan ketiga fage FR38, FR19, dan FR84 memiliki kondisi optimum pada pH 7 dan cendrung tahan pada suasana pH asam dibandingkan dengan pH basa. Kestabilan fage pada kondisi asam dibandingkan dengan basa kemungkinan dikarenakan pada pH basa dapat menyebabkan terjadinya denaturasi protein fage. Berdasarkan penelitian Siang et al. (2004) adanya perubahan pH dapat merubah struktur dari Peptide Binding Site yang terdapat di luar permukaan virus. Perubahan struktur protein ini mempengaruhi kestabilan interaksi antara fage dengan inang.
Suhu memegang peranan penting terhadap kestabilan protein fage. Beberapa protein dapat terdenaturasi pada suhu tinggi, bahkan pada suhu sedikit di atas suhu optimum (Siang et al. 2004). Ketiga fage FR38, FR19, dan FR84 stabil pada suhu 27°C dan 37°C, akan tetapi menjadi tidak stabil apabila suhu dinaikkan menjadi 45°C, 55°C, dan 60°C. Karakteristik fage FR39, FR19, dan FR84 sama dengan bakteriofage FBp-AMP1 yang menginfeksi Burkholderia pseudomallei. Fage tersebut tidak stabil pada suhu 60°C (Gatedee et al. 2011). Jumlah plak terbesar didapat pada inkubasi suhu 37°C selama 30 menit, akan tetapi jumlah plak ini terus menurun seiring dengan penambahan waktu inkubasi yaitu selama 60 dan 90 menit. Karakteristik ini berbeda dengan fage yang diinkubasi pada suhu 27°C. Pada suhu tersebut jumlah plak cenderung stabil hingga waktu inkubasi selama 60 dan 90 menit. Ketidakstabilan fage pada suhu yang cenderung tinggi dikarenakan pada suhu tersebut terjadi kerusakan beberapa partikel fage (Jończyk et al. 2011).
Berdasarkan penelitian Evilevitch et al. (2010) adanya multivalen ion seperti Mg2+ dan Sp4+ pada bufer dapat mengurangi tekanan hidrasi pada DNA fage yang menyebabkan perubahan struktur kapsid. Perubahan struktur kapsid pada fage ini mempengaruhi kestabilan fage di lingkungan. Bufer SM menjadi unggul dibandingkan dengan bufer lainnya karena terdapat gelatin pada bufer tersebut yang dapat melindungi fage. Berdasarkan penelitian Robenson et al. (2008) penambahan gelatin pada aplikasi bakteriofage di lapangan disarankan, karena dapat melindungi fage dari kondisi lingkungan yang kurang menguntungkan. Penyimpanan fage dalam bufer ringer menunjukkan hasil yang cukup stabil walaupun hasil terbaik diperoleh pada bufer SM. Komposisi kimia bufer ringer terdiri dari NaCl, KCl, CaCl2, MgCl2.6H2O, NaH2PO4, dan glukosa. Berdasarkan penelitian Cele (2009) penambahan Ca2+ dan Mg2+ secara bersamaan dapat meningkatkan jumlah plak fage, hal ini karena ion multivalen tersebut dapat meningkatkan efisiensi adsorbsi fage ke dalam sel inang. Kestabilan terendah terdapat pada fage yang diinkubasi dalam bufer PBS. Bufer ini terdiri dari NaCl, KCl, NaH2PO4, dan KH2PO4.Fage menjadi tidak stabil dikarenakan tidak adanya
ion multivalen pada bufer tersebut. Mylon et al. (2009) telah meneliti bahwa garam monovalen seperti NaCl dan KCl tidak mampu melindungi fage dan tidak mempengaruhi perkembangan fage.
Penampakan morfologi dari fage yang terpurifikasi diperiksa dengan menggunakan Transmission Electron Microscope (TEM). Pemeriksaan dengan TEM dapat memperlihatkan bentuk morfologi fage secara 2 dimensi dengan perbesaran 80000× dan 100000×. Bakteriofage dapat diklasifikasikan ke dalam famili berdasarkan morfologi dan ukurannya. Analisis morfologi dengan menggunakan TEM pada FR38 menunjukkan morfologi kepala fage yang besar dan berbentuk heksagonal ikosahedral. Diameter kepala fage sebesar 73.3 ± 0.21 nm dengan panjang ekor sebesar 93.7 ± 0.21 nm dan lebar ekor sebesar 17.3 ± 0.07 nm (Gambar 7a). Berdasarkan ciri-ciri morfologi yang dimiliki fage FR38, maka morfologi fage tersebut hampir serupa dengan banyak fage dari famili
Siphoviridae ordo Caudovirales. Berdasarkan klasifikasi dari International Committee on Taxonomy of Viruses (ICTVdB Index of Viruses 2002) fage yang termasuk ke dalam famili Siphoviridae memiliki ekor fleksibel, tidak memiliki selaput kontraktil, ekor panjang, heliks, dan kepala heksagonal ikosahedral. Morfologi fage FR19 dan 84 hampir serupa dengan fage dari family Podoviridae
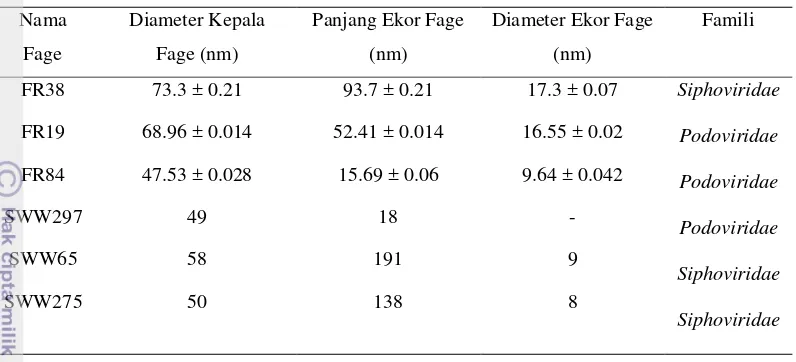
Tabel 4 Perbandingan morfologi fage FR38, FR19, dan FR84 dengan Turki et al. (2012)
Nama
Fage
Diameter Kepala
Fage (nm)
Panjang Ekor Fage
(nm)
Diameter Ekor Fage
(nm)
Famili
FR38 73.3 ± 0.21 93.7 ± 0.21 17.3 ± 0.07 Siphoviridae
Podoviridae
Podoviridae
Podoviridae
Siphoviridae
Siphoviridae
FR19 68.96 ± 0.014 52.41 ± 0.014 16.55 ± 0.02
FR84 47.53 ± 0.028 15.69 ± 0.06 9.64 ± 0.042
SWW297 49 18 -
SWW65 58 191 9
SWW275 50 138 8
Protein yang dimiliki oleh ketiga fage FR38, FR19, dan FR84 cenderung lebih besar dibandingkan dengan fage litik Enteropathogenic Escherichia coli
(Budiarti et al. 2011). Pada fage litik EPEC konsentrasi protein fage berkisar 82.5 µg/ml hingga 225.55 µg/ml. Hasil konsentrasi protein fage ini masih lebih rendah dibandingkan dengan konsentrasi fage litik Salmonella sp FR38, FR19, dan FR84, yaitu berkisar 230 µg/ml hingga 305 µg/ml. Setelah dijalankan dengan SDS-PAGE, ketiga fage Salmonella sp. FR38, FR19, dan FR84 menunjukkan adanya pita protein. Kisaran protein yang diperoleh antara 12.68 hingga 120 kDA (Gambar 8). Hal ini hampir serupa dengan penelitian Andrews et al. (2005), dimana setelah dianalisis dengan SDS-PAGE menunjukkan kisaran ukuran protein 18-215.4 kDa untuk fage yang menginfeksi Salmonella enteric Serovar
SIMPULAN DAN SARAN
Simpulan
Ketiga Fage litik Salmonella sp. FR38, FR19, dan FR84 memiliki karakteristik yang sama terhadap kondisi pH, suhu, dan bufer, yaitu optimal pada pH netral, suhu mesofil, dan dalam bufer SM. Ketiga fage tersebut tidak stabil pada suhu termofil. Fage FR38 memiliki kestabilan terbaik dalam bufer SM. Fage FR38 tidak kehilangan aktivitasnya setelah penyimpanan selama 8 minggu dalam SM bufer pH netral pada suhu penyimpanan dingin dan suhu ruang. Analisis morfologi dengan menggunakan TEM pada fage FR38 menunjukkan kepala fage yang berbentuk heksagonal ikosahedral.
Saran
DAFTAR PUSTAKA
Andrews D et al. 2005. Bacteriophage P22 tail accessory factor GP26 is a long triple-stranded coiled-coil. J Biol Chem 7: 5929-5993.
Atamer Z, Dietich J, Müller-Merbach M, Neve H, Heller KJ, Hinrichs J. 2008. Screening for and characterization of Lactococcus lactis
bacteriophages with high thermal resistance. J Int Diary 19:228–235. Atterbury RJ, Connerton PL, Dodd CER, Rees CED, Connerton IF. 2003.
Application of host-specific bacteriophages to the surface of chicken skin leads to a reduction in recovery of Campylobacter jejuni. Appl Environ Microbiol 69: 6302–6306.
Bielke LR, Higgins SE, Donoghue AM, Donoghue DJ, Hargis BM, Tellez G. 2007. Use of widehost range bacteriophages to reduce Salmonella on poultry products. J Poul Sci 6: 754-757.
Bradford MM. 1976. A rapid and sensitive method for the quantification of microgram quantities of protein utilizing the principle of protein utilizing the principle of protein dye binding. Anal Biochem 72: 248-254.
Budiarti S, Pratiwi RH, Rusmana I. 2011. Infectivity of lytic phage to enteropathogenic Escherichia coli from diarrheal patients in Indonesia. JUCMS 8:72-81.
Carey GVS, Billington C, Cornelius AJ, Hudson JA, Heinemann JA. 2006. Isolation and characterisation of bacteriophages infecting Salmonella
spp. FEMS Microbiol Lett 258: 182–186.
Carrillo CL, Attembury RJ, Shibiny PL, Connerton, Dillon, Scott A, Connerton IF. 2005. Bacteriophage therapy to reduce Campylobacter jejuni colonization of broiler chickens. Appl Environ Microbiol 71: 6554-6563.
Cele N. 2009. Strategies to control bacteriophage infection in threonine bioprocess [tesis]. South Africa: Durban University of Technology. Chandra M, Thakur S, Narang D, Saxena HM. 2011. Isolation of a bacteriophage
against Salmonella dublin and determination of its physical resistance under varied in vitro conditions. J Microbiol 5: 2044-2047.
Djaafar TF, Rahayu S. 2007. Cemaran mikroba pada produk pertanian, penyakit yang ditimbulkan dan pencegahannya. J Litbang Pertan 26: 1-9. Evilevitch A, Roos WH, Ivanovska IL, Jeembaeva M, Jonsson B, Wuite GJL.
2010. Effect of salt on internal DNA pressure and mechanical properties of phage capsids. J Mol Biol 405: 18-23.
Fiorentin L, Vieira ND, Barioni JW. 2005. Use of lytic bacteriophages to reduce
Foschino R, Perrone F, Galli A. 1995. Cracterization of two virulent Lactobacillus fermentum bacteriophages isolated from sour dough. Appl Bacteriol
79:677-683.
Flynn GO, Ross RP, Fitzgerald GF, Coffey A. 2004. Evaluation of a cocktail of three bacteriophages for biocontrol of Escherichia coli 0157:H7 Appl Environ Microbiol 70: 3417-3424.
Gatedee J, Kritsiriwuthinan K, Galyov EE, Shan J, Dubinina E, Intarak N, Martha RJC, Korbsrisate S. 2011. Isolation and characterization of a novel podovirus which infects Burkholderia pseudomallei. J Virol 8: 1-5. Goodridge L, Gallaccio A, Griffiths MW. 2003. Morphological, host range, and
genetic characterization of two coliphages. Appl Environ Microbiol
69:5364-5371.
Higgins JP, Gaona G, Wolfenden AD, Tellez G, Hargis BM. 2005. Ability of bacteriophages isolated from different sources to reduce Salmonella enterica Serovar enteritidis in vitro and in vivo. J poul Sci 86(9): 1904-1909.
International Committee on Taxonomy of Viruses. 2002. [terhubung berkala]. http://ictvdb.bio-mirror.cn/Ictv/fs_podov.htm [ 7 Mar 2012].
Jepson CD, March JB. 2004. Bacteriophage lambda is highly stable DNA vaccine delivery vehicle. Vaccine 22:3413–1419.
Jończyk E, Kłak M, Międzybrodzki R, Górski A. 2011. The influence of external factors on bacteriophages. J Folia Microbiol 56:191–200.
Laemmli EK. 1970. Cleavage of structural protein during the assembly of head of bacteriophage T4. J Natur 227:680-685.
Madigan MT, Martinko JM, Jack P. 2000. Brock Biology of Microorganisms. Ed ke-9. New Jersey: Prentice Hall.
Mylon SE, Rinciog CI, Schmidt N, Gutierrez L. 2009. Influence of salt and natural organic matter on the stability of bacteriophage MS2.
Langmuir 30: 1-8.
Oliveira CM, Reginato RA, Ruschel PF. 2006. Antibiotic resistance in
Salmonella Enteritidis isolated from broiler carcasses. J Braz Microbiol 37: 1517-8382.
Olson MR, Axler RP, Hicks RE. 2004. Effects of freezing and storage temperature on MS2 viability. J Virol Meth 122:147–152.
Pelczar MJ, Chan ECS. 2006. Dasar-dasar Mikrobiologi 1, Alih bahasa: Hadioetomo RS, Imas T, Tjitrosomo SS, dan Angka SL. Jakarta: UI Press.
Phumkhachorn P, Rattanachaikunsopon P. 2010. Isolation and partial characterization of a bacteriophage infecting the shrimp pathogen
Robenson J, Retamales J, Borie C. 2008. Genomic variants of bacteriophages against Salmonella enterica serovar enteritidis with potential application in the poultry industry. JPoul Sci 10: 173-178.
Rode TM, Axelsson L, Granum PE, Even. 2011. High stability of Stx2 phage in food and under food-processing conditiond. Appl Environ Microbiol
77: 5336.
Ronnest SA, Dalsgaard I, Middelboe M. 2008. Isolation and characterization of bacteriophages infecting the fish pathogen Flavobacterium psychrophilum.Appl Environ Microbiol 74: 4070–4078.
Siang TW, Ramanujam P, Nathan S. 2004. Effect pH and temperature on the binding of a fusion phage to newcastle disease virus. J Biochem 9: 35-37.
Smith HW, Huggins MB, Shaw KM. 1987. The control of experimental Escherichia coli diarrhoea in calves by means of bacteriophages. J Gen Microbiol 133: 1111-1126.
Sunarti RN. 2011. Spesifitas dan efektivitas fage litik Salmonella sp. resisten antibiotik [tesis]. Bogor: Program Pascasarjana, Institut Pertanian Bogor.
Snyder L, Champness W. 2003. Molecular Genetics of Bacteria. Ed ke-2. Washington: Asm Press.
Soni K, Nannapenen R. 2010. Bacteriophage significantly reduces Listeria monocytogenes on raw salmon fillet tissue. J Food Protect 73: 32-38. Turki Y, Ouzari H, Mehri I , Ammar AB , Hassen A. Evaluation of a cocktail of
three bacteriophages for the biocontrol of Salmonella of wastewater. J Food Internation 45: 1099–1105.
Verthe K, Possemiers S, Boon N, Vaneechoutte M, Verstraete W. 2004. Stability and activity of an Enterobacter aerogenes-specific bacteriophage under simulated gastro-intestinal conditions. Appl Microbiol Biotechnol 65: 465–472.
Yang H, Liang , Shuxiang L, Shiru J. 2010. Isolationland characterization of a virulent bacteriophage AB1 of Acinetobacter baumannii. J Microbiol
10:1-10.
Yates MV, Gerba CP, Kelley LM. 1985. Virus persistence in ground water. Appl Environ Microbiol 31:778–781.
Lampiran 1 Komposisi Bufer
a. Bufer Ringer
No Jenis Bahan Jumlah
1 NaCl 8 g
2 KCl 0,42 g
3 CaCl2 0,24 g
4 NaHCO3 0,20 g
5 H2O 1 L
b. Bufer SM
No Jenis Bahan Jumlah
1 NaCl 5,8 g
2 MgSO4.7H2O 2 g
3 Tris-Cl 50 ml
4 Gelatin 5 ml
5 H2O 1 L
c. Bufer Phosphate Buffer Saline (PBS)
No Jenis Bahan Jumlah
1 NaCl 8,01 g
2 KCl 0, 2 g
3 Na2HPO4.2H2O 1,78 ml
4 KH2PO4 0,27 ml
Lampiran 2 Pembuatan pereaksi Bradford untuk pengukuran konsentrasi protein
Coomassie Brilliant Blue G-250 sebanyak 100 mg dilarutkan di dalam 50 ml etanol 95%. Kemudian ditambahkan 100 ml asam orto-fosfat 85% dan diencerkan dengan akuades sampai satu liter. Larutan ini kemudian disaring dengan kertas saring. Larutan stok lima kali ini dapat disimpan beberapa bulan pada suhu 4°C dan apabila akan digunakan, satu bagian larutan stok ini diencerkan dengan empat bagian akuades.
Lampiran 3 Komposisi bahan untuk membuat gel pengumpul dan gel pemisah
No Komponen Konsentrasi
Gel pengumpul (4%)
Gel Pemisah (10%)
1 Larutan stok akrilamida 30% 0.67 ml 3.3 ml
2 Bufer gel pemisah - 2.5 ml
3 Bufer gel pengumpul 1.25 ml -
4 Akuades 3.075 ml 4.1 ml
5 SDS 10% (w/v) 0.05 ml 0.1 ml
6 Amonium persulfat 10% (w/v) 0.05 ml 0.1 ml
7 TEMED 0.005 ml 0.01 ml
Lampiran 4 Prosedur pewarnaan silver stain dan komposisi larutan yang digunakan
Gel diendapkan ke dalam larutan fixaxi selama 2 jam
Gel dicuci dengan larutan washing solution selama 20 detik
Bilas dengan akuades bebas ion (ddH2O) selama 10 menit
Gel direndam dalam larutan sensitizing selama 1 menit
Di bilas dengan ddH2O selama 20 detik
Gel diinkubasi ke dalam kulkas dengan penambahan 0.1% AgNO3 selama 20 detik
Di cuci dengan ddH2O selama 20 menit
Pindahkan tempat kemudian dicuci kembali dengan ddH2O selama 10 menit
Dibilas dengan larutan developing, hingga pewarnaan cukup
Tambahkan stop solution selama 5 detik
Komposisi larutan fixaxi terdiri dari: metanol 50%, asam asetat 12%, dan formalin 0.05%. Komposisi washing solution terdiri daari etanol 20%. Komposisi
sensitizing terdiri dari Na2S2O3 sebanyak 0.05 g dalam larutan 250 L ddH2O. Komposisi larutan developing terdiri dari Na2CO3 sebanyak 3 g, formalin 25 µl, AgNO3 0.1 g dalam 50 ml akuades bebas ion. Komposisi stop solution terdiri dari asam asetat sebanyak 60 ml dan akuades bebas ion sebanyak 440 ml.
Lampiran 5 Kurva standard protein untuk penentuan konsentrasi sampel
Konsentrasi BSA (ppm) Absorbansi terkoreksi (OD)
0 0
0.02 0.074
0.04 0.1455
0.06 0.184
0.08 0.255
0.1 0.2985
y = 2.962x + 0.011 R² = 0.991
0 0.05 0.1 0.15 0.2 0.25 0.3 0.35
0 0.02 0.04 0.06 0.08 0.1 0.12
OD
(
595 n
m
)
ABSTRACT
SANG AYU PUTU LISTYA. Characterization lytic Phage of Salmonella sp.
FR38, FR19, and FR84. Under direction of SRI BUDIARTI and IMAN RUSMANA.
The ability of bacteriophage to survive under unfavorable conditions is different depend on the strains. Various external physical and chemical factors such as pH, temperature, and buffer can inactivate a phage. The aim of this research was to characterized lytic phage Salmonella FR38, such as: analyze the stability of lytic phage of Salmonella sp. FR38, FR19, and FR84 i.e: stability of lytic activity of phage on different conditions of pH, temperature, buffers, and morphological structure. Phage FR38, FR19, and FR84 could survive at various pH conditions.A temperature above 60°C was found to be deleterious for survival of the phages. Phage FR38 had the highest stability in various conditions. The best performance buffer for storage of phage was SM buffer at pH 7 and temperature of 27°C. Phage stored in buffer at low temperatures (4°C) showed that the number of plaque was not different to that of at room temperature. Transmission electron microscopy analysis showed that phage FR38 had an icosahedral head 73.3 ± 0.21 nm in diameter and noncontractile tail of 93.7 ± 0.21 nm in length and 17.3 ± 0.07 nm in diameter. Phage FR19 had an icosahedral head with 68.96 ± 0.014 nm in diameter and noncontractile tail of 52.41 ± 0,014 nm in length and 16.55 ± 0.02 nm in diameter. While phage FR84 had an icosahedral head 47,53 ± 0.028 nm in diameter and noncontractile tail of 15.69 ± 0.06 nm in length and 9.64 ± 0.042 nm in diameter. The proteins of FR38, FR19, and FR84 had molecular weights of 16.48 – 120.49 kDa, 16.48 – 42.28 kDa, and 12.68 – 57.88 kDa respectively.
RINGKASAN
SANG AYU PUTU LISTYA. Karakterisasi Fage Litik Salmonella sp. FR38, FR19, dan FR84. Dibimbing oleh SRI BUDIARTI dan IMAN RUSMANA.
Penyakit infeksi di Indonesia masih menduduki peringkat pertama. Infeksi ini tidak hanya terjadi di negara berkembang, akan tetapi terjadi pula di negara maju. Sebagai contoh yang sering terjadi di Eropa dan Amerika Serikat adalah kasus penyakit yang disebabkan oleh Salmonella enteritidis yang ditularkan melalui daging ayam, telur, dan produk olahannya. Beberapa bakteri patogen seperti E. coli, Salmonella, Shigella, Staphylococcus aureus, dan Campylobacter
sp. juga dapat mencemari makanan. Dari 18 kasus keracunan makanan yang terjadi pada tahun 2003, sebesar 83,30% disebabkan oleh bakteri patogen, dan pada tahun 2004 dan 2005 masing-masing 60% dari 41 kasus dan 72,20% dari 53 kasus. Antibiotik telah digunakan untuk terapi akibat infeksi bakteri patogen tersebut, akan tetapi pada saat ini penggunaan antibiotik menjadi tidak efektif karena munculnya resistensi dan akumulasi residu bagi pengkonsumsinya.
Fage litik Salmonella sp FR38, FR19, dan FR84 adalah fage yang diisolasi dari limbah cair rumah tangga (LCRT) di daerah Babakan, Darmaga. Pada penelitian tersebut dilaporkan fage litik ini dapat melisiskan Salmonella sp. resisten antibiotik yang diisolasi dari feses penderita diare di Puskesmas Sindang Barang Bogor.
pada pH 5 dan pH 4 sebesar 27.7% dan 48.8%, sedangkan dalam kondisi basa, yaitu pH 9 dan pH 11 terjadi penurunan jumlah plak yang lebih besar yaitu 52.3% dan 73.3%. Fage FR 19 memiliki kestabilan terendah dibandingkan dengan FR38 dan FR19. Pada FR84 terjadi penurunan jumlah plak pada pH 5 dan pH 4 sebesar 42.7% dan 62.7%, serta dalam pH 9 dan pH 11 terjadi penurunan jumlah plak yang lebih besar yaitu 46.7% dan 77.3%.
Fage FR38, FR19, dan FR84 cenderung stabil pada suhu 27°C dan 37°C. Pada Fage FR38 yang diinkubasi selama 30 menit pada suhu 27°C jumlah plak lebih kecil dibandingkan dengan fage yang diinkubasi selama 30 menit pada suhu 37°C, tetapi jumlah plak tetap stabil setelah diinkubasi selama 60 dan 90 menit. Jumlah plak tertinggi terjadi pada suhu 37°C setelah inkubasi 30 menit, akan tetapi jumlah plak tidak stabil setelah inkubasi 60 dan 90 menit. Terjadi penurunan plak sebesar 7.5% setelah inkubasi 90 menit. Fage FR38 tidak stabil pada suhu 45°C, dan 55°C, dan 60°C. Ketidakstabilan fage terlihat dari penurunan jumlah plak atau sama sekali tidak terbentuk plak. Fage FR19 dan FR84 memiliki karakteristik yang sama dengan fage FR38 yaitu tidak stabil pada suhu 45°C, 55°C, dan 60°C.
Pengujian efek bufer terhadap stabilitas bakteriofage bertujuan untuk mengetahui bufer terbaik untuk penyimpanan bakteriofage. Perlakuan penyimpanan fage dilakukan pada tiga bufer yang berbeda, yaitu: SM (NaCl, MgSO4.7H2O, Gelatin, Tris-Cl), Ringer (NaCl, KCl, CaCl2, MgCl2.6H2O, NaH2PO4, dan glukosa), dan PBS (NaCl, KCl, NaH2PO4, dan KH2PO4) pada dua suhu yang berbeda, yaitu: suhu ruang (27°C) dan suhu dingin (4°C). Penyimpanan fage di dalam Nutrient Broth (NB) dijadikan sebagai kontrol. Kestabilan terbaik terdapat pada fage yang disimpan dalam bufer SM ( 275×107 pfu/ml ) dan diikuti secara berturut-turut pada bufer Ringer ( 120×107 pfu/ml ), dan PBS ( 100×107 pfu/ml ).
Analisis morfologi dengan menggunakan TEM pada Fage FR 38
menunjukkan kepala fage yang berbentuk heksagonal ikosahedral. Diameter kepala fage sebesar 73.3 ± 0.21 nm dengan panjang ekor sebesar 93.7 ±
± 0.014 nm dengan panjang ekor sebesar 52.41 ± 0.014 nm dan lebar ekor sebesar 16.55 ± 0.02 nm. Fage FR84 menunjukkan diameter kepala fage sebesar 47.53 ± 0.028 nm dengan panjang ekor sebesar 15.69 ± 0.06 nm dan lebar ekor sebesar 9.64 ± 0.042 nm.
Kadar protein masing-masing fage berbeda satu sama lain. Fage FR38 memiliki konsentrasi protein yang paling tinggi, yaitu sebesar 305 µg/ml dan dikuti secara berturut-turut oleh FR19, dan FR84 yaitu sebesar 268 µg/ml dan 230 µg/ml. Setelah dilihat dengan SDS-PAGE, hasil analisis fage FR38 memperlihatkan ada 5 pita protein, dengan berat molekul 120; 105.6; 60.99; 27.82; dan 16.48 kDa. Fage FR19 memperlihatkan ada 3 pita protein, dengan berat molekul 42.28; 30.88; dan 16.48 kDa. Fage FR84 memperlihatkan ada 2 pita protein 57.88 dan 12.68.
PENDAHULUAN
Latar Belakang
Penyakit infeksi di Indonesia masih menduduki peringkat pertama. Infeksi ini tidak hanya terjadi di negara berkembang, akan tetapi terjadi pula di negara maju. Sebagai contoh yang sering terjadi di Eropa dan Amerika Serikat adalah kasus penyakit yang disebabkan oleh Salmonella enteritidis yang ditularkan melalui daging ayam, telur, dan produk olahannya (Higgins et al. 2005). Beberapa bakteri patogen seperti E. coli, Salmonella, Shigella, Staphylococcus aureus, dan
Campylobacter sp. juga dapat mencemari makanan. Dari 18 kasus keracunan makanan yang terjadi pada tahun 2003, sebesar 83,30% disebabkan oleh bakteri patogen, dan pada tahun 2004 dan 2005 masing-masing 60% dari 41 kasus dan 72,20% dari 53 kasus (Djaafar et al. 2007).
Bakteri patogen tidak hanya menyerang manusia, akan tetapi dapat juga menginfeksi hewan, produk peternakan, dan tanaman penting lainnya. Serangan ini mengakibatkan berkurangnya nilai ekonomis. Penggunaaan antibiotik pada saat ini menjadi tidak efektif dikarenakan munculnya mekanisme resisten. Berdasarkan penelitian Oliveira et al. (2006) menunjukkan beberapa isolat
Salmonella yang berasal dari isolasi karkas ayam multiresisten terhadap enam jenis antibiotik secara invitro yakni: kanamisin, enrofloxacin, neomisin, fosfomisin, sulphonamides dan nitrofurantoin. Tingkat resistensinya sebesar 1.25% terhadap kanamisin, 3.75% terhadap enrofloxacin, 20% terhadap fosfomisin, 86.25% terhadap sulphonamides, dan 90% terhadap nitrofurantoin. Munculnya bakteri-bakteri resisten terhadap antibiotik mendorong para ilmuan untuk mencari biokontrol alami yang ramah lingkungan untuk mengatasi bakteri patogen ini.
(LCRT) di daerah Babakan, Darmaga (Sunarti 2011). Pada penelitian tersebut dilaporkan fage litik ini dapat melisiskan Salmonella sp. resisten antibiotik yang diisolasi dari feses penderita diare di Puskesmas Sindang Barang Bogor.
Bakteriofage telah digunakan sebagai biokontrol pencemaran makanan oleh Bielke et al. (2007). Pada penelitian tersebut dilaporkan bakteriofage memiliki kemampuan untuk mereduksi Salmonella pada produk pakan ayam.
Atterbury et al. (2003) telah melaporkan bahwa bakteriofage dapat mereduksi
Campylobacter jejuni pada permukaan kulit ayam. Ronnest et al. (2008) melakukan isolasi bakteriofage yang berasal dari perairan Scandinavia. Fage tersebut dapat dijadikan sebagai biokontrol terhadap Flavobacterium psychrophilum yang merupakan patogen terhadap ikan salmon dan dapat menyebabkan kematian.
Tujuan
Tujuan dari penelitian ini adalah untuk mengkarakterisasi fage litik
Salmonella sp. FR38, FR19, dan FR84 dengan cara menganalisis kestabilan fage FR38, FR19, dan FR84 pada berbagai pH, suhu, dan bufer, serta karakteristik morfologinya.
Manfaat Penelitian