1
STUDI PENYERAPAN LOGAM BESI (Fe) DAN SULFAT
DARI LIMBAH INDUSTRI PERTAMBANGAN DENGAN
ADSORBEN KULIT UBI KAYU DAN
SPENT MUSHROOM
SUBSTRAT (SMS)
T E S I S
Oleh
FAISAL ABRANY SIREGAR
107004001/PSL
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
STUDI PENYERAPAN LOGAM BESI (Fe) DAN SULFAT
DARI LIMBAH INDUSTRI PERTAMBANGAN DENGAN
ADSORBEN KULIT UBI KAYU DAN
SPENT MUSHROOM
SUBSTRAT (SMS)
T E S I S
Diajukan Sebagai Salah Satu Syarat untuk Memperoleh Gelar Magister Sains dalam Program Studi Pengelolaan Sumber Daya Alam dan Lingkungan
pada Sekolah Pascasarjana Universitas Sumatera Utara
Oleh
FAISAL ABRANY SIREGAR
107004001/PSL
SEKOLAH PASCASARJANA
UNIVERSITAS SUMATERA UTARA
Judul Tesis : STUDI PENYERAPAN LOGAM BESI (Fe) DAN
SULFAT DARI LIMBAH INDUSTRI
PERTAMBANGAN DENGAN ADSORBEN
KULIT UBI KAYU DAN SPENT MUSHROOM
SUBSTRAT (SMS)
Nama Mahasiswa : Faisal Abrany Siregar
Nomor Pokok : 107004001
Program Studi : Pengelolaan Sumber Daya Alam dan Lingkungan
Menyetujui, Komisi Pembimbing
(Prof. Dr. Setiaty Pandia) Ketua
(Prof. Dr. Harry Agusnar, MSc, M.Phil) Drs. Chairuddin,
MSc
Anggota Anggota
Ketua Program Studi, Direktur,
(Prof. Dr. Retno Widhiastuti, MS) (Prof. Dr. Ir. A. Rahim Matondang, MSIE)
Telah diuji pada
Tanggal : 07 Januari 2013
PANITIA PENGUJI TESIS
Ketua : Prof. Dr. Setiaty Pandia
Anggota : 1. Prof. Dr. Harry Agusnar, MSc, M.Phil
2. Drs. Chairuddin, MSc
3. Prof. Dr. Harlem Marpaung
PERNYATAAN
Judul Tesis
STUDI PENYERAPAN LOGAM BESI (Fe) DAN SULFAT DARI LIMBAH INDUSTRI PERTAMBANGAN DENGAN ADSORBEN KULIT UBI KAYU
DAN SPENT MUSHROOM SUBSTRAT (SMS)
Dengan ini penulis menyatakan bahwa tesis ini disusun sebagai syarat untuk memperoleh gelar Magister Sains pada Program Studi Pengelolaan Sumber Daya Alam dan Lingkungan Sekolah Pascasarjana Universitas Sumatera Utara adalah benar merupakan hasil karya penulis sendiri.
Adapun pengutipan – pengutipan yang penulis lakukan pada bagian – bagian tertentu dari hasil karya orang lain dalam penulisan tesis ini, telah penulis cantumkan sumbernya secara jelas sesuai dengan norma, kaidah, dan etika penulisan ilmiah.
Apabila di kemudian hari ternyata ditemukan seluruh atau sebagian disertasi ini bukan hasil karya penulis sendiri atau adanya plagiat dalam bagian – bagian tertentu, penulis bersedia menerima sanksi pencabutan gelar akademik yang penulis sandang dan sanksi – sanksi lainnya sesuai dengan peraturan perundangan yang berlaku.
Medan, Januari 2013 Penulis,
ABSTRAK
Salah satu dampak yang dihasilkan dari kegiatan penambangan adalah terbentuknya proses air asam tambang. Karaktersitik air asam tambang yang dihasilkan dari industri pertambangan di daerah Batangtoru, Tapanuli Selatan adalah tingginya konsentrasi logam besi (Fe) 4086,86 mg/L dan konsentrasi Sulfat 5131,25 mg/L. Tujuan dari penelitian ini adalah untuk mengetahui efisiensi pengolahan alternatif air asam tambang dengan menggunakan media karbon aktif berbahan dasar kulit bagian dalam ubi kayu dan material organik Spent Mushroom Substrat (SMS) dari sisa pengolahan industri pengembangbiakan jamur. Hasil dari masing – masing media ini menghasilkan adsorpsi logam besi (Fe) sebesar 84,50% dan penyisihan Sulfat sebesar 63,24 % dengan media karbon aktif dan efisiensi penyisihan logam besi (Fe) sebesar 99,99% dan 72,41% untuk penyisihan Sulfat dengan media SMS.
ABSTRACT
One of the effects of mining activity is the forming of the process of acid mine drainage. The characteristics of acid mine drainage produced by mining industry at Batangtoru, South Tapanuli, is high in iron metal (Fe) concentration at 4086.86 mg/L and in sulfate concentration at 5131.25 mg/L. The aim of the research was to know the efficiency of alternative processing of acid mine drainage using the medium of active carbon made of inner peel of cassava and Spent Mushroom Substrate (SMS) from waste of mushroom industrial processing. The results demonstrated that the adsorption of iron metal (Fe) and sulfate using activated carbon were 84.50% and 63.24%, respectively and the adsorption of iron metal (Fe) and sulfate using Spent Mushroom Substrate (SMS) were 99.99% and 72.41%, respectively.
Keywords: Acid Mine Drainage, Concentration of Iron Metal (Fe), Concentration of Sulfate, Adsorption, Active Carbon, Spent Mushroom Substrate
KATA PENGANTAR
Segala puji bagi Allah Subhanahu Wata‟ala atas yang telah memberikan
kesempatan dan kesehatan kepada penulis untuk menyelesaikan tesis ini. Shalawat beriring salam penulis sampaikan kepada nabi besar Muhammad Shallallahu „Alaihi Wassalam.
Dalam penyusunan tesis ini penulis banyak mendapat bantuan, bimbingan dan arahan dari berbagai pihak. Dalam kesempatan ini penulis menyampaikan ucapan terima kasih dan penghargaan yang setinggi-tingginya kepada :
1. Bapak Prof. Dr. dr. Syahril Pasaribu, DTM&H, MSc(CTM), SpA(K), selaku Rektor Universitas Sumatera Utara.
2. Bapak Prof. Dr. Ir. A. Rahim Matondang, MSIE selaku Direktur Sekolah Pascasarjana Universitas Sumatera Utara.
3. Ibu Prof. Dr. Retno Widhiastuti, MS selaku Ketua Program Studi Pengelolaan Sumber Daya Alam dan Lingkungan Sekolah Pascasarjana Universitas Sumatera Utara.
4. Ibu Prof. Dr. Setiaty Pandia, selaku ketua komisi Dewan Pembimbing yang telah membimbing dan mengarahkan penulis dalam penulisan tesis ini.
6. Bapak Drs. Chairuddin, MSc selaku anggota komisi Dewan Pembimbing dan selaku Sekretaris Program Studi Magister Pengelolaan Sumber Daya Alam dan Lingkungan Sekolah Pascasarjana Universitas Sumatera Utara. 7. Bapak Prof. Dr. Harlem Marpaung dan Bapak Prof. Dr. Ir. B. Sengli J
Damanik selaku dosen pembanding atas saran, kritik dan arahan guna perbaikan tesis ini.
8. Seluruh Dosen pengajar, staf administrasi dan rekan – rekan mahasiswa yang telah banyak membantu selama perkuliahan hingga penulisan tesis ini.
9. Kedua orang tua, istri dan anak tercinta untuk semangat dan dorongan motivasi yang telah diberikan kepada penulis.
Tak lupa penulis menghaturkan permohonan maaf atas segala kekurangan kepada semua pihak dalam kaitan dengan proses penyusunan tesis ini serta selama dalam proses pendidikan saya dan berharap semoga tesis ini dapat bermanfaat bagi semua pihak yang berkepentingan.
Medan, Januari 2013
DAFTAR ISI
Halaman
ABSTRAK ... i
ABSTRACT ... ii
KATA PENGANTAR ... iii
DAFTAR ISI ... v
DAFTAR TABEL ... vii
DAFTAR GAMBAR ... ... viii
DAFTAR LAMPIRAN ... ix
BAB I PENDAHULUAN ... 1
1.1 Latar Belakang ... 1
1.2 Perumusan Masalah ... 3
1.3 Tujuan ... 3
1.4 Hipotesis ... 3
1.5 Manfaat Penelitian ... 4
BAB II TINJAUAN PUSTAKA ... 5
2.1 Industri Pertambangan ... 5
2.2 Air Asam Tambang (AAT)... 6
2.3 Pengolahan Air Asam Tambang ... 9
2.4 Metoda Successive Alkalinity Producing System (SAPS) ... 10
2.5 Adsorpsi dan Jenis Adsorpsi ... 12
2.6 Jenis Adsorben ... 13
2.7 Kulit Dalam Ubi Kayu Sebagai Adsorben Arang Aktif ... 14
2.8 Percobaan Batch ... 17
2.9 Isoterm Freundlich ... 17
2.10 Isoterm Langmuir ... 18
2.11 Isoterm Brunauer – Emmet – Teller (BET) ... 19
2.12 Analisis Regresi ... 20
2.13 Analisis Korelasi ... 21
BAB III METODE PENELITIAN ... 24
3.1 Tempat dan Waktu Penelitian... 24
3.2 Persiapan Alat dan Bahan ... 24
3.2.1 Pengambilan Sampel dan Persiapan Media ... 24
3.2.2 Media SMS ... 24
3.2.3 Media Karbon Aktif ... 25
3.3 Langkah Kerja ... 26
3.4 Diagram Alir Penelitian ... 28
BAB IV HASIL DAN PEMBAHASAN ... 29
4.1 Karakteristik Air Asam Tambang ... 29
4.2 Uji Pendahuluan ... 30
4.4 Penentuan Isoterm ... 33
4.4.1 Model Isoterm Freundlich ... 33
4.4.2 Model Isoterm Langmuir ... 34
4.4.3 Model Isoterm Brunauer – Emmet – Teller (BET) ... 36
4.5 Pemilihan Model Adsorpsi Fe ... 38
4.6 Analisis Sulfat dengan Media Karbon Aktif ... 39
4.7 Pemilihan Model Adsorpsi Sulfat ... 40
4.8 Analisis Fe dengan Media SMS ... 43
4.9 Analisis Sulfat dengan Media SMS ... 48
4.10 Perbandingan Biaya Pembuatan Karbon Aktif dan Media SMS . 51 BAB V KESIMPULAN DAN SARAN ... 52
5.1 Kesimpulan ... 52
5.2 Saran ... 52
DAFTAR TABEL
No. Judul Halaman
DAFTAR GAMBAR
No. Judul Halaman
DAFTAR LAMPIRAN
No Lampiran Halaman
1. Hasil analisa laboratorium pra-penelitian 56 2. Hasil analisa laboratorium parameter Fe dengan media
karbon aktif
57 3. Hasil analisa laboratorium parameter Sulfat dengan media
karbon aktif
58 4. Hasil analisa laboratorium parameter Sulfat dengan media
SMS
ABSTRAK
Salah satu dampak yang dihasilkan dari kegiatan penambangan adalah terbentuknya proses air asam tambang. Karaktersitik air asam tambang yang dihasilkan dari industri pertambangan di daerah Batangtoru, Tapanuli Selatan adalah tingginya konsentrasi logam besi (Fe) 4086,86 mg/L dan konsentrasi Sulfat 5131,25 mg/L. Tujuan dari penelitian ini adalah untuk mengetahui efisiensi pengolahan alternatif air asam tambang dengan menggunakan media karbon aktif berbahan dasar kulit bagian dalam ubi kayu dan material organik Spent Mushroom Substrat (SMS) dari sisa pengolahan industri pengembangbiakan jamur. Hasil dari masing – masing media ini menghasilkan adsorpsi logam besi (Fe) sebesar 84,50% dan penyisihan Sulfat sebesar 63,24 % dengan media karbon aktif dan efisiensi penyisihan logam besi (Fe) sebesar 99,99% dan 72,41% untuk penyisihan Sulfat dengan media SMS.
ABSTRACT
One of the effects of mining activity is the forming of the process of acid mine drainage. The characteristics of acid mine drainage produced by mining industry at Batangtoru, South Tapanuli, is high in iron metal (Fe) concentration at 4086.86 mg/L and in sulfate concentration at 5131.25 mg/L. The aim of the research was to know the efficiency of alternative processing of acid mine drainage using the medium of active carbon made of inner peel of cassava and Spent Mushroom Substrate (SMS) from waste of mushroom industrial processing. The results demonstrated that the adsorption of iron metal (Fe) and sulfate using activated carbon were 84.50% and 63.24%, respectively and the adsorption of iron metal (Fe) and sulfate using Spent Mushroom Substrate (SMS) were 99.99% and 72.41%, respectively.
Keywords: Acid Mine Drainage, Concentration of Iron Metal (Fe), Concentration of Sulfate, Adsorption, Active Carbon, Spent Mushroom Substrate
BAB I. PENDAHULUAN
1.1 Latar belakang
Indonesia dikenal sebagai negara yang kaya akan kandungan bahan tambang atau mineral. Majalah The economist tahun 2007 dalam Sembiring (2009), melaporkan rangking Indonesia dalam komoditas global dunia seperti timah penghasil ke-2 terbesar dunia, emas (7), Nikel (5), Tembaga (5) dan Batubara (7). Hal ini mendorong pemerintah dan masyarakat untuk melakukan eksploitasi bahan tambang untuk memenuhi kebutuhan dan kegiatan ekonominya.
Di sisi lain kegiatan penambangan akan menghasilkan perubahan dan dampak terhadap lingkungan. Salah satu dampak yang dihasilkan dari kegiatan eksploitasi penambangan adalah terbentuknya proses air asam tambang. Air asam tambang merupakan hasil dari proses oksidasi dari pirit yang membentuk asam sulfat, menghasilkan debit yang bersifat asam dan juga mengandung logam seperti besi, alumunium dan mangan. Keasaman dan kandungan logam di dalamnya berdampak kepada ekosistem, manusia dan struktur bangunan. Logam – logam berat yang terkandung di dalam air asam tambang apabila lepas ke badan air akan mengalami akumulasi dan mengganggu biota perairan dan apabila dikonsumsi masyarakat akan menyebabkan penyakit yang serius. Air asam tambang merupakan masalah penting dan serius didalam industri pertambangan, karena itu diperlukan suatu metoda untuk mereduksi logam – logam berat terlarut.
2009). Media SMS atau sisa pengolahan industri pengembangbiakan jamur pada saat ini dapat dijumpai di kota Medan, walaupun masih dalam skala rumah tangga. Penggunaan media SMS untuk mereduksi logam dan menaikkan pH dalam kondisi anaerobik disebut metode Successive Alkalinity Producing System
(SAPS). Pada sistem SAPS terdapat dua proses utama yang menyebabkan terjadinya peningkatan pH dan reduksi logam, yakni larutnya batu kapur
(limestone) dan reduksi sulfat secara biologis. Kedua proses ini menghasilkan alkalinitas dalam bentuk bikarbonat sebagai senyawa penetral. Menurut Neculita (2009), efisiensi pengolahan secara pasif air asam tambang dengan bioreaktor, dalam hal ini SMS dan batu kapur dapat menaikkan pH dari 2,9-5,7 menjadi pH 6 dan mereduksi logam 60-82% untuk logam Fe, dan 99,9% untuk logam Cd, Ni dan Zn dengan hidraulic retention times (HRTs) atau waktu kontak 7,3 dan 10 hari.
Selain media SMS ini, penelitian ini juga akan menggunakan sisa produksi pabrik pengolahan ubi kayu, yaitu kulit ubi kayu bagian dalam yang efektif untuk mereduksi logam (Obiri et al, 2006). Kulit ubi kayu ini dapat dimanfaatkan sebagai adsorben dalam bentuk karbon aktif (Darmawan, 2010). Dalam penelitian Koeswardhani (1995), yang melakukan analisis adsorpsi logam Fe dan Zn pada limbah cair industri tekstil dengan karbon aktif bubuk menyatakan bahwa efektivitas adsorpsi karbon aktif dipengaruhi waktu kontak dengan waktu kontak terbaik 10 menit/liter dan kadar terendah yaitu 7,5% (75 gram karbon aktif/liter limbah cair.
mengurangi limbah industri jamur dan pabrik tapioka, tapi juga untuk pengolahan air asam tambang pada industri pertambangan.
1.2 Perumusan Masalah
Perumusan masalah dalam tesis ini adalah mengetahui sejauh mana kemampuan kulit ubi kayu sebagai adsorben (karbon aktif) dan media SMS dalam metode SAPS dapat mereduksi logam terlarut besi (Fe), sulfat terlarut yang mempunyai konsentrasi tinggi dan menaikkan derajat keasaman pH air asam tambang.
1.3 Tujuan
Tujuan dari penelitian ini adalah untuk mengetahui :
1. Efisiensi optimal media adsorben karbon aktif berbahan dasar kulit bagian dalam ubi kayu berdasarkan jumlah dan waktu adsorpsi dalam menyerap logam terlarut besi (Fe), sulfat dan peningkatan pH yang terkandung dalam air asam tambang.
2. Efisiensi optimal SMS sebagai media organik dalam menyerap logam terlarut besi (Fe), sulfat dan peningkatan pH yang terkandung dalam air asam tambang.
1.4 Hipotesis
1.5 Manfaat Penelitian
BAB II. TINJAUAN PUSTAKA
2.1 Industri Pertambangan
Air asam tambang adalah salah satu permasalahan lingkungan yang dihasilkan oleh industri pertambangan. Air asam tambang merupakan hasil dari oksidasi batuan yang mengandung pirit (FeS2) dan mineral sulfida dari sisa batuan
yang terpapar oleh oksigen yang berada dalam air (Elberling.et.al, 2008). Permasalahan air asam tambang adalah salah satu dampak potensial yang dihadapi industri pertambangan. Air asam tambang juga mengandung logam berat seperti besi (Fe), alumunium (Al), mangan (Mn). Kesalahan dalam pemantauan, pengumpulan dan pengolahan air asam tambang dapat menyebabkan kontaminasi terhadap air tanah dan air permukaan yang berdampak kepada ekosistem, manusia dan struktur bangunan (MEND Program, 1997).
Seperti diketahui beberapa komponen atau kegiatan pertambangan menghasilkan dampak yang serius terhadap lingkungan. Kolam tailing (tailing impoundment) dan penempatan batuan sisa (waste rock piles) merupakan bagian yang harus benar-benar diperhatikan karena menghasilkan dampak negatif terhadap saluran air, tanah dan air permukaan (Bussiere, 2009).
mineral – mineral spesifik yang terdiri dari batuan sisa akan bereaksi dengan air akan menghasilkan tingkat asam atau basa yang bervariasi. Alternatif lain adalah test dinamis yang secara empiris menentukan kualitas lindi berdasarkan subjek batuan sampel yang disimulasikan dengan proses pelapukan dan pemantauan kualitas efluen yang dihasilkan. Masing – masing teknik mempunyai kelebihan dan kekurangan satu dengan yang lainnya (Bradham dan Carrucio, 1990).
2.2 Air Asam Tambang (AAT)
Air asam tambang (AAT) dihasilkan di atau dalam sisa batuan, tailing, dinding pit tambang terbuka dan tambang bawah tanah. Mineral sulfida seperti pirit teroksidasi dan hadir di air dan udara melalui oksigen yang menghasilkan air asam tambang melalui proses kimia dan biokimia. Oksidasi mineral sulfida dapat dideskripsikan dengan persamaan (Morin and Hutt, 1997 dalam Bussiere, 2009) dengan langkah pertama terjadinya oksidasi langsung dari pirit (FeS2) oleh
oksigen yang menghasilkan sulfat (SO42-), ferrous iron (Fe2+) dan keasaman (H+) :
2FeS2 + 7O2 + 2H2O = 2Fe2+ + 4SO42- + 4H+ (1)
Reaksi selanjutnya ferrous iron teroksidasi menjadi ferric iron (Fe3+). 2Fe2+ + 1/2O2 + 2H+ = 2Fe3+ + H2O (2)
Ferrous iron juga dapat teroksidasi menghasilkan iron hidroksida (FeOOH) dan keasaman.
Fe2+ + 1/4O2 + 3/2H2O = FeOOH + 2H+ (3)
Pada saat pH > 4, Fe3+ akan terendapkan sebagai ferric hidroksida (Fe(OH)3), lepas ke lingkungan dengan sangat asam.
Pada saat pH < 4, Ferric iron akan larut dan mengoksidasi pirit secara langsung dan melepas asam kesekelilingnya dengan bebas.
FeS2 + 14Fe3+ + 8H2O = 15Fe2+ + 2SO42- + 16H+ (5)
Secara keseluruhan reaksi oksidasi pirit dapat diperlihatkan sebagai berikut :
FeS2 + 15/4O2 + 7/2H2O = Fe(OH)3 + 2H2SO4 (6)
Oksidasi 1 mol pirit akan menghasilkan 2 mol asam sulfur. Secara umum pertimbangan literatur (Aubertin et al, 2002 dalam Bussiere 2009) bahwa oksidasi oleh oksigen (persamaan 1) berlangsung pada pH netral (5 < pH > 7), sementara itu oksidasi tidak langsung (Persamaan 5) lebih dominan pada pH rendah (pH < 3). Persamaan diatas berdasarkan pada persamaan stoikiometri tanpa mempertimbangkan kondisi kinetik setiap reaksi. Seperti nilai rata-rata oksidasi sebagai fungsi faktor penambah (Jerz dan Rimstidt, 2004 dalam Bussiere, 2009),
supply oksigen, temperatur, pH, aktivitas bakteri, luas paparan. Pertimbangan secara umum rata-rata reaksi dikontrol oleh (persamaan 2). Rata-rata reaksi berjalan lambat pada pH rendah, tetapi meningkat dengan cepat dan menurunkan pH karena adanya bakteri. Contohnya Acidithiobaccilus ferrooxidans sebagai katalisator reaksi oksidasi ferrous iron menjadi ferric iron.
Kualitas kimia dari drainase juga tergantung dari mineral lain yang ada di batuan sisa. Asam dapat bereaksi dengan penetral oleh karbonat dan mineral sillicate, yang dapat dipertimbangkan sebagai penetral utama adalah calcite (CaCO3) dan dolomite (CaMg(CO3)2) (Lapakko,1992).
2CaCO3 + H2SO4 = 2Ca2+ + 2HCO3- + SO42- (7)
Persamaan diatas memperlihatkan bahwa 2 mol calcite dan 1 mol dolomit dibutuhkan untuk menetralkan 1 mol asam sulfur. Kapasitas mineral penetral untuk membatasi pembentukan air asam tambang juga tergantung kepada faktor yang berbeda beda untuk mempengaruhi proses reaksi seperti : temperatur, pH, tekanan, permukaan mineral.
Ketika potensi penetral kurang dari potensial pembentukan asam, air asam tambang akan terjadi dan diperlukan pengukuran yang akurat dan tindakan mitigasi. Beberapa tahun terakhir, beberapa teknik telah diajukan untuk membatasi dampak air asam tambang terhadap lingkungan. Salah satu pendekatan yang dikembangkan untuk mengontrol produksi air asam tambang dari tailing
dan batuan sisa adalah dengan mengeliminasi atau menghilangkan satu atau lebih dari 3 komponen utama reaksi oksidasi yaitu : oksigen, air dan mineral sulfida. Beberapa metode yang dikembangkan adalah :
a. Ekstraksi sulfida
Kehadiran mineral sulfida adalah esensi utama pembentukan air asam tambang. Air asam tambang dapat dikontrol dengan melakukan ekstraksi mineral sulfida sehingga membatasi pembentukan air asam tambang di lingkungan.
Recovery atau penyimpanan mineral sulfida yang diperlukan tergantung kepada jumlah mineral penetral. Teknik yang berbeda dapat digunakan seperti flotasi dan pemisahan dengan gravimetri dapat digunakan untuk memisahkan sulfida dari
b. Hambatan oksigen / oxygen barriers
Oksigen merupakan salah satu komponen kunci terhadap pembentukan air asam tambang. Membatasi kemampuan oksigen bereaksi pada batuan sisa adalah salah satu teknik yang paling sering digunakan untuk mengontrol air asam tambang, terutama pada daerah lembab (MEND, 2008). Pendekatan yang berbeda dapat digunakan untuk menghambat oksigen dengan cara menempatkan pelindung air dan megatur elevasi air tanah.
2.3 Pengolahan Air Asam Tambang
Pemilihan pengolahan air asam tambang dikategorikan atas 2 yaitu pengolahan pasif dan pengolahan aktif. Pengolahan yang paling umum digunakan adalah dengan metode mengolah debit air asam tambang dengan pengolahan aktif dimana pengolahan menggunakan kimia penetral yang ditambahkan terus menerus ke air asam tambang. (Johnson and Hallberg, 2005 dalam Newcombe, 2009). Proses penetralan air asam tambang ini akan mengendapkan logam-logam terlarut dan akan membentuk selimut lumpur (sludge blanket). Kelemahan dari pengolahan aktif ini adalah memerlukan biaya yang besar dan memindahkan atau membuang selimut lumpur yang mengandung logam.
Pemilihan metode pasif dalam pengolahan air asam tambang dibandingkan dengan pengolahan secara aktif mempunyai kelebihan terutama dari segi perawatan dan biaya yang lebih rendah. Sistem pengolahan pasif hanya memerlukan perawatan dan penggantian secara periodik.
Gambar 2.1 Pemilihan pengolahan air asam tambang (amd), Johnson and Hallberg, 2005a Dalam Newcombe (2009)
2.4 Metoda Successive Alkalinity Producing System (SAPS)
Successive Alkalinity Producing System (SAPS) merupakan salah satu metode pengolahan pasif air asam tambang yang terdiri atas lapisan bahan organik dan batu kapur. Keduanya disusun secara vertikal dengan ketebalan tertentu. Air asam tambang yang diolah akan mengalir secara vertilal ke dalam sistem berdasarkan tekanan gravitasi hidrolik.
Pada sistem SAPS terdapat dua proses utama yang menyebabkan terjadinya Peningkatan pH dan reduksi logam, yakni larutnya batu kapur dan reduksi sulfat secara biologis. Kedua proses ini menghasilkan alkalinitas dalam bentuk bikarbonat sebagai senyawa penetral.
Penetral kimia AA T Pengolahan aktif
Abiotik Biologis
Bioreaktor
Pengolahan pasif
Abiotik Biologis
Lapisan bahan organik yang umum digunakan adalah komposisi produk organik sisa yang biasanya dari industri perkembangbiakan jamur yang disebut dengan Spent Mushroom Substrat (SMS). SMS merupakan material organik yang bersifat heterogen yang mengandung serbuk gergaji, kotoran hewan, dedak dan gypsum. SMS ini mengandung nutrient dan penyedia sumber Karbon (Newcombe, 2009). Media SMS ini sangat kaya jenis mikrobiologi di dalamnya, tinggi kandungan organiknya tetapi rendah konsentrasi material esensi nutrient untuk tumbuhan.
Serbuk gergaji yang terdapat dalam komposisi SMS berfungsi sebagai penyedia nutrisi bagi jamur. Sebelum digunakan sebagai media, biasanya serbuk kayu harus dikompos terlebih dahulu agar bisa terurai menjadi senyawa yang lebih sederhana agar mudah dicerna oleh jamur. Proses pengomposan berlangsung 1 – 2 hari menggunakan plastik atau terpal. Alternatif bahan yang digunakan untuk mengganti serbuk kayu adalah berbagai macam ampas, misalnya ampas kopi, ampas kertas, ampas tebu dan ampas teh. Dedak atau bekatul berfungsi sebagai substrat dan penghasil kalori untuk pertumbuhan jamur (Chazali dan Pratiwi, 2010).
akumulasi berubah terhadap loading rate dan waktu. Dengan ketebalan batu kapur 1 m dan diameter 1,3 – 1,9 cm dapat menghasilkan paling sedikit 100 mg/L alkalinitas untuk periode 10 tahun.
Menurut Neculita (2009), efisiensi pengolahan secara pasif air asam tambang dengan bioreaktor, dalam hal ini SMS dan batu kapur dapat menaikkan pH dari 2,9-5,7 menjadi pH 6 dan mereduksi logam 60-82% untuk logam Fe, dan 99,9% untuk logam Cd, Ni dan Zn dengan hidraulic retention times (HRTs) atau waktu kontak 7,3 dan 10 hari.
2.5 Adsorpsi dan Jenis Adsorpsi
Adsorpsi adalah proses dimana satu atau lebih unsur-unsur pokok dari suatu larutan fluida akan lebih terkonsentrasi pada permukaan suatu padatan tertentu (adsorben). Dengan cara ini, komponen-komponen dari suatu larutan, baik dari larutan gas ataupun cairan, bisa dipisahkan satu sama lain (Treybal, 1980). Adsorpsi melibatkan proses perpindahan massa dan menghasilkan kesetimbangan distribusi dari satu atau lebih larutan antara fasa cair dan partikel. Pemisahan dari suatu larutan tunggal antara cairan dan fasa yang diserap membuat pemisahan larutan dari fasa curah cair dapat dilangsungkan. Berdasarkan interaksi molekular antara permukaan adsorben dengan adsorbat, adsorpsi dibagi menjadi 2 (dua) jenis :
teradsorpsi tidak larut dalam adsorben tapi hanya sampai permukaan saja. Pada adsorpsi fisik, adosrbat tidak terikat kuat pada permukaan adsorben sehingga adsorbat dapat bergerak dari satu bagian permukaan ke bagian permukaan lainnya. Permukaan yang ditinggalkan oleh adsorbat dapat digantikan oleh adsorbat lainnya (multilayer).
2. Adsorpsi Kimia Adsorpsi kimia adalah adsorpsi yang terjadi akibat interaksi kimia antara molekul adsorben dengan molekul adsorbat. Proses ini pada umumnya menurunkan kapasitas dari adsorben karena gaya adhesinya yang kuat sehingga proses ini tidak reversibel. Ikatan yang terbentuk merupakan ikatan yang kuat sehingga lapisan yang terbentuk adalah lapisan monolayer.
2.6 Jenis Adsorben
Adsorben merupakan material berpori dan proses adsorpsi berlangsung di dinding pori. Adsorben dapat digolongkan menjadi 2 (dua) jenis yaitu adsorben tidak berpori (non-porous sorbents) dan adsorben berpori (porous sorbents).
1. Adsorben tidak berpori (non-porous sorbents)
Adsorben tidak berpori dapat diperoleh dengan cara presipitasi deposit kristalin seperti BaSO4 atau penghalusan padatan kristal. Luas permukaan
2. Adsorben berpori
Luas permukaan spesifik adsorben berpori berkisar antara 100 – 1000 m2/g. Beberapa jenis adsorben berpori yang telah digunakan secara komersial antara lain adalah karbon aktif, zeolit, silica gel, activated alumina.
2.7 Kulit Bagian Dalam Ubi Kayu Sebagai Adsorben Karbon Aktif
Karbon aktif merupakan arang yang telah diproses sedemikian rupa dengan cara diaktifasi oleh suatu zat sehingga mempunyai daya serap yang tinggi. Karbon atau arang merupakan padatan berpori yang mengandung 85-95% karbon, dihasilkan dari pemanasan pada suhu tinggi. Luas permukaan karbon aktif 300 – 3500 m2/g yang berhubungan dengan struktur pori internal yang berhubungan dengan struktur pori internal yang menyebabkan karbon aktif mempunyai sifat sebagai adsorber (Darmawan, 2010).
Menurut Darmawan (2010), salah satu cara untuk mengatasi limbah kulit ubi kayu adalah dengan membuatnya menjadi lebih berguna dan mempunyai nilai ekonomi yang lebih tinggi, yaitu sebagai bahan baku pembuatan karbon aktif.
Dalam penelitian Koeswardhani (1995) yang melakukan analisis adsorpsi logam Fe dan Zn pada limbah cair industri tekstil dengan karbon aktif bubuk menyatakan bahwa efektivitas adsorpsi karbon aktif dipengaruhi waktu kontak. Waktu kontak terbaik adalah 10 menit/liter dan kadar terendah yaitu 7,5% (75 gram karbon aktif/liter limbah cair). Dari penelitian ini juga disebutkan bahwa karbon aktif masih efektif digunakan sebanyak 20 kali tanpa regenerasi.
Menurut Wasay, et.al, 1997 menyatakan bahwa karbon aktif berbentuk granular mempunyai efektivitas mengadsorpsi logam (Cd, Cu, Cr, Hg, Mn, Pb dan Zn) dari air lindi remediasi tanah yang terkontaminasi logam berat dengan efektivitas 96 – 97% dengan pH antara 5,4-6,9 dan waktu kontak 5 – 7 jam. Remediasi harian tanah 20 ton atau 10 m3 yang terkontaminasi logam berat yang menghasilkan volume 62,5 m3 lindi dengan kadar 148 mg/L logam berat memerlukan 575 kg granular karbon aktif. Regenerasi karbon aktif dilakukan dengan cairan HCl.
Faktor – faktor yang mempengaruhi performa karbon aktif sebagai adsorber adalah (Desilva, 2010) :
1. Berat molekul
2. pH
Penyerapan biasanya dipengaruhi oleh konsentrasi ion hidrogen dalam larutan. Untuk asam – asam organik adsorpsi akan meningkat bila pH diturunkan atau pH rendah. Bila pH asam dinaikkan dengan penambahan alkali, adsorpsi akan berkurang sebagai akibat terbentuknya garam.
3. Ukuran partikel
Ukuran partikel karbon aktif berpengaruh terhadap penyerapan logam. Ukuran partikel yang tersedia 8-50 mesh. Ukuran yang terbaik 20-50 mesh.
4. Laju Aliran
Secara umum, laju aliran yang rendah mengakibatkan waktu kontak yang lebih lama. Ukuran partikel 20 – 50 mesh mengalirkan dua kali lebih cepat dari 12 – 40 mesh, dan 12 – 40 mesh mengalirkan dua kali lebih cepat dari ukuran 8 - 30 mesh.
Kapasitas adsorpsi dapat dihitung dengan menggunakan rumus :
qt = (Co – Ct).V (9)
m
dimana : qt : kapasitas adsorpsi dalam waktu t (mg adsorbate/g adsorbent) Co : konsentrasi logam (mg/L)
Ct : konsentrasi residual setelah adsorpsi (mg/L) V : volume sampel (l)
m : massa adsorbent (g)
Untuk menghitung persentase (%) penyisihan logam dapat dihitung dengan menggunakan rumus :
2.8 Percobaan Batch
Sistem batch merupakan pengoperasian yang sederhana. Tujuan dari sistem ini adalah untuk mengetahui karakteristik adsorbat dan adsorbant yang dinyatakan dalam hubungan antara penurunan adsorbate dan berat adsorbent dalam suatu koefisien dari persamaan yang ada (Reynold,1982).
Partikel adsorben ditempatkan di dalam sebuah larutan adsorbat dan diaduk untuk mendapatkan kontak yang merata sehingga terjadi proses adsorpsi. Konsentrasi larutan awal (Co) akan berkurang dan bergerak ke konsentrasi kesetimbangan (Ce) setelah waktu tertentu. Makin lama waktu kontak maka makin setimbang larutan tersebut (Eckenfelder, 2000).
Kuantitas adsorbat yang dapat diadsorpsi oleh adsorben merupakan fungsi dari dua hal yaitu karakteristik dan konsentrasi adsorbat. Umumnya jumlah adsorbat ditentukan dari fungsi konsentrasi pada suhu konstan, dan menghasilkan fungsi yang disebut isoterm adsorpsi. Pendekatan dengan model isoterm dapat membantu menganalisis karakteristik isoterm berupa kapasitas, afinitas, selektifitas serta mekanisme interaksi adsorpsi. Persamaan yang sering digunakan untuk menggambarkan data isoterm adsorpsi secara eksperimental dilakukan oleh Freundlich, Langmuir, Brunauer Emmet Teller (BET isoterm).
2.9 Isoterm Freundlich
Menurut Metcalf and Eddy (2003), secara empiris penurunan rumus isoterm Freundlich adalah sebagai berikut :
Dimana : x/m : jumlah adsorbat yang terserap per unit berat adsorben Ce : konsentrasi kesetimbangan adsorbat dalam larutan setelah
proses adsorpsi Kf,n : konstanta empiris
Model isoterm Freundlich menggunakan asumsi bahwa adsorpsi berjalan secara fisika. Konstanta dalam isoterm Freundlich dapat ditentukan dengan membuat grafik antara q (x/m) versus C, dan menggunakan kembali persamaan di atas yang sudah dilogkan menjadi :
(12)
Dari persamaan linier dapat dibuat kurva linear adsorpsi isoterm Freundlich yang dapat diketahui nilai konstanta Freundlich dengan pendekatan dan plot nilai log q dengan nilai log C sehingga akan didapatkan slope (m) = 1/n dan intercept (b) = log k.
Jika konsentrasi zat terlarut relatif tinggi, penggunaan persamaan diatas menjadi tidak sesuai karena akan menyebabkan terjadinya penyimpangan. Selain itu isoterm Freundlich juga digunakan untuk identitas zat terlarut tidak diketahui misalnya adsorpsi mineral, minyak nabati dan warna (Sawyer, 2003).
2.10 Isoterm Langmuir
Menurut Metcalf and Eddy (2003), isoterm adsorpsi Langmuir didefinisikan sebagai berikut :
Dimana : x/m : jumlah adsorbat yang terserap per unit massa adsorban a,b : konstanta empiris
Ce : konsentrasi kesetimbangan adsorbat dalam larutan setelah adsorpsi
Isoterm adsorpsi Langmuir dikembangkan dengan mengasumsikan bahwa (1) sejumlah bagian adsorbat tetap tersedia pada permukaan adsorban, dimana bagian permukaan tersebut memiliki energi yang sama, (2) adsorpsi yang terjadi reversible (dua arah). Kesetimbangan terjadi apabila kecepatan adsorpsi molekul ke dalam permukaan sama dengan kecepatan desorpsi dari permukaan. Konstanta isoterm Langmuir dapat ditentukan dengan membuat grafik antara C/(x/m) versus C dan mengubah persamaan diatas menjadi :
(14)
Dari persamaan linear diatas dapat dibuat kurva linear adsorpsi isoterm Langmuir dan dapat diketahui nilai konstanta Langmuir dengan pendekatan plot nilai Ce/(x/m) dan nilai Ce sehingga akan didapatkan slope (m) = 1/ab dan
intercept (b) = 1/a.
2.11 Isoterm Brunauer – Emmet – Teller (BET)
Selain dua persamaan isoterm diatas, pada adsorpsi juga berlaku persamaan isoterm Brunauer – Emmet – Teller (BET). Persamaan ini digunakan dengan asumsi untuk mendiskripsikan adsorpsi multilayer (Metcalf, 2003). Selain itu asumsi pada model persamaan BET adalah :
1. Molekul terserap tidak berpindah ke permukaan
3. Semua molekul di luar lapisan pertama memiliki energi yang sama untuk adsorpsi
4. Untuk memulai pada lapisan yang lain lapisan sebelumnya tidak harus penuh
Berdasarkan atas asumsi di atas, bentuk persamaan BET adalah :
(15)
Dimana :
q : x/m : jumlah adsorbat yang terserap per unit massa adsorban qm : maksimum adsorbat teradsorpsi
Cs : konstanta awal larutan
Kb : konstanta (tergantung pada energi adsorpsi)
Persamaan tersebut dapat diubah menjaadi persamaan linear menjadi persamaan seperti dibawah ini (Metcalf, 2003)
(16)
2.12 Analisis Regresi
kedua disebut juga variabel bebas. Jika variabel bebas lebih dari satu maka analisis regresi disebut regresi linear berganda.
Regresi sederhana adalah bentuk regresi dengan model yang bertujuan untuk mempelajari hubungan antara dua variabel yakni variabel independen (bebas) dan variabel dependen (terikat). Jika ditulis dalam bentuk persamaan model regresi sederhana adalah :
y = a + bx (17)
Dimana : y = variabel dependen (terikat) x = variabel independen (bebas) a = penduga bagi intercept ()
b = penduga bagi koefisien regresi ()
2.13 Analisis Korelasi
Dalam ilmu statistika ada dua macam hubungan antara dua variabel yang relatif sering digunakan yaitu bentuk hubungan dan keeratan hubungan. Bentuk hubungan bisa diketahui melalui analisis regresi, sedangkan keeratan hubungan dapat diketahui melalui analisis korelasi.
Analisis korelasi digunakan untuk mengetahui derajat linear antara dua variabel atau lebih. Hubungan antara satu variabel dengan variabel yang lain dapat merupakan hubungan yang terjadi dengan ketidaksengajaan, tetapi dapat juga merupakan hubungan sebab akibat.
Besarnya hubungan antara variabel yang satu dengan yang lain dinyatakan dengan koefisien korelasi yang disimbolkan dengan huruf “r”. Besarnya koefisien
korelasi akan berkisar antara -1 (negatif 1) sampai dengan +1 (positif satu). -1 < r < +1
Keterangan : + menunjukkan korelasi positif - menunjukkan korelasi negatif 0 menunjukkan tidak adanya korelasi
a. Korelasi positif
Terjadi korelasi positif apabila perubahan pada variabel yang satu diikuti dengan perubahan variabel yang lain dengan arah yang sama (berbanding lurus). Artinya apabila variabel yang satu meningkat maka akan diikuti dengan peningkatan variabel yang lain. Apabila variabel yang satu turun, maka akan diikuti dengan penurunan variabel yang lain.
b. Korelasi negatif
c. Korelasi nihil
BAB III. METODE PENELITIAN
3.1 Tempat dan Waktu Penelitian
Tempat penelitian dilaksanakan di Laboratorium Kimia Analitik USU dan Balai Riset dan Standarisasi Industri (Baristand) Medan. Sampel merupakan air paparan batuan tambang yang berasal dari industri pertambangan di Kecamatan Batangtoru, Kabupaten Tapanuli Selatan, Sumatera Utara. Penelitian dilakukan pada bulan April 2012 sampai dengan Mei 2012.
3.2 Persiapan Alat dan Bahan
3.2.1 Pengambilan Sampel dan Persiapan Media
Media yang digunakan adalah :
a. 1 paket media Spent Mushroom Substrat (SMS), dengan berat 1 kg dengan komposisi : serbuk gergaji 80%, dedak (bekatul) 10%, tebu gula 2%, tepung jagung 2%, kalsium karbonat 1%, tepung gypsum 1%, air 2,5% dan air kelapa 1%.
b. Kulit dalam ubi kayu dalam bentuk karbon aktif yang dihancurkan.
3.2.2 Media SMS
Penelitian ini menggunakan reaktor kaca berbentuk persegi panjang dengan ukuran panjang 17 cm, lebar 17 cm, dan tinggi 20 cm. Volume reaktor kaca kapasitas 5 liter. Reaktor di isi dengan (Neculita, 2009) :
b. Penetral (batu kapur) yang berfungsi untuk meningkatkan pH air asam tambang (5-8) untuk mendapatkan kondisi ideal pertumbuhan bakteri. c. Pasir atau kerikil sebagai media untuk optimalisasi media kontak air asam
tambang dan tempat melekatnya bakteri.
d. Sumber bakteri, yang berasal dari kotoran hewan atau sedimen sungai.
3.2.3 Media Karbon Aktif
Tahapan persiapan pembuatan karbon aktif dari kulit bagian dalam ubi kayu adalah sebagai berikut (Julius et al, 2011) :
1. Penyiapan bahan baku
Kulit bagian dalam ubi kayu dibersihkan dan dicuci, kemudian dipotong dengan ukuran 1 x 0,5 x 1 cm3. Selanjutnya kulit dalam ubi kayu dikeringkan dalam oven selama 24 jam pada suhu 120 oC.
2. Aktivasi
Kulit dalam ubi kayu seberat 100 gram diaduk dengan 1,5 liter larutan KOH 0,3 N dalam reaktor berpengaduk, aktivasi kimia berlangsung 1 jam pada suhu 50 oC. Setelah itu kulit ubi kayu ditiriskan dan dimasukkan dalam oven selama 24 jam pada suhu 120 oC.
3. Karbonisasi
a) Kulit ubi kayu dipanaskan dalam furnace selama 2 jam pada suhu 300 oC (karbonisasi).
c) Karbon aktif dikeringkan dalam oven selama 2 jam pada suhu 110
o
C.
3.3 Langkah Kerja
Langkah kerja penelitian ini adalah sebagai berikut :
[image:42.595.193.431.310.504.2]1. Penelitian dilakukan secara batch dalam reaktor kaca dengan ukuran panjang 17 cm, lebar 17 cm dan tinggi 20 cm. Kapasitas reaktor 5 liter. Gambar 3.1 dibawah ini adalah reaktor kaca yang digunakan.
Gambar 3.1 Reaktor penelitian yang digunakan
2. Sampel yang dibutuhkan dalam penelitian ini adalah 3,5 liter untuk masing – masing reaktor.
3. Sebelum sampel dimasukkan, terlebih dahulu sampel dianalisis untuk kandungan logam terlarut yaitu Fe, Zn, Mn, Sulfat dan pH.
4. Masing – masing reaktor diisi dengan media sebagai berikut :
aktif dengan berat 100 g, dan (3) media karbon aktif dengan berat 150 g.
b) Reaktor untuk media SMS diberi label dengan nomor : (4) media SMS 50 g, 10 g pasir, 10 g sedimen sungai dan 100 g kapur, (5) media SMS 100 g, 10 g pasir, 10 g sedimen sungai dan 100 g kapur, dan (6) media SMS 150 g, 10 g pasir, 10 g sedimen sungai dan 100 g kapur.
c) Komposisi reaktor media SMS disusun dengan urutan dari bawah ke atas : 1) pasir, 2) kapur, 3) sedimen sungai, dan 4) SMS.
5. Sampel dengan volume 3,5 liter dimasukkan secara perlahan ke dalam masing – masing reaktor yang telah diisi dengan media.
6. Untuk mendapatkan kondisi homogen, sampel yang telah dimasukkan dalam reaktor diaduk secara perlahan selama 5 menit, setelah itu didiamkan. Dilakukan pengamatan pada waktu 6 jam, 12 jam, 24 jam untuk arang aktif dan 6 jam, 12 jam, 24 jam, 48 jam dan 96 jam untuk media SMS.
7. Persentase (%) penyisihan logam dihitung dengan menggunakan rumus :
R(%) = (Co – Ct). 100 (18)
Co
3.4 Diagram Alir Penelitian
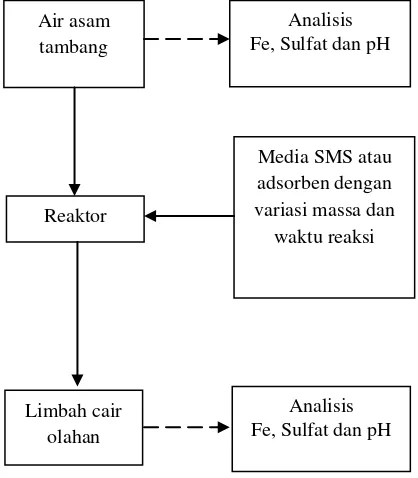
[image:44.595.210.419.136.375.2]Diagram alir penelitian dapat dilihat pada gambar 3.2 dibawah ini :
Gambar 3.2 Diagram alir penelitian
Air asam tambang
Analisis Fe, Sulfat dan pH
Reaktor
Analisis Fe, Sulfat dan pH
Media SMS atau adsorben dengan variasi massa dan waktu reaksi
BAB IV. HASIL DAN PEMBAHASAN
4.1 Karakteristik Air Asam Tambang
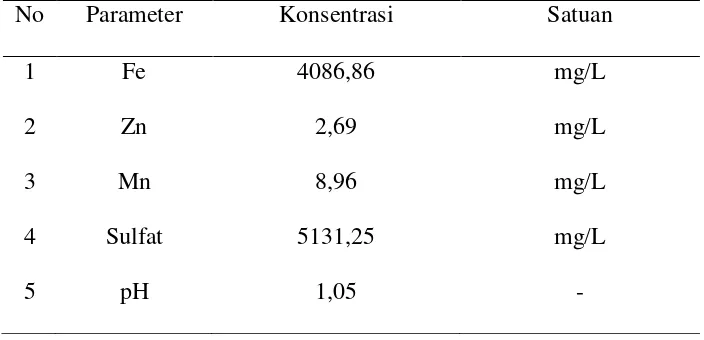
[image:45.595.136.488.304.474.2]Sampel air asam tambang yang digunakan dalam penelitian ini terlebih dahulu di uji kandungan logam terlarut yang dilakukan di laboratorium Kimia Analitik USU. Karakteristik air asam tambang dapat dilihat pada Tabel dibawah ini.
Tabel 4.1 Karakteristik air asam tambang No Parameter Konsentrasi Satuan
1 Fe 4086,86 mg/L
2 Zn 2,69 mg/L
3 Mn 8,96 mg/L
4 Sulfat 5131,25 mg/L
5 pH 1,05 -
4.2 Uji Pendahuluan
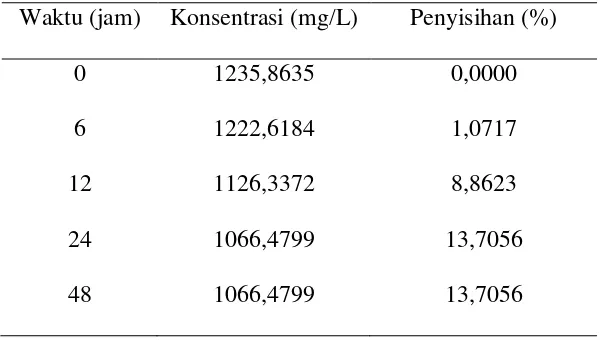
[image:46.595.162.462.277.447.2]Uji pendahuluan dilakukan untuk mengetahui waktu seimbang suatu adsorben atau media SMS. Uji pendahuluan dilakukan dengan menganalisis sampel air asam tambang dengan volume 3,5 liter dengan massa arang aktif 100 gram. Parameter yang dianalisis adalah Fe dengan konsentrasi awal 1235 mg/L. Hasil uji penelitian dapat dilihat pada tabel berikut.
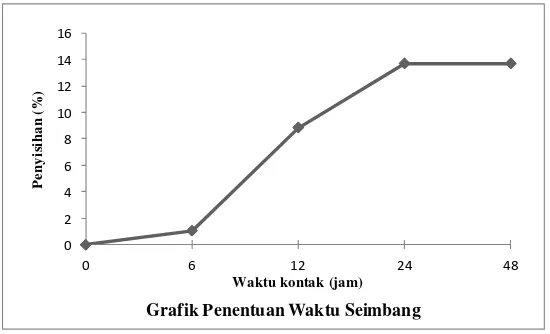
Tabel 4.2 Penentuan waktu seimbang
Waktu (jam) Konsentrasi (mg/L) Penyisihan (%) 0 1235,8635 0,0000 6 1222,6184 1,0717 12 1126,3372 8,8623 24 1066,4799 13,7056 48 1066,4799 13,7056
0 2 4 6 8 10 12 14 16
0 6 12 24 48
P
e
n
y
isi
h
a
n
(
%)
[image:47.595.193.468.84.251.2]Waktu kontak (jam)
Grafik Penentuan Waktu Seimbang
Gambar 4.1 Penentuan waktu seimbang
Gambar di atas menunjukkan waktu keseimbangan terjadi pada waktu kontak 24 – 48 jam. Menurut Eckenfelder (2000), adsorpsi dapat terjadi dengan waktu seimbang selama 24 jam. Pada tabel 4.2 di atas penyisihan adsorpsi logam Fe pada waktu kontak 6 jam sebesar 1% dan pada waktu 24 jam sebesar 13%, terjadi selisih penyisihan sebesar 12% dengan rentang waktu kontak 18 jam. Hal ini menjelaskan pada awal waktu kontak gaya tarik menarik antara ion – ion Fe dengan arang aktif masih sangat kuat, setelah itu penurunan konsentrasi berlangsung sampai terjadi keseimbangan.
4.3 Analisis Fe dengan Media Karbon Aktif
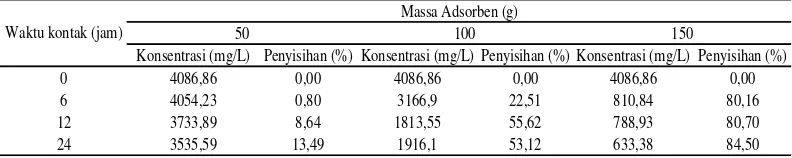
Tabel 4.3 Penurunan konsentrasi dan penyisihan Fe
Konsentrasi (mg/L) Penyisihan (%) Konsentrasi (mg/L) Penyisihan (%) Konsentrasi (mg/L) Penyisihan (%)
0 4086,86 0,00 4086,86 0,00 4086,86 0,00
6 4054,23 0,80 3166,9 22,51 810,84 80,16
12 3733,89 8,64 1813,55 55,62 788,93 80,70
24 3535,59 13,49 1916,1 53,12 633,38 84,50
Massa Adsorben (g)
50 100 150
Waktu kontak (jam)
Dari tabel di atas dapat dilihat bahwa lamanya waktu kontak dan massa adsorben mempengaruhi konsentrasi akhir dan penyisihan logam Fe terlarut. Grafik penurunan konsentrasi Fe dengan berjalannya waktu dapat dilihat pada gambar dibawah ini.
0 500 1000 1500 2000 2500 3000 3500 4000 4500
0 6 12 18 24
C s Fe ( m g /L
[image:48.595.178.446.316.519.2]Waktu kontak (jam)
Grafik Penurunan Konsentrasi Fe Terhadap Waktu
50 g 100 g 150 g
Gambar 4.2 Penurunan konsentrasi Fe terhadap waktu
4.4 Penentuan Isoterm
Data keseimbangan digambarkan dalam bentuk kurva isoterm adsorpsi ditunjukkan dengan suatu model adsorpsi. Dengan adanya suatu model dapat dihitung nilai pendekatan jumlah zat yang mampu diserap oleh sejumlah masssa adsorben pada kondisi tertentu. Model umum untuk proses adsorpsi terdiri dari tiga jenis model yaitu isoterm Freundlich, Langmuir dan BET.
4.4.1 Model Isoterm Freundlich
Model isoterm freundlich didapatkan dari persamaan isoterm Freundlich.
x/m = Kf Ce1/n (19)
Dengan Kf dan n adalah suatu tetapan. Kf merupakan konstanta yang
menggambarkan kapasitas adsorspsi (mg/g adsorban) dan n merupakan konstanta yang mewakili intensitas adsorpsi. Nilai K yang lebih tinggi akan menunjukkan lebih besarnya gaya tarik menarik antara arang aktif dengan Fe maupun Sulfat dan nilai n antara 1 hingga 10 menunjukkan sistem adsorpsi yang menguntungkan. Perhitungan tetapan Kf dan n dapat diperoleh dari logaritmik dengan membuat kurva isoterm Freundlich antara log (x/m) dan log C.
[image:49.595.112.512.582.647.2]Log x/m = log Kf + 1/n Log Ce (20)
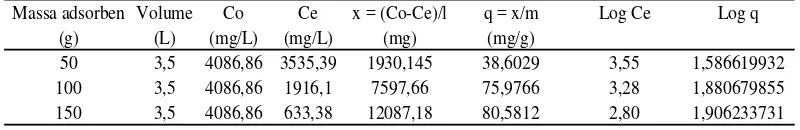
Tabel 4.4 Perhitungan isoterm Freundlich untuk parameter Fe
Massa adsorben Volume Co Ce x = (Co-Ce)/l q = x/m Log Ce Log q (g) (L) (mg/L) (mg/L) (mg) (mg/g)
50 3,5 4086,86 3535,39 1930,145 38,6029 3,55 1,586619932 100 3,5 4086,86 1916,1 7597,66 75,9766 3,28 1,880679855 150 3,5 4086,86 633,38 12087,18 80,5812 2,80 1,906233731
y = -0,383x + 3,020 R² = 0,666
0 0,5 1 1,5 2 2,5
2,00 2,50 3,00 3,50 4,00
lo
g
q
[image:50.595.148.477.83.243.2]Log Ce
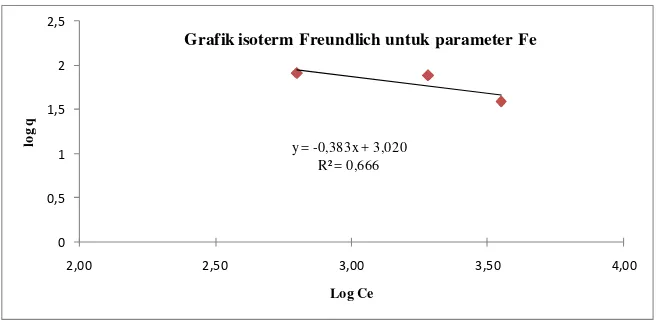
Grafik isoterm Freundlich untuk parameter Fe
Gambar 4.3 Isoterm Freundlich untuk parameter Fe
Dari gambar grafik di atas dapat diketahui slope dan intercept sehingga harga k dan n pada persamaan Freundlich dapat diketahui. Y = -0,383x + 3,020 sehingga diperoleh nilai slope sebesar -0,383 dan intercept sebesar 3,020 dengan R2 = 0,66. Nilai k merupakan hasil antilog dari intercept yaitu sebesar 1047,29. Nilai n merupakan 1/slope yaitu -2,61.
x/m = kf.Ce1/n (21)
x/m = 1047,29.Ce1/-2,61 (22)
4.4.2 Model Isoterm Langmuir
Model isoterm Langmuir didapatkan dari persamaan isoterm Langmuir. (23)
Parameter a menunjukkan qmaks sebagai kapasitas maksimum monolayer
(24)
y = a + bx (25)
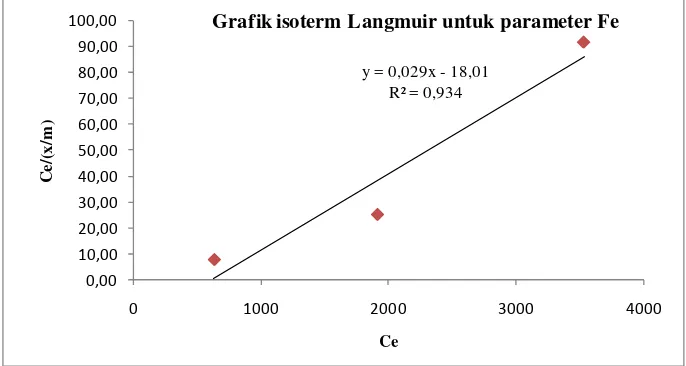
[image:51.595.113.513.199.269.2]Berikut adalah tabel perhitungan isoterm Langmuir.
Tabel 4.5 Perhitungan isoterm Langmuir untuk parameter Fe
Massa adsorben Volume Co Ce x = (Co-Ce)/l q = x/m Ce/(x/m)
(g) (L) (mg/L) (mg/L) (mg) (mg/g)
50 3,5 4086,86 3535,39 1930,145 38,6029 91,58
100 3,5 4086,86 1916,1 7597,66 75,9766 25,22
150 3,5 4086,86 633,38 12087,18 80,5812 7,86
Penentuan isoterm Langmuir untuk proses adsorpsi dilakukan dengan membuat grafik Ce/(x/m) vs Ce. Plot grafik akan menghasilkan garis lurus dengan kemiringan (slope) 1/a dan intercept adalah 1/ab. Sehingga harga a dan b pada persamaan Langmuir dapat diketahui. Nilai a merupakan 1/slope dan nilai b ditentukan dari nilai 1/(nilai a x intercept). Plot grafik seperti gambar dibawah ini.
y = 0,029x - 18,01 R² = 0,934
0,00 10,00 20,00 30,00 40,00 50,00 60,00 70,00 80,00 90,00 100,00
0 1000 2000 3000 4000
[image:51.595.140.483.423.606.2]C e /( x /m ) Ce
Grafik isoterm Langmuir untuk parameter Fe
Gambar 4.4 Isoterm Langmuir untuk parameter Fe
Pada gambar di atas terdapat persamaan garis y = 0,029x – 18,01 dengan R2 = 0,934 dengan slope sebesar 0,029 dan intercept sebesar -18,01. Dari nilai
(26)
(27)
(28)
4.4.3 Model Isoterm Brunauer – Eemmet – Teller (BET)
Model isoterm BET didapatkan dari persamaan BET.
(29)
qm menunjukkan kapasitas maksimum adsorben (mg/g adsorben), dan nilai
kb sebagai konstanta afinitas yang menunjukkan kekuatan ikatan molekul adsorbat
pada permukaan adsorben (l/g). Perhitungan tetapan qm dan kb dapat diperoleh
dengan membuat kurva isoterm BET antara Ce/(Co – Ce).(x/m) dan Ce/Co. Konsentrasi keseimbangan digunakan sebagai input data konsentrasi akhir adsorpsi.
(30)
y = a + bx (31)
[image:52.595.111.512.590.648.2]Berikut adalah perhitungan serta grafik isoterm BET.
Tabel 4.6 Perhitungan isoterm BET untuk parameter Fe
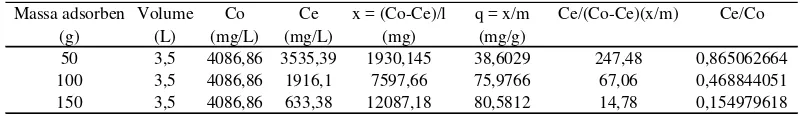
Massa adsorben Volume Co Ce x = (Co-Ce)/l q = x/m Ce/(Co-Ce)(x/m) Ce/Co
(g) (L) (mg/L) (mg/L) (mg) (mg/g)
50 3,5 4086,86 3535,39 1930,145 38,6029 247,48 0,865062664
100 3,5 4086,86 1916,1 7597,66 75,9766 67,06 0,468844051
150 3,5 4086,86 633,38 12087,18 80,5812 14,78 0,154979618
Penentuan isoterm BET untuk proses adsorpsi dilakukan dengan membuat kurva isoterm BET antara Ce/(Co – Ce).(x/m) dan Ce/Co. Plot grafik akan menghasilkan persamaan y = a + bx. Dari persamaan tersebut dapat diketahui
diketahui. Nilai kb merupakan hasil a dari persamaan 1/(kb.qm). Nilai qm
merupakan hasil b dari persamaan (kb-1)/(kb.qm). Grafik persamaan isoterm BET
dapat dilihat pada gambar berikut.
y = 333,1x - 55,58 R² = 0,943
-50,00 0,00 50,00 100,00 150,00 200,00 250,00 300,00
0 0,2 0,4 0,6 0,8 1
C
e
/(
C
o
-C
e
)(
x
/m
)
[image:53.595.142.482.166.348.2]Ce/Co
Grafik isoterm BET untuk parameter Fe
Gambar 4.5 Isoterm BET untuk parameter Fe
Dari gambar di atas terdapat persamaan y = 333,1x – 55,58 dengan R2 = 0,943 dengan slope sebesar 333,1 dan intercept sebesar -55,58 sehingga harga kb
dan qm pada persamaan BET dapat diketahui. Dari persamaan
maka (kb.qm) = -0,002. Nilai ini disubstitusi pada persamaan = 333,1 maka
(kb – 1) = -5,99 sehingga nilai kb = -4,99. Nilai qm dipeoleh dari kb.qm = -0,002. Nilai qm = 0,0004. Dari nilai kb dan qm diperoleh persamaan :
(32)
(33)
4.5 Pemilihan Model Adsorpsi untuk Fe
[image:54.595.120.501.332.431.2]Model isoterm adsorpsi untuk tiap massa adsorben ditentukan dengan melihat nilai koefisien determinasi (R2) pada persamaan adsorpsi. Nilai koefisien korelasi terbesar menunjukkan bahwa proses adsorpsi menggunakan adsorbat tersebut sesuai dengan karakteristik asumsi. Semakin besar nilai koefisien korelasi menunjukkan bahwa terdapat korelasi yang signifikan antara jumlah adsorbat yang diserap dengan massa adsorben. Berikut adalah tabel nilai koefisien korelasi dari masing - masing persamaan isoterm.
Tabel 4.7 Nilai korelasi isoterm adsorpsi untuk parameter Fe Isoterm Adsorpsi R2
Freundlich 0,666
Langmuir 0,934
BET 0,943
4.6 Analisis Sulfat dengan Media Karbon Aktif
[image:55.595.114.509.224.313.2]Nilai konsentrasi sulfat yang sangat tinggi pada air asam tambang sebesar 5131,25 mg/L dengan penyisihan (%) terhadap waktu kontak dapat dilihat pada tabel dibawah ini.
Tabel 4.8 Penurunan konsentrasi dan penyisihan Sulfat
Konsentrasi (mg/L) Penyisihan (%) Konsentrasi (mg/L) Penyisihan (%) Konsentrasi (mg/L) Penyisihan (%)
0 5131,25 0,00 5131,25 0,00 5131,25 0,00
6 4909,38 4,32 4143,75 19,24 2205 57,03
12 4843,75 5,60 3959,38 22,84 2428,75 52,67
24 4843,75 5,60 3362,5 34,47 1886,25 63,24
Waktu kontak (jam)
Massa Adsorben (g)
50 100 150
Dari tabel di atas dapat dilihat bahwa lamanya waktu kontak dan massa adsorben mempengaruhi konsentrasi akhir dan penyisihan sulfat. Penyisihan tertinggi diperoleh pada waktu kontak 24 jam dengan massa adsorben 150 gram dengan penyisihan sebesar 63,24%. Grafik penurunan konsentrasi sulfat dengan berjalannya waktu dapat dilihat pada gambar dibawah ini.
0 1000 2000 3000 4000 5000 6000
0 6 12 18 24
C s S u lf a t (m g /L )
[image:55.595.159.466.461.662.2]Waktu kontak (jam)
Grafik Penurunan Konsentrasi Sulfat Terhadap Waktu
50 g 100 g 150 g
Gambar 4.6 Penurunan konsentrasi Sulfat terhadap waktu
menghasilkan penyisihan 63,24%, dengan menurunkan konsentrasi dari 5131,25 mg/L menjadi 1886,25 mg/L. Dengan massa adsorben 150 gram dan waktu kontak 6 – 12 jam terjadi penyisihan 52 – 57% dan penurunan konsentrasi sebesar 3000 mg/L dari konsentrasi awal 5131,25 mg/L. Dari grafik di atas juga diperoleh penyisihan penurunan konsentrasi sulfat dengan massa 50 gram sebesar 5,6% dan 34,47% untuk massa adsorben 100 gram pada waktu kontak optimum selama 24 jam.
4.7 Pemilihan Model Adsorpsi Sulfat
[image:56.595.114.509.558.642.2]Model isoterm adsorpsi untuk tiap massa adsorben ditentukan dengan melihat nilai koefisien korelasi (R2) pada persamaan adsorpsi. Nilai koefisien korelasi terbesar menunjukkan bahwa proses adsorpsi menggunakan adsorbat tersebut sesuai dengan karakteristik asumsi. Semakin besar nilai koefisien korelasi menunjukkan bahwa terdapat korelasi yang signifikan antara jumlah adsorbat yang diserap dengan massa adsorben. Secara tabel dan grafik masing – masing model isoterm untuk sulfat dapat dilihat pada penjelasan dibawah ini.
Tabel 4.9 Perhitungan isoterm Freundlich untuk parameter Sulfat
Massa adsorben Volume
Co
Ce
x = ( co-ce)/l
q = x/m
Log Ce
Log q
(g)
(L)
(mg/L)
(mg/L)
(mg)
(mg/g)
50
3,5
5131,25 4843,75
1006,25
20,125
3,68518172
1,303735889
100
3,5
5131,25 3362,5
6190,625
61,90625
3,526662293 1,791734497
150
3,5
5131,25 1886,25
11357,5
75,71666667 3,275599253 1,879191486
y = -1,309x + 6,234 R² = 0,760
0 0,5 1 1,5 2 2,5
3,25 3,3 3,35 3,4 3,45 3,5 3,55 3,6 3,65 3,7 3,75
lo
g
q
[image:57.595.140.486.80.254.2]Log Ce
Grafik isoterm Freundlich untuk parameter Sulfat
Gambar 4.7 Isoterm Freundlich untuk parameter Sulfat
Hasil perhitungan model isoterm Langmuir dapat dilihat pada tabel dan gambar dibawah ini.
Tabel 4.10 Perhitngan isoterm Langmuir untuk parameter Sulfat
Massa adsorben Volume Co Ce x = (Co - Ce)/l q = x/m Ce/(x/m)
(g) (L) (mg/L) (mg/L) (mg) (mg/g)
50 3,5 5131,25 4843,75 1006,25 20,125 240,68
100 3,5 5131,25 3362,5 6190,625 61,90625 54,32
150 3,5 5131,25 1886,25 11357,5 75,7166667 24,91
y = 0,073x - 138,9 R² = 0,850
-50,00 0,00 50,00 100,00 150,00 200,00 250,00 300,00
0 1000 2000 3000 4000 5000 6000
[image:57.595.125.498.358.643.2]C e /( x /m ) Ce
Grafik isoterm Langmuir untuk parameter sulfat
Gambar 4.8 Isoterm Langmuir untuk parameter Sulfat
Tabel 4.11 Perhitungan isoterm BET untuk parameter Sulfat Massa adsorben Volume Co Ce x = (Co-Ce)/l q = x/m Ce/(Co-Ce)(x/m) Ce/Co
(g) (L) (mg/L) (mg/L) (mg) (mg/g)
50 3,5 5131,25 4843,75 1006,25 20,125 339,06 0,943970767 100 3,5 5131,25 3362,5 6190,625 61,90625 117,69 0,655298417 150 3,5 5131,25 1886,25 11357,5 75,7166667 44,01 0,367600487
y = 512,0x - 168,7 R² = 0,923
0,00 50,00 100,00 150,00 200,00 250,00 300,00 350,00 400,00
0 0,2 0,4 0,6 0,8 1
C e /( C e -C o )( x /m ) Ce/Co
[image:58.595.116.512.107.391.2]Grafik isoterm BET untuk parameter Sulfat
Gambar 4.9 Isoterm BET untuk parameter Sulfat
Dari ketiga grafik di atas diperoleh persamaan garis dengan nilai koefisien determinasi (R2) yang dapat dilihat pada tabel dibawah ini.
Tabel 4.12 Nilai korelasi isoterm adsorpsi untuk parameter Sulfat Isoterm Adsorpsi R2
Freundlich 0,760
Langmuir 0,850
BET 0,923
Nilai koefisien determinasi (R2) terbesar diperoleh dari model isoterm BET
sebesar 0,923. Maka persamaan model isoterm penyisihan sulfat digunakan persamaan
maka (kb.qm) = -0,006. Nilai ini disubstitusi pada persamaan
= 512 maka (kb – 1) = -3,03 sehingga nilai kb = -2,03. Nilai qm diperoleh
dari kb.qm = -0,006. Nilai qm = 0,003. Dari nilai kb dan qm diperoleh persamaan: (35)
(36)
(37)
4.8 Analisis Fe Dengan Media SMS
Analisis Fe dan Sulfat dengan media SMS didasarkan kepada pemodelan
keseimbangan derajat keasaman atau pH yang terjadi selama waktu kontak dengan media
[image:59.595.166.460.478.587.2]SMS. Grafik waktu kontak dengan pH dapat dilihat pada tabel dan gambar dibawah ini.
Tabel 4.13 Nilai pH terhadap waktu kontak
Waktu kontak (jam) pH 1 pH 2 pH 3 pH rata - rata 0 1,05 1,05 1,05 1,05 6 1,13 0,97 1,07 1,06 12 1,77 1,55 1,3 1,54 24 1,72 1,66 1,68 1,69 48 1,73 1,68 1,68 1,70 96 7,06 7,14 7,58 7,26
0,00 1,00 2,00 3,00 4,00 5,00 6,00 7,00 8,00
0 12 24 36 48 60 72 84 96
pH
[image:60.595.155.472.84.273.2]Waktu kontak (jam) Grafik pH Terhadap Waktu Kontak
Gambar 4.10 Perubahan pH Terhadap Waktu Kontak
Dari gambar di atas dapat dilihat bahwa keseimbangan pH atau waktu netral
dicapai pada waktu kontak 96 jam. Dengan komposisi kapur 100 gr pada masing –
masing reaktor terlihat bahwa pH meningkat mulai pada waktu kontak 48 jam sampai
[image:60.595.112.510.440.541.2]dengan 96 jam. Untuk penyisihan penyisihan Fe dapat dilihat pada tabel dibawah ini.
Tabel 4.14 Penyisihan Fe dengan media SMS
Konsentrasi (mg/L) Penyisihan (%) Konsentrasi (mg/L) Penyisihan (%) Konsentrasi (mg/L) Penyisihan (%)
0 4086,86 0,00 4.086,86 0,00 4.086,86 0,00
6 0,66 99,98 0,35 99,99 0,34 99,99
12 0,11 99,99 0,24 99,99 0,24 99,99
24 0,24 99,99 0,23 99,99 0,25 99,99
48 0,15 99,99 0,20 99,99 0,21 99,99
96 0,06 99,99 0,08 99,99 0,06 99,99
Waktu kontak (jam)
Massa Media SMS (g)
50 100 150
Dari tabel di atas terlihat tingkat penyisihan Fe sangat tinggi. Pada 6 jam pertama terlihat penyisihan mencapai 99,99% untuk masing – masing media SMS baik 50, 100 ataupun 150 gram. Komposisi massa SMS baik 50 gram, 100 gram ataupun 150 gram menghasilkan penyisihan yang sama besar. Ini memperlihatkan bahwa penyisihan penyisihan Fe lebih dipengaruhi oleh komposisisi kapur (CaCO3) pada masing – masing media reaktor dengan massa 100 gram per media
Secara grafik, masing – masing penyisihan penyisihan logam Fe berdasarkan massa media SMS terhadap waktu kontak dapat ditampilkan pada gambar dibawah ini.
y = -19,46x + 1284, R² = 0,177
-1000 0 1000 2000 3000 4000 5000
0 12 24 36 48 60 72 84 96
K on se n tr as i F e ( m g/ L )
[image:61.595.164.458.168.356.2]Waktu kontak (jam)
Grafik penyisihan efisiensi Fe dengan media 50 g SMS
Gambar 4.11 Penyisihan Fe dengan media 50 gram SMS
Penyisihan logam Fe dengan media 50 gram SMS pada waktu kontak 6 jam pertama mengalami penyisihan yang sangat tinggi sebesar 99,99%, sehingga menurunkan konsentrasi Fe dari 4086,86 mg/L menjadi 0,66 mg/L. Waktu kontak 12 jam konsentrasi Fe sebesar 0,11 mg/L. Konsentrasi Fe mengalami kenaikan pada waktu kontak 24 jam menjadi 0,24 mg/L dan turun lagi menjadi 0,15 mg/L pada waktu kontak 48 jam dan konsentrasi Fe pada waktu kontak optimum 96 jam menjadi 0,06 mg/L. Dari grafik dapat dilihat regresi linear dengan persamaan garis lurus y = -19,46x + 1284 dengan koefisien determinasi R2 = 0,177
y = -19,46x + 1284, R² = 0,177
-1.000,00 0,00 1.000,00 2.000,00 3.000,00 4.000,00 5.000,00
0 12 24 36 48 60 72 84 96
K o n se n tr a si F e ( m g /L)
[image:62.595.160.461.84.244.2]Waktu kontak (jam)
Grafik penyisihan Fe dengan media 100 g SMS
Gambar 4.12 Penyisihan Fe dengan media 100 gram SMS
[image:62.595.161.465.534.703.2]Dari gambar grafik di atas dapat terlihat bahwa penyisihan penyisihan logam Fe pada 6 jam pertama mencapai 99,99%, dengan penyisihan konsentrasi Fe dari 4086,86 mg/L menjadi 0,35 mg/L. Waktu kontak 12 jam mereduksi Fe menjadi 0,24 mg/L dan relatif stabil pada 24 jam sebesar 0,23 mg/L dan 0,20 mg/L pada waktu kontak 48 jam. Konsentrasi akhir Fe pada 96 jam sebesar 0,08 mg/L. Persamaan garis lurus yang dihasilkan y = -19,46x + 1248. Koefisien determinasi R2 = 0,177.
Grafik penyisihan Fe terhadap waktu kontak dengan media 150 gram SMS dapat dilihat pada gambar dibawah ini.
y = -19,46x + 1284, R² = 0,177
-1.000,00 0,00 1.000,00 2.000,00 3.000,00 4.000,00 5.000,00
0 12 24 36 48 60 72 84 96
K o n se n tr a si F e ( m g /L)
Waktu kontak (jam)
Grafik penyisihan Fe dengan media 150 g SMS
Penyisihan logam Fe dengan media 150 gram SMS juga mengalami penyisihan yang tinggi pada 6 jam pertama sebesar 99,98% dengan konsentrasi Fe sebesar 0,34 mg/L. Konentsrasi Fe pada waktu kontak 12 jam sebesar 0,24 mg/L. Konsentrasi Fe pada waktu kontak 24 jam sebesar 0,25 mg/L. Konsentrasi Fe pada 48 jam sebesar 0,21 mg/L dan menurun pada waktu kontak optimum sebesar 0,08 mg/L dan menurun kembali pada waktu kontak 12 jam sebesar 73,47% dan relatif stabil pada waktu kontak 24 jam sebesar 74,48% dan 70,49% pada 48 jam dan mencapai penyisihan optimum pada 96 jam dengan konsentrasi Fe sebesar 0,06 mg/L. Persamaan garis linier yang dihasilkan y = -19,46x + 1284. Koefisien determinasi R2 = 0,177.
Dari ketiga media SMS yang digunakan dengan variasi massa yang berbeda yaitu 50 gram, 100 gram dan 150 gram menghasilkan korelasi linear dengan persamaan garis yang sama yaitu y = -19,46x + 1284 dengan koefisien determinasi R2 = 0,177.
Koefisien determinasi R2 = 0,177 = 17,7% menjelaskan bahwa pengaruh media SMS dalam penyisihan konsentrasi Fe terkait dengan waktu kontak hanya bisa dijelaskan 17,7% dimana sisanya oleh faktor lain.
4.9 Analisis Sulfat dengan Media SMS
Konsentrasi sulfat pada limbah air asam tambang sangat tinggi sebesar 5131,25
mg/L. Perlakuan yang dilakukan untuk meyisihkan Sulfat digunakan 3 (tiga) reaktor
dengan komposisi 50 gram SMS, 100 gram SMS dan 150 gram SMS. Masing masing
reaktor ditambahkan dengan 100 gram kapur. Hasil analisis Sulfat dengan media SMS
[image:64.595.112.510.377.478.2]dapat dilihat pada tabel dibawah ini.
Tabel 4.15 Penyisihan Sulfat dengan media SMS
Konsentrasi (mg/L) Penyisihan (%) Konsentrasi (mg/L) Penyisihan (%) Konsentrasi (mg/L) Penyisihan (%)
0 5.131,25 0,00 5.131,25 0,00 5.131,25 0,00
6 2.896,30 43,56 3.811,00 25,73 2.641,70 48,52
12 2.292,90 55,31 2.565,40 50,00 2.636,90 48,61
24 2.204,90 57,03 2.577,30 49,77 2.232,20 56,50
48 1.892,60 63,12 1.919,94 62,58 2.251,50 56,12
96 1.415,50 72,41 1.753,60 65,83 1.504,80 70,67
Waktu kontak (jam)
Massa Media SMS (g)
50 100 150
Grafik masing - masing media dapat dilihat pada gambar dibawah ini.
y = -25,54x + 3430, R² = 0,491
0,00 1.000,00 2.000,00 3.000,00 4.000,00 5.000,00 6.000,00
0 12 24 36 48 60 72 84 96
K o n se n tr a si s u lf a t (m g /L )
[image:64.595.156.469.527.711.2]Waktu kontak (jam)
Grafik penyisihan Sulfat dengan media 50 g SMS
Penyisihan sulfat pada waktu kontak 6 jam pertama sebesar 43,56%, menurunkan konsentrasi sulfat dari 5131,25 mg/L menjadi 2896,30 mg/L. Waktu kontak 12 jam menghasilkan penyisihan 55,31% dengan konsentrasi sulfat 2292,9 mg/L. Konsentrasi sulfat mengalami penurunan pada 24 jam menjadi 2204,9 mg/L dengan penyisihan 57,03% dan 1892,60 mg/L pada 48 jam dengan penyisihan 63,12 mg/L. Waktu kontak 96 jam menghasilkan penyisihan 72,41% dengan konsentrasi sulfat 1415,5 mg/L. Persamaan garis linier y = -25,54x + 3430 dengan koefisien determinasi R2 = 0,491. Koefisien korelasi r = 0,70.
y = -26,80x + 3790, R² = 0,565
0,00 1.000,00 2.000,00 3.000,00 4.000,00 5.000,00 6.000,00
0 12 24 36 48 60 72 84 96
K o n se n tr a si su lf a t (m g /L )
[image:65.595.159.467.305.478.2]Waktu kontak (jam)
Grafik penyisihan Sulfat dengan media 100 g SMS
Gambar 4.15 Penyisihan Sulfat dengan media 100 gram SMS
menghasilkan y = -26,8x + 3790. Koefisien determinasi R2 = 0,565. Koefisien korelasi r = 0,75.
y = -23,77x + 3470 R² = 0,474
0,00 1.000,00 2.000,00 3.000,00 4.000,00 5.000,00 6.000,00
0 12 24 36 48 60 72 84 96
K o n se n tr a si su lf a t (m g /L )
[image:66.595.148.475.134.297.2]Waktu kontak (jam)
Grafik penyisihan Sulfat dengan media 150 g SMS
Gambar 4.16 Penyisihan Sulfat dengan media SMS 150 gram
Penyisihan penyisihan sulfat dengan media 150 gram SMS menghasilkan 48,52% pada 6 jam pertama menghasilkan konsentrasi sulfat 2641,7 mg/L dari konsentrasi awal 5131,25 mg/L, relatif stabil pada 12 jam berikutnya dengan penyisihan 48,61% dengan konsentrasi sulfat 2636,9 mg/L dan penyisihan 56,50% pada 24 jam dengan konsentrasi 2232,2 mg/L. Penyisihan pada 48 jam sebesar 56,12% dan 70,67% pada 96 jam. Persamaan garis linier dari grafik di atas y = -23,77x + 3470. Koefisien determinasi R2 = 0,543 dengan koefisien korelasi r = 0,73.
Tabel 4.16 Persamaan garis linear media SMS untuk penyisihan Sulfat
MEDIA SMS
PERSAMAAN GARIS LINEAR
KOEFISIEN DETERMINASI (R2) 50 gram y = -25,54x + 3430 0,491
Dari ketiga persamaan garis di atas, nilai koefisien determinasi terbesar adalah 0,565 dengan persamaan y = -26,8x + 3790. Koefisien korelasi r = 0,75 menjelaskan tingkat keeratan hubungan atau korelasi antara 2 variabel cukup tinggi. Arah korelasi negatif (inversion correlation) yang menjelaskan bahwa hubungan antara dua