STUDI AWAL HIDROGEL POLIAKRILAMIDA-CO-KITOSAN SEBAGAI PENYERAP ION LOGAM Cr, Co, Ni, Cu, Zn DAN Pb
ERVA NURFILAH
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
STUDI AWAL HIDROGEL
POLIAKRILAMIDA-CO-KITOSAN SEBAGAI PENYERAP ION LOGAM Cr, Co, Ni, Cu,
Zn DAN Pb
Skripsi
Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Sarjana Sains Program Studi Kimia
Fakultas Sains dan Teknologi
Universitas Islam Negeri Syarif Hidayatullah Jakarta
Oleh :
ERVA NURFILAH 108096000040
PROGRAM STUDI KIMIA
FAKULTAS SAINS DAN TEKNOLOGI
UNIVERSITAS ISLAM NEGERI SYARIF HIDAYATULLAH
JAKARTA
vi
KATA PENGANTAR
Assalamu’alaikum Wr. Wb.
Puji syukur penulis panjatkan kehadirat Allah SWA atas rahmat dan
ridhonya, penulis dapat menyelesaikan skripsi yang berjudul “Studi Awal
Hidrogel Poliakrilamida-co-Kitosan Sebagai Penyerap Ion Logam Cr, Co, Ni,
Cu, Zn dan Pb” disusun untuk memenuhi persyaratan Sarjana Strata 1 (S1),
Program Studi Kimia, Fakultas Sains dan Teknologi, Universitas Islam Negeri
Syarif Hidayatullah, Jakarta.
Selama penelitian dan penulisan skripsi ini, berbagai pihak telah banyak
memberikan bantuan dan dorongan. Oleh karena itu, pada kesempatan ini
disampaikan rasa hormat dan ucapan terimakasih terutama diberikan kepada :
1. Adi Riyadhi, M.Si selaku dosen pembimbing I yang telah sabar
membimbing dan memberikan banyak ilmunya kepada penulis selama ini.
2. Tita Puspitasari, M.Si selaku dosen pembimbing II yang penuh kesabaran
dan keikhlasan dalam membimbing penulis selama ini.
3. Drs. Dede Sukandar, M.Si selaku Ketua Program Studi Kimia, Fakultas
Sains dan Teknologi, UIN Syarif Hidayatullah, Jakarta.
4. Dr. Agus Salim, M.Si selaku Dekan Fakultas Sains dan Teknologi, UIN
Syarif Hidayatullah, Jakarta.
5. Siti Nurbayti, M.Si selaku dosen penasehat akademik dan juga
dosen-dosen lainnya yang tidak saya sebutkan satu-persatu yang telah
vii
6. Teristimewa untuk kedua orangtuaku yang senantiasa memberikan doa,
kasih sayang, semangat serta dorongannya yang tak terhingga kepada
penulis. Kakak, adik, keponakanku dan ka Aji yang telah memberikan
keceriaan dan semangat kepada penulis.
7. Seluruh staff Pusat Aplikasi Teknologi Isotop dan Radiasi (PATIR)
BATAN Pasar Jumat (Ibu Oktaviani, Ibu Dewi, Ibu Dian dan yang
lainnya) yang telah memberikan bantuan, saran dan mangajarkan hal baru
kepada penulis.
8. Pak Maryoto dan ka Nita yang telah banyak membantu penulis dalam
menyelesaikan penelitian dan skripsi ini.
9. Teman-teman terbaikku (Isti, Jenia, Meilisa, Ita, Fada, Cide, Nina, Endah,
Arti, Tsani serta yang lainnya) yang telah memberikan dukungan,
semangat dan dorongan kepada penulis.
10.Keluarga besar kimia 2008, yang tidak dapat disebutkan satu persatu,
terimakasih atas saran, dukungan dan bantuannya. Serta semua pihak yang
tidak dapat disebutkan satu persatu.
Penulis menyadari bahwa skripsi ini masih jauh dari kesempurnaan. Maka
dari itu, diperlukan saran dan kritik yang membangun. Semoga skripsi ini dapat
bermanfaat bagi penulis khususnya dan bagi khazanah ilmu pengetahuan pada
umumnya.
Jakarta, Januari 2013
viii ABSTRAK
Erva Nurfilah. Studi Awal Hidrogel Poliakrilamida-co-Kitosan Sebagai Penyerap Ion Logam Cr, Co, Ni, Cu, Zn dan Pb. Dibimbing oleh Adi Riyadhi dan
Tita Puspitasari.
Hidrogel poliakrilamida-co-kitosan merupakan suatu hidrogel yang dapat dimanfaatkan sebagai suatu adsorben untuk menurunkan kadar logam berat. Penelitian ini bertujuan untuk mengetahui kemampuan hidrogel berbasis poliakrilamida dan kitosan sebagai adsorben dalam menyerap ion logam Cr6+, Co2+, Ni2+, Cu2+, Zn2+ dan Pb2+. Penelitian ini mengkaji pengaruh waktu perendaman hidrogel terhadap kapasitas penyerapan ion logam, juga untuk mengetahui pengaruh pH larutan logam, pengaruh berat hidrogel poliakrilamida-co-kitosan dan pengaruh konsentrasi larutan logam terhadap kapasitas penyerapan ion logam tersebut. Hidrogel poliakrilamida-co-kitosan direndam dalam larutan logam dan dikocok pada kecepatan 100 rpm dengan variasi waktu perendaman hidrogel, variasi pH larutan logam, variasi berat hidrogel, dan variasi konsentrasi larutan logam. Hasilnya disaring dan filtratnya dianalisis dengan Spektofotometer Serapan Atom (SSA). Berdasarkan hasil yang diperoleh waktu optimum perendaman hidrogel poliakrilamida-co-kitosan untuk logam Co2+ dan Zn2+ adalah 30 menit, Cr6+, Ni2+, Pb2+adalah 60 menit (1 jam) dan Cu2+ adalah 300 menit (5 jam). pH optimum untuk Cr6+ dan Pb2+ yaitu pada pH 7, sedangkan untuk Co2+, Ni2+, Cu2+dan Zn2+ yaitu relatif baik pada pH 9. Kondisi penyerapan yang relatif baik yaitu pada berat hidrogel 5 mg dan konsentrasi larutan logam 100 ppm.
ix ABSTRACT
Erva Nurfilah. Preliminary study of hydrogel polyacrylamide-co-chitosan as an absorbent metals ion Cr, Co, Ni, Cu, Zn and Pb. Guided by Adi riyadhi and Tita Puspitasari.
Hydrogel polyacrylamide-co-chitosan is a hydrogel that can be used as an adsorbent to lower the levels of heavy metals. Research is aimed to determine the ability of hydrogel based Polyacrylamide and chitosan as the adsorbent in absorbing metal ions Cr6+, Co2+, Ni2+, Cu2+, Zn2+, and Pb2+. This research had study the influence of time due to soaking hydrogel against the capacity of the absorption of metal ions, also to know the influence of metal pH solution, influence of hydrogel polyacrylamide-co-chitosan weight and influence of metal solution concentration to the capacity of the absorption of the metal ions. Hydrogel polyacrylamide-co-Chitosan had been swelled in a solution of metal and in shaker at 100 rpm with soaking variation time of hydrogel, solution pH variations, variations of hydrogel weight, and variations of metal consentration solution. The results are filtered and the filtrate analyzed by Atomic Absorption Spectrophotometer (AAS). Based on the obtained results the optimum time of soaking hydrogel polyacrylamide-co-Chitosan for Co2+ and Zn2+ metal is 30 minutes, Cr6+, Ni2+, Pb2+ is 60 minutes (1 hour) and Cu2+ is 300 minutes (5 hours). the optimum pH for Cr6+ and Pb2+ are at pH 7, while for metal Co2+, Ni2+, Cu2+ and Zn2+ relatively good at pH 9. A relatively good absorption conditions namely weight on 5 mg hydrogel and concentration of metal solution 100 ppm.
x DAFTAR ISI
Halaman
KATA PENGANTAR ... vi
DAFTAR ISI ... x
DAFTAR TABEL ... xiii
DAFTAR GAMBAR ... xv
DAFTAR LAMPIRAN ... xvi
BAB I PENDAHULUAN ... 1
1.1. Latar Belakang ... 1
1.2. Perumusan Masalah ... 4
1.3. Hipotesis ... 4
1.4. Tujuan Penelitian ... 4
1.5. Manfaat Penelitian ... 5
BAB II TINJAUAN PUSTAKA ... 6
2.1. Adsorpsi ... 6
2.1.1. Metode Sorpsi ... 9
2.1.2. Biosorpsi ... 9
2.2. Hidrogel ... 11
2.3. Poliakrilamida ... 13
2.4. Kitosan ... 15
2.5. Logam Berat ... 17
xi
2.5.2. Kobalt (Co) ... 19
2.5.3. Nikel (Ni) ... 20
2.5.4. Tembaga (Cu)... 21
2.5.5. Seng (Zn) ... 22
2.5.6. Timbal (Pb) ... 23
2.6. Iradiasi Sinar Gamma (γ) ... 24
2.6.1. Interaksi Sinar Gamma dengan Materi ... 25
2.6.2. Sumber Radiasi ... 27
2.6.3. Dosis Radiasi ... 28
2.6.4. Efek Radiasi terhadap Materi ... 29
2.7. Spektrofotometer Serapan Atom (SSA) ... 30
2.7.1. Instrumentasi Spektrofotometer Serapan Atom ... 33
BAB III METODE PENELITIAN ... 37
3.1. Waktu dan Tempat Penelitian ... 37
3.2. Alat dan Bahan ... 37
3.2.1. Alat ... 37
3.2.2. Bahan ... 37
3.3. Pembuatan Hidrogel Poliakrilamida-co-Kitosan ... 38
3.4. Uji Sifat Fisika ... 38
3.4.1. Penentuan fraksi gel dari hidrogel ... 38
3.4.2. Penentuan rasio swelling ... 39
xii
3.5.1. Efek waktu perendaman gel terhadap kapasitas penyerapan logam 39
3.5.2. Efek pH larutan logam terhadap kapasitas penyerapan logam ... 40
3.5.3. Efek berat gel terhadap kapasitas penyerapan logam ... 40
3.5.4. Efek konsentrasi awal larutan logam terhadap kapasitas penyerapan logam ... 40
BAB IV HASIL DAN PEMBAHASAN ... 42
4.1. Uji Sifat Fisika Hidrogel ... 43
4.1.1. Penentuan fraksi gel dari hidrogel ... 43
4.1.2. Penentuan rasio swelling ... 43
4.1.3. Penentuan Equilibrium Degree of Swelling (EDS) ... 45
4.2. Penentuan Kondisi Optimum ... 46
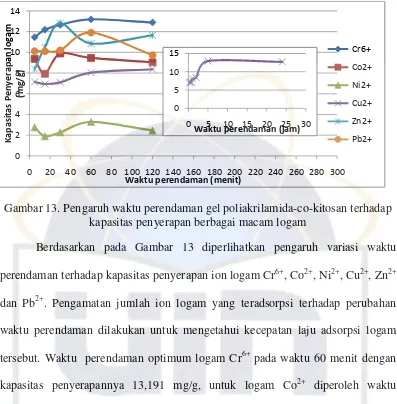
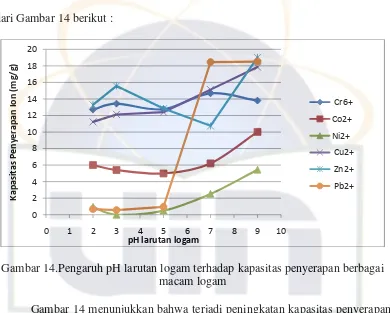
4.2.1. Pengaruh waktu perendaman hidrogel terhadap penyerapan logam 46 4.2.2. Pengaruh pH terhadap penyerapan logam ... 49
4.2.3. Pengaruh berat gel terhadap penyerapan logam ... 51
4.2.4. Pengaruh konsentrasi awal logam terhadap penyerapan logam ... 53
BAB V KESIMPULAN DAN SARAN ... 57
5.1. Kesimpulan ... 57
5.2. Saran ... 58
DAFTAR PUSTAKA ... 59
xiii
DAFTAR TABEL
Halaman
Tabel 1. Perbedaan adsorpsi fisika dan adsorpsi kimia... 8
Tabel 2. Pengaruh waktu perendaman gel terhadap kapasitas penyerapan ion logam ... 48
Tabel 3. Pengaruh pH larutan logam terhadap kapasitas penyerapan ion logam 50 Tabel 4. Pengaruh berat hidrogel terhadap kapasitas penyerapan ion logam .. 52
Tabel 5. Pengaruh konsentrasi awal larutan logam terhadap kapasitas penyerapan ion logam ... 55
Tabel 6. Data fraksi gel ... 65
Tabel 7. Data rasio swelling ... 66
Tabel 8. Data EDS ... 67
Tabel 9. Pembuatan larutan buffer ... 71
Tabel 10. Kurva standar logam kromium (Cr) ... 73
Tabel 11. Kurva standar logam kobalt(Co) ... 74
Tabel 12. Kurva standar logam nikel (Ni) ... 75
Tabel 13. Kurva standar logam tembaga (Cu) ... 76
Tabel 14. Kurva standar logam seng (Zn) ... 77
Tabel 15. Kurva standar logam timbal (Pb) ... 78
Tabel 16. Data hasil analisis pengaruh waktu perendaman hidrogel terhadap penyerapan ion logam ... 79
Tabel 17. Data hasil analisis pengaruh pH larutan logam terhadap penyerapan ion logam ... 82
xiv
Tabel 19. Data hasil analisis pengaruh konsentrasi awal larutan logam
terhadap penyerapan ion logam ... 88
xv
DAFTAR GAMBAR
Halaman
Gambar 1. (a) Ilustrasi hidrogel poliakrilamida-co-kitosan, (b) Struktur
Hidrogel Poliakrilamida-co-Kitosan ... 12
Gambar 2. Struktur poliakrilamida ... 15
Gambar 3. Struktur kitosan ... 16
Gambar 4. Efek fotolistrik... 26
Gambar 5. Efek hamburan Compton ... 26
Gambar 6. Produksi pasangan ion ... 27
Gambar 7. Prinsip kerja Spektrofotometer Serapan Atom... 32
Gambar 8. Hollow Cathode Lamp ... 35
Gambar 9. Electrodelles Discharge Lamp ... 35
Gambar 10. Hidrogel poliakrilamida-co-kitosan, (a) sebelum swelling, (b) setelah swelling ... 42
Gambar 11. (a) Ilustrasi proses swelling hidrogel ... 43
Gambar 12. Rasio swelling ... 44
Gambar 13. Pengaruh waktu perendaman gel poliakrilamida-co-kitosan terhadap kapasitas penyerapan berbagai macam logam... 47
Gambar 14. Pengaruh pH larutan logam terhadap kapasitas penyerapan berbagai macam logam ... 49
xvi
DAFTAR LAMPIRAN
Halaman
Lampiran 1. Bagan Kerja Pembuatan Hidrogel Poliakrilamida-co-Kitosan .... 64
Lampiran 2. Hasil Analisis Fraksi Gel ... 65
Lampiran 3. Hasil Analisis Rasio Swelling ... 66
Lampiran 4. Hasil Analisis EDS ... 67
Lampiran 5. Contoh perhitungan fraksi gel, rasio swelling dan EDS ... 68
Lampiran 6. Contoh perhitungan pembuatan larutan logam dan larutan buffer ... 69
Lampiran 7. Contoh perhitungan kapasitas penyerapan dan efisiensi Penyerapan ... 72
Lampiran 8. Kurva kalibrasi ... 73
Lampiran 9. Data Hasil Analisil Logam ... 79
1 BAB I
PENDAHULUAN
1.1. Latar Belakang
Perkembangan penduduk yang semakin pesat saat ini memicu pula
pesatnya pertumbuhan dalam bidang industri sehingga semakin banyak limbah
yang dihasilkan. Limbah industri yang mengandung logam berat dan tergolong
limbah B3 (Bahan Beracun dan Berbahaya) jika berada di lingkungan dalam
jumlah yang melewati ambang batas dapat membahayakan lingkungan sekitarnya.
Salah satu industri yang menimbulkan pencemaran yaitu industri pelapisan logam
atau electroplating. Logam berat yang terkandung dalam limbah industri ini
antara lain Cr, Co, Ni, Cu, Zn dan Pb. Limbah ini memerlukan penanganan
khusus agar konsentrasinya dapat diminimalisir dan tidak berdampak buruk bagi
lingkungan.
Belakangan ini, usaha pengendalian limbah ion logam semakin
berkembang dan mengarah pada upaya pencarian metode baru yang murah, efektif
dan efisien. Salah satunya yaitu dengan menggunakan metode adsorpsi. Proses
adsorpsi ini lebih banyak dipakai dalam industri karena mempunyai beberapa
keuntungan, yaitu lebih ekonomis dan tidak menimbulkan efek samping yang
beracun serta mampu menghilangkan bahan-bahan organik. Adsorpsi adalah
proses akumulasi adsorbat pada permukaan adsorben yang disebabkan oleh gaya
tarik antar molekul adsorbat dengan permukaan adsorben. Interaksi yang terjadi
2
interaksi, tergantung pada struktur kimia masing-masing komponen.Ada dua jenis
adsorpsi yaitu adsorpsi fisika dan adsorpsi kimia. Pada adsorpsi fisika ini terjadi
karena disebabkan oleh gaya Van der Waals yang ada pada permukaan adsorben,
panas adsorpsi fisika biasanya lebih rendah. Sedangkan pada adsorpsi kimia
terjadi reaksi antara zat yang terserap dengan adsorben dan panas adsorpsinya
tinggi. Adsorpsi juga dipengaruhi oleh beberapa faktor, yaitu proses pengadukan,
karakteristik adsorben, kelarutan dari adsorbat, ukuran molekul adsorbat, pH dan
temperatur (Pujiastuti et al., 2004).
Hidrogel adalah salah satu bahan yang akhir-akhir ini banyak diteliti
sebagai alternatif adsorben ion logam berat (Ozkahraman, 2011). Hidrogel ini
mampu menyerap air, sehingga aplikasi hidrogel sebagai adsorben ion logam
dalam air perlu terus dikembangkan.
Akrilamida adalah salah satu jenis monomer hidrofilik yang merupakan
bahan baku paling populer untuk pembuatan polimer poliakrilamida. Sesuai
dengan pengembangan di bidang penelitian dan teknologi, maka pada beberapa
tahun belakangan ini penelitian yang berkaitan dengan polimer poliakrilamida
sedang dikembangkan sebagai bahan dasar untuk bahan biomaterial baru seperti
hidrogel poliakrilamida. Hal ini dikarenakan hidrogel poliakrilamida digunakan
untuk matriks penyimpan air dan yang paling menjanjikan ke depan adalah
sebagai bahan penyerap (absorbent). Namun demikian, hidrogel poliakrilamida
mempunyai kelemahan seperti kemampuannya dalam menyerap air (swelling)
terbatas dan merupakan homopolimer dengan sifat fisik relatif rendah, sehingga
3
Untuk menaikkan sifat swellingnya perlu ditambahkan suatu zat lain
misalnya polimer yang juga bersifat menyerap air. Pada umumnya penambahan
polimer lain yang kompatibel pada suatu jenis homopolimer akan menaikkan sifat
fisiknya baik modifikasinya dilakukan dengan cara reaksi kimia maupun radiasi.
Kitosan sebagai biopolimer dapat digunakan untuk menyerap ion logam
berat yang terdapat dalam air permukaan dan limbah industri. Selain karena
biopolimer ini mudah diperoleh dan ramah lingkungan, biopolimer tersebut
memiliki gugus-gugus fungsi yang berbeda seperti hidroksil dan amina yang
memungkinkan ion logam dapat terikat baik secara adsorpsi fisik maupun
adsorpsi kimia (Schmul et al., 2001). Penggunaan biopolimer ini dapat
bermanfaat dalam pengolahan limbah industri yang mengandung logam-logam
berat seperti Cr, Co, Ni, Cu, Zn dan Pb (Marganof, 2007). Pencemaran
logam-logam berat tersebut dapat membahayakan kehidupan perairan dan kesehatan
manusia meskipun dalam jumlah yang sangat kecil. Penelitian sebelumnya
melaporkan bahwa telah banyak metode yang digunakan untuk menghilangkan
logam berat dalam perairan diantaranya presipitasi, filtrasi, penukar ion,
elektrodeposisi, adsorpsi dan sistem membrane (Schmul et al., 2001).
Metode-metode tersebut memiliki kelebihan dan kekurangan masing-masing, bahkan
terkadang masih menyisakan masalah.
Dalam penelitian ini akan dipelajari kemampuan hidrogel berbasis
poliakrilamida-co-kitosan dibuat dengan menggunakan metode iradiasi sinar
gamma. Analisis logam yang terserap oleh hidrogel di ukur dengan menggunakan
4 1.2. Perumusan Masalah
1. Bagaimanakah potensi hidrogel poliakrilamida-co-kitosan dalam
menyerap ion logam Cr, Co, Ni, Cu, Zn dan Pb.
2. Apakah terdapat hubungan antara penyerapan ion logam Cr, Co, Ni, Cu,
Zn dan Pb oleh hidrogel poliakrilamida-co-kitosan dengan variasi waktu
perendaman gel dalam larutan ion logam, pH larutan ion logam, berat gel
dan konsentrasi larutan ion logam.
1.3. Hipotesis
1. Hidrogel poliakrilamida-co-kitosan dapat menyerap ion logam berat Cr,
Co, Ni, Cu, Zn dan Pb pada kondisi optimum.
2. Kemampuan penyerapan ion logam Cr, Co, Ni, Cu, Zn dan Pb dipengaruhi
oleh variasi waktu perendaman, pH, berat gel dan konsentrasi larutan ion
logam.
1.4.Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui kemampuan hidrogel berbasis
poliakrilamida dan kitosan sebagai adsorben yang dapat menyerap ion logam Cr,
Co, Ni, Cu, Zn dan Pb dan mempelajari kondisi optimum penyerapan ion logam
tersebut. Kondisi optimum yang dipelajari meliputi efek waktu perendaman, pH
5 1.5.Manfaat Penelitian
Manfaat yang diharapkan dari penelitian ini adalah dapat memberikan
informasi bahwa hidrogel poliakrilamida-co-kitosan dapat digunakan sebagai
penyerap ion logam Cr, Co, Ni,Cu, Zn dan Pb sehingga dapat diaplikasikan dalam
6 BAB II
TINJAUAN PUSTAKA
2.1. Adsorpsi
Adsorpsi merupakan suatu proses penyerapan oleh padatan tertentu
terhadap zat tertentu yang terjadi pada permukaan zat padat karena adanya gaya
tarik atom atau molekul pada permukaan zat padat tanpa meresap ke dalam
(Atkins, 1982).
Proses adsorpsi dapat terjadi karena adanya gaya tarik atom atau molekul
pada permukaan padatan. Adanya gaya ini, padatan cenderung menarik
molekul-molekul yang lain yang bersentuhan dengan permukaan padatan, baik fasa gas
atau fasa larutan ke dalam permukaannya. Akibatnya, konsentrasi molekul pada
permukaan menjadi lebih besar dari pada dalam fasa gas atau zat terlarut dalam
larutan. Adsorpsi berbeda dengan absorpsi. Pada absorpsi zat yang diserap masuk
ke dalam absorben sedangkan pada adsorpsi zat yang diserap hanya terdapat pada
permukaannya (Sukardjo, 1990).
Adsorpsi dapat terjadi pada antarfasa padat-cair, padat-gas atau gas-cair.
Molekul yang terikat pada bagian permukaan disebut adsorbat, sedangkan
permukaan yang menyerap molekul-molekul adsorbat disebut adsorben. Pada
adsorpsi, interaksi antara adsorben dengan adsorbat hanya terjadi pada permukaan
adsorben. Adsorpsi adalah gejala pada permukaan, sehingga semakin besar luas
permukaan, maka semakin banyak zat yang teradsopsi. Walaupun demikian,
7
Faktor-faktor yang mempengaruhi adsorpsi antara lain struktur adsorben,
berat adsorben, pH media, ukuran partikel, kapasitas pertukaran ion dan suhu.
Adsorpsi tergantung luas permukaan adsorben, semakin poros adsorben, maka
daya adsorpsinya semakin besar. Adsorben padat yang baik yaitu porositasnya
tinggi, permukaannya sangat luas sehingga adsorbsi terjadi pada banyak tempat.
Demikian juga untuk konsentrasi dan luas permukaan, semakin besar konsentrasi
adsorbat maka semakin banyak adsorbat yang teradsorpsi dan semakin besar luas
permukaan adsorben, maka adsorpsinya pun semakin besar pula (Wiyarsi dan
Priyambodo, 2009).
Berdasarkan besarnya interaksi antara adsorben dengan adsorbat, adsorpsi
dibedakan menjadi dua macam yaitu adsorpsi fisika dan adsorpsi kimia.Dalam
adsorpsi fisika, molekul-molekul teradsorpsi pada permukaan adsorben dengan
ikatan yang lemah (ikatan Van der Waals). Adsorpsi ini bersifat reversibel,
sehingga molekul-molekul yang teradsorpsi mudah dilepaskan kembali dengan
cara menurunkan tekanan gas atau konsentrasi zat terlarut. Panas adsorpsi yang
menyertai adsorpsi fisika yaitu berkisar 10 kJ/mol (Danarto, 2007). Adsorpsi
fisika umumnya terjadi pada temperatur yang rendah dan jumlah zat yang
teradsorpsi akan semakin kecil dengan naiknya suhu. Demikian juga kondisi
kesetimbangan tercapai segera setelah adsorben bersentuhan dengan adsorbat. Hal
ini dikarenakan dalam fisika tidak melibatkan energi aktivasi.
Pada adsorpsi kimia, molekul-molekul yang teradsorpsi pada permukaan
adsorben bereaksi secara kimia. Hal ini disebabkan pada adsorpsi kimia terjadi
8
mempunyai kisaran yang sama seperti reaksi kimia, yaitu berkisar 100 kJ/mol.
Ikatan antara adsorben dengan adsorbat dapat cukup kuat sehingga struktur
aslinya tidak dapat ditemukan kembali. Adsorpsi ini bersifat irreversibel dan
diperlukan energi yang banyak untuk melepaskan kembali adsorbat (dalam proses
adsorpsi) karena ikatannya berupa ikatan kimia yang sangat kuat. Pada umumnya,
dalam adsorpsi kimia jumlah (kapasitas) adsorpsi bertambah besar dengan
naiknya temperatur. Zat yang teradsorpsi membentuk satu lapisan monomolekuler
dan relatif lambat tercapai kesetimbangan karena dalam adsorpsi kimia
melibatkan energi aktivasi (Oscik, 1982).
Secara singkatnya perbedaan adsorpsi secara fisika dan kimia dapat dilihat
pada tabel di bawah ini :
Tabel 1. Perbedaan adsorpsi fisika dan adsorpsi kimia
Adsorpsi fisika Adsropsi kimia
1. Molekul terikat pada adsorben oleh gaya van der waals
2. Mempunyai entalpi -4 sampai -40 kJ/mol
3. Dapat membentuk lapisan multilayer
4. Adsorbsi dapat terjadi pada suhu ruang
5. Jumlah adsorpsi pada permukaan merupakan fungsi adsorbat 6. Tidak melibatkan energi aktivasi
tertentu
7. Bersifat tidak spesifik
1. Molekul terikat pada adsorben oleh ikatan kimia
2. Mempunyai entalpi reaksi -40 sampai -800 kJ/mol
3. Membentuk lapisan monolayer 4. Adsorpsi dapat terjadi pada suhu
tinggi
5. Jumlah adsorpsi pada permukaan merupakan karakteristik adsorben dan adsorbat
6. Melibatkan energi aktivasi tertentu
7. Bersifat sangat spesifik
Proses adsorpsi berlangsung melalui tiga tahapan, yaitu makrotransport,
mikrotransport dan sorpsi. Makrotransport meliputi perpindahan adsorbat melalui
9
difusi adsorbat melalui sistem makroposi dan submikropori.Sorpsi merupakan
istilah untuk menjelaskan kontak adsorbat terhadap adsorben. Istilah ini
digunakan karena sulitnya membedakan proses yang berlangsung, apakah
fisiosorpsi atau kimisorpsi. Kapasitas adsorpsi suatu adsorben untuk sebuah
kontaminan dapat ditentukan dengan menghitung isoterm adsorpsi.
2.1.1. Metode sorpsi
Metode sorpsi dapat dilakukan dengan dua cara yaitu statis (batch) dan
dinamis (kolom).
1. Cara statis (batch) yaitu ke dalam wadah yang berisi sorben dimasukkan
larutan yang mengandung komponen yang diinginkan, selanjutnya di aduk
dalam waktu tertentu, kemudian dipisahkan dengan cara penyaringan atau
dekantasi. Komponen yang telah terikat pada sorben dilepaskan kembali
dengan melarutkan sorben dalam pelarut tertentu dan volumenya lebih
kecil dari volume larutan mula-mula.
2. Cara dinamis (kolom) yaitu ke dalam kolom yang telah diisi dengan
sorben dilewatkan larutan yang mengandung komponen tertentu
selanjutnya komponen yang telah terserap dilepaskan kembali dengan
mengalirkan pelarut (eluen) sesuai yang volumenya lebih kecil (Hanjono,
1995).
2.1.2. Biosorpsi
Pencarian untuk teknologi baru yang melibatkan pemindahan logam
beracun dari air limbah telah mengarahkan perhatian terhadap biosorpsi,
10
dapat didefinisikan sebagai kemampuan material biologi untuk mengakumulasi
logam berat dari air limbah melalui jalur metabolisme fisika-kimia dimediasi atau
melalui proses serapan (Fourest dan Roux, 1992). Ganggang, bakteri, jamur dan
ragi telah terbukti potensial sebagai biosorben logam (Volesky, 2011).Keuntungan
utama dari biosorpsi atas metode konvensional yaitu diantaranya biaya rendah,
efisiensi tinggi, minimisasi bahan kimia dan biologi. Proses biosorpsi melibatkan
fasa padat (sorben atau biosorben) dan fase cair (pelarut, biasanya air) berisi
spesies terlarut akan diserap (adsorbat, ion logam).
Proses biosorpsi terjadi ketika ion logam berat mengikat dengan 2 cara
yang berbeda, pertama terjadi pertukaran ion dimana ion monovalen dan divalen
seperti Na, Mg dan Ca pada dinding sel digantikan oleh ion-ion logam berat dan
kedua terbentuk senyawa kompleks antara ion-ion logam berat dengan fungsional
grup seperti karbonil, amino, thiol, hidroksi, pospat dan hidroksi-karbonil yang
berada pada dinding sel. Proses biosorpsi dapat lebih efektif dengan adanya pH
dan ion-ion lainnya.
Proses penyerapan (sorpsi) dapat melalui pengikatan aktif dan pasif.
Pengikatan aktif melibatkan reaksi metabolisme terjadi pada biomaterial, tidak
seperti sorben sintesis (resin, silika dan selulosa) yang hanya mengandung satu
macam gugus fungsi.Biomaterial memiliki beberapa gugus fungsi yang ditemukan
dalam sel dan dinding selnya. Gugus fungsi aktif dalam proses penyerapan
diantaranya, karboksil, hidroksil, amino, phospat dan lain-lain (Guibal et al.,
11 2.2.Hidrogel
Hidrogel adalah salah satu jenis makromolekul polimer hidrofilik yang
berbentuk jaringan berikatan silang, mempunyai kemampuan mengembang dalam
air (swelling) serta mempunyai daya diffusi air yang tinggi. Hidrogel ini memiliki
sifat dasar dapat menyerap air lebih dari 15 kali berat keringnya sendiri, bisa
menggembung (swelling) karena meningkatnya entropi jaringan polimer dan air
yang telah diserap sukar untuk lepas dan hidrogel tersebut tidak larut oleh solvasi
molekul-molekul air melalui ikatan hidrogen karena adanya gugus ionik alami dan
struktur saling bersambungan (interconnected) (Anahet al., 2010).
Faktor yang mempengaruhi penyerapan air adalah tekanan osmotik, yang
berdasarkan pada ion penukar yang dapat berpindah dan afinitas antara polimer
elektrolit dan air. Faktor yang menahan tenaga penyerapan sebagai lawannya
adalah adanya elastisitas gel hasil dari struktur jaringannya. Karena
karakteristiknya yang unggul maka hidrogel di pakai secara luas dibidang
agrikultur, holtikultur, sanitary dan medis. Kemampuan gel yang membengkak
dan melepaskan air ke sekelilingnya secara terkendali telah menjadikan material
hidrogel di pakai untuk produk-produk pengendali kelembaban, keperluan farmasi
dan sebagai pengkondisi tanah. Karakteristik lain dari hidrogel adalah sifat seperti
karet alam yang dapat digunakan untuk mengendalikan konsistensi produk dalam
bidang kosmetik, dan di pakai untuk memberi sifat-sifat yang berdampak segel
untuk produk–produk yang kontak dengan air atau larutan encer, seperti kawat
dan kabel bawah tanah. Jadi kapasitas penyerapan air atau water absorption
12
Kelemahan utama dari hidrogel ini berbentuk homopolimer yang
mempunyai sifat mekanik relatif rendah dan mudah rapuh sehingga
pengembangannya untuk aplikasi menjadi sangat terbatas. Kelebihan dari hidrogel
ini adalah harganya yang ekonomis dan mudah untuk dibuat serta bahan-bahannya
yang mudah di dapat.struktur hidrogel dapat dilihat dari Gambar 1 berikut :
(a)
(b)
Gambar 1.(a) Ilustrasi Hidrogel Poliakrilamida-co-Kitosan, (b) Struktur Hidrogel Poliakrilamida-co-Kitosan
C
CHH C C
N NHH
2 2 C
C O O
C
CHH C C
N NHH
2 2 C C OO
C
CHH CC
N NHH
2 2 C
C O O
C
CHH C C
N NHH
2 2 C C O O
C
CHH CC
N NHH
2 2 C
C OO
C CHH C C N NHH 2 2 C C O O C CHH C C N NHH22
C C O O C CHH C C N NHH 2 2 C C O O C CHH C C N NHH 2 2 C C O O C CHH C C N NHH22
13
Salah satu hidrogel lain selain poliakrilamida-co-kitosan adalah Poli(vinil)
pirolidon (PVP)-k-karaginan yang digunakan sebagai pembalut luka bakar.
Poli(vinil) pirolidon (PVP) dan k-karaginan merupakan polimer yang tidak toksik,
pada umumnya banyak digunakan dalam bidang kesehatan, farmasi, serta
kosmetika. Kegunaan k-karaginan dalam sintesis hidrogel ini adalah untuk
menaikkan viskositas larutan PVP dan untuk mengekang air, sehingga diperoleh
suatu sistem padatan campuran PVP-karaginan yang mudah dalam
penanganannya pada shaping (membentuk produk) yang diinginkan dalam proses
iradiasi. Hal ini merupakan salah satu keunggulan dari aplikasi radiasi selain
untuk reaksi polimerisasi/kopolimerisasi maupun sterilisasi produk yang dapat
berlangsung secara simultan (Erizal, 2008).
2.3.Poliakrilamida
Poliakrilamida merupakan polimer dari akrilamida.Akrilamida
(CH2=CHCONH2) adalah senyawa kimia berwarna putih, tidak berbau, berbentuk
kristal padat yang sangat mudah larut dalam air dan mudah bereaksi melalui
reaksi amida atau ikatan rangkapnya. Monomernya cepat berpolimerisasi pada
titik leburnya atau di bawah sinar ultraviolet. Akrilamida dalam larutan bersifat
stabil pada suhu kamar dan tidak berpolimerisasi secara spontan (Harahap, 2006).
Akrilamida (AAM) adalah salah satu jenis monomer hidrofilik yang
merupakan bahan baku paling populer untuk pembuatan polimer poliakrilamida
(PAAM) yang digunakan sebagai media penunjang dalam elektroforesis
14
penelitian dan teknologi, maka pada beberapa tahun belakangan ini penelitian
yang berkaitan dengan polimer PAAM sedang dikembangkan secara intensif
sebagai bahan dasar (base material) untuk bahan biomaterial baru antara lain
sebagai hidrogel PAAM digunakan di bidang kosmetik sebagai pengganti silikon
dalam bedah plastik. Hal ini dikarenakan hidrogel PAAM mempunyai sifat
biokompatibel dengan tubuh tidak menyebabkan sensititasi pada kulit, tidak
pirogen, dan tidak menyebabkan hidrolisis protein. Selain itu, hidrogel PAAM
digunakan sebagai bahan penyerap (absorbent) dalam personal care misalnya,
sebagai absorben dalam popok bayi, pembalut wanita dan pembalut luka. Namun
demikian, hidrogel PAAM mempunyai kelemahan antara lain kemampuannya
dalam menyerap air (swelling) terbatas dan merupakan homopolimer dengan sifat
fisik yang relatif rendah, sehingga pengembangan untuk aplikasinya juga terbatas
(Erizal dan Rahayu, 2009).
Untuk menaikkan sifat swellingnya perlu ditambahkan suatu zat lain
misalnya polimer yang juga bersifat menyerap air. Pada umumnya penambahan
polimer lain yang kompatibel pada suatu jenis homopolimer akan menaikkan sifat
fisiknya yang dapat dimodifikasi dengan cara reaksi kimia maupun radiasi
(Erizal et al., 2007).
Akrilamida merupakan monomer yang mempunyai ikatan rangkap dua
dalam struktur molekulnya yang peka terhadap paparan radiasi membentuk
radikal bebas, pada akhir proses reaksi radikal bebas membentuk hidrogel dengan
jaringan ikatan silang IPN (interpenetrating network) yang memungkinkan
15
[image:31.595.92.491.142.547.2]Struktur akrilamida dapat dilihat pada Gambar 2 sebagai berikut :
Gambar 2.Struktur Poliakrilamida
2.4.Kitosan
Kitosan dihasilkan dari kitin dan mempunyai sruktur kimia yang sama
dengan kitin, terdiri dari rantai molekul yang panjang dan berat molekulnya
tinggi. Perbedaan antara kitin dengan kitosan adalah pada setiap cincin molekul
kitin terdapat gugus asetil (-CH3-CO) pada atom karbon kedua, sedangkan pada
kitosan terdapat gugus amina (-NH2). Kitosan dapat dihasilkan dari kitin melalui
proses deasetilasi yaitu dengan cara direaksikan dengan menggunakan alkali
konsentrasi tinggi dengan waktu yang relatif lama dan suhu yang tinggi (Apsari,
2010).
Jika sebagian besar gugus asetil pada kitin disubstitusikan oleh hidrogen
menjadi gugus amino dengan penambahan basa konsentrasi tinggi, maka hasilnya
dinamakan kitosan atau kitin terdeasetilasi. Kitosan relatif lebih banyak digunakan
pada berbagai bidang industri kesehatan dan terapan karena kitosan dapat dengan
16
Struktur kitosan dapat dilihat dari Gambar 3 sebagai berikut :
Gambar 3.Struktur Kitosan
Adanya gugus fungsi hidroksil primer dan sekunder mengakibatkan
kitosan mempunyai keaktifan kimia yang tinggi. Gugus fungsi yang terdapat pada
kitosan memungkinkan juga untuk modifikasi kimia yang beraneka ragam
termasuk reaksi-reaksi dengan zat perantara ikatan silang, kelebihan ini dapat
memungkinkan kitosan digunakan sebagai bahan campuran bioplastik, yaitu
plastik yang dapat terdegradasi dan tidak mencemari lingkungan.
Salah satu kegunaan kitosan adalah afinitasnya dalam menyerap ion logam
berat. Besarnya afinitas kitosan dalam mengikat logam sangat tergantung dari
karakteristik makro-struktur kitosan yang dipengaruhi oleh sumber dan kondisi
pada proses isolasi (Schmuhl et al.,2001). Bentuk serpihan kitosan, afinitasnya
terhadap ion logam telah diuji coba terhadap ion Pb2+, Ni2+, dan Cr6+ oleh
Jamaludin (1994) dan ion logam Cu(II) dan Cr(VI) oleh Nurdiani (2005).
Modifikasi kitosan dapat dilakukan untuk meningkatkan penyerapannya terhadap
ion logam. Guibal etal(1992) menyatakan bahwa modifikasi kimia kitosan
menjadi bentuk gel dapat meningkatkan kemampuan dan kapasitas serapnya
terhadap ion logam berat. Hal ini disebabkan karena bentuk gel mempunyai
17
Kegunaan kitosan yang lainnya diantaranya digunakan didalam berbagai
industri seperti industri farmasi, kesehatan, biokimia, bioteknologi, pangan,
pengolahan limbah, kosmetik, agroindustri, tekstil, industri perkayuan, industri
kertas, dan industri elektronika. Aplikasi khusus berdasarkan sifat yang
dimilikinya diantaranya untuk pengolahan limbah cair terutama sebagai resin
penukar ion untuk meminimalisir logam-logam berat dan mengurangi kekeruhan
(Meriatna, 2008).
2.5. Logam Berat
Menurut Fardiaz (1995) istilah logam berat sebenarnya sudah
dipergunakan secara luas terutama dalam perpustakaan ilmiah sebagai unsur yang
menggambarkan bentuk dari logam tertentu.Semua logam berat dapat dikatakan
sebagai bahan beracun yang dapat meracuni makhluk hidup.Sebagai contoh logam
berat air raksa (Hg), kadmium (Cd), timbal (Pb), dan krom (Cr).Namun demikian,
meskipun semua logam berat dapat mengakibatkan keracunan atas makhluk
hidup, sebagian dari logam-logam berat tersebut dibutuhkan oleh makhluk
hidup.Kebutuhan tersebut dalam jumlah yang sangat kecil/sedikit.Tetapi apabila
kebutuhan yang sangat kecil tersebut tidak terpenuhi dapat berakibat fatal
terhadap kelangsungan makhluk hidup.Karena tingkat kebutuhan yang sangat
dipentingkan maka logam-logam tersebut juga dinamakan sebagai logam-logam
esensial tubuh.Bila logam-logam esensial yang masuk ke dalam tubuh dalam
jumlah yang berlebihan, maka berubah fungsi menjadi racun.Contoh dari logam
18 2.5.1. Kromium (Cr)
Kromium ditemukan pada tahun 1797 oleh Vanquelin yang membuat
logam krom pada tahun berikutnya. Kromium adalah unsur kimia dalam tabel
periodik yang memiliki lambang Cr dan nomor atom 24. Kromium berwarna
abu-abu, berkilau, keras sehingga memerlukan proses pemolesan yang cukup tinggi.
Kromium merupakan unsur yang paling banyak di dalam kerak bumi dengan
konsentrasi rata-rata 100 ppm. Senyawa kromium terdapat di dalam lingkungan
karena erosi dari batuan yang mengandung kromium dan dapat terdistribusi
karena peristiwa letusan gunung berapi. Kromium digunakan untuk mengeraskan
baja, pembuatan baja tahan karat dan membentuk banyak alloy (logam campuran)
yang berguna. Krom digunakan dalam proses pelapisan logam untuk
menghasilkan permukaan logam yang keras, indah dan juga dapat mencegah
korosi. Kromium memberikan warna hijau emerald pada kaca (Svehla, 1985).
Kromium juga banyak digunakan oleh berbagai macam industri, salah
satunya adalah industri tekstil. Industri tekstil merupakan industri yang mengolah
serat menjadi bahan pakaian dengan kromium sebagai zat pengoksidasi pada
proses penyempurnaan tekstil. Karena itu pula limbah cair dari industri tekstil
mengandung kromium dengan konsentrasi tinggi.Limbah tersebut dapat
membahayakan lingkungan karena kromium, terutama kromium heksavalen,
merupakan jenis bahan berbahaya dan beracun (B3) (Wahyuadi, 2004).
Dalam perairan, kromium dalam keadaan heksavalen karena ion kromat
19
(III) bertahan dalam larutan.Dalam larutan, ion ini berwarna hijau dan dapat
terkompleks dengan berbagai jenis ligan dan struktur.
Logam kromium (Cr) adalah salah satu jenis polutan logam berat yang
bersifat toksik. Dalam tubuh, logam krom biasanya berada dalam keadaan sebagai
ion Cr3+. Krom dapat menyebabkan kanker paru-paru, kerusakan hati (liver) dan
ginjal. Jika kontak dengan kulit dapat menyebabkan iritasi dan jika tertelan dapat
menyebabkan sakit perut dan muntah.
Nilai baku mutu krom menurut KEP-51/MENLH/10/1995 tentang baku
mutu limbah cair kegiatan industri mengharuskan kadar maksimum sebesar 0,5
mg/L pada hasil pengolahan air limbah.
2.5.2. Kobalt (Co)
Kobalt adalah salah satu unsur kimia dalam tabel periodik yang memiliki
lambang Co dan nomor atom 27. Elemen bebasnya, diproduksi dari peleburan
reduktif dan logam ini berwarna abu-abu perak yang keras dan berkilau.
Ketersediaan unsur kimia kobalt tersedia di dalam banyak formulasi yang
mencakup kertas perak, potongan, bedak, tangkai dan kawat (Svehla, 1985).
Beberapa faktor yang mempengaruhi tingkat toksisitas kobalt adalah besar
dosis, lama dan cara paparan, selain itu juga ditentukan oleh faktor umur, jenis
kelamin, status gizi, gaya hidup dan status kesehatan orang yang terpapar. Kadar
kobalt lebih tinggi terdapat dalam organ hati, jantung serta rambut dibandingkan
organ lainnya. Pada manusia, kadar kobalt normal dalam urin adalah sebesar 98
20
kobalt normal dalam tubuh sebesar 1,1 mg; 43% berada di otot, 14% berada di
tulang dan sisanya terdapat pada jaringan lunak (Widowatiet al., 2008).
Nilai baku mutu kobalt menurut KEP-51/MENLH/10/1995 tentang baku
mutu limbah cair kegiatan industri mengharuskan kadar maksimum sebesar 0,4
mg/L pada hasil pengolahan air limbah.
2.5.3. Nikel (Ni)
Nikel adalah unsur kimia metalik dalam tabel periodik yang memiliki
simbol Ni dan nomor atom 28. Nikel mempunyai sifat tahan karat. Dalam keadaan
murni, nikel bersifat lembek, tetapi jika dipadukan dengan besi, krom dan logam
lainnya, dapat membentuk baja tahan karat yang keras. Perpaduan nikel, krom dan
besi menghasilkan baja tahan karat (stainless steel) yang banyak di aplikasikan
pada peralatan dapur (sendok, dan peralatan masak), ornamen-ornamen rumah dan
gedung, serta komponen industri. Nikel berwarna putih keperak-perakan dengan
pemolesan tingkat tinggi. Bersifat keras, mudah ditempa, sedikit ferromagnetis
dan merupakan konduktor yang cukup baik terhadap panas dan listrik. Nikel
tergolong dalam grup logam besi-kobalt yang dapat menghasilkan alloy yang
sangat berharga. Paparan nikel bisa terjadi melalui inhalasi, oral dan kontak kulit.
Reaksi nikel dan karbonmonoksida menghasilkan nikel karbonil (Ni[CO]4) yang
bisa terurai menjadi Ni dan CO pada pemanasan 2000oC (Widowatiet al., 2008).
Nilai baku mutu nikel menurut KEP-51/MENLH/10/1995 tentang baku
mutu limbah cair kegiatan industri mengharuskan kadar maksimum sebesar 0,2
mg/L pada hasil pengolahan air limbah.
21
Unsur tembaga di alam dapat ditemukan dalam bentuk logam bebas, akan
tetapi lebih banyak ditemukan dalam bentuk persenyawaan atau sebagai senyawa
padat dalam bentuk mineral. Secara kimia, senyawa-senyawa yang dibentuk oleh
logam Cu (tembaga) mempunyai bilangan valensi +1 dan +2. Berdasarkan
bilangan valensinya, yang dibawanya logam Cu dinamakan juga cuppro untuk
yang bervalensi +1 dan Cuppri untuk yang bervalensi +2. Kedua jenis ion Cu
tersebut dapat membentuk kompleks ion yang sangat stabil seperti Cu(NH3)6C12.
Logam Cu dalam beberapa bentuk persenyawaannya seperti CuO, CuCO3,
Cu(OH)2 dan Cu(CN)2 tidak dapat larut dalam air dingin atau panas, tetapi mereka
dapat larut dalam asam seperti H2SO4 dan dalam larutan basa NH4OH (Svehla,
1985).
Logam Cu merupakan jenis logam penghantar listrik terbaik setelah perak,
oleh karena itu banyak digunakan dalam bidang elektronika atau pelistrikan. Cu
juga dapat membentuk alloy dengan berbagai macam logam lainnya seperti
dengan seng, timah dan timbal (Cu-Zn-Sn-Pb) dalam bentuk kuningan yang
banyak digunakan dalam peralatan rumah tangga. Senyawa Cu banyak digunakan
dalam industri cat sebagai antifoling, industri insektisida dan fungisida, sebagai
katalis, baterai, elektroda, penarik sulfur dan sebagai pigmen serta pencegah
pertumbuhan lumut.
Secara ilmiah, Cu masuk ke perairan sebagai akibat dari peristiwa erosi
atau pengikisan batuan mineral dan melalui persenyawaan Cu di atmosfer yang
dibawa oleh air hujan, serta berasal dari buangan industri, pertambangan Cu dan
22
perairan. Dalam kondisi normal, keberadaan Cu dalam perairan ditemukan dalam
bentuk senyawa CuCO3, Cu(OH)2 dan lain-lain. Bila dalam badan perairan terjadi
peningkatan kelarutan Cu melalui ambang batas yang diperbolehkan, maka akan
terjadi peristiwa biomanifikasi terhadap biota-biota perairan.
Tembaga bersifat toksik bagi organisme. Bentuk tembaga yang paling
beracun adalah debu-debu Cu yang dapat mengakibatkan kematian pada dosis 3,5
mg/kg. Efek keracunan pada manusia yang ditimbulkan akibat terpapar oleh debu
atau uap logam Cu adalah terjadinya gangguan jalur pernafasan atas atau terjadi
kerusakan atropik pada selaput lendir yang berhubungan dengan hidung (Palar,
2004).
Nilai baku mutu tembaga menurut KEP-51/MENLH/10/1995 tentang baku
mutu limbah cair kegiatan industri mengharuskan kadar maksimum sebesar 2
mg/L pada hasil pengolahan air limbah.
2.5.5. Seng (Zn)
Seng dengan nama lainnya zink dilambangkan dengan Zn. Sebagai salah
satu unsur logam berat Zn mempunyai nomor atom 30 dan memiliki berat atom
65,39, logam ini cukup mudah ditempa dan dilihat pada 110-150oC. Zn melebur
pada 410oC dan mendidih pada 906oC. Zn dalam pemanasan tinggi akan
menimbulkan endapan seperti pasir. Zn diperlukan tubuh untuk proses
metabolisme, tetapi dalam kadar tinggi dapat bersifat menjadi racun (Al-Harisi,
2008).
Seng adalah komponen alam yang terdapat di kerak bumi, Zn adalah
23
bila terkena uap udara, dan terbakar bila terkena udara dengan api hijau terang. Zn
dapat bereaksi dengan asam, basa dan senyawa non logam. Zn di alam tidak
berada dalam keadaan bebas tetapi dalam bentuk terikat dengan unsur lain berupa
mineral. Mineral yang mengandung Zn di alam bebas antara lain kalamin,
franklinite, smitkosonit, willenit dan zinkit (Widowati et al., 2008).
Nilai baku mutu seng menurut KEP-51/MENLH/10/1995 tentang baku
mutu limbah cair kegiatan industri mengharuskan kadar maksimum sebesar 5
mg/L pada hasil pengolahan air limbah.
2.5.6. Timbal (Pb)
Timbal atau dalam keseharian lebih dikenal dengan timah hitam
merupakan logam yang lunak dan tahan terhadap korosi atau karat sehingga
logam timbal sering digunakan sebagai bahan coating. Pb dan persenyawaannya
dapat berada dalam badan perairan secara alamiah dan sebagai dampak terhadap
aktivitas manusia. Secara ilmiah, Pb dapat masuk ke badan perairan melalui
pengkristalan Pb di udara dengan bantuan air hujan. Pb yang masuk ke dalam
badan perairan sebagai dampak aktivitas manusia diantaranya adalah air buangan
limbah dari industri yang berkaitan dengan Pb, misalnya dari pertambangan bijih
timah hitam dan buangan sisa industri baterai.
Senyawa Pb yang ada dalam badan perairan dapat ditemukan dalam
bentuk ion-ion divalen atau ion-ion tetravalen (Pb2+, Pb4+). Ion Pb tetravalen
mempunyai daya racun yang lebih tinggi bila dibandingkan dengan ion Pb
divalen. Timbal bersifat toksik bagi semua organisme hidup, bahkan juga sangat
24
188 mg/L dapat membunuh ikan-ikan. Keracunan timbal bersifat akut dan kronis.
Hal itu disebabkan senyawa-senyawa Pb dapat memberikan racun terhadap
banyak fungsi organ sistem syaraf yang terdapat dalam tubuh (Palar, 2004).
Nilai baku mutu timbal menurut KEP-51/MENLH/10/1995 tentang baku
mutu limbah cair kegiatan industri mengharuskan kadar maksimum sebesar 0,1
mg/L pada hasil pengolahan air limbah.
2.6.Iradiasi Sinar Gamma (γ)
Iradiasi adalah proses radiasi energi pada suatu sasaran. Menurut Maha
(1985), iradiasi merupakan suatu teknik yang digunakan untuk pemakaian energi
radiasi secara sengaja dan terarah. Sedangkan menurut Winarno et al (1980)
iradiasi merupakan teknik penggunaan energi untuk penyinaran bahan dengan
menggunakan sumber iradiasi buatan.
Sinar gamma (γ) adalah radiasi elektromagnetik yang diproduksi oleh
radioaktivitas atau subatomik lainnya seperti penghancuran elektron-positron.
Sinar gamma memiliki panjang gelombang yang paling kecil dan energi terbesar
dibandingkan spektrum gelombang elektromagentik yang lain (sekitar 10.000 kali
lebih besar dibandingkan dengan energi gelombang pada spektrum sinar tampak).
Selain itu, sinar gamma memiliki daya ionisasi yang paling rendah namun
jangkauan tembus yang paling besar dibandingkan sinar beta dan alfa. Sinar
gamma bisa mengionisasi jaringan secara langsung atau menyebabkan yang
disebut dengan “secondary ionizations.” yakni ionisasi yang disebabkan ketika
25
dengan partikel beta) yang kemudian partikel berenergi tersebut akan berinteraksi
dengan jaringan untuk membentuk ion. Daya mengionisasi sinar gamma lebih
kecil daripada sinar alfa atau beta.Akan tetapi, karena daya tembusnya yang besar,
maka dapat menyebabkan kerusakan yang mirip dengan kerusakan yang
disebabkan oleh sinar-X, seperti terbakar, kanker, dan mutasi genetika. Manfaat
dari iradiasi sinar gamma dalam penelitian ini adalah energi dan penetrasinya
besar sehingga dapat menghasilkan radikal bebas yang memicu terjadinya reaksi
kimia sehingga dapat membentuk ikatan silang yang terjadi antara dua
polimer/monomer membentuk kopolimer (Khopkar, 2003).
Iradiasi gamma maupun berkas elekton dapat dimanfaatkan untuk proses
polimerisasi dengan mekanisme pengikatan silang rantai polimer. Proses
degradasi yaitu proses pemutusan rantai polimer sehingga diperoleh rantai yang
lebih pendek dan proses pencangkokan dengan menambahkan gugus fungsi aktif
pada rantai panjang polimer. Keunggulan dari pemakaian teknik iradiasi untuk
memodifikasi suatu bahan yaitu hasil prosesnya bersih karena tidak mengandung
residu dari bahan kimia misalnya katalisator, prosesnya mudah karena dilakukan
pada suhu kamar dan mudah dikontrol, Efisien karena mempunyai kedapatan
yang relatif tinggi (Maha, 1985).
2.6.1. Interaksi Sinar Gamma dengan Materi
Sinar gamma merupakan radiasi elektromagnetik yang dipancarkan dalam
bentuk partikel-partikel berenergi atau disebut foton (Donnel dan Sangser, 1969).
26
Mekanisme interaksi sinar gamma dengan materinya dibagi menjadi tiga macam
(Spinks dan Woods, 1976) :
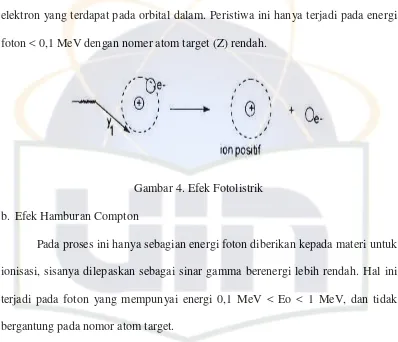
a. Efek fotolistrik
Dalam peristiwa ini seluruh energi foton digunakan untuk mengeksitasi
elektron yang terdapat pada orbital dalam. Peristiwa ini hanya terjadi pada energi
foton < 0,1 MeV dengan nomer atom target (Z) rendah.
Gambar 4. Efek Fotolistrik
b. Efek Hamburan Compton
Pada proses ini hanya sebagian energi foton diberikan kepada materi untuk
ionisasi, sisanya dilepaskan sebagai sinar gamma berenergi lebih rendah. Hal ini
terjadi pada foton yang mempunyai energi 0,1 MeV < Eo < 1 MeV, dan tidak
[image:42.595.93.491.215.557.2]bergantung pada nomor atom target.
Gambar 5. Efek Hamburan Compton
27
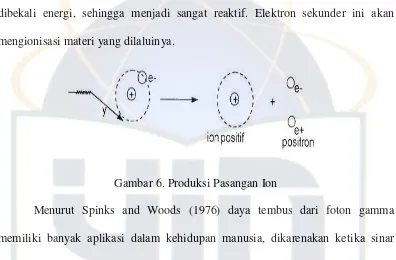
Proses ini terjadi bila seluruh energi foton diberikan dan menghasilkan
pasangan elektron–positron. Kedua spesi ini saling menghapuskan dan
membentuk sinar gamma dengan energi 0,5 MeV. Proses ini dapat terjadi pada
foton yang mempunyai energi > 1,02 MeV dengan nomor atom target tinggi.
Elektron yang terbentuk dari interaksi sinar gama disebut elektron sekunder yang
dibekali energi, sehingga menjadi sangat reaktif. Elektron sekunder ini akan
[image:43.595.96.492.245.505.2]mengionisasi materi yang dilaluinya.
Gambar 6. Produksi Pasangan Ion
Menurut Spinks and Woods (1976) daya tembus dari foton gamma
memiliki banyak aplikasi dalam kehidupan manusia, dikarenakan ketika sinar
gamma menembus beberapa bahan, sinar gamma tidak akan membuatnya menjadi
radioaktif.
2.6.2. Sumber Radiasi
Sumber radiasi yang banyak digunakan adalah sumber radiasi gamma
berupa isotop radioaktif dan sumber radiasi elektron yang berupa mesin berkas
elektron. Isotop radioaktif yang banyak digunakan adalah Cobalt-60 dan
Cesium-137. Sebagai sumber radiasi dapat diambil dari radiasi alam (peluruhan dengan
inti radioaktif sinar gamma () dengan radioisotop60Co dan 137Cs atau radiasi
28 2.6.3. Dosis Radiasi
Dosis radiasi adalah banyaknya energi radiasi yang diserap oleh materi yang
dilaluinya. Ada tiga macam besaran dosis radiasi, yaitu:
a. Dosis paparan (exposure dose), yakni kemampuan radiasi tertentu untuk
menimbulkan ionisasi pada medium yang tertentu pula. Satuan besaran dosis
ini adalah Roentgen (R).
1 R = 1 sme/gram
Atau dalam SI:
1 R = 2,58 x 10-4 Coulomb
b. Dosis serap (absorbed dose), yaitu jumlah energi radiasi (semua jenis radiasi
pengion) yang diserap oleh satu satuan massa/berat dari bahan atau medium
yang dilaluinya. Satuan dari dosis serap adalah rad (radiation absorbed dose).
1 rad = 100 erg/gram
Atau dalam SI, satuan dosis serap adalah Gray (Gy),
1 Gray = 1 joule/kg = 104 erg/gram = 100 rad
c. Dosis setara atau dosis ekivalen (eqivalent dose), yaitu menyatakan jumlah
energi radiasi yang diserap oleh satuan massa/berat bahan atau medium yang
dilaluinya dan sekaligus dikaitkan dengan efek biologisnya. Satuan yang
lazim dipakai adalah rem (rontgen equivalent man), atau dalam SI digunakan
satuan Sievert (Sv).
29 2.6.4. Efek Radiasi terhadap Polimer
Radiasi pada polimer dapat menyebabkan terjadinya degradasi polimer
atau dapat pula terbentuknya ikatan silang pada polimer. Perubahan kimia dan
fisika. Perubahan ini dapat diamati pada timbulnya warna, pembentukan gas,
berkurangnya ikatan tidak jenuh serta terbentuknya ikatan tak jenuh yang baru.
a. Crosslinking
Reaksi crosslinking merupakan proses kimia yang menghubungkan
rantai polimer yang satu dengan yang lainnya melalui ikatan kovalen
maupun ionik. Senyawa yang termasuk reagen crosslinking yaitu berupa
molekul yang memiliki dua atau lebih sisi reaktif untuk menyerang gugus
fungsi spesifik dan molekul lain. Polimer mempunyai ikatan crosslinking
yang apabila diregangkan, ikatan crosslinking mencegah rantai untuk
terpisah.
b. Degradasi
Degradasi polimer pada dasarnya berkaitan dengan terjadinya
perubahan sifat karena ikatan rantai utama makromolekul. Pada polimer
linier, reaksi tersebut mengurangi masa molekul atau panjang rantainya.
Sesuai dengan penyebabnya, kerusakan atau degradasi polimer ada
beberapa macam. Kerusakan termal (panas), foto degradasi (cahaya),
radiasi(energi tinggi), kimia, biologi (biodegradasi) dan mekanis.Dalam
artian peningkatanberat ukuran molekul ikat silang dapat dianggap lawan
30
c. Pembentukan gas
Radiasi terhadap polimer menghasilkan molekul gas dengan berat
molekul rendah yang berasal dari pemutusan ikatan pada rantai utama atau
pada rantai samping polimer.
d. Perubahan dalam ketidakjenuhan (pembentukan berbagai ikatan rangkap
antara atom karbon)
Pada iradiasi PVC menyebabkan terbentuknya dehydrochlorination
sehingga akan dilepaskan HCl dan pembentukan polien dengan double
bond.
e. Perubahan warna (physical change)
Terbentuknya ikatan rangkap pada iradiasi terhadap PVC
menyebabkan terjadinya peningkatan intensitas warna menjadi kuning
hingga merah tergantung pada absorben.
f. Oksidasi
Dalam beberapa hal oksigen sangat berpengaruh dalam radiolisis
polimer menyebabkan oksidasi.Oksidasi dapat terjadi karena oksidasi
berdifusi ke dalam polimer selama atau sesudah iradiasi atau oksigen yang
terlah ada terlarut dalam polimer (Umam et al., 2007).
2.7.Spektrofotometer Serapan Atom (SSA)
Spektrofotometer Serapan Atom (SSA) adalah suatu teknik yang sering
digunakan untuk menentukan konsentrasi logam tertentu dalam suatu sampel yang
31
dari 70 jenis logam yang berbeda dalam suatu spesi larutan. Spektrofotometri
serapan atom dipergunakan untuk mengidentifikasi dan menentukan keberadaan
ion logam baik secara kualitatif maupun kuantitatif dalam semua jenis materi dan
larutan. Pengukuran dalam spektrofotometri serapan atom ini didasarkan pada
radiasi yang diserap oleh atom yang tidak tereksitasi dalam bentuk uap
(Hermanto, 2009)
Teknik analisa dari spektrofotometer serapan atom pertama kali
diperkenalkan oleh Welsh pada tahun 1955. SSA merupakan metode yang populer
untuk analisa logam karena disamping sederhana metode ini juga selektif dan
sangat sensitif.Teknik analisa SSA berdasarkan pada penguraian molekul menjadi
atom dengan energi dari arus listrik (Underwood dan Day, 1986).
Metode SSA berprinsip pada absorpsi cahaya oleh atom.Atom-atom
menyerap cahaya tersebut pada panjang gelombang tertentu, tergantung pada sifat
unsurnya. Misalkan natrium menyerap pada 589 nm, uranium pada 358,5 nm,
sedangkan kalium pada 766,5 nm. Cahaya pada panjang gelombang ini
mempunyai cukup energi untuk mengubah tingkat elektronik suatu atom.Transisi
elektronik suatu unsur bersifat spesifik. Dengan mengabsorpsi energi, berarti
memperoleh lebih banyak energi, sehingga suatu atom pada keadaan dasar akan
naik tingkat energinya ke tingkat eksitasi dan tingkat-tingkat eksitasinya pun
bermacam-macam. Misalkan unsur Na dengan nomor atom 11 mempunyai
konfigurasi elektron 1s2 2s2 sp6 3s1, tingkat dasar untuk elektron valensi 3s,
artinya tidak memiliki kelebihan energi. Elektron ini dapat tereksitasi ke tingkat
masing-32
masing sesuai dengan panjang gelombang 589 nm dan 330 nm. Kita dapat
memilih di antara panjang gelombang ini yang menghasilkan garis spektrum yang
tajam dan dengan intensitas maksimum.Inilah yang dikenal dengan garis
resonansi.Spektrum atomik untuk masing-masing unsur terdiri atas garis-garis
resonansi. Garis-garis lain yang bukan garis resonansi dapat berupa spektrum
yang berasosiasi dengan tingkat energi molekul, biasanya berupa pita-pita lebar
ataupun garis tidak berasal dari eksitasi tingkat dasar yang disebabkan proses
atomisasinya. Berikut ini merupakan bagan alat SSA (Underwood dan Day,
[image:48.595.100.488.293.532.2]1986):
Gambar 7.Prinsip kerja Alat Spektrofotometer Serapan Atom (Sumber : Underwood dan Day, 1986)
Prinsip kerja alat spektrofotometri serapan atom adalah nyala api yang
mengandung atom-atom netral dari unsur yang dianalisis yang berada pada
keadaan dasarnya disinari oleh sinar yang dipancarkan oleh sumber sinar.
Sebagian intensitas sinar dari sumber sinar dengan panjang gelombang tersebut
diteruskan menuju monokromator lalu ke detektor, kemudian ke amplifier dan
rekorder .
Spektra absorpsinya lebih sederhana dibandingkan dengan spektra
33
vibrasi-rotasi. Jadi spektra absorpsi atom terdiri dari garis-garis yang jauh lebih
tajam daripada pita-pita yang diamati dalam spektroskopi molekuler.Absorpsi
atom telah dikenal bertahun-tahun yang lalu. Misalnya garis-garis gelap pada
frekuensi tertentu dalam spektrum matahari dan tanpa garis itu akan kontinu, hal
tersebut pertama kali diperhatikan oleh Wollaston dalam tahun 1802. Garis-garis
tersebut ditemukan ulang dan dipelajari lebih mendalam oleh Joseph von
Fraunhofer dan diberi namagaris-garis Fraunhofer.Pentingnya garis-garis ini baru
dipahami pada tahun 1859 ketika Kirchhoff menerangkan asal-usulnya setelah
mengamati gejala yang serupa di laboratorium.Permukaan matahari yang tampak
jauh lebih panas daripada selimut gas yang mengitarinya dan atom-atom dalam
atmosfer itu menyerap frekuensi-frekuensi khas dari dalam kontinum pancaran
dari permukaan yang lebih panas.Kirchhoff dan yang lain-lainnya, terutama
Bunsen mengidentifikasi sejumlah unsur dalam atmosfer matahari dengan
membandingkan frekuensi garis-garis Fraunhofer dengan frekuensi garis dari
unsur-unsur yang dikenal di laboratorium (Underwood dan Day, 1986).
2.7.1. Instrumentasi Spektrofotometer Serapan Atom
Spektrofotometer Serapan Atom memiliki lima bagian utama, yaitu
sumber radiasi atau sistem emisi untuk menghasilkan sinar yang diperlukan,
sistem pengatoman atau sistem absorpsi untuk menghasilkan atom-atom bebas
dan menyediakan media absorpsi, monokromator atau sistem seleksi untuk
menyeleksi atau memisahkan spektra sinar yang dikehendaki, detektor atau
34
rekorder untuk menampilkan bentuk sinyal listrik menjadi satuan yang dapat
dibaca (Hendayana, 1994).
a. Sumber radiasi.
Sumber radiasi berfungsi memancarkan spektrum atom dari unsur yang
akan ditentukan. Sumber radiasi yang biasa digunakan ada dua jenis, yaitu :
1) Lampu HCL (Hollow Cathode Lamps)
Lampu ini merupakan sumber radiasi dengan spektra yang tajam dan
mengemisikan gelombang monokromatis. Lampu ini terdiri dari katoda cekung
yang silindris yang terbuat dari unsur yang akan ditentukan atau campurannya
(alloy) dan anoda yang terbuat dari tungsten. Elektroda-elektroda ini berada dalam
tabung gelas dengan jendela quartz karena panjang gelombang emisinya sering
berada pada daerah ultraviolet.Tabung gelas tersebut dibuat bertekanan rendah
dan diisi dengan gas inert Ar dan Ne. Beda voltase yang tinggi dikenakan pada
kedua elektroda tersebut sehingga atom gas pada anoda terionisasi.Ion positif ini
dipercepat kearah katoda dan ketoka menabrak katoda menyebabkan beberapa
logam pada katoda terpental dan berubah menjadi uap.Atom yang teruapkan ini,
karena tabrakan dengan ion gas yang berenergi tinggi, tereksitasi ke tingkat
energy electron yang lebih tinggi dan ketika kembali ke keadaan dasar, atom-atom
tersebut memancarkan sinar dengan λ yang karakteristik untuk katoda tersebut.
Berkas sinar yang diemisikan bergerak melalui nyala berkas dengan λ tertentu
yang dipilih dengan monokromator akan diserap oleh uap atau yang ada dalam
35
sinar yang berasal darii transisi electron ke tingkat eksitasi terendah. Sinar ini
disebut garis resonansi (Hermanto, 2009)
Gambar 8.Hollow Cathode Lamps
2). Electrodelles Discharge lamps
EDLs dibentuk dari tabung yang ditutup kuarsa sedikit torr dari gas inert
seperti argon dan kuantitas kecil dari logam (atau garamnya). Lampu tidak
mengandung elektroda namun malah diberi energi dengan radiasi microwave atau
frekuensi radio intesitas tinggi. Lampu ini mempunyai prinsip kerja hampir sama
dengan HCL, tetapi mempunyai output radiasi lebih tinggi dan biasanya
digunakan untuk analisis unsur As dan Se, karena lampu HCL untuk
[image:51.595.98.492.167.618.2]unsur-unsur tersebut mempunyai sinyak yang lemah dan tidak stabil (Hermanto, 2009).
Gambar 9. Electrodelles Discharge Lamp
b. Nyala
Nyala digunakan untuk mengubah sampel yang berupa apadatan atau
cairan menjadi bentuk uap atomnya dan juga berfungsi untuk atomisasi.Nyala
36
tereksitasi dipengaruhi oleh komposisi nyala.Komposisi nyala asetilen-udara
sangat baik digunakan untuk lebih dari 30 unsur sedangkan komposisi nyala
propane-udara disukai untuk logam yang mudah menjadi uap atomic (Hendayana,
1994).
c. Monokromator
Dalam Spektrofotometer Serapan Atom (SSA) fungsi monokromator
adalah untuk memisahkan garis resonansi dari semua garis yang tidak diserap
yang dipancarkan oleh sumber radiasi. Dalam kebanyakan instrument komersial
digunakan kisi difraksi karena sebaran yang dilakukan oleh kisi seragam daripada
yang dilakukan oleh prisma dan akibatnya instrument kisi dapat memelihara daya
pisah yang lebih tinggi sepanjang jangka gelombang yang lebih besar
(Hendayana, 1994).
a. Detektor
Detektor berfungsi sebagai alat penguat dari spektrum cahaya yang telah
melewati sampel.Syarat yang harus dipenuhi oleh sebuah detektor adalah
memiliki respon yang linear terhadap energi sinar dalam kawasan spektrum yang
bersangkutan. Pada spektrofotometer serapan atom detektor yang lazim dipakai
adalah detektor tabung pengadaan (Photon Multiplier Tube Detector, PMTD)
e. Rekorder
Recorder berfungsi untuk menampilkan bentuk sinyal listrik menjadi
satuan yang dapat dibaca.Tampilan yang terdapat pada layar menunjukkan data
37 BAB III
METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian ini dilakukan selama sembilan bulan pada bulan Februari
sampai dengan Oktober 2012. Tempat pelaksanaan penelitian ini adalah di Pusat
Aplikasi Teknologi Isotop dan Radiasi (PATIR) BATAN Pasar Jumat, Jakarta
Selatan dan di Pusat Laboratorium Terpadu (PLT) UIN Syarif Hidayatullah
Jakarta.
3.2. Alat dan Bahan 3.2.1. Alat
Alat yang digunakan dalam penelitian ini adalah timbangan analitik
(Mettler Toledo), kawat kassa, plastik polietilen, oven, pH meter Jenway 3503,
shaker incubator(Konterman-Jerman), iradiator sinar γCo-60 (IRKA PATIR
BATAN) dan Spektrofotometer Serapan Atom (SSA) (AAnalyst Perkin Elmer)
dan peralatan gelas lainnya.
3.2.2. Bahan
Bahan yang digunakan dalam penelitian ini adalah kitosan, akrilamida,
asam asetat glasial, HCl, CH3COONa,(K2Cr2O7,Co(NO3)2.5H2O, NiCl2.6H2O,
38 3.3. Pembuatan Hidrogel Poliakrilamida-co-Kitosan
3 gram kitosan dilarutkan dengan 1,5 gram asam asetat glasial lalu
ditambahkan dengan aquadest 20 mL. Kemudian ditambahkan dengan 7,5 gram
akrilamida dan ditambahkan aquadest kembali hingga 100 gram.Setelah itu
dikemas dalam plastikdan diiradiasi dengan sinar γ Co-60 pada dosis 15 kGy.Di
potong kecil dan di keringkan dengan suhu 40-60oC selama 24 jam.
3.4. Uji Sifat Fisika
3.4.1. Penentuan fraksi gel dari hidrogel
Hidrogel hasil radiasi dengan bobot 100 mg dikeringkan dalam oven pada
suhu sekitar 40-60oC selama 24 jam, lalu hidrogel ditimbang hingga bobot
konstan (Wo). Hidrogel kering dimasukkan kedalam wadah kassa steinless
kemudian dicuci dalam wadah berisi aquadest sambil dikocok dalam shaker
incubator dengan kecepatan 100 rpm, pada temperatur ruang, selama 24 jam
untuk menghilangkan zat-zat yang tidak bereaksi. Kemudian hidrogel dikeringkan
dalam oven pada suhu 60oC dan ditimbang sampai bobot konstan (W1). Fraksi gel
dihitung dengan persamaan sebagai berikut: <