SINTESIS NANOPARTIKEL PERAK (NPAg) DENGAN
METODE YANG RAMAH LINGKUNGAN DAN KAJIAN
AKTIFITASNYA DALAM MENGHAMBAT PERTUMBUHAN
BAKTERI GRAM POSITIF DAN BAKTERI GRAM NEGATIF
ARA NUGRAHAYU NALAWATI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Sintesis Nanopartikel Perak (NPAg) denganMetode yang Ramah Lingkungan dan Kajian Aktifitasnya dalam Menghambat Bakteri Gram Positif dan Bakteri Gram Negatif adalah benar karya saya denganarahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Desember 2015 Ara Nugrahayu Nalawati NRP F251114031
RINGKASAN
ARA NUGRAHAYU NALAWATI. Sintesis Nanopartikel Perak (NPAg) denganMetode yang Ramah Lingkungan dan Kajian Aktifitasnya dalam Menghambat Bakteri Gram Positif dan Bakteri Gram Negatif. Dibimbing oleh RIZAL SYARIEF dan NUGRAHA EDHI SUYATMA.
Nanopartikel perak (NPAg) merupakan partikel logam perak yang memiliki ukuran kurang dari 100 nm. NPAg memiliki banyak keunggulan, antara lain memiliki aktifitas dengan spektrum yang luas baik terhadap bakteri (Sintubin et al., 2011), kapang (Vivek et al., 2011), dan bahkan virus (Elechiguerra et al., 2005). Kemampuan antimikroba perak, antara lain disebabkan karena kemampuannya merusak dinding sel bakteri, menganggu metabolisme sel, dan menghambat sintesis sel mikroba. Metabolisme sel dapat dihambat karena adanya interaksi antara perak dengan makromolekul di dalam sel, seperti protein dan DNA. Sintesis NPAg dari ekstrak tumbuhan (green synthesis) bersifat ramah lingkungan karena mampu mengurangi penggunaan bahan kimia berbahaya. Potensi pengembangan NPAg di berbagai bidang sangat terbuka luas, antara lain sebagai sensor dan antimikroba. Pada bidang pangan, NPAg dapat diaplikasikan pada pengemas makanan sebagai film kemasan antimikroba. NPAg pada kemasan dapat memperpanjang daya tahan makanan serta mempertahankan rasa dan bau. Tujuan dari penelitian ini adalah untuk mensintesis NPAg dengan memanfaatkan ekstrak biji jarak pagar (Jatropha curcas L.) sebagai agen dan penyalut dengan bahan awal larutan perak nitrat.
Sintesis NPAg telah dilakukan dengan mencampur 50 ml ekstrak biji jarak pagar dan larutan AgNO3 10-2 M dengan variasi perbandingan 1:5 (E1P5); 1:10 (E1P10); dan 1:15 (E1P15) (vol.ekstrak biji jarak pagar : vol. AgNO3 10-2 M). Karakterisasi NPAg dilakukan menggunakan analisis spektrofotometer UV-vis, Fourier Transform Infra Red (FTIR), Scanning Electron Microscopy (SEM), dan Particle Size Analyzer (PSA). Sedangkan, uji aktivitas antibakteri dilakukan dengan menggunakan metode difusi sumur.
Terbentuknya NPAg dapat diamati secara visual dengan adanya perubahan warna larutan dari kuning ke coklat kemerahan. Selain itu, untuk memastikan terbentuknya NPAg dapat diamati menggunakan spektrofotometer UV-vis dimana NPAg memiliki λmax pada kisaran 400-500 nm. Berdasarkan hasil analisis PSA menunjukkan bahwa ukuran partikel sampel E1P5, E1P10, dan E1P15 secara berturut-turut, yaitu 33,8; 37,7; dan 116,3 nm. Formula terbaik dengan ukuran partikel terkecil yaitu terdapat pada sampel E1P5 (NPAg S). Selanjutnya, sampel terbaik diuji aktivitas antibakterinya dan dibandingkan dengan nanopartikel perak komersil (NPAg K). Hasil pengujian menunjukkan bahwa aktivitas antibakteri dari nanopartikel perak hasil sintesis (NPAg S) lebih kuat dibandingkan nanopartikel perak produk komersil (NPAg K) dalam menghambat pertumbuhan bakteri gram positif (Staphylococcus aureus dan Bacillus cereus) maupun gram negatif (Eschericia coli dan Salmonella typhii).
SUMMARY
ARA NUGRAHAYU NALAWATI. Synthesis of Silver Nanoparticles (NPAg) with Eco-Friendly Methods and TheirActivity in Inhibits Gram-Positive Bacteria and Gram-Negative Bacteria. Supervised by RIZAL SYARIEFandNUGRAHA EDHI SUYATMA.
Silver nanoparticles (NPAg) is a silver metal particles having a size less than 100 nm. NPAg has many advantages, such as having a broad spectrum of activity against bacteria (Sintubin et al., 2011), molds (Vivek et al., 2011), and also viruses (Elechiguerra et al., 2005). NPAg has antimicrobial activity due to their abilities in damaging bacterial cell wall, disrupting cellular metabolism, and inhibiting microbial cells replication. Cell metabolism can be inhibited because of the interaction between the silver with macromolecules in cells, such as proteins and DNA.The synthesis of NPAg by using plant extracts (green synthesis) is environmentally friendly because it does not use hazardous chemicals. NPAg development is prospective because it is applicable in various fields, e.g. sensors and antimicrobial. In the field of food, NPAg can be incorporated or embedded into packaging materials to produce antimicrobial packaging. NPAg on the packaging can extend the shelf life of food while maintaining the taste and smell. The aim of this study was to synthesize NPAg by utilizing the seed extract of Jatropha (Jatropha curcas L.) as reducing and capping agent with silver nitrate solution as starting materials.
NPAg synthesis has been carried out by mixing 50 ml of Jatropha seeds extract and the solution of AgNO310-2 M with the ratio as follows: 1: 5 (E1P5); 1:10 (E1P10); and 1:15 (E1P15) (vol. Jatropha seeds extract: vol. AgNO3 10-2 M). The characterization of NPAg was performed using spectrophotometer UV-vis, Fourier Transform Infra Red (FTIR), Scanning Electron Microscopy (SEM), and Particle Size Analyzer (PSA). Additionally, the antibacterial activity test was done by using the well diffusion method.
The formation of NPAg can be observed visually by the color changes of the solution from yellow to reddish brown. To ensure the formation of NPAg was occurred, it was observed by using a UV-vis where NPAg had a λmax in the range of 400-500 nm. The analysis of PSA showed that the particle size of the sample E1P5, E1P10, and E1P15 is 33,8; 37,7; and 116,3 nm, respectively. The best formula with the smallest particle size was E1P5 (NPAg S). Subsequently, the antibacterial activity has been tested and compared with the commercial silver nanoparticles (NPAg K). The antibacterial test showed that the antibacterial activity of NPAg S was stronger than NPAg K in inhibiting the growth of both gram-positive(Staphylococcus aureus and Bacillus cereus) and gram-negative (Eschericia coli and Salmonella typhii) bacteria.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Ilmu Pangan
SINTESIS NANOPARTIKEL PERAK (NPAg) DENGAN
METODE YANG RAMAH LINGKUNGAN DAN KAJIAN
AKTIFITASNYA DALAM MENGHAMBAT PERTUMBUHAN
BAKTERI GRAM POSITIF DAN BAKTERI GRAM NEGATIF
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
PRAKATA
Puji dan syukur saya panjatkan kepada Allah SWT karena atas rahmat dan karuniaNya saya mampu menyelesaikan penelitian dan penulisan karya ilmiah
yang berjudul “Sintesis Nanopartikel Perak (NPAg) denganMetode yang Ramah Lingkungan dan Kajian Aktifitasnya dalam Menghambat Bakteri Gram Positif dan Bakteri Gram Negatif”. Saya menyadari bahwa tanpa bantuan dan bimbingan dari berbagai pihak, sangatlah sulit bagi saya untuk menyelesaikan karya ilmiah ini. Oleh karena itu, penulis ucapkan terima kasih kepada:
1. Prof. Dr. Ir. Rizal Syarief, DESS dan Dr. Nugraha Edhi Suyatma, STP, DEA selaku dosen pembimbing yang telah menyediakan waktu, tenaga, dan pikiran untuk mengarahkan saya dalam penyusunan tesis ini;
2. Prof. Dr. Ir. Ratih Dewanti-Hariyadi, MS selaku ketua program studi Ilmu Pangan dan seluruh dosen Ilmu Pangan Sekolah Pascasarjana Institut Pertanian Bogor yang telah memberikan saya wawasan sebagai mahasiswa ilmu pangan;
3. Kedua orang tua saya Ayahanda Drs. Awandi, MPd dan Ibunda Dra. Sry Rahaju serta adikku yang terkasih Abram Atmaja, SP yang senantiasa memberikan bantuan doa, kasih sayang, tenaga, motivasi, dan semangatnya; 4. Suamiku tersayang Faris Fathurrohman, STP dan Putraku tercinta Daniswara
Yahya Fathurrohman atas segala doa, cinta, semangat, dan dukungannya yang membuat saya bersemangat untuk segera menyelesaikan tesis ini;
5. Semua rekan-rekan Ilmu Pangan angkatan 2011 dan 2012 yang bersama-sama berjuang dalam menyelesaikan tesis;
6. Seluruh pihak yang telah membantu dalam menyelesaikan tesis ini.
Penulis menyadari bahwa tesis ini masih jauh dari kesempurnaan. Semoga tulisan ini bisa memberikan manfaat dan informasi bagi para pembaca.
Bogor, Desember 2015
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
1 PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Hipotesis 3
2 TINJAUAN PUSTAKA 3
Tanaman Jarak Pagar (Jatropha curcas L.) 3
Biji Jarak Pagar (Jatropha curcas L.) 4
Nanopartikel Perak 6
Sintesis Nanopartikel Perak 7
Senyawa Antimikroba 8
Bakteri Uji 9
3 METODE 10
Bahan 10
Alat 10
Waktu dan Lokasi 10
Prosedur Percobaan 10
Prosedur Analisis Data 13
4 HASIL DAN PEMBAHASAN 13
5 SIMPULAN DAN SARAN 20
Simpulan 20
Saran 20
DAFTAR PUSTAKA 21
LAMPIRAN 24
DAFTAR TABEL
2.1 Klasifikasi tanaman jarak pagar (Jatropha curcas L.) 3
DAFTAR GAMBAR
2.1 Bagian tanaman jarak pagar (Jatropha curcas L): daun jarak dan buah jarak 42.2 Bunga jarak; biji jarak (Jatropha curcas L.) 5
2.3 Struktur kimia curcin (C19H22O2) 6
3.1 Diagram alir persiapan kultur uji 12
3.2 Diagram alir metode sumur 13
4.1 Hasil pengujian spektrum NPAg spektro UV-vis dengan variasi rasio ekstrak jarak dan AgNO3 14
4.2 Hasil pengujian pH dengan variasi rasio ekstrak jarak dan AgNO3 15
4.3 Hasil spektrum NPAg dari ekstrak biji jarak dengan spektro-IR 15
4.4 Hasil SEM pada NPAg perbesaran 10000x 17
4.5 Distribusi ukuran nanopartikel perak pada sampel 18
4.6 Grafik uji aktivitas antibakteri untuk sampel nanopartikel perak (NPAg) 19
4.7 Visualisasi antibakteri untuk dua sampel (NPAg S dan NPAg K) pada konsentrasi 1 % (a) dan konsentrasi 2 % (b) 20
DAFTAR LAMPIRAN
1 Hasil pengukuran absorbansi 262 Hasil pengukuran pH 26
3 Hasil karakterisasi koloid nanopartikel perak (NPAg) menggunakan Particle Size Analyzer (PSA) pada sampel E1P5 27
4 Hasil karakterisasi koloid nanopartikel perak (NPAg) menggunakan Particle Size Analyzer (PSA) pada sampel E1P10 28
5 Hasil karakterisasi koloid nanopartikel perak (NPAg) menggunakan Particle Size Analyzer (PSA) pada sampel E1P15 29
6 Hasil karakterisasi koloid nanopartikel perak (NPAg) menggunakan Particle Size Analyzer (PSA) pada sampel NPAg K 30
1
1 PENDAHULUAN
Latar Belakang
Nanoteknologi merupakan teknik untuk mendesain dan menyusun material pada skala nano yang memungkinkan untuk memanfaatkan dan merekayasa struktur materi tiap atomnya (Thomas, 2006; Yokoyama, 2007). Nanopartikel telah banyak dikaji untuk berbagai aplikasi teknologi dan dalam penelitian ilmu material, kimia, fisika, biologi, dan ilmu lingkungan (Huang et al., 2006). Nanopartikel merupakan suatu partikel dengan ukuran nanometer, yaitu berkisar 1 sampai 100 nm (Hosokawa et al., 2007). Nanopartikel dapat berupa polimer, logam, oksida logam, semikonduktor, senyawa organik, serta biologi seperti protein, enzim, dan DNA.
Bagian penting dari nanoteknologi yaitu pengembangan penelitian tentang proses sintesis nanopartikel. Salah satu jenis nanopartikel yang saat ini banyak menarik perhatian untuk bidang pangan, farmasi, biomedis, dan kemasan adalah nanopartikel perak karena dapat berfungsi sebagai agen antimikroba. Nanopartikel perak (NPAg) merupakan partikel logam perak yang berukuran nano sehingga memiliki karakteristik yang lebih baik dibandingkan perak dalam bentuk bulk. Menurut Tolaymat (2010) menyatakan bahwa terjadi peningkatan reaktivitas pada perak yang berukuran nano. Koloid perak telah lama diketahui memiliki sifat antimikroba dan juga ramah lingkungan. Hingga kini sebagai agen, antimikroba perak dapat membunuh semua mikroorganisme patogen dan belum dilaporkan adanya mikroba yang resisten terhadap perak (Haryono, A., et al., 2008). Perak dalam bentuk ion bersifat toksik bagi sel mikroba, tetapi aman bagi manusia. Selain itu, NPAg memiliki banyak keunggulan dibandingkan senyawa antimikroba lainnya, yaitu memiliki aktifitas dengan spektrum yang luas baik terhadap bakteri (Sintubin et al., 2011), kapang (Vivek et al., 2011), dan bahkan virus (Elechiguerra et al., 2005). Kemampuan antimikroba perak, antara lain disebabkan karena kemampuannya merusak dinding sel bakteri, mengganggu metabolisme sel, dan menghambat sintesis sel mikroba. Metabolisme sel dapat dihambat karena adanya interaksi antara perak dengan makromolekul di dalam sel, seperti protein dan DNA. Potensi pengembangan NPAg di berbagai bidang sangat terbuka luas, antara lain sebagai sensor dan agen antimikroba. Pada bidang pangan, NPAg dapat diaplikasikan pada pengemas makanan sebagai film kemasan antimikroba. NPAg pada kemasan dapat memperpanjang umur simpan makanan. NPAg yang diinkorporasikan kedalam kemasan pangan dirancang untuk tetap menempel pada kemasan dan tidak dilepaskan kedalam produk pangan.
2
menjadi partikel perak berukuran nano secara mekanik serta membutuhkan peralatan yang mahal. Oleh karena itu, diperlukan suatu metode sintesis nanopartikel yang aman dan mudah didapatkan dengan menggunakan ekstrak tumbuhan (green synthesis).
Sintesis NPAg dari ekstrak tumbuhan (green synthesis) bersifat ramah lingkungan karena mampu mengurangi penggunaan bahan kimia berbahaya. Menurut Rai et al. (2008), green synthesis bersifat cepat, mudah dibuat, dan tidak perlu isolasi, serta ekstrak tumbuhan lebih berpotensi menghasilkan ion logam dibandingkan dengan menggunakan metode biologis dengan mikroorganisme. Contoh sintesis nanopartikel yang berhasil diperoleh dari ekstrak tumbuhan, baik dari intrasel maupun ekstrasel, antara lain ekstrak daun geranium (Shivshankar et al., 2003, 2004, 2005), daun cinnanomum nanopartikel dilakukan dengan mereaksikan ion logam dengan air rebusan (Shankar et al., 2004; Chandran et al., 2006; Song et al., 2010) ataupun ekstrak tumbuhan (Dubey et al., 2009). Bagian tumbuhan yang dpat digunakan dapat berupa daun (Shankar et al., 2004; Philip, 2010), buah (Jain et al., 2009), maupun biji (Kumar et al., 2010).
Tujuan Penelitian
Tujuan umum dari penelitian ini yaitu untuk mensintesis nanopartikel perak yang ramah lingkungan dengan memanfaatkan biji jarak pagar (Jatropha curcas L.) sebagai agen pereduksi dan sekaligus sebagai “capping agent” serta sebagai bahan awal larutan perak nitrat.
Tujuan khusus dari penelitian ini, antara lain:
1. mengetahui cara ekstraksi biji jarak (Jatropha curcas L.) dengan pelarut air,
2. mempelajari cara sintesis nanopartikel perak dengan menggunakan ekstrak biji jarak (Jatropha curcas L.),
3. mendapatkan formulasi yang optimum untuk sintesis nanopartikel perak menggunakan ekstrak biji jarak (Jatropha curcas L.) sebagai agen pereduksi,
4. mengetahui karakterisasi sifat fisik dan kimiawi nanopartikel perak yang dihasilkan,
5. menguji kapasitas antibakteri dari nanopartikel perak yang dihasilkan serta membandingkannya terhadap nanopartikel perak komersial.
Perumusan Masalah
3
dimanfaatkan sebagai ion pereduksi logam(nanopartikel perak) yang ramah lingkungan.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan manfaat, antara lain: 1.menghasilkan paket inovasi teknologi untuk sintesis nanopartikel yang
ramah lingkungan dengan memanfaatkan ekstrak biji jarak (Jatropha curcas L.), dan
2.paket inovasi teknologi untuk pembuatan kemasan antimikroba berbasis nanokomposit.
Hipotesis Penelitian
Ekstrak biji jarak (Jatropha curcas L.) dapat digunakan sebagai agen pereduksi dalam proses sintesis nanopartikel perak.
2 TINJAUAN PUSTAKA
Tanaman Jarak Pagar (Jatropha curcas L.)
Tanaman jarak pagar (Jatropha curcas L.) yang dapat dilihat pada Gambar 2.1 telah lama dikenal masyarakat Indonesia pada masa penjajahan oleh bangsa Jepang pada tahun 1942. Jatropha curcas L. termasuk tanaman perdu dengan tinggi 1 sampai 7 meter dan bercabang tidak teratur. Batangnya berkayu, silindris, dan bila terluka akan mengeluarkan getah. Klasifikasi tanaman jarak pagar dapat dilihat pada Tabel 2.1.
Tabel 2.1 Klasifikasi tanaman jarak pagar (Jatropha curcas L.) Divisi Spermatophyta
Subdivisi Angiospermae Kelas Dicotyledonae
Ordo Euphorbiaceae
Genus Jatropha
Spesies Jatropha curcas Linn Sumber: Deptan (2011)
Tanaman ini dapat tumbuh dengan baik pada dataran rendah sampai pada ketinggian 500 m dpl. Curah hujan yang sesuai untuk tanaman jarak pagar adalah 625 mm/tahun, namun masih dapat tumbuh pada kisaran curah hujan 300 mm sampai 2.380 mm/tahun. Sedangkan, kisaran suhu yang diperlukan adalah antara 20 ºC sampai 26ºC, pada suhu ekstrim (dibawah 15 ºC atau diatas 35ºC) akan menghambat pertumbuhan, serta mengurangi kadar minyak dalam biji dan mengubah komposisinya (Deptan, 2011).
4
ketika masak. Buahjarak terbagi menjadi 3 sampai 5 ruang, masing-masing berisi satu biji sehingga tiap buah terdapat 3 sampai 5 biji. Biji berbentuk bulat lonjong dan berwarna coklat kehitaman. Biji inilah yang banyak mengandung minyak dengan rendemen mencapai30% sampai 50% dan mengandung toksin sehingga tidak dapat dimakan (Deptan, 2011).
(a) (b)
Gambar 2.1 Bagian tanaman jarak pagar (Jatropha curcas L): (a) daun jarak & (b) buah jarak
Biji Jarak Pagar(Jatropha curcas L.)
Biji jarak pagar (Jatropha curcas L.) rata-rata berukuran 18 x 11 x 9 mm, berat 0.62 gram, dan terdiri atas 58.1 % biji inti berupa daging (kernel) dan 41.9 % kulit. Biji jarak dapat dilihat pada Gambar 2.2. Kulit mengandung 0.8% ekstrak eter. Kadar minyak (trigliserida) dalam inti biji ekuivalen dengan 55% atau 33% dari berat total biji (Brodjonegoro et al., 2005). Biji dan cangkang jarak pagar mengandung 20 sampai 40% minyak, namun bagian inti biji (biji tanpa cangkang) mengandung 45 sampai 60 % minyak kasar.
(a) (b)
Gambar 2.2 (a) Bunga jarak; (b) biji jarak (Jatropha curcas L.) (Pambudi, 2007)
5
bagian biji. Curcin adalah sejenis racun lektin yang terdapat pada tanaman jarak pagar. Berdasarkan penelitian yang telah dilakukan oleh Aderibigbe et al. (1997) dan Aregheore et al. (2003), menyebutkan bahwa curcin dapat diinaktifkan dengan pemanasan basah pada suhu 121 oC selama 30 menit dengan kadar air 66%. Perlakuan pemanasan juga dapat mengurangi antinutrisi labil dan juga dapat meningkatkan kecernaan protein (Aderibigbe et al., 1997).
Asam lemak penyusun minyak jarak pagar terdiri atas 22.7 % asam lemak jenuh dan 77.3% asam lemak tak jenuh. Kadar asam lemak minyak terdiri dari 17.0% asam palmitat, 5.6 % asam stearat, 37.1 % asam oleat, dan 40.2% asam linoleat (Brodjongoroet al., 2005). Komposisi asam oleat dan linoleat bervariasi, sedangkan asam palmitat dan stearat berada pada komposisi yang relatif tetap (Heller, 1996). Kadar protein biji jarak pagar (Jatropha curcas L.) berkisar antara 22.2 sampai 27.2 %. Buah jarak pagar yang berumur 7 tahun atau sampel yang segar memiliki rasio biji dengan kulit(63:37), dengan protein kasar 25.6%, lemak 57%, dan abu 3.4%. Bijinya mengandung berbagai senyawa alkaloida, saponin, dan sejenis protein beracun yang disebut curcin (Sinaga, 2007). Senyawa alkaloid memiliki aktivitas fisiologi sehingga banyak digunakan dalam bidang pengobatan. Begitu juga dengan saponin yang merupakan senyawa aktif yang dihasilkan dari grup steroid atau triterpen yang berikatan dengan gula. Senyawa saponin dapat berfungsi sebagai penghambat atau pembunuh mikroba dengan cara berinteraksi dengan membran sterol. Efek utama saponin terhadap bakteri adalah pelepasan protein dan enzim dari dalam sel-sel (Zablotowicz et al., 1996).
Menurut Bar et al. (2009), biji jarak pagar (Jatropha curcas L.) mengandung gugus karbonil, hidroksil, dan gugus fungsional amina yang dapat berpotensi sebagai ion pereduksi logam dan membatasi pembentukan partikel baru selama proses pertumbuhannya. Dalam sebuah diskusi terakhir, telah dilaporkan juga bahwa lateks J. curcas dapat digunakan untuk mereduksi Ag+ menjadi Ago dan komponen lateks juga bertindak sebagai agen capping untuk menstabilkan nanopartikel Ag (perak).
Gambar 2.3 Struktur kimia curcin (C19H22O2) (www.Giftplanzen.com/Jatropha curcas/html)
6
Nanopartikel perak memiliki banyak manfaat dalam kehidupan manusia, terutama sebagai agen antifungal (jamur) dan antibakteri sehingga sering digunakan pada industri produk pangan. Adapun fakta yang perlu diketahui yaitu ion maupun nanopartikel perak bersifat sangat beracun dan berbahaya bagi mikroorganisme. Hal ini diketahui dari nanopartikel perak yang memiliki aktifitas penghambatan dan efek bakteriasidal serta aplikasinya secara luas digunakan sebagai agen antibakteri. Aktifitas antibakteri dari nanopartikel perak dapat diperkirakan melalui pembentukan zona penghambatan. Beberapa studi menunjukkan bahwa nanopartikel perak memiliki aktifitas antibakteri yang relatif lebih tinggi pada bakteri gram negatif dibandingkan pada bakteri gram positif. Hal ini disebabkan karena adanya lapisan tipis peptidoglikan dan protein beta barel yang disebut porin. Menurut Geoprincy et al. (2012), mekanisme nanopartikel perak sebagai zat antimikroba, yaitu nanopartikel perak dapat melekat pada dinding sel mikroorganisme sehingga dapat mengganggu permeabilitas dinding sel serta respirasi seluler. Selain itu, nanopartikel perak juga dapat menembus jauh kedalam dinding sel sehingga menyebabkan terjadinya kerusakan sel dengan cara berinteraksi dengan fosfor ataupun senyawa yang mengandung sulfur, seperti DNA dan protein yang terdapat didalam sel. Sifat bakteriosidal nanopartikel perak disebabkan karena adanya proses pelepasan ion perak dari partikel yang dapat memberikan aktifitas antimikroba.
Tim peneliti gabungan dari Florida Institute of Technology (FIT), State University of New York (SUNY), dan National Institute of Standards and Technology (NIST) melaporkan bahwa ion perak dan asam humat (humic acid) dapat membentuk nanopartikel perak yang stabil. Mereka menganalisis sampel sedimen sungai yang diperkirakan mengandung asam humat dengan TEM (Transfer Electron Microscopy) dan mendapatkan bahwa asam humat menyelubungi nanopartikel perak membentuk struktur yang stabil.
Pada tahun 2003, Gardea-Torresdey et al., memanfaatkan tumbuhan afalfa (Medicago sativa) yang ditanam pada media dengan penambahan prekursor AgNO3 sebagai sumber ion Ag+. Hasil yang diperoleh menunjukkan akar dari tumbuhan afalfa mampu mengabsorbsi perak sebagai Ago dari media agar melalui suatu kanal dan kemudian ditransfer ke bagian tunas tumbuhan pada kondisi oksidasi yang sama. Atom-atom perak tersebut akan membentuk partikel berukuran < 100 nm melalui proses nukleasi dan beberapa diantaranya saling bergabung membentuk ukuran yang lebih besar hingga terakumulasi di dalam jaringan tumbuhan. Penelitian tersebut menunjukkan bahwa tumbuhan mampu menyintesis nanopartikel perak.
Sintesis Nanopartikel Perak
7
terbentuk di akar kemudian ditransport dalam tumbuhan dan diakumulasi dalam sel tumbuhan. Sedangkan, diluar sel, proses sintesis dilakukan dengan mereaksikan ion logam dengan air rebusan (Shankar et al., 2004; Chandran et al., 2006; Song et al., 2010) ataupun ektrak tumbuhan (Dubey et al., 2009). Bagian tumbuhan yang dapat digunakan, antara lain: daun (Shankar et al., 2004; Philip, 2010), buah (Jain et al., 2009) ataupun biji (Kumar et al., 2010; Han et al., 2009).
Komponen poli-ol maupun heterosiklik larut air yang terdapat didalam tanaman merupakan komponen utama yang bertanggung jawab terhadap reduksi ion perak dan menstabilkan perak (Kumar et al., 2009). Selain itu, adanya reduktase dalam tanaman dapat mempengaruhi stabilisasi nanopartikel perak dan juga berperan dalam proses sintesis nanopartikel.
Perkembangan teknologi nano tidak terlepas dari riset mengenai material nano. Dalam pengembangannya, material nano diklasifikasikan menjadi tiga kategori, yaitu: material nano berdimensi nol (nanoparticle), material nano berdimensi satu (nanowire), dan material nano berdimensi dua (thin films). Pengembangan metoda sintesis nanopartikel merupakan salah satu bidang yang menarik minat banyak peneliti. Nanopartikel dapatterjadi secara alamiah ataupun melalui proses sintesis oleh manusia. Sintesis nanopartikel bermakna pembuatan nanopartikel dengan ukuran yang kurang dari 100 nm dan sekaligus mengubah sifat atau fungsinya.
Preparasi material nanopartikel merupakan tahap awal untuk pengembangan teknologi skala nano. Selama ini, preparasi material nanopartikel dilakukan melalui proses sintesis bottom up dengan cara sintesis secara kimiawi ataupun top down secara fisika untuk memperoleh jenis, ukuran, bentuk, dan komposisi nanopartikel yang diinginkan (Parsons et al., 2007; Tolaymat et al., 2010). Sintesis nanopartikel logam dengan metoda kimiawi dilengkapi dengan penggunaan surfaktan atau polimer yang membentuk susunan teratur (self-assembly) pada permukaan nanopartikel logam. Bagian surfaktan atau polimer yang hidrofob langsung teradsorpsipada permukaan nanopartikel dan bagian hidrofilnya berada pada bulk larutan. Bahan organik tersebut (surfaktan dan polimer) dapat mengontrol kecepatan reduksi danagregasi nanopartikel logam.
8
Senyawa Antimikroba
Senyawa antimikroba merupakan senyawa biologis atau kimia yang dapat menghambat pertumbuhan atau aktivitas mikroba (Jay, 1992). Senyawa-senyawa kemoterapeutik, baik yang sintesis maupun alami bersifat toksik terhadap mikroorganisme disebut senyawa antimikroba.
Berdasarkan mekanisme kerjanya, antimikroba dikelompokkan dalam 5 jenis, antara lain:
1) antibakteri yang bekerja menganggu metabolisme sel mikroba, contoh: sulfonamid, asam p-aminosalisilat (PAS), dan sulfon;
2) antimikroba yang menghambat sintesis membran sel mikroba, contoh: penisilin, sefalosporin, basitrasin, vankomisin, dan sikloresin;
3) antimikroba yang menganggu permeabilitas mebran sel mikroba, contoh: polimiksin;
4) antimikroba yang menghambat sintesis protein sel mikroba, contoh: tetrasiklin dan kloramfenikol; dan antimikroba yang menghambat sintesis atau merusak asam nukleat sel mikroba, contoh: rifampisin (Setiabudy, 2007).
Aktivitas zat antimikroba dipengaruhi oleh lingkungan, yaitu konsentrasi atau intensitas zat antimikrobial, jumlah mikroorganisme, suhu, spesies mikroorganisme, adanya bahan organik, dan pH. Bakteri gram positif lebih sensitif terhadap senyawa antimikroba, jika dibandingkan dengan bakteri gram negatif yang lebih resisten terhadap senyawa antimikroba. Hal ini disebabkan karena struktur dinding sel bakteri gram positif lebih sederhana dibandingkan bakteri gram negatif (Pelczar & Chan, 1986).
Dalam penelitian yang telah dilakukan oleh Panacek et al. (2006) diketahui adanya aktivitas antimikroba dan antibakteri yang tinggi dari nanopartikel perak pada bakteri gram positif dan gram negatif termasuk pada galur multiresisten seperti metisilin S. aureus. Aktivitas antibakteri nanopartikel perak dipengaruhi oleh ukuran. Ukuran nanopartikel perak yang memiliki aktivitas antibakteri paling baik yaitu pada kisaran 25 nm.
Bakteri Uji
9
1) Staphylococcus aureus (S. aureus)
S. aureus adalah bakteri gram positif yang termasukdalam genus Staphylococcus. Bakteri ini berbentuk kokus dengan suhu optimal pertumbuhan 37 sampai 40oC, pH optimum 6.0 sampai 8.0 dan aktivitas air (aw) minimum 0.86 (Jay, 1992). S.aureus merupakan mikroba flora normal yang terdapat pada permukaan kulit, rambut, hidung, mulut, dan tenggorokan. S. aureus dapat menghasilkan enterotoksin yang menyebabkan keracunan makanan (Blackburn dan McClure, 2002).
S.aureus tumbuh secara anaerobik fakultatif, tidak berkapsul, tidak motil, dan tidak membentuk spora. Kumpulan sel-selnya menyerupai buah anggur. S.aureus juga tahan garam dan tumbuh baik pada medium yang mengandung 7.5% NaCl. Bakteri ini memproduksi enterotoksin yang dapat menyebabkan keracunan (Fardiaz, 1983).
2) Eschericia coli (E. coli)
Bakteri E. coli termasuk bakteri gram negatif yang berukuran panjang 2.0 sampai 6.0 mikron dan lebar 1.1 sampai 1.5 mikron. Bakteri ini ditemukan dalam bentuk tunggal atau berpasangan, bersifat motil atau non motil (Fardiaz, 1983). Bakteri E.coli merupakan bakteri gram negatif yang termasuk dalam famili Enterobacteriaceae. E. coli bersifat aerobik dan fakultatif anaerobik. Bakteri ini dapat tumbuh optimum pada suhu 35 sampai 40oC. Bakteri ini dapat tumbuh pada aktivitas air (aw) minimum 0.95 dan pH optimum 4.4 (Blackburn dan McClure, 2002).
3) Bacilus cereus (B. cereus)
B. cereustermasuk bakteri gram positif, bersifat aerobik, dan dapat membentuk endospora. B. cereus merupakan bakteri berbentuk batang. Keracunan akan timbul jika seseorang menelan bakteri atau bentuk sporanya, kemudian bakteri bereproduksi dan menghasilkan toksin di dalam usus atau seseorang mengkonsumsi pangan yang telah mengandung toksin dari B. cereus.
4) Salmonella typhimurium(S. typhimurium)
10
1
3 METODE
Bahan
Bahan utama yang digunakan dalam penelitian ini yaitu menggunakan bubuk perak nitrat (AgNO3) dari Sigma Aldrich serta biji jarak pagar (Jatropha curcas L.) dari Biosurfactan yang digunakan sebagai agen pereduksi nanopartikel perak (NPAg). Sedangkan, bahan yang digunakan untuk uji aktivitas antimikroba, antara lain: nutrient agar (NA), nutrient broth (NB), dan beberapa jenis bakteri (Eshericia coli, Staphylococcus aureus, Salmonella typhii., dan Bacillus cereus).
Alat
Alat yang digunakan untuk produksi NPAg, antara lain: hot plate, autoklaf, sentrifus, pH-meter, neraca analitik, jarum ose, pipet mikro, pipet Mohr, gelas ukur, sudip, batang pengaduk, shaker incubator, oven, labu erlenmeyer, kertas Whatman No. 1, dan alat-alat gelas lainnya.
Sedangkan, peralatan analisis yang digunakan, yaitu spektrofotometer UV-Vis(UV-1800 Shimadzu), Particle Size Analyzer (PSA), Scanning Electron Microscopy (SEM) (JEOL Model JSM 5310 LV), serta FTIR (Shimadzu-FTIR spectrometer).
Waktu dan Lokasi
Penelitian dilaksanakan pada bulan Januari 2014 sampai Februari 2015. Penelitian dilaksanakan di laboratorium Teknologi Pengolahan Pangan, laboratorium Biokimia Pangan, dan laboratorium Kimia Pangan Departemen Ilmu dan Teknologi Pangan, Fakultas Teknologi Pertanian IPB, laboratorium Kimia dan Mikrobiologi, PAU, SEAFAST Center IPB, Balai Inkubator Puspiptek - Serpong, serta Departemen Kehutanan Gunung Batu - Bogor.
Prosedur Percobaan
1. Ekstraksi biji jarak (Bar et al., 2009) dan(Jagtap, et al., 2013)
11
untuk proses sintesis nanopartikel perak. Air rebusan dapat disimpan pada suhu 6 oC selama 2 minggu.
2. Sintesis nanopartikel perakBar et al., (2009)
Sintesis dilakukan dengan mencampur larutan AgNO3 dan larutan ekstrak biji jarak. Sebanyak 250 ml AgNO3 10-2 M akan direaksikan dengan 50 ml ekstrak biji jarak dan dilakukan proses pemanasan pada suhu 80 o
C.Sebagai indikator telah terbentuknya nanopartikel perak, maka diamati adanya perubahan warna larutan ekstrak biji jarak dari awalnyaberwarna bening sampai berwarna kekuningan hingga cokelat setelah pemanasan selama 15 menit. Perlakuan yang dilakukan dalam penelitian ini yaitu dengan memvariasikan rasio volume campuran larutan ekstrak bii jarak dengan AgNO3. Rasio yang akan diujikan, yaitu 1:5 (E1P5); 1:10 (E1P10); dan 1:15 (E1P15) (v:v).
3. Karakterisasi nanopartikel perak
3.1 Analisis spektrofotometri UV-Vis (Bar et al., 2009)
Karakterisasi hasil sintesis dilakukan dengan spektrofotometer UV-Vis (UV-1800 Shimadzu) yang memiliki resolusi 1 nm. Instrumen spektrofotometer UV-Vis distandarisasi dengan menggunakan blanko. Blanko yang digunakan adalah larutan yang tidak ditambahkan AgNO3. Larutan yang mengandung nanopartikel perak dimasukkan ke dalam kuvet kuarsa kemudian dilakukan pengukuran pada panjang gelombang 200-800 nm.
3.2 Analisis Particle Size Analyzer (PSA) (Balachandran, 2013)
Sebelum analisis distribusi ukuran nanopartikel perak dengan menggunakan PSA terlebih dahulu diukur indeks refraksi dan viskositas supernatan kultur yang tidak ditambahkan AgNO3. Larutan yang mengandung nanopartikel perak dimasukkan ke dalam kuvet kemudian dianalisis dengan instrumen PSA. Sampel dengan nilai PSA yang terkecil selanjutnya akan diuji aktivitas antimikroba dan dibandingkan dengan sampel NPAg komersial (NPAg K).
3.3 Analisis ukuran dan bentuk nanopartikel (SEM) (Ibrahim, 2014)
Analisis ukuran dan bentuk nanopartikel menggunakan Scanning Electron Microscopy (SEM) dengan JEOL Model JSM 5310 LV. Prosedur analisisnya yaitu dengan meneteskan suspensi diatas plat listrik yang bersih dan memungkinkan air dapat menguap. Tegangan listrik yang digunakan untuk analisis menggunakan SEM yaitu sebesar 15 kW, serta sampel akan dilapisi dengan emas.
3.4 Analisis dengan spektrometer FTIR (Bar et al., 2009)
12
ekstrak biji jarak (Jatropha curcas L.) sehingga dapat berperan dalam proses sintesis nanopartikel perak.
4. Pengujian kapasitas antimikroba dari nanopartikel Ag 4.1 Persiapan kultur uji
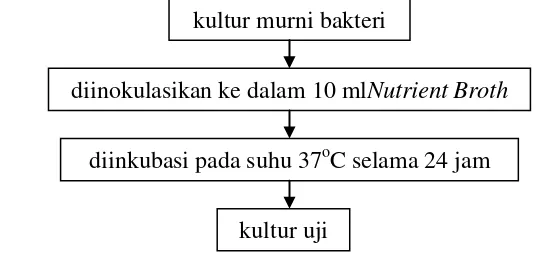
Terlebih dahulu disiapkan kultur uji (Gambar 3.1) dengan menginokulasikan satu ose kultur murni dari agar miring Nutrient Agar (NA) kedalam 10 ml medium cair Nutrient Broth (NB) secara aseptik. Kultur uji kemudian diinkubasi selama 24 jam pada suhu 37oC. Kultur uji yang digunakan dalam penelitian ini, antara lain Bacillus cereus, Eschericia coli, Salmonella typhimurium, dan Staphylococcus aureus.
Gambar 3.1 Diagram alir persiapan kultur uji 4.2 Pengujian aktifitas antimikroba dengan metode cakram
Kultur uji diinokulasikan sebanyak 0.2 ml kedalam media NA 100 ml sehingga diperoleh konsentrasi 0.2% yang telah siap dituang ke cawan petri steril. Selanjutnya, 20 ml media NA yang telah berisi kultur uji dituangkan ke cawan petri dan dibiarkan menjadi padat.Setelah memadat, dibuat sumur dengan diameter 6mm dengan kedalaman yang seragam, larutan nanopartikel perak dituangkan kedalam sumur hingga setengah sumur terisi oleh larutan nanopartikel perak, dan diinkubasi pada suhu 37oC selama 1 hari. Zona penghambatan adalah lebar areal bening yang terbentuk di sekitar sumur yang diukur dengan jangka sorong dengan satuan mm (Gambar 3.2).
kultur murni bakteri
diinokulasikan ke dalam 10 mlNutrient Broth diinkubasi pada suhu 37oC selama 24 jam
13
Gambar 3.2 Diagram alir metode sum
4 HASIL DAN PEMBAHASAN
PEMBAHASAN
Berdasarkan hasil sintesis menggunakan air rebusan ekstrak biji jarak (Jatropha curcas L.) yang direaksikan dengan larutan AgNO3 terjadi perubahan warna pada larutan ekstrak biji jarak. Perubahan warna yang terjadi pada larutan ekstrak biji jarak yaitu dari berwarna kuning bening menjadi cokelat kemerahan. Hal ini merupakan salah satu indikasi terjadinya reaksi yaitu terbentuknya nanopartikel perak (NPAg). Perubahan warna terjadi karena adanya proses reduksi ion perak dengan menggunakan ekstrak biji jarak. Akan tetapi, perubahan warna tidak dapat dijadikan sebagai indikasi utama terbentuknya nanopartikel. Perlu dilakukan uji lain yaitu salah satunya menggunakan spektrofotometri UV-vis. Spektrofotometri UV-vis menjadi salah satu karakter yang dapat digunakan untuk mengkonfirmasi telah terbentuknya nanopartikel perak.
Analisis Spektrofotometri UV-vis Nanopartikel Perak
Analisis spektrofotometer UV-vis digunakan untuk mengkonfirmasi pembentukan nanopartikel dari hasil sintesis. Absorbansi pada panjang gelombang tertentu menunjukkan karakter yang unik dari suatu partikel.
Selain itu, spektrum panjang gelombang maksimum (λmaks) menunjukkan sebaran ukuran partikel yang dihasilkan dari proses sintesis. Kestabilan NPAg diindikasikan dengan terbentuknya larutan berwarna coklat kemerahan. Karakterisasi ini dilakukan pada saat 15 menit setelah ekstrak biji jarak direaksikan dengan larutan AgNO3 dengan tiga macam variasi perbandingan E1P5, E1P10, dan E1P15.
Kultur uji
diinokulasi 0.2 % kedalam 20 ml NA
dituangkan kedalam cawan petri dan dibiarkan
diinkubasi pada suhu 37 oC selama 24 jam
diukur diameter penghambatan
14
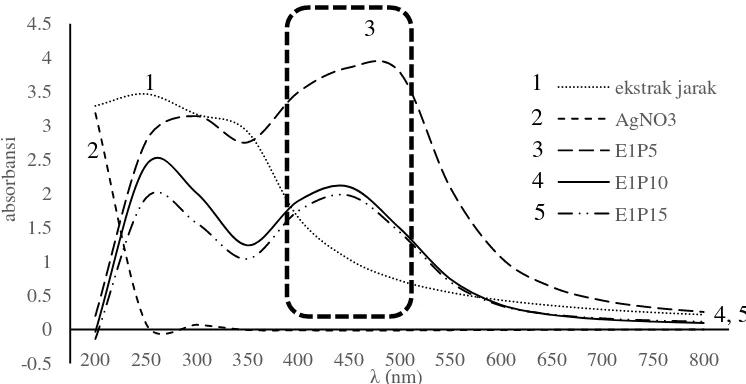
Gambar 4.1 Hasil pengujian spektrum NPAg spektro UV-vis dengan variasi rasio ekstrak jarak dan AgNO3
Pada Gambar 4.1 dapat terlihat bahwa larutan AgNO3 memiliki λmaks
sebesar 200 nm. Sedangkan, larutan ekstrak biji jarak memiliki λmaks yang lebih lebar yaitu sebesar 250 hingga 300 nm. Setelah kedua larutan
direaksikan, diperoleh kisaran λmaks yang berbeda yaitu antara 400 hingga 500 nm. Hal ini menunjukkan terbentuknya komponen baru pada larutan. Menurut Solomon et al. (2007) & Vivekanandan (2008) menyatakan bahwa pada umumnya NPAg memiliki absorpsi yang kuat pada panjang gelombang antara 400 hingga 500 nm. Adanya serapan baru pada daerah 400 hingga 500 nm membuktikan bahwa proses sintesis menggunakan ekstrak biji jarak telah menghasilkan NPAg.
Berdasarkan hasil penelitian dengan mempelajari pengaruh variasi volume larutan AgNO3 yang direaksikan dengan larutan ekstrak biji jarak,
diperoleh hasil bahwa λmaks terbesar terdapat pada variasi penambahan volume larutan AgNO3 yang paling sedikit yaitu sampel E1P5 (rasio volume ekstrak biji jarak : AgNO3 yaitu 1 : 5). Seperti yang dapat dilihat pada Gambar 4.1 bahwa penurunan λmaks terjadi seiring dengan meningkatnya volume larutan AgNO3 yang ditambahkan kedalam larutan ekstrak biji
jarak. Nilai λmaks menunjukkan ukuran partikel yang terbentuk dari sintesis nanopartikel perak dari hasil sintesis. Secara kualitatif, dapat diasumsikan
bahwa semakin tinggi λmaks, maka jumlah nanopartikel yang terbentuk semakin banyak.
Selain itu, nilai absorbansi juga dapat menunjukkan kecenderungan ukuran NPAg. Menurut Solomon et al. (2007) menyatakan bahwa ukuran nanopartikel perak akan semakin kecil seiring dengan pertambahan waktu
dan λmaks suatu larutan. Semakin tinggi nilai absorbansi, maka ukuran NPAg semakin besar. Dari hasil penelitian ini dapat disimpulkan bahwa sampel E1P5 memiliki λmaks paling tinggi dibandingkan E1P10 dan E1P15. Larutan NPAg memiliki nilai pH= 5 selama proses reaksi yang diukur menggunakan indikator pH universal (Gambar 4.2).
200 250 300 350 400 450 500 550 600 650 700 750 800
15
Gambar 4.2 Hasil pengujian pH dengan variasi rasio ekstrak jarak dan AgNO3
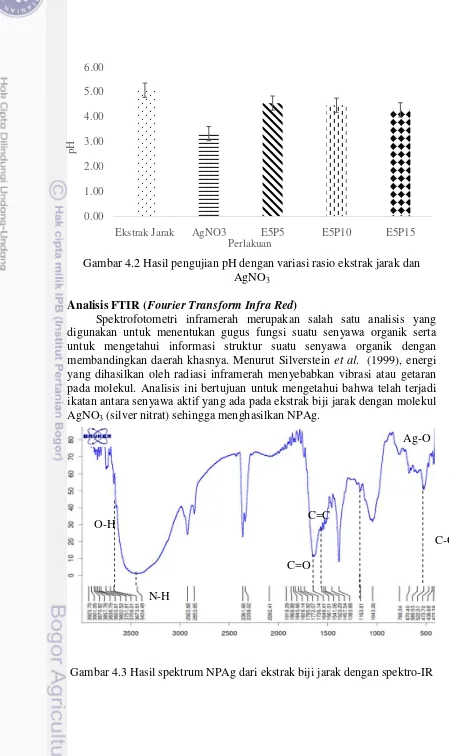
Analisis FTIR (Fourier Transform Infra Red)
Spektrofotometri inframerah merupakan salah satu analisis yang digunakan untuk menentukan gugus fungsi suatu senyawa organik serta untuk mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah khasnya. Menurut Silverstein et al. (1999), energi yang dihasilkan oleh radiasi inframerah menyebabkan vibrasi atau getaran pada molekul. Analisis ini bertujuan untuk mengetahui bahwa telah terjadi ikatan antara senyawa aktif yang ada pada ekstrak biji jarak dengan molekul AgNO3 (silver nitrat) sehingga menghasilkan NPAg.
Gambar 4.3 Hasil spektrum NPAg dari ekstrak biji jarak dengan spektro-IR
0.00 1.00 2.00 3.00 4.00 5.00 6.00
Ekstrak Jarak AgNO3 E5P5 E5P10 E5P15
pH
Perlakuan
O-H
C-O C=C
C=O N-H
16
Berdasarkan hasil yang telah diperoleh pada Gambar 4.3, menunjukkan adanya peak pada bilangan gelombang 3673.81 yang merupakan ikatan O-H dengan tipe senyawa alkohol dan fenol (Skoog 2007). Gugus polar pada ikatan O-H yang berasal dari ekstrak biji jarak memiliki kemampuan yang baik untuk bereaksi dengan ion logam (seperti: ion perak). Menurut Gurunathan et al. (2009), ion hidroksida diperlukan untuk mempercepat proses reduksi ion Ag+. Hal tersebut dikarenakan daya mereduksi protein yang terlibat sebagai agen pereduksi, mengalami peningkatan dalam kondisi basa. Selain itu, terdapat peak pada bilangan gelombang 3434.49 yang merupakan ikatan N-H dengan tipe senyawa amina dan amida dengan intensitas sedang (Skoog 2007). Protein yang terdapat pada ekstrak biji jarak pagar (Jatropha curcas L.) yang memiliki gugus amina berperan dalam proses reduksi ion Ag+ menjadi Ago (nanopartikel Ag). Hasil ini sama dengan yang telah dikemukan oleh Li et al. (2007), menyatakan bahwa berdasarkan hasil karakterisasi FTIR pada Capsicum annuum L, protein yang memiliki gugus amina berperan dalam proses reduksi. Hasil ini menunjukkan bahwa protein dapat mengikat permukaan nanopartikel baik melalui kelompok amina bebas atau residu sistein, yang bertindak sebagai agen capping dan menstabilkan partikel. Pada saat terjadinya proses reduksi terjadi penambahan elektron sehingga muatan dari ion Ag menjadi tidak bermuatan (Timberlake 2010). Selain itu, ditemukan peak serapan pada bilangan gelombang 1736.14 yang merupakan ikatan C=O (karbonil) dengan intensitas kuat. Peak lain juga ditemukan pada daerah bilangan gelombang 1646.41 merupakan ikatan C=C dengan tipe senyawa alkena, serta pada bilangan gelombang 1163.81 yang merupakan ikatan C-O dengan tipe senyawa alkohol, eter, asam karboksilat, dan ester.
SEM (Scanning Electron Microscopy)
Analisis SEM bertujuan untuk mengetahui morfologi dari NPAg yang disintesis dari ekstrak biji jarak. Prinsip kerja SEM yaitu dengan cara menembakkan permukaan benda dengan berkas elektron berenergi tinggi, permukaan benda yang dikenai berkas elektron akan memantulkan kembali berkas tersebut atau menghasilkan elektron sekunder ke segala arah.
17
belum stabil, terlihat dari dari banyaknya endapan yang terdapat pada larutan hasil sintesis. Oleh karena itu, diperlukan suatu senyawa sebagai agen penstabil dalam proses sintesis nanopartikel.
Gambar 4.4 Hasil SEM pada NPAg perbesaran 10000x Analisis PSA (Particle Size Analyzer)
Konfirmasi terbentuknya nanopartikel perak berdasarkan korelasi
λmaks pada spektrum UV-Vis juga dapat dipastikan dengan menggunakan PSA (Particle Size Analyzer). Analisis distribusi ukuran partikel
menggunakan alat Beckman Coulter Delsa™ NanoC Particle Analyzer. Tujuan dari analisis ini adalah untuk mengetahui ukuran partikel. Pengukuran menggunakan PSA lebih akurat dibandingkan dengan menggunakan SEM (Scanning Electron Microscope). Pada Gambar 4.5 menunjukan distribusi ukuran partikel untuk sampel E1P5, E1P10, dan E1P15. Hasil pengukuran PSA berbentuk distribusi sehingga dapat digunakan untuk menentukan ukuran partikel secara keseluruhan. Pengukuran dilakukan pada suhu 25oC dengan indeks bias sebesar 1.3332 dan viskositas sampel sebesar 0.8878 cP. Indeks bias dan viskositas penting diketahui untuk meningkatkan akurasi pengukuran menggunakan instrumen PSA.
18
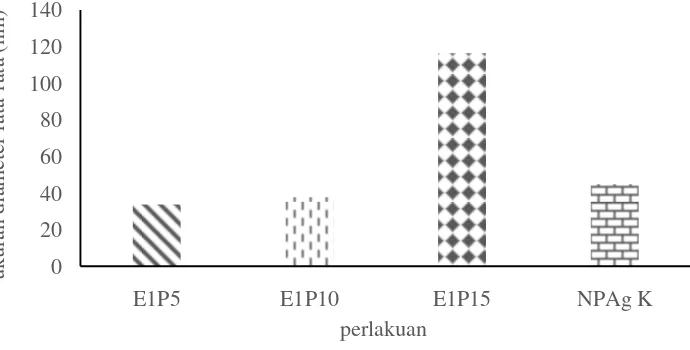
Gambar 4.5 Distribusi ukuran nanopartikel perak pada sampel
Nilai PI menunjukkan ukuran lebarnya distribusi ukuran partikel. Nilai PI lebih kecil dari 0.3 menunjukkan bahwa ukuran partikel memiliki distribusi sempit dan pada umumnya ukuran partikel lebih homogen. Apabila nilai PI lebih dari 0.3 menunjukkan distribusi ukuran partikel lebih besar dan cenderung tidak seragam. Dari hasil analisis menggunakan PSA diperoleh bahwa sampel E1P5 memiliki nilai PI sebesar 0.246 yang menunjukkan bahwa nanopartikel perak yang terbentuk memiliki ukuran partikel cenderung homogen. Sedangkan, untuk sampel E1P10 dan E1P15 memiliki nilai PI lebih dari 0.3 yang menunjukkan bahwa nanopartikel perak yang terbentuk memiliki ukuran partikel cenderung beragam. Hal ini menguatkan dugaan bahwa senyawa aktif yang terdapat pada ekstrak biji jarak (Jatropha curcas) mampu melakukan sintesis nanopartikel perak. Pengujian Aktivitas Antibakteri
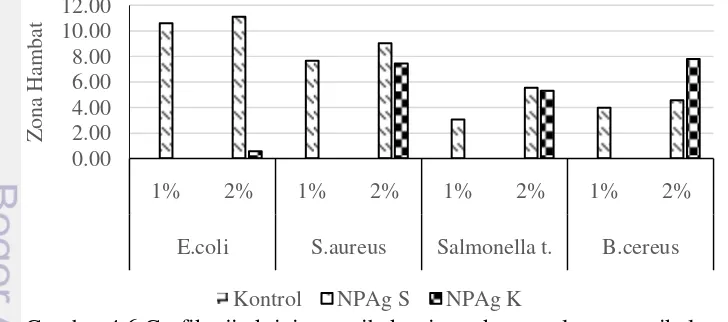
Pengujian aktivitas antibakteri menggunakan metode sumur dengan nutrient agar (NA) sebagai media pertumbuhan bakteri. Bakteri uji yang digunakan untuk analisis dibiakkan pada agar NA dan diinokulasikan selama 24 jam. Kemudian dibuat sumur dengan cara membuat lubang pada media yang telah padat. Sampel uji diteteskan pada sumur yang telah dibuat sebanyak 1 µL dan disimpan selama 24 jam dalam oven suhu 37 oC. Hal ini dilakukan dengan tujuan agar sampel berdifusi kedalam media agar yang telah ditumbuhi bakteri. Bakteri yang digunakan dalam penelitian ini menggunakan dua jenis bakteri, yaitu bakteri gram positif (Staphylococcus aureus dan Bacillus cereus) dan gram negatif (Eschericia coli dan Salmonella typhimurium). Dari hasil penelitian ini diperoleh hasil analisis antimikroba sampel NPAg S (nanopartikel perak hasil sintesis) dan NPAg K (nanopartikel perak produk komersil) dengan variasi dua perlakuan konsentrasi yang berbeda yaitu 1% dan 2%. Hasil uji dapat dilihat pada Gambar 4.6.
Dari hasil uji aktivitas antibakteri yang dapat dilihat pada Gambar 4.6 menunjukkan bahwa pada sampel NPAg K dengan konsentrasi sebesar 1% tidak ditemukan adanya daya hambat untuk semua jenis bakteri. Namun, aktifitas penghambatan baru terlihat dengan adanya peningkatan konsentrasi
19
sebesar 2% pada sampel NPAg K. Nilai diameter hambat tertinggi terdapat pada bakteri B.cereus yaitu sebesar 7.80 mm. Berbeda halnya dengan sampel NPAg S pada dua konsentrasi (1% dan 2%) yang menunjukkan adanya aktifitas penghambatan untuk semua jenis bakteri. Baik pada konsentrasi 1 dan 2% diameter penghambatan optimum yaitu terdapat pada bakteriE. coli masing-masing sebesar 10.59 dan 11.11 mm.
Selain itu, berdasarkan hasil diatas menunjukkan bahwa sampel NPAg S lebih efektif dibandingkan NPAg K dalam menghambat bakteri baik gram positif maupun gram negatif. Hal ini dikarenakan dari hasil analisis distribusi ukuran partikel menggunakan PSA, didapatkan ukuran partikel sampel NPAg S lebih kecil yaitu sebesar 33.8 nm dibandingkan sampel NPAg K sebesar 44.8 nm. Ukuran partikel berpengaruh terhadap aktivitas antibakteri suatu sampel. Apabila ukuran partikel NPAg semakin kecil, maka aktivitas antibakteri yang diberikan suatu sampel akan semakin baik (besar). Namun, semakin meningkatnya ukuran partikel NPAg, maka aktivitas antibakteri suatu sampel akan semakin berkurang. Hal ini dapat terlihat dari hasil penelitian yang menunjukkan bahwa sampel NPAg S yang memiliki ukuran partikel lebih kecil memiliki aktivitas antibakteri yang lebih baik dibandingkan dengan NPAg K untuk keempat jenis bakteri, yaitu eshericia coli, staphylococcus aureus, salmonella typhii., dan bacillus cereus.
Kemampuan nanopartikel perak (NPAg) dalam menghambat pertumbuhan bakteri dikarenakan luas permukaannya yang besar memungkinkan untuk kontak dengan mikroorganisme dengan sangat baik (M. Rai et al 2009). Selama proses difusi berlangsung, NPAg mendekat pada membran sel bakteri dan melakukan penetrasi kedalam bakteri. Membran bakteri mengandung protein dengan komponen utamanya yaitu sulfur. Protein inilah yang akan berinteraksi dengan NPAg dan kemudian berinteraksi lagi dengan fosfor yang mengandung senyawa seperti DNA. Pada saat NPAg masuk dalam sel bakteri menyebabkan terbentuknya daerah dengan berat molekul (BM) rendah ditengah gumpalan bakteri. Gumpalan bakteri ini memiliki fungsi untuk melindungi DNA. Kemudian NPAg melakukan difusi dan menyerang rantai pernafasan bakteri sehingga sel tersebut menjadi mati.
20
(a)
(b)
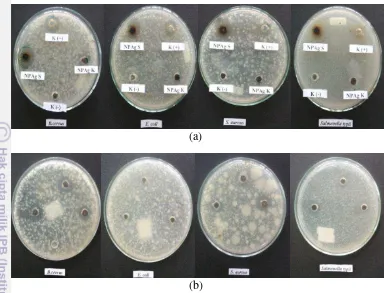
Gambar 4.7 Visualisasi antibakteri untuk dua sampel (NPAg S dan NPAg K) pada konsentrasi 1 % (a) dan konsentrasi 2 % (b)
Aktivitas antibakteri sangat dipengaruhi oleh ukuran partikel dari suatu sampel. Hal ini seperti yang telah dijelaskan oleh Sharma et al (2009) bahwa ukuran nanopartikel perak yang kecil memiliki luas permukaan besar untuk berinteraksi dengan beberapa bakteri dibandingkan nanopartikel perak berukuran besar, sehingga dapat memberikan efek antibakteri lebih baik (besar). Selain itu, kerusakan sel mikroba disebabkan adanya interaksi NPAg dengan komponen yang mengandung fosfor maupun sulfur seperti DNA. Mekanisme NPAg dalam merusak sel mikroba yaitu dengan cara ion Ag+ berinteraksi kuat dengan grup –SH yang tersedia pada biomolekul sehingga dapat menginaktifkan bakteri. Selain itu, aktivitas antibakteri ion Ag+ pada kondisi anaerob ditemukan kurang kuat dibandingkan kondisi aerob.
5 SIMPULAN DAN SARAN
Simpulan
21
terdapat pada formulasi sampel dengan volume penambahan AgNO3 yang terkecil (1:5), yaitu sebesar 37 nm dengan nilai PI sebesar 0.246. NPAg dengan ukuran partikel terkecil ini yang lebih lanjut digunakan untuk uji aktivitas antimikroba. Dari hasil uji aktivitas antimikroba menggunakan metode sumur dapat ditunjukkan bahwa nanopartikel perak memiliki efek penghambatan terkuat pada bakteri E. coli baik pada konsentrasi nanopartikel perak 1 maupun 2%.
Saran
22
DAFTAR PUSTAKA
Aderibigbe AO, COLE Johnson, HPS Makkar,& K Becker. 1997. Chemical composition and effect of heat on organic matter and nitrogen degradability and some anti-nutritional components of Jatropha meal. Animal. Feed Science Technology. 67: 223-243.
Aregheore EM, K Becker, &HPS Makkar. 2003. Detoxification of a toxicvariety of Jatropha curcas using heat and chemical treatments, andpreliminary nutritional evaluation with rats. Journal Natural Science21: 50-60.
Bar H, Dipak KB, Gobinda PS, Priyanka S, Santanu P, &Ajay M. 2009. Green synthesis of silver nanoparticles using seed extract of Jatropha curcas. Colloid and Surfaces A: Physicochemical English, Aspects 348: 212-216.
Balachandran YL, Shanmugam G, Rajendran S, Saowanit T, Arno CG, & Sarvajeyakesavalu S. 2013. Differently Environment Stable Bio-Silver Nanoparticles: Study on Their Optical Enhancing and Antibacterial Properties. PLoS ONE 8(10): e77046.
Brodjonegoro TP, IK Reksowardjojo, & TH Soerawidjaja. 2005. Jarak Pagar, Sang Primadona.http://gerbangkota.multiply.com [diakses pada 28 Juni 2013].
Chandran SP, MChaundhary, R Pasricha, A Ahmad, & M Sastry. (2006). Synthesis of gold nanotriangels and silver nanoparticles using Aloe vera plant extract. Biotechnology Progress22: 577-583.
Departemen Pertanian. 2011. Perlindungan. http://ditjenbun.deptan.go.id [diakses pada 28 Juni 2013].
Dubey M, S Bhadauria, & BSKushwah. 2009. Green synthesis of nanosilver particles from extract of Eucalyptus hybrid (Safeda) leaf. Journal of Nanomaterials and Biostructure 4(3): 537-543.
Elechiguerra JL, Burt JL, Morones JR, Camacho-Bragado A, Gao X, Lara HH, & Yacaman MJ. 2005. Interaction of silver nanoparticles with HIV-1. Journal Nanobiotechnology3:1-10.
Geoprincy G, BN Vidhya S, U Poonguzhali N, Nagendra G, & S. Renganathan. 2012. A review on green synthesis of silver nanoparticles. Asian Journal of Pharamaceutical and Clinical Research Volume 6, Supply 1, 2013.
Gurunathan S, Kalimuthu K, Ramanathan V, Venkataraman D, Sureshbabu RKP, Jeyaraj M, Nellaiah H, & Soo HE. 2009. Biosynthesis, purification, and characterization of silver nanoparticles using E. coli. Colloids and surface B: Biointerfaces 74: 328-335.
23
Haryono A, Dewi S, Sri Budi H, & M. Randy. 2008. Sintesa nanopartikel perak dan potensi aplikasinya. Pusat Penelitian Kimia. Jurnal Riset Industri volume 2, no. 3: 155-163.
Heller J. 1996. Physic nut. Jatropha curcas L. Promoting the conservation and use of underutilized and neglected crop 1. Rome: Institute of Plant Generics and Crop Plant Reseach, Gaterleben/International Plant Genetic Resources Institute.
Hosokawa M., Nogi K., Naito M, & Yokozawa T. 2007. Nanoparticles technology handbook. Elsevier, Amsterdam.
Huang, Chih-Ching, Chang, &Huan-Tsung. 2006. Selective gold-nanoparticle-based “Turn on” fluorescent sensor for detection of mercury (II) in aqueous solution. Analysis Chemsitry 78: 8332-8338.
Ibrahim HMM. 2015. Green synthesis and characterization of silver nanoparticles using banana peel extract and their antimicrobial activity against representative microorganisms. Journal of Radiation Research and Applied SciencesXXX: I-II.
JagtapUB & Vishwas AB. 2013. Greensynthesis ofsilvernanoparticlesusingseedextractand its antibacterial activityArtocarpus heterophyllusLam.Industrial Crops and Products 46: 132-137.
Jain D, Daima HK, Kachhwaha S, & Kothari SL. 2009. Synthesis of plant-mediated silver nanoparticles using papaya fruit extract and evaluation of their antimicrobial activities. Digest Journal of Nanomaterials and Biostructures4: 557-563.
Jha AK, KPrasad, L Prasad, & AR Kulkarni. 2009. Plant system: nature’s
nanofactory. Colloids and surface B: Biointerfaces 73: 219-223.
Kacem I, H Majdoub, & S Roudesli. 2008. Physicochemical properties of pectin from retama raetam obtained using sequential extraction. Journal of Applied Sciences 8 (9): 1713-1719.
Kliemann E, K N de Limas, ER Amante, ES Prudencio, RF Teofi lo, MMC Ferriera, & RDMC Amboni. 2009. Optimasitaion of pectin acid extraction from passion fruit peel (Passiflora edulis flavicarpa) using response surface methodology. International Journal of Food Science and Technology 44: 476-483.
Koswara S, Purwiyatno H, & Eko HP. 2002. Edible film. JurnalTeknologi Pangan dan Agroindustri volume 1 (12):183-196.
Kumar V, Yadav SC, S. K. 2010. Syzygium cumini leaf and seed extract mediated biosynthesis of silver nanoparticles and their characterization. Journal Chemistry Technology and Biotechnology: 1-9.
Li S, Yuhua S, Anjian X, Xuerong Y, Lingguang Q, Li Z, & Qingfeng Z. 2007. Green synthesis of silver nanoparticles using Capsicum annuum L. extract. Green chemistry: 852-858.
24
Nurdjanah N & S Usmiati. 2006. Ekstraksi dan karakterisasi pektin dari kulit labu kuning. Jurnal Penelitian Pascapanen Pertanian, volume 3(1): 13-23.
Panacek A, Kvitek L, Prucek R, Kolar M, Vecerova R, &Pizurova N. 2006. Silver colloid nanoparticles: synthesis, characterization, and their antibacterial activity. Journal Physico Chemical, 110, 33: 16248-16253. Pelczar MJJr & Chan ECS. 1986. Dasar-dasar mikrobiologi volume ke-1, 2.
Hadioetomo R. S., Imas T., Tjitrosomo, S. S., Angka, S. L., penerjemah. Jakarta: UI Press. Terjemahan dari: Elements of Microbiology.
Philip D. 2010. Green synthesis of gold and silver nanoparticles using Hibiscus rosa sinensis. Physica E42: 1417-1424.
Rai SN, Chopra RC, &Sharma K. 2008. Chemical composition and mineral profiles of certain sea weeds of Indian coast. The Indian journal of animal sciences78: 11.
Rai M, Yadav, Y Alka, & G Aniket. 2009. Nanoparticles as a new generation of antimicrobial. Biotechnology Advances 27: 76-83.
Shankar SS, A Rai, A Ahmad,& M Sastry. 2004. Rapid synthesis of Au, Ag, and bimetallic Au core-Ag shell nanoparticles using Neem (Azadirachta indica) leaf broth. Journal of Colloid and Interface Science 275 (4): 496-502.
Sinaga E. 2007. Jatropha curcas L. Pusat Penelitian dan Pengembangan Tumbuhan Obat UNAS/P3TO UNAS. http://iptek.apiji.or.id [diakses pada 28 Juni 2013].
Sintubin L, De Gusseme B, Van der Meeren P, Pycke BF, Verstraete W, & BoonN. 2011. The antibacterial activity of biogenic silver and its mode of action. Applied Microbiology Biotechnology84:741–749.
Solomon SD, M. Bahadory, A. V. Jeyarajasingam, S. A. Rutkowsky, C. Boritz, & L. Mulfinger. 2007. Synthesis and study of silver nanoparticles. Journal of Chemical Education 84 (2): 322-325.
Syamsir E. 2008. Mengenal edible film. http://id.shvoong.com/exact-sciences/1798848-mengenal-edible-film/. [diakses 19 November 2013]. Syarwani M. 2001. Pengambilan pektin dari buah apel, pepaya, dan kulit
jeruk dengan pengendap minuman beralkohol. Jurnal Teknik Kimia dan Kimia (Chemical Engineering) Politek, vol. 3,no. 2.
Thomas J. 2006. Ain introduction to nanotechnology: the next small big thing. Development 49 (4): 39-40.
Tolaymat T, El Badawy A, Genaidy A, Scheckel K, Luxton T,& Suidan M. 2010. An evidence-based environmental perspective of manufactured silver nanoparticle in syntheses and applications: A systematic review and critical appraisal of peer-reviewed scientific papers. Science Tot. Environment 5: 999-1006.
Widodo LU, Karaman N, & Candra Y. 2011. Pektin dari kulit buah pepaya. Jurnal teknik kimia volume 6, no.1: 783-786.
Vivek M, Kumar PS, Steffi S, & Sudha S. 2011. Biogenic silver nanoparticles by gelidiela acerosa extract and their antifungal effects. Avicenna Journal of Medical Biotechnology3:143-148.
25
Hosokawa, M., K. Nogi, M. Naito, and T. Yokozama (Eds). 2007. Nanoparticles technology handbook. Tokyo:Elsevier.
Yujaroen P, U. Supjaroenkul, & Rungrodnimit-chai. 2008. Extraction of pectin from sugar palm meat. Thammasat International Journal Science Technology vol. 13: 44-47.
26
DAFTAR LAMPIRAN
Lampiran 1 Hasil Pengukuran Absorbansi
Perlakuan Ulangan Rerata STDEV
1 2 3
Kontrol 3.468 3.468 3.468 3.468 0.0000
E1P5 3.883 3.823 3.883 3.863 0.0346
E1P10 2.084 2.121 2.121 2.109 0.0214
E1P15 1.975 1.972 1.975 1.974 0.0017
Lampiran 2 Hasil Pengukuran pH
Sampel 1 2 3 Rerata STDEV
Kontrol 3.35 3.32 3.29 3.32 0.0300
E1P5 4.54 4.55 4.54 4.54 0.0058
E1P10 4.47 4.46 4.45 4.46 0.0100
27
28
Lampiran 4 Hasil karakterisasi koloid nanopartikel perak
29
30
31
Lampiran 6 Daya hambat sampel NPAg S dan NPAg K terhadap bakteri E. coli, S. aureus, Salmonella t., dan B. cereus
No Perlakuan Ulangan
Diameter hambatan (mm)
E. coli S. aureus Salmonella t. B. cereus
1% 2% 1% 2% 1% 2% 1% 2%
1 K (-) 1 0 0 0 0
2 NPAg K 1 0 0.80 0 7.36 0 5.30 0 7.70
2 0 0.30 0 7.50 0 5.27 0 7.90
3 NPAg S 1 10.57 11.06 8.67 9.05 3.57 5.32 3.20 4.23
32