KONSTRUKSI DAN EKSPRESI GEN PENYANDI ENZIM
L
-ARABINOSA ISOMERASE PADA PERMUKAAN SEL
KHAMIR
Pichia pastoris
AGNES YULIANA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa Tesis yang berjudul Konstruksi dan Ekspresi Gen Penyandi Enzim L-Arabinosa Isomerase pada Permukaan Sel Khamir Pichia pastoris adalah karya saya bersama komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir Tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor dan LIPI.
Bogor, Agustus 2016
Agnes Yuliana
RINGKASAN
AGNES YULIANA. Konstruksi dan Ekspresi Gen Penyandi Enzim L-Arabinosa Isomerase pada Permukaan Sel Khamir Pichia pastoris. Dibimbing oleh ANTONIUS SUWANTOdan WIEN KUSHARYOTO.
D-tagatosa, isomer dari D-galaktosa merupakan golongan ketoheksosa yang langka di alam. D-tagatosa memiliki kemiripan tingkat kemanisan (92%) dan rasa dengan sukrosa, namun sedikit menghasilkan kalori, sehingga D-tagatosa berpotensi menjadi pemanis dan pengganti gula pada industri makanan dan farmasi. Belakangan ini mulai berkembang pembuatan D-tagatosa dari D -galaktosa secara biologis menggunakan biokatalis. Beberapa enzim yang terlibat dalam biotransformasi D-tagatosa telah banyak dipelajari dan L-arabinosa isomerase (L-AI) dianggap paling berpotensi untuk digunakan pada produksi D -tagatosa karena dapat mengkatalis isomerisasi D-galaktosa menjadi D-tagatosa. Penelitian sebelumnya menunjukkan aktivitas relatif L-AI dalam mengkatalis D -galaktosa menjadi D-tagatosa meningkat sejalan dengan kenaikan temperatur. Oleh karena itu, penggunaan temperatur tinggi pada L-AI diharapkan dapat meningkatkan produksi D-tagatosa. Teknologi berbasis permukaan sel adalah salah satu pendekatan yang memungkinkan peptida atau protein target diekspresikan pada permukaan sel dan sejauh ini sistem ekspresi pada permukaan sel khamir merupakan sistem yang paling banyak digunakan dibandingkan sistem ekspresi yang lain. Sistem ini membutuhkan suatu protein permukaan yang dapat menampilkan protein target pada pemukaan sel khamir. α-agglutinin adalah protein yang terdapat pada permukaan Saccharomyces cerevisiae dan dapat digunakan dalam sistem tampilan permukaan pada khamir lainnya, seperti Pichia pastoris. P. pastoris merupakan khamir metilotropik yang dapat menggunakan metanol sebagai sumber karbon. Kelebihan utama yang dimiliki oleh P. pastoris
dibandingkan sel prokariot adalah sel ini mampu melakukan modifikasi pascatranslasi seperti pelipatan protein, glikosilasi, dan pembentukkan ikatan disulfida. Penelitian ini bertujuan untuk mengkonstruksi dan mengekspresikan gen penyandi L-AI pada permukaan sel khamir P. pastoris.
Gen araA, penyandi L-AI, telah disubkloning ke dalam vektor pJ912-AGα di bawah kontrol promotor terinduksi metanol (PAOXI) dan difusi dengan sinyal
berhasil mengekspresikan protein target yang menyatu dengan α-agglutinin dan
tag His. Percobaan menggunakan manik magnet menunjukkan bahwa sel P. pastoris rekombinan melekat pada permukaan manik magnet. Secara keseluruhan hasil tersebut meyakinkan bahwa fusi protein L-AI telah berhasil diekspresikan pada permukaan sel P. pastoris.
SUMMARY
AGNES YULIANA. Construction and Expression Gene Encoding of L-Arabinose Isomerase in Cell-Surface of Pichia pastoris. Supervised by ANTONIUS SUWANTO and WIEN KUSHARYOTO
D-tagatose, an isomer of D-galactose is a rare natural ketohexose. It has similar levels of sweetness (92%) and flavor with sucrose, but it has low caloric value. D-tagatose potentially be a sweetener and sugar substitute in the food and pharmaceutical industries. Recently, there has been great interest in the biological manufacture of D-tagatose from D-galactose. Several enzymes involved in the biotransformation of D-tagatose have been investigated and L-arabinose isomerase (L-AI) is considered the most potential to be used in the production of D-tagatose as it can catalyze the isomerization of D-galactose to D-tagatose. Previous research showed relatively L-AI activity in catalyzing the D-galactose to D -tagatose increases at elevated temperature. Therefore, the use of high temperature in L-AI may expected to increase the production of D-tagatose. Microbial cell-surface based technology is one approach that allows a target peptide or protein to be presented on the surface of cells, and yeast cell-surface display is the most useful among various display systems developed so far. This system requires a surface protein that could display target protein on the cell surface. The α -agglutinin is a protein found on the cell-surface of Saccharomyces cerevisiae and can be used in yeast cell-surface display system in other yeast strains, such as
Pichia pastoris. P. pastoris is a methylotropic yeast which could use methanol as carbon source. A main advantage possessed by P. pastoris over prokaryotic cells is that the cell could proceed post-translational modifications of proteins such as protein folding, glycosylation and disulfide-bond formation. The aim of this study is to construct and express the gene encoding L-AI in the cell-surface of P. pastoris.
The araA, gene encoding L-AI, was subcloned into pJ-912-AGα vector under the control of the promoter is induced methanol (PAOXI) and fused with MF-α signal peptide, α-agglutinin and His-Tag, resulting in pJ912-AGα-araA
surface and His6-tagged protein. Those results also assured that the L-AI fusion protein was successfully expressed on the cell-surface of P. pastoris.
© Hak Cipta Milik IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB dan LIPI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Teknologi Industri Pertanian
KONSTRUKSI DAN EKSPRESI GEN PENYANDI ENZIM
L
-ARABINOSA ISOMERASE PADA PERMUKAAN SEL
KHAMIR
Pichia pastoris
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2016
Judul : Konstruksi dan Ekspresi Gen Penyandi Enzim L-Arabinosa Isomerase pada Permukaan Sel Khamir Pichia pastoris
Nama : Agnes Yuliana NIM : P051130041
Disetujui oleh Komisi Pembimbing
Prof Dr Ir Antonius Suwanto, M.Sc Dr rer nat Wien Kusharyoto Ketua Anggota
Diketahui oleh
Ketua Program Studi Dekan Sekolah Pascasarjana Bioteknologi
Prof Dr Ir Suharsono, DEA Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah subhanahu wa ta‟ala
karena berkat Rahmat dan Hidayah-Nya penulis dapat menyelesaikan penelitian yang dilaksanakan sejak November 2014 dengan judul “Konstruksi dan Ekspresi Gen Penyandi Enzim L-Arabinosa Isomerase pada Permukaan Sel Khamir Pichia pastoris”. Tesis ini merupakan hasil penelitian yang dilakukan di Laboratorium Rekayasa Genetika Terapan dan Disain Protein, Pusat Penelitian Bioteknologi-LIPI dan dibiayai oleh Pusat Penelitian Bioteknologi Bioteknologi-LIPI. Hasil penelitian ini sedang dalam penelaahan untuk dipublikasikan pada International Journal on Advanced Science, Engineering and Information Technology (IJASEIT).
Terima kasih penulis ucapkan kepada Prof. Dr. Ir. Antonius Suwanto, M.Sc dan Dr. rer. nat. Wien Kusharyoto selaku dosen pembimbing yang telah memberikan bimbingan dan arahan selama penelitian hingga penyusunan tesis ini. Penulis juga tidak lupa berterima kasih kepada Dr. Ir. Utut Widyastuti, M.Si selaku penguji di luar komisi pembimbing pada sidang tesis yang telah memberikan kritik dan saran dalam penulisan. Di samping itu, penghargaan penulis sampaikan kepada Dr. Asrul Muhamad Fuad, M.Si beserta seluruh staf Laboratorium Rekayasa Genetika Terapan dan Disain Protein serta Laboratorium Rekayasa Protein dan Sistem Penyampaian Obat, Pusat Penelitian Bioteknologi-LIPI yang telah membantu penulis selama melakukan penelitian. Ungkapan terima kasih juga tidak lupa disampaikan kepada mama, papa, dan seluruh keluarga yang telah memberikan begitu banyak perhatian, dukungan, do‟a dan kasih sayang kepada penulis, serta sahabat, orang terkasih, dan teman-teman Bioteknologi IPB 2013 atas segala perhatian, do‟a, kerja sama, dan waktu luang kepada penulis.
Penulis menyadari akan keterbatasan yang dimiliki, maka masukan berupa saran dan kritik guna penyempurnaan penulisan karya ilmiah ini sangat diharapkan. Semoga karya ilmiah ini dapat bermanfaat bagi para pembaca dan terutama pengembangan ilmu penulis.
Bogor, Agustus 2016
DAFTAR ISI Sistem Tampilan Permukaan Khamir (Yeast Surface Display/YSD) 8
3 METODE PENELITIAN 12 Transformasi P. pastoris melalui elektroporasi 14 Seleksi koloni P. pastoris transforman 14 Ekspresi protein rekombinan 14 Analisis ekspresi protein rekombinan dengan Immunofluoresence 15 Ekstraksi protein rekombinan dari dinding sel P. Pastoris 15 Analisis ekspresi protein dengan SDS-PAGE (Sodium Dodecyl
Sulphate Polyacrylamide Gel Electrophoresis) 16 Analisis ekspresi protein permukaaan dengan manik magnet 16
4 HASIL DAN PEMBAHASAN 18
DAFTAR TABEL
1. Karakteristik fisik dan kimia D-tagatosa (Levin 2002; Skytte 2006) 4
2. Primer yang digunakan 12
DAFTAR GAMBAR
1. Perbandingan struktur molekul tagatosa dan fruktosa 4 2. Reaksi isomerisasi yang dikatalis enzim L-AI 6 3. Model molekul L-AI ketika mengikat substrat galaktosa 7 4. Komposisi dan struktur permukaan sel S. cerevisiae 10 5. Prinsip tampilan permukaan sel khamir 11 6. Vektor kloning dan ekspresi pJ912-AGα (DNA 2.0) 12 7. Konstruksi vektor PJ912-AGα-araA 13 8. Immunofluorescence di permukaan sel khamir 15 9. Pemotongan rantai β-glukan oleh selulase kompleks 16 10.Analisis protein permukaan menggunakan manik magnet 17 11.Hasil isolasi plasmid pET-21b-araA 18 12.Skema amplifikasi PCR dan pemotongan gen araA 19 13.Hasil analisis elektroforesis gel agarosa terhadap hasil isolasi gen
target 19
14.Skema pemotongan plasmid pJ912-AGα dengan enzim restriksi SalI
dan Kpn2I 20
15.Visualisasi hasil isolasi plasmid pJ912-AGα dan pemotongan
menggunakan enzim restriksi 20 16.Vektor rekombinan pJ912-AGα-araA 21 17.Koloni hasil transformasi pada E. coli DH5α 21 18.Hasil isolasi vektor rekombinan pJ912-AGα-araA 22 19.Skema amplifikasi PCR vektor rekombinan pJ912-AGα-araA
menggunakan primer AOX-F dan AOX-R 22 20.Hasil amplifikasi vektor rekombinan pJ912-AGα-araA dengan
menggunakan primer AOX-F dan AOX-R 23 21.Skema pemotongan vektor rekombinan pJ912-AGα-araA dengan
enzim restriksi SalI dan NcoI 23 22.Hasil analisis restriksi pJ912-AGα-araA 24 23.Hasil analisis restriksi pJ912-AGα-araA dengan enzim SacI 25 24.Integrasi vektor reokombinan pada genom P. pastoris 25 25.Sel P. pastoris hasil transformasi 26 26.Skema amplifikasi PCR vektor rekombinan pJ912-AGα-araA
menggunakan primer PPAI-F dan PPAI-R 27 27.Hasil PCR koloni P. pastoris transforman dengan menggunakan
primer PPAI-F dan PPAI-R 27 28.Struktur bagian permukaan sel P. pastoris rekombinan 28 29.Ekstraksi protein target dari dinding sel P. pastoris rekombinan
32.Struktur kimia Histidin 31 33.Skema pengikatan gugus N cincin imidazole pada protein His Tag
dengan ion logam Ni2+ yang menempel pada manik magnet 32 34.Analisis mikroskopis interaksi antara sel, manik magnet dan antibodi
fluoresence 33
DAFTAR LAMPIRAN
1. Sekuen DNA dan asam amino dari Indo-GSAI 45 2. Sekuen DNA vektor ekspresi pJ912-AGα (DNA 2.0) 46 3. Elektroforesis gel agarosa 48 4. Komposisi larutan dan media yang digunakan beserta cara
pembuatannya 49
1 PENDAHULUAN
Latar Belakang
L-arabinosa isomerase (L-AI) merupakan enzim intrasel yang mengkatalis isomerisasi reversibel D-galaktosa menjadi D-tagatosa (Cheetam dan Wootton 1993). D-tagatosa dikenal sebagai salah satu pemanis rendah kalori (1.5 kkal/g).
D-tagatosa merupakan ketoheksosa yang diisomerisasi dari D-galaktosa oleh L-AI, memiliki rasa seperti sukrosa, namun tingkat kemanisan 92% jika dibandingkan dengan sukrosa (Levin et al. 2002). D-tagatosa secara alami terdapat di alam dalam jumlah sedikit pada getah Stericulia setigera, dan dapat ditemukan pada produk olahan susu (Troyono et al. 1992; Mendoza et al. 2005). D-tagatosa bermanfaat bagi kesehatan diantaranya dapat menurunkan berat badan, bertindak sebagai prebiotik, anti-histolisis (Oh 2007), serta mereduksi sejumlah gejala yang berhubungan dengan diabetes tipe 2, hiperglikemia, obesitas, anemia dan hemofilia (Levin 2002; Lu et al. 2007). Peran D-tagatosa sebagai antidiabetes akan bermanfaat sebagai gula alternatif di Indonesia, mengingat Indonesia menempati peringkat ke-4 dengan jumlah penderita diabetes terbesar di dunia (Wild et al. 2004). Produksi tagatosa dalam bentuk bulk sweeteners telah dilakukan pada skala industri secara kimiawi menggunakan katalis kalsium (Beadle et al. 1991). Tahapan-tahapan dan proses purifikasi yang kompleks, limbah kimia, serta produk samping (by-product) yang dihasikan menyebabkan penggunaan katalis kimia mulai ditinggalkan. Alternatif yang saat ini banyak digunakan adalah menggunakan katalis biologis seperti enzim (Oh 2007).
L-AI merupakan salah satu enzim yang dapat digunakan dalam pembentukan D-tagatosa dan menjadi enzim yang paling banyak dicari untuk memproduksi D-tagatosa. Pembentukan D-tagatosa dari D-galaktosa menggunakan enzim L-AI lebih efisien dalam hal substrat dan tahapan produksinya. Studi produksi dan pencarian enzim L-AI termostabil lebih difokuskan, sebab konversi D-galaktosa menjadi D-tagatosa akan meningkat dengan peningkatan temperatur (>50ºC) (Kim et al. 2002). Selain itu, enzim-enzim pangan yang bersifat termostabil juga menjadi semakin penting dalam dunia industri. Hal ini berkaitan dengan keuntungan yang akan diperoleh bila proses produksi dilakukan pada temperatur tinggi diantaranya adalah mengurangi kontaminasi, meningkatkan kecepatan reaksi sehingga menghemat waktu, tenaga dan biaya, serta menurunkan viskositas larutan fermentasi sehingga memudahkan proses produksi. Pada industri temperatur produksi D-tagatosa yang direkomendasikan jika menggunakan enzim L-AI adalah 60-65ºC, karena pada temperatur yang lebih tinggi akan menyebabkan terjadinya reaksi pencoklatan (Cheng et al. 2009). Oleh karena itu perlu adanya enzim yang dapat tetap aktif dan memiliki aktifitas optimal pada suhu tinggi.
Seperti yang dilaporkan oleh Lee et al. (2005a) bahwa L-AI termofilik memiliki aktivitas katalitik untuk mengkonversi D-galaktosa menjadi D-tagatosa pada teperatur tinggi >70oC. Dari beberapa penelitian sebelumnya, diperoleh beberapa bakteri termofilik yang menghasilkan enzim L-AI, seperti Geobacillus stearothermophilus (Jung et al. 2005), G. thermodenitrificans (Kim dan Oh 2005),
2004) dan Alicyclobacillus acidocaldarius (Lee et al. 2005b). Menurut Kim et al
(2003) L-AI yang berasal dari G. stearothermophilus dapat menghasilkan 230 g/L tagatosa dari 500 g/L galaktosa dengan produktivitas mencapai 319 g/L per hari pada sistem batch. Sedangkan fermentasi secara kontinu menghasilkan 145 g/L tagatosa dari 300 g/L galaktosa dengan produktifitas 1,296 g/L per hari (Ryu, et al. 2003). Hasil tersebut mendekati kriteria produksi komersial.
Dalam beberapa tahun terakhir, kemajuan ilmu bioteknologi dan rekayasa genetika, telah mengembangkan sistem ekspresi yang dapat menghasilkan protein heterolog fungsional seperti enzim dari inang asal ke sel mikroorganisme lainnya untuk diproduksi lebih banyak, seperti menggunakan mutan Escherichia coli
(Kim et al. 2002), dan Saccharomyces cerevisiae (Sedlak dan Ho 2001), dan sistem tampilan protein heterolog pada permukaan sel mikroorganisme (bakteri, fage dan khamir). Teknik tampilan permukaan sel (cell-Surface display) merupakan teknik baru yang secara luas digunakan untuk pengembangan biokatalis sel dengan menggunakan sel sebagai pembawa enzim amobil, sehingga protein yang diinginkan menyatu dengan protein dinding sel dan diperoleh strain yang dapat menghasilkan enzim sebagai protein fusi permukaan sel (Tanaka et al. 2012; Tsai et al. 2015; Smith et al. 2015; Mohamad et al. 2015). Produksi biokatalis melalui sistem tampilan permukaan sel merupakan salah satu metode yang paling hemat biaya karena tidak memerlukan pemecahkan sel, pemurnikan protein dan imobilisasi enzim, karena dengan menumbuhkan dan menginduksi sel inang, enzim akan diproduksi sebagai protein amobil pada permukaan sel, dan sel yang dipanen dapat langsung digunakan sebagai biokatalis. Sel-sel yang mengekspresikan enzim pada permukaan sel dapat digunakan beberapa kali sebagai biokatalis (Kondo dan Ueda 2004). Perkembangan sistem tampilan permukaan sel untuk ekspresi protein terus dilakukan hingga diperoleh sistem ekspresi protein heterolog pada permukaan sel mikroorganisme salah satunya adalah sistem ekspresi protein pada permukaan sel khamir.
Teknik tampilan permukaan khamir (Yeast Surface Display/YSD) merupakan metode baru ekspresi protein fungsional pada permukaan sel khamir yang dapat meningkatkan afinitas, spesifisitas, dan stabilitas dari protein yang diekspresikan (Boder dan Wittrup 1997). Teknik ini juga menarik perhatian para peneliti karena dapat diaplikasikan di berbagai bidang bioteknologi dan industri, seperti imobilisasi enzim, biokonversi, bioremediasi, transduksi sinyal, biosensor, pengembangan vaksin hidup, dan screening untuk mengidentifikasi biokatalis baru (Becker et al. 2004; Ueda dan Tanaka 2000a, b; Won et al. 2006; Yue et al.
2008; Zhu et al. 2006).
Teknik YSD pertama kali dikembangkan menggunakan khamir S.
(Schreuder et al. 1993), namun dalam perkembangannya khamir metilotropik P. pastoris juga dapat digunakan sebagai inang dalam ekspersi pada permukaan sel (Mergler et al. 2004). Kelebihan menggunakan P. pastoris dibandingkan S. cerevisiae sebagai inang, yaitu integrasi DNA transformasi menjadi DNA genomik, pembentukan transforman yang lebih stabil dengan produktivitas protein yang lebih tinggi, dan tidak terjadinya proses hiperglikosilasi (Daly dan Hearn 2005). Hampir seluruh sistem YSD pada P. pastoris didasari pada pengembangan sistem tampilan permukaan pada S. cerevisiae (Mergler et al.
merupakan salah satu protein permukaan pada S. cerevisiae. Mergler et al. (2004) telah mengkonstruksikan enzim Kluyveromyces yellow pada sebagian α-agglutinin ujung C terminal dari S. Cerevisiae, dan mengekspresikannya pada permukaan sel
P. pastoris. Sejak itu, mulai dikembangkan teknik ekspresi protein heterolog pada permukaan sel khamir menggunakan beberapa jenis protein permukaan sebagai jangkar protein, seperti Flo1p (Jiang et al. 2007; Tanino et al. 2006), Pir1 (Wang
et al. 2008; Khasa et al. 2011), sistem Sed1 (Su et al. 2010; Dai et al. 2012) dan
α-agglutinin (Pan et al. 2012), yang semua berasal dari S. cerevisiae telah dikembangkan dan diterapkan pada sistem tampilan permukaan sel P. pastoris.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengkonstruksi dan mengekspresikan gen
araA penyandi enzim L-AI dari G. stearothermophilus pada permukaan sel khamir P. pastoris.
Manfaat Penelitian
2 TINJAUAN PUSTAKA
D-Tagatosa
D-tagatosa termasuk ke dalam monosakarida golongan ketoheksosa (Karabinos, 1952). D-tagatosa merupakan isomer dari D-galaktosa dan sangat jarang ditemukan di alam. Oleh karena itu D-tagatosa termasuk ke dalam golongan gula langka. Secara alami D-tagatosa dapat ditemukan pada getah S. setigera (Hirst et al. 1949). D-tagatosa memiliki struktur kimia yang mirip dengan fruktosa dan telah dikenal sebagai pemanis yang aman digunakan pada bahan pangan dan produk farmasi. Food and Drug Administration Amerika Serikat (US. FDA) telah menetapkan D-tagatosa sebagai komponen Generally Recognized As Safe (GRAS) (Levin 2002).
Gambar 1 Perbandingan struktur molekul tagatosa dan fruktosa (Skytte 2006)
Temperatur leleh (Tm) D-tagatosa berkisar 134oC dan stabil pada pH 2-7. D -tagatosa memiliki kelarutan yang tinggi (58% (w/w) pada suhu 21oC). D-tagatosa merupakan gula reduksi dan akan mengalami reaksi karamelisasi pada temperatur tinggi sehingga akan menghasilkan warna coklat. D-tagatosa lebih mudah terurai pada temperatur tinggi dibandingkan dengan sukrosa (Kim 2004; Levin 2002). D -tagatosa merupakan gula malabsorbing, gula ini dapat diserap dalam jumlah sedikit di usus kecil (Buemann et al. 1999a,b, 2000; Laerke dan Jensen 1999). Fraksi D-tagatosa yang tidak dapat diserap tubuh dapat ditemukan pada usus besar dan difermentasi oleh mikroflora usus (Bertelsen et al. 2001). D-tagatosa memiliki kemiripan rasa dan tingkat kemanisan (92%) dengan gula sukrosa namun tidak menimbulkan cooling effects setelah mengkonsumsinya (Levin et al
1995). Meskipun rasa D-tagatosa mirip dengan sukrosa, D-tagatosa tidak berperan dalam menghasilkan kalori (Levin 2002, Zehner dan Lee 1988).
Tabel 1 Karakteristik fisik dan kimia D-tagatosa (Levin 2002; Skytte 2006) Karakteristik Penjelasan
Nama umum D-tagatosa, tagatosa Sinonim D-lyxo-hexulose
Titik leleh 133-137oC Massa jenis (g/mL) 0.7-0.9
Bentuk fisik Kristal
Nilai kalori < 1.5 Kkal/g
D-tagatosa bermanfaat bagi kesehatan karena berperan dalam penurunan berat badan (Buemann et al. 2000), tidak memiliki efek glikemik (Donner et al. 1999; Seri et al. 1993), dapat mengurangi gejala diabetes tipe 2, hiperglikemia, anemia, dan hemofilia (Levin 2002; Seri et al. 1993). D-tagatosa dapat digunakan sebagai pemanis rendah kalori dalam berbagai makanan, minuman, suplemen kesehatan, obat-obatan, dan pasta gigi, dll. D-tagatosa juga digunakan dalam sintesis senyawa aktif, dan sebagai bahan tambahan dalam detergen, kosmetik, dan formula obat-obatan (Ibrahim dan Spardlin 2000).
D-tagatosa dapat diproduksi dengan metode kimia menggunakan katalis kalsium (Beadle et al. 1991), namun metode kimia memiliki beberapa kelemahan seperti membutuhkan proses purifikasi yang kompleks, menghasilkan limbah kimia dan produk samping. Untuk mengatasi hal tersebut, maka dikembangkan metode produksi D-tagatosa melalui proses biologis dengan menggunakan biokatalis. Pembentukan D-tagatosa secara biologi telah dipelajari menggunakan beberapa sumber biokatalis, seperti enzim sorbitol dehidrogenase yang dihasilkan oleh Arthrobacter globiformis (Izumori et al. 1984), Gluconobacter oxydans
(Manzoni dan Rollini 2001; Rollini dan Manzoni 2005), Mycobacterium smegmatis (Izumori dan Tsuzaki 1988), Klebsiella pneumoniae (Shimonishi et al. 1994) dan Enterobacter agglomerans (Muniruzzanman et al. 1994) yang dapat mengkonversi D-galaktikol menjadi D-tagatosa (Rollini & Manzoni 2005). Selain itu, enzim D-psikosa 3-epimerase dari Agrobacterium tumefaciens (Kim et al. 2006) dan D-tagatosa 3-epimerase yang dihasilkan oleh Pseudomonas cichorii
yang dapat mengkonversi D-sorbosa menjadi D-tagatosa (Itoh et al. 1994; Ishida
et al. 1997; Yoshida et al. 2007). Namun, D-sorbosa dan D-galaktikol merupakan substrat yang mahal sehingga kecil kemungkinan untuk dapat diproduksi pada skala industri.
Mekanisme baru dalam memproduksi D-tagatosa adalah menggunakan mekanisme konversi D-galaktosa menjadi D-tagatosa (Cheetham dan Wootton 1993; Patel et al. 2016). E. agglomerans dapat menghasilkan D-tagatosa dari D -galaktosa ketika ditumbuhkan dalam media terinduksi L-arabinosa (Oh et al. 1998). Berdasarkan studi selajutnya ditemukan enzim L-AI dari mikroorganisme seperti E. coli dan Bacillus subtilis yang dapat mengkatalis konversi D-tagatosa dari D-galaktosa (Roh et al. 2000).
L-Arabinosa Isomerase
dibandingkan dengan D-nukleosida, karena pada penggunaan L-nukleosida dihasilkan aktivitas biologis yang lebih tinggi dan toksisitas yang lebih rendah (Cho et al. 2005).
Gambar 2 Reaksi isomerisasi yang dikatalis enzim L-AI (Lee et al. 2004)
Beberapa mikroorganisme telah diketahui menghasilkan enzim L-AI. Beberapa mikroorganisme mesofilik yang menghasilkan enzim L-AI antara lain
E. coli (Yoon et al. 2003), B. halodurans (Lee et al. 2005a), dan Lactobacillus fermentum (Xu et al. 2011). Selain itu L-AI juga telah diisolasi dari mikroorganisme termofilik seperti G. stearothemophilus (Lee et al. 2005a), G. thermodenitrificans (Kim dan Oh 2005), B. stearothermophilus US100 (Rhimi dan Bejar 2005), B. stearothermophilus IAM11001 (Cheng et al. 2010), B. coagulans (Mei et al. 2016), Alicyclobacillus acidocaldarius (Lee et al. 2005b),
Anoxybacillus flavithermus (Li et al. 2011), Thermus sp. IM6501 (Kim, 2003),
Acidothermus cellulolytics (Cheng et al. 2010), Thermoanaerobacter mathranii
(Jørgensen et al. 2004), dan Enterococcus faecium (Manzo et al. 2015), dan pada mikroorganisme hipertermofilik seperti Thermotoga neapolitana (Kim et al. 2002), dan T. maritima (Lee et al. 2004; Bortone dan Fidaleo 2015).
Sebagian besar L-AI aktif dan optimal pada temperatur 60-96oC dan pH lebih dari 7; hanya L-AI yang berasal dari L. sakei23K yang menunjukkan aktivitas optimum pada temperatur rendah berkisar 30-40oC dan kisaran pH 5-7. Selain itu, hampir semua karakteristik L-AI memerlukan ion logam bivalen seperti Mn2+ atau Co2+ sebagai kofaktor untuk stabilitas dan aktivitas yang lebih tinggi (Lee et al. 2005b). Namun, untuk memproduksi bahan pangan penggunaan kofaktor Co2+ tidak direkomendasikan karena menimbulkan bahaya kesehatan (Jørgensen et al. 2004). Beberapa kofaktor lain yang dapat meningkatkan aktivitas katalis dan stabilitas enzim L-AI antara lain ion Fe2+, Mg2+ dan Ca2+ (Oh 2007; Kim dan Oh 2005). Aktivitas enzim L-AI akan menurun jika tidak ada ion logam sebagai kofaktor (Lee et al. 2005a)
Enzim L-AI disandikan oleh gen araA yang terletak pada kompleks gen L -arabinosa. Gen araA terdiri dari 1494-1535 pasang basa (pb). Jumlah pb yang dimiliki gen araA tergantung dari mikroorganisme yang menghasilkannya. Gen
araA yang dimikili G. stearothermophilus strain lokal adalah 1512 pb (Firiani dan Saksono 2010). Enzim L-AI yang diekspresikan oleh mikroorganisme B. stearothermophilus US 100, G. stearothermophilus dan G. thermodenitrificans
L-AI terdiri dari 4 (tetramer) struktur sekunder yang berbentuk alfa-heliks, namun
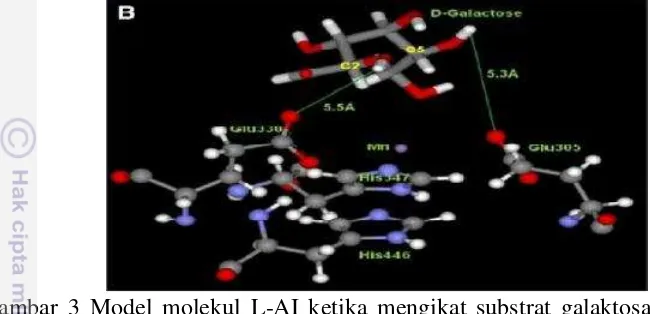
L-AI yang dihasilkan oleh E. coli terdiri dari heksamer. Asam amino yang berada pada sisi aktif L-AI adalah asam glutamat pada posisi 305 dan 330 yang akan mengikat substrat arabinosa maupun galaktosa untuk dikatalis menjadi produk. Struktur L-AI pada saat mengikat substrat galaktosa dapat dilihat pada gambar 3 dibawah ini.
Gambar 3 Model molekul L-AI ketika mengikat substrat galaktosa (Kim et al. 2009)
Sistem Ekspresi P. pastoris
Dalam pengembangan industri bioproses, pemilihan inang mikroorganisme yang sesuai merupakan hal yang paling penting. Beberapa parameter yang harus dipertimbangkan dalam memilih inang mikroorganisme antara lain harus aman, mudah diperoleh, memiliki produktivitas yang tinggi, menghasilkan sedikit produk samping, dapat tumbuh dalam media yang sederhana, dapat tumbuh dalam kondisi yang moderat dan memungkinkan untuk peningkatan skala produksi (Kirk dan Othmer 1994; Soetaert dan Vandamme 2010).
Salah satu sel inang yang paling populer digunakan untuk ekspresi protein rekombinan yang merupakan turunan dari genom eukariotik adalah khamir metilotropik P. pastoris (Eckart dan Bussineau 1996). P. pastoris merupakan khamir metilotropik yang memanfaatkan metanol sebagai sumber karbon tunggal dan pertama kali dilaporkan oleh Ogata et al. (1969). P. pastoris diketahui berpotensi sebagai penghasil protein sel tunggal (PST) untuk pakan ternak. Pada tahun 1970, Philips Petroleum Company mengembangkan metode pertumbuhan dan komposisi media untuk P. pastoris dan diketahui bahwa pertumbuhan P. pastoris pada media metanol kultur kontinu mencapai kepadatan sel tertinggi berkisar > 130 g/L berat sel kering (Wegner 1990). Setelah itu di tahun 1980-an,
Philips Petroleum Company and Salk Institute Biotechnology/Industrial Associates Inc. (SIBIA, La Jolla, CA) mulai mempelajari P. pastoris sebagai sistem ekspresi untuk produksi protein heterolog (Cereghino dan Cregg, 2000).
glikolisasi, pembentukan ikatan disulfida, dan proses sproteolitik, (4) ketersediaan sistem ekspresi sebagai kit komersial, (5) dapat hidup pada media yang sederhana (6) memiliki promotor yang sangat kuat yaitu alkohol oksidase 1 (PAOX1) sehingga
tingkat ekspresinya tinggi dan dapat menginduksi hingga 1000 kali lipat ketika sumber karbon diubah menjadi metanol, (7) penggunaan metanol dapat mengurangi kontaminasi bakteri, (8) kemampuannya untuk tumbuh hingga diperoleh kepadatan sel yang tinggi mencapai 10 kali lipat dibandingkan dengan kultur S. cerevisiae sehingga memungkinkan untuk diproduksi dalam skala besar, dan (9) mensekresikan sangat sedikit protein native sehingga mempermudah proses purifikasi protein rekombinan yang disekresikan (Cereghino dan Cregg 2000). Sudah lebih dari 700 protein telah diekspresikan menggunakan P. pastoris
(Zhang et al. 2009), diantaranya adalah enzim Lipase B yang dihasilkan oleh
Candida antartica (Moura et al. 2015), Lipase dari Rhizopus orizae (Li et al. 2015), serta protein mPmRab7 dab pVP28 yang merupakan protein pertahanan dari White Spot Syndrome Virus (WSS) pada udang (Ananphongmanee et al. 2015).
Ada tiga fenotipe P. pastoris yang dapat memanfaatkan metanol. Pertama, Mut+ atau methanol utilization plus phenotype yang mempunyai gen AOX1 dan
AOX2, tumbuh dalam metanol pada tingkat tipe liar dan karena itu membutuhkan metanol dalam jumlah banyak pada saat kultivasi skala besar (Cereghino dan Cregg 2000). Kedua, Muts atau methanol utilization slow phenotype, gen AOX1
dihilangkan sehingga tingkat penyerapan metanol melambat karena AOX2 lemah. Pada kasus yang sama strain Muts mempunyai produktivitas yang tinggi dibandingkan dengan strain tipe liar (Cregg et al. 1987; Pal et al. 2006). Yang ketiga Mut- atau methanol-utilising minus phenotype, dimana kedua gen AOX
dihilangkan sehingga tidak dapat tumbuh pada metanol dan memiliki tingkat pertumbuhan yang rendah (Macauley-Patrick et al. 2005). Ekspresi protein rekombinan sebagian besar dilakukan menggunakan strain fenotip Mut+ (Macauley-Patrick et al. 2005).
Promotor yang biasa digunakan dalam sistem ekspresi protein rekombinan pada P. pastoris adalah promotor alkohol oksidase 1 (PAOX1) (Cereghino dan
Cregg 2000, Bushell et al. 2003, Lee et al. 2003, Macauley-Patrick et al. 2005, Jahic et al. 2006, Potvin et al. 2010). PAOX1 akan ditekan/direpresi ketika P. pastoris tumbuh dalam medium yang mengandung glukosa atau gliserol, tapi akan terinduksi kuat hingga 1000 kali lipat ketika sel ditumbuhkan pada media yang mengandung metanol. Kemampuan menekan ekspresi protein asing akan bermanfaat ketika protein yang dihasilkan merupakan racun bagi sel (Cereghino et al. 2002). Enzim alkohol oksidase membuat hingga 33% dari total protein sel ketika sel ditumbuhkan pada media metanol (Couderec dan Baretti 1980).
Sistem Tampilan Permukaan Khamir (Yeast Surface Display/YSD)
pertukaran molekul, transpor protein dan sebagainya (Shibasaki et al. 2009) Beberapa protein permukaan diperpanjang melintasi membran plasma dan yang lainnya terikat oleh interaksi kovalen maupun nonkovalen dengan komponen permukaan sel. Sel memiliki sistem untuk menahan protein permukaan spesifik dan untuk membatasi protein permukaan domain tertentu pada permukaan sel. Di bidang bioteknologi, permukaan sel dapat dimanfaatkan dengan memanfaatkan mekanisme transpor protein ke permukaan sel. Pembentukan sistem untuk menampilkan protein heterolog pada permukaan sel mikrooraganisme diharapkan dapat digunakan dalam pemisahan polipeptida yang dihasilkan; memproduksi katalis mikroba, dan vaksin hidup, dan screening dan modifikasi protein baru. Pemanfaatan permukaan sel hidup sangat berguna untuk aplikasi dalam bidang mikrobiologi dan biologi molekuler (Ueda dan Tanaka 2000a, b).
Sistem ekspresi permukaan awalnya diketahui ketika sebuah penelitian menunjukkan bahwa peptida dapat berfusi dengan protein docking (PIII) dari filament fage tanpa mempengaruhi kemampuannya untuk menginfeksi E. coli
(Scott dan Smith 1990). Hal ini menyebabkan pengembangan terhadap sistem tampilan fage (Chiswell dan McCafferty 1992; Wu et al. 2016; Tan et al. 2016). Namun, hibridisasi polipeptida yang berukuran lebih besar dan menyatu dengan mantel protein fage membuatnya tidak mudah untuk dimasukkan ke dalam fage, akhirnya muncul teknologi baru yang menggunakan bakteri sebagai inang untuk ekspresi protein heterolog (Georgiou et al. 1997; Little et al. 1993; Ko et al. 2015; Michon et al. 2016). Bakteri gram negatif seperti E. coli yang memiliki membran luar pada permukaan selnya telah digunakan untuk ekspresi sejumlah protein heterolog pada permukaan sel. Selain itu bakteri gram positif dalam kelompok
Staphylococcus telah digunakan sebagai inang sistem tampilan permukaan (Francisco et al. 1993). Meskipun beragam mikroorganisme telah diteliti, namun untuk menampilkan ekspresi protein heterolog yang berasal dari organisme eukariot sangat sulit dilakukan di sel bakteri (Shibasaki et al. 2009) sehingga dikembangkan teknik baru menggunakan khamir sebagai inang untuk ekspresi protein heterolog.
Sistem ekspresi YSD merupakan teknik yang paling populer digunakan diantara berbagai sistem ekspresi protein heterolog yang telah dikembangkan (Kondo dan Ueda 2004; Liu et al. 2015; Tanaka dan Kondo, 2015). Sistem ekspresi ini merupakan salah satu metode ekspresi protein fungsional yang kuat dan dapat digunakan untuk meningkatkan afinitas, spesifisitas dan stabilitas protein yang diekspresikan (Boder dan Wittrup 1997). Kelebihan utama dari sistem ekspresi tampilan permukaan sel khamir adalah pada kesamaan mekanisme pelipatan dan sekresi protein dengan sel mamalia. Pada sistem ini protein rekombinan diekspresikan pada permukaan sel khamir dalam bentuk fusi dengan protein permukaan yang bertindak sebagai jangkar protein (anchoring protein) (Kondo dan Ueda 2004). Sistem ekspresi pada pemukaan sel khamir pertama kali dikembangkan menggunakan S. cerevisiae (Screuder et al. 1993). S. cerevisiae
telah memiliki status GRAS yang menyatakan khamir ini aman digunakan untuk aplikasi di bidang pangan dan farmasi (Kondo dan Ueda 2004)
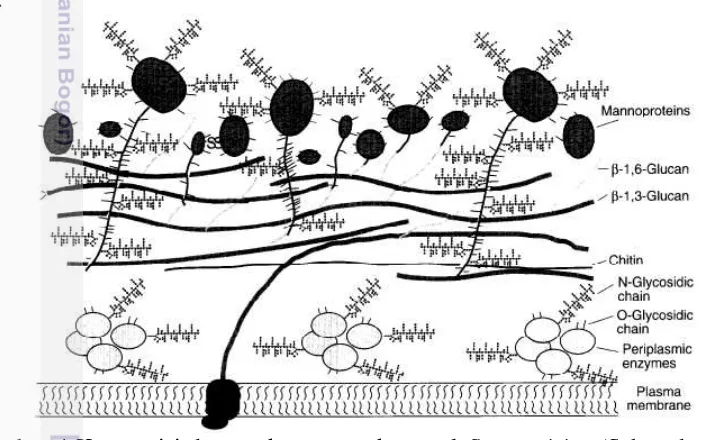
menguntungkan karena sel ini dapat tumbuh hingga diperoleh kepadatan sel yang tinggi pada media yang sederhana. Ditambah lagi khamir memiliki kemampuan untuk menampilkan protein eukariot yang berbeda beda pada permukaan sel yang sama (Shibasaki et al. 2009). Sel khamir S. cerevisiae dikelilingi oleh dinding sel yang tebal (Gambar 4) yang terdiri dari rantai β-glukan dan mannoprotein (Fleet, 1991). Dinding sel khamir terdiri dari lapisan glukan pada bagian dalam yang tersusun atas rantai β-glukan (β-1,3-glukosa dan β1,6-glukosa) (Manners et al. 1973). Dan pada lapisan luar sebagian besar tersusun atas mannoprotein yang berbentuk fibri atau sisir (Horisberger dan Vonlanthen 1977). Ada berbagai jenis mannoprotein pada dinding sel (Cid et al. 1995). Salah satu jenis mannoprotein yang ada pada dinding sel khamir adalah yang beikatan secara non-kovalen dengan dinding sel dan dapat diekstraksi dengan sodium dodecyl sulfate (SDS), sedangkan jenis lainnya dapat diekstraksi dengan digesti dinding sel
menggunakan β-1,3- atau β-1,6- glukanase (Fleet dan Manners 1997; Nakayama
et al. 2005).
Mannoprotein yang dapat diekstrak menggunakan glukanase pada permukaan khamir, antara lain agglutinin (Aga1 dan Aga2), Flo1, Sed1, Cwp1 dan Tip1 yang memiliki jangkar glycosylphosphatidylinositol (GPI) yang tersusun atas ethanolamine phosphate-phosphate-6-mannose-α1,2-mannose-α
1,6-mannose-α1,4-glucosamine-α1,6-myo-inositol-1-phospholipid (Hardwick et al. 1992; Lipke et al. 1989;Van der Vaart et al. 1995; Watari et al. 1994; Roy et al. 1991). Jangkar GPI ditemukan pada banyak protein membran plasma organisme eukariot, banyak berperan pada protein permukaan sel dan esensial untuk viabilitas khamir. Rantai glukofosfolipid ini berikatan kovalen dengan protein C-terminal dan mempunyai fungsi utama dalam asosiasi protein dengan membran sel.
Gambar 4 Komposisi dan struktur permukaan sel S. cerevisiae (Schreuder et al. 1996)
komponen dinding sel yang terletak pada permukaan terluar dan berperan dalam mediasi adhesi sel pada saat reproduksi seksual antara tipe mating sel yang berbeda. Selama mating, satu dari dua tipe agglutinin diekspresikan ke permukaan sel. Tipe mating a dan α masing-masing mengekspresikan a-agglutinin dan α -agglutinin. Protein a-agglutinin terdiri atas subunit Aga1p yang menghubungkan ke Aga2p dan merupakan subunit yang lebih kecil melalui ikatan disulfida. Aga1p dikode oleh gen AGα1 dan Aga2p dikode oleh gen AGα2. Sedangkan α-agglutinin dikode oleh gen AGα1, dan berinteraksi dengan subunit Aga2p pada tipe sel
mating a. Struktur dari α-agglutinin dan subunit Aga1p tersusun atas daerah sinyal sekresi, daerah aktif, dan daerah pendukung yang mengandung serin dan treonin, dan jangkar GPI (Lipke et al. 1989). Domain yang mengandung serin dan treonin berperan sebagai spacer yang membentuk konformasi seperti batang yang merupakan hasil perluasan O-glikosilasi (Schreuder et al. 1996). Untuk menampilkan protein asing pada dinding sel, diperlukan informasi genetik dari masing-masing tipe agglutinin. Tipe α-agglutinin merupakan jangkar penahan pada permukaan sel dan sering dikombinasikan dengan sekuen sinyal sekresi melalui rekayasa genetika (Gambar 5). Fusi pada setengah bagian C-terminal α -agglutinin digunakan sebagai jangkar penahan protein asing pada permukaan sel. Dalam kasus a-agglutinin, tipe protein sekresi Aga2, subunit berikatan dengan ikatan disulfida pada protein inti Aga1, sehingga protein heterolog akan berikatan dengan lapisan glukan (Boder dan Wittrup 1997).
3 METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan November 2014 sampai dengan Juli 2016 di Laboratorium Rekayasa Genetika Terapan dan Disain Protein, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong.
Bahan
Bahan yang digunakan dalam penelitian ini adalah gen araA penyandi enzim L-AI yang diperoleh dari isolasi bakteri G. sterothermophylus di Tanjung Api, Poso, Indonesia (Fitriani dan Saksono 2010). Vektor pJ912-AGα IP-Free, E. coli DH5α, P. pastoris GS115, enzim restriksi SalI, Kpn2I, NcoI, dan SacI, media tumbuh bakteri LSLB (Low Salt Luria Bertani), media tumbuh khamir YPD (Yeast Potato Dextrose), BMGY (Buffered Glycerol Complex Medium), dan BMMY (Buffered Methanol Complex Medium), antibiotik ampisilin dan zeocin, primer spesifik untuk proses subkloning maupun sekuensing.
Tabel 2 Primer yang digunakan
Primer Sekuen nukleotida (5' → 3')
PPAI-F 5'-GCGTCGACATGCATCACCATCACCATCACATGCTGTC ATTACGTCCTTATGAATTTTGG-3'
PPAI-R 5'-GTCACAGTACTCCGCCCCCGCCAAAATACTTCATTCC ATC-3'
SeqPPAI-F 5'-CCTTGAGGGTGATTTCGACGTC-3' SeqPPAI-R 5'-GACCTCGGAAGTAGTTCTGTTTCC-3' AOX1-F 5' GACTGGTTCCAATTGACAAGC 3' AOX1-R 5' GCAAATGGCATTCTGACATCC 3' Desain primer menggunakan software online Primer3Plus
Prosedur Penelitian
Konstruksi vektor ekspresi dan sub-kloning
Pada penelitian sebelumnya telah diperoleh gen araA yang mengkode enzim
L-AI yang diisolasi dari isolat G. stearothermophilus asal Tanjung Api, Poso, Indonesia, dan telah dikloning dalam plasmid pET-21b serta digunakan untuk transformasi E.coli DH5α.
Sub-kloning gen araA ke dalam plasmid pJ912-AGα diawali dengan proses amplifikasi gen araA pada plasmid pET-21b. Gen araA diamplifikasi menggunakan pasangan primer PPAI-F dan PPAI-R. Pada gen araA ditambahkan
tag His dan situs restriksi SalI pada ujung 5' serta situs restriksi Kpn2I pada ujung 3'. Gen araA hasil amplifikasi dan plasmid pJ912-AGα kemudian dipotong dengan enzim restriksi SalI dan Kpn2I. Fragmen araA dan plasmid pJ912-AGα yang telah dipotong selanjutnya dielektroforesis pada gel agarosa 1%. Kedua komponen tersebut kemudian diekstraksi dari gel agarosa menggunakan MinElute Gel Extraction Kit (Qiagen). Hasil ekstraksi kemudian diverifikasi dengan elektroforesis gel agarosa 1%. Ligasi antara gen araA dan plasmid pJ912-AGα dilakukan menurut protokol umum biologi molekuler (Ausubel et al. 2002). Hasil ligasi kemudian digunakan untuk transformasi E.coli DH5α menggunakan metode kejut panas (heat shock) dan ditumbuhkan pada media seleksi LSLB agar yang mengandung antibiotik zeocin (25µg/mL). Zeocin dipilih karena vektor
pJ912-AGα membawa faktor resisten terhadap antibiotik zeocin.
Gambar 7 Konstruksi vektor PJ912-AGα-araA
Analisis vektor rekombinan dapat dilakukan dengan isolasi plasmid rekombinan dari sel E.coli DH5α yang tumbuh pada media seleksi yang mengandung zeocin (25µg/mL), PCR vektor rekombinan, dan analisis sekuen basa DNA.
Pembuatan sel kompeten Pichia pastoris
diresuspensi dengan 2 mL sorbitol 1M. Kultur kembali disentrifugasi dan selanjutnya pelet diresuspensi menggunakan sorbitol 1M sebanyak 1 mL. Sel kompeten P. pastoris GS115 dapat disimpan dalam kondisi beku sebelum digunakan.
Transformasi P. pastoris melalui elektroporasi
Sebanyak 5-10 μg vektor rekombinan pJ912-AGα-araA dilinearisasi dengan cara dipotong menggunakan enzim restriksi SacI. Hasil pemotongan diverifikasi dengan elektroforesis gel agarosa 1%. Vektor rekombinan yang telah dipotong dipurifikasi menggunakan MinElute Gel Extraction Kit (Qiagen). Transformasi P. pastoris dilakukan dengan metoda elektroporasi.
Sebanyak 80 µL sel kompeten dan 5-10 µg DNA linier (dalam 5-10 μL air steril) dimasukkan dalam kuvet elektroporasi steril (2 mm gap) kemudian diinkubasi dalam es selama 5 menit. Selanjutnya elektroporasi dilakukan menggunakan elektroporator (Gene Pulser BioRad, USA). Kondisi elektroporasi adalah kondisi optimal yang disarankan oleh produsen alat (Biorad, USA), yaitu
2000 V, 25 μF, 200 Ω, dan 5 msec. Segera setelah elektroporasi dilakukan, ditambahkan 1 mL sorbitol 1M ke dalam kuvet, dan isi kuvet kemudian dipindahkan ke tube 1.5 mL steril untuk selanjutnya diinkubasi pada temperatur 30oC selama 1-2 jam. Hasil elektroporasi disebar pada cawan media YPDS agar yang mengandung 100 µg/mL zeocin dengan volume beragam pada setiap cawan
(25, 50 dan 100 μL). Cawan diinkubasikan selama 3-10 hari pada temperatur 30oC sampai koloni tumbuh (Invitrogen 2001)
Seleksi koloni P. pastoris transforman
Analisis integrasi gen araA ke dalam genom P. pastoris dilakukan menggunakan teknik PCR koloni. Sebelum dilakukan PCR, koloni khamir rekombinan diberi perlakuan terlebih dahulu. Koloni khamir dicuplik dengan
tusuk gigi steril dan diresuspensikan ke dalam 50 μL NaOH 0.04M. Suspensi
tersebut diinkubasi selama ≥ 5 menit pada temperatur 37°C. Suspensi ini digunakan sebagai sumber DNA dan pasangan primer PPAI-F dan PPAI-R digunakan pada proses PCR. Kondisi PCR yang digunakan adalah 40 siklus dengan kondisi denaturasi pada temperatur 95°C selama 30 detik, penempelan primer pada temperatur 56°C selama 30 detik dan perpanjangan pada temperatur 72°C selama 1 menit. Sebelum siklus PCR, dilakukan denaturasi awal selama 8 menit pada temperatur 95°C dan perpanjangan akhir selama 5 menit pada temperatur 72°C pada akhir siklus.
Ekspresi protein rekombinan
Koloni P. pastoris rekombinan ditumbuhkan pada media agar miring YPD
dengan zeocin 100 μg/mL, kemudian dilakukan uji ekspresi protein rekombinan.
Uji ekspresi protein rekombinan mengikuti prosedur pada manual EasySelectTM Pichia Expression Kit (Invitrogen, 2001). Sebanyak 1 ose koloni P. pastoris
cair YPD tanpa zeocin. Biakan selanjutnya diinkubasi selama 48 jam pada temperatur 30°C dengan agitasi 250 rpm. Biakan yang tumbuh selanjutnya dipindahkan ke 5 mL media BMGY. Biakan selanjutnya diinkubasi selama 24 jam pada inkubator bergoyang dengan temperatur 30oC dan kecepatan 250 rpm. Sel khamir dipanen dari media BMGY dengan cara disentrifugasi pada temperatur 4°C dengan kecepatan 3000×g selama 7 menit. Biomassa sel diresuspensi dalam 5 mL media induksi BMMY. Suspensi sel dipindahkan ke dalam 25 mL BMMY baru dengan OD600 awal= 1. Metanol dengan konsentrasi akhir 0.5% (v/v) ditambahkan ke dalam media induksi BMMY setiap 12 jam selama 3 hari untuk menginduksi ekspresi protein rekombinan. Biakan diinkubasi pada temperatur 30°C, dengan kecepatan 250 rpm. Pengambilan contoh untuk analisis dilakukan setiap jam ke-24, 48, dan 72 setelah waktu induksi pertama dan densitas sel (OD600) diukur. Biakan dipanen dengan cara sentrifugasi pada temperatur 4°C, dengan kecepatan 3000×g selama 10 menit.
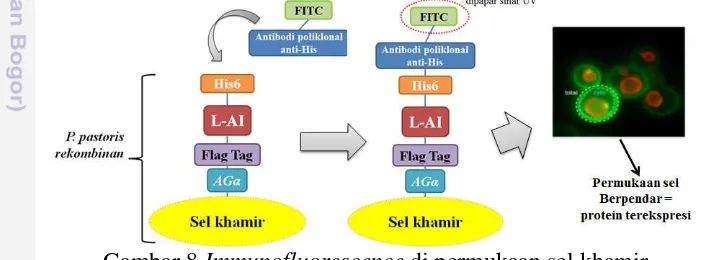
Analisis ekspresi protein rekombinan dengan Immunofluoresence
Sebanyak 10 μL kultur sel (2×109 sel/mL) dicuci dengan 500 μL bufer TBS (50 mM Tris-HCl, 150 mM NaCl [pH7.5]) dan disentrifugasi selama 3 menit pada temperatur4oC dan kecepatan 5000×g. Selanjutnya pelet diresuspensi dalam 300
μL bufer TBS dan kemudian ditambahkan 3 μg FITC-conjugated rabbit polyclonal antibody to His6 (Abcam). Suspensi lalu diinkubasi selama 2 jam pada temperatur ruang di inkubator bergoyang dengan kecepatan 100 rpm. Sel kemudian dicuci dengan 200 μL TBST 0.1% dan setelahnya diresuspensi dalam
300 μL bufer TBS (Berlec et al. 2011). Sel diamati di bawah mikroskop
fluoresence Zeiss Axio Imager.Z2 (Zeiss Axio, Jerman) menggunakan filter FITC.
Gambar 8 Immunofluorescence di permukaan sel khamir
Ekstraksi protein rekombinan dari dinding sel P. Pastoris
hemiselulase, dan β-glukosidase. Selulase kompleks tersebut yang dapat memutus
ikatan glikosidik pada rantai β-glukan di dinding sel khamir, sehingga protein rekombinan dapat terpisah dari sel. Inkubasi dilakukan selama 4 jam pada temperatur 37°C. Suspensi sel dan enzim kemudian disentrifugasi pada kecepatan 15,000×g selama 10 menit. Selanjutnya bagian supernatan dipipet untuk dipisahkan dari debris sel. Bagian supernatan merupakan bagian yang mengandung protein target. Sampel protein kemudian dianalisis dengan SDS PAGE.
Gambar 9 Pemotongan rantai β-glukan oleh selulase kompleks
Analisis ekspresi protein dengan SDS-PAGE (Sodium Dodecyl Sulphate Polyacrylamide Gel Electrophoresis)
Protein rekombinan yang diekspresikan dianalisis menggunakan SDS-PAGE. Sampel yang dianalisis merupakan supernatan yang telah dipresitasi sebelumnya menggunakan larutan aseton absolut.
Prosedur SDS-PAGE dilakukan sesuai metode Ausubel et al. (2002) dengan pewarnaan coomasie blue. SDS-PAGE dimulai dengan pembuatan gel poliakrilamid. Pembutan gel poliakrilamid dilakukan dengan dua tahap yaitu pembuatan gel stacking dan gel separating. Gel separating dibuat dengan konsentrasi 15% sedangkan gel stacking dibuat dengan konsentrasi 8% (Lampiran 5). Larutan dihomogenkan kemudian dicetak pada kaca elektroforesis hingga menjadi gel. Langkah selanjutnya adalah memasukkan sampel yang telah ditambahkan dengan bufer Laemmli (Tris HCl, bromopenol biru, gliserol, dan SDS) dan telah didenaturasi pada temperature 100oC selama 5 menit ke dalam sumur gel. Pemisahan dilakukan dengan tegangan 90 volt selama 2.5 jam. Protein yang telah terpisah dalam gel kemudian diwarnai menggunakan coomasie blue
selama satu malam, dilanjutkan dengan destaining menggunakan akuadestilata selama 1 jam. Gel poliakrilamid kemudian divisualisasi dengan kamera.
Analisis ekspresi protein permukaaan dengan manik magnet
Analisis ini menggunakan interaksi antara manik magnet Pure ProteomeTM
magnetic stand agar manik magnet terkumpul dan bufer dapat dibuang dengan cara dipipet. Selanjutnya, manik magnet diresuspensi dengan 100 μL bufer
binding dan diinkubasi selama 1 menit di temperatur ruang. Untuk menghilangkan cairan bufer binding, tube diletakkan pada magnetic stand dan bufer dibuang dengan cara dipipet. Proses pembersihan ini dilakukan sebanyak dua kali. Setelah manik magnet bersih, 20 μL manik magnet dicampurkan dengan 20 μL sel P. pastoris transforman dan diinkubasi dengan agitasi rendah selama 1 jam pada temperatur ruang. Sel P. pastoris transforman yang digunakan dalam proses ini merupakan sel yang telah diinduksi dengan metanol dan telah dibersihkan dengan bufer A yang mengandung 1 mM PMSF sebanyak tiga kali. Untuk memisahkan manik magnet dan suspensi sel yang tidak terikat dari manik magnet, tube diletakkan pada magnetic stand dan suspensi sel dipipet keluar. Selanjutnya, manik magnet diresuspensi dengan 100 μL bufer binding dan diinkubasi selama 1 menit di temperatur ruang. Proses ini dilakukan untuk membersihkan manik magnet dari sel yang tidak terikat dan dilakukan sebanyak tiga kali. Manik magnet disuspensi dengan 20 μL bufer TBS dan diamati di bawah Zeiss Axio Imager.Z2 (Zeiss, Jerman).
4 HASIL DAN PEMBAHASAN
Subkloning Gen araA ke dalam Vektor Ekspresi
Gen araA yang digunakan dalam penelitian ini merupakan penyandi enzim
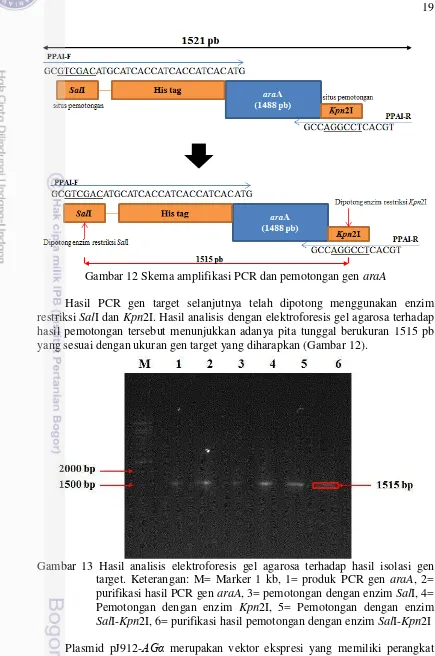
L-AI berasal dari isolat G. stearothermophilus yang diisolasi dari Tanjung Api, Poso, Indonesia. Enzim L-AI dapat mengisomerisasi D-galaktosa menjadi D -tagatosa. Sebagai gula rendah kalori, D-tagatosa dapat digunakan sebagai pemanis pengganti sukrosa. Secara umum proses isomerisasi berjalan pada temperatur tinggi, oleh kerena itu digunakan gen penyandi L-AI yang berasal dari bakteri termofilik G. stearothermophilus. Isomerisasi pada temperatur tinggi memiliki beberapa kelebihan, yaitu hasil atau produk konversi yang lebih tinggi, laju reaksi cepat, dan viskositas substrat rendah (Liu et al. 1996). Pada studi sebelumnya, L -AI yang berasal dari G. stearothermophilus (GSAI) sangat sesuai untuk memproduksi D-tagatosa pada skala besar karena memiliki tingkat konversi D -tagatosa yang tinggi (Kim et al. 2003; Ryu et al. 2003). Gen araA dari G. stearothermophilus sebelumnya telah diisolasi dan diklon di dalam plasmid pET-21b. Hasil isolasi plasmid pET21b yang mengandung gen araA dapat dilihat pada Gambar 11. Isolasi gen araA selanjutnya telah dilakukan dengan teknik PCR, yaitu dengan mengamplifikasi gen araA pada pET-21b-araA menggunakan pasangan susunan primer spesifik PPAI-F dan PPAI-R (Gambar 12).
Gambar 11 Hasil isolasi plasmid pET-21b-araA
Gambar 12 Skema amplifikasi PCR dan pemotongan gen araA
Hasil PCR gen target selanjutnya telah dipotong menggunakan enzim restriksi SalI dan Kpn2I. Hasil analisis dengan elektroforesis gel agarosa terhadap hasil pemotongan tersebut menunjukkan adanya pita tunggal berukuran 1515 pb yang sesuai dengan ukuran gen target yang diharapkan (Gambar 12).
Gambar 13 Hasil analisis elektroforesis gel agarosa terhadap hasil isolasi gen target. Keterangan: M= Marker 1 kb, 1= produk PCR gen araA, 2= purifikasi hasil PCR gen araA, 3= pemotongan dengan enzim SalI, 4= Pemotongan dengan enzim Kpn2I, 5= Pemotongan dengan enzim
SalI-Kpn2I, 6= purifikasi hasil pemotongan dengan enzim SalI-Kpn2I
keluar sel, gen She ble sebagai gen penyandi resisten terhadap antibiotik zeocin yang digunakan sebagai marker selektif untuk transforman, pUC ORI sebagai titik awal replikasi pada E.coli, dan gen AGα1 yang merupakan gen penyandi ujung C dari α-agglutinin yang berfungsi sebagai protein penahan pada permukaan sel khamir.
Gambar 14 Skema pemotongan plasmid pJ912-AGα dengan enzim restriksi SalI dan Kpn2I
Plasmid pJ912-AGα telah diperbanyak di dalam sel E. coli DH5α dan diperoleh dengan cara isolasi menggunakan QIAprep Spin Miniprep KIT
(Qiagen). Plasmid hasil isolasi tersebut kemudian dipotong menggunakan enzim restriksi SalI dan Kpn2I. Hasil pemotongan dianalisis dengan elektroforesis gel agarosa dan menunjukkan adanya pita berukuran 4813 pb dan 750 pb sesuai dengan ukuran plasmid linier teoritis (Gambar 15).
Gambar 15 Visualisasi hasil isolasi plasmid pJ912-AGα dan pemotongan menggunakan enzim restriksi. Keterangan : M= Marker 1 kb, 1= hasil isolasi plasmid pJ912-AGα, 2= pJ912-AGα dipotong dengan enzim SalI, 3= pJ912-AGα dipotong dengan enzim SalI dan dipurifikasi, 4= pJ912-AGα dipotong dengan enzim Kpn2I, 5= pJ912-AGα dipotong dengan enzim Kpn2I dan dipurifikasi, 6= pJ912-AGα dipotong dengan enzim SalI-Kpn2I.
Gambar 16 Vektor rekombinan pJ912-AGα-araA
Selanjutnya vektor rekombinan telah diintroduksikan kedalam E.coli DH5α dengan metode kejut panas (heat shock) dan telah ditumbuhkan dalam media seleksi LSLB agar yang mengandung antibiotik zeocin 25 μg/mL. Banyak faktor yang mempengaruhi efisiensi transformasi, diantaranya kondisi inkubasi, konsentrasi vektor rekombinan, kondisi relatif sel kompeten dan kehadiran DNA kontaminan (Classen et al. 2002). Dari hasil transformasi diperoleh sebanyak 25 koloni yang diduga membawa vektor rekombinan (Gambar 17).
Gambar 17 Koloni hasil transformasi pada E. coli DH5α. Keterangan: A=
pJ912-AGα, B= pJ912-AGα-araA, C= sel kompeten E. coli DH5α pada medium dengan zeocin, D= sel kompeten E. coli DH5α pada medium tanpa zeocin
Gambar 18 Hasil isolasi vektor rekombinan pJ912-AGα-araA. Keterangan: M= Marker 1 kb, 1 dan 2= vektor rekombinan pJ912-AGα-araA
PCR vektor digunakan untuk memastikan keberadaan sisipan gen di dalam vektor pJ912-AGα. PCR vektor rekombinan dilakukan menggunakan pasangan primer AOX1-F dan AOX1-R (Gambar 19).
Gambar 19 Skema amplifikasi PCR vektor rekombinan pJ912-AGα-araA
menggunakan primer AOX-F dan AOX-R
atau panjang nukleotida yang menggantung yang mungkin menjadi faktor dalam ligasi oleh T4 DNA ligase. Bola (2005) menyatakan bahwa ujung kohesif yang kaya nukleotida G-C memiliki efisiensi ligasi lebih tinggi jika dibandingkan dengan ujung kohesif lainnya. Efisiensi ligasi ujung kohesif yang mengandung nukleotida A, T, G, C akan lebih tinggi jika memiliki ujung yang menggantung lebih panjang dibandingkan ujung kohesif dengan nukleotida yang menggantung sedikit. Ujung kohesif kaya nuleotida A-T akan memiliki efisiensi ligasi yang lebih rendah.
Gambar 20 Hasil amplifikasi vektor rekombinan pJ912-AGα-araA dengan menggunakan primer AOX-F dan AOX-R. Keterangan: M= Marker
O‟gene ruler 1 kb plus, 1-3= sampel plasmid transforman, 4= pET-21b-araA, dan 5= ddH2O
Hasil analisis restriksi dengan digesti tunggal maupun digesti ganda menggunakan enzim rekstriksi SalI dan NcoI (Gambar 22) dilakukan untuk memastikan keberadaan sisipan gen araA pada vektor rekombinan. Hasil digesti tunggal menggunakan enzim SalI dan NcoI menunjukkan pita tunggal yang berukuran sekitar 6334 pb, dan hasil digesti ganda menggunakan kedua enzim tersebut menghasilkan dua pita yang berukuran masing-masing 3412 pb dan 2922 pb. Hal itu sesuai dengan ukuran plasmid rekombinan yang diharapkan (Gambar 21).
Gambar 21 Skema pemotongan vektor rekombinan pJ912-AGα-araA dengan enzim restriksi SalI dan NcoI
polymerase pada saat replikasi DNA didapatkan karena adanya proses pemeriksaan secara akurat setiap nukleotida yang disintesis.
Gambar 22 Hasil analisis restriksi pJ912-AGα-araA. Keterangan: M= Marker
O‟gene ruler 1 kb plus, 2= pJ912-AGα-araA dipotong dengan enzim
SalI-NcoI, 3= pJ912-AGα-araA dipotong dengan enzim SalI, 3= pJ912-AGα-araA dipotong dengan enzim NcoI, dan 4= pJ912-AGα -araA tidak dipotong
Introduksi P. pastoris dengan Vektor Rekombinan
P. pastoris yang digunakan dalam proses transformasi ini adalah P. pastoris
GS115 yang memiliki genotip his4 serta fenotip Mut+. Konstruksi plasmid rekombinan pJ912-AGα-araA telah berhasil diintroduksikan ke dalam genom P. pastoris GS115. Vektor rekombinan menyisip ke dalam genom P. pastoris
melalui mekanisme rekombinasi homologus dengan memanfaatkan kesamaan sekuen PAOXI yang terdapat pada genom P. pastoris dan vektor pJ912-AGα (Cregg 2007). Proses integrasi diawali dengan dipotongnya vektor ekspresi menggunakan enzim SacI pada bagian promotor AOX1. Selanjutnya DNA vektor yang berbentuk linier menstimulasi terjadinya rekombinasi homologus di lokus yang terpotong melalui peristiwa pindah silang tunggal. Fragmen DNA linier yang dihasilkan mengandung cassette ekspresi dan gen penanda resistensi zeocin yang diapit oleh 5' dan 3' AOX1. Kondisi ini merangsang terjadinya pergantian gen pada AOX1 genom sehingga menyebabkan gen AOX1 digantikan oleh cassette
ekspresi beserta gen penanda resistensi zeocin (Li et al. 2007). Oleh karena itu, sebelum proses transformasi dilakukan vektor rekombinan dipotong terlebih dahulu menggunakan enzim restriksi SacI (Gambar 23). Proses linierisasi vektor rekombinan merupakan salah satu hal penting dalam proses transformasi P. pastoris karena proses linierisasi vektor rekombinan dapat menstimulasi rekombinasi ketika vektor ditransformasikan ke dalam genom P. pastoris
Gambar 23 Hasil analisis restriksi pJ912-AGα-araA dengan enzim SacI. M=
marker O‟gene ruler 1 kb plus, 1= sampel vektor rekombinan
dipotong dengan SacI, 2= vektor rekombinan yang tidak dipotong
Vektor ekspresi pJ912-AGα dirancang untuk berintegrasi ke dalam genom
P. pastoris sehingga memungkinkan ekspresi protein yang stabil, namun efisiensi transformasi akan menjadi sangat rendah. Efisiensi transformasi P.pastoris
menjadi sangat rendah karena vektor tidak hanya masuk ke dalam sel inang, tetapi juga harus berintegrasi ke dalam genom sel inang. Efisiensi transformasi yang rendah biasanya terjadi karena situs integrasi yang tidak efisien, DNA sisipan yang sulit dan kondisi transformasi yang tidak optimal. Konsentrasi dan jumlah DNA, kepadatan sel kompeten, situs integrasi vektor dalam genom P. pastoris,
dan kondisi elektroporasi seperti voltase, kapasitas dan resistan pada saat transformasi, mempengaruhi tingkat efisiensi transformasi pada P. pastoris (Wu dan Letchworth 2004).
Gambar 24 Integrasi vektor reokombinan pada genom P. pastoris (Invitogen 2002)
antibiotik zeocin 100 μg/mL karena vektor ekspresi yang digunakan dirancang mengandung gen She ble dari Streptoalloteichus hindustanus yang merupakan gen penyandi resisten terhadap antibiotik zeocin. Mekanisme kerja dari zeocin dalam menyeleksi koloni-koloni yang mengandung vektor rekombinan adalah sebagai berikut: zeocin mengandung kelat tembaga (Cu) yang jika tidak digunakan berada dalam bentuk non aktif. Ketika antibiotik masuk ke dalam sel, kation tembaga direduksi dari Cu2+ menjadi Cu+ dan dipindahkan oleh senyawa sulfhydryl yang terdapat di dalam sel. Selama pemindahan tembaga zeocin menjadi aktif dan akan berikatan dengan DNA dan merusaknya, sehingga menyebabkan kematian sel (Invitrogen 2001).
Pada penelitian ini diperoleh 107 koloni P. pastoris transforman dan tidak ada koloni non transforman yang dapat tumbuh pada medium mengandung zeocin 100 μg/mL (Gambar 25). Keseluruhan koloni transforman yang tumbuh merupakan hasil transformasi menggunakan 5 μg vektor rekombinan per reaksi transformasi sesuai dengan jumlah plasmid yang disarankan untuk memperoleh hasil yang baik. Dengan jumlah DNA 5-10 μg disebutkan dapat diperoleh sedikitnya 1×103 sampai 1×104 koloni transforman dengan kondisi transformasi yang optimal (Invitrogen 2008).
Gambar 25 Sel P. pastoris hasil transformasi. Keterangan: A= P. pastoris GS115 dengan pJ912-AGα-araA pada media YPDS dengan zeocin 100
μg/mL. B= P. pastoris GS115 pada media YPDS tanpa zeocin. C= P. pastoris GS115 pada media YPDS dengan zeocin 100 μg/mL
Seleksi Transforman P. pastoris
keseluruhan vektor rekombinan yang diintroduksikan terintegrasi ke dalam genom
P. pastoris. Fenomena gene loss dapat terjadi ketika proses perbanyakan sel dan duplikasi genom (Lin et al. 2014).
Gambar 26 Skema amplifikasi PCR vektor rekombinan pJ912-AGα-araA
menggunakan primer PPAI-F dan PPAI-R
Gambar 27 Hasil PCR koloni P. pastoris transforman dengan menggunakan primer PPAI-F dan PPAI-R. Keterangan: M= Marker O‟gene ruler 1 kb plus, 1-3= Sampel koloni P. pastoris transforman, 4= Kontrol negatif, 5= Kontrol positif
Ekspresi Protein Rekombinan
Ekspresi protein rekombinan dilakukan menggunakan sistem ekspresi P. pastoris. P. pastoris memiliki kelebihan sebagai sistem ekspresi terutama kemudahan dalam hal manipulasi pada tingkat molekuler, modifikasi pasca translasi, pelipatan protein, dan sekresi protein secara ekstraseluler (Cereghino dan Cregg 2000). Proses produksi yang mudah, peralatan produksi yang relatif murah, dan kemudahan dalam proses scale up membuat sistem ekspresi P. pastoris lebih diminati untuk memproduksi protein rekombinan (Balamurugan et al. 2007). Proses scale up membuat sistem ekspresi P. pastoris dapat lebih besar dibandingkan sistem ekspresi E. coli (Vozza et al. 1996). Sistem ekspresi pada beberapa kasus dapat mengekspresikan protein rekombinan lebih tinggi dibandingkan sistem ekspresi khamir konvensional menggunakan S. cerevisiae
Sistem ekspresi menggunakan khamir P. pastoris diawali dengan peningkatan biomassa khamir kemudian dilanjutkan dengan sistem induksi ekspresi L-AI. Peningkatan biomassa P. pastoris dilakukan pada media BMGY. Media BMGY mengandung gliserol yang merupakan sumber karbon. Gliserol bersifat represi terhadap kerja PAOX1 sehingga aliran karbon hanya akan digunakan
untuk peningkatan biomassa sel (Cereghino dan Cregg 2000; Fickers 2014). Tahap selanjutnya adalah sistem induksi ekpresi protein L-AI pada media BMMY yang mengandung metanol sebagai sumber karbon. P. pastoris merupakan khamir metilotropik yang menggunakan metanol sebagai sumber karbon dan energi (Krainer et al. 2012).
Ekspresi protein rekombinan dilakukan dengan menambahkan metanol pada media pertumbuhan. Penambahan metanol dimaksudkan untuk mengingkatkan hasil ekspresi protein rekombinan karena promotor yang digunakan untuk ekspresi protein rekombinan adalah alkohol oksidase 1 (PAOX1) yang akan tertekan
ketika P. pastoris tumbuh dalam media yang mengandung glukosa atau gliserol, tapi akan terinduksi kuat pada media metanol (Cereghino et al. 2002). Namun, konsentrasi metanol yang terlalu tinggi bersifat toksik dan dapat menghambat pertumbuhan P. pastoris sedangkan konsentrasi metanol yang rendah tidak mampu menginisiasi proses transkripsi, sehingga penambahan mentanol ke dalam media ekspresi menentukan efisiensi produksi protein rekombinan (Poutou-Pinales et al. 2010).
Protein yang telah diekspresikan dianalisis menggunakan teknik
immunofluorescence dan SDS-PAGE. SDS-PAGE dapat memberikan informasi tentang ukuran (bobot molekul) dari protein dengan cara membandingkan pita yang dihasilkan dengan ukuran marker dalam satuan kiloDalton (kDa), sedangkan
immunofluoresence dapat memberi informasi ekspresi protein rekombinan pada permukaan sel khamir. Sampel yang digunakan dalam analisis SDS-PAGE merupakan sampel protein yang telah diberi perlakuan tanpa dan diinduksi metanol. Sebelumnya P. pastoris yang telah mengekspresikan protein rekombinan diberi perlakukan penambahan enzim selulase untuk memisahkan protein rekombinan dengan debris sel P. pastoris. Protein rekombinan tertambat pada permukaan sel P. pastoris dengan bantuan protein permukaan α-agglutinin sebagai jangkar protein. α-agglutinin sebagai mannoprotein permukaan dapat melekat pada dinding sel melalui ikatan kovalen dengan polisakarida penyusun
dinding sel yaitu β-1,6-glukan. Pada ujung C α-agglutinin terdapat modifikasi GPI dan terdapat banyak situs glikosilasi. GPI termodifikasi berikatan kovalen dengan
β-1,6-glukan dan membantu menahan protein pada dinding sel (Gambar 28).