PROFIL GULA SEDERHANA DAN OLIGOSAKARIDA DAUN
KOLESOM (
Talinum triangulare
(Jacq.) Willd) HASIL
PEMUPUKAN ORGANIK PADA MUSIM HUJAN
DONI HERWANTO HARIANJA
ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa skripsi berjudul Profil Gula Sederhana dan Oligosakarida Daun Kolesom (Talinum triangulare (Jacq.) Willd) Hasil Pemupukan Organik pada Musim Hujan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Januari 2014
Doni Herwanto Harianja
ABSTRAK
DONI HERWANTO HARIANJA. Profil Gula Sederhana dan Oligosakarida Daun Kolesom (Talinum triangulare (Jacq.) Willd) Hasil Pemupukan Organik pada Musim Hujan. Dibimbing oleh RIZAL SYARIEF dan DIDAH NUR FARIDAH.
Kolesom (Talinum triangulare (Jacq.) Willd) adalah tanaman yang dapat dimanfaatkan sebagai tanaman obat dan sayuran. Keunggulan kolesom adalah mengandung pektin yang merupakan metabolit primer dan juga komponen serat larut yang dapat menurunkan kadar kolesterol LDL dalam darah. Tujuan penelitian ini adalah untuk mengetahui pengaruh hasil pemupukan organik terhadap profil gula sederhana, oligosakarida, dan total gula pucuk kolesom pada musim hujan. Ada tiga jenis pupuk organik yang digunakan, yaitu pupuk kandang sapi (PK), rock phosphate (RP), abu sekam (AS) dengan 4 kombinasi perlakuan pupuk, yaitu RP+AS, PK+AS, PK+RP, dan PK+RP+AS, serta 1 kontrol (tanpa pupuk). Hasil penelitian menunjukkan bahwa kandungan gula sederhana tertinggi terdapat pada pucuk kolesom tanpa pemupukan (1025.79 mg/100 g BK); kandungan total oligosakarida tertinggi terdapat pada pucuk kolesom hasil pemupukan PK+RP+AS (87.61 mg/100 g BK); dan total gula tertinggi terdapat pada pucuk kolesom tanpa pemupukan (1365.20 mg/100 g BK). Hasil analisis kandungan gula sederhana, oligosakarida, dan total gula pada pucuk kolesom tidak menghasilkan perbedaan yang nyata (p>0.05) antar perlakuan kombinasi pupuk.
Kata kunci: pupuk organik, rafinosa, stakiosa, Talinum triangulare (Jacq.) Willd
ABSTRACT
DONI HERWANTO HARIANJA. Mono- and Oligosaccharides Profile of Waterleaf (Talinum triangulare (Jacq.) Willd) of Organic Fertilization Results at Wet Season. Supervised by RIZAL SYARIEF and DIDAH NUR FARIDAH.
Waterleaf (Talinum triangulare (Jacq.) Willd) is one of tropical plant and has long been used as herbs and vegetables. It contains pectin which is soluble dietary fiber component and performs ability to reduce cholesterol and LDL level in blood. The aim of this research was to study the effect of organic fertilization results on mono- and oligosaccharides profile of waterleaf at wet season. The organic fertilizers were cow manure (CM), rock phosphate (RP), and rice-hull ash (HA). There were four combination of treatment: RP+HA, CM+HA, CM+RP, and CM+RP+HA, also control (no-fertilizer). The result of this research shows that the highest monosaccharides was the waterleaf of control (1025.79 mg/100 g dry basis); the highest oligosaccharides was the waterleaf of CM+RP+HA fertilization (87.61 mg/100 g dry basis); and the highest total carbohydrates was the waterleaf of no-fertilization (1365.20 mg/100 g dry basis). The organic fertilization did not significantly affect the mono-, oligosaccharides, and total carbohydrates in waterleaf (p>0.05).
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Teknologi Pertanian
pada
Departemen Ilmu dan Teknologi Pangan
PROFIL GULA SEDERHANA DAN OLIGOSAKARIDA DAUN
KOLESOM (
Talinum triangulare
(Jacq.) Willd) HASIL
PEMUPUKAN ORGANIK PADA MUSIM HUJAN
DONI HERWANTO HARIANJA
ILMU DAN TEKNOLOGI PANGAN FAKULTAS TEKNOLOGI PERTANIAN
INSTITUT PERTANIAN BOGOR BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Tuhan Yesus Kristus karena atas segala karunia-Nya, penulis dapat menyelesaikan karya ilmiah yang berjudul “Profil Gula Sederhana dan Oligosakarida Daun Kolesom (Talinum triangulare
(Jacq.) Willd) Hasil Pemupukan Organik pada Musim Hujan” dengan baik. Karya ilmiah ini disusun berdasarkan hasil penelitian penulis yang dilakukan sejak bulan April 2013. Ucapan terima kasih penulis sampaikan kepada semua pihak yang telah membantu dalam penyelesaian karya ilmiah ini, yaitu:
1. Keluarga tercinta: Papa, Mama, dan Adik-adik: Belman, Defria, dan Yanti. Terima kasih atas doa, dukungan, dan cinta kasih yang telah diberikan. 2. Prof. Dr. Ir. Rizal Syarief, DESS dan Dr. Didah Nur Faridah, S.TP, M.Si,
selaku dosen pembimbing. Terima kasih atas bimbingan, dukungan, serta nasehat yang telah diberikan.
3. Dr. Nancy Dewi Yuliana, STP, M.Sc., selaku penguji dalam sidang akhir sarjana. Terima kasih atas waktu dan saran yang telah diberikan.
4. Ev. Stenly Lailewan selaku mentor. Terima kasih untuk bimbingan dan pengajarannya akan tradisi reformed.
5. Keluarga MRII Bogor: Pdt. Romeo Mazo, M. Div, Ev. Stenly Lailewan, Ko Suryadi, Ci Sisi, Ko Adi, Ci Susi, Pak Budi, Ci Wina, Pak Peter, Ibu Magda, Ci Aling, Ci Anna, Erni, dan Abraham. Terima kasih telah menguatkan penulis di dalam iman pada Tuhan Yesus Kristus.
6. Paul Brugman dan Erni Steffi. Terima kasih untuk mengenalkan teologi dan teologi reformed pada penulis.
7. Sahabat Kos Purnama (DR D33): Richard, Paul, Brian, Jodi, dan Marcel. Terima kasih untuk kebersamaan serta semangat yang diberikan.
8. Adik-adik kelompok kecil yang terkasih: Efraim, Rilsan, Hasfan, dan Ardi. Terima kasih atas doa dan semangat yang telah diberikan.
9. Saudara-saudari Komisi Pelayanan Khusus (Kopelkhu) PMK IPB angkatan 46: Theovany, Erni, Mutiara, Oni, Cathrina, Marco, Alfred, Kadek, Sarah, Gracia, Anugrah.; dan seluruh keluarga besar kopelkhu.
10. Teman-teman seperjuangan ITP 46.
11. Seluruh teknisi laboratorium di Seafast Center, Laboratorium Jasa Analisis, dan Departemen Ilmu dan Teknologi Pangan, serta seluruh pegawai Departemen Ilmu dan Teknologi Pangan atas bantuan yang telah diberikan.
Semoga karya ilmiah ini bermanfaat.
Bogor, Januari 2014
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 2
Kolesom 2
Oligosakarida 3
Pemupukan 4
Nitrogen 5
Fosfor 5
Kalium 6
METODOLOGI PENELITIAN 7
Bahan dan Alat 7
Metode Penelitian 7
Analisis Data 11
HASIL DAN PEMBAHASAN 11
Persiapan Sampel 11
Ekstraksi Oligosakarida 13
Analisis Gula Sederhana Pucuk Kolesom 19
Analisis Oligosakarida Pucuk Kolesom 23
Total Gula Pucuk Kolesom 27
SIMPULAN DAN SARAN 28
Simpulan 28
Saran 29
DAFTAR PUSTAKA 29
LAMPIRAN 32
DAFTAR TABEL
1 Kombinasi perlakuan pupuk organik 8
2 Kadar hara tanah dan tajuk kolesom pada musim tanam pertama 12 3 pH tanah dan rasio C/N sebelum dan sesudah penanaman 12
4 Kandungan gula sederhana pucuk kolesom 19
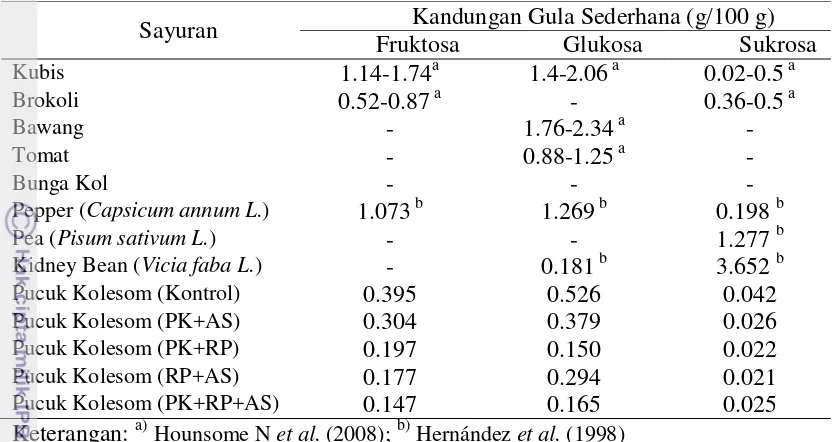
5 Kadar gula sederhana berbagai sayuran 23
6 Kandungan oligosakarida pucuk kolesom 23
7 Kadar oligosakarida berbagai sayuran 26
8 Kandungan oligosakarida dan total oligosakarida pucuk kolesom 27
DAFTAR GAMBAR
1 Tanaman kolesom 3
2 Proses ekstraksi oligosakarida daun kolesom 10
3 Ekstrak kolesom yang telah disaring dan yang belum disaring 14 4 Ekstrak kolesom setelah dan sebelum Pb-asetat dan Na-oksalat 15 5 Ekstrak kolesom terhadap etanol (1:8) dan ekstrak kolesom terhadap
etanol (1:16) 16
6 Ekstrak kolesom dengan Pb-asetat dan Na-oksalat, Ekstrak kolesom dengan silica gel-60, dan Ekstrak kolesom dengan kombinasi silica
gel-60 dengan Pb-asetat dan Na-oksalat 16
7 Ekstrak kolesom sebelum dan sesudah dielusikan dengan silica gel-60 17
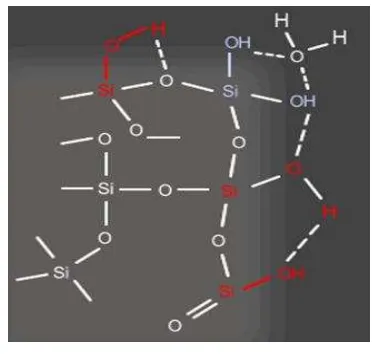
8 Kromatogram HPLC metode ekstraksi (f) 17
9 Struktur Silica gel-60 18
10 Struktur Oktadesil silan pada SepPak C-18 18
11 Larutan ekstrak daun kolesom setelah dan sebelum dielusikan dengan
cartridge SepPak C-18 (Agilent) 19
12 Kromatogram kolesom hasil metode ekstraksi (g) 21
13 Kandungan gula sederhana pucuk kolesom 22
14 Kandungan oligosakarida pucuk kolesom 25
15 Kurva standar glukosa 27
16 Total gula pucuk kolesom 28
DAFTAR LAMPIRAN
1 Uji Oneway ANOVA terhadap kandungan fruktosa pucuk kolesom 32 2 Uji Oneway ANOVA terhadap kandungan glukosa pucuk kolesom 33 3 Uji Oneway ANOVA terhadap kandungan sukrosa pucuk kolesom 34 4 Uji Oneway ANOVA terhadap kandungan rafinosa pucuk kolesom 35 5 Uji Oneway ANOVA terhadap kandungan stakiosa pucuk kolesom 36 6 Uji Oneway ANOVA terhadap kandungan total oligosakarida pucuk
kolesom 37
7 Uji Oneway ANOVA terhadap kandungan total gula pucuk kolesom 38 8 Berat sampel, kadar air, dan berat kering pucuk kolesom 39 9 Waktu retensi, luas area, dan kromatogram standar 40
PENDAHULUAN
Latar Belakang
Kolesom (Talinum triangulare (Jacq.) Willd) merupakan tanaman tahunan yang dapat dimanfaatkan sebagai tanaman obat. Selain itu, kolesom juga dapat dimanfaatkan sebagai sayuran dengan mengonsumsi bagian daun dan pucuknya. Pucuk kolesom dapat dipanen dengan interval panen terbaik 15 hari sekali (Susanti et al. 2011). Bagian batangnya berbentuk bulat, lunak dan berair, bercabang banyak, akar tunggangnya menggembung berbentuk menyerupai ginseng (Rifai 1994), dan memiliki daun tebal berdaging, duduknya tersebar atau berhadapan (Tjitrosoepomo 2007).
Kolesom mengandung metabolit primer dan metabolit sekunder. Metabolit primer adalah senyawa yang bersifat esensial bagi tumbuhan yang berperan dalam proses pertumbuhan dan perkembangan, respirasi dan fotosintesis, dan sintesis protein dan hormon (Hounsome et al. 2008). Proses sintesis metabolit ini dilakukan setiap saat untuk kelangsungan hidup bagi tumbuhan. Berbeda dengan metabolit primer, metabolit sekunder adalah senyawa yang bersifat tidak esensial bagi tumbuhan dan proses sintesisnya hanya pada saat tertentu saja. Metabolit sekunder berfungsi untuk mempertahankan diri dari kondisi lingkungan yang kurang menguntungkan (Edwards dan Gatehouse 1999). Metabolit primer yang umumnya terdapat pada sayuran antara lain karbohidrat, asam amino, asam lemak, dan asam organik (Hounsome et al. 2008). Kandungan metabolit primer yang terdapat pada kolesom salah satunya adalah pektin. Pektin merupakan komponen serat larut, sehingga dapat berfungsi menurunkan kadar kolesterol LDL dalam darah (Aja et al. 2010). Pektin dengan viskositas yang tinggi akan berperan dalam membentuk misela dan asam empedu dengan laju difusi rendah melalui bolus untuk mengikat kolesterol pada saluran pencernaan (Sharma et al. 2006).
Kandungan pektin ini merupakan salah satu keunggulan kolesom, sebab sebagian besar sayuran yang umum dikonsumsi masyarakat Indonesia didominasi serat tidak larut yang lebih berkhasiat melancarkan pencernaan, namun tidak berfungsi menurunkan kadar kolesterol LDL dalam darah (Aja et al. 2010). Menurut Prabekti (2012), kadar pektin yang terkandung dalam kolesom hasil budidaya organik pada musim hujan (0.35 g/100 g) lebih rendah dibandingkan pada musim kemarau (0.63 g/100 g). Kadar pektin sebesar 0.23 g/100 g dari kulit jeruk yang dicampurkan ke dalam ransum, dapat menurunkan kadar LDL tikus percobaan hingga 5%, serta menurunkan respon glukosanya (Baker 1994).
2
Selain pektin dan serat pangan, metabolit primer yang dapat ditemukan pada tumbuhan adalah gula sederhana dan oligosakarida. Komponen gula sederhana yang secara umum terdapat dalam tumbuhan (sayuran) adalah fruktosa, glukosa (monosakarida), dan sukrosa (disakarida). Oligosakarida merupakan bagian dari polimer karbohidrat dengan berat molekul rendah yang berperan penting terhadap kesehatan, yaitu mempengaruhi pertumbuhan bakteri yang menguntungkan dalam saluran pencernaan (Liying et al. 2003), menurunkan resiko kanker kolon (Xu Qiang et al. 2009), serta dapat meningkatkan penyerapan mineral, seperti kalsium, magnesium, dan besi (Tenorio et al. 2010). Komponen oligosakarida yang terdapat pada tumbuhan (sayuran) secara umum adalah rafinosa dan stakiosa (Hounsome et al. 2008).
Kolesom membutuhkan teknik budidaya yang baik untuk mengoptimalkan pertumbuhan, produksi, dan kadar metabolit yang terdapat di dalamnya. Salah satu teknik budidaya yang umum dilakukan adalah pemupukan. Pupuk organik saat ini banyak digunakan untuk mendukung sistem pertanian organik. Keunggulan pupuk organik dibandingkan dengan pupuk anorganik adalah dapat memperbaiki sifat fisik, kimia, dan biologi tanah selain dapat menyumbang unsur hara pada tanah dan tanaman. Namun, ketersediaan hara dari pupuk organik cenderung lambat, karena harus mengalami proses mineralisasi agar bisa diserap oleh tanaman. Tidak hanya itu, curah hujan pada musim hujan juga akan mempengaruhi pertumbuhan kolesom.
Berbagai hasil penelitian tersebut mendorong timbulnya hipotesis bahwa terdapat pengaruh jenis dan dosis pupuk organik yang berbeda terhadap profil gula sederhana dan oligosakarida pada pucuk kolesom.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengetahui pengaruh hasil pemupukan organik terhadap profil gula sederhana, oligosakarida, dan total gula pada pucuk kolesom hasil pemupukan organik yang ditanam pada musim hujan.
Manfaat Penelitian
Manfaat dari penelitian ini adalah memberikan informasi profil gula sederhana, oligosakarida, dan total gula pada pucuk kolesom hasil pemupukan organik.
TINJAUAN PUSTAKA
Kolesom
3 Plantae, division Spermatophyta, sub division Angiospermae, classis Dicotyledonae, ordo Caryophyllales, familia Portulacaceae, dan genus Talinum (Hutapea 1994). Tanaman ini memiliki banyak spesies, tetapi dikenal dua spesies Talinum, yaitu Talinum paniculatum Gaertn. dan Talinum triangulare (Jacq.) Willd. (Syukur dan Hernani 2002).
Kolesom merupakan tanaman herba menahun yang tumbuh tegak. Batang tanaman ini berbentuk bulat, pangkalnya berwarna ungu kemerahan, sedangkan batang bagian tengah hingga ujung berwarna hijau (Wahyuni dan Hadipoentyanti 1999). Daunnya berbentuk oblongatus-spatulans (memanjang dan menyerupai bentuk bulat telur), berwarna hijau muda, tebal berdaging, filotaksis spiral, dan kadang-kadang berhadapan. Secara anatomi, daunnya memiliki tipe dorsiventral, stomata parasitik, parenkim daun yang mengandung kristal kalsium oksalat dan kelenjar minyak atsiri. Bunganya berwarna merah jambu keunguan, bentuk tangkai bunga adalah segitiga dan bentuk rangkaian bunganya adalah tandan (racemus). Bunga mekar pada pagi hari dan buahnya berbentuk bulat memanjang, berwarna hijau kekuningan, dan berisikan biji hitam mengkilat. Biji dari kolesom berbentuk lonjong pipih dan berdiameter ± 1 mm. Akarnya menebal (membengkak) menyerupai akar ginseng (Panax ginseng).
Gambar 1 Tanaman kolesom (Susanti 2012)
Daun, batang, dan umbi tanaman kolesom diketahui berkhasiat sebagai obat herbal. Penduduk Kalimantan Selatan biasa menggunakan daun kolesom untuk campuran bedak dingin (Susanti et al. 2008). Selain itu, masyarakat di Nigeria menggunakan air perasan dari daun kolesom sebagai obat hipertensi yang diminum langsung (Aiyeloja dan Bello 2006). Umbi kolesom memiliki kandungan alkaloid, steroid, saponin, dan tannin. Daunnya mengandung alkaloid, saponin, tannin, fenolik, flavonoid, triterpenoid, steroid, dan glikosida (Mualim 2009).
Oligosakarida
4
Oligosakarida dapat diklasifikasikan berdasarkan jumlah monomer monosakarida penyusun komponen tersebut. Disakarida adalah oligosakarida yang terdiri dari dua molekul monosakarida; trisakarida terdiri dari tiga molekul monosakarida; dan tetrasakarida terdiri dari empat molekul monosakarida. Oligosakarida terdiri dari dua jenis, yaitu homooligosakarida dan heterooligosakarida. Homooligosakarida adalah tipe oligosakarida yang tersusun dari hanya satu jenis monosakarida, seperti maltooligosakarida (MOS) yang tersusun dari glukosa, sedangkan heterooligosakarida adalah tipe oligosakarida yang terdiri dari dua atau lebih jenis monosakarida, seperti fruktooligosakarida (FOS) dan galaktooligosakarida (GOS). Oligosakarida sangat mudah larut di dalam air dan pelarut polar lainnya (Patel dan Goyal 2011).
Berdasarkan kemampuannya untuk dicerna, oligosakarida merupakan kelompok karbohidrat yang tidak dapat dicerna oleh tubuh manusia. Menurut Rupѐrez (2006), manusia tidak memiliki enzim α-galaktosidase yang dibutuhkan untuk memutuskan ikatan galaktosidik pada oligosakarida, sehingga oligosakarida yang dikonsumsi tidak dapat dicerna. Pada saluran pencernaan, oligosakarida tersebut difermentasi oleh bakteri yang menguntungkan, seperti bakteri dari genus bifidobakteria dan laktobasili, yang memiliki enzim untuk mencerna oligosakarida tersebut. Hasil fermentasi tersebut berupa gas karbon dioksida, hidrogen, metana, dan asam lemak rantai pendek. Gas hasil fermentasi tersebut dapat menyebabkan
flatulensi, namun aktivitas bakteri tersebut dapat meningkatkan sistem imun tubuh dan menekan pertumbuhan bakteri patogen (Nzeussea et al. 2006).
Secara umum, oligosakarida yang terdapat di dalam tumbuhan merupakan oligosakarida kelompok fruktooligosakarida (FOS). Fruktooligosakarida (FOS) merupakan jenis oligosakarida yang terdiri dari monomer glukosil-(fruktosil)n
-fruktosa-(GFn) dan (fruktosil)m-fruktosa (Fm). Rafinosa merupakan trisakarida
yang memiliki terdiri dari 1 unit monomer α-D-galaktosa, 1 unit monomer α -D-glukosa, dan 1 unit monomer α-D-fruktosa; sedangkan stakiosa merupakan tetrasakarida yang terdiri dari dua unit monomer α-D-galaktosa, 1 unit monomer α-D-glukosa, dan 1 unit monomer α-D-fruktosa (Cui 2005).
Pemupukan
Pupuk adalah bahan yang ditambahkan ke dalam tanah, baik secara organik, maupun anorganik dengan maksud untuk menggantikan kehilangan unsur hara di dalam tanah dan bertujuan meningkatkan produksi tanaman (Sutedjo 1987). Secara alami, unsur hara yang dibutuhkan oleh tanaman tersedia di dalam tanah. Namun, seiring meningkatnya pertumbuhan tanaman, unsur hara dalam tanah pun semakin berkurang karena terus-menerus diserap oleh tanaman dan juga hilang akibat pencucian oleh air hujan ataupun air irigasi. Oleh karena itu, diperlukan pemupukan untuk mempertahankan pertumbuhan dan produktivitas tanaman sesuai yang diinginkan.
5 yang lebih rendah dan membutuhkan waktu lebih lama untuk diserap tanaman karena masih berupa senyawa organik kompleks yang perlu didekomposisi terlebih dahulu, sebelum dapat digunakan oleh tanaman (Sutedjo 1987). Kelebihan pupuk organik adalah sifatnya yang mampu menggemburkan lapisan tanah (top soil), meningkatkan jasad renik dalam tanah, mempertinggi daya serap dan daya simpan air, yang secara keseluruhan dapat meningkatkan kualitas tanah (Sutedjo 1987).
Unsur hara yang dibutuhkan oleh tanaman digolongkan ke dalam dua kelompok, yaitu unsur hara makro dan mikro. Unsur hara makro merupakan unsur hara yang diperlukan tanaman dalam jumlah besar, yaitu C, H, O, N, P, K, Ca, Mg, dan S. Unsur hara mikro merupakan unsur hara yang dibutuhkan oleh tanaman dalam jumlah kecil, yaitu Fe, Mn, B, Mo, Cu, Zn, Cl, dan Co (Gardner Pearce 1991).
Nitrogen
Nitrogen merupakan unsur hara terpenting yang digunakan untuk pertumbuhan vegetatif tanaman, seperti daun, batang, dan akar. Unsur hara ini bersifat mobile di dalam tanaman, sehingga gejala kekurangan N pertama kali tampak pada daun tua, daun cenderung cepat gugur, tanaman tumbuh kerdil, kemampuan fotosintesis berkurang, dan sistem perakaran terbatas. Jika pemberian unsur ini terlalu banyak, akan menghambat pembungaan dan pembuahan pada tanaman (Salisbury and Ross 1992).
Nitrogen yang ada di alam tersedia dalam jumlah yang besar. Namun, N2
yang ada di atmosfer maupun yang terikat di dalam tanah tidak bisa dimanfaatkan oleh tanaman. Nitrogen hanya bisa diserap dalam bentuk NO3- (nitrat) dan NH4+
(amonium). Secara umum, nitrat merupakan bentuk yang paling disukai untuk pertumbuhan oleh tanaman, namun dipengaruhi jenis dan faktor lingkungan. Tanaman pertanian cenderung menyerap NO3-, meskipun pupuk yang diberikan ke
dalam tanah dalam bentuk NH4+ (Munawar 2011). Perbedaan utama serapan NO3
-dan NH4+ adalah kepekaannya terhadap pH. Serapan NH4+ berlangsung paling
baik pada media netral dan semakin berkurang dengan menurunnya pH. Sebaliknya, serapan NO3- lebih cepat pada pH rendah. Namun, dalam sintesis
asam amino bentuk nitrat perlu diasimilasikan ke bentuk amonium oleh enzim nitrat reduktase dan nitrit reduktase dengan menggunakan energi oksidasi dari karbohidrat (Dubey dan Pessarakli 1995). Nitrogen berperan dalam pembentukan klorofil, alkaloid, dan protein, seperti asam amino, enzim, dan nukleotida, berperan terhadap pembelahan dan pembesaran sel, serta berpengaruh terhadap penggunaan karbohidrat dan penyerapan nutrisi yang lain (Gardner Pearce 1991).
Fosfor
Fosfor merupakan unsur hara esensial yang paling sering dijumpai dalam keadaan kahat setelah unsur nitrogen (Mosali et al. 2005). Unsur P yang tersedia dalam tanah umumnya sangat rendah karena fosfor bersifat immobile di dalam tanah dan memiliki retensi yang sangat tinggi (Salisbury and Ross 1992).
6
kelarutan, kandungan bahan organik, temperatur, dan tipe dari liat (Mosali et al.
2005).
Fosfor diserap oleh tanaman dalam bentuk anion, yaitu H2PO4- dan HPO4
2-(Gardner Pearce 1991). Mobilitas anion fosfat dalam tanah sangat rendah, karena retensinya dalam tanah sangat tinggi. Oleh sebab itu, efisiensi dari pupuk P sangat rendah antara 10-30%, sisanya 70-90% P tertinggal dalam bentuk immobile atau hilang karena erosi (Leiwakabessy dan Sutandi 1998).
Fungsi fosfor yang penting pada tanaman, antara lain untuk penyimpanan dan transfer energi dalam bentuk adenosine trifosfat (ATP), adenosine difosfat (ADP), NAD, NADPH, serta merupakan komponen struktural penting dalam penyusunan asam nukleat, kofaktor enzim, fosfolipid, dan nukleotida (Gardner Pearce 1991; Mosali et al. 2005).
Gejala defisiensi fosfor berlawanan dengan gejala defisiensi nitrogen, yaitu daun tidak menguning, melainkan berwarna hijau gelap atau hijau kebiru-biruan, serta tanaman tumbuh kerdil. Pada tanaman yang yang mengalami defisiensi fosfor, terjadi penimbunan gula, yang ditunjukkan dalam bentuk pigmentasi antosianin pada bagian dasar batang dan urat daun, terutama pada tanaman jagung (Gardner Pearce 1991).
Kalium
Kalium berasal dari mineral primer dan mineral sekunder, misalnya tanah liat. Umumnya, tanah yang kandungan tanah liatnya tinggi cenderung untuk mengandung K yang relatif tinggi juga, sedangkan tanah organik dan tanah berpasir umumnya rendah kandungan unsur K-nya (Gardner Pearce 1991). Unsur ini tersedia di dalam tanah dalam tiga bentuk, yaitu (1) bentuk K tidak dapat dipertukarkan, (2) bentuk K dapat dipertukarkan, dan (3) bentuk K larut. Bentuk K yang tidak dapat dipertukarkan, banyak terdapat di dalam tanah, tetapi pelepasannya lambat, sehingga sulit diserap oleh tanaman. Bentuk K dipertukarkan adalah bentuk K yang tersedia (ada yang cepat tersedia dan ada yang lambat tersedia). Bentuk K yang mudah diserap tanaman adalah bentuk K terlarut (Gardner Pearce 1991).
Kalium pada tanaman berperan sebagai aktivator enzim, mempertahankan vigor tanaman, merangsang pertumbuhan akar, dan sebagai katalisator. Selain itu, K juga berperan dalam proses pembentukan karbohidrat, translokasi gula, dan metabolisme protein. Dalam mempertahankan vigor tanaman, K berperan dalam proses pemeliharaan status air tanaman, tekanan turgor dalam sel, serta proses membuka dan menutupnya stomata (Salisbury and Ross 1992).
7
METODOLOGI PENELITIAN
Bahan
Bahan yang digunakan dalam penelitian ini, yaitu lima belas sampel daun kolesom (bubuk) yang diambil pada bagian pucuk tanaman kolesom sepanjang ±10 cm dari ujung bagian atas tanaman dengan umur 10 minggu setelah tanam (MST), standar rafinosa (Sigma R.0514-25g), standar stakiosa (Sigma S.4001-100mg), standar glukosa (Merck), standar fruktosa (Merck), standar sukrosa (Merck), etanol (Merck), air HPLC grade, dan Acetonitrile HPLC grade (Merck).
Alat
Alat yang digunakan, yaitu neraca analitik, waterbath, vortex, spektrofotometer UV-Vis, kertas Whatman 42, alat-alat gelas, HPLC Agilent yang dilengkapi dengan degasser (model G1322A Agilent), pompa solvent (model G1310A Agilent), dan detektor Refractive Index (model G1362A Agilent), kolom HPLC untuk karbohidrat (ZORBAX Carbohydrate Analysis Columns) berukuran 150 mm x 4.6 mm x 5 µm (Agilent), membran filter 0.45 µm, dan kolom Sep-Pak C-18 Varian (Agilent).
Metode Penelitian
Penelitian ini terdiri dari tiga tahapan. Tahapan pertama adalah persiapan sampel. Tahapan kedua adalah ekstraksi oligosakarida. Tahapan ketiga adalah analisis kadar gula sederhana, oligosakarida, dan total gula pada lima belas sampel pucuk kolesom (bubuk).
1. Persiapan Sampel
Sampel pucuk kolesom yang digunakan dalam penelitian ini adalah sampel pucuk kolesom yang diperoleh dari Departemen Agronomi dan Hortikultura IPB yang merupakan hasil pemanenan pada musim tanam pertama dengan umur 10 MST (minggu setelah tanam) yang dilakukan oleh Saleh (2013) dalam meneliti pertumbuhan, produksi, dan kadar metabolit pucuk kolesom dengan pemupukan organik berulang. Kolesom ini juga telah diberi perlakuan dengan penambahan tiga jenis pupuk organik, yaitu pupuk kandang sapi (PK), rock phosphate (RP), dan abu sekam padi (AS). Curah hujan yang terjadi saat minggu ke-9 dan ke-10 adalah 168.6 mm/minggu dan 240.6 mm/minggu (Saleh 2013).
Adapun kombinasi dan dosis dari masing-masing pupuk organik, dapat dilihat pada Tabel 1. Masing-masing perlakuan terdiri dari tiga ulangan, sehingga jumlah sampel daun kolesom adalah 15 sampel.
8
Tabel 1 Kombinasi Perlakuan Pupuk Organik Perlakuan
Keterangan: PK: pupuk kandang sapi; RP: Rock Phosphate; AS: Abu Sekam, 1 kadar N 1.29%, 2 kadar P2O5 2.87%, dan 3 kadar K2O 1.10% (Saleh 2013).
2. Ekstraksi Oligosakarida
Ekstraksi oligosakarida pada lima belas sampel bubuk pucuk kolesom dilakukan dengan menggunakan metode Wang et al. (2007) yang dilakukan pada sampel kedelai. Pada penelitian ini digunakan tujuh metode ekstraksi oligosakarida. Tujuh metode tersebut merupakan hasil modifikasi dari metode Wang et al. (2007) yang diujicobakan untuk memperoleh metode ekstraksi oligosakarida yang baik pada pucuk kolesom. Metode ekstraksi oligosakarida yang digunakan dalam penelitian ini adalah sebagai berikut:
a) 1 g bubuk pucuk kolesom dilarutkan dalam 8 ml etanol 80% + CaCO3 (0.5
g/L). Setelah itu dipanaskan dalam waterbath 70oC selama 1 jam. Kemudian disentrifuse 2400 rpm selama 30 menit dan pemindahan supernatan. Setelah itu, disaring dengan menggunakan kertas saring Whatman#42. Hasil penyaringan dipindahkan ke dalam vial tertutup.
b) 1 g bubuk pucuk kolesom dilarutkan dalam 8 ml etanol 80% + CaCO3 (0.5
g/L). Setelah itu dipanaskan dalam waterbath 70oC selama 1 jam. Kemudian disentrifuse 2400 rpm selama 30 menit dan pemindahan supernatan. Ke dalam supernatan ditambahkan Pb-asetat jenuh. Kemudian dilakukan pengenceran dalam labu takar 10 ml (ditera dengan EtOH 80%). Larutan tersebut ditambahkan Na-oksalat dan disaring dengan kertas saring Whatman#42. Hasil penyaringan dipindahkan ke dalam vial tertutup.
c) 1 g bubuk pucuk kolesom dilarutkan dalam 16 ml etanol 80% + CaCO3 (0.5
g/L). Setelah itu dipanaskan dalam waterbath 70oC selama 1 jam. Kemudian disentrifuse 2400 rpm selama 30 menit dan pemindahan supernatan. Ke dalam supernatan ditambahkan Pb-asetat jenuh. Kemudian dilakukan pengenceran dalam labu takar 10 ml (ditera dengan EtOH 80%). Larutan tersebut ditambahkan Na-oksalat dan disaring dengan kertas saring Whatman#42. Hasil penyaringan dipindahkan ke dalam vial tertutup.
d) 1 g bubuk pucuk kolesom dilarutkan dalam 16 ml etanol 80% + CaCO3 (0.5
g/L). Setelah itu dipanaskan dalam waterbath 70oC selama 1 jam. Kemudian disentrifuse 2400 rpm selama 30 menit dan pemindahan supernatan. Ke dalam supernatan ditambahkan Pb-asetat jenuh. Kemudian dilakukan pengenceran dalam labu takar 10 ml (ditera dengan EtOH 80%). Larutan tersebut ditambahkan Na-oksalat dan disaring dengan kertas saring Whatman#42. Hasil penyaringan dengan kertas saring dielusikan ke dalam
9 e) 1 g bubuk pucuk kolesom dilarutkan dalam 16 ml etanol 80% + CaCO3 (0.5
g/L). Setelah itu dipanaskan dalam waterbath 70oC selama 1 jam. Kemudian disentrifuse 2400 rpm selama 30 menit dan pemindahan supernatan. Setelah itu, dielusikan ke dalam cartridge dengan 1 g silica gel-60 dan dipindahkan ke dalam vial tertutup.
f) 200 mg bubuk pucuk kolesom dilarutkan dalam 3.2 ml etanol 80% + CaCO3
(0.5 g/L). Kemudian dilarutkan dalam 25 ml labu takar (ditera dengan EtOH 80%). Setelah itu, dipanaskan dalam waterbath 70oC selama 1 jam. Kemudian, disentrifuse 2400 rpm selama 30 menit (dibagi ke dalam 2 tube). Supernatan dipindahkan dari masing-masing tube sebanyak 2.5 ml ke dalam tabung reaksi. Setelah itu, dilakukan pengenceran 5x dan diambil 2 ml. Kemudian, dielusikan ke dalam cartridge dengan 1 g silica gel-60 dan dipindahkan ke dalam vial tertutup.
g) 0.5 g bubuk pucuk kolesom dilarutkan ke dalam 5 ml etanol 70% + CaCO3
(0.5 g/L). Setelah itu dipanaskan dalam waterbath 70oC selama 1 jam. Kemudian disentrifuse 2400 rpm selama 30 menit dan pemindahan supernatan. Supernatan dilarutkan ke dalam labu takar 5 ml. Setelah itu, diambil 1 ml untuk dielusikan dengan cartridge SepPak C-18 dan dipindahkan ke dalam vial tertutup.
Sejumlah tujuh metode ekstraksi oligosakarida yang dilakukan, diperoleh bahwa metode ekstraksi oligosakarida (g) adalah metode ekstraksi oligosakarida yang baik pada kolesom (Gambar 2).
3. Analisis Gula Sederhana, Oligosakarida, dan Total Gula Analisis Gula Sederhana dan Oligosakarida (Metode HPLC)
Oligosakarida pucuk kolesom yang telah diisolasi akan dianalisis dengan menggunakan HPLC. HPLC yang digunakan dilengkapi dengan peralatan sebagai berikut:
degasser (model G1322A Agilent), pompa solvent (model G1310A Agilent), dan detector Refractive Index (model G1362A Agilent)
kolom HPLC untuk karbohidrat (ZORBAX Carbohydrate Analysis Columns) berukuran 150 mm x 4.6 mm x 5 µm (Agilent) yang dilapisi dengan 3-aminopropilsilan pada partikel silica
fase gerak yang digunakan adalah campuran larutan Acetonitrile:Air (75:25) dengan kecepatan alir 1 ml/menit
standar pada pengujian oligosakarida adalah rafinosa (Sigma) dan stakiosa (Sigma), serta standar gula sederhana berupa fruktosa (Merck), glukosa (Merck), dan sukrosa (Merck). Perhitungan kadar gula sederhana dan oligosakarida dilakukan dengan menggunakan rumus:
Keterangan: As = Luas area peak sampel Ast = Luas area peak standar
Vs = Volume larutan ekstrak sampel (5 ml) Cst = Konsentrasi standar (mg/ml)
10
Gambar 2 Proses ekstraksi oligosakarida daun kolesom
Analisis Total Gula, Metode Anthrone Modifikasi (Apriyantono et al. 1989) a. Persiapan Sampel
Sampel yang digunakan adalah sampel hasil ekstraksi daun kolesom yang telah melewati kolom Sep-Pak C18.
Daun Kolesom
Pencampuran dengan heksana (0,5 g bubuk kolesom dalam 10
ml heksana)-Sonikasi 30 menit
Penyaringan dengan kertas Whatman 42
Pemindahan residu ke dalam gelas piala
Penambahan 5 ml EtOH 70%+0,5 g/L CaCO3
Pemanasan pada suhu 70o C selama 1 jam
Sentrifuse 30 menit pada 2400 rpm
Pemindahan supernatan dan pelarutan kembali pada 5 ml
labu takar
Penyaringan 1 ml ekstraksi kolesom pada kolom Sep-Pak
C-18
11
b. Pembuatan Kurva Standar
Larutan glukosa standar dipipet masing-masing 0.0 (blanko), 0.2, 0.4, 0.6, 0.8, dan 1.0 ml ke dalam tabung reaksi, kemudian ditambahkan akuades sampai total volume masing-masing tabung reaksi 1.0 ml. Sebanyak 5 ml pereaksi anthrone ditambahkan dengan cepat ke dalam masing-masing tabung, tabung reaksi ditutup, dan larutan divortex hingga tercampur merata. Kemudian ditempatkan dalam waterbath 100oC selama 12 menit, didinginkan, dan dibaca absorbansinya pada panjang gelombang 630 nm. Selanjutnya dibuat kurva standar hubungan antara absorbansi dengan jumlah glukosa standar.
c. Penetapan Sampel
Sampel sebanyak ± 1 ml dari persiapan sampel dimasukkan ke dalam labu takar 25 ml dan diencerkan dengan akuades hingga tanda tera. Setelah itu, 1 ml sampel dimasukkan ke dalam tabung reaksi dan ditambahkan 5 ml pereaksi anthrone, tabung reaksi ditutup, lalu dikocok. Kemudian ditempatkan dalam
waterbath 100oC selama 12 menit, didinginkan, dan dibaca absorbansinya pada panjang gelombang 630 nm. Konsentrasi total gula pada sampel dapat ditentukan dengan perhitungan:
Persamaan garis kurva standar: Total gula (mg/g BK) Keterangan: C = Kandungan gula dari kurva standar
FP = Faktor Pengenceran
Vo= Volume ekstraksi awal (5 ml) Vt = Volume ekstraksi analisis (1 ml)
Analisis Data
Data hasil penelitian dianalisis dengan Analisis Sidik Ragam (ANOVA) pada taraf signifikansi 5% menggunakan aplikasi SPSS 16.0. Masing-masing hasil pemupukan pada pucuk kolesom terdiri dari tiga ulangan dan dianalisis dua kali (duplo).
HASIL DAN PEMBAHASAN
Persiapan Sampel
12
hara secara lengkap (terdapat unsur N, P, dan K), meskipun terdapat kombinasi pupuk organik yang terdiri hanya dua jenis pupuk.
Hasil analisis tanah sebelum aplikasi pemupukan, setelah penanaman, dan kadar hara pada jaringan tanaman dapat dilihat pada Tabel 2 dan Tabel 3. Hasil ini diperoleh dari hasil penelitian yang dilakukan Saleh (2013).
Tabel 2 Kadar hara tanah dan tajuk kolesom pada musim tanam pertama
Perlakuan N P K Keterangan: PK: pupuk kandang, RP: rock phosphate, AS: abu sekam, SB: sebelum aplikasi, SD: setelah penanaman pada tanah; Jar: kadar hara pada jaringan tanaman (Saleh 2013).
Tabel 3 pH tanah dan rasio C/N tanah sebelum dan sesudah penanaman
Perlakuan pH tanah C/N
Keterangan: PK: pupuk kandang, RP: rock phosphate, AS: abu sekam, SB: sebelum aplikasi, SD: setelah penanaman pada tanah; Jar: kadar hara pada jaringan tanaman (Saleh 2013).
Kadar N pada lahan menunjukkan terjadinya penurunan dari sebelum pemupukan hingga setelah penanaman (Tabel 2). Berdasarkan Balittanah (2005) status N di awal percobaan sebelum aplikasi pemupukan tergolong sedang, namun di akhir percobaan tergolong rendah. Kondisi ini menunjukkan bahwa unsur N yang berasal dari pupuk organik belum tersedia bagi tanaman, sehingga serapan hara bagi tanaman berasal dari N tanah. Tabel 3 menunjukkan bahwa pH tanah pada berbagai perlakuan tergolong asam karena pH sebelum maupun sesudah aplikasi pemupukan berada di bawah 6. Kondisi pH yang rendah ini akan mempengaruhi aktivitas penyerapan unsur nitrogen dalam bentuk nitrat (NO3-).
Ion nitrat (NO3-) akan lebih tinggi penyerapannya pada pH yang rendah (Gardner
Pearce 1991; Munawar 2011).
13 meningkatkan aktivitas enzim fosfatase. Rock phosphate yang digunakan sebagai salah satu pupuk organik ini merupakan sumber P yang bersifat slow release
(Pickering et al. 2002). Havlin et al. (2005) menyatakan bahwa kadar P pada jaringan tanaman berkisar 0.1-0.5%. Tabel 2 menunjukkan bahwa rata-rata kadar P pada jaringan kolesom adalah 0.35%. Kondisi ini menunjukkan bahwa pupuk
rock phosphate tidak terlalu berpengaruh pada metabolit primer kolesom di musim tanam pertama.
Unsur K tanah yang tersedia di awal percobaan, baik sebelum aplikasi pemupukan maupun sesudah aplikasi pemupukan tergolong rendah (Balittanah 2005). Unsur K secara umum merupakan unsur yang banyak diserap tanaman dan mudah tercuci, namun perubahan bentuk dari mineral primer ke bentuk tersedia berjalan sangat lambat (Havlin et al. 2005). Selain itu, tanaman juga cenderung mengambil K dalam jumlah yang lebih banyak dari yang dibutuhkan (Hardjowigeno 2007). Hal tersebut menyebabkan kadar kalium dalam tanah menjadi rendah setelah aplikasi pemupukan pada musim tanam pertama (Tabel 2). Rasio C/N juga mempengaruhi ketersediaan unsur hara N, P, dan K yang dibutuhkan oleh tanaman. Tabel 3 menunjukkan bahwa rasio C/N baik sebelum maupun sesudah aplikasi pemupukan pada musim tanam pertama berada dibawah 20. Munawar (2011) menyatakan bahwa rasio C/N <20, mengakibatkan terjadinya proses mineralisasi, yaitu proses perubahan bentuk organik menjadi bentuk anorganik yang tersedia bagi tanaman. Kondisi tanah yang asam dapat menghambat proses mineralisasi unsur nitrogen (Munawar 2011). Akibatnya, ketersediaan unsur nitrogen bagi tanaman menjadi rendah. Kondisi pH yang rendah mengakibatkan ketersediaan unsur P menjadi rendah, karena pada tanah asam (pH rendah), fosfat larut akan bereaksi dengan Fe atau Al larut yang membentuk senyawa Fe- atau Al-fosfat yang tidak larut. Akibatnya, unsur P tidak dapat diserap oleh tanaman. Unsur kalium secara umum masih dapat diserap oleh tanaman pada kondisi asam, yaitu pH >5.5 (Munawar 2011). Oleh karena itu, unsur hara yang diperlukan oleh tanaman sebagian besar berasal dari tanah.
Menurut BMKG (2005), curah hujan yang terjadi selama musim tanam pertama tersebut termasuk kategori sedang. Curah hujan yang demikian akan mempengaruhi suhu, pencucian unsur hara dalam tanah, dan juga fotosintesis. Kondisi curah hujan yang tinggi akan mengurangi intensitas cahaya selama fotosintesis yang akan mempengaruhi hasil fotosintesis, yaitu jumlah karbohidrat yang terbentuk. Semakin tinggi curah hujan, maka akan semakin berkurang intensitas cahaya matahari yang diperlukan oleh tumbuhan dan mengakibatkan jumlah karbohidrat hasil fotosintesis akan semakin berkurang. Selain itu, curah hujan yang tinggi juga akan mengikis unsur hara di dalam tanah, sehingga unsur hara yang ada di dalam tanah menjadi berkurang (Gardner Pearce 1991).
Ekstraksi Oligosakarida
14
Ada tujuh metode yang diujicobakan untuk mendapatkan metode ekstraksi oligosakarida yang sesuai dengan sampel kolesom. Permasalahan dalam isolasi komponen oligosakarida pada pucuk kolesom adalah terdapat komponen klorofil dan juga pektin. Menurut Nielsen (2003), proses ekstraksi komponen karbohidrat dengan menggunakan larutan etanol 80% akan memaksimalkan ekstraksi komponen pigmen yang terdapat di dalam sampel. Bubuk CaCO3 yang digunakan
dalam proses ekstraksi oligosakarida, berfungsi untuk menjaga kondisi pada sampel tidak asam saat proses pemanasan berlangsung (Shiomi 1992) dan meningkatkan terbentuknya pektin saat proses ekstraksi (Ridley at al. 2000), sehingga komponen pektin yang bereaksi dengan ion Ca2+ akan dapat dipisahkan dengan proses sentrifuse.
Metode ekstraksi oligosakarida pertama yang diujicobakan adalah metode ekstraksi (a). Jika Wang et al. (2007) menggunakan perbandingan sampel:larutan (1:10), maka dalam metode ekstraksi (a) digunakan perbandingan sampel:larutan (1:8). Larutan ekstrak pucuk kolesom yang dihasilkan dari metode ekstraksi (a) masih terdapat pengotor berupa serbuk potongan daun yang halus yang mengendap pada bagian bawah tabung reaksi setelah penyimpanan selama 24 jam di freezer dan komponen klorofil yang masih pekat. Jika dibandingkan antara larutan ekstraksi yang disaring dengan kertas saring dan larutan ekstraksi yang tidak disaring dengan kertas saring, maka hasilnya tidak menunjukkan adanya perbedaan.
Ekstraksi oligosakarida dengan metode ekstraksi (b), terdapat penambahan Pb-asetat dan Na-oksalat setelah pemindahan supernatant. Pb-asetat yang ditambahkan berfungsi untuk menghilangkan komponen pigmen klorofil dan Na-oksalat berfungsi untuk menghilangkan kelebihan Pb-asetat dalam larutan ekstraksi (Çağet al. 2007). Hasil ekstraksi dengan metode (b) akan menghasilkan larutan ekstrak berwarna hijau kekuning-kuningan, namun jumlah ekstrak sedikit dan terdapat kristal garam di dalam sampel pada tabung reaksi, serta terdapat endapan pada bagian bawah tabung reaksi setelah penyimpanan di dalam freezer
selama 24 jam.
15 Metode ekstraksi oligosakarida (a) dan (b) merupakan metode ekstraksi oligosakarida dengan perbandingan sampel dan pelarut 1:8, yang masih menghasilkan larutan ekstrak yang berwarna hijau yang pekat. Oleh karena itu, metode ekstraksi oligosakarida (c) menggunakan perbandingan sampel dan pelarut 1:16 agar komponen klorofil dalam larutan ekstraksi tidak terlalu pekat dan dikombinasikan dengan Pb-asetat dan Na-oksalat.
Gambar 4 (Kiri-Kanan) Ekstrak kolesom yang telah ditambahkan Pb-asetat dan Na-oksalat dan Ekstrak kolesom tanpa Pb-asetat dan Na-oksalat
Hasil ekstraksi metode (c) dengan perbandingan 1:16, menghasilkan larutan ekstrak berwarna hijau yang tidak pekat, seperti metode ekstraksi dengan perbandingan 1:8. Penambahan Pb-asetat hingga penetralan dengan Na-oksalat pada proses ekstraksi, akan menghasilkan larutan ekstrak berwarna hijau kekuning-kuningan dengan jumlah yang sedikit dan terdapat kristal garam di dalam sampel pada tabung reaksi, serta masih terdapat endapan pada bagian bawah tabung reaksi setelah penyimpanan selama 24 jam di dalam freezer.
Proses ekstraksi oligosakarida dengan menggunakan tiga metode sebelumnya, masih terdapat bintik hijau (pengotor) berupa serbuk pucuk kolesom yang halus yang akan mengendap pada bagian bawah tabung reaksi, setelah penyimpanan selama 24 jam di dalam freezer. Oleh karena itu, proses ekstraksi selanjutnya akan menggunakan silica gel-60 untuk menjerap pigmen atau pengotor yang terdapat pada larutan hasil ekstraksi.
Metode ekstraksi (d) memiliki kesamaan proses dengan metode ekstraksi (c), namun pada metode (d) terdapat proses elusi dengan silica gel-60 setelah proses penyaringan dengan kertas saring. Serbuk pucuk kolesom yang diekstraksi dengan metode (d) masih terdapat pengotor yang mengendap pada bagian bawah tabung reaksi setelah penyimpanan selama 24 jam di dalam freezer. Namun, endapan yang ditemukan di bagian bawah tabung reaksi lebih sedikit dibandingkan dengan endapan pada metode ekstraksi sebelumnya.
gel-16
60. Hasil ekstraksi dengan menggunakan metode ini, masih terdapat endapan pada bagian bawah tabung reaksi setelah penyimpanan selama 24 jam di dalam freezer.
Gambar 5 (Kiri-Kanan) Ekstrak kolesom terhadap etanol (1:8) dan Ekstrak kolesom terhadap etanol (1:16)
Penambahan Pb-asetat dan Na-oksalat, maupun silica gel-60, serta kombinasi Pb-asetat dan Na-oksalat dengan silica gel-60 pada proses ekstraksi, masih terdapat endapan pada larutan ekstraksi, sehingga setelah penyimpanan selama 24 jam di dalam freezer serbuk pucuk kolesom yang halus akan mengendap pada bagian bawah tabung reaksi. Proses ekstraksi selanjutnya tidak menggunakan Pb-asetat dan Na-oksalat, namun akan menggunakan prinsip pengenceran untuk mengurangi konsentrasi klorofil di dalam larutan ekstraksi dan proses elusi ke dalam cartridge dengan silica gel-60.
Metode ekstraksi (f) menggunakan perbandingan sampel dan pelarut 1:16, namun dengan skala yang lebih kecil dari sebelumnya. Proses ekstraksi ini menggunakan prinsip pengenceran sebelum dan sesudah proses sentrifuse, yang bertujuan untuk mengurangi konsentrasi komponen klorofil di dalam larutan ekstraksi. Hasil ekstraksi dengan metode ini, menghasilkan larutan ekstraksi berwarna kuning dan tampak jernih. Setelah dilakukan penyimpanan selama 24 jam, tidak ditemukan endapan atau pengotor pada bagian bawah tabung reaksi.
17
Gambar 7 (Kiri-Kanan) Ekstrak kolesom sebelum dielusikan dengan silica gel-60
dan Ekstrak kolesom setelah dielusikan dengan silica gel-60
Hasil ekstraksi dengan metode ekstraksi (f) dianalisis kandungan gula sederhana dan oligosakaridanya dengan menggunakan HPLC. Namun, metode ekstraksi (f) tidak menghasilkan peak kromatogram pada analisis HPLC dan diduga bahwa hasil ekstraksi dengan metode tersebut terlalu encer dan komponen oligosakarida terikat dengan silica gel-60, sehingga tidak terdapat peak pada kromatogram HPLC. Komponen oligosakarida yang terikat dengan silica gel-60
dapat dikeluarkan dengan mengelusi kembali silica gel-60 menggunakan larutan etanol 80%.
18
Gambar 9 Struktur Silica gel-60
Struktur kimia pada bubuk silica gel-60 (Gambar 9) menunjukkan terdiri dari gugus silanol (-Si-OH) dan silandiol (-Si(OH)2) yang bersifat polar. Struktur
senyawa yang demikian akan mengikat senyawa oligosakarida yang memiliki gugus hidroksil (-OH) yang juga bersifat polar, sehingga saat proses elusi dengan
silica gel-60, komponen analit (oligosakarida) yang akan dianalisis akan tertahan dan berikatan dengan silica gel-60 dan komponen klorofil yang bersifat non-polar akan tetap berada di dalam larutan ekstraksi.
Proses ekstraksi selanjutnya tidak menggunakan silica gel-60 untuk menjerap atau mengkelat komponen pigmen. Namun digunakan kolom Sep-Pak C-18 Varian dan larutan etanol 70%. Kolom SepPak C-18 Varian digunakan sebagai alat untuk proses clean-up hasil ekstraksi yang bersifat non-polar (Gambar 10), sehingga untuk mengekstrak komponen oligosakarida digunakan metode ekstraksi (g). Larutan ekstraksi hasil metode (g) yang dielusikan dengan menggunakan kolom Sep-Pak C-18 Varian akan menghasilkan larutan berwarna kuning dan setelah penyimpanan selama 24 jam tidak ditemukan serbuk halus pucuk kolesom yang mengendap di bagian bawah tabung reaksi. Hasil ekstraksi ini kemudian diinjeksikan ke HPLC dan terdapat peak yang terlihat pada kromatogram HPLC (Gambar 12) sesuai dengan waktu retensi standar (Lampiran 9) yang digunakan. Dengan demikian, proses ekstraksi komponen oligosakarida selanjutnya akan menggunakan metode ekstraksi (g).
19
Gambar 11 (Kiri-Kanan) Larutan ekstrak daun kolesom setelah dielusikan dengan
cartridge SepPak C-18 (Agilent) dan Larutan ekstrak daun kolesom sebelum dielusikan dengan cartridge SepPak C-18 (Agilent)
Analisis Gula Sederhana Pucuk Kolesom
Kandungan gula sederhana (fruktosa, glukosa, dan sukrosa) pucuk kolesom dihitung berdasarkan perbandingan luas area peak standar gula yang digunakan dan luas area peak sampel. Hasil analisis kandungan gula sederhana pucuk kolesom dapat dilihat pada Tabel 4:
Tabel 4 Kandungan Gula Sederhana Pucuk Kolesom Nama Sampel
Pukan sapi (0 ton/ha)+RP (0 ton/ha) + Abu Sekam (0 ton/ha)
Fruktosa Glukosa Sukrosa
Kolesom 4 322.45 ± 8.14 220.44 ± 5.85 12.21 ± 1.85 Kolesom 9 658.94 ± 15.26 1055.87 ± 81.03 32.61 ± 4.03 Kolesom 14 277.48 ± 5.54 407.95 ± 12.44 89.44 ± 35.92 Rata-rata 419.62 ± 208.47 561.42 ± 438.35 44.75 ± 40.02
Pukan sapi (0 ton/ha)+RP (1,5 ton/ha) + abu sekam (5,5 ton/ha) Kolesom 3 295.96 ± 4.27 176.18 ± 8.15 20.76 ± 0.30 Kolesom 8 195.57 ± 6.75 371.49 ± 62.74 24.71 ± 4.03 Kolesom 13 79.60 ± 1.08 402.98 ± 8.14 20.86 ± 2.87 Rata-rata 190.38 ± 108.27 316.88 ± 122.87 22.11 ± 2.25 Pukan sapi (12,3 ton/ha)+RP (0 ton/ha) + abu sekam (5,5 ton/ha) Kolesom 2 434.17 ± 3.84 254.71 ± 0.09 41.28 ± 0.92 Kolesom 7 382.47 ± 3.37 303.90 ± 23.84 10.84 ± 1.57 Kolesom 12 139.31 ± 29.24 632.61 ± 206.78 30.76 ± 9.87 Rata-rata 318.65 ± 157.45 397.07 ± 205.46 27.63 ± 15.46
20
Pukan sapi (12,3 ton/ha)+RP (1,5 ton/ha) + abu sekam (5,5 ton/ha) Kolesom 5 88.01 ± 10.94 76.39 ± 26.45 50.25 ± 3.31 Kolesom 10 331.56 ± 13.53 17.65 ± 0.45 16.24 ± 3.40 Kolesom 15 37.80 ± 9.93 430.41 ± 10.31 13.83 ± 0.92 Rata-rata 152.46 ± 157.13 174.82 ± 223.29 26.77 ± 20.37 Keterangan: Kandungan Gula dalam mg/100 g BK ± Standar Deviasi
Berdasarkan hasil analisis, kandungan fruktosa tertinggi terdapat pada pucuk kolesom tanpa pemupukan, yakni sebesar 419.62 mg/100 g BK dan terendah terdapat pada pucuk kolesom hasil pemupukan PK+RP+AS, yakni sebesar 152.46 mg/100 g BK. Secara berurutan, pucuk kolesom dengan kadar fruktosa dari tertinggi ke rendah antara lain pucuk kolesom tanpa pemupukan (kontrol), pucuk kolesom hasil pemupukan PK+AS, pucuk kolesom hasil pemupukan PK+RP, pucuk kolesom hasil pemupukan RP+AS, dan pucuk kolesom hasil pemupukan PK+RP+AS.
Kandungan glukosa tertinggi terdapat pada pucuk kolesom tanpa pemupukan (kontrol), yakni sebesar 561.42 mg/100 g B dan terendah terdapat pada pucuk kolesom hasil pemupukan PK+RP, yakni sebesar 157.64 mg/100 g BK. Secara berurutan, pucuk kolesom dengan kadar glukosa dari yang tertinggi ke rendah antara lain pucuk kolesom tanpa pemupukan, pucuk kolesom hasil pemupukan PK+AS, pucuk kolesom hasil pemupukan RP+AS, pucuk kolesom hasil pemupukan PK+RP+AS, dan pucuk kolesom hasil pemupukan PK+RP.
Analisis kadar sukrosa pada pucuk kolesom menunjukkan kadar sukrosa tertinggi terdapat pada pucuk kolesom tanpa pemupukan (kontrol), yakni sebesar 44.75 mg/100 g BK dan kadar sukrosa terendah terdapat pada pucuk kolesom hasil pemupukan RP+AS. Secara beurutan, pucuk kolesom dengan kadar sukrosa dari yang tertinggi ke terendah antara lain pucuk kolesom tanpa pemupukan, pucuk kolesom hasil pemupukan PK+AS, pucuk kolesom hasil pemupukan PK+RP+AS, pucuk kolesom hasil pemupukan PK+RP, dan pucuk kolesom hasil pemupukan RP+AS.
Total kadar gula sederhana (fruktosa, glukosa, dan sukrosa) yang terdapat pada pucuk kolesom, jika diurutkan dari yang tertinggi ke terendah antara lain 1025.79 mg/100 g BK (pucuk kolesom tanpa pemupukan), 743.35 mg/100 g BK (pucuk kolesom hasil pemupukan PK+AS), 529.37 mg/100 g BK (pucuk kolesom hasil pemupukan RP+AS), 389.68 mg/100 g BK (pucuk kolesom hasil pemupukan PK+RP), dan 354.05 mg/100 g BK (pucuk kolesom hasil pemupukan PK+RP+AS).
21
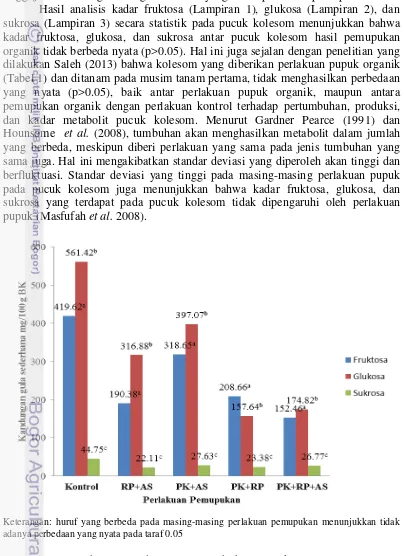
Gambar 12 Kromatogram kolesom hasil metode ekstraksi (g)
Meskipun kadar N dalam jaringan yang terdapat pada kontrol adalah yang terendah, namun kadar K dalam jaringan yang terdapat pada kontrol adalah yang tertinggi. Hasil metabolit primer akan lebih dipengaruhi oleh penyerapan unsur kalium yang berperan dalam mempertahankan vigor tanaman, terlibat dalam
F G
St R
S
U
U
U
Keterangan: F : Fruktosa G : Glukosa S : Sukrosa R : Rafinosa St : Stakiosa U : Unknown
U
22
pembentukan karbohidrat, dan translokasi gula. Selain itu, unsur kalium juga berperan dalam memelihara potensial osmotis pada tanaman (Gardner Pearce 1991). Tanaman yang cukup unsur K hanya kehilangan sedikit air saat proses fotosintesis dan proses fotosintesis yang membutuhkan air akan lebih maksimal. Kondisi laju asimilasi dan penyerapan kalium yang tinggi pada kolesom tanpa perlakuan pemupukan ini, akan menghasilkan komponen gula sederhana yang tinggi jika dibandingkan dengan kolesom yang diberi perlakuan pemupukan.
Hasil analisis kadar fruktosa (Lampiran 1), glukosa (Lampiran 2), dan sukrosa (Lampiran 3) secara statistik pada pucuk kolesom menunjukkan bahwa kadar fruktosa, glukosa, dan sukrosa antar pucuk kolesom hasil pemupukan organik tidak berbeda nyata (p>0.05). Hal ini juga sejalan dengan penelitian yang dilakukan Saleh (2013) bahwa kolesom yang diberikan perlakuan pupuk organik (Tabel 1) dan ditanam pada musim tanam pertama, tidak menghasilkan perbedaan yang nyata (p>0.05), baik antar perlakuan pupuk organik, maupun antara pemupukan organik dengan perlakuan kontrol terhadap pertumbuhan, produksi, dan kadar metabolit pucuk kolesom. Menurut Gardner Pearce (1991) dan Hounsome et al. (2008), tumbuhan akan menghasilkan metabolit dalam jumlah yang berbeda, meskipun diberi perlakuan yang sama pada jenis tumbuhan yang sama juga. Hal ini mengakibatkan standar deviasi yang diperoleh akan tinggi dan berfluktuasi. Standar deviasi yang tinggi pada masing-masing perlakuan pupuk pada pucuk kolesom juga menunjukkan bahwa kadar fruktosa, glukosa, dan sukrosa yang terdapat pada pucuk kolesom tidak dipengaruhi oleh perlakuan pupuk (Masfufah et al. 2008).
Keterangan: huruf yang berbeda pada masing-masing perlakuan pemupukan menunjukkan tidak adanya perbedaan yang nyata pada taraf 0.05
23 Tabel 5 Kadar gula sederhana berbagai sayuran
Keterangan: a)Hounsome N et al. (2008); b) Hernández et al. (1998)
Tabel 5 merupakan tabel yang menampilkan kadar gula sederhana pada berbagai sayuran. Jika dibandingkan sayuran lainnya, seperti brokoli, bawang, bunga kol, tomat, pea, dan kidney bean, pucuk kolesom memiliki profil gula sederhana yang lengkap, yakni memiliki kandungan fruktosa, glukosa, dan sukrosa.
Analisis Oligosakarida Pucuk Kolesom
Kandungan oligosakarida (rafinosa dan stakiosa) pucuk kolesom dihitung berdasarkan perbandingan luas area peak standar gula yang digunakan dan luas area peak sampel. Hasil analisis kandungan oligosakarida pucuk kolesom dapat dilihat pada Tabel 6:
Tabel 6 Kandungan Oligosakarida Pucuk Kolesom Nama Sampel
Pukan sapi (0 ton/ha)+RP (0 ton/ha) + Abu Sekam (0 ton/ha)
Rafinosa Stakiosa
Kolesom 4 29.05 ± 2.57 29.58 ± 11.88
Kolesom 9 47.01 ± 7.20 37.18 ± 7.57
Kolesom 14 55.47 ± 3.96 37.68 ± 3.71
Rata-rata 43.84 ± 13.49 34.81 ± 4.54
Pukan sapi (0 ton/ha)+RP (1,5 ton/ha) + abu sekam (5,5 ton/ha)
Kolesom 3 9.02 ± 3.00 15.18 ± 6.91
Kolesom 8 20.82 ± 3.26 48.78 ± 5.11
Kolesom 13 26.94 ± 0.54 51.66 ± 2.17
Rata-rata 18.93 ± 9.11 38.54 ± 20.28
Pukan sapi (12,3 ton/ha)+RP (0 ton/ha) + abu sekam (5,5 ton/ha) Sayuran Kandungan Gula Sederhana (g/100 g)
Fruktosa Glukosa Sukrosa
Pucuk Kolesom (Kontrol) 0.395 0.526 0.042
Pucuk Kolesom (PK+AS) 0.304 0.379 0.026
Pucuk Kolesom (PK+RP) 0.197 0.150 0.022
Pucuk Kolesom (RP+AS) 0.177 0.294 0.021
24
Kolesom 2 16.54 ± 10.50 44.70 ± 3.94
Kolesom 7 50.58 ± 54.78 36.09 ± 2.57
Kolesom 12 42.35 ± 1.87 66.79 ± 9.63
Rata-rata 36.49 ± 17.76 49.19 ± 15.84
Pukan sapi (12,3 ton/ha)+RP (1,5 ton/ha) + abu sekam (0 ton/ha)
Kolesom 1 14.46 ± 2.97 22.63 ± 3.42
Kolesom 6 44.11 ± 1.47 24.58 ± 3.97
Kolesom 11 71.27 ± 0.13 47.72 ± 6.90
Rata-rata 43.28 ± 28.41 31.64 ± 13.96
Pukan sapi (12,3 ton/ha)+RP (1,5 ton/ha) + abu sekam (5,5 ton/ha)
Kolesom 5 17.93 ± 0.52 10.34 ± 0.98
Kolesom 10 19.56 ± 3.38 10.29 ± 2.41
Kolesom 15 104.33 ± 37.73 100.38 ± 68.02
Rata-rata 47.27 ± 49.42 40.34 ± 52.00
Keterangan: Kandungan Gula dalam mg/100 g BK ± Standar Deviasi
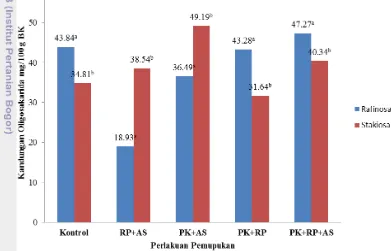
Berdasarkan hasil analisis, kandungan rafinosa tertinggi terdapat pada pucuk kolesom hasil pemupukan, yakni sebesar 47.27 mg/100 g BK dan kandungan rafinosa terendah terdapat pada pucuk kolesom hasil pemupukan RP+AS, yakni sebesar 18.93 mg/100 g BK. Secara berurutan, pucuk kolesom dengan kadar rafinosa dari tertinggi ke rendah antara lain pucuk kolesom hasil pemupukan PK+RP+AS, pucuk kolesom tanpa pemupukan (kontrol), pucuk kolesom hasil pemupukan PK+RP, pucuk kolesom hasil pemupukan PK+AS, dan pucuk kolesom hasil pemupukan RP+AS.
Kandungan stakiosa tertinggi terdapat pada pucuk kolesom hasil pemupukan PK+AS, yakni sebesar 49.19 mg/100 g BK dan kandungan stakiosa terendah terdapat pada pucuk kolesom hasil pemupukan PK+RP, yakni sebesar 31.64 mg/100 g BK. Secara beurutan, pucuk kolesom dengan kadar stakiosa dari yang tertinggi ke terendah antara lain pucuk kolesom hasil pemupukan PK+AS, pucuk kolesom hasil pemupukan PK+RP+AS, pucuk kolesom hasil pemupukan RP+AS, pucuk kolesom tanpa pemupukan (kontrol), dan pucuk kolesom hasil pemupukan PK+RP.
25 bentuk pati, fruktan, atau bentuk cadangan makanan yang lain (Gardner Pearce 1991). Hal ini mengakibatkan kondisi perlakuan pemupukan PK+RP+AS memiliki kandungan oligosakarida yang tinggi dibandingkan perlakuan kontrol.
Hasil analisis kadar rafinosa (Lampiran 4) dan kadar stakiosa (Lampiran 5) secara statistik pada pucuk kolesom menunjukkan bahwa kadar rafinosa dan stakiosa antar pucuk kolesom hasil pemupukan organik tidak berbeda nyata (p>0.05). Penelitian yang dilakukan Saleh (2013) terhadap kolesom yang ditanam pada musim tanam pertama menyatakan bahwa kolesom yang diberikan perlakuan pupuk organik (Tabel 1) dan ditanam pada musim tanam pertama, tidak menghasilkan perbedaan yang nyata (p>0.05), baik antar perlakuan pupuk organik, maupun antara pemupukan organik dengan perlakuan kontrol terhadap pertumbuhan, produksi, dan kadar metabolit pucuk kolesom. Standar deviasi yang tinggi pada masing-masing perlakuan pupuk pada pucuk kolesom juga menunjukkan bahwa kadar rafinosa yang terdapat pada pucuk kolesom tidak dipengaruhi oleh perlakuan pupuk (Masfufah et al. 2008).
Keterangan: huruf yang berbeda pada masing-masing perlakuan pemupukan menunjukkan tidak adanya perbedaan yang nyata pada taraf 0.05
Gambar 14 Kandungan oligosakarida (rafinosa dan stakiosa) pucuk kolesom Kandungan rafinosa yang terdapat pada pucuk kolesom tidak terlalu tinggi jika dibandingkan dengan kandungan rafinosa yang terdapat pada sayur kubis, brokoli, pea, dan kidney bean. Kandungan stakiosa yang terdapat pada pucuk kolesom tidak terlalu tinggi jika dibandingkan dengan kandungan stakiosa yang terdapat pada kubis, brokoli, bawang, pea, dan kidney bean (Tabel 7).
26
yang dilakukan oleh Benno et al. (1984) dalam Salminen et al. (2004) menyatakan bahwa pemberian 15 gram rafinosa perhari selama 4 minggu dapat meningkatkan jumlah bifidobakteria dalam saluran pencernaan manusia secara signifikan.
FOS merupakan senyawa yang termasuk kategori GRAS. Menurut FDA (2007) konsumsi regular FOS adalah sekitar 3-20 g/hari pada orang dewasa. Menurut Roberfroid et al. (1998), umumnya dosis FOS dalam asupan terhadap percobaan klinis yang pernah dilakukan berkisar antara 3-20 g/hari untuk orang dewasa dan 0.4-3 g/hari untuk balita. Dengan demikian, jika mengonsumsi 100 g pucuk kolesom, maka sumbangan asupan oligosakarida (Tabel 8) yang diperoleh dari pucuk kolesom adalah sekitar 1.8-2.77% dari asupan atau kebutuhan minimal FOS yang dianjurkan FDA.
Tabel 7 Kadar oligosakarida pada berbagai sayuran
Sayuran Kandungan Oligosakarida (g/100 g)
Maltotriosa Maltotetriosa Rafinosa Stakiosa
Kubis - - 0.06-0.1 a 0.06 a
Pucuk kolesom tidak hanya memiliki kandungan oligosakarida berupa rafinosa dan stakiosa. Hasil analisis kromatogram pucuk kolesom (Gambar 12) menunjukkan bahwa terdapat tiga peak unknown pada range wilayah peak sukrosa dan rafinosa dan satu peak unknown pada range wilayah rafinosa dan stakiosa.
27 Tabel 8 Kandungan oligosakarida dan total oligosakarida pucuk kolesom
Total Gula Pucuk Kolesom
Pengukuran total gula pada pucuk kolesom dilakukan dengan metode Anthrone yang dibagi menjadi dua tahap, yaitu pembuatan kurva standar dan penetapan total gula pada pucuk kolesom. Pembuatan kurva standar dilakukan dengan menggunakan larutan glukosa dan menghasilkan persamaan regresi (Gambar 15). Penetapan total gula pada pucuk kolesom dilakukan dengan dengan menggunakan persamaan regresi yang diperoleh dari kurva standar glukosa. Hasil pengukuran total gula pada pucuk kolesom pada masing-masing hasil kombinasi pemupukan dapat diamati pada Gambar 16.
Gambar 15 Kurva standar glukosa
Berdasarkan analisis dengan metode Anthrone, total gula pucuk kolesom yang tertinggi terdapat pada pucuk kolesom tanpa pemupukan (kontrol), yakni 1365.20 gm/100 g BK dan total gula pucuk kolesom yang terendah terdapat pada pucuk kolesom hasil pemupukan PK+RP+AS, yakni sebesar 647.34 mg/100 g BK. Secara berurutan, pucuk kolesom dengan total gula yang tertinggi ke terendah antara lain pucuk kolesom tanpa pemupukan (kontrol), pucuk kolesom hasil pemupukan PK+AS, pucuk kolesom hasil pemupukan PK+RP, pucuk kolesom hasil pemupukan RP+AS, dan pucuk kolesom hasil pemupukan PK+RP+AS.
Sayuran Kandungan Oligosakarida (g/100 g) Total Oligosakarida Rafinosa Stakiosa
Pucuk Kolesom
(Kontrol) 0.041 0.033 0.074
Pucuk Kolesom
(PK+AS) 0.035 0.047 0.082
Pucuk Kolesom
(PK+RP) 0.041 0.030 0.071
Pucuk Kolesom
(RP+AS) 0.018 0.036 0.054
Pucuk Kolesom
28
Keterangan: huruf pada masing-masing perlakuan pemupukan menunjukkan tidak adanya perbedaan yang nyata pada taraf 0.05
Gambar 16 Total gula pucuk kolesom
Berdasarkan analisis statistik, total gula pucuk kolesom pada masing-masing pemupukan tidak berbeda nyata (p>0.05) (Lampiran 7). Standar deviasi yang tinggi pada masing-masing perlakuan pupuk pada pucuk kolesom menunjukkan bahwa kadar total yang terdapat pada pucuk kolesom tidak dipengaruhi oleh perlakuan pupuk (Masfufah et al. 2008).
SIMPULAN DAN SARAN
Simpulan
29
Saran
Pemupukan organik dan musim hujan, tidak memberikan pengaruh yang nyata terhadap kandungan oligosakarida dan total gula daun kolesom hasil musim tanam pertama. Penelitian lebih lanjut mengenai identifikasi senyawa gula sederhana dan oligosakarida pada pucuk kolesom dapat dilakukan dengan menganalisis peak kromatogram yang muncul di antara peak sukrosa dan rafinosa, serta peak antara rafinosa dan stakiosa. Penelitian lebih lanjut mengenai daun kolesom hasil musim tanam pertama, dapat diarahkan pada pengkajian kandungan antioksidan dan total fenol.
DAFTAR PUSTAKA
Aja PM, Okaka ANC, Onu PN, Ibiam U, Urako AJ. 2010. Phytochemical composition of Talinum triangulare (water leaf) leaves. Pakistan Journal of Nutrition 9 (6): 527-530.
Aja PM, Okaka ANC, Onu PN, Ibiam U, Urako AJ. 2010. Proximate analysis of
Talinum triangulare (water leaf) leaves and its softening principle. Pakistan Journal of Nutrition (9) 6: 524-528.
Apriyantono A, Fardiaz D, Puspitasari NL, Sedarnawati, Budiyanto S. 1989. Analisis Pangan. Bogor: PAU Pangan dan Gizi IPB
[Balittanah] Balai Penelitian Tanah. 2005. Analisis Kimia Tanah, Tanaman, dan Air. Bogor (ID): Balittanah
Cui SW. 2005. Food Carbohydrates: Chemistry, Physical Properties, and Application. USA: CRC Press
Epshtein NA. 2004. Structure of chemical compounds, methods of analysis and process control: Validation of HPLC techniques for pharmaceutical analysis. Pharmaceutical Chemistry Journal 38 (4):40-56
Farchany SA. 2012. Pemberian Kombinasi Pupuk Organik sebagai Pengganti Penggunaan Pupuk Anorganik pada Pertumbuhan dan Produksi Kolesom [Skripsi]. Bogor (ID): Institut Pertanian Bogor
Gardner FP and Pearce RB. 1991. Fisiologi Tanaman Budidaya. Cetakan ke-1. Susilo H, Subiyanto, penerjemah. Jakarta (ID): UI Press. Terjemahan dari:
Physiology of Crop Plants
Garg S and Bahl GS. 2008. Phosphorus availability to maize as influenced by organic manures and fertilizer P associated phosphatase activity in soils.
J.biortech. 99:5773-5777
Harmita. 2004. Petunjuk pelaksanaan validasi metode dan cara perhitungannya. Dalam: Majalah Ilmu Kefarmasian, Vol. I, No. 3:117-135
Hasibuan BE. 2006. Pupuk dan Pemupukan. Medan: Fakultas Pertanian Universitas Sumatera Utara
30
Hernández I, Alegre L, Munné-Bosch S. 2004. Drought-induced changes in flavonoids and other low molecular weight antioxidants in Cistuss clusii
grown under Mediteranian field conditions. Tree physiology. 24:1303-1311
Hounsome N, Hounsome B, Tomos D, and Jones GE. 2008. Plant metabolites and nutritional quality of vegetables. Journal of Food Science Vol. 73 Nr. 4
Kusuma ME. 2012. Pengaruh beberapa jenis pupuk kandang terhadap kualitas bokashi. Jurnal Ilmu Hewani Tropika Vol 1. No. 2
Lingga dan Marsono. 2007. Petunjuk Penggunaan Pupuk. Jakarta: Penebar Swadaya
Liying Z, Li D, Qiao S, Johnson EW, Li B, Thacker PA, Han NK. 2003. Effect of stachyose on performance, diarrhea incidence and intestinal bacteria in weanling pigs. Arch Anim Nutr (57):1-10
Mualim L. 2012. Produksi dan kualitas kolesom dengan pemupukan organik dan inorganik [Disertasi]. Bogor (ID): Institut Pertanian Bogor
Munawar A. 2011. Kesuburan Tanah dan Nutrisi Tanaman. Bengkulu (ID): IPB-Press
Mosali J, Girma K, Teal RK, Freeman KW, Martin KL, Raun WR. 2005. Effect of foliar application on winter grain yield, phosporus uptake and use efficiency. J Plant Nutr 29:2147-2163
Pickering HW, Menzies NW, Hunter MN. 2002. Zeolite/rock phosphate –a novel slow release phosphorus fertilizer for potted plant production. Scientia Horticulturae 94:333-343
Prabekti YS. 2012. Kandungan serat pangan daun kolesom (Talinum triangulare
(Jacq.) Willd) pada budidaya dengan pemupukan organik dan anorganik [Skripsi]. Bogor (ID): Institut Pertanian Bogor
Ravindran G. 1990. Study on the flatus potential of dietary fibre from some legumes. J. Natn. Sci. Coun. Sri langka 18 (2): 127-132.
Ridley BL, O’Neil MA, Mohnen D. 2001. Pectins: structure, biosynthesis, and oligogalacturonide-related signaling. Phytochemistry 57: 929-967
Roberfroid MB, van Loo JAE, dan Gibson GR. 1998. The bifidogenic nature of chicory inulin and its hydrolysis product. J Nutr 128:11-19
Saleh I. 2013. Pertumbuhan, produksi, dan kadar metabolit pucuk kolesom (Talinum triangulare (Jacq.) Willd) dengan pemupukan organik berulang [Tesis]. Bogor (ID): Institut Pertanian Bogor
Salisbury FB and Ross CW. 1992. Fisiologi Tumbuhan. Jilid ke-2. Lukman DR, Sumaryono, penerjemah. Bandung (ID). Penerbit ITB. Terjemahan dari:
Plant Physiology, 4th edition
Salminen S, Wright AV, Ouwehand A. 2004. Lactic Acid Bacteria: Microbiology and Functional Aspect 2nd Edition, Revised, and Expanded. New York: Marcell Dekker, Inc