KARAKTERISASI FAG LITIK Proteus mirabilis
RESISTEN ANTIBIOTIK ASAL FESES PENDERITA DIARE
RACHMI AFRIANI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Karakterisasi Fag Litik Proteus mirabilis Resisten Antibiotik Asal Feses Penderita Diare adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
RINGKASAN
RACHMI AFRIANI. Karakterisasi Fag Litik Proteus mirabilis Resisten Antibiotik Asal Feses Penderita Diare. Dibimbing oleh SRI BUDIARTI dan IMAN RUSMANA.
Penyakit diare masih menjadi salah satu penyebab utama tingginya angka kematian di negara berkembang, termasuk Indonesia. Diare dapat disebabkan oleh berbagai mikroorganisme seperti virus, protozoa dan bakteri enteropatogen. Proteus mirabilis merupakan salah satu bakteri enteropatogen kelompok Gram negatif dari famili Enterobacteriacea yang dapat menyebabkan diare. Sebanyak 94 isolat Proteus berhasil diisolasi dari 518 sampel feses anak penderita diare dengan persentase P. mirabilis sebesar 91.5 % dan P. penneri sebesar 8.5%. Selain itu, terdapat 8 bakteri enteropatogen termasuk Proteus spp dengan jumlah 6 isolat yang berhasil diisolasi dari 100 sampel feses anak penderita diare berumur di bawah 5 tahun. Penggunaan antibiotik yang telah lama dipakai sebagai terapi dalam mengatasi infeksi bakteri patogen saat ini dilaporkan sudah tidak efektif, karena banyaknya bakteri yang telah resisten terhadap antibiotik. P. mirabilis termaksuk bakteri yang telah resisten terhadap antibiotik ampicillin, amoxicillin dan trimethoprim-sulfomethoxazole. Fag litik sebagai virus penginfeksi bakteri dapat digunakan untuk terapi alternatif yang dapat mengendalikan pertumbuhan bakteri patogen manusia. Oleh karena itu, penelitian ini bertujuan untuk mendapatkan dan mengkarakterisasi fag litik yang dapat melisiskan P. mirabilis yang telah resisten terhadap antibiotik.
Fag litik P. mirabilis diisolasi dari berbagai sumber fag, yaitu limbah cair rumah tangga, feses ayam dan kambing, limbah padat peternakan ayam, air sungai Ciparigi dan air sungai Situ Letik. Isolasi fag litik P. mirabilis berhasil didapatkan dari limbah peternakan ayam dan air sungai Situ Letik, Dramaga dengan jumlah 3 isolat. Masing-masing isolat menunjukkan morfologi plak yang berbeda dengan diameter mencapai 2 mm pada setiap plak yang muncul. Isolat fag 1 memiliki morfologi plak berbentuk bulat, bening dan memiliki cincin disekitar plak. Isolat fag 2 memiliki morfologi plak berbentuk bulat, samar tanpa ada cincin disekitar plak, sedangkan isolat fag 3 memiliki morfologi plak berbentuk bulat, bening tanpa ada cincin disekitar plak. Ketiga isolat fag ini memiliki tingkat stabilitas yang berbeda walaupun disimpan pada suhu yang sama dan di dalam bufer yang sama, yaitu bufer Saline Magnesium (SM). Isolat fag 1 dan 3 tidak dapat ditumbuhkan kembali saat dilakukan tahapan produksi fag. Hasil kisaran inang isolat fag 2 sebagai fag P. mirabilis yang berhasil dipurifikasi dan diproduksi menunjukkan bahwa fag litik P. mirabilis bersifat spesifik. Fag litik P. mirabilis tidak melisiskan bakteri Salmonella sp., Bacillus pumilus, Photobacterium damselae dan EPEC K.1.1.
SDS-PAGE menunjukkan adanya delapan pita protein dengan bobot molekul yang bervariasi sebesar 90.50, 82.03, 74.35, 43.31, 37.37, 30.70, 27.83 dan 20.72 kDa. Molekul protein dengan berat tertentu menunjukkan penyusun komponen fag seperti kepala, ekor dan serabut ekor. Hasil perhitungan terhadap konsentrasi protein fag P. mirabilis menunjukkan bahwa konsentrasi proteinnya sebesar 316.198 µg/mL.
SUMMARY
RACHMI AFRIANI. Characterization Lytic Phage of Proteus mirabilis Antibiotics Resistant from Feces of Diarrheal Patient. Supervised by SRI BUDIARTI and IMAN RUSMANA.
Diarrheal disease remains one of the main causes of death in developing countries, including Indonesia. Diarrhea can be caused by a variety of microorganisms such as viruses, protozoa and bacterial enteropathogens. Proteus mirabilis is a Gram-negative bacteria enteropathogens group of families Enterobacteriacea which can cause diarrhea. A total of 94 isolates of Proteus were isolated from faecal samples of 518 children with diarrhea by percentage of P. mirabilis 91.5% and P. penneri 8.5%. In addition, there are 8 bacterial enteropathogens including Proteus spp with 6 isolates that were isolated from stool samples of 100 children with diarrhea aged under 5 years. Antibiotics has been long used as a therapy to overcome the current pathogenic bacterial infection. Antibiotic treatment has been reported to be ineffective due to the emergence of antibiotic resistant bacteria, including P. mirabilis. P. mirabilis was resistant to ampicillin, amoxicillin and trimethoprim-sulfomethoxazole. Infection of lytic phages can be used as alternative therapies to control pathogenic bacteria. Therefore, this study aimed to obtain and characterize the lytic phage that can lyse P. mirabilis that were resistant to antibiotics.
Lytic phages P. mirabilis were isolated from various sources, namely domestic wastewater, feces of chicken and goat, chicken farm sewage, Ciparigi and Situ Letik river. Three isolates of lytic P. mirabilis phages were obtained from sewage of chicken farms and Situ Letik river, Dramaga. The isolates had different plaque morphology with a diameter up to 2 mm. Phage isolate 1 has plaque morphology round, translucent and has a ring around the plaque. Phage isolate 2 has plaque morphology round, with no ring around the cryptic plaques, whereas
components such as phage heads, tails and tail fibers. The proteins concentration of P. mirabilis phage is 316.1λ8 g/mL.
Keywords: diarrhea, lytic phage, Proteus mirabilis
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
KARAKTERISASI FAG LITIK Proteus mirabilis
RESISTEN ANTIBIOTIK ASAL FESES PENDERITA DIARE
RACHMI AFRIANI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Karakterisasi Fag Litik Proteus mirabilis Resisten Antibiotik Asal Feses Penderita Diare
Nama : Rachmi Afriani NIM : G351120301
Disetujui oleh
Komisi Pembimbing
Dr dr Sri Budiarti Ketua
Dr Ir Iman Rusmana Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji syukur penulis panjatkan kehadirat Allah SWT atas berkat rahmat, hidayah dan karuniaNya sehingga karya ilmiah ini berhasil diselesaikan. Judul yang dipilih dalam penelitian yang dilaksanakan sejak bulan September 2013 sampai Mei 2014 ini ialah Karakterisasi Fag Litik Proteus mirabilis Resisten Antibiotik Asal Feses Penderita Diare.
Terima kasih, penghargaan dan apresiasi penulis ucapkan kepada ibu Dr dr Sri Budiarti selaku ketua komisi pembimbing, yang telah memberikan bimbingan, perhatian, keteladanan, arahan, nasihat dan motivasi, membagikan ilmu, memberikan dorongan semangat yang tiada henti kepada penulis sejak awal pemilihan tema penelitian hingga penulisan tesis ini. Penulis banyak tergugah dengan kata “SEMANGAT” yang sering beliau ucapkan sehingga penulis tetap bersemangat dalam menjalankan penelitian hingga menyelesaikan penulisan tesis ini. Selain itu, terima kasih dan apresiasi setinggi-tingginya penulis ucapkan kepada bapak Dr Ir Iman Rusmana selaku anggota komisi pembimbing yang telah memberikan ide-ide cemerlang beliau kepada penulis, bimbingan, masukan, serta logika ilmiah beliau yang sangat banyak membantu penulis selama menjalankan penelitian dan menyelesaikan tesis. Penulis juga mengucapkan terima kasih kepada ibu Prof Dr Anja Meryandini, MS selaku ketua Program Studi Mikrobiologi dan ibu Dr drh Sri Murtini, MSi selaku penguji luar komisi pada ujian tesis yang telah memberikan masukan untuk kesempurnaan tesis ini.
Ungkapan terima kasih tak lupa penulis ucapkan untuk ibu Ita selaku asisten peneliti di Laboratorium TEM dan Histologi Lembaga Eijkman Jakarta Pusat, serta ibu Dewi selaku teknisi di Laboratorium Bioteknologi Hewan dan Biomedis PPSHB IPB yang telah banyak membagikan ilmu dan pengalamannya kepada penulis. Beliau dengan hati ikhlasnya meluangkan waktu dan tenaga demi kelancaran proses penelitian ini. Ungkapan sayang dan terima kasih yang tak terhingga penulis ucapkan untuk ayahanda Syech Idham Choled dan ibunda Nining Mariani Azwar atas semua dukungan, motivasi, nasehat dan doa-doa mereka yang senantiasa mengiringi setiap langkah penulis. Terima kasih abah dan ibu atas segala perjuangan dan pengorbanan ikhlas tanpa pamrih yang penulis rasakan dari kecil hingga sampai pada titik ini. Semoga Allah SWT memberikan kesempatan kepada penulis agar dapat menjadi anak yang berbakti bagi abah, ibu dan keluarga yang sangat penulis sayangi. Kepada seluruh keluarga di Pontianak dan Sintang, adik Syech Indah Rahmawati, Syech M. Reza Fahlevi dan Syech Dinda Hanriani, bu Upik, tek Atik, ayah Daus, tek buyung, om Hen, uni Vety dan Agung yang tak pernah putus memberikan doa, semangat dan dukungan kepada penulis agar terus semangat menyelesaikan penelitian ini.
Semoga bantuan, dukungan, perhatian dan doa yang telah diberikan kepada penulis mendapat berkah dan balasan pahala yang banyak dari Allah SWT. Akhir kata semoga karya ilmiah ini bermanfaat bagi kemajuan ilmu pengetahuan khususnya ilmu mikrobiologi.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN viv
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
Ruang Lingkup Penelitian 2
TINJAUAN PUSTAKA 3
Karakteristik Proteus mirabilis 3
Patogenisitas Proteus mirabilis 3
Karakteristik Fag 4
Penelitian dan Aplikasi Fag 5
METODE PENELITIAN 6
Kerangka Penelitian 6
Waktu dan Tempat Penelitian 6
Peremajaan Proteus mirabilis 7
Reidentifikasi dan Uji Patogenisitas Proteus mirabilis 7
Sensitifitas Proteus mirabilis terhadap Antibiotik 7
Isolasi Fag 7
Produksi Fag 8
Titrasi Fag 9
Penentuan Kisaran Inang Fag 9
Pengamatan Morfologi Fag dengan Transmision Electron Microscope (TEM) 9
Karakterisasi Protein 9
HASIL DAN PEMBAHASAN 11
Hasil 11
Pembahasan 15
Simpulan 19
Saran 19
DAFTAR PUSTAKA 20
LAMPIRAN 24
RIWAYAT HIDUP 27
DAFTAR TABEL
1 Hasil identifikasi KIT API 20E bakteri P. mirabilis 11 2 Resistensi P. mirabilis terhadap beberapa antibiotik 12
3 Hasil isolasi fag dari berbagai sumber fag 12
4 Karakteristik isolat-isolat fag litik P. mirabilis 13
5 Kisaran inang fag P. mirabilis 13
DAFTAR GAMBAR
1 Diagram alur penelitian 6
2 Morfologi fag P. mirabilis menggunakan TEM model JEOL JEM-1010 14 dengan pewarnaan 2% uranil asetat
3 Kisaran berat molekul protein fag P. mirabilis pada SDS-PAGE 14
DAFTAR LAMPIRAN
1 Pembuatan pereaksi Bradford untuk pengukuran konsentrasi protein 24
2 Kurva standar protein 24
3 Komposisi bahan dalam pembuatan gel pengumpul dan pemisah 25
4 Prosedur pewarnaan silver staining dan komposisi larutannya 25
5 Hasil pewarnaan Gram, morfologi dan hemolisin P. mirabilis 26
PENDAHULUAN
Latar Belakang
Penyakit diare masih menjadi salah satu penyebab utama tingginya angka kematian di negara berkembang, termasuk Indonesia. Diare dapat disebabkan oleh berbagai mikroorganisme seperti virus, protozoa dan bakteri enteropatogen. Proteus mirabilis merupakan salah satu bakteri enteropatogen kelompok Gram negatif dari famili Enterobacteriacea yang dapat menyebabkan diare. Silham (2012) melaporkan dari 518 sampel feses anak penderita diare terdapat sekitar 94 isolat Proteus dengan persentase Proteus mirabilis sebesar 91.5 % dan Proteus penneri sebesar 8.5%. Hasil penelitian Kilic et al. (2007) menunjukkan bahwa terdapat 8 bakteri enteropatogen termaksuk Proteus spp. dengan jumlah 6 isolat yang berhasil diisolasi dari 100 sampel feses anak penderita diare berumur di bawah 5 tahun.
Langkah pengobatan yang paling sering digunakan untuk mengendalikan penyakit diare akibat P. mirabilis adalah dengan pemberian antibiotik yang dapat menghambat pertumbuhan dan atau membunuh bakteri patogen tersebut. Namun, beberapa penelitian melaporkan bahwa saat ini penggunaan antibiotik untuk mengendalikan bakteri patogen ini menjadi tidak efektif digunakan karena timbulnya resistensi P. mirabilis terhadap antibiotik. Kim et al. (2004) menyatakan bahwa beberapa isolat P. mirabilis multiresisten terhadap sepuluh jenis antibiotik, yaitu: ampicillin, gentamicin, ceftazidime, cefotaxime, cefuroxime, cefalothin, cefepime, piperacillin, trimethoprim/sulfamethoxazole dan ciprofloxacin. Hasil penelitian Noriyuki et al. (2003) menunjukkan bahwa beberapa isolat P. mirabilis memiliki gen ESBL (extended-spectrum β- lactamases) yang berperan dalam peningkatan resistensi P. mirabilis terhadap antibotik golongan β- lactam.
Bakteri P. mirabilis yang resisten antibiotik dapat mencemari air dan makanan. Seiring dengan pesatnya perkembangan ilmu pengetahuan dan teknologi maka banyak penelitian dilakukan untuk mencari dan mengetahui agen biokontrol yang bersifat ramah lingkungan untuk mengatasi pencemaran air dan makanan oleh P. mirabilis, salah satunya dengan penggunaan fag litik.
Penggunaan fag litik dalam mengontrol pertumbuhan bakteri patogen manusia merupakan suatu metode alternatif alami yang bersifat ramah lingkungan. Sumber fag yang paling umum digunakan untuk mereduksi bakteri patogen pencemar air dan makanan dapat diisolasi dari tinja, berbagai macam bahan pangan, air, limbah, tanah, dan jaringan tubuh yang terinfeksi. Beberapa fag telah diaplikasikan sebagai biokontrol pencemaran makanan, diantaranya fag litik Enterobacter sakazaki yang diaplikasikan pada susu formula bayi (Kim 2007), fag litik Salmonella dan Campylobacter pada karkas ayam (Goode et al. 2003), fag litik FR38 yang diaplikasikan pada sosis, susu dan air mampu menurunkan cemaran Salmonella P38 indigenous secara signifikan (Sartika 2012).
2
resisten antibiotik yang diisolasi dari pasien penderita diare di Indonesia. Penelitian efektivitas fag litik terhadap bakteri patogen P. mirabilis resisten antibiotik yang dapat mencemari air, makanan serta penyebab diare belum pernah dilakukan, oleh karena itu penelitian ini penting dilakukan untuk mengetahui efektivitas fag litik agar dapat digunakan sebagai biokontrol pencemaran air dan makanan yang disebabkan oleh P. mirabilis.
Perumusan Masalah
Bakteri P. mirabilis merupakan salah satu bakteri enteropatogen penyebab diare. Banyak penelitian melaporkan P. mirabilis multiresisten terhadap beberapa antibiotik, diantaranya antibiotik ampicillin, gentamicin, ciprofloxacin dan sulfamethoxazole. Oleh karena itu, diperlukan terapi alternatif yang dapat mengendalikan pertumbuhan bakteri patogen. Terapi alternatif yang dapat dilakukan adalah dengan menggunakan fag litik. Fag litik merupakan virus penginfeksi bakteri yang dapat melisiskan dinding sel bakteri sehingga fag litik dapat digunkaan sebagai agen biokontrol terhadap P. mirabilis. Fag litik bersifat non toksik dan aman digunakan sebagai metode alternatif alami untuk mereduksi dan mengontrol pertumbuhan bakteri P. mirabilis yang sering mengontaminasi air dan makanan.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan dan mengkarakterisasi fag litik yang efektif melisiskan P. mirabilis resisten antibiotik .
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat diaplikasikan sebagai biokontrol terhadap pencemaran air dan makanan yang disebabkan oleh bakteri P. mirabilis sehingga dapat mencegah penyakit diare.
Ruang Lingkup Penelitian
3
TINJAUAN PUSTAKA
Karakteristik Proteus mirabilis
Proteus mirabilis adalah bakteri Gram negatif anggota famili Enterobacteriaceae yang terdapat dalam saluran pencernaan manusia dan hewan. Bakteri ini berbentuk batang (1.5 x 2.0 m), tidak membentuk spora, bergerak sangat aktif dengan flagella peritrik (Jacobsen et al. 2008). Bakteri P. mirabilis tumbuh optimum pada suhu 35-37 °C, berbentuk batang pendek dengan 6-10 flagella peritrik jika ditumbuhkan di dalam media cair (Manos dan Belas 2006).
Karakteristik biokimia bakteri ini umumnya memfermentasi xilosa, namun tidak memfermentasi laktosa, manitol, dulsitol, adonitol, sorbitol, arabinosa dan rhamnosa. Uji oksidase negatif, uji urease positif dan uji lisin dekarboksilase negatif. P. mirabilis memberi reaksi positif terhadap uji sitrat dan ornithin dekarboksilase serta menghasilkan hidrogen sulfida (O’hara et al. 2000).
Bakteri P. mirabilis sebagai salah satu flora normal ditemukan hidup pada saluran pencernaan mamalia dalam jumlah yang kecil, namun tetap memiliki peranan untuk mencegah kolonisasi bakteri lain melalui kompetisi bakteri dan mencegah melekatnya mikroorganisme patogen pada mukosa usus (Collins dan Gibson 1999). Pada tahun 1979 dilaporkan adanya wabah P. mirabilis yang multiresisten terhadap antibiotik ampisilin, tetrasiklin, carbenicillin, klorampenikol, cephalothin, colistin dan aminoglikosida. Bakteri P. mirabilis yang resisten terhadap 7 antibiotik dilaporkan menjadi agen utama penyebab infeksi pada 90 pasien di Inggris pada tahun 1λ87 (O’hara et al. 2000). Hasil penelitian Tibbetts et al. (2008) menunjukkan adanya isolat P. mirabilis yang multiresisten terhadap imipenem, meropenem dan ertapenem.
Patogenisitas Proteus mirabilis
Faktor virulensi yang terlibat dalam patogenisitas P. mirabilis dapat dibagi menjadi dua kelompok: 1) protein, enzim serta produk yang disekresikan lainnya, dan 2) struktur permukaan seperti flagella. Faktor virulensi yang paling signifikan adalah: urease, Zapa (protease yang secara khusus menurunkan imunoglobulin IgA dan IgG), lipopolisakarida, protein pada membran luar, hemolisin, dan enzim metaloprotease (Burall et al. 2004). Gendlina et al. (2002) menyatakan kemampuan P. mirabilis dan P. penneri dalam memproduksi enzim urease lebih tinggi daripada spesies bakteri lainnya. Enzim urease memecah urea menjadi amonia dan karbondioksida yang dapat menyebabkan peningkatan pH sehingga dapat meningkatkan kolonisasi spesies bakteri lain seperti Helicobacter pylori (Kuwahara et al. 2000).
4
infeksi P. mirabilis (Stickler dan Hughes 1999). Bakteri P. mirabilis memiliki flagella peritrik yang memungkinkannya bergerak dan pindah ke sel lain lalu membentuk koloni (Jansen et al. 2003).
Karakteristik Fag
Fag adalah virus yang menginfeksi sel bakteri, mengganggu kegiatan metabolisme dan mengakibatkan lisis pada sel bakteri (Sulakvelidze et al. 2001). Fag ditemukan oleh Frederick W. Twort pada tahun 1λ15 dan Felix d’Herelle pada tahun 1917. Saat itu, Twort mengamati adanya koloni bakteri yang lisis. Fenomena lisis pada koloni bakteri terjadi dari satu koloni bakteri ke koloni bakteri lainnya. Koloni bakteri lisis yang difiltrasi menggunakan membran filter masih dapat melisiskan koloni, namun jika filtrat dipanaskan maka sifat litiknya hilang dan tidak terdapat koloni bakteri yang menjadi lisis. Twort menyimpulkan bahwa fenomena lisis tersebut disebabkan oleh virus. Felix d’Herelle menemukan fenomena yang sama pada tahun 1917, oleh karena itu disebut fenomena
Twort-d’Herelle (Pelczar dan Chan 2007).
Fag memiliki kemampuan menginfeksi bakteri, namun tidak dapat menginfeksi tumbuhan, hewan dan manusia. Fag bersifat parasit obligat intraselular yang dapat menggandakan diri di dalam sel bakteri, mengandung asam nukleat berupa ss-DNA, ds-DNA, ss-RNA atau ds-RNA yang dilindungi oleh suatu selubung protein yang disebut kapsid. Kapsid ini terdiri atas subunit-subunit kapsomer, sedangkan kapsomer terdiri atas subunit-subunit- subunit-subunit protein yang disebut protomer (Snyder dan Champness 2003).
Siklus hidup fag terdiri atas litik dan lisogenik. Mekanisme replikasi fag litik terdiri atas beberapa tahap, yaitu: adsorpsi, penetrasi, sintesis, pematangan, dan lisis sel. Fag litik yang menginfeksi sel bakteri sebagai sel inang akan bereplikasi di dalam sel inang, membentuk fag baru, lalu melisiskan sel inang. Pada tahap adsorpsi, ujung ekor fag melekat pada dinding sel melalui reseptor pada permukaan sel. Reseptor dapat berupa lipopolisakarida, flagella, pili, karbohidrat atau protein pada membran dinding sel(Madigan et al. 2011).
Pelekatan fag pada sel bakteri atau sel inang diikuti dengan proses penetrasi asam nukleat fag ke dalam sel bakteri. Penetrasi fag ke dalam sel inang bersifat mekanis dan dibantu dengan proses enzimatis. Tahap transkrispi fage disandi oleh gen awal, gen tengah dan gen akhir. Produk gen awal dan gen tengah berupa enzim nuklease yang akan menguraikan DNA bakteri. Produk gen tengah akan mengakibatkan enzim restriksi bakteri tidak dapat menguraikan DNA fag karena adanya penggantian nukleotida menjadi 5-hidroksimetilsitosin. Produk gen tengah juga berperan sebagai enzim polimerase dan ligase yang terlibat dalam replikasi fag. Gen akhir menyandikan protein penyusun kepala, serabut ekor dan enzim lisozim (Kutter dan Sulakvelidze 2005). Fag memasuki tahap pematangan setelah proses replikasi dan transkripsi selesai. Tahap pematangan diawali dengan pengemasan asam nukleat yang baru disintesis ke dalam selubung protein yang disebut kapsid. Fag yang telah matang akan keluar dengan jumlah yang sangat banyak dari sel inang yang telah lisis. Fag-fag tersebut akan menginfeksi sel bakteri yang lain dan siklus litik akan diulang kembali (Madigan et al. 2011).
5
Propionibacterium freudenreichii pada keju swiss (Gautier et al. 1999) dan fag Escherichia coli pada wortel (Endley et al. 2003). Sumber fag lainnya adalah limbah cair rumah tangga. Sunarti (2012) menyatakan bahwa jumlah fag sebanyak 3,36 x 104 PFU/mL ditemukan pada limbah cair rumah tangga. Fag ini dapat menginfeksi isolat bakteri Salmonella P38. Hasil penelitian Iswadi (2012) menunjukkan bahwa fag juga umum ditemukan di lingkungan, terutama pada sampel limbah cair. Limbah merupakan habitat bagi banyak bakteri sehingga di dalam limbah mengandung banyak fag bagi bakteri-bakteri tertentu, terutama bakteri fekal (coliform).
Penelitian dan Aplikasi Fag
Aplikasi aktivitas fag semakin banyak diteliti. Penelitian-penelitian fag semakin banyak dikembangkan sejak Ernest Hanbury Hankin melakukan pengamatan fag yang menginfeksi Vibrio cholerae pada tahun 1896 di India (Skurnik dan Strauch 2006). Pada tahun 1λ1λ, Felix d’Herelle mengaplikasikan fag sebagai terapi terhadap penyakit disentri hemorrhagic pada ayam yang disebabkan oleh Bacillus gallinarum (Kutter dan Sulakvelidze 2005). Doyle et al. (2007) melaporkan pada perang dunia kedua, Soviet dan Jerman mengaplikasikan fag untuk digunakan pada terapi penyakit disentri. Saat senyawa antibiotik ditemukan pada tahun 1940-an, peneltian dan aplikasi fag sebagai agen terapi mengalami penurunan. Namun, seiring dengan adanya peningkatan jumlah bakteri yang resisten terhadap antibiotik, saat ini penelitian tentang fag mengalami peningkatan(Doyle et al. 2007).
Beberapa penelitian melaporkan bahwa aplikasi fag terbukti efektif dalam mereduksi kontaminasi bakteri patogen pada bahan pangan. Park et al. (2000) melaporkan bahwa fag memiliki potensi untuk mengontrol kontaminasi Lactococcus garviae dan Pseudomonas plecoglossicida pada ikan. Leverentz et al. (2001) menggunakan fag untuk mengurangi kontaminasi Salmonella pada buah melon. Hasil penelitian Modi et al. (2001) menunjukkan bahwa fag yang digunakan dalam starter keju cheddar mampu menekan kontaminasi S. enteritidis. Fag juga dapat mengurangi kontaminasi S. typhimurium pada sosis ayam (Whichard et al. 2003). Pao et al. (2004) menyatakan fag mampu mereduksi pertumbuhan S. typhimurium dan S. enteritidis pada biji brokoli dan biji sawi.
6
METODE PENELITIAN
Kerangka Penelitian
Penelitian ini terdiri dari 6 tahapan kerja. Tahapan kerja penelitian disajikan pada Gambar 1.
Gambar 1 Diagram alur penelitian
Waktu dan Tempat Penelitian
Penelitian dilakukan mulai bulan September 2013 sampai Mei 2014 di Laboratorium Bioteknologi Hewan, Pusat Penelitian Sumber Daya Hayati dan Bioteknologi (PPSHB) IPB Darmaga dan Laboratorium TEM dan Histologi Lembaga Eijkman Biologi Molekular Jakarta.
Peremajaan Proteus mirabilis
Reidentifikasi dan Uji Patogenisitas Proteus mirabilis
Isolasi Fage
a. Pengambilan Sampel b. Filtrasi Sampel c. Pencawanan Fag d. Purifikasi Fag
e. Kuantifikasi Fag (PFU/mL)
Penentuan Kisaran Inang Fag
Pengamatan Morfologi Fag dengan Transmission Electron Microscope (TEM)
7
Peremajaan Proteus mirabilis
Bakteri P. mirabilis resisten antibiotik hasil isolasi dari feses penderita diare ditumbuhkan pada media cair Tryptone Soy Bean (TSB) (Difco), kemudian ditumbuhkan dengan cara digores menggunakan metode kuadran pada media Salmonella shigella agar (SSA) (Himedia) dan diinkubasi pada suhu 37 oC selama 24 jam. Koloni tunggal yang terbentuk diambil dan ditumbuhkan pada media agar miring SS kemudian diinkubasi pada suhu 37 oC selama 24 jam. Bakteri uji P. mirabilis kemudian disimpan pada suhu 4 oC untuk digunakan sebagai stok bakteri uji.
Reidentifikasi dan Uji Patogenisitas Proteus mirabilis
Tahapan reidentifikasi P. mirabilis dilakukan menggunakan uji pewarnaan gram dan API KIT 20E. Uji patogenisitas dilakukan pada media Blood Agar. Bakteri digores pada media Blood Agar secara aseptis. Pengamatan terhadap perubahan warna media Blood Agar dilakukan pada 3 jam dan 5 jam pertama, kemudian inkubasi dilanjutkan hingga 24 jam untuk menentukan faktor virulen yang berperan dalam patogenisitas bakteri P. mirabilis.
Sensitifitas Proteus mirabilis terhadap Antibiotik
Proteus mirabilis diuji sensitifitasnya terhadap 4 jenis antibiotik, yaitu ampicillin, amoxicillin, ciprofloxacin, dan trimethoprim-sulfomethoxazole dengan konsentrasi 1 mg/mL. Metode yang digunakan adalah difusi agar menggunakan kertas cakram berdiameter 6 mm. Kertas saring mengandung 10 µg antibiotik ampicillin, 20 µg amoxicillin, 5 µg ciprofloxacin dan 5 µg trimethoprim-sulfomethoxazole (CLSI 2012).
Sebanyak 150 L kultur bakteri P. mirabilis (OD600nm=1) dimasukkan ke
dalam tabung reaksi yang berisi 15-17 mL media NA bersuhu 50 oC, lalu dihomogenkan menggunakan vortex, dituang ke dalam cawan petri dan dibiarkan hingga media menjadi padat. Kertas cakram yang mengandung antibiotik diletakkan pada permukaan media yang telah memadat dan diinkubasi pada suhu 37 oC selama 24 jam (Madigan et al. 2011). Diameter zona hambat yang terbentuk di ukur dan dibandingkan dengan diameter zona hambat menurut CLSI 2012 untuk menentukan tingkat sensitifitas P. mirabilis terhadap antibiotik ampicillin, amoxicillin, ciprofloxacin dan trimethoprim-sulfomethoxazole.
Isolasi Fag
8
dalam botol steril kemudian dihomogenkan menggunakan vorteks di laboratorium.
Filtrasi Sampel. Sebanyak 4.5 mL sampel fag dimasukkan ke dalam tabung sentrifus yang telah berisi 0.5 mL kultur P. mirabilis OD600nm=1 dengan jumlah bakteri P. mirabilis sebanyak 108 CFU/mL lalu ditambahkan 5 mL Nutrien Broth (NB) (Difco) dan diinkubasi pada suhu 37 oC selama 24-48 jam. Sampel tersebut kemudian disentrifugasi pada kecepatan 6000 rpm selama 20 menit sebanyak 2 kali ulangan. Sebanyak 3 mL supernatan diambil dengan syringe dan difiltrasi menggunakan membran filter milipore 0.22 µm. Supernatan yang telah difiltrasi disimpan di dalam tabung steril pada suhu 4 oC (Pitt danGaston (1995).
Pencawanan fag. Kultur P. mirabilis diinokulasikan sebanyak 2-3 ose ke dalam media NB lalu diinkubasi pada suhu 37 oC selama 24 jam sampai diperoleh kultur P. mirabilis OD600nm=1. Sebanyak 100 µ L kultur P. mirabilis dicampurkan dengan 100 µ L supernatan yang telah difiltrasi lalu diinkubasi selama 30 menit pada suhu 37 oC. Campuran tersebut kemudian dimasukkan ke dalam 6 mL soft agar yang bersuhu 47 oC, lalu di homogenkan menggunakan vorteks, dituang pada media Nutrient Agar (NA) di dalam cawan petri dan diinkubasi pada suhu 37 o
C selama 24 jam (Atterbury et al. 2007).
Purifikasi fag. Purifikasi fag dilakukan berdasarkan metode Goodridge et al. (2001). Plak (zona bening) yang terbentuk dipindahkan menggunakan pipet Pasteur ke dalam tabung sentrifus yang telah diisi dengan 5-7 mL bufer Saline Magnesium (SM). Suspensi fag dihomogenkan dengan vorteks dan dibiarkan selama 5-10 menit pada suhu ruang. Suspensi tersebut kemudian disentrifugasi pada kecepatan 6000 rpm selama 20 menit sebanyak 2 kali ulangan. Supernatan diambil menggunakan syringe lalu difiltrasi menggunkaan membran filter milipore 0.22 µm. Supernatan yang telah difiltrasi disimpan sebagai stok fag pada suhu 4 oC di dalam tabung steril.
Produksi Fag
9
Titrasi Fag
Kuantifikasi fag dilakukan berdasarkan metode Foschino et al. (1995). Jumlah fag ditentukan dengan cara menghitung jumlah plak yang terbentuk (Plaque forming unit (PFU/mL)). Stok fag diencerkan sampai 108, kemudian sebanyak 100 µ L dari masing-masing pengenceran tersebut diambil dan ditambahkan dengan 100 µ L kultur P. mirabilis yang telah ditumbuhkan pada media NB (OD600nm=1). Suspensi tersebut diinkubasi pada suhu 37 oC selama 30 menit lalu dimasukkan ke dalam 6 mL soft agar yang bersuhu 47 oC, dituang pada media NA dan diinkubasi pada suhu 37 oC selama 24 jam. Jumlah plak atau zona bening yang terbentuk (PFU/mL) dihitung setelah diinkubasi selama 24 jam.
Penentuan Kisaran Inang Fag
Uji penentuan kisaran inang fag dilakukan berdasarkan metode Carey et al. (2006). Sebanyak 100 µ L kultur P. mirabilis yang telah ditumbuhkan pada media NB (OD600nm=1) dan 100 µl kultur EPEC K.1.1, Salmonella sp., Bacillus pumilus, dan Photobacterium damselae yang ditumbuhkan di media NB
(OD600nm=1) masing-masing dicampurkan dengan 100 µL stok fag dan diinkubasi
pada suhu 37 oC selama 15-30 menit. Masing-masing campuran tersebut lalu dimasukkan ke dalam 5 mL soft agar yang bersuhu 47 oC dan diinkubasi pada suhu 37 oC selama 24 jam.
Pengamatan Morfologi Fag dengan Transmision Electron Microscope (TEM)
Stok fag diteteskan sebanyak 10 µ L pada grid (400 mesh) lalu dibiarkan selama 1 menit. Sebanyak 5 µ L larutan uranil asetat 2% diteteskan ke atas grid. Grid kemudian dikeringkan menggunakan kertas saring dan dibiarkan hingga kering. Grid yang telah kering diletakkan pada holder dan diamati menggunakan mikroskop elektron transmisi model JEOL JEM-1010 pada perbesaran 60000-80000x (Carey et al. 2006).
Karakterisasi Protein
Kadar protein stok fage diukur berdasarkan metode Bradford (1976). Konsentrasi standar protein yang digunakan pada penelitian ini dibuat secara serial dengan konsentrasi standar protein Bovine Serum Albumin (BSA) dari 0.1 hingga 1.0 mg/mL. Masing-masing protein BSA dan sampel diambil sebanyak 400 µL lalu dimasukkan pada tabung-tabung reaksi. Masing-masing tabung reaksi ditambahkan dengan 4 mL pereaksi Bradford (Lampiran 1). Larutan tersebut lalu dihomogenkan dengan vortex, diinkubasi pada suhu 37 oC selama 15
menit kemudian diukur absorbansinya pada panjang gelombang ( ) 5λ5 nm.
10
absorbansi sebagai sumbu y (ordinat), kemudian ditentukan persamaan garis regresinya (Lampiran 2).
11
HASIL DAN PEMBAHASAN
Hasil
Reidentifikasi dan Patogenisitas Proteus mirabilis
Hasil pewarnaan Gram menunjukkan bahwa P. mirabilis adalah bakteri Gram negatif berbentuk batang. Koloni P. mirabilis berwarna hitam saat ditumbuhkan pada media SSA dengan warna hitam pada bagian tengah koloni dan tampak bening pada tepi koloni. Hasil uji patogenisitas P. mirabilis yang dilakukan pada media agar darah menunjukkan bahwa P. mirabilis mampu melisiskan sel darah dan menghasilkan alfa hemolisin (Lampiran 5).
Berdasarkan hasil identifikasi dengan KIT API 20E menunjukkan bahwa isolat A31 adalah Proteus mirabilis (99.9%). Bakteri P. mirabilis tampak tidak memfermentasikan manosa, sorbitol, glukosa, arabinosa, rhamnosa. Uji ornithin dekarboksilase, produksi H2S, urease dan gelatin menunjukkan hasil yang positif, sedangkan uji indol dan lisin dekarboksilase menunjukkan hasil yang negatif (Tabel 1).
Tabel 1 Hasil identifikasi KIT API 20E bakteri P. mirabilis
+ : reaksi positif; - : reaksi negatif
Resistensi Proteus mirabilis terhadap Antibiotik
Hasil uji resistensi antibiotik menunjukkan bahwa P. mirabilis telah resisten terhadap antibiotik ampicillin, amoxicillin dan trimethoprim-sulfametahoxazole (Tabel 2). Hal ini terlihat dari tidak adanya zona penghambatan yang terbentuk saat P. mirabilis diujikan dengan ketiga antibiotik
Uji Fsiologis Reaksi Uji Fisiologis Reaksi
-12
tersebut, sedangkan terhadap antibiotik ciprofloxacin masih dalam kriteria sensitif. Zona penghambatan yang dihasilkan ciprofloxacin cukup besar, yaitu mencapai 26 mm.
Tabel 2 Resistensi P. mirabilis terhadap beberapa antibiotik
S: sensitif, I: intermediet, R: resisten
Isolasi Fag
Fag berhasil diisolasi dari limbah peternakan ayam dan air sungai di Desa Situ Letik Kecamatan Darmaga, Bogor (Tabel 3). Fag yang didapatkan berjumlah 3 isolat, yaitu 1 isolat dari limbah peternakan ayam dan 2 isolat dari air sungai Desa Situ Letik. Hal ini mengindikasikan adanya bakteri P. mirabilis yang terdapat di limbah peternakan ayam dan air sungai di Desa Situ Letik.
Tabel 3 Hasil isolasi fag dari berbagai sumber fag
13
Tabel 4 Karakteristik isolat-isolat fag litik P. mirabilis
*Isolat fag tidak dapat ditumbuhkan kembali
Hasil purifikasi dan produksi terhadap ketiga isolat fag menunjukkan bahwa isolat fag yang dapat dimurnikan dan ditumbuhkan kembali adalah isolat fag 2. Isolat fag 1 dan 3 tidak dapat diproduksi karena kedua isolat tersebut tidak dapat ditumbuhkan kembali saat proses pencawanan fag. Oleh karena itu, isolat fag 2 dipilih sebagai isolat fag P. mirabilis yang dapat dikarakterisasi morfologi dan proteinnya. Hasil produksi isolat fag 2 sebagai fag P. mirabilis yang berhasil diproduksi kembali adalah sebesar 1.61 x 109 PFU/mL.
Kisaran Inang Fag
Hasi uji kisaran inang menunjukkan bahwa fag P. mirabilis bersifat spesifik. Fag P. mirabilis hanya dapat menginfeksi P. mirabilis dan tidak dapat menginfeksi bakteri lain seperti B. pumilus, P. damselae, Salmonellla sp. dan EPEC K.1.1 (Tabel 5).
Tabel 5 Kisaran inang fag P. mirabilis
Morfologi Fag
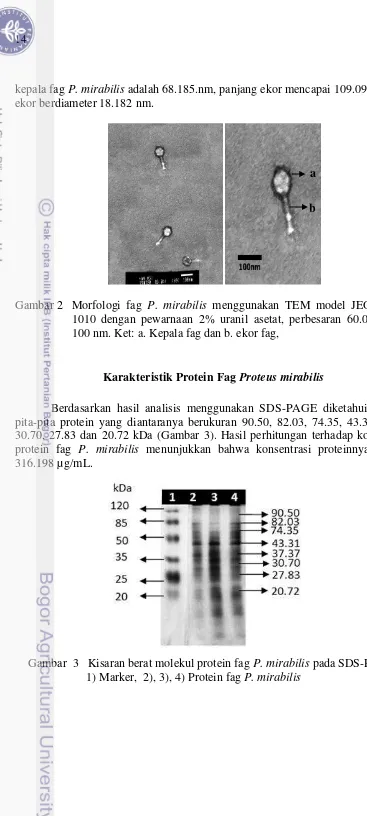
Berdasarkan hasil pengamatan dengan Transmission electron microscope, diketahui bahwa fag P. mirabilis memiliki kepala berbentuk heksagonal ikosahedral dan ekor yang panjang berbentuk tabung heliks (Gambar 2). Diameter Isolat fag Jumlah plak (PFU/mL) Morfologi plak
Fag 1 1 x 104* Plak bulat, bening, diameter 2 mm, memiliki cincin di sekitar plak
Fag 2 1.3 x 108 Plak bulat, samar, diameter 2 mm, tidak ada cincin di sekitar plak
Fag 3 2 x 107* Plak bulat, bening, diameter 2 mm, tidak ada cincin di sekitar plak
Bakteri inang Keterangan
Proteus mirabilis Terbentuk plak Salmonella sp Tidak terbentuk plak
EPEC K.1.1 Tidak terbentuk plak
14
kepala fag P. mirabilis adalah 68.185.nm, panjang ekor mencapai 109.091 nm dan ekor berdiameter 18.182 nm.
Gambar 2 Morfologi fag P. mirabilis menggunakan TEM model JEOL JEM-1010 dengan pewarnaan 2% uranil asetat, perbesaran 60.000x, Bar 100 nm. Ket: a. Kepala fag dan b. ekor fag,
Karakteristik Protein Fag Proteus mirabilis
Berdasarkan hasil analisis menggunakan SDS-PAGE diketahui terdapat pita-pita protein yang diantaranya berukuran 90.50, 82.03, 74.35, 43.31, 37.37, 30.70, 27.83 dan 20.72 kDa (Gambar 3). Hasil perhitungan terhadap konsentrasi protein fag P. mirabilis menunjukkan bahwa konsentrasi proteinnya sebesar 316.198 µg/mL.
Gambar 3 Kisaran berat molekul protein fag P. mirabilis pada SDS-PAGE. 1) Marker, 2), 3), 4) Protein fag P. mirabilis
a
e
b
15
Pembahasan
Hasil analisis terhadap patogenitas P. mirabilis menunjukkan bahwa bakteri tersebut memiliki toksin berupa alfa hemolisin sebagai salah satu faktor virulensinya. Alfa hemolisin adalah prototipe dari racun RTX (repeat toxin), yaitu sebuah kelompok protein yang memiliki banyak struktur genetik dan struktural. Sanchez et al. (2011) mengatakan alfa hemolisin merupakan faktor virulensi penting pada bakteri patogen yang dapat mengakibatkan berbagai kasus infeksi. Alfa hemolisin sebagai salah satu faktor virulen bakteri patogen mampu membentuk pori sehingga memicu respon seluler dan efek jangka panjang bagi organisme inang seperti mamalia. Konsentrasi tinggi alfa toksin dapat menyebabkan lisis beberapa sel-sel seperti eritrosit, granulosit dan monosit.
Tahapan isolasi fag yang dilakukan pada penelitian ini menggunakan metode enrichment. Prinsip metode ini adalah memperkaya nutrisi media pertumbuhan bakteri agar pertumbuhan bakteri meningkat sehingga replikasi fag juga semakin banyak. Fag yang bersifat parasit intraseluler obligat akan bereplikasi dengan baik, cepat dan dalam jumlah yang banyak apabila kondisi pertumbuhan bakteri inangnya berada pada kondisi optimum. Bakteri P. mirabilis yang digunakan sebagai bakteri inang untuk mengisolasi fag ditumbuhkan di dalam media cair NB dengan suhu optimum 37 oC pada fase logaritma yakni saat kultur bakteri P. mirabilis pada OD600nm=1 dengan jumlah bakteri mencapai 108 CFU/mL.
Verifikasi keberhasilan isolasi fag dilakukan dengan melakukan pencawanan fag bersama dengan bakteri inang P. mirabilis. Proses pencawanan ini menggunakan teknik media double layer. Bagian atas media double layer terdiri atas media agar dengan konsentrasi 0.8 %. Pada konsentrasi ini, fag dapat bergerak lebih cepat mencari dan menemukan bakteri inang disekitarnya. Bagian bawah media double layer adalah media nutrient agar yang menyediakan nutrisi untuk pertumbuhan bakteri inang, sehingga bakteri inang dapat membelah lebih banyak dan lebih cepat karena nutrisi yang banyak akibatnya fag juga semakin banyak menginfeksi dan melisiskan bakteri inang.
16
menunjukkan bahwa kedua isolat fag tersebut tidak dapat diproduksi untuk dilakukan perbanyakan karena tidak dapat ditumbuhkan kembali saat proses pencawanan fag. Hal ini diduga disebabkan oleh perbedaan tingkat stabilitas pada masing-masing isolat fag. Faktor stabilitas pada fag sangat erat kaitannya dengan protein-protein penyusun fag (Evilevitch et al. 2010).
Berdasarkan hasil penelitian, diketahui pembentukan plak pada isolat fag 2 sebagai fag P. mirabilis yang berhasil dipurifikasi dan diproduksi terjadi antara 30-35 menit waktu inkubasi. Hal ini menunjukkan bahwa fag P. mirabilis sangat efektif dan bersifat infektif kuat terhadap Proteus mirabilis yang telah resisten terhadap antibiotik ampicillin, amoxicillin, dan trimetoprin-sulfomethoxazole, sehingga penelitian ini menjadi bukti nyata kemampuan fag yang bersifat ramah lingkungan dan aman dalam mengontrol serta mengendalikan bakteri P. mirabilis yang dapat menyebabkan diare dan sering mengkontaminasi air dan makanan. Hasil penelitian Shao dan Wang (2008) menunjukkan bahwa waktu lisis optimal fag berkisar diantara 29,3-68 menit. Waktu lisis ini dipengaruhi oleh laju adsorpsi fag pada bakteri inangnya. Fag yang memiliki laju adsorpsi tinggi akan menghasilkan waktu lisis yang relatif lebih cepat. Oleh karena itu, fag P. mirabilis dapat disimpulkan memiliki laju adsorpsi yang tinggi dengan waktu lisis yang pendek. Berdasarkan hasil pengamatan terhadap ukuran plak diketahui bahwa ukuran plak yang dihasilkan oleh fag P. mirabilis akan semakin membesar seiring dengan bertambahnya waktu inkubasi hingga 24 jam. Jika kepadatan bakteri meningkat, maka jumlah plak yang terbentuk semakin banyak dan jarak setiap plak semakin rapat. Toro et al. (2005) menyatakan bahwa setelah menginfeksi bakteri inangnya, fag dengan siklus litik akan bereplikasi di dalam sel inang untuk membentuk fag-fag baru lalu keluar sel dengan melisiskan sel inang hingga pada akhirnya masing-masing fag baru akan mencari dan menginfeksi bakteri inang lain disekitarnya. Proses lisis ini menggunakan enzim lisozim yang disandikan oleh gen pada fag namun disintesis di dalam sel bakteri inang (Tortora et al. 2006). Madigan et al. (2011) menyatakan lisozim dapat memutuskan ikatan β -1,4-glikosida antara N-asetil glukosamin dan N-asetil muramat, akibatnya bakteri menjadi lisis karena adanya kerusakan pada struktur peptidoglikan.
Saat dilakukan pencawanan fag, maka fag yang tumbuh memiliki siklus hidup yang terdiri dari fase ekstraseluler yakni ketika proses adsorpsi fag atau difusi virion dan fase intraseluler yakni saat proses produksi progeni yang baru. Tingkat adsorpsi fag yang tinggi terhadap bakteri inang akan memungkinkan virion untuk menyebar lebih jauh mencari dan menemukan bakteri inang baru lainnya di dalam cawan, sedangkan jika fase intraseluler yang tinggi akan menghasilkan lebih banyak progeni yang dapat dikeluarkan (Gallet et al. 2011).
17
maka dapat mengakibatkan terjadinya kerusakan partikel fag karena sebagian besar protein yang menyusun partikel fag rusak akibat denaturasi protein. Bufer yang digunakan untuk penyimpanan fag P. mirabilis adalah bufer SM. Hasil penelitian Astriningsih (2012) menunjukkan adanya tingkat stabilitas yang sama antara fag Salmonella FR 19, 38 dan 84 yang disimpan dalam bufer SM pada suhu ruang dan suhu rendah. SM bufer terdiri atas gelatin, NaCl, Tris-Cl, dan MgSO4.7H2O. MgSO4 merupakan sumber multivalent ion yang berfungsi mengurangi tekanan hidrasi pada DNA fag. Tekanan hidrasi yang berlebih dapat menyebabkan perubahan struktur kapsid fag (Evilevitch et al. 2010). Gelatin yang terdapat di dalam SM buffer berfungsi melindungi fag dari kondisi yang kurang menguntungkan (Robenson et al. 2008). Abedon (2008) menyatakan bahwa kondisi lingkungan yang tidak menguntungkan akan mengganggu kemampuan replikasi dan infektifitas fag, sehingga berpengaruh pada pembentukan plak.
Stok fag murni dapat dititrasi dengan menghitung jumlah plak yang terbentuk pada cawan. Tortora et al. 2006 menyatakan bahwa satu plak berasal dari replikasi satu fag sehingga jumlah fag dapat ditentukan dengan menghitung jumlah plak yang terbentuk (Plaque Forming Unit (PFU)). Kuantifikasi fag dilakukan menggunakan perbandingan yang sama yaitu 100 µl kultur bakteri
(OD600nm=1) dan 100 µl stok fag, sehingga setiap plak yang terbentuk berasal dari
satu fag. Barrow et al. (1998) menyatakan bahwa perbandingan yang sama antara konsentrasi fag dan konsentrasi bakteri inang juga dapat meningkatkan laju lisis sel bakteri oleh fag.
Uji kisaran inang dilakukan terhadap 4 bakteri uji yaitu Salmonella sp., EPEC K.1.1, Bacillus pumilus dan Photobacterium damselae. Uji ini dilakukan untuk mengetahui spesifitas fag dan besarnya spektrum infeksi fag. Hasil uji kisaran inang menunjukkan bahwa plak hanya terbentuk ketika fag diinfeksikan dengan bakteri inang P. mirabilis. Fag yang diinfeksikan dengan bakteri uji lain seperti Salmonella sp., EPEC K.1.1, Bacillus pumilus, dan Photobacterium damselae tidak menunjukkan adanya pembentukan plak. Hasil ini mengindikasikan bahwa spektrum infeksi fag P. mirabilis adalah sempit dan spesifik khusus bagi P. mirabilis. Sifat spesifik inang yang dimiliki fag merupakan suatu keunggulan fag yang tidak dimiliki antibiotik. Fag lebih bersifat aman karena hanya menginfeksi dan mereduksi bakteri inang spesifik tanpa mengganggu mikroflora normal usus.
18
bersifat sangat spesifik antara reseptor yang dikenali fag dan fag tertentu sebagai pasangannya. Jika reseptor tidak dikenali oleh fag maka tidak terjadi tahap adsorpsi atau pelekatan fag, akibatnya proses infeksi tidak terjadi. Kudva et al. (1999) menyatakan variasi molekul reseptor dapat menjadi penghalang adsorpsi yang mempengaruhi spesifitas fag terhadap bakteri inangnya masing-masing. Saat tahapan adsorpsi, fag akan menempel pada reseptor spesifik di dinding sel bakteri. Proteus mirabilis sebagai salah satu bakteri Gram negatif diduga memiliki reseptor spesifik berupa protein dan lipopolisakarida yang berada pada lapisan luar dinding sel yang dapat dikenali oleh fag tertentu.
19
SIMPULAN DAN SARAN
Simpulan
Fag litik P. mirabilis hasil isolasi dari air sungai Desa Situ Letik dapat menginfeksi P. mirabilis. Plak atau zona kerusakan sel yang dihasilkan berbentuk bulat dengan diameter 2 mm. Fag litik P. mirabilis bersifat spesifik terhadap bakteri P. mirabilis sebagai bakteri inangnya dan tidak dapat menginfeksi bakteri lain seperti EPEC K.1.1, Salmonella sp., Photobacterium damselae dan Bacillus pumilus. Fag ini memiliki kepala berbentuk heksagonal ikosahedral berdiameter 68.185 nm, ekor fag relatif panjang mencapai 109.091 nm dan berdiameter 18.182 nm. Berat molekul protein fag berkisar antara 20-91 kDa.
Saran
20
DAFTAR PUSTAKA
Abedon ST, Herschler TD, Stopar D. 2000. Bacteriophage latent-period evaluation as a response to resource availability. Appl Environ Microbiol 67:4233-4241.
Abedon ST. 2008. Bacteriophage Ecology. Cambridge: Cambridge University Press.
Anany H. 2011. A Shigella boydii bacteriophage which resembles Salmonella phage Vil. Virol J 8:242-252.
Astriningsih SAP. 2012. Karakterisasi fage litik Salmonella sp. FR 38, FR 19, dan FR 84 [Thesis]. Bogor: IPB.
Atterbury RJ, Van Bergen MAP, Ortiz F, Lovell MA, Harris JA, De Boer A, Wagenaar JA, Allen VM, Barrow PA. 2007. Bacteriophage therapy to reduce Salmonella colonization of broiler chickens. Appl Environ Microbiol 73:4543-4549.
Barrow P, Lovell M, Berchieri A. 1998. Use of lytic bacteriophage for control of experimental Escherichia coli, septicemia, and meningitis in chickens and calves. Clin Diagn Lab Immunol 5: 294-298.
Bradford MM. 1976. A rapid and sensitive method for the quantification of microgram quantities for protein utilizing the principle of protein dye binding. Anal Biochem 72:248-254.
Budiarti S, Pratiwi RH, Rusmana I. 2011. Infectivity of lytic phage to enteropathogenic Escherichia coli from diarrheal patients in Indonesia. J US-China Med Sci 8: 72-81.
Burall LS, Harro JM, Lockatell CV, Himpsl SD, Hebel JR, Johnson DE, Mobley HLT. 2004. Proteus mirabilis genes that contribute to pathogenesis of urinary tract infection: identification of 25 signature-tagged mutants attenuated at least 100-fold. Infect Immun 72:2922-2938
Carey GVS, Billington C, Cornelius AJ, Hudson JA, Heinemann JA. 2006. Isolation and characterization of bacteriophages infecting Salmonella spp. FEMS Microbiol Lett 258: 182-186.
Carlton RM, Noordman WH, Biswas B, de Meester ED, Loessner MJ. 2005. P100 for control of Listeria monocytogenes in foods: Genome sequence, bioinformatic analyses, oral toxicity study, and application. Regul Toxicol and Pharmacol 43:301-312.
[CLSI] Clinical and Laboratory Standards Institute. 2012. Performance Standards for Antimicrobial Susceptibility Testing. Pennsylvania: CLSI.
Collins MD, Gibson GR. 1999. Probiotics, prebiotics and synbiotics: approaches modulating the microbiol ecology of the gut. Am J Clin Nutrit. 69:10525-10575.
Doyle MP, Beuchat LR, Montville TJ. 2007. Food Microbiology: fundamentals and frontiers. Washington DC: ASM Press.
21
Evilevitch A, Roos WH, Ivanovska IL, Jeembaeva M, Jonsson B, Wuite GJL. 2010. Effect of salt on internal DNA pressure and mechanical properties of phage capsids. J Mol Biol 405:18-23.
Flynn GO, Ross RP, Fitzgerald GF, Coffey A. 2004. Evaluation of a cocktail of three bacteriophages for biocontrol of Escherichia coli O157:H7. Appl Environ Microbiol 70:3417-3424.
Foschino R, Perrone F, Galli A. 1995. Characterization of two virulent Lactobacillus fermentum bacteriophages isolated from sour dough. J Appl Bacteriol 79: 677-683. and Campylobacter contamination of chicken skin by application of lytic bacteriophages. Appl Environ Microbiol 69:5032–5036.
Goodridge L, Gallaccio A, Griffiths WM. 2001. Morphological, host range, and genetic characterization of two colifages. Appl Environ Microbiol 69: 5364-5371.
Gurnev PA, Oppenheim AB, Winterhalter M, Bezrukov SM. 2006. Docking of a single phage lambda to its membrane receptor maltoporin as a time resolved event. J Mol Biol 359:1447-1455.
International Committee on Taxonomy of Viruses. 2002. [terhubung berkala]. http://ictvdb.bio-mirror.cn/Ictv/fs_podov.htm [31 Maret 2014].
Iswadi. 2012. Efektivitas isolat fage litik Shigella sp [Thesis]. Bogor: IPB.
Jacobsen SM, Stickler DJ, Mobley HLT, Shirtliff ME. 2008. Complicated catheter-associated urinary tract infections due to Escherichia coli and Proteus mirabilis. Clin Microbiol Rev 21:26-59.
Jansen, A. M., C. V. Lockatell, D. E. Johnson, and H. L. Mobley. 2003. Visualization of Proteus mirabilis morphotypes in the urinary tract: the elongated swarmer cell is rarely observed in ascending urinary tract Nosocomial outbreak by Proteus mirabilis producing extended-spectrum β-lactamase VEB-1 in a Korean university hospital. J Antimic Chemo 54:1144-1147.
22
Kudva IT, Jelacic S, Tarr PI, Youderian P, Hovde CJ. 1999. Biocontrol of Escherichia coli O157-specific bacteriophages. Appl Environ Microbiol 65:3767-3773.
Kutter E, Sulakvelidze A. 2005. Bacteriophages Biology and Application. Boca Raton: CRC Press.
Kuwahara H, Miyamoto Y, Akaike T, Kubota T, Sawa T, Okamoto S, Maeda H. 2000. Helicobacter pylori urease suppresses bactericidal activity of peroxynitrite via carbon dioxide production. Infect Immun 68:4378–4383. Laemmli EK. 1970. Cleavage of structural protein during the assembly of head of
bacteriophage T4. J Nature 227: 680-685.
Leverentz B, Conway WS, Alavidze Z, Janisiewicz WJ, Fuchs Y, Camp MJ, Chighladze E, Sulakvelidze A. 2001. Examination of bacteriophage as a biocontrol method for Salmonella on fresh-cut fruit: a model study. J Food Prot 64: 1116-1121.
Lu Z, Altermann E, Breidt F, Predki P, Fleming HP, Klaenhammer TR. 2005. Sequence analysis of the Lactobacillus plantarum bacteriophage JL-1. Gene 348:45-54.
Madigan MT, Martinko JM, Stahl DA, Clark DP. 2011. Brock Biology of Microorganisms. Edisi ke-13. New Jersey: Prentice Hall.
Manos J, Belas R. 2006. The genera Proteus, Providencia, and Morganella. Prokaryotes 6:245-269.
Modi R, Hirvi Y, Hill A, Griffiths MW. 2001. Effect of phage on survival of Salmonella enteritidis during manufacture and storage of cheddar cheese made from was and pasteurized milk. J Fiid Protect 64: 927-933.
Noriyuki N, Naohira S, Yuko S, Yukiko N, Yoshichika A. 2003. Nosocomial outbreak of infections by Proteus mirabilis that produces extended-spectrum CTX-M-2 type β-lactamase. J Clin Microbiol 41: 5530-5536. O’hara CM, Brenner FW, Miller JM. 2000. Classification, identification, and
clinical significance of Proteus, Providensia, and Morganella. Clin Microbiol Rev 13:534-546.
Park SC, Shimamura I, Fukunaga M, Mori KI, Nakai T. 2000. Isolation of bacteriophages specific to a fish pathogen, Pseudomonas plecoglossicida, as a candidate for disease control. Appl Environ Microbiol 66:1416-1422. Pao S, Randolph SP, Westbrook EW, Shen H. 2004. Use of bacteriophage to
control Salmonella in experimentally contaminated sprout seeds. J Food Sci 69: 127-130.
Pelczar MJ, Chan ECS. 2007. Elements of Microbiology. New York: McGraw- Hill.
Pitt TL, Gaston MA. 1995. Bacteriophage Typing. Methods Mol Biol 46: 15-26. Prescott LM, Harley JP, Klein DA. 2002. Microbiology. Edisi ke-5. New York:
McGraw-Hill.
Projan S. 2004. Phage-inspired antibiotics?. Nat Biotechnol 22: 167-168.
Prozesky OW, Klerk HC, Coetzee JN. 1995. Morphology of Proteus Bacteriophages. J Gen Microbiol 41: 29-36.
23
Rode TM, Axelsson L, Granum PE, Even. 2011. High Stability of Stx2 phage in food and under food-procesing condition. Appl Environ Microbiol 77: 5336-5340.
Sanchez S, Luna B, Enrico G, Vanela H. 2011. Alpha hemolysin induces an increase of erythrocytes calcium: a flim 2-photon phasor analysis approach. J PLoS Pathogen 6:1-9.
Sartika D. 2012. Efektifitas dan keamanan in vivo fage litik FR38 dari limbah domestik dalam menurunkan cemaran Salmonella 38 indigenous pada sosis, susu, dan air [Disertasi]. Bogor: IPB.
Shao Y, Wang I. 2008. Bacteriophage adsorption rate and optimal lysis time. Genetics 180: 471-482.
Silham S. 2012. Study of some virulance factors in Proteus sp. associated with diarrhea [Thesis]. Irak: University of Kirkuk.
Sillankorva S, Neubauer P, Azeredo J. 2008. Isolation and characterization of a T7-like lytic phage for Pseudomonas fluorescens. BMC Biotechnol 8: 80-90.
Skurnik M, Strauch E. 2006. Phage therapy: Facts and fiction (Review). Int J Medical Microbiol 296:5-11.
Snyder L, Champness W. 2003. Molecular Genetics of Bacteria. Edisi ke-2. Washington: ASM Press.
Stickler D, Hughes G. 1999. Ability of Proteus mirabilis to swarm over urethral catheters. J Clin Microbiol Infect Dis 18:206–208.
Sulakvelidze A, Alavidze Z, Morris JG Jr. 2001. Bacteriophage therapy. Antimicrob Agents Chemother 45: 649-659.
Sunarti RN. Spesifitas dan efektivitas fage litik Salmonella sp. [Thesis]. Bogor: IPB.
Toro H, Price SB, McKee S, Hoerr FJ, Krehling J, Perdue M, Bauermeister L. 2005. Use of bacteriophages in combination with competitive exclusion to reduce Salmonella from infected chickens. Avian Dis 49: 118-124.
Tortora GJ, Funke BR, Case CL. 2006. Microbiology: An introduction. Ninth Edition. New York: Benjamin Cummings.
Tibbetts R, Frye JG, Marschall, Warren D, Dunne W. 2008. Detection of KPC-2 in a clinical isolate of Proteus mirabilis and first reported description of
carbapenemase resistance caused by a KPC β-lactamase in P. mirabilis.
Infect Immun 46:3080-3083.
24
LAMPIRAN
Lampiran 1 Pembuatan pereaksi Bradford untuk pengukuran konsentrasi protein
Coomassie Brilliant Blue G-250 sebanyak 100 mg dilarutkan di dalam 50 mL etanol 95%, ditambahkan 100 mL asam orto-fosfat 85% dan diencerkan dengan akuades sampai satu liter. Larutan lalu di saring menggunakan kertas saring dan disimpan pada suhu 4 oC. Larutan stok dapat digunakan dengan melakukan pengenceran menggunakan akuades steril dengan perbandingan 4:1.
Lampiran 2 Kurva standar protein
Konsentrasi BSA (ppm) Absorbansi terkoreksi (OD)
25
Lampiran 3 Komposisi bahan dalam pembuatan gel pengumpul dan pemisah
Komponen Konsentrasi
Gel pengumpul (4%)
Gel pemisah (12.5%) Larutan stok akrilamida 30% 0.67 mL 4.17 mL
Bufer gel pemisah - 2.5 mL
Bufer gel pengumpul 1 mL -
Akuades 2.3 mL 3.33 mL
SDS 10% 25 L 50 L
Amonium persulfat 10% 30 L 50 L
TEMED 5 L 5 L
Jumlah 4.03 L 10.105 L
Lampiran 4 Prosedur pewarnaan silver staining dan komposisi larutannya
Komposisi fixation solution terdiri atas metanol 50%, asam asetat 12% dan formalin 0.05%. Washing solution terdiri atas etanol 20%, sensitizing solution terdiri dari Na2S2O3 sebanyak 0.05 gram dalam 250 mL ddH2O, sedangkan developing solution terdiri atas 3 gram Na2CO3, 25 L formalin, 0.1 gram AgNO3 yang dilarutkan dalam 50 mL akuades bebas ion. Komposisi stop solution terdiri atas 60 mL asam asetat dan 440 mL akuades bebas ion .
Gel diendapkan ke dalam fixation solution selama 2 jam
Gel dicuci dengan larutan washing solution selama 20 menit sebanyak 3 kali ulangan
Gel dibilas dengan ddH2O selama 10 detik
26
Lampiran 5 Hasil pewarnaan Gram, morfologi dan hemolisin P. mirabilis
Lampiran 6 Morfologi plak dari tiga isolat fag litik P. mirabilis
Gel diinkubasi ke dalam kulkas dengan penambahan 0.1% AgNO3 selama 20 menit
Dicuci dengan ddH2O selama 20 detik sebanyak 2 kali ulangan
Di bilas dengan developing solution hingga pewarnaan cukup
Gel direndam dengan stop solution selama 5 menit
27
RIWAYAT HIDUP
Penulis dilahirkan di Sintang, Kalimantan Barat pada tanggal 31 Desember 1988 sebagai anak pertama dari 4 bersaudara pasangan Syech Idham Choled dan Nining Mariani Azwar. Pendidikan sarjana (S1) ditempuh di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Tanjungpura Pontianak, lulus pada tahun 2011. Selama menempuh pendidikan sarjana (S1), penulis menjadi asisten dosen pada praktikum ilmu genetika, biologi umum, biokimia, kultur jaringan tanaman dan mikrobiologi dasar pada Program Studi Biologi dan Farmasi Universitas Tanjung Pura. Pada tahun 2011, penulis bekerja sebagai staf pengajar pada Sekolah Tinggi Ilmu Kesehatan (STIKes) Kapuas Raya dan Universitas Kapuas Sintang, Kalimantan Barat. Pada tahun 2012, Penulis diterima di Program Studi Mikrobiologi (MIK) pada Program Pascasarjana IPB.