ISOLASI DAN SELEKSI
Bacillus
sp
.
DARI IKAN LELE
(
Clarias
sp.) SERTA POTENSINYA SEBAGAI PROBIOTIK
HAMTINI
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Isolasi dan Seleksi Bacillus sp. dari Ikan Lele (Clarias sp.) serta Potensinya sebagai Probiotik adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka dibagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, September 2014
RINGKASAN
HAMTINI. Isolasi dan Seleksi Bacillus sp. dari Ikan Lele (Clarias sp.) serta Potensinya sebagai Probiotik. Dibimbing oleh ANJA MERYANDINI dan WIDANARNI.
Budi daya ikan lele menghadapi berbagai macam permasalahan diantaranya mengenai tingkat pertumbuhannya dan salah satu yang dapat dilakukan adalah dengan meningkatkan kecernaan pakan yang diberikan. Pakan yang diberikan pada ikan tidak semuanya dapat dicerna, ada yang dikeluarkan dalam bentuk feses dan sisa metabolisme lainnya. Oleh karena itu, peningkatan kualitas pakan sangat diperlukan agar pakan yang diberikan dapat lebih banyak terserap oleh ikan sehingga dapat mengurangi penumpukan sisa metabolisme ikan di dasar kolam. Aplikasi probiotik merupakan salah satu cara yang dapat dilakukan untuk mengatasi permasalahan tersebut. Probiotik pada akuakultur selain dapat menekan bakteri patogen di lingkungan akuakultur juga dapat menghasilkan sejumlah metabolit dan enzim-enzim pencernaan untuk mempermudah penyerapan pakan sehingga dapat meningkatkan laju pertumbuhan.
Penelitian ini bertujuan untuk mengisolasi dan menyeleksi Bacillus sp. dari usus ikan lele serta menguji potensinya sebagai kandidat probiotik pada pakan ikan. Isolasi usus ikan lele sebanyak 1 gram dilakukan dengan pemanasan sampel usus yang telah dimasukkan di dalam tabung reaksi yang telah berisi larutan garam fisiologis steril pada suhu 80 oC selama 10-15 menit. Isolasi menggunakan media Triptone soy agar (TSA) yang ditambahkan 1% susu skim untuk aktivitas proteolitik dan 1% pati untuk aktivitas amilolitik. Seleksi bakteri probiotik meliputi uji patogenitas, uji kepekaan antibiotik dan total padatan tersuspensi. Isolat yang memiliki kemampuan degradasi pakan terbesar selanjutnya akan dibuat kurva pertumbuhan, aktivitas amilase dan protease serta proses pencampuran Bacillus sp. pada pakan ikan. Isolat yang terseleksi sebagai kandidat probiotik selanjutnya diidentifikasi gen 16S-rRNA.
Berdasarkan BLAST-N isolat PTB 1.4 memiliki nilai homologi sebesar 99% dan hasil pensejajaran 1011 bp menunjukkan isolat PTB 1.4 memiliki kedekatan dengan Bacillus megaterium. Isolat PTB 1.4 sebagai isolat terbaik karena tidak bersifat patogen, peka terhadap antibiotik yang diuji, memiliki aktivitas enzim protease dan amilase serta kemampuan mendegradasi pakan terbaik.
SUMMARY
HAMTINI. Isolation and Selection of Bacillus sp. from Catfish (Clarias sp.) as a Potential Probiotic. Supervised by ANJA MERYANDINI and WIDANARNI.
Problem in aquaculture Clarias sp. is the growth rate and one of the ways to solve this problem is the digestibility of feed. Feed for the fish can not digest it all, there are issued in the form of feces and other metabolic wastes. Therefore, improving the quality of feed is necessary that the feed can be absorbed by the fish so it will not any longer buildup in the bottom of the pool. Application of probiotic can be a promosing way to overcome this problem. Probiotics in aquaculture in addition can suppress pathogenic bacteria in aquaculture environments and produce a number of metabolites and digestive enzymes to facilitate absorption so as to increase the growth rate.
The aims of this study were to isolate and select Bacillus sp. from the gut of catfish (Clarias sp.) and know the potential probiotic candidates in the fish feed production. Isolation 1 gram of catfish (Clarias sp.) gut carried out by heating the sample that have been included in the gut in a test tube which contains a sterile physiological saline solution at 80 °C for 10-15 minutes. Isolation using Triptone soy agar (TSA) media which have been added with 1% skim milk for proteolytic activity and 1% starch for amylolytic activity. Selection was conducted based on pathogenicity test, antibiotic susceptibility test and total suspended solids. Isolate that have ability to degrade feed would be made the growth curves, analysis activities protease and amilase and also combine Bacillus sp. with feed. Selected isolate as candidate probiotic furthermore 16S-rRNA gene identified.
Result of isolation from gut catfish (Clarias sp.) obtained 16 isolates, 14 isolates of bacteria from staining spore are Bacillus sp. Result of in vitro pathogenicity test using blood agar medium there were 7 isolates that have gamma hemolytic activity (PTB 1.1, PTB 1.2, PTB 1.4, PTB 1.7, STB 1.6, STB 1.1 and STB 2.1). Antibiotic susceptibility test showed that 3 isolates were sensitive to the tested antibiotics (PTB 1.4, PTB 1.7 and STB 1.6). These three selected isolates were tested for their ability to degrade fish feed. PTB 1.4 isolate was able to degrade the feed with the smallest residue on the filter paper (0.0068 g). PTB 1.4 isolate also has proteolytic and amylolytic index of 0.61 and 0.60, respectively. Amylase activity of PTB 1.4 isolate added with 1.2% feed reached the highest peak in 120-hour of observation time (0.399 U/mL) and the highest protease activity was in 72-hour of observation time (0,065 U/mL). Inoculum amount on bacterial isolates PTB 1.4 is 108 CFU/mL, after combained with feed and CMC then incubated, inoculum of amount 106 CFU/mL.
Based on 16S-rRNA gene sequences isolate PTB 1.4 was 99% homolog and aligment result have 1011 bp showed PTB 1.4 distanly related with Bacillus megaterium. Isolation and selection of probiotic candidate from catfish get PTB 1.4 as a best isolate, there are not pathogenic, sensitive to antibiotic test, has protease and amilase activities. PTB 1.4 isolate has capability to degrade the feed.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
ISOLASI DAN SELEKSI
Bacillus
sp
.
DARI IKAN LELE
(
Clarias
sp.) SERTA POTENSINYA SEBAGAI PROBIOTIK
HAMTINI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
Judul Tesis : Isolasi dan Seleksi Bacillus sp. dari ikan lele (Clarias sp.) serta Potensinya sebagai Probiotik
Nama : Hamtini
NIM : G 351120051
Disetujui oleh
Komisi Pembimbing
Prof Dr Anja Meryandini, MS Ketua
Dr Ir Widanarni, MSi Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi
Prof Dr Anja Meryandini, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah SWT yang telah memberikan rahmat dan karunia-Nya kepada penulis, sehingga karya ilmiah ini berhasil diselesaikan. Penelitian yang dilaksanakan sejak bulan Juli 2013 sampai
Mei 2014 ini berjudul “Isolasi dan Seleksi Bacillus sp. dari Ikan Lele (Clarias sp.)
serta Potensinya sebagai Probiotik”. Penelitian ini bertempat di Laboratorium
Bioteknologi Hewan dan Biomedis PPSHB dan Laboratorium Mikrobiologi Departemen Biologi Institut Pertanian Bogor.
Penulis mengucapkan terima kasih kepada Prof Dr Anja Meryandini, MS dan Dr Ir Widanarni, MSi sebagai komisi pembimbing yang telah banyak membantu dan memberikan bimbingan serta sarannya. Terima kasih penulis ucapkan kepada Lembaga Pengelola Dana Pendidikan (LPDP) atas beasiswa tesis yang telah diberikan kepada penulis. Terima kasih penulis sampaikan kepada Dr Dinamella Wahjuningrum, SSi, MSi yang telah menjadi penguji sidang dan memberi saran dalam penyusunan karya ilmiah ini. Ucapan terima kasih kepada Ketua Program Studi Mikrobiologi Prof Dr Anja Meryandini, MS atas saran-saran dan nasehatnya. Penulis juga mengucapkan terima kasih kepada Prof Dr Ir Suharsono, DEA sebagai Kepala Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) IPB Yang telah memberikan fasilitas laboratorium, serta ucapan terima kasih buat seluruh staf-staf dan teknisi PPSHB IPB yang telah banyak memberikan bantuan.
Ungkapan terima kasih juga penulis sampaikan kepada kedua orang tua tercinta Yamin (alm) dan Noriah, serta keluarga yang telah banyak memberikan bantuan dan kata-kata semangat. Penulis sangat berterima kasih kepada Mbak Sri Murtini dan keluarga atas segala bantuan dan kata-kata semangatnya buat penulis serta ucapan terima kasih buat Bu Dewi, Teteh Pipit, Pak Pras, Pak Jaka, Pak Hendar, Pak Yayat dan Mbak Lilis atas segala bantuan yang telah diberikan. Buat teman-teman di laboratorium yaitu Hapsari Dewi, Anik, Ayun, Lia, Ika, Rahmi, Novi, Debby, Bob, Yeni, Leni, Dedi, Wahyu, Ira, Fathin serta buat teman-teman mikrobiologi 2012, Anja, Eja, Wulan, Dina, Vita, Ayun dan Rika terima kasih tak terhingga atas segala bantuan yang telah kalian berikan. Penulis juga ingin mengucapkan terima kasih kepada Tina, Tisrin, Windi, Siti, Rini, Ina dan Feni atas bantuan dan semangat yang telah diberikan, buat Afi, Ayu, Indah, Janah, Mona, Teh Ai, Delfi, Ika, Tiva dan Guntur terima kasih atas segala bantuan dan doanya buat penulis.
Semoga karya ilmiah ini bermanfaat.
Bogor, September 2014
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xii
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 2
Manfaat Penelitian 2
TINJAUAN PUSTAKA 3
Bacillus sp. sebagai Bakteri Probiotik 3
Mekanisme Kerja Bakteri Probiotik 3
Seleksi Bakteri Probiotik 4
METODE PENELITIAN 4
Tempat dan Waktu Penelitian 4
Isolasi Bacillus sp. dari Usus Ikan Lele 4
Seleksi Bacillus sp. sebagai Kandidat Probiotik 5
Identifikasi gen 16S-rRNA 8
HASIL DAN PEMBAHASAN 8
Hasil 8
Pembahasan 13
SIMPULAN DAN SARAN 18
Simpulan 18
Saran 18
DAFTAR PUSTAKA 19
LAMPIRAN 23
DAFTAR TABEL
1 Isolat yang diperoleh dari usus ikan lele dengan masa inkubasi
24 jam pada suhu ruang 8
2 Sifat patogenisitas Bacillus sp. media agar-agar darah dengan
masa inkubasi 24 jam pada suhu ruang 9
3 Kepekaan Bacillus sp. terhadap 3 jenis antibiotik. Kriteria yang diamati berdasarkan diamater zona hambat (mm) yang terbentuk
dengan masa inkubasi 24 jam pada suhu ruang 9
4 Penurunan total padatan tersuspensi (TPT) pakan yang ditambah isolat-isolat Bacillus sp. Substrat 1.2% pakan ikan, diinkubasi
120 jam pada kecepatan 120 rpm suhu ruang 10
5 Hasil BLAST-N gen sekuen 16S-rRNA isolat PTB 1.4 13
DAFTAR GAMBAR
1 Zona bening yang terbentuk, 1% susu skim, 1% pati, inkubasi
24 jam pada suhu ruang 11
2 Aktivitas protease isolat PTB 1.4 pada 1.2% media pakan ikan,
di shaker 120 rpm selama 120 jam pada suhu ruang 11
3 Aktivitas amilase isolat PTB 1.4 pada 1.2% media pakan ikan,
di shaker 120 rpm selama 120 jam pada suhu ruang 12
4 Kurva nilai kerapatan optik (Optical Density), isolat PTB 1.4 Isolat ditumbuhkan pada media TSB, ph 7.2, dan di shaker
120 rpm pada suhu ruang selama 24 jam 12
DAFTAR LAMPIRAN
1 Prosedur uji aktivitas protease (Walter 1984) 23
2 Prosedur uji aktivitas amilase (Bernfeld 1959) 24
3 Komposisi reagen yang digunakan 26
4 Karakteristik morfologi isolat dari usus ikan lele 27
5 Hasil contig gen parsial 16S-rRNA 28
6 Hasil Blast sekuen basa nukleotida isolat PTB 1.4
1
PENDAHULUAN
Latar Belakang
Ikan lele (Clarias sp.) merupakan hasil produksi perikanan budi daya yang sangat populer di Indonesia. Ikan lele memiliki kandungan gizi dan protein yang tinggi sehingga banyak digunakan dalam industri makanan serta berbagai jenis olahan dan fillet untuk diekspor ke luar negeri. Berdasarkan data dari Kementerian Kelautan dan Perikanan (2010) produksi ikan lele menempati urutan ketiga sebesar 273,554 ton di bawah ikan nila dan ikan mas. Upaya untuk peningkatan laju pertumbuhan ikan lele masih terus ditingkatkan sehingga penggunaan pakan akan lebih efektif dan efesien. Seperti kita ketahui bahwa sebagian besar budi daya perikanan intensif telah mengalami berbagai hambatan karena masalah penyakit, pertumbuhan yang lambat dan tingkat kelangsungan hidup ikan yang rendah (Mohapatra et al. 2012).
Budi daya ikan lele masih menghadapi berbagai macam permasalahan diantaranya mengenai tingkat pertumbuhannya yang masih rendah dan salah satu yang dapat dilakukan adalah dengan meningkatkan kecernaan pakan yang diberikan. Pakan yang diberikan hanya sebagian kecil yang dapat diserap oleh ikan sedangkan sebagiannya lagi akan dikeluarkan sebagai hasil buangan berupa feses dan sisa metabolisme lainnya. Menurut Antony dan Philip (2006) proporsi pakan yang digunakan oleh hewan aquatik hanya dalam jumlah yang sedikit, akibatnya sebagian besar pakan tersisa sebagai limbah di air yang diikuti eutrofikasi dan pengayaan material organik yang tinggi pada dasar kolam. Oleh karena itu, diperlukan upaya untuk efisiensi pakan pada budi daya ikan lele agar selain dapat meningkatkan pertumbuhan ikan lele, juga dapat menekan biaya pembelian pakan.
Aplikasi probiotik merupakan salah satu cara yang dapat dilakukan untuk menangani permasalahan tersebut. Dalam peningkatan nilai nutrisi pakan, bakteri probiotik memiliki mekanisme dalam menghasilkan beberapa enzim exogenous untuk pencernaan pakan seperti amilase, protease, lipase dan selulase (Bairagi et al. 2002; Aslamyah 2006; Wang et al. 2008). Enzim-enzim pencernaan yang dihasilkan tersebut dapat membantu meningkatkan daya cerna ikan sehingga penggunaan pakan akan lebih efisien.
Prinsip dasar kerja probiotik pada akuakultur salah satunya adalah pemanfaatan kemampuan mikroorganisme dalam memecah atau menguraikan rantai panjang karbohidrat, protein dan lemak yang menyusun pakan yang diberikan (Feliatra et al. 2004). Spesies Bacillus banyak yang dapatmenghasilkan berbagai enzim ekstraseluler dan digunakan secara luas untuk menghasilkan enzim bagi industri, seperti protease dan amilase (Fleming et al. 1995). Keunggulan bakteri ini adalah sporanya dapat dibuat dalam bentuk kering sehingga mudah ditambahkan ke dalam pakan buatan (Gatesoupe 1999).
2
karbohidrat meningkat. Sun et al. (2010) menyatakan bahwa pemberian Bacillus pumilus dan Bacillus clausii dapat memperbaiki efisiensi pakan dan laju pertumbuhan pada ikan kerapu Epinephelus coides. Tilapia yang diberi probiotik Enterococcus faecum dengan konsentrasi 107 CFU/mL menunjukkan bobot akhir dan penambahan bobot harian secara nyata lebih baik dibanding kontrol (Wang et al. 2008).
Penambahan probiotik dalam pakan telah mampu meningkatkan kinerja pertumbuhan ikan nila (Putra 2010). Isolat probiotik 1Ub, SKT-b dan Ua efektif menghambat pertumbuhan Vibrio harveyi dan secara signifikan dapat meningkatkan kelangsungan hidup dan pertumbuhan larva udang windu (Widanarni et al. 2008). Probiotik dapat diberikan pada inang atau ditambahkan ke lingkungan akuatik melalui beberapa cara pemberian (Moriarty 1998).
Perumusan Masalah
Pakan ikan yang diberikan tidak semuanya dapat dicerna oleh ikan karena ada sebagian yang dikeluarkan dalam bentuk limbah berupa feses dan sisa metabolisme. Selain banyaknya sisa pakan juga disebabkan kurangnya enzim pencernaan yang ada pada ikan untuk mengurai karbohidrat, protein atau lemak yang menyusun pakan. Oleh karena itu, diperlukan suatu cara untuk meningkatkan efisiensi pakan yaitu dengan penggunaan bakteri probiotik. Diketahuinya manfaat bakteri probiotik dalam saluran pencernaan ikan yang mempunyai kemampuan enzimatis sehingga dapat membantu proses penyerapan pakan. Spesies dari Bacillus sp. banyak digunakan sebagai probiotik pada akuakultur dikarenakan terdapat berbagai macam keunggulan diantaranya memiliki enzim amilase, protease dan lipase yang berperan sebagai enzim pencernaan serta memiliki spora yang dapat dibuat dalam bentuk kering.
Tujuan Penelitian
Penelitian ini bertujuan untuk mengisolasi dan menyeleksi Bacillus sp. dari usus ikan lele serta menguji potensinya sebagai kandidat probiotik pada pakan ikan.
Manfaat Penelitian
3
TINJAUAN PUSTAKA
Bacillus sp. sebagai Bakteri Probiotik
Bakteri probiotik yang telah dilaporkan untuk budi daya perairan seperti ikan, kerang maupun udang adalah bakteri fotosintetik, Lactobacillus dan Bacillus (Zhou et al. 2009). Genus Bacillus termasuk bakteri Gram positif, berbentuk batang lurus atau dapat sedikit bengkok, berukuran 0.3-2.2 μm x 1.2-7.0 μm, aerobik atau dapat berupa fakultatif anaerobik, kebanyakan bersifat motil dan memiliki endospora. Struktur endospora pada Bacillus membuatnya memiliki eksistensi yang tinggi di alam karena spora tersebut tahan terhadap cekaman lingkungan. Spora dari genus Bacillus memiliki keunggulan dibandingkan sel vegetatif, karena stabil dalam jangka waktu yang lama serta dapat dijadikan produk komersial yang berguna yaitu sebagai agen biologis (Hong et al. 2005). Toldar (2009) menyatakan bahwa pembentukan spora ditemukan secara universal pada genus, diperkirakan sebagai suatu strategi untuk bertahan pada lingkungan.
Mesalhy et al. (2008) melaporkan bakteri probiotik yang diisolasi dari saluran pencernaan ikan nila adalah dari jenis B. firmis, B. pumilus dan Citrobacter freundi. Banyak dari spesies Bacillus sp. yang dimanfaatkan sebagai probiotik, hal ini dikarenakan keberadaan dari spesies yang melimpah di alam. Definisi probiotik untuk akuakultur adalah sebagai mikroba hidup yang menguntungkan bagi inang dengan memodifikasi hubungan komunitas mikroba yang dapat berasosiasi dengan inang atau lingkungannya dalam meningkatkan penggunaan pakan atau nilai nutrisi, memacu respon inang terhadap penyakit, atau dengan meningkatkan kualitas perairan (Verschuere et al. 2000). Probiotik mikroba memiliki peran penting bagi akuakultur, yaitu mengenai pengaruhnya terhadap produktivitas, sumber nutrisi bagi hewan akuatik, kualitas air, pengendalian penyakit dan perbaikan lingkungan (Verschuere et al. 2000).
Mekanisme Kerja Bakteri Probiotik
Mikroflora normal dalam saluran pencernaan memiliki peranan yang penting dalam proses pencernaan hewan (Singh et al. 2010). Berbagai galur bakteri dalam saluran pencernaan mempunyai kemampuan merubah substrat-substrat makanan menjadi metabolit potensial dengan menghasilkan enzim-enzim pencernaan sehingga metabolit-metabolit potensial tersebut dapat dimanfaatkan oleh inangnya (Lisal 2005).
4
(3) menstimulasi imunitas melalui peningkatan kadar antibodi atau aktivitas makrofag.
Seleksi Bakteri Probiotik
Menurut Faturrahman (2012) sebelum melakukan seleksi mikroba probiotik, pemahaman tentang mekanisme kerja probiotik sangat penting karena merupakan dasar untuk menentukan kriteria seleksi yang diinginkan. Prosedur seleksi dan pengembangan probiotik bagi akuakultur terdiri atas enam tahapan, yaitu (1) pengumpulan informasi dari literatur serta di lapangan, manajemen produksi dan pengendalian penyakit, (2) isolasi kandidat probiotik potensial dari pool atau sumber terbaiknya (inang, pakan alami maupun dari lingkungan budi daya), (3) seleksi dan evaluasi kemampuan calon probiotik potensial, (4) penilaian patogenisitas probiotik potensial, (5) pengujian skala laboratorium termasuk melihat pengaruh kandidat probiotik secara in vivo terhadap variabel imunologi, sintasan dan keragaan inang, dan (6) analisis ekonomi (Gomez-Gill et al. 2000).
Manfaat probiotik pada budi daya meliputi peningkatan kualitas air, peningkatan nutrisi inang melalui produksi enzim pencernaan tambahan, kelangsungan hidup yang lebih besar bagi hewan akuakultur, serta meningkatkan respon imun (Verschuere et al. 2000). Ada beberapa cara pemberian probiotik pada inang diantaranya adalah melalui pemberian pakan hidup (Gomez-Gill et al. 2000), penambahan pada media budi daya (Moriarty 1998), dan penambahan pada pakan buatan (Rengpipat et al. 2000).
METODE PENELITIAN
Tempat dan Waktu Penelitian
Penelitian ini dilaksanakan di Laboratorium Bioteknologi Hewan dan Biomedis, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi (PPSHB) dan Laboratorium Mikrobiologi, Institut Pertanian Bogor. Waktu pelaksanaan penelitian dimulai pada bulan Juli 2013 hingga Mei 2014.
Isolasi Bacillus sp. dari Usus Ikan Lele
5
pengenceran 10-1 hingga 10-3. Petri yang telah berisi sampel kemudian diinkubasi selama 24 jam pada suhu ruang. Isolat yang tumbuh akan diindentifikasi secara morfologi dan dimurnikan sehingga didapatkan koloni tunggal.
Seleksi Bacillus sp. sebagai Kandidat Probiotik
Uji patogenisitas
Isolat bakteri diuji patogenitasnya dengan digoreskan pada media agar-agar darah. Biakan diinkubasi selama 24 jam pada suhu ruang. Isolat dengan aktivitas gamma hemolisis atau tidak terbentuknya zona bening di sekitar koloni akan diambil untuk diuji lanjut.
Uji kepekaan antibiotik
Isolat diuji kepekaannya terhadap 3 jenis antibiotik yaitu amoxicillin 20
μg/mL, rifampisin 5 μg/mL, dan ciprofloxacin 5 μg/mL. Kepekaan antibiotik dihitung berdasarkan ukuran zona hambat yang terbentuk menggunakan metode sumur. Kultur bakteri masing-masing ditanam pada medium TSA dengan cara dituang secara merata pada petri. Pada cawan yang telah dituangkan bakteri dibuat sumur untuk dimasukkan antibiotik dengan menggunakan corckborer, diinkubasi pada suhu ruang selama 24 jam kemudian diukur zona hambatnya. Resistensi antibiotik dihitung berdasarkan ukuran zona hambatan yang terbentuk menggunakan metode sumur. Interpretasi zona hambatan untuk resistensi, intermediet dan rentan ditentukan berdasarkan CLSI (2007). Isolat yang memiliki profil resistensi terhadap salah satu dari ke - 3 antibiotik dieliminasi sebagai kandidat probiotik.
Total Padatan Tersuspensi (TPT)
6
Pengujian Aktivitas Proteolitik dan Amilolitik
Pengujian ini bertujuan untuk mengukur besarnya kemampuan dari aktivitas proteolitik dan amilolitik pada masing-masing isolat yang diuji melalui uji hidrolisis susu skim dan pati. Hidrolisis proteolitik ditandai dengan adanya zona bening di sekeliling isolat yang ditumbuhkan pada media TSA ditambah 1% susu skim sedangkan hidrolisis amilolitik ditandai dengan zona bening pada media TSA ditambah 1% pati. Indeks proteolitik dan amilolitik diukur dengan menggunakan rumus menurut Lim dan Rahim (1987).
IP/IA : Indeks aktivitas proteolitik /amilolitik X1 : Rata-rata diameter zona bening
X2 : Rata-rata diameter koloni
Produksi Protease dan Amilase Ekstraseluler
Isolat yang memiliki indeks proteolitik dan amilolitik terbesar serta penurunan total padatan tersuspensi tertinggi dikarakterisasi lanjut. Isolat terpilih diukur aktivitas enzim protease dan amilasenya. Satu ose koloni tunggal bakteri diinokulasikan pada 20 mL media TSB (Triptone soy Broth). Sebanyak 10 mL kultur bakteri (108 CFU/mL) diinokulasikan pada 100 mL kultur pakan 1.2%. Kultur diinkubasi pada waterbath shaker dengan kecepatan 120 rpm. Setiap selang waktu 24 jam selama 120 jam diambil sampel kultur untuk pengujian aktivitas protease dan amilase. Enzim diperoleh dengan cara mensentrifugasi kultur pada kecepatan 5000x g selama 30 menit.
Pengukuran aktivitas protease
7
0.5 mL pereaksi Folin Cicalteau (1:2) dan dikocok kuat. Setelah didiamkan 20 menit setiap perlakuan diukur absorbansinya pada panjang gelombang 578 nm. Satu unit aktivitas enzim adalah jumlah enzim yang dibutuhkan untuk
menghasilkan 1 μmol tirosin per menit pada kondisi pengukuran.
Pengukuran aktivitas amilase
Aktivitas amilase diukur menurut metode Bernfeld (1955) (Lampiran 2). Campuran 1 mL enzim dalam substrat berupa 1 mL 1% pati terlarut yang dilarutkan dalam bufer fosfat 0.05 M, pH 7.5 diinkubasi pada suhu ruang selama 10 menit kemudian ditambahkan 2 mL reagen asam 3,5-dinitrosalisilat (DNS) untuk mendeteksi gula pereduksi. Kontrol dibuat dengan menggunakan komposisi yang sama tetapi enzim ditambahkan setelah pemberian DNS (Lampiran 3). Sampel dan kontrol dididihkan selama 5 menit untuk menghentikan reaksi, lalu didinginkan selama 15 menit dalam air. Gula pereduksi yang dihasilkan diukur dengan spektrofotometer pada panjang gelombang 550 nm. Aktivitas enzim didapatkan dengan mengukur konsentrasi maltosa reaksi dengan persamaan regresi linear dari kurva standar maltosa. Satu unit aktivitas amilase didefinisikan sebagai jumlah enzim yang reaksinya menghasilkan produk setara dengan 1 μmol maltosa per menit pada kondisi pengukuran.
Kurva Pertumbuhan
Pembuatan kurva pertumbuhan bakteri kandidat probiotik bertujuan untuk mengetahui fase-fase pertumbuhan bakteri dan penentuan waktu dalam pemanenan sel bakteri. Koloni tunggal bakteri diinokulasikan ke dalam 20 mL medium cair TSB, diinkubasi selama 24 jam pada suhu ruang. Sebanyak 10 mL kultur segar diinokulasikan ke dalam medium TSB steril 90 mL, di shaker 120 rpm selama24 jam. Pertumbuhan bakteri diamati setiap 2 jam dengan mengukur nilai kerapatan optik pada panjang gelombang 620 nm dan dicawankan pada beberapa titik pengamatan (Hadioetomo 1993).
Pencampuran Bacillus sp. pada Pakan Ikan
8
Identifikasi 16S-rRNA
Amplifikasi gen penyandi 16S-rRNA menggunakan primer 63f (5’CAG GCC TAA CACATG CAA GTC-3’) dan primer 1387r (5’-GGG GGG WGT GTA CAA CGC-3’) Marchesi et al. (1998). Komposisi master mix PCR setiap tabung terdiri atas 25 µl GoTaq (Promega), 4 µl primer 63f, 4 µl primer 1387r, 17 µl ddH2O dan DNA cetakan (template) diambil dengan tusuk gigi secara langsung
dari isolat Bacillus. Kondisi PCR sebagai berikut: pradenaturasi 95 oC selama 5 menit, denaturasi 95 oC selama 1 menit, annealing primer 55 oC selama 1 menit, elongasi 72 oC selama 1 menit, dan post PCR pada suhu 72 oC selama 5 menit dan di running sebanyak 30 siklus. Penghentian reaksi dilakukan dengan penurunan suhu ke 4 oC. Produk PCR dijalankan pada elektroforesis gel agarose 1% dengan bufer TAE 1X pada 80 volt selama 45 menit. Selanjutnya, diletakkan di atas paparan sinar UV transluminator untuk divisualisasikan dan dilihat ada tidaknya pita DNA bakteri hasil isolasi.
Penentuan urutan gen (sekuensing) dilakukan dengan mengirimkan DNA hasil amplifikasi ke perusahaan penyedia jasa sekuensing. Analisis data kasar hasil sekuensing menggunakan Mega 5 software. Hasil alignment sekuen DNA disejajarkan dengan data base di Gene Bank menggunakan program BLAST-N online software (www.ncbi.nlm.nih.gov).
HASIL DAN PEMBAHASAN
Hasil
Bacillus sp.dari Usus Ikan Lele
9
Pewarnaan spora dilakukan untuk memastikan bahwa isolat yang ada merupakan Bacillus sp. Hasil dari pewarnaan spora terdapat 14 isolat yang merupakan Bacillus sp. (Tabel 1) kecuali STB 2.4 dan STB 2.5.
Bacillus sp. sebagai Kandidat Probiotik
Patogenisitas Bacillus sp. secara in vitro
Hasil uji patogenisitas dengan inokulasi isolat pada media agar-agar darah menunjukkan bahwa dari 14 isolat yang diuji terdapat 2 isolat yang memiliki aktivitas beta hemolisis, 5 isolat alfa hemolisis dan 7 isolat dengan aktivitas gamma hemolisis (Tabel 2).
Tabel 2 Sifat patogenisitas Bacillus sp. pada media agar-agar darah dengan masa inkubasi 24 jam pada suhu ruang
Kepekaan Bacillus sp. terhadap antibiotik
Pada penelitian ini telah dilakukan uji kepekaaan terhadap 3 jenis antibiotik menggunakan metode sumur. Uji kepekaan isolat dilakukan terhadap beberapa antibiotik yaitu rifampisin, amoxicillin dan ciprofloxacin. Hasil uji kepekaan terhadap 3 jenis antibiotik tersebut disajikan pada Tabel 3.
Tabel 3 Kepekaan Bacillus sp. terhadap 3 jenis antibiotik. Kriteria yang diamati berdasarkan diameter zona hambat (mm) yang terbentuk dengan masa inkubasi 24 jam pada suhu ruang
*Standar resistensi rifampisin 5μg/mLμ ≤16 mm resisten, 17-19 mm intermediet, ≥20 peka; amoxicillin
20μg/mLμ ≤13 mm resisten, 14-16 mm intermediet, ≥17 peka; ciprofloxacin 5μg/mLμ ≤15 mm resisten, 16-20
mm intermediet, ≥21 peka; Øμ diameter zona hambat. S = Peka, I = Intermediet dan R = resisten (CLSI 2007).
10
Resisten rifampisin dan amoxicillin ditunjukkan oleh isolat STB 1.1, STB 2.1, sedangkan intermediet amoxicillin ditunjukkan oleh isolat PTB 1.1, dan PTB 1.2 (Tabel 3). Isolat yang masih sensitif terhadap antibiotik yang diuji adalah STB 1.6, PTB 1.4 dan PTB 1.7.
Total Padatan Tersuspensi (TPT)
Pengukuran TPT didasarkan pada berat partikel pakan yang tersuspensi dalam air. Pakan ikan yang digunakan sebagai media terdiri atas campuran protein, karbohidrat, lemak, vitamin dan mineral. Hasil uji total TPT pada pakan yang ditambahkan isolat-isolat Bacillus sp. dengan melihat kadar penurunannya pada kertas saring disajikan pada Tabel 4.
Tabel 4 Penurunan total padatan tersuspensi (TPT), pakan yang ditambah isolat-isolat Bacillus sp. Substrat 1.2% pakan ikan, diinkubasi 120 jam pada kecepatan 120 rpm suhu ruang
Isolat Ks + filtrat (g) Ks (g) Volum (mL) TPT (g)
PTB 1.4 0,1179 0,1111 10 0,0068
PTB 1.7 0,1215 0,1110 10 0,0105
STB 1.6 0,1215 0,1127 10 0,0088
Kontrol * 0,1288 0,1125 10 0,0163
*
Tidak ada penambahan kultur bakteri; Ks: kertas saring
Isolat PTB 1.4 memiliki kemampuan mendegradasi pakan terbesar dengan sisa pakan pada kertas saring terkecil yaitu 0,0068 g. Isolat PTB 1.7 dan STB 1.6 memiliki kemampuan mendegradasi pakan dengan sisa pakan pada kertas saring sebesar 0,0105 g dan 0,0088 g, dengan nilai pada kertas saring lebih besar dibanding isolat PTB 1.4, sehingga isolat PTB 1.4 menjadi isolat terpilih untuk dilihat aktivitas proteolitik dan amilolitiknya. Kontrol tanpa penambahan kultur bakteri memiliki kemampuan degradasi lebih kecil dengan sisa pada kertas saring terbesar yaitu 0,0163 g.
Aktivitas Proteolitik dan Amilolitik
11
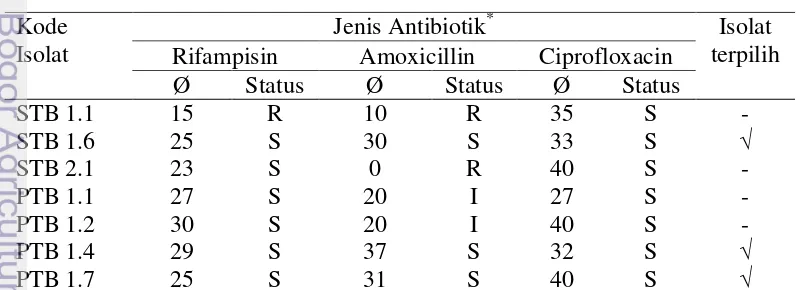
Gambar 1 Zona bening yang terbentuk, a. 1% susu skim, b 1% pati, inkubasi 24 jam pada suhu ruang
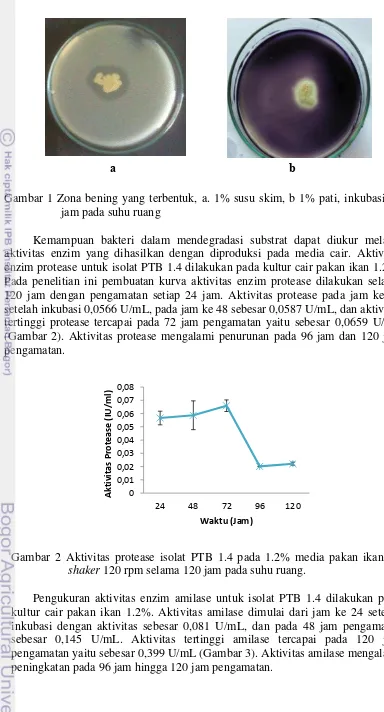
Kemampuan bakteri dalam mendegradasi substrat dapat diukur melalui aktivitas enzim yang dihasilkan dengan diproduksi pada media cair. Aktivitas enzim protease untuk isolat PTB 1.4 dilakukan pada kultur cair pakan ikan 1.2%. Pada penelitian ini pembuatan kurva aktivitas enzim protease dilakukan selama 120 jam dengan pengamatan setiap 24 jam. Aktivitas protease pada jam ke 24 setelah inkubasi 0,0566 U/mL, pada jam ke 48 sebesar 0,0587 U/mL, dan aktivitas tertinggi protease tercapai pada 72 jam pengamatan yaitu sebesar 0,0659 U/mL (Gambar 2). Aktivitas protease mengalami penurunan pada 96 jam dan 120 jam pengamatan.
Gambar 2 Aktivitas protease isolat PTB 1.4 pada 1.2% media pakan ikan, di shaker 120 rpm selama 120 jam pada suhu ruang.
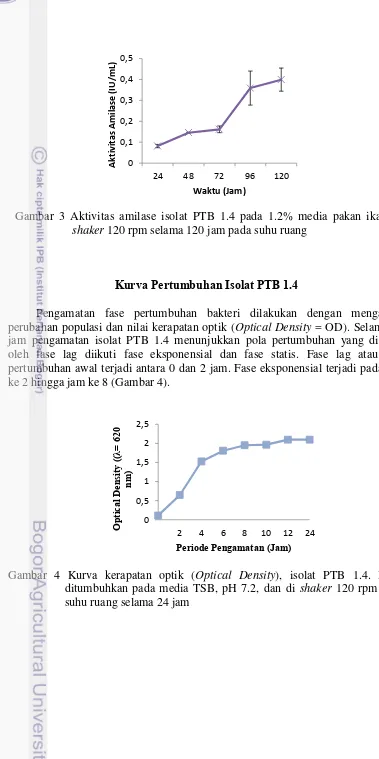
Pengukuran aktivitas enzim amilase untuk isolat PTB 1.4 dilakukan pada kultur cair pakan ikan 1.2%. Aktivitas amilase dimulai dari jam ke 24 setelah inkubasi dengan aktivitas sebesar 0,081 U/mL, dan pada 48 jam pengamatan sebesar 0,145 U/mL. Aktivitas tertinggi amilase tercapai pada 120 jam pengamatan yaitu sebesar 0,399 U/mL (Gambar 3). Aktivitas amilase mengalami peningkatan pada 96 jam hingga 120 jam pengamatan.
12
Gambar 3 Aktivitas amilase isolat PTB 1.4 pada 1.2% media pakan ikan, di shaker 120 rpm selama 120 jam pada suhu ruang
Kurva Pertumbuhan Isolat PTB 1.4
13
Ketahanan Bacillus sp. dalam Pakan Ikan
Pencampuran isolat PTB 1.4 dengan pakan ikan dimaksudkan sebagai media pembawa probiotik bagi ikan. Pemilihan bakteri berspora dengan tujuan agar pembuatan pelet dengan proses pemanasan tidak menyebabkan bakteri mati. Jumlah inokulum awal adalah 108 CFU/mL, setelah digabungkan pada pakan dan CMC kemudian diinkubasi selama 10 menit jumlah inokulum akhir menjadi 106 CFU/mL.
Identifikasi gen 16S-rRNA
Berdasarkan BLAST-N (Lampiran 5), isolat PTB 1.4 memiliki nilai homologi sebesar 99% dan hasil pensejajaran 1011 bp menunjukkan isolat PTB 1.4 memiliki kedekatan dengan Bacillus megaterium (Tabel 5 dan Lampiran 6).
Tabel 5 Hasil BLAST-N gen sekuen 16S-rRNA isolat PTB 1.4
Pembahasan
Suatu probiotik yang baik seharusnya diisolasi dari hewan inang, habitat atau pakannya sehingga dapat beradaptasi dengan lingkungan maupun saluran pencernaannya. Menurut Verschuere et al. (2000) probiotik merupakan agen mikroba hidup yang memberikan pengaruh menguntungkan pada inangnya dengan berbagai macam interaksi, salah satunya adalah menjamin perbaikan dalam penggunaan pakan atau memperbaiki nilai nutrisinya. Pada penelitian ini isolat yang didapatkan diharapkan adalah spesies dari Bacillus sp. Hasil isolasi dari usus ikan lele didapatkan 14 isolat merupakan Bacillus sp. Penapisan Bacillus dilakukan dengan cara memanaskan sampel usus ikan lele, metode ini sudah menjadi cara yang umum dilakukan untuk menyeleksi Bacillus dari sampel alam, karena bakteri ini merupakan bakteri penghasil endospora. Hong et al. (2005) menyatakan bahwa spora dari genus Bacillus memiliki keunggulan dibandingkan sel vegetatif, karena stabil dalam jangka waktu yang lama serta dapat dijadikan produk komersil yang berguna.
Nama Spesies Homologi Nomor Assesi
Bacillus sp. WP-XY01-5 99 KF052591.1
Bacillus megaterium galur RD30 99 KJ534462.1
Bacillus megaterium galur S-3 99 KJ572280.1
Bacillus megaterium galur RC55 99 KJ534461.1
Bacillus megaterium galur RB132 99 KJ534460.1
Bacillus megaterium galur LA141 99 KJ534459.1
Bacillus megaterium galur RA138 99 KJ534458.1
Bacillus megaterium galur BMN1 99 KJ461522.1
Bacillus megaterium galur RLS12 99 KF957737.1
14
Bacillus sp. merupakan bakteri Gram positif, pembentuk spora yang secara normal terdapat di udara, air, tanah, sedimen dan diperkirakan dapat masuk saluran pencernaan melalui asosiasi dengan makanan (Moriarty 1999; Farzanfar 2006). Bakteri ini banyak digunakan dalam aplikasi probiotik, khususnya pada akuakultur karena bakteri ini banyak ditemukan di alam dan spesiesnya dapat menghasilkan enzim ekstraseluler serta memiliki spora. Toldar (2009) menyatakan bahwa bakteri ini tersebar luas di alam dan dikenal dengan sporanya yang tahan terhadap senyawa kimia dan agen fisik. Beberapa spesies Bacillus yang dilaporkan untuk probiotik pada sistem akuakultur, diantaranya adalah Bacillus coagulans SC8168 (Zhou et al. 2009), Bacillus spp. (Ziaei-Nejad et al. 2006), dan Bacillus S11 (Rengpipat et al. 2000). Selanjutnya biakan yang telah murni diseleksi berdasarkan sejumlah kriteria diantaranya uji patogenisitas secara in vitro menggunakan agar-agar darah kemudian kepekaan isolat terhadap antibiotik uji dan kemampuan isolat untuk mendegradasi pakan dengan uji total padatan tersuspensi serta uji aktivitas enzim protease dan amilase yang dihasilkan. Pada uji patogenisitas menggunakan agar-agar darah didapatkan 7 isolat yang memiliki aktivitas gamma hemolisis yang ditandai dengan tidak ada perubahan warna dalam media. Media yang digunakan adalah media agar-agar darah yang merupakan media diferensial, media ini digunakan untuk membedakan bakteri berdasarkan kemampuan melisiskan sel darah merah. Bakteri yang mampu melisiskan sel darah merah bersifat lebih virulen dibandingkan yang tidak mampu melisiskan sel darah merah. Kemampuan bakteri untuk melisiskan sel darah merah ditentukan oleh substansi berupa protein ekstraseluler yang disebut hemolisin. Ada 3 tipe hemolisis yaitu, beta, gamma dan alfa hemolisis. Beta hemolisis disebut sebagai lisis lengkap sel darah merah dan hemoglobin, sehingga media yang ada koloninya menjadi bening. Pada gamma hemolisis tidak terjadi hemolisis, ditandai dengan tidak ada perubahan warna dalam media sedangkan alfa hemolisis disebut sebagai lisis sebagian dari sel darah merah dan hemoglobin (Suryanto et al. 2007).
Faktor-faktor lingkungan mikro, seperti faktor adhesi dan kompetisi terhadap bakteri komensal lainnya, perolehan nutrisi, dan pH di dalam saluran gastrointestinal berpengaruh terhadap produksi enterotoksin. Duc et al. (2004) menyatakan bahwa bakteri tidak selalu memproduksi enterotoksin. Selain melalui uji hemolisis pada media agar-agar darah untuk sifat patogenitas dapat juga dilakukan secara molekuler dengan PCR. Das et al. (2009) melakukan deteksi cepat terhadap gen yang mencirikan Bacillus cereus enterotoksigenik (hbla) melalui teknik PCR. Namun dalam penelitian ini uji patogenitasnya hanya menggunakan media agar-agar darah sehingga hanya isolat dengan aktivitas gamma hemolisis akan diseleksi lebih lanjut dan isolat yang memiliki aktivitas alfa dan beta hemolisis akan dieliminasi dari seleksi karena dikhawatirkan akan dapat bersifat patogen.
15
Uji kepekaan isolat dilakukan terhadap beberapa antibiotik. Rifampisin merupakan inhibitor RNA polimerase melalui pengikatan kuat pada subunit- dan memblok masuknya nukleotida pertama yang dibutuhkan untuk aktivasi polimerase sehingga menghambat laju transkripsi, sedangkan antibiotik amoxicillin dan ciprofloxacin merupakan antibiotik yang mekanisme kerjanya merusak sintesis peptidoglikan.
Bakteri resisten antibiotik bila digunakan akan dapat meningkatkan potensi ancaman melalui transfer gen resistensi kepada patogen manusia lewat saluran gastrointestinal atau lingkungan. Brashear et al. (2003) menyatakan dari 55 isolat kandidat probiotik yang diuji kerentanannya terhadap 6 jenis antibiotik hanya 19 isolat yang masih bersifat rentan. Faturrahman (2012) melaporkan bahwa dari 14 isolat kandidat probiotik yang diuji sensitifitasnya terhadap 4 jenis antibiotik (tetrasiklin, rifampisin, ampisilin dan vankomisin) hanya diperoleh 7 isolat yang bersifat sensitif. Resistensi pada bakteri disebabkan oleh beberapa faktor diantaranya adanya gen resistensi pada kromosom atau plasmid dan dapat juga karena terjadinya transfer materi genetik. Isolat-isolat yang sensitif terhadap antibiotik yang diuji kemudian diseleksi lanjut dengan melihat kemampuan isolat mendegradasi pakan ikan melalui uji total padatan tersuspensi.
Pada pengukuran total padatan tersuspensi yang diamati ialah berat partikel pakan yang tersuspensi dalam air. Pakan ikan yang digunakan sebagai media terdiri atas campuran protein, karbohidrat, lemak, vitamin dan mineral. Pakan ikan yang berkualitas selain dapat dihasilkan dari sumber bahan pakan, dapat juga dengan penambahan enzim pencernaan. Semakin tinggi nutrien pakan yang tercerna, semakin besar pula kemungkinan nutrien tersebut dimanfaatkan oleh ikan untuk pertumbuhannya dan menurunkan porsi nutrien yang akan terbuang ke lingkungan, sehingga secara tidak langsung dapat menekan laju penurunan mutu lingkungan. Peranan probiotik dalam meningkatkan kecernaan pakan dan pemanfaatan bagi pertumbuhan ikan telah banyak diteliti. Rengpipat et al. (1998) melaporkan bahwa keberadaan probiotik dalam saluran pencernaan dapat meningkatkan penyerapan pakan serta menekan jumlah patogen dalam saluran pencernaan.
Seperti diketahui bahwa enzim ekstraseluler yang disekresikan oleh bakteri untuk mendegradasi pakan ditujukan untuk memenuhi kebutuhan karbon atau energi bagi bakteri itu sendiri, akan tetapi karena ketersediaan nutrien lebih banyak dibandingkan dengan kebutuhan bakteri menyebabkan ketersediaan nutrien untuk inang tidak terganggu (Faturrahman 2012). Peranan enzim-enzim pencernaan sangat penting, karena dapat berperan dalam menghidrolisis senyawa-senyawa kompleks menjadi lebih sederhana dan mudah diserap. Kemampuan isolat dalam mendegradasi pakan didukung oleh kemampuan isolat dalam menghasilkan enzim-enzim ekstraseluler yang digunakan untuk memecah senyawa kompleks menjadi senyawa sederhana. Sonenschein et al. (1993) menyatakan bahwa enzim ekstraseluler Bacillus sangat efisien dalam memecah berbagai senyawa karbohidrat, lipid dan protein rantai panjang menjadi unit-unit rantai pendek atau senyawa yang lebih sederhana. Isolat PTB 1.4 yang memiliki kemampuan degradasi tertinggi dilakukan uji proteolitik dan amilolitik serta dilihat aktivitas amilase dan proteasenya.
16
berdasarkan luas daerah zona bening yang dihasilkan dari isolat pada media padat yang terdapat substrat. Lim dan Rahim (1987); Wang et al. (2007) menyeleksi isolat penghasil enzim potensial berdasarkan indeks aktivitas tertinggi.
Kemampuan isolat PTB 1.4 dalam menghasilkan aktivitas proteolitik dan amilolitik menunjukkan bahwa bakteri ini memiliki pengaruh menguntungkan terhadap proses pencernaan ikan. Menurut Fardiaz (1992) sebagian dari Bacillus sp. mempunyai sifat proteolitik yang dapat mensekresikan enzim protease, sebagian bersifat amilolitik yang dapat mensekresikan enzim amilase dan bersifat lipolitik yang dapat mensekresikan enzim lipase. Uji aktivitas proteolitik dan amilolitik yang dilakukan hanya bersifat kualitatif berdasarkan zona bening yang dihasilkan, sehingga untuk mengetahui aktivitas enzimnya secara kuantitatif dilakukan pengukuran aktivitas enzim ekstraselulernya.
Enzim protease merupakan salah satu jenis enzim yang paling banyak digunakan dalam indutrsi. Protease merupakan enzim yang berfungsi menghidrolisis ikatan peptida pada protein menjadi oligopeptida dan asam amino (Fatoni et al. 2008). Kemampuan bakteri dalam mendegradasi substrat dapat diukur melalui aktivitas enzim yang dihasilkan dengan diproduksi pada media cair. Aktivitas enzim protease untuk isolat PTB 1.4 dilakukan pada kultur cair pakan ikan 1.2%. Hal ini dikarenakan pakan ikan memiliki kandungan protein dan karbohidrat yang tinggi sehingga untuk uji aktivitas protease dan amilase digunakan sebagai substrat.
Aktivitas enzim protease tertinggi pada 72 jam pengamatan dan mengalami penurunan setelah 96 jam pengamatan, terjadinya penurunan dikarenakan telah berkurangnya substrat pada media sehingga aktivitasnya menurun. Selain itu aktivitas enzim juga dapat dipengaruhi oleh berbagai macam faktor seperti suhu, pH, substrat, ion-ion dan berbagai macam senyawa lain. Kontribusi enzimatik dari bakteri probiotik bagi inang adalah berupa peningkatan aktivitas enzim-enzim pencernaan seperti amilase, protease dan lipase (Ziaei-Nejad et al. 2006). Aktivitas protease lebih tinggi pada Bacillus cereus yang diisolasi dari usus ikan dibandingkan dengan sumber lainnya (Essakiraj et al. 2008). Menurut Jamilah et al. (2009) Bacillus sp. DA 5.2.3 dapat memanfaatkan protein dan karbohidrat dari pakan udang sebagai sumber nitrogen dan karbon. Aktivitas maksimum protease Bacillus cereus MTCC pada fase pertumbuhan stasioner dengan aktivitas sebesar 90 (U/mL) pada jam ke – 24 (Joshi et al. 2007).
17
Bacillus merupakan genus bakteri penghasil enzim amilase ekstraseluler terbesar. Menurut Sivaramakrishnan et al. (2006) beberapa spesies B. subtilis, B. stearothermophilus, B. licheniformis, B. amiloquefaciens seringkali digunakan untuk memproduksi enzim amilase secara komersial untuk berbagai keperluan.
Pengamatan fase pertumbuhan bakteri dilakukan dengan mengamati perubahan populasi dan nilai kerapatan optik (Optical Density = OD). Faturrahman (2012) mendapatkan isolat bakteri kandidat probiotik yaitu Abn2.1 dan Alg 3.1 dengan fase lag terjadi antara 0 dan 2 jam. Cepat atau lamanya fase lag memberikan konsekuensi pada fase eksponensial dan laju dari pertumbuhan bakteri. Fase eksponensial tercepat merupakan bakteri yang cukup baik digunakan sebagai probiotik. Kandidat bakteri probiotik Np 4 dan Np 5 asal ikan nila mencapai fase eksponensial tercepat (Putra 2010). Hal ini berhubungan dengan waktu panen sel bakteri dalam memproduksi suatu produk atau senyawa metabolit, diantarannya adalah enzim, antibakterial, vitamin dan asam organik. Menurut Faturrahman (2012) bahwa isolat bakteri kandidat probiotik yang baik adalah yang memiliki laju pertumbuhan tercepat hal ini dikarenakan berhubungan dengan kemampuan isolat untuk berkompetisi dengan bakteri lain untuk menempel pada saluran pencernaan. Sebagian besar mikroorganisme uniseluler tumbuh eksponensial namun dengan laju yang bervariasi karena dipengaruhi oleh berbagai kondisi lingkungan seperti, suhu, substansi kimia dan ciri genetika dari mikroorganisme (Madigan et al. 2009).
18
Identifikasi gen 16S-rRNA merupakan suatu pendekatan secara molekuler yang dilakukan untuk mengetahui spesies dari isolat bakteri berdasarkan kemiripan sekuen gen dengan data pada GenBank. Analisis gen penyandi 16S rRNA praktis untuk definisi spesies, karena molekul ini bersifat ubikuitas dengan fungsi yang identik pada seluruh organisme, dan molekul ini juga dapat berubah sesuai jarak evolusinya dan dapat digunakan sebagai kronometer evolusi yang baik sehingga dirancang suatu primer yang universal untuk seluruh kelompok (Pangastuti 2006). Menurut Marchesi et al. (1998), penggunaan primer 63f dan
1387r tidak membentuk struktur dupleks dengan ujung 5’ yang dapat dikenali
oleh enzim eksonuklease 5’-3’dan tidak terdapat nukleotida yang terpotong pada
ujung 5’ yang mempengaruhi suhu penempelan (anneling) primer. Homologi
menunjukkan bahwa sekuen tersebut memiliki hubungan evolusi (Pertsemlidis dan Fondon III 2002).
Isolat PTB 1.4 yang diperoleh dalam peneltian ini telah diidentifikasi sebagai Bacillus megaterium. Bacillus megaterium yang digunakan sebagai probiotik dapat memproduksi enzim-enzim pencernaan seperti protease, amilase dan lipase (Solano dan Olmos 2006). B. megaterium umumnya bersifat mesofilik dengan suhu optimal antara 30–45 °C dan merupakan penghasil amidase penisilin (Toldar 2009). BLAST (Basic Local Alignment Search Tool) merupakan salah satu program bioinformatika yang digunakan untuk pensejajaran sekuen dan jenis BLAST-N (Nukleotida) yang digunakan dalam analisis sekuen gen 16S-rRNA.
SIMPULAN DAN SARAN
Simpulan
Sebanyak 16 isolat telah berhasil diisolasi dari usus ikan lele dan 14 diantaranya adalah Bacillus sp. Seleksi kandidat probiotik menghasilkan isolat PTB 1.4 sebagai isolat terbaik karena tidak bersifat patogen, peka terhadap antibiotik yang diuji, memiliki aktivitas enzim protease dan amilase serta kemampuan mendegradasi pakan terbaik. Berdasarkan hasil sekuensing gen 16S-rRNA isolat PTB 1.4 adalah Bacillus megaterium.
Saran
19
DAFTAR PUSTAKA
Antony SP, Philip R. 2006. Biomerediation in shrimp culture system. NAGA Worldfish Center Quarter. 29(3&4): 62-66.
Aslamyah S. 2006. Penggunaan mikroflora saluran pencernaan sebagai probiotik untuk meningkatkan pertumbuhan dan kelangsungan hidup ikan Bandeng [disertasi]. Bogor (ID) : Institut Pertanian Bogor.
Aygan A, Arikan B, Korkmaz H, Dincer S, Colak O. 2008. Highly thermostable
and alkaline α-amylase from a halotolerant alkaliphilic Bacillus sp. AB68.
Braz J Microbiol. 39:547-553.
Bairagi A, Shakar Ghosh K, Sen SK, Ray AK. 2002. Enzyme producing bacterial flora isolated from fish digestive tracts. Aquacult Int 10: 109-21.
Bernfeld P. 1955. Amylases a and ß: Method Enzymol 1:149-58.
Brashear MM, Jaroni D, Trimble J. 2003. Isolation, selection and characterization of lactic acid bacteria as competitive exclusion product to reduced Escherichia coli 0157:H7 in cattle. J food Protec 66:355-363.
[CLSI] Clinical and Laboratory Standards Institute. 2007. Performance Standars for Antimicrobial Susceptibility Testing; Twenty-Second Informational Supplement. Pennsylavania (US): CLSI.
Cordeiro CAM, Martin MLL, Luciano AB. 2002. Production and properties of α -amylase from thermophilic Bacillus sp.. Braz J Microbiol. 33:57-61.
Das S, Surendran PK, Thampuran N. 2009. PCR-based detection of enterotoxigenic isolate of Bacillus cereus from tropical seafood. Indian J Med Res. 129:316-320.
Duc LH, Hong HA, Barbosa TM, Henriques AO, Cutting SM. 2004. Characterization of Bacillus probiotic available for human use. Appl Environ Microbiol. 70(4):2161-2171.
Essakiraj P, Immanuel G, Sowmya, Iyaparaj P, Palevesam A. 2009. Evaluation of protease-producing ability of fish gut isolate Bacillus cereus for aqua feed. J. Food. Bioproc. Technol. 2: 383-390.
Farzanfar A. 2006. The use of probiotic in shrimp aquaculture. FEMS. 20:1-10. Fardiaz S. 1992. Mikrobiologi Pangan 1. Jakarta (ID): PT. Gramedia.
Fatoni A, Zusfahair, Lestari P. 2008. Isolasi dan karakterisasi protease ekstraseluler dari bakteri dalam limbah cair tahu. J Natur Indones. 10(2):83-88.
Faturrahman. 2012. Potensi bakteri agarolitik sebagai penyedia enzim agarase untuk memperbaiki pertumbuhan juvenil abalon (Haliotis asinina Linn. 1758) [disertasi]. Bogor (ID) : Institut Pertanian Bogor.
Feliatra, Efendi I, Suryadi E. 2004. Isolasi dan identifikasi bakteri probiotik dari ikan kerapu Macan (Ephinephelus fuscogatus) dalam upaya efisiensi pakan ikan. J Natur Indonesia. 6(2): 75-80.
Fleming AB, Tangney M, Jorgensen PL, Diderrichsen B, Priest FG. 1995. Extracellular enzymes synthesis in a sporulation-deficient strain of Bacillus licheniformis. J Appl Environ Mirobiol. 61: 3775-3780.
20 study of their immunostimulatory effect in penaeus vanname. Aquaculture. 233:1-14.
Hadioetomo RS. 1993. Mikrobiologi Dasar dalam Praktek: Teori dan Praktek. Jakarta (ID): PT. Gramedia.
Hong HA, Duc LH, Cutting SM. 2005. The use of bacterial spore formers as probiotics. FEMS Microb Rev 29:813-835.
Irianto A. 2003. Probiotik Akuakultur. Yogyakarta (ID): Gadjah Mada University Press.
Jamilah I, Meryandini A, Rusmana I, Suwanto A, Mubarik NR. 2009. Activity of proteolytic and amylolytic enzymes from Bacillus spp. isolated from shrimp ponds. Microbiol Indones. 3(2):67-71.
Joshi GK, Kumar S, Sharma V. 2007. Production of moderately Halotoleran, SDS stable, alkaline protease from Bacillus cereus MTCC 6840 isolated from lake Nainital Uttarachal State, India. Braz J Microbiol. 38:773-779.
Jusadi D, Gandara E, Mokoginta I. 2004. Pengaruh penambahan probiotik Bacillus sp. pada pakan komersil terhadap konversi pakan dan pertumbuhan ikan patin (Pangasius hypophthalamus). J Akuakul Indones. 3(1):15-18. Kementerian Kelautan dan Perikanan. 2010. Kelautan dan Perikanan dalam
Angka 2010. Kementerian Kelautan dan Perikanan. Jakarta (ID).
Kesarcodi-Watson A, Kaspan H, Lategan J, Gibson L. 2008. Probiotics in aquaculture: the need principles and mechanismes of action and screening processes. Aquaculture. 274: 1-14.
Lin LL, Chyau CC, Hsu WH. 1998. Production and properties of a raw-starch-degrading amylase from the thermophilic alkaliphilic Bacillus sp. TS-23. Biotechnol Appl Biochem. 28:61-68.
Lim G, Tan TK, Rahim NA. 1987. Variations in amylase and protease activities among Rhizopus isolates. Mircen J. 3:319-322.
Lisal JS. 2005. Konsep probiotik dan prebiotik untuk modulasi mikrobiota usus besar. Medical Nusantara. 26: Oktober-Desember.
Madigan MT. Matinko JM, Dunlap PV, Clark DP. 2009. Brock Biology of Microorganisms. Edisi 12. San Francisco (US): Pearson Benjamin Cummings.
Marchesi J.R, Sato T, Weightman A.J, Martin T.A, Fry J.C, Hiom S.J, Wade W.G.1998. Design and evaluation of useful bacterium-specific PCR primers that amplify genes coding for bacterial 16S-rRNA. J Appl Environ Microbiol. 64(2):795-799.
21
Mohapatra S, Chakraborty T, Prusty AK, Das P, Paniprasad K, Mohanta KN. 2012. Use of different microbial probiotics in the diet of rohu, Labeo rohita fingelings: effects on growth, nutrient digestibility and retention, digestive enzyme activities and intestinal microflora. Aquacult Nutr. 18:1-11.
Moriarty DJW. 1999. Disease control in shrimp aquaculture with probiotic bacteria. Di dalam: Bell CR, Brylinski M, Johnson-Green P, editor. Microbiol Biosystem: New Frontiers. Proceding of 8 th, International Symposium on Microbial Ecology; Halifax: Atlantic Canada Society for Microbiol Ecology. 237-243.
Moriarty D. 1998. Control of luminous Vibrio species in penaeid aquaculture ponds. Aquaculture. 164:351-358.
Murni. 2004. Pengaruh penambahan bakteri probiotik Bacillus sp. dalam pakan buatan terhadap aktivitas enzim pencernaan, efisiensi pakan dan pertumbuhan ikan gurame [tesis]. Bogor (ID): Institut Pertanian Bogor. Pangastuti A. 2006. Definisi spesies prokaryota berdasarkan urutan basa gen
penyandi 16S-rRNA dan gen penyandi protein [Ulasan]. Biodiversitas. 7(3):292-296.
Pertsemlidis A, Fondon III JW. 2002. Having a BLAST with bioinformatics (and avoiding BLAST phemy). Gen Biol. 2:1-10.
Putra AN. 2010. Kajian probiotik, prebiotik dan sinbiotik untuk meningkatkan kinerja pertumbuhan ikan Nila (Oreochromis niloticus) [tesis]. Bogor (ID): Institut Pertanian Bogor.
Ray AK, Bairagi A, Ghosh KS, Sen SK. 2007. Optimazation of fermentation condition for cellulase production by Bacillus subtilis CY5 and Bacillus circulans TB3 isolated from fish gut. Acta Ichthyol Piscat. 37(1):47-53. Rengpipat S, Rukpratanporn S, Piyatitiratitivorakul S, Menasaveta P. 2000.
Immunity enhancement in black tiger shrimp (Penaeus monodon) by a probiont bacterium (Bacillus S11). J. Aquacult. 167:301-313.
Singh SK, Tripathi VR, Jain RK, Vikram S. 2010. An antibiotic, heavy metal resistent and halotolerant Bacillus cereus SIU1 and its thermoalkaline protease. Microb Cell Fac. 9:59-64.
Sivaramakrishnan S, Gangadharan D, Madhavan K, Nampothiri, Soccol CR, Pandet A. 2006. α-amylase from microbiol sources an overview on recent development. Food Technol Biotechnol. 44(2):173-184.
Solano O, Olmos S. 2006. The functional property of Bacillus for shrim feeds. Aquaculture. 23:519-525.
Sonenschein AL, Losick R, Hoch JA. 1993. Bacillus subtilis and Other Gram Positive Bacteria. Biochemistry Physiology and Moleculer Genetics Washington DC (US): American Society for Microbiology.
Sun YZ, Yang HL, Ma RL, Lin WY. 2010. Probiotic applications of two dominant gut Bacillus strains with antagonistic activity improved the growth performance and immune response of grouper Epinephelus coioides. J Fish Shellfish Immunol. 29:803-809.
Suryanto D, Irmayanti, Lubis, S. 2007. Karakterisasi dan uji kepekaan antibiotik beberapa isolat Staphylococcus aureus dari Sumatera Utara. Majalah Kedokteran Nusantara. 40(2):104-107.
22
Verschuere L, Rombaut G, Sorgeloos P, Verstraete W. 2000. Probiotic bacteria as biological control agents in aquaculture. J Mircobiol Mol Biol Rev. 64(4): 655-671.
Walter HE. 1984. Method with haemoglobin, casein, and azocoll as substrate. Di dalam: Bergmeyer, editor. Methods of Enzymatic Analysis. Ed ke-3. Weinheim (JE): Verlag Chemie. hlm. 270 – 278.
Wang H, Liu Y, Cheng C, Ma O, Zhang Y. 2007. Screening and mutagenesis of a novel Bacillus pumilis strain producing alkaline protease for dehairing. Lent Appl Microb. 44: 1-6.
Wang YB, Li JR, Lin J. 2008. Probiotics in aquaculture: Challenges and outlook. J Aquacult. 281: 1-4.
Widanarni, Sukenda, Setiawati M. 2008. Bakteri probiotik dalam budidaya udang: seleksi, mekanisme aksi, karakterisasi, dan aplikasinya sebagai agen biokontrol. JIPI. 13(2): 80-89.
Zhou XX, Wang YF, Li WF. 2009. Effect of probiotic on larva shrimp (Penaeus vannamei) based on water quality, survival rate and digestive enzyme activities. J Aquacult. 287: 349-353.
23
Lampiran 1 Prosedur uji aktivitas protease (Walter 1984)
Pereaksi Blanko (μl) Kontrol (μl) Sampel (μl)
Kasein 1% 500 500 500
Bufer fospat 50 - -
Tirosin 5 mM - 50 -
Enzim - - 50
Diinkubasi 10 menit pada suhu optimum
TCA 0,3 M 500 500 500
Enzim 50 50 -
Bufer fosfat - - 50
Diinkubasi 10 menit suhu ruang, sentrifugasi kecepatan 14000 rpm; 10 menit
Na2CO3 0,4 M 2000 2000 2000
Filtrat 600 600 600
Folin Ciocalteu (1:2) 400 400 400
Diinkubasi 20 menit = 578 nm
Aktivitas enzim dihitung menurut rumus:
x P x 1/T
Keterangan :
UA : Jumlah enzim yang dapat menghasilkan 1 mikromol produk tirosin permenit
A Sampel : Absorbansi sampel A Standar : Absorbansi standar A Blanko : Absorbansi Blanko
P : Faktor pengenceran
24
Lampiran 2 Prosedur uji aktivitas amilase (Bernfeld 1959)
Pereaksi Blanko (mL) Kontrol (mL) Sampel (mL)
Substrat (pati terlarut 0.3 %)
1 1 1
Enzim (EEK) - - 1
DNS - 1 -
Aquades 1 - -
Dikocok dan diinkubasi 10 menit pada suhu ruang
DNS 1 - 1 Enzim (EEK) - 1 -
dikocok dan dipanaskan pada 100 oC selama 5 menit, kemudian didinginkan dalam air selama 20 menit, diukur absorbansi pada = 550 nm
Keterangan :
UA : Unit aktivitas enzim
FP : Faktor pengenceran
BM : Berat molekul (BM maltosa = 360.32 Da)
25
Kurva standar maltosa
Persamaan regresi linear y = 1,4165x – 0,0428 Konsentrasi Maltosa
( mg/mL)
Absorban rata-rata
( =550 nm) Absorbansi terkoreksi ( =550 nm)
0 0.052 0
0.15 0.180 0.128
0.25 0.341 0.289
0.35 0.511 0.459
0.45 0.645 0.593
0.55 0.793 0.741
0.65 0.942 0.890
y = 1,4165x - 0,0428 R² = 0,9932
-0,2 0 0,2 0,4 0,6 0,8 1
0 0,1 0,2 0,3 0,4 0,5 0,6 0,7
Abs
orba
sni
(λ
=5
50
nm
)
26
Lampiran 3 Komposisi reagen yang digunakan
1. Phosphate Buffered saline (PBS): 10 mM K2PO4-KH2PO4, 0,14 M NaCl pH
7.2
2. Reagen Dinitrosalisilic acid (DNS) (g/L):
-NaOH padat : 10
- KNa –Tartarat : 182
- Na2SO3 : 0.5
- DNS : 10
-Aquades : sampai dengan 1000 mL
Sebanyak 10 g NaOH, 182 g KNa-Tartarat, 0.5 g Na2SO3 dimasukkan
dalam erlenmeyer 1000 mL dan dilarutkan dengan akuades sedikit demi sedikit. Setelah larut ditambahkan DNS sambil dihomogenkan perlahan-lahan. Larutan disaring dengan kertas saring dan disimpan dalam botol gelap pada suhu dingin.
3. Lugol’s Iodine (100 mL)μ
- KI : 2 g
- Akuades : 20 mL
- I2 : 1 g
27
Lampiran 4 Karakteristik morfologi isolat dari usus ikan lele
No Kode
Isolat Karateristik morfologi
1. PTB 1.1 Batang, putih susu, licin, disekitar tepian melengkung
2. PTB 1.2 Batang, putih susu, tepian bergerigi, permukaan sedikit kasar
3. PTB 1.3 Batang, putih susu, tepian licin, permukaan licin/halus (ada
bulatan kecil ditengah)
4. PTB 1.4 Batang, putih susu, tepian licin, bulat, permukaan halus
5. PTB 1.5 Batang, krem, tepian bergerigi, bulat kecil, permukaan
mengkerut
6. PTB 1.6 Batang, krem, tepian bergerigi, bulat kecil, permukaan
kasar/mengkerut
7. PTB 1.7 Batang, kuning, tepian licin, permukaan licin
8. PTB 2.0 Batang, krem, tepian bergerigi, permukaan kasar, bulat besar
9. STB 1.1 Batang, putih susu, tepian bergerigi, permukaan kasar/tidak
licin
10. STB 1.5 Batang, putih susu, tepian licin, permukaan licin
11. STB 1.6 Batang, krem, tepian licin, bulat, permukaan licin
12. STB 2.1 Batang, krem, tepian bergerigi, permukaan kasar
13. STB 2.2 Batang, krem, tepian bergerigi, permukaan kasar
14. STB 2.3 Batang, krem, tepian licin, permukaan licin
15. STB 2.4 Bundar, tepian bergerigi, bening, permukaan kasar/mengkerut
28
Lampiran 5 Hasil contig gen 16S-rRNA isolat PTB 1.4
GGCCGCGGCATGCTGATCCGCGATTACTAGCGATTCAGCTTCATGTAGGCGAGTTGCA GCCTACAATCCGAACTGAGAATGGTTTTATGGGATTGGCTTGACCTCGCGGTCTTGCA GCCCTTTGTACCATCCATTGTAGCACGTGTGTAGCCCAGGTCATAAGGGGCATGATGA TTTGACGTCATCCCCACCTTCCTCCGGTTTGTCACCGGCAGTCACCTTAGAGTGCCCAA CTAAATGCTGGCAACTAAGATCAAGGGTTGCGCTCGTTGCGGGACTTAACCCAACATC TCACGACACGAGCTGACGACAACCATGCACCACCTGTCACTCTGTCCCCCGAAGGGG AACGCTCTATCTCTAGAGTTGTCAGAGGATGTCAAGACCTGGTAAGGTTCTTCGCGTT GCTTCGAATTAAACCACATGCTCCACCGCTTGTGCGGGCCCCCGTCAATTCCTTTGAG TTTCAGTCTTGCGACCGTACTCCCCAGGCGGAGTGCTTAATGCGTTAGCTGCAGCACT AAAGGGCGGAAACCCTCTAACACTTAGCACTCATCGTTTACGGCGTGGACTACCAGG GTATCTAATCCTGTTTGCTCCCCACGCTTTCGCGCCTCAGCGTCAGTTACAGACCAAA AAGCCGCCTTCGCCACTGGTGTTCCTCCACATCTCTACGCATTTCACCGCTACACGTGG AATTCCGCTTTTCTCTTCTGCACTCAAGTTCCCCAGTTTCCAATGACCCTCCACGGTTG AGCCGTGGGCTTTCACATCAGACTTAAGAAACCGCCTGCGCGCGCTTTACGCCCAATA ATTCCGGATAACGCTTGCCACCTACGTATTACCGCGGCTGCTGGCACGTAGTTAGCCG TGGCTTTCTGGTTAGGTACCGTCAAGGTACGAGCAGTTACTCTCGTACTTGTTCTTCCC TAACAACAGAGTTTTACGACCCGAAAGCCTTCATCACTCACGCGGCGTTGCTCCGTCA GACTTTCGTCCATTGCGGAAGATTCCCTACTGCTGCCTCCCGTAGGAATCTGGGCCCG GGCCTCAGTCCCAGTTGGGGCCGATCACCCCTCTCAGGTCNGGCAATGCATCGTTTGC CTTGGTGAAGCCGTTACCCTCACCAACTAAGCTAATGGAACCGCGGGGCCCATTCTGG AAAGTGATAGCCGAAAACCATCTTTTCAATCCATCTCCCCATTGAAGAGAAGAAGAA CCCTATCCCGGTATATACGTTTCCGGTTTCCCGAAAATTATCCCCAGTTNTTACAGGGC AGGTTGTGCCAGCTGTTGAACTCAACCCGGTCCCGCCGCTAAACGCTATAAGAAANC AGATTTCTTATAAGAATT
29
RIWAYAT HIDUP
Penulis dilahirkan di Penebal Kabupaten Bengkalis, Riau pada tanggal 19 Maret 1986 sebagai anak ke-tiga dari 3 bersaudara pasangan Yamin (Alm) dan Noriah. Tahun 2005 penulis lulus dari SMA Negeri 2 Bengkalis, pada tahun yang sama lulus seleksi masuk PBUD (Penelurusan Bibit Unggul Daerah) Universitas Riau. Penulis memilih program studi Pendidikan Biologi, Fakultas Keguruan dan Ilmu Pendidikan dan selesai pada tahun 2009.
Penulis pernah bekerja sebagai Tenaga Pengajar pada Sekolah Dasar Swasta di Pekanbaru pada tahun 2010 hingga 2012. Pada tahun 2012 penulis melanjutkan perkuliahan di Program studi Mikrobiologi Sekolah Pascasarjana IPB. Penulis mendapatkan Beasiswa Tesis dalam Negeri 2013 dari LPDP (Lembaga Pengelola Dana Pendidikan). Tulisan karya ilmiah ini akan
dipublikasikan dalam Jurnal Biologi Indonesia dengan judul “ Isolasi dan Seleksi