KARAKTERISASI BAKTERI NITRIFIKASI
KOLAM IKAN AIR TAWAR PROVINSI RIAU DAN JAMBI
MEGAWATI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI SKRIPSI DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa skripsi berjudul Karakterisasi Bakteri Nitrifikasi Kolam Ikan Air Tawar Provinsi Riau dan Jambi adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
ABSTRAK
MEGAWATI. Karakterisasi Bakteri Nitrifikasi Kolam Ikan Air Tawar Provinsi Riau dan Jambi. Dibimbing oleh IMAN RUSMANA dan YUNI PUJI HASTUTI.
Akumulasi senyawa nitrogen anorganik dalam kolam budidaya ikan air tawar dapat menurunkan kualitas kolam ikan. Permasalahan tersebut dapat diatasi dengan pendekatan bioremediasi yang melibatkan aktivitas metabolisme mikroba untuk menurunkan konsentrasi nitrogen anorganik sampai tingkat konsentrasi yang aman. Salah satu proses mikrobial yang terlibat dalam bioremediasi adalah nitrifikasi. Nitrifikasi adalah proses oksidasi amonium menjadi nitrit dan oksidasi nitrit menjadi nitrat. Penelitian ini bertujuan melakukan karakterisasi bakteri nitrifikasi yang diisolasi dari kolam ikan air tawar di Provinsi Riau dan Jambi. Karakterisasi dilakukan terhadap 14 isolat yang merupakan bakteri Gram negatif. Hasil uji oksidasi amonium menunjukkan bahwa terdapat 6 isolat mampu melakukan aktivitas oksidasi amonium di atas 80%. Tiga isolat yang diuji kinetika oksidasi amonium, yaitu RCC1, RCSC2, dan JCSC2 mempunyai nilai konstanta Michaelis-Menten (Km) sebesar 2.44, 3.95, dan 7.99 mM. Isolat RCC1 yang mempunyai nilai Km lebih kecil dibandingkan keduanya menunjukkan bahwa isolat RCC1 mempunyai enzim dengan afinitas tinggi terhadap substratnya.
Kata kunci: karakterisasi bakteri, kualitas air, oksidasi amonium, nitrifikasi
ABSTRACT
MEGAWATI. Characterization of Nitrifying Bacteria of Freshwater Pond in Riau and Jambi Province. Supervised by IMAN RUSMANA and YUNI PUJI HASTUTI.
Accumulation of inorganic nitrogen compounds in a freshwater pond could decrease water quality of a freshwater pond. This problem could be solved using bioremediation approach involving microbial metabolic activities to decrease the inorganic nitrogen concentration until the safe level. One of microbial processes involved in bioremediation is nitrification. Nitrification is oxidation process of ammonium to nitrite and nitrate. The objective of this research was to characterize nitrifying bacteria isolated from freshwater ponds in Riau and Jambi Province. The characterization was carried out on 14 isolates which were Gram-negative bacteria. Ammonium oxidation test showed that 6 isolates could oxidize ammonium up to 80%. Michaelis-Menten constant values (Km) of three isolates i.e. RCC1, RCSC2, and JCSC2 isolates were 2.44, 3.95, and 7.99 mM respectively. The RCC1 isolate had the smallest Km values, it indicated that this isolate had enzymes with high affinity to their substrates.
Skripsi
sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
pada
Departemen Biologi
KARAKTERISASI BAKTERI NITRIFIKASI
KOLAM IKAN AIR TAWAR PROVINSI RIAU DAN JAMBI
MEGAWATI
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan Januari 2014 ini ialah nitrogen, dengan judul Karakterisasi Bakteri Nitrifikasi Kolam Ikan Air Tawar Provinsi Riau dan Jambi.
Ungkapan terimakasih penulis sampaikan kepada:
1 Bapak Dr Ir Iman Rusmana, MSi dan Ibu Yuni Puji Hastuti, SPi, MSi selaku pembimbing atas saran dan dukungan dalam penelitian dan penyusunan karya ilmiah ini.
2 Keluarga tercinta, yaitu Bapak Atmaja (ayah), Ibu Asenih (ibu), Siti Hardiyanti (adik), dan Oktavia Rahmawati (adik) serta keluarga besar atas limpahan doa, kasih sayang, dan motivasinya.
3 Rekan satu bimbingan, yaitu Tiara AD, Nurlatiefah, Nindya S, Yuli SF, Erma S, Kak Randi, Kak Masrukhin, Kak Aay, Kak Antri, dan Kak Hendri atas motivasi dan bantuannya.
4 Rekan-rekan Mikrobiologi atas segala motivasi dan arahannya selama penelitian.
5 Rekan-rekan Biologi 47 atas segala pengalaman dan motivasi.
6 Sahabat Pondok Aisyah, yaitu Desty, Tiara, Lupita, Tri, Khairunnisa, Wanda, Astri, Sulis, dan Indah atas doa, motivasi, dan pengalaman berharga menjadi keluarga kedua bagi saya.
7 Sahabat terkasih, antara lain Desty, Angga, Hanafi, Dwi, Olivia, dan sahabat Rohis 22 atas doa dan motivasinya.
8 Semua pihak yang turut memberikan doa dan semangatnya. Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Tujuan Penelitian 1
Manfaat Penelitian 2
METODE 2
Waktu dan Tempat Penelitian 2
Bahan 2
Prosedur Analisis Data 2
HASIL DAN PEMBAHASAN 4
Hasil 4
Pembahasan 9
SIMPULAN 11
DAFTAR PUSTAKA 11
LAMPIRAN 13
DAFTAR TABEL
1 Karakteristik isolat bakteri nitrifikasi 6
2 Perbandingan hasil pengukuran OD sel pada media nitrifikasi autotrof
dan heterotrof per hari 7
3 Kemampuan isolat untuk mengoksidasi amonium dengan menghasilkan senyawa nitrit dan nitrat setelah 5 hari inkubasi 7
4 Hasil uji kinetika nilai Km dan Vmaks 9
DAFTAR GAMBAR
1 Hasil pemurnian dengan metode kuadran. (a) Isolat RCSC2, (b) Isolat
RCC1, (c) Isolat JCSC2 5
2 Hasil pewarnaan Gram. (a) Isolat RCSC2, (b) Isolat RCC1, (c) Isolat
JCSC2 5
3 Laju oksidasi amonium dan akumulasi nitrit isolat RCSC2, RCC1 dan
JCSC2 8
DAFTAR LAMPIRAN
1 Kurva standar amonium 13
2 Kurva standar nitrit 13
3 Kurva standar nitrat 13
PENDAHULUAN
Latar Belakang
Provinsi Riau dan Jambi memiliki sumberdaya perikanan yang cukup besar. Berdasarkan data pada tahun 2007, Riau memiliki potensi perikanan budidaya kolam seluas 8200 Ha dengan realisasi seluas 3685 Ha sedangkan Jambi memiliki 3000 Ha dengan realisasi seluas 1606 Ha (KKP 2009). Produksi perikanan budidaya ikan air tawar di Provinsi Jambi pada tahun 2011 sebanyak 34478.8 ton dengan budidaya terbesar berupa budidaya ikan patin (BPS 2013). Hasil produksi tersebut tidak terlepas dari sistem budidaya yang dilakukan secara intensif. Pada sistem budidaya intensif, ikan dipelihara dengan kepadatan tinggi dan semua nutrisi diperoleh secara langsung dari pakan yang diberikan dengan kandungan protein yang tinggi (Rohmana 2009).
Aktivitas budidaya ikan air tawar yang dilakukan dengan sistem intensif menghasilkan limbah pakan yang tinggi, dari semua pakan yang diberikan hanya 70% yang dimakan oleh ikan dan sisanya sebanyak 30% akan lepas ke badan perairan sebagai bahan pencemar atau limbah (Rachmansyah 2004). Degradasi sisa pakan (bahan organik) tersebut akan menghasilkan senyawa nitrogen anorganik berupa NH3 (amonia), NO3- (nitrat), dan NO2- (nitrit) (Widiyanto 2006). Akumulasi senyawa nitrogen anorganik tersebut dapat menghambat pertumbuhan bahkan menyebabkan kematian massal ikan-ikan yang dibudidayakan (Erlania et al. 2010).
Permasalahan akumulasi senyawa nitrogen anorganik tersebut dapat diatasi melalui pendekatan bioremediasi yang melibatkan aktivitas metabolisme mikroba dengan tujuan menurunkan tingkat akumulasi sampai tingkat konsentrasi yang aman (Widiyanto 2006). Konsentrasi yang aman untuk budidaya ikan air tawar, yaitu amonia kurang dari 0.01 mg/l dan nitrit kurang dari 0.06 mg/l (BBPBAT 2014). Salah satu proses yang terlibat dalam menurunkan akumulasi senyawa nitrogen anorganik tersebut adalah nitrifikasi. Nitrifikasi merupakan proses mikrobial yang mengoksidasi komponen nitrogen (amonium) menjadi nitrit dan nitrat. Nitrifikasi berlangsung melalui dua tahapan reaksi, yaitu pada tahap pertama oksidasi amonium menjadi nitrit yang dilakukan oleh mikroba pengoksidasi amonium, contohnya Nitrosomonas dan Nitrosococcus. Tahap kedua adalah oksidasi nitrit menjadi nitrat oleh mikroba pengoksidasi nitrit, contohnya Nitrobacter. Selain itu, ada kelompok bakteri heterotrofik dapat melakukan nitrifikasi, contohnya Pseudomonas (EPA 2002).
Salah satu pendekatan bioremediasi dalam mengatasi permasalahan lingkungan perairan budidaya memerlukan gambaran karakteristik bakteri nitrifikasi. Karakteristik secara morfologi dan aktivitas bakteri mengoksidasi amonium dan nitrit adalah hal yang perlu diamati dalam katakterisasi ini.
Tujuan Penelitian
2
Manfaat Penelitian
Penelitian ini diharapkan bisa dijadikan sebagai acuan dalam melakukan karakterisasi bakteri nitrifikasi yang diisolasi dari kolam ikan air tawar dan mengetahui kemampuan bakteri dalam mengoksidasi amonium.
METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan pada bulan Januari 2014 sampai Juli 2014 di Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB. Sampel merupakan isolat yang diambil dari kolam ikan air tawar di Provinsi Riau dan Jambi.
Bahan
Bahan yang digunakan ialah isolat bakteri nitrifikasi kolam ikan air tawar sebanyak 14 isolat terdiri atas 5 isolat asal Jambi dan 9 isolat asal Riau koleksi Laboratorium Mikrobiologi, Departemen Biologi, FMIPA IPB. Nama isolat dari Riau ditandai dengan huruf awal R sedangkan isolat dari Jambi ditandai dengan huruf awal J. Media yang digunakan adalah media cair nitrifikasi dan media padat nitrifikasi (Rodina 1972 dalam Novita 2006). Reagen yang digunakan adalah reagen amonium, reagen nitrit, dan reagen nitrat.
Prosedur Analisis Data
Pemurnian dan peremajaan isolat
Pemurnian isolat dilakukan dengan menumbuhkan isolat bakteri pada media agar nitrifikasi melalui metode kuadran dan diinkubasi pada suhu ruang (28-31 °C) selama 5 hari. Koloni murni yang diperoleh ditumbuhkan kembali pada media agar nitrifikasi, kemudian diinkubasi pada suhu ruang selama 3-4 hari hingga sel bersifat murni.
Karakterisasi morfologi
Isolat murni hasil isolasi diamati morfologi koloninya, meliputi bentuk, warna, elevasi, dan tepiannya. Bentuk sel diamati dan reaksi Gram dari tiap isolat ditentukan dengan teknik pewarnaan Gram. Warna merah muda menunjukkan bahwa sel bakteri bersifat Gram negatif sedangkan warna ungu menunjukkan bahwa sel bakteri bersifat Gram positif (Hadioetomo 1983).
Pengujian isolat pada media autotrof dan heterotrof
3 sebagai sumber karbon). Isolat ditumbuhkan pada kedua media cair nitrifikasi dan diinkubasi pada inkubator berpenggoyang dengan suhu ruang (28-31 °C). Pertumbuhan sel isolat pada media nitrifikasi heterotrof dianalisis pada hari ketiga sedangkan pertumbuhan sel isolat pada media nitrifikasi autotrof dianalisis pada hari keempat dengan kerapatan optik (OD) menggunakan spektrofotometer pada panjang gelombang 550 nm.
Uji aktivitas oksidasi amonium
Sebanyak 2 lup isolat murni diinokulasikan pada 10 ml media cair nitrifikasi, kemudian diinkubasi pada inkubator berpenggoyang dengan suhu ruang (28-31 °C) selama 5 hari. Pengukuran aktivitas oksidasi amonium dilakukan pada hari ke-5. Pengukuran ini dilakukan melalui analisis kadar amonium, nitrit, dan nitrat.
Presentase jumlah amonium yang teroksidasi (AO) dan senyawa nitrat atau nitrit yang terbentuk dihitung dengan rumus sebagai berikut:
[ ] [ ][ ]
Keterangan:
AO : Persentase amonium yang teroksidasi AK : Konsentrasi amonium pada media kontrol
AP : Konsentrasi amonium pada media yang diinokulasi bakteri
Persentase jumlah nitrat yang terbentuk (PNA) atau persentase jumlah nitrit yang terbentuk (PNI) dihitung dengan rumus sebagai berikut:
[ ] [ ][ ]
Keterangan:
PNA : Persentase jumlah nitrat yang terbentuk
NT : Kandungan nitrat pada suspensi perlakuan (diinokulasi isolat bakteri)
NK : Kandungan nitrat pada kontrol (tidak diinokulasi bakteri) AK : Kandungan amonium pada kontrol
AP : Kandungan amonium pada suspensi perlakuan
Kinetika oksidasi amonium
4
dibuat tanpa diinokulasi kultur bakteri. Pengukuran aktivitas oksidasi amonium dilakukan setelah 3 jam inkubasi. Analisis kinetika oksidasi amonium dilakukan dengan menggunakan persamaan kinetika Michaelis-Menten (White 2000). Nilai Km (konstanta Michaelis-Menten) digunakan dalam menentukan ukuran afinitas enzim-substrat (E-S), yang merupakan suatu indikator kekuatan ikatan kompleks E-S atau suatu tetapan keseimbangan untuk disosiasi kompleks E-S menjadi E dan S. Nilai Km kecil berarti afinitas enzim tinggi terhadap substrat, sedangkan bila Km besar berlaku kebalikannya (Fox 1991 diacu dalam Putra 2009).
Analisis kadar amonium
Kadar amonium ditentukan dengan metode spektrofotometri. Sebanyak 2 ml sampel yang telah disaring ditambah dengan 0.08 ml fenol alkohol 10%, 0.08 ml sodium nitroprusid, dan 0.2 ml campuran hipoklorit teknis dan alkalin sitrat 20% (1 : 4), kemudian didiamkan selama 1 jam pada kondisi gelap. Setiap setelah pemberian pereaksi dilakukan pengadukan. Pemberian pereaksi akan menghasilkan warna biru. Warna yang terbentuk dibaca serapannya pada panjang gelombang 640 nm (Eaton et al. 2005). Nilai absorban yang diperoleh dikonversi menggunakan standar hingga diperoleh satuan dalam konsentrasi (μM).
Analisis kadar nitrit
Sebanyak 2 ml sampel yang telah disaring ditambah dengan 0.08 ml pewarna nitrit. Pewarna nitrit dibuat dengan mencampurkan 1 gram sulfanilamid, 10 ml phosphoric acid 85%, dan 80 ml aquades dengan 0.1 gram NED (Naftalena Etilena Diamina). Kemudian didiamkan selama 10 menit. Setiap setelah pemberian pereaksi dilakukan pengadukan. Pemberian pereaksi akan menghasilkan warna merah muda hingga keunguan. Warna yang terbentuk dibaca serapannya pada panjang gelombang 543 nm (Eaton et al. 2005). Nilai absorban yang diperoleh dikonversi menggunakan standar hingga diperoleh satuan dalam konsentrasi (μM).
Analisis kadar nitrat
Sebanyak 1 ml sampel yang telah disaring ditambah dengan 0.2 ml larutan natrium klorida, 1 ml asam sulfat 80%, dan 0.05 ml brucine sulfanilic acid, kemudian dipanaskan selama 20 menit. Setiap setelah pemberian pereaksi dilakukan pengadukan. Pemberian pereaksi akan menghasilkan warna kuning. Warna yang terbentuk dibaca serapannya pada panjang gelombang 410 nm (Rand et al. 1979). Nilai absorban yang diperoleh dikonversi menggunakan standar hingga diperoleh satuan dalam konsentrasi (μM).
HASIL DAN PEMBAHASAN
Hasil
Pemurnian dan Peremajaan Isolat
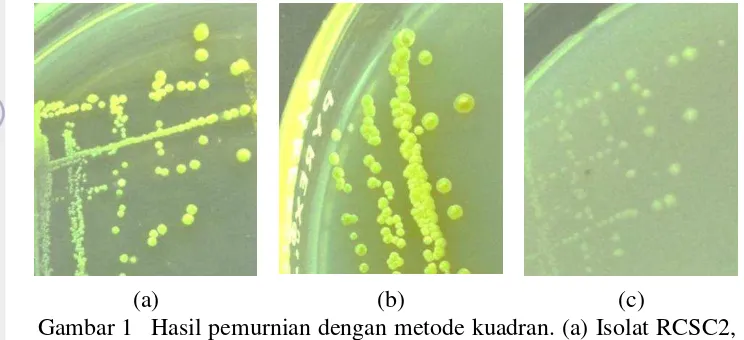
5 hidup secara aerobik dalam media yang mengandung amonium sebagai sumber nitrogen dan karbonat sebagai sumber karbonnya. Pemurnian bakteri dilakukan dengan metode kuadran agar menghasilkan koloni tunggal (Gambar 1). Hasil pewarnaan Gram menunjukkan sel berwarna merah muda (Gambar 2).
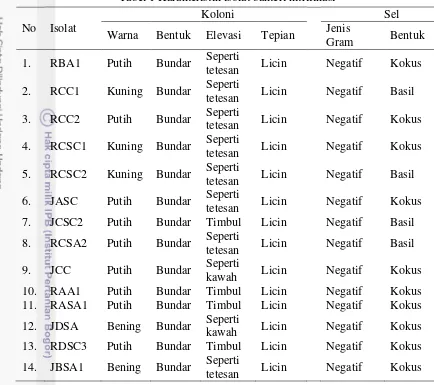
Berdasarkan pengamatan pada keempat belas isolat, terlihat bahwa isolat mempunyai bentuk koloni yang didominasi oleh bentuk bundar dan tepian licin. Warna koloninya sebagian besar berwarna putih, sedangkan isolat lainnya berwarna kuning dan bening. Karakteristik morfologi pada sel dilakukan dengan pewarnaan Gram, warna merah muda pada sel bakteri menunjukkan bahwa semua sel bakteri berjenis Gram negatif. Sel pada sepuluh isolat berbentuk kokus sedangkan empat isolat lainnya berbentuk basil (Tabel 1).
(a) (b) (c)
Gambar 1 Hasil pemurnian dengan metode kuadran. (a) Isolat RCSC2, (b) Isolat RCC1, (c) Isolat JCSC2
(a) (b) (c)
6
Tabel 1 Karakteristik isolat bakteri nitrifikasi No Isolat
Koloni Sel
Warna Bentuk Elevasi Tepian Jenis
Gram Bentuk 1. RBA1 Putih Bundar Seperti
tetesan Licin Negatif Kokus 2. RCC1 Kuning Bundar Seperti
tetesan Licin Negatif Basil 3. RCC2 Putih Bundar Seperti
tetesan Licin Negatif Kokus 4. RCSC1 Kuning Bundar Seperti
tetesan Licin Negatif Kokus 5. RCSC2 Kuning Bundar Seperti
tetesan Licin Negatif Basil 6. JASC Putih Bundar Seperti
tetesan Licin Negatif Kokus 7. JCSC2 Putih Bundar Timbul Licin Negatif Basil 8. RCSA2 Putih Bundar Seperti
tetesan Licin Negatif Basil 9. JCC Putih Bundar Seperti
tetesan Licin Negatif Kokus
Pengujian Isolat pada Media Autotrof dan Heterotrof
7 Tabel 2 Perbandingan hasil pengukuran OD sel pada media nitrifikasi autotrof
dan heterotrof per hari
Uji Aktivitas Oksidasi Amonium
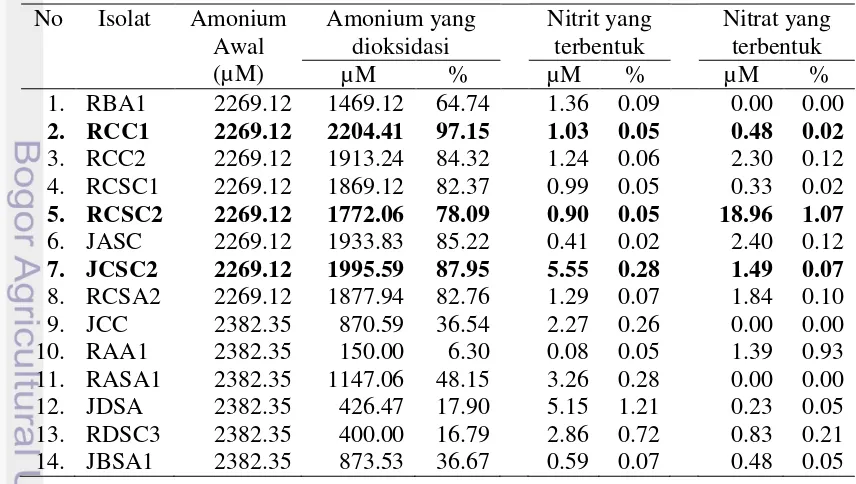
Kemampuan 14 isolat dalam mengoksidasi amonium diuji pada kondisi aerob dengan konsentrasi amonium sebesar + 2000 M. erdasarkan hasil ji aktivitas oksidasi amonium, terlihat bahwa semua isolat dapat mengoksidasi amonium, bahkan terdapat 6 isolat yang mempunyai aktivitas di atas 80%. Konsentrasi nitrit yang terakumulasi dari semua isolat relatif rendah, yaitu sekitar 0.02-1.21%. Sebelas isolat mempunyai aktivitas menghasilkan nitrat dengan persentase 0.02-1.07%. Isolat RCSC2 mempunyai akumulasi nitrat sebesar 1.07%. Tabel 3 Kemampuan isolat untuk mengoksidasi amonium dengan menghasilkan
8
Laju rata-rata dan Kinetika Oksidasi Amonium
Bedasarkan uji aktivitas oksidasi amonium, dipilih tiga isolat untuk laju rata-rata dan uji kinetika oksidasi amonium, yaitu isolat RCC1, RCSC2, dan JCSC2. Isolat RCC1 mempunyai aktivitas oksidasi amonium sangat baik sekitar 97% dengan konsentrasi nitrit yang terbentuk sekitar 0.05% dan nitrat sebesar 0.02%. Isolat JCSC2 mempunyai aktivitas oksidasi amonium sebesar 87.95%, nitrit yang terbentuk sebesar 0.28%, dan nitrat 0.07%. Isolat RCSC2 mempunyai aktivitas pembentukan nitrat sebesar 1.07% dengan amonium yang teroksidasi sebesar 78.09% dan nitrit 0.05% (Tabel 3).
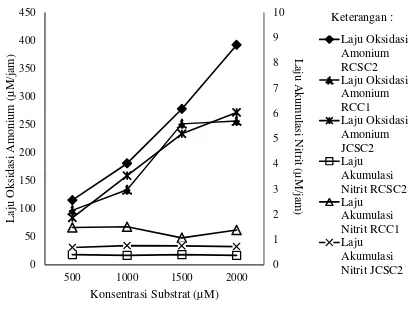
Laju rata-rata oksidasi amonium isolat RCSC2 lebih tinggi dibandingkan laju pada isolat JCSC2 dan RCC1. Laju rata-rata oksidasi amonium pada RCC1, RCSC2, dan JCSC2 mengalami kenaikan seiring dengan pertambahan substrat yang diberikan (Gambar 3).
Gambar 3 Laju oksidasi amonium dan akumulasi nitrit isolat RCSC2, RCC1 dan JCSC2
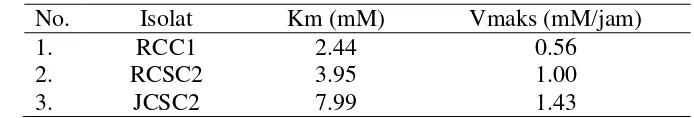
Uji kinetika oksidasi amonium dilakukan dengan konsentrasi amonium 0, 500, 1000, 1500, dan 2000 M. erdasarkan hasil ji kinetika oksidasi amonium, isolat JCSC2 memiliki nilai kecepatan maksimum (Vmaks) dan konstanta Michaelis-Menten (Km) lebih tinggi dibandingkan isolat RCC1 dan RCSC2. Nilai Km terendah dimiliki oleh isolat RCC1 (Tabel 4).
9 Tabel 4 Hasil uji kinetika nilai Km dan Vmaks
No. Isolat Km (mM) Vmaks (mM/jam)
1. RCC1 2.44 0.56
2. RCSC2 3.95 1.00
3. JCSC2 7.99 1.43
Pembahasan
Berdasarkan hasil peremajaan pada 14 isolat, semua bakteri dapat tumbuh secara aerobik pada media agar yang mengandung amonium sebagai sumber nitrogen dan karbonat sebagai sumber karbon. Menurut Moat dan Foster (1988), bakteri nitrifikasi hidup secara aerobik. Bakteri tersebut memerlukan oksigen sebagai penerima elektron terakhir di dalam rangkaian proses respirasi untuk pembentukan energi.
Isolat-isolat tersebut ditumbuhkan pada media agar dengan kondisi pH sekitar 6.00-7.00 dan suhu berkisar 28-31 oC. Hasil pengamatan menunjukkan bahwa bakteri dapat tumbuh setelah 3 hari masa inkubasi. Hal ini sesuai dengan pernyataan Holt et al. (1994) bahwa bakteri nitrifikasi umumnya dapat tumbuh optimal pada pH antara 6.5-8.5 dan suhu 5-30 oC.
Hasil pewarnaan Gram menunjukkan bahwa semua bakteri tersebut merupakan bakteri Gram negatif dan sebanyak 4 isolat berbentuk basil dan 10 isolat berbentuk kokus. Menurut Holt et al. (1994), bakteri nitrifikasi umumnya mempunyai ciri Gram negatif dan berbentuk kokus, basil, spiral, atau ellipsoid.
Isolat-isolat yang telah murni ditumbuhkan pada media nitrifikasi autotrof dengan sumber karbon berupa karbonat dan media nitrifikasi heterotrof dengan sumber karbon berupa glukosa. Berdasarkan pengamatan, pertumbuhan sel bakteri pada media nitrifikasi heterotrof menunjukkan pertumbuhan sel lebih tinggi dibandingkan dengan pertumbuhan sel pada media nitrifikasi autotrof (Tabel 2). William et al. (1998) menyatakan bahwa media karbonat merupakan media nitrifikasi autotrof yang membuat pertumbuhan bakteri lambat dan perbanyakan selnya rendah. Menurut Tresnawati (2006), media nitrifikasi heterotrof menghasilkan pertumbuhan sel yang lebih tinggi daripada pertumbuhan sel pada media nitrifikasi autotrof. Berdasarkan penelitiannya, pertumbuhan sel pada media heterotrof yang paling tinggi terjadi pada media glukosa sebagai sumber karbon dengan aktivitas mengoksidasi amonium cukup tinggi.
Perbedaan pertumbuhan sel pada kedua media diduga karena perbedaan senyawa yang digunakan untuk pembentukan energi, yaitu glukosa dan amonium. Menurut Widiyanto (2006), isolat pada media heterotrof memanfaatkan sumber karbon dari glukosa. Isolat tersebut mengoksidasi glukosa melalui siklus asam sitrat sehingga didapatkan 38 ATP per molekul glukosa. Sedangkan isolat pada media nitrifikasi autotrof memanfaatkan amonium sebagai sumber energi. Proses oksidasi amonium menghasilkan 2 ATP per molekulnya sehingga mendapatkan energi lebih sedikit daripada glukosa. Hal ini menyebabkan pertumbuhan isolat pada media heterotrof lebih tinggi dibandingkan pada media autotrof.
10
6.6-8.0 tetapi dapat terhambat pada pH di bawah 4.5, sedangkan suhu yang optimal berkisar 30-35 oC tetapi dapat berjalan lambat pada suhu di bawah 5 oC dan di atas 40 oC.
Nitrifikasi merupakan proses oksidasi amonium menjadi nitrit dengan perantara hidroksilamin dan oksidasi senyawa nitrit menjadi nitrat (Paul dan Clark 1989). Uji aktivitas oksidasi amonium pada 14 isolat menunjukkan bahwa semua isolat dapat mengoksidasi amonium, bahkan terdapat 6 isolat mempunyai kemampuan mengoksidasi amonium di atas 80% (Tabel 3). Aktivitas oksidasi amonium ini terlihat dari pengurangan konsentrasi amonium pada masing-masing isolat. Pengurangan konsentrasi amonium mengindikasikan bahwa isolat tersebut dapat memanfaatkan amonium sebagai sumber energi atau sumber nitrogen untuk pembentukan biomassa sel. Amonium yang teroksidasi membentuk nitrit, terlihat dari adanya konsentrasi nitrit pada setiap isolat. Hal ini mengindikasikan bahwa isolat tersebut mempunyai enzim amonia monooksigenase (AMO) dan hidroksilamin oksidase (HAO). Menurut Moir et al. (1996), amonium dioksidasi menjadi nitrit dengan perantara hidroksilamin dan enzim yang terlibat dalam aktivitas oksidasi tersebut adalah AMO dan HAO.
Berdasarkan hasil uji aktivitas isolat, konsentrasi nitrit pada semua isolat menunjukkan persentase yang rendah, yaitu berkisar 0.02-1.21% (Tabel 3). Hal ini dapat menjadi salah satu indikator adanya bakteri yang potensial sebagai agen bioremediasi. Menurut Widiyanto (2006), tidak terbentuknya senyawa nitrit merupakan salah satu dasar seleksi bakteri yang potensial sebagai agen bioremediasi karena senyawa nitrit bersifat toksik terhadap hewan budidaya. Sutka et al. (2006) mengemukakan bahwa terdapat aktivitas bakteri saat mengoksidasi amonium menjadi nitrit, yaitu produksi N2O dari oksidasi hidroksilamin (NH2OH) oleh bakteri nitrifikasi, Nitrosomonas europaea.
Sebelas isolat mempunyai aktivitas menghasilkan nitrat dengan persentase 0.02-1.07%. Isolat RCSC2 mempunyai persentase nitrat sebesar 1.07%. Isolat tersebut diduga mempunyai enzim nitrit oksidase. Menurut Steinmuller dan Bock (1977), aktivitas bakteri dalam mengoksidasi nitrit melibatkan enzim nitrit oksidase.
Laju rata-rata oksidasi amonium yang diujikan pada isolat RCC1, RCSC2, dan JCSC2 mempunyai pola kenaikan laju yang berbeda. Laju isolat RCSC2 dan JCSC2 dalam mengoksidasi amonium mengalami kenaikan seiring dengan penambahan substrat yang diberikan, yaitu dari konsentrasi amonium 0, 500, 1000, 1500, hingga 2000 µM. Sedangkan pada isolat RCC1 mengalami kenaikan laju rata-rata pada konsentrasi 1000-1500 µM dan memberikan reaksi yang berbeda pada konsentrasi 1500-2000 µM yaitu tidak mengalami kenaikan yang signifikan (Gambar 3). Perbedaan laju tersebut menunjukkan perbedaan kemampuan ketiga isolat dalam memanfaatkan amonium berdasarkan tingkat konsentrasi amonium yang diberikan.
11
SIMPULAN
Empat belas isolat bakteri nitrifikasi asal kolam ikan air tawar Riau dan Jambi yang dikarakterisasi bersifat Gram negatif dengan bentuk sel kokus dan basil. Enam isolat mampu melakukan aktivitas oksidasi amonium di atas 80%. Tiga isolat yang diuji kinetika oksidasi amonium, yaitu RCC1, RSCS2, dan JCSC2 mempunyai nilai konstanta Michaelis-Menten (Km) sebesar 2.44, 3.95, dan 7.99 mM. Isolat RCC1 yang mempunyai nilai Km terkecil menunjukkan bahwa isolat RCC1 mempunyai enzim dengan afinitas tinggi terhadap substratnya.
DAFTAR PUSTAKA
[BBPBAT] Balai Besar Perikanan Budidaya Air Tawar. 2014. Baku Mutu Kualitas Air Budidaya. BBPBAT [internet]. [diunduh 2014 Sep 1]. Tersedia pada: http://www.bbpbat.net/index.php/artikel/60-baku-mutu-kualitas-air-budidaya.
[BPS] Badan Pusat Statistik. 2013. Jambi dalam angka. BPS [internet]. [diunduh 2013 Des 17]. Tersedia pada: http://jambi.bps.go.id/pub/fb/2013/jda2012/ files/assets/basichtml/page353.html.
Eaton AD, Clesceri LS, Greenberg AE, Rice EW. 2005. Standard Method of Examination of Water and Wastewater. Ed ke-21. Washington DC (US): APHA-AWWA-WPCF.
[EPA] US Enviromental Protection Agency. 2002. Nitrification. USEPA [internet]. [diunduh 2013 Des 12]. Tersedia pada: http://water.epa.gov/ lawsregs/ rulesregs/ sdwa/tcr/upload/ nitrification.pdf.
Erlania, Rusmaedi, Prasetio AB, Haryadi J. 2010. Dampak manajemen pakan dari kegiatan budidaya ikan nila (Oreochromis niloticus) di keramba jaring apung terhadap kualitas keramba jaring apung terhadap kualitas perairan Danau Maninjau. Prosiding Forum Inovasi Teknologi Akuakultur. Jakarta (ID): Pusat Riset Perikanan Budidaya. hlm 621-631.
Hadioetomo RS. 1983. Mikrobiologi Dasar dalam Praktek. Jakarta (ID): PT Gramedia Pustaka Utama.
Holt JG, Krieg NR, Smeath PHA. Stanley JT. Williams ST. 1994. Bergey’s Manual of Determinative Bacteriology. Ed ke-9. Baltimore (US): Williams and Wilkins Company.
[KKP] Kementerian Kelautan dan Perikanan. 2009. Kelautan dan Perikanan dalam Angka 2009. Jakarta (ID): Pusat Data, Statistik dan Informasi. Moat AG, Foster JW. 1988. Microbial Physiology. Ed ke-2. New York (US): John
Wiley & Sons, Inc.
Moir JWB, Crossman LC, Spiro S, Richardson DJ. 1996. The purification of ammonia monooxygenase of Paracoccus denitrificans. FEBS Letters 387: 71-74.
12
Paul EA, Clark FE. 1989. Soil Microbiology and Biochemistry. London (UK): Academic Press.
Putra GPG. 2009. Penentuan kinetika enzim poligalakturonase (PG) endogenous dari pup biji kakao. J Biol 8(1): 21-24.
Rachmansyah. 2004. Analisis daya dukung lingkungan Perairan Teluk Awarange Kabupaten Barru, Sulawesi Selatan bagi pengembangan budidaya bandeng dalam keramba jaring apung [disertasi]. Bogor (ID): Institut Pertanian Bogor.
Rand MC, Greenberg AE, Taras MJ. 1979. Standard Method of Examination of Water and Wastewater. Ed ke-14. Washington DC (US): APHA-AWWA-WPCF.
Rohmana D. 2009. Konversi limbah budidaya ikan lele, Clarias sp. menjadi biomassa bakteri heterotrof untuk perbaikan kualitas air dan makanan udang galah, Macrobrachium rosenbergii. [tesis]. Bogor (ID): Institut Pertanian Bogor.
Steinmuller W, Bock E. 1977. Enzymatic studies on autotrophically, mixotrophically, and heterotrophically grown Nitrobacter agilis with special reference to nitrite oxidase. Arch Microbiol 115: 51-54.
Sutka RL, Ostrom NE, Ostrom PH, Breznak JA, Gandhi H, Pitt AJ, Li F. 2006. Distinguishing nitrous oxide production from nitrification and denitrification on the basis of isotopomer abundances. J Appl and Envir Microbiol 72(1): 638–644.
Tresnawati T. 2006. Aktivitas bakteri pengoksidasi amonium isolat ASR1 dan ASR2 asal tambak udang pada sumber karbon dan salinitas yang berbeda [skripsi]. Bogor (ID): Institut Pertanian Bogor.
White D. 2000. The Physiology and Biochemistry of Procaryotes. Ed ke-2. New York (US): Oxford University Press.
Widiyanto T. 2006. Seleksi bakteri nitrifikasi dan denitrifikasi untuk bioremediasi di tambak udang [disertasi]. Bogor (ID): Institut Pertanian Bogor.
13 Lampiran 1 Kurva standar amonium
Lampiran 2 Kurva standar nitrit
Lampiran 3 Kurva standar nitrat
14
Lampiran 4 Komposisi media nitrifikasi
Komposisi media nitrifikasi (g/L) (Rodina 1972 dalam Novita 2006) 13.5 KH2PO4
15
RIWAYAT HIDUP
Penulis dilahirkan di Depok pada tanggal 16 September 1992 sebagai anak pertama dari tiga bersaudara, Siti Hardianti dan Oktavia Rahmawati, dengan ayah bernama Atmaja dan ibu bernama Asenih.
Pada tahun 2010, penulis lulus dari SMA Negeri 3 Depok dan pada tahun yang sama diterima di Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB (USMI).
Selama mengikuti perkuliahan di IPB, penulis aktif pada berbagai organisasi mahasiswa. Penulis pernah menjadi pengurus BEM KM Institut Pertanian Bogor pada tahun 2010/ 2011 dan melanjutkan kembali pada tahun 2011/2012 di dalam Kementerian Sosial dan Kesejahteraan Masyarakat dengan menjadi Ketua Program Rumah Harapan. Penulis pernah juga menjadi pengurus HIMABIO divisi Pengembangan Sumber Daya Mahasiswa pada tahun 2012/2013. Penulis juga aktif dalam beberapa kepanitian di kampus dan di organisasi. Penulis mendapatkan beasiswa PPA (Peningkatan Prestasi Akademik) dari semester tiga hingga semester delapan.