SINTESA N,N (DI-2-MONO ETIL MALEAT) PALMITAMIDA
HASIL ESTERIFIKASI N,N (DI-2-ETANOL)PALMITAMIDA
DENGAN ANHIDRIDA MALEAT
SKRIPSI
SHEYLA SENARI BARUS
090802042
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
SINTESA N,N (DI-2-MONO ETIL MALEAT) PALMITAMIDA HASIL ESTERIFIKASI N,N (DI-2-ETANOL) PALMITAMIDA
DENGAN ANHIDRIDA MALEAT
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
SHEYLA SENARI BARUS 090802042
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : SINTESA N,N (DI-2-MONO ETIL MALEAT) PALMITAMIDA HASIL ESTERIFIKASI N,N (DI-2-ETANOL) PALMITAMIDA DENGAN ANHIDRIDA MALEAT
Kategori : SKRIPSI
Nama : SHEYLA SENARI BARUS
NIM : 090802042
Program Studi : SARJANA (S1) KIMIA Departemen : KIMIA
Fakultas : MATEMATIKA DAN ILMU PENGETAHUAN ALAM ( FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di, Medan, Februari 2014
KomisiPembimbing :
DosenPembimbing 2, DosenPembimbing 1,
Dr.Mimpin Ginting, MS Dra.Herlince Sihotang, M.Si NIP. 195510131986011001 NIP.195503251986012002
DisetujuiOleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
SINTESA N,N (DI-2-MONO ETIL MALEAT) PALMITAMIDA HASIL ESTERIFIKASI N,N (DI-2-ETANOL) PALMITAMIDA
DENGAN ANHIDRIDA MALEAT
SKRIPSI
Saya mengakui bahwa skripsi ini adalah hasil karya sendiri. Kecuali beberapa kutipan dan ringkasan yang masing – masing disebutkan sumbernya.
Medan, Februari 2014
PENGHARGAAN
Segala puji dan syukur peneliti ucapkan kepada Tuhan Yesus Kristus atas kasihNya sehingga peneliti dapat menyelesaikan penelitian dan penyusunan skripsi ini sesuai. Dalam pelaksaan penelitian hingga penyelesaian skripsi ini, peneliti menyadari banyak mendapat motivasi dan dukungan dari berbagai pihak. Untuk itu pada kesempatan ini peneliti mengucapkan terimakasih kepada :
• Ibu Dra.Herlince Sihotang,M.Si sebagai pembimbing I dan Bapak Dr.Mimpin Ginting,MS sebagai pembimbing II yang dengan sabar telah memberikan dorongan, bimbingan dan saran sehingga skripsi ini dapat diselesaikan.
• Ibu DR.Rumondang Bulan,M.S dan Bapak Drs.Albert pasaribu,M.sc sebagai Ketua dan Sekretaris Departemen Kimia FMIPA USU.
• Bapak Prof.Dr.Jamaran Kaban,M.sc selaku ketua bidang Kimia Organik FMIPA USU.
• Kepala Laboratorium Kimia Organik FMIPA USU Medan Bapak Dr.Mimpin Ginting,MS beserta Dosen dan Staff Laboratorium Kimia Organik FMIPA USU.
• Seluruh Dosen Departemen Kimia FMIPA USU yang telah memberikan waktunya untuk memberi bimbingan selama penulis mengikuti kuliah di Departemen Kimia FMIPA USU, terkhusus kepada Bapak Drs.Amir Hamzah Siregar,M.Si sebagai dosen wali yang telah memberikan waktunya untuk memberikan pengarahan dalam menyelesaikan studi selama perkuliahan dan penelitian berlangsung.
• Seluruh Asisten Laboratorium Kimia Organik FMIPA USU (Egitarius, Naomi, Despita, Rimenda, kak Sion, bang Bayu dan lainnya).
• Keluarga ABLE (Sudirman, Emilia, Malem, Iwan, Nora, Melda, Sabam, Royman).
• Teman-teman stambuk 2009 ( Mawar, Septian, Desta dan yang lainnya) • Kakak (D. br Barus dan D.Ginting) dan keponakan penulis ( Irene, Ilfi,
dan Gavriel)
SINTESA N,N (DI-2-MONO ETIL MALEAT) PALMITAMIDA HASIL ESTERIFIKASI N,N (DI-2-ETANOL) PALMITAMIDA
DENGAN ANHIDRIDA MALEAT
ABSTRAK
SYNTHESIS N,N (DI-2-MONO ETHYL MALEATE) PALMYTAMIDE FROM ESTERIFICATION OF N,N (DI-2-ETHANOL)
PALMYTAMIDE WITH MALEIC ANHYDRIDE
ABSTRACT
Has been synthized N,N (di-2-mono ethyl maleate) palmytamide from esterification of N,N (di-2-ethanol) palmytamide with maleic anhydride used HCl catalyst at temperature 140-1500 C present product as 2,8 grams (74,20%), where N,N (di-2-ethanol) palmytamide obtained from amidation of methyl palmitic with diethanolamine use NaOCH3 catalyst at temperature 110-1200 C. Compound N,N
DAFTAR ISI
Halaman
Persetujuan ii
Pernyataan iii
Penghargaan iv
Abstrak v
Abstract vi
Daftar Isi vii
Daftar Tabel x
Daftar Gambar xi
Daftar Lampiran xii
BAB 1. Pendahuluan
1.1. Latar Belakang 1
1.2. Permasalahan 3
1.3. Pembatasan Masalah 3
1.4. Tujuan Penelitian 4
1.5. Manfaat Penelitian 4
1.6. Lokasi Penelitian 4
1.7. Metode Penelitian 5
BAB 2. Tinjauan Pustaka
2.1. Oleokimia 6
2.2. Lemak 7
2.2.1. Asam Lemak 8
2.2.2. Asam Palmitat 10
2.3. Ester 11
2.4.1. Reaksi Amidasi 14
2.4.2. Dietanolamina 16
2.4.3. Alkanolamida 16
2.4.4. Dietanolamida 17
2.5. Anhidrida Asam 17
2.5.1. Anhidrida Maleat 19
2.6. Reaksi Esterifikasi 20
2.7. Surfaktan 22
BAB 3. Metode Penelitian
3.1. Alat dan Bahan 25
3.1.1. Alat-alat 25
3.1.2. Bahan-bahan 26
3.2. Prosedur Penelitian 27
3.2.1. Esterifikasi Asam Palmitat dengan Metanol 27 3.2.2. Amidasi Metil Palmitat dengan Dietanolamina 27 3.2.3. Esterifikasi Alkanolamida dengan Anhidrida Maleat 28
3.2.4. Analisa Hasil Reaksi 29
3.2.4.1. Analisa dengan Spektrofotometer FT-IR 29 3.2.4.2. Penentuan Titik Lebur 29
a. Metil palmitat 29
b. Alkanolamida dan N,N (di-2-Mono Etil Maleat) 29 palmitamida
3.2.4.3. Penentuan Nilai Hydrophylic Lypophylic 29 Balance (HLB)
a. Penentuan Bilangan Penyabunan 30 b. Penentuan Bilangan Asam 30 3.2.4.4. Analisa dengan Spektrofotometer 1H-NMR 31
3.3. Bagan Penelitian 32
3.3.4. Penentuan Nilai Hydrophylic Lypophylic Balance (HLB) 35 3.3.4.1. Penentuan Bilangan Penyabunan 35 3.3.4.2. Penentuan Bilangan Asam 35
BAB 4. Hasil dan Pembahasan
4.1. Hasil Penelitian 36
4.1.1. Esterifikasi Asam Palmitat dengan Metanol 36 4.1.2. Amidasi Metil Palmitat dengan Dietanolamina 37 4.1.3. Esterifikasi Alkanolamida dengan Anhidrida Maleat 38
4.1.4. Penentuan Titik Lebur 40
4.1.5. Penentuan Nilai Hydrophylic Lypophylic Balance (HLB) 40
4.2. Pembahasan 41
4.1.1. Esterifikasi Asam Palmitat dengan Metanol 41 4.1.2. Amidasi Metil Palmitat dengan Dietanolamina 42 4.1.3. Esterifikasi Alkanolamida dengan Anhidrida Maleat 44
4.1.4. Penentuan Titik Lebur 46
4.1.5. Penentuan Nilai Hydrophylic Lypophylic Balance (HLB 47
BAB 5. Kesimpulan dan Saran
5.1. Kesimpulan 48
5.2. Saran 48
DAFTAR TABEL
Nomor Judul Halaman
Tabel
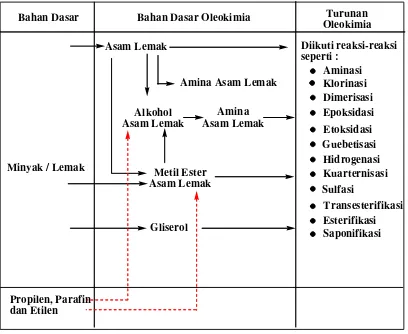
2.1. Diagram Alur Proses Oleokimia dari Bahan Dasar Minyak 7 Atau Lemak menjadi Oleokimia dan Turunan Oleokimia
2.2. Asam Lemak Jenuh yang Terdapat dalam Lemak dan 9 Minyak
2.3. Asam Lemak Tidak Jenuh yang Terdapat dalam Lemak dan 10 Minyak
4.1. Data Kromatografi Lapis Tipis 38
4.2. Data Titik Lebur 40
4.3. Data Penentuan Bilangan Penyabunan 40
DAFTAR GAMBAR
Nomor Judul Halaman
Gambar
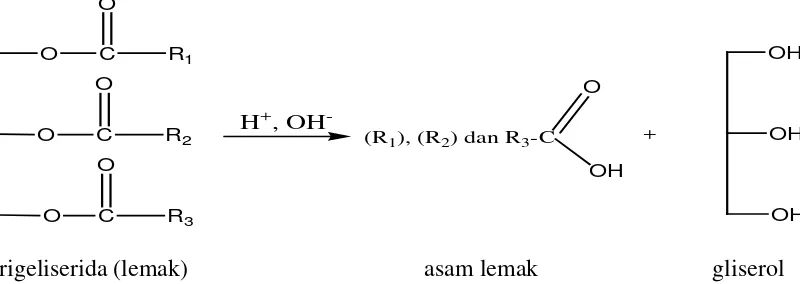
2.1. Hasil Hidrolisa Trigliserida menjadi Asam Lemak dan 8 Gliserol
2.2. Rumus Umum Asam lemak 8
2.3. Rumus Umum Ester 11
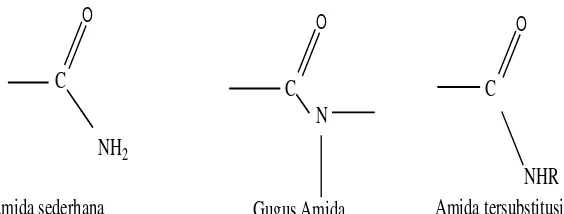
2.4. Bentuk-Bentuk Amida 13
2.5. Contoh Amida siklik 13
2.6. Anhidirda Asam 18
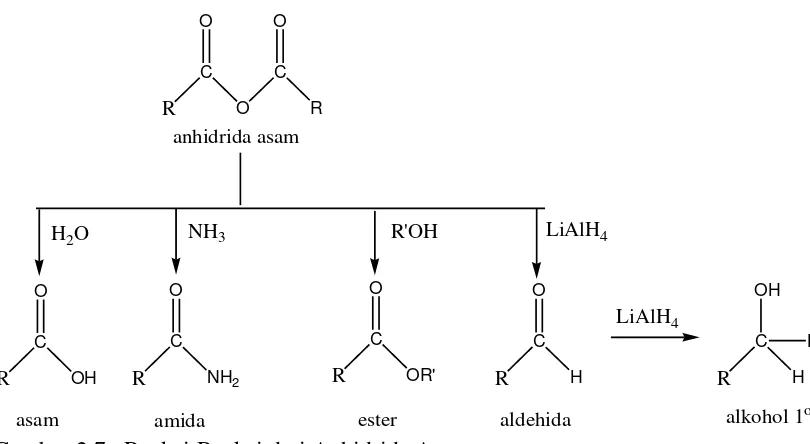
2.7. Reaksi-Reaksi dari Anhidrida Asam 19
2.8. Anhidrida Maleat 19
2.9. Lambang Umum Surfaktan 23
2.10. Skala Rentang Nilai HLB untuk Beberapa Zat Aktif 24 Permukaan
4.1. Spektrum FT-IR Metil Palmitat 36
4.2. Spektrum FT-IR Alkanolamida 37
4.3. Spektrum FT-IR N,N (Di-2-Mono Etil Maleat) Palmitamida 39 4.4. Spektrum 1H-NMR N,N (Di-2-Mono Etil Maleat) 39
Palmitamida
4.5. Mekanisme Reaksi Esterifikasi Asam Palmitat dengan Metanol 42 4.6. Mekanisme Reaksi Amidasi Metil palmitat dengan 44
Dietanolamina
DAFTAR LAMPIRAN
Nomor Judul Halaman
lampiran
1. Gambar Metil Ester Asam Palmitat 52
2. Gambar N,N (Di-2-Etanol) Palmitamida 52 3. Gambar N,N (Di-2-Mono Etil Maleat) Palmitamida 52
Sebelum Pemurnian dengan Kromatografi Kolom
SINTESA N,N (DI-2-MONO ETIL MALEAT) PALMITAMIDA HASIL ESTERIFIKASI N,N (DI-2-ETANOL) PALMITAMIDA
DENGAN ANHIDRIDA MALEAT
ABSTRAK
SYNTHESIS N,N (DI-2-MONO ETHYL MALEATE) PALMYTAMIDE FROM ESTERIFICATION OF N,N (DI-2-ETHANOL)
PALMYTAMIDE WITH MALEIC ANHYDRIDE
ABSTRACT
Has been synthized N,N (di-2-mono ethyl maleate) palmytamide from esterification of N,N (di-2-ethanol) palmytamide with maleic anhydride used HCl catalyst at temperature 140-1500 C present product as 2,8 grams (74,20%), where N,N (di-2-ethanol) palmytamide obtained from amidation of methyl palmitic with diethanolamine use NaOCH3 catalyst at temperature 110-1200 C. Compound N,N
BAB 1
PENDAHULUAN
1.1. Latar Belakang
Asam palmitat merupakan asam lemak jenuh yang paling besar jumlahnya di dalam minyak kelapa sawit, yaitu sebesar 40-46%. Asam palmitat juga terdapat pada berbagai minyak yang bersumber dari bahan nabati lainnya. Pada minyak wijen sebesar 9,1%, minyak jagung 8,1%, minyak kedelai 7-10%, minyak kacang tanah 6,3%, minyak jambu mente 4,1-17,3%, minyak tengkawang 18%, minyak biji kapas 23,4%, dan minyak kelapa 7,5-10,5% (Ketaren, 2008).
Turunan asam palmitat telah banyak dihasilkan. Salah satunya adalah metil ester asam lemak. Metil ester asam lemak merupakan hasil transesterifikasi dari suatu minyak dengan metanol (Noureddini and Medikonduru,1997). Metil ester asam lemak selain digunakan sebagai pengganti solar, juga digunakan dalam pembuatan kosmetik, detergen, aditif pada tekstil dan kertas (Kimmel, 2004).
Alkanolamida merupakan surfaktan nonionik yang secara luas digunakan sebagai agen pengemulsi yang stabil. Senyawa ini juga digunakan dalam industri farmasi, kosmetik, kebutuhan rumah tangga seperti sampho dan deterjen, serta sebagai agen pengontrol busa, aditif bahan bakar, corrosion inhibitors (Rosen, 2004).
Sejak lama telah diketahui bahwa maleanized drying oil menghasilkan pelapis yang larut dalam air. Pada tahun 1971, Balakrishna dan Sivasamban telah mereaksikan minyak jarak kering atau minyak biji rami dan minyak safflower yang telah diisomerisasi dengan anhidrida maleat menghasilkan film alkyd resin yang memiliki sifat kekerasan dan fleksibilitas yang baik serta tahan air (Balakrishna and Sivasamban, 1971).
Telah dilakukan sintesa senyawa alkanolamida turunan albizia benth oil dengan anhidrida maleat yang bermanfaat dalam material polimer sehingga memberikan dorongan untuk melakukan penelitian dari bahan yang tersedia, dapat diperbaharui, harga murah dan alami. Pada sintesa tersebut, gugus OH pada senyawa alkanolamida turunan albizia benth oil digantikan dengan gugus maleat, menghasilkan senyawa maleanised albizia benth oil polyesteramide (MA-ABOPEA). Kehadiran gugus maleat dalam senyawa tersebut meningkatkan berat molekul dan sifat ketidakjenuhan sehingga lebih mudah untuk membentuk suatu film . Gugus maleat juga dapat meningkatkan sifat tahan benturan, fleksibilitas, dan kekerasan goresan. Umumnya, anhidrida maleat dikenal untuk memperkuat adhesi, yaitu gaya tarik menarik antara molekul yang tidak sejenis (Akintayo et al,2012).
1.2. Permasalahan
1. Apakah senyawa N,N (di-2-mono etil maleat) palmitamida dapat disintesa melalui reaksi esterifikasi antara senyawa N,N ( di-2-etanol ) palmitamida dengan anhidrida maleat dengan menggunakan pelarut xylena-aseton pada suhu 145oC.
2. Berapakah nilai Hydrophilic Lipophilic Balance ( HLB ) dari senyawa N,N (di-2-etanol) palmitamida dan N,N (di-2-mono etil maleat) palmitamida yang dihasilkan melalui metode titrasi.
1.3. Pembatasan Masalah
1. Pembuatan metil palmitat yang diperoleh dari hasil reaksi esterifikasi antara asam palmitat dengan metanol menggunakan katalis H2SO4(p).
2. Pembuatan senyawa N,N ( di-2-etanol ) palmitamida yang diperoleh dari hasil reaksi amidasi antara metil palmitat dengan dietanolamina menggunakan katalis NaOCH3.
3. Pembuatan senyawa N,N (di-2-mono etil maleat) palmitamida yang diperoleh dari hasil reaksi esterifikasi antara senyawa N,N ( di-2-etanol ) palmitamida dengan anhidrida maleat.
1.4. Tujuan Penelitian
1. Untuk menghasilkan senyawa N,N (di-2-mono etil maleat) palmitamida melalui reaksi esterifikasi antara senyawa N,N ( di-2-etanol ) palmitamida dengan anhidrida maleat dengan menggunakan pelarut xylena-aseton pada suhu 145oC.
2. Untuk mengetahui nilai Hydrophilic Lipophilic Balance ( HLB ) dari senyawa N,N (di-2-etanol) palmitamida dan N,N (di-2-mono etil maleat) palmitamida yang dihasilkan melalui metode titrasi.
1.5. Manfaat Penelitian
Diharapkan hasil penelitian ini dapat memberikan informasi tentang perkembangan sintesa organik dalam bidang oleokimia, dimana senyawa alkanolamida turunan asam palmitat yang diesterifikasi dengan anhidrida maleat, diharapkan dapat dimanfaatkan sebagai bahan pelapis pada bidang industri.
1.6. Lokasi Penelitian
1.7. Metodologi Penelitian
Penelitian ini dilakukan melalui ekperimen laboratorium, dimana semua zat-zat kimia yang digunakan merupakan p.a E’merck. Asam palmitat diesterifikasi dengan metanol menggunakan katalis H2SO4(p) dalam kondisi refluks
menghasilkan metil palmitat. Selanjutnya metil palmitat diamidasi dengan dietanolamina pada suhu 110-120oC menggunakan katalis NaOCH3 yang
BAB 2
TINJAUAN PUSTAKA
2.1. Oleokimia
Oleokimia merupakan bahan kimia yang berasal dari minyak/lemak alami, baik tumbuhan maupun hewani. Bidang keahlian teknologi oleokimia merupakan salah satu bidang keahlian yang mempunyai prospek yang baik dan penting dalam teknik kimia. Pada saat ini dan pada waktu yang akan datang, produk oleokimia diperkirakan akan semakin banyak berperan menggantikan produk-produk turunan minyak bumi (petrokimia). Pada saat ini, permintaan akan produk oleokimia semakin meningkat. Hal ini dapat dimaklumi karena produk oleokimia mempunyai beberapa keunggulan dibandingkan produk petrokimia, seperti harga, sumber yang dapat diperbaharui dan produk yang ramah lingkungan (Spitz, 2004).
Tabel 2.1. Diagram Alur Proses Oleokimia dari Bahan Dasar Minyak atau Lemak menjadi Oleokimia dan Turunan Oleokimia
Bahan Dasar Bahan Dasar Oleokimia Turunan
Oleokimia
Minyak / Lemak
Asam Lemak Diikuti reaksi-reaksi
seperti :
Sumber : Richtler and Knaut, 1984 : Alami
: Sintesis
Gliserol
2.2. Lemak
R3-COOH ialah molekul asam lemak yang terikat pada gliserol. Ketiga molekul
asam lemak tersebut boleh sama dan boleh berbeda (Poedjiadi, 2006).
Perbedaan antara suatu lemak dan minyak bersifat sembarang: pada temperatur kamar lemak berwujud padat dan minyak berwujud cair. Sebagian besar gliserida pada hewan adalah berupa lemak, sedangkan gliserida dalam tumbuhan cenderung berupa minyak. Karena itu biasa terdengar ungkapan lemak hewani dan minyak nabati. (Fessenden dan Fessenden, 1992).
2.2.1. Asam Lemak
Asam lemak merupakan asam karboksilat yang diperoleh dari hidrolisis suatu minyak ataupun lemak, umumnya mempunyai rantai hidrokarbon panjang dan tak bercabang (Fessenden dan Fessenden, 1992).
O
trigeliserida (lemak) asam lemak gliserol Gambar 2.1.Hasil Hidrolisis Trigliserida menjadi Asam Lemak dan Gliserol (Bahl, 2004)
Asam lemak adalah asam organik yang terdapat sebagai ester trigliserida atau lemak dimana rumus umum dari asam lemak adalah sebagai berikut:
R
CO
OH
Gambar 2.2. Rumus Umum Asam Lemak
karbon yang tidak mengandung ikatan rangkap, sedangkan yang mengandung ikatan rangkap disebut rantai karbon tidak jenuh. Pada umumnya asam lemak memiliki jumlah atom karbon yang genap (Poedjiadi, 2006).
Tabel 2.2. Asam Lemak Jenuh yang Terdapat dalam Lemak dan Minyak
Asam lemak jenuh Rumus kimia Sumber (Asal)
Titik cair (oC)
n- Butirat CH3(CH2)2COOH lemak susu sapi, mentega -7,6
n-Kaproat CH3(CH2)4COOH mentega, minyak kelapa, minyak kelapa sawit
-1,5
n-Kaprilat CH3(CH2)6COOH Domba 1,6
Kaprat CH3(CH2)8COOH susu sapi dan kambing, minyak kelapa, minyak kelapa sawit
31,5
Laurat CH3(CH2)10COOH susu, minyak inti sawit, spermaseti, minyak laural, minyak kelapa
44
Miristat CH3(CH2)12COOH minyak pala, susu ternak, dan lemak nabati; minyak babi dan minyak ikan hiu
58
Palmitat CH3(CH3)14COOH sebagian besar terdapat dalam lemak hewani dan minyak nabati
64
Stearat CH3(CH3)16COOH Domba 69,4
Asam lemak tak jenuh
Rumus kimia Sumber
(asal)
2.2.2. Asam palmitat
Asam palmitat adalah asam lemak jenuh yang terdiri dari 16 atom karbon dengan rumus C15H31COOH (Poedjiadi dan Supriyanti, 2006). Merupakan komposisi
asam lemak yang paling besar pada minyak kelapa sawit (40-60%). Asam palmitat disebut juga asam heksadekanoat, asam heksadecylik, ataupun asam cetylic yang dapat diperoleh dari minyak kelapa sawit, lilin Jepang dan minyak sayuran China.
• Berat molekul : 256,42 • Wujud : Kristal putih • Densitas : 0,853 • Titik lebur : 63-64oC • Titik didih : 215oC
Asam palmitat tidak larut dalam air tetapi larut dalam alkohol dingin ataupun petroleum eter dan larut cepat dalam dalam alkohol panas, eter, propil alkohol, dan kloroform (Anonimous, 1967).
2.3. Ester
Ester adalah turunan asam karboksilat yang gugus OH dari karboksilnya diganti gugus OR dari alkohol ester mengandung gugus karbonil dan satu ikatan eter dengan karbon karbonil.
Rumus Umum
R C
O
O R Gambar 2.3. Rumus Umum Ester (Wilbraham dan Matta, 1992)
Ester dapat diperoleh dari asam organik yang di reaksikan dengan alkohol. Pembentukan air pada reaksi esterifikasi, selalu OH nya berasal dari asam, sebab reaksi senyawa organik bersifat molekular, meskipun asam karboksilat terionisasi sedikit, tetapi alkohol tidak terionisasi.
• Berupa larutan bila massa rumusnya tidak terlalu besar
• Larutan yang netral, tidak berwarna, lebih mengkilat dibandingkan air dan berbau harum
• Senyawa yang massa rumusnya rendah dapat larut dalam air tapi sangat sedikit, lebih banyak larut dalam alkohol dan eter
• Titik didih relatif rendah, dibandingkan titik didih asam atau alkohol yang menyusunnya (Besari dkk, 1982).
Senyawa ester dapat dibentuk dengan cara :
1. Esterifikasi yaitu reaksi antara asam karboksilat dengan alkohol menghasilkan ester dengan hasil samping air.
R C
2. Interesterifikasi yaitu reaksi antara ester yang satu dengan ester yang lain menghasilkan ester yang baru.
R C
3. Alkoholisis yaitu reaksi antara ester dengan alkohol menghasilkan suatu ester baru.
4. Asidolisis yaitu reaksi pembentukan suatu ester baru antara asam karboksilat dengan ester yang lain .
R C
2.4. Amida
Amida adalah turunan amonia atau amina dari asam organik, senyawanya mungkin sederhana, bersubstituen satu atau dua. Amida dinamai dengan membuang akhiran –at ataupun –oat dari asam induknya, di ganti dengan amida. Salah satu metode pembuatan amida adalah reaksi amonia atau amina dengan turunan asam karboksilat. Ester, terutama metil ester adalah turunan asam karboksilat yang paling sering di gunakan (Wilbraham dan Matta,1992 ).
Bentuk sederhana dari amida adalah sebagai berikut:
Amida sederhana
Gambar 2.4. Bentuk-Bentuk Amida (Fessenden dan Fessenden, 1992)
Amida siklik mempunyai nama khusus, yaitu diberi akhiran –laktam sebagai pengganti dari gugus lakton yang di dalam cincinnya mengandung atom nitrogen.
β−butirolaktam ε−kaprolaktam
Gambar 2.5. Contoh Amida Siklik (Riswiyanto, 2009).
Amida disintesis dari derivat asam karboksilat dan amonia atau amina yang sesuai. Reaksi pembuatan amida secara umum dapat digambarkan sebagai berikut:
C
(Fessenden dan Fessenden,1992)
Reaksi antara monoetanolamin dengan metil ester asam lemak untuk membentuk alkanolamida telah banyak dikembangkan untuk pembuatan steramida (amida asam lemak) yang banyak digunakan dalam kosmetik dan sabun kecantikan (Urata and Takaishi, 1998).
Apabila senyawa amina direaksikan dengan ester, reaksi akan terjadi pada suhu tinggi, tetapi sangat lambat sekali apabila dilakukan pada suhu rendah dan tanpa bantuan katalis basa Lewis seperti NaOCH3yang lebih kuat dari trietilamin.
Reaksi amidasi antara amina dan ester dengan bantuan katalis NaOCH
3 dapat
berlangsung pada suhu 100o-120oC, sedangkan apabila tidak menggunakan katalis maka reaksi dapat berlangsung pada suhu 150o-250o C (Gabriel, 1984).
HOH
2. Dalam perdagangan didapat dari garam amoniumnya dipanaskan pada temperatur 100 -200 oC
amonium asetat asetamida air
3. Dengan mereaksikan anhidrida asam dengan amoniak
H NH2
anhidrida asetat amoniak asetamida asam asetat
4. Dengan menghidrolisa senyawa nitril, yakni pada reaksi sebelum terbentuknya asam karboksilat, terbentuk dahulu amida sebagai salah satu hasil antara.
+ H2O
Asetamida air asam asetat amoniak
(Besari dkk, 1982)
Dietanolamina dinamakan juga dengan 2,2 iminobisetanol; 2,2 iminodietanol; dietilolamina; bis (hidroksietil) amina; 2,2 dihidroksidietilamina. Rumus molekul C4H11NO2 dengan berat molekul 105,14. Dihasilkan bersama-sama dengan mono
dan trietanolamine dengan cara ammonolisis dari etilen oksida. Dietanolamina dapat digunakan sebagai emulsifier, dalam pembuatan surfaktan, agen pendispersi, dalam bidang kosmetik dan juga dalam bidang farmasi. Dietanolamine melebur pada suhu 28oC, biasanya terdapat sebagai suatu cairan viskos yang berbau amonia ringan (Anonimous, 1967).
2.4.3. Alkanolamida
Alkanolamida merupakan salah satu senyawa yang dapat diturunkan dari asam lemak dan merupakan produk reaksi kondensasi alkanolamina primer atau sekunder dengan asam lemak, metil ester, atau trigliserida (Gervajio, 2005).
Alkanolamida adalah surfaktan bukan ionik dimana gugus hidroksil yang dimilikinya tidak cukup hidrofilik untuk membuat alkanolamida larut dalam air dengan sendirinya. Alkanolamida digunakan sebagai bahan pembusa (foom boosting) dalam pembuatan shampoo.
Jenis alkanolamida yang paling penting adalah dietanolamida. Senyawa N-etanol alkil amida adalah senyawa yang termasuk dalam golongan asam lemak yang dapat dimanfaatkan sebagai surfaktan dalam produk detergen, kosmetik dan tekstil. Senyawa ini dapat dibuat dengan mereaksikan asam lemak sawit destilat dengan senyawa yang mengandung gugus atom Nitrogen seperti alkanolamina (Nuyanto, dkk, 2002). Sifat kimia dari suatu senyawa alkanolamida sangat bervariasi, tergantung dari panjang cincin hidrokarbon dan sifat substituen pada atom nitrogen (Bilyk et al, 1992).
Dietanolamida pertama kali diperoleh dengan mereaksikan dua mol dietanolamina dengan satu mol asam lemak. Senyawa ini diberi nama kritchevsky sesuai dengan nama penemunya. Bahan baku yang digunakan dalam produksi dietanolamida dapat berupa asam lemak, trigliserida atau metil ester. Dietanolamida biasanya diproduksi secara kimia konvensional pada temperature 150oC selama 6-12 jam (Herawan, 1999).
Dietanolamida merupakan senyawa amida yang tergolong pada kelompok alkanolamida. Dietanolamida termasuk dalam kelompok surfaktan nonionik (Stauffer, 1996).
Berikut merupakan reaksi pembuatan dietanolamida:
+
trigliserida dietanolamina dietanolamida gliserol (Hugles and Lew, 1970).
2.5. Anhidrida Asam
Anhidrida asam berasal dari dua asam karboksilat yang melepaskan satu molekul air. Anhidrida berarti tanpa air. Anhidrida dinamai dengan menambahkan kata anhidrida di depan nama asamnya. Anhidrida dari asam monokarboksilat berwujud cair, sedangkan asam dikarboksilat dan asam karboksilat aromatik berwujud padat (Wilbraham dan Matta, 1992).
CH3COCCH3
Gambar 2.6. Anhidrida Asam
IUPAC : anhidrida asam etanoat
Trivial : anhidrida asam asetat (Fessenden dan Fessenden, 1992).
Asam anhidrida lebih reaktif dibandingkan dengan ester, tetapi reaksinya dengan nukleofil kurang reaktif dibandingkan dengan asil halida. Air menghidrolisis anhidrida kembali menjadi asam. Reaksinya dengan alkohol menghasilkan ester, sedangkan dengan amonia menghasilkan asam (Hart, 1990).
Salah satu contoh pembuatan anhidrida asam ialah pembuatan anhidrida maleat dari asam maleat dimana 100 gram asam maleat dicampurkan dengan 1,1,2,2,-tetrakloroetan sebanyak 100 ml dalam sebuah labu destilat, termometer dan kondensor dirangkai membentuk rangkaian alat destilasi. Campuran dipanaskan dalam suhu kamar ketika suhu mencapai 150oC, sebanyak 75 ml 1,1,2,2,-tetrakloroetan dan antara 15-15,5 ml air dihasilkan pada labu destilat. Destilasi dilanjutkan dengan menggunakan kondensor udara dan labu destilat sebelumnya diganti dengan labu detilat lain ketika suhu mencapai 150oC. Anhidrida maleat dihasilkan pada suhu 195-197oC. Kemudian anhidrida maleat yang dihasilkan, direkristalisasi dengan kloroform. Anhidrida maelat murni yang dihasilkan memiliki titik lebur sebesar 54oC sebanyak 70 gram (83%) (Furniss et al,1989).
Reaksi pembuatan anhidrida asam umumnya berlangsung antara asil klorida dengan garam dari asam karboksilat. Sifat kimia anhidrida asam sama dengan klorida asam, namun anhidrida bereaksi sedikit lebih lambat dibandingkan klorida asam.
R
asam amida ester aldehida
H2O NH3 R'OH LiAlH4 Gambar 2.7. Reaksi-Reaksi dari Anhidrida Asam
(Riswiyanto, 2002)
2.5.1. Anhidrida Maleat
Anhidrida maleat disebut juga 2,5-furandione; cis butenedioat anhidrida. Dengan rumus molekul C4H2O3, berat molekul 98,06 dan titik lebur 52,8oC. Larut dalam
air membentuk asam maleat.
O O
O
Gambar 2.8. Anhidrida Maleat (Anonimous, 1967)
Maleat anhidrida adalah senyawa vinil tidak jenuh yang merupakan bahan mentah dalam sintesa resin poliester, pelapisan permukaan karet, detergen, bahan aditif dan minyak pelumas (Retno, 1995).
tahan benturan, fleksibilitas dan kekerasan goresan yang lebih baik. Umumnya, anhidrida maleat dikenal untuk memperkuat adhesi, yaitu gaya tarik menarik antara molekul yang tidak sejenis (Akintayo et al, 2012).
2.6. Reaksi Esterifikasi
Reaksi esterifikasi adalah suatu reaksi antara asam karboksilat dan alkohol membentuk ester. Turunan asam karboksilat membentuk ester asam karboksilat. Ester asam karboksilat ialah suatu senyawa yang mengandung gugus –CO2R
dengan R dapat berupa alkil maupun aril. Esterifikasi dikatalisis asam dan bersifat dapat balik (Fessenden dan Fessenden 1992).
Menurut Besari dkk (1982), reaksi esterifikasi dapat dilakukan dengan reaksi-reaksi berikut ini:
1. Asam karboksilat ditambah dengan alkohol
H3C C
2. Alkil halida ditambah garam dari suatu asam karboksilat
CH3I + AgOC CH3
O
H3C C
O
OCH3 + AgI
Metil Iodida garam argentum metil asetat argentum iodida
3. Ester ditambah dengan natrium metoksida
H3C C
CH3 C
5. Asil halida ditambah dengan alkohol
H3C C
6. Alkohol ditambah dengan amida
C2H5OH + H3C C
+
Albizia Benth Oil dietanolamina
Hidroksietil Albizia Benth Oil Amida (HEABOA) anhidrida maleat
HCl
Maleanised HEABOA
(Akintayo et al,2012)
2.7. Surfaktan
O
Ekor hidrofobik Ekor hidrofilik Gambar 2.9. Lambang Umum Surfaktan
Surfaktan dapat dikelompokkan sebagai surfaktan anionik, kationik, atau netral, bergantung pada sifat dasar gugus hidrofiliknya. Surfaktan menurunkan tegangan permukaan air dengan cara mematahkan ikatan-ikatan hidrogen pada permukaan. Mereka melakukan ini dengan menaruh kepala-kepala hidrofiliknya pada permukaan air dengan ekor-ekor hidrofobiknya terentang menjauhi permukaan air (Fessenden dan Fessenden, 1992).
Senyawa yang mengandung bagian hidrofilik dan hidrofobik, umumnya disebut sebagai zat amphiphilic. Keseimbangan hidrofilik-lipofilik (HLB = hidrophilic-lipophilic balance) dari suatu zat amphiphilic cukup penting dalam fenomena kelarutan dan emulsifikasi (Winsor, 1956).
Nilai HLB dapat dihitung dengan menggunakan rumus sebagai berikut :
HLB = 20 1
S
A
Dimana S adalah bilangan penyabunan dan A adalah bilangan asam (Martin, 1960).
0 3 6 15 18
12
9
H
id
ro
fi
li
k
L
ipof
il
ik
Zat pelarut
Detergen
Zat pengemulsi o/w
Zat penyebar dan pembasah
Zat pengemulsi w/o
Kebanyakan zat antibusa
Skala HLB
BAB 3
METODE PENELITIAN
3.1. Alat dan Bahan
3.1.1. Alat-alat
1. Neraca analitis Mettler PM 480
2. Spatula -
3. Labu leher dua 500 ml Pyrex
4. Labu leher tiga 500 ml Pyrex
5. Stopper -
6. Pipet tetes -
7. Gelas ukur 100 ml Pyrex
8. Gelas ukur 10 ml Pyrex
9. Hotplate stirrer Thermolyne
10. Kondensor bola Pyrex
11. Tabung CaCl2 Pyrex
12. Corong penetes 50 ml Pyrex
13. Termometer 300oC Pyrex
14. Pengaduk magnetik -
15. Gelas Beaker 250 ml Pyrex
16. Corong pisah 500 ml Pyrex
17. Statif dan klem -
18. Kertas saring biasa -
19. Corong Pyrex
20. Kaca arloji Pyrex
21. Rotarievaporator Heidolph
23. Alat vakum Fisons
24. Tabung gas nitrogen -
25. Gelas Erlenmeyer Pyrex
26. Buret Pyrex
27. Botol vial -
28. Teflon Onda
29. Pipa kapiler Blaubrand
30. Spektrofotometer FT-IR Shimadzu
31. Spektrofotometer 1H-NMR Delta2-NMR500MHz
3.1.2. Bahan-bahan
1. Asam palmitat p.a E’merck
2. Metanol p.a E’merck
3. Benzena p.a E’merck
4. CaCl2 anhidrous p.a E’merck
5. Asam sulfat p.a E’merck
6. n-Heksana p.a E’merck
7. Akuades -
8. Natrium sulfat anhidrous p.a E’merck
9. Dietanolamina p.a E’merck
10. Natrium metoksida p.a E’merck
11. Dietil eter p.a E’merck
12. Natrium klorida p.a E’merck
13. Xylena p.a E’merck
14. Aseton p.a E’merck
15. Asam klorida p.a E’merck
16. Anhidrida maleat p.a E’merck
17. Gas nitrogen -
20. Alkohol netral p.a E’merck
21. NaOH p.a E’merck
22. Plat KLT p.a E’merck
3.2. Prosedur Penelitian
3.2.1. Esterifikasi asam palmitat dengan metanol
Ke dalam labu leher dua volume 250 ml dimasukkan 50 gram (0,195 mol) asam palmitat kemudian ditambahkan 80 ml metanol dan 80 ml benzena diaduk dengan menggunakan pengaduk magnet. Dirangkai alat refluks yang dihubungkan dengan tabung CaCl2anhidrous, dalam keadaan dingin sambil diaduk diteteskan H2SO4(p)
sebanyak 2 ml melalui corong penetes. Direfluks selama 5 jam, hasil reaksi kemudian diuapkan dengan menggunakan rotarievaporator. Selanjutnya residu diekstraksi dengan 100 ml n-heksana, kemudian dicuci dengan 10 ml akuades sebanyak dua kali. Lapisan atas dikeringkan dengan CaCl2 anhidrous dan
disaring. Selanjutnya filtrat ditambahkan dengan Na2SO4 anhidrous kemudian
disaring. Filtrat diuapkan mengunakan rotarievaporator, residu yang diperoleh diukur volumenya kemudian di ukur titik lebur dan di analisis dengan spektroskopi FT-IR.
3.2.2. Amidasi metil palmitat dengan dietanolamina (Sembiring, 2013)
Ke dalam labu leher dua volume 250 ml dimasukkan 13,5 gram (0,05 mol) metil palmitat kemudian ditambahkan 9 ml (0,093 mol) dietanolamina diaduk dengan menggunakan pengaduk magnet. Dirangkai alat refluks yang dihubungkan dengan tabung CaCl2 anhidrous, ditambahkan 5 gram natrium metoksida dalam 20 ml
25 ml larutan NaCl jenuh sebanyak 3 kali. Lapisan atas yang diperoleh, diuapkan menggunakan rotarievaporator kemudian residu di keringkan didalam oven pada suhu 50oC dalam keadaan vakum selanjutnya dikeringkan dalam desikator. Hasil yang diperoleh diukur titik leburnya, dilanjutkan analisis dengan spektroskopi FT-IR dan diukur nilai HLB dengan menggunakan metode titrasi.
3.2.3. Esterifikasi alkanolamida dengan anhidrida maleat (Akintayo et al, 2012)
Ke dalam labu leher tiga 250 ml dimasukan 2,4 gram (0,021 mol) alkanolamida (hasil amidasi metil palmitat dengan dietanolamina) dan ditambahkan 50 ml campuran xylena:aseton (3:1) v/v. Dirangkai alat refluks yang dihubungkan dengan tabung berisi CaCl2 anhidrous, diaduk dengan pengaduk magnet pada
3.2.4. Analisa hasil reaksi
3.2.4.1. Analisa dengan spektrofotometer FT-IR
Untuk masing-masing cuplikan yaitu untuk metil palmitat yang berwujud cair dioleskan pada plat NaCl. Alkanolamida dan N,N (di-2- mono etil maleat) palmitamida yang berwujud padat dicetak hingga terbentuk plat dengan KBr kemudian diukur spektrumnya dengan alat spektrofotometer FT-IR.
3.2.4.2. Penentuan titik lebur a. Metil Palmitat
Metil palmitat dimasukkan kedalam pipa kapiler setinggi 1 cm kemudian dimasukkan kedalam freezer selama satu malam. Setelah disimpan satu malam, dikeluarkan pipa kapiler lalu diikatkan pada thermometer sehingga ujung pipa kapiler sama letaknya dengan ujung tempat air raksa dari thermometer. Bersama dengan thermometer, pipa kapiler tersebut dicelupkan kedalam gelas Beaker yang diisi campuran air dengan es. Kemudian dinaikkan suhu secara perlahan sambil diaduk dan diamati perubahan yang terjadi (Ketaren,2008).
b. Alkanolamida dan N,N (di-2- mono etil maleat) palmitamida
Senyawa yang diperoleh, diambil sedikit mungkin dengan spatula kemudian diletakkan diatas melting point apparatus lalu dicatat perubahan titik leburnya.
3.2.4.3. Penentuan nilai Hidrophilic Lipophilic Balance (HLB)
Nilai HLB = 20 ( 1 – S/A )
Dimana : S = Bilangan penyabunan A = Bilangan Asam
a. Penentuan Bilangan Penyabunan
Sebanyak 0,1 gram sampel dimasukkan kedalam gelas erlenmeyer, kemudian ditambahkan sebanyak 5 ml KOH alkohol 0,5 N, lalu ditutup dengan plastik dan dipanaskan hingga larut, kemudian didinginkan dan dititrasi dengan HCl 0,05 N menggunakan indikator fenolftalein sebanyak 3 tetes hingga warna merah hilang, lalu dicatat volume HCl 0,05 N yang dipakai.
Hal yang sama dilakukan untuk larutan blanko.
Bilangan Penyabunan = (V Blanko-V.titrasi) x N.HCl x BM KOH Berat sampel (gram)
b. Penentuan Bilangan Asam
Sebanyak 0,1 gram sampel dimasukkan kedalam gelas erlenmeyer, kemudian ditambahkan 10 ml alkohol netral, lalu ditutup dengan plastik dan dipanaskan hingga larut kemudian didinginkan dan dititrasi dengan KOH 0,02 N menggunakan indikator fenolftalein sebanyak 3 tetes sampai tepat warna merah lembayung, lalu dicatat volume KOH 0,02 N yang dipakai.
3.2.4.6. Analisis Spektrofotometer 1H-NMR
Cuplikan senyawa N,N (di-2-mono etil maleat) palmitamida hasil sintesis dilarutkan dalam CDCl3 selanjutnya diukur spektrumnya dengan spektrofotometer
3.3. Bagan Penelitian
a. Esterifikasi asam palmitat dengan metanol
50 gram asam palmitat
dimasukkan ke dalam labu leher dua ditambahkan 80 ml metanol
ditambahkan 80 ml benzena
ditambahkan 2 ml H2SO4 (p) secara perlahan-lahan dalam keadaan
dingin melalui corong penetes direfluks sambil diaduk selama 5 jam
campuran
didinginkan pada suhu kamar diuapkan dengan rotarievaporator
residu
diekstraksi dengan 100 ml n-heksana dicuci dengan 10 ml akuades sebanyak 2 kali
destilat
lapisan atas lapisan bawah
ditambahkan dengan CaCl2 anhidrous selama 1 jam
disaring
ditambahkan dengan Na2SO4 anhidrous selama 1 jam
disaring
diuapkan dengan rotarievaporator
filtrat residu
filtrat residu
HASIL
dirangkai alat refluks yang dihubungkan dengan tabung CaCl2
b. Amidasi metil palmitat dengan dietanolamina
13,5 gram metil palmitat
dimasukkan kedalam labu leher dua
ditambahkan 9 ml dietanolamina
dirangkai alat refluks
ditambahkan 5 gram natrium metoksida dalam 20 ml metanol
dipanaskan pada suhu 110-120oC sambil diaduk selama 5 jam
campuran
diuapkan dengan rotarievaporator
residu destilat
diekstraksi dengan 100 ml dietil eter
dicuci dengan larutan NaCl jenuh sebanyak 3 kali masing-masing 25 ml
lapisan atas lapisan bawah
diuapkan dengan rotarievaporator
residu destilat
dikeringkan didalam oven pada suhu 50oC dalam keadaan vakum
HASIL
c. Esterifikasi alkanolamida dengan anhidrida maleat
2,4 gram alkanolamida
dimasukkan kedalam labu leher tiga
ditambahkan 50 ml campuran xylena-aseton dengan perbandingan 3:1 (v/v)
dirangkai alat refluks
ditambahkan 4 tetes HCl 1 N melalui corong penetes ditambahkan 1,5 gram anhidrida maleat yang telah dilarutkan dalam 50 ml xylena-aseton secara perlahan melalui corong penetes
dilanjutkan pemanasan pada suhu 140-150oC selama 4 jam yang diikuti pemantauan menggunakan analisis KLT dipanaskan pada suhu 100oC sambil dialiri gas nitrogen dan diaduk hingga larut
Campuran
diuapkan dengan destilasi vakum
residu destilat
dicuci dengan metanol disaring
residu filtrat
didiamkan di dalam desikator selama 1 malam
d. Penentuan bilangan penyabunan
e. Penentuan bilangan asam
0,2 gram sampel
dimasukkan kedalam gelas erlenmeyer
ditutup dengan plastik
dipanaskan hingga larut
campuran
didinginkan
ditambahkan 3 tetes indikator fenolftalein
dititrasi dengan KOH 0,1 N hingga berwarna merah lembayung
dicatat volume KOH 0,1 N yang terpakai
HASIL
ditambahkan alkohol netral 95% sebanyak 10 ml 0,2 gram sampel
dimasukkan kedalam gelas erlenmeyer
ditambahkan KOH alkohol 0,1 N sebanyak 5 ml ditutup dengan plastik
dipanaskan hingga larut
campuran
didinginkan
ditambahkan 3 tetes indikator fenolftalein dititrasi dengan HCl 0,1 N hingga warna merah hilang
dicatat volume HCl 0,1 N yang terpakai
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Esterifikasi asam palmitat dengan metanol
Pembuatan metil palmitat secara esterifikasi terhadap asam palmitat dengan metanol dalam pelarut benzena menggunakan katalis asam sulfat pekat diperoleh metil palmitat sebanyak 52 ml (84,14%) dan berbentuk cairan bening tidak berwana.
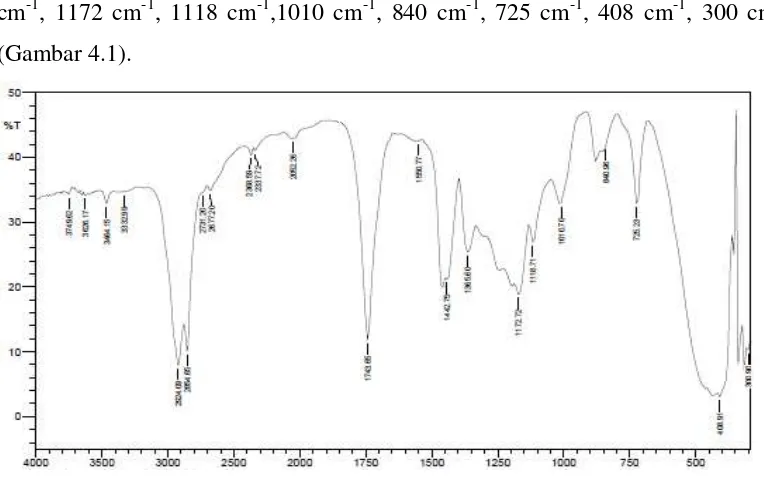
Hasil yang diperoleh dianalisa dengan spektroskopi FT-IR memberikan spektrum dengan puncak-puncak serapan pada daerah bilangan gelombang 3749 cm-1, 3626 cm-1, 3464 cm-1, 3332 cm-1, 2924 cm-1, 2854 cm-1, 2731 cm-1, 2677 cm-1, 2368 cm-1, 2337 cm-1, 2052 cm-1, 1743 cm-1, 1550 cm-1, 1442 cm-1, 1365 cm-1, 1172 cm-1, 1118 cm-1,1010 cm-1, 840 cm-1, 725 cm-1, 408 cm-1, 300 cm-1 (Gambar 4.1).
4.1.2. Amidasi metil palmitat dengan dietanolamina
Pembuatan alkanolamida secara amidasi antara senyawa metil palmitat dengan dietanolamina dalam pelarut metanol dengan bantuan katalis natrium metoksida diperoleh alkanolamida sebanyak 16 gram (91,42%) berbentuk padatan berwarna putih.
Hasil yang diperoleh dianalisa dengan spektroskopi FT-IR memberikan spektrum dengan puncak-puncak serapan pada daerah bilangan 3842 cm-1, 3410 cm-1, 2916 cm-1, 2846 cm-1, 2708 cm-1, 2368 cm-1, 2337 cm-1, 1851 cm-1, 1620 cm-1, 1566 cm-1, 1442 cm-1, 1365 cm-1, 1265 cm-1, 1188 cm-1, 1064 cm-1, 925 cm
-1
, 871 cm-1, 717 cm-1, 594 cm-1, 540 cm-1, 447 cm-1, 354 cm-1 (Gambar 4.2).
4.1.3 Esterifikasi alkanolamida dengan anhidrida maleat
Pembuatan N,N (di-2-mono etil maleat) palmitamida secara esterifikasi antara alkanolamida dengan anhidrida maleat dalam pelarut xylena-aseton (3:1). Senyawa N,N (di-2-mono etil maleat) palmitamida yang diperoleh dari hasil pemurnian dengan kolom kromatografi sebanyak 2,8 gram (74,20%) berbentuk padatan berwarna putih kekuningan.
Uji kromatografi lapis tipis N,N (di-2- mono etil maleat) palmitamida hasil dari pemurnian senyawa menggunakan kromatografi kolom dimana fase diam yang digunakan adalah silika gel 60G dan fase gerak n-Heksana : Dietil eter dengan perbandingan 8:2 v/v menunjukkan hasil sebagai berikut:
Tabel 4.1. Data Kromatografi Lapis Tipis
No Fraksi Jumlah noda Harga Rf
1. 1-4 2 0,475
0,75
2 5-12 1 0,475
3. 12-16 1 -
Hasil yang diperoleh dianalisa dengan spektroskopi FT-IR memberikan spektrum dengan puncak-puncak serapan pada daerah bilangan 3749 cm-1, 3502 cm-1, 3363 cm-1, 2924 cm-1, 2854 cm-1, 2368 cm-1, 2337 cm-1, 1975 cm-1, 1735 cm-1, 1581 cm-1, 1519 cm-1, 1465 cm-1, 1373 cm-1, 1172 cm-1, 1118 cm-1, 1080 cm-1, 979 cm-1, 864 cm-1, 725 cm-1, 655 cm-1, 586 cm-1, 532 cm-1, 354 cm-1, 324 cm-1 (Gambar 4.3).
Senyawa N,N (2-di-mono maleat etil) palmitamida dianalisa dengan spektrometer 1H-NMR yang memberikan spektrum dengan puncak-puncak
5,2698 ppm; 5,3502-5,3619 ppm; 5,8094 ppm; 6,7446-6,7615 ppm; 6,9794ppm; 7,1298 ppm; 7,2608 ppm (Gambar 4.4).
Gambar 4.3 Spektrum FT-IR N,N (di-2-mono etil maleat) palmitamida.
4.1.4 Uji Titik Lebur
Penentuan titik lebur pada senyawa asam palmitat, metil palmitat, alkanolamida, dan N,N (di-2-mono etil maleat) palmitamida menunjukkan data sebagai berikut:
Tabel 4.2. Data Penentuan Titik Lebur
NO Nama senyawa Titik Lebur (0C)
1. Asam palmitat 63
2. Metil palmitat 38
3. Alkanolamida 118
4. N,N (di-2-mono etil maleat) palmitamida 75
4.1.6 Harga HLB
Harga HLB (Hydrophylic Lypophylic Balance) dari alkanolamida dan N,N (di-2-mono etil maleat) palmitamida yang dilakukan berdasarkan metode titrasi menunjukkan data dan perhitungan sebagai berikut :
Tabel 4.3. Data Penentuan Bilangan Penyabunan
Tabel 4.4. Data Penentuan Bilangan Asam
4.2.1. Esterifikasi asam palmitat dengan metanol
Pembuatan metil palmitat secara esterifikasi terhadap asam palmitat dengan metanol dalam pelarut benzena menggunakan katalis asam sulfat pekat pada suhu 70-800C. Hasil yang diperoleh dianalisa dengan spektrofotometer FT-IR pada gambar 4.2, memberikan puncak serapan pada daerah bilangan gelombang 2924 cm-1 dan 2854 cm-1 menunjukkan serapan khas dari vibrasi streching (C-H) sp3 yang didukung oleh vibrasi bending (C-H) sp3 pada daerah bilangan gelombang 1465 cm-1. Serapan pada daerah bilangan gelombang 1743 cm-1 adalah frekuensi vibrasi streching gugus karbonil (C=O) dari ester yang terbentuk dan didukung dengan vibrasi streching asimetris (C-O) ester dari (C-(C=O)-O) pada daerah 1172 cm-1. Spektrum yang menunjukkan puncak vibrasi pada daerah bilangan gelombang 725 cm-1 adalah vibrasi rocking (CH2)n dan munculnya puncak
Hipotesa dari mekanisme reaksi yang terjadi diperkirakan seperti pada gambar berikut:
CH3(CH2)14C
Gambar 4.5. Mekanisme reaksi esterifikasi asam palmitat dengan metanol
Dalam media asam, pasangan elektron bebas atom oksigen karbonil dapat terprotonasi menghasilkan atom oksigen karbonil bermuatan positif, sehingga dengan demikian atom karbon karbonil dapat diserang oleh nukleofil yang lemah seperti metanol (Riswiyanto,2002)
4.2.2 Amidasi metil palmitat dengan dietanolamina
bending (O-H), dan hal ini juga didukung dengan munculnya pita serapan pada daerah bilangan gelombang 1064 cm-1 yang menunjukkan vibrasi streching (C-O) dari (C-C-(C-O) alkohol primer. Puncak serapan pada daerah bilangan gelombang 1620 cm-1 menunjukkan vibrasi streching (C=O) gugus karbonil amida tersier. Adanya gugus karbonil amida ini didukung oleh munculnya pita serapan daerah bilangan gelombang 1566 cm-1 merupakan vibrasi streching (C-N). Serapan pada daerah bilangan gelombang 2916-2846 cm-1 merupakan serapan khas dari vibrasi streching (C-H) sp3 yang didukung dengan vibrasi bending (C-H) sp3 pada daerah 1442 cm-1. Munculnya pita serapan pada daerah bilangan gelombang 717 cm-1 menunjukkan puncak rocking (CH2)n yang merupakan rantai hidrokarbon alkil
rantai panjang. Tidak adanya pita melebar pada daerah bilangan gelombang 700-600 cm-1 menunjukkan tidak adanya wagging (N-H) diluar bidang. Ini membuktikan (-C(=O)-N) sudah terikat. Gugus (C=O) amida tersier muncul pada daerah gelombang 1620 cm-1 ini lebih kecil dibandingkan bilangan gelombang (C=O) ester, hal ini dikarenakan adanya efek resonansi pada (-C(=O)-N) sehingga melemahkan ikatan antara C dan O pada gugus karbonil (Silverstein,1984).
CH3(CH2)14 C
Gambar 4.6. Mekanisme reaksi amidasi metil palmitat dengan dietanolamina
Berdasarkan konsep HSAB (Hard Soft Acid Base), dimana H+ dari dietanolamina HN-(CH2CH2OH)2 merupakan asam keras yang mudah bereaksi dengan basa
keras CHO- dari metil palmitat sehingga membentuk metanol. Sebaliknya nitrogen dengan sepasang elektron bebasnya merupakan basa lunak yang akan terikat pada asam lunak ion karboksilat R-C+=O dan membentuk senyawa alkanolamida.
4.2.3. Esterifikasi alkanolamida dengan anhidrida maleat
daerah bilangan gelombang 1735 cm-1 merupakan frekuensi vibrasi streching (C=O) dari ester yang terbentuk dan didukung oleh vibrasi streching asimetris (C-O) dari (C-C(=(C-O)-(C-O) ester jenuh pada daerah bilangan gelombang 1172 cm-1. Munculnya puncak serapan pada daerah bilangan gelombang 1581 cm-1. Menunjukkan vibrasi streching (C-N). Puncak serapan pada daerah bilangan gelombang 725 cm-1 menunjukkan puncak vibrasi rocking (CH2)n yang
merupakan rantai hidrokarbon alkil rantai panajng. Puncak vibrasi pada bilangan gelombang sekitar 1625 cm-1 menunjukkan adanya ikatan rangkap (C=C) dan dengan munculnya puncak vibrasi pada bilangan gelombang 3363 cm-1 menunjukkan vibrasi (H-O-C=O) (Silverstein,1984).
Hipotesa dari mekanisme reaksi yang terjadi diperkirakan seperti pada gambar berikut:
Hasil analisa spektroskopi FT-IR tersebut didukung oleh hasil spektrometer 1H-NMR. Dimana hasil tersebut menunjukkan puncak-puncak
pergeseran kimia (δ) pada daerah-daerah berikut:
1. Pergeseran kimia pada daerah δ=6,7446-6,7615 ppm dengan puncak doublet-doublet menunjukkan proton dari gugus CH=CH.
2. Pergeseran kimia pada daerah δ= 4,1530-4,1660 ppm dengan puncak triplet menunjukkan proton dari gugus –CH2-O.
3. Pergeseran kimia pada daerah δ= 2,2968-2,3189 ppm dengan puncak triplet menunjukkan proton dari gugus –N-CH2.
4. Pergeseran kimia pada daerah δ= 2,0309-2,0439 ppm dengan puncak triplet menunjukkan proton dari gugus –CH2-N.
5. Pergeseran kimia pada daerah δ= 1,1904-1,2994 ppm dengan puncak multiplet menunjukkan proton dari gugus –CH2- .
6. Pergeseran kimia pada daerah δ= 0,8661-0,8934 ppm dengan puncak triplet menunjukkan proton dari gugus CH3-.
4.2.4. Penentuan Nilai HLB
Harga HLB dari palmitamida dan etil maleat dapat dihitung berdasarkan persamaan berikut:
HLB = 20 1 S
A
dimana : S = Bilangan penyabunan A= Bilangan asam
a. HLB senyawa palmitamida
HLB = 20 1 12,343
34,108
b. HLB senyawa etil maleat
HLB = 20 1
=
34,782 74,500
10,8
Penentuan harga HLB yang dilakukan terhadap senyawa alkanolamida dan etil maleat masing-masing diperoleh yaitu 12,8 dan 10,8 menunjukkan senyawa tersebut dapat digunakan sebagai zat pengemulsi o/w.
4.2.5. Uji Titik Lebur
Uji titik lebur dilakukan untuk menganalisa kemurnian senyawa yang diperoleh. Dari hasil penelitian yang diperoleh titik lebur senyawa alkanolamida berada pada kisaran 1180C, dalam hal ini titik lebur senyawa alkanolamida dipenggaruhi oleh panjang rantai karbonnya. Kenaikan titik lebur suatu asam lemak akan meningkat dengan semakin panjangnya rantai karbon senyawa tersebut (Krischenbaeur,1960) dimana bahan dasar yang digunakan untuk pembuatan senyawa alkanolamida adalah metil palmitat dengan titik lebur 380C.
BAB 5
KESIMPULAN DAN SARAN
5.1 Kesimpulan
1. Senyawa N,N (di-2-mono etil maleat) palmitamida dapat disintesa melalui reaksi esterifikasi antara senyawa N,N ( di-2-etanol ) palmitamida dengan anhidrida maleat dengan menggunakan pelarut xylena-aseton pada suhu 145oC dalam kondisi refluks menghasilkan senyawa N,N (di-2-mono etil maleat) palmitamida dengan rendemen 74,20%.
2. Hasil analisa penentuan nilai Hydrophilic Lipophilic Balance ( HLB ) dari senyawa N,N (di-2-etanol) palmitamida dan N,N (di-2-mono etil maleat) palmitamida yang dilakukan melalui metode titrasi diperoleh nilai HLB masing-masing 12,8 dan 10,8.
5.2 Saran
Diharapakan kepada peneliti selanjutnya untuk melakukan sintesa senyawa N,N (di-2-mono etil maleat) palmitamida dengan
DAFTAR PUSTAKA
Akintayo,C.O.,Akintayo,E.T.,Azeez,M.A.2012. Albizia Benth Oil Maleanised Polyesteramides: Synthesis, Structure, and Characteristic.ISRN Polymer Science.
Anonimous I.1976. The Merck Index.USA: Merk and CO.,Inc.
Bahl, A. 2004. Organic Chemistry. New Delhi : S. Chand and Company LTD. Balakrishna,R.S dan Sivasamban,M.A.1971. Water Soluble Alkyd Resin Based On
Malleanized Oil.J Colour Society 10.
Besari,I.,Sulistiowati,E.,Ishak,M.1982. Kimia Organik.Bandung:Penerbit Armico. Bilyk, A., Bistline, R. G., Piazza, G. J., Feairheller, S.H,. and Hass, M.J., 1992, A
Novel technique for preparation of secondary fatty amide. JAOCS.69
Fessenden dan Fessenden.1986. Kimia Organik. Edisi Ketiga. Jilid II.Jakarta:Erlangga.
Furniss, B.S., Hannaford, A.J., Smith, P.W.G., dan Tatchel, A.R. 1989. Textbook Of Practical Organic Chemistry. Fifth Edition. United States. : Longman Scientific & Technical.
Gabriel,R.1984.”Selective Amidation of Fatty Methyl Esther with N-(2-amino ethyl Ethanolamine Under Base Catalysis”.JAOCS Vol 6 1.965.USA. Pada Lubis,B.2012. Sintesis Senyawa Alkanolamida dan Alkanolamida Fosfat dari Asam Lemak Bebas Hasil Pengolahan Minyak Goreng dari CPO. Medan.USU press
Gandhi, R. 1997. “Aplicattion of Lipase”, Dalam Tarigan, J. 2002. Ester Asam lemak Digitized by USU Digital Library FMIPA USU.
Griffin, W.C. 1949. Cosmetic Chemistry. J.Soc 1 : 311. Dalam Martin, A.N. 1960. Physical Pharmacy. Philadelphia : Lea & Febiger.
Gervajio,G.C.2005.Bailey’s Industrial Oil and Fat Product. Edisi 6.New York:John Wiley and Sons, Inc.
Herawan.1999. Penggunaan Asam Lemak Sawit Destilat sebagai Superpalmida.Jurnal Penelitian kelapa Sawit Z(1).
Hughes, F. A and Lew, B. W. 1970. Physical and Funftional Properties of Some Higher Alkyl Polyglucosides. J. Am Oil Chem Soc 47 : 162-167.
Kimmel,T.2004. Kinetic Investigation Of the Base-Catalyzed Glycerolysis of Fatty Acid Methyl Esters.Berlin. der Technischen Universität Berlin
Ketaren, S.2008. Pengantar Teknologi Lemak dan Minyak Pangan. Jakarta: UI-Press.
Lubis,B.F.2012. Sintesis Senyawa Alkanolamida dan Alkanolamida Fosfat dari Asam Lemak Bebas Hasil Pengolahan Minyak Goreng dari CPO. Medan.USU press
Maag,H.1984. Fatty Acid Derivatives : Important surfactants for Household, CosmeticandIndustrialPurposes. JAOCS.Vol.61.No.2.
Noureddini,H.and Medikonduru,V.1997. Glycerolysis of Fats and Methyl Esters.Lincoln: JAOCS.Vol 74.No.4
Nuryanto,E.T.,Hariati dan Elisabet,J..2002. Pembuatan Fatty Amida Dari ALSD untuk Produksi Detergen Cair dan Shampoo. Badan Penelitian dan Pengembangan Pertanian.
Poedjiadi dan Supriyanti.2006. Dasar-Dasar Biokimia.Jakarta:UI Press.
Retno,Y.1995. Penempatan Anhidrida Maleat Pada Low Density Polyethylene untuk Polimer Degradable.Jurnal Simposius Nasional Himpunan Polimer Indonesia.
Richtler, H. J and Knaut, J. 1984. Challengges to A Mature Industry Marketing and Economics of Oleo Chemicals. Western Europe : J. Am. Oil Chem. Soc. 61,2.
Riswiyanto. 2009. KimiaOrganik. Jakarta : Erlangga.
Rosen, M.J., 2004, Surfactants and Interfacial Phenomena, Edisi 3, New York: John Wiley and Sons, Inc.
Spitz,L.2004. SODEOPEC (Soap, Detergents, Oleochemicals, and Personal Care Products). Illnois:AOCS Press.
Urata, K and N. Takaishi. 1998. Applications of Protecting Groups In The Synthesis of Surfactants, Lipid, and Related Compound. J. Sur & Det, 1 (1) 73-82
Wilbraham dan Matta.1992. Pengantar Kimia Organik dan Hayati.Bandung:Penerbit ITB.
Winsor, P.A. 1956. Solvent Properties of Amphiphilic Compounds. London : Butterworth’s Scientific Publications. Mfg Chemist. 27 : 89. Dalam Martin, A.N. 1960. Physical Pharmacy. Philadelphia : Lea & Febiger.
Richtler, H. J and Knaut, J. 1984. Challengges to A Mature Industry Marketing and Economics of Oleo Chemicals. Western Europe : J. Am. Oil Chem. Soc. 61,2.
Riswiyanto. 2009. KimiaOrganik. Jakarta : Erlangga.
Rosen, M.J., 2004, Surfactants and Interfacial Phenomena, Edisi 3, New York: John Wiley and Sons, Inc.
Spitz,L.2004. SODEOPEC (Soap, Detergents, Oleochemicals, and Personal Care Products). Illnois:AOCS Press.
Stauffer,C.E.1996. Emulsifier for The Food Industries.New York:John Wiley and Son.
Urata, K and N. Takaishi. 1998. Applications of Protecting Groups In The Synthesis of Surfactants, Lipid, and Related Compound. J. Sur & Det, 1 (1) 73-82
Wilbraham dan Matta.1992. Pengantar Kimia Organik dan Hayati.Bandung:Penerbit ITB.
Lampiran 1. Gambar Metil Ester Asam Palmitat
Lampiran 2. Gambar N,N (Di-2-etanol) Palmitamida