PURIFIKASI DAN KARAKTERISASI
XILANASE EKSTRASELULER
Streptomyces sp. SKK1-8 ASAL SUKABUMI
NUNUK WIDHYASTUTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul purifikasi dan karakterisasi xilanase ekstraseluler Streptomyces sp.SKK1-8asal Sukabumi adalah benar hasil karya sayasendiri denngan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, September 2007
ABSTRACT
NUNUK WIDHYASTUTI. G3501040101. Purification and Characterization of
Streptomyces sp SKK1-8 Extracellular Xylanase from Sukabumi. Under the direction of ANJA MERYANDINI and YULIN LESTARI.
Hemicelluloses, consist of mainly xylans, are the second most abundant polysaccharides on earth and renewable organic carbon. Bioconversion of hemicelluloses by enzymatic process to valuable products has recieved much attention. Xylanase catalyzes the hydrolysis of 1,4-β-glycosidic bound from xylans into small oligomers and xylose residues. Xylanolytic enzymes and its hydrolysis products have potential application in various agro-industrial processes such as in the pulp and paper industries, food and chemical industries, agriculture and poultry. This research was focused on purification and characterization of xylanase from
Streptomyces sp SKK1-8.
Selective precipitation and isolation of xylanase were studied using ammonium sulphate, aceton and anionic polimer eudragit S100. The results indicated that ammonium sulphate and polimer eudragit S100 were not effective for xylanase precipitation. Therefor, xylanase was precipitated with 50-80% acetone.
Xylanase was purified by the procedures of aceton precipitation, gel filtration (Sephadex G100) and anion exchange chromatography (DEAE-Sephadex A-50). The purity of xylanase increased 12.97 fold than those of the crude enzyme. The specific activity after purification was 1.3817 U/mg. The purified xylanase contains two proteins with the estimated molecular weights of 14.4 kDa and 13.4 kDa as shown on native PAGE and SDS-PAGE stained with silver nitrate.
The purified xylanase had different characters from crude xylanase. The activity of purified xylanase was optimal at 50 oC, pH 4.5. The xylanase maintained its stability at 50 oC and over pH range from pH 4.0 – 8.5. The activity and stability of the enzyme were influenced by the buffer system used. Strong inhibition of xylanase activity was observed when Sr2+, Ag2+ and Ba2+ were added to the enzyme reaction mixture, but Cu2+ dan Zn2+ activated the enzyme. The xylanase was capable of hydrolising p-NP-β-D-xylanopiranoside, p-NP-α-L-arabinofuranoside, p-NP-α -D-glucopiranoside and p-NP-α-D-galactopiranoside, but not p-NP-acetate. The capability of hydrolising four kinds of substrates indicated that this purified xylanase had bifungtional activity. The Km and Vmax values at 50 oC measured on birchwood xylan were 0.101 (mg/ml) and 0.1796 (μmoles xilosa/menit/ml) respectively.
RINGKASAN
NUNUK WIDHYASTUTI. G3501040101. Purifikasi dan Karakterisasi Xilanase Ekstraseluler Streptomyces sp. SKK1-8 Asal Sukabumi. Dibimbing oleh ANJA MERYANDINI dan YULIN LESTARI
Hemiselulosa merupakan heteropolimer yang keberadaaannya di alam kedua terbanyak setelah selulosa. Kadar hemiselulosa pada tanaman mencapai 20-30% berat kering kayu. Saat ini sebagian besar limbah hemiselulosa masih belum dimanfaatkan secara optimal padahal berpotensi untuk diolah menjadi berbagai produk yang lebih bernilai ekonomi. Komponen utama hemiselulosa adalah xilan yang memiliki tulang punggung rantai D-xilopiranosa dengan ikatan glikosidik β-1,4. Residu O-asetil, arabinosil dan 4-O-metil asam glukoronat terikat pada tulang punggung xilan. Kadar dan komposisi xilan pada tanaman bervariasi tergantung pada jenis tanaman. Diperlukan kerja sinergi dari beberapa enzim xilanolitik untuk mendegradasi secara lengkap struktur xilan yang kompleks menjadi monomernya.
Xilanase merupakan enzim kompleks yang terdiri atas 1,4-β-endoxilanase, β -xilosidase, α-L-arabinofuranosidase, α-glukuronidase, asetil xilan esterase dan asam fenolat esterase. Xilanase dan produk hidrolisisnya memiliki potensi untuk diaplikasikan dalam berbagai industri. Xilanase dapat diaplikasikan pada industri kertas, pangan, peternakan dan pengolahan limbah. Xilitol, furfural, xilooligosakarida dan asam glukuronat merupakan produk hidrolisis xilanase yang berpotensi untuk diaplikasikan pada industri pangan, farmasi dan kimia.
Xilanase dihasilkan oleh bakteri, cendawan dan khamir. Streptomyces adalah bakteri Gram positif yang membentuk miselium dan telah digunakan untuk mensintesis senyawa antibiotik, metabolit sekunder lain dan enzim dalam skala industri. Beberapa Streptomyces asal Indonesia diketahui berpotensi sebagai penghasil xilanase, diantaranya Streptomyces sp. 1141-1, Streptomyces sp. 234P-16,
Streptomyces sp 451-3 dan Streptomyces sp SKK1-8.
Xilanase memiliki karakter yang bervariasi. Xilanase bakteri biasanya bersifat netral sampai alkali sedangkan xilanase cendawan bersifat asam. Pada umumnya suhu optimal xilanase antara 40-60 oC, namun xilanase beberapa mikroba diketahui bersifat thermostabil. Studi mengenai karakter xilanase perlu dilakukan untuk mengetahui aplikasi xilanase pada industri yang sesuai. Misalnya xilanase yang digunakan dalam proses bleaching pada industri pulp harus memiliki pH optimum alkali dan stabil pada pH tersebut, bersifat thermostabil dan tidak terkontaminasi selulase.
menunjukkan adanya tiga pita xilanase yang berdekatan dengan berat molekul 16.80 kDa, 15.21 kDa dan 13.86 kDa.
Dewasa ini penggunaan polimer Eudragit S100 pada tahap awal pemurnian telah dikembangkan. Eudragit S100 merupakan polimer asam metakrilat dan metilmetakrilat yang mengalami perubahan kelarutan tergantung dari pH larutan. Pada kondisi di atas pH 5.5 eudragit S100 bersifat larut sedangkan di atas pH tersebut akan mengendap. Hasil pengujian menunjukkan bahwa Eudragit S100 tidak efektif untuk memisahkan xilanase Streptomyces sp SKK1-8 dari senyawa pengotornya. Sebanyak 40.6% xilanase tidak terikat oleh polimer tersebut dan hanya 5.9% yang dapat dielusi dengan 0.1 M bufer fosfat pH 7.5 yang mengandung 1M NaCl dan 0.2% Triton X-100.
Pengendapan xilanase dilakukan dengan menggunakan amonium sulfat dan aseton. Xilanase Streptomyces sp SKK1-8 mengendap maksimal pada konsentrasi 90% amonium sulfat dengan aktivitas sebesar 8.872 U/ml dan pemulihan 25%. Xilanase yang diendapkan dengan aseton mulai mengendap pada konsentrasi 60% dan maksimal pada konsentrasi 80% dengan aktivitas sebesar 33.606 U/ml dan pemulihan 96%.
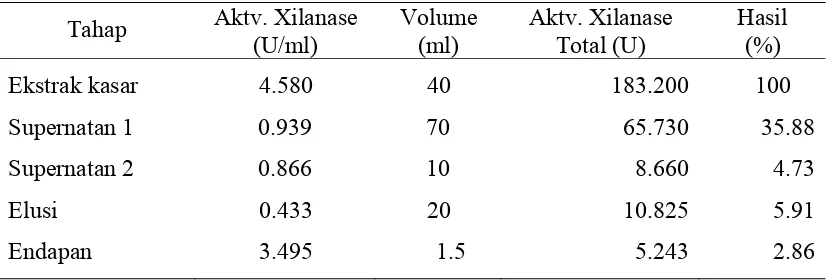
Semipurifikasi xilanase Streptomyces sp SKK1-8 dilakukan dengan filtrasi gel (matrik Sephadex G100) dan kromatografi penukar ion (matrik DEAE-Sephadex. A50). Hasil SDS-PAGE dan native PAGE menunjukkan adanya 2 pita protein yang memiliki BM sekitar 43.2 kDa dan 39.2 kDa. Kemurnian xilanase hasil kromatografi meningkat 12.97 kali dibandingkan aktivitas enzim kasarnya dengan aktivitas spesifik sebesar 1.3817 U/mg.
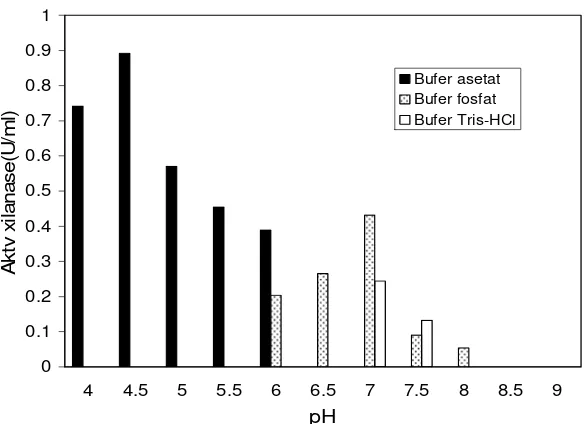
Proses pemurnian merubah sebagian karakter xilanase Streptomyces sp. SKK1-8 sehingga berbeda dengan karakter xilanase hasil pengendapan dengan aseton. Karakter yang berubah yaitu pH optimum reaksi enzimatis dan pengaruh 1 mM kation terhadap aktivitas xilanase. Xilanase hasil pemurnian memiliki aktivitas optimum pada pH 4.5 dan suhu 50 oC, stabil pada rentang pH 4-8.5 dan suhu 50 oC. Aktivitas dan stabilitas xilanase dipengaruhi baik oleh pH maupun jenis bufer yang digunakan. Aktivitas xilanase dihambat oleh adanya 1 mM Ag2+, Ba2+, Ca2+, Co2+, K+, Na+ dan Sr2+, diaktivasi oleh 1 mM Cu2+ dan Zn2+, dan relatif tidak terpengaruh oleh 1 mM Fe3+ dan Ni2+. Nilai Km dan Vmax xilanase pada substrat birchwood xilan berturut-turut yaitu 0.101 (mg/ml) dan 0.1796 (μM/menit/ml).
©Hak cipta milik IPB, tahun 2007
Hak cipta dilindungi UU
1.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbera. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar
IPB
2.
Dilarang mengumumkan dan memperbanyak sebagian atauPURIFIKASI DAN KARAKTERISASI
XILANASE EKSTRASELULER
Streptomyces sp. SKK1-8 ASAL SUKABUMI
NUNUK WIDHYASTUTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul : Purifikasi dan Karakterisasi Xilanase Ekstraseluler Streptomyces sp.SKK1-8 asal Sukabumi
Nama Mahasiswa : Nunuk Widhyastuti NIM : G351040101
Disetujui
Komisi Pembimbing
Dr. Anja Meryandini MS Ketua
Dr. Ir. Yulin Lestari Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pasca Sarjana
Dr. Ir. Dedy Duryadi S. DEA Prof. Dr. Ir. Khairil A. Notodiputro, MS
RIWAYAT HIDUP
Penulis dilahirkan di Madiun, Jawa Timur pada tanggal 28 Agustus 1964. Penulis merupakan anak kelima dari delapan bersaudara dari ayah yang bernama Arianto dan ibu Soetami.
Penulis menyelesaikan pendidikan sekolah menengah atas di SMU Negeri 1 Madiun pada tahun 1983. Pada tahun yang sama penulis diterima di jurusan Biologi Lingkungan, Fakultas Biologi, Universitas Gajah Mada, Yogyakarta. Penulis menyelesaikan studi strata 1 pada tahun 1988.
PURIFIKASI DAN KARAKTERISASI
XILANASE EKSTRASELULER
Streptomyces sp. SKK1-8 ASAL SUKABUMI
NUNUK WIDHYASTUTI
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
BOGOR
PERNYATAAN MENGENAI TESIS
DAN SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis yang berjudul purifikasi dan karakterisasi xilanase ekstraseluler Streptomyces sp.SKK1-8asal Sukabumi adalah benar hasil karya sayasendiri denngan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber data dan informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, September 2007
ABSTRACT
NUNUK WIDHYASTUTI. G3501040101. Purification and Characterization of
Streptomyces sp SKK1-8 Extracellular Xylanase from Sukabumi. Under the direction of ANJA MERYANDINI and YULIN LESTARI.
Hemicelluloses, consist of mainly xylans, are the second most abundant polysaccharides on earth and renewable organic carbon. Bioconversion of hemicelluloses by enzymatic process to valuable products has recieved much attention. Xylanase catalyzes the hydrolysis of 1,4-β-glycosidic bound from xylans into small oligomers and xylose residues. Xylanolytic enzymes and its hydrolysis products have potential application in various agro-industrial processes such as in the pulp and paper industries, food and chemical industries, agriculture and poultry. This research was focused on purification and characterization of xylanase from
Streptomyces sp SKK1-8.
Selective precipitation and isolation of xylanase were studied using ammonium sulphate, aceton and anionic polimer eudragit S100. The results indicated that ammonium sulphate and polimer eudragit S100 were not effective for xylanase precipitation. Therefor, xylanase was precipitated with 50-80% acetone.
Xylanase was purified by the procedures of aceton precipitation, gel filtration (Sephadex G100) and anion exchange chromatography (DEAE-Sephadex A-50). The purity of xylanase increased 12.97 fold than those of the crude enzyme. The specific activity after purification was 1.3817 U/mg. The purified xylanase contains two proteins with the estimated molecular weights of 14.4 kDa and 13.4 kDa as shown on native PAGE and SDS-PAGE stained with silver nitrate.
The purified xylanase had different characters from crude xylanase. The activity of purified xylanase was optimal at 50 oC, pH 4.5. The xylanase maintained its stability at 50 oC and over pH range from pH 4.0 – 8.5. The activity and stability of the enzyme were influenced by the buffer system used. Strong inhibition of xylanase activity was observed when Sr2+, Ag2+ and Ba2+ were added to the enzyme reaction mixture, but Cu2+ dan Zn2+ activated the enzyme. The xylanase was capable of hydrolising p-NP-β-D-xylanopiranoside, p-NP-α-L-arabinofuranoside, p-NP-α -D-glucopiranoside and p-NP-α-D-galactopiranoside, but not p-NP-acetate. The capability of hydrolising four kinds of substrates indicated that this purified xylanase had bifungtional activity. The Km and Vmax values at 50 oC measured on birchwood xylan were 0.101 (mg/ml) and 0.1796 (μmoles xilosa/menit/ml) respectively.
RINGKASAN
NUNUK WIDHYASTUTI. G3501040101. Purifikasi dan Karakterisasi Xilanase Ekstraseluler Streptomyces sp. SKK1-8 Asal Sukabumi. Dibimbing oleh ANJA MERYANDINI dan YULIN LESTARI
Hemiselulosa merupakan heteropolimer yang keberadaaannya di alam kedua terbanyak setelah selulosa. Kadar hemiselulosa pada tanaman mencapai 20-30% berat kering kayu. Saat ini sebagian besar limbah hemiselulosa masih belum dimanfaatkan secara optimal padahal berpotensi untuk diolah menjadi berbagai produk yang lebih bernilai ekonomi. Komponen utama hemiselulosa adalah xilan yang memiliki tulang punggung rantai D-xilopiranosa dengan ikatan glikosidik β-1,4. Residu O-asetil, arabinosil dan 4-O-metil asam glukoronat terikat pada tulang punggung xilan. Kadar dan komposisi xilan pada tanaman bervariasi tergantung pada jenis tanaman. Diperlukan kerja sinergi dari beberapa enzim xilanolitik untuk mendegradasi secara lengkap struktur xilan yang kompleks menjadi monomernya.
Xilanase merupakan enzim kompleks yang terdiri atas 1,4-β-endoxilanase, β -xilosidase, α-L-arabinofuranosidase, α-glukuronidase, asetil xilan esterase dan asam fenolat esterase. Xilanase dan produk hidrolisisnya memiliki potensi untuk diaplikasikan dalam berbagai industri. Xilanase dapat diaplikasikan pada industri kertas, pangan, peternakan dan pengolahan limbah. Xilitol, furfural, xilooligosakarida dan asam glukuronat merupakan produk hidrolisis xilanase yang berpotensi untuk diaplikasikan pada industri pangan, farmasi dan kimia.
Xilanase dihasilkan oleh bakteri, cendawan dan khamir. Streptomyces adalah bakteri Gram positif yang membentuk miselium dan telah digunakan untuk mensintesis senyawa antibiotik, metabolit sekunder lain dan enzim dalam skala industri. Beberapa Streptomyces asal Indonesia diketahui berpotensi sebagai penghasil xilanase, diantaranya Streptomyces sp. 1141-1, Streptomyces sp. 234P-16,
Streptomyces sp 451-3 dan Streptomyces sp SKK1-8.
Xilanase memiliki karakter yang bervariasi. Xilanase bakteri biasanya bersifat netral sampai alkali sedangkan xilanase cendawan bersifat asam. Pada umumnya suhu optimal xilanase antara 40-60 oC, namun xilanase beberapa mikroba diketahui bersifat thermostabil. Studi mengenai karakter xilanase perlu dilakukan untuk mengetahui aplikasi xilanase pada industri yang sesuai. Misalnya xilanase yang digunakan dalam proses bleaching pada industri pulp harus memiliki pH optimum alkali dan stabil pada pH tersebut, bersifat thermostabil dan tidak terkontaminasi selulase.
menunjukkan adanya tiga pita xilanase yang berdekatan dengan berat molekul 16.80 kDa, 15.21 kDa dan 13.86 kDa.
Dewasa ini penggunaan polimer Eudragit S100 pada tahap awal pemurnian telah dikembangkan. Eudragit S100 merupakan polimer asam metakrilat dan metilmetakrilat yang mengalami perubahan kelarutan tergantung dari pH larutan. Pada kondisi di atas pH 5.5 eudragit S100 bersifat larut sedangkan di atas pH tersebut akan mengendap. Hasil pengujian menunjukkan bahwa Eudragit S100 tidak efektif untuk memisahkan xilanase Streptomyces sp SKK1-8 dari senyawa pengotornya. Sebanyak 40.6% xilanase tidak terikat oleh polimer tersebut dan hanya 5.9% yang dapat dielusi dengan 0.1 M bufer fosfat pH 7.5 yang mengandung 1M NaCl dan 0.2% Triton X-100.
Pengendapan xilanase dilakukan dengan menggunakan amonium sulfat dan aseton. Xilanase Streptomyces sp SKK1-8 mengendap maksimal pada konsentrasi 90% amonium sulfat dengan aktivitas sebesar 8.872 U/ml dan pemulihan 25%. Xilanase yang diendapkan dengan aseton mulai mengendap pada konsentrasi 60% dan maksimal pada konsentrasi 80% dengan aktivitas sebesar 33.606 U/ml dan pemulihan 96%.
Semipurifikasi xilanase Streptomyces sp SKK1-8 dilakukan dengan filtrasi gel (matrik Sephadex G100) dan kromatografi penukar ion (matrik DEAE-Sephadex. A50). Hasil SDS-PAGE dan native PAGE menunjukkan adanya 2 pita protein yang memiliki BM sekitar 43.2 kDa dan 39.2 kDa. Kemurnian xilanase hasil kromatografi meningkat 12.97 kali dibandingkan aktivitas enzim kasarnya dengan aktivitas spesifik sebesar 1.3817 U/mg.
Proses pemurnian merubah sebagian karakter xilanase Streptomyces sp. SKK1-8 sehingga berbeda dengan karakter xilanase hasil pengendapan dengan aseton. Karakter yang berubah yaitu pH optimum reaksi enzimatis dan pengaruh 1 mM kation terhadap aktivitas xilanase. Xilanase hasil pemurnian memiliki aktivitas optimum pada pH 4.5 dan suhu 50 oC, stabil pada rentang pH 4-8.5 dan suhu 50 oC. Aktivitas dan stabilitas xilanase dipengaruhi baik oleh pH maupun jenis bufer yang digunakan. Aktivitas xilanase dihambat oleh adanya 1 mM Ag2+, Ba2+, Ca2+, Co2+, K+, Na+ dan Sr2+, diaktivasi oleh 1 mM Cu2+ dan Zn2+, dan relatif tidak terpengaruh oleh 1 mM Fe3+ dan Ni2+. Nilai Km dan Vmax xilanase pada substrat birchwood xilan berturut-turut yaitu 0.101 (mg/ml) dan 0.1796 (μM/menit/ml).
©Hak cipta milik IPB, tahun 2007
Hak cipta dilindungi UU
1.
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbera. Pengutipan hanya untuk kepentingan pendidikan,
penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah
b. Pengutipan tidak merugikan kepentingan yang wajar
IPB
2.
Dilarang mengumumkan dan memperbanyak sebagian atauPURIFIKASI DAN KARAKTERISASI
XILANASE EKSTRASELULER
Streptomyces sp. SKK1-8 ASAL SUKABUMI
NUNUK WIDHYASTUTI
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Biologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
HALAMAN PENGESAHAN
Judul : Purifikasi dan Karakterisasi Xilanase Ekstraseluler Streptomyces sp.SKK1-8 asal Sukabumi
Nama Mahasiswa : Nunuk Widhyastuti NIM : G351040101
Disetujui
Komisi Pembimbing
Dr. Anja Meryandini MS Ketua
Dr. Ir. Yulin Lestari Anggota
Diketahui
Ketua Program Studi Biologi Dekan Sekolah Pasca Sarjana
Dr. Ir. Dedy Duryadi S. DEA Prof. Dr. Ir. Khairil A. Notodiputro, MS
RIWAYAT HIDUP
Penulis dilahirkan di Madiun, Jawa Timur pada tanggal 28 Agustus 1964. Penulis merupakan anak kelima dari delapan bersaudara dari ayah yang bernama Arianto dan ibu Soetami.
Penulis menyelesaikan pendidikan sekolah menengah atas di SMU Negeri 1 Madiun pada tahun 1983. Pada tahun yang sama penulis diterima di jurusan Biologi Lingkungan, Fakultas Biologi, Universitas Gajah Mada, Yogyakarta. Penulis menyelesaikan studi strata 1 pada tahun 1988.
KATA PENGANTAR
Puji syukur penulis panjatkan kehadirat Allah SWT yang telah memberikan rahmat dan karuniaNya sehingga penelitian dan penulisan tesis dapat diselesaikan. Tesis dengan judul Purifikasi dan Karakterisasi Xilanase Streptomyces sp. SKK1-8 asal Sukabumi ini disusun sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada Program Studi Biologi, Sekolah pasca sarjana IPB.
Baik selama penelitian maupun penyusunan tesis, penulis banyak mendapat bantuan dari berbagai pihak. Tiada kata-kata yang dapat penulis sampaikan kecuali ucapan terima kasih yang sebesar-besarnya kepada:
1. Dr. Anja Meryandini M.S. selaku ketua komisi pembimbing yang telah berkenan memberikan bantuan dana penelitian dari Hibah Bersaing XIII 2006, bimbingan dan pengarahan selama penelitian dan penulisan tesis.
2. Dr. Ir.Yulin Lestari selaku anggota komisi pembimbing yang dengan penuh kesabaran dan ketelitian memberikan pengarahan dan saran sehingga penulisan tesis ini dapat diselesaikan.
3. Prof. Dr. Maggy T Suhartono selaku dosen penguji yang telah memberikan saran dalam penulisan tesis.
4. Dr. Hedy Julistiono, Kepala Bidang Mikrobiologi, Puslit Biologi-LIPI, dan Ir. Tatik Khusniati MApp.Sc, penanggung jawab Laboratorium Biokimia Mikroba yang telah memberikan ijin kepada penulis untuk menggunakan fasilitas di Laboratorium Biokimia Mikroba.
5. Suami dan anak-anakku tercinta yang selalu menumbuhkan semangat dan inspirasi, memberikan doa dan pengertian selama penulis menjalani studi. 6. Temanku Prima Agung Nugroho yang memberi dukungan referensi, Niken
7. Teman-teman di Laboratorium Biokimia khususnya ibu Kasirah dan Ninu serta teman-teman di Laboratorium Mikrobiologi yang telah membantu selama penelitian.
8. Semua pihak yang telah membantu penulis yang tidak dapat disebutkan satu persatu.
Penulis menyadari sepenuhnya bahwa hasil penelitian ini masih jauh dari sempurna, untuk itu saran dari semua pihak sangat diperlukan. Akhir kata semoga hasil penelitian ini dapat bermanfaat bagi yang berkepentingan.
Bogor, Agustus 2007
DAFTAR ISI
Halaman DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xiii
I PENDAHULUAN
1.1 Latar Belakang ... 1 1.2 Tujuan Penelitian ... 3 1.3 Hipotesa ... 3
II TINJAUAN PUSTAKA
2.1 Xilan dan Pemanfaatannya ... 4 2.2 Enzim Xilanolitik ... 7 2.2.1 Mikroba Penghasil Xilanase ... 8 2.2.2 Aplikasi Xilanase ... 10 2.3 Pemurnian Xilanase ... 12 2.3.1 Filtrasi Gel ... 13 2.3.2 Kromatografi Pertukaran Ion ... 16 2.3.3 Elektroforesis ... 19 2.4 Streptomyces ... 20 2.4.1 Morfologi ... 20 2.4.2 Ekologi dan Fisiologi ... 21
III BAHAN DAN METODE
3.3.2 Pengujian Aktivitas Xilanase ... 24 3.3.3 Pengendapan Xilanase Menggunakan Amonium Sulfat dan
Aseton ... 25 3.3.4 Pemisahan Xilanase dengan Polimer Eudragit S100 ... 25 3.3.5 Pemurnian Xilanase ... 26 3.3.6 Penghitungan Berat Molekul Xilanase ... 27 3.3.7 Pengukuran Kadar Protein ... 28 3.3.8 Pengaruh pH dan Suhu Terhadap Aktivitas dan Stabilitas
Xilanase ... 28 3.3.9 Pengaruh Kation Terhadap Aktivitas Xilanase ... 29 3.3.10 Studi Kinetika Xilanase ... 29 3.3.11 Hidrolisis Substrat Spesifik ... 30
IV HASIL DAN PEMBAHASAN ... 31
V SIMPULAN DAN SARAN ... 54
DAFTAR PUSTAKA ... 56
DAFTAR TABEL
Halaman 1 Teknik pemurnian xilanase beberapa Streptomyces... 13 2 Aktivitas xilanase hasil pemisahan dengan eudragit S100 ... 33 3 Tahap permurnian xilanase Streptomyces sp SKK1-8 ……….. 37 4 Aktivitas hidrolisis substrat spesifik oleh xilanase... 41 5 Jumlah amonium sulfat yang ditambahkan ke dalam 1 liter larutan
DAFTAR GAMBAR
Halaman 1 Struktur xilan dengan residu pengganti dan letak ikatan yang dipecah
oleh enzim xilanolitik... 5 2 Pemurnian enzim dengan filtrasi gel ………... 14 3 Pemurnian enzim dengan kromatografi pertukaran ion ... 17 4 Aktivitas xilanase yang diendapkan dengan amonium sulfat pada
berbagai konsentrasi ... 31 5 Aktivitas xilanase yang diendapkan dengan aseton pada berbagai
konsentrasi ... 32 6 Profil elusi filtrasi gel dengan matrik sephadex G-100 dari
xilanase ... 34 7 Profil elusi kromatografi pertukaran ion dengan matrik DEAE-sephadex
DAFTAR LAMPIRAN
I PENDAHULUAN
1.1 Latar Belakang
Hemiselulosa merupakan heteropolimer polisakarida yang keberadaaannya di alam kedua terbanyak setelah selulosa. Kandungan hemiselulosa pada tanaman berkisar antara 20-30% berat kering kayu (Kulkarni et al. 1999), sedangkan pada daun kadarnya mencapai 80-85% (Howard et al. 2003). Keberadaan hemiselulosa yang melimpah di alam dan sifatnya yang dapat diperbaharui memungkinkan pemanfaatan hemiselulosa sebagai bahan baku untuk diolah menjadi produk yang bernilai ekonomis. Xilooligosakarida yang merupakan produk hidrolisis xilan oleh xilanase dilaporkan dapat menghambat pertumbuhan sel tumor, memiliki aktivitas antibakteri, anti inflamasi, meningkatkan sistem imun (Christakopoulos et al. 2003) dan berpotensi untuk digunakan sebagai prebiotik (Hsu et al. 2004).
Xilan adalah komponen utama hemiselulosa yang memiliki tulang punggung rantai D-xilopiranosa dengan ikatan glikosidik β-1,4. Xilan memiliki residu O-asetil, arabinosil dan 4-O-metil-D-asam glukoronat yang terikat pada tulang punggungnya. Hidrolisa lengkap xilan menjadi monomernya memerlukan kerja sinergi beberapa enzim xilanolitik (Subramaniyan & Prema 2002).
Enzim xilanolitik merupakan enzim kompleks yang terdiri atas 1,4-β -endoxilanase, β-xilosidase, α-L-arabinofuranosidase, α-glukuronidase, asetil xilan esterase dan asam fenolat (asam ferulat dan asam fumarat) esterase (Collins 2005). Xilanase mikroba memiliki aplikasi yang luas. Enzim ini dapat digunakan untuk
biobleaching pada industri kertas, penjernihan dan meningkatkan aroma juice dan wine, meningkatkan kualitas roti dan pakan ternak, pengolahan limbah serta pengomposan.
Xilanase dihasilkan oleh bakteri, cendawan dan khamir. Salah satu kelompok bakteri yang berpotensi menghasilkan xilanase yaitu Aktinomisetes, terutama genus
SKK1-8) dilaporkan berpotensi menghasilkan xilanase ekstraseluler dengan karakter yang berbeda (Hendarwin 2006).
Karakter xilanase yang dihasilkan mikroba sangat bervariasi. Xilanase bakteri biasanya bersifat netral sampai alkali sedangkan xilanase cendawan bersifat asam. Pada umumnya suhu optimal xilanase antara 40-60 oC, namun xilanase beberapa mikroba diketahui bersifat thermostabil (Perez et al. 2002). Studi mengenai karakter xilanase diperlukan untuk mengetahui aplikasinya pada industri yang sesuai, misalnya xilanase yang digunakan dalam proses bleaching pada industri pulp harus memiliki pH optimum alkali dan stabil pada pH tersebut, bersifat thermostabil dan tidak terkontaminasi selulase.
Penelitian ini merupakan lanjutan dari penelitian terdahulu oleh Meryandini et al. (2006) yang melakukan karakterisasi xilanase Streptomyces sp. SKK1-8 fraksi aseton dan analisa produk hidrolisisnya. Xilanase tersebut memiliki karakter yang menarik sehingga dirasa perlu untuk dilakukan pemurnian. Karakter xilanase tersebut yaitu optimum pada suhu 50 oC, memiliki aktivitas pada rentang pH yang luas, stabil pada penyimpanan selama 1 bulan dalam refrigerator dan bebas dari selulase. Xilosa dan arabinosa merupakan produk hidrolisis birchwood xilan oleh xilanase. Hasil SDS-PAGE dan zimogram menunjukkan adanya tiga pita xilanase yang berdekatan dengan berat molekul 16.80 kDa, 15.21 kDa dan 13.86 kDa.
Pada umumnya pemurnian xilanase dilakukan dengan teknik filtrasi gel dan kromatografi pertukaran ion. Dewasa ini, polimer eudragit S100 digunakan dalam tahap awal pemurnian. Polimer tersebut memiliki kelarutan yang dipengaruhi oleh pH larutan, yaitu larut diatas pH 5.5 dan mengendap di bawah pH tersebut (Sardar et al. 1997).
1.2 Tujuan penelitian
Penelitian ini bertujuan untuk memurnikan xilanase Streptomyces sp. SKK1-8 asal Sukabumi dan mengetahui karakternya.
1.3 Hipotesa
1 Xilanase Streptomyces sp SKK1-8 dapat dimurnikan melalui tahap pengendapan, filtrasi gel dengan matrik Sephadex G-100 dan kromatografi pertukaran ion dengan matrik DEAE-Sephadex A-50.
II TINJAUAN PUSTAKA
2.1 Xilan dan Pemanfaatannya
Lignoselulosa merupakan komponen struktural utama tanaman dan merupakan sumber bahan organik yang dapat diperbaharui (Howard et al. 2003). Selulose bersama-sama dengan hemiselulosa dan lignin merupakan komponen utama penyusun kayu yang berikatan sangat kuat melalui ikatan kovalen dan ikatan silang nonkovalen. Komposisi dan persentase kandungan masing-masing komponen pada kayu bervariasi pada berbagai tanaman, tergantung dari umur, tahap pertumbuhan tanaman serta kondisi lainnya.
Hemiselulosa merupakan bahan organik terbanyak kedua di alam setelah selulosa (Collins et al. 2005). Hemiselulosa memiliki berat molekul lebih rendah dari selulosa dan lebih mudah dihidrolisa. Kandungan hemiselulosa pada tanaman berkisar antara 20-30% berat kering kayu (Kulkarni et al. 1999; Subramaniyan & Prema 2002). Hemiselulosa mengandung xilosa, manosa, galaktosa, D-glukosa, L-arabinosa, 4,O-metil-glukoronat, D-galakturonat dan asam D-glukoronat. Gula-gula tersebut dihubungkan dengan ikatan glikosidik β-1,4 dan kadang-kadang ikatan glikosidik β-1,3 (Howard et al. 2003).
kayu keras dan sereal terasilasi sedangkan pada kayu lunak tidak. Pada xilan sereal, residu samping arabinofuranosil juga teresterifikasi oleh gugus fenolat seperti asam
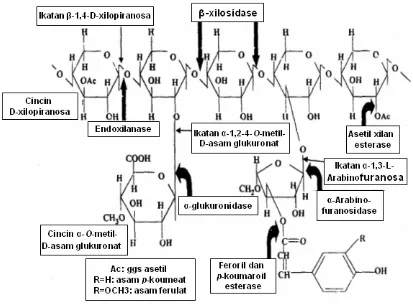
[image:32.612.114.527.223.528.2]p-koumerat dan asam ferulat (Ryan et al. 2003). Diperlukan kerja yang sinergi dari beberapa enzim xilanolitik untuk mendegradasi xilan secara lengkap menjadi monomernya. Struktur xilan dengan residu pengganti dan letak ikatan yang dipecah oleh enzim xilanolitik diperlihatkan dalam Gambar 1.
Gambar 1 Struktur xilan dengan residu pengganti dan letak ikatan yang dipecah oleh enzim xilanolitik (Beg et al. 2001).
esparto, tangkai tanaman tembakau dan kulit biji guar. Xilan dengan ikatan glikosidik
β-1,3 pada tulang punggungnya ditemukan pada ganggang laut, sedangkan campuran ikatan glikosidik β-1,3 dan β-1,4 terdapat pada rumput laut (Beg et al. 2001).
Limbah yang mengandung hemiselulosa terdapat melimpah di alam dan dihasilkan dari berbagai aktivitas, seperti pertanian, kehutanan termasuk industri penebangan kayu, industri kertas dan agroindustri lain. Sampai saat ini sebagian limbah hemiselulosa dimanfaatkan untuk pakan ternak, kompos dan kertas daur ulang, sedang sebagian besar lainnya masih belum dimanfaatkan secara optimal padahal berpotensi untuk diolah menjadi berbagai produk yang lebih memiliki nilai ekonomis. Biokonversi bahan berlignoselulosa menjadi etanol yang dapat digunakan sebagai bahan bakar dan menjadi produk kimia lain telah mendapat perhatian yang besar.
Xilosa sebagai hasil akhir degradasi xilan secara enzimatis dapat dirubah menjadi derivatnya, xilitol dan furfural. Xilitol digunakan sebagai pemanis pada industri makanan dan diaplikasikan dalam bidang odontologi sebagai pengeras gigi, remineralisasi dan agen antimikroba. Xilitol dapat ditambahkan pada formula pasta gigi dan permen karet. Furfural digunakan pada industri plastik furfural fenol, minyak vernis dan pestisida. Lebih dari 200.000 ton furfural dihasilkan pertahunnya dengan harga $1700 perton (Howard et al. 2003). Xilooligosakarida diketahui memiliki efek memicu pertumbuhan Bifidobakteria, mensuplai asam lemak rantai pendek dan menurunkan pH kolon sehingga dapat digunakan sebagai prebiotik (Hsu et al. 2004). Beberapa senyawa xilooligosakarida juga dilaporkan merupakan senyawa aktif yang berpotensi untuk diaplikasikan dalam bidang farmasi (Christakopoulos et al. 2003), yaitu:
- xilan yang mengandung asam glukoronat dapat menghambat pertumbuhan sarkoma-180 dan sel tumor.
- Arabino-(glukurono)xilan memiliki efek meningkatkan sistem imun
- 4-O-metilglukuronoxilan dan heteroxilan yang memiliki rantai samping banyak memiliki aktivitas antiinflamasi
2.2 Enzim Xilanolitik
Berdasarkan sifat fisikokimianya, Wong et al. (1988) membagi xilanase menjadi 2 kelompok, yaitu: xilanase yang memiliki BM rendah (<30 kDa) dengan titik isoelektrik (pI) basa dan xilanase yang memiliki BM tinggi (>30 kDa) dengan pI asam. Namun demikian, 30% xilanase yang teridentifikasi (terutama xilanase cendawan) tidak dapat diklasifikasikan dengan sistem tersebut (Collins et al. 2005). Sistem klasifikasi berdasarkan perbandingan struktur primer domain katalitik secara umum mengelompokkan enzim-enzim glikosida hidrolase ke dalam famili-famili. Sampai saat ini terdapat 96 famili. Kebanyakan xilanase masuk dalam famili 10 dan 11, namun demikian beberapa enzim yang memiliki aktivitas xilanase juga terdapat dalam famili 5, 7, 8, 16, 26, 43, 52 dan 62. Pengamatan sekuen lebih mendalam menunjukkan bahwa sekuen yang dimasukkan ke dalam famili 5, 7, 8, 10, 11 dan 43 hanya memiliki domain katalitik endo-1,4-β-xilanase, sedangkan sekuen famili 16, 52 dan 62 merupakan enzim bifungsional yang memiliki 2 katalitik domain dimana salah satunya adalah katalitik domain dari famili 10 atau 11. Klasifikasi enzim hidrolase secara lengkap dapat diakses di http://afmb.cnrs-mrs.fr/~cazy/CAZY/.
Enzim xilanolitik terdiri atas 1,4-β-endoxilanase, β-xilosidase, α -L-arabinofuranosidase, α-D-glukuronidase, asetil xilan esterase dan asam fenolat (asam ferulat dan asam koumarat) esterase (Collins et al. 2005). Enzim 1,4-β- endoxilanase (1,4-β-xilan xilanohidrolase, EC 3.2.1.8) menghidrolisa secara acak rantai xilan dari bagian dalam menghasilkan xilooligosakarida dan xilosa. Endoxilanase terutama dihasilkan oleh mikroba, meskipun beberapa tanaman dan hewan juga dilaporkan dapat menghasilkan enzim ini (Subramaniyan & Prema 2002).
Ekso1,4-β-xilosidase (1,4-β-D-xilan xilanohidrolase, E.C3.2.1.37) menghidrolisa 1,4-β-D-xilooligosakarida dan xilobiosa secara berturut-turut dari ujung nonreduksi menghasilkan D-xilosa. Endoxilanase dilaporkan tidak dapat menghidrolisis selobiose sedangkan β-xilosidase dapat. Bacillus sp. dan cendawan diketahui dapat menghasilkan β-xilosidase intraseluler (Collins et al. 2005).
baik cendawan, Aktinomisetes dan bakteri dilaporkan dapat menghasilkan α -arabinofuranosidase. Bakteri yang bersifat extrem termofilik, Rhodothermus marinus, diketahui dapat menghasilkan α-L-arabinofuranosidase. Bacillus polymixa
menghasilkan 2 macam polipeptida berbeda yang memiliki aktivitas α -L-arabinofuranosidase (Subramaniyan & Prema 2002).
Alfa-D-glukuronidase (E.C 3.2.1.1) hidrolisa ikatan glikosidik α-1,2 antara xilosa dan asam D-glukuronat atau ikatan 4-O-metil eter. Ikatan glikosidik α-1,2 bersifat sangat stabil dan sulit dipecahkan oleh xilanase, demikian juga ikatan 4,O -metil-asam glukuronat yang merupakan penghalang pada proses degradasi kayu secara enzimatis. Beberapa mikroba dilaporkan dapat menghasilkan α-glukuronidase (Subramaniyan & Prema 2002).
Hidrolisa lengkap glukurunoxilan memerlukan esterase untuk memotong ikatan asam asetat dan asam fenolat. Asetil xilan esterase (EC3.1.1.6) memotong ikatan xilosa dengan asam asetat, feruloil esterase memotong ikatan samping residu arabinosa dengan asam ferulat dan p-koumaroil esterase memotong ikatan samping residu arabinosa dengan asam p-koumaroat. Pemotongan gugus asetil, feruloil dan koumaroil dari xilan sangat membantu dalam penghilangan lignin pada proses
bleaching. Hidrolisa ikatan ester antara lignin dan hemiselulosa dapat meningkatkan kelarutan lignin. Bila digunakan bersama dengan xilanase dan enzim pendegradasi xilan lain dalam proses bleaching, maka esterase dapat mengganggu dan melemahkan struktur dinding sel (Subramaniyan & Prema 2002).
2.2.1 Mikroba Penghasil Xilanase
Berbagai mikroba dilaporkan mampu menghasilkan xilanase. Bakteri dari genus Bacillus, cendawan dari genus Trichoderma dan Aspergillus, Aktinomisetes dari genus Streptomyces diketahui merupakan mikroba berpotensi penghasil xilanase. Mikroba tersebut memiliki relung ekologi yang bervariasi dan tersebar luas (Collins
Bacillus SSP-34 yang ditumbuhkan pada medium dengan kandungan nitrogen optimal dapat menghasilkan xilanase yang memiliki aktivitas tinggi dengan sedikit aktivitas selulase. Pada kondisi media optimum dihasilkan xilanase dengan aktivitas sebesar 506 IU/ml. Pada medium yang mengandung sumber nitrogen terseleksi (kombinasi ekstrak khamir dan pepton) terdeteksi adanya protease dengan aktivitas yang rendah pada larutan ekstrak kasar xilanase. Bakteri lainnya seperti Bacillus circulans, B. amylolequefaciens, B. firmus, Bacillus sp, Cellulomonas flavigena, Streptomyces cuspidosporus, Streptomyces sp QG-11-3, S. roseiscleroticus NRRL-B-11019, Aeromonas caviae, juga merupakan penghasil xilanase. Bacillus spp.,
Rhodotermus marinus, Caldocellum saccharolyticum, Dictyoglomus sp. dilaporkan memproduksi xilanase alkali yang bersifat termostabil dengan aktivitas dan karakter yang bervariasi (Subramaniyan & Prema 2002). Bakteri dan Aktinomisetes asal Indonesia juga dilaporkan berpotensi sebagai penghasil xilanase. Bacillus thermoleovorans IT-08 menghasilkan β-xilosidase dan α-L-arabinofuranosidase yang bersifat termostabil dengan suhu optimum 70 oC (Puspaningsih 2004). Xilanase B.
licheniformis relatif stabil pada suhu 90 oC, pH 7.0-9.0 selama 30 menit (Nareswari 2006). Streptomyces spp. menghasilkan β-xilosidase dan α-L-arabinofuranosidase dengan suhu optimum 50-90 oC (Hendarwin 2006).
Xilanase cendawan pada umumnya memiliki aktivitas pada rentang pH yang lebih rendah dibandingkan xilanase bakteri dengan aktivitas optimum pada pH 5 dan stabil pada pH 3-8. Trichoderma viride, T. Reesei dan Schizophillum commune dapat menghasilkan xilanase dengan aktivitas tinggi, yaitu berturut-turut sebesar 118.1 IU/ml, 960 IU/ml dan 1244 IU/ml. Namun demikian, pada kebanyakan larutan xilanase cendawan terdeteksi adanya aktivitas selulase yang signifikan sehingga tidak dapat diaplikasikan pada industri kertas. Xilanase Thermomyces lanuginosus
dilaporkan hanya sedikit terkontaminasi oleh selulase yang aktivitasnya dapat diabaikan (Subramaniyan & Prema 2002).
kesamaan pada biologi molekuler dan biokimia dari xilanase mikroba prokariotik dan eukariotik (Subramaniyan & Prema 2002).
2.2.2 Aplikasi Xilanase
Menurut Beg et al. (2001), saat ini enzim xilanolitik mendapat perhatian terutama karena memiliki potensi yang besar untuk diaplikasikan pada berbagai industri. Beberapa aplikasi xilanase diantaranya adalah :
1 Penggunaan xilanase dalam proses prebleaching pulp dapat meningkatkan fibrilasi dan penyerapan air, mengurangi waktu pengadukan pulp, perbaikan pengikatan dan meningkatkan freeness pada serat yang didaur ulang, penghilangan secara selektif xilan dari pulp yang terlarut. Xilanase juga dapat digunakan untuk menghasilkan selulosa dari pulp terlarut pada produksi rayon dan biobleaching
pulp kayu. Proses penghilangan lignin dari pulp untuk menghasilkan kertas yang lebih bersih dan putih biasanya dilakukan secara kimiawi dengan penambahan senyawa klorin pada proses bleaching. Senyawa klorin dari limbah industri pulp dan kertas ini jika masuk ke dalam lingkungan dapat mengklorinasi senyawa organik dan merubahnya menjadi senyawa yang bersifat toksik, mutagenik, persisten, mengalami biomagnifikasi dan dapat mengakibatkan ketidakseimbangan yang berbahaya terhadap sistem biologi di lingkungan. Oleh karena itu proses biobleaching yang menggunakan enzim sangat disarankan dalam industri pulp dan kertas untuk mengurangi tingkat pencemaran lingkungan dan mendapatkan kertas yang lebih putih dan bersih. Selain itu, penggunaan enzim lignolitik dan hemiselulolitik pada proses biobleaching lebih ekonomis dan efisien jika dibandingkan dengan metode lain, misalnya penggunaan oksigen untuk delignifikasi, memperpanjang pemasakan atau penggunaan klorin dioksida dan ozon untuk mengurangi penggunaan klorin. Xilanase yang digunakan pada proses bleaching harus bebas selulase, memiliki aktivitas pada pH alkali dan termostabil.
3 Pada industri roti, xilanase digunakan untuk meningkatkan tekstur, volume dan daya tahan roti (Howard et al. 2003). Xilanase Aspergillus niger var awamori
yang ditambahkan ke dalam adonan roti menghasilkan kenaikan volume spesifik roti. Amilase dan xilanase yang digunakan secara bersama-sama akan meningkatkan kualitas roti.
4 Xilanase dimanfaatkan untuk menjernihkan sari buah, ekstraksi kopi, minyak nabati dan pati, likuifikasi buah dan sayuran, meningkatkan kemampuan daya cerna tanaman pakan ternak dan membantu pengomposan. Pada proses tersebut xilanase digunakan bersama dengan selulase dan pektinase.
5 Xilanase bersama dengan enzim lain, seperti mananase, ligninase, xiloxidase, glukanase, glukosidase dan lain-lain dapat digunakan untuk menghasilkan bahan bakar etanol dari bahan berlignoselulosa. Proses produksi bahan bakar etanol memerlukan delignifikasi lignoselulosa untuk melepaskan selulosa dan hemiselulosa dari kompleks lignin yang diikuti dengan depolimerisasi polimer karbohidrat (selulosa dan hemiselulosa) untuk menghasilkan gula, kemudian dilanjutkan dengan proses fermentasi campuran pentosa dan heksosa untuk menghasilkan etanol.
6 Alfa-L-Arabinofuranosidase dan β-D-glukopiranosidase digunakan dalam pengolahan makanan untuk memberi aroma pada anggur dan sari buah.
7 Xilanase digunakan untuk meningkatkan maserasi dinding sel pada pembuatan protoplast tanaman.
2.3 Pemurnian Xilanase
(amonium sulfat, sodium sulfat, sodium fosfat dsb) atau pelarut organik (metanol, etanol, propanol, aseton). Penambahan garam netral amonium sulfat ke dalam larutan enzim merupakan cara yang paling sering digunakan untuk pengendapan protein. Hal ini dikarenakan amonium sulfat bersifat mudah larut air, tidak merusak enzim, harganya murah dan dapat mencegah kontaminasi mikroba bila hasil endapan disimpan dalam waktu lama (Harris 1989).
Penggunaan polimer Eudragit S100 pada tahap awal pemurnian juga telah dikembangkan. Eudragit S100 merupakan polimer asam metakrilat dan metilmetakrilat yang dapat mengalami perubahan kelarutan tergantung dari pH larutan. Pada kondisi di atas pH 5.5 eudragit S100 bersifat larut sedangkan di atas pH tersebut akan mengendap. Sifat tersebut memungkinkan polimer eudragit untuk digunakan dalam pemisahan protein maupun digunakan sebagai matriks larut untuk imobilisasi enzim. Besarnya pemulihan (recovery) enzim yang dipisahkan dengan eudragit tergantung dari konsentrasi polimer pada waktu pengendapan (Sardar et al. 1997).
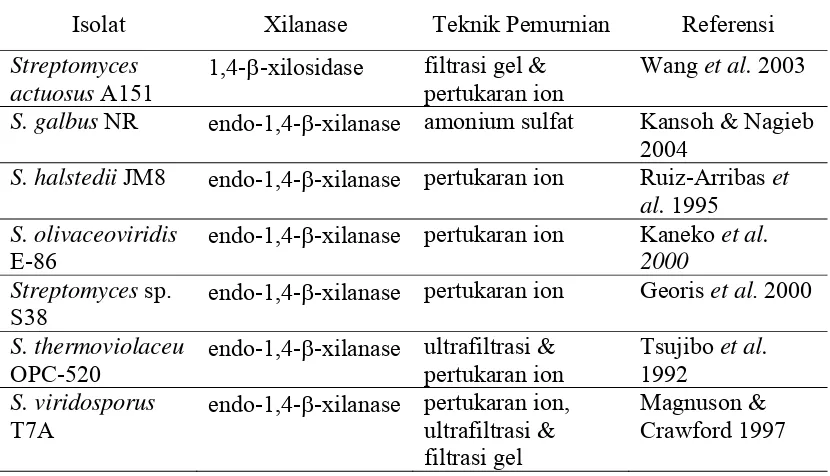
Tabel 1 Teknik pemurnian xilanase beberapa Streptomyces
Isolat Xilanase Teknik Pemurnian Referensi
Streptomyces actuosus A151
1,4-β-xilosidase filtrasi gel & pertukaran ion
Wang et al. 2003
S. galbus NR endo-1,4-β-xilanase amonium sulfat Kansoh & Nagieb 2004
S. halstedii JM8 endo-1,4-β-xilanase pertukaran ion Ruiz-Arribas et al. 1995
S. olivaceoviridis
E-86
endo-1,4-β-xilanase pertukaran ion Kaneko et al. 2000
Streptomyces sp. S38
endo-1,4-β-xilanase pertukaran ion Georis et al. 2000
S. thermoviolaceu
OPC-520
endo-1,4-β-xilanase ultrafiltrasi & pertukaran ion
Tsujibo et al.
1992
S. viridosporus
T7A
endo-1,4-β-xilanase pertukaran ion, ultrafiltrasi & filtrasi gel
Magnuson & Crawford 1997
2.3.1 Filtrasi Gel
.
Gambar 2 Pemurnian enzim dengan filtrasi gel.
http://fig.cox.miami.edu/~cmallery/255/255tech/mcb3.34a.gel.jpg.
Beberapa matrik yang digunakan dalam filtrasi gel adalah dekstran, akrilamid, agarosa dan polistiren. Beberapa istilah juga digunakan untuk gel dari polimer yang berbeda, misalnya Sephadex (gel dekstran), superose (gel agarosa), bio-gel (gel akrilamida), superdex (gel agarosa/ dekstran), sephacryl (dekstran/bis-akrilamida) dan sebagainya (Hedlund 2004). Sephadex bersifat tahan terhadap garam atau basa pada konsentrasi tinggi, tetapi rusak oleh asam (dibawah pH 2) dan oksidator kuat. Contoh Sephadex adalah Sephadex G-25, Sephadex G-50, Sephadex G-75 dan Sephadex G-100. Huruf G menunjukkan bahwa Sephadex tersebut dikembangkan dengan air sedangkan nomor dibelakangnya menunjukkan besarnya pengembangan tersebut, misalnya 20 kali, 50 kali dan sebagainya (Suhartono 1989).
Beberapa faktor yang mempengaruhi resolusi protein yang dielusi adalah: ukuran partikel matrik, kecepatan aliran, panjang kolom, volume dan viskositas sampel. Semakin kecil ukuran partikel maka resolusi semakin baik dan waktu pemisahan dapat dipersingkat karena kecepatan aliran dapat ditingkatkan tanpa mengurangi resolusi. Kecepatan aliran merupakan parameter penting karena filtrasi gel berdasar pada kesetimbangan antara fase mobil dan stasioner. Kecepatan aliran yang terlalu tinggi menyebabkan kesetimbangan tidak tercapai sehingga menghasilkan puncak yang meluas, khususnya untuk molekul besar. Aliran yang terlalu lambat tidak sesuai untuk molekul kecil karena difusi aksial kolom tidak dapat diabaikan lagi. Panjang kolom berpengaruh pada resolusi, semakin panjang kolom resolusi semakin baik. Volume sampel berpengaruh pada efisiensi pemisahan. Matrik yang memiliki partikel berukuran kecil lebih sensitif terhadap perubahan volume sampel dibanding partikel berukuran besar. Biasanya digunakan 0.5% dan 2-5% volume kolom untuk partikel matrik berukuran 10 μm dan 100 μm berturut-turut. Volume sampel dapat ditingkatkan sampai 30% untuk proses penghilangan garam (desalting). Sampel yang memiliki viskositas jauh lebih tinggi dari eluen akan membentuk zona sampel yang tidak stabil dan akan dengan cepat menyebar dan miring (asimetris). Guna mendapatkan hasil optimum, konsentrasi sampel yang disarankan yaitu 70 mg/ml (Hedlund 2004).
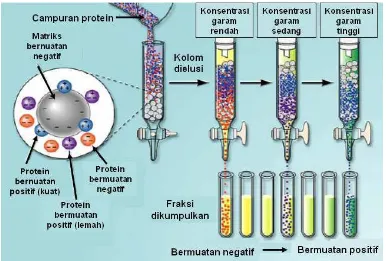
2.3.2 Kromatografi Pertukaran Ion
Kromatografi pertukaran ion memisahkan protein berdasarkan pada muatan bersih protein dan pada kekuatan relatif dari muatan bersih protein tersebut. Kromatografi pertukaran ion memerlukan fase diam yang biasanya merupakan polimer terhidratasi yang bersifat tidak larut seperti selulosa, dekstran dan agarosa. Gugus penukar ion diimobilisasikan pada matrik. Beberapa gugus penukar anion yaitu aminoetil (AE-) kuaternari aminoetil (QAE-) dan dietilaminoetil (DEAE-), sedangkan gugus penukar kation yaitu sulfopropil (SP-), metil sulfonat dan karboksimetil (CM-). Penukar ion lemah hanya dapat mempertahankan kondisi terionisasi pada rentang pH sempit dan kehilangan muatannya pada pH tertentu, sedangkan penukar ion kuat dapat mempertahankan kondisi terionisasi pada rentang pH yang luas. Misalnya gugus penukar anion lemah DEAE- terionisasi sempurna dibawah pH 6.0 dan akan kehilangan muatannya pada pH 9.0. Gugus penukar kation lemah CM- akan kehilangan muatannya dibawah pH 4.5. Gugus penukar ion kuat Q (penukar anion kuat) dan SP- (penukar kation kuat) dapat mempertahankan kondisi terionisasi pada rentang pH 1 - 10 (Coligan et al. 2003).
kromatrografi pertukaran ion ditunjukkan dalam Gambar 3 (http://voh.chem.ucla.edu/vohtar/winter99/153L/lec1.html).
Gambar 3 Pemurnian enzim dengan kromatrografi pertukaran ion. http://voh.chem.ucla.edu/vohtar/winter99/153L/lec1.html.
Kolom untuk kromatografi pertukaran ion biasanya tidak panjang dan memiliki diameter lebih besar dari pada kolom untuk filtrasi gel. Banyaknya sampel yang dimasukkan umumnya sekitar 10-20% dari kapasitas kolom. Pembilasan dengan gradien konsentrasi NaCl yang linier baik digunakan untuk memisahkan molekul-molekul yang memiliki perbedaan muatan bersih yang tidak terlalu besar sedangkan gradien konsentrasi NaCl bertahap baik digunakan untuk memisahkan molekul-molekul yang memiliki perbedaan muatan bersih yang besar.
Apabila protein stabil pada pH diatas titik isoelektriknya (pI) maka digunakan penukar anion (positif), tetapi bila protein stabil pada pH dibawah pI nya maka digunakan penukar kation (negatif). Jika protein stabil pada rentang 1 unit diatas dan dibawah pI maka kedua penukar ion dapat digunakan.
Matrik yang mengikat gugus fungsional menentukan sifat aliran, ion yang dapat diikat, stabilitas mekanik dan kimia. Ada 3 kelompok matrik yang biasanya digunakan, yaitu : 1. polistiren, poliakrilik atau polifenol; 2. selulosa; dan 3. dekstran (Sephadex) atau agarosa (sepharose). Matrik polistiren dan polifenolik lebih sering digunakan untuk memisahkan molekul-molekul kecil seperti asam-asam amino, peptida kecil, nukleotida, nukleotida siklik, asam-asam organik. Matrik selulosa biasanya digunakan untuk memisahkan protein (termasuk enzim), polisakarida dan asam nukleat. DEAE-selulosa, CM-selulosa dan fosfoselulosa paling sering digunakan. Matrik polidekstran dan agarosa (misalnya DEAE-Sephadex, CM-Sephadex) digunakan untuk memisahkan protein, hormon, tRNA dan polisakarida. Pada pemurnian xilanase, matrik selulosa biasanya tidak digunakan karena beberapa xilanase tertentu memiliki cellulose binding domain (Subramaniyan & Prema 2002) yang akan berinteraksi pada proses elusi normal.
Pemilihan penukar ion kuat atau lemah tergantung pada pH molekul target. Molekul yang memerlukan pH sangat rendah atau sangat tinggi untuk dapat berionisasi atau apabila molekul stabil pada pH ekstrim maka penukar ion kuat harus digunakan. Penukar ion lemah akan memberikan hasil pemisahan yang lebih baik untuk protein-protein yang memiliki muatan bersih yang berdekatan. Keuntungan kromatografi penukar ion diantaranya adalah tidak merusak protein yang dimurnikan dan pada umumnya memiliki kapasitas pengikatan yang tinggi. Kelemahannya adalah protein-protein yang memiliki distribusi gugus bermuatan pada permukaannya atau memiliki pI yang sama atau mirip akan sulit dipisahkan dengan cara kromatografi penukar ion. Selain itu larutan enzim hasil kromatografi penukar ion mengandung kadar garam cukup tinggi yang harus dihilangkan untuk proses pemurnian selanjutnya (http://www.chem.purdue.edu/chm333/
2.3.3 Elektroforesis
Elektroforesis adalah suatu cara untuk memisahkan fraksi-fraksi suatu campuran berdasarkan atas pergerakan partikel koloid yang bermuatan dibawah pengaruh medan listrik. Protein enzim di dalam larutan akan bermuatan bergantung pada pH larutan dan pI enzim. Pada titik isoelektriknya, protein enzim tidak akan bergerak dibawah medan listrik. Pada keadaan pH di bawah pI, protein bergerak sebagai kation menuju elektroda negatif dan kecepatannya naik dengan turunnya pH. Pada keadaan pH di atas pI, protein bergerak sebagai anion menuju elektroda positif dan kecepatannya naik dengan naiknya pH (Suhartono 1989).
2.4 Streptomyces
Berdasarkan analisis gen 16S rRNA, Aktinomisetes diklasifikasikan dalam domain Bacteria, filum Actinobacteria, kelas Schizomycetes, dan ordo
Actinomycetales (Hayakawa, 2003). Aktinomisetes adalah mikroba uniseluler yang dikelompokkan ke dalam bakteri Gram positif dengan DNA yang kaya kandungan G + C, yaitu sekitar 57-75% (Lo et al. 2002). Sampai saat ini, Genus Streptomyces
merupakan satu-satunya anggota dari famili Streptomycetaceae.
Aktinomisetes, terutama dari genus Streptomyces, mendapat perhatian yang besar dan banyak diteliti karena kemampuannya menghasilkan berbagai senyawa metabolit yang memiliki nilai penting, diantaranya yaitu antibiotik, enzim, inhibitor enzim, biopigmen dan imunomodifier. Enzim yang dihasilkan oleh Streptomyces
diantaranya yaitu selulase (Al-Tai et al. 1998),xilanase (Beg et al. 2001) dan kitinase (Hoster et al. 2005). Streptomyces sp. telah digunakan sebagai penghasil kitinase komersial oleh Sigma Chemical Co. dari Amerika Serikat (Felse & Panda 1999).
Streptomyces asal Indonesia dilaporkan berpotensi sebagai penghasil amilase dan protease (Amri 2004), mananase (Ambarwati 2005) dan xilanase (Hendarwin 2006).
2
2..44..11 MMoorrffoollooggii
Diantara prokariotik yang lain, Aktinomisetes menunjukkan diferensiasi morfologi yang unik dalam siklus hidupnya. Mula-mula spora berkecambah membentuk miselium vegetatif yang kemudian bercabang membentuk hifa yang masuk ke dalam medium. Hifa aerial akan terbentuk pada permukaan medium dan mengalami fragmentasi menghasilkan spora. Morfologi Aktinomisetes dan cendawan mempunyai kemiripan, antara lain bentuk koloni, tumbuhnya miselium dan adanya spora. Namun demikian, Aktinomisetes dan cendawan adalah dua kelompok organisme yang berbeda. Aktinomisetes termasuk kelompok prokariot, sedangkan cendawan termasuk kelompok eukariot. Meskipun bentuknya mirip, tetapi miselium cendawan lebih tebal daripada miselium Aktinomisetes (Miyadoh 2003).
tumbuh akar di dalam medium agar-agar, berbeda dengan bakteri lain yang koloninya lunak di atas medium agar-agar. Bentuk koloni Aktinomisetes bulat dengan elevasi timbul dan cembung, tepian rata dan tidak beraturan serta permukaan bertepung, licin, kasar atau keriput. Keistimewaan bentuk koloni Aktinomisetes yang lain adalah hifanya bersifat hidrofobik, tetapi miselium vegetatifnya bersifat hidrofilik (Miyadoh 2003).
Guna memudahkan identifikasi, Aktinomisetes dikelompokkan menjadi 2 yaitu
Streptomyces dan non-Streptomyces. Kedua kelompok tersebut dapat dengan mudah dibedakan dengan pengamatan morfologi dan analisis komponen dinding sel asam diaminopimelat (A2pm atau DAP). Pengamatan yang penting dilakukan adalah ada tidaknya hifa, miselium, spora, rantai spora atau kantong spora (sporangium). Pada umumnya genus Streptomyces tumbuh subur, membentuk banyak sekali hifa bercabang, miselium substrat jarang yang bersekat, umumnya miselium aerial cepat matang membentuk spora dari pucuk belahannya dan membentuk rantai spora panjang (lebih dari 50 spora) yang menggulung atau heliks. Beberapa spesies memiliki rantai spora yang pendek (kurang dari 10 spora). Kondisi biakan yang bervariasi dan bermacam-macam warna hifa, miselium, pigmen serta penggunaan berbagai karbohidrat, model sporulasi (vertisilata atau tidak), morfologi rantai spora (lurus sampai lentur, melengkung, berputar atau spiral) dan permukaan spora (halus, berbintil-bintil, berduri, berambut, rugose atau knobby) digunakan untuk standar taksonomi sampai tingkat spesies (Miyadoh 2003).
2.4.2 Ekologi dan Fisiologi
Aktinomisetes banyak ditemukan dalam tanah terutama pada topsoil dan jumlahnya semakin berkurang dengan semakin dalamnya tanah. Genus Streptomyces
tersebar di berbagai habitat, seperti tanah, laut, sungai, atmosfer dan lain-lain. Beberapa isolat Streptomyces juga diketahui sebagai patogen pada manusia , hewan dan tanaman.
III BAHAN DAN METODE
3.1 Waktu dan Tempat
Penelitian ini dilakukan dari bulan Maret 2006 sampai Maret 2007. Penelitian bertempat di laboratorium Mikrobiologi, Departemen Biologi, Fakultas MIPA, Institut Pertanian Bogor dan di laboratorium Biokimia Mikroba, Bidang Mikrobiologi, Pusat Penelitian Biologi, LIPI, Bogor.
3.2 Alat dan Bahan
Alat-alat yang digunakan untuk penelitian yaitu : autoklaf, UV-VIS spektrofotometer (Shimadzu UV-1700), sentrifusa (Kubota 6500), shaker, laminar air flow, penangas air, pipet mikro (Gilson), piranti elektroforesis (Mini Protean 3, Biorad), kolom kromatografi, fraction collector (Biorad model 2110), timbangan analitik (AND GR-200), pH meter (Schott), pengaduk bermagnet, vorteks, cawan petri, gelas piala, labu ukur, gelas ukur, tabung reaksi, pipet serologis, dan erlenmeyer. Bahan-bahan yang digunakan yaitu : isolat Streptomyces sp SKK1-8 (koleksi Dr. Ir. Yulin Lestari, Departemen Biologi, FMIPA, IPB), substrat birchwood xilan (Fluka), sukrosa, ekstrak khamir, agar-agar, DNS, KNa tartrat, NaOH, Na2SO3, Coomassie brilliant blue G-250, etanol 95%, asam fosfor 85%, aseton, Na2HPO4,
NaH2PO4, asam sitrat, Tris, HCl, Sephadex G-100 (Sigma), DEAE-Sephadex A50
(Sigma), NaCl, sodium dedosil sulfat (SDS), poliakrilamida, bis akrilamida, N,N,N,N-Tetrametiletilendiamina (TEMED), amonium persulfat, bromophenol blue, glisin, protein penanda dengan berat molekul rendah, p-nitrofenol dan berbagai substrat turunannya (p-NP-β-D-xilanopiranosida, p-NP-α-L-arabinofuranosida, p
3.3 Metode Penelitian
3.3.1 Preparasi Larutan Xilanase
Streptomyces sp. SKK1-8 diremajakan pada cawan petri berisi media agar-agar xilan (mengandung 1 % ekstrak khamir, 10.3 % sukrosa dan 0.5 % birchwood xilan), diinkubasi pada suhu kamar selama 4 hari sampai terbentuk spora (sporulasi). Sebanyak 3 cockborer kultur padat Streptomyces sp SKK1-8 tersebut diinokulasikan ke dalam erlenmeyer yang berisi 100 ml media cair xilan, diinkubasikan pada suhu kamar selama 10 hari dengan pengocokan (150 rpm). Kultur cair disentrifugasi pada kecepatan 10.000 rpm selama 10 menit pada suhu 4 oC. Filtrat yang diperoleh dipisahkan dari endapan dan digunakan sebagai ekstrak kasar xilanase.
3.3.2 Pengujian Aktivitas Xilanase
3.3.3 Pengendapan Xilanase Menggunakan Amonium Sulfat dan Aseton
Xilanase diendapkan pada suhu dingin (diatas penangas es) dengan cara menambahkan amonium sulfat yang telah dihaluskan atau aseton dingin sedikit demi sedikit ke dalam larutan xilanase kasar sambil diaduk perlahan dengan pengaduk bermagnet sampai mencapai kejenuhan tertentu. Pengadukan dilanjutkan selama 15 menit kemudian larutan disimpan dalam lemari pendingin selama semalam. Endapan yang terbentuk dipisahkan dengan sentrifugasi dan dilarutkan dengan 10 mM bufer fosfat pH 6.0. Penghitungan banyaknya amonium sulfat atau aseton yang ditambahkan ke dalam larutan enzim diperlihatkan dalam lampiran 4.
Guna memperoleh hasil yang optimal maka pengendapan xilanase
Streptomyces sp. SKK1-8 dilakukan secara bertahap, yaitu dengan 50%-80% aseton. Mula-mula aseton ditambahkan pada larutan enzim kasar sampai mencapai konsentrasi 50%, disentrifugasi pada kecepatan 5.000 rpm dan endapan yang merupakan protein pengotor dibuang. Selanjutnya aseton ditambahkan lagi ke dalam filtrat sampai mencapai konsentrasi 80%, disentrifugasi dan filtratnya dibuang. Endapan dilarutkan dengan 0.05M bufer fosfat pH 6.0, disentrifugasi untuk memisahkan protein tidak larut yang merupakan protein terdenaturasi. Filtrat yang diperoleh dimurnikan lebih lanjut.
3.3.4 Pemisahan Xilanase dengan Polimer Eudragit S100
Preparasi 2% Eudragit S100: 2 gr eudragit S100 ditambah 80 ml akuades, dinaikkan pHnya dengan penambahan 3 M NaOH sampai mencapai pH 11. Selanjutnya pH diturunkan dengan penambahan 3 M HCl sampai mencapai pH 7.0 dan volume ditepatkan menjadi 100 ml. Larutan disimpan dalam lemari pendingin sampai digunakan.
pada kecepatan 5 000 g selama 15 menit. Supernatan disimpan (supernatan 1) dan endapan dicuci dengan 10 mM bufer asetat pH 4.0 dan disentrifugasi. Supernatan disimpan (supernatan 2), endapan dilarutkan dengan 14 ml 0.1 M bufer fosfat pH 7.5 kemudian ditambahkan NaCl dan Triton X-100 dengan konsentrasi akhir berturut-turut 1M dan 0.2%. Larutan diinkubasi pada suhu kamar selama 10 menit. Ditambahkan 2 M asam asetat sampai pH mencapai 4.0, didiamkan selama 20 menit dan disentrifugasi. Supernatan disimpan (supernatan 3) dan endapan dilarutkan dalam 1.5 ml 0.1 M bufer fosfat pH 7.5 (xilanase terikat eudragit S100). Dilakukan pengujian aktivitas xilanase pada supernatan 1, 2, 3 dan xilanase terikat eudragit S100 (terimobilisasi).
3.3.5 Pemurnian Xilanase
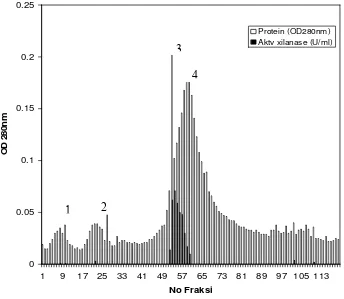
Xilanase dimurnikan dengan menggunakan kromatografi filtrasi gel dan penukar ion. Matrik Sephadex G-100 sebanyak 10 gram dikembangkan dalam 10 mM bufer fosfat pH 6.0, dipanaskan dalam penangas air mendidih selama 1 jam dan dimasukkan ke dalam lemari pendingin selama semalam. Didekantasi untuk membuang matrik yang tidak mengendap dan ditambahkan 100 ml larutan bufer yang sama. Matrik dituang ke dalam kolom kromatografi dan diseimbangkan dengan 10 mM bufer fosfat pH 6.0. Selanjutnya dibilas dengan bufer yang sama dengan kecepatan alir 0.5 ml/menit. Setiap 3 ml eluen ditampung, diukur kadar proteinnya pada panjang gelombang 280 nm dan diukur aktivitas xilanasenya. Dibuat grafik Profil elusi dimana sumbu X merupakan nomor fraksi sedangkan sumbu Y merupakan nilai kadar protein dan nilai aktivitas xilanase. Fraksi yang mengandung xilanase hasil filtrasi gel digabungkan, dimasukkan ke dalam kantong dialisis (molecular weight cut off 10 000) dan didialisis dengan 10 mM Tris-HCl pH 8.0 dalam lemari pendingin. Selama dialisis bufer diganti sebanyak 2 kali.
dituang ke dalam kolom kromatografi dan diseimbangkan dengan 10 mM bufer Tris-HCl pH 8.0. Larutan xilanase hasil dialisis dimasukkan ke dalam kolom yang berisi matrik DEAE-Sephadex A50. Protein yang tidak terikat matrik dibilas dengan bufer yang sama, sedangkan protein yang terikat matrik dibilas dengan gradien linier larutan NaCl (0-0.5 M NaCl dalam bufer yang sama) dan 1 M NaCl. Pembilasan dilakukan dengan kecepatan alir 0.5 ml/menit, setiap 3 ml eluen ditampung, diukur kadar protein dan diuji aktivitasnya. Dibuat grafik profil elusi dan dilihat kemurniannya dengan elektroforesis.
Elektroforesis dilakukan pada piranti elektroforesis vertikal Mini Protean 3 (Bio-Rad) pada kondisi protein terdenaturasi (SDS-PAGE) atau tidak terdenaturasi (native PAGE). Larutan xilanase dari setiap tahap pemurnian dilarikan pada gel poliakrilamida (4% akrilamida pada gel penahan dan 10% akrilamida pada gel pemisah). Elektroforesis dilakukan pada tegangan 100 volt, 50 mA sampai pewarna bromofenol biru mencapai sekitar 1 cm dari tepi gel bagian bawah. Hasil elektroforesis diwarnai dengan pewarna Coomasie Brilliant Blue (CBB) atau pewarna perak nitrat. Fraksi filtrasi gel dan fraksi kromatografi penukar anion dipekatkan 40 kali sebelum dilakukan elektroforesis.
3.3.6 Penghitungan Berat Molekul Xilanase
Penghitungan berat molekul xilanase dilakukan dengan cara membandingkan jarak migrasi pita xilanase dengan pita protein penanda yang memiliki berat molekul rendah (low molecular weight marker). Protein penanda yang digunakan yaitu monoalbumin (serum babi, 66 kDa), albumin (telur ayam, 45kDa), karbonik anhidrase (29 kDa) dan α-lactalbumin (14.2 kDa). Persamaan linier protein penanda diperoleh dengan membuat kurva antara Rf dan log berat molekul protein penanda. Perkiraan berat molekul xilanase dihitung dari persamaan linier tersebut.
3.3.7 Pengukuran Kadar Protein
Kadar protein selama pemurnian diukur dengan metode Bradford (Bradford 1976) dan absorbansi pada panjang gelombang 280 nm (untuk pembuatan kromatogram). Pengukuran protein dengan metode Bradford dilakukan dengan cara sebagai berikut : sebanyak 0.4 ml larutan enzim ditambah 4 ml reagen Bradford, dikocok sampai homogen dan diinkubasikan pada suhu kamar selama 15 menit. Diukur absorbansinya dengan spektrofotometer pada panjang gelombang 595 nm.
Bovine Serum Albumine (BSA) digunakan sebagai standar untuk menghitung kadar protein larutan enzim.
3.3.8 Pengaruh pH dan Suhu Terhadap Aktivitas dan Stabilitas Xilanase
Pengaruh pH terhadap aktivitas enzim diuji dengan cara mereaksikan larutan enzim dengan substrat pada suhu 50 oC selama 30 menit pada berbagai kondisi pH larutan bufer (pH 4.0-9.0 dengan selang 0.5 unit). Gula pereduksi yang terbentuk diukur dengan metode Miller (1959). Stabilitas enzim terhadap pH diuji dengan menginkubasikan larutan enzim dalam 10 mM larutan bufer berbagai pH (3.0-9.0 dengan selang 0.5 unit) selama 1 jam. Setelah inkubasi selesai, dengan cepat diuji aktivitas enzim tersisanya pada kondisi optimum reaksi enzim xilanase dengan konsentrasi larutan bufer sebesar 0.1 M. Nilai aktivitas enzim tersisa dinyatakan dalam persentase dibandingkan dengan kontrol (enzim tanpa perlakuan). Bufer yang digunakan yaitu bufer asetat (pH 4.0-6.0), bufer fosfat (pH 6.0-8.0) dan bufer Tris-HCl (pH 7.0-9.0).
xilanase. Nilai aktivitas enzim tersisa dinyatakan dalam persentase dibandingkan dengan kontrol (enzim tanpa perlakuan)
3.3.9 Pengaruh Kation Terhadap Aktivitas Xilanase
Pengaruh kation terhadap aktivitas xilanase diuji dengan cara menambahkan kation (konsentrasi akhir 1 mM) ke dalam campuran substrat-bufer-enzim, dan diinkubasikan pada kondisi optimal reaksi enzimatis. Penghambatan atau peningkatan aktivitas xilanase oleh kation dinyatakan dalam persentase aktivitas xilanase dibandingkan dengan kontrolnya (tanpa penambahan kation logam). Kation ditambahkan dalam bentuk larutan garam klorida, yaitu KCl, NaCl, BaCl2, CaCl2,
CoCl2, CuCl2, NiCl2, SrCl2, ZnCl2, FeCl3. Selain itu juga diuji pengaruh EDTA
terhadap aktivitas xilanase.
3.3.10 Studi Kinetika Xilanase
Studi kinetika dilakukan dengan membuat grafik Lineweaver-Burk (double reciprocal) untuk menentukan nilai Km dan Vmax reaksi enzimatis dari xilanase
Streptomyces sp SKK1-8. Persamaan Lineweaver-Burk : 1 = Km 1 + 1 V Vmax [S] Vmax
transformasi linier dari persamaan Michaelis Menten. Grafik double reciprocal
diperoleh dari hubungan antara 1/[S] sebagai sumbu X dan 1/v sebagai sumbu Y. Kecepatan reaksi (v) diukur sebagai kecepatan pembentukan produk (xilosa) persatuan waktu.
waktu (sumbu X) dan kadar xilosa (sumbu Y) dari berbagai konsentrasi substrat awal dimana nilai kecepatan reaksi (v) merupakan nilai kemiringan grafik tersebut. Selanjutnya dibuat grafik double reciprocal dan didilakukan penentuan nilai Km dan Vmaxnya.
3.3.11 Hidrolisis Substrat Spesifik
Pengujian hidrolisis substrat spesifik dilakukan dengan cara mereaksikan larutan enzim dengan berbagai substrat spesifik yang merupakan turunan p-nitrofenol, yaitu : p-nitrofenol-α-L-arabinosida (substrat untuk α-L-arabinosidase), p
-nitrofenol-β-D-xilanopiranosida (substrat untuk β-D-xilanopiranosidase), p-nitrofenol-β
-D-glukopiranosida (substrat untuk β-D-glukopiranosidase), p-nitrofenol-α -D-galaktopiranosida (substrat untuk α-D-galaktopiranosidase) dan p-nitrofenol-asetat (substrat untuk asetil xilan esterase). Sebanyak 100 µl larutan enzim ditambahkan ke dalam tabung reaksi yang berisi 900 µl substrat spesifik dalam 50 mM bufer pada pH optimal, kemudian diinkubasi pada suhu optimal selama 30 menit. Reaksi enzimatis dihentikan dengan penambahan 100 µl Na2CO3 0.4M dan banyaknya p-nitrofenol
IV HASIL DAN PEMBAHASAN
4.1 Hasil
4.1.1 Produksi xilanase
Produksi xilanase dari Streptomyces sp. SKK1-8 dilakukan pada media cair yang mengandung 0.5% xilan, diinkubasi pada suhu kamar selama 10 hari dengan pengocokan. Kultur disentrifugasi dengan kecepatan 10.000 rpm selama 5 menit pada suhu 4 oC untuk memisahkan larutan enzim dari sel. Larutan enzim kasar memiliki aktivitas xilanase sebesar 7.015 U/ml. Aktivitas tersebut jauh lebih kecil dibanding aktivitas xilanase jamur misalnya xilanase T. reesei (960 U/ml), S. commune (1244 U/ml) (Subramaniyan & Prema 2002), tetapi tidak jauh berbeda dengan xilanase B. amyloliquifaciens (10.4 U/ml) ( Breccia et al. 1998).
4.1.2 Pengendapan Xilanase
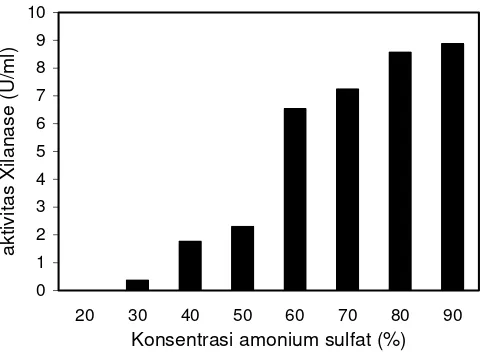
Guna mengetahui senyawa yang efektif untuk mengendapkan xilanase maka pada penelitian ini dicoba garam amonium sulfat dan pelarut organik aseton. Sebanyak 5 ml larutan enzim kasar diendapkan dengan amonium sulfat atau aseton pada berbagai konsentrasi dan aktivitasnya diuji. Aktivitas xilanase hasil pengendapan dengan amonium sulfat dan aseton diperlihatkan pada Gambar 4 dan 5.
0 1 2 3 4 5 6 7 8 9 10
20 30 40 50 60 70 80 90
Konsentrasi amonium sulfat (%)
[image:58.612.219.461.487.663.2]ak tiv it as X ila nas e (U /ml )
Hasil pengujian menunjukkan bahwa xilanase Streptomyces sp. SKK1-8 tidak mengendap pada konsentrasi amonium sulfat 20% dan mulai mengendap pada konsentrasi amonium sulfat 30% dengan aktivitas sebesar 0.362 U/ml. Semakin tinggi konsentrasi amonium sulfat maka semakin banyak xilanase yang mengendap. Aktivitas xilanase tertinggi terdapat pada konsentrasi 90% yaitu 8.872 U/ml, tetapi
recovery xilanase hanya sekitar 25%. Hal ini dikarenakan hanya sebagian xilanase dapat mengendap setelah disentrifugasi, sedangkan sebagian lain masih melayang sehingga sulit dipisahkan dari cairannya dengan cara dekantasi. Pemisahan agregat xilanase dengan penyaringan dapat dilakukan akan tetapi perlu bufer untuk membilas xilanase dari kertas saring. Hal ini dirasa kurang efektif mengingat reduksi volume larutan enzim hanya sekitar 40-60% sementara banyaknya volume sampel yang dapat dimasukkan ke dalam kolom kromatografi jumlahnya terbatas. Amonium sulfat juga tidak efektif untuk mengendapkan xilanase Bacillus thermoleovarans IT-08 karena semakin tinggi amonium sulfat, xilanase yang mengendap semakin sedikit (Puspaningsih 2004). 0 5 10 15 20 25 30 35 40
20 30 40 50 60 70 80 90
Konsentrasi aseton (%)
[image:59.612.206.479.423.601.2]Ak ti v it a s x ilanas e ( U /m l)
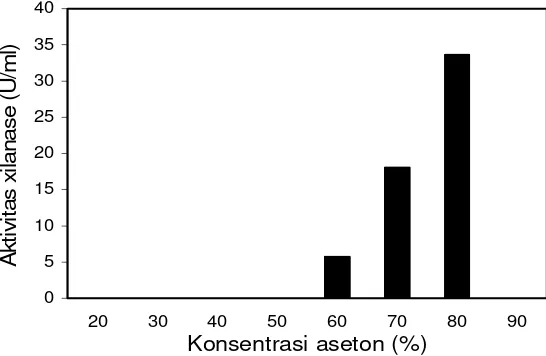
Gambar 5 Aktivitas xilanase yang diendapkan dengan aseton pada berbagai konsentrasi.
filtratnya cukup dilakukan dengan dekantasi. Hasil pengendapan menunjukkan bahwa xilanase tidak mengendap sampai konsentrasi aseton mencapai 50%, mulai mengendap pada konsentrasi 60% dengan aktivitas sebesar 5.762 U/ml dan maksimal pada konsentrasi 80% dengan aktivitas sebesar 33.606 U/ml. Tidak terdeteksinya aktivitas xilanase pada konsentrasi 90% aseton dan recovery (pemulihan) aktivitas xilanase sebesar 96% pada 80% aseton menunjukkan bahwa xilanase sebagian besar telah mengendap pada 80% aseton. Aktivitas xilanase hasil pengendapan 80% aseton meningkat 4.8 kali dibandingkan dengan larutan enzim kasar (7.015 U/ml).
4.1.3 Pemisahan Xilanase dengan Polimer Eudragit S100
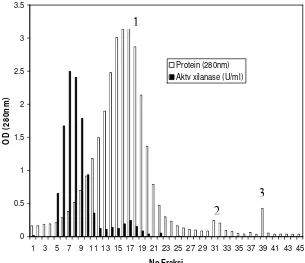
[image:60.612.115.529.560.700.2]Pemisahan xilanase d