KERAGAMAN KARAKTER XILANASE DARI
TIGA ISOLAT Streptomyces
ASAL INDONESIA
Oleh:
Trio Hendarwin
G 34101061
DEPARTEMEN BIOLOGI
ABSTRAK
TRIO HENDARWIN. Keragaman Karakter Xilanase Dari Tiga Isolat Streptomyces Asal Indonesia. Dibimbing oleh ANJA MERYANDINI dan DEDEN SAPRUDIN
Xilan adalah komponen terbesar hemiselulosa pada dinding sel tanaman. Kelimpahan xilan di alam menggambarkan pentingnya biokonversi xilan oleh enzim xilanase. Tiga isolat
Streptomyces asal Indonesia masing-masing isolat 45I -3, 234P -16, dan SKK1-8 mampu menghasilkan enzim xilanase ekstraseluler bila ditumbuhkan di dalam media yang mengandung
birchwood xylan. Waktu paruh xilanase isolat 234P-16, SKK1-8, dan 45I-3 pada suhu optimumnya masing-masing, yaitu 6 jam 24 menit, 1 jam 45 menit, dan 2 jam 9 menit. Xilanase ketiga isolat stabil pada perlakuan inkubasi di suhu 3 oC. Ketiga isolat menunjukkan aktivitas tertinggi pada substrat jenis Oatspelt xylan dan sangat rendah pada substrat CMC. Analisis HPLC menunjukkan produk hidrolisis xilanase ketiga isolat diantaranya berupa xilosa dan arabinosa. Xilanase ketiga isolat dapat diendapkan dengan aseton. Analisis zimogram menunjukkan ketiga is olat mampu menghidrolisis substrat birchwood xylan dengan pita aktif berbobot molekul sebesar 16.37 kDa, 14.39 kDa, dan 12.65 kDa untuk isolat 45I-3; 16.80 kDa dan 14.76 kDa untuk isolat 234P-16; dan 16.80 kDa, 15.21 kDa, dan 13.86 kDa untuk isolat SKK1-8.
ABSTRACT
TRIO HENDARWIN. Diversity of Xylanases Character from Three Indonesian Streptomyces
Isolates. Under direction of ANJA MERYANDINI and DEDEN SAPRUDIN
Xilan is the major component of hemicellulose found in plant cell wall. The aboundance of xylan in nature suggested the importance of xylan bioconvertion by xylanases. Three isolates of
Streptomyces from Indonesia respective to 45I-3, 234P-16, and SKK1-8 could produce extracelluler xylanases when grown in birchwood xylan medium. Stability test in optimum temperature showed that xylanases from 234P-16, SKK1-8, and 45I-3 have half life time 23 hour 9 minute, 1 hour 45 minute, and 2 hour 9 minute, respectively. Xylanases from three isolates were stable at temperature 3 oC. Xylanases from three isolates showed the highest activity at oatspelt xylan and the lowest at CMC. HPLC analysis showed that hydrolytic product of birchwood xylan
KERAGAMAN KARAKTER XILANASE DARI
TIGA ISOLAT Streptomyces
ASAL INDONESIA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
Trio Hendarwin
G 34101061
DEPARTEMEN BIOLOGI
Judul : KERAGAMAN KARAKTER XILANASE DARI TIGA ISOLAT Streptomyces ASAL
INDONESIA
Nama : Trio Hendarwin
NIM : G34101061
Menyetujui,
Pembimbing I Pembimbing II
Dr. Anja Meryandini, M.S. D rs. Dede n Saprudin , M.Si.
NIP. 131663016 NIP. 132126040
Mengetahui,
Dekan Fakultas MIPA
Dr. Ir. Yonny Koesmaryono, M .S .
NIP. 131473999
RIWAYAT HIDUP
PRAKATA
Puji syukur senantiasa penulis panjatkan kepada Allah SWT yang telah melimpahkan rahmat, karunia, kesabaran, dan keteguhan hati kepada penulis selama melaksanakan penelitian hingga selesainya penulisan skripsi ini. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Sains pada Departemen Biologi.
Penelit ian ini dilaksanakan mulai bulan Januari hingga Agustus 2005 , bertempat di Laboratorium Mikrobiologi Departemen Biologi, FMIPA, IPB dan Laboratorium Pengujian Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian, Cimanggu, Bogor, dengan topik berjudul “Keragaman Karakter Xilanase Dari Tiga Isolat Streptomyces Asal Indonesia”. Penelitian ini didanai oleh proyek hibah bersaing atas nama Dr. Anja Meryandini MS.
Pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih yang mendalam kepada Ibu Dr.Anja Meryandini, M.S. selaku pembimbing pertama dan Bapak Drs.Deden Saprudin, M.Si. selaku pembimbing kedua atas bimbingan, ilmu pengetahuan, kesabaran serta saran yang diberikan kepada penulis selama penelitian hingga selesainya penulisan skripsi ini, juga kepada Bapak Dr.Ir.Achmad Farajallah, M.Si. selaku perwakilan komisi pendidikan dan penguji kelayakan skripsi atas saran dan masukannya yang sangat berharga. Ucapan terima kasih yang mendalam juga penulis sampaikan kepada ibu Dr.Ir.Yulin Lestari yang telah mengizinkan pemakaian ketiga isolat Streptomyces pada penelitian ini. Penulis juga menyampaikan ucapan terima kasih kepada Mba Heni, Pak Jaka, Pak Endang, dan Bu Kokoy selaku staf laboratorium mikrobiologi FMIPA IPB, juga kepada Pak Djoni, Pak Edi, dan Bu Yeti atas segala bantuannya.
Ucapan terima kasih serta apresiasi yang tinggi juga penulis berikan kepada Deri, Ambar, Irma dan Andini sebagai teman-teman seperjuangan yang telah menunjukkan pada penulis sebuah persahabatan yang sangat indah, tak l upa pula kepada Mas Prima, Mas Ozy, Bu Nunuk, Mba Kiky, Mba Wiwit, Ka Tono, Mba Aini, Mba Lies, Ka Herman, Mba Awil, Mba Elsi, Mba Dini, Mba Nana, Mba Fenty, Mba Dina, Rika, Henry, Iwul, Mba Piti, Made, serta teman-teman di kos Assyabab; Rully, Bahrelfi, Bekti, Angga, Isnan, Amir, Erwin dan seluruh rekan-rekan biologi angkatan 38 yang tidak dapat penulis sebutkan satu persatu, terima kasih atas kebersamaanya selama ini.
Penghargaan terbesar penulis berikan kepada kedua orang tua tercinta yaitu Bapak dan Ibu di Bekasi, kakak-kakak tercinta (Mas Purwo dan Mba Dwi) atas doa, cinta, kasih sayang, serta dukungan baik material maupun moral yang senantiasa diberikan kepada penulis selama ini.
Akhirnya penulis berharap semoga skripsi ini dapat berguna bagi pihak-pihak yang memerlukannya, serta bermanfaat untuk kemajuan ilmu pengetahuan kedepan.
Bogor, Desember 2005
DAFTAR ISI
Halaman
DAFTAR TABEL ...vi
DAFTAR GAMBAR ...vi
DAFTAR LAMPIRAN ...vii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 1
BAHAN DAN METODE Waktu dan Tempat Penelitian ...2
Bahan dan Alat ... 2
Metode ... 2
Peremajaan Isolat dan Penyiapan Inokulum ... 2
Penentuan Waktu Optimum Produksi dan Aktivitas Xilanase Harian ... 2
Penentuan Aktivitas Enzim pada Beberapa Jenis Substrat Xilan... 2
Uji Kestabilan Xilanase Ekstrak Kasar ... 2
Pengendapan Xilanase Ekstrak Kasar dengan Aseton ... 2
Analisis Sodium Dodecyl Sulfate Polyacrilamide Gel Electrophoresis (SDS-PAGE) dan Zimogram ... 2
Analisis Hasil Produk Hidrolisis Xilanase dengan High Performance Liquid Chromatography (HPLC) ... 3
HASIL Peremajaan Streptomyces Isolat 45I-3, 234P-16, dan SKK1-8 ... 3
Penentuan Waktu Optimum Produ ksi dan Aktivitas Xilanase Harian ... 3
Penentuan Aktivitas Enzim pada Beberapa Jenis Substrat Xilan... 4
Uji Kestabilan Xilanase Ekstrak Kasar ... 4
Pengendapan Xilanase Ekstrak Kasar dengan Aseton ... 4
Analisis Sodium Dodecyl Sulfate Polyacrilamide Gel Electrophoresis (SDS-PAGE) dan Zimogram ... 5
Analisis Hasil Produk Hidrolisis Xilanase dengan High Performance Liquid Chromatography (HPLC) ... 5
PEMBAHASAN... 6
SIMPULAN DAN SARAN ... 7
DAFTAR PUSTAKA ... 7
DAFTAR TABEL
Halaman
1. Aktivitas xilanase (U/ml) hasil pengendapan dengan berbagai konsentrasi aseton ... 5
2. Produk hidrolisis xilanase isolat 45I-3, SKK1-8, dan 234P -16 ... 5
DAFTA R GAMBAR
Halaman 1. Koloni Streptomyces isolat SKK1-8, 234P-16, dan 45I-3 pada media agar-agar xilan setelah diinkubasi selama lima hari ... 3
2. Kemampuan xilanolitik Streptomyces isolat 45I-3, 234P-16, dan SKK1-8 pada media agar-agar xilan setelah diinkubasi selama dua hari ... 3
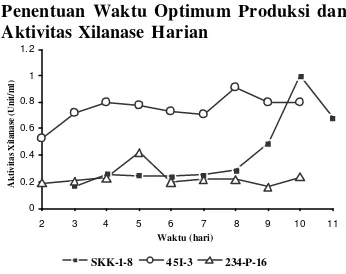
3. Kurva produksi xilanase harian isolat 45I-3, 234P -16, dan SKK1-8 yang diuji pada pH dan suhu optimum masing-masing enzim ... 3
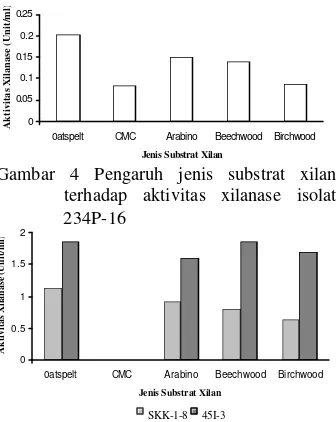
4. Pengaruh jenis substrat xilan terhadap aktivitas xilanase isolat 234P-16 ... 4
5. Pengaruh jenis substrat xilan terhadap aktivitas xilanase isolat SKK1-8 dan 45I-3 ... 4
6. Stabilitas xilanase isolat 234P-16, 45I-3, dan SKK1-8 pada suhu optimum ... 4
7. Stabilitas xilanase isolat 234P-16, 45I-3, dan SKK1-8 pada suhu 3 oC ... 4
8. Profil SDS-PAGE (A) dan zimogram (B) xilanase fraksi aseton isolat 234P-16 ... 5
9. Profil SDS-PAGE (A) dan zimogram (B) xilanase fraksi aseton isolat SKK1-8 ... 5
DAFTAR LAMPIRAN
Halaman
1. Komposisi media agar xilan dan media produksi xilanase (Ruiz-Arribas et al. 1995)...11
2. Komposisi gel poliakrilamid (15%)...11
3. Komposisi reagen Dinitrosalisilic Acid (DNS) (Miller 1959) ...11
4. Jumlah aseton yang ditambahkan dalam 10 ml ekstrak kasar enzim (Scopes 1987) ...11
5. Penentuan aktivitas xilanase (Miller 1959) ...11
6. Aktivitas xilanase (Unit/ml) harian...12
7. Aktivitas xilanase (Unit/ml) pada uji stabilitas di suhu dan pH optimum ...12
8. Aktivitas xilanase (Unit/ml) pada uji stabilitas di suhu 3 oC dan pH optimum ...12
9. Aktivitas xilanase (Unit/ml) pada beberapa jenis substrat...12
10. Aktivitas xilanase (Unit/ml) pada beberapa konsentrasi pengendapan aseton...12
1
PENDAHULUAN
Latar Belakang
Hemiselulosa merupakan komponen dinding sel tanaman disamping selulosa dan lignin dengan komposisi mencapai 25-30% total bobot kering kayu (Perez et al. 2002). Komponen terbesar penyusun hemiselulosa sel tanaman yaitu xilan. Xilan merupakan jenis polisakarida paling melimpah ke-2 di alam setelah selulosa (Kubata et al. 1994, Saha 2002, Subramaniyan & Prema2002).
Xilan termasuk ke dalam heteropolisakarida kompleks dengan rantai punggung yang tersusun atas homopolimer unit-unit D -xilopiranosa yang tergabung melalui ikatan ß-1,4 D -xylosa (Saha 2002, Tseng et al. 2002). Rantai punggung ini kemudian dapat juga mengandung beberapa substituen yang kemudian menjadi rantai sampingnya seperti kelompok O-acetyl, a -L-arabinofuranosyl, D-glucuronyl, dan residu O-methyl-D -glucuronyl (Kubata et al. 1994, Silveira et al. 1999 , Saha 2003), sehingga untuk lebih efektif menghidrolisis xilan menjadi monomer penyusunnya dibutuhkan suatu sistem enzim yang bekerja secara sinergis dan memiliki fungsi khusus (Ruiz-arribas et al.1995, Ryan et al.2003).
Hidrolisis xilan melibatkan dua tipe enzim utama yaitu endo-ß-1,4-xylanase (1,4- ß -xilan xilanohidrolase) dan ß-xilosidase (ß-D-xilosida xilohidrolase) (Ali et al. 2004, Sunna et al. 1997). Endo-ß-1,4-xylanase mendepolimerisasi xilan melalui hidrolisis secara acak ikatan tulang punggung ß-1,4 menjadi xilooligosakarida dan xilosa; dan ß-xilosidase menghidrolisis xilooligosakarida dari ujung non pereduksi untuk membebaskan xilosa (Gilbert & Hazlewood 1993). Sementara itu, gugus-gugus samping yang ada pada xilan akan dibebaskan oleh a -L-arabinofuranosidase, a-D -glukuronidase, asetil xilan esterase dan galaktosidase (Subramaniyan & Prema 2002), sehingga nantinya produk yang dihasilkan ialah gula sederhana yang dapat dimanfaatkan oleh organisme bersangkutan (Deobald & Crawford 2002).
Beberapa kelompok mikroorganisme telah diketahui dapat menghasilkan enzim xilanase, diantaranya kelompok cendawan (Lin et al.1999, Saha 2002, Ryan et al.2003), bakteri (Kubata et al. 1994, Sunna et al.
1997, Breccia et al. 1998, Beg et al. 2001), dan protozoa (Devillard et al. 2003). Salah satu kelompok bakteri yang sangat berpotensi menghasilkan xilan ase yaitu kelompok
Aktinomiset, khususnya dari kelompok
Streptomyces (Ruiz -arribas et al. 1995, Georis
et al. 2000, Belfaquih & Penninckx 2000, Kaneko et al. 2000, Wang et al. 2003, Kansoh & Nagieb 2004).
Aktinomiset merupakan kelompok bakteri filamentous yang membentuk miselia, bersifat gram positif, dan sebagian besar membentuk spora (Madigan et al. 2000). Aktinomiset dapat hidup pada zona aerob tanah, sebagai saprob dengan substrat organik yang luas, dan di air tawar serta sedimen laut (Ensign 1992). Beberapa spesies dari kelompok Aktinomiset memiliki peranan yang penting di dalam mendekomposisi beberapa jenis polimer, dan kemampuan kapasitas biodegradasi makromolekul ini didukung oleh produksi enzim ekstraseluler yang beragam. Beberapa jenis Streptomyces
diketahui dapat menghasilkan enzim xilanase yang dapat mendegradasi kompleks lignoselulose (Wendisch & Kutzner 1992).
Pada dekade terakhir, aplikasi bioteknologi xilanase semakin berkembang. Dalam industri pulp dan kertas, xilanase dapat mereduksi penggunaan alkalin dan klorin yang digunakan sebagai agen pemutih kertas (Breccia et al. 1998, Lin et al. 1999). Pada industri makanan, xilanase digunakan untuk mempercepat proses pemanggangan kue, roti dan makanan lainnya dengan membantu pemecahan polisakarida dalam adonan (Gilbert & Hazlewood 1993, Li et al.2000). Pada industri pakan ternak, xilanase digunakan untuk menurunkan viskositas pakan sehingga meningkatkan tingkat kecernaan t ernak (Breccia et al. 1998). Hasil hidrolisis xilan juga digunakan dalam pembuatan tablet, pemanis buatan rendah kalori (Kulkarni et al.1999), dan bahan bakar cair (Chen et al.1997) .
Pada penelitian ini digunakan tiga isolat
Streptomyces asal Indonesia yang telah diketahui pH dan suhu optimum xilanasenya. Masing-masing isolat yang dimaksud meliputi 45I-3 asal Kalimantan (xilanasenya optimum pada pH 5 dan suhu 50 oC), 234P-16 asal Kalimantan (xilanasenya optimum pada pH 5 dan suhu 90 oC), dan SKK1-8 asal Sukabumi (xilanasenya optimum pada pH 6 dan suhu 50
o
C).
Tujuan
Tujuan penelitian ini adalah mengkarakter isasi xilanase dari Streptomyces
KERAGAMAN KARAKTER XILANASE DARI
TIGA ISOLAT Streptomyces
ASAL INDONESIA
Oleh:
Trio Hendarwin
G 34101061
DEPARTEMEN BIOLOGI
ABSTRAK
TRIO HENDARWIN. Keragaman Karakter Xilanase Dari Tiga Isolat Streptomyces Asal Indonesia. Dibimbing oleh ANJA MERYANDINI dan DEDEN SAPRUDIN
Xilan adalah komponen terbesar hemiselulosa pada dinding sel tanaman. Kelimpahan xilan di alam menggambarkan pentingnya biokonversi xilan oleh enzim xilanase. Tiga isolat
Streptomyces asal Indonesia masing-masing isolat 45I -3, 234P -16, dan SKK1-8 mampu menghasilkan enzim xilanase ekstraseluler bila ditumbuhkan di dalam media yang mengandung
birchwood xylan. Waktu paruh xilanase isolat 234P-16, SKK1-8, dan 45I-3 pada suhu optimumnya masing-masing, yaitu 6 jam 24 menit, 1 jam 45 menit, dan 2 jam 9 menit. Xilanase ketiga isolat stabil pada perlakuan inkubasi di suhu 3 oC. Ketiga isolat menunjukkan aktivitas tertinggi pada substrat jenis Oatspelt xylan dan sangat rendah pada substrat CMC. Analisis HPLC menunjukkan produk hidrolisis xilanase ketiga isolat diantaranya berupa xilosa dan arabinosa. Xilanase ketiga isolat dapat diendapkan dengan aseton. Analisis zimogram menunjukkan ketiga is olat mampu menghidrolisis substrat birchwood xylan dengan pita aktif berbobot molekul sebesar 16.37 kDa, 14.39 kDa, dan 12.65 kDa untuk isolat 45I-3; 16.80 kDa dan 14.76 kDa untuk isolat 234P-16; dan 16.80 kDa, 15.21 kDa, dan 13.86 kDa untuk isolat SKK1-8.
ABSTRACT
TRIO HENDARWIN. Diversity of Xylanases Character from Three Indonesian Streptomyces
Isolates. Under direction of ANJA MERYANDINI and DEDEN SAPRUDIN
Xilan is the major component of hemicellulose found in plant cell wall. The aboundance of xylan in nature suggested the importance of xylan bioconvertion by xylanases. Three isolates of
Streptomyces from Indonesia respective to 45I-3, 234P-16, and SKK1-8 could produce extracelluler xylanases when grown in birchwood xylan medium. Stability test in optimum temperature showed that xylanases from 234P-16, SKK1-8, and 45I-3 have half life time 23 hour 9 minute, 1 hour 45 minute, and 2 hour 9 minute, respectively. Xylanases from three isolates were stable at temperature 3 oC. Xylanases from three isolates showed the highest activity at oatspelt xylan and the lowest at CMC. HPLC analysis showed that hydrolytic product of birchwood xylan
KERAGAMAN KARAKTER XILANASE DARI
TIGA ISOLAT Streptomyces
ASAL INDONESIA
Skripsi
Sebagai salah satu syarat untuk memperoleh gelar Sarjana Sains
Pada Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor
Oleh:
Trio Hendarwin
G 34101061
DEPARTEMEN BIOLOGI
Judul : KERAGAMAN KARAKTER XILANASE DARI TIGA ISOLAT Streptomyces ASAL
INDONESIA
Nama : Trio Hendarwin
NIM : G34101061
Menyetujui,
Pembimbing I Pembimbing II
Dr. Anja Meryandini, M.S. D rs. Dede n Saprudin , M.Si.
NIP. 131663016 NIP. 132126040
Mengetahui,
Dekan Fakultas MIPA
Dr. Ir. Yonny Koesmaryono, M .S .
NIP. 131473999
RIWAYAT HIDUP
PRAKATA
Puji syukur senantiasa penulis panjatkan kepada Allah SWT yang telah melimpahkan rahmat, karunia, kesabaran, dan keteguhan hati kepada penulis selama melaksanakan penelitian hingga selesainya penulisan skripsi ini. Skripsi ini merupakan salah satu syarat untuk memperoleh gelar Sarjana Sains pada Departemen Biologi.
Penelit ian ini dilaksanakan mulai bulan Januari hingga Agustus 2005 , bertempat di Laboratorium Mikrobiologi Departemen Biologi, FMIPA, IPB dan Laboratorium Pengujian Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian, Cimanggu, Bogor, dengan topik berjudul “Keragaman Karakter Xilanase Dari Tiga Isolat Streptomyces Asal Indonesia”. Penelitian ini didanai oleh proyek hibah bersaing atas nama Dr. Anja Meryandini MS.
Pada kesempatan ini penulis ingin menyampaikan ucapan terima kasih yang mendalam kepada Ibu Dr.Anja Meryandini, M.S. selaku pembimbing pertama dan Bapak Drs.Deden Saprudin, M.Si. selaku pembimbing kedua atas bimbingan, ilmu pengetahuan, kesabaran serta saran yang diberikan kepada penulis selama penelitian hingga selesainya penulisan skripsi ini, juga kepada Bapak Dr.Ir.Achmad Farajallah, M.Si. selaku perwakilan komisi pendidikan dan penguji kelayakan skripsi atas saran dan masukannya yang sangat berharga. Ucapan terima kasih yang mendalam juga penulis sampaikan kepada ibu Dr.Ir.Yulin Lestari yang telah mengizinkan pemakaian ketiga isolat Streptomyces pada penelitian ini. Penulis juga menyampaikan ucapan terima kasih kepada Mba Heni, Pak Jaka, Pak Endang, dan Bu Kokoy selaku staf laboratorium mikrobiologi FMIPA IPB, juga kepada Pak Djoni, Pak Edi, dan Bu Yeti atas segala bantuannya.
Ucapan terima kasih serta apresiasi yang tinggi juga penulis berikan kepada Deri, Ambar, Irma dan Andini sebagai teman-teman seperjuangan yang telah menunjukkan pada penulis sebuah persahabatan yang sangat indah, tak l upa pula kepada Mas Prima, Mas Ozy, Bu Nunuk, Mba Kiky, Mba Wiwit, Ka Tono, Mba Aini, Mba Lies, Ka Herman, Mba Awil, Mba Elsi, Mba Dini, Mba Nana, Mba Fenty, Mba Dina, Rika, Henry, Iwul, Mba Piti, Made, serta teman-teman di kos Assyabab; Rully, Bahrelfi, Bekti, Angga, Isnan, Amir, Erwin dan seluruh rekan-rekan biologi angkatan 38 yang tidak dapat penulis sebutkan satu persatu, terima kasih atas kebersamaanya selama ini.
Penghargaan terbesar penulis berikan kepada kedua orang tua tercinta yaitu Bapak dan Ibu di Bekasi, kakak-kakak tercinta (Mas Purwo dan Mba Dwi) atas doa, cinta, kasih sayang, serta dukungan baik material maupun moral yang senantiasa diberikan kepada penulis selama ini.
Akhirnya penulis berharap semoga skripsi ini dapat berguna bagi pihak-pihak yang memerlukannya, serta bermanfaat untuk kemajuan ilmu pengetahuan kedepan.
Bogor, Desember 2005
DAFTAR ISI
Halaman
DAFTAR TABEL ...vi
DAFTAR GAMBAR ...vi
DAFTAR LAMPIRAN ...vii
PENDAHULUAN Latar Belakang ... 1
Tujuan ... 1
BAHAN DAN METODE Waktu dan Tempat Penelitian ...2
Bahan dan Alat ... 2
Metode ... 2
Peremajaan Isolat dan Penyiapan Inokulum ... 2
Penentuan Waktu Optimum Produksi dan Aktivitas Xilanase Harian ... 2
Penentuan Aktivitas Enzim pada Beberapa Jenis Substrat Xilan... 2
Uji Kestabilan Xilanase Ekstrak Kasar ... 2
Pengendapan Xilanase Ekstrak Kasar dengan Aseton ... 2
Analisis Sodium Dodecyl Sulfate Polyacrilamide Gel Electrophoresis (SDS-PAGE) dan Zimogram ... 2
Analisis Hasil Produk Hidrolisis Xilanase dengan High Performance Liquid Chromatography (HPLC) ... 3
HASIL Peremajaan Streptomyces Isolat 45I-3, 234P-16, dan SKK1-8 ... 3
Penentuan Waktu Optimum Produ ksi dan Aktivitas Xilanase Harian ... 3
Penentuan Aktivitas Enzim pada Beberapa Jenis Substrat Xilan... 4
Uji Kestabilan Xilanase Ekstrak Kasar ... 4
Pengendapan Xilanase Ekstrak Kasar dengan Aseton ... 4
Analisis Sodium Dodecyl Sulfate Polyacrilamide Gel Electrophoresis (SDS-PAGE) dan Zimogram ... 5
Analisis Hasil Produk Hidrolisis Xilanase dengan High Performance Liquid Chromatography (HPLC) ... 5
PEMBAHASAN... 6
SIMPULAN DAN SARAN ... 7
DAFTAR PUSTAKA ... 7
DAFTAR TABEL
Halaman
1. Aktivitas xilanase (U/ml) hasil pengendapan dengan berbagai konsentrasi aseton ... 5
2. Produk hidrolisis xilanase isolat 45I-3, SKK1-8, dan 234P -16 ... 5
DAFTA R GAMBAR
Halaman 1. Koloni Streptomyces isolat SKK1-8, 234P-16, dan 45I-3 pada media agar-agar xilan setelah diinkubasi selama lima hari ... 3
2. Kemampuan xilanolitik Streptomyces isolat 45I-3, 234P-16, dan SKK1-8 pada media agar-agar xilan setelah diinkubasi selama dua hari ... 3
3. Kurva produksi xilanase harian isolat 45I-3, 234P -16, dan SKK1-8 yang diuji pada pH dan suhu optimum masing-masing enzim ... 3
4. Pengaruh jenis substrat xilan terhadap aktivitas xilanase isolat 234P-16 ... 4
5. Pengaruh jenis substrat xilan terhadap aktivitas xilanase isolat SKK1-8 dan 45I-3 ... 4
6. Stabilitas xilanase isolat 234P-16, 45I-3, dan SKK1-8 pada suhu optimum ... 4
7. Stabilitas xilanase isolat 234P-16, 45I-3, dan SKK1-8 pada suhu 3 oC ... 4
8. Profil SDS-PAGE (A) dan zimogram (B) xilanase fraksi aseton isolat 234P-16 ... 5
9. Profil SDS-PAGE (A) dan zimogram (B) xilanase fraksi aseton isolat SKK1-8 ... 5
DAFTAR LAMPIRAN
Halaman
1. Komposisi media agar xilan dan media produksi xilanase (Ruiz-Arribas et al. 1995)...11
2. Komposisi gel poliakrilamid (15%)...11
3. Komposisi reagen Dinitrosalisilic Acid (DNS) (Miller 1959) ...11
4. Jumlah aseton yang ditambahkan dalam 10 ml ekstrak kasar enzim (Scopes 1987) ...11
5. Penentuan aktivitas xilanase (Miller 1959) ...11
6. Aktivitas xilanase (Unit/ml) harian...12
7. Aktivitas xilanase (Unit/ml) pada uji stabilitas di suhu dan pH optimum ...12
8. Aktivitas xilanase (Unit/ml) pada uji stabilitas di suhu 3 oC dan pH optimum ...12
9. Aktivitas xilanase (Unit/ml) pada beberapa jenis substrat...12
10. Aktivitas xilanase (Unit/ml) pada beberapa konsentrasi pengendapan aseton...12
1
PENDAHULUAN
Latar Belakang
Hemiselulosa merupakan komponen dinding sel tanaman disamping selulosa dan lignin dengan komposisi mencapai 25-30% total bobot kering kayu (Perez et al. 2002). Komponen terbesar penyusun hemiselulosa sel tanaman yaitu xilan. Xilan merupakan jenis polisakarida paling melimpah ke-2 di alam setelah selulosa (Kubata et al. 1994, Saha 2002, Subramaniyan & Prema2002).
Xilan termasuk ke dalam heteropolisakarida kompleks dengan rantai punggung yang tersusun atas homopolimer unit-unit D -xilopiranosa yang tergabung melalui ikatan ß-1,4 D -xylosa (Saha 2002, Tseng et al. 2002). Rantai punggung ini kemudian dapat juga mengandung beberapa substituen yang kemudian menjadi rantai sampingnya seperti kelompok O-acetyl, a -L-arabinofuranosyl, D-glucuronyl, dan residu O-methyl-D -glucuronyl (Kubata et al. 1994, Silveira et al. 1999 , Saha 2003), sehingga untuk lebih efektif menghidrolisis xilan menjadi monomer penyusunnya dibutuhkan suatu sistem enzim yang bekerja secara sinergis dan memiliki fungsi khusus (Ruiz-arribas et al.1995, Ryan et al.2003).
Hidrolisis xilan melibatkan dua tipe enzim utama yaitu endo-ß-1,4-xylanase (1,4- ß -xilan xilanohidrolase) dan ß-xilosidase (ß-D-xilosida xilohidrolase) (Ali et al. 2004, Sunna et al. 1997). Endo-ß-1,4-xylanase mendepolimerisasi xilan melalui hidrolisis secara acak ikatan tulang punggung ß-1,4 menjadi xilooligosakarida dan xilosa; dan ß-xilosidase menghidrolisis xilooligosakarida dari ujung non pereduksi untuk membebaskan xilosa (Gilbert & Hazlewood 1993). Sementara itu, gugus-gugus samping yang ada pada xilan akan dibebaskan oleh a -L-arabinofuranosidase, a-D -glukuronidase, asetil xilan esterase dan galaktosidase (Subramaniyan & Prema 2002), sehingga nantinya produk yang dihasilkan ialah gula sederhana yang dapat dimanfaatkan oleh organisme bersangkutan (Deobald & Crawford 2002).
Beberapa kelompok mikroorganisme telah diketahui dapat menghasilkan enzim xilanase, diantaranya kelompok cendawan (Lin et al.1999, Saha 2002, Ryan et al.2003), bakteri (Kubata et al. 1994, Sunna et al.
1997, Breccia et al. 1998, Beg et al. 2001), dan protozoa (Devillard et al. 2003). Salah satu kelompok bakteri yang sangat berpotensi menghasilkan xilan ase yaitu kelompok
Aktinomiset, khususnya dari kelompok
Streptomyces (Ruiz -arribas et al. 1995, Georis
et al. 2000, Belfaquih & Penninckx 2000, Kaneko et al. 2000, Wang et al. 2003, Kansoh & Nagieb 2004).
Aktinomiset merupakan kelompok bakteri filamentous yang membentuk miselia, bersifat gram positif, dan sebagian besar membentuk spora (Madigan et al. 2000). Aktinomiset dapat hidup pada zona aerob tanah, sebagai saprob dengan substrat organik yang luas, dan di air tawar serta sedimen laut (Ensign 1992). Beberapa spesies dari kelompok Aktinomiset memiliki peranan yang penting di dalam mendekomposisi beberapa jenis polimer, dan kemampuan kapasitas biodegradasi makromolekul ini didukung oleh produksi enzim ekstraseluler yang beragam. Beberapa jenis Streptomyces
diketahui dapat menghasilkan enzim xilanase yang dapat mendegradasi kompleks lignoselulose (Wendisch & Kutzner 1992).
Pada dekade terakhir, aplikasi bioteknologi xilanase semakin berkembang. Dalam industri pulp dan kertas, xilanase dapat mereduksi penggunaan alkalin dan klorin yang digunakan sebagai agen pemutih kertas (Breccia et al. 1998, Lin et al. 1999). Pada industri makanan, xilanase digunakan untuk mempercepat proses pemanggangan kue, roti dan makanan lainnya dengan membantu pemecahan polisakarida dalam adonan (Gilbert & Hazlewood 1993, Li et al.2000). Pada industri pakan ternak, xilanase digunakan untuk menurunkan viskositas pakan sehingga meningkatkan tingkat kecernaan t ernak (Breccia et al. 1998). Hasil hidrolisis xilan juga digunakan dalam pembuatan tablet, pemanis buatan rendah kalori (Kulkarni et al.1999), dan bahan bakar cair (Chen et al.1997) .
Pada penelitian ini digunakan tiga isolat
Streptomyces asal Indonesia yang telah diketahui pH dan suhu optimum xilanasenya. Masing-masing isolat yang dimaksud meliputi 45I-3 asal Kalimantan (xilanasenya optimum pada pH 5 dan suhu 50 oC), 234P-16 asal Kalimantan (xilanasenya optimum pada pH 5 dan suhu 90 oC), dan SKK1-8 asal Sukabumi (xilanasenya optimum pada pH 6 dan suhu 50
o
C).
Tujuan
Tujuan penelitian ini adalah mengkarakter isasi xilanase dari Streptomyces
2
BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilaksanakan mulai Januari-Agustus 2005 di Laboratorium Mikrobiologi Departemen Biologi , FMIPA, IPB dan Laboratorium Pengujian Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian, Cimanggu, Bogor.
Bahan dan Alat
Bahan yang digunakan meliputi tiga isolat Streptomyces yaitu 45I-3, 234P-16, dan SKK1-8. Substrat birchwood xylan, oats pelt xylan, beechwood xylan, carboxy methyl cellulose (Sigma, St.Louis), dan wheat arabinoxylan (Megazyme, Korea).
Alat -alat yang digunakan meliputi spektrofotometer (Spectronic 20, USA), inkubator bergoyang (Eberbach, USA), sentrifusa (Jouan, Perancis), piranti elektroforesis protein (Hoefer SE40, USA), HPLC (Waters, USA), dan peralatan laboratorium lainnya.
Metode
Peremajaan Isolat dan Penyiapan Inokulum
Ketiga isolat Streptomyces masing-masing 45I-3, 234P-16, dan SKK1-8 diremajakan pada media agar-agar YM (0.4%
yeast extract, 1% malt extract, 1.5% glukosa), kemudian ditumbuhkan pada media agar-agar xilan (1% yeast extract, 10.3% sukrosa, dan 0.5% birchwood xylan). Inkubasi dilakukan pada suhu ruang.
Penentuan Waktu Optimum Produksi dan Aktivitas Xilanase Harian
Ketiga isolat yang telah ditumbuhkan pada media agar-agar xilan digunakan sebagai inokulum media produksi dengan menginokulasikan sebanyak dua cockbor
koloni isolat ke dalam 100 ml media cair xilan dalam 500 ml erlenmeyer lalu diinkubasi dengan agitasi di inkubator bergoyang pada suhu ruang.
Ekstrak kasar xilanase tiap harinya diperoleh dengan cara mensentrifugasi kultur pada kecepatan 8400 xg selama 10 menit pada suhu 4 oC. Supernatan (ekstrak kasar enzim) diukur aktivitasnya pada pH dan suhu optimum masing-masing isolat sehingga didapatkan waktu optimum produksi xilanase. Aktivitas xilanase diukur dengan metode DNS berdasarkan Miller (1959) dengan xilosa
dihasilkan diukur dengan spektrofotometer pada panjang gelombang 540 nm. Satu unit aktivitas xilanase didefinisikan sebagai jumlah enz im yang menghasilkan 1 µmol xilosa dalam waktu 1 menit.
Penentuan Aktivitas Enzim pada Beberapa Jenis Substrat Xilan
Aktivitas xilanase pada beberapa jenis substrat ditentukan dengan mengukur aktivitas ekstrak kasar enzim pada substrat
birchwood xylan, oats pelt xylan, wheat arabinoxylan, beechwood xylan, dan Carboxy Methyl Cellulose (CMC) dengan metode DNS.
Uji Kestabilan Xilanase Ekstrak Kasar
Kestabilan xilanase ekstrak kasar ketiga isolat diuji dengan menginkubasi xilanase ekstrak kasar tanpa substrat pada dua suhu yang berbeda yaitu pada suhu optimum dan suhu 3 oC. Pengukuran aktivitas xilanase dilakukan pada kondisi pH dan suhu optimum, pada rentang waktu tertentu dengan metode DNS.
Pengendapan Xilanase Ekstrak Kasar dengan Aseton
Ekstrak kasar xilanase diendapkan dengan berbagai konsentrasi aseton untuk memperoleh kondisi optimum fraksinasi xilanase. Konsentrasi aseton yang di uji yaitu pada rentang 60-90% dengan selang 10%.
Sebanyak 10 ml supernatan ekstrak kasar enzim ditambahkan dengan aseton dingin (disimpan pada suhu -20 oC) dengan volume
tertentu berdasarkan Scopes (1987), selanjutnya secara perlahan diaduk menggunakan pengaduk magnetik selama 15 menit dalam kondisi dingin dan disimpan dalam lemari pendingin semalam, setelah itu disentrifugasi dengan kecepatan 8400 xg selama 10 menit pada suhu 4 oC. Enzim yang mengendap disuspensikan dalam 0.2 M bufer pH optimum, kemudian ditentukan aktivitasnya dengan metode DNS.
Analisis Sodium Dodecyl Sulfate
Polyacrylamide Gel Electrophoresis (SDS-PAGE) dan Zimogram
3 0 0.2 0.4 0.6 0.8 1 1.2
2 3 4 5 6 7 8 9 10 11
Waktu (hari)
Aktivitas Xilanase (Unit/ml)
SKK-1-8 45I-3 234-P-16 Aktivitas xilanase di dalam gel
ditentukan melalui analisis zimogram, dengan menambahkan 1% (w/v) substrat birchwood xylan ke dalam campuran gel poliakrilamid sebelum polimerisasi. Setelah elektroforesis, gel direnaturasi dengan merendamnya dalam 2.5% (w/v) Triton-X 100 selama satu jam . Gel kemudian diinkubasi di dalam 0.2 M bufer fosfat -sitrat pada pH dan suhu optimum enzim selama 2 jam, setelah itu diwarnai dengan 0.1% (w/v) pewarna merah kongo selama 30 menit dan dicuci dengan NaCl 1 M .
Analisis Hasil Produk Hidrolisis Xilanase
dengan High Performance Liquid
Chromatography (HPLC)
Sebanyak 20 ml xilanase ekstrak kasar diendapkan dengan aseton pada konsentrasi optimum masing-masing isolat. Xilanase yang mengendap kemudian disuspensikan dalam 5 ml substrat birchwood xylan 0.5% (w/v) (substrat dilarutkan dalam bufer fosfat-sitrat 0.2 M pH optimum enzim), kemudian diinkubasi pada suhu optimum selama 5 jam.
Hasil hidrolisis selanjutnya dianalisis dengan HPLC (Waters, USA) dengan kondisi sebagai berikut:
- Kolom : Karbohidrat - Detektor : Indeks bias - Pelarut : Metanol 60% (v/v) - Kecepatan aliran : 1 ml/menit - Volume injeksi : 10-20 µ l - Temperatur kolom : Suhu ruang
Standar yang digunakan adalah standar xilosa dan standar arabinosa (Sigma, St.Louis) dengan konsentrasi masing-masing 400 ppm.
Analisis hasil produk hidrolisis xilanase dengan High Performance Liquid Chromatography (HPLC) dilakukan di Laboratorium Pengujian Balai Besar Penelitian dan Pengembangan Pascapanen Pertanian, Cimanggu, Bogor.
HASIL
Peremajaan Streptomyces Isolat 45I-3,
234P-16, dan SKK1-8
Ketiga isolat Streptomyces yaitu isolat 45I-3, 234P -16, dan SKK1-8 yang ditumbu hkan pada media agar-agar xilan masing-masing memperlihatkan bentuk koloni dan warna spora yang berbeda-beda (Gambar 1). Masing-masing isolat
Streptomyces tersebut memperlihatkan kemampuan xilanolitik yang ditunjukkan dengan terbentuknya zone bening di sekitar koloni pada media agar-agar xilan dengan visualisasi menggunakan pewarna merah kongo 0.1 % (Gambar 2).
Gambar 1 Koloni Streptomyces isolat SKK1-8, 234P-16, dan 45I-3 pada media agar-agar xilan setelah diinkubasi selama lima hari.
Gambar 2 Kemampuan xilanolitik
Streptomyces isolat 45I-3, 234P-16, dan SKK1-8 pada media agar -agar xilan setelah diinkubasi selama dua hari.
Penentuan Waktu Optimum Produksi dan Aktivitas Xilanase Harian
4
Gambar 6 Stabilitas xilanase isolat 234P-16, 45I-3, dan SKK1-8 pada suhu optimum. Gambar 5 Pengaruh jenis substrat xilan
terhadap aktivitas xilanase isolat SKK1-8 dan 45I-3
Produksi xilanase ekstraseluler oleh ketiga isolat mencapai optimum masing-masing pada saat umur biakan mencapai hari ke-8 dengan aktivitas 0.917 Unit/ml (45I-3), hari ke-5 dengan aktivitas 0.423 Unit/ml (234P-16), dan hari ke-10 dengan aktivitas 1 Unit/ml (SKK1-8) (Gambar 3).
Penentuan Aktivitas Enzim pada Beberapa Jenis Substrat Xilan
Xilanase isolat 234P-16 dan SKK1-8 menunjukkan aktivitas tertinggi berturut-turut pada substrat jenis oatspelt xylan, wheat arabino xylan, beechwood xylan, dan
birchwood xylan, sedangkan xilanase isolat 45I-3 berturut -turut pada substrat jenis
oatspelt xylan, beechwood xylan, birchwood xylan, dan wheat arabino xylan (Gambar 4 & 5).
Aktivitas paling rendah dari ketiga isolat, yaitu pada substrat CMC (Gambar 4 & 5), dan bahkan xilanase isolat 45I-3 tidak menunjukkan aktivitas sama sekali pada substrat tersebut (Gambar 5).
Uji Kestabilan Xilanase Ekstrak Kasar
Xilanase isolat 234P -16 memperlihatkan kenaikan aktivitas selama perlakuan inkubasi di suhu optimumnya hingga 4 jam masa inkubasi kemudian turun pada jam -jam berikutnya. Aktivitas xilanase isolat 45I-3 dan SKK1-8 terus mengalami penurunan pada perlakuan inkubasi di suhu optimumnya (Gambar 6).
Berdasarkan kurva hubungan antara log unit aktivitas (Unit/ml) dengan waktu inkubasi diketahui waktu paruh masing-masing enzim, yaitu 23 jam 9 menit (234P-16), 2 jam 9 menit (45I-3), dan 1 jam 45 menit ( SKK1-8).
Pada suhu 3 oC, xilanase ketiga isolat memperlihatkan aktivitas yang stabil. Hal ini diperlihatkan oleh bentuk kurva aktivitas dengan bentuk mendatar (Gambar 7).
Pengendapan Xilanase Ekstrak Kasar dengan Aseton
Penentuan konsentrasi optimum aseton yang digunakan untuk pengendapan ditunjukkan oleh data hubungan antara konsentrasi aseton (% v/v) dengan unit aktivitas enzim (Unit/ml). Konsentrasi aseton yang menghasilkan aktivitas xilanase tertinggi untuk ketiga isolat masing-masing, yaitu 90% untuk isolat 234-P-16 dan SKK-1-8, dan 80% untuk isolat 45I-3 (Tabel 1).
0 0.05 0.1 0.15 0.2
0 2 4 8 24
Jam
ke-Aktivitas Xilanase (Unit/ml) 0 0.2 0.4 0.6
0 2 4 8 24
Jam
ke-Aktivitas Xilanase (Unit/ml)
0 0.5 1 1.5
0 4 8 12 18 30
Jam
ke-Aktivitas Xilanase (Unit/ml)
234P-16 SKK1-8 45I-3
Gambar 4 Pengaruh jenis substrat xilan terhadap aktivitas xilanase isolat 234P-16 0 0.05 0.1 0.15 0.2 0.25
0atspelt CMC Arabino Beechwood Birchwood
Jenis Substrat Xilan
Aktivitas Xilanase (Unit/ml)
0 0.5 1 1.5 2
0atspelt CMC Arabino Beechwood Birchwood
Jenis Substrat Xilan
Aktivitas Xilanase (Unit/ml)
SKK-1-8 45I-3 0 0.5 1 1.5 2 2.5
0 4 8 12 18 24 48 168
Jam
ke-Aktivitas Xilanase (Unit/ml)
234-P-16 SKK 1-8 45I-3 Gambar 7 Stabilitas xilanase isolat
5
Aktivitas Unit (U/ml) Konsentrasi
Aseton 45I-3 234P-16 SKK1-8
Kontrol * 2.12 0.32 0.23
60% 10.25 0.12 0.11
70% 11.24 0.21 0.32
80% 13.10 0.69 1.18
90% 9.26 1.19 1.38
Tabel 1 Aktivitas xilanase (U/ml) hasil pengendapan dengan berbagai konsentrasi aseton
* Kontrol merupakan ekstrak kasar enzim tanpa pengendapan dengan aseton
Analisis Sodium Dodecyl Sulfate
Polyacrylamide Gel Electrophoresis (SDS -PAGE) dan Zimogram
Hasil SDS-PAGE xilanase fraksi aseton ketiga isolat didapatkan sedikitnya 18 pita protein untuk isolat 234P-16 (Gambar 8A), 17 pita protein untuk isolat SKK1-8 (Gambar 9A), dan 22 pita protein untuk isolat 45I-3 (Gambar 10A).
Dari hasil zimogram xilanase fraksi aseton ketiga isolat, diketahui terdapat beberapa pita protein yang mampu menghidrolisis substrat birchwood xylan. Hasil zimogram menunjukkan bahwa fraksi aseton dari xilanase isolat 234-P-16 memiliki 2 pita aktif dengan kisaran bobot molekul 16.80 kDa dan 14.76 kDa (Gambar 8B), xilanase isolat SKK1-8 memiliki tiga pita protein aktif dengan kisaran bobot molekul sebesar 16.80 kDa, 15.21 kDa, dan 13.86 kDa (Gambar 9B), dan xilanase isolat 45I-3 memiliki 3 pita protein yang memiliki aktivitas xi lanolitik dengan kisaran bobot molekul sebesar 16.37 kDa, 14.39 kDa, dan 12.65 kDa (Gambar 10B ).
Analisis Produk Hidrolisis Birchwood xylan
dengan High Performance Liquid
Chromatography (HPLC)
Isolat 45I-3 menghasilkan produk hidrolisis berupa xilosa dan arabinosa dengan konsentrasi masing-masing 280.02 ppm dan 106.13 ppm, isolat SKK1-8 menghasilkan xilosa dengan konsentrasi 282.74 ppm dan arabinosa dengan konsentrasi 119.10 ppm, dan isolat 234P-16 menghasilkan xilosa dan arabinosa dengan konsentrasi masing-masing 26.55 ppm dan 96.61 ppm (Tabel 2).
Tabel 2 Produk hidrolisis xilanase isolat 45I-3, SKK1-8, dan 234P-16
Konsentrasi Produk (ppm) Isolat Xilosa Arabinosa
45I-3 280.22 106.13
SKK1-8 282.74 119.10
234P-16 26.55 96.61
16.80 kDa 14.76 kDa 14.76 kDa
16.80 kDa
Gambar 8 Profil SDS-PAGE (A) dan zimogram (B) xilanase fraksi aseton isolat 234P-16.
(A)
(B) 16.80 kDa 15.21 kDa 13.86 kDa 16.80 kDa 15.21 kDa 13.86 kDa
Gambar 9 Profil SDS-PAGE (A) dan zimogram (B) xilanase fraksi aseton isolat SKK1-8.
(A)
(B) 12.65 kDa 16.37 kDa 14.39 kDa 12.65 kDa 16.37 kDa 14.39 kDa
Gambar 10 Profil SDS-PAGE (A) dan zimogram (B) xilanase fraksi aseton isolat 45I -3.
(A)
6
PEMBAHASAN
Isolat 234P-16, 45I -3, dan SKK1-8 mampu memanfaatkan xilan sebagai sumber karbon. Kemampuan xilanolitik dari ketiga isolat tersebut ditunjukkan dengan terbentuknya zone bening pada media agar-agar xilan setelah diinkubasi selama dua hari pada suhu ruang (Gambar 2).
Media yang mengandung birchwood xylan 0.5 % (b/v) mampu menginduksi sintesis xilanase. Peningkatan unit aktivitas xilanase selama inkubasi kultur hingga waktu optimumnya menunjukkan terjadinya induksi xilanase pada masing-masing isolat. Menurut Beg et al. (2001) sintesis xilanase akan diinduksi oleh media yang mengandung residu xilan atau xilan murni. Selain itu senyawa-senyawa seperti xilooligosakarida, xilosa, dan residu lignoselulosa juga dapat menginduksi disintesis nya xilanase. Keberadaan sumber jenis karbon lain seperti glukosa dilaporkan dapat menekan sintesis xilanase (Beg et al.2001).
Penurunan unit aktivitas xilanase ketiga isolat setelah mencapai waktu optimumnya diduga terjadi akibat efek feedback inhibition. Menurut White (1995), produk akhir dari enzim biasanya akan memberikan efek alosterik negatif terhadap kerja enzim. Selain itu penurunan unit aktivitas enzim juga dimungkinkan terjadi akibat menurunnya jumlah substrat yang tersedia di dalam kultur sehingga mengakibatkan kompetisi penggunaan substrat oleh jumlah sel yang semakin bertambah dan juga akibat adanya aktivitas proteolisis (Kansoh & Nagieb 2004). Aktivitas proteolisis dapat disebabkan oleh dihasilkannya protease indigenus yang lepas ke dalam media akibat pecahnya sel yang telah mati.
Perbedaan waktu optimum produksi xilanase ketiga isolat menunjukkan terdapatnya keragam an fisiologi di antara masing-masing isolat dalam hal memanfaatkan xilan sebagai sumber karbon.
Jika dibandingkan dengan xilanase kedua isolat lainnya, xilanase isolat 234P-16 memiliki waktu paruh enzim yang lebih lama pada suhu optimumnya, s ehingga dapat dikatakan xilanase isolat 234P-16 lebih stabil jika dibandingkan xilanase kedua isolat lainnya.
Penurunan unit aktivitas xilanase seiring bertambahnya waktu inkubasi pada suhu optimum diduga berkaitan dengan berubahnya struktur tiga dimensi protein enzim yang
Pada suhu 3 oC xilanase ketiga isolat memperlihatkan unit aktivitas yang stabil hingga mencapai waktu satu minggu . Hal tersebut mengindikasikan tidak terjadinya denaturasi atau perusakan protein enzim pada saat inkubasi.
Beberapa pita aktif yang dihasilkan pada profil zimogram menunjukkan kemungkinan dihasilkannya beberapa enzim yang berbeda oleh ketiga isolat. Hal ini didukung oleh hasil HPLC yaitu dihasilkannya produk gula yang berbeda diantaranya berupa xilosa dan arabinosa. Dihasilkannya xilosa menunjukkan aktivitas ß-xilosidase yang bekerja membebaskan xilosa dari ujung-ujung non pereduksi tulang punggung xilan, sedangkan dihasilkannya arabinosa menunjukkan terdapatnya aktivitas a-L-arabinofuranosidase yang bekerja membebaskan rantai samping arabinosa.
Isolat 45 I-3 dan SKK1-8 lebih banyak menghasilkan produk berupa xilosa dibanding arabinosa, hal ini diduga karena aktivitas ß-xilosidase yang menghasilkan xilosa lebih tinggi dibandingkan aktivitas a-L-arabinofuranosidase. Hal sebaliknya diperlihatkan oleh isolat 234P-16, dimana produk berupa arabinosa lebih banyak dibanding xilosa, hal tersebut diperkirakan terjadi karena aktivitas a-L-arabinofuranosidase dari isolat ini untuk membebaskan rantai samping gula arabinosa lebih tinggi jika dibandingkan dengan aktivitas ß-xilosidase.
Dari hasil penentuan bobot molekul protein enzim, xilanase ketiga isolat termasuk ke dalam kelompok xilanase dengan bobot molekul yang rendah (<30 kDa) berdasarkan klasifikasi xilanase menjadi famili 10 dengan bobot molekul berat (>30 kDa) dan famili 11 dengan bobot molekul rendah (<30 kDa) (Collins 2002). Wang et al. (2003) melaporkan bobot molekul xilanase
Streptomyces actuosus A-151 berada pada kisaran 21-43 kDa, tiga xilanase Streptomyces lividans memiliki bobot molekul masing-masing 22 kDa, 31 kDa, 45 kDa (Shareck et
al. diacu dalam K aneko et al.2000), dan salah satu dari tiga xilanase yang dihasilkan oleh
Streptomyces sp. strain S38 memiliki bobot molekul rendah (Georis et al.2000).
Beberapa xilanase dengan bobot molekul rendah dari s elain Streptomyces diantaranya, endoxilanase Trichoderma longbrachiatum
7
lanuginosus memiliki bobot molekul sebesar 18 kDa dan 19.6 kDa.
Keragaman karakter xilanase juga diperlihatkan oleh perbedaan aktivitas xilanase masing-masing isolat pada beberapa jenis substrat xilan. Hal ini dapat dilihat dari perbedaan urutan jenis substrat xilan yang memberikan aktivitas tertinggi antara xilanase isolat 234P-16 dan SKK1-8 dengan isolat 45I-3. Aktivitas tertinggi xilanase isolat 234P-16 dan SKK1-8 berturut -turut pada substrat
oatspelt xylan, wheat arabino xylan, beechwood xylan, dan birchwood xylan, sedangkan pada isolat 45I -3 urutan aktivitas tertinggi ke-2, ke-3, dan ke-4 setelah oatspelt xylan ditempati oleh substrat beechwood xylan, birchwood xylan, dan wheat arabino xylan.
Xilanase ketiga isolat menunjukkan aktivitas tertinggi pada substrat jenis oatspelt xylan. Hal ini sesuai dengan yang dilaporkan Georis et al. (2000) yaitu xilanase
Streptomyces sp. strain S38 dan Streptomyces malaysiensis (Nascinento et al. 2003) memiliki aktivitas yang lebih tinggi pada substrat jenis oatspelt xylan dibandingkan substrat birchwood xylan. Demikian juga pada
Streptomyces halstedii JM8 (Ruiz-Arribas et al. 1995), xilanasenya menunjukkan aktivitas tertinggi pada substrat oatspelt xylan.
Enzim dari ketiga isolat memperlihatkan aktivitas yang sangat rendah pada substrat jenis CMC. Hal ini seperti yang telah dilaporkan sebelumnya, dimana Streptomyces galbus NR (Kansoh & Nagieb 2004),
Streptomyces sp. S38 (Georis et al. 2000),
Streptomyces halstedii JM8 (Ruiz-Arribas et al. 1995), Streptomyces viridosporus T7A (Magnuson & Crawford 1997) tidak menunjukkan aktivitas hidrolitik pada substrat jenis CMC. Pengujian xilanase terhadap substrat jenis CMC perlu dilakukan karena menurut Tjusibo et al. (1991) ada beberapa xilanase yang tidak hanya dapat menghidrolisis xilan namun juga selulosa. Aktivitas yang rendah pada media CMC menunjukkan tidak dihasilkannya enzim selulase yang memiliki aktivitas hidrolitik terhadap struktur selulosa.
SIMPULAN
Keragaman karakter xilanase dari ketiga isolat Streptomyces diperlihatkan oleh perbedaan w aktu optimum produksi, bobot molekul, kestabilan, produk hidrolisis, dan aktivitasnya pada beberapa jenis substrat xilan.
Waktu optimum produksi xilanase isolat 45I-3, SKK1-8, dan 234P-16 masing-masing tercapai pada saat umur biakan mencapai 8 hari, 10 hari, dan 5 hari.
Isolat 45I -3 menghasilkan xilanase dengan kisaran bobot molekul 16.37 kDa, 14.39 kDa, dan 12.65 kDa, xilanase isolat SKK1-8 memiliki kisaran bobot molekul 16.80 kDa, 15.21 kDa, dan 13.86 kDa, dan xilanase isolat 234P-16 memiliki kisaran bobot molekul sebesar 16.80 kDa dan 14.76 kDa. Xilanase ketiga isolat dapat diendapkan menggunakan aseton.
Pada perlakuan inkubasi di suhu optimum, xilanase isolat 234P-16, 45I-3, dan SKK1-8 memperlihatkan waktu paruh enzim masing-masing selama 23 jam 9 menit, 2 jam 16 menit, dan 1 jam 45 menit. Aktivitas xilanase ketiga isolat stabil pada perlakuan inkubasi di suhu 3 oC. Ketiga isolat juga memperlihatkan aktivitas yang tertinggi pada substrat jenis oatspelt xylan dan terendah pada substrat jenis CMC. Isolat 45I-3 dan SKK1-8 lebih banyak menghasilkan produk hidrolisis dari birchwood xylan berupa xilosa dibanding arabinosa, dan sebaliknya isolat 234P-16 lebih banyak menghasilkan arabinosa dibanding xilosa.
SARAN
Untuk melihat produk hidrolisis xilanase ketiga isolat , disarankan menggunakan standar gula yang lain seperti xilooligosakarida pada saat analisis HPLC, sehingga efisiensi hidrolisis xilanase ketiga isolat terhadap substrat xilan dapat ditentukan dengan akurat.
Karena xilanase yang dikarakterisasi dan diuji masih berupa ekstrak kasar, maka teknik purifikasi perlu dilakukan untuk mem peroleh xilanase yang murni, setelah itu kar akterisasi lanjutan juga perlu dilakukan untuk membandingkan karakteristik xilanase ketiga isolat sebelum dan sesudah dimurnikan.
Dan untuk meningkatkan kestabilan xilanase dalam aplikasi kedepan pada bidang industri, teknik imobilisasi enzim perlu dilakukan untuk melihat apakah xilanase ketiga isolat stabil apabila diimobilisasi.
DAFTAR PUSTAKA
Ali MK, Rudolph FB, Bennett GN. 2004. Thermostable xylanases 10B from
8
Beg QK, Kapoor M, Mahajan L, Hoondal GS. 2001. Microbial xylanases and their industrial applications: a review. Appl Microbiol Biotech 56: 326-338.
Belfaquih N, Penninckx MJ. 2000. A bifunctional ß-xylopsidase-xylose isomerase from Streptomyces sp. EC 10.
Enzyme Microb Techl 27: 114-121. Breccia JD, Sineriz F, Baigori MD, Castro
GR, Hatti-Kaul R. 1998. Purification and characterization of a thermostable
xylanase from Bacillus
amyloliquefaciens. Enzyme Microbiol Tech 22:42-49.
Chen C, Chen JL, Lin TY. 1997. Purification and characterization of a xylanase from
Trichoderma longbrachiatum for xylooligosaccharide production. Enzyme Microbiol Tech 21: 91-96.
Collins T, et al. 2002. A novel family 8 xylanase, functional and physicochemical characterization. J Biological Chem 277: 35113-35139.
Deobald LA, Crawford D. 2002. Lignocellulose biodegradation. Di dalam: Hurst CJ, Crawford RL, Kudsen GR, Mclnerney MJ, Stetzenbach LD, editor.
Manual of Enviromental Microbiology. Ed ke-2. Washington: ASM Press. Devillard E, et al. 2003. Characterization of
XYN10B, a modular xylanase from the ruminal protozoan Polyplastron multivesiculatum, with a family 22 carbohydrat e-binding module that binds to cellulose. Biochem J 373: 495-503. Dusterhoft EM, Linssen VAJM, Voragen
AGJ, Beldman G. 1997. Purification, characterization, and properties of two xylanases from Humicola insolens.
Enzyme Microbiol Tech 20: 437-445. Ensign JC. 1992. Introduction to the
Actinomycetes. Di dalam: Balows A, Truper H, Dworkin M, Harder W, Schleifer KH, editor. The Procaryotes, A Handbook On The Bacteria: Ecophysiology, Isolation, Identification, Applications. Ed ke-2. Volume ke-1. New York: Springer-Verlag.
Georis J, Giannotta F, De Buylb E, Granier B, Frere JM. 2000. Purification and properties of three endo-ß-1,4-xylanases produced by Streptomyces sp. strain S38 which differ in their ability to enhance the bleaching of kraft pulps. Enzyme Microbiol Tech 26: 178 -186.
Gilbert HJ, Hazlewood GP. 1993. Bacterial cellulase and xylanases (review article). J
Kaneko S, et al. 2000. Purification and characterization of a family G/11 ß-xylanase from Streptomyces olivaceoviridis E-86. Bioschi Biotech Biochem 64: 447-451.
Kans oh AL, Nagieb ZA. 2004. Xylanase and mannanase enzymes from Streptomyces galbus NR and their use in bioleaching of shoftwood kraft pulp. Antonie Van Leeuwenhoek 85: 103-114.
Kubata BK, Suzuki T, Horitsu H, Kawal K, Takamizawa K. 1994. Purification and characterization of Aeromonas caviae
M E-1 xylanases V, which produces exclusevely xylobiose from xylan. Appl Environ Microbiol 60(2): 531-535. Kulkarni NA, Shendye, Rao M. 1999.
Molecular and biotechnologycal aspect of xylanases. FEMS Microbiol Rev 23: 411-456.
Laemmli UK. 1970. Cleavage of structural proteins during the assembly of the head of bacteriophage T4. Nature 227: 680-685.
Li K, Azadi P, Collins R, Tolan J, Kim JS, Eriksson KL. 2000. Relationship between activities of xylanases and xylan structures. Enzyme Microb Technol 27: 89-94.
Lin J, Ndlovu LM, Singh S, Pillay B. 1999. Purification and biochemical characteristics of ß-D -xylanase from thermophilic fungus, Thermomyces lanuginosus-SSBP. Biotechnol Appl Biochem 30: 73-79.
Madigan MT, Martinko JM, Parker J. 2000.
Brock Biology of Microorganisms. Ed ke-9. New Jersey: Prentice Hall Internasional Inc.
Magnuson TS, Crawford DL. 1997. Purification and characterization of an alkaline xylanase from Streptomyces viridosporus T7A. Enzyme Microbiol Tech 21: 160-164.
Miller GL. 1959. Dinitrosalisilic assay. Anal Chem 31: 426-428.
Nascinento RD, Marques S, Alves L, Amaral-Collaco MT. 2003. A novel strain of
Streptomyces malaysiensis isolated from Brazilia soil produces high endo-ß-1,4-xylanase titres. World J Microbiol Biotech 19: 878 -881.
Perez J, Munoz -Dorado J, De La Rubia T, Martinez J. 2002. Biodegradation and biological treatments of cellulose, hemicellulose and lignin: an overview.
9
Ruiz -Arribas A, Abalos JMF, Shanchez P, Garda AL, Santamaria RI. 1995. Overproduction, purification, and biochemical characterization of a xylanases (xys1) from Streptomyces halstedii JM8. Appl Environ Microbiol 61(6): 2414-2419.
Ryan RE, et al. 2003. Purification and characterization of a new low molecular weight endoxylanase from Penicillium capsulatum. Enzym Microbiol Technol
33: 775-785.
Saha BC. 2002. Purification and characterization of an extracellular ß-xylosidase from a newly isolated
Fusarium verticilloides. J Industrial Microbiol Biotechnol 27: 241 -245. Saha BC. 2003. Hemicellulose bioconversion.
J Ind Microbiol Biotechnol 30: 279-291. Salisbury FB, Ross CW. 1995. Fisiologi
Tumbuhan. Jilid ke-1.Ed ke-4. Lukman DR, Su maryono, penerjemah; Niksolihin S, editor. Bandung: Penerbit ITB. Terjemahan dari: Plant Physiology. Ed ke-4.
Scopes RK. 1987. Protein Purification, Principles and Practice. Ed ke-2. New York: Springer-Verlag.
Silveira FQP, et al. 1999. Hydrolysis of xylans by enzyme systems from solid cultures of Trichoderma harzianum
strains. Braz J Med Biol Res 32: 947-952. Subramaniyan S, Prema P. 2002.
Biotechnology of microbial xylanases: enzymology, molecular biology, and application. Critical Rev in Biotech 22(1): 33-64.
Sunna A, Prowe SG, Stoffregen T, Antranikian G. 1997. Characterization of the xylanases from the new isolated thermophilic xylan-degrading Bacillus thermoleovorans strain K-3d and Bacillus flavothermus strain LB3A. FEMS Microbiol Letters 148: 209-216.
Tjusibo H, et al. 1991. Purification, properties, and partial amino acid sequences of thermostable xylanases from Streptomyces thermoviolaceus
OPC-520. Appl Environt Mirobiol 58: 371-375.
Tseng MJ, Yap MN, Ratanakhanokchai K, Kyu KL, Chen ST. 2002. Purification and partial characterization of two cellulase free xylanases from an alkaliphilic
Bacillus firmus. Enzyme Microb Tech 30: 590-595.
Wang SL, et al. 2003. Production of xylanases from rice bran by Streptomyces
actuosus A-151. Enzym Microbiol Tech
33: 917-925.
Wendisch FK, Kutzner HJ. 1992. Role of Streptomycetaceae in biodegradation. Di dalam: Balows A, Truper H, Dworkin M, Harder W, Schleifer KH, editor. The Procaryotes, A Handbook On The Bacteria: Ecophysiology, Isolation, Identification, Applications. Ed ke-2. Volume ke-1. New York: Springer-Verlag.
10
11
Lampiran 1 Komposisi media agar xilan dan media produksi xilanase (Ruiz-Arribas et al. 1995)
Bahan Media produksi (% w/v) Media agar xilan (% w/v)
Ekstrak khamir Sukrosa Birchwood xylan Agar-agar 1 10.3 0.5 - 1 10.3 0.5 1.5
Lampiran 2 Komposisi gel poliakrilamid (15 %)
Bahan Gel pengumpul (ml) Gel pemisah (ml)
Aquades Tris-HCl pH 6.8 SDS
Akrilamid
Amonium persulfat TEMED
Tris-HCl pH 8.8
Birchwood xylan 11 - 0.16 2.6 0.16 0.016 2 - 6.9 7.5 0.3 25 0.3 0.012 - 1 %
Lampiran 3 Komposisi Reagen Dinitrosalisilic Acid (DNS) (Miller 1959)
NaOH padat……….10 gr KNa Tartrat………182 gr Na2SO3 ………...0.5 gr
Dinitrosalisilic acid (DNS) ……… 10 gr Aquades ………1000 gr
Lampiran 4 Jumlah aseton yang ditambahkan dalam 10 ml ekstrak kasar enzim (Scopes 1987)
Konsentrasi Aseton (% v/v) Jumlah aseton (ml)
60 70 80 90 15 23.33 40 90
Lampiran 5 Penentuan aktivitas xilanase (Miller 1959)
Bahan Jumlah Kontrol Sampel Blanko
Substrat
Buffer pH optimum Enzim
DNS Aquades
1 ml 900 µl 100 µl 3 ml 1 ml
Ya Ya Ya (setelah DNS)
Ya -
Ya Ya Ya (sebelum DNS) Ya (setelah inkubasi)
- Ya - - Ya Ya
Aktivitas xilanase dihitung dengan rumus :
1 Unit Aktivitas Xilanase ~ 1 µmol xilosa / menit
Aktivitas xilanase (U/ml) =
Xilosa BM x T 1000 n Pengencera F. x Ckt)
12
Keterangan
Csp : Kadar xilosa sampel Ckt : Kadar xilosa kontrol T : Waktu inkubasi (30 menit) BM xilosa : 150.13 g/mol
Lampiran 6 Aktivitas xilanase (Unit/ml) harian
Hari ke - Isolat
2 3 4 5 6 7 8 9 10 11
SKK1-8 0.171 0.261 0.251 0.245 0.255 0.288 0.493 1.000 0.686
45I-3 0.525 0.723 0.803 0.782 0.736 0.711 0.917 0.801 0.801
234P-16 0.192 0.203 0.231 0.423 0.200 0.215 0.220 0.164 0.236
Lampiran 7 Aktivitas xilanase (Unit/ml) pada uji stabilitas di suhu dan pH optimum
Jam
ke-Isolat Suhu
Optimum 0 2 4 8 12 18 24 30
SKK1-8 50oC 0.432 0.145 0.100 0.061 0.059
45I-3 50oC 1.349 0.727 0.472 0.217 0.060 0.031
234P -16 90oC 0.091 0.144 0.160 0.129 0.032
Lampiran 8 Aktivitas xilanase (Unit/ml) pada uji stabilitas di suhu 3 oC dan pH optimum
Jam ke-Isolat
0 4 8 12 18 24 48 168 672
SKK1-8 0.432 0.367 0.475 0.376 0.317 0.386 0.272 0.424 1.101 45I-3 1.349 1.339 1.377 1.395 1.323 1.272 1.312 1.025 2.056 234P -16 0.091 0.070 0.069 0.057 0.129 0.095 0.059 0.110 0.355
Lampiran 9 Aktivitas xilanase (Unit/ml) pada beberapa jenis substrat
Jenis Substrat Isolat
0atspelt CMC Arabino Beechwood Birchwood
SKK1-8 1.135 0.021 0.906 0.801 0.656
45I-3 1.874 0.000 1.610 1.872 1.705
234P-16 0.204 0.084 0.150 0.141 0.088
Lampiran 10 Aktivitas xilanase (Unit/ml) pada beberapa konsentrasi pengendapan aseton
Konsentrasi Isolat
Ekstrak kasar 60 70 80 90
Endapan 0.11 0.32 1.18 1.38
SKK1-8
Supernatan 0.23 0.006 0.006 0.008 0.000
Endapan 10.25 11.24 13.10 9.26
45I-3
Supernatan 2.12 0.09 0.07 0.05 0.00
Endapan 0.12 0.21 0.69 1.19
234P -16
13
Lampiran 11 Profil kromatogram hasil analisis HPLC xilanase isolat 45I -3, SKK1-8, dan 234P-16
CROMATOPAC C-R6A
FILE
0
SAMPLE NO
0
METHODE
41
REPORT NO
495
PKNO
TIME
AREA MK
IDNO
CONC
NAME
1
3.032 1876963 E 400 ppm Xilosa
2 4.115
2538766 V
400 ppm
Arabinosa
TOTAL 4409729 800 ppm
CROMATOPAC C-R6A
FILE
0
SAMPLE NO
0
METHODE
41
REPORT NO
496
PKNO
TIME
AREA MK
IDNO
CONC
NAME
1
3.05 1309757 E 280 ppm Xilosa
2 4.093
673620 V
106 ppm
Arabinosa
TOTAL 1983378 386 ppm
Stand ar Xilosa dan Arabinosa
14
CROMATOPAC C-R6A
FILE
0
SAMPLE NO
0
METHODE
41
REPORT NO
497
PKNO
TIME
AREA MK
IDNO
CONC
NAME
1
2.987 1322486 E 283 ppm Xilosa
2 3.995
755911 V
119 ppm
Arabinosa
TOTAL 2078397 402 ppm
CROMATOPAC C-R6A
FIL E
0
SAMPLE NO
0
METHODE
41
REPORT NO
498
PKNO
TIME
AREA MK
IDNO
CONC
NAME
1
3.167 124195 E 27 ppm Xilosa
2 4.05
625874 V
97 ppm Arabinosa
TOTAL 2078397 124 ppm
Perhitungan
:
(Standar) xilosa
ppm (Standar) xilosa
area Luas
(Sampel) xilosa
area Luas (Sampel) xilosa
ppm = ×
(Standar) arabinosa ppm
(Standar) arabinosa
area Luas
(Sampel) arabinosa
area Luas (Sampel) arabinosa
ppm = ×
15
Isolat 45I-3
ppm 280.02 ppm 00 4 1876963 1309757 xilosa
ppm = × =
ppm 106.13 ppm 400 2538766
673620 arabinosa
ppm = × =
Isolat SKK1-8
ppm 74 . 282 ppm 00 4 1876963 1322486 xilosa
ppm = × =
ppm 119.10 ppm 400 2538766
755911 arabinosa
ppm = × =
Isolat 234P-16
ppm 55 . 26 ppm 00 4 1876963
124195 xilosa
ppm = × =
ppm 98.61 ppm 400 2538766
625874 arabinosa
16