KADAR GENISTEIN DAN DAIDZEIN PADA KEDELAI,
AMPAS TAHU, DAN ONCOM MERAH
RIMA JANNATUN NI’MAH
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
KADAR GENISTEIN DAN DAIDZEIN PADA
KEDELAI, AMPAS TAHU, DAN ONCOM MERAH
RIMA JANNATUN NI’MAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Kimia
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul : Kadar Genistein dan Daidzein pada Kedelai, Ampas Tahu, dan
Oncom Merah
Nama : Rima Jannatun Ni’mah
NIM : G44204007
Disetujui
Pembimbing I,
Pembimbing II,
Ir. Elly Suradikusumah, MS
NIP 130 350 043
Dr. dr. Irma H. Suparto, MS
NIP 131 606 776
Diketahui
Dekan Fakultas Matematika dan Ilmu Pengetahuan Alam
Institut Pertanian Bogor,
Dr. drh. Hasim, DEA
NIP 131 578 806
ABSTRAK
RIMA JANNATUN NI’MAH. Kadar Genistein dan Daidzein pada Kedelai,
Ampas tahu, dan Oncom Merah. Dibimbing oleh ELLY SURADIKUSUMAH
dan IRMA HERAWATI SUPARTO.
Isoflavon (genistein dan daidzein) terdapat pada kacang-kacangan,
terutama kedelai. Kedelai dapat diolah menjadi tahu dan diperoleh hasil samping
berupa ampas tahu yang selanjutnya diolah menjadi oncom merah. Kedelai,
ampas tahu, dan oncom merah yang dianalisis pada penelitian ini diharapkan
mengandung genistein dan daidzein dengan kadar yang cukup tinggi.
Kedelai, ampas tahu, dan oncom merah dihidrolisis menggunakan HCl 4 N
dan etanol, yang selanjutnya dipartisi menggunakan etil asetat. Pemurnian
komponen menggunakan
flash chromatography
dan kadarnya ditentukan dengan
kromatografi cair kinerja tinggi. Kadar genistein dan daidzein pada kedelai
sebesar 128.69 mg/100g dan 134.46 mg/100g. Ampas tahu memiliki kadar
genistein dan daidzein sebesar 65.93 mg/100g dan 63.68 mg/100g, sedangkan
oncom merah kadar genistein dan daidzeinnya adalah 32.41 mg/100g dan 27.70
mg/100g. Kedelai memiliki kadar genistein dan daidzein dua kali lebih tinggi
dibandingkan dengan ampas tahu dan empat kali lebih tinggi dibandingkan
dengan oncom merah.
ABSTRACT
RIMA JANNATUN NI’MAH. Genistein and Daidzein Content of Soybean,
Tofu Waste, and “Oncom Merah”. Supervised by ELLY SURADIKUSUMAH
and IRMA HERAWATI SUPARTO.
Isoflavone (genistein and daidzein) can be found in Leguminosae,
especially in soybean. Soybean can be processed into tofu and get around to tofu
waste, which can be processed finally to “oncom merah”. Soybean, tofu waste,
and “oncom merah” had been analysed in this research for genistein and daidzein
contents.
PRAKATA
Puji dan syukur penulis panjatkan ke hadirat Allah SWT, Tuhan semesta
alam, karena berkat rahmat-Nya lah penulis dapat menyelesaikan karya ilmiah
yang berjudul Kadar Genistein dan Daidzein pada Kedelai, Ampas Tahu, dan
Oncom Merah. Penelitian dilaksanakan dari bulan April sampai Agustus 2008 di
Laboratorium Kimia Analitik, Pusat Studi Biofarmaka, LPPM IPB, dan Balai
Besar Pascapanen, Cimanggu, Bogor.
Terima kasih penulis ucapkan kepada Ibu Ir. Elly Suradikusumah, MS dan
Ibu Dr. dr. Irma Herawati Suparto, MS selaku pembimbing yang telah
memberikan arahan serta bimbingan dengan sabar, sehingga karya ilmiah ini
dapat diselesaikan. Penulis juga mengucapkan terima kasih kepada PSB, LPPM
IPB dan Balai Besar Pascapanen yang telah memberi izin penggunaan alat.
Ucapan terimakasih yang sebesar-besarnya kepada Bapak Eman, Ibu Nunung,
seluruh staf laboratorium Kimia Analitik, Kimia Anorganik, Budi, Anah, Retno,
Desti, Rini, Anti, Tri, dan Dewi yang telah membantu memberikan masukan
serta memecahkan masalah yang penulis hadapi selama penelitian. Tidak lupa
juga ucapan terima kasih penulis sampaikan untuk Bapak, Mamah, dan keluarga
tercinta yang selalu memberikan dukungan moril dan materil. Terimakasih atas
bantuan dan semangat yang diberikan, mudah-mudahan mendapat balasan dari
Allah SWT. Amin.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2008
RIWAYAT HIDUP
Penulis dilahirkan di Bogor pada tanggal 1 Maret 1986 dari pasangan
Lukman Hakim dan Tutih Mulyati. Penulis adalah anak ke-3 dari 4 bersaudara.
Tahun 2004 penulis lulus dari SMUN 1 Leuwiliang dan pada tahun yang
sama lulus seleksi masuk IPB melalui jalur Undangan Seleksi Masuk IPB
(USMI) dan memilih Program Studi Kimia, Departemen Kimia, Fakultas
Matematika dan Ilmu Pengetahuan Alam IPB.
DAFTAR ISI
Halaman
DAFTAR TABEL ...
iv
DAFTAR GAMBAR ...
iv
DAFTAR LAMPIRAN ...
iv
PENDAHULUAN ...
1
TINJAUAN PUSTAKA
Kedelai
...
1
Ampas Tahu ...
2
Oncom Merah ...
2
Isoflavon
...
3
Teknik Pemisahan Isoflavon ...
4
Kromatografi Cair Kinerja Tinggi (KCKT) ...
4
BAHAN DAN METODE
Bahan dan Alat ...
5
Metode
...
5
HASIL DAN PEMBAHASAN
Kadar
Air
...
6
Ekstraksi
...
6
Hasil Pemurnian Komponen ...
7
Analisis
KCKT
...
7
SIMPULAN DAN SARAN
Simpulan
...
9
Saran
...
9
DAFTAR PUSTAKA ...
9
DAFTAR TABEL
Halaman
1 Komposisi gizi ampas tahu per 100 g bahan basah ...
2
2 Penggabungan komponen hasil KLT ...
7
3 Kadar total genistein dan daidzein ...
9
DAFTAR GAMBAR
Halaman
1 Tanaman kedelai ...
2
2 Bentuk dan warna kacang kedelai ...
2
3 Oncom merah ...
3
4 Instrumen
flash chromatography
...
4
5 Diagram alir KCKT
...
5
6 Kromatogram sampel hasil KLT ...
7
7 Kromatogram standar (a) genistein; (b) daidzein ...
8
DAFTAR LAMPIRAN
Halaman
1 Proses pembuatan tahu ...
13
2 Bagan alir penelitian ...
14
3 Penentuan kadar air kedelai, ampas tahu, dan oncom merah ...
15
4 Penentuan rendemen ekstrak kedelai, ampas tahu, dan oncom merah ...
15
5 Jarak Rf kedelai hasil fraksinasi ...
16
6 Jarak Rf ampas tahu dan oncom merah hasil fraksinasi ...
16
7 Kromatogram hasil KCKT ...
17
8 Penentuan kadar genistein kedelai, ampas tahu, dan oncom merah ...
19
1
PENDAHULUAN
Isoflavon termasuk ke dalam golongan flavonoid yang memiliki distribusi terbatas dibandingkan dengan flavonoid. Flavonoid banyak ditemukan pada berbagai jenis tanaman, sedangkan isoflavon umumnya hanya terdapat pada kacang-kacangan, seperti kedelai. Kedelai memiliki kandungan isoflavon (genistein dan daidzein), fitosterol, asam fitat, asam lemak, saponin, asam fenolat, lesitin, dan inhibitor protease yang merupakan zat antioksidan dan dapat berkhasiat sebagai obat (Messina dalam Gilani & Anderson 2002). Kandungan isoflavon dalam kedelai lebih tinggi dibandingkan dengan tanaman bahan pangan lainnya. Pada kedelai, kandungan isolavon yang lebih tinggi terdapat pada biji kedelai, khususnya pada bagian hipokotil yang akan tumbuh menjadi tanaman (Anderson 1997).
Selama proses pengolahan, baik melalui proses fermentasi maupun non-fermentasi, senyawa isoflavon dapat mengalami transformasi, terutama melalui proses hidrolisis, sehingga dapat diperoleh senyawa isoflavon bebas (aglikon) yang memiliki aktivitas lebih tinggi dibandingkan dengan isoflavon dalam bentuk terikat (glikon). Senyawa aglikon tersebut adalah genistein, daidzein, dan sistein (Pawiroharsono 1994). Genistein dan daidzein mempunyai peran potensial dalam mencegah, mengurangi, atau menurunkan berbagai macam penyakit kronis, seperti jantung koroner, osteoporosis, kanker payudara, kanker prostat, kanker usus besar, kanker paru-paru, kanker kulit, dan kanker darah.
Genistein dan daidzein dikenal merupakan senyawa fitoestrogen, karena mempunyai sejumlah aktivitas estrogen. Estrogen dapat digunakan untuk pengobatan gejala pascamenopouse dan penghambat ovulasi untuk kontrasepsi (Murphy 1981). Kandungan zat dalam kedelai juga diyakini oleh masyarakat cukup berkhasiat untuk menyembuhkan penyakit diabetes, ginjal, anemia, rematik, diare, hepatitis, dan hipertensi.
Kedelai dapat diolah menjadi beberapa macam produk, antara lain susu kedelai, tempe, tauco, dan tahu. Proses pembuatan tahu memperoleh hasil samping berupa limbah cair dan limbah padat. Penggunaan limbah cair tahu masih terbatas, yaitu sebagian kecil digunakan sebagai biang tahu atau digunakan sebagai media pertumbuhan beberapa jenis bakteri. Hasil penelitian Ernita
(1995), menyebutkan bahwa limbah cair tahu masih mengandung senyawa isoflavon yaitu genistein dan daidzein. Limbah padat tahu, yaitu ampas tahu pada umumnya digunakan sebagai makanan ternak atau diolah menjadi oncom merah. Oncom merah merupakan makanan yang banyak dikonsumsi oleh masyarakat karena dapat menjadi sumber energi dan protein. Oncom merah dibuat dari ampas tahu yang diperkirakan masih mengandung senyawa-senyawa isoflavon seperti genistein dan daidzein. Jika kandungan genistein dan daidzein pada oncom merah cukup tinggi, maka oncom merah sangat baik digunakan sebagai makanan, karena proses pembuatannya lebih mudah dan harganya relatif lebih murah dibandingkan dengan produk olahan kedelai yang lain. Dengan demikian, ampas tahu dapat lebih bermanfaat bagi manusia daripada hanya digunakan sebagai makanan ternak. Oleh sebab itu, dalam penelitian ini akan dilakukan penentuan kadar genistein dan daidzein pada kedelai, ampas tahu, serta oncom merah menggunakan kromatografi cair kinerja tinggi (KCKT), dengan terlebih dahulu memurnikan ekstrak menggunakan flash chromatography.
Kedelai, ampas tahu, dan oncom merah yang dianalisis pada penelitian diharapkan mengandung genistein dan daidzein dengan kadar yang cukup tinggi, sehingga ampas tahu dan oncom merah dapat bernilai ekonomi.
TINJAUAN PUSTAKA
Kedelai
Kedelai merupakan tanaman semusim dengan tinggi berkisar 10–200 cm, berupa semak rendah, tegak, berdaun lebat, dapat bercabang sedikit atau banyak tergantung kultivar. Tanaman ini tumbuh baik pada tanah dengan pH 4.5 dan daerah pertumbuhannya tidak lebih dari 500 m di atas pemukaan laut. Nama botani kedelai yang dibudidayakan adalah Glycine max (Gambar 1), dengan klasifikasi sebagai berikut:
2
Gambar 1 Tanaman kedelai.
Kedelai sebagai bahan makanan mempunyai nilai gizi yang cukup tinggi dan merupakan sumber protein, lemak, vitamin, mineral, dan serat yang paling baik. Kandungan protein kedelai sekitar 30–50% (b/b), tetapi kadar karbohidratnya hanya sekitar 22–29% (b/b). Kadar lemaknya antara 16–20% (b/b), sedangkan kadar total gula sekitar 7.97% (b/b) (Liu 1997). Hasil utama dari kedelai adalah bijinya. Biji kedelai juga mengandung mineral-mineral kalsium, fosfor, besi, dan klor. Bentuk biji ada yang bundar, lonjong, gepeng, dan bulat telur. Warnanya tergantung dari varietas, ada yang hitam, kuning kehijauan, putih kekuningan, dan kuning gading (Gambar 2).
Gambar 2 Bentuk dan warna kacang kedelai.
Ampas Tahu
Tahu merupakan makanan tradisional terbuat dari kedelai yang sudah lama dikenal di Indonesia dan memegang peranan penting dalam pola makan sehari-hari masyarakat. Proses pembuatan tahu terdapat pada Lampiran 1. Ampas tahu merupakan suatu limbah yang dihasilkan oleh industri pengolahan tahu dalam jumlah cukup banyak yang masih memiliki nilai gizi cukup tinggi. Limbah ini biasanya dimanfaatkan sebagai makanan ternak atau digunakan sebagai bahan utama dalam pembuatan oncom merah.
Ampas tahu merupakan produk olahan dari tahu yang kemungkinan sifat proteinnya hampir sama dengan tahu dan kedelai,
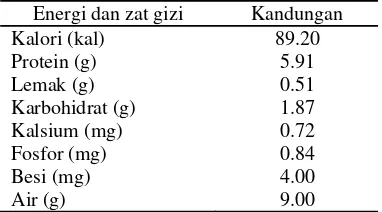
walaupun telah mengalami banyak perubahan karena perlakuan tertentu selama proses pembuatan tahu, seperti pemanasan. Protein ampas tahu masih mengandung 17% dari jumlah protein kedelai. Jika kadar protein kedelai sekitar 35%, maka protein yang terdapat pada ampas tahu sekitar 6% (Shurtleff & Aoyagi 1977). Kandungan kalori ampas tahu sangat tinggi, yaitu sebesar 89.20 kal dengan kadar lemak yang cukup rendah, yaitu 0.51 g/100g. Ampas tahu juga masih mengandung karbohidrat dan mineral-mineral logam, seperti kalsium, fosfor, dan besi walaupun dengan kadar yang cukup rendah (Tabel 1).
Tabel 1 Komposisi gizi ampas tahu per 100 g bahan basah.
Energi dan zat gizi Kandungan Kalori (kal) 89.20 Protein (g) 5.91 Lemak (g) 0.51 Karbohidrat (g) 1.87 Kalsium (mg) 0.72 Fosfor (mg) 0.84 Besi (mg) 4.00 Air (g) 9.00
Sumber: Direktorat Gizi Depkes RI 1993
Oncom Merah
Oncom merah merupakan salah satu makanan tradisional yang proses pembuatannya dilakukan dengan fermentasi. Bahan baku yang umum digunakan dalam proses pembuatan oncom adalah bungkil kacang tanah atau ampas tahu. Bungkil kacang tanah adalah ampas yang berasal dari kacang tanah yang telah diambil minyaknya dengan proses pemerasan mekanis atau proses ekstraksi, sedangkan ampas tahu merupakan residu pengolahan kedelai menjadi tahu.
Ampas tahu sebenarnya masih mempunyai nilai gizi yang cukup tinggi, tetapi kebanyakan sifat organoleptiknya kurang disukai. Ampas tahu dengan proses fermentasi (oncom merah) lebih disukai sebagai makanan daripada tanpa fermentasi. Proses pembuatan oncom termasuk jenis fermentasi media padat, yaitu fermentasi yang menyertakan penggunaan substrat padat sebagai sumber karbon, nitrogen, dan energi.
Oncom merah terbuat dari kapang
3
fermentasi dan memegang peranan penting dalam penguraian pati menjadi gula, penguraian lemak, serta pembentukan sedikit alkohol dan berbagai ester yang berbau sedap dan harum. Dengan adanya proses fermentasi, maka struktur kimia bahan-bahan yang bersifat kompleks, akan terurai menjadi senyawa-senyawa yang sederhana, sehingga lebih mudah dicerna dan dimanfaatkan oleh tubuh (Siswono 2002).
Kapang Neurospora sitophila telah dibuktikan dapat mencegah terjadinya efek flatulensi (kembung perut). Selama proses fermentasi oncom, kapang akan menghasilkan enzim alpha-galaktosidase yang dapat menguraikan raffinosa dan stakiosa kedelai sampai pada level yang sangat rendah, sehingga tidak berdampak pada terbentuknya gas.
Gambar 3 Oncom merah.
Isoflavon
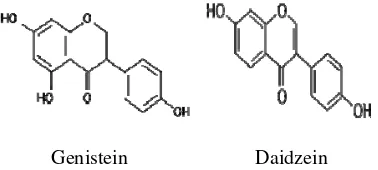
Isoflavon termasuk golongan senyawa flavonoid yang penyebarannya terbatas dan banyak terdapat pada tanaman kacang-kacangan, terutama kedelai (Harborne 1973). Isoflavon yang terdiri atas struktur dasar C6-C3-C6, secara alami disintesis oleh tumbuh-tumbuhan dan senyawa asam amino aromatik fenilalanin atau tirosin. Biosintesis ini berlangsung secara bertahap dan melalui sederetan senyawa antara, yaitu asam sinamat, asam kumarat, kalkon, dan isoflavon. Berdasarkan biosintesis tersebut, maka isoflavon digolongkan sebagai senyawa metabolit sekunder yang berfungsi mengendalikan pertumbuhan (fitohormon) dan mempertahankan diri dari makhluk lain, seperti insektisida (Achmadi et al. 1990). Isoflavon pada kedelai seperti genistein dan daidzein memiliki aktivitas estrogenik, antijamur, dan antikanker (Rakes & Russet 2001). Struktur umum isoflavon sebagai berikut:
Isoflavon terdiri atas 4 bentuk, yaitu aglikon, glikosida, malonil glikosida, dan asetil glikosida, yang masing-masing bentuk tersebut memiliki 3 jenis isomer. Bentuk aglikon terdiri atas genistein, daidzein, dan glisitein. Bentuk glikosida terdiri atas genistin, daidzin, dan glisitin. Malonil glikosida terdiri atas 6”-O-malonilgenistin, 6”-O -malonildaidzin, dan 6”-O-malonilglisitin. Asetil glikosida terdiri atas 6”-O -asetilgenistin, 6”-O-asetildaidzin, dan 6”-O -asetilglisitin (Gugger dalam Gilani & Anderson 2002). Jenis isoflavon yang paling banyak ditemukan dalam protein dan produk makanan kedelai adalah genistein dan daidzein (Friedman & Brandon 2001). Struktur molekul kedua senyawa tersebut dapat dilihat di bawah ini.
Genistein Daidzein
Ekstrak kedelai mengandung lebih dari 35% genistein dan daidzein yang berada dalam bentuk glikosidanya, hanya 8–20% daidzein dan 13–19% genistein berada dalam bentuk bebas (Petterson & Kiesling 1984). Isoflavon yang berada dalam bentuk bebas bersifat kurang polar, sehingga cenderung lebih mudah larut dalam pelarut organik. Isoflavon dalam bentuk terikat bersifat lebih polar, sehingga mudah larut dalam air. Bentuk terikat ini dapat berupa isoflavon O-glikosida atau C-glikosida. Isoflavon di alam sering terdapat dalam bentuk O-glikosida (Markham 1982).
4
Kromatografi lapis tipis (KLT) merupakan cara analisis cepat yang memerlukan bahan sangat sedikit, baik penyerap maupun cuplikannya. KLT dapat digunakan untuk memisahkan senyawa-senyawa yang sifatnya hidrofobik seperti lipida-lipida dan hidrokarbon yang sulit dikerjakan dengan kromatografi kertas. KLT juga dapat berguna untuk mencari eluen untuk kromatografi kolom, analisis fraksi yang diperoleh dari kromatografi kolom, identifikasi senyawa secara kromatografi, dan isolasi senyawa murni skala kecil. Pelarut yang dipilih untuk pengembang disesuaikan dengan sifat kelarutan senyawa yang dianalisis. Data yang diperoleh dari KLT adalah nilai Rf yang
berguna untuk penggabungan fraksi-fraksi. lebih tahan terhadap asam dibandingkan
dengan isoflavon O-glikosida (Ernita 1995).
Teknik Pemisahan Isoflavon
Isolasi isoflavon dapat dilakukan dengan ekstraksi menggunakan beberapa jenis pelarut, umumnya digunakan eter atau etil asetat. Larutan HCl ditambahkan sebelum proses ekstraksi untuk menghidrolisis glikon-glikon dari isoflavon (Markham 1982). Penambahan larutan HCl pada proses hidrolisis dapat meningkatkan efisiensi ekstraksi isoflavon (Murphy 1981). Ekstraksi isoflavon juga dapat menggunakan pelarut organik, seperti metanol dan etanol yang telah dipanaskan, atau direfluks di dalam alkohol, sehingga menghasilkan konversi yang lengkap dari bentuk malonil glikosida, asetil glikosida, dan aglikon (Jackson & Rupasinghe dalam Gilani & Anderson 2002).
Teknik analisis untuk penentuan kadar isoflavon pada kedelai dapat menggunakan metode High Performance Liquid Chromatography (HPLC) atau Gas Chromatography (GC) sebagai metode utama, tetapi metode lain juga dapat digunakan, seperti Capillary Electrophoresis (CE), Time Resolved Fluoroimmunoassay (TR-FIA),
luminescent immunoassays, ELISA, dan RIA (Jackson & Rupasinghe dalam Gilani & Anderson 2002).
Kondisi yang paling baik untuk menghidrolisis senyawa-senyawa isoflavon dari kedelai adalah dengan menggunakan larutan HCl 4 N, suhu sekitar 70°C selama 2 jam (Nicollier & Thompson 1982). Pemisahan dapat dilakukan dengan flash chromatography (kromatografi kilat) dan kromatografi lapis tipis (KLT). Flash chromatography digunakan untuk memisahkan suatu campuran. Flash chromatography menggunakan tekanan udara untuk menggerakkan pelarut melalui kolom (Gambar 4). Menurut Still et al. (1978), flash chromatography digerakkan tekanan udara hibrida antara tekanan sedang dan kolom kromatografi yang pendek, yang telah dioptimasi untuk pemisahan senyawa secara cepat. Tekanan udara akan membuat waktu pemisahan dengan flash chromatography
lebih singkat dibandingkan dengan kromatografi kolom gravitasi. Adsorben yang digunakan pada teknik ini memiliki ukuran partikel yang lebih kecil, sekitar 200–400 mesh. Eluat yang ditampung dari hasil flash chromatography pada penelitian berdasarkan volume retensi. Pemurnian komponen hasil
flash chromatography dilakukan dengan menggunakan metode kromatografi lapis tipis.
Kromatografi Cair Kinerja Tinggi (KCKT)
Kromatografi adalah suatu istilah umum yang digunakan untuk bermacam-macam teknik pemisahan yang didasarkan atas partisi sampel diantara suatu fasa gerak yang bisa berupa gas ataupun cair dan fasa diam yang juga bisa berupa cairan ataupun suatu padatan. Kromatografi cair kinerja tinggi (KCKT) atau
High Pressure Liquid Chromatography
(HPLC) termasuk ke dalam kromatografi cair. KCKT merupakan suatu teknik kromatografi dengan fase gerak cairan dan fase diam berupa cairan atau padatan.
Kromatografi cair kinerja tinggi dapat digunakan untuk analisis, baik secara kualitatif maupun kuantitatif. Analisis kualitatif berdasarkan waktu retensi, sedangkan analisis kuantitatif berdasarkan luas puncak. Teknik ini memiliki banyak kelebihan dibandingkan dengan metode lain. Menurut Snyder & Kirkland (1979), kelebihan KCKT, yaitu mampu memisahkan molekul-molekul dari suatu campuran, mudah melaksanakannya, kecepatan analisis dan kepekaan yang tinggi, dapat dihindari terjadinya dekomposisi/ kerusakan bahan yang dianalisis, resolusi yang baik, dapat digunakan bermacam-macam detektor, dan kolom dapat digunakan kembali.
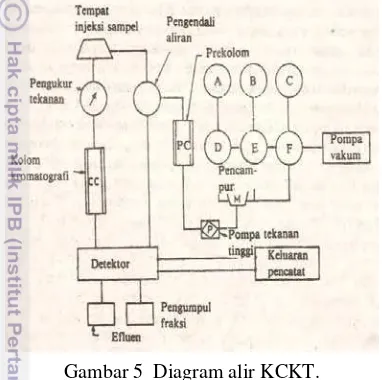
5
Komponen yang perlu diperhatikan dalam sistem KCKT adalah reservoir, pompa, injektor, kolom, integrator, dan detektor. Sampel yang diinjeksikan akan bergerak melalui kolom dan komponen sampel yang berada di dalam kolom akan dideteksi oleh suatu detektor. Signal yang terukur akan ditampilkan dalam bentuk kromatogram pada rekorder. Diagram alir KCKT dapat dilihat pada Gambar 5.
Gambar 5 Diagram alir KCKT.
BAHAN DAN METODE
Penelitian dilaksanakan dari bulan April sampai September 2008, di Pusat Studi Biofarmaka, LPPM IPB dan Laboratorium Kimia Analitik Departemen Kimia, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Bahan dan Alat
Bahan-bahan yang digunakan adalah kedelai, ampas tahu, dan oncom merah yang diperoleh dari pabrik pengolahan tahu di desa Cibadak (Ciampea), HCl 4 N, etanol, etil asetat, kloroform, metanol, air destilata, standar genistein dari Sigma, standar daidzein dari Fluka, dan plat KLT.
Alat-alat yang digunakan adalah botol vial, cawan porselen, peralatan kaca, corong pisah, bejana kromatografi, lampu UV, pompa vakum, rotavapor, instrumen flash chromatography Buchi C-60, instrumen KCKT dengan merk Waters.
Metode
Penelitian terdiri atas beberapa tahap, yaitu (1) penentuan kadar air; (2) ekstraksi; (3)
pemurnian; (4) penentuan kadar genistein dan daidzein (Lampiran 2)
Penentuan kadar air
Cawan porselen dikeringkan di oven pada suhu 105°C selama 1 jam, setelah itu didinginkan di desikator dan bobot cawan kosong ditimbang. Tiga gram contoh (kedelai, ampas tahu, dan oncom) dimasukkan ke dalam cawan dan dikeringkan di oven pada suhu 105°C selama 48 jam, setelah itu didinginkan di desikator dan ditimbang sampai bobotnya tetap. Penentuan kadar air dilakukan sebanyak 3 kali ulangan (triplo).
Kadar air = Bobot awal – Bobot akhir x 100% Bobot awal
Ekstraksi
Sampel kedelai sebanyak 200 g direfluks menggunakan campuran HCl dan etanol dengan nisbah 1:8 selama 2 jam pada suhu 70°C. Campuran disaring dengan menggunakan pompa vakum dan kertas saring Whatman nomor 41. Filtrat yang diperoleh kemudian dipekatkan menggunakan rotavapor. Setelah itu, dilakukan pemisahan dengan etil asetat menggunakan corong pisah. Fraksi etil asetat yang diperoleh kemudian disaring, dan dipekatkan dengan rotavapor. Rendemen ekstrak dihitung menggunakan rumus sebagai berikut:
Rendemen ekstrak = a × 100% (1-kadar air) x b
Keterangan: a = bobot ekstrak b = bobot contoh
Hal yang sama dilakukan untuk ampas tahu dan oncom merah dengan bobot 600 g.
Pemurnian komponen
Pemurnian ekstrak dilakukan dengan menggunakan flash chromatography. Sebanyak 0.5 gram ekstrak ditambah 1 mL eluen kloroform:metanol (9:1) diinjeksikan ke dalam alat flash chromatography dengan laju alir 0.3 mL/menit. Fase gerak yang digunakan adalah kloroform:metanol dengan nisbah 9:1 (Rinawati 1995). Fraksi-fraksi hasil flash chromatography ditampung berdasarkan volume retensi setiap 5 mL.
6
spot dilihat dengan lampu UV pada panjang gelombang 254 nm. Jarak Rf-nya dihitung dengan menggunakan rumus:
Jarak spot Jarak eluen
Spot yang memiliki jarak Rf sama, digabungkan menjadi satu fraksi, serta ditentukan kadar genistein dan daidzein menggunakan KCKT.
Analisis KCKT
Fraksi-fraksi yang telah digabung dan dipekatkan, kemudian dilarutkan dalam metanol. Masing-masing fraksi diinjeksikan ke dalam kolom KCKT, menggunakan eluen campuran metanol dan air dengan nisbah 80:20. Standar genistein dan daidzein dengan konsentrasi 100 ppm juga diinjeksikan ke dalam kolom KCKT. Kolom yang digunakan adalah C18 dengan laju alir 0.5 mL/menit,
volume injeksi 10 µL, dan detektor yang digunakan adalah detektor UV dengan panjang gelombang 254 nm (Genovesse et al. 2006). Kromatogram yang dihasilkan akan digunakan untuk menghitung konsentrasi contoh dengan menggunakan rumus:
Luas puncak contoh Luas puncak standar
Keterangan : Csa = Konsentrasi sampel
Cstd = Konsentrasi standar
HASIL DAN PEMBAHASAN
Kadar Air
Penentuan kadar air berguna untuk menyatakan kandungan zat dalam tumbuhan sebagai persen bahan kering (Harjadi 1993). Penentuan kadar air dilakukan sebelum proses ekstraksi. Pengukuran kadar air merupakan pengukuran susut pengeringan atau banyaknya air yang masih terdapat dalam simplisia. Menurut Winarno (1997), sampel yang dapat disimpan dalam jangka panjang adalah sampel yang memiliki kadar air kurang dari 10%.
Hasil penelitian menunjukkan bahwa kadar air dalam sampel kedelai, ampas tahu, dan oncom merah berturut-turut adalah 7.51%, 81.60%, dan 58.57%. Besarnya kadar air yang terdapat pada sampel akan mempengaruhi proses penapisan senyawa aktif. Kedelai memiliki kadar air yang kurang dari 10%, sehingga bobot kering yang
tertimbang akan besar, sedangkan ampas tahu dan oncom merah memiliki kadar air yang lebih dari 10%, sehingga menyebabkan sampel ampas tahu dan oncom merah yang tertimbang menjadi sedikit. Kadar air yang didapat dari hasil penelitian tidak jauh berbeda dengan hasil peneliti-peneliti sebelumnya. Danuwarsa (1997), memperoleh kadar air untuk kedelai sebesar 7.55%. Ampas tahu memiliki kadar air sebesar 84.1% menurut Yuslinawati (2006), sedangkan oncom merah belum pernah dilakukan. Hasil perhitungan kadar air dapat dilihat pada Lampiran 3.
Rf =
Ekstraksi
Ekstraksi dilakukan untuk mengambil zat-zat yang terkandung dalam suatu campuran. Menurut Achmadi et al. (1990), ekstraksi merupakan proses yang secara selektif mengambil zat terlarut dengan bantuan pelarut. Sampel kedelai, ampas tahu, dan oncom merah pada tahap awal diekstraksi dengan metode refluks. Metode refluks dipilih berdasarkan hasil penelitian Rinawati (1995), yang membandingkan dua metode ekstraksi, yaitu maserasi dan refluks. Ternyata, metode refluks menghasilkan rendemen yang lebih besar dibandingkan dengan maserasi. Hal ini disebabkan adanya pemanasan yang akan mempercepat reaksi. Ekstraksi dilakukan dengan menggunakan pelarut etanol dan HCl dengan nisbah 8:1. Sampel dipanaskan pada suhu 70°C selama 2 jam. Uap yang terbentuk akan melewati kondensor, terdinginkan, lalu menetes kembali ke dalam larutan ekstrak. Csa = × Cstd
7
oncom merah yang diperoleh dari hasil penelitian berturut-turut adalah 5.02%, 3.61%, dan 0.62% (Lampiran 4). Kedelai dan ampas tahu memiliki rendemen yang cukup tinggi, sedangkan oncom merah memiliki rendemen yang rendah, karena bahan baku dalam pembuatan oncom merah adalah ampas tahu yang merupakan limbah padat hasil pengolahan kedelai menjadi tahu.
Hasil Pemurnian Komponen
Ekstrak yang telah dipartisi kemudian dipekatkan dengan rotavapor. Ekstrak kasar ini dimurnikan kembali dengan metode kromatografi kolom, yaitu flash chromatography. Fase diam yang digunakan adalah silika gel, sedangkan fase gerak yang digunakan berupa campuran kloroform-metanol dengan nisbah 9:1. Eluen tersebut merupakan eluen terbaik untuk memisahkan isoflavon dari komponen-komponennya (Rinawati 1995). Hal ini juga telah dibuktikan oleh peneliti menggunakan ekstrak kasar dari sampel yang ditotolkan pada KLT, dan diperoleh kromatogram yang pemisahannya cukup bagus (Gambar 6).
Gambar 6 Kromatogram sampel hasil KLT. Pada flash chromatography, Sejumlah ekstrak dimasukkan ke dalam kolom yang kemudian membentuk jalur-jalur serapan dari senyawa. Eluen dibiarkan mengalir melalui kolom dan akan mengangkut senyawa-senyawa yang merupakan komponen campuran. Eluat dari hasil flash chromatography ditampung berdasarkan volume retensi sebanyak 5 ml. Dari hasil fraksinasi, diperoleh hasil pemisahan untuk kedelai sebanyak 51 tabung, sedangkan ampas tahu dan oncom merah masing-masing sebanyak 25 tabung.
Masing-masing tabung dari setiap sampel, diuji menggunakan kromatografi lapis tipis (KLT). Tabung yang memiliki komponen yang sama, dilihat dari jarak Rf nya, disatukan menjadi satu fraksi. Kedelai ulangan 1 dan 2 menghasilkan 3 fraksi, ampas tahu ulangan 1 dan 2 juga menghasilkan 3 fraksi, sedangkan
oncom merah ulangan 1 dan 2 hanya menghasilkan 1 fraksi. Hal ini mungkin disebabkan oncom merah merupakan sisa dari ampas tahu, sehingga komponen yang terdapat pada oncom merah hanya sedikit. Tabung-tabung yang tidak menghasilkan spot, tidak digunakan untuk pengujian lebih lanjut pada KCKT. Jarak Rf dapat dilihat pada Lampiran 5 dan 6, sedangkan penggabungan komponen dalam tabung dapat dilihat pada Tabel 2.
Tabel 2 Penggabungan komponen hasil KLT Sampel Ulangan Fraksi Tabung Kedelai 1 1 2-3
2 4-7
3 15-21 2 1 2-3
2 4-13 3 15-21 Ampas 1 1 2-3
Tahu 2 4-10 3 11-19 2 1 2-3
2 4-10 3 11-19 Oncom 1 1 2-3
Merah 2 1 2-3
Analisis KCKT
Analisis KCKT dilakukan dengan menggabungkan fraksi-fraksi yang diduga merupakan senyawa isoflavon. Fraksi-fraksi yang telah digabungkan, kemudian dipekatkan dengan rotavapor. Fraksi yang telah pekat, dilarutkan dalam metanol. KCKT yang digunakan pada penelitian menggunakan fase terbalik KCKT, dengan fase diam silika yang dimodifikasi menjadi non polar melalui pelekatan rantai-rantai hidrokarbon pada permukaannya yang berupa atom karbon 18 (C18). Pelarut yang digunakan adalah
8
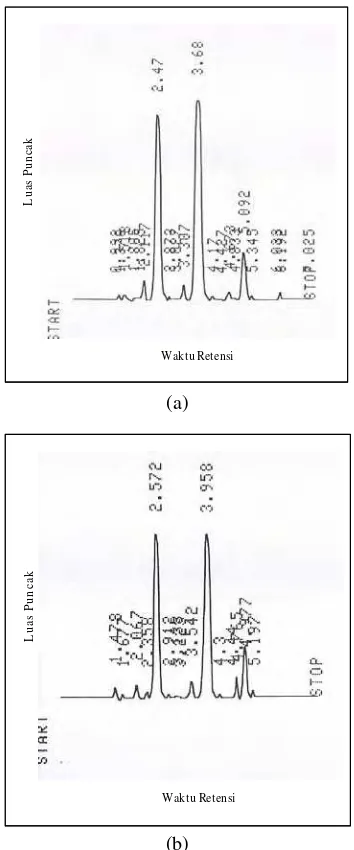
tinggi dari panjang gelombang metanol dan air untuk menghindari pembacaan yang salah dari pelarut (Putra 2004). Sebelum sampel diinjeksikan ke dalam alat, terlebih dahulu diinjeksikan standar daidzein dan genistein. Waktu retensi yang diperoleh untuk standar genistein dan daidzein berturut-turut adalah 2.572 dan 3.747 menit (Gambar 7).
(a) (b)
Gambar 7 Kromatogram standar (a) genistein; (b) daidzein.
Waktu retensi genistein lebih pendek daripada daidzein. Hal ini disebabkan terjadinya interaksi yang kuat antara pelarut yang bersifat polar dengan senyawa polar dalam campuran yang bergerak melalui kolom, sehingga senyawa polar akan bergerak bersama dengan pelarut. Senyawa-senyawa nonpolar dalam campuran kurang larut dalam pelarut dan cenderung membentuk interaksi dengan gugus hidrokarbon karena adanya dispersi gaya Van der Waals, sehingga
senyawa nonpolar akan terjerap pada fase diam dan bergerak lambat dalam kolom. Oleh karena itu, senyawa yang lebih polar (genistein) akan keluar lebih dahulu dibandingkan dengan senyawa yang kurang polar (daidzein).
Kedelai, ampas tahu, dan oncom merah mengandung genistein dan daidzein, karena mempunyai puncak kromatogram dengan waktu retensi yang mendekati atau sama dengan waktu retensi kedua standar tersebut. Kedelai memiliki waktu retensi 2.470 dan 3.680 menit. Ampas tahu memiliki waktu retensi sekitar 2.572 dan 3.958 menit, sedangkan oncom merah waktu retensinya adalah 2.655 dan 3.973 menit (Gambar 8).
0 0.2 0.4 0.6 0.8 1 1.2
0 0.5 1 1
Waktu Retensi L u as P u n c ak .5 0 0.2 0.4 0.6 0.8 1 1.2
0 0.5 1 1
Waktu Retensi L u as P u n cak .5 0 0.2 0.4 0.6 0.8 1 1.2
0 0.5 1 1.5
Waktu Retensi L u as P u n cak (a) 0 0.2 0.4 0.6 0.8 1 1.2
0 0.5 1 1
9 (c)
Gambar 8 Kromatogram sampel (a) kedelai; (b) ampas tahu; dan (c) oncom merah fraksi 1
ulangan 1.
Kromatogram sampel yang dihasilkan memiliki puncak yang bagus, akan tetapi pemisahannya belum optimal, karena masih terdapat dua puncak dalam satu fraksi (Lampiran 7). Hal ini dapat disebabkan belum diperoleh eluen yang terbaik pada saat flash chromatography.
Kadar genistein dan daidzein kedelai, ampas tahu, dan oncom merah diperoleh dari hasil perhitungan dengan membandingkan luas puncak standar dan sampel (Lampiran 8 dan 9). Kadar total genistein dan daidzein kedelai, ampas tahu, dan oncom merah dapat dilihat pada Tabel 3.
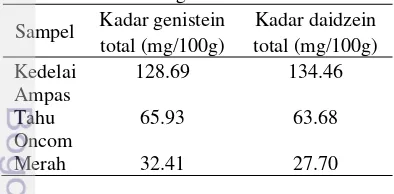
Tabel 3 Kadar total genistein dan daidzein. Sampel Kadar genistein Kadar daidzein
total (mg/100g) total (mg/100g) Kedelai 128.69 134.46 Ampas
Tahu 65.93 63.68 Oncom
Merah 32.41 27.70
Berdasarkan hasil pada Tabel 3, kedelai memiliki kadar genistein dan daidzein yang lebih tinggi dibandingkan dengan ampas tahu dan oncom merah. Urutan kadar genistein dan daidzein dari yang paling tinggi ke rendah adalah kedelai > ampas tahu > oncom merah. Hal ini disebabkan kedelai yang digunakan belum mengalami proses pengolahan yang dapat merusak atau menghilangkan kandungan isoflavon, sedangkan ampas tahu merupakan residu dari hasil pengolahan
kedelai menjadi tahu, dan oncom merah merupakan produk hasil pengolahan dari ampas tahu. Dari data juga dapat diketahui bahwa kedelai lebih banyak mengandung daidzein dibandingkan dengan genistein, sedangkan ampas tahu dan oncom merah mengandung lebih banyak genistein dibandingkan dengan daidzein walaupun perbedaannya tidak terlalu signifikan.
SIMPULAN DAN SARAN
Simpulan
Berdasarkan analisis menggunakan KCKT, kedelai memiliki kadar genistein dan daidzein sebesar 128.69 mg/100g dan 134.46 mg/100g bobot kering. Ampas tahu memiliki kadar genistein dan daidzein sebesar 65.93 mg/100g dan 63.68 mg/100g bobot kering, sedangkan oncom merah kadar genistein dan daidzeinnya adalah 32.41 mg/100g dan 27.70 mg/100g bobot kering. Kedelai memiliki kadar genistein dan daidzein 2 kali lebih besar daripada ampas tahu dan 4 kali lebih besar dibandingkan dengan oncom merah. Oncom merah sangat baik untuk dikonsumsi karena mengandung isoflavon. 0 0.2 0.4 0.6 0.8 1 1.2
0 0.5 1 1
Waktu Retensi L u as P u n cak .5 Saran
Perlu dilakukan penelitian lebih lanjut untuk memperoleh metode ekstraksi terbaik, pemilihan eluen terbaik, penentuan kadar isoflavon pada tahu, penentuan kadar untuk jenis isoflavon yang lain, serta analisis struktur yang lengkap.
DAFTAR PUSTAKA
[Anonim]. 1983. Buku Seri Teknologi Pangan. Bogor: Pusbangtepa IPB.
Achmadi SS, Hakim EH, Makmur L. 1990. Flavonoid dan phyto medica, kegunaan dan prospek. Phyto Med 1:120–127.
Anderson JW. 2002. Meta-analysis of the effect of soy proteins intake of serum lipid. J Med 333:276–282.
10
Mandibula [tesis]. Jakarta: Universitas Indonesia.
Coward L, Barnes NC, Serchell KD, Barnes S. 1993. Genistein, daidzein, and their
betha-glycosidase conjugates: antitumor isoflavone in soybean foods
from American and asian diets. J Agric Food Chem 41:1961–1967.
Danuwarsa. 2006. Analisis Proksimat dan Asam Lemak pada Beberapa Komoditas Kacang-Kacangan. Bogor: Buletin Teknik Pertanian.
Direktorat Gizi Departemen Kesehatan RI. 1993. Daftar Komposisi Bahan Makanan. Jakarta: Bharata Karya Aksara.
Ernita E. 1995. Senyawa-senyawa Isoflavon dari Limbah Tahu [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Franke AA, Custer LJ, Cerna CM, Narala KK. 1994. Quantitation of phytoestrogens in legumes by HPLC. J Agric Food Chem
42:1905–1913.
Friedman M, Brandon DL. 2001. Nutritional and helth benefits of soy protein. J Agric Food Chem 49:1069–1086.
Genovesse MI, Davila J, Lajolo FM. 2006. Isoflavones in processed soybean product from Ecuador. Braz Arch Biol Tech 49(5):853–859.
Gugger ET. 2002. Phytoestrogens and Health. Gilani GS, Anderson JB, editor. Canada: AOCS Pr.
Harborne JB. 1973. Phytochemical Methods: A Guide to Modern Techniques of Plant Analysis. London: Chapman & Hall.
Harjadi W. 1993. Ilmu Kimia Analitik Dasar.
Jakarta: PT Gramedia Pustaka Utama.
Jackson CC, Rupasinghe HP. 2002.
Phytoestrogens and Health. Gilani GS, Anderson JB, editor. Canada: AOCS Pr.
Liu K. 1997. Soybeans. Chem, Tech, and Utilization. New York: Chapman & Hall.
Markham KR. 1982. Techniques of Flavonoid Identification. London: Academic Pr.
Messina M. 2002. Phytoestrogens and Health. Gilani GS, Anderson JB, editor. Canada: AOCS Pr.
Murphy PA. 1981. Phytoestrogen content of processed soybean food. Food Technology 36:4–50.
Nicollier GF, Thompson AC. 1982. Separation and quantification of estrogen-isoflavon from clover by HPLC. J Chromatography. 249(2):582–585.
Pawiroharsono S. 1994. Prospek dan Manfaat Isoflavon untuk Kesehatan. Direktorat Teknologi Bioindustri, Badan Pengkajian dan Penerapan Teknologi.
Petterson K, Kiessling KH. 1984. Liquid chromatographic determination of the plant estrogens coumesterol and isoflavones in animal feed. J Assoc Anal Chem 67(3):503–506.
Putra ED. 2004. Kromatografi Cair Kinerja Tinggi Dalam Bidang Farmasi. Sumatra: Universitas Sumatra Utara.
Rakes G, Russett C. 2001. Soy Isoflavones. Central Soya Company.
Rinawati. 1995. Efisiensi Ekstraksi Senyawa Isoflavonoid dari Akar Kedelai [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Shurtleff W, Aoyagi A. 1977. The Book of Tofu. Massachusetts: Au Pr.
Siswono. 2002. Oncom, Menutup Kekurangan
Energi dan Protein.
http://id.wikipedia.org.wiki.oncom. [3
Oktober 2002].
11
Still et al. 1978. Rapid chromatographic technique for preparative separations with moderate resolution. JOrg Chem
43(14):2923–2925.
Wang H, Murphy PA. 1994. Isoflavone content in comercial soybean food. J Agric Food Chem 42:1666–1673.
Winarno FG. 1997. Kimia Pangan dan Gizi. Jakarta: Gramedia Pustaka Utama.
13
Lampiran 1 Proses pembuatan tahu
Kedelai kering
Direndam (4–12 jam)
Dikupas
Direndam (30–45 menit)
Digiling (Air:Kedelai = 8:1)
Direbus (15–20 menit)
pada suhu 100–110°C
Disaring
Susu kedelai Ampas tahu
Dididihkan 30 menit Oncom
Digumpalkan
(+ CaSO
4)
Disaring
Limbah tahu Gumpalan tahu
Tahu
14
Lampiran 2 Bagan alir penelitian
Kedelai, ampas tahu, dan oncom
Hidrolisis
(HCl 4 N dan etanol)
Ekstrak
Rotavapor
Ekstrak
Partisi (etil asetat)
Rotavapor
Ekstrak
Flash
Chromatography
Fraksi-fraksi
KLT
analitik
Gabungan fraksi
dengan Rf sama
Kadar air
15
Lampiran 3 Penentuan kadar air kedelai, ampas tahu, dan Oncom merah.
Sampel Ulangan
Bobot Awal
Bobot Akhir
Kadar Air
Rerata
(g) (g)
(%)
(%)
Kedelai 1 3.0089 2.7832 7.50
2
3.0042
2.7777
7.54
7.51
3
3.0016
2.7771
7.48
Ampas Tahu
1
3.0172
0.5763
80.90
2
3.0093
0.5627
81.30
81.60
3
3.0191
0.5253
82.60
Oncom Merah
1
3.012
1.2367
58.94
2
3.0234
1.2638
58.20
58.57
3
3.0059
1.2456
58.56
Contoh perhitungan kadar air kedelai ulangan 1
Kadar Air = Bobot awal – Bobot akhir x 100%
Bobot awal
= 3.0089 g – 2.7832 g x 100%
3.0089 g
= 7.50%
Lampiran 4 Penentuan rendemen ekstrak kedelai, ampas tahu, dan oncom merah.
Sampel Ulangan
Bobot
Sampel
Bobot
Ekstrak Rendemen
Rerata
(g) (g)
(%)
Kedelai 1
200.0215
9.4967 5.13
5.02
2
200.0143
9.0705
4.90
Ampas Tahu
1
600.0101
3.9958
3.62
3.61
2
600.0221
3.9709
3.60
Oncom Merah
1
600.0059
1.5467
0.62
0.62
2
600.0215
1.5733
0.63
Contoh perhitungan rendemen kedelai ulangan 1
Rendemen
= Bobot ekstrak x 100%
(1-kadar air) x Bobot sampel
= 9.4967 g x 100%
(1-0.0751) x 200.0215 g
16
Lampiran 5 Jarak Rf kedelai hasil fraksinasi.
Tabung
Rf Kedelai
Ulangan 1
Ulangan 2
1 -
-
2
0.45; 0.69; 0.77
0.69; 0.76
3
0.46; 0.69; 0.77
0.69; 0.76
5 0.12
0.15
7 0.12
0.15
9 -
0.15
11 -
0.15
13 -
0.15
15 0.05
0.10
17 0.05
0.10
19 0.05
0.10
21 0.05
0.10
23 -
-
25 -
-
27 -
-
29 -
-
31 -
-
33 -
-
39 -
-
45 -
-
Lampiran 6 Jarak Rf ampas tahu dan oncom merah hasil fraksinasi.
Tabung
Rf
Ampas tahu
Oncom merah
Ulangan 1
Ulangan 2
Ulangan 1
Ulangan 2
1 -
-
- -
2
0.42; 0.52; 0.71
0.48; 0.55; 0.73
0.49; 0.64
0.51; 0.67
3
0.41; 0.51; 0.69
0.45; 0.54; 0.70
0.50; 0.65
0.51; 0.67
5 0.2
0.2
-
-
7 0.2
0.2
-
-
9 0.2
0.2
-
-
11 0.08
0.08
-
-
13 0.08
0.08
-
-
15 0.08
0.08
-
-
17 0.08
0.08
-
-
19 0.08
0.08
-
-
21 -
-
-
-
23 -
-
-
-
17
Lampiran 7 Kromatogram hasil KCKT
(a)
Fraksi 1 kedelai ulangan 1
(e) Fraksi 2 kedelai ulangan 2
(b)
Fraksi 2 kedelai ulangan 1
(f) Fraksi 3 kedelai ulangan 2
(c)
Fraksi 3 kedelai ulangan 1
(g) Fraksi 1 ampas tahu ulangan 1
(d)
Fraksi 1 kedelai ulangan 2
(h) Fraksi 2 ampas tahu ulangan 1
18
Lanjutan Lampiran 7 Kromatogram hasil KCKT
(i) Fraksi 3 ampas tahu ulangan 1
(m) Fraksi 1 oncom merah ulangan 1
(j) Fraksi 1 ampas tahu ulangan 2
(n) Fraksi 1 oncom merah ulangan 2
(k) Fraksi 2 ampas tahu ulangan 2
19
Lampiran 8 Penentuan kadar genistein kedelai, ampas tahu, dan oncom merah.
Waktu Luas Kadar Total Rerata
Sampel n Fraksi
Retensi
Puncak
(mg/100 g)
(mg/100 g)
(mg/100 g)
Kedelai 1
1
2.47
136440
66.18
132.16
2 2.515
147972 44.86
3 2.545
136427 21.12
128.69
2 1 2.538 131251 63.67
125.22
2 2.445
135711 41.15
3 2.592
131767 20.4
Ampas 1
1
2.572
88593
31.77
66.42
tahu
2
2.605
96307
15.66
3 2.472 91508 18.99
65.93
2 1 2.628 85303 30.58
65.44
2 2.623 97321 15.83
3 2.502 91699 19.03
Oncom 1
1
2.655
116295
31.49
31.49
32.41
2
1
2.625
123078
33.32
33.32
Genistein
2.572 185711
Contoh perhitungan konsentrasi dan kadar kedelai 1 fraksi 1
Konsentrasi sampel = Luas puncak sampel x Konsentrasi standar
Luas puncak standar
= 136440 x 100 ppm
185711
=
73.46
ppm
Kadar genistein (mg/g)
= Konsentrasi sampel x Volume larutan x FP
Bobot sampel (1 – Kadar air)
Kadar genistein (mg/g)
= 73.46 mg/L x 10 mL x 10/0.06 x 1 L
200.0215 g (1 – 0.0751) 1000 mL
=
0.6618
mg/g
Kadar genistein (mg/100g)
= 0.6618 mg/g x 100
20
Lampiran 9 Penentuan kadar daidzein kedelai, ampas tahu, dan oncom merah.
Sampel n Fraksi
Waktu Luas Kadar
Total
Rerata
Retensi Puncak (mg/100 g)
(mg/100 g)
(mg/100 g)
Kedelai
1
1
3.68
178238
75
137.19
2
3.683
157686
41.47
3
3.665
154255
20.72
134.46
2
1
3.783
152990
40.24
131.72
2
3.818
144488
19.4
3
3.877
171315
72.08
Ampas
1
1
3.958
105334
32.77
64.91
tahu
2
3.87
97688
13.77
3
3.78
102071
18.37
63.68
2
1
3.978
102439
31.87
62.45
2
3.787
110174
15.54
3
3.715
83570
15.04
Oncom 1 1 3.973
126554 29.72
29.72
27.70
2
1
3.888
109362
25.68 25.68
Daidzein
3.747 214105
Contoh perhitungan konsentrasi dan kadar kedelai 1 fraksi 1
Konsentrasi sampel = Luas puncak sampel x Konsentrasi standar
Luas puncak standar
= 178238 x 100 ppm
214105
=
83.25
ppm
Kadar daidzein (mg/g)
= Konsentrasi sampel x Volume larutan x FP
Bobot sampel (1 – Kadar air)
Kadar daidzein (mg/g)
= 83.25 mg/L x 10 mL x 10/0.06 x 1 L
200.0215 g (1 – 0.0751) 1000 mL
=
0.7500
mg/g
Kadar daidzein (mg/100g)
= 0.7500 mg/g x 100