MIKROB PELARUT KALIUM DARI TIGA LOKASI LAHAN
DAN KEMAMPUANNYA DALAM MENINGKATKAN
KETERSEDIAAN KALIUM
DENI PRATAMA
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis saya yang berjudul Mikrob Pelarut Kalium dari Tiga Lokasi Lahan dan Kemampuannya dalam Meningkatkan Ketersediaan Kalium adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Maret 2016
RINGKASAN
DENI PRATAMA. Mikrob Pelarut Kalium dari Tiga Lokasi Lahan dan Kemampuannya dalam Meningkatkan Ketersediaan Kalium. Dibimbing oleh ISWANDI ANAS dan SUWARNO.
Kalium merupakan salah satu dari unsur hara makro yang berperan penting terhadap pertumbuhan dan produksi tanaman. Secara umum total kalium di tanah diperkirakan antara 0.5 sampai 2.5%, tetapi sekitar 90 sampai 98% dari total kalium tersebut dalam bentuk yang tidak tersedia sehingga tidak dapat diserap oleh tanaman. Pupuk kalium anorganik seperti KCl seringkali diperlukan agar tanaman mendapat cukup kalium. Di Indonesia, penggunaan pupuk kalium anorganik menemui kendala dikarenakan pupuk tersebut di impor dari luar negeri sehingga harga pupuk menjadi mahal. Oleh karena itu bayak beredar pupuk palsu di pasaran. Padahal Indonesia memiliki potensi sumber kalium yaitu batuan kalium (kalium feldspar dan mika).
Permasalahan dari penggunaan batuan kalium adalah proses pelapukannya lama untuk melepaskan kalium tersedia yang dapat diserap tanaman. Oleh karena itu, untuk menggunakan batuan kalium sebagai pupuk bagi tanaman, diperlukan metode yang dapat mempercepat proses pelapukan dari batuan kalium. Berdasarkan hasil penelitian sebelumnya, lambatnya proses pelapukan batuan kalium dapat dipercepat dengan menggunakan agen hayati yaitu mikrob pelarut kalium (MPK). Meskipun begitu, tidak semua isolat MPK dapat digunakan. Isolat MPK yang dapat digunakan adalah isolat yang memiliki sifat nonpatogen terhadap tumbuhan, hewan, dan manusia. Isolat MPK yang digunakan harus merupakan isolat unggul yang memiliki kemampuan melarutkan kalium di atas rata-rata. Lingkungan yang berbeda merupakan salah satu faktor untuk mendapat isolat MPK yang memiliki kemampuan berbeda dikarenakan faktor lingkungan seperti derajat keasaman, aerasi tanah, dan suhu dapat mempengaruhi pertumbuhan dan kemampuan mikrob.
Tujuan penelitian ini adalah, 1) mengisolasi MPK dari lahan bekas tambang timah, bekas tambang emas, dan lahan pertanian, 2) menyeleksi MPK terbaik berdasarkan sifat patogenitas, kemampuan MPK dalam melarutkan kalium di media tumbuh dan kemampuan MPK dalam memperbaiki pertumbuhan tanaman sorgum, 3) mengidentifikasi spesies MPK terbaik dari hasil seleksi sebelumnya menggunakan metode analisa molekuler.
Penelitian ini berhasil mengisolasi 162 isolat bakteri pelarut kalium (BPK) dan 23 fungi pelarut kalium (FPK) dari sampel tanah yang diisolasi di media
Alexandrov agar yang ditambahkan 2 jenis sumber kalium yang berbeda. Dari
185 isolat tersebut, 48 isolat tidak mempunyai sifat patogen bagi tanaman, hewan, dan manusia. Dari 48 isolat tersebut, didapatlah 10 isolat MPK yang memiliki indeks pelarutan kalium terbesar yaitu 1.16 sampai 6.77 untuk sumber kalium berupa feldspar asal Cirebon dan 1.07 sampai 5.91 untuk sumber kalium berupa feldspar asal Malang. Diantara 10 isolat tersebut, 9 isolat dapat melarutkan fosfat dari sumber fosfat Ca3(PO4)2 dan 5 isolat dapat melarutkan fosfat dari batuan fosfat asal Blitar. Berdasarkan kemampuan 10 isolat MPK dalam melarutkan kalium di media cair, isolat BPK6 cenderung memiliki kemampuan lebih baik dalam melarutkan sumber kalium berupa feldspar asal Cirebon dan feldspar asal Malang dengan nilai K terlarut 248.10 ppm dan 273.21 ppm. Isolat BPK6 juga cenderung memiliki kemampuan lebih baik dalam melarutkan fosfat dari sumber fosfat berupa Ca3(PO4)2 dan batuan fosfat asal Blitar dengan kadar P terlarut masing-masing 893.8 ppm dan 172 ppm.
Dari 10 isolat yang diuji di media cair, diambil 5 isolat terbaik yang memiliki kemampuan tertinggi dalam melarutkan kalium. Sebanyak 5 isolat tersebut kemudian diuji dengan mengaplikasikan isolat tersebut pada tanaman sorgum. Dari 5 isolat yang diuji, isolat BPK2 yang berasal dari lahan bekas tambang emas memiliki pengaruh terbaik terhadap tinggi tanaman dan bobot kering tajuk tanaman. Di lain pihak, isolat BPK6 yang berasal dari lahan bekas tambang timah memiliki pengaruh terbaik terhadap bobot kering akar dan kadar K pada tanaman sorgum. Isolat yang berasal dari lahan bekas tambang baik bekas tambang emas maupun bekas tambang timah memiliki kemampuan lebih baik dalam memperbaiki pertumbuhan tanaman sorgum dibandingkan dengan isolat dari lahan pertanian.
Isolat BPK2 dan BPK6 yang merupakan isolat terbaik dari pengujian pada tanaman sorgum diambil untuk dianalisa secara molekuler untuk mengidentifikasi spesies isolat tersebut. Berdasarkan hasil analisis molekuler, isolat BPK2 yang berasal dari lahan bekas tambang emas, Pongkor mempunyai kemiripan sebesar 97.8% dengan Achromobacter xylosoxidans dan kemungkinan adalah spesies baru
dari genus Achromobacter. Isolat BPK6 dari lahan bekas tambang timah, Bangka memiliki kemiripan 99% dengan Burkholderia cepacia.
Kata kunci: Achromobacter xylosoxidans, Burkholderia cepacia, feldspar, lahan
SUMMARY
DENI PRATAMA. Potassium-Solubilizing Microbes from Three Locations and Their Ability to Increase Potassium Availability. Supervised by ISWANDI ANAS and SUWARNO.
Potassium is one of macro nutrients that play an important role towards the growth and production of a plant. Generally, the total of potassium in the soil is estimated from 0.5 to 2.5%, but around 90 to 98% from the total potassium is the form in which it is not available so it can not be absorbed by plants. Inorganic potassium fertilizer like KCl is often needed in order to make the plant get enough potassium. In Indonesia, the use of inorganic potassium fertilizer meets some problems because the fertilizer is imported from foreign country so that the price of fertilizer is expensive. Thus, there are many low quality fertilizers in markets even though Indonesia has potential potassium sources, i.e., potassium rocks (potassium feldspar and mica). using biological agents such as potassium-solubilizing microbes (KSM). However, not every KSM can be used. The isolates of KSM that can be used were isolates that have non-pathogenic characteristics towards plants, animals and human. The isolates of KSM used must the superior isolates that can solubilize potassium above the average. Different environment is one of the factors that can be used to get superior KSM, because environmet factors, such as, land aeration and temperature can influence the growth and ability of microbes.
The purposes of this research are, 1) to isolate KSM from ex-tin mining, ex-gold mining, and agricultural land, 2) to select the best KSM based on pathogenic characteristics, ability of KSM to solubilize the potassium in the growing medium and ability of KSM to improve the growth of sorghum plants, 3) to identify the species of the best KSM from the resulf of previous selection by using molecular analysis.
This research was carried out from September 2014 to August 2015. Soil samples were taken from three locations, that are, agriculture land in Cikabayan, West Java, ex-tin mining land in Bangka, and ex-gold mining land in Pongkor, West Java. This research was divided into three parts that are, 1) KSM isolation from soil samples; 2) KSM selection based on the pathogenic test, ability to solubilize potassium sources in growing medium and ability to improve the growth of sorghum plants; 3) molecular analysis to identify species from 2 best isolates of KSM from the previous selection.
As many as 162 isolates of potassium-solubilizing bacteria (KSB) and 23 potassium-solubilizing fungi (KSF) were isolated from soil samples by using
Alexandrov agar medium. Two sources of potassium rock used were feldspar
isolates, there were 10 isolates of KSM that had the biggest potassium-solubilizing index 1.16 to 6.77 for feldspar from Cirebon and 1.07 to 5.91 for feldspar from Malang. Among 10 isolates, 9 isolates can also solubilize phosphate from Ca3(PO4)2 and 5 isolates can solubilize phosphate from the phosphate rocks, Blitar. Based on the ability of 10 isolates of KSM to solubilize potassium in liquid medium, Isolate KSB6 had the highest ability to solubilize potassium sources that are feldspar from Cirebon and feldspar from Malang with soluble potassium content 248.10 ppm and 273.21 ppm respectively. Isolate KSB6 also had the highest ability to solubilize phosphate sources that are Ca3(PO4)2 and phosphate rocks from Blitar with soluble phosphate content of 893.8 ppm and 172 ppm.
Of 10 isolates tested in liquid medium, there were 5 best isolates that had the highest ablitiy to solubilize feldspar from Cirebon and feldspar from Malang. As many as 5 isolates were then examined by applying those isolates in sorghum plants. Of the 5 isolates tested, the isolates of BPK2 from ex-gold mining land had the best influence on the plant height and shoot dry weight of sorghum. On the other hand, BPK6 from the ex-tin mining land had the best influence on the root dry weight and the total potassium content in sorghum plants. Isolates from the ex-gold and ex-tin minings land had the better ability to improve the growth of sorghum plants compared to the isolates from the agricultural land.
The isolates of BPK2 and BPK6 that had the best isolates from the tests of sorghum plants were taken to be analyzed to identify the species of those isolates. Based on the result of molecular analysis, BPK2 from the ex-gold mining land, Pongkor had 97.8% similaritay to Achromobacter xylosoxidans, and it has
possibly a new species from genus of Achromobacter. BPK6 isolate from ex-tin mining land, Bangka had 99% similarity to Burkholderia cepacia.
Key words: Achromobacter xylosoxidans, Burkholderia cepacia, feldspar, ex-gold
© Hak Cipta IPB, Tahun 2016
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah dan pengutipan tersebut tidak merugikan kepentingan IPB.
MIKROB PELARUT KALIUM DARI TIGA LOKASI LAHAN
DAN KEMAMPUANNYA DALAM MENINGKATKAN
KETERSEDIAAN KALIUM
DENI PRATAMA
Tesis
Sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi Tanah dan Lingkungan
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Mikrob Pelarut Kalium dari Tiga Lokasi Lahan dan Kemampuannya dalam Meningkatkan Ketersediaan Kalium
Nama : Deni Pratama
NIM : A154130141
Disetujui oleh
Komisi Pembimbing
Prof Dr Ir Iswandi Anas, MSc Dr Ir Suwarno, MSc
Ketua Anggota
Diketahui Oleh
Ketua Program Studi
Bioteknologi Tanah dan Lingkungan
Dekan Sekolah Pasca Sarjana IPB
Prof Dr Ir Dwi Andreas Santosa, MS Dr Ir Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis ucapkan kepada Allah SWT atas segala limpahan karunia-Nya sehingga penelitian yang berjudul “Mikrob Pelarut Kalium dari Tiga Lokasi Lahan dan Kemampuannya dalam Meningkatkan Ketersediaan Kalium”
dapat terselesaikan. Penghargaan dan terimakasih yang sedalam-dalamnya penulis ucapkan kepada,
1. Bapak Prof Dr Iswandi Anas, MSc selaku ketua komisi pembimbing dan bapak Dr Ir Suwarno, MSc selaku anggota komisi pembimbing yang telah banyak memberi saran dan bimbingan dalam penyelesaian tesis ini.
2. Dirjen DIKTI yang telah memberikan dukungan melalui BPP-DN Calon Dosen 2013.
3. Kepala jurusan Bioteknologi Tanah dan Lingkungan bapak Prof Dr Ir Dwi Andreas Santosa, MS beserta dosen-dosen Bioteknologi Tanah dan Lingkungan, ibu Dr Ir Rahayu Widyastuti, MSc dan bapak Ir Fahrizal Hazra, MSc atas saran yang telah diberikan dalam penyelesaian tesis ini.
4. Penguji luar komisi, bapak Dr Ir Atang Sutandi, MSi atas waktu yang telah diluangkan sebagai penguji serta saran dan masukan yang telah diberikan untuk penyelesaian tesis ini.
5. Staff Laboratorium Bioteknologi Tanah, ibu Asih, ibu Jul, bapak Jito, dan ibu Yeti atas bantuan dalam menyiapkan alat dan bahan untuk penelitian ini. 6. PT. Antam (Aneka Tambang), bapak Nico beserta staff karyawan lain yang
telah membantu dalam proses sampling tanah di lahan bekas tambang emas, Pongkor.
7. Staff karyawan Laboratorium Residu Bahan Agroteknologi (RBA) yang telah membantu dalam melengkapi alat dan bahan penelitian.
8. Ibu Dr Ir Tri Kusumaningtyas, MS, atas bantuan dalam mempersiapkan benih sorgum yang digunakan dalam penelitian.
9. Rekan-rekan di jurusan Bioteknologi Tanah dan Lingkungan angkatan 2012, 2013 dan 2014 yang telah membantu dalam penyelesaian tesis ini.
10.Bapak, ibu, adik dan seluruh keluarga, atas segala dukungan, doa, semangat dan kasih sayangnya.
11.Seluruh pihak yang tidak bisa saya sebutkan satu persatu atas segala bantuan yang telah diberikan untuk penyelesaian tesis ini.
Semoga tesis ini bermanfaat untuk kemajuan teknologi terutama di bidang pertanian khususnya untuk pengembangan pupuk hayati di Indonesia.
Bogor, Maret 2016
DAFTAR ISI
DAFTAR TABEL xiv
DAFTAR GAMBAR xiv
DAFTAR LAMPIRAN xv
PENDAHULUAN
Latar Belakang 1
Rumusan Masalah 2
Tujuan 3
Hipotesis 3
TINJAUAN PUSTAKA
Kalium 4
Mikrob Pelarut Kalium 6
METODE PENELITIAN
Waktu dan Tempat 8
Alat dan Bahan 9
Prosedur Penelitian 9
Analisis Data 17
HASIL DAN PEMBAHASAN
Jumlah Mikrob Pelarut Kalium 18
Sifat Patogenitas Isolat MPK 20
Indeks Pelarutan dan Kemampuan MPK Melarutkan Kalium dan Fosfat 21 Kemampuan MPK Memperbaiki Pertumbuhan Tanaman Sorgum 27 Karakterisasi dan Identifikasi Mikrob Pelarut Kalium 30
SIMPULAN DAN SARAN
Simpulan 32
Saran 32
DAFTAR PUSTAKA 33
LAMPIRAN
DAFTAR TABEL
1. Lokasi, jenis vegetasi, dan koordinat pengambilan sampel tanah 9
2. Komposisi media Alexsandrov 10
3. Komposisi media Blood agar 12
4. Komposisi media Pikovskaya 13
5. Parameter dan metode analisis kimia tanah dan tanaman sorgum 14 6. Populasi MPK yang diisolasi dari sampel tanah 18 7. Kode isolat, jenis isolat, lokasi, dan jenis vegetasi dari 10 isolat MPK 21 8. Indeks pelarutan kalium dan fosfat pada media tumbuh
dengan aplikasi 10 isolat MPK terbaik 24
9. Kadar kalium dan fosfat tersedia serta persen kalium dan fosfat tersedia pada media tumbuh dengan aplikasi 10 isolat MPK terbaik 24 10. Pertumbuhan tanaman sorgum umur 6 MST yang diaplikasi
5 isolat BPK terbaik 29
11 Kadar kalium pada sampel tanah dan tanaman sorgum umur 6 MST
yang diaplikasi 5 isolat BPK terbaik 29
12 Hasil karakterisasi dan identifikasi 2 isolat MPK terbaik 31
DAFTAR GAMBAR
1 Potensi sebaran feldspar di Indonesia 5
2 Lokasi pengambilan sampel tanah 8
3 Denah pengambilan contoh tanah 10
4 Metode Pengenceran 11
5 Isolat MPK yang tumbuh pada media Alexandrovagar 18
6 Daun tembakau yang disuntikkan dengan isolat BPK 20 7 Pertumbuhan benih padi yang direndam isolat FPK 20
8 Isolat MPK pada media Blood agar 21
9 Isolat MPK terbaik pada media Alexandrov agar dengan
sumber kalium berupa feldspar asal Cirebon, Jawa Barat 22 10 Isolat MPK terbaik pada media Alexandrov agar dengan
sumber kalium berupa feldspar asal Malang, Jawa Timur 22 11 Isolat MPK terbaik pada media Pikovskaya agar dengan
sumber fosfat berupa Ca3PO4 23
12 Isolat MPK terbaik pada media Pikovskaya agar dengan
sumber fosfat berupa batuan fosfat asal Blitar, Jawa Timur 23 13 Grafik dan koefisien korelasi (r) antara indeks pelarutan dan
DAFTAR LAMPIRAN
1. Total K2O dan P2O5 pada sumber kalium dan fosfat 38 2. Hasil analisa pupuk dan perhitungan pupuk untuk penanaman sorgum 39 3. Parameter kimia pada air yang digunakan untuk menyiram
tanaman sorgum dan parameter fisik dan kimia pada media tanah dari lahan pertanian Cikabayan yang digunakan untuk
penanaman sorgum 40
4. Parameter dan metode analisis fisik dan kimia sampel tanah 41 5. Kurva pertumbuhan 5 isolat BPK untuk aplikasi ke tanaman sorgum 42 6. Hasil analisa sifat fisik dan kimia sampel tanah 43
7. Jadwal penelitian 44
1
PENDAHULUAN
Latar Belakang
Unsur hara kalium (potassium) merupakan salah satu unsur hara makro
yang berperan penting dalam pertumbuhan dan produksi tanaman. Total kandungan kalium di tanah berbeda pada tiap daerah tergantung pada jenis batuan induk dan letak geografis, tetapi secara umum kalium total di tanah diperkirakan antara 0.5 sampai 2.5 % (Havlin et al. 2005). Hanya saja, sekitar 90 sampai 98 %
dari kalium total tersebut dalam bentuk yang tidak tersedia sehingga tidak dapat diserap oleh tanaman (Rehm & Schmitt 1997). Rendahnya kandungan kalium dalam bentuk yang tersedia di tanah menyebabkan rendahnya penyerapan kalium oleh tanaman yang berdampak pada pertumbuhan dan kualitas hasil tanaman yang kurang baik (Jones et al. 1991).
Pupuk kalium anorganik seperti KCl sering digunakan petani untuk menambah kadar kalium tersedia di tanah agar tanaman mendapat cukup kalium. Di Indonesia, penggunaan pupuk kalium anorganik menemui kendala dikarenakan pupuk tersebut diimpor dari luar negeri sehingga harga pupuk mahal. Oleh karena itu, banyak beredar pupuk palsu di pasaran. Survei pupuk fosfor (P) dan kalium (K) pada kios pertanian di Kabupaten Bogor, Cianjur dan Sukabumi yang dilakukan Anas et al. (2012) menemukan 9 merek pupuk P dan 5 merek pupuk K
yang tidak berkualitas (kandungan P dan K tidak sesuai dengan izin edar).
Padahal, Indonesia memiliki potensi sumber kalium seperti kalium feldspar dan mika. Data dari KESDM (2015) menunjukkan bahwa potensi batuan kalium secara keseluruhan di Indonesia tahun 2013 diperkirakan mencapai 455 juta ton. Sumber kalium tersebut dapat menjadi alternatif sebagai pupuk kalium sehingga dapat mengurangi penggunaan pupuk impor. Hanya saja, batuan kalium memerlukan proses pelapukan yang lama untuk melepaskan kalium tersedia yang dapat diserap tanaman. Oleh karena itu, untuk menggunakan batuan kalium sebagai pupuk bagi tanaman, diperlukan metode yang dapat mempercepat proses pelapukan dari batuan kalium.
Roger et al. (1998) melaporkan bahwa proses pelapukan batuan kalium
dapat dipercepat dengan menggunakan agen hayati yaitu mikrob pelarut kalium (MPK). MPK dapat mempercepat proses pelapukan mineral pembawa kalium dan melepaskan kalium menjadi bentuk tersedia sehingga dapat diserap tanaman (Archana 2007). Berbagai jenis mikrob pelarut kalium dilaporkan telah ditemukan yaitu bakteri pelarut kalium (BPK) yang terdiri dari Bacillus mucilaginosus
(Han dan Lee 2005), Enterobacter hormaechei (Prajapati dan Modi 2012),
Microbacterium hominis, Flectobacillus sp., Agrobacterium tumefasciens,
Bacillus cereus, Bacillus coagulans, Bacillus subtilis, Bacillus megaterium (Diep
dan Hieu 2013) dan fungi pelarut kalium (FPK) seperti Aspergillus terreus
(Prajapati et al. 2013).
2
manusia. Isolat MPK yang digunakan harus merupakan isolat unggul yang memiliki kemampuan melarutkan kalium diatas rata-rata sehingga keberadaannya dapat meningkatkan pertumbuhan tanaman.
Salah satu cara untuk mencari MPK yang memiliki kemampuan yang baik adalah dengan mengisolasi MPK tersebut dari berbagai lokasi lahan dikarenakan isolat yang diisolasi dari lokasi lahan yang berbeda kemungkinan memiliki kemampuan yang berbeda dalam melarutkan kalium. Pandey et al. (2000)
melaporkan bahwa faktor lingkungan seperti derajat keasaman, aerasi tanah dan suhu mempengaruhi pertumbuhan mikrob. Perbedaan dari faktor lingkungan ini dapat mengakibatkan perubahan sifat morfologi dan fisiologi mikrob, juga dapat mengakibatkan laju pertumbuhan menurun ataupun meningkat. Isolat mikrob dari lingkungan dengan kandungan hara lebih sedikit memungkinkan untuk memiliki kemampuan yang lebih unggul dibandingkan dengan mikrob yang berasal dari lingkungan dengan kandungan hara lebih banyak.
Di luar negeri, sudah semakin banyak hasil penelitian tentang MPK mulai dari eksplorasi, identifikasi sampai pengaruhnya terhadap pertumbuhan tanaman. Sedangkan, di Indonesia masih sedikit hasil penelitian tentang potensi MPK, kemampuannya dalam melarutkan kalium sukar larut dan perannya terhadap pertumbuhan tanaman. Hal ini menjadi tantangan yang menarik untuk diteliti tentang kemampuan MPK untuk pengembangan di bidang pertanian terutama perkembangan teknologi produksi pupuk hayati yang bermutu.
Rumusan Masalah
Rendahnya kandungan kalium tersedia di tanah untuk tanaman mengharuskan petani menggunakan pupuk kalium untuk menambah suplai kalium tersedia bagi tanaman. Pupuk kalium yang digunakan kebanyakan berupa pupuk kalium anorganik seperti KCl. Penggunaan pupuk kalium anorganik ini ternyata menemui kendala karena pupuk tersebut diimpor dari luar negeri membuat harganya mahal dan juga banyak beredar pupuk palsu di pasaran.
Indonesia sebenarnya memiliki potensi sumber kalium seperti feldspar yang dapat menjadi alternatif untuk mengurangi penggunaan pupuk kalium anorganik. Hanya saja, proses pelapukan dari feldspar ini lama membuat proses pelepasan kalium dalam bentuk tersedia bagi tanaman juga lama. Oleh sebab itu, diperlukan cara untuk mempercepat proses pelapukan dari feldspar ini, sehingga feldspar dapat digunakan sebagai alternatif untuk mengurangi pemakaian pupuk kalium anorganik.
3
Tujuan
Tujuan dilakukannya penelitian ini adalah,
1. Mengisolasi isolat MPK dari sampel tanah pertanian, pasca tambang timah dan pasca tambang emas.
2. Menyeleksi isolat MPK hasil isolasi dengan menguji sifat patogenitas, kemampuannya melarutkan kalium pada media tumbuh dan kemampuannya dalam memperbaiki pertumbuhan tanaman sorgum.
3. Mengidentifikasi spesies isolat MPK terbaik dari hasil seleksi menggunakan metode analisa molekuler.
Hipotesis
Hipotesis dari penelitian ini adalah,
1. Diperoleh isolat MPK dari hasil isolasi sampel tanah dari tanah pertanian, pasca tambang timah dan pasca tambang emas.
2. Beberapa isolat MPK yang diisolasi memiliki sifat nonpatogen terhadap tumbuhan, hewan dan manusia.
3. Isolat MPK yang lolos uji patogenitas memiliki kemampuan yang berbeda dalam melarutkan sumber kalium pada media tumbuh dan penambahan isolat MPK pada media tumbuh dapat meningkatkan kadar kalium terlarut dalam media tumbuh.
4
TINJAUAN PUSTAKA
Kalium
Bentuk dan Kandungan Kalium Total di Tanah
Kalium di dalam tanah ada dalam berbagai bentuk dengan potensi penyerapannya untuk setiap tanaman berbeda-beda. Kalium total di tanah berbeda pada tiap lokasi lahan tergantung pada jenis batuan induk dan kondisi iklim daerah tersebut. Daerah dengan curah hujan dan temperatur yang tinggi, memiliki kandungan kalium yang lebih sedikit di dalam tanah dibandingkan dengan daerah yang memiliki curah hujan yang lebih rendah. Rendahnya kadar kalium total tersebut dikarenakan curah hujan dan temperatur yang tinggi akan mempercepat proses pelepasan dan pencucian kalium yang ada di dalam tanah (Tisdale et al.
1985).
Bentuk dan kandungan kalium total di dalam tanah terdiri dari mineral (0.05-2.5 %) (Chapman & Pratt 1961), tidak dapat ditukar (50-750 ppm), dapat ditukar (40-600 ppm) dan terlarut (1-10 ppm) (Havlin et al. 2005). Kalium dalam
bentuk mineral dan bentuk tidak dapat ditukar merupakan kalium tidak tersedia. Kalium tidak tersedia biasanya ditemukan dalam feldspar dan mika (Tisdale et al.
1985) yang terikat dalam mineral primer seperti ortoklas dan muskovit (Goldstein 1994). Kalium tersedia merupakan kalium dalam bentuk dapat ditukar dan bentuk larutan. Kalium tersedia ini merupakan kalium yang mudah diserap oleh tanaman. Bentuk kalium tersedia dalam tanah untuk diserap tanaman adalah K terlarut. Tanaman menyerap K dari tanah dalam bentuk ion K+ (Silahooy 2008).
Fungsi Kalium bagi Tanaman
Kalium diserap oleh tanaman dalam jumlah yang lebih besar dibadingkan dengan unsur hara lain selain nitrogen. Kalium diserap tanaman dalam bentuk K+ dan kandungannya berkisar antara 0.5 sampai 6 % dari bobot kering tanaman (Havlin et al. 2005). Kalium merupakan unsur hara esensial yang berperan dalam
mempertahankan status air, tekanan turgor sel dan buka tutup stomata (Jones et al. 1991). Kalium dapat mempengaruhi penambahan kadar
sclerenchyma pada dinding-dinding sel batang, sehingga dapat terjadi pengerasan
bagian kayu dari batang tanaman. Kalium juga berfungsi meningkatkan sintesis dan translokasi karbohidrat, sehingga mempercepat penebalan dinding sel dan ketegaran tangkai bunga, buah dan cabang (Taufiq 2002).
5
Kalium bersifat mobile di dalam tanaman, sehingga gejala kekurangan
kalium akan terlihat dari gejala nekrosis yang muncul pada daun tua. Kekurangan kalium membuat tanaman lebih sensitif terhadap ammonium yang dapat memungkinkan terjadinya sindrom keracunan ammonium (Jones et al. 1991).
Gejala kekurangan kalium juga ditandai dengan melemahnya jerami atau tangkai tanaman, menyebabkan tanaman mudah roboh. Kekurangan kalium juga menyebabkan peningkatan kerusakan tanaman oleh bakteri, fungi, nematoda dan virus penyebab penyakit tanaman (Havlin et al. 2005).
Tanaman yang mengalami kelebihan kalium akan mengalami kekurangan magnesium dan kemungkinan juga akan kekurangan kalsium karena adanya hubungan keseimbangan antara kalium dengan magnesium dan kalium dengan kalsium (Jones et al. 1991).
Sumber Kalium
Sumber kalium terbesar yang ada di dalam tanah adalah kalium feldspar (KAlSi3O8). Kandungan kalium total pada kalium feldspar mencapai 14 % (Tisdale et al. 1985). Mineral yang mengandung kalium pada feldspar biasanya
berupa ortoklas, sanidin, adularia, mikroklin dan anortoklas (Munir 1996). Keberadaan kalium feldspar di dalam tanah biasanya menandakan bahwa tanah tersebut kaya akan potensi kalium. Pelapukan dari kalium feldspar akan melepaskan ion K+ yang dapat meningkatkan kesuburan tanah.
Selain feldspar, mika juga merupakan sumber kalium. Kadungan kalium pada mika diperkirakan mencapai 10 % (Tisdale et al. 1985). Mineral yang
mengandung kalium pada mika berupa muskovit, lepidolit, plogopit dan biotit. Keberadaan mika di dalam tanah juga dapat dijadikan patokan untuk menentukan bahwa tanah tersebut memiliki kemungkinan kaya akan K, Mg dan Fe.
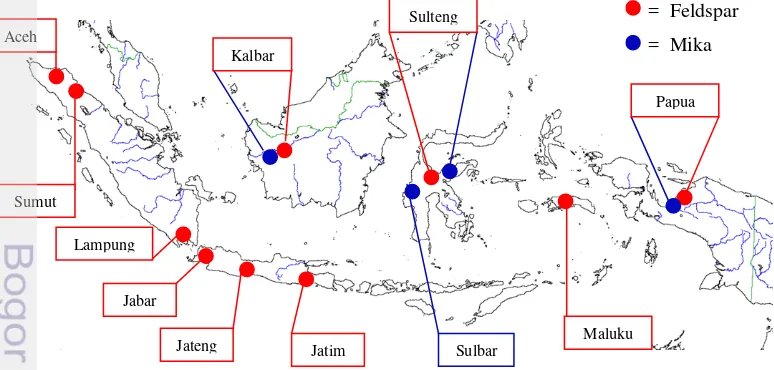
Feldspar terdapat di beberapa provinsi di Indonesia antara lain Aceh, Sumatera Utara, Lampung, Jawa Barat, Jawa Tengah, Jawa Timur, Kalimantan Barat, Sulawesi Tengah, Maluku dan Papua. Sedangkan, mika terdapat di provinsi Kalimantan Barat, Sulawesi Tengah, Sulawesi Barat dan Papua (Gambar 1).
Gambar 1 Sebaran feldspar dan mika di Indonesia (Tekmira 2015)
6
Berdasarkan data KESDM (2015), Indonesia memiliki sumber cadangan kalium seperti kalium feldspar dan mika. Sebaran feldspar secara umum (kalium dan kalsium feldspar) hampir terdapat di seluruh provinsi di Indonesia dengan komposisi mineral yang berbeda pada tiap daerah. Data cadangan mineral feldspar di Indonesia dibagi menjadi cadangan mineral feldspar terukur (proved), tereka
(probable) dan terindikasi (possible) dengan jumlah masing-masing sebesar 4827
juta, 3621 juta dan 409 juta ton.
Mikrob Pelarut Kalium
Mikrob Pelarut Kalium dan Manfaatnya
Mikrob memainkan peran kunci dalam siklus kalium alami. Beberapa spesies mikrob mampu menyediakan kalium dalam bentuk tersedia di dalam tanah. Secara umum, MPK dapat ditemukan baik di tanah ataupun di daerah rhizosfer akar. MPK menghasilkan asam-asam organik yang dapat membantu melepaskan kalium yang terikat pada mineral pembawa kalium (Archana 2007). Berbagai spesies BPK telah ditemukan seperti di India oleh Prajapati dan Modi (2012) yang menemukan BPK spesies Enterobacter hormaechei dari tanah
industri keramik di daerah Kadi, Kalol dan Himmatnagar. Selain itu, masih di negara yang sama penelitian oleh Sugumaran dan Janarthanam (2007) menemukan BPK spesies Bacillus mucilaginosus.
Diep dan Hieu (2013) melaporkan penemuan BPK spesies
Microbacterium hominis, Flectobacillus sp., Agrobacterium tumefasciens,
Bacillus cereus, Bacillus coagulans, Bacillus subtilis dan Bacillus megaterium
dari daerah gunung Ha Tien, provinsi Kien Giang, Vietnam. Penelitian lain yang dilakukan di Korea oleh Han dan Lee (2005), berhasil menemukan BPK spesies
Bacillus mucilaginosus yang ternyata spesies tersebut juga dapat melarutkan
fosfat. Penelitian Archana (2007) juga menemukan FPK yang mengasilkan asam-asam organik yaitu asam sitrat dan asam oksalat yang dapat melepaskan ikatan antara kalium dan silikat.
MPK memiliki kemampuan untuk melepaskan kalium yang terikat dengan silikat pada berbagai jenis feldspar dan mika. Kemampuan tersebut berbeda-beda tergantung spesies dan jenis mineral. Sugumaran dan Janarthanam (2007) membandingkan efektivitas pelarutan kalium oleh BPK spesies Bacillus
mucilaginosus dengan jenis mineral mikroklin, ortoklas dan muskovit mika. Hasil
penelitian tersebut menunjukkan bahwa kalium pada muskovit mika memiliki efektivitas pelarutan yang lebih tinggi dibandingkan dengan mikroklin dan ortoklas.
Pemanfaatan Mikrob Pelarut Kalium dalam Bidang Pertanian
7
Basak dan Biswas (2009) melaporkan bahwa penggunaan BPK meningkatkan biomassa hasil dan penyerapan kalium tanaman sorgum. Selain itu, Han et al. (2006) melaporkan bahwa aplikasi BPK dengan BPF yang tidak
bersifat antagonis satu sama lain meningkatkan serapan hara N, P dan K, juga meningkatkan kemampuan penyerapan hara oleh tajuk dan akar tanaman lada dan mentimun, serta meningkatkan bobot kering tajuk dan bobot akar tanaman lada dan mentimun.
Prajapati et al. (2013) melaporkan bahwa aplikasi MPK spesies Enterobacter hormaechei dan Aspergillus terreus meningkatkan kandungan
kalium tersedia di tanah. Aplikasi Enterobacter hormaechei meningkatkan
pertumbuhan tajuk dan akar tanaman okra. Sangeeth et al. (2012) juga
melaporkan bahwa aplikasi MPK spesies Paenibacillus glucanolyticus yang
8
METODE PENELITIAN
Waktu dan Tempat
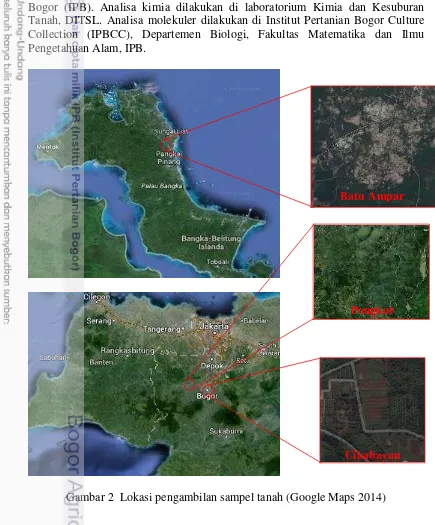
Penelitian ini dilaksanakan dari bulan September 2014-Agustus 2015. Sampel tanah diambil dari tiga lokasi lahan (Gambar 2) yaitu lahan bekas tambang timah di Batu Ampar, Bangka Belitung, lahan bekas tambang emas di Pongkor, Bogor, Jawa Barat dan lahan pertanian di Cikabayan, Bogor, Jawa Barat (Tabel 1). Isolasi dan seleksi MPK dilakukan di laboratorium Bioteknologi Tanah, Departemen Ilmu Tanah dan Sumber Daya Lahan (DITSL), Institut Pertanian Bogor (IPB). Analisa kimia dilakukan di laboratorium Kimia dan Kesuburan Tanah, DITSL. Analisa molekuler dilakukan di Institut Pertanian Bogor Culture Collection (IPBCC), Departemen Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, IPB.
Gambar 2 Lokasi pengambilan sampel tanah (Google Maps 2014) Batu Ampar
Pongkor
9
Tabel 1 Lokasi, jenis vegetasi dan koordinat pengambilan sampel tanah
Lokasi Jenis Vegetasi Koordinat
Karamunting (Melastoma malabathricum L.) S 01059.376' ; E 106008.579’
Akasia (Acacia mangium Willd.) S 01059.401’ ; E 106008.589’
Simpur (Dillenia suffruticosa (Griff) Martelli) S 01059.393’ ; E 106008.389’
Lahan bekas tambang emas, Pongkor
Sonobrit (Dalbergia latifolia Roxb.) S 06038.692’ ; E 106034.233’
Ganitri (Elaeocarpus serratus L.) S 06038.627’ ; E 106034.219’
Puspa (Schima wallichii (DC.) Korth.) S 06038.745’ ; E 106034.256’
Alat dan Bahan
Alat-alat yang digunakan untuk pengambilan sampel tanah adalah bor tanah dan cangkul, sedangkan penentuan koordinat lokasi pengambilan sampel tanah digunakan alat berupa Global Positioning System (GPS). Isolasi, seleksi dan
pengujian MPK digunakan alat berupa autoclave, laminar air flow dan micropipet. Perlengkapan uji ke tanaman sorgum terdiri dari cangkul dan pipa
paralon ukuran ¾ inch. Peralatan analisa kimia terdiri dari spekrofotometer UV-Vis (Varian-Cary 300) dan Flamefotometer (Corning 405). Perlengkapan identifikasi molekuler terdiri dari UV transilluminator, Polymerase Chain
Reaction (PCR) dan perangkat elektroforesis.
Bahan untuk isolasi, seleksi dan pengujian MPK terdiri dari sampel tanah dari tanah pasca tambang timah, tanah pasca tambang emas, tanah pertanian, media Alexsandrov, media blood agar, media NA (Nutrient Agar), media pikovskaya, bibit tembakau varietas Havana, benih padi varietas Ciherang dan
pereaksi molibdat. Sumber kalium yang digunakan adalah feldspar dari 2 lokasi yaitu feldspar asal Gunung Kuda, Cirebon, Jawa Barat dengan kadar K2O 1.93 % dan feldspar asal Malang, Jawa timur dengan kadar K2O 1.74 %. Sumber fosfat yang digunakan adalah Ca3(PO4)2 dengan kadar kadar P2O5 45.76 % dan batuan fosfat asal Blitar, Jawa Timur dengan kadar kadar P2O5 26.61 %. Sebelum digunakan, feldspar dan batuan fosfat terlebih dahulu digerus lalu disaring dengan ukuran saringan 270 mesh. Bahan untuk uji ke tanaman sorgum terdiri dari benih sorgum varietas Numbu, pupuk Urea (46.72 % N) dan pupuk SP-36 (33.59 % P2O5), air minim hara (51.12 ppm C-organik, 14.06 ppm N total, 0.23 ppm P total dan 0.12 ppm K total) dan media tanah dari lahan pertanian Cikabayan, Bogor, Jawa Barat (1.23 % C-organik, 0.13 % N total, 144 ppm P total, 23.08 ppm P tersedia, 140 ppm K total dan 26.58 ppm K tersedia). Bahan yang digunakan untuk identifikasi molekuler terdiri dari larutan penyangga, proteinase-K, agarosa, Etidium Bromida (EtBr), dNTP dan taq DNA polymerase.
Prosedur Penelitian
Pengambilan Sampel Tanah
10
tanah dengan 3 ulangan. Pengambilan sampel tanah dilakukan dengan membagi daerah pengambilan sampel menjadi 4 titik (Gambar 3). Pengambilan sampel tanah menggunakan cangkul atau linggis dengan cara menggali tanah sampai kedalaman 0 sampai 20 cm, tanah yang telah digali dilihat lapisan tanah yang ada, kemudian pada lapisan yang terlihat sama, sampel tanah diambil menggunakan sendok semen, lalu dikompositkan. Tanah diambil 100 g untuk isolasi mikrob dan 250 g untuk analisis fisik dan kimia tanah.
Keterangan : = Tanaman = Titik Sampling
Gambar 3 Denah pengambilan contoh tanah
Isolasi Mikrob Pelarut Kalium
Isolasi MPK memodifikasi metode dari Prajapati dan Modi (2012) menggunakan media Alexandrov (Tabel 2). Sampel tanah dikeringanginkan
terlebih dahulu. Tahapan isolasi BPK dimulai dengan menginkubasi 10 g berat kering mutlak (BKM) tanah ke 90 ml media Alexandrov broth selama 4 hari.
Sedangkan isolasi FPK dilakukan dengan menginkubasi 10 g BKM tanah ke 90 ml media Alexandrov broth yang telah ditambahkan kloramfenikol selama 7 hari.
Sampel tanah yang telah diinkubasi diencerkan menggunakan metode pengenceran (dilution method) dengan mensuspensikan 1 ml media dari hasil
inkubasi ke 9 ml larutan fisiologis (NaCl 0,85 %) (10-1), langkah tersebut diulang sampai pengenceran 10-4 untuk bakteridan 10-3 untuk fungi (Gambar 4).
Isolasi mikrob menggunakan metode sebar (spread plate). Media
Alexandrovagar (bakteri) atau Alexandrovagar yang ditambahkan kloramfenikol
(fungi) dituang dan disebar ke seluruh permukaan cawan petri dan dibiarkan sampai mengeras. Sebanyak 0.1 ml hasil pengenceran dimasukkan ke dalam cawan petri yang berisi media Alexandrov agar kemudian disebar ke seluruh
permukaan media dan dinkubasi selama 4 sampai 7 hari.Perlakuan ini diulang sebanyak 2 ulangan. Prajapati et al. (2012) menyebutkan bahwa koloni yang
tumbuh dan membentuk zona bening pada media merupakan koloni MPK. Tabel 2 Komposisi media Alexandrov agar (Prajapati & Modi 2012)
11
Seleksi patogenitas terdiri dari uji hipersensitif dan uji hemolisis. Pengujian respon hipersensitif dilakukan untuk mengetahui potensi MPK sebagai patogen bagi tanaman. Pengujian respon hipersensitif pada BPK memodifikasi metode Schaad et al. (2001) yang dilakukan dengan membiakkan isolat bakteri
pada media Nutrient broth (NB) dan diinkubasi selama 12 jam pada suhu ruang.
Isolat pada media NB kemudian diambil menggunakan alat suntik (syringe) lalu
disuntikkan sebanyak 0.1 ml (109 SPK/ml) ke daun tembakau (Nicotiana tabacum L.) varietas Havana. Penyuntikan isolat ke daun tembakau dilakukan tanpa
menggunakan jarum suntik. Kontrol negatif dilakukan dengan menyuntikkan daun tembakau menggunakan aquadest steril dan kontrol positif dilakukan dengan
menyuntikkan daun tembakau menggunakan Xantomonas sp. Pengamatan
dilakukan dengan mengamati perubahan pada daun tembakau selama 72 jam, jika terjadi gejala nekrosis pada titik penyuntikan, maka BPK tersebut berpotensi sebagai patogen tanaman.
Pengujian respon hipersensitif pada FPK memodifikasi metode Mahmoud et al. (2013) yang dilakukan dengan membiakkan isolat fungi pada
media Potato Dextrose Broth (PDB) sampai fungi menutupi seluruh permukaan
media. Benih padi varietas Ciherang non-steril direndam selama 24 jam pada media PDB yang telah ditumbuhi FPK. Benih padi yang telah direndam kemudian disemai pada kapas steril yang telah dibasahi dengan aquadest. Penyemaian benih
12
terus dijaga dengan menyiram kapas secara rutin dengan aquadest. Sebagai
kontrol negatif digunakanlah benih padi yang direndam dengan air steril dan kontrol positif digunakan benih padi yang direndam dengan fungi Rhizotocnia solani. Kriteria seleksi dilihat dari persentase tumbuh, jika persentase tumbuh
benih yang direndam lebih rendah dari kontrol negatif (aquadest), maka fungi
berpotensi sebagai patogen bagi tanaman. Mikrob yang teridentifikasi sebagai patogen bagi tanaman tidak digunakan dalam pengujian selanjutnya.
Pengujian hemolisis dilakukan untuk mengetahui potensi MPK sebagai patogen bagi manusia dan hewan. Uji hemolisis memodifikasi metode Difco (2009) dengan menumbuhkan MPK yang lulus dari uji hipersensitif pada media
Blood agar (Tabel 3) yang telah dicampur darah domba 5 % dari domba jenis
Ekor Gemuk, kemudian diinkubasi selama 24 jam pada suhu ruang. Zona bening yang terbentuk di sekeliling koloni menunjukkan bahwa koloni mikrob tersebut bersifat patogen bagi manusia dan hewan.
Tabel 3 Komposisi media Blood agar (Himedia 2013)
Bahan Dosis (%)
Pengujian indeks pelarutan kalium dilakukan untuk menentukan 10 MPK terbaik dari MPK yang lolos uji patogenitas. Pengujian dilakukan dengan membiakkan isolat yang lolos uji patogenitas ke media Alexandrov agar
kemudian dihitung indeks pelarutan kalium dari koloni MPK tersebut. Sumber kalium yang ditambahkan pada media Alexandrov adalah feldspar yang berasal
dari Gunung Kuda, Cirebon, Jawa Barat dan feldspar yang berasal dari Jawa Timur. Sebanyak 10 isolat MPK yang memiliki indeks pelarutan kalium terbesar diambil untuk dilakukan pengujian selanjutnya yaitu uji indeks pelarutan fosfat dan uji kemampuan mikrob melarutkan sumber kalium dan fosfat di media cair.
Uji indeks pelarutan fosfat bertujuan untuk mengetahui kemampuan mikrob selain sebagai pelarut kalium, juga sebagai pelarut fosfat. Pengujian dilakukan dengan membiakkan 10 isolat mikrob pelarut kalium terbaik pada media Pikovskaya agar (Tabel 4) dengan sumber fosfat berupa Ca3(PO4)2 dan
batuan fosfat asal Blitar, Jawa timur. Isolat yang membentuk zona bening pada media menunjukkan isolat dapat melarutkan fosfat. Rumus yang digunakan untuk mengukur indeks pelarutan fosfat sama dengan rumus pengukuran indeks pelarutan kalium (Edi et al. 1996). Rumus indeks pelarutan kalium dan fosfat
adalah sebagai berikut,
13
Tabel 4 Komposisi media Pikovskaya (Himedia 2011)
Bahan Dosis (%)
Uji Kemampuan MPK Melarutkan Kalium dan Fosfat di Media Cair
Pengujian bertujuan mendapatkan 5 MPK terbaik dari 10 MPK hasil uji sebelumnya berdasarkan kemampuannya dalam melarutkan sumber kalium sukar larut. Pengujian kemampuan MPK pada media cair dalam melarutkan sumber kalium dan fosfat merupakan percobaan faktor tunggal dengan 11 perlakuan yang diulang sebanyak 3 kali. Pengujian ditempatkan dalam rancangan acak lengkap (RAL). Perlakuan adalah pemberian isolat MPK yaitu MPK0 (tanpa isolat) dan 10 isolat MPK terbaik dari uji indeks pelarutan kalium.
Pengujian dilakukan dengan mengisolasi 10 isolat mikrob pada 25 ml media tumbuh selama 7 hari. Media tumbuh yang digunakan komposisinya terdiri dari 1 % glukosa, 0.05 % yeast extract dan 0.5 % sumber kalium (feldspar) atau
sumber fosfat (Ca3(PO4)2 dan batuan fosfat). Setelah 7 hari, suspensi isolat kemudian di centrifuge selama 25 menit dengan kecepatan 4000 rpm untuk
memisahkan supernatan dari sel mikrob dan kalium atau fosfat tidak larut, lalu supernatan diambil dan disaring.
Pengukuran kalium terlarut memodifikasi metode yang dilakukan Parmar dan Sindhu (2013) dengan mengukur supernatan menggunakan flamefotometer. Larutan standar menggunakan K titrisol. Pengukuran fosfat terlarut memodifikasi metode yang dilakukan oleh Susilowati dan Syekhfani (2014), 1 ml supernatan hasil centrifuge dicampurkan dengan larutan pereaksi
(asam borat 0.5 %, ammonium molibdat 0.38 %, HCl 7.5 %) kemudian ditambahkan 5 tetes larutan pereduksi. Larutan hasil reaksi diukur menggunakan spektrofotometer dengan panjang gelombang 660 nm serta larutan standar menggunakan KH2PO4.
Berdasarkan hasil pengukuran kalium dan fosfat pada media cair, persentase kelarutan kalium dan fosfat kemudian dihitung untuk mengetahui seberapa besar kemampuan MPK dalam melarutkan sumber kalium dan fosfat. Persentase kelarutan kalium dan fosfat dihitung dengan rumus,
14
Parameter pengamatan adalah kadar kalium dan fosfat terlarut (ppm) serta persentase kalium dan fosfat terlarut (%) pada media tumbuh yang telah ditambahkan dengan sumber kalium atau sumber fosfat. Sebanyak 5 isolat yang memiliki kemampuan pelarutan kalium terbesar diambil untuk diuji pada tanaman sorgum.
Uji Kemampuan Mikrob Pelarut Kalium pada Tanaman Sorgum
Pengujian kemampuan MPK dilakukan untuk mengetahui seberapa besar kemampuan MPK dalam melarutkan kalium di tanah dari bentuk yang tidak tersedia menjadi bentuk tersedia dan pengaruhnya terhadap pertumbuhan vegetatif tanaman sorgum. Pengujian kemampuan MPK pada tanaman sorgum merupakan percobaan faktor tunggal dengan 6 perlakuan yang diulang sebanyak 3 kali. Pengujian ditempatkan dalam rancangan acak lengkap (RAL). Perlakuan adalah pemberian isolat MPK pada media penanaman yaitu P0 (tanpa isolat) dan 5 isolat terbaik dari uji pada media cair (P1, P2, P3, P4 dan P5).
Aplikasi mikrob memodifikasi metode yang dilakukan oleh Basak dan Biswas (2009) dengan modifikasi pada tanaman yang digunakan yaitu tanaman sorgum. Tanah jenis Latosol dari kebun percobaan Cikabayan sebanyak 5 kg berat kering oven dimasukkan ke dalam polibag dan masing-masing diberi 1/3 dosis pupuk anorganik berupa 100 ppm N dan 50 ppm P2O5. Aplikasi MPK dilakukan dengan membiakkan isolat pada 100 ml media NB selama 12 jam, kemudian 20 ml MPK (populasi 109 SPK/ml) pada media NB tersebut dicampur dengan 250 ml
aquadest dan diaplikasikan ke polibag perlakuan sebelum penanaman. Pada
perlakuan kontrol tidak diberi isolat MPK. Polibag tersebut kemudian ditanami benih sorgum, kelembaban tanah dijaga dengan menyiram tanah menggunakan air minim hara. Sebanyak 2/3 dari dosis pupuk N dan pupuk P diberikan ke tanaman pada umur tanaman 3 minggu setelah tanam (MST).
Pengamatan dilakukan pada saat tanaman sorgum berumur 6 MST. Tanaman sorgum yang telah diukur pertumbuhannya pada 6 MST dikeringkan dengan oven pada suhu 60 0C selama 24 jam lalu dihaluskan kemudian dianalisis kandungan kalium total pada tanaman tersebut. Tanah yang ditanami sorgum juga diukur pH tanah kemudian dikeringkan menggunakan oven pada suhu 60 0C selama 24 jam lalu dianalisa kandungan kalium total dan kalium tersedia tanah (Tabel 5). Parameter pengamatan yaitu tinggi tanaman (cm), jumlah daun (helai), bobot kering akar (g), bobot kering tajuk (g), pH tanah, kadar kalium tanaman
K tanaman (%) Pengabuan basah Flamefotometer K total (me/100 g) HNO3 dan HClO4 Flamefotometer
15
Identifikasi dan Karakterisasi Mikrob Pelarut Kalium
a. Identifikasi MPK
Identifikasi mikrob secara molekuler dilakukan dengan metode analisa molekuler berdasarkan sekuen gen 16s rRNA (Santosa 2001; Sulandri dan Zein 2003). Tahapan identifikasi berupa ekstraksi, purifikasi, Polymerase
Chain Reaction (PCR), elektroforesis dan sekuensing DNA. Tahapan ekstraksi
dilakukan dengan menumbuhkan isolat pada media luria bertani (LB) selama 3 hari, sebanyak 10 ml kultur yang telah tumbuh disetrifugasi (8000 ppm selama 10 menit). Supernatan hasil setrifugasi dibuang dan pelet dicuci untuk digunakan. Sebanyak 30 mg pelet dicampur dengan 1.5 ml yang berisi 500 µl buffer STE, kemudian pelet disuspensikan. Tambahkan 20 µl protease K (10 mg/ml) dan 50 µl larutan SDS 10 %. Suspensi selanjutnya diinkubasi dalam waterbath (55 0C selama 2 jam). Tambahkan 50 µl 5 M NaCl, 400 µl
phenol dan 400 µl CIAA, kemudian putar pelan pada temperatur ruang selama
1.5 jam lalu disentrifugasi 3000 rpm selama menit. Supernatan ditambahan 50 µl 5 M NaCl dan 1 ml etanol absolut lalu diinkubasi di freezer selama 1 jam.
Setrifugasi 8000 ppm selama 5 menit, supernatan lalu dibuang kemudian tambahkan 1 ml etanol 70 % lalu setrifugasi (8000 ppm selama 5 menit) dan supernatan dibuang. Tiriskan dan keringkan sisa-sisa etanol. Tambahkan 50 µl TE kemudian simpan pada temperatur 4 0C sampai digunakan.
Purifikasi dilakukan dengan mengekstraksi 50 µl DNA ditambah 5 µl RNAase (10 mg/ml) kemudian diaduk menggunakan vortek lalu diinkubasi selama 3 jam dengan suhu 37 0C. Tambahkan 200 µl air destilasi steril, 200 µl fenol dan 200 µl kloroform lalu tabung Eppendorf yang berisi campuran DNA
kemudian dibolak-balik secara perlahan. Suspensi kembali disentrifugasi (8000 ppm selama 5 menit). Supernatant dipindahkan ke dalam tabung
eppendorf steril dan ditambahkan 25 µl 5 M NaCl, 500 µl etanol absolut
kemudian diinkubasi pada suhu -20 0C selama 1 jam. Suspensi disentrifugasi (8000 ppm selama 10 menit), supernatan dibuang dan ditiriskan. Tambahkan 50 µl aquadest dan simpan pada temperatur 4 0C sampai digunakan.
Proses PCR diawali dengan pembuatan campuran komponen reaksi PCR sebanyak 50 µl yang terdiri dari, 5 µl 10x penyangga PCR, 4 µl 2.5 mM dNTP, 5 µl 2.5pmol/µl primer 63f (5’ –CAG GCC TAA CAC ATG CAA GTC– 3’), 5 µl 2.5pmol/µl primer 1387r (5’ –GGG CGG WGT GTA CAA GGC–3’), 0.25 µl taq polymerase, sampel DNA dan aquabidest steril sampai 50 µl. Running PCR dimulai dengan proses denaturasi 94 0C selama 2 menit,
kemudian diikuti dengan 30 siklus denaturasi (94 0C selama 1 menit). Proses
annealing dilakukan pada suhu 45 0C selama 1 menit. Proses elongasi
dilakukan pada suhu 72 0C selama 2 menit, lalu pada siklus terakhir waktu polimerisasi diperpanjang menjadi 10 menit. Reaksi PCR dihentikan dengan menurunkan suhu menjadi 4 0C.
Proses elektroforesis dilakukan dengan membuat gel agarose dengan
mencampurkan 4 gram agarosa dalam 200 ml 1x penyangga TAE, panaskan sampai mendidih. Dinginkan larutan samapi 60 0C kemudian tambahkan 5 µl etidium bromida (EtBr/C21H20BrN3) (10 mg/ml) dan aduk hingga rata. Larutan kemudian dituang ke dalam tray dan pasang well-forming combs dan tunggu
16
diletakkan ke dalam tanki elektroforesis dan tuang 1x penyangga TAE hingga 1 mm diatas permukaan gel. Ambil sampel sebanyak well capacity (kapasitas
sumur), letakkan diatas parafilm dan tambahkan loading dye buffer 1/10
volume sampel lalu aduk rata. Ambil larutan kemudian masukkan ke dalam sumur pada gel agarose, lalu tutup tanki dan hubungkan dengan arus listrik.
Setelah proses elektroforesis selesai, tray diambil, kemudian gel ditaruh pada
UV Transilluminalator.
Sekuensing DNA dilakukan dengan mengamplifikasi DNA dengan primer tunggal dan 20 µl campuran komponen reaksi dari taq polymerase. Tambahkan 100 µl aquadest ke DNA yang telah diamplifikasi. Masukkan
larutan ke tabung eppendorf steril lalu tambahkan 18 µl 2 M sodium asetat dan
300 µl etanol. Setrifugasi selama 10 menit, buang supernatan secara hati-hati, sisakan kira-kira 20 sampai 30 µl dan cuci dengan etanol 70 %. Setrifugasi kembali selama 2 menit, sisakan kira-kira 20 sampai 30 µl lagi kemudian keringkan menggunakan pompa vakum. Produk PCR disekuensing menggunakan automatic DNA sequencer dan hasil sekuensing dibandingkan
dengan sekuen pada European Molecular Biology Laboratory (EMBL)
menggunakan piranti FASTA pada situs www.ebi.ac.uk.
b. Karakterisasi MPK
Pengamatan karakterisasi 2 MPK terbaik yang telah lolos seleksi sebelumnya terdiri dari,
Morfologi Koloni Mikrob Pelarut Kalium
Pengamatan morfologi koloni bakteri meliputi bentuk koloni, warna, elevasi (kenampakan dari samping) dan bentuk tepian (Marista et al. 2013).
Pengamatan morfologi koloni fungi meliputi bentuk, warna miselium dan warna spora.
Bentuk Sel dan Pewarnaan Gram
Pengamatan bentuk sel dan pewarnaan gram dilakukan dengan cara mengambil 1 ose isolat BPK dan diletakkan diatas kaca objek, kemudian difiksasi dengan melewatkan kaca objek diatas api bunsen. Kaca objek yang berisi isolat kemudian ditetesi kristal violet dan didiamkan selama 30 detik, kemudian dibilas dengan aquadest. Kaca objek tersebut kemudian ditetesi
dengan iodin, lalu didiamkan selama 1 menit, lalu bilas dengan aquadest.
Kaca objek lalu ditetesi dengan alkohol 70 %, lalu dibilas dengan aquadest.
Kaca objek kemudian ditetesi dengan safranin, didiamkan selama 45 detik, lalu dibilas dengan aquadest dan dikeringkan (Pelczar & Chan 1986). Kaca
objek diamati di bawah mikroskop untuk melihat bentuk sel dan hasil pewarnaan gram.
Uji Biokimia
Uji biokimia BPK meliputi uji motilitas, uji katalase, uji indol, uji urea, uji fermentasi glukosa, uji pati dan uji sitrat (Faddin 1979).
1. Uji Motilitas
17
suhu ruang selama 48 jam. Hasil inkubasi diamati dari perluasan areal tusukan. Jika areal tusukan meluas, berarti mengindikasikan bakteri tersebut bersifat motil.
2. Uji Katalase
Isolat bakteri diinokulasikan pada media NA miring dengan metode gores. Kultur hasil inkubasi kemudian ditetesi dengan H2O2 3 %, jika terbentuk gelembung maka uji dinyatakan positif.
3. Uji Indol
Isolat bakteri diinokulasikan pada media NA tegak setengah padat di dalam tabung reaksi dengan metode tusuk, kemudian diikubasi pada suhu ruang selama 24 sampai 48 jam. Kultur hasil inkubasi kemudian
ditetesi dengan reagen Kovac’s sebanyak 10 tetes. Warna merah yang terbentuk menunjukkan bahwa bakteri memiliki kemampuan untuk memecah asam amino triptofan.
4. Uji Urea
Isolat bakteri diinokulasikan ke dalam media Urea Broth dan
diinkubasi pada suhu ruang selama 24 sampai 48 jam. Terbentuknya warna merah keunguan menunjukkan hasil positif karena bakteri mampu menggunakan urea dan mengubah pH menjadi basa.
5. Uji Fermentasi Glukosa
Isolat bakteri diinokulasikan ke dalam media pertumbuhan cair yang masing-masing mengandung glukosa 2 % kemudian diinkubasi dilakukan pada suhu ruang selama 24 sampai 48 jam. Indikasi sifat fermentasi glukosa terjadi jika terbentuk gas pada tabung durham.
6. Uji Pati
Isolat bakteri diinokulasi pada media agar lempeng pati kemudian diinkubasi pada suhu ruang selama 24 sampai 48 jam. Kultur bakteri hasil inkubasi kemudian ditambahkan larutan yodium dan dibiarkan selama 30 detik. Munculnya warna biru kehitaman di sekeliling tumbuhnya biakan merupakan indikasi bahwa bakteri tersebut mampu menghidrolisis pati. 7. Uji Sitrat
Isolat bakteri diiokulasikan pada media agar miring Simmon’s
Citrat dan diinkubasi pada suhu ruang selama 24 sampai 48 jam.
Perubahan warna media dari hijau menjadi biru menunjukkan hasil positif, dikarenakan bakteri mampu menggunakan sitrat sebagai sumber energi.
Analisis Data
18
HASIL DAN PEMBAHASAN
Jumlah Mikrob Pelarut Kalium
Keberadaan MPK ditunjukkan oleh adanya koloni yang membentuk zona bening pada media Alexandrov agar (Gambar 5). Hasil isolasi mendapatkan 185
isolat MPK yang terdiri 162 isolat BPK dan 23 isolat FPK (Tabel 6). MPK lebih banyak tumbuh pada media Alexandrov yang ditambah sumber feldspar asal
Cirebon yaitu sebanyak 97 isolat bakteri dan 13 isolat fungi. Sedangkan MPK yang tumbuh pada media Alexandrov yang ditambahkan sumber feldspar asal
Malang sebanyak 65 isolat bakteri dan 10 isolat fungi. Dari 185 isolat yang berhasil diisolasi, ada kemungkinan isolat tersebut merupakan spesies yang sama.
Gambar 5 Isolat MPK yang tumbuh pada media Alexandrov agar, a) bakteri, b) fungi
Tabel 6 Populasi MPK yang diisolasi dari sampel tanah menggunakan media
Alexandrov agar yang ditambahkan dua jenis feldspar yang berbeda
Jenis Lahan Jenis vegetasi Feldspar asal Cirebon Feldspar asal Malang
19
Isolat MPK yang tumbuh pada media Alexandrov agar yang ditambahkan
sumber kalium berupa feldspar asal Cirebon memiliki populasi yang lebih banyak dibandingkan isolat MPK yang tumbuh pada media Alexandrov agar yang
ditambahkan feldspar asal Malang. Perbedaan populasi MPK diduga karena terdapat perbedaan dari kadar kalium dan jenis mineral kalium yang ada pada feldspar asal Cirebon dan feldspar asal Malang. Kadar K2O pada feldspar asal Cirebon sebesar 1.93 %, lebih tinggi dibandingkan dengan feldspar asal Malang yang sebesar 1.74 %. Jenis mineral pembawa kalium juga mempengaruhi kemampuan MPK dalam melarutkan kalium sehingga memepengaruhi pembentukan zona bening pada media. Diduga mineral kalium pada feldspar asal Cirebon lebih mudah dilarutkan oleh asam organik yang dihasilkan MPK dibandingkan dengan mineral pada feldspar asal Malang. Hal tersebut menyebabkan koloni yang membentuk zona bening lebih banyak ditemukan pada media Alexandrov agar yang ditambahkan feldspar asal Cirebon.
Perbedaan kemampuan tersebut dikarenakan perbedaan kemampuan asam organik yang dihasilkan MPK dalam melarutkan sumber kalium yang berbeda. Meskipun jenis asam organik yang dihasilkan MPK adalah asam organik yang sama, asam organik tersebut memiliki kemampuan yang berbeda dalam melarutkan mineral kalium yang berbeda. Hal ini sejalan dengan penelitian Pessoa et al. (2015) yang membuktikan bahwa asam organik yang sama berupa
asam sitrat memiliki kemampuan yang berbeda dalam melarutkan sumber kalium yang berbeda yaitu nepheline syenite dan glauconite.
Populasi MPK dari lahan pertanian lebih banyak dari lahan bekas tambang baik lahan bekas tambang timah maupun lahan bekas tambang emas (Tabel 6). Perbedaan populasi kemungkinan besar dipengaruhi oleh jumlah karbon dan nitrogen yang terkandung pada sampel tanah yang diisolasi. Hasil analisa sampel tanah menunjukkan bahwa lahan pertanian memiliki kandungan 2.29 % C-organik, 0.17 % N total, 893.73 ppm NO3 dan 259.47 ppm NH4. Sedangkan, lahan bekas tambang timah memiliki kandungan 0.92 % C-organik, 0.06 % N total, 297.91 ppm NO3 dan 86.46 ppm NH4 dan lahan bekas tambang emas memiliki kandung 1.1 % C-organik, 0.08 % N total, 297.91 ppm NO3 dan 86.49 ppm NH4. Lahan pertanian memiliki kandungan karbon dan nitrogen yang lebih tinggi dibandingkan dengan lahan bekas tambang timah dan lahan bekas tambang emas. Hal ini diduga menjadi faktor yang menyebabkan MPK yang diisolasi dari lahan pertanian memiliki populasi lebih banyak dibandingkan dengan lahan bekas tambang timah dan lahan bekas tambang emas.
Touratier et al. (1999) melaporkan bahwa karbon dan nitrogen merupakan
20
Sifat Patogenitas Mikrob Pelarut Kalium
Berdasarkan hasil uji hipersensitif, dari keseluruhan 185 isolat MPK, ditemukan 79 isolat yang tidak memiliki sifat patogen bagi tanaman. Sebanyak 64 isolat bakteri yang terdiri dari 34 isolat asal lahan pertanian Cikabayan, 23 isolat asal lahan bekas tambang timah dan 7 isolat asal lahan bekas tambang emas tidak berpotensi patogen bagi tanaman (Gambar 6). Sebanyak 15 isolat fungi yang terdiri dari 7 isolat asal lahan pertanian, 6 isolat asal lahan bekas tambang timah dan 2 isolat asal lahan bekas tambang emas juga tidak berpotensi patogen bagi tanaman (Gambar 7).
Hasil uji hemolisis dari 79 isolat MPK yang bersifat nonpatogen bagi tanaman menemukan 48 isolat MPK yang bersifat nonpatogen terhadap hewan dan manusia. Sebanyak 36 isolat bakteri yang terdiri dari 26 isolat asal lahan pertanian Cikabayan, 5 isolat asal lahan bekas tambang timah dan 5 isolat asal lahan bekas tambang emas tidak berpotensi patogen untuk hewan atau manusia. Sebanyak 12 isolat fungi yang terdiri dari 5 isolat asal lahan pertanian Cikabayan, 6 isolat asal lahan bekas tambang timah dan 1 isolat asal lahan bekas tambang emas juga tidak berpotensi patogen untuk hewan atau manusia (Gambar 8), sehingga secara keseluruhan terdapat 48 isolat MPK yang tidak bersifat patogen bagi tumbuhan, hewan dan manusia.
Gambar 6 Daun tembakau yang disuntikkan dengan isolat BPK, a) kontrol
negatif (aquadest steril), b) kontrol positif (Xantomonas sp.), c) isolat MPK yang bersifat nonpatogen (kiri) dan patogen (kanan)
Gambar 7 Pertumbuhan benih padi yang direndam isolat FPK, a) kontrol negatif
(aquadest), b) kontrol positif (Rhizoctonia solani), c) isolat yang
bersifat nonpatogen, d) isolat yang bersifat patogen
a b c d
21
Gambar 8 Isolat MPK pada media Blood agar, a) isolat BPK nonpatogen, b) isolat BPK patogen, c) isolat FPK patogen, d) isolat FPK
nonpatogen
Seleksi dengan pengujian hipersensitif dari isolat MPK ditujukan agar mendapatkan isolat yang tidak memiliki sifat patogen pada tanaman. Sehingga, sewaktu isolat MPK tersebut diaplikasikan pada tanaman budidaya, isolat tersebut tidak meracuni tanaman budidaya itu sendiri. Pengujian hemolisis ditujukan agar mendapatkan isolat yang tidak memiliki sifat patogen terhadap hewan dan manusia. Sehingga, sewaktu isolat MPK tersebut diaplikasikan pada tanaman budidaya oleh petani, isolat tersebut tidak meracuni petani dan organisme yang ada di sekitar daerah yang diaplikasi isolat MPK tersebut.
Indeks Pelarutan dan Kemampuan MPK Melarutkan Kalium dan Fosfat
Hasil pengukuran indeks pelarutan kalium pada 48 isolat yang lulus uji patogenitas mendapatkan isolat MPK yang memiliki indeks pelarutan kalium yang berbeda. Berdasarkan indeks pelarutan kalium tersebut, diambil 10 isolat MPK yang menunjukkan indeks pelarutan kalium terbesar dibandingkan dengan isolat lainnya (Tabel 7).
Tabel 7 Kode isolat, jenis isolat, lokasi dan jenis vegetasi dari 10 isolat MPK terbaik berdasarkan indeks pelarutan kalium
Kode Isolat Jenis Isolat Lokasi Jenis Vegetasi
BPK1 Bakteri Lahan pertanian Kakao
BPK2 Bakteri Lahan bekas tambang emas Sonobrit
BPK3 Bakteri Lahan pertanian Kelapa sawit
BPK4 Bakteri Lahan bekas tambang timah Akasia
BPK5 Bakteri Lahan bekas tambang emas Puspa
BPK6 Bakteri Lahan bekas tambang timah Simpur
FPK1 Fungi Lahan pertanian Kelapa sawit
FPK2 Fungi Lahan pertanian Kopi
FPK3 Fungi Lahan bekas tambang timah Akasia
FPK4 Fungi Lahan bekas tambang timah Karamunting
22
(Gambar 11) dan 5 jenis MPK dapat melarutkan fosfat dari sumber fosfat berupa batuan fosfat asal Blitar, Jawa Timur (Gambar 12).
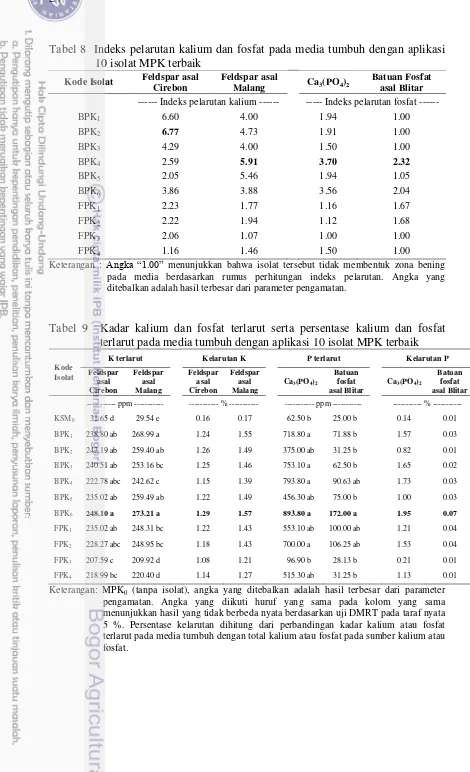
Sebanyak 10 isolat MPK terbaik berdasarkan indeks pelarutan kalium diuji kemampuannya melarutkan kalium dan fosfat sukar larut pada media cair. Hasil pengujian menunjukkan bahwa setiap isolat memiliki kemampuan yang berbeda dalam melarutkan sumber kalium dan fosfat. Isolat BPK6 cenderung memiliki kemampuan lebih baik dalam melarutkan sumber kalium berupa feldspar asal Cirebon dan feldspar asal Malang dengan nilai K terlarut masing-masing 248.10 ppm dan 273.21 ppm serta tingkat kelarutan kalium masing-masing 1.29 % dan 1.57 %. Isolat BPK6 juga cenderung memiliki kemampuan lebih baik dalam melarutkan fosfat dari sumber fosfat berupa Ca3(PO4)2 dan batuan fosfat asal Blitar dengan kadar P terlarut masing-masing 893.8 ppm dan 172 ppm serta tingkat kelarutan P masing-masing 1.95 % dan 0.07 % (Tabel 9).
Gambar 9 Sepuluh MPK terbaik pada media Alexandrov agar dengan sumber
kalium berupa feldspar asal Cirebon, Jawa Barat, a) BPK1, b) BPK2, c) BPK3, d) BPK4, e) BPK5, f) BPK6, g) FPK1, h) FPK2, i) FPK3, j) FPK4
Gambar 10 Sepuluh MPK terbaik pada media Alexandrov agar dengan sumber
kalium berupa feldspar asal Malang, Jawa Timur, a) BPK1, b) BPK2, c) BPK3, d) BPK4, e) BPK5, f) BPK6, g) FPK1, h) FPK2, i) FPK3, j) FPK4
a b c d e
f g h i j
a b c d e
23
Gambar 11 Sepuluh MPK terbaik pada media Pikovskaya agar dengan sumber
fosfat berupa Ca3(PO4)2, a) BPK1, b) BPK2, c) BPK3, d) BPK4, e) BPK5, f) BPK6, g) FPK1, h) FPK2, i) FPK3, j) FPK4
Gambar 12 Sepuluh MPK terbaik pada media Pikovskaya agar dengan sumber
fosfat berupa batuan fosfat asal Blitar, Jawa Timur, a) BPK1, b) BPK2, c) BPK3, d) BPK4, e) BPK5, f) BPK6, g) FPK1, h) FPK2, i) FPK3, j) FPK4
Penambahan MPK pada media cair meningkatkan kadar kalium dan fosfat terlarut dibandingkan tanpa penambahan isolat MPK. Persentase peningkatan kadar K terlarut pada feldspar asal Cirebon berkisar antara 555.89 % sampai 683.89 %. Persentase peningkatan kadar K terlarut pada feldspar asal Malang berkisar antara 610.63 % sampai 824.88 %. Persentase peningkatan kadar P terlarut pada Ca3(PO4)2 berkisar antara 55.04 % sampai 1330.08 %. Persentase peningkatan kadar P terlarut pada batuan fosfat asal Blitar berkisar antara 25 % sampai 588 %.
Indeks pelarutan biasanya dihubungkan dengan kemampuan isolat dalam melarutkan kalium maupun fosfat (Tabel 8 & 9). Semakin tinggi indeks pelarutan, diasumsikan kemampuan melarutkan kalium maupun fosfat juga semakin tinggi. Pernyataan tersebut kurang tepat jika hanya menghubungkan indeks pelarutan dengan kemampuan melarutkan kalium maupun fosfat. Indeks pelarutan tidak selalu berkorelasi nyata dengan kemampuan melarutkan kalium maupun fosfat.
a b c d e
f g h i j
a b c d e
24
Tabel 8 Indeks pelarutan kalium dan fosfat pada media tumbuh dengan aplikasi 10 isolat MPK terbaik
--- Indeks pelarutan kalium --- --- Indeks pelarutan fosfat ---
BPK1 6.60 4.00 1.94 1.00 pada media berdasarkan rumus perhitungan indeks pelarutan. Angka yang ditebalkan adalah hasil terbesar dari parameter pengamatan.
Tabel 9 Kadar kalium dan fosfat terlarut serta persentase kalium dan fosfat terlarut pada media tumbuh dengan aplikasi 10 isolat MPK terbaik
Kode Isolat
K terlarut Kelarutan K P terlarut Kelarutan P
25
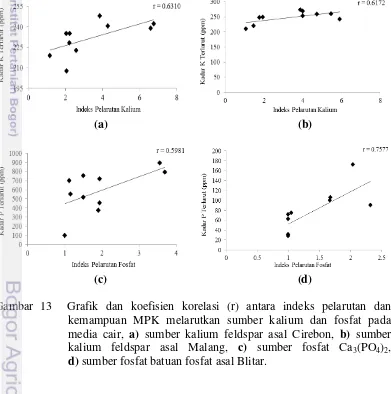
Korelasi antara indeks pelarutan dengan kemampuan melarutkan sumber kalium dan fosfat dapat dilihat dari nilai r pada grafik regresi linear (Gambar 13). Keseluruhan pengamatan menunjukkan korelasi positif antara indeks pelarutan dengan kemampuan melarutkan kalium dan fosfat pada media cair. Berdasarkan koefisien korelasi Spearman, nilai kritik koefisien korelasi dapat dilihat dari nilai derajat bebas (total perlakuan-2) dengan nilai r (koefisien korelasi). Nilai kritik koefisien korelasi untuk taraf nyata 5 % dengan derajat bebas 8 adalah 0.643. Jika pada perlakuan nilai r lebih besar atau sama dengan 0.643, maka perlakuan tersebut berkorelasi nyata pada taraf 5 % (Walpole 1982).
Indeks pelarutan kalium dan kemampuan melarutkan sumber kalium di media cair dengan sumber kalium berupa feldspar asal Cirebon dan feldspar asal Malang menunjukkan koefisien korelasi sebesar 0.6310 dan 0.6172. Hal ini menunjukkan bahwa indeks pelarutan kalium dan kemampuan melarutkan sumber kalium di media cair baik itu dengan sumber kalium berupa feldspar asal Cirebon maupun Malang berkorelasi tidak nyata. Selain itu, indeks pelarutan fosfat dan kemampuan melarutkan sumber fosfat berupa Ca3(PO4)2 memiliki nilai koefisen korelasi 0.5981 dan menunjukkan korelasi yang tidak nyata. Indeks pelarutan fosfat dan kemampuan melarutkan sumber fosfat berupa batuan fosfat asal Blitar memiliki nilai koefisen korelasi 0.7577 dan menunjukkan korelasi yang nyata.
(a) (b)
(c) (d)
Gambar 13 Grafik dan koefisien korelasi (r) antara indeks pelarutan dan kemampuan MPK melarutkan sumber kalium dan fosfat pada media cair, a) sumber kalium feldspar asal Cirebon, b) sumber