TANAH SECARA IN VITRO DAN IN PLANTA
NURMAYA PAPUANGAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
LEMBAR
PERNYATAAN
ABSTRACT
NURMAYA PAPUANGAN. The Activity inhibiting of Antimicrobial Compounds of Streptomyces spp. against of Soil Borne Microbial Pathogens based on In Vitro and In Planta Assays. Under the direction of YULIN LESTARI and RASTI SARASWATI.
The main problem on horticulture plant cultivation is caused by soil borne microbial pathogens. The use of chemical substances to control the microbial pathogens can cause negative effect on the environment. Biological control is used as an alternative way to solve the problems. Streptomyces spp. is selected as an agent of biological control because of its capability to produce antimicrobial compounds. The research aimed to find local Streptomyces spp. isolates which have growth inhibition potency to various soil borne microbial pathogens based on in vitro and in planta assays. There were 32 local isolates of Streptomyces spp. examined in an in vitro assay using dual culture and Kirby-Bauer methods. Hypersensitivity test of Streptomyces spp. on tobacco plant was conducted to examine their pathogenicity. Amongst the 32 Streptomyces spp. tested, six selected isolates have excellent in vitro inhibiting activity against soil borne microbial pathogens and they did not pathogenic on tobacco plant used for the in planta assay. Their effectiveness in inhibiting Sclerotium rolfsii, in particular, was examined using pepper plant. The glass house experiment was conducted in a Split Plot Design with two factors (Streptomyces spp and application technique) and five replications. As an antibacterial producer, the LSW1, LSW05, PD2-9, LBR02, and PS4-16 isolates of Streptomyces spp. inhibited the growth of Bacillus subtilis (diameter of inhibition zone ranged from 14.5-18.5 mm). Meanwhile, LBR02, SSW02, and PS4-16 inhibited Xantomonas oryzae by producing 19-21 mm inhibition zone, and the LBR02 was capable of inhibiting Xanthomonas axonopodis (7.5 mm). Screening of antifungal producer showed that five isolates (LBR02, LSW1, LSW05, PD2-9, dan PS4-16) strongly inhibited the growth of Rhizoctonia solani (47.8-68.9%) and Fusarium oxysporum (48.8-57.8%). SSW02, LBR02, PD2-9, and PS4-16 moderately inhibited S. rolfsii (21,25-31,25%). The in planta test showed that the Streptomyces spp. examined significantly reduced pepper plant diseases severity (P=0,0003). LSW05 and PS4-16 isolates showed to have profound effect on the plant diseases severity by decreasing of LADKP value by 56,2% and 54,9%, higher pepper seed germination which LSW05 inoculation value by 92,0% to follow by PS4-16 (86,0%) as compared to the control (80,0%). Soil inoculated with Streptomyces spp. showed to be the most effective in controlling the disease as compared with seed coating treatment. The results clearly indicate that local isolates of Streptomyces spp. which are not plant pathogen have capability to be developed further as biocontrol agent for soil borne microbial pathogens.
RINGKASAN
NURMAYA PAPUANGAN. Aktivitas Penghambatan Senyawa Antimikrob Streptomyces spp. terhadap Mikrob Patogen Tular Tanah Secara In Vitro dan In Planta. Dibimbing oleh YULIN LESTARI dan RASTI SARASWATI.
Sayuran adalah merupakan salah satu komoditas hortikultura yang mempunyai potensi penting dalam pemenuhan gizi, peningkatan kesejahteraan masyarakat, dan perbaikan pendapatan petani. Akan tetapi, dalam usaha budidaya tanaman sayuran ditemui kendala berupa penyakit tanaman yang disebabkan oleh mikrob patogen tular tanah yang dapat menimbulkan resiko kerusakan tanaman dan kehilangan hasil yang cukup tinggi, sehingga menyebabkan kerugian ekonomi di bidang pertanian dan industri hortikultura. Pengendalian dengan cara kimiawi dapat berdampak negatif terhadap lingkungan dan bahkan dapat menimbulkan resistensi patogen. Adanya kekhawatiran dengan penggunaan mikrobisida kimiawi, dan adanya permintaan produk pertanian yang sehat dan aman bagi konsumen, pengendalian hayati menjadi satu pilihan cara mengendalikan mikrob patogen penyebab penyakit tanaman yang perlu untuk dipertimbangkan. Indonesia memiliki keanekragaman mikroorganisme yang cukup tinggi salah satunya adalah Streptomyces yang merupakan kelompok Actinomycetes. Isolat-isolat Streptomyces yang terisolasi dari berbagai daerah di Indonesia diketahui berpotensi menghasilkan senyawa antimikrob yang mampu menghambat dan mengendalikan beberapa jenis mikrob patogen tular tanah dan penyakit yang ditimbulkan. Penelitian ini bertujuan untuk mendapatkan isolat lokal Streptomyces spp. yang memiliki kemampuan unggul dalam menghambat pertumbuhan mikrob patogen tular tanah melalui uji in vitro terhadap beragam mikrob patogen tular tanah dan in planta terhadap Sclerotium rolfsii salah satu patogen pada tanaman cabai.
Uji in vitro kemampuan penghambatan Streptomyces terhadap mikrob patogen tular tanah dilakukan dengan menggunakan isolat Streptomyces secara langsung dan filtrat kultur Streptomyces. Metode uji penghambatan Streptomyces menggunakan sel secara langsung terhadap mikrob patogen tular tanah kelompok bakteri dengan menggunakan teknik cakram agar (agar disc method) dan filtrat kultur Streptomyces diuji aktivitas antibakteri dengan menggunakan metode Kirby-Bauer. Aktivitas antibakteri diindikasikan dengan terbentuknya zona penghambatan (zona bening) dan bioaktivitasnya dievaluasi berdasarkan ukuran diameter zona bening yang terbentuk dikurangi dengan diameter cakram agar isolat Streptomyces. Metode biakan ganda (dual culture) digunakan terhadap mikrob patogen tular tanah kelompok cendawan. Adanya penghambatan pertumbuhan cendawan dideteksi dengan adanya barier antara cendawan dengan Streptomyces. Tingkat penghambatan (∆ ) dihitung dengan cara mengurangi jarak tumbuh miselium cendawan menjahui inokulum Streptomyces spp. ( ◦) dengan jarak tumbuh miselium cendawan yang terhambat oleh inokulum Streptomyces spp. ( ), dengan formulasi (∆ = ◦- ). Persentase penghambatan menggunakan formulasi (%) = [( ◦- ) x 100]/ ◦.
rolfsii khususnya diuji menggunakan tanaman cabai. Percobaan rumah kaca menggunakan Split Plot Design dengan dua faktor yaitu jenis Streptomyces spp. dan cara aplikasi dan diulang sebanyak lima ulangan. Data intensitas penyakit, LADKP, dan persentase perkecambahan dianalisis dengan menggunakan prosedur ANOVA dari program Statistical Analysis System (SAS) versi 9.1. Perbedaan rata-rata antar perlakuan diuji menggunakan uji jarak berganda Duncan pada taraf nyata 5%.
Pengujian antagonis isolat Streptomyces spp. secara in vitro dengan menggunakan sel secara langsung, menunjukkan sebanyak 17 isolat mampu menghambat mikrob patogen tular tanah dengan aktivitas penghambatan yang beragam dan memiliki spektrum luas. Sebanyak 14 isolat Streptomyces spp. mempunyai aktivitas penghambatan terhadap bakteri dan cendawan patogen tular tanah, dan tiga isolat lainnya hanya mampu menghambat bakteri. Enam isolat dipilih untuk uji selanjutnya karena memiliki aktivitas yang beragam terhadap bakteri dan cendawan patogen tular tanah. Enam isolat tersebut yaitu: SSW02, LBR02, LSW1, LSW05, PS4-16, dan PD2-9. Keenam isolat tersebut mampu menghambat lebih dari satu jenis bakteri dan cendawan dan mampu menghambat kedua-duanya dengan daya hambat yang berbeda. Isolat SSW02, LBR02, LSW1, LSW05, dan PS4-16 mampu menghambat Bacillus subtilis dan B. cereus dengan diameter zona hambat sebesar 7-15 mm, Xanthomonas axonopodis mampu dihambat oleh LBR02, LSW1, LSW05, PS4-16 dan PD2-9 dengan zona hambat sebesar 5-8 mm, Xanthomonas oryzae dihambat oleh keenam isolat Streptomyces spp. Dengan zona hambat 4-11,5 mm dan Ralstonia solanacearum dihambat oleh isoat PD2-9 dan PS4-16 dengan menghasilkan zona hambat sebesar 7-8 mm. Selain mempunyai aktivitas antibakteri, SSW02, LBR02, LSW1, LSW05, dan PS4-16 mempunyai aktivitas penghambatan yang kuat terhadap Rhizoctonia solani dan Fusarium oxysporum dengan persentase penghambatan berturut-turut 46,6% - 62,22% dan 21,0% - 77.7%. Isolat SSW02, LBR02, LSW05, PS4-16, dan PD2-9 mempunyai aktivitas penghambatan terhadap S. rolfsii dengan persentase penghambatan sebesar 11,1% - 84,1%.
Berdasarkan hasil uji in planta, Streptomyces spp. Memberi pengaruh yang signifikan (P=0,0003) terhadap intensitas penyakit pada tanaman cabai. Isolat LSW05 dan PS4-16 efektif dalam menekan intensitas penyakit tanaman dengan menurunkan LADKP sebesar 56,2% dan 54,9%, rata-rata persentase perkecambahan benih cabai yang diinokulasi Streptomyces LSW05 lebih tinggi (92,0%) disusul PS4-16 (86,0%) dan campuran isolat (84%) dibandingkan dengan kontrol (80,0%). Inokulasi tanah dengan Streptomyces spp. lebih efektif mengendalikan penyakit dibandingkan dengan seed coating. Hasil ini mengindikasikan bahwa isolat lokal Streptomyces spp. nyata tidak bersifat patogen. Isolat LSW05 dan PS4-16 mempunyai kemampuan sebagai agen pengendali hayati untuk mikrob patogen tular tanah baik secara in vitro maupun in planta.
Kata kunci : senyawa antimikrob, Streptomyces spp, mikrob patogen tular tanah, in vitro, in planta
HAK
CIPTA
LEMBAR
PENGESAHAN
PRAKATA
xiv
DAFTAR ISI
Halaman
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
PENDAHULUAN ... 1
Latar Belakang ... 1
Hipotesis ... 3
Tujuan Penelitian ... 3
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA ... 5
Mikrob Patogen Tular Tanah ... 5
Upaya Pengendalian ... 8
Karakteristik Streptomyces spp. ... 11
Potensi Streptomyces spp. ... 12
BAHAN DAN METODE ... 17
Waktu dan Tempat Penelitian ... 17
Bahan ... 17
Metode ... 17
Peremajaan Isolat Streptomyces spp. dan Mikrob Patogen Tular Tanah (Bakteri dan Cendawan) ... 17
Uji In-Vitro Kemampuan Penghambatan Streptomyces spp. terhadap Mikrob Patogen Tular Tanah ... 17
Produksi Filtrat Kultur Streptomyces spp. ... 18
Uji Anatagonis Filtrat Kultur Streptomyces spp. terhadap Mikrob Patogen Tular Tanah ... 19
Uji Reaksi Hipersensitivitas Streptomyces spp. pada Tanaman Tembakau ... 20
TANAH SECARA IN VITRO DAN IN PLANTA
NURMAYA PAPUANGAN
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
LEMBAR
PERNYATAAN
ABSTRACT
NURMAYA PAPUANGAN. The Activity inhibiting of Antimicrobial Compounds of Streptomyces spp. against of Soil Borne Microbial Pathogens based on In Vitro and In Planta Assays. Under the direction of YULIN LESTARI and RASTI SARASWATI.
The main problem on horticulture plant cultivation is caused by soil borne microbial pathogens. The use of chemical substances to control the microbial pathogens can cause negative effect on the environment. Biological control is used as an alternative way to solve the problems. Streptomyces spp. is selected as an agent of biological control because of its capability to produce antimicrobial compounds. The research aimed to find local Streptomyces spp. isolates which have growth inhibition potency to various soil borne microbial pathogens based on in vitro and in planta assays. There were 32 local isolates of Streptomyces spp. examined in an in vitro assay using dual culture and Kirby-Bauer methods. Hypersensitivity test of Streptomyces spp. on tobacco plant was conducted to examine their pathogenicity. Amongst the 32 Streptomyces spp. tested, six selected isolates have excellent in vitro inhibiting activity against soil borne microbial pathogens and they did not pathogenic on tobacco plant used for the in planta assay. Their effectiveness in inhibiting Sclerotium rolfsii, in particular, was examined using pepper plant. The glass house experiment was conducted in a Split Plot Design with two factors (Streptomyces spp and application technique) and five replications. As an antibacterial producer, the LSW1, LSW05, PD2-9, LBR02, and PS4-16 isolates of Streptomyces spp. inhibited the growth of Bacillus subtilis (diameter of inhibition zone ranged from 14.5-18.5 mm). Meanwhile, LBR02, SSW02, and PS4-16 inhibited Xantomonas oryzae by producing 19-21 mm inhibition zone, and the LBR02 was capable of inhibiting Xanthomonas axonopodis (7.5 mm). Screening of antifungal producer showed that five isolates (LBR02, LSW1, LSW05, PD2-9, dan PS4-16) strongly inhibited the growth of Rhizoctonia solani (47.8-68.9%) and Fusarium oxysporum (48.8-57.8%). SSW02, LBR02, PD2-9, and PS4-16 moderately inhibited S. rolfsii (21,25-31,25%). The in planta test showed that the Streptomyces spp. examined significantly reduced pepper plant diseases severity (P=0,0003). LSW05 and PS4-16 isolates showed to have profound effect on the plant diseases severity by decreasing of LADKP value by 56,2% and 54,9%, higher pepper seed germination which LSW05 inoculation value by 92,0% to follow by PS4-16 (86,0%) as compared to the control (80,0%). Soil inoculated with Streptomyces spp. showed to be the most effective in controlling the disease as compared with seed coating treatment. The results clearly indicate that local isolates of Streptomyces spp. which are not plant pathogen have capability to be developed further as biocontrol agent for soil borne microbial pathogens.
RINGKASAN
NURMAYA PAPUANGAN. Aktivitas Penghambatan Senyawa Antimikrob Streptomyces spp. terhadap Mikrob Patogen Tular Tanah Secara In Vitro dan In Planta. Dibimbing oleh YULIN LESTARI dan RASTI SARASWATI.
Sayuran adalah merupakan salah satu komoditas hortikultura yang mempunyai potensi penting dalam pemenuhan gizi, peningkatan kesejahteraan masyarakat, dan perbaikan pendapatan petani. Akan tetapi, dalam usaha budidaya tanaman sayuran ditemui kendala berupa penyakit tanaman yang disebabkan oleh mikrob patogen tular tanah yang dapat menimbulkan resiko kerusakan tanaman dan kehilangan hasil yang cukup tinggi, sehingga menyebabkan kerugian ekonomi di bidang pertanian dan industri hortikultura. Pengendalian dengan cara kimiawi dapat berdampak negatif terhadap lingkungan dan bahkan dapat menimbulkan resistensi patogen. Adanya kekhawatiran dengan penggunaan mikrobisida kimiawi, dan adanya permintaan produk pertanian yang sehat dan aman bagi konsumen, pengendalian hayati menjadi satu pilihan cara mengendalikan mikrob patogen penyebab penyakit tanaman yang perlu untuk dipertimbangkan. Indonesia memiliki keanekragaman mikroorganisme yang cukup tinggi salah satunya adalah Streptomyces yang merupakan kelompok Actinomycetes. Isolat-isolat Streptomyces yang terisolasi dari berbagai daerah di Indonesia diketahui berpotensi menghasilkan senyawa antimikrob yang mampu menghambat dan mengendalikan beberapa jenis mikrob patogen tular tanah dan penyakit yang ditimbulkan. Penelitian ini bertujuan untuk mendapatkan isolat lokal Streptomyces spp. yang memiliki kemampuan unggul dalam menghambat pertumbuhan mikrob patogen tular tanah melalui uji in vitro terhadap beragam mikrob patogen tular tanah dan in planta terhadap Sclerotium rolfsii salah satu patogen pada tanaman cabai.
Uji in vitro kemampuan penghambatan Streptomyces terhadap mikrob patogen tular tanah dilakukan dengan menggunakan isolat Streptomyces secara langsung dan filtrat kultur Streptomyces. Metode uji penghambatan Streptomyces menggunakan sel secara langsung terhadap mikrob patogen tular tanah kelompok bakteri dengan menggunakan teknik cakram agar (agar disc method) dan filtrat kultur Streptomyces diuji aktivitas antibakteri dengan menggunakan metode Kirby-Bauer. Aktivitas antibakteri diindikasikan dengan terbentuknya zona penghambatan (zona bening) dan bioaktivitasnya dievaluasi berdasarkan ukuran diameter zona bening yang terbentuk dikurangi dengan diameter cakram agar isolat Streptomyces. Metode biakan ganda (dual culture) digunakan terhadap mikrob patogen tular tanah kelompok cendawan. Adanya penghambatan pertumbuhan cendawan dideteksi dengan adanya barier antara cendawan dengan Streptomyces. Tingkat penghambatan (∆ ) dihitung dengan cara mengurangi jarak tumbuh miselium cendawan menjahui inokulum Streptomyces spp. ( ◦) dengan jarak tumbuh miselium cendawan yang terhambat oleh inokulum Streptomyces spp. ( ), dengan formulasi (∆ = ◦- ). Persentase penghambatan menggunakan formulasi (%) = [( ◦- ) x 100]/ ◦.
rolfsii khususnya diuji menggunakan tanaman cabai. Percobaan rumah kaca menggunakan Split Plot Design dengan dua faktor yaitu jenis Streptomyces spp. dan cara aplikasi dan diulang sebanyak lima ulangan. Data intensitas penyakit, LADKP, dan persentase perkecambahan dianalisis dengan menggunakan prosedur ANOVA dari program Statistical Analysis System (SAS) versi 9.1. Perbedaan rata-rata antar perlakuan diuji menggunakan uji jarak berganda Duncan pada taraf nyata 5%.
Pengujian antagonis isolat Streptomyces spp. secara in vitro dengan menggunakan sel secara langsung, menunjukkan sebanyak 17 isolat mampu menghambat mikrob patogen tular tanah dengan aktivitas penghambatan yang beragam dan memiliki spektrum luas. Sebanyak 14 isolat Streptomyces spp. mempunyai aktivitas penghambatan terhadap bakteri dan cendawan patogen tular tanah, dan tiga isolat lainnya hanya mampu menghambat bakteri. Enam isolat dipilih untuk uji selanjutnya karena memiliki aktivitas yang beragam terhadap bakteri dan cendawan patogen tular tanah. Enam isolat tersebut yaitu: SSW02, LBR02, LSW1, LSW05, PS4-16, dan PD2-9. Keenam isolat tersebut mampu menghambat lebih dari satu jenis bakteri dan cendawan dan mampu menghambat kedua-duanya dengan daya hambat yang berbeda. Isolat SSW02, LBR02, LSW1, LSW05, dan PS4-16 mampu menghambat Bacillus subtilis dan B. cereus dengan diameter zona hambat sebesar 7-15 mm, Xanthomonas axonopodis mampu dihambat oleh LBR02, LSW1, LSW05, PS4-16 dan PD2-9 dengan zona hambat sebesar 5-8 mm, Xanthomonas oryzae dihambat oleh keenam isolat Streptomyces spp. Dengan zona hambat 4-11,5 mm dan Ralstonia solanacearum dihambat oleh isoat PD2-9 dan PS4-16 dengan menghasilkan zona hambat sebesar 7-8 mm. Selain mempunyai aktivitas antibakteri, SSW02, LBR02, LSW1, LSW05, dan PS4-16 mempunyai aktivitas penghambatan yang kuat terhadap Rhizoctonia solani dan Fusarium oxysporum dengan persentase penghambatan berturut-turut 46,6% - 62,22% dan 21,0% - 77.7%. Isolat SSW02, LBR02, LSW05, PS4-16, dan PD2-9 mempunyai aktivitas penghambatan terhadap S. rolfsii dengan persentase penghambatan sebesar 11,1% - 84,1%.
Berdasarkan hasil uji in planta, Streptomyces spp. Memberi pengaruh yang signifikan (P=0,0003) terhadap intensitas penyakit pada tanaman cabai. Isolat LSW05 dan PS4-16 efektif dalam menekan intensitas penyakit tanaman dengan menurunkan LADKP sebesar 56,2% dan 54,9%, rata-rata persentase perkecambahan benih cabai yang diinokulasi Streptomyces LSW05 lebih tinggi (92,0%) disusul PS4-16 (86,0%) dan campuran isolat (84%) dibandingkan dengan kontrol (80,0%). Inokulasi tanah dengan Streptomyces spp. lebih efektif mengendalikan penyakit dibandingkan dengan seed coating. Hasil ini mengindikasikan bahwa isolat lokal Streptomyces spp. nyata tidak bersifat patogen. Isolat LSW05 dan PS4-16 mempunyai kemampuan sebagai agen pengendali hayati untuk mikrob patogen tular tanah baik secara in vitro maupun in planta.
Kata kunci : senyawa antimikrob, Streptomyces spp, mikrob patogen tular tanah, in vitro, in planta
HAK
CIPTA
LEMBAR
PENGESAHAN
PRAKATA
xiv
DAFTAR ISI
Halaman
DAFTAR TABEL ... xvi
DAFTAR GAMBAR ... xvi
DAFTAR LAMPIRAN ... xvii
PENDAHULUAN ... 1
Latar Belakang ... 1
Hipotesis ... 3
Tujuan Penelitian ... 3
Manfaat Penelitian ... 4
TINJAUAN PUSTAKA ... 5
Mikrob Patogen Tular Tanah ... 5
Upaya Pengendalian ... 8
Karakteristik Streptomyces spp. ... 11
Potensi Streptomyces spp. ... 12
BAHAN DAN METODE ... 17
Waktu dan Tempat Penelitian ... 17
Bahan ... 17
Metode ... 17
Peremajaan Isolat Streptomyces spp. dan Mikrob Patogen Tular Tanah (Bakteri dan Cendawan) ... 17
Uji In-Vitro Kemampuan Penghambatan Streptomyces spp. terhadap Mikrob Patogen Tular Tanah ... 17
Produksi Filtrat Kultur Streptomyces spp. ... 18
Uji Anatagonis Filtrat Kultur Streptomyces spp. terhadap Mikrob Patogen Tular Tanah ... 19
Uji Reaksi Hipersensitivitas Streptomyces spp. pada Tanaman Tembakau ... 20
xv
HASIL DAN PEMBAHASAN ... 24
Peremajaan Streptomyces spp. ... 24
Uji In-Vitro Kemampuan Penghambatan Streptomyces spp. terhadap Mikrob Patogen Tular Tanah ... 25
Uji Antagonis Filtrat Kultur Streptomyces spp. ... 27
Uji Reaksi Hipersensitif Streptomyces spp. pada Tanaman Tembakau ... 31
Uji In-Planta Kemampuan Penghamabatan Streptomyces spp. Terhadap Sclerotium sp ... 32
SIMPULAN DAN SARAN ... 39
DAFTAR PUSTAKA ... 40
LAMPIRAN ... 46
xvi
DAFTAR TABEL
Halaman
1 Pemanfaatan mikrob antagonis sebagai agen pengendali hayati mikrob
patogen tular tanah ... 9 2 Kriteria keefektifan relatif pengendalian ... 23 3 Kemampuan penghambatan Streptomyces spp. terhadap bakteri
patogen dengan menggunakan sel secara langsung ... 26 4 Kemampuan penghambatan Streptomyces spp. terhadap cendawan
patogen dengan menggunakan sel secara langsung ... 26 5 Hasil uji antagonis filtrat kultur enam isolat Streptomyces spp.
terhadap bakteri patogen ... 27 6 Hasil uji antagonis filtrat kultur enam isolat Streptomyces spp.
terhadap cendawan patogen ... 28 7 Pengaruh aplikasi dan keefektifan (%) Streptomyces spp. Terhadap luas
area di bawah kurva perkembangan penyakit (LADKP) pada 48 hari setelah tanam benih cabai dalam pot yang diinfestasi
dengan Sclerotium rolfsii ... 34 8 Pengaruh aplikasi Streptomyces spp. terhadap perkecambahan benih
cabai yang ditanam dalam pot yang diinfestasi dengan
Sclerotium rolfsii ... 35
DAFTAR GAMBAR
Halaman 1 Morfologi koloni isolat Streptomyces spp. yang ditumbuhkan pada
media YMA ... 24 2 Aktivitas penghambatan filtrat kultur enam isolat Streptomyces spp.
xvii 5 Reaksi hipersensitif filtrat kultur Streptomyces spp. pada daun tanaman
tembakau 72 jam setelah inokulasi ... 32 6 Intensitas penyakit pada tanaman cabai berumur 14, 20
dan 48 hst ... 32 7 Intensitas penyakit pada tanaman cabai umur 34, 41, dan 48 hst
yang diinokulasi Streptomyces ... 33
DAFTAR LAMPIRAN
Halaman 1 Tabel kemampuan tumbuh isolat Streptomyces spp. hasil peremajaan
pada media YMA dan OA ... 46 2 Tabel kemampuan penghambatan Streptomyces spp. terhadap mikrob
PENDAHULUAN
Latar Belakang
Sayuran merupakan salah satu komoditas hortikultura yang mempunyai potensi penting sebagai pusat pertumbuhan baru dan mendapat prioritas pembangunan dalam rangka pemenuhan gizi, perolehan devisa, peningkatan kesejahteraan masyarakat dan perbaikan pendapatan petani. Berdasarkan data
perdagangan internasional produk hortikultura Indonesia tahun 2002–2003, Indonesia cenderung sebagai pengimpor produk-produk hortikultura mencapai 362 ribu ton sayuran segar dan mengalami defisit perdagangan produk sayuran yang mencapai 54,8 juta USD (Indonesian Agricultural Sciences Association 2005). Rendahnya produktivitas sayuran di Indonesia antara lain dapat disebabkan
oleh penyakit yang menyerang tanaman pada berbagai fase pertumbuhan. Penyakit tanaman dapat disebabkan antara lain oleh mikrob patogen tular tanah (soil borne). Mikrob patogen ini dapat menyerang lebih dari satu macam tanaman dan menimbulkan masalah serius pada budidaya tanaman hortikultura di daerah
tropis dan subtropis, sehingga menimbulkan resiko kerusakan tanaman dan kehilangan hasil yang cukup tinggi, yang menyebabkan kerugian ekonomi di bidang pertanian dan industri hortikultura (Cahyaniati et al. 1999; Direktorat Perlindungan Hortikultura 2004).
Mikrob patogen penyebab penyakit pada tanaman dapat berupa bakteri, cendawan, dan virus. Penyakit tanaman yang disebabkan bakteri antara lain
adalah layu bakteri (Ralstonia solanacearum) (El-Abyad et al. 1993), busuk hitam (Xanthomonas campestris pv. campestris), bercak daun (X. campestris pv. vesicatoria), busuk basah (Erwinia caratovora pv. caratovora) (Cahyaniati et al. 1999; Semangun 2006), dan penyakit kudis kentang oleh Streptomyces scabies
(Agrios 1995; Lee et al. 2004). Cendawan patogen menyebabkan banyak penyakit pada tanaman hortikultura antara lain: penyakit busuk daun (Phytophtora infestans), layu Fusarium (Fusarium oxisporum f. sp. lycopersici (Sacc.)), bercak kering dan rebah kecambah (Alternaria solani), penyakit rebah kecambah, busuk pangkal batang dan busuk akar oleh Rhizoctonia solani (Cahyaniati et al. 1999;
(Sacc.) menyebabkan antraknosa dan hawar daun, serta busuk batang (Prapagdee et al. 2008). Selain bakteri dan cendawan, virus juga menyerang dan menyebabkan penyakit pada tanaman antara lain penyakit mosaik laten (potato
virus X (PVX)), mosaik lemas (potato virus S (PVS)), mosaik lunak(potato virus A (PVA)), mosaik tembakau dan mosaik ketimun disebabkan oleh tobacco mosaic virus (TMV) dan cucumber mosaic virus (CMV) (Semangun 1991; Cahyaniati et al. 1999).
Mikrob patogen tanaman memiliki kisaran inang yang luas dan merupakan
penyakit serius pada sayuran penting seperti tanaman cabai, tomat, bawang, dan tanaman sayuran lainnya. Beberapa diantaranya mempunyai struktur istirahat, sehingga penyakit yang ditimbulkannya menjadi sulit dikendalikan. Penyakit rebah kecambah disebabkan oleh lebih dari satu jenis cendawan, seperti Alternaria spp., R. solani Khun, Pythium debaryanum Hesse, dan Fusarium spp.
(Semangun 1991), serta Sclerotium rolfsii (Widyastuti et al. 2003) dapat menjadi sangat merugikan karena menyerang tanaman pada masa persemaian juga menyebabkan penyakit busuk pangkal batang dan busuk akar pada tanaman muda yang sampai saat ini belum dapat diatasi dengan baik.
Pengendalian penyakit tanaman banyak dilakukan dengan menggunakan mikrobisida kimiawi. Namun demikian, penggunaannya yang berlebihan dan dalam jangka waktu yang lama dapat berdampak negatif pada kesehatan manusia dan pencemaran lingkungan karena residu yang ditinggalkan dan bahkan dapat
menimbulkan resistensi patogen. Oleh karena itu diperlukan upaya penanggulangan alternatif untuk mengendalikan mikrob patogen penyebab penyakit tanaman misalnya dengan memanfaatkan agen pengendali hayati yang lebih ramah lingkungan.
Alam telah menyediakan mekanisme perlindungan alami yaitu mikrob yang
dapat mengendalikan organisme patogen tersebut. Mikrob antagonis ini secara luas telah digunakan sebagai agen pengendali terhadap penyakit tanaman karena mikrob patogen tular tanah. Galur bakteri yang digunakan sebagai agen pengendali hayati harus dapat menghambat pertumbuhan dan aktivitas mikrob patogen (Sigee 1993), dan mempunyai kemampuan untuk bersaing di dalam
3
mikrob patogen (Hayward et al. 1994). Streptomyces spp. telah diketahui mampu berperan sebagai agen pengendali hayati. Streptomyces spp. adalah bakteri Gram positif berfilamen, resisten terhadap kondisi stres lingkungan seperti kekeringan
dan kekurangan makanan dengan cara membentuk spora (Zamanian et al. 2005), penghasil berbagai macam senyawa bioaktif seperti antibiotik, enzim pendegradasi, dan inhibitor enzim (Todar 2002; Madigan et al. 2006). Streptomyces spp. yang diisolasi dari berbagai daerah di Indonesia diketahui berpotensi menghasilkan senyawa bioaktif dengan beragam fungsi. Beberapa
Sreptomyces spp. isolat lokal mampu menghambat bakteri patogen pada benih padi dan kedelai (Winarni 2004), dan dapat meningkatkan pertumbuhan tanaman kedelai (Ifdal 2003; Andri 2004). Streptomyces sp. PD14-19 memiliki aktivitas penghambatan terhadap Ralstonia solanacearum dan mampu menekan kejadian
penyakit layu pada tanaman cabai mencapai 100% pada uji in planta (Muthahanas 2004). Berdasarkan uraian tersebut, kajian lebih lanjut perlu dilakukan untuk mengetahui potensi Streptomyces spp. lokal sebagai agen pengendali mikrob patogen tular tanah.
Hipotesis
Untuk mengarahkan jalannya penelitian diajukan hipotesis:
− Streptomyces spp. menghasilkan senyawa antimikrob
− Senyawa antimikrob dari Streptomyces spp. mampu menghambat mikrob
patogen tular tanah
− Streptomyces spp. mampu mengendalikan mikrob patogen tular tanah secara
in vitro dan in planta.
Tujuan Penelitian
Penelitian ini bertujuan untuk mendapatkan isolat lokal Streptomyces spp.
Manfaat Penelitian
Penelitian ini diharapkan dapat memberikan informasi ilmiah tentang kemampuan Streptomyces spp. isolat lokal dalam menghambat pertumbuhan mikrob patogen tular tanah sebagai dasar pengembangan lebih lanjut untuk aplikasi teknologi pengendalian hayati terhadap miktob patogen tular tanah
TINJAUAN PUSTAKA
Mikrob Patogen Tular Tanah
Mikrob patogen tular tanah (soil borne) adalah salah satu patogen penyebab penyakit tanaman. Mikrob patogen ini dapat menyerang lebih dari satu macam tanaman dan menimbulkan masalah serius pada budidaya tanaman ekonomi penting terutama di daerah tropis dan subtropis. Salah satunya adalah resiko kerusakan tanaman dan kehilangan hasil yang cukup tinggi yang menyebabkan kerugian ekonomi di bidang pertanian dan industri hortikultura (Cahyaniati et al. 1999; Direktorat Perlindungan Hortikultura 2004). Mikrob patogen tular tanah termasuk beberapa bakteri dan cendawan dapat hidup dan berdiam dalam tanah dan sisa-sisa tanaman untuk jangka waktu yang pendek ataupun panjang. Mikrob patogen tular tanah menyerang tanaman melalui penetrasi akar yang dapat menyebabkan tanaman inang menjadi mati, dan patogen dapat berpindah ke setiap bagian tanaman yang lain. Erwinia cartovora subsp. Cartovora (Zamanian et al. 2005), Pseudomonas solanacearum, F. oxysporum, Alternaria solani (El-Abyad et al. 1993), R. Solani (Sabaratnam & James 2002), dan Sclerotium rolfsii
(Prapagdee et al. 2008) adalah beberapa jenis mikrob patogen tular tanah yang dapat menyerang tanaman pertanian. Tanaman yang terinfeksi patogen tular tanah dapat menyebabkan berbagai macam penyakit seperti busuk akar, busuk pangkal batang, layu, rebah kecambah dan penyakit tanaman lainnya (Haas & Defago 2005). Mikrob patogen tular tanah memiliki kisaran inang yang luas dan beberapa diantaranya mempunyai struktur istirahat, sehingga penyakit yang ditimbulkannya menjadi sulit dikendalikan. S. rolfsii merupakan salah satu jenis mikrob patogen tular tanah yang dapat menyebabkan berbagai jenis penyakit pada lebih dari satu jenis tanaman. Penelitian ini lebih difokuskan pada mikrob patogen tular tanah S. rolfsii karena selain memiliki virulensi yang tinggi, juga disebabkan karena beberapa mikrob patogen tular tanah yang digunakan mempunyai virulensi yang sangat rendah atau menurun.
Prapagdee et al. 2008). S. rolfsii merupakan salah satu cendawan patogen tular tanah yang dapat menyebabkan penyakit pada tanaman hortikultura. Cendawan patogen ini memiliki jangkauan inang yang luas, setidaknya 500 spesies dalam 100 famili tanaman dilaporkan rentan antara lain adalah: alfalfa, amarilis, pisang, kacang-kacangan, kubis, wortel, kol kembang, seledri, krisan, kopi, kapas, ketimun, andewi, bawang putih, jahe, labu, mangga, melon, mustar, bawang merah, kacang tanah, nenas, kentang, lobak, kedelai, tembakau, tulip, dan ketela (Ferreira & Boley 1992). Akan tetapi, tanaman inang yang paling umum adalah famili Leguminoceae, Cruciferaceae, dan Cucurbitaceae. Di Amerika, dilaporkan lebih dari 270 jenis tanaman merupakan tanaman inang S. rolfsii (Ferreira & Boley 1992; Fichtner 1999; Palaiah et al. 2007).
Pertumbuhan S. rolfsii. S. rolfsii sangat cepat pertumbuhannya, mempunyai hifa berbentuk seperti kapas dan berwarna putih. Cendawan tersebut dapat membentuk struktur istirahat berupa sklerotia yang dapat bertahan lama di dalam tanah walaupun tidak ada pertanaman dan dapat berfungsi sebagai sumber inokulum pada pertanaman selanjutnya (Fichtner 1999). Sklerotia mulai terbentuk setelah 4-7 hari pertumbuhan miselia. Ukurannya relatif seragam (diameter 0,5-2,0 mm), berbentuk agak bundar dan putih ketika belum matang kemudian menjadi coklat sampai hitam gelap (Ferreira & Boley 1992; Fichtner 1999). Sklerotia merupakan struktur bertahan berisi hifa yang dapat hidup dan merupakan inokulum awal untuk perkembangan penyakit. S. rolfsii mampu bertahan dan berkembang dalam berbagai kondisi lingkungan. Pertumbuhan dapat terjadi dalam rentang pH yang luas, dan optimalnya pada tanah asam. Rentang pH optimal untuk pertumbuhan miselia adalah 3,0 hingga 5,0, dan perkecambahan sklerotia terjadi antara pH 2,0 dan 5,0. Perkecambahan akan terhambat pada pH di atas 7,0. Pertumbuhan maksimum miselium terjadi pada suhu antara 25 dan 35 ˚C pertumbuhan sedikit atau tidak ada pada suhu 10 atau 40 ˚C. Miselium dapat mati pada suhu 0 ˚C, tetapi sklerotia dapat bertahan pada suhu serendah-rendahnya -10 ˚C (Fichtner 1999).
7
menyerang tanaman di dekat tanah atau di atas permukaan tanah. Sebelum penetrasi pada jaringan tanaman, diproduksi massa miselium oleh patogen pada permukaan tanaman yang dapat terjadi dalam 2 sampai 10 hari. Penetrasi pada jaringan tanaman inang terjadi ketika patogen memproduksi enzim ekstraseluler yang menyebabkan lapisan luar sel menjadi rusak dan dengan cepat menghancurkan jaringan dan dinding sel, sehingga memudahkan penetrasi Sclerotium ke tanaman inang. Hal ini menyebabkan kerusakan jaringan, selanjutnya diproduksi miselium dan pembentukan sklerotia (Ferreira & Boley 1992; Fichtner 1999; Edmunds et al. 2000).
Hasil telaah literatur penelitian patogenisitas cendawan patogen mengemukakan bahwa banyak cendawan patogen tanaman menyerang dan merusak jaringan tanaman dengan mensekresikan enzim yang dapat mendegradasi dinding sel. Smith et al. (1986) menyatakan bahwa dalam menginfeksi jaringan tanaman inang, S. rolfsii mensekresikan enzim dan asam oksalat yang membuat jaringan menjadi lunak kemudian mati sehingga memudahkan penetrasinya. S. rolfsii juga diketahui mensekresikan enzim selulase (Bateman 1969, diacu dalam
Smith et al. 1986). Enzim selulolitik yang disekresikan akan melunakkan dan menguraikan bahan penyusun dinding sel, dan memudahkan penetrasi dan penyebaran patogen di dalam inang dan menyebabkan pecah (kolapse) dan terurainya struktur seluler, sehingga membantu patogen menimbulkan penyakit (Agrios 1995). Enzim pendegradasi dinding sel yang dihasilkan S. rolfsii adalah endo-polygalacturonase (endo-PG) dan senyawa asam oksalat. Endo-PG dan
asam oksalat dilaporkan dapat menyebabkan kerusakan pada jaringan tanaman (Bateman dan Beer 1965, diacu dalam Agilo 2001).
S. rolfsii terutama menyerang batang tanaman, meskipun dapat menular di
Ganesan et al. 2006), busuk umbi (bulb rot) pada Allium victorialis var. platyphyllum Makino di Korea (Jin, Hyeong & Chang 2007), dan menyebab
penyakit southern blight pada tanaman cabai dan tanaman sayuran lainnya serta tanah pertanian. Penyakit layu Sclerotium telah lama dikenal di Indonesia dan umumnya terdapat di pertanaman kacang-kacangan (Semangun 2006). Selain penyakit layu, Sclerotium juga menyebabkan penyakit busuk pangkal batang (collar rot) pada tanaman kacang tanah (Kuswinanti 2006). S. rolfsii (Sacc.) dilaporkan dapat menyebabkan penyakit antraknosa, hawar daun, busuk batang dan penyakit pada berbagai jenis tanaman pertanian (Prapagdee et al. 2008).
Upaya Pengendalian
Berbagai upaya pengendalian telah dilakukan untuk mengendalikan berbagai penyakit yang disebabkan oleh Sclerotium rolfsii pada tanaman hortikultura, misalnya pengendalian tanpa bahan kimia (non-kimia), rotasi tanaman, pembajakan, solarisasi tanah, pemakaian mulsa plastik hitam, penggunaan mikrobisida kimiawi dan mikrobisida hayati (Ferreira & Boley 1992). Upaya pengendalian tersebut ada yang berhasil tetapi beberapa lainnya kurang berhasil. Penggunaan mikrobisida kimiawi umumnya digunakan untuk perlindungan secara langsung permukaan tanaman dari infeksi atau untuk mengeradikasi patogen yang telah menginfeksi tanaman sebelumnya cukup berhasil. Namun demikian, penggunaan yang berlebihan dan dalam jangka waktu yang lama dapat berdampak negatif pada kesehatan manusia dan pencemaran lingkungan karena residu yang ditinggalkan bersifat racun dan bahkan dapat menimbulkan resistensi patogen (Alam et al. 2003). Oleh karena itu, untuk menghindari masalah tersebut perhatian difokuskan untuk menggunakan mikroorganisme seperti cendawan, bakteri dan Actinomycetes sebagai agen pengendali hayati untuk meminimalkan infeksi yang disebabkan oleh patogen tanaman. Pengendalian hayati merupakan salah satu upaya yang mendapat perhatian lebih dalam pengembangannya. Pengendalian hayati (biological control) adalah penurunan atau penghancuran populasi patogen baik dalam
9
ataupun melalui manipulasi inang, lingkungan atau antagonis (Agrios 1995; Pal & Spaden 2006).
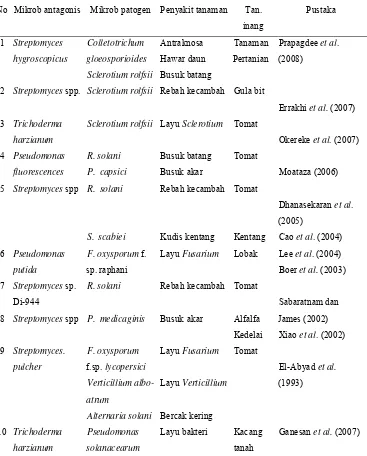
[image:32.612.137.504.242.698.2]Penelitian yang dilakukan baik di luar maupun di dalam negeri ( Tabel 1 ) merupakan suatu upaya dalam mencari agen pengendali hayati dan cara pengelolaan yang efektif terhadap penyakit tanaman. Pemanfaatan mikrob antagonis yang secara alami dapat diperoleh dari tanah-tanah pertanian, dapat Tabel 1 Pemanfaatan mikrob antagonis sebagai agen pengendali hayati mikrob
patogen tanaman
No Mikrob antagonis Mikrob patogen Penyakit tanaman Tan.
inang Pustaka 1 2 3 4 5 6 7 8 9 10 Streptomyces hygroscopicus
Streptomyces spp.
Trichoderma
harzianum
Pseudomonas
fluorescences
Streptomyces spp
Pseudomonas
putida
Streptomyces sp.
Di-944
Streptomyces spp
Streptomyces. pulcher Trichoderma harzianum Colletotrichum gloeosporioides Sclerotium rolfsii Sclerotium rolfsii Sclerotium rolfsii R. solani
P. capsici
R. solani
S. scabiei
F. oxysporum f.
sp. raphani
R. solani
P. medicaginis
F. oxysporum
f.sp. lycopersici
Verticillium albo-atrum Alternaria solani Pseudomonas solanacearum Antraknosa Hawar daun Busuk batang Rebah kecambah
Layu Sclerotium
Busuk batang
Busuk akar
Rebah kecambah
Kudis kentang
Layu Fusarium
Rebah kecambah
Busuk akar
Layu Fusarium
Layu Verticillium
Bercak kering Layu bakteri Tanaman Pertanian Gula bit Tomat Tomat Tomat Kentang Lobak Tomat Alfalfa Kedelai Tomat Kacang tanah
Prapagdee et al.
(2008)
Errakhi et al. (2007)
Okereke et al. (2007)
Moataza (2006)
Dhanasekaran et al.
(2005)
Cao et al. (2004)
Lee et al. (2004)
Boer et al. (2003)
Sabaratnam dan
James (2002)
Xiao et al. (2002)
El-Abyad et al.
(1993)
No Mikrob antagonis Mikrob patogen Penyakit tanaman Tan.
Inang Pustaka
11 12 13 14 15 Pseudomonas spp.
Bacillus spp.
Streptomyces spp.
P. fluorescens
B. subtilis
Bacillus sp.
Streptomyces sp
P. fluorescens B. subtilis T. viride Streptomyces pulcher R. solanacearum R. solanacearum X. axonopodis
pv. glycines
Bacilus subtillis
Pseudomonas sp.
R. solanacearum Clavibacter michi- ganensis subsp. michiganensis Layu bakteri Layu bakteri Pustul bakteri Busuk benih Daun bergaris merah Hawar daun Layu bakteri Kanker bakteri Tembaka u Tomat Kedelai Kedelai Padi Tomat Tomat
Djatmiko et al. (2007)
Nawangsih (2006)
Andri (2004)
Winarni I (2004)
Nurjanani (2001)
El-Abyad et al.
(1993)
secara efektif mengendalikan satu bahkan beberapa mikrob patogen tanaman sehingga dapat menekan terjadinya penyakit. Pemanfaatan mikrob antagonis juga dapat meningkatkan hasil dan dapat mengurangi pemakaian mikrobisida kimiawi. Mikrob patogen tanaman menyerang dan menyebabkan penyakit pada berbagai jenis tanaman hortikultura dan beberapa diantaranya memiliki struktur istirahat sehingga sulit dikendalikan. Penggunaan mikrobisida kimiawi kurang efektif dan bahkan menimbulkan dampak negatif. Oleh karena itu, untuk menghindari masalah tersebut perhatian difokuskan untuk menggunakan mikroorganisme seperti cendawan, bakteri dan Actinomycetes sebagai agen pengendali hayati untuk meminimalkan infeksi yang disebabkan oleh patogen tanaman.
11
rekayasa genetik (Sigee 1993). Pengendalian hayati lebih efektif apabila mikrob yang memiliki sifat antagonis juga mampu berkompetisi untuk jangka waktu lama dalam kondisi alaminya. Beberapa penelitian berhasil mengisolasi beberapa mikroorganisme dari kelompok cendawan dan bakteri yang memiliki sifat antagonistik terhadap S. rolfsii seprti; Trichoderma harzianum, T. viride, Bacillus subtilis, Penicillium spp., dan Gliocladium virens (Ferreira & Boley 1992).
Aplikasi kombinasi Trichoderma harzianum (ITTC-4572) dan Rhizobium berhasil menurunkan penyakit busuk batang (stem rot) pada kacang tanah (Ganesan et al. 2006). Trichoderma harzianum, dapat menekan penyakit layu Sclerotium sebesar 80,3% pada tanaman tomat (Okereke et al. 2007).
Senyawa bioaktif yang dihasilkan oleh Bacillus subtilis diketahui juga mempunyai aktivitas antagonistik terhadap R. solani (Kondoh et al. 2001), dan S. rolfsii (Nalisha et al. 2006). Bakteri lain yang juga mendapat perhatian besar dan
terus dilakukan pengembangannya adalah kelompok bakteri Actinomycetes, terutama pada genus Streptomyces. Streptomyces spp, diketahui memiliki kemampuan dalam mensekresikan senyawa bioaktif sebagai metabolit sekunder yang bersifat antagonistik baik terhadap bakteri, nematoda dan cendawan patogen. Streptomyces spp. dapat mereduksi penyakit pada benih jagung yang disebabkan
oleh Fusarium subglutinas dan Chepalosporium acremonium (Bressan 2003). Streptomyces olivaceus strain 115 memiliki aktivitas antagonistik yang kuat
terhadap Rhizoctonia solani (Shahrokhi et al. 2005). Errakhi et al. (2007), melaporkan senyawa antimikrob yang dihasilkan Streptomyces spp., secara in vitro mampu menghambat Sclerotium rolfsii, dan isolat J-2 secara signifikan dapat
mengurangi penyakit rebah kecambah dan meningkatkan pertumbuhan benih tanaman gula bit (sugar beet).
Karakteristik Streptomyces spp.
Actinomycetes secara kemotaksonomi dikelompokkan ke dalam bakteri Gram- positif yang mempunyai kandungan Guanine-Cytosine (GC) tinggi (high-GC Gram positive bacteria) antara 63–78% ((Madigan et al. 2006). Dibandingkan
medium padat. Koloninya keras seperti tumbuh akar di dalam media, berbeda dengan bakteri lain yang koloninya lunak diatas media agar. Hifanya bersifat hidrofobik tetapi miselium vegetatifnya bersifat hidrofilik. Actinomycetes dikenal sebagai sumber penghasil beberapa metabolit sekunder seperti antibiotik, dan enzim yang berguna untuk kesehatan, industri, dan juga sebagai agen biokontrol penyakit tanaman dan telah diproduksi dalam skala industri (Betina 1983; Ensign 1992; Sabaratnam & James 2002; Miyadoh 2003). Salah satu anggota Actinomycetes adalah Streptomyces yang mampu membentuk spora udara (konidia) (Madigan et al. 2006). Hifa vegetatif bakteri ini berdiameter 0,5 – 2,0 µm, spora nonmotil, dan menghasilkan berbagai macam pigmen yang terlihat pada miselium vegetatif dan aerialnya. Dinding selnya tersusun oleh sejumlah besar asam L-diaminopimelat. Streptomyces adalah bakteri aerob, kemoorganotrof, memberikan reaksi katalase positif, dan umumnya mampu mereduksi nitrat menjadi nitrit (Holt et al. 1994; Dhanasekaran et al. 2005).
Streptomyces dan beberapa genus kelompok Actinomycetes lainnya dikenal
sebagai bakteri penghasil antibiotik, karena dari 10000 antibiotik yang telah ditemukan, 2/3 nya dihasilkan oleh bakteri ini (Miyadoh 2004). Streptomyces memiliki siklus hidup yang kompleks dan mampu menghasilkan dan mensekresi metabolit sekunder, senyawa bioaktif seperti antibiotik, enzim hidrolitik (protease dan lipase), dan inhibitor enzim. Streptomyces biasanya hidup di tanah dan merupakan dekomposer penting karena dapat menguraikan bahan organik, khususnya polimer seperti lignosellulosa, pati, dan kitin, dalam tanah, serta tahan terhadap keadaan stres lingkungan seperti kekeringan dan kekurangan makanan dengan membentuk spora (Cao et al. 2004; Dhanasekaran et al. 2005; Zamanian et al. 2005). Spora Streptomyces dibentuk secara sederhana dengan terbentuknya
dinding penyekat pada sporofor multinukleat, kemudian diikuti oleh pemisahan individu sel secara langsung. Perbedaan bentuk, susunan, filamen, dan pembentukan struktur spora digunakan dalam pengelompokan Streptomyces (Madigan et al. 2006).
Potensi Streptomyces spp.
13
Beberapa usaha telah dilakukan untuk memanfaatkan Actinomycetes yang bersifat antagonistik sebagai agen pengendali hayati. Streptomyces spp. dapat dijumpai dalam jumlah cukup banyak di dalam tanah, sampah organik, dan kompos. Dari sejumlah mikroorganisme yang diisolasi dari tanah, 90% diantaranya merupakan Streptomyces spp. Streptomyces spp. termasuk dalam mikroorganisme saprofit
dan dapat mendegradasi beberapa senyawa seperti lignin, kitin, pektin, keratin, senyawa aromatik, dan asam humat (Cao et al. 2004). Streptomyces spp. dapat tumbuh pada kisaran suhu 44-45 ˚C sehingga merupakan mikrob pengurai yang berperan penting dalam proses pengomposan dan pembuatan pupuk organik. Mikroorganisme ini juga dapat memproduksi senyawa bioaktif seperti antibiotik antara lain; eritromisin, tetrasiklin, streotimisin, nistatin, neomisin, kanamisin, sikloheksimida, sikloserin, linkomisin, aminoglikosida, aureomisin, kloramfenikol, nistatin, amphoterisin dan amfosetin B ( Todar 2002; Purnomo et al. 2005; Madigan et al. 2006).
fenil asetat dan sodium fenil asetat. Xiao, Kinkel, & Samac (2002) mengemukakan bahwa 53 koleksi antibiotik yang diperoleh dari Streptomyces spp. asal isolat Minnesota, Nebraska, dan Washington setelah dievaluasi menunjukkan kemampuan dalam menghambat pertumbuhan patogen tanaman Phytophthora medicaginis dan Phytophthora sojae secara in vitro. Delapan isolat
mempunyai kemampuan yang besar dalam mengendalikan penyakit busuk akar Phytophthora (Phytophthora root rots) pada tanaman alfalfa dan kedelai.
Penapisan agen biokontrol yang dilakukan Lee et al (2004) terhadap Streptomyces scabies penyebab penyakit kudis kentang, menemukan empat isolat Streptomyces
(A020645, A010321, A010564, & A020973) yang sangat berpotensial. Keempat isolat tersebut memiliki aktivitas antagonistik yang tinggi > 60% dan memiliki ketahanan yang tinggi terhadap 10 macam bahan kimia. Shahrokhi et al. (2005) menyatakan bahwa isolat Actinomycetes dari Iran, mempunyai aktivitas antifungi. Streptomyces olivaceus strain 115 menunjukkan aktivitas antagonistik yang kuat
terhadap Rhizoctonia solani Khun AG-3 yang menyebabkan kanker pada tanaman kentang. Selain Streptomyces spp. asal tanah, Taechowisan et al. (2005) mengemukakan bahwa Streptomyces aureofaciens CMUAc 130 yang diisolasi dari jaringan akar tanaman Zingiber officinale Rosc. juga dapat memberikan penghambatan terhadap pertumbuhan hifa cendawan Colletotrichum musae dan Fusarium oxysporum yang dikenal sebagai agen antraknosa dan layu pada
tanaman pisang. Streptomyces aureofaciens CMUAc 130 mengendalikan cendawan patogen tanaman dengan menghasilkan senyawa 5,7-dimethoxy-4-p-methoxylphenylcoumarin dan 5,7-dimethoxy-4 phenylcoumarin. Dua senyawa antifungi alifatik (SPM5C-1 dan SPM5C-2) dengan unit lakton dan keton yang dihasilkan oleh Streptomyces sp. PM5 ternyata mempunyai aktivitas antifungi pada tanaman padi. Senyawa SPM5C-1 menghambat pertumbuhan miselium Pyricularia oryzae dan R. solani pada konsentrasi 25, 50, 75, dan 100 µg/ml
dibandingkan dengan SPM5C-2 yang aktivitas antifungi lebih rendah terhadap P. oryzae, dan tidak mempunyai aktivitas terhadap R. solani. Penyemprotan dengan
15
Penelitian yang dilakukan Sadeghi et al. (2006) menunjukkan bahwa dua isolat Streptomyces spp. (S2 & C) efektif digunakan untuk pengendalian rebah kecambah pada tanaman gula bit (sugar beet). Kedua isolat tersebut memiliki aktivitas antifungi terhadap tiga isolat R. solani AG-4 (Rs1, Rs2, dan Rs3) dengan menghasilkan siderofor (isolat C) dan enzim kitinase (isolat S2 & C). Prapagdee et al. (2008) juga melaporkan bahwa Streptomyces hygroscopicus (SRA 14) dapat
menghambat Colletotrichum gloeosporioides (Penz.) dan Sclerotium rolfsii (Sacc.) penyebab penyakit antraknosa, hawar daun, dan busuk batang pada berbagai jenis tanaman pertanian, dengan menghasilkan enzim ekstraseluler, yaitu kititanse dan -1,3-glukanase. Enzim ini dapat mengkatalisis senyawa glukan yang menyebabkan lisisnya dinding sel cendawan tersebut.
Penelitian yang dilakukan El-Abyad et al. (1993) menunjukkan bahwa secara in vitro, pada konsentrasi 80% filtrat kultur S. pulcher atau S. canescens sangat signifikan menghambat perkecambahan spora, pertumbuhan miselium, dan sporulasi dari F. oxysporum f.sp. lycopersici, Verticillium albo-atrum, dan Alternaria solani. Pada konsentrasi yang sama, filtrat S. pulcher atau S.
citreofluorescens menyebabkan kerusakan pada bakteri patogen Clavibacter michiganensis subsp. michiganensis dan Pseudomonas solanacearum. Pada uji in
planta menunjukkan bahwa perlakuan pelapisan benih (seed coating) tomat dengan Streptomyces spp. lebih efektif dalam mengendalikan semua patogen pada 42 dan 63 hari setelah tanam. Perlakuan inokulasi tanah dengan antagonis tujuh hari sebelum tanam kurang efektif mengendalikan patogen tanaman tomat dibanding dengan perlakuan pelapisan benih (seed coating). Sedangkan perlakuan perendaman benih efektifitasnya sangat rendah dalam mengendalian penyakit. Perlakuan pelapisan benih (seed coating) sangat signifikan dalam memperbaiki pertumbuhan tanaman tomat. Dalam laporan penelitian Yuan dan Crawford (1995) mengemukakan bahwa perlakuan dengan Streptomyces lydicus WYEC108 pada benih setelah 96 jam tanam, menunjukkan intensitas serangan patogen hanya mencapai 40–70%, sedangkan yang tidak diberi perlakuan dengan Streptomyces lydicus WYEC108 intensitas serangan patogen mencapai 70–100% pada 24–48
tular tanah dan tular benih (soil borne dan seed borne). Streptomyces spp. efektif dalam mengurangi penyakit tanaman yang disebabkan oleh cendawan patogen dan dapat meningkatkan pertumbuhan tanaman. Streptomyces sp. WYE 20 dan WYE 324 mampu melindungi tanaman terhadap Rhizoctonia solani dan Phytoptora capsici penyebab penyakit rebah kecambah, busuk batang dan akar,
hawar daun dan buah pada tanaman ketimun dan cabai (Suh & Won 2001). Benih yang dilapisi spora Streptomyces sp. DSMZ 12.424 dapat menekan munculnya penyakit oleh Rhizoctonia solani dan Pythium ultimum (Berg et al. 2001).
Streptomyces spp. yang diisolasi dari berbagai daerah di Indonesia diketahui
berpotensi menghasilkan berbagai macam senyawa bioaktif (Lestari 2006). Streptomyces spp. berpotensi sebagai agen pengendali hayati berdasarkan kemampuannya dalam menghambat pertumbuhan bakteri patogen dan mampu meningkatkan pertumbuhan tanaman kedelai (Ifdal 2003; Andri 2004). Winarni (2004) melaporkan bahwa beberapa Sterptomyces spp. isolat lokal ternyata mampu menghambat bakteri patogen pada benih padi dan kedelai. Selain itu juga dapat menghambat mikrob patogen cabai Ralstonia solanacearum dan mampu menekan kejadian penyakit layu mencapai 100% Muthahanas (2004). Djatmiko et al. (2007) juga melaporkan bahwa Streptomyces spp. (S4) mempunyai
kemampuan yang lebih baik dalam menekan Ralstonia solanacearum dan Meloidogyne incognita penyebab penyakit layu bakteri. Streptomyces spp. (S4)
BAHAN DAN METODE
Waktu dan Tempat
Penelitian ini dilaksanakan pada Bulan September 2007 sampai Bulan Oktober 2008 di Laboratorium Mikrobiologi Departemen Biologi FMIPA IPB dan Rumah Kaca Fitopatologi Litbang Deptan Cimanggu.
Bahan
Bahan yang digunakan dalam penelitian ini adalah 32 isolat lokal Streptomyces. spp koleksi Laboratorium Mikrobiologi, Departemen Biologi
FMIPA IPB dan Laboratorium Mikrobiologi, Kelti Biologi Tanah, Balai Penelitian Tanah. Tiga isolat patogen dari kelompok bakteri (Ralstonia solanacearum, Xanthomonas sp, dan Bacillus sp) dan tiga isolat patogen dari kelompok cendawan (Rhizoctonia solani, Fusarium oxysporum) koleksi Laboratorium Bakteriologi dan Laboratorium Mikologi Departemen Proteksi Tanaman FAPERTA IPB dan Sclerotium rolfsii.
Metode
Peremajaan Isolat Streptomyces spp. dan Mikrob Patogen Tular Tanah Streptomyces spp. diremajakan dalam media Yeast Malt Agar (YMA) dan Oatmeal Agar (OA) dan diinkubasi selama 7-10 hari pada suhu ruang kemudian diinokulasikan kembali pada media YMA baru dan siap di uji. Patogen target (Bakteri) diremajakan pada media Nutrient Agar (NA) dan media Potato Dekstrosa Agar (PDA) untuk cendawan.
Uji in vitro Kemampuan Penghambatan Streptomyces spp. terhadap Mikrob Patogen Tular Tanah
Bioesei aktivitas antimikrob dengan metode cakram agar (agar disc-method). Kultur isolat Streptomyces spp. berumur 7-10 hari pada medium YMA, diambil dengan menggunakan sedotan steril berdiameter 5 mm. Inokulum Streptomyces spp. secara steril dipindahkan ke cawan media NA semi solid yang
minimal 106 sel/ml. Cawan tersebut diinkubasi pada suhu ruang selama 24 jam. Aktivitas antibakteri diindikasikan dengan terbentuknya zona bening. Evaluasi bioaktivitasnya berdasarkan ukuran diameter zona penghambatan (zona bening) yang terbentuk (diameter zona penghambatan dikurangi dengan diameter cakram agar). Penilaian daya penghambatan merujuk pada Suriawiria (1973).
Bioesei aktivitas antimikrob dengan metode biakan ganda (dual culture). Inokulum cendawan dibentuk dengan menggunakan sedotan steril diameter 5 mm, ditumbuhkan di tengah media PDA pada cawan petri berdiameter 9 cm kemudian inokulum Streptomyces spp. dibentuk dengan sedotan steril diletakkan berhadapan dengan inokulum cendawan pada jarak 3 cm dan diinkubasi pada suhu ruangan selama 3-5 hari (R. solani dan S. rolfsii.) dan 5-7 hari (F. oxysporum). Adanya penghambatan pertumbuhan cendawan dideteksi dengan adanya barier antara cendawan dengan Streptomyces spp. Tingkat penghambatan (∆ ) dihitung dengan cara mengurangi jarak tumbuh miselium cendawan menjahui inokulum Streptomyces spp. ( ◦) dengan jarak tumbuh miselium cendawan yang terhambat oleh inokulum Streptomyces spp. ( ), dengan formulasi (∆ = ◦- ). Dasar penghitungan tingkat penghambatan menggunakan cara Yuan dan Crawford (1995) yang dimodifikasikan. Tingkat penghambatan +++, ∆ > 2.0 cm (penghambatan kuat); ++, 2.0 cm > ∆ > 1.0 cm (penghambatan sedang); +, 1.0 cm > ∆ > 0.5 cm (penghambatan lemah) dan –, ∆ < 0.5 cm (tidak ada penghambatan). Persentase penghambatan menggunakan formula dari Taechowisan et al (2005) sebagai berikut: persentase penghambatan (%) = [( ◦-
) x 100]/ ◦.
Produksi Filtrat Kultur Streptomyces spp.
Isolat Streptomyces spp. terpilih ditumbuhkan pada media produksi International Streptomyces Project 4 (ISP4) selama 10 hari pada suhu ruang
19
Uji Antagonis Filtrat Kultur Streptomyces spp. terhadap Mikrob Patogen Tular Tanah
Uji aktivitas antagonis terhadap bakteri. Filtrat kultur Streptomyces spp. diuji aktivitas antibakteri dengan menggunakan metode Kirby-Bauer (Madigan et al, 2000). Cara pengujiannya adalah media NA semisolid (0.85%) yang berisi 100 μL biakan bakteri target dengan konsentrasi minimal 106 sel/ml dituang di atas media NA (100%) yang telah memadat. Selanjutnya 15 μL filtrat kultur Streptomyces spp. diteteskan di atas kertas cakram steril berdiameter 8 mm dan
diletakkan dengan sedikit ditekan. Pengamatan dilakukan setelah 24 jam masa inkubasi, dengan mengukur zona bening yang terbentuk. Besar diameter zona bening diukur berdasarkan diameter seluruh zona yang terbentuk dikurangi diameter cakram kertas (8 mm). Penilaian daya penghambatan merujuk pada Suriawiria (1973).
Uji Hipersensitivitas Sreptomyces spp. pada Tanaman Tembakau Streptomyces spp. diuji hipersensitivitas pada tanaman tembakau sebelum
dilakukan uji inplanta. Hal ini bertujuan untuk mengetahui patogenisitas Streptomyces spp. yang dilakukan dengan cara filtrat kultur Streptomyces spp.
diinokulasikan pada daun tanaman tembakau dengan menggunakan siring 3 ml dan dilakukan pengamatan setelah 24 dan 48 jam inokulasi.
Uji In Planta Kemampuan Penghambatan Streptomyces spp. terhadap
Sclerotium rolfsii
Penyiapan Streptomyces spp.
Dua isolat Streptomyces spp. terpilih (LSW05 dan PS4-16) hasil penapisan enam isolat Streptomyces spp. terhadap fungi Sclerotium rolfsii secara in vitro diuji lebih lanjut pada tanaman cabai. LSW05 memiliki daya penghambatan yang tinggi hanya jika diaplikasikan menggunakan sel secara langsung sedangkan sel dan filtrat kultur isolat PS4-16 memiliki daya penghambatan yang sebanding. Kedua isolat ditumbuhkan dalam media produksi ISP4 di atas rotary shaker dengan kecepatan 100 rpm selama 10 hari pada suhu ruangan. Selanjutnya kultur disentrifugasi dengan kecepatan 8000×g pada suhu 4 oC selama 15 menit. Supernatan dan pelet yang diperoleh digunakan untuk pengujian selanjutnya. Massa sel kemudian dicuci dengan larutan fisiologis 0.85% sebelum diaplikasi.
Penyiapan dan infestasi Sclerotium rolfsii.
S. rolfsii dibiakkan pada media gabah-pepton selama 1 minggu pada suhu
ruangan. Sebanyak 5 g inokulum S. rolfsii dengan kepadatan 3.23×104 cfu/g diinfestasikan pada pot yang berisi 300 g media tanam steril yang terdiri dari campuran tanah dan kompos (1 : 1, b/b).
Aplikasi Streptomyces spp.
21
cara seed coating, 100 benih diaduk dalam 20 ml formulasi massa sel Streptomyces spp. (2 g) dalam larutan tapioka 3% (b/v) steril sebagai pembawa dan Tween 80 70% (v/v) dengan bantuan stirrer selama 30 menit kemudian dikeringanginkan dalam laminar air flow. Benih kemudian ditanam pada pot sebanyak 5 benih/pot. Aplikasi dengan cara penyiraman dilakukan dengan menyiram media tanam dengan 20 ml suspensi Streptomyces spp. yang mengandung 2×10-3 g sel/ml.
Kedua isolat Streptomyces spp. diaplikasikan secara tunggal dan dikombinasikan antar kedua isolat. Untuk perlakuan kombinasi dua isolat, masing-masing isolat diaplikasikan dengan dosis setengah dari dosis aplikasi isolat tunggal. Sebagai kontrol adalah benih cabai yang dilapisi larutan tapioka 3% steril dan/atau benih cabai yang disiram dengan air saja.
Rancangan Percobaan
Rancangan percobaan yang digunakan adalah faktorial 2×4 dalam Rancangan Acak Kelompok (RAK) dengan menggunakan model Rancangan Petak Terpisah (split plot design). Terdapat dua faktor dalam rancangan percobaan ini yaitu cara aplikasi Streptomyces spp. sebagai petak utama yang terdiri atas dua perlakuan, yaitu seedcoating dan penyiraman. Jenis isolat Streptomyces spp. sebagai anak petak yang terdiri dari empat perlakuan, yaitu LSW05, PS4-16, kombinasi LSW05 dan PS4-16, dan tanpa Streptomyces spp. Dengan demikian dalam percobaan ini terdapat delapan kombinasi perlakuan. Tiap kombinasi perlakuan diulang lima kali sehingga terdapat 40 unit percobaan.
Pengamatan
Pengamatan dilakukan setiap hari sampai timbul gejala pertama pada masing-masing perlakuan, dan perkembangan intensitas penyakit (IP) diamati setiap minggu sejak munculnya gejala. Parameter yang diamati meliputi kemampuan berkecambah dan intensitas penyakit (IP).
Kategori serangan S. rolfsii discor berdasarkan skala sebagai berikut (Latunde-Dada 1993 ):
2 = Infeksi ringan, miselium hanya menutupi permukaan tanah, 3 = Infeksi sedang, tanaman layu dan miselium menutupi pangkal batang,
4 = Infeksi berat, tanaman semakin layu dengan bercak coklat pada pangkal batang dan sklerotia berlimpah.
5 = Tanaman mati.
IP dihitung dengan menggunakan rumus (Gunawan 1989):
a1n1 + a2n2 + ... + annn
IP = ×100%
5 × jumlah tanaman yang diamati IP = intensitas penyakit
a = nilai skor tiap tanaman
n = jumlah tanaman dengan nilai skor tertentu
IP kumulatif dikonversi menjadi luasan area di bawah kurva perkembangan penyakit (LADKP) yang dihitung dengan menjumlahkan luas semua bangun trapesium di bawah kurva perkembangan IP pada waktu pengamatan tertentu dengan rumus (Marroni et al. 2006):
n
LADKP =
∑
[
(Xi+1 + Xi)/2]
× (ti+1 - ti)i=1
Xi = Intensitas penyakit pada pengamatan ke-i ti = waktu pengamatan ke-i
n = pengamatan pada saat terminal penyakit
Keefektifan relatif pengendalian (KRP) Streptomyces spp. terhadap S. rolfsii dihitung menggunakan rumus sebagai berikut (Unterstenhofer 1976 diacu
dalam Nurjanani 2001):
LADKPKo – LADKPS
23
KRP = Keefektifan relatif pengendalian
LADKPKo = IP kontrol pada masing-masing cara aplikasi dan jenis Streptomyces spp.
LADKPS = IP pada perlakuan
Kriteria keefektifan pengendalian perlakuan ditentukan sebagai berikut (Unterstenhofer 1976 diacu dalam Nurjanani 2001):
Tabel 2 Kriteria keefektifan relatif pengendalian Nilai keefektifan relatif pengendalian
(KRP)
Kategori keefektifan
KRP ≥ 80% 60% ≤ KRP < 80% 40% ≤ KRP < 60% 20% ≤ KRP < 40%
KRP <20%
Sangat efektif Efektif Agak efektif Kurang efektif
Tidak efektif
Peremajaan Streptomyces spp.
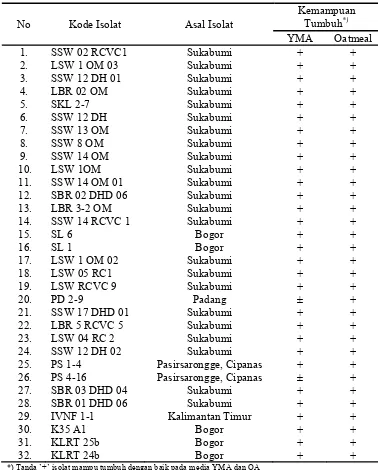
Hasil peremajaan 32 isolat Streptomyces spp. pada media YMA dan Oatmeal Agar (OA) selama 14 hari masa inkubasi pada suhu ruangan (Tabel
[image:47.612.199.435.405.542.2]lampiran 1), menunjukkan 30 isolat dapat tumbuh dengan baik dan dua isolat tumbuh kurang baik pada media YMA, akan tetapi ke-32 isolat tumbuh dengan baik pada media OA. Ke-30 isolat tersebut adalah isolat-isolat yang masih baru sehingga lebih mudah tumbuh pada media YMA yang tinggi kandungan nutrisinya dan dua isolat yang tumbuh kurang baik adalah isolat yang telah berusia beberapa tahun yang lebih sering diremajakan dan ditumbuhkan pada media OA. Petrolini et al. 1993 melaporkan bahwa Actinomycetes yang ditumbuhkan pada media YMA pertumbuhan miselia aerealnya sangat lambat yaitu setelah 21 hari masa inkubasi sedangkan pada media OA produksi miselia aereal dan spora sangat baik. Gambar 1 memperlihatkan beberapa contoh hasil peremajaan isolat Streptomyces spp. yang memiliki keragaman morfologi koloni.
Gambar 1 Morfologi koloni isolat Streptomyces spp. yang ditumbuhkan pada media YMA (LSW05, SSW02, LSW1, dan LBR02) dan OA (PD2-9 dan PS4-16)
Pembentukan miselia aereal dan sporulasi merupakan salah satu tahap yang penting dalam siklus hidup Streptomyces ( Abe et al. 2005). Menurut Miyadoh dan Otoguro (2004), spora Actinomycetes akan tumbuh dan berkembang menjadi miselium dan koloni apabila nutrisi, kelembapan dan suhu, serta kondisi lainnya memenuhi syarat untuk kehidupan. Isolat yang tumbuh baik pada kedua media, permukaan koloninya ada yang halus seperti beludru, bertepung, kasar atau
PS4-16 LSW05 PD2-9
25
keriput. Warna koloni ada yang krem, coklat muda, coklat kehitaman, abu-abu, dan pink. Bentuk koloni ada yang bulat dengan tepi rata atau bergelombang ataupun patahan.
Kemampuan Penghambatan Streptomyces spp. terhadap Mikrob Patogen Tular Tanah Secara In Vitro
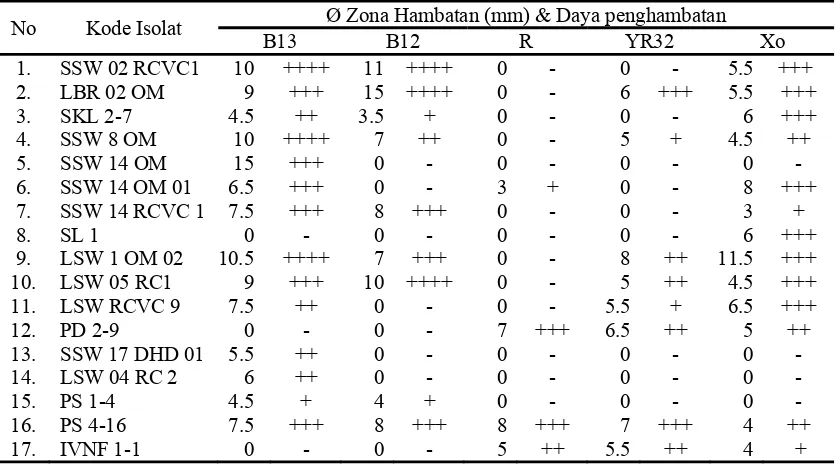
Pengujian antagonis isolat Streptomyces spp. terhadap mikrob patogen target dengan menggunakan sel secara langsung merupakan pengujian awal untuk mendapatkan isolat yang memiliki kemampuan dalam menghambat pertumbuhan mikrob patogen tular tanah. Hasil uji antagonis ke-32 isolat Streptomyces spp. dengan menggunakan sel secara langsung menunjukkan sebanyak 17 isolat mampu menghambat mikrob patogen target. Ke-17 isolat tersebut (Tabel lampiran 2) memiliki aktivitas penghambatan yang beragam, 14 isolat diantaranya menunjukkan aktivitas penghambatan terhadap bakteri dan cendawan patogen, sedangkan tiga isolat lainnya hanya memiliki aktivitas penghambatan terhadap bakteri. Beberapa isolat Streptomyces spp. yang diuji diketahui memiliki spektrum yang luas karena dapat menghambat kelompok bakteri positif dan Gram-negatif, serta mampu menghambat kelompok cendawan. Kemampuan tersebut menunjukkan bahwa isolat lokal Streptomyces spp. yang diujikan dapat dimanfaatkan sebagai agen pengendali hayati mikrob patogen tular tanah. Salah satu persyaratan agen pengendali hayati yang baik untuk digunakan dalam mengendalikan mikrob patogen tular tanah yaitu memiliki spektrum yang luas (Cook & Baker 1996).
yaitu 7 – 15 mm, X. axonopodis mampu dihambat oleh isolat LBR02, LSW1, LSW05, PD2-9, dan PS4-16 yang menghasilkan zona hambat sebesar 5 – 8 mm, sedangkan X. oryzae mampu dihambat oleh keenam isolat Streptomyces tersebut dengan diameter zona hambat sebesar 4 – 11.5 mm, sedangkan R. solanacearum hanya mampu dihambat oleh isolat PD2-9 dan PS4-16 dengan diameter zona hambat sebesar 7 - 8 mm.
Tabel 3 Kemampuan penghambatan Streptomyces spp. terhadap pertumbuhan bakteri patogen dengan menggunakan sel secara langsung
No Kode Isolat
Daya Hambat (Ø zona bening) (mm)
B13 B12 R YR32 Xo
Ø
(mm) Daya Ø
(mm) Daya
Ø
(mm) Daya
Ø
(mm) Daya
Ø
(mm) Daya
1. 2. 3. 4. 5. 6. SSW02 LBR02 LSW1 LSW05 PD2-9 PS4-16 10 9 10.5 9 0 7.5 ++++ +++ ++++ +++ - +++ 11 15 7 10 0 8 ++++ ++++ +++ ++++ - +++ 0 0 0 0 7 8 - - - - +++ +++ 0 6 8 5 6.5 7 - +++ ++ ++ ++ +++ 5.5 5.5 11.5 4.5 5 4 +++ +++ +++ +++ ++ ++
B13 : B. cereus; B12 : B. subtilis; R : R. solanacearum; YR32 : X. axonopodis; Xo : X. oryzae
Tabel 4 Kemampuan penghambatan Streptomyces spp. terhadap pertumbuhan cendawan patogen dengan menggunakan sel secara langsung
*)
Daya hambat : +++, ∆ > 2,0 cm; ++, 2,0 cm > ∆ > 1,0 cm; +, 1,0 > ∆ > 0,5 cm; dan −, ∆ < 0,5 cm
Penghambatan terhadap cendawan (Tabel 4) ditunjukkan oleh isolat SSW02, LSW1, LSW05, dan PS4-16 yang mampu menghambat dengan kuat
No Kode Isolat.
Daya Hambat (%)
R. solani F. oxysporum S. rolfsii
∆
(cm) Daya %
∆
(cm) Daya %
∆
(cm) Daya %
27
pertumbuhan R. solani, keempat isolat tersebut juga mampu menghambat F. oxysporum dengan tingkat daya hambat yang berbeda. Isolat SSW02 dan PS4-16
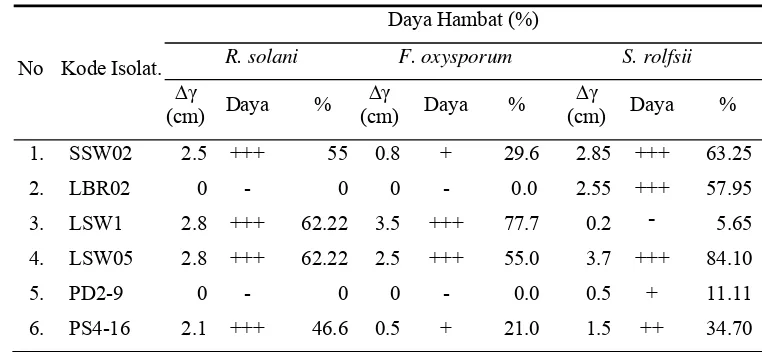
mampu menghambat dalam tingkatan sedang, sedangkan LSW1 dan LSW05 menghasilkan daya hambat yang kuat terhadap F. Oxysporum. Hasil uji antagonis isolat Streptomyces spp. terhadap S. rolfsii diketahui isolat SSW02, LBR02, dan LSW05 memiliki daya hambat yang kuat, dan masing-masing satu isolat memiliki kemampuan sedang dan lemah dalam menghambat pertumbuhan cendawan tersebut yaitu isolat PS4-16 dan PD2-9.
Uji Antagonis Filtrat Kultur Streptomyces spp. terhadap Mikrob Patogen Tular Tanah
Filtrat kultur Streptomyces spp. yang telah dikumpulkan digunakan untuk uji antagonis terhadap bakteri dan cendawan patogen. Hasil uji antagonis keenam filtrat kultur Streptomyces spp. menunjukkan adanya peningkatan dan penurunan aktivitas penghambatan terhadap bakteri dan cendawan target.
Tabel 5 Hasil uji antagonis filtrat kultur enam isolat Streptomyces spp. terhadap bakteri patogen
No Kode Isolat
Daya Hambat (Ø zona bening) (mm)
B13 B12 R YR32 Xo
Ø
(mm) Daya Ø (mm) Daya
Ø
(mm) Daya
Ø
(mm) Daya
Ø
(mm) Daya
1. 2. 3. 4. 5. 6. SSW02 LBR02 LSW1 LSW05 PD2-9 PS4-16 0.0 3.0 4.0 4.5 7.0 4.0 - ++ ++ + ++ + - 15 18.5 14,5 15,5 14,5 - ++++ ++++ ++++ ++++ ++++ 0 0 0 0 0 0 - - - - - - 0 7.5 0 0 0 0 - ++ - - - - 19 19 - - - 21,5 ++++ ++++ - - - ++++
B13 : B. cereus; B12 : B. subtilis; R : R. solanacearum; YR32 : X. axonopodis; Xo : X. oryzae
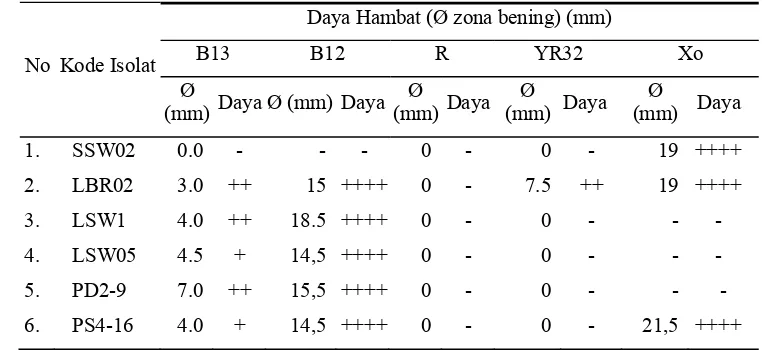
Tabel 5 menunjukkan filtrat kultur isolat LSW1, LSW05, PD2-9, dan PS4-16 memiliki daya hambat kuat terhadap B. subtilis dengan diameter zona hambat sebesar 14,5 – 18,5 mm, filtrat kultur LBR02 relatif stabil aktivitasnya terhadap B. subtilis dan X. axonopodis dengan diameter zona hambat 15 dan 7,5 mm. Hasil uji
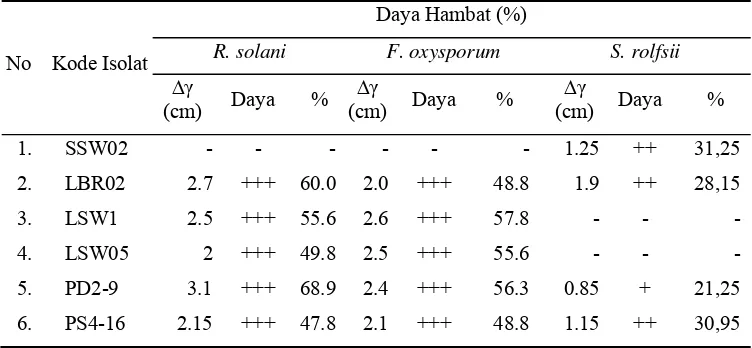
meningkatkan aktivitas penghambatan terhadap X. oryzae dengan diameter zona hambat yang dihasilkan lebih besar yaitu 19 – 21 mm. Aktivitas filtrat kultur Streptomyces spp. terhadap cendawan patogen (Tabel 6) terlihat bahwa filtrat kultur isolat LBR02, LSW1, LSW05, PD2-9, dan PS4-16 memiliki daya hambat kuat terhadap R. solani dan F. oxysporum dengan persentase penghambatan masing-masing sebesar 47,8 – 68,9% dan 48,8 – 57,8%. Penghambatan terhadap S. rolfsii ditunjukan oleh filtrat kultur isolat SSW02, LBR02, PD2-9, dan PS4-16
yang memiliki daya hambat sedang dengan persentase penghambatan seb