vii
SELEKSI DAN KARAKTERISASI BAKTERI PENGHASIL
SIDEROFOR SEBAGAI AGENS ANTAGONIS
Ralstonia solanacearum
PADA TOMAT
IDA PARIDA
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
i
ABSTRAK
IDA PARIDA. Seleksi dan Karakterisasi Bakteri Penghasil Siderofor sebagai
Agens Antagonis Ralstonia solanacearum pada Tomat. Dibimbing oleh
ABDJAD ASIH NAWANGSIH.
Siderofor merupakan senyawa pengelat besi (Fe) yang dapat memfasilitasi transfer Fe dari lingkungan menjadi tersedia bagi tanaman. Senyawa ini diketahui berperan dalam mekanisme pengendalian bakteri patogen tumbuhan. Penelitian ini bertujuan mengetahui kelimpahan bakteri penghasil siderofor pada rizosfer tomat, mendapatkan isolat bakteri penghasil siderofor yang potensial sebagai
agens antagonis terhadap Ralstonia solanacearum pada tomat, dan mengetahui
karakter bakteri tersebut. Bakteri penghasil siderofor yang digunakan dalam
penelitian ini diisolasi dari perakaran tanaman tomat sehat pada lahan yang terinfestasi R. solanacearum di wilayah Cipanas dan Lembang, Jawa Barat. Isolat bakteri penghasil siderofor diuji kemampuan antagonismenya terhadap bakteri
patogen R. solanacearum, kemudian masing-masing isolat yang potensial sebagai
agens antagonis diamati karakternya. Hasil penelitian menunjukkan bahwa kelimpahan populasi bakteri penghasil siderofor di Cipanas dan Lembang tidak berbeda nyata. Populasi bakteri penghasil siderofor di daerah Lembang sebanyak 5,333 x 107 cfu/gram dan populasi bakteri penghasil siderofor di daerah Cipanas sebanyak 1,977 x 107 cfu/gram. Isolat bakteri penghasil siderofor yang memiliki
kemampuan antagonisme terhadap R. solanacearum secara in vitro adalah Cp1C,
Cp2B, Cp2D, Cp3E, Lb1A, Lb1C, dan Lb1L. Isolat yang mampu memproduksi senyawa fluoresens adalah Cp2B dan Lb1A. Isolat yang termasuk kelompok Gram positif adalah Lb1C dan yang termasuk Gram negatif adalah Cp1C, Cp2B, Cp2D, Cp3E, Lb1A dan Lb1L. Isolat yang mampu melarutkan fosfat adalah Cp1C, Cp2B, Cp2D, Lb1A, Lb1C, dan Lb1L. Isolat yang tahan terhadap
perlakuan suhu sampai 80 oC adalah Cp1C, Cp2D, Lb1C, dan Lb1L. Isolat
ii
SELEKSI DAN KARAKTERISASI BAKTERI PENGHASIL
SIDEROFOR SEBAGAI AGENS ANTAGONIS
Ralstonia solanacearum
PADA TOMAT
IDA PARIDA
Skripsi
sebagai salah satu syarat untuk memperoleh
gelar Sarjana Pertanian
pada
Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor
DEPARTEMEN PROTEKSI TANAMAN
FAKULTAS PERTANIAN
INSTITUT PERTANIAN BOGOR
BOGOR
iii
Judul : Seleksi dan Karakterisasi Bakteri Penghasil Siderofor
sebagai Agens Antagonis Ralstonia solanacearum pada Tomat
Nama Mahasiswa : Ida Parida
NIM : A34070038
Disetujui, Pembimbing
Dr. Ir. Abdjad Asih Nawangsih, MSi. NIP 19650621 198910 2 001
Diketahui,
Ketua Departemen Proteksi Tanaman
Dr. Ir. Abdjad Asih Nawangsih, MSi. NIP 19650621 198910 2 001
iv
RIWAYAT HIDUP
Penulis dilahirkan di Ciamis tanggal 1 Mei 1989. Penulis merupakan anak tunggal dari pasangan Ai Ruhaeman dan Titi Rositi. Penulis menempuh pendidikan menengah atas di Madrasah Aliyah Negeri Cipasung, sekaligus pendidikan pesantren di Pondok Pesantren Cipasung, Tasikmalaya (2004-2007). Tahun 2007 penulis diterima di Institut Pertanian Bogor melalui jalur Undangan Seleksi Masuk IPB, dan pada tahun 2008 diterima di Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor.
Selama menjadi mahasiswa, penulis aktif sebagai anggota klub sepeda kampus Ability (2007-2008), anggota pengurus DKM Al-Hurriyah Divisi Pengembangan Sumber Daya Manusia (2008), dan anggota Forum Komunikasi Rohis Departemen (FKRD) Divisi Kemuslimahan (2009). Penulis juga aktif di organisasi keprofesian Himpunan Mahasiswa Proteksi Tanaman sebagai bendahara (2009).
Selain aktif di beberapa organisasi, penulis juga aktif dalam ajang kreatifitas dengan mengikuti kegiatan Program Kreativitas Mahasiswa khususnya dalam
bidang penelitian dengan judul “Perakitan Teknik Pengendalian Xanthomonas
oryzae Terbawa Benih Padi” pada tahun 2010 dibawah bimbingan Dr. Ir. Giyanto, MSi.
Puji dan syukur ke hadirat Allah SWT, karena berkat ridho-Nya penulis dapat menyelesaikan skripsi dengan judul ‘Seleksi dan Karakterisasi Bakteri
Penghasil Siderofor sebagai Agens Antagonis Ralstonia solanacearum pada
Tomat’. Penelitian dan penulisan skripsi ini disusun sebagai salah satu syarat untuk memperoleh gelar Sarjana Pertanian pada Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor. Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi Tanaman Fakultas Pertanian, Institut Pertanian Bogor dari Oktober 2010 sampai dengan Juni 2011. Sumber dana yang digunakan dalam penelitian ini berasal dari penelitian Hibah Bersaing dengan judul ‘Studi Keragaman Bakteri Penghasil Siderofor pada Rizosfer Tomat dan Upaya Pemanfaatannya sebagai Pemacu Pertumbuhan Tanaman serta Pengendalian Penyakit Layu Bakteri oleh Ralstonia solanacearum’ dibiayai DIPA IPB No. 27/I3.24.4/SPK/PD/2010 Tanggal 05 Maret 2010 .
Penulis menyadari bahwa banyak pihak yang telah berjasa dalam memberikan bimbingan, dukungan, dan bantuan dalam menyelesaikan skripsi ini. Terima kasih dan penghargaan penulis sampaikan kepada:
1. Dr. Ir. Abdjad Asih Nawangsih, M.Si. selaku dosen pembimbing yang
senantiasa memberikan bimbingan, arahan, dan dukungan yang sangat berarti.
2. Ir. Djoko Prijono, MAgrSc. selaku dosen penguji tamu atas saran dan masukan
dalam penulisan skripsi.
3. Kedua orang tua, Ai Ruhaeman, S.Pd.I. dan Titi Rositi serta seluruh keluarga
besar atas doa dan dukungannya.
4. Ratdiana SP., M.Si., atas arahan dan bimbingan selama penelitian.
5. Dr. Ir. Kikin Hamzah M, M.Si. atas saran dan masukan dalam penulisan
skripsi.
6. Keluarga besar Laboratorium Bakteriologi Tumbuhan, Departemen Proteksi
Tanaman, IPB, Dr. Ir Giyanto, MSi., Dr. Rustam Batutah, MSi., Ir. Haliatur Rahma, MSi., Dr. Ir. Husda Marwan, MSi., Ir. Awaludin, MSi., Tita Widjayanti, SP., Adelin Elsina T, S.Si., Agus Eko Prasetyo, SP., Candra Budiman SP., Tatit Sastrini, Yayu Siti N, Nur Izza FH, Zhenita Vinda TH, Yana Anisa, dan Nurul Widyanti.
7. Sahabat-sahabat seperjuangan angkatan 44 Departemen Proteksi Tanaman,
Faperta, IPB, terutama Lutfi Afifah, Rita Kurnia A, Kurniatus Ziyadah, Yulius Dika Ciptadi, Ahmad Riyadi, dan Irma Utami, atas bantuan selama penelitian.
8. Sahabat-sahabat tercinta, Apan Iskandar, Tega Hidayati, Dini Khoerotul K,
Maya Hermawati dan sahabat “Ceriwis”, Risma Junita S.KPm, Frida Agustiani, Erin Roslina, dan Ima Karimah, S.Gz.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena itu saran dan kritik yang bersifat membangun sangat diharapkan. Akhir kata, penulis berharap semoga hasil penelitian ini dapat bermanfaat bagi pihak-pihak yang berkepentingan terutama dalam bidang proteksi tanaman.
Bogor, Januari 2012
Isolasi dan Uji Reaksi Hipersensitif Bakteri Penghasil Siderofor ... 10
Uji Antagonisme Bakteri Penghasil Siderofor terhadap R. solanacearum ... 11
Pengaruh bakteri penghasil siderofor terhadap daya kecambah ... 13
Pengaruh bakteri penghasil siderofor terhadap tinggi tanaman ... 14
Pengaruh bakteri penghasil siderofor terhadap bobot basah, bobot kering, dan kadar air tanaman tomat ... 14
HASIL DAN PEMBAHASAN ... 16
Isolasi dan Reaksi Hipersensitif Bakteri Penghasil Siderofor Asal Cipanas dan Lembang ... 16
Antagonisme Bakteri Penghasil Siderofor terhadap R. solanacearum ... 18
Karakterisasi Bakteri Penghasil Siderofor ... 20
KESIMPULAN DAN SARAN ... 33
DAFTAR PUSTAKA ... 34
viii
DAFTAR TABEL
Halaman
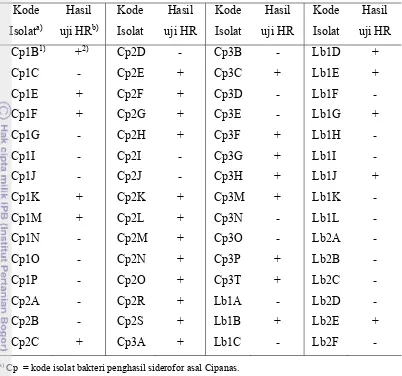
1 Sifat patogenisitas isolat-isolat bakteri penghasil siderofor ... 18
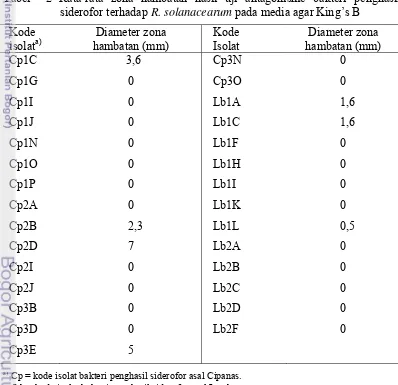
2 Rata-rata zona hambatan hasil uji antagonisme bakteri penghasil
siderofor terhadap R. solanacearum pada media King’s B agar ... 19
3 Ciri-ciri morfologi isolat bakteri penghasil siderofor yang potensial
sebagai agens antagonis diamati pada media King’s B agar ... 21
4 Beberapa karakter bakteri penghasil siderofor yang potensial sebagai
agens antagonis ... 23
5 Persentase peningkatan daya kecambah tanaman tomat varietas Arthaloka dan Ratna yang diberi perlakuan bakteri penghasil
siderofor ... 25
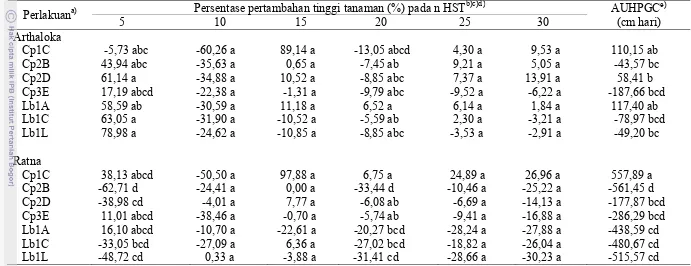
6 Persentase peningkatan tinggi tanaman tomat varietas Arthaloka
dan Ratna yang diberi perlakuan isolat bakteri penghasil siderofor ... 27
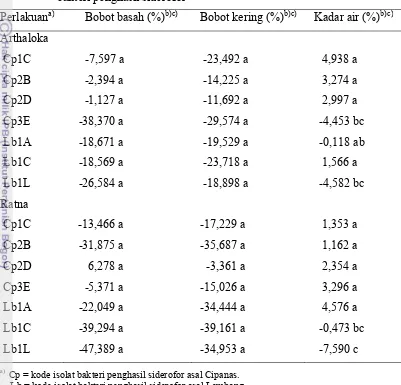
7 Persentase peningkatan bobot basah, bobot kering, dan kadar air tanaman tomat varietas Arthaloka dan Ratna yang diberi perlakuan
bakteri penghasil siderofor ... 29
ix
DAFTAR GAMBAR
Halaman
1 Kelompok pengikat besi dari mikroba penghasil siderofor ... 7
2 Zona berwarna jingga yang dibentuk bakteri penghasil siderofor pada Media CAS ... 16
3 Hasil uji rekasi hipersensitif beberapa isolat bakteri penghasil siderofor yang menunjukkan hasil positif, diamati setelah 24 jam ... 17
4 Zona hambatan hasil uji antagonisme bakteri penghasil siderofor
terhadap R. solanacearum pada media King’s B agar ... 19
5 Morfologi bakteri penghasil siderofor yang berpotensi sebagai agens antagonis Cp1C (a); Cp2B (b); Cp2D (c); Cp3E (d); Lb1A (e);
Lb1C (f); Lb1L (g) ... 22
6 Karakteristik bakteri penghasil siderofor isolat Cp2B menghasilkan senyawa fluoresens yang paling tinggi (a); isolat Lb1C yang
memiliki kemampuan melarutkan fosfat yang paling tinggi terlihat dengan membentuk zona bening di sekitar koloni pada media
vi
DAFTAR LAMPIRAN
Halaman
1 Pembuatan media Chrom Azurol Sulfat ( CAS ) ... 37
2 Sidik ragam pengaruh bakteri penghasil siderofor terhadap persentase peningkatan daya kecambah tanaman tomat varietas Arthaloka
dan Ratna ... 37
3 Sidik ragam pengaruh bakteri penghasil siderofor terhadap persentase peningkatan tinggi tanaman dan nilai AUHPGC tanaman tomat
varietas Arthaloka dan Ratna ... 37
4 Tabel Pertambahan tinggi tanaman tomat varietas Arthaloka dan
Ratna yang diberi perlakuan bakteri penghasil siderofor ... 40
5 Sidik ragam pengaruh bakteri penghasil siderofor terhadap persentase peningkatan bobot basah, bobot kering, dan kadar air tanaman tomat
varietas Arthaloka dan Ratna ... 41
6 Sidik ragam hasil uji lanjut Duncan untuk persentase peningkatan tinggi tanaman pada 5 HST, 20 HST, nilai AUHPGC, dan kadar air
tanaman tomat varietas Arthaloka dan Ratna ... 41
7 Gambar daya kecambah varietas Ratna ... 42
8 Gambar daya kecambah varietas Arthaloka ... 43
9 Gambar perbedaan pengaruh perlakuan Cp3E (a) dan Cp2D (b) pada
varietas Arthaloka ... 43
1
PENDAHULUAN
Latar Belakang
Tomat (Lycopersicon esculentum Mill.) merupakan tanaman sayuran
penting di Indonesia. Luas penanaman tomat setiap tahun sekitar 50.000 ha
dengan produksi mencapai 891.616 ton (BPS 2010). Daerah sentra produksi
tomat meliputi Jawa Barat dengan luas penanaman ± 11.234 ha, Sumatera Utara ±
4.215 ha, dan Bengkulu ± 6.285 ha (Purwati 2008).
Salah satu kendala yang memengaruhi produksi tomat adalah penyakit layu
bakteri yang disebabkan oleh Ralstonia solanacearum. Bakteri ini merupakan
patogen tular tanah (Denny & Hayward 2000; Alvarez et al. 2010) dan air
(Alvarez et al. 2010) yang bersifat nonfluoresens dari famili Pseudomonadaceae
(Denny & Hayward 2000). Gejala yang sering terlihat yaitu tanaman seperti
kekurangan air (Duriat et al. 1997) dan dapat menyebabkan kematian (Agrios
2005).
Usaha pengendalian penyakit layu bakteri yang pernah dilakukan adalah
rotasi tanaman, sanitasi, dan pengembangan varietas tahan. Permasalahannya,
pengendalian dengan rotasi tanaman dan sanitasi sering tidak efektif. Sedikitnya
tanaman yang dapat digunakan untuk rotasi menjadi salah satu kendala usaha
pengendalian dengan rotasi tanaman. Sedangkan pengembangan varietas tahan
keberhasilannya sangat dipengaruhi oleh kepadatan populasi patogen, strain
patogen, suhu, kelembaban tanah, dan keberadaan nematoda akar (Wang & Lin
2005).
Teknik pengendalian penyakit layu bakteri yang banyak dikembangkan saat
ini adalah dengan agens hayati. Menurut Sigee (1993) pengendalian secara
biologi sangat berpotensi karena memiliki sasaran yang spesifik, tidak merusak
lingkungan, dan tidak menimbulkan efek fitotoksisitas. Pengendalian hayati pada
dasarnya adalah usaha untuk memanfaatkan dan menggunakan musuh alami
sebagai pengendali populasi patogen. Mekanisme yang menguntungkan dari
penggunaan agens hayati adalah dengan cara memanfaatkan hubungan antagonis
antara patogen dan inang secara langsung (antibiosis, kompetisi, dan parasitisme)
2
banyak dikembangkan dalam pengendalian penyakit tanaman di antaranya
Bacillus subtilis (Nawangsih 2006; Chrisnawati et al. 2009) dan Pseudomonas
flourescens (Chrisnawati et al. 2009).
Salah satu senyawa yang dihasilkan bakteri antagonis adalah siderofor.
Sejauh ini belum banyak penelitian yang mengungkap peranan bakteri penghasil
siderofor dalam pengendalian penyakit layu bakteri. Menurut Glick dan Pasternak
(2003) siderofor dihasilkan oleh plant growth promoting rhizobacteria dan
merupakan senyawa organik selain antibiotik yang dapat digunakan dalam
pengendalian penyakit tanaman. Diduga mekanisme bakteri penghasil siderofor
dalam pengendalian penyakit tanaman adalah dengan cara kompetisi. Siderofor
itu sendiri merupakan molekul yang memiliki bobot molekul relatif rendah,
sebagai agens spesifik pengelat ion Fe yang diuraikan oleh bakteri dan cendawan
yang tumbuh pada keadaan cekaman lingkungan akibat Fe rendah. Siderofor
memiliki afinitas tinggi untuk Fe3+ dan dapat memfasilitasi transportasi besi
seluler (Yasmin 2009). Sifat antagonis bakteri penghasil siderofor diharapkaan
dapat membantu dalam usaha pengendalian penyakit layu bakteri oleh R.
solanacearum.
Tujuan Penelitian
Penelitian ini bertujuan mengetahui kelimpahan bakteri penghasil siderofor
pada rizosfer tomat, mendapatkan isolat bakteri penghasil siderofor yang potensial
sebagai agens antagonis R. solanacearum pada tomat, dan mengetahui karakter
bakteri tersebut.
Manfaat Penelitian
Hasil penelitian ini diharapkan dapat memberi manfaat berupa informasi
dasar mengenai bakteri penghasil siderofor yang dapat digunakan sebagai agens
antagonis R. solanacearum penyebab penyakit layu bakteri pada tomat, serta
3
TINJAUAN PUSTAKA
Tanaman Tomat
Tomat termasuk tanaman perdu semusim, berbatang lemah, daun berbentuk
segi tiga, bunga berwarna kuning atau hijau di waktu muda dan kuning atau merah
di waktu tua, serta berbiji banyak. Tanaman tomat dapat tumbuh baik di dataran
tinggi sampai dataran rendah pada ketinggian tempat 0 sampai dengan 1250 m di
atas permukaan laut (Purwati 2008). Tomat dapat tumbuh di lahan basah/sawah
maupun lahan kering/tegalan bergantung pada varietas yang ditanam (Purwati
2008). Suhu optimal untuk pertumbuhan tanaman tomat adalah sekitar 23 oC
pada siang hari dan 17 oC pada malam hari (Duriat et al. 1997).
Tomat merupakan komoditas hortikultura yang penting di Indonesia dan
banyak digunakan sebagai sayuran, bumbu masak, bahan kosmetik, dan
obat-obatan (Duriat et al. 1997). Khusus bagi tubuh, tomat sangat bermanfaat karena
memiliki kandungan vitamin C (Wang & Lin 2005), mineral (Cahyono 2008),
likopen, β-karoten (Wang & Lin 2005) yang diperlukan untuk pertumbuhan dan
kesehatan (Cahyono 2008).
Budidaya tanaman tomat di Indonesia terus berkembang dengan luas
penanaman setiap tahun mencapai ± 50.000 ha (Purwati 2008). Menurut BPS
(2010), produksi tomat dari tahun ke tahun terus mengalami peningkatan dari
594.022 ton pada tahun 2002 menjadi 891.616 ton pada tahun 2010. Daerah
sentra produksi tomat di Indonesia meliputi Jawa Barat dengan luas penanaman ±
11234 ha, Sumatera Utara ± 4215 ha, dan Bengkulu ± 6285 ha (Purwati 2008).
Layu Bakteri pada Tomat
Penyebab penyakit layu bakteri pada tomat yaitu R. solanacearum yang
sebelumnya dikenal dengan nama Pseudomonas solanacearum (Smith et al.
1995). Bakteri ini merupakan patogen tular tanah (Denny & Hayward 2000;
Alvarez et al. 2010) dan air (Alvarez et al. 2010) yang bersifat nonfluoresens dari
famili Pseudomonadaceae (Denny & Hayward 2000). Bakteri ini mampu
4
merupakan salah satu penyebab penyakit layu yang penting di wilayah tropis,
subtropis, dan daerah beriklim hangat (Jeung et al. 2007).
R. solanacearum merupakan patogen yang memiliki kisaran inang luas lebih
dari 200 spesies dari 53 famili yang berbeda. R. solanacearum memiliki efek
mematikan pada sejumlah tanaman yang bernilai ekonomi tinggi (Alvarez et al.
2010). Tanaman inang R. solanacerum yang paling penting diantaranya pisang
(Musa paradisiaca), terung (Solanum melongena), kacang tanah (Arachis
hypogaea), kentang (S. tuberosum), tembakau (Nicotiana tabacum), tomat
(L. esculentum) (Alvarez et al. 2010), dan nilam (Pogostemon cablin) (Nasrun et
al. 2007).
Gejala permulaan yang ditimbulakan oleh serangan bakteri ini adalah
layunya beberapa daun muda, menguningnya daun-daun tua, dan batang tanaman
sakit cenderung lebih banyak membentuk akar adventif sampai setinggi bunga
(Semangun 2007). Gejala serangan R. solanacearum secara umum adalah
tanaman seperti kekurangan air, daun muda pada pucuk tanaman menjadi layu,
dan daun-daun tua atau daun-daun di bagian bawah menguning (Duriat et al.
1997). Hal ini karena bakteri menyerang pembuluh xilem (Agrios 2005). R.
solanacearum masuk dan menginfeksi pada luka-luka di bagian akar, termasuk
luka yang disebabkan nematoda atau organisme lain. Selanjutnya bakteri masuk
ke jaringan tanaman bersama-sama unsur hara dan air secara difusi, dan menetap
di pembuluh xilem dalam ruang antarsel (Duriat et al. 1997). Bakteri
memperbanyak diri melalui pembuluh xilem (Agrios 2005), dan merusak sel-sel
tanaman yang ditempatinya tersebut sehingga pengangkutan air dan zat-zat
makanan terganggu oleh massa bakteri dan sel-sel pembuluh xilem yang hancur
(Duriat et al. 1997). Menurut Duriat et al. (1997), hancurnya sel-sel tanaman
tersebut karena bakteri mengeluarkan enzim penghancur dinding sel tanaman
yang mengandung selulosa dan pektin yang dikenal dengan nama enzim selulase
dan pektinase. Akibat serangan ini, proses translokasi air dan nutrisi menjadi
terganggu, sehingga tanaman menjadi layu dan mati (Agrios 2005).
Pengendalian Penyakit Layu Bakteri
Usaha pengendalian penyakit layu bakteri yang pernah dilakukan adalah
rotasi tanaman, sanitasi, dan penggunaan pestisida. Pengendalian dengan rotasi
tanaman dan sanitasi sering tidak efektif (Wang & Lin 2005), sedangkan
penggunaan pestisida selain harganya mahal juga dapat berpengaruh terhadap
keseimbangan ekosistem. Pengembangan varietas tahan juga pernah dilakukan,
akan tetapi keberhasilannya sangat dipengaruhi oleh kepadatan populasi patogen,
strain patogen, suhu, kelembapan tanah, dan keberadaan nematoda akar (Wang &
Lin 2005). Menurut Wiryanta (2002), varietas Ratna merupakan contoh varietas
tomat yang tahan terhadap layu bakteri dan Arthaloka merupakan contoh varietas
tomat yang toleran terhadap penyakit layu bakteri.
Menurut Wang & Lin (2005), penerapan stategi pengendalian terpadu untuk
mengendalikan penyakit layu bakteri pada tomat bisa dilakukan dengan cara
memilih dan menggunakan lahan bebas patogen, menekan kemungkinan
terjadinya infeksi pada tanaman, menggunakan varietas yang resisten dan benih
yang bebas patogen, dan pencegahan penyebaran penyakit di lapangan. Beberapa
tanaman yang dapat digunakan untuk rotasi dengan tanaman tomat diantaranya
jagung, kacang hijau, sorgum, wortel, seledri, selada, dan sawi (Wang & Lin
2005).
Teknik pengendalian penyakit layu bakteri yang banyak dikembangkan saat
ini adalah dengan agens hayati. Menurut Sigee (1993) pengendalian secara
biologi sangat berpotensi karena memiliki sasaran yang spesifik, tidak merusak
lingkungan, dan tidak menimbulkan efek fitotoksisitas. Pengendalian hayati pada
dasarnya adalah usaha untuk memanfaatkan dan menggunakan musuh alami
sebagai pengendali populasi patogen. Mekanisme yang menguntungkan dari
penggunaan agens hayati adalah dengan cara memanfaatkan hubungan antagonis
antara patogen dan inang secara langsung (antibiosis, kompetisi, danparasitisme)
maupun secara tidak langsung (induksi ketahanan) (Janse 2005). Bakteri yang
banyak dikembangkan dalam pengendalian penyakit tanaman diantaranya B.
subtilis (Nawangsih 2006; Chrisnawati et al. 2009) dan P. fluorescens
6
Beberapa contoh pengendalian dengan agen antagonis adalah menggunakan
agens antagonis yang difermentasi dalam pupuk kandang sapi (Chrisnawati et al.
2009), pengendalian hayati menggunakan B. subtilis (Nawangsih 2006;
Chrisnawati et al. 2009), P. fluorescens (Chrisnawati et al. 2009), serta bakteri
endofit (Damayanti 2010).
Manfaat Besi (Fe) untuk Tanaman
Besi (Fe) merupakan unsur keempat yang paling melimpah di bagian
litosfer (Datnoff et al. 2007). Perkiraan konsentrasi unsur Fe dalam tanah adalah
kurang dari 0,1 ppm (Sutanto 2005), tetapi pada pH 5,0 atau 5,5 besi menjadi larut
dalam jumlah cukup banyak dan dapat menyebabkan tanaman menjadi keracunan
(Soepardi 1983). Besi termasuk unsur hara mikro (Soepardi 1999) dan sangat
dibutuhkan untuk kelangsungan hidup organisme (Glick & Pasternak 2003).
Walaupun demikian, besi dalam tanah tidak bisa langsung digunakan oleh
tanaman dan mikroorganisme. Besi dimanfaatkan tanaman dalam bentuk Fe2+ dan
Fe3+ (Soepardi 1999). Menurut (Datnoff et al. 2007) unsur ini memiliki fungsi
penting dalam respirasi, sintesis DNA, fotosintesis, dan fiksasi nitrogen. Gejala
kekurangan Fe pada tumbuhan hijau yaitu klorosis intervenal pada daun muda.
Menurut Soepardi (1983) serapan hara oleh tanaman menyaratkan adanya
asosiasi yang erat antara akar dan tanah. Akar tanaman menghasilkan CO2 dan
asam organik yang dapat mempercepat pertukaran hara. Selain itu ekskresi akar
merupakan sumber makanan dan energi bagi mikroorganisme. Adanya aktivitas
mikroorganisme di sekitar akar maupun tanah dapat memperlancar serapan unsur
hara oleh tanaman.
Bakteri Penghasil Siderofor
Menurut Neilands (1995), siderofor berasal dari bahasa Yunani yang artinya
pembawa besi. Siderofor merupakan molekul yang memiliki bobot molekul
relatif rendah, sebagai agens spesifik pengelat ion Fe yang diuraikan oleh bakteri,
cendawan, dan tumbuhan kelompok rumput-rumputan yang tumbuh pada keadaan
cekaman lingkungan akibat Fe rendah. Siderofor memiliki afinitas tinggi untuk
Glick dan Pasternak (2003) kelompok utama siderofor adalah hidroksamat,
katekolat, karboksilat, dan etilendiamina. Umumnya siderofor tipe hidroksamat
merupakan ciri khas untuk cendawan, katekolat untuk bakteri, dan karboksilat
untuk tumbuhan.
kelompok kelompok kelompok kelompok
hidroksamat katekolat karboksilat etilendiamina
Gambar 1 Kelompok pengikat besi dari mikroba penghasil siderofor (Glick & Pasternak 2003).
Siderofor merupakan salah satu zat kimia yang dihasilkan oleh plant growth
promoting rhizobacteria (Glick & Pasternak 2003). Siderofor diproduksi di luar
sel, dapat mengikat Fe3+, dan mentransfernya melalui membran sel dalam ruang
periplasmatik (Budzikiewicz 2001).
Siderofor dapat digunakan dalam pengendalian penyakit tumbuhan dengan
memanfaatkan peranannya untuk menyerap besi dari lingkungan dan
menyediakan mineral yang penting bagi sel mikroba (Neilands 1995).
Kemampuan bakteri penghasil siderofor dalam mengikat Fe3+ merupakan pesaing
terhadap mikroorganisme lain. Mekanisme kerja siderofor terjadi melalui
perkembangan yang cepat dari bakteri yang mengolonisasi akar tanaman dan
memindahkan besi di daerah permukaan serta terciptanya kondisi yang sesuai
untuk pertumbuhan akar dan tidak sesuai untuk pertumbuhan mikroba rhizoplant
(Budzikiewicz 2001). Bakteri penghasil siderofor juga dapat menginduksi
ketahanan tanaman. Mekanisme ketahanan tanaman terjadi karena adanya
perbaikan lingkungan tumbuh dari adanya interaksi mikroba tanaman (Dey et al.
8
Beberapa bakteri penghasil siderofor yang telah digunakan dalam bidang
pertanian diantaranya P. aeruginosa (Budzikiewicz 2001, Wahyuni et al. 2010),
P. flourescens, (Budzikiewicz 2001; Rachid & Ahmed 2005), P. putida
(Budzikiewicz 2001; Wahyuni et al. 2003) dan Bacillus sp. (Wahyudi et al. 2011).
Menurut Meyer (2000), Pseudomonas strain yang berbeda memiliki kemampuan
untuk menghasilkan siderofor dalam jumlah yang tinggi. Siderofor ini diketahui
efektif menekan pertumbuhan penyakit Fusarium oxysporum. Hal ini karena ion
Fe yang dibutuhkan F. oxysporum untuk berkecambah tidak tersedia akibat dikelat
oleh siderofor (Budzikiewicz 2001). Menurut Wahyuni et al. (2010), P.
aeruginosa mampu menginduksi ketahanan tanaman terhadap Cucumber mosaic
virus (CMV) dengan memproduksi siderofor pada kondisi Fe terbatas.
Plant Growth Promoting Rhizobacteria (PGPR)
Menurut Soesanto (2008), PGPR merupakan rizobakteria pemacu
pertumbuhan tanaman dan mampu mengoloni perakaran tanaman. PGPR dapat
meningkatkan pertumbuhan tanaman dengan berbagai mekanisme
(Ashrafuzzaman et al. 2009). Keaktifan pengolonisasian akar tersebut dapat
membantu akar dalam menyerap produk mikroba yang secara langsung
memengaruhi pertumbuhan dan fisiologi akar serta invasi patogen.
Menurut Yasmin et al. (2009), pengaruh penggunaan PGPR terhadap
pertumbuhan tanaman dikaitkan dengan mekanisme seperti produksi fitohormon,
pelarut posfat, penekanan patogen dengan memproduksi antibiotik dan siderofor,
atau bakteri dan cendawan yang memiliki aktivitas antagonisme. PGPR dapat
mencegah perkembangan cendawan dan patogen lainnya dengan memproduksi
siderofor yang mengikat sebagian besar Fe3+ di daerah sekitar akar tanaman
(Siddiqui dan Shakeel 2009).
Menurut Ramezanpour et al. (2011) P. fluorescens memiliki kemampuan
melarutkan fosfat dan meproduksi siderofor. Selain itu, P. fluorescens juga dapat
memacu pertumbuhan dan meningkatkan hasil panen tanaman padi. Menurut
Widawati dan Suliasih (2006), isolat bakteri pelarut fosfat jenis B. pantotheticus,
Klebsiella aerogenes, Chromobacterium lividum dan B. megaterium mampu
aeruginosa selain dapat berperan sebagai PGPR juga dapat membantu
menginduksi ketahanan tanaman tembakau terhadap CMV karena kemampuannya
yang dapat memproduksi siderofor.
Bakteri Pelarut Fosfat (P)
Fosfat merupakan unsur esensial kedua setelah N yang berperan penting
dalam proses pertumbuhan tanaman, serta metabolisme dan proses mikrobiologi
tanah (Widawati & Suliasih 2006). Kemampuan bakteri pelarut fosfat dalam
melarutkan unsur P menjadi bentuk yang tersedia bagi tanaman memiliki peranan
penting bagi pertanian berkelanjutan untuk meningkatkan hasil (Ekin 2010).
Unsur Fe meningkat dalam jumlah berlebihan dalam tanah yang masam (pH
rendah). Keadaan yang berlebihan tersebut akan meracuni tanaman atau
menyebabkan tanaman mudah terserang penyakit. Pada tanah masam, fosfat tidak
dapat diserap maksimal oleh tanaman karena terjerap oleh Al dan Fe, demikian
pula peredaran fosfat dalam tubuh tanaman akan terhambat. Beberapa bakteri
yang telah diketahui dapat melarutkan fosfat diantaranya B. pantotheticus, K.
aerogenes, C. lividum, B. megaterium (Widawati & Suliasih 2006), dan P.
10
BAHAN DAN METODE
Tempat dan waktu penelitian
Penelitian dilaksanakan di Laboratorium Bakteriologi Tumbuhan,
Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian Bogor, dari
Oktober 2010 sampai dengan Juni 2011.
Bahan dan Alat
Bakteri penghasil siderofor yang digunakan dalam penelitian ini diisolasi
dari perakaran tanaman tomat sehat pada lahan yang terinfestasi R. solanacearum
di wilayah Cipanas dan Lembang. Isolat P. fluorescens RH4003 dan isolat R.
solanacearum yang digunakan merupakan koleksi Laboratorium Bakteriologi
Tumbuhan, Departemen Proteksi Tanaman, Fakultas Pertanian, Institut Pertanian
Bogor. Benih tomat yang digunakan untuk pengujian kemampuan memacu
pertumbuhan tanaman yaitu varietas Arthaloka dan Ratna. Media tanam yang
digunakan yaitu campuran antara pupuk kompos dan tanah steril dengan
perbandingan 1:1.
Isolasi dan Uji Reaksi Hipersensitif Bakteri Penghasil Siderofor
Bakteri penghasil siderofor diisolasi dari bagian rizosfer tanaman tomat
sehat asal Cipanas dan Lembang, Jawa Barat. Tanaman tomat yang dipilih
sebagai sampel dicabut kemudian tanah yang berada di bagian perakaran serta
bagian akar-akar halus diambil sebanyak 10 g dan disuspensikan ke dalam 100 ml
akuades steril. Suspensi tersebut kemudian digoyang menggunakan shaker
dengan kecepatan 200 rpm selama 10 menit. Sebanyak 1 ml suspensi bakteri
diambil, kemudian dilakukan pengenceran berseri menggunakan akuades steril
hingga pengenceran 10-7. Suspensi diambil dari pengenceran 10-3, 10 -5, 10 -7
masing-masing sebanyak 100 µl kemudian disebar pada media chrom azurol
sulfat (CAS) secara duplo. Larutan indikator yang terkandung dalam media ini
adalah Fe-CAS yang membantu pembentukan zona berwarna jingga di sekitar
koloni bakteri yang menghasilkan siderofor. Zona berwarna jingga di sekitar
penghasil siderofor. Bakteri penghasil siderofor kemudian diisolasi dan
digunakan untuk berbagai pengujian.
Sampel tanaman tomat asal Cipanas diberi kode Cp, kemudian diikuti
dengan nomor sampel sehingga akan diperoleh sampel dengan kode Cp1, Cp2,
dan Cp3. Sampel tanaman tomat asal Lembang diberi kode Lb, kemudian diikuti
dengan nomor sampel, sehingga akan diperoleh sampel dengan kode Lb1 dan
Lb2. Bakteri penghasil siderofor hasil isolasi disimpan dalam media cair dengan
kombinasi 80% nutrient broth dan 20% gliserol pada suhu -20 oC. Sebelum
perlakuan, bakteri dipindahkan untuk peremajaan pada media agar King’s B
dalam cawan petri.
Uji reaksi hipersensitif (HR) bakteri penghasil siderofor dilakukan untuk
mengetahui patogenisitas bakteri penghasil siderofor. Pengujian dilakukan
dengan menggunakan daun tembakau sehat. Bakteri sebelumnya dibiakkan pada
media Luria Bertani broth (LB). Setelah diinkubasi selama 24 sampai 48 jam,
sebanyak 1 ml suspensi diambil dan disuntikkan pada daun tembakau.
Pengamatan dilakukan setelah 24 jam. Sebagai kontrol positif digunakan isolat R.
solanacearum dan Erwinia carotovora. Bakteri dinyatakan bersifat HR positif
apabila menimbulkan gejala nekrosis pada permukaan daun tembakau.
Uji Antagonisme Bakteri Penghasil Siderofor terhadap R. solanacearum Uji antagonisme bakteri penghasil siderofor dilakukan pada media agar
King’s B. Biakan bakteri penghasil siderofor yang berumur 24 sampai 48 jam
masing-masing disuspensikan dalam akuades steril dan kerapatannya diusahakan
mencapai 108 – 109 cfu/ml. Media agar King’B yang telah disterilisasi dituang
pada cawan berdiameter 9 cm dan ditunggu sampai membeku. Suspensi R.
solanacearum diambil sebanyak 100 µl kemudian disebar di permukaan media
tersebut. Setelah R. solanacearum yang disebar tersebut kering angin, satu potong
kertas saring steril berdiameter 5 mm diletakkan di atas permukaan agar.
Sebanyak 5 µl suspensi bakteri penghasil siderofor diteteskan di atas kertas saring
tersebut. Sebagai kontrol, potongan kertas saring ditetesi dengan akuades steril.
Setiap pengujian dilakukan sebanyak tiga ulangan. Diameter zona hambatan
12
Karakterisasi Bakteri Penghasil Siderofor
Karakterisasi dilakukan untuk mengetahui karakter dari masing-masing
bakteri penghasil siderofor yang memiliki kemampuan antagonisme terhadap R.
solanacearum. Karakterisasi meliputi pengamatan morfologi, produksi senyawa
fluoresens, reaksi Gram, kemampuan melarutkan fosfat, kemampuan bertahan
pada suhu 80 oC, dan kemampuan dalam memacu pertumbuhan tanaman tomat
yang meliputi daya kecambah, pertambahan tinggi tanaman, dan bobot kering
tanaman.
Morfologi Bakteri Penghasil Siderofor
Pengamatan morfologi bakteri penghasil siderofor dilakukan dengan cara
menggores kuadran bakteri penghasil siderofor pada media agar King’s B.
Pengamatan dilakukan setelah biakan berumur 24 sampai 48 jam. Pengamatan
morfologi meliputi diameter, bentuk, warna, elevasi, dan tepian dari koloni
tunggal masing-masing isolat bakteri.
Produksi Senyawa Fluoresens Bakteri Penghasil Siderofor
Produksi senyawa fluoresens oleh bakteri penghasil siderofor dideteksi
dengan cara menggoreskan bakteri penghasil siderofor pada media agar King’s B.
Setelah berumur 24 sampai 48 jam biakan bakteri kemudian diamati dibawah
lampu near ultraviolet (NUV) yang memiliki panjang gelombang sekitar 200
sampai 380 nm. Sebagai pembanding digunakan isolat bakteri P. fluorescens
RH4003 (P1).
Uji Gram Bakteri Penghasil Siderofor
Sifat Gram suatu bakteri dapat diketahui dengan metode sederhana
menggunakan KOH 3%. Biakan bakteri yang sebelumnya telah ditumbuhkan di
media padat diambil sebanyak satu lup, kemudian dilarutkan dalam KOH 3%.
Bakteri yang menghasilkan lendir mengindikasikan bahwa bakteri tersebut
termasuk kelompok Gram negatif, sedangkan yang tidak menghasilkan lendir
Uji Aktivitas Pelarutan Fosfat oleh Bakteri Penghasil Siderofor
Uji aktivitas pelarutan fosfat dilakuan dengan cara menumbuhkan
isolat-isolat bakteri penghasil siderofor pada media Pikovskaya padat menurut meode
Rao dan Sinha (1963). Setelah diinkubasi selama 48 jam pada suhu ruang,
dilakukan pengamatan zona bening di sekeliling koloni bakteri. Adanya zona
bening mengindikasikan bahwa bakteri penghasil siderofor tersebut memiliki
kemampuan melarutkan fosfat.
Uji Kemampuan Bertahan pada Suhu 80 oC
Bakteri yang akan diuji kemampuan bertahan pada suhu 80 oC sebelumnya
dibiakkan pada media LB. Setelah diinkubasi selama 24 jam bakteri tersebut
dipanaskan pada suhu 80 oC selama 15 menit, kemudian disebar pada media
tryptic soy agar. Bakteri yang tumbuh pada media TSA mengindikasikan bahwa
bakteri tersebut dapat bertahan pada suhu panas sampai 80 oC.
Uji Pemacuan Pertumbuhan Tanaman Tomat oleh Bakteri Penghasil Siderofor
Kemampuan bakteri penghasil siderofor dalam memacu pertumbuhan
tanaman diukur berdasarkan kemampuannya dalam meningkatkan daya
kecambah, pertambahan tinggi, bobot basah, bobot kering, dan kadar air tanaman
tomat. Jenis tanaman tomat yang digunakan yaitu varietas Arthaloka dan Ratna.
Pengaruh bakteri penghasil siderofor terhadap daya kecambah. Media tanam yang digunakan berupa tanah steril dan kompos yang dicampur dengan
perbandingan 1:1. Media tanam tersebut dimasukkan dalam pot tray berukuran
50 cm x 30 cm dengan jumlah lubang tanam sebanyak 128 lubang. Sebelum
ditanam, benih diberi perlakuan dengan cara direndam dalam suspensi bakteri
penghasil siderofor selama 16 jam atau semalaman sambil digoyang
menggunakan shaker. Sebagai kontrol, benih direndam dalam akuades steril.
Benih ditanam sebanyak satu benih per lubang tanam. Jumlah perlakuan untuk
setiap varietas sebanyak delapan perlakuan termasuk kontrol dengan
14
Pengamatan dilakukan untuk melihat persentase daya kecambah (DK) dari
masing-masing perlakuan yang dihitung dengan menggunakan rumus :
DK (%) = jumlah benih yang berkecambah X 100%
jumlah benih yang diamati
Pengaruh bakteri penghasil siderofor terhadap tinggi tanaman. Sebagai media tanam digunakan campuran tanah dan kompos dengan
perbandingan 1:1. Tanah dimasukkan ke dalam polybag berukuran 10 cm x 15
cm. Sebelum ditanam benih tersebut diberi perlakuan dengan cara direndam
dalam suspensi bakteri selama 16 jam atau semalaman sambil digoyang
menggunakan shaker. Sebagai kontrol, benih direndam dalam akuades steril.
Benih kemudian ditanam sebanyak satu benih per polybag. Jumlah perlakuan
untuk setiap varietas sebanyak delapan perlakuan termasuk kontrol.
Masing-masing perlakuan diulang sebanyak tiga kali dan Masing-masing-Masing-masing ulangan terdiri
atas lima unit. Pengamatan tinggi tanaman dilakukan setelah muncul daun
pertama sampai 30 hari setelah tanam. Selain itu dihitung nilai AUHPGC (area
under height of plant growth curve) dengan rumus yang dinyatakan oleh Van der
Plank (1963) sebagai berikut:
Keterangan:
yi+1= data pengamatan ke-i+1
yi = data pengamatan ke-i
ti+1 = waktu pengamatan ke-i+1
ti = waktu pengamatan ke-i
Pengaruh bakteri penghasil siderofor terhadap bobot basah, bobot kering, dan kadar air tanaman tomat. Bobot basah tanaman tomat diukur setelah panen dengan menggunakan timbangan digital. Bobot kering tanaman
diperoleh dengan cara mengeringkan terlebih dahulu tanaman yang dicabut
kemudian ditimbang sampai mendapatkan nilai bobot kering yang konstan. Kadar
Kadar air (%) = Bobot basah – Bobot Kering x 100%
Bobot Basah
Semua data yang diperoleh dari pengukuran daya kecambah, pertambahan
tinggi tanaman, nilai AUHPGC, bobot kering, bobot basah, dan kadar air tanaman
diubah dalam bentuk persentase peningkatan atau penurunan yang dibandingkan
dengan nilai kontrol masing-masing.
Analisis Data
Data populasi bakteri hasil isolasi dianalisis menggunakan uji t, dengan
bantuan program Minitab versi 13.3. Rancangan percobaan yang digunakan
untuk menentukan pengaruh bakteri penghasil siderofor terhadap pertumbuhan
tanaman adalah rancangan acak lengkap faktorial dengan varietas sebagai faktor
pertama dan isolat bakteri penghasil siderofor sebagai faktor kedua. Data ditata
menggunakan program Microsoft Excel 2007, kemudian dianalisis menggunakan
analisis ragam dengan program Statistical Analysis System (SAS) versi 9.1
Windows. Perlakuan yang berbeda nyata diuji lanjut dengan uji selang berganda
HASIL DAN PEMBAHASAN
Isolasi dan Reaksi Hipersensitif Bakteri Penghasil Siderofor Asal Cipanas dan Lembang
Daerah perakaran tanaman tomat sehat diduga lebih banyak dikolonisasi
oleh bakteri yang bermanfaat dan mendukung pertumbuhan tanaman yang dikenal
dengan PGPR. Siderofor merupakan salah satu senyawa yang dihasilkan PGPR
yang dapat membantu mencegah perkembangan patogen dengan cara mengikat
sebagian besar ion Fe3+ di daerah sekitar akar tanaman (Siddiqui & Shakeel 2009).
Berdasarkan hasil isolasi, kelimpahan populasi bakteri penghasil siderofor di
daerah Cipanas sebanyak 1,977 x 107 cfu/gram dan populasi di daerah Lembang
sebanyak 5,333 x 107 cfu/gram. Hasil analisis dengan menggunakan uji t
menunjukkan bahwa populasi bakteri penghasil siderofor di kedua tempat tersebut
tidak berbeda nyata.
Gambar 2 Zona berwarna jingga yang dibentuk bakteri penghasil siderofor pada media CAS
Bakteri hasil isolasi dari sampel Cp1, Cp2, Cp3, Lb1, dan Lb2 kemudian
dibiakkan kembali pada media NA. Isolat bakteri penghasil siderofor dari sampel
Cp1 sebanyak 12 isolat, Cp2 sebanyak 17 isolat, Cp3 sebanyak 13 isolat, Lb1
sebayak 12 isolat, dan Lb2 sebanyak 6 isolat. Total isolat bakteri penghasil
siderofor yang berhasil diisolasi dari lapangan sebanyak 60 isolat. Isolat hasil
isolasi kemudian diberi kode sesuai dengan nama daerah asal sampel dan
diurutkan sesuai urutan alfabet.
Bakteri-bakteri yang dipilih merupakan bakteri-bakteri yang berbeda
berdasarkan penampakan bentuk, ukuran, dan warna koloni yang diamati pada
permukaan media CAS. Kelimpahan populasi bakteri penghasil siderofor asal
Lembang lebih tinggi daripada bakteri penghasil siderofor asal Cipanas, tetapi
keragaman bakteri penghasil siderofor asal Lembang lebih rendah daripada
keragaman bakteri penghasil siderofor asal Cipanas. Hal ini diduga karena
perbedaan ekologi di kedua tempat tersebut. Faktor nutrisi, kimia, dan fisik yang
berbeda pada umumnya mempengaruhi keberadaan mikroba tanah, sehingga
diduga mempengaruhi kelimpahan dan keragaman bakteri penghasil siderofor di
kedua tempat tersebut.
Salah satu syarat utama suatu bakteri dapat dijadikan agens biokontrol
adalah tidak menimbulkan pengaruh negatif atau fitotoksisitas (Nawangsih 2006). Melalui uji reaksi hipersensitif (HR), bakteri penghasil siderofor diseleksi
berdasarkan patogenisitasnya. Isolat-isolat bakteri penghasil siderofor yang
bersifat HR positif tidak dapat digunakan sebagai agens antagonis. Hal ini karena
bakteri tersebut bersifat patogen dan dapat menyebabkan penyakit pada tanaman.
Hanya isolat-isolat bakteri penghasil siderofor yang bersifat HR negatif yang
dapat digunakan sebagai salah satu kandidat agens antagonis R. solanacearum.
Hasil uji reaksi hipersensitif dapat dilihat pada Tabel 1.
18
Tabel 1 Sifat patogenisitas isolat-isolat bakteri penghasil siderofor
Kode
Cp = kode isolat bakteri penghasil siderofor asal Cipanas. Lb = kode isolat bakteri penghasil siderofor asal Lembang. b)
+ = isolat bakteri bersifat patogen tumbuhan. - = isolat bakteri tidak bersifat patogen tumbuhan.
Antagonisme Bakteri Penghasil Siderofor terhadap R. solanacearum Uji antagonisme bakteri penghasil siderofor bertujuan menentukan
kemampuan penghambatan dari masing-masing isolat bakteri penghasil siderofor
terhadap pertumbuhan bakteri patogen R. solanacearum. Kemampuan
penghambatan bakteri penghasil siderofor terhadap R. solanacearum didasarkan
pada diameter zona bening yang terbentuk di sekitar koloni bakteri penghasil
siderofor. Semakin besar diameter zona bening yang terbentuk menunjukkan
bahwa semakin besar pula kemampuan isolat bakteri penghasil siderofor
Gambar 4 Zona hambatan hasil uji antagonisme bakteri penghasil siderofor terhadap R. solanacearum pada media agar King’s B
Tabel 2 Rata-rata zona hambatan hasil uji antagonisme bakteri penghasil siderofor terhadap R. solanacearum pada media agar King’s B
Kode
20
Berdasarkan uji antagonisme diketahui bahwa beberapa isolat bakteri
penghasil siderofor yang memiliki kemampuan antagonisme terhadap R.
solanacearum adalah isolat Cp1C, Cp2B, Cp2D, Cp3E, Lb1A, Lb1C, dan Lb1L.
Penghambatan bakteri penghasil siderofor terhadap pertumbuhan R.
solanacearum pada media King’s B diduga karena isolat bakteri penghasil
siderofor tersebut memiliki kemapuan menghasilkan senyawa antibiotik.
Antibiotik tersebut dapat mengganggu pertumbuhan dan metabolisme mikroba
lain (Pelczar & Chan 2009). Menurut Glick dan Pasternak (2003) salah satu
mekanisme plant growth promoting bacterium yang paling efektif dalam
menghambat proliferasi patogen adalah menyintesis antibiotik. Hasil pengujian
ini menunjukkan bahwa ada beberapa isolat bakteri penghasil siderofor yang
mampu menghambat pertumbuhan bakteri patogen R. solanacearum dan dapat
dijadikan kandidat agens antagonis untuk pengendalian penyakit tersebut. Cp2D
merupakan isolat yang mampu membentuk zona hambatan paling lebar yaitu 7
mm, sehingga memiliki kemampuan antagonisme paling tinggi di antara isolat
yang lain.
Agens biokontrol sering memiliki beberapa mekanisme yang berperan
secara bersama-sama dalam menekan patogen (Nawangsih 2006). Menurut
Budzikiewicz (2001) kemampuan siderofor mengikat Fe3+ merupakan pesaing
terhadap mikroorganisme lain. Keuntungan lain yang diperoleh dari bakteri
penghasil siderofor yang dapat menghasilkan antibiotik adalah senyawa antibiotik
tersebut dapat menghambat pertumbuhan patogen pada saat kontak lansung di
daerah perakaran tanaman. Mekanisme antagonis isolat-isolat bakteri penghasil
siderofor ini terhadap R. solanacearum bisa secara kompetisi dalam perebutan
unsur Fe dan menghambat pertumbuhan petogen dengan mengeluarkan senyawa
antibiotik.
Karakteristik Bakteri Penghasil Siderofor
Karakterisasi bakteri penghasil siderofor yang memiliki sifat antagonisme
terhadap R. solanacearum diperlukan untuk mengetahui sifat-sifat dari bakteri
tersebut. Menurut Pelczar dan Chan (2008) pengetahuan mengenai sifat-sifat
keterangan yang tidak ternilai bagi banyak aspek lain mengenai penelaahan,
penggunaan, dan pengendalian mikroorganisme. Bakteri penghasil siderofor yang
dikarakterisasi merupakan isolat-isolat hasil seleksi, yaitu yang memiliki
kemampuan antagonisme terhadap R. solanacearum dan tidak bersifat patogen.
Isolat-isolat tersebut adalah Cp1C, Cp2B, Cp2D, Cp3E, Lb1A, Lb1C, dan Lb1L.
Tabel 3 Ciri-ciri morfologi koloni bakteri penghasil siderofor yang berpotensi sebagai agens antagonis pada media agar King’s B
Isolata) Ciri koloni
Cp = kode isolat bakteri penghasil siderofor asal Cipanas. Lb = kode isolat bakteri penghasil siderofor asal Lembang.
Isolat-isolat bakteri penghasil siderofor yang potensial sebagai agens
antagonis umumnya berukuran ± 1 mm dengan warna koloni beragam antara putih
susu, putih pucat, putih tulang, putih kehijauan, dan kuning tua. Umumnya
isolat-isolat ini memiliki koloni dengan elevasi cembung, tepian licin, dan bentuk koloni
bundar. Selain itu ada yang memiliki elevasi seperti tombol atau berbuki-bukit,
tepian berombak atau seperti ikal rambut, serta bentuk yang keriput. Berdasarkan
pengamatan morfologi ini, diketahui ketujuh isolat tersebut memiliki morfologi
yang berbeda antara satu dengan lainnya. Diduga antara isolat yang satu dengan
yang lain bukan merupakan bakteri yang sama. Koloni bakteri penghasil
22
Gambar 5 Morfologi koloni bakteri penghasil siderofor yang berpotensi sebagai agens biokontrol, Cp1C (a); Cp2B (b); Cp2D (c); Cp3E (d); Lb1A (e); Lb1C (f); Lb1L (g)
f e
d c
b a
Tabel 4 Beberapa karakter bakteri penghasil siderofor yang potensial sebagai agens antagonis
Isolata) Menghasilkan senyawa
fluoresensb)
Gramc) Aktivitas
pelarutan fosfatd)
Tahan suhu 80 oCe)
Cp1C - - + +
Cp2B +++ - + -
Cp2D - - + +
Cp3E - - - -
Lb1A + - + -
Lb1C - + + +
Lb1L - - + +
a)
Cp = kode isolat bakteri penghasil siderofor asal Cipanas Lb = kode isolat bakteri penghasil siderofor asal Lembang b)
(+) = menghasilkan senyawa fluorescence; (-) = tidak menghasilkan senyawa fluorescence c)
(+) = kelompok Gram positif; (-) = kelompok Gram negatif d)
(+) = memiliki kemampuan melarutkan unsur fosfat; (-) = tidak memiliki kemampuan melarutkan unsur fosfat
e)
(+) = memiliki kemampuan bertahan hidup samapai suhu 80 oC; (-) = tidak memiliki kemampuan bertahan hidup samapai suhu 80 oC.
Gambar 6 Karakteristik bakteri penghasil siderofor isolat Cp2B dengan
fluoresens yang paling tinggi (a); isolat Lb1C memiliki kemampuan melarutkan fosfat yang paling tinggi terlihat dengan membentuk zona bening pada media Pikovskaya (b).
Isolat bakteri penghasil siderofor yang dapat memproduksi senyawa
fluoresens adalah Cp2B dan Lb1A (Tabel 4). Berdasarkan pengamatan secara
kualitatif, daya pendar isolat Cp2B tiga kali lipat daripada daya pendar Lb1A.
Fluoresens merupakan pigmen hijau-kuning yang dihasilkan oleh beberapa bakteri
dari kelompok Pseudomonas (Silva et al. 2006). Berdasarkan hasil ini, diduga
24
isolat Cp2B dan Lb1A merupakan bakteri yang termasuk dalam kelompok
Pseudomonas yang berfluoresensi. Menurut Glick dan Pasternak (2003) semua
produk fluoresens dari Pseudomonas secara stuktural barkaitan dengan siderofor
yang berbeda terutama dalam jumlah dan konfigurasi dari asam amino dan rantai
peptida yang membentuk ikatan utama.
Hasil uji Gram menunjukkan bahwa isolat bakteri penghasil siderofor
tersebut umumnya termasuk dalam kelompok Gram negatif (Tabel 4). Hanya
isolat Lb1C yang memiliki sifat Gram positif. Perbedaan antara bakteri Gram
negatif dan positif dijelaskan oleh Pelczar dan Chan (2008) yang menyatakan
bahwa bakteri gram negatif mengandung lipid, lemak, atau substansi seperti
lemak dalam persentase lebih tinggi daripada yang dikandung bakteri Gram
positif. Dinding sel bakteri Gram negatif juga lebih tipis dibandingkan dengan
dinding sel bakteri Gram positif.
Kemampuan bakteri dalam melarutkan unsur fosfat (P) sangat bermanfaat
dalam kondisi P kurang. Zona bening pada media Pikovskaya menunjukkan
bahwa bakteri penghasil siderofor tersebut mampu melarutkan fosfat dari bentuk
kalsium fosfat yang terkandung dalam media tersebut. Hasil pengujian
menunjukkan bahwa isolat bakteri penghasil siderofor yang memiliki kemampuan
melarutkan fosfat di antaranya adalah Cp1C, Cp2B, Cp2D, Lb1A, Lb1C, dan
Lb1L. Hanya isolat Cp3E yang terbukti tidak dapat melarutkan fosfat (Tabel 4).
Artinya sebagian besar isolat yang potensial ini tidak hanya memiliki kemampuan
menghasilkan siderofor, tetapi juga dapat melarutkan fosfat.
Unsur Fe meningkat dalam jumlah berlebihan dalam tanah yang masam (pH
rendah). Pada tanah masam, fosfat tidak dapat diserap maksimum oleh tanaman
karena terjerap oleh Al dan Fe, demikian pula peredaran fosfat dalam jaringan
tanaman akan terhambat. Dalam keadaan ini isolat bakteri penghasil siderofor ini
masih dapat melakukan fungsi lain yaitu membantu ketersediaan fosfat yang
kurang tersebut.
Karakter lain yang diamati adalah kemampuan tahan terhadap suhu 80 oC.
Umumnya sel bakteri dapat mati dalam waktu 5 sampai 10 menit pada suhu 60
sampai 70 oC dengan panas lembap. Beberapa bakteri di alam memiliki
suhu panas adalah bakteri yang mampu membentuk endospora (Pelczar & Chan
2008). Isolat bakteri penghasil siderofor yang memiliki kemampuan tahan suhu
panas sampai 80 oC adalah Cp1C, Cp2D, Lb1C, dan Lb1L (Tabel 4). Menurut
Pelczar dan Chan (2008) kebanyakan bakteri yang mampu membentuk endospora
adalah spesies yang memiliki morfologi sel berbentuk batang seperti dari genus
Bacillus.
Tabel 5 Persentase peningkatan daya kecambah tanaman tomat varietas
Arthaloka dan Ratna yang diberi perlakuan bakteri penghasil siderofor
Perlakuana) Peningkatan daya kecambah (%)b)c)
Arthaloka
Cp = kode isolat bakteri penghasil siderofor asal Cipanas. Lb = kode isolat bakteri penghasil siderofor asal Lembang. b)
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf nyata 5%.
c)
Tanda (-) di depan angka menunjukkan nilai yang lebih rendah dibandingkan dengan kontrol.
Berdasarkan hasil analisis statistika dengan taraf nyata 5%, faktor varietas
berpengaruh nyata terhadap daya kecambah tanaman tomat (Lampiran 2).
26
daripada rata-rata persentase peningkatan daya kecambah varietas Arthaloka
(-5,138%) (Tabel 5). Faktor isolat dan interaksi antara varietas dan isolat tidak
berpengaruh nyata terhadap persentase peningkatan daya kecambah tanaman
tomat (Lampiran 2).
Hasil analisis statistika untuk persentase peningkatan tinggi tanaman pada 5
sampai 30 HST menunjukkan bahwa pengaruh interaksi antara faktor varietas dan
isolat tidak berpengaruh nyata kecuali pada hasil pengamatan 5 dan 20 HST
(Tabel 6). Perlakuan yang memberi pengaruh nyata pada 5 HST adalah isolat
Cp2B untuk varietas Ratna bila dibandingkan isolat Cp1C, Cp2B, Cp2D, Lb1A,
Lb1C, dan Lb1L untuk varietas Arthaloka. Hasil pengamatan pada 20 HST
menunjukkan pengaruh isolat Cp2B berbeda nyata dengan perlakuan lainnya
kecuali dengan Cp1C untuk varietas Arthaloka, dan Lb1A, Lb1C, Lb1L untuk
varietas Ratna.
Faktor varietas, isolat, serta interaksi antara varietas dan isolat berpengaruh
nyata terhadap persentase peningkatan nilai AUHPGC (Lampiran 3). Rata-rata
persentase peningkatan nilai AUHPGC pada varietas Arthaloka (-10,49%) lebih
besar daripada persentase peningkatan nilai AUHPGC pada varietas Ratna
(-270,80%). Isolat Cp1C memilki rata-rata peningkatan nilai AUHPGC tertinggi
(334,0%) dan berbeda nyata bila dibandingkan dengan isolat lainnya. Pengaruh
isolat Cp1C untuk varietas Ratna berbeda dengan perlakuan lainnya kecuali
dengan Cp1C dan Lb1A untuk varietas Arthaloka.
Hasil ini menunjukkan bahwa pengaruh isolat yang paling dominan adalah
Cp1C. Isolat ini mampu meningkatkan persentase peningkatan tinggi tanaman
varietas Arthaloka dan Ratna lebih tinggi bila dibandingkan dengan isolat lain.
Nilai AUHPGC isolat ini meningkat sebesar 110,156% untuk varietas Arthaloka,
dan 557,899% untuk varietas Ratna. Diduga isolat ini mampu memacu
27
Tabel 6 Persentase peningkatan tinggi tanaman tomat varietas Arthaloka dan Ratna yang diberi perlakuan isolat bakteri penghasil siderofor
Perlakuana) Persentase pertambahan tinggi tanaman (%) pada n HST
b)c)d)
Cp = kode isolat bakteri penghasil siderofor asal Cipanas. Lb = kode isolat bakteri penghasil siderofor asal Lembang. b)
HST = hari setelah tanam. c)
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf nyata. d)
Tanda (-) di depan angka menunjukkan nilai yang lebih rendah dibandingkan dengan kontrol. e)
AUHPGC = Area Under Height of Plant Growth Curve.
28
Berdasarkan analisis statistika, faktor varietas tidak berpengaruh nyata
terhadap persentase peningkatan bobot basah tanaman tomat. Hal ini dijelaskan
oleh nilai –p (0,4276) yang lebih besar dari nilai α= 5% (Lampiran 5). Rata-rata
persentase peningkatan bobot basah varietas Arthaloka (-16,187%) tidak
berpengaruh nyata bila dibandingakan dengan rata-rata persentase peningkatan
bobot basah varietas Ratna (-21,887%). Faktor isolat tidak berpengaruh nyata
terhadap persentase peningkatan bobot basah tanaman tomat dengan nilai –p
(0,1248) lebih besar dari nilai α= 5%. Interaksi antara faktor varietas dan isolat
(-p= 0,2972) tidak berpengaruh nyata terhadap persentase peningkatan bobot basah
pada α= 5% (Lampiran 5).
Faktor varietas tidak berpengaruh nyata terhadap bobot kering tanaman
tomat. Hal ini dijelaskan oleh nilai –p (0,3321) lebih besar dari nilai α= 5%
(Lampiran 5). Rata-rata persentase peningkatan bobot kering varietas Arthaloka
(-20,161%) tidak berbeda nyata dengan rata-rata persentase peningkatan bobot
kering varietas Ratna (-25,694%). Faktor isolat tidak berpengaruh nyata terhadap
persentase peningkatan bobot kering tanaman tomat dengan nilai –p (0,4036)
lebih besar dari nilai α= 5%. Interaksi antara faktor varietas dan isolat (-p=
0,4612) tidak berpengaruh nyata terhadap rata-rata persentase peningkatan bobot
kering tanaman tomat dengan α= 5%.
Faktor varietas tidak berpengaruh nyata terhadap persentase peningkatan
kadar air tanaman tomat. Hal ini dijelaskan oleh nilai –p (0,8756) lebih besar dari
nilai α= 5%. Rata-rata persentase peningkatan kadar air varietas Arthaloka
(0,573%) tidak berbeda nyata dengan rata-rata peningkatan kadar air varietas
Ratna (0,6682%). Faktor isolat berpengaruh nyata terhadap kadar air tanaman
tomat dengan nilai –p (0,0002) lebih kecil dari nilai α= 5%. Rata-rata kadar air
tanaman tomat yang diberi perlakuan Lb1L (-6,086%) lebih kecil dan berbeda
nyata bila dibandingkan dengan perlakuan lainnya. Interaksi antara faktor varietas
dan isolat berpengaruh nyata terhadap kadar air tanaman tomat dengan nilai –p
(0,0235) lebih kecil dari nilai α= 5%. Uji lanjutan dilakukan untuk melihat
seberapa besar pengaruh interaksi tersebut. Hasil uji lanjut menunjukkan bahwa
terendah (-7,590%) dan berbeda nyata bila dibandingkan dengan perlakuan
lainnya kecuali dengan isolat Cp3E dan Lb1L untuk varietas Arthaloka.
Tabel 7 Persentase peningkatan bobot basah, bobot kering, dan kadar air
tanaman tomat varietas Arthaloka dan Ratna yang diberi perlakuan bakteri penghasil siderofor
Perlakuana) Bobot basah (%)b)c) Bobot kering (%)b)c) Kadar air (%)b)c)
Cp = kode isolat bakteri penghasil siderofor asal Cipanas. Lb = kode isolat bakteri penghasil siderofor asal Lembang. b)
Angka yang diikuti huruf yang sama pada kolom yang sama tidak berbeda nyata berdasarkan uji Duncan pada taraf nyata 5%.
c)
Tanda (-) di depan angka menunjukkan nilai yang lebih rendah dibandingkan dengan kontrol.
Persen kadar air yang lebih rendah menunjukkan penyusutan kadar air
tanaman yang lebih rendah pula. Tanaman yang memiliki penyusutan kadar air
rendah menunjukkan bahwa tanaman tersebut tidak sukulen. Tanaman yang tidak
sukulen berarti proses fotosintesis tanaman tersebut efisien, sehingga diduga hasil
30
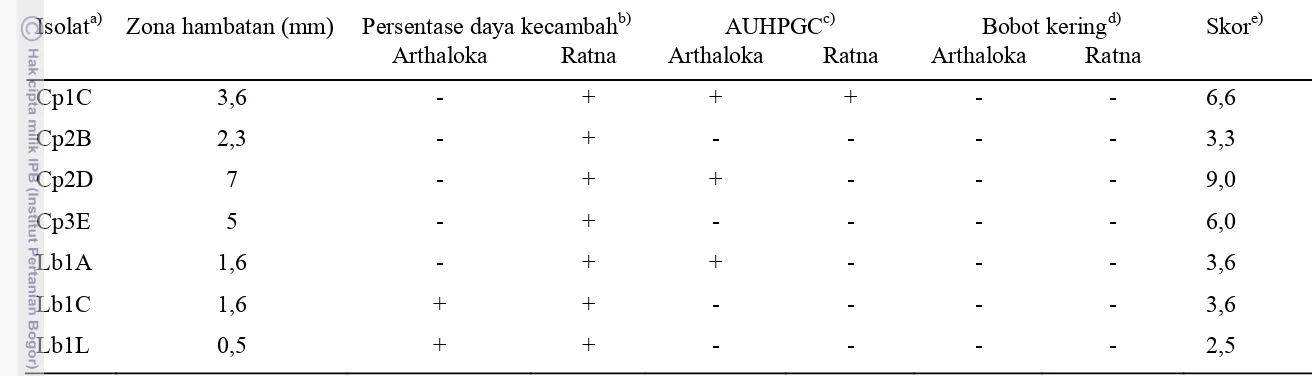
Berdasarkan Tabel 8 isolat bakteri penghasil siderofor yang memiliki sifat
unggul sebagai agens antagonis R. solanacearum adalah isolat Cp2D. Karakter
dari isolat ini adalah tidak menghasilkan senyawa fluoresens termasuk kelompok
Gram negatif, dapat melarutkan unsur fosfat, dan tahan pada perlakuan suhu
sampai 80 oC. Isolat ini memiliki kemampuan menghambat R. solanacerum
paling tinggi diantara isolat lainnya. Isolat ini berpengaruh positif terhadap
persentase peningkatan daya kecambah tanaman tomat varietas Ratna dan
persentase peningkatan nilai AUHPGC varietas Arthaloka. Dapat disimpulkan
bahwa isolat ini memiliki potensi yang cukup besar untuk digunakan sebagai
31
Tabel 8 Rangkuman karakter unggul bakteri penghasil siderofor yang potensial sebagai agens antagonis
Isolata) Zona hambatan (mm) Persentase daya kecambahb) AUHPGCc) Bobot keringd) Skore)
Cp = isolat bakteri penghasil siderofor asal Cipanas. Lb = isolat bakteri penghasil siderofor asal Lembang. b)
Kemampuan isolat bakteri penghasil siderofor dalam meningkatkan daya kecambah tanaman tomat. c)
Kemampuan isolat bakteri penghasil siderofor dalam meningkatkan nilai AUHPGC tanaman tomat. d)
Kemampuan isolat bakteri penghasil siderofor dalam meningkatkan bobot kering tanaman tomat. e)
Hasil penjumlahan untuk masing-masing indikator; tanda (+) memiliki nilai 1; tanda (-) memiliki nilai 0.
16
KESIMPULAN DAN SARAN
Kelimpahan populasi bakteri penghasil siderofor di Cipanas dan Lembang
tidak berbeda nyata. Kelimpahan populasi bakteri penghasil siderofor di daerah
Lembang sebanyak 5,333 x 107 cfu/gram dan populasi bakteri penghasil siderofor
di daerah Cipanas sebanyak 1,977 x 107 cfu/gram. Terdapat tujuh isolat bakteri
penghasil siderofor yang memiliki kemampuan antagonisme terhadap R.
solanacearum secara in vitro. Ketujuh isolat tersebut adalah Cp1C, Cp2B, Cp2D,
Cp3E, Lb1A, Lb1C, dan Lb1L. Isolat bakteri penghasil siderofor yang paling
besar penghambatannya terhadap R. solanacearum secara in vitro adalah Cp2D.
Isolat yang mampu memproduksi senyawa fluoresens adalah Cp2B dan Lb1A.
Isolat yang termasuk kelompok Gram positif adalah Lb1C dan yang termasuk
Gram negatif adalah Cp1C, Cp2B, Cp2D, Cp3E, Lb1A dan Lb1L. Isolat yang
mampu melarutkan fosfat adalah Cp1C, Cp2B, Cp2D, Lb1A, Lb1C, dan Lb1L.
Isolat yang tahan terhadap perlakuan suhu sampai dengan 80 oC adalah Cp1C,
Cp2D, Lb1C, dan Lb1L. Hasil analisis menunjukkan bahwa isolat bakteri
penghasil siderofor tidak berpengaruh nyata terhadap persentase peningkatan daya
kecambah tanaman tomat. Isolat Cp1C memiliki persentase peningkatan nilai
AUHPGC paling tinggi dibandingkan dengan perlakuan lain. Bakteri penghasil
siderofor tidak berpengaruh nyata terhadap persentase peningkatan bobot kering
dan bobot basah tanaman tomat. Isolat Lb1L berpengaruh terhadap persentase
penurunan kadar air tanaman tomat varietas Arthaloka dan Ratna.
Identifikasi lebih lanjut diperlukan untuk mengetahui spesies bakteri
penghasil siderofor yang potensial sebagai agens antagonis R. solanacearum.
Pengaruh bakteri penghasil siderofor perlu diamati sampai masa produksi tanaman
agar diperoleh data yang lebih bermanfaat.
33
DAFTAR PUSTAKA
Agrios GN. 2005. Plant Pathology. Ed ke-5. New York: Academic Press.
Alvarez B, Biosca EG, Lopez MM. 2010. On the life of Ralstonia solanacearum, a destructive bacterial plant pathogen. Current Research, Technology and Education Tropics in Applied Microbiology and Microbial Biotechnology 267-279.
Ashrafuzzaman M et al. 2009. Efficiency of plant growth-promoting rhizobcteria
(PGPR) for the enhancement of rice growth. African Journal of
Biotechnology 8(7): 1247-1252.
[BPS] Badan Pusat Statistik. 2010. Statistik Pertanian. Luas panen, rata-rata hasil dan produksi sayuran. Badan Pusat Statistik. Direktorat Bina Produksi Hortikultura. Ditjen Tanaman Pangan, Jakarta. http://www.bps.go.id/tab_sub/view.php?tabel=1&daftar=1&id_subyek=55& notab=2. [28 Agustus 2011]
Budzikiewicz H. 2001. Siderophore-antibiotic conjugates used as Trojan horses
against Pseudomonas aeruginosa. Current Topics in Medicinal Chemystry
1: 73-92.
Cahyono B. 2008. Tomat; Usaha Tani dan Penanganan Pascapanen.
Yogyakarta: Kanisius.
Chrisnawati, Nasrun, Arwiyanto T. 2009. Pengendalian penyakit bakteri nilam menggunakan Bacillus spp. dan Pseudomonad flouresen. Jurnal Penelitian Tanaman Industri 15: 116-123.
Damayanti I. 2010. Seleksi dan karakterisasi bakteri endofit untuk menekan
kejadian penyakit layu bakteri (Ralstonia solanacearum) pada tanaman
tomat [skripsi]. Bogor: Fakultas Pertanian, Institut Pertanian Bogor.
Datnoff LE, Elmer WH, Huber DM. 2009. Mineral Nutrition and Plant Desease.
St. Paul Minnesota: APS Press.
Denny TP, Hayward AC. 2000. Gram negative bacteria. Di dalam : Schaad NW,
Jones JB, Chun W, editor. Laboratory Guide for Identification of Plant
Pathogenic Bacteria. Ed ke-3. St. Paul Minnesota: APS Press.
Dey R, Pal KK, Bhatt DM, Chauhan SM. 2004. Growth promotion and yield
enhancement of peanut (Arachis hypogaea L.) by application of plant
growth-promoting rhizobacteria. Microbiological Research 159: 371-389.
Duriat AS et al.. 1997. Teknologi Produksi Tomat. Bandung: Balai Penelitian Tanaman Sayuran.
Ekin Z. 2010. Performance of phosphate solubilizing bacteria for improving growth and yield of sunflower (Helianthus annuus L.) in the presence of phosphorus fertilizer. African Journal of Biotechnology 9(25): 3794-3800.
34
Glick BR, Pasternak JJ. 2003. Moleculer Biotechnology: Principles dan
Applications of Recombinant DNA. Ed ke-3. Washington: ASM Press.
Janse JD. 2005. Phytobacteriology: Principles and Practice. London: CABI
Publishing.
Jeung Y, Kim J, Kang Y. 2007. Genetic diversity and distribution of Korean isolates of Ralstonia solanacearum. Plant Disease 91(10) : 1277-1287.
Meyer JM. 2000. Pyoverdins: pigments, siderophores and potential taxonomic markers of fluorescent Pseudomonas species. Arch. Microbiol. [abstrak] 174(3): 135-142.
Nasrun, Christanti, Arwiyanto T, Mariska I. 2007. Karakteristik fisiologis
Ralstonia solanacearum penyebab penyakit layu bakteri nilam. Jurnal
Penelitian Tanaman Industri 13 (2): 43-48.
Nawangsih AA. 2006. Seleksi dan karekterisasi bakteri biokontrol untuk
mengendalikan penyakit layu bakteri (R. solanacearum) pada tomat
[disertasi]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor.
Neilands JB. 1995. Siderophores: structure and fungtional of microbial iron
transport compounds. The Journal of Biologycal Chemistry 270(45):
26723-26726.
Pelczar MJ, Chan ECS. 2008. Dasar-dasar Mikrobiologi. Jilid 1. Hadioetomo
dkk, penerjemah. Jakarta: UI press. Terjemahan dari: Elements of
Microbiology.
Pelczar MJ, Chan ECS. 2009. Dasar-dasar Mikrobiologi. Jilid 2. Hadioetomo
dkk, penerjemah. Jakarta: UI press. Terjemahan dari: Elements of
Microbiology.
Purwati E. 2008. Hubungan antara karakteristik fenotipik buah tomat dengan jumlah biji. Journal Agrivigor 7(3): 222-229.
Rachid D, Ahmed B. 2005. Effect of iron and growth inhibitors on siderophores
production by Pseudomonas solanacearum. African Journal of
Biotechnology 4(7): 697-702.
Ramezanpour MR, Popov Y, Khavazi K, Rahmani HA. 2011. Molecular genosystematic and physiological characteristics of fluorescent pseudomonads isolated from the rice rhizophere of Iranian paddy fields. African Journal of Agricultural Research 6(1): 145-151.
Rao SWVB, Sinha MK. 1963. Phosphate dissolving microorganism in the soil and rhizosphere. Indian Journal of Agricultural Science 33: 272-278.
Semangun H. 2004. Penyakit-penyakit Tanaman Hortikultura di Indonesia.
Yogyakarta : UGM Press.
Siddiqui ZA, Shakeel U. 2009. Biocontrol of wilt disease complex of pigeon pea (Cajanus cajan (L.) Millsp.) by isolates of Pseudomonas spp.. African Journal of Plant Science 3(1): 001-01
Sigee DC. 1993. Bacterial Plant Pathology : Cell and Molecular Aspects.