UNTUK MENGENDALIKAN PENYAKIT LAYU BAKTERI
(
Ralstonia solanacearum
) PADA TOMAT
ABDJAD ASIH NAWANGSIH
Disertasi
sebagai salah satu syarat untuk memperoleh gelar Doktor pada
Program Studi Entomologi/Fitopatologi
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
ABDJAD ASIH NAWANGSIH. Seleksi dan karakterisasi bakteri bio-kontrol untuk mengendalikan penyakit layu bakteri (Ralstonia solanacearum) pada tomat. Dibimbing oleh BUDI TJAHJONO, ANTONIUS SUWANTO, MEITY SURADJI SINAGA dan GUSTAF ADOLF WATTIMENA.
Penyakit layu bakteri yang disebabkan oleh Ralstonia solanacearum merupakan salah satu penyakit penting pada beberapa tanaman pertanian di wilayah tropis, subtropis dan wilayah yang hangat di dunia. Penyakit ini penting selain karena sebaran geografisnya juga kisaran inangnya sangat luas. Pengendalian dengan senyawa antibiotik sintetis dikhawatirkan menimbulkan resistensi. Pengendalian dengan varietas tahan juga mengalami kendala karena patogen memiliki banyak ras. Cara pengendalian lain yang memungkinkan untuk dikembangkan dan relatif aman adalah pengendalian secara biologi menggunakan agens biokontrol.
Dalam penelitian ini agens biokontrol diisolasi dari rizosfer tanaman sehat yang terdapat pada pertanaman tomat yang terserang penyakit layu bakteri. Isolat yang diperoleh diuji kemampuan penghambatannya terhadap Ralstonia solanacearum melalui mekanisme antibiosis pada berbagai media agar dan kompetisi pada media King’s B cair.. Berdasarkan hasil pengujian tersebut diperoleh tiga isolat yang potensial dalam menekan perkembangan R. solanacearum. Ketiga isolat tersebut adalah: Bacillus subtilis AB89, RH4003 dan L32. Identifikasi berdasarkan karakterisasi sifat fisiologi dan sekuens sebagian dari 16S rDNA, isolat RH4003 adalah Pseudomonas fluorescens RH4003 dan isolat L32 adalah Bacillus cereus L32. Keefektifan pengendalian di rumah kaca oleh P. fluorescens dan B. cereus L32 masing-masing mencapai 62%, sedangkan di lapangan keefektifan pengendalian oleh B. subtilis AB89, P. fluorescens RH4003 dan B. cereus L32 berturut-turut adalah 35, 32 dan 22%. Ketiga agens biokontrol yang diuji tidak menimbulkan pengaruh fitotoksik dan hingga hari ke-24 setelah diaplikasikan ke dalam tanah, populasi agens biokontrol tetap tinggi, yaitu ± 107 cfu/gram akar.
Analisis mekanisme ketahanan pada tanaman inang yang mendapat perlakuan agens biokontrol menunjukkan bahwa P. fluorescens RH4003, B. subtilis AB89 dan B. cereus L32 mampu menginduksi ketahanan tomat melalui peningkatan aktivitas enzim peroksidase pada akar. Ketiga bakteri biokontrol tersebut juga menghasilkan siderofor. Selain itu B. subtilis AB89 dan B. cereus L32 diketahui menghasilkan enzim protease sedangkan P. fluorescens RH4003 tidak. Ketiga agens biokontrol tidak menghasilkan enzim kitinase dan HCN.
ABDJAD ASIH NAWANGSIH. Selection and caracterization of biocontrol bacteria to control the bacterial wilt disease (Ralstonia solanacearum) of tomato. Supervised by BUDI TJAHJONO, ANTONIUS SUWANTO, MEITY SURADJI SINAGA dan GUSTAF ADOLF WATTIMENA.
Bacterial wilt disease caused by Ralstonia solanacearum is one of the important disease on some comodities in tropical, subtropical and warmer area in the world. The disease is important not only because of the geografic distribution, but also because of its wide host range. Application of some antibiotics will caused of resistance. Disease control using the resistant varieties was difficult because the pathogen have some races. The other alternatives for disease control is the application of biocontrol agents.
In this experiments the biocontrol agents were isolated from the rhizosphere of healthy tomato among the one infected by tomato bacterial wilt. The isolates of biocontrol agents were investigated of their suppression to R. solanacearum by antibiosis mechanism in some agar media and their competitiveness in King’s B broth medium. From these experiment, three isolates were found potential to suppress the population of R. solanacearum. Identification based on the fisiological characteristics and partial sequence of 16S rDNA, the isolate RH4003 was identified as Pseudomonas fluorescens RH4003 while isolate L32 was identified as B. cereus L32. Control effectiveness in the green house of P.fluorescens RH4003 or B. cereus L32 was up to 62% while in the open field control effectiveness of B. subtilis AB89, P. fluorescens RH4003 and B. cereus L32 was up to 35, 32 and 22%, respectively. All of the biocontrol agents tested have no phytotoxic effects on seed viability and the growth of tomato seedlings and the population of biocontrol agents was still high, i.e. ± 107 cfu/gram root until 24 days after application into the soil.
P. Fluorescens RH4003, B. subtilis AB89 and B. cereus L32 were able to induced the host defence by increasing the activity of peroxidase in the root. The bacteria were also produce siderophore. B. subtilis AB89 and B. cereus L32 produced protease but P. fluorescens RH4003 was not. All of the biocontrol agents did not produce chitinase and HCN.
Mengandalikan Penyakit Layu Bakteri (Ralstonia solanacearum) pada Tomat
Nama : Abdjad Asih Nawangsih
NIM : P 086 00003
Disetujui Komisi Pembimbing
Dr. Ir. Budi Tjahjono, MAgr. Prof. Dr. Ir. Antonius Suwanto, MSc. Ketua Anggota
Dr. Ir. Meity Suradji Sinaga,MSc. Prof. Dr. Ir. G. A. Wattimena, MSc. Anggota Anggota
Diketahui
Ketua Program Studi Entomologi/ Dekan Sekolah Pascasarjana Fitopatologi
Dr. Ir. Sri Hendrastuti Hidayat, MSc. Dr. Ir. Khairil Anwar Notodiputro, MS.
UNTUK MENGENDALIKAN PENYAKIT LAYU BAKTERI
(
Ralstonia solanacearum
) PADA TOMAT
ABDJAD ASIH NAWANGSIH
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
© Hak cipta milik Institut Pertanian Bogor, tahun 2006 Hak cipta dilindungi
Penulis dilahirkan di Kudus, Jawa Tengah, pada tanggal 21 Juni 1965 sebagai anak ketiga dari tujuh bersaudara dari pasangan Abdul Djamil (alm.) dan Nasrifah (alm.). Pendidikan Dasar sampai Menengah Atas diselesaikan di Kudus, Jawa Tengah. Pendidikan sarjana ditempuh di Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian IPB, lulus pada tahun 1988. Pada tahun 1993, penulis diterima di Program Studi Entomologi/Fitopatologi pada Program Pascasarjana IPB dan menamatkannya pada tahun 1997. Kesempatan untuk melanjutkan ke program doktor pada program studi dan perguruan tinggi yang sama diperoleh pada tahun 2000. Beasiswa pendidikan pascasarjana diperoleh dari Program QUE (Quality Improvement of Undergraduate Education Project), Departemen Proteksi Tanaman, Fakultas Pertanian – IPB.
Penulis bekerja sebagai tenaga pengajar di Departemen Proteksi Tanaman, Fakultas Pertanian – IPB sejak tahun 1988. Bidang penelitian yang menjadi pilihan penulis adalah bakteriologi tumbuhan terutama pengendalian hayati bakteri patogen tumbuhan.
Selama mengikuti program S3, penulis menjadi anggota Perhimpunan Fitopatologi Indonesia (PFI), Perhimpunan Mikrobiologi Indonesia (Permi) dan The International Society of Southeast Asian Agricultural Sciences (ISSAAS). Sebuah artikel telah diterbitkan berjudul “Biological control of tomato bacterial wilt, Ralstonia solanacearum, by Bacillus sp. L32” pada Journal of ISSAAS Vol. 11, No. 2, November 2005. Artikel lain berjudul “Effects of tomato varieties and biocontrol mixtures to the effectiveness of Pseudomonas fluorescens RH4003” sudah dikirimkan ke Journal of ISSAAS. Karya-karya ilmiah tersebut merupakan bagian dari program S3 penulis.
BIODATA
Penulis dilahirkan di Kudus, Jawa Tengah, pada tanggal 21 Juni 1965 sebagai anak ketiga dari pasangan Abdul Djamil (alm.) dan Nasrifah (alm.). Pendidikan Dasar sampai Menengah Atas diselesaikan di Kudus, Jawa Tengah. Pendidikan sarjana ditempuh di Jurusan Hama dan Penyakit Tumbuhan, Fakultas Pertanian IPB, lulus pada tahun 1988. Pada tahun 1993, penulis diterima di Program Studi Entomologi/Fitopatologi pada Program Pascasarjana IPB dan menamatkannya pada tahun 1997. Kesempatan untuk melanjutkan ke program doktor pada program studi dan perguruan tinggi yang sama diperoleh pada tahun 2000. Beasiswa pendidikan pascasarjana diperoleh dari Program QUE (Quality Improvement of Undergraduate Education Project), Departemen Proteksi Tanaman, Fakultas Pertanian – IPB.
Penulis bekerja sebagai tenaga pengajar di Departemen Proteksi Tanaman, Fakultas Pertanian – IPB sejak tahun 1988. Bidang penelitian yang menjadi pilihan penulis adalah bakteriologi tumbuhan terutama pengendalian hayati patogen tumbuhan.
Selama mengikuti program S3, penulis menjadi anggota Perhimpunan Fitopatologi Indonesia (PFI), Perhimpunan Mikrobiologi Indonesia (Permi) dan The International Society of Southeast Asian Agricultural Sciences (ISSAAS). Sebuah artikel telah diterbitkan berjudul “Biological control of tomato bacterial wilt, Ralstonia solanacearum, by Bacillus sp. L32” pada Journal of ISSAAS Vol. 11, No. 2, November 2005. Artikel lain berjudul “Effects of tomato varieties and biocontrol mixtures to the effectiveness of Pseudomonas fluorescens RH4003” sudah dikirimkan ke Journal of ISSAAS. Karya-karya ilmiah tersebut merupakan bagian dari program S3 penulis.
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karuniaNya sehingga disertasi ini berhasil diselesaikan. Penelitian ini dilaksanakan sejak bulan Februari 2002 dengan judul Seleksi dan Karakterisasi Bakteri Biokontrol untuk Mengendalikan Penyakit Layu Bakteri (Ralstonia solanacearum) pada Tomat.
Disertasi ini terdiri dari empat bab yang merupakan pengembangan dari naskah artikel yang diajukan ke jurnal ilmiah. Artikel berjudul “Biological control of tomato bacterial wilt, Ralstonia solanacearum, by Bacillus sp. L32” telah diterbitkan dalam Journal of ISSAAS Vol. 11, No. 2, November 2005. Artikel lain berjudul “Effects of tomato varieties and biocontrol mixtures to the effectiveness of Pseudomonas fluorescens RH4003” sudah dikirimkan ke Journal of ISSAAS.
Ucapan terimakasih terutama penulis sampaikan kepada pembimbing, yaitu: Dr. Ir. Budi Tjahjono, MAgr, Prof. Dr. Ir. Antonius Suwanto, MSc., Dr. Ir. Meity Suradji Sinaga, MSc. dan Prof. Dr. Ir. G.A. Wattimena, MSc., yang telah banyak memberikan bimbingan dan saran selama penulis menempuh studi S3. Terimakasih juga penulis sampaikan kepada Prof. Dr. Kazuo SUYAMA dan Dr. Hiromitsu NEGISHI yang telah berperan sebagai pembimbing dan induk semang selama penulis melaksanakan penelitian di Laboratory of Phytopathology, Tokyo University of Agriculture.
Penulis juga menyampaikan penghargaan dan ucapan terimakasih yang sebesar-besarnya kepada Dr. Ir. Suryo Wiyono, MSc., Dr. Karden Mulya serta Dr. Ir. Widodo, MS., selaku Penguji Luar Komisi yang telah banyak memberikan kritik dan saran untuk perbaikan disertasi ini.
pengajar di Departemen Proteksi Tanaman, Fak. Pertanian-IPB atas dukungan moril yang diberikan sehingga penulis mampu menyelesaikan disertasi ini. Ungkapan terimakasih juga penulis sampaikan kepada Bapak (alm.), Ibu (alm.), Bapak mertua, Ibu mertua, suami, anak-anak dan seluruh keluarga atas segala doa dan kasih sayangnya. Tak lupa kepada rekan-rekan ENT/FIT: Bu Rini, Pak Heru dan yang lainnya yang tidak dapat saya sebutkan satu persatu, penulis mengucapkan banyak terimakasih atas bantuan dan kebersamaannya.
Penulis menyadari bahwa disertasi ini masih jauh dari sempurna, oleh karena itu kritik dan saran sangat diharapkan. Penulis berharap semoga karya ilmiah ini bermanfaat bagi pembaca.
Bogor, Juli 2006
DAFTAR TABEL ………. xi
Beberapa Teknik Pengendalian Penyakit Layu Bakteri ….. 7
Pengendalian Biologi Penyakit Layu Bakteri ……… 7
SELEKSI DAN IDENTIFIKASI BAKTERI BIOKONTROL UNTUK MENGENDALIKAN PENYAKIT LAYU BAKTERI PADA TOMAT YANG DISEBABKAN OLEH Ralstonia solanacearum ….………... 11
TERHADAP KEEFEKTIFAN PENGENDALIAN
PENYAKIT LAYU BAKTERI ……… 54
Abstrak ……… 54
Abstract ……….. 54
Pendahuluan ……… 55
Bahan dan Metode ……….. 56
Hasil dan Pembahasan ……… 59
Kesimpulan ………. 69
Daftar Pustaka ………. 73
KEEFEKTIFAN Pseudomonas fluorescens RH4003 DALAM MENGENDALIKAN PENYAKIT LAYU BAKTERI PADA BEBERAPA VARIETAS TOMAT ………. 72
Abstrak ……… 72
Abstract ……….. 72
Pendahuluan ……… 73
Bahan dan Metode ……….. 74
Hasil dan Pembahasan ……… 77
Kesimpulan ………. 84
Daftar Pustaka ………. 85
PEMBAHASAN UMUM ………. 87
KESIMPULAN ……… 98
DAFTAR PUSTAKA ……… 99
Halaman 1. Pengaruh jenis media terhadap pembentukan zone hambatan
oleh agens biokontrol ……….. 21 2. Pengaruh agens biokontrol terhadap pertumbuhan kecambah
tomat melalui penyiraman media tumbuh (germination sheets) … 25 3. Pengaruh agens biokontrol terhadap pertumbuhan kecambah
tomat setelah perlakuan perendaman benih (seed treatment) …… 25 4. Pengaruh aplikasi agens biokontrol melalui benih dan infestasi
tanah terhadap tinggi bibit di rumah kaca ……… 60 5. Keefektifan pengendalian (Index Penekanan) agens biokontrol
pada aplikasi tunggal dan kombinasi ……… 66 6. Nilai SF (Synergism Factor) dan jenis hubungan
beberapa kombinasi antar agens biokontrol ………. 68 7. Rata-rata keparahan penyakit layu bakteri pada enam varietas ... 79 8. Pengaruh aplikasi P. fluorescens RH4003 terhadap keparahan
penyakit layu bakteri pada tomat ... 80
9. Selisih keparahan penyakit pada beberapa varietas tomat yang tidak diberi agens biokontrol dengan yang diberi agens biokontrol ... 80 10. Populasi P. fluorescens RH4003 rifr pada permukaan akar dan
tanah rizosfer dari beberapa varietas tomat ………. 82 11. Aktifitas enzim peroksidase pada berbagai varietas tomat
setelah perendaman akar dengan P. fluorescens RH4003
Halaman
1. Bagan alir penelitian ... 5
2. Pot plastik yang digunakan untuk menumbuhkan benih tomat secara steril ……… 18
3. Pembentukan zone hambatan oleh agens biokontrol pada beberapa media uji ……… 22
4. Kemampuan penghambatan beberapa isolate agens biokontrol terhadap populasi R. solanacearum pada media cair KBB …….. 23
5. Pengaruh agens biokontrol terhadap perkembangan penyakit layu bakteri di dalam rumah kaca ……… 27
6. kemampuan agens biokontrol dalam menekan penyakit layu bakteri di lapangan ………. 27
7. Dinamika populasi agens biokontrol pada permukaan perakaran bibit tomat ……… 29
8. Sekuens parsial 16S rDNA isolat RH4003 (5’---3’) dengan primer 16S-2F dan primer 16S-3R ………. 30
9. Sekuens parsial 16S rDNA isolat l32 (5’---3’) dengan primer 16S-2F dan primer 16S-3R ……… 31
10. Karakter P. fluorescens RH4003 ……… 32
11. Karakter B. cereus L32 ………. 32
12. Bentuk koloni pada medium TSA ……… 33
13. Produksi asam dari xylosa oleh agens biokontrol ……… 33
14. Pengaruh perendaman akar tomat dengan agens biokontrol terhadap aktivitas enzim peroksidase ………... 45
15. Aktivitas proteolitik oleh B. cereus L32 dan B. subtilis AB89 pada medium King’s B agar yang mengandung skim milk 2% …… 47 16. Zimogram dari filtrat bakteri agens biokontrol tanpa pemurnian … 47
17. Aktivitas protease oleh B. subtilis AB89 dan B. cereus L32 setelah diinkubasikan selama 14 dan 24 jam pada suhu 28oC
dalam media King’B cair ……….. 48 18 Pembentukan siderofor (warna jingga) di sekeliling koloni bakteri … 50 19. Pengaruh aplikasi agens biokontrol terhadap keparahan penyakit
layu bakteri ……… 62 20. Keparahan penyakit layu bakteri tomat pada berbagai perlakuan
agens biokontrol secara tunggal dan campuran ……….. 66 21. Keparahan penyakit pada beberapa varietas tomat ……… 78
Halaman 1. Analisis ragam pengaruh aplikasi agens biokontrol pada benih
dan infestasi tanah pembenihan terhadap keparahan penyakit
pada pengamatan 26 – 34 hst ... 107 2. Analisis ragam pengaruh aplikasi agens biokontrol melalui
perendaman akar bibit terhadap keparahan penyakit pada
pengamatan 27 – 44 hst ... 107 3. Analisis ragam pengaruh aplikasi agens biokontrol melalui
perendaman akar bibit terhadap keparahan penyakit pada
pengamatan 13 – 22 hst ... 108 4. Analisis ragam pengaruh aplikasi agens biokontrol pada benih
dan infestasi tanah pembenihan terhadap tinggi bibit tomat di dalam rumah kaca pada pengamatan 10 – 24 hari setelah
aplikasi (has) ... 108 5. Analisis ragam pengaruh aplikasi agens biokontrol melalui
perendaman benih terhadap tinggi kecambah tomat (pengaruh fitotoksisitas) pada pengamatan 5 – 15 hari setelah aplikasi
(hsa) ... 108 6. Analisis ragam pengaruh aplikasi agens biokontrol melalui
penyiraman media tumbuh terhadap tinggi kecambah tomat (pengaruh fitotoksisitas) pada pengamatan 5 – 15 hari setelah
aplikasi (hsa) ... 109 7. Perbandingan sekuens parsial 16S rDNA dari isolat
RH4003 menggunakan primer 16S - 2F dengan data Gene
Bank NCBI ……… 110
8. Perbandingan sekuens parsial 16S rDNA dari isolat RH4003 menggunakan primer 16S - 2F dengan data Gene
Bank NCBI ……… 111
9. Perbandingan sekuens parsial 16S rDNA dari isolat
RH4003 menggunakan primer 16S – 3R dengan data Gene
Bank NCBI ……… 112
10. Perbandingan sekuens parsial 16S rDNA dari isolat
RH4003 menggunakan primer 16S – 3R dengan data Gene
Bank NCBI ……… 113
L32 menggunakan primer 16S - 2F dengan data Gene Bank
NCBI ………. 114
12. Perbandingan sekuens parsial 16S rDNA dari isolat
L32 menggunakan primer 16S - 2F dengan data Gene Bank
NCBI ………. 115
13. Perbandingan sekuens parsial 16S rDNA dari isolat
L32 menggunakan primer 16S - 2F dengan data Gene Bank
NCBI ………. 116
14. Perbandingan sekuens parsial 16S rDNA dari isolat
L32 menggunakan primer 16S – 3R dengan data Gene Bank
NCBI ……….. 117
15. Perbandingan sekuens parsial 16S rDNA dari isolat
L32 menggunakan primer 16S – 3R dengan data Gene Bank
NCBI ……….. 118
16. Perbandingan sekuens parsial 16S rDNA dari isolat
L32 menggunakan primer 16S – 3R dengan data Gene Bank
NCBI ……….. 119
Latar belakang
Penyakit layu bakteri yang disebabkan oleh Ralstonia solanacearum merupakan salah satu penyakit penting pada beberapa tanaman pertanian di wilayah tropis, subtropis dan wilayah yang hangat di dunia (Hayward 1991). Penyakit ini penting selain karena sebaran geografisnya juga kisaran inangnya sangat luas (Arlat et al. 1993). Luasnya kisaran inang tersebut menyebabkan pengendalian dengan sistem rotasi tanaman relatif sulit dilakukan.
Penyakit layu bakteri terutama menyerang tanaman dari famili Solanaceae. Salah satu spesies tanaman yang banyak terserang adalah tomat, Lycopersicon esculentum Mill (Young & Danesh 1994). Penyakit ini terutama merusak selama musim panas atau musim yang basah dan hangat. Pada tomat hibrida di Taiwan penyakit ini menyebabkan kehilangan produksi buah segar hingga 29% (Hartman et al. 1993; Hsu et al. 1993). Di Indonesia, selama tahun 2003 luas serangan yang diakibatkan penyakit ini adalah 159,7 Ha (Ditlin 2004).
Berbagai upaya pengendalian yang telah dilakukan antara lain dengan cara bercocok tanam dan penggunaan varietas tahan (Arlat et al. 1993). Beberapa keberhasilan telah dicapai dengan menggunakan kultivar komersial yang toleran terhadap bakteri ini (Trigalet et al. 1994) tetapi kultivar yang memiliki ketahanan tinggi belum dapat dikembangkan (Hsu et al. 1993). Walaupun beberapa varietas yang resisten telah dikembangkan tetapi ketahanannya seringkali patah apabila ditanam di daerah pertanaman lain. Hal tersebut terjadi karena adanya perbedaan ras atau biovar dari patogen dan/atau ketahanan yang tidak mencukupi pada kondisi yang menguntungkan patogen (Scott et al. 1993). Selain itu juga terdapat variasi genetik yang cukup besar diantara strain-strain dalam satu ras seperti yang berhasil diidentifikasi dari pertanaman tomat di Taiwan oleh Thierry & Wang (1998).
bakteri ini yang tidak berlendir (tidak virulen) apabila ditumbuhkan pada media yang mengandung tetracycline 4 ug/ml akan menghasilkan keturunan yang sebagian berlendir dengan laju pengurangan koloni yang tidak berlendir mencapai 71% sedangkan pada media yang mengandung terramycin 10 ug/ml laju pengurangannya 53% dibanding pada media tanpa antibiotik tersebut.
Adanya sifat oligogenik dari resistensi tanaman, besarnya perbedaan keagresifan isolat-isolat yang berbeda di seluruh dunia (Trigalet et al. 1994) dan adanya dampak negatif dari senyawa antibiotik maka perlu dicarikan alternatif pengendalian yang lebih aman. Cara pengendalian lain yang memungkinkan untuk dikembangkan dan relatif aman adalah pengendalian secara biologi menggunakan agens biokontrol.
Mekanisme pengendalian biologi yang berpotensi efektif yaitu yang berdasarkan pada kemampuan agens pengendali untuk berkompetisi pada rizosfer, menghasilkan antibiotik atau menginduksi suatu respons pada inang yang menguntungkan bagi pertumbuhan agens biokontrol dan/atau menghambat pertumbuhan R. solanacearum (Howie & Suslow 1991; Hartman & Elphinstone 1994). Penelitian tentang mikrob antagonis, seperti Pseudomonas fluorescens (Hsu et al. 1993; Hartman et al. 1993) dan Bacillus spp. (Shekhawat et al. 1993), telah dilaporkan efektif untuk pengendalian penyakit layu bakteri ini.
merupakan salah satu keuntungan dalam penggunaan agens biokontrol yang menghasilkan senyawa antibiotik.
Selama ini seleksi awal terhadap agens biokontrol yang potensial dilakukan berdasarkan adanya zone hambatan pada media agar. Hal tersebut dapat dilakukan hanya pada bakteri-bakteri yang menghasilkan senyawa-senyawa penghambat, seperti senyawa antibiotik atau siderofor. Pada bakteri-bakteri yang tidak menghasilkan senyawa penghambat, yang bersifat kompetitor, kemampuan penghambatannya kemungkinan tidak terdeteksi. Untuk itu dalam penelitian ini bakteri-bakteri yang tidak menghasilkan zone hambatan pada media agar akan diuji kemampuan penghambatannya terhadap populasi R. solanacearum dalam media cair.
Kemampuan suatu agens biokontrol dalam menekan patogen biasanya melibatkan satu atau beberapa cara atau mekanisme penghambatan. Mekanisme penghambatan yang terjadi antara agens biokontrol dengan patogen adalah: kompetisi ruang dan/atau nutrisi, antibiosis dan induksi resistensi. Pengetahuan tentang mekanisme penghambatan dapat membantu dalam aplikasi agar agens biokontrol bekerja efektif.
Kemampuan suatu agens biokontrol dalam menekan penyakit dapat ditingkatkan antara lain dengan memadukan dua atau lebih agens biokontrol. Dalam memadukan beberapa agens biokontrol perlu diperhatikan bahwa masing-masing tidak saling menghambat. Graham & Mitchell (1999) menyebutkan salah satu syarat untuk aplikasi dua atau lebih agens biokontrol secara bersama-sama adalah memiliki mekanisme pengendalian yang berbeda, misalnya kompetisi dan antibiosis. Selain kombinasi agens biokontrol, keefektivan pengendalian juga dapat ditingkatkan melalui cara aplikasi yang berbeda. Aplikasi agens biokontrol melalui benih diharapkan memberi perlindungan sejak awal munculnya tanaman melalui kolonisasi perakaran saat pertama muncul dari benih. Untuk agens biokontrol yang bersifat menginduksi ketahanan tanaman, perendaman akar bibit sebelum pindah tanam diharapkan dapat memberikan efek induksi lebih cepat.
sumber bahwa hal tersebut berkaitan dengan adanya exudat yang dikeluarkan oleh suatu spesies kemungkinan berbeda dengan spesies lain. Cieslinski et al. (1965 dalam Brimecombe et al. 2001) menyatakan bahwa jumlah senyawa asam organik dengan bobot molekul rendah yang dikeluarkan oleh akar dari lima kultivar gandum dan empat kultivar flax berbeda nyata antar kultivar. Perbedaan aktivitas bakteri diantara kultivar pada spesies yang sama berhubungan dengan perbedaan senyawa yang dikeluarkan oleh akar dari kultivar yang berbeda. Berdasarkan uraian tersebut maka pengaruh varietas terhadap keefektifan dan karakter agens biokontrol juga perlu diketahui kaitannya dengan pemanfaatan varietas tahan dalam mengendalikan penyakit layu bakteri pada tomat.
Tujuan Penelitian
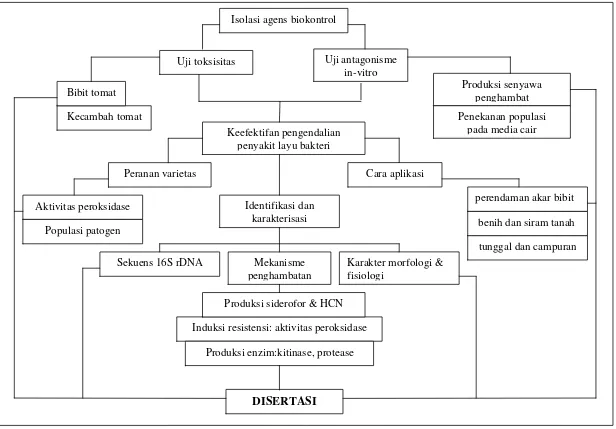
5 Uji toksisitas Uji antagonisme
in-vitro
Produksi senyawa penghambat Kecambah tomat
Bibit tomat
Penekanan populasi pada media cair Keefektifan pengendalian
penyakit layu bakteri
Cara aplikasi
tunggal dan campuran benih dan siram tanah
Mekanisme penghambatan
Induksi resistensi: aktivitas peroksidase Produksi enzim:kitinase, protease
Produksi siderofor & HCN Identifikasi dan
karakterisasi Peranan varietas
Aktivitas peroksidase
Sekuens 16S rDNA Karakter morfologi & fisiologi
perendaman akar bibit Populasi patogen
DISERTASI
TINJAUAN PUSTAKA
Penyakit layu bakteri
Di Indonesia, sejarah tentang penyakit ini banyak ditulis oleh Semangun (1994). Dalam bukunya tersebut antara lain Semangun menyatakan bahwa penyakit ini dilaporkan oleh Van Breda de Haan pada tahun 1897 terdapat pada pertanaman tembakau di Deli dan Pulau Jawa. Kemudian pada tahun 1901 Hunger melaporkan bahwa penyakit ini menyerang tanaman tomat di daerah Sumatera Barat dan Jawa Barat dan menyebabkan kehilangan hasil yang cukup tinggi. Pada tahun 1912 Van Hall melaporkan serangan penyakit ini pada tanaman kentang di daerah Karo, Sumatera Utara dan sejak itu penyakit ini terus menyebar ke daerah lain di Indonesia.
Gejala khas yang ditimbulkan oleh bakteri ini adalah terjadinya kelayuan, tanaman menjadi kerdil dan penguningan daun. Semakin muda umur tanaman yang terserang maka gejala yang ditimbulkan semakin parah (Brown et al. 1980). Pada tanaman dewasa, gejala awal berupa daun menguning kemudian sebagian tanaman menjadi layu, tanaman menjadi kerdil, akhirnya tanaman layu total dan mati (Semangun 1994). Pada tanaman tomat, gejala diawali dengan menguning nya tangkai daun pada waktu cuaca sangat panas selama beberapa hari. Pada tanaman yang layu seringkali terbentuk celah-celah kebasahan berwarna coklat. Untuk mengimbangi penyumbatan pada jaringan pembuluh, tanamn yang terserang seringkali membentuk akar-akar samping pada batang bagian bawah. Tanaman menjadi kerdil dan mengalami klorosis (Hartman & Elphinstone 1994)
Gejala pada bagian dalam tanaman umumnya sama. Apabila dibuat potongan memanjang maka jaringan pembuluh terlihat berwarna coklat. Jika batang dipotong melintang akan terlihat adanya ooze berwarna putih kotor hingga kecoklatan dan apabila dimasukkan ke dalam air maka akan terlihat aliran ooze seperti benang berwarna putih (Brown et al. 1980).
memproduksi enzim pectinesterase, cellulase, protease dan senyawa EPS (Hayward 1995).
Berdasarkan tabel yang dibuat oleh Cook & Sequeira (1994) bakteri yang dapat menyebabkan penyakit layu pada tanaman tomat termasuk dalam ras 1 atau 3 dan biovar 1, 2, 3, dan 4. Pengelompokan ke dalam ras didasarkan pada kisaran inang, sedangkan pengelompokan kedalam biovar didasarkan pada pemanfaatan senyawa gula dan gula alkohol tertentu.
Beberapa teknik pengendalian penyakit layu bakteri
Berbagai upaya sudah banyak dilakukan untuk mengendalikan penyakit layu bakteri pada tanaman tomat. Beberapa upaya pengendalian tersebut ada yang berhasil tetapi beberapa lainnya gagal. Hartman et al. (1993) menyatakan bahwa suatu senyawa bakterisida, Terlai, ternyata efektif dalam mengurangi penyakit layu di rumah kaca. Tetapi senyawa ini tidak dikomersialkan.
Pengendalian dengan sistem bercocok tanam yang dilaporkan berhasil adalah rotasi tanaman menggunakan jagung pada tanaman kentang di Peru (Elphinstone & Aley 1993). Di Indonesia, Machmud (1993) melaporkan bahwa rotasi tanaman selama 2 tahun dengan tanaman bukan inang, seperti padi atau jagung, dapat mengendalikan penyakit layu bakteri pada kacang tanah.
Teknik pengendalian yang secara potensial paling efisien adalah penanaman varietas tahan. Pada beberapa tanaman, seperti tembakau, terong, kentang, cabai, dan tomat sudah banyak ditemukan varietas-varietas yang tahan terhadap serangan bakteri layu (Hartman & Elphinstone 1994). Tetapi Akiew & Trevorrow (1994) tetap menyarankan untuk mengembangkan teknik pengendalian lain dan digunakan secara gabungan dengan tanaman resisten. Penggunaan tanaman resisten semata-mata sangat tidak direkomendasikan karena adanya kemungkinan perubahan patogen menjadi populasi yang lebih virulen.
Pengendalian biologi penyakit layu bakteri
dormannya oleh satu atau lebih organisme yang hidup bersama secara alamiah atau melalui manipulasi lingkungan, inang atau antagonis. Pengendalian biologi didasarkan pada antagonisme mikroba yang dapat bersifat langsung (kompetisi, antibiosis) atau tidak langsung (induksi resistensi inang)
Antagonisme langsung. Bakteri yang bersifat antagonis terhadap R. solanacearum telah diisolasi dari berbagai sumber, seperti misalnya tanah suppressive dan rizosfer tanaman inang (Trigalet et al. 1994). P. fluorescens, Bulkholderia cepacia dan P. gladioli dapat menghambat pertumbuhan R. solanacearum pada media. P. gladioli (Pg10) yang diaplikasikan dalam tanah 7 hari sebelum inokulasi R. solanacearum dapat mengurangi terjadinya layu hingga 60% dibanding kontrol (Hartman et al. 1993).
Produksi pigmen fluoresen berwarna kuning-hijau yang berfungsi sebagai siderofor oleh Pseudomonas kelompok fluoresen telah terbukti berperan dalam pengendalian berbagai penyakit tular tanah (Leong 1986; Weller 1988). Hal tersebut dibuktikan juga oleh Hsu et al. (1993) dari hasil penelitiannya bahwa apabila ditambahkan FeCl3 sebanyak 100 uM atau lebih ke dalam medium King’s B maka Pseudomonas kelompok fluorescens (FP) strain D-4, T-9-1, 14 dan G-59 tidak menghasilkan pigmen lagi dan juga kehilangan kemampuan untuk menghambat R. solanacearum.
Selain siderofor, beberapa bakteri Pseudomonas kelompok fluoresen ada yang menghasilkan senyawa beracun yaitu 2,4-Diacetylphloroglucinol (Phl). Senyawa Phl memiliki peranan penting dalam menekan berbagai patogen tular tanah (Keel et al. 1992; Raaijmakers et al. 1999). Raaijmakers et al. (1999) selanjutnya menyatakan bahwa produksi Phl di rizosfer gandum sangat erat hubungannya dengan kemampuan strain yang diintroduksikan dalam mengkolonisasi perakaran.
Pada tomat yang ditanam di rumah kaca, B. subtilis NB22 yang diisolasi dari kompos dapat menekan penyakit layu bakteri sampai 80% dibanding kontrol. Senyawa yang berperan pada agens antagonis ini adalah iturin yang melisis dinding sel (Phae et al. 1992; Bernal et al. 2002).
Keuntungan penggunaan agens biokontrol dari bakteri Gram positif, dalam hal ini Bacillus spp., antara lain adalah kemudahan dalam membuat formulasi. Mikroorganisme Gram positif yang bersporulasi membentuk spora yang tahan panas dan tahan kekeringan sehingga dapat diformulasikan dalam bentuk serbuk kering (Emmert & Handelsman 1999).
Resistensi terinduksi. Resistensi sistemik terinduksi (Induced Systemic Resistance = ISR) didefinisikan sebagai perlindungan sistemik pada tanaman yang ditimbulkan oleh suatu agens apabila diaplikasikan pada salah satu bagian tanaman (Kuc 1983). Secara klasik agens penginduksi dapat berupa patogen, patogen yang sudah dimatikan atau dilemahkan, bahan kimia sintetis, produk metabolit dari inang agens yang menginfeksi dan patogen yang inkompatibel (Liu et al. 1995).
Induksi resistensi tanaman inang sebagai akibat dari inokulasi buatan dengan strain virulen yang dimatikan dengan pemanasan, mutan avirulen atau strain R. solanacearum yang inkompatibel pada akar, batang dan daun tanaman inang telah banyak dilaporkan (Trigalet et al. 1994). Frey et al. (1993) menyatakan bahwa mutan hrp (GMI8171, GMI8172 dan GMI8173) yang diaplikasikan dapat menginduksi resistensi tanaman. Demikian juga mutan avirulen Str-10 yang diisolasi dari Strelitzia reginae (Str-10 op type) secara nyata dapat melindungi tanaman tomat dari penyakit layu bakteri (Arwiyanto et al. 1994).
R. solanacearum untuk pengendalian biologi layu bakteri pada tomat me-nimbulkan dugaan bahwa cara ini memungkinkan untuk diterapkan di lapangan. Menurut Frey et al. (1994) inokulasi dengan mutan avirulen tidak menimbulkan efek negatif terhadap hasil buah.
Penyebaran mutan ini secara sistemik sangat terbatas dan populasinya biasanya menurun, kemungkinan disebabkan aglutinasi oleh senyawa lektin tanaman dan/atau terjerap pada dinding sel tanaman (Sequeira 1982). Frey et al. (1994) menyatakan bahwa tiga bulan setelah inokulasi strain GMI8172 pada perakaran tomat, bakteri avirulen tersebut tidak pernah ditemukan pada jaringan tengah batang atau jaringan kambium. Hal tersebut berlawanan dengan bakteri yang virulen, yang menyebar secara sistemik ke seluruh tanaman yang terserang. Mutan yang sedikit virulen ternyata lebih dapat menginduksi pertahanan dibanding mutan yang benar-benar avirulen (Hara & Ono 1991).
Selain mutan avirulen dari patogen, agens penginduksi lain adalah dari kelompok PGPR (Plant Growth Promoting Rhizobacteria) yang telah dilaporkan dapat mengendalikan beberapa patogen tular tanah (Defago et al. 1990). Mekanisme pengendalian biologi oleh PGPR umumnya meliputi kompetisi (Elad & Chet 1987) atau produksi metabolit seperti siderofor yang berperan dalam antagonisme melawan patogen (Weller 1988). Pseudomonas kelompok fluoresen dan Bacillus merupakan contoh PGPR yang efektif untuk menekan penyakit (Leong et al. 1991). Mathre et al. (1999) menyatakan bahwa Bacillus juga menghasilkan spora sehingga mempunyai potensi untuk mampu bertahan hidup lebih lama.
MENGENDALIKAN PENYAKIT LAYU BAKTERI PADA TOMAT YANG DISEBABKAN OLEH Ralstonia solanacearum
(Selection and identification of biocontrol bacteria to control bacterial wilt disease of tomato caused by Ralstonia solanacearum)
ABSTRAK
Pengendalian penyakit layu bakteri menggunakan agens biokontrol masih sulit dilakukan karena agens biokontrol yang dikembangkan umumnya efektif di laboratorium tetapi seringkali gagal di lapangan dan bersifat spesifik lokasi. Berdasarkan hal tersebut pencarian agens biokontrol yang efektif baik di laboratorium maupun di lapangan masih perlu dilakukan. Penelitian ini dilakukan untuk menseleksi dan mengidentifikasi agens biokontrol yang potensial dalam mengendalikan penyakit layu bakteri pada tomat. Enam belas isolat agens biokontrol telah diuji kemampuannya untuk menekan keparahan penyakit layu bakteri pada tomat yang disebabkan oleh Ralstonia solanacearum. Salah satu isolat yang efektif menekan keparahan penyakit adalah Bacillus subtilis AB89. Berdasarkan karakterisasi dan identifikasi sekuens sebagian dari 16S rDNA, dua isolat lain yang efektif teridentifikasi sebagai Bacillus cereus L32 dan
Pseudomonas fluorescens RH4003. Percobaan di dalam rumah kaca
menunjukkan bahwa keefektifan pengendalian oleh P. fluorescens dan B. cereus
L32 masing-masing mencapai 62%. Berdasarkan hasil percobaan di lapangan, keefektifan pengendalian oleh B. subtilis AB89, P. fluorescens RH4003 dan B.
cereus L32 berturut-turut adalah 34, 30 dan 28%. Ketiga agens biokontrol yang
diuji tidak menimbulkan pengaruh fitotoksik terhadap daya kecambah benih dan pertumbuhan bibit tomat secara in-vitro maupun in-vivo di dalam rumah kaca. B.
subtilis AB89 membentuk zona hambatan pada media King’s B, NA, YDCA,
CPGA, CPMA dan CPMA-Ca2+ sedangkan P. fluorescens RH4003 hanya pada media King’s B, CPGA and CPMA-Ca2+. B. cereus L32 tidak membentuk zone hambatan pada semua media yang diuji. Populasi agens biokontrol tetap tinggi, ± 107 cfu/gram akar, pada hari ke-24 setelah diaplikasikan ke dalam tanah.
Kata kunci: Pseudomonas fluorescens, Bacillus sp., perlakuan benih
ABSTRACT
Ralstonia solanacearum. One of the isolate is Bacillus subtilis AB89, was effective to reduce index of the disease. Based on physiological characterization and partial sequence of 16S rDNA, the other two isolates were identified as
Bacillus cereus L32 and Pseudomonas fluorescens RH4003. Based on the green
house experiment, control effectiveness of P.fluorescens RH4003 or B. cereus
L32was more than 62%. In the open field, control effectiveness of B. subtilis
AB89, P. fluorescens RH4003 and B. cereus L32 was up to 35, 32 and 22%, respectively. All of the biocontrol agents tested have no phytotoxic effects on seed viability and the growth of tomato seedlings in-vitro or in-vivo in the green house. B. subtilis AB89 produced inhibition zone on media King’s B, NA, YDCA, CPGA, CPMA and CPMA-Ca2+ while P. fluorescens RH4003 only on media King’s B, CPGA and CPMA-Ca2+. B. cereus L32 did not produce inhibition zone on all media tested. At the 24th day after application into the soil, the population of biocontrol agents was still high, i.e. ± 107 cfu/gram root.
Keywords: Pseudomonas fluorescens, Bacillus sp., seed treatment
PENDAHULUAN
Isolasi dan seleksi merupakan langkah awal untuk mendapatkan agens
biokontrol yang potensial. Walaupun sudah banyak agens biokontrol yang
dikembangkan untuk mengendalikan penyakit layu bakteri tetapi penyakit ini
masih sulit dikendalikan karena umumnya agens biokontrol yang dikembangkan
masih bersifat spesifik lokasi atau kemampuannya berkurang di lapangan. Oleh
karena itu masih terbuka peluang untuk mencari dan menseleksi kandidat agens
biokontrol dari wilayah-wilayah yang belum diteliti.
Dalam melakukan seleksi agens biokontrol perlu dipilih metode yang
sesuai. Beberapa metode seleksi in-vitro tidak dapat memprediksi penampilan di
lapangan secara baik walaupun metode yang sesuai dapat memberi keuntungan
besar bagi program pengendalian biologi karena murah dan merupakan metode
standar. Secara umum, pengujian di lapangan seringkali terlalu sulit dilaksanakan
atau terlalu mahal untuk menseleksi isolat dalam jumlah yang besar (Andrews
1992).
Selama ini seleksi awal terhadap agens biokontrol yang potensial biasanya
dilakukan berdasarkan adanya zone hambatan pada media agar. Pada
bakteri-bakteri yang tidak menghasilkan senyawa penghambat tetapi bersifat kompetitor,
ini bakteri-bakteri yang tidak menghasilkan zone hambatan pada media agar akan
diuji kemampuan penghambatannya terhadap populasi R. solanacearum dalam
media cair dan kemampuan menekan penyakit layu bakteri pada tanaman tomat.
Menurut Johnson (1994) kemampuan agens biokontrol menekan penyakit
tergantung kerapatan populasi mikroorganisme antagonis, tetapi dalam kasus
Fusarium oxysporum, perbandingan kerapatan populasi antara yang patogen dan
bukan patogen lebih penting dibandingkan dengan nilai mutlak kepadatan
populasinya. Alabouvette et al. (1998) menyatakan bahwa untuk mengendalikan
penyakit, selain konsentrasi agens biokontrol harus tepat juga harus aktif dalam
mengekspresikan aktivitas antagonismenya.
Penelitian dilakukan untuk menseleksi beberapa agens biokontrol dan
melakukan identifikasi serta karakterisasi sifat-sifat fisiologi agens biokontrol
yang potensial dalam mengendalikan penyakit layu bakteri pada tomat.
BAHAN DAN METODE
Isolat patogen dan agens biokontrol
Isolat R. solanacearum KN118 (Ras 1, Biovar 3) yang digunakan dalam
percobaan ini diperoleh dari Dr Nishiyama, National Institute for
Agro-Environmental Sciences, Tsukuba. Agens biokontrol diisolasi dari rizosfer
tanaman tomat sehat yang terdapat pada pertanaman tomat yang mengalami
penyakit layu bakteri. Isolat yang diperoleh diuji kemampuannya menghambat R.
solanacearum pada berbagai media agar untuk mendeteksi mekanisme antibiosis
berdasarkan adanya zone hambatan. Isolat-isolat yang tidak menghasilkan zone
hambatan selanjutnya diuji kemampuannya menghambat R. solanacearum melalui
kompetisi pada media King’s B cair.
Berdasarkan hasil penapisan melalui pembentukan zone hambatan pada
medium King’s B agar dan kecepatan pertumbuhan pada isolat yang tidak
menghasilkan zone hambatan terpilih 16 isolat untuk digunakan dalam pengujian
selanjutnya. Enam belas isolat agens biokontrol tersebut diuji kemampuannya
dalam menghambat pertumbuhan populasi R. solanacearum secara in-vitro dan
kemampuannya menekan perkembangan penyakit layu bakteri di rumah kaca dan
Tokyo University of Agriculture, Japan, yaitu: Pseudomonas kelompok
fluorescence R4011 dan RH4003, Bacillus subtilis AB89 dan B. subtilis AN; satu
isolat Pseudomonas fluorescens Gi-19 merupakan koleksi dari Laboratorium
Bakteriologi Tumbuhan, Departemen Hama dan Penyakit Tumbuhan, Fakultas
Pertanian-IPB dan sebelas isolat agens biokontrol lainnya diisolasi dari
pertanaman tomat di Bogor dan Lembang, Jawa Barat.
Pengaruh media terhadap pembentukan zone hambatan
Biakan bakteri agens biokontrol pada media King’s B agar yang berumur
48 – 72 jam masing-masing disuspensikan dalam aquadest steril dan kerapatannya
diusahakan 108 - 109 cfu/ml. Semua media yang diuji dipanaskan hingga mencair
dan setelah suhunya kira-kira 45 – 50oC ditambahkan suspensi R. solanacearum
dengan kerapatan 1010 – 1011 cfu/ml. Setiap 9 ml media ditambah 1 ml suspensi
patogen dicampur hingga merata dan kemudian dituang ke dalam cawan petri
steril. Selanjutnya satu potongan kertas saring steril dengan diameter 8 mm yang
sudah dicelupkan ke dalam suspensi agens biokontrol diletakkan di tengah
permukaan agar. Sebagai kontrol, potongan kertas saring dicelupkan ke dalam
aquadest steril. Masing-masing agens biokontrol diuji sebanyak tiga kali dan
diameter zone hambatan diukur setelah inkubasi pada suhu ruang selama 3 – 4
hari. Media-media yang diuji adalah: NA (meat extract, 10 g; peptone, 10 g;
NaCl, 1.5 g; Agar, 15 g; Aquadest, 1000 ml); King`s B Agar 10% (Proteose
Kemampuan penghambatan bakteri pada media cair
Kandidat agens biokontrol yang tidak menghasilkan zone hambatan,
pengujian kemampuan antagonisme dilakukan dengan menumbuhkan
masing-masing agens biokontrol bersama-sama dengan patogen dalam media King’s B
adalah bakteri yang resisten secara spontan terhadap rifampisin 50 µg/ml.
Suspensi R. solanacearum dan agens biokontrol yang mempunyai kerapatan 105 –
106 cfu/ml, masing-masing diambil sebanyak 1 ml dan dimasukkan ke dalam
erlenmeyer yang berisi 50 ml KBB 10%. Sebagai kontrol, ke dalam erlenmeyer
ditambahkan 1 ml suspensi patogen dan 1 ml aquadest steril. Inkubasi dilakukan
pada suhu ruang dan digoyang menggunakan shaker dengan kecepatan 150
rpm/menit. Populasi R. solanacearum dihitung dengan metode pencawanan 24
jam setelah inkubasi. Pencawanan dilakukan secara duplo pada media King’s B
10% yang mengandung rifampisin 50 µg/ml. Penghitungan populasi R.
solanacearum dilakukan pada periode inkubasi 1, 3, dan 7 hari setelah inokulasi
dan pencawanan dilakukan sebanyak dua kali.
Pengaruh agens biokontrol terhadap pertumbuhan kecambah tomat (uji pengaruh fitotoksisitas)
Benih tomat hibrida varietas Big Fukujyu disterilkan dengan alkohol 70%
selama 5 menit kemudian direndam dalam NaOCl 1% selama 10 menit dan
selanjutnya dibilas dengan aquadest steril. Agens biokontrol diaplikasikan dengan
dua cara yaitu : 1. Kontaminasi kertas pembenihan (PC); 3 ml suspensi agens biokontrol dengan kerapatan 109 – 1010 cfu/ml dituangkan ke dalam cawan petri
sehingga membasahi kertas pembenihan. Untuk kontrol, kertas pembenihan
disiram dengan 3 ml aquadest steril. Selanjutnya sebanyak 50 benih steril
diletakkan di atas kertas tersebut; 2. Perlakuan benih (ST); sebanyak 50 benih yang sudah steril direndam dalam suspensi agens biokontrol selama 14 jam dan
kemudian diletakkan dalam cawan petri. Untuk kontrol, benih direndam dalam
aquadest steril. Masing-masing perlakuan dilakukan dengan tiga ulangan.
Masing-masing cawan petri tanpa penutup selanjutnya diberi kerudung
kantong plastik bening dan diletakkan di laboratorium dengan suhu 26 oC dan
diberi cahaya selama 12 jam. Pengukuran tinggi kecambah dilakukan pada
periode 5, 10, dan 15 hari setelah perlakuan.
Keefektifan agens biokontrol terhadap penyakit layu bakteri
Kemampuan agens biokontrol dalam menekan penyakit layu bakteri diuji
dengan cara perendaman akar bibit sebelum pindah tanam. Percobaan dilakukan
Rumah kaca. Bibit tomat yang berumur dua minggu setelah tanam dicabut dari media pembibitan dan setelah akarnya dicuci dengan air kemudian
direndam dalam suspensi agens biokontrol dengan kerapatan 109 – 1010 cfu/ml
selama 14 jam. Untuk kontrol, akar direndam dalam aquadest steril. Pot plastik
berukuran 20 cm x 20 cm x 40 cm diisi dengan tanah steril setinggi ± 8 cm
kemudian ditambahkan tanah yang sudah diinokulasi R. solanacearum setinggi ±
5 cm dan terakhir ditambahkan tanah steril setinggi ± 2 cm. Bibit yang sudah
direndam akarnya dalam suspensi agens biokontrol kemudian ditanam dalam
pot-pot tersebut. Tiap-tiap pot-pot ditanami dengan 10 bibit dan masing-masing
perlakuan diulang dua kali.
Keparahan penyakit dihitung menggunakan rumus Townsend dan
Hueberger (Unterstenhover 1963). Kriteria penyakit dihitung menggunakan skala
yang disebutkan oleh Arwiyanto et al. (1994) dengan beberapa modifikasi, yaitu:
0 = tidak ada gejala, 1 = 0 < kelayuan daun ≤ 10%, 2 = 10 < kelayuan daun ≤
30%, 3 = 30 , kelayuan daun ≤ 60%, 4 = 60 < kelayuan daun ≤ 90%, dan 5 = 90 <
kelayuan daun 100%. Rumus keparahan penyakit adalah :
5 ∑ ni x vi
i=0
Keparahan penyakit (%) = x 100% N x Z
ni = jumlah tanaman dengan skala penyakit ke-i
vi = skala penyakit ke-i
N = Jumlah tanaman pada tiap perlakuan Z = Skala penyakit tertinggi
Rumus index penekanan penyakit:
DIc – DIb
Indeks penekanan penyakit = x 100% Dic
DIc = Index penyakit pada kontrol
DIb = index penyakit pada perlakuan agens biokontrol
Lapangan. Metode aplikasi agens biokontrol dilakukan seperti pada percobaan di rumah kaca, kecuali umur bibit yang digunakan adalah tiga minggu
setelah tanam. Bibit yang sudah direndam kemudian ditanam pada plot percobaan
di luar rumah kaca yang sudah diinfestasi dengan R. solanacearum.
masing-masing perlakuan diulang dua kali. Tingkat keparahan penyakit, index
penyakit dan index penekanan penyakit dihitung menggunakan rumus seperti
disebut terdahulu.
Kemampuan agens biokontrol mengkolonisasi akar
Kemampuan agens biokontrol dalam mengkolonisasi perakaran diuji pada
bibit tomat di laboratorium secara “gnotobiotik” dengan dua perlakuan yaitu :
infestasi tanah dan perlakuan benih.
Kontaminasi tanah. Pot plastik transparan (AGRIPOT) berdiameter 8 cm dan tinggi 15 cm yang bertutup (Gambar 1) diisi dengan 55 g tanah dan
disterilkan pada suhu 121oC selama 15 menit. Tanah dalam pot disiram dengan
10 ml suspensi agens biokontrol yang memiliki kerapatan 109 – 1010 cfu/ml.
Benih tomat yang sudah disterilkan permukaannya ditanam dalam pot tersebut,
satu benih dalam satu pot. Pot-pot tersebut ditempatkan di laboratorium dengan
suhu 26oC dan 12 jam penyinaran.
Pada interval waktu tertentu bibit yang sudah tumbuh dicabut secara
hati-hati supaya perakarannya tidak banyak yang terputus. Partikel-partikel tanah yang
melekat di permukaan akar dihilangkan. Akar dipotong di dekat pangkal batang
dan dimasukkan ke dalam tabung reaksi yang berisi 10 ml aquadest steril. Setelah
dikocok menggunakan vortex selama 5 menit dan dilakukan pengenceran berseri.
Sebanyak 100 µl suspensi dari masing-masing pengenceran disebar pada
permukaan media King’s B agar dalam cawan petri. Cawan petri tersebut
diinkubasi pada suhu 26oC dan populasi agens biokontrol dihitung tiga hari
setelah inkubasi. Akar-akar yang ada dalam tabung reaksi kemudian diambil,
dikeringkan menggunakan kertas tissue dan ditimbang.
Perlakuan benih. Benih yang sudah steril direndam dalam suspensi agens biokontrol selama 14 jam. Benih kemudian ditanam dalam pot seperti yang
digunakan pada perlakuan kontaminasi tanah. Pada interval waktu tertentu
populasi agens biokontrol dihitung dengan metode yang sama dengan perlakuan
Gambar 2. Pot plastik yang digunakan untuk menumbuhkan benih tomat secara steril
Identifikasi dan karakterisasi sifat-sifat fisiologi agens biokontrol
Dua isolat agens biokontrol yaitu isolat RH4003 dan L32 selanjutnya
diidentifikasi dan dikarakterisasi sifat-sifat fisiologisnya. Karakterisasi dilakukan
dengan metode yang disebutkan dalam Klement et al. (1990) dan Schaad et al.
(2001). Identifikasi dilakukan berdasarkan sekuens parsial dari 16S rDNA
menggunakan BigDye Terminator v3.0 Ready Reaction Cycle Sequencing Kit.
Isolasi dan pemurnian DNA dilakukan berdasarkan metode yang dikemukakan
oleh Schaad et al. (2001).
DNA diekstraksi dengan phenol-chloroform kemudian diamplifikasi
menggunakan mesin PCR ( dengan primer 16S-1F : 5’AGTGGCGGACGG
GTGAGTAA3’ dan 16S-4R: 5’TGACGGGCGGTGTGTACAAG3’. Total
volume reaksi 20 µl yang terdiri dari 10xEx-Taq buffer 2 µl, dNTP 1,6 µl, primer
16S-1F 10 pmol/µl, primer 16S-4R 10 pmol/ µl, DNA template 0,5 µl atau 10 –
20 ng DNA, Ex-Taq 0,1 µl. Kondisi awal PCR terdiri dari denaturasi pada suhu
94oC selama 4 menit, pelekatan primer (annealing) pada suhu 64oC selama 30
detik dan ekstensi pada 72oC selama 2 menit diikuti dengan 35 siklus yang terdiri
pada suhu 64oC selama 30 detik dan ekstensi pada suhu 72oC selama 30 detik dan
ekstensi akhir pada 72oC selama 7 menit.
Sekuensing dilakukan menggunakan Big Dye Terminator V3.0 Kit
(Applied Biosystems, Tokyo) sesuai dengan instruksi produsen. Reaksi PCR
untuk sekuensing dilakukan dengan Gene Amp System 9600 (Perkin Elmer
Applied Biosystems, Tokyo). Amplifikasi parsial 16S rDNA (kurang lebih
1,3-kpb) dilakukan dengan 2 pasang primer, yaitu; 16S-2F: 5’TGCCA
GCAGCCGCGG3’ dan 16S-2R: 5’CCGCGGCTGCTGGCA3’ serta 16S-3F:
5’CCGCAA-CGAGCGCAA3’ dan 16S-3R: 5’TTGCGCTCGT TGCGG3’. Total
volume reaksi PCR untuk DNA yang akan disekuens adalah 20 µl yang terdiri
dari Terminator Ready Reaction Mix 8,0 µl, DNA template 20 ng, primer 3,2
pmol atau 3,2 µl dan air bebas ion sesuai kebutuhan. PCR untuk sekuensing
dilakukan sebanyak 25 siklus yang terdiri dari denaturasi pada suhu 96oC selama
10 detik, pelekatan (annealing) pada suhu 50oC selama 5 detik dan pemanjangan
(extension) pada 60oC selama 4 menit. Potongan DNA hasil amplifikasi
dipisahkan dari agarose gel menggunakan metode presipitasi ethanol sesuai
petunjuk produsen.
Sekuensing DNA dilakukan dengan mesin DNA sekuenser otomatis
Applied Biosystem prism 3100 (Perkin Elmer Applied Biosystems) dengan
perangkat Sequencing Analysis ver. 3.7 dan Data collection ver. 1.0.1. Data hasil
sekuensing dicocokkan dengan data Gene Bank NCBI menggunakan program
BLAST pada http://www.ncbi.nlm.nih.org.
HASIL DAN PEMBAHASAN
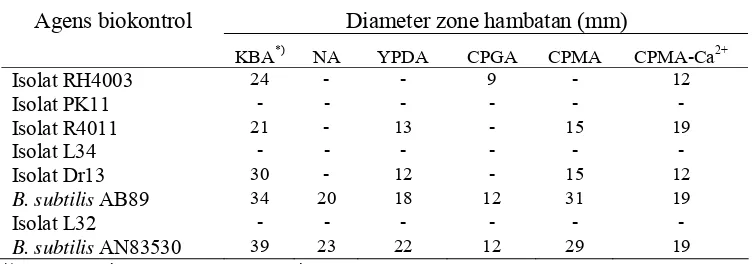
Kemampuan pembentukan zone hambatan pada berbagai jenis media agar Pembentukan zone hambatan akibat pemberian agens biokontrol ternyata
bervariasi pada berbagai media yang berbeda. Pada Tabel 1 terlihat bahwa isolat
RH4003 dan R4011 tidak menghasilkan zone hambatan pada media NA tetapi
pada media King’s B dan CPMA-Ca2+ keduanya menunjukkan hasil positif. Luas
ternyata King’s B mampu menstimulasi terbentuknya zone hambatan lebih baik
dibanding media lain. Media King’s B merupakan media yang memiliki
kandungan Fe sangat rendah yang sangat cocok bagi pembentukan siderofor oleh
P. fluorescens.
Penambahan elemen Ca2+ pada media CPMA ternyata dapat menginduksi
pembentukan zone hambatan oleh isolat RH4003 yang semula tidak terbentuk
pada media CPMA saja. Peningkatan konsentrasi senyawa antibiotik dalam
medium kemungkinan merupakan akibat meningkatnya permeabilitas dinding sel
yang dipengaruhi oleh Ca2+ yang mempunyai peranan penting dalam tahap akhir
dari sekresi suatu senyawa (Bernal et al. 2002).
Berdasarkan hasil tersebut diketahui bahwa untuk bekerja secara optimal,
suatu agens biokontrol memerlukan kandungan bahan kimia tertentu. Oleh
karena itu untuk mendeteksi adanya mekanisme antibiosis pada suatu agens
biokontrol perlu dilakukan pada berbagai media yang berbeda, karena suatu agens
biokontrol yang tidak menghasilkan zone hambatan pada suatu media
kemungkinan dapat menghasilkan zone hambatan pada media yang lain.
Pada NA yang merupakan medium yang kaya nutrisi, pembentukan zone
hambatan oleh agens biokontrol justru lebih rendah dibandingkan dengan pada
medium King’s B. Pada kondisi nutrisi yang cukup mikroorganisme tidak perlu
berkompetisi dalam memperoleh unsur hara sehingga menyebabkan agens
biokontrol kurang mendapat tantangan untuk memproduksi senyawa penghambat.
Jenis gula yang terkandung dalam media ternyata juga berpengaruh
terhadap pembentukan zone hambatan oleh bakteri tertentu. Isolat RH4003
membentuk zone hambatan pada media yang mengandung glukosa tetapi tidak
pada pada media yang mengandung mannitol maupun dextrosa. Hal tersebut
berbeda dengan isolat R4011 yang membentuk zone hambatan pada media yang
mengandung mannitol maupun dextrose tetapi tidak pada media yang
mengandung glukosa. Berdasarkan hasil penelitian terhadap mutan Bacillus sp.
yang memiliki aktivitas antibiotik, Bernal et al. (2002) melaporkan bahwa
mannitol merupakan sumber karbon yang lebih baik untuk produksi antibiotik dan
meningkatkan penghambatan terhadap patogen (Erwinia carotovora) dua kali
Penapisan agens biokontrol melalui deteksi pembentukan zone hambatan
pada media agar hanya dapat digunakan untuk menseleksi agens biokontrol
dengan mekanisme penghambatan secara antibiosis. Metode ini tidak dapat
digunakan untuk mendeteksi agens biokontrol yang mempunyai mekanisme
penghambatan berdasarkan kompetisi. Oleh karena itu keabsahan penentuan
suatu agens biokontrol hanya berdasarkan uji penghambatan pada media agar saja
perlu dipertanyakan.
Tabel 1. Pengaruh jenis media terhadap pembentukan zone hambatan oleh agens biokontrol Casamino acid Peptone Glucose Agar; CPMA = Casamino acid Peptone Mannitol Agar
Pengujian pada berbagai media agar juga dapat dijadikan sebagai sumber
informasi senyawa-senyawa yang dapat menginduksi produksi antibiotik oleh
agens biokontrol. Pada media dapat ditambahkan berbagai senyawa dalam
berbagai konsentrasi untuk melihat pengaruhnya terhadap luas zone hambatan
yang terbentuk. Informasi tersebut akan sangat diperlukan pada saat aplikasi di
lapangan.
Penambahan senyawa-senyawa atau unsur-unsur kimia yang dapat
memacu pembentukan antibiotik dari agens biokontrol di lapangan diharapkan
dapat meningkatkan kemampuannya menekan patogen. Wiyono (2003)
menyatakan bahwa H3BO3, MnSO4 dan ZnSO4 dapat memacu efek penghambatan
Gambar 3. Pembentukan zone hambatan oleh agens biokontrol pada beberapa media uji; a) B. subtilis AB89 pada media YPDA, b) B. subtilis
AB89 pada media CPGA, c) B. subtilis AB89 pada media NA, d) B.
subtilis AB89 pada media CPMA, e) B. subtilis AB89 pada media
CPMA-Ca2+ dan f) isolat RH4003 pada media CPMA-Ca2+
Faktor lain yang mempengaruhi pembentukan antibiotik nampaknya
ber-hubungan dengan berkurangnya nutrisi yang dibutuhkan untuk pertumbuhan sel.
Keterbatasan ini menstimulir diferensiasi yang, kaitannya dengan bakteri
kelompok bacilli, berarti pembentukan endospora. Sporulasi berkaitan dengan
sintesis dinding sel baru dan degradasi dinding sel pada sel induk (mother sel).
Dinding sel tersebut yang berperan sebagai antibiotik mengandung D-aminoacid,
a b
c d
dan diduga bahwa suatu metabolisme untuk pembentukan dinding sel dapat
menjadi prekursor bagi sintesis antibiotik (Bernal et al. 2002).
Kemampuan penghambatan bakteri pada media cair
Pengujian menggunakan media agar yang didasarkan pada adanya
pembentukan zone hambatan oleh agens biokontrol akan menghilangkan peluang
memperoleh agens biokontrol yang mempunyai mekanisme penghambatan
melalui kompetisi nutrisi atau kompetisi ruang. Untuk itu penggunaan kultur cair
dengan menumbuhkan patogen dan agens biokontrol secara bersama-sama dalam
suatu media yang terbatas jumlahnya diharapkan dapat mendeteksi adanya
kompetisi.
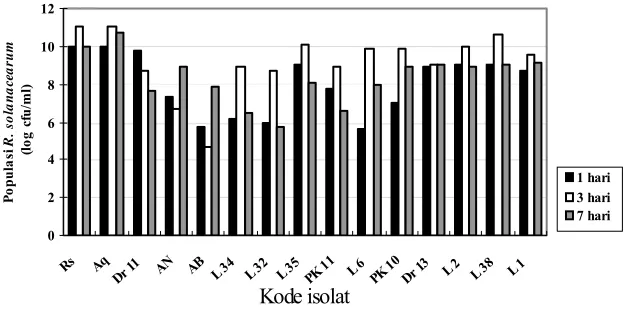
Berdasarkan uji perlakuan pada media cair, pada pengamatan 1 hari dan 3
hari setelah inokulasi, populasi R. solanacearum paling rendah terjadi pada biakan
yang diberi B. subtilis AB89 tetapi pada hari ke-7 setelah inokulasi isolat L32
memberikan penekanan paling tinggi. Dari data pada Gambar 4 terlihat bahwa
walaupun isolat L32 tidak meng-hasilkan zone hambatan pada media agar tetapi
memiliki kemampuan penekanan terhadap populasi R. solanacearum lebih tinggi
dibanding isolat Dr13 yang menghasilkan zone hambatan.
Gambar 4. Kemampuan penghambatan beberapa isolat agens biokontrol terhadap populasi R. solanacearum pada media cair KBB
Gambar 4 menunjukkan bahwa beberapa bakteri agens biokontrol (antara
lain isolat L32 dan L34) yang tidak menghasilkan zone hambatan pada media agar
ternyata dalam media cair mampu menekan populasi R. solanacearum. Walaupun
penekanan yang dihasilkan oleh isolat L32 dan L34 relatif lebih rendah
dibandingkan dengan yang dihasilkan oleh B. subtilis AB89 (kode isolate AB89)
tetapi relatif lebih tinggi dibandingkan dengan Dr13 yang juga menghasilkan zone
hambatan pada media agar.
Pengujian agens biokontrol menggunakan media agar maupun cair hanya
sebagai sarana seleksi awal terhadap agens biokontrol. Kedua cara tersebut belum
dapat dijadikan acuan untuk menentukan keefektifan suatu agens biokontrol
dalam menekan penyakit. Dalam pengujian ini agens biokontrol dan patogen
dipaksa untuk berhadapan langsung. Hal tersebut kemungkinan berbeda dengan
kondisi di lapangan. Di alam masing-masing mikroorganisme memiliki niche
ekologi yang berbeda. Oleh karena itu masih diperlukan pengujian lanjutan
menggunakan metode yang lebih mendekati kondisi alamiah yaitu pengujian di
rumah kaca menggunakan tanaman atau bahkan di lapangan.
Pengaruh agens biokontrol terhadap pertumbuhan kecambah tomat (uji fitotoksisitas)
Salah satu syarat utama suatu bakteri untuk dijadikan agens biokontrol
adalah tidak menimbulkan pengaruh negatif atau fitotoksisitas. Bakteri rizosfer
yang berhasil diisolasi sebelum diuji pada media agar maupun media cair terlebih
dahulu diuji kemampuannya dalam menimbulkan reaksi hipersensitif (HR) pada
daun tembakau. Isolat yang menghasilkan HR positif (muncul gejala nekrotik)
berarti bersifat patogenik sehingga tidak dapat dijadikan sebagai agens biokontrol.
Seperti pada pengujian menggunakan media agar, pengujian sifat HR juga tidak
menggambarkan pengaruh langsung terhadap tanaman tomat.
Aplikasi agens biokontrol seringkali dilakukan melalui perlakuan benih
dengan cara merendam benih dalam suspensi bakteri. Beberapa bakteri
kemungkinan dapat menyebabkan busuk pada benih setelah perendaman. Oleh
karena itu perlu dilakukan pengujian terhadap pertumbuhan kecambah dan bibit
Berdasarkan hasil pengujian, pemberian agens biokontrol melalui
penyiraman kertas pertumbuhan (germination sheets) ternyata tidak menimbulkan
pengaruh negatif atau fitotoksik terhadap pertumbuhan kecambah tomat (Tabel 2).
Keberadaan agens biokontrol pada tempat tumbuh bahkan cenderung lebih
meningkatkan pertumbuhan tanaman. Hal ini berbeda dengan pemberian agens
biokontrol melalui perendaman benih (Tabel 3).
Table 2. Pengaruh agens biokontrol terhadap pertumbuhan kecambah tomat melalui penyiraman media tumbuh (germination sheets)
Tinggi kecambah (mm) ± SD
**) Angka pada kolom yang sama dan diikuti huruf yang sama tidak berbeda nyata pada taraf 5% berdasarkan uji BNT.
Table 3. Pengaruh agens biokontrol terhadap pertumbuhan kecambah tomat setelah perlakuan perendaman benih (seed treatment)
Tinggi kecambah (mm) ± SD Agens Biokontrol
**) Angka pada kolom yang sama dan diikuti huruf yang sama tidak berbeda nyata pada taraf 5% berdasarkan uji BNT
Pada awal pertumbuhan benih setelah direndam dalam suspensi agens
biokontrol, isolat B. subtilis AN89 dan isolat L32 sedikit menekan pertumbuhan
kecambah. Tetapi 15 hari setelah perlakuan, pertumbuhan kecambah pada benih
Perendaman benih dalam suspensi P. fluorescens Gi19 dan isolat R4011
menyebabkan pertumbuhan kecambah tomat pada pengamatan 10 hst lebih rendah
dibandingkan dengan kontrol tetapi pada pengamatan 15 hst pertumbuhan
kecambah pada semua perlakuan dengan agens biokontrol tidak berbeda.
Kemampuan agens biokontrol dalam menekan penyakit layu bakteri tomat Untuk menguji keefektifan agens biokontrol dalam menekan penyakit layu
bakteri maka agens biokontrol diberikan melalui perendaman akar bibit tomat
sebelum pindah tanam.
Rumah kaca. Aplikasi agens biokontrol melalui perendaman akar bibit sebelum pindah tanam ternyata mampu menekan perkembangan penyakit. Pada
Gambar 5 terlihat bahwa isolat RH4003 dan L32 memberikan penekanan yang
sama pada pengamatan 45 hst walaupun pada awalnya isolat RH4003 kurang
mampu memberikan penekanan terhadap penyakit ini dibanding L32. Indeks
penekanan oleh isolat RH4003 dan L32 nilainya sama yaitu 62%.
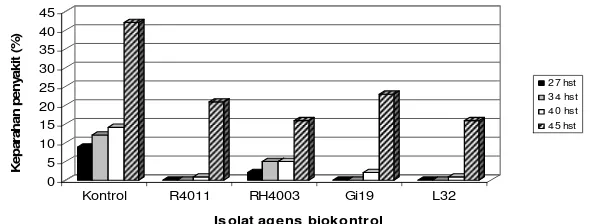
Lapangan. Pengaruh aplikasi agens biokontrol melalui perendaman akar bibit pada plot percobaan di luar rumah kaca disajikan dalam Gambar 6. Dalam
percobaan ini P. fluorescens Gi19 dan B. subtilis AB89 memberikan penekanan
terhadap perkembangan penyakit yang relatif paling besar dan konsisten hingga
tanaman berumur 22 hst.
Isolat bakteri L32 pada perlakuan ini relatif paling kecil penekanannya
dibanding isolat yang lain, tetapi pada pengamatan 22 hst penekanannya lebih
besar dibandingkan dengan isolat RH4003. Indeks penekanan oleh isolat L32, B.
subtilis AB89, Pf Gi19, isolat R4011 dan isolat RH4003 berturut-turut adalah: 28,
34, 24, 13 dan 30 %. Pada percobaan ini ternyata B. subtilis AB89 menghasilkan
indeks penekanan paling tinggi.
Index penekanan agens biokontrol di rumah kaca ternyata lebih
tinggi dibandingkan di lapangan. Isolat RH4003 di rumah kaca mampu menekan
keparahan penyakit hingga 62% tetapi di lapangan hanya 30%. Isolat L32 bahkan
lebih rendah lagi, di rumah kaca index penekanannya mencapai 62% sedangkan di
lapangan hanya 28%. Hal ini umum terjadi pada aplikasi agens biokontrol,
kaca suhu diusahakan stabil pada 26oC dengan menggunakan pemanas sehingga
kehidupan agens biokontrol tidak terpengaruh. Penggunaan tanah yang relatif
steril menyebabkan persaingan dengan mikroorganisme lain berkurang atau tidak
ada. Pertumbuhan tanaman di dalam rumah kaca juga relatif lebih baik
dibandingkan di lapangan sehingga lebih tahan terhadap serangan patogen.
Gambar 5. Pengaruh agens biokontrol terhadap perkembangan penyakit layu bakteri di dalam rumah kaca; agens biokontrol diaplikasikan dengan perendaman akar bibit tomat dalam suspensi agens biokontrol sebelum pindah tanam
Gambar 6. Kemampuan agens biokontrol dalam menekan penyakit layu bakteri di lapangan; aplikasi melalui perendaman akar bibit sebelum pindah tanam
Di lapangan, kondisi-kondisi tersebut tidak dapat dipertahankan seperti di
dalam rumah kaca. Suhu tanah di lapangan kemungkinan berubah-ubah dan
mikroorganisme di lapangan kemungkinan juga menjadi pesaing bagi agens
biokontrol yang diaplikasikan.
Kemampuan agens biokontrol mengkolonisasi perakaran tomat
Patogen R.solanacearum merupakan bakteri tular tanah yang dapat
menginfeksi tanaman melalui perakaran. Oleh karena itu salah satu syarat agar
dapat bekerja efektif maka suatu agens biokontrol harus dapat mengkolonisasi
daerah rizosfer dan rizoplane. Agens biokontrol yang mampu mengkolonisasi
rizosfer maupun rizosfer dapat melakukan kontak langsung dengan patogen. Bagi
agens biokontrol dengan mekanisme antibiosis maka senyawa antibiotik yang
dihasilkan dapat mengenai patogen sedangkan agens biokontrol yang bersifat
sebagai pesaing dapat menutup permukaan akar tempat penetrasi awal patogen.
Agens biokontrol yang mampu mengkolonisasi daerah rizosfer secara lebih cepat
dan lebih besar kemungkinan akan mampu bersaing dengan patogen secara lebih
baik.
Hasil penghitungan populasi agens biokontrol menunjukkan bahwa
populasi isolat-isolat bakteri yang bersifat fluoresen baik yang diaplikasikan
dengan penyiraman maupun melalui perendaman benih relatif stabil, yaitu ± 108
cfu/g akar. Aplikasi agens biokontrol melalui benih, menggunakan populasi awal
yang relatif lebih sedikit dibanding dengan penyiraman tanah, tetapi pada hari
ke-9 setelah perlakuan ternyata populasinya hampir sama dengan populasi bakteri
pada perlakuan penyiraman tanah dengan populasi awal yang lebih besar. Hal
tersebut berbeda dengan isolat agens biokontrol dari kelompok Bacillus spp. Pada
Gambar 7 terlihat bahwa populasi B. subtilis AB89 maupun isolat L32 mengalami
penurunan dan pada hari ke-25 populasi B.subtilis AB89 hanya sekitar 104 cfu/g
akar. Penurunan populasi B.subtilis AB89 kemungkinan ada kaitannya dengan
perbedaan habitat.
Isolat B. subtilis AB89 merupakan isolat yang berhasil diisolasi dari daun
padi, menghasilkan antibiotik kanosamine dan zwittermycin (Furuya et al. 1997).
Simon et al. (2001) menyatakan bahwa strain Bacillus pertumbuhannya relatif
terbatas dibanding strain Pseudomonas dan ada faktor spesifik dari inang yang
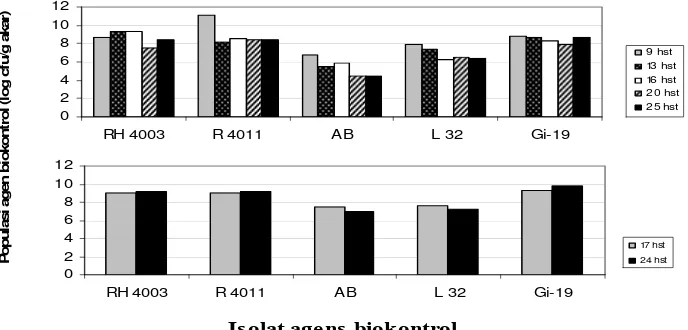
Gambar 7. Dinamika populasi agens biokontrol pada permukaan perakaran bibit tomat; aplikasi melalui perendaman benih (atas) dan penyiraman tanah (bawah).
Menurut Brimecombe et al. (2001) kolonisasi akar oleh bakteri terdiri dari
empat tahap, yaitu: pergerakan bakteri menuju permukaan akar tanaman secara
aktif (induksi spesifik terhadap aktifitas flagella secara kemotaksis), penempelan
pada akar, pelekatan (menempel lebih kuat) dan induksi ekspresi gen.
Gambar 7 menunjukkan bahwa untuk isolat RH4003, R4011 dan Gi19
aplikasi agens biokontrol melalui perendaman benih maupun penyiraman tanah
tidak mempengaruhi tingkat kolonisasi. Hasil ini memberikan gambaran bahwa
untuk aplikasi di lapangan lebih baik dilakukan melalui perendaman benih karena
lebih praktis dan efisien. Meskipun agens biokontrol yang diberikan hanya
sebanyak yang dapat melekat pada benih (jumlahnya relatif lebih kecil
dibandingkan dengan yang disiramkan ke dalam tanah) tetapi tingkat kolonisasi
pada rhizosfer tidak banyak berbeda dibandingkan dengan tingkat kolonisasi
melalui penyiraman tanah.
Identifikasi dan karakterisasi agens biokontrol
Berdasarkan hasil sekuensing parsial 16S rDNA (Gambar 8), isolat
RH4003 memiliki kesamaan 98% dengan P. fluorescens. Karakter fisiologi isolat
tersebut adalah : Gram negatif, tidak membentuk spora, menghasilkan senyawa Is olat age ns biokontrol