DENGAN BAHAN BAKU ETHYLENE
DENGAN KAPASITAS PRODUKSI 175.000 TON/TAHUN
TUGAS AKHIR
Diajukan Untuk Memenuhi Persyaratan Ujian Sarjana Teknik Kimia
OLEH :
NIM : 040405004
BOBBY YULANDIKA PUTRA
D E P A R T E M E N T E K N I K K I M I A
F A K U L T A S T E K N I K
UNIVERSITAS SUMATERA UTARA
M E D A N
Puji dan syukur penulis ucapkan ke hadirat Tuhan Yang Maha Kuasa atas berkat dan rahmatNya penulis dapat menyelesaikan Tugas Akhir yang berjudul:
PRA RANCANGAN PABRIK PEMBUATAN LINEAR LOW DENSITY
POLYETHYLENE (LLDPE) DENGAN BAHAN BAKU ETHYLENE DENGAN
KAPASITAS PRODUKSI 175.000 TON/TAHUN
Tugas akhir ini disusun untuk melengkapi tugas-tugas dan merupakan salah
satu syarat untuk mengikuti ujian sarjana pada Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara.
Dalam menyelesaikan tugas akhir ini penulis banyak menerima bantuan, bimbingan dan dukungan dari berbagai pihak, oleh karena itu penulis mengucapkan terima kasih kepada :
1. Bapak Dr. Ir. Fahmi, M.Eng., selaku dosen pembimbing dalam penyusunan tugas akhir ini
2. Ibu Farida Hanum, ST, selaku co-dosen pembimbing dalam penyusunan tugas akhir ini
3. Ibu Ir. Renita Manurung, MT., Ketua Jurusan Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara
4. Bapak M. Hendra Sahputra Ginting ST, MT., Sekretaris Jurusan Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara
5. Bapak Dr.Eng Ir. Irvan, M.Si, Koordinator Tugas Akhir Departemen Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara
6. Bapak dan Ibu dosen serta pegawai Program Studi Teknik Kimia, Fakultas Teknik, Universitas Sumatera Utara
7. Orangtua Penulis, yang telah banyak memberikan dukungan moril dan materil kepada penulis
8. Nenek di Padang, yang selalu mendukung penulis dan semua keluarga yang penulis sayangi
10. Bapak Tulus Hastono yang telah banyak memberikan input dan bimbingan mengenai LLDPE plant
11. Rizka Taufenda, Medi Hafiz dan Yudi Martian yang telah banyak memberikan support bagi penulis dalam penulisan tugas akhir ini
12. Arifin Suden atas kerjasamanya dalam penulisan tugas akhir ini
13. Sahabat-sahabat terbaik di Teknik Kimia USU yaitu Deni, Welly, Ija dan Idel 14. Teman-teman di Teknik Kimia, Andrikhe, Laswin, Fandi, Asrul, dan
teman-teman mahasiswa/i Teknik Kimia, khususnya stambuk 2004 yang memberikan banyak dukungan kepada penulis
15. Mas Kelik, Teman Kerja Praktek di Chandra Asri yang banyak memberikan informasi selama penulisan tugas akhir ini
16. Teman-teman OJT PT. CAPC yang telah membantu secara langsung maupun tidak langsung yang tidak dapat penulis sebutkan satu persatu
Medan, 5 Desember 2008 Penulis,
INTISARI
Salah satu sektor industri petrokmia yang berkembang cukup pesat saat ini yaitu industri petrokimia yang memproduksi polietilena (PE). Akan tetapi, hingga saat ini Indonesia masih mengandalkan produk impor untuk mencukupi kebutuhan domestik dalam konsumsi PE tersebut. Hal ini dikarenakan sampai sekarang hanya ada dua pabrik PE di dalam negeri yaitu PT. Chandra Asri Petrochemical Center (CAPC) dan PT. Petrokimia Nusantara Interindo (PENI) (Yeni H. Simanjuntak, 2007). Total hasil produksi PE dari PT. CAPC dan PT. PENI akan diekspor sebanyak 80.000 ton sedangkan untuk kebutuhan PE domestik akan diimpor 25-30 % dari total konsumsi PE domestik (Malini Hariharan, 2003).
Dengan minimnya produksi PE domestik mengakibatkan berbagai produk turunan PE terutama LLDPE akan diimpor terutama dari Asia dan Eropa Barat, dengan harga beli yang masih tergolong mahal. Dan mengingat Indonesia memiliki sumber daya migas yang cukup banyak dan potensial sehingga hal ini mendorong untuk dibuatnya suatu pra rancangan pabrik pembuatan Linear Low Density
Polyetylene (LLDPE) dengan tujuan mencukupi kebutuan LLDPE domestik.
LLDPE diproduksi 175.000 ton/tahun dengan 330 hari kerja dalam 1 tahun. Lokasi pabrik direncanakan di daerah Kawasan Industri Panca Puri di Jln. Raya Anyer Km. 123 Desa Ciwandan, Kotamadya Cilegon, Propinsi Banten dengan luas areal 15.330 m2, tenaga kerja yang dibutuhkan berjumlah 195 orang dengan bentuk badan usaha Perseroan Terbatas (PT) yang dipimpin oleh seorang direktur dengan struktur organisasi sistem garis dan staf.
Hasil analisa ekonomi Pabrik Pembuatan LLDPE adalah sebagai berikut : Total Modal Investasi : Rp. 3.022.942.882.405,-
Total Biaya Produksi : Rp. 4.260.489.468.562,- Hasil Penjualan : Rp. 5.090.261.305.909,- Laba Bersih : Rp 551.815.771.835,-
Profit Margin (PM) : 15,486 %
Break Even Point (BEP) : 53,359 %
Return on Investment (ROI) : 18,254 %
Pay Out Time (POT) : 5,478 tahun
Return on Network (RON) : 30,424 %
Internal Rate of Return (IRR) : 31,145 %
Halaman
KATA PENGANTAR ...i
INTISARI ... iii
DAFTAR ISI ... iv
DAFTAR GAMBAR ... viii
DAFTAR TABEL ... ix
BAB I PENDAHULUAN ... I-1
1.1 Latar Belakang ... I-1
1.2 Perumusan Masalah ... I-5
1.3 Tujuan Pra Rancangan ... I-6
1.4 Manfaat Pra Rancangan ... I-6
BAB II TINJAUAN PUSTAKA ... II-1
2.1 Sejarah Plastik ... II-1
2.2 Tinjauan Umum Polimer ... II-1
2.2.1 Karakteristik Polimer ... II-2
2.2.2 Proses Polimerisasi Secara Umum ... II-3
2.2.2.1 Polimerisasi Kondensasi (Step Polymerization) ... II-3
2.2.2.2 Polimerisasi Adisi (Chain Polymerization) ... II-4
2.2.3 Penggolongan Polimer ... II-10
2.2.4 Pemanfaatan Polimer... II-12
2.3 Polyethylene ... II-13
2.3.1 Teknologi Proses Polimerisasi Ethylene menjadi
Polyethylene ... II-14
2..3.1.1 Macam-macam Proses Pembuatan Polyethylene .... II-15
2.3.1.2 Perbandingan Proses Pembuatan Polyethylene... II-17
2.3.2 Klasifikasi Polyethylene ... II-18
2.4 Sifat Bahan Baku ... II-19
2.4.1 Bahan Baku Utama ... II-19
2.4.2 Bahan Baku Penunjang ... II-20
2.4.2.2 Nitrogen ... II-20
2.4.2.3 Hidrogen ... II-20
2.4.2.4 Katalis ... II-21
2.4.2.5 Co-catalyst ... II-22
2.5 Deskripsi Proses ... II-22
BAB III NERACA MASSA ...III-1
BAB IV NERACA ENERGI ... IV-1
BAB V SPESIFIKASI PERALATAN ... V-1
BAB VI INSTRUMENTASI DAN KESELAMATAN KERJA ... VI-1
6.1 Instrumentasi ... VI-1
6.2 Keselamatan dan Keselamatan Kerja... VI-7
6.3 Keselamatan Kerja pada Pabrik Pembuatan LLDPE ... VI-8
6.3.1 Pencegahan terhadap Kebakaran dan Peledakan ... VI-8
6.3.2 Peralatan Perlindungan Diri... VI-9
6.3.3 Keselamatan Kerja terhadap Listrik ... VI-10
6.3.4 Pencegahan terhadap Gangguan Kesehatan ... VI-10
6.3.5 Pencegahan terhadap Bahaya Mekanis ... VI-10
BAB VII UTILITAS ... VII-1
7.1 Kebutuhan Uap (Steam) ... VII-1
7.2 Kebutuhan Air ... VII-1
7.2.1 Screening ... VII-5
7.2.2 Sedimentasi ... VII-5
7.2.3 Klarifikasi ... VII-5
7.2.4 Filtrasi ... VII-6
7.2.5 Demineralisasi ... VII-7
7.2.5.1 Penukar Kation (Cation Exchanger) ... VII-7
7.2.5.2 Penukar Anion (Anion Exchanger) ... VII-8
7.2.6 Deaerator ... VII-10
7.3 Kebutuhan Bahan Kimia ... VII-10
7.4 Kebutuhan Listrik ... VII-10
7.5 Kebutuhan Bahan Bakar ... VII-11
7.6.1 Bak Penampungan (BP) ... VII-14
7.6.2 Bak Pengendapan Awal (BPA)... VII-14
7.6.3 Bak Netralisasi (BN) ... VII-15
7.6.4 Unit Pengolahan Limbah dengan Sistem Activated
Sludge (Lumpur Aktif) ... VII-16
7.6.5 Tangki Sedimentasi (TS) ... VII-19
7.7 Spesifikasi Peralatan Utilitas ... VII-19
BAB VIII LOKASI DAN TATA LETAK PABRIK ... VIII-1
8.1 Lokasi Pabrik ... VIII-1
8.2 Tata Letak Pabrik ... VIII-3
8.3 Perincian Luas Tanah ... VIII-4
BAB IX ORGANISASI DAN MANAJEMEN PERUSAHAAN... IX-1
9.1 Organisasi Perusahaan ... IX-1
9.1.1 Bentuk Organisasi Garis ... IX-2
9.1.2 Bentuk Organisasi Fungsionil... IX-2
9.1.3 Bentuk Organiasi Garis dan Staf... IX-3
9.1.4 Bentuk Organisasi Fungsionil dan Staf ... IX-3
9.2 Manajemen Perusahaan ... IX-3
9.3 Bentuk Hukum Badan Usaha ... IX-4
9.4 Uraian Tugas, Wewenang, dan Tanggung Jawab ... IX-6
9.4.1 Rapat Umum Pemegang Saham (RUPS) ... IX-6
9.4.2 Dewan Komisaris ... IX-6
9.4.3 Direktur ... IX-6
9.4.4 Sekretaris ... IX-7
9.4.5 Manager Produksi ... IX-7
9.4.6 Manager Teknik ... IX-7
9.4.7 Manager Umum dan Keuangan ... IX-8
9.4.8 Manager Pembelian dan Pemasaran... IX-8
9.5 Sistem Kerja ... IX-8
9.6 Jumlah Karyawan dan Tingkat Pendidikan ... IX-10
9.7 Sistem Penggajian ... IX-11
9.9 JAMSOSTEK dan Fasilitas Tenaga Kerja ... IX-14
BAB X ANALISIS EKONOMI ... X-1
10.1 Modal Investasi ... X-1
10.1.1 Modal Investasi Tetap (MIT) ... X-1
10.1.2 Modal Kerja / Working Capital (WC) ... X-3
10.1.3 Biaya Tetap (Fixed Cost) ... X-4
10.1.4 Biaya Variabel (Variabel Cost) ... X-5
10.2 Total Penjualan ... X-5
10.3 Bonus Perusahaan ... X-5
10.4 Perkiraan Rugi/Laba Usaha ... X-5
10.5 Analisa Aspek Ekonomi ... X-6
10.5.1 Profit Margin (PM)... X-6
10.5.2 Break Even Point (BEP) ... X-6
10.5.3 Return on Investment (ROI) ... X-7
10.5.4 Pay Out Time (POT) ... X-7
10.5.5 Return on Network (RON) ... X-8
10.5.6 Internal Rate of Return (IRR) ... X-8
BAB XI KESIMPULAN ... XI-1
DAFTAR PUSTAKA ... xiii
LAMPIRAN A PERHITUNGAN NERACA MASSA ... LA-1
LAMPIRAN B PERHITUNGAN NERACA ENERGI ... LB-1
LAMPIRAN C PERHITUNGAN SPESIFIKASI PERALATAN ... LC-1
LAMPIRAN D PERHITUNGAN SPESIFIKASI PERALATAN UTILITAS ... LD-1
Gambar 1.1 Produsen Kimia dan Petrokimia Domestik ... I-4
Gambar 2.1 Katalis Ziegler - Natta ... II-22
Gambar 6.1 Instrumentasi pada Pompa ... VI-4
Gambar 6.2 Instrumentasi pada Tangki Gas ... VI-4
Gambar 6.3 Instrumentasi pada Tangki Cairan ... VI-5
Gambar 6.4 Instrumentasi pada Reaktor ... VI-5
Gambar 6.5 Instrumentasi pada Cooler ... VI-6
Gambar 6.6 Instrumentasi pada Flash Drum ... VI-6
Gambar 6.7 Instrumentasi pada Mixer ... VI-7
Gambar 6.8 Instrumentasi pada Pelletizer ... VI-7
Gambar 6.9 Instrumentasi pada Belt Conveyor ... VI-7
Gambar 6.10 Instrumentasi pada Product Purge Bin (PPB) ... VI-8
Gambar 8.1 Tata Letak Pabrik Pembuatan LLDPE dengan skala 1:1100 ... VIII-6
Gambar 8.2 Tata Letak Areal Proses pada Pabrik Pembuatan LLDPE
Dengan skala 1 : 640 ... VIII-7
Gambar 8.2 Tata Letak Areal Utilitas pada Pabrik Pembuatan LLDPE
Dengan skala 1 : 235 ... VIII-8
Gambar LC-1 Bagian dari fluidized bed reactor (R-201) ...LC-46
Gambar LD-1 Sketsa Sebagian Bar Screen (dilihat dari atas) ... LD-2
Gambar LD-2 Grafik Entalpi dan Temperatur Cairan pada Cooling Tower ... LD-57
Gambar LD-3 Kurva Hy terhadap 1/(Hy*– Hy) ... LD-58
Gambar LE-1 Harga Peralatan untuk Tangki Penyimpanan (Storage) dan
DAFTAR TABEL
Tabel 1.1 Data Statistik Produksi dan Konsumsi Petrokimia Nasional ... I-2
Tabel 1.2 Data Statistik Harga PE – Eropa Barat tahun 2004-2005 ... I-5
Tabel 1.3 Data Statistik Harga PE – Asia tahun 2005 ... I-5
Tabel 2.1 Perbedaan Antara Mekanisme Polimerisasi Kondensasi
Dengan Polimerisasi Adisi ... II-5
Tabel 2.2 Contoh Polimer Alam ... II-10
Tabel 2.3 Contoh Polimer Statistik ... II-11
Tabel 2.4 Perbandingan Proses Pembuatan Polyethylene ... II-17
Tabel 2.5 Struktur HDPE, LDPE dan LLDPE... II-19
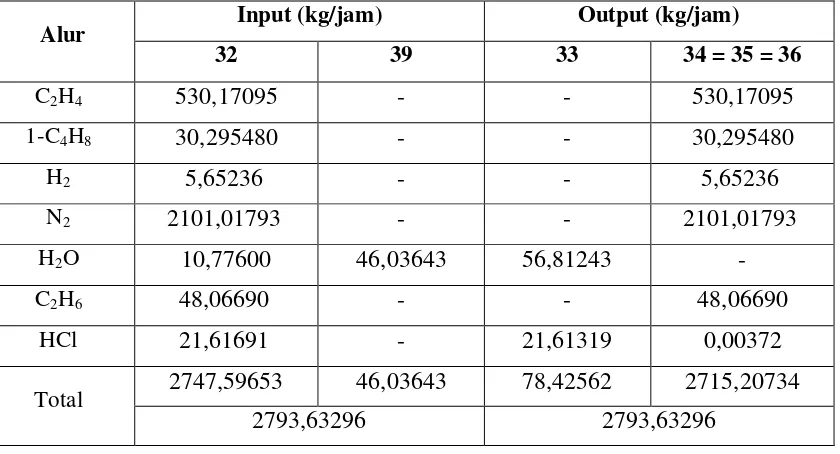
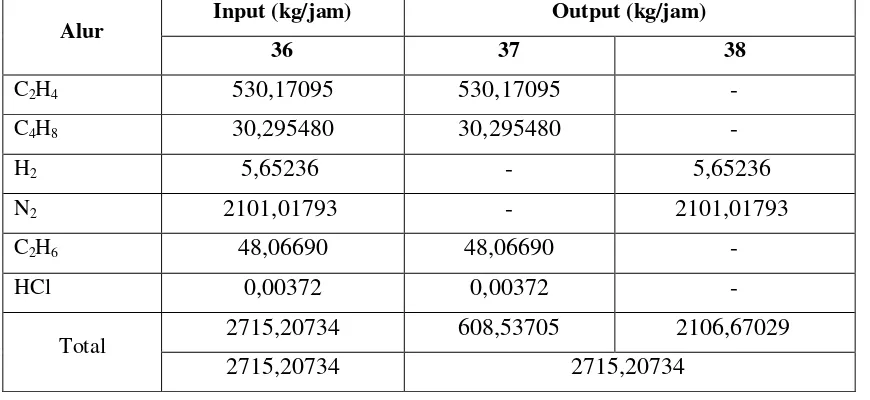
Tabel 3.1 Neraca Massa Splitter I (S-101) ...III-1
Tabel 3.2 Neraca Massa Mix Point I (S-201) ...III-1
Tabel 3.3 Neraca Massa Splitter II (S-301) ...III-1
Tabel 3.4 Neraca Massa Mix Point II (S-201) ...III-2
Tabel 3.5 Neraca Massa Fluidized bed reactor (R-201) ...III-2
Tabel 3.6 Neraca Massa Product Chamber (V-201)...III-2
Tabel 3.7 Neraca Massa Product Blow Tank (V-202) ...III-3
Tabel 3.8 Neraca Massa Product Purge Bin (R-301) ...III-3
Tabel 3.9 Neraca Massa Mixing Tank (M-301) ...III-4
Tabel 3.10 Neraca Massa Pelletizer (PE-301) ...III-4
Tabel 3.11 Neraca Massa Scrubber (V-301) ...III-4
Tabel 3.12 Neraca Massa Flash Drum (V-302) ...III-5
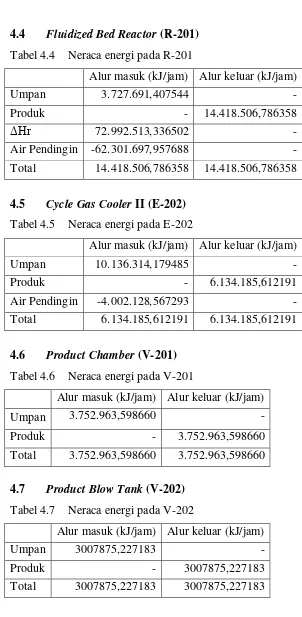
Tabel 4.1 Neraca Energi Heater (E-101) ... IV-1
Tabel 4.2 Neraca Energi Cycle Gas Cooler (E-201) ... IV-1
Tabel 4.3 Neraca Energi Mix Point I (S-201) ... IV-1
Tabel 4.4 Neraca Energi Fluidized bed reactor (R-201) ... IV-2
Tabel 4.5 Neraca Energi Cooler (E-202) ... IV-2
Tabel 4.6 Neraca Energi Product Chamber (V-201) ... IV-2
Tabel 4.7 Neraca Energi Product Blow Tank (V-202) ... IV-2
Tabel 4.8 Neraca Energi Mix Point II (S-302) ... IV-3
Tabel 4.9 Neraca Energi Product Purge Bin (R-301) ... IV-3
Tabel 4.11 Neraca Energi Heater (E-301) ... IV-3
Tabel 4.12 Neraca Energi Pelletizer (PE-301) ... IV-4
Tabel 4.13 Neraca Energi Scrubber (V-301) ... IV-4
Tabel 4.14 Neraca Energi Cooler (E-302) ... IV-4
Tabel 4.15 Neraca Energi Flash Drum (V-302) ... IV-4
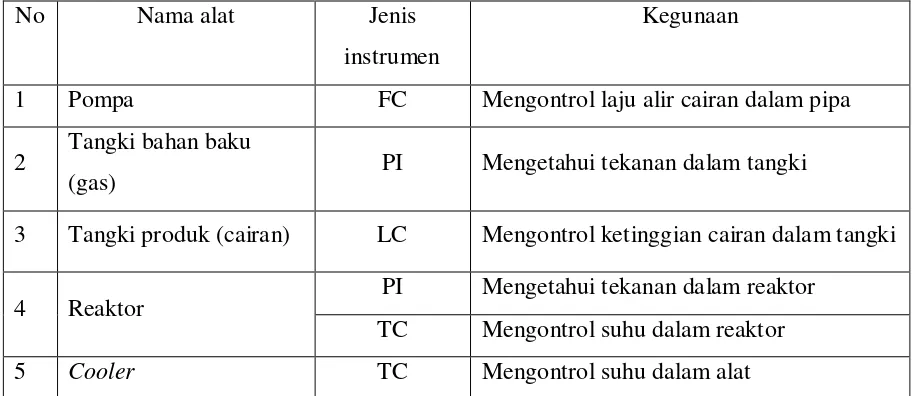
Tabel 6.1 Daftar Penggunaan Instrumentasi pada Pra Rancangan
Pabrik Pembuatan LLDPE ... VI-3
Tabel 7.1 Kebutuhan Uap (Steam) Pabrik ... VII-1
Tabel 7.2 Kebutuhan Air Pendingin Pabrik ... VII-2
Tabel 7.3 Pemakaian Air Untuk Berbagai Kebutuhan ... VII-3
Tabel 7.4 Kualitas Air Sungai Teluklada, Jawa Barat ... VII-4
Tabel 8.1 Perincian Luas Tanah ... VIII-5
Tabel 9.1 Susunan Jadwal Shift Karyawan ... IX-9
Tabel 9.2. Jumlah Karyawan dan Kualifikasinya ... IX-10
Tabel 9.3 Perincian Gaji Karyawan ... IX-11
Tabel LA-1 Data Laju Alir Alur 3-21 ... LA-5
Tabel LB-1 Nilai Konstanta a, b, c, d dan e untuk Perhitungan Cp Gas ... LB-1
Tabel LB-2 Nilai Konstanta a, b, c, d dan e untuk Perhitungan Cp Cairan ... LB-2
Tabel LB-3 Konstribusi Unsur dan Gugus untuk Estimasi Cp ... LB-2
Tabel LB-4 Konstribusi Gugus untuk Estimasi Data ∆Hof(298K)
(Kj/mol) ... LB-3
Tabel LB-5 Panas Reaksi Pembentukan Senyawa Lainnya ... LB-4
Tabel LB-6 Data Perhitungan Panas Laten ... LB-4
Tabel LB-7 Nilai Panas Laten ... LB-5
Tabel LB-8 Neraca Energi pada E-202 ... LB-6
Tabel LB-9 Neraca Energi pada input S-201 ... LB-7
Tabel LB-10 Neraca Energi pada output S-201 ... LB-7
Tabel LB-11 Neraca Energi pada E-201 ... LB-8
Tabel LB-12 Neraca Energi pada input R-201 ... LB-9
Tabel LB-13 Neraca Energi pada output R-201 ... LB-9
Tabel LB-14 Neraca Energi pada input V-201 ...LB-11
Tabel LB-15 Neraca Energi pada output V-201 ...LB-11
Tabel LB-17 Neraca Energi pada output V-202 ...LB-12
Tabel LB-18 Neraca Energi pada S-302 ...LB-13
Tabel LB-19 Neraca Energi pada input R-301 ...LB-14
Tabel LB-20 Neraca Energi pada output R-301 ...LB-15
Tabel LB-21 Neraca Energi pada E-301 ...LB-15
Tabel LB-22 Neraca Energi pada S-303 ...LB-16
Tabel LB-23 Neraca Energi pada M-301 ...LB-16
Tabel LB-24 Neraca Energi pada input PE-301 ...LB-17
Tabel LB-25 Neraca Energi pada output PE-301...LB-17
Tabel LB-26 Neraca Energi pada input V-301 ...LB-18
Tabel LB-27 Neraca Energi pada output V-301 ...LB-19
Tabel LB-28 Neraca Energi pada output E-302 ...LB-20
Tabel LB-29 Neraca Energi pada V-302 ...LB-21
Tabel LB-30 Neraca Energi pada E-301 ...LB-21
Tabel LC-1 Viskositas Gas Campuran ...LC-30
Tabel LC-2 Viskositas Gas Campuran Cycle Gas Cooler ...LC-34
Tabel LC-3 Viskositas Product Discharge System ...LC-37
Tabel LC-4 Data-data Konsentrasi Komponen yang Terdapat
Dalam Reaktor ...LC-39
Tabel LC-5 Data-data Titik Kritis Komponen di dalam Reaktor...LC-39
Tabel LC-6 Data-data Viskositas Komponen di dalam Reaktor ...LC-40
Tabel LC-7 Data-data Difusivitas Komponen di dalam Reaktor ...LC-40
Tabel LC-8 Perhitungan ρ campuran non-gas pada R-201 ...LC-44
Tabel LC-9 Fraksi Mol Komponen ...LC-49
Tabel LC-10 Densitas Campuran ...LC-57
Tabel LC-11 Viskositas Campuran ...LC-58
Tabel LC-12 Densitas Campuran pada Product Chamber ...LC-60
Tabel LC-13 Densitas Campuran Product Blow Tank ...LC-63
Tabel LC-14 Densitas Campuran pada Product Purge Bin ...LC-72
Tabel LC-15 Densitas Campuran Product Blow Tank ...LC-77
Tabel LC-16 Viskositas Campuran Product Blow Tank ...LC-77
Tabel LC-18 Viskositas Gas Campuran Scrubber ...LC-80
Tabel LC-19 Densitas Gas Campuran Pipa Product Purge Bin - scrubber ...LC-84
Tabel LC-20 Viskositas Gas Campuran Pipa Product Purge Bin - scrubber....LC-85
Tabel LC-21 Densitas Campuran pada Tangki HCl ...LC-86
Tabel LC-22 Densitas Campuran pada Tangki HCl ...LC-89
Tabel LC-23 Viskositas Campuran pada Tangki HCl ...LC-89
Tabel LC-24 Fraksi Mol Komponen ...LC-91
Tabel LC-25 Densitas Gas Campuran Pipa Scrubber – Flash Drum ... LC-103
Tabel LC-26 Viskositas Gas Campuran Pipa Scrubber – Flash Drum ... LC-104
Tabel LC-27 Viskositas Campuran Mixer ... LC-105
Tabel LC-28 Densitas Campuran Mixer ... LC-106
Tabel LC-29 Densitas Campuran Mixer ... LC-110
Tabel LC-30 Viskositas Campuran Mixer ... LC-111
Tabel LC-31 Densitas Campuran Melt Pump ... LC-112
Tabel LC-32 Viskositas Campuran Melt Pump ... LC-113
Tabel LC-33 Densitas Campuran Belt Conveyor ... LC-116
Tabel LD-1 Perhitungan Entalpi dalam Penentuan Tinggi Menara
Pendingin... LD-57
Tabel LE-1 Perincian Harga Bangunan ... LE-1
Tabel LE-2 Harga Indeks Marshall dan Swift ... LE-3
Tabel LE-3 Estimasi Harga Peralatan Proses Impor ... LE-5
Tabel LE-4 Estimasi Harga Peralatan Proses Non Impor ... LE-6
Tabel LE-5 Estimasi Harga Peralatan Utilitas Impor ... LE-6
Tabel LE-6 Estimasi Harga Peralatan Utilitas Non Impor ... LE-7
Tabel LE-7 Biaya Sarana Transportasi... LE-10
Tabel LE-8 Perincian Gaji ... LE-14
Tabel LE-9 Perincian Biaya Kas ... LE-16
Tabel LE-10 Perincian Modal Kerja ... LE-18
Tabel LE-11 Aturan Depresiasi Sesuai UU Republik Indonesia
No. 17 Tahun 2000 ... LE-19
Tabel LE-12 Aturan Biaya Depresiasi Sesuai UU Republik Indonesia
INTISARI
Salah satu sektor industri petrokmia yang berkembang cukup pesat saat ini yaitu industri petrokimia yang memproduksi polietilena (PE). Akan tetapi, hingga saat ini Indonesia masih mengandalkan produk impor untuk mencukupi kebutuhan domestik dalam konsumsi PE tersebut. Hal ini dikarenakan sampai sekarang hanya ada dua pabrik PE di dalam negeri yaitu PT. Chandra Asri Petrochemical Center (CAPC) dan PT. Petrokimia Nusantara Interindo (PENI) (Yeni H. Simanjuntak, 2007). Total hasil produksi PE dari PT. CAPC dan PT. PENI akan diekspor sebanyak 80.000 ton sedangkan untuk kebutuhan PE domestik akan diimpor 25-30 % dari total konsumsi PE domestik (Malini Hariharan, 2003).
Dengan minimnya produksi PE domestik mengakibatkan berbagai produk turunan PE terutama LLDPE akan diimpor terutama dari Asia dan Eropa Barat, dengan harga beli yang masih tergolong mahal. Dan mengingat Indonesia memiliki sumber daya migas yang cukup banyak dan potensial sehingga hal ini mendorong untuk dibuatnya suatu pra rancangan pabrik pembuatan Linear Low Density
Polyetylene (LLDPE) dengan tujuan mencukupi kebutuan LLDPE domestik.
LLDPE diproduksi 175.000 ton/tahun dengan 330 hari kerja dalam 1 tahun. Lokasi pabrik direncanakan di daerah Kawasan Industri Panca Puri di Jln. Raya Anyer Km. 123 Desa Ciwandan, Kotamadya Cilegon, Propinsi Banten dengan luas areal 15.330 m2, tenaga kerja yang dibutuhkan berjumlah 195 orang dengan bentuk badan usaha Perseroan Terbatas (PT) yang dipimpin oleh seorang direktur dengan struktur organisasi sistem garis dan staf.
Hasil analisa ekonomi Pabrik Pembuatan LLDPE adalah sebagai berikut : Total Modal Investasi : Rp. 3.022.942.882.405,-
Total Biaya Produksi : Rp. 4.260.489.468.562,- Hasil Penjualan : Rp. 5.090.261.305.909,- Laba Bersih : Rp 551.815.771.835,-
Profit Margin (PM) : 15,486 %
Break Even Point (BEP) : 53,359 %
Return on Investment (ROI) : 18,254 %
Pay Out Time (POT) : 5,478 tahun
Return on Network (RON) : 30,424 %
Internal Rate of Return (IRR) : 31,145 %
2.1 Sejarah Plastik
Plastik merupakan salah satu produk polimer. Industri plastik mulai berkembang pada tahun 1968. Seorang Amerika yang bernama John Wesley Hyatt menemukan cellulose nitrate yang terbentuk dari reaksi asam nitrat pada temperatur dan tekanan tertentu. Percobaan ini menghasilkan zat yang dapat dicetak untuk dibentuk. Ia menyebutnya dengan celluloid. Selanjutnya, seorang warganegara Jerman, Adolph Spitteler, menemukan plastik dengan mencampur susu asam dengan
formaldehyde sehingga dihasilkan casein plastic. Pada tahun 1909, seorang Amerika yang bernama Dr. Leo Baekeland mencoba untuk memproduksi resin sintetik dengan mencampur phenol dengan formaldehyde pada kondisi tertentu sehingga dihasilkan resin sintetik untuk pertama kalinya. Plastik baru ini dikenal dengan nama Bakelite. Industri plastik baru berkembang dengan pesat sejak ditemukannya Bakelite.
2.2 Tinjauan Umum Polimer
Polimer berasal dari bahasa Yunani yaitu dari kata poly (banyak) dan meros
(bagian-bagian). Polimer merupakan bahan kimia yang sangat penting dalam kehidupan manusia.
Polimer merupakan molekul besar yang dibangun oleh pengulangan kesatuan kimia yang kecil dan sederhana. Unit yang berulang dari suatu polimer biasanya berasal dari monomer yang sama, namun tidak menutup kemungkinan polimer terbentuk dari dua jenis monomer atau lebih.
Beberapa contoh polimer yang dapat ditemukan dalam kehidupan sehari-hari misalnya plastik, karet, serat, nilon, polisakarida, protein, dan asam nukleat.
2.2.1 Karakteristik Polimer
Polimer memiliki beberapa karakteristik untuk menggambarkan sifat fisik dan sifat kimianya. Sifat-sifat tersebut akan mempengaruhi aplikasi penggunaan polimer tersebut. Karakteristik polimer antara lain :
1. Crystallinity (kristalinitas)
Struktur polimer yang tidak tersusun secara teratur umumnya memiliki warna transparan. Karakteristik ini membuat polimer dapat digunakan untuk berbagai aplikasi seperti pembungkus makanan, kontak lensa dan sebagainya. Semakin tinggi derajat kristalisasinya, semakin sedikit cahaya yang dapat melewati polimer tersebut.
2. Thermosetting dan Thermoplastic (Daya tahan terhadap panas)
Berdasarkan ketahanannya terhadap panas, polimer dibedakan menjadi polimer thermoplastic dan thermosetting. Polimer thermoplastic dapat melunak bila dipanaskan, sehingga jenis polimer ini dapat dibentuk ulang. Sedangkan polimer thermosetting setelah dipanaskan tidak dapat dibentuk ulang. Ketahanan polimer terhadap panas ini membuatnya dapat digunakan pada berbagai aplikasi antara lain untuk insulasi listrik, insulasi panas, penyimpanan bahan kimia dan sebagainya.
3. Branching (percabangan)
Semakin banyak cabang pada rantai polimer maka densitasnya akan semakin kecil. Hal ini akan membuat titik leleh polimer berkurang dan elastisitasnya bertambah karena gaya ikatan intermolekularnya semakin lemah.
4. Tacticity (taktisitas)
Berbagai teknik telah dikenali untuk mengenali sifat-sifat dari polimer.
Angle X-ray scattering digunakan untuk mengenali struktur kristal polimer. Gel
Permeation Chromatography digunakan untuk mengetahui berat molekul rata-rata
jumlah polimer (Mn), berat molekul rata-rata berat polimer (Mw), dan polidisperity
polimer. FTIR dan NMR digunakan untuk mengetahui komposisi polimer.
Calorymetric dan Dynamic Mechanical Analysis digunakan untuk mengetahui titik leleh polimer. Pyrolisis digunakan untuk mengetahui struktur polimer.
2.2.2 Proses Polimerisasi Secara Umum
Pada umumnya proses polimerisasi (pembentukan polimer) dibagi menjadi dua cara, yaitu polimerisasi kondensasi dan polimerisasi adisi.
2.2.2.1 Polimerisasi Kondensasi (Step Polymerization)
Menurut M.A Cowd pada tahun 1991, polimerisasi kondensasi yaitu polimerisasi yang terjadi pada saat zat bermassa molekul rendah, dimana terjadi reaksi antara dua molekul bergugus fungsi banyak (molekul yang mengandung dua gugus fungsi atau lebih yang dapat bereaksi) dan terbentuk satu molekul besar bergugus fungsi banyak, disertai penyingkiran molekul kecil (seperti air).
Contohnya, jika campuran ethanol (etil alkohol) dan asam etanoat (asam asetat) dipanasi bersama sedikit asam sulfat pekat, akan dihasilkan ester etil etanoat (etil asetat) yang disertai penyingkiran air, reaksinya :
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Reaksi berhenti sampai disini, karena tidak terdapat gugus fungsi yang dapat bereaksi (pada contoh ini gugus –COOH dan -OH) akan tetapi, jika tiap molekul pereaksi mengandung dua atau tiga gugus fungsi, maka reaksi berikutnya dapat terjadi.
Misalnya reaksi antara 2 monomer asam heksanadioat (asam adiapat) dan etana 1,2-diol :
Polimerisasi kondensasi hampir selalu berlangsung secara bertahap dengan reaksi antara pasangan gugus fungsi, sehingga terbentuk dimer, trimer, tetramer, dan seterusnya hingga terbentuk polimer.
Polimer yang terbentuk mengandung kesatuan yang berulang, berikut reaksinya :
[-O(CH2)2COO(CH2)4CO-]n
Dengan demikian massa molekul nisbi bertambah secara bertahap selama reaksi berlangsung dan waktu rekasi lama jika diperlukan massa molekul polimer nisbi yang besar. Jadi berbeda dengan polimerisasi adisi rantai yang membentuk polimer bernassa molekul besar sekaligus.
2.2.2.2 Polimerisasi Adisi (Chain Polymerization)
Polimerisasi adisi adalah polimerisasi yang melibatkan reaksi rantai dan disebabkan oleh radikal bebas (partikel reaktif yang mengandung elektron tak berpasangan) atau ion. Polimer penting yang dihasilkan melalui polimerisasi adisi adalah turunan etena berbentuk CH2=CHX atau CH2=CXY, yang disebut monomer
vynil.
Menurut F.W Billmeyer pada tahun 1984 reaksi umumnya dapat dituliskan sebagai berikut :
CH2=CH -CH2-CH-CH2-CH- dst
X X X
Polimerisasi ini berlangsung sangat cepat (beberapa detik). Reaksi keseluruhannya memakan waktu lama, karena penelitian menunjukan bahwa reaksi rantai berlangsung dalam suatu deret reaksi cepat yang diselingi waktu yang cukup panjang yang diistilahkan sebagai gejolak.
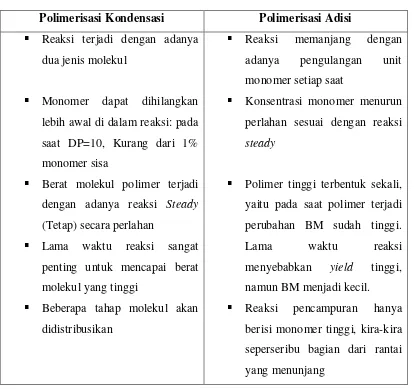
Tabel 2.1 Perbedaan Antara Mekanisme Polimerisasi Kondensasi dengan Polimerisasi Adisi
Polimerisasi Kondensasi Polimerisasi Adisi
Reaksi terjadi dengan adanya dua jenis molekul
Monomer dapat dihilangkan lebih awal di dalam reaksi: pada saat DP=10, Kurang dari 1% monomer sisa
Berat molekul polimer terjadi dengan adanya reaksi Steady
(Tetap) secara perlahan
Lama waktu reaksi sangat penting untuk mencapai berat molekul yang tinggi
Beberapa tahap molekul akan didistribusikan
Reaksi memanjang dengan
adanya pengulangan unit monomer setiap saat
Konsentrasi monomer menurun perlahan sesuai dengan reaksi
steady
Polimer tinggi terbentuk sekali, yaitu pada saat polimer terjadi perubahan BM sudah tinggi. Lama waktu reaksi menyebabkan yield tinggi, namun BM menjadi kecil.
Reaksi pencampuran hanya berisi monomer tinggi, kira-kira seperseribu bagian dari rantai yang menunjang
A. Polimerisasi Radikal Bebas
Menurut F.W Billmeyer pada tahun 1984, tahap-tahap yang terjadi pada polimerisasi radikal bebas yaitu:
1. Inisiasi (tahap pemicuan)
Pemicuan dapat dipandangsenagai penguraian pemicu dan adisi molekul monomer pada salah satu radikal bebas yang terbentuk. Jika merupakan pemicu , R sebagai Radikal Bebas dan molekul monomer dinyatakan dengan CH2=CHx,
Proses pemicuan dapat digambarkan sebagai berikut: I 2R•
H R• + CH2=CHX R CH2C•
X
2. Propagasi (tahap perambatan)
Pada tahap ini terbentuk rantai radikal, dan dapat berturut-turut bereaksi dengan monomer sehingga memperbanyak rantai.
H H R-(CH2CHX-)xCH2C• + CH2=CHX …. R-(CH2CHX-)x+1CH2C•
X X Tahap ini berjalan terus menerus sampai suplai monomer habis.
3. Terminasi (tahap pengakhiran)
Tahap terminasi dapat tercapai dengan dua cara, yaitu: Kombinasi atau Coupling
H H H H CH2C• + •CCH2- -CH2C-CCH2-
Disproporsionasi
H H H H CH2C• + •CCH2- -CH2C-H + C=CH
X X X X
Tranfer hidrogen menghasilkan dua bentuk akhir molekul jenuh dan tak jenuh. Terminasi Polystyrene lebih banyak menggunakan cara kombinasi. Sedangkan Poly (methylmethacrylate) menggunakan disproporsionasi.
B. Polimerisasi Ion
Menurut M.A.Cowd pada tahun 1991, polimerisasi ion dapat berlangsung dengan mekanisme yang tidak melibatkan radikal bebas. Misalnya, pembawa rantai dapat berupa ion carbonium (polimerisasi kation) atau carbonium (polimerisasi anion).
a. Polimerisasi Kation
Pada polimerisasi ini, monomernya CH2=CHX dan pembawa rantainya
adalah ion karbonium. Katalis yang digunakan pada reaksi polimerisasi adalah asam Lewis (penerima pasangan elektron) dan katalis Friedel-Crafts (AlCl3, AlBr3, BF3, TiCl4, SnCl4, H2SO4 dan asam kuat lainnya). Berbeda
dengan polimerisasi radikal bebas yang umumnya berlangsung pada suhu tinggi, polimerisasi kation paling baik berlangsung pada suhu rendah. Misalnya, polimerisasi 2-methyl propena (isobutilena) berlangsung sangat cepat pada suhu -100 oC dengan adanya katalis AlCl3 atau BF3. Pelarut sangat
berpengaruh, sebab mekanisme ion melibatkan partikel-partikel bermuatan. Sedangkan radikal bebas umumnya netral. Polimerisasi kation sering terjadi pada monomer yang mengandung gugus pelepasan elektron. Dengan katalis asam, proses dapat digambarkan sebagai berikut:
1. Inisiasi
H HA + CH2=CHX CH3-C+ + A-
HA adalah molekul asam, seperti: asam sulfat, asam klorida, asam perklorat. Pada tahap pemicuan ini, proton dialihkan dari asam ke monomer sehingga menghasilkan ion karbonium.
2. Propagasi
Tahap perambatan ini berupa adisi monomer pada ion karbonium yang dihasilkan tadi.
H H H H CH3-C+ + CH2=CHX CH3C-C-C+
X X H X
Oleh karena katalis Friedel-Crafts tidak mengandung hidrogen, polimerisasi memerlukan bantuan katalis (co-catalis) berupa air:
BF3 + H2O BF3.H2O
H H
BF3.H2O + H2C=C H3C-C+ + [BF3OH]
X X Adanya air menyebabkan alih proton terjadi. 3. Terminasi
Pengakhiran rantai paling sederhana dan nyata adalah penggabungan ion karbonium dan anion pasangannya (ion lawan).
H H ~~~CH2-C+ + A- ~~~CH2-C-A
X X
b. Polimerisasi Anion
metakrilat), dan fenilethena (styrena). Polimerisasi anion bersuhu rendah (-73
o
C). Katalis yang dipakai meliputi logam alkali, alki, aril dan amida logam alkali. Salah satu penerapan paling awal polimerisasi ini dalam dunia industri asalah pada pembuatan karet sintetis, di Jerman dan Rusia, dari buta-1,3-diena (butabuta-1,3-diena) dengan katalis logam alkali.
Contoh polimerisasi anion: 1. Inisiasi
Amida logam alkali, seperti kalium amida (KNH2) dalam pelarut
amonia cair terionisasi kuat, sehingga tahap pemicuannya:
H H H2N- + H2C=C H2N-CH2-C-:
H X
2. Propagasi
Ion lawan (penetral) bagi karbonium adalah K+
H H H H H H H H2N-C-C-: + H2C=C H2N-C-C-C-C:
H X X H X H X
3. Terminasi
Polimerisasi hanya berhenti ketika seluruh monomer pereaksi habis terpakai. Walaupun demikian, pusat aktif (atau karbonium) tidak rusak, dan jika lebih banyak monomer ditambahkan, maka dapat dipicu lagi. Untuk mengakhiri pertumbuhan rantai, hanya diperlukan sedikit air, karbondioksida dan alkohol.
H H H H
C-C-:K+ + H2O ~~~C-C-H + K+ OH
Katalis utama bagi polimerisasi anion adalah katalis Ziegler-Natta
(Katalis Ziegler) yang ditemukan oleh Ziegler pada tahun 1953. ia menggunakan katalisnya untuk polimerisasi ethylene. Selanjutnya, Natta pada tahun 1955 menggunakan katalis tersebut untuk polimerisasi propilene dan monomer jenuh lainnya. Katalis ziegler-Natta dapat dibuat dengan mencampurkan alkil atau aril dari golongan I-III pada susunan berkala, dengan halida unsur transisi. Misalnya Tri Isobutil Alumunium {Al(i-C4H9)3} yang jika ditambahkan ke dalam
Titanium (IV) Klorida dalam pelarut heksana, menghasilkan endapan coklat hitam yang dapat mempercepat polimerisasi etena pada tekanan rendah.
2.2.3 Penggolongan Polimer
Polimer dapat dibedakan berdasarkan asalnya, jenis monomer penyusunnya, pengaruh panas terhadap sifat fisiknya dan berdasarkan strukturnya.
1. Berdasarkan asalnya
Polimer dibedakan menjadi polimer alam dan polimer sintetik. Polimer alam telah banyak dikembangkan sejak tahun 1880 untuk memproduksi berbagai material. Polimer sintetik merupakan polimer yang dibuat di pabrik dan tidak terdapat di alam. Polimer ini meliputi semua jenis plastik, serat, karet sintetik dan nilon.
Beberapa contoh dari polimer alam disajikan pada Tabel 2.2 Tabel 2.2 Contoh Polimer Alam
Polimer Monomer Polimerisasi Terdapat pada
Protein Asam amino Kondensasi Wol, sutera
Amilum Glukosa Kondensasi Beras, gandum
Selulosa Glukosa Kondensasi Kayu
Asam nukleat Nukleotida Kondensasi DNA, RNA
Karet alam Isoprena Adisi Getah pohon karet
Beberapa contoh polimer sintetik disajikan dalam Tabel 2.3 Tabel 2.3 Contoh Polimer Sintetik
Polimer Monomer Polimerisasi Terdapat pada
Polietilena Etena Adisi Plastik
PVC Vinilklorida Adisi Pelapis lantai, pipa
Polipropilena Propena Adisi Tali plastik, botol
Teflon Tetrafluoroetilena Adisi Panci anti lengket (Sumber : Michael Purba, 2000)
2. Berdasarkan jenis monomer penyusunnya
Berdasarkan monomer penyusunnya maka polimer dibedakan menjadi homopolimer dan kopolimer. Homopolimer terbentuk dari monomer yang sejenis. Contohnya yaitu polyethylene, polypropylene, polystyrene, PVC, teflon, amilum, selulosa dan sebagainya. Kopolimer terbentuk dari dua atau lebih monomer yang berbeda jenisnya. Contoh polimer ini yaitu dakron.
3. Berdasarkan pengaruh panas terhadap sifat fisik
Dibedakan menjadi dua yaitu polimer thermosetting dan polimer thermoplastic. Polimer thermosetting bila dipanaskan akan mengeras dan bila dipanaskan lagi akan rusak, sehingga tidak dapat kembali ke bentuk semula. Contoh : phenol
formaldehyde. Sedangkan polimer thermoplastic, apabila dipanaskan akan
meleleh dan setelah didinginkan akan mengeras dan dapat kembali ke bentuknya semula. Contoh : polyethylene dan poly vinyl chloride.
4. Berdasarkan struktur
Berdasarkan strukturnya, maka dibedakan atas polimer yang berstruktur tiga dimensi dan polimer yang berstruktur linear. Polimer yang berstruktur tiga dimensi memiliki susunan rantai yang saling mengikat membentuk struktur tiga dimensi dan biasanya bersifat therosetting. Contoh : phenol formaldehyde. Sedangkan polimer yang berstruktur linear memiliki susunan rantai yang berbentuk lurus (linear) dan biasanya bersifat thermopalstic. Contoh :
2.2.4 Pemanfaatan Polimer
Banyak polimer yang telah dikenal dan secara umum digunakan dalam kehidupan sehari-hari yaitu :
1. Polyethylene
Biasanya digunakan untuk pembungkus makanan, kantung plastik, ember dan sebagainya
2. Polypropylene
Biasanya digunakan untuk membuat karung, tali, botol dan sebagainya 3. Teflon
Teflon atau politetrafluoroetilena memiliki sifat yang tahan terhadap bahan kimia dan panas, sehingga seringkali digunakan untuk pelapis tangki atau panci anti lengket
4. PVC
PVC (polivinilklorida) biasanya digunakan untuk membuat pipa, selang, pelapis lantai dan sebagainya
5. Akrilat
Beberapa polimer dibuat dari asam akrilat sebagai monomernya. Polimetilmetakrilat atau flexiglass merupakan plastik bening, keras tetapi ringan. Polimer jenis ini banyak digunakan untuk kaca jendela pesawat terbang dan mobil
6. Bakelit
Bakelit banyak digunakan untuk alat-alat listrik
7. Polyester
Poliester dibentuk dari monomer-monomer ester. Salah satu contoh polimer ini adalah dakron. Dakron digunakan sebagai serat tekstil. Selain dakron dikenal pula Mylar, yang digunakan sebagai pita perekam magnetik
8. Polyurethanes
9. Karet alam dan karet sintetis
Karet diperoleh dari getah pohon karet (lateks). Karet alam merupakan polimer isoprena. Karet sintetis terdiri dari beberapa macam, misalnya polibutadiena, polikloroprena dan polistirena. Karet sintetis yang telah banyak dikenal yaitu SBR. SBR terdiri dari monomer stirena dan 1,3-butadiena, banyak digunakan untuk pembuatan ban mobil.
2.3 Polyethylene
Polyethylene atau polyethene merupakan polimer termoplastik yang banyak digunakan dalam kehidupan sehari-hari. Polyethylene tidak larut dalam pelarut apapun pada suhu kamar. Polimer ini juga tahan terhadap asam dan basa tetapi tidak dapat dirusak oleh asam nitrat pekat.
Nama polyethylene berasal dari monomer penyusunnya yaitu etana (ethylene). Polyethylene pertama kali disintesis secara tidak sengaja dari pemanasan
Karakteristik polyethylene antara lain : Sifat Fisik :
Berat Molekul : 10.000 – 1.000.000 g/mol Bentuk : padatan, cairan, slurry Densitas : 0,91 - 0,96 g/cm3 Titik lebur : 109 – 183 oC
Sifat Kimia :
Tidak larut dalam pelarut apapun pada suhu kamar
Tahan terhadap asam/basa, tetapi dapat dirusak oleh asam nitrat pekat
Tidak tahan terhadap cahaya dan oksigen
Bila dipanasi secara kuat akan membentuk sambung silang yang diikuti dengan pembelahan ikatan secara acak pada suhu lebih tinggi, tetapi di polimerisasi tidak terjadi
Larutan dari suspensi polyethylene dengan tetra klorida pada suhu 60 oC dapat direaksikan dengan Cl membentuk produk lunak dan kenyal
Pemasukan atom Cl secara acak ke dalam rantai dapat menghancurkan kekristalan polyethylene.
2.3.1 Teknologi Proses Polimerisasi Ethylene menjadi Polyethylene
Menurut Byrson, J.A pada tahun 1995, reaksi polimerisasi dapat dilakukan pada fase cair, gas maupun padat. Proses polimerisasi yang mula-mula banyak digunakan adalah polimerisasi dalam fase cair atau larutan. Permasalahan utama yang timbul dari proses semacam itu adalah pemisahan katalis dan sisa pelarut dari produk dan memiliki biaya yang tinggi.
katalis dan kemungkinan terbentuknya oligomer. Oligomer adalah rangkaian beberapa molekul bukan polimer, misalnya dimer, trimer, tetramer dan lain-lain.
Penggunaan katalis sangat berpengaruh pada faktor ekonomis dari teknologi polimerisasi. Reaksi polimerisasi adisi memerlukan adanya senyawa pemicu, yaitu senyawa yang dapat memberikan muatan atau elektron bebas pada ikatan rangkap ethylene. Tanpa katalis reaksi polimerisasi dapat berlangsung pada suhu tinggi (± 350 oC-500 oC) dengan tekanan 2.5-10 atm. Hal ini karena energi aktivasi cukup tinggi yaitu sekitar 35-43.5 kkal/mol. Adanya katalis akan mempercepat jalannya reaksi yaitu dengan mengurangi energi aktivasi yang diperlukan.
Secara ringkas faktor penentu dari keberhasilan proses polimerisasi adalah tipe katalis yang digunakan. Katalis ini harus memilki keaktifan yang tinggi namun mudah dikendalikan. Katalis yang saat ini banyak digunakan adalah katalis organo metalic seperti TiCl4.
Proses dasar polimerisasi ethylenen yang mula-mula dipatenkan adalah proses yangdigunakan oleh perusahaan Imperial College Industri (ICI) pada tahun 1936. Proses ini menghasilkan polyethylene jenis LLDPE dengan kondisi pada tekanan tinggi. Namun pada tahun 1954 muncul cara lain untuk reaksi polimerisasi
ethylene dengan proses Ziegler yang menggunakan katalis alumunium alkyl (TiCl4).
Dengan proses tersebut polyethylene dapat diproduksi pada tekanan dan suhu yang rendah.
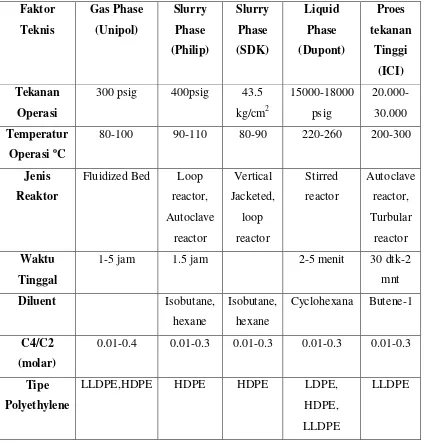
2.3.1.1 Macam-macam Proses Pembuatan Polyethylene
Ada beberapa macam proses pembuatan produk polyethylene, diantaranya: A. High Presure Process
Dalam proses high pressure ini dapat digunakan 2 jenis reaktor yaitu
autoclave reaktor atau tubular reaktor (jacketted tube) yang mempunyai kondisi operasi yang berbeda seperti :
• Autoclave reaktor
• Tubular Reaktor
- Tekanan operasi yang digunakan antara 200-250 Mpa (typical)
- Temperatur reaksinya tergantung dari jenis inisiator oksigen maka temperatur reaksinya 1900 oC dan jika menggunakan inisiator peroxycarbonate maka temperatur reaksinya menjadi 1400 oC.
B. Suspension (Slurry) Process
Dalam proses ini polyethylene disuspensikan dalam diluent hidrocarbon untuk mempermudah proses.
Ada 2 macam proses dalam suspension (slurry) proses, yaitu autoclave process dan loop reaktor process.
• Autoclave Process
- Tekanan operasinya 0.5-1 Mpa (typical)
- Temperatur reaksinya antara 80-900 oC (typical) - Diluent yang digunakan adalah hexane
- Katalis yang digunakan dicampur dengan alkyl alumunium
• Loop Reactor Process
- Tekanan operasinya 3-4 Mpa (typical) - Temperatur reaksinya 1000 oC (typical) - Diluent yang digunakan adalah isobutene
- Jika menggunakan Philip type maka katalisnya adalah campuran Ti dan Alkyl alumunium
C. Gas Phase Process
Union Carbide banyak menggunakan proses ini dengan menggunakan reaktor fluidized bed. Disebut gas phase process karena hampir semua bahan baku disuplai dalam bentuk gas.
- Tekanan operasi yang digunakan antara 0.7-2 Mpa (typical) - Temperatur reaksinya antara 80-100 oC (typical)
2.3.1.2 Perbandingan Proses Pembuatan Polyethylene
Tabel 2.4 Perbandinganproses pembuatan polyethylene
Faktor
Fluidized Bed Loop reactor,
Dalam Pra-rancangan pembuatan Pabrik Linear Low Density Polyethylene
(LLDPE) ini dipilih proses Gas Phase (Unipol). Pemilihan proses dilakukan dengan memperhatikan :
Kebutuhan Utility Plant sedikit
Produk yang dihasilkan memiliki kemurnian yang tinggi
Konversi reaksi yang diperoleh mencapai 98 % sehingga secara ekonomis proses ini layak dibuat dalam skala pabrik
2.3.2 Klasifikasi Polyethylene
Menurut Irwan Hidajat pada tahun 1995, polyethylene merupakan salah satu polimer dengan struktur molekul paling sederhana, bersifat termoplastik dari polimerisasi ethylene (C2H4). Polimer termoplastik adalah polimer yang dapat
mencair dan mengalir pada suhu tinggi.
Polyethylene diklasifikasikan berdasarkan rantai dan densitasnya menjadi : 1. UHMWPE (Ultra High Molecular Weight Polyethylene), merupakan
polyethylene dengan berat molekul sangat besar antara 3,1 dan 5,57 juta dengan densitas 0,935-0,930 g/cm3
2. HDPE (High Density Polyethylene), merupakan polyethylene dengan densitas lebih besar atau sama dengan 0,941 g/cm3.
3. PEX (Cross-linked Polyethylene), merupakan polyethylene dengan densitas medium yang terdiri dari ikatan cross-linked.
4. MDPE (Medium Density Polyethylene), merupakan polyethylene dengan kisaran densitas antara 0,926-0,940 g/cm3.
5. LLDPE (Linear Low Density Polyethylene), merupakan polyethylene dengan kisaran densitas antara 0,915-0,925 g/cm3, berbentuk linear dengan cabang-cabang pendek.
6. LDPE (Low Density Polyethylene), merupakan polyethylene dengan kisaran densitas antara 0,910-0,940 g/cm3 dengan cabang-cabang pendek maupun panjang.
7. VLDPE (Very Low Density Polyethylene), merupakan polyethylene dengan kisaran densitas antara 0,880-0,915 g/cm3.
cabag yang ditentukan tanpa adanya rantai cabang panjang. LLDPE diproduksi untuk berbagai macam barang, antara lain:
a. Film : plastik, plastik pembungkus baju, plasti karung. b. Kabel : pembungkus kabel tegangan rendah
c. injection : kursi plastik, ember, gelas dan piring plastik.
Struktur HDPE, LDPE dan LLDPE menurut Irwan Hidayat pada tahun 1995 dapat dilihat pada Tabel 2.5
Tabel 2.5Struktur HDPE, LDPE dan LLDPE
Jenis Gambar Struktur Jenis Rantai Cabang
HDPE Rantai cabang pendek
LDPE Rantai cabang pendek dan panjang
LLDPE Rantai cabang pendek
(sumber : IrwanHidajat, 1995, hal 6)
2.4 Sifat-sifat Bahan Baku
Bahan baku yang digunakan pada LLDPE plant terdiri dari bahan baku utama dan bahan baku penunjang. Bahan baku utama yang digunakan
yaitu ethylene dan bahan baku penunjang terdiri dari nitrogen, hidrogen dan
comonomer.
2.4.1 Bahan Baku Utama
LLDPE plant menggunakan bahan baku utama yaitu ethylene. Ethylene ini diperoleh dari hasil produksi Ethylene plant.
Sifat Fisik Ethylene (CH2=CH2)
Berat Molekul : 28,05 g/mol
Spesific gravity : 0,57-102/4
Fase : gas
2.4.2 Bahan Baku Penunjang
2.4.2.1 Comonomer
Comonomer yang digunakan pada LLPDE plant yaitu 1-butene. Sifat-sifat fisik dari comonomer tersebut yaitu :
Sifat Fisik Butene-1 (CH2 = CHCH2CH3)
Berat Molekul : 56,10 g/mol
Spesific gravity : 0,6013
Fase : cair
Titik didih : -5 oC Titik leleh : -130 oC Temperatur kritis : 146,85 oC Tekanan kritis : 40,43 bar Volume kritis : 293,3 cm3/mol
Larut dalam pelarut organik tetapi tidak dapat larut dalam air
2.4.2.2 Nitrogen
Sifat fisik dari nitrogen yaitu :
Berat Molekul : 28,02 g/mol
Spesific gravity : 0,8081
Fase : gas
Titik didih : -195,8 oC Titik leleh : -209,86 oC Temperatur kritis : -147 oC Tekanan kritis : 34 bar (abs)
2.4.2.3 Hidrogen
Sifat Fisik Hidrogen (H2) adalah sebagai berikut :
Berat Molekul : 2,016 g/mol
Spesific gravity : 0,0709-252,7
Fase : gas
Temperatur kritis : -1240 oC Tekanan kritis : 13 bar (abs)
2.4.2.4 Katalis
Katalis yang digunakan LLDPE plant terdiri dari tiga jenis, tergantung pada spesifikasi produk yang diinginkan. Ketiga jenis katalis tersebut yaitu :
1. Katalis M-1
Katalis M-1 terdiri dari metal aktif Titanium yang di-support dengan silika dan aluminium. Berdiameter 700-900µm.
Karaktristik
a. Memiliki distribusi berat molekul (MWD) terbatas, b. Harga MeltIndex tinggi dan densitas yang cukup luas, c. Aktivitas yang baik (2-4 ppm Ti),
d. Produktivitas Katalis 3000-5000 kg resin/kg katalis, Penggunaan : untuk memproduksi LLDPE.
2. Katalis S-2
Katalis S-2 terdiri dari chrome aktif yang di-support dengan silika dan aluminium. Berdiameter 500-600µm.
Karaktristik
a. Memiliki distribusi berat molekul (MWD) sangat luas, b. Harga Melt Indekx rendah dan densitas tinggi,
c. Aktivitas yang baik (kurang dari1ppm Cr),
d. Produktivitas Katalis 6000-8000 kg resin/kg katalis, e. Polimerisasi baik, sturtur molekul produk yang lebih luas.
Penggunaan : untuk memproduksi HDPE, tipe blow molding, film, pipa,
3. Katalis F-3
Katalis F-3 merupakan katalis yang tergolong katalis chrome. Berdiameter 500-600µm.
Karaktristik
a. Memiliki distribusi berat molekul (MWD) produk yang luas, b. Produktivitas Katalis 15000 kg resin/kg katalis.
Penggunaan : untuk memproduksi HDPE.
2.4.2.5 Co-catalyst
Sifat Fisik TEAL (Al(C2H5)3) yaitu :
Berat Molekul : 114,17 g/mol
Densitas : 0,834 g/ml
Viskositas : 2,6 mPa.sg
Contoh struktur katalis Ziegler Natta dengan kombinasi Titanium (IV) Chloride (TiCl4) dan co-catalyst TEAL (Triethylalumunium) dapat dilihat pada gambar 2.1
Gambar 2.1 Katalis Ziegler – Natta
2.5 Deskripsi Proses
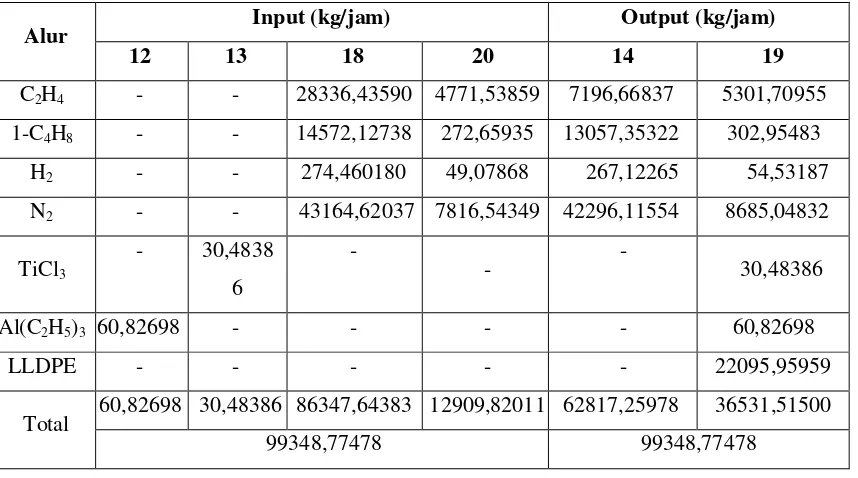
Umpan berupa C2H4, C4H8, H2, dan N2 dialirkan menuju ke mix point (S-201)
untuk selanjutnya dialirkan ke reaktor fluidized bed (R-201). Pada N2, alirannya
dibagi menjadi 2 produk yaitu nitrogen bertekanan tinggi (NBT) dan nitrogen bertekanan rendah (NBR). NBT digunakan sebagai carrier gas pada reaktor fluidized bed (R-201) yang beroperasi pada 85 oC dan 12 bar sedangkan NBR digunakan sebagai purger gas untuk Product Purge Bin (V-301).
Ti Cl Al
Cl
Cl Cl
C2H5
C2H5
C2H5
Umpan yang dialirkan pada R-201 akan mengalami reaksi polimerisasi yang akan menghasilkan resin LLDPE dengan tingkat konversi 10% setiap pass-nya. Umpan yang tidak terkonversi disesuaikan kembali tekanannya agar sesuai dengan tekanan operasi yang dibutuhkan untuk fluidisasi dalam R-201. Setelah itu, untuk mempertahankan suhu operasi di dalam reaktor dipergunakan cycle gas cooler (E-201). Untuk menurunkan energi aktivasi reaksi, maka ditambahkan katalis TiCl3 dan
co-katalis Al(C2H5)3 (TEAL). Setelah terbentuk produk berupa resin LLDPE (500 -
900 μm), maka secara periodik dialirkan ke product chamber (V-201), lalu diumpankan ke product blow tank (V-202) secara gravitasi.
Kemudian, produk dari V-202 dibawa ke product purge bin (R-301) yang beroperasi pada 100 oC dan 1 atm. Pada R-301, impuritis yang terbawa akan disingkirkan dengan N2 yang dialirkan pada cone I dan katalis serta co-katalis
dideaktivasi dengan hidrolisis menggunakan steam yang dialirkan pada cone II, menurut reaksi :
2TiCl3 + 4H2O → 2TiO2 + 6HCl + H2
Al(C2H5)3 + 3H2O → Al(OH)3 + 3C2H6
Setelah itu, resin LLDPE dialirkan ke mixer (M-301) yang bersuhu 160 oC. Dengan suhu ini resin LLDPE akan meleleh. Lelehan ini akan dialirkan ke pelletizer
(PE-301). Pada PE-301, lelehan ini akan dibentuk menjadi pellet LLDPE, lalu disalurkan ke gudang produk (V-304).
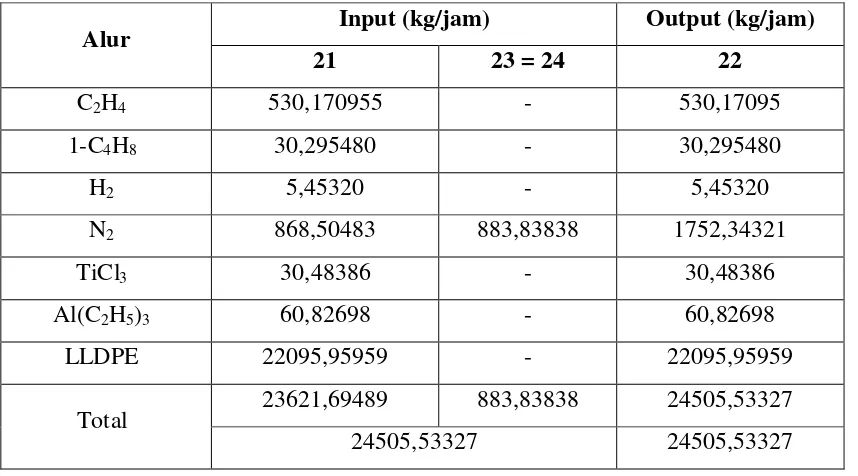
produk berupa serbuk (500 - 900μm), maka secara periodik dialirkan ke product chamber (sekaligus untuk menjaga kestabilan tinggi standar isian), lalu diumpankan ke product blow tank.
Dengan blower, produk di bawa ke product purge bin dimana pengotor LLDPE yang terbawa seperti etilen, N2, H2, dan comonomer disingkirkan dan katalis dideaktivasi dengan hidrolisis menggunakan steam menurut reaksi :
Al(C2H5)3 + 3H2O → Al(OH)3 + C2H6
Etilen (C2H4), H2, dan N2 dialirkan dari tangki penyimpanannya masing-masing (V-101,V-102, dan V-103) menuju ke kompresornya agar sesuai dengan tekanan yang diinginkan. Pada N2, pemakaian kompresor dibagi menjadi 2 untuk menghasilkan 2 produk yaitu nitrogen bertekanan tinggi (NBT) dan nitrogen bertekanan rendah (NBR). NBT digunakan sebagai carrier gas pada reaktor fluidization batch (R-201) yang beroperasi pada 80-100oC dan 1-2MPa sedangkan NBR digunakan sebagai purger gas untuk Product Purge Bin (V-301). Ke-3 senyawa kimia yang telah diumpankan ke alur 13 kemudian disesuaikan kembali tekanannya agar sesuai dengan tekanan operasi yang dibutuhkan untuk fluidisasi pada kompresor C-201. Setelah itu, diumpankan suhu operasi pada cycle gas cooler E-201. Untuk menurunkan energi aktivasi reaksi, maka ditambahkan katalis Ziegler – Natta. Setelah terbentuk produk berupa serbuk (500 - 900 μm), maka secara periodik dialirkan ke product chamber (sekaligus untuk menjaga kestabilan tinggi standar isian), lalu diumpankan ke product blow tank (V-202).
Dengan blower, produk dari product blow tank di bawa ke product purge bin (V-301) dimana pengotor LLDPE yang terbawa seperti etilen, H2, dan comonomer disingkirkan dengan N2 dan katalis dideaktivasi dengan hidrolisis menggunakan steam menurut reaksi :
Al(C2H5)3 + 3H2O → Al(OH)3 + C2H6
Proses penghilangan etilen, H2, dan comonomer terjadi pada cone I dari atas dan proses deakivasi katalis terjadi pada cone II dari atas.
Setelah itu, LLDPE dinaikkan suhunya menjadi 150 – 230oC ke heater (M-301) agar meleleh sehingga dapat dibentuk pada pelleter (P-301).
2.1 Sejarah Plastik
Plastik merupakan salah satu produk polimer. Industri plastik mulai berkembang pada tahun 1968. Seorang Amerika yang bernama John Wesley Hyatt menemukan cellulose nitrate yang terbentuk dari reaksi asam nitrat pada temperatur dan tekanan tertentu. Percobaan ini menghasilkan zat yang dapat dicetak untuk dibentuk. Ia menyebutnya dengan celluloid. Selanjutnya, seorang warganegara Jerman, Adolph Spitteler, menemukan plastik dengan mencampur susu asam dengan
formaldehyde sehingga dihasilkan casein plastic. Pada tahun 1909, seorang Amerika yang bernama Dr. Leo Baekeland mencoba untuk memproduksi resin sintetik dengan mencampur phenol dengan formaldehyde pada kondisi tertentu sehingga dihasilkan resin sintetik untuk pertama kalinya. Plastik baru ini dikenal dengan nama Bakelite. Industri plastik baru berkembang dengan pesat sejak ditemukannya Bakelite.
2.2 Tinjauan Umum Polimer
Polimer berasal dari bahasa Yunani yaitu dari kata poly (banyak) dan meros
(bagian-bagian). Polimer merupakan bahan kimia yang sangat penting dalam kehidupan manusia.
Polimer merupakan molekul besar yang dibangun oleh pengulangan kesatuan kimia yang kecil dan sederhana. Unit yang berulang dari suatu polimer biasanya berasal dari monomer yang sama, namun tidak menutup kemungkinan polimer terbentuk dari dua jenis monomer atau lebih.
Beberapa contoh polimer yang dapat ditemukan dalam kehidupan sehari-hari misalnya plastik, karet, serat, nilon, polisakarida, protein, dan asam nukleat.
2.2.1 Karakteristik Polimer
Polimer memiliki beberapa karakteristik untuk menggambarkan sifat fisik dan sifat kimianya. Sifat-sifat tersebut akan mempengaruhi aplikasi penggunaan polimer tersebut. Karakteristik polimer antara lain :
1. Crystallinity (kristalinitas)
Struktur polimer yang tidak tersusun secara teratur umumnya memiliki warna transparan. Karakteristik ini membuat polimer dapat digunakan untuk berbagai aplikasi seperti pembungkus makanan, kontak lensa dan sebagainya. Semakin tinggi derajat kristalisasinya, semakin sedikit cahaya yang dapat melewati polimer tersebut.
2. Thermosetting dan Thermoplastic (Daya tahan terhadap panas)
Berdasarkan ketahanannya terhadap panas, polimer dibedakan menjadi polimer thermoplastic dan thermosetting. Polimer thermoplastic dapat melunak bila dipanaskan, sehingga jenis polimer ini dapat dibentuk ulang. Sedangkan polimer thermosetting setelah dipanaskan tidak dapat dibentuk ulang. Ketahanan polimer terhadap panas ini membuatnya dapat digunakan pada berbagai aplikasi antara lain untuk insulasi listrik, insulasi panas, penyimpanan bahan kimia dan sebagainya.
3. Branching (percabangan)
Semakin banyak cabang pada rantai polimer maka densitasnya akan semakin kecil. Hal ini akan membuat titik leleh polimer berkurang dan elastisitasnya bertambah karena gaya ikatan intermolekularnya semakin lemah.
4. Tacticity (taktisitas)
Berbagai teknik telah dikenali untuk mengenali sifat-sifat dari polimer.
Angle X-ray scattering digunakan untuk mengenali struktur kristal polimer. Gel
Permeation Chromatography digunakan untuk mengetahui berat molekul rata-rata
jumlah polimer (Mn), berat molekul rata-rata berat polimer (Mw), dan polidisperity
polimer. FTIR dan NMR digunakan untuk mengetahui komposisi polimer.
Calorymetric dan Dynamic Mechanical Analysis digunakan untuk mengetahui titik leleh polimer. Pyrolisis digunakan untuk mengetahui struktur polimer.
2.2.2 Proses Polimerisasi Secara Umum
Pada umumnya proses polimerisasi (pembentukan polimer) dibagi menjadi dua cara, yaitu polimerisasi kondensasi dan polimerisasi adisi.
2.2.2.1 Polimerisasi Kondensasi (Step Polymerization)
Menurut M.A Cowd pada tahun 1991, polimerisasi kondensasi yaitu polimerisasi yang terjadi pada saat zat bermassa molekul rendah, dimana terjadi reaksi antara dua molekul bergugus fungsi banyak (molekul yang mengandung dua gugus fungsi atau lebih yang dapat bereaksi) dan terbentuk satu molekul besar bergugus fungsi banyak, disertai penyingkiran molekul kecil (seperti air).
Contohnya, jika campuran ethanol (etil alkohol) dan asam etanoat (asam asetat) dipanasi bersama sedikit asam sulfat pekat, akan dihasilkan ester etil etanoat (etil asetat) yang disertai penyingkiran air, reaksinya :
CH3COOH + C2H5OH CH3COOC2H5 + H2O
Reaksi berhenti sampai disini, karena tidak terdapat gugus fungsi yang dapat bereaksi (pada contoh ini gugus –COOH dan -OH) akan tetapi, jika tiap molekul pereaksi mengandung dua atau tiga gugus fungsi, maka reaksi berikutnya dapat terjadi.
Misalnya reaksi antara 2 monomer asam heksanadioat (asam adiapat) dan etana 1,2-diol :
Polimerisasi kondensasi hampir selalu berlangsung secara bertahap dengan reaksi antara pasangan gugus fungsi, sehingga terbentuk dimer, trimer, tetramer, dan seterusnya hingga terbentuk polimer.
Polimer yang terbentuk mengandung kesatuan yang berulang, berikut reaksinya :
[-O(CH2)2COO(CH2)4CO-]n
Dengan demikian massa molekul nisbi bertambah secara bertahap selama reaksi berlangsung dan waktu rekasi lama jika diperlukan massa molekul polimer nisbi yang besar. Jadi berbeda dengan polimerisasi adisi rantai yang membentuk polimer bernassa molekul besar sekaligus.
2.2.2.2 Polimerisasi Adisi (Chain Polymerization)
Polimerisasi adisi adalah polimerisasi yang melibatkan reaksi rantai dan disebabkan oleh radikal bebas (partikel reaktif yang mengandung elektron tak berpasangan) atau ion. Polimer penting yang dihasilkan melalui polimerisasi adisi adalah turunan etena berbentuk CH2=CHX atau CH2=CXY, yang disebut monomer
vynil.
Menurut F.W Billmeyer pada tahun 1984 reaksi umumnya dapat dituliskan sebagai berikut :
CH2=CH -CH2-CH-CH2-CH- dst
X X X
Polimerisasi ini berlangsung sangat cepat (beberapa detik). Reaksi keseluruhannya memakan waktu lama, karena penelitian menunjukan bahwa reaksi rantai berlangsung dalam suatu deret reaksi cepat yang diselingi waktu yang cukup panjang yang diistilahkan sebagai gejolak.
Tabel 2.1 Perbedaan Antara Mekanisme Polimerisasi Kondensasi dengan Polimerisasi Adisi
Polimerisasi Kondensasi Polimerisasi Adisi
Reaksi terjadi dengan adanya dua jenis molekul
Monomer dapat dihilangkan lebih awal di dalam reaksi: pada saat DP=10, Kurang dari 1% monomer sisa
Berat molekul polimer terjadi dengan adanya reaksi Steady
(Tetap) secara perlahan
Lama waktu reaksi sangat penting untuk mencapai berat molekul yang tinggi
Beberapa tahap molekul akan didistribusikan
Reaksi memanjang dengan
adanya pengulangan unit monomer setiap saat
Konsentrasi monomer menurun perlahan sesuai dengan reaksi
steady
Polimer tinggi terbentuk sekali, yaitu pada saat polimer terjadi perubahan BM sudah tinggi. Lama waktu reaksi menyebabkan yield tinggi, namun BM menjadi kecil.
Reaksi pencampuran hanya berisi monomer tinggi, kira-kira seperseribu bagian dari rantai yang menunjang
A. Polimerisasi Radikal Bebas
Menurut F.W Billmeyer pada tahun 1984, tahap-tahap yang terjadi pada polimerisasi radikal bebas yaitu:
1. Inisiasi (tahap pemicuan)
Pemicuan dapat dipandangsenagai penguraian pemicu dan adisi molekul monomer pada salah satu radikal bebas yang terbentuk. Jika merupakan pemicu , R sebagai Radikal Bebas dan molekul monomer dinyatakan dengan CH2=CHx,
Proses pemicuan dapat digambarkan sebagai berikut: I 2R•
H R• + CH2=CHX R CH2C•
X
2. Propagasi (tahap perambatan)
Pada tahap ini terbentuk rantai radikal, dan dapat berturut-turut bereaksi dengan monomer sehingga memperbanyak rantai.
H H R-(CH2CHX-)xCH2C• + CH2=CHX …. R-(CH2CHX-)x+1CH2C•
X X Tahap ini berjalan terus menerus sampai suplai monomer habis.
3. Terminasi (tahap pengakhiran)
Tahap terminasi dapat tercapai dengan dua cara, yaitu: Kombinasi atau Coupling
H H H H CH2C• + •CCH2- -CH2C-CCH2-
Disproporsionasi
H H H H CH2C• + •CCH2- -CH2C-H + C=CH
X X X X
Tranfer hidrogen menghasilkan dua bentuk akhir molekul jenuh dan tak jenuh. Terminasi Polystyrene lebih banyak menggunakan cara kombinasi. Sedangkan Poly (methylmethacrylate) menggunakan disproporsionasi.
B. Polimerisasi Ion
Menurut M.A.Cowd pada tahun 1991, polimerisasi ion dapat berlangsung dengan mekanisme yang tidak melibatkan radikal bebas. Misalnya, pembawa rantai dapat berupa ion carbonium (polimerisasi kation) atau carbonium (polimerisasi anion).
a. Polimerisasi Kation
Pada polimerisasi ini, monomernya CH2=CHX dan pembawa rantainya
adalah ion karbonium. Katalis yang digunakan pada reaksi polimerisasi adalah asam Lewis (penerima pasangan elektron) dan katalis Friedel-Crafts (AlCl3, AlBr3, BF3, TiCl4, SnCl4, H2SO4 dan asam kuat lainnya). Berbeda
dengan polimerisasi radikal bebas yang umumnya berlangsung pada suhu tinggi, polimerisasi kation paling baik berlangsung pada suhu rendah. Misalnya, polimerisasi 2-methyl propena (isobutilena) berlangsung sangat cepat pada suhu -100 oC dengan adanya katalis AlCl3 atau BF3. Pelarut sangat
berpengaruh, sebab mekanisme ion melibatkan partikel-partikel bermuatan. Sedangkan radikal bebas umumnya netral. Polimerisasi kation sering terjadi pada monomer yang mengandung gugus pelepasan elektron. Dengan katalis asam, proses dapat digambarkan sebagai berikut:
1. Inisiasi
H HA + CH2=CHX CH3-C+ + A-
HA adalah molekul asam, seperti: asam sulfat, asam klorida, asam perklorat. Pada tahap pemicuan ini, proton dialihkan dari asam ke monomer sehingga menghasilkan ion karbonium.
2. Propagasi
Tahap perambatan ini berupa adisi monomer pada ion karbonium yang dihasilkan tadi.
H H H H CH3-C+ + CH2=CHX CH3C-C-C+
X X H X
Oleh karena katalis Friedel-Crafts tidak mengandung hidrogen, polimerisasi memerlukan bantuan katalis (co-catalis) berupa air:
BF3 + H2O BF3.H2O
H H
BF3.H2O + H2C=C H3C-C+ + [BF3OH]
X X Adanya air menyebabkan alih proton terjadi. 3. Terminasi
Pengakhiran rantai paling sederhana dan nyata adalah penggabungan ion karbonium dan anion pasangannya (ion lawan).
H H ~~~CH2-C+ + A- ~~~CH2-C-A
X X
b. Polimerisasi Anion
metakrilat), dan fenilethena (styrena). Polimerisasi anion bersuhu rendah (-73
o
C). Katalis yang dipakai meliputi logam alkali, alki, aril dan amida logam alkali. Salah satu penerapan paling awal polimerisasi ini dalam dunia industri asalah pada pembuatan karet sintetis, di Jerman dan Rusia, dari buta-1,3-diena (butabuta-1,3-diena) dengan katalis logam alkali.
Contoh polimerisasi anion: 1. Inisiasi
Amida logam alkali, seperti kalium amida (KNH2) dalam pelarut
amonia cair terionisasi kuat, sehingga tahap pemicuannya:
H H H2N- + H2C=C H2N-CH2-C-:
H X
2. Propagasi
Ion lawan (penetral) bagi karbonium adalah K+
H H H H H H H H2N-C-C-: + H2C=C H2N-C-C-C-C:
H X X H X H X
3. Terminasi
Polimerisasi hanya berhenti ketika seluruh monomer pereaksi habis terpakai. Walaupun demikian, pusat aktif (atau karbonium) tidak rusak, dan jika lebih banyak monomer ditambahkan, maka dapat dipicu lagi. Untuk mengakhiri pertumbuhan rantai, hanya diperlukan sedikit air, karbondioksida dan alkohol.
H H H H
C-C-:K+ + H2O ~~~C-C-H + K+ OH
Katalis utama bagi polimerisasi anion adalah katalis Ziegler-Natta
(Katalis Ziegler) yang ditemukan oleh Ziegler pada tahun 1953. ia menggunakan katalisnya untuk polimerisasi ethylene. Selanjutnya, Natta pada tahun 1955 menggunakan katalis tersebut untuk polimerisasi propilene dan monomer jenuh lainnya. Katalis ziegler-Natta dapat dibuat dengan mencampurkan alkil atau aril dari golongan I-III pada susunan berkala, dengan halida unsur transisi. Misalnya Tri Isobutil Alumunium {Al(i-C4H9)3} yang jika ditambahkan ke dalam
Titanium (IV) Klorida dalam pelarut heksana, menghasilkan endapan coklat hitam yang dapat mempercepat polimerisasi etena pada tekanan rendah.
2.2.3 Penggolongan Polimer
Polimer dapat dibedakan berdasarkan asalnya, jenis monomer penyusunnya, pengaruh panas terhadap sifat fisiknya dan berdasarkan strukturnya.
1. Berdasarkan asalnya
Polimer dibedakan menjadi polimer alam dan polimer sintetik. Polimer alam telah banyak dikembangkan sejak tahun 1880 untuk memproduksi berbagai material. Polimer sintetik merupakan polimer yang dibuat di pabrik dan tidak terdapat di alam. Polimer ini meliputi semua jenis plastik, serat, karet sintetik dan nilon.
Beberapa contoh dari polimer alam disajikan pada Tabel 2.2 Tabel 2.2 Contoh Polimer Alam
Polimer Monomer Polimerisasi Terdapat pada
Protein Asam amino Kondensasi Wol, sutera
Amilum Glukosa Kondensasi Beras, gandum
Selulosa Glukosa Kondensasi Kayu
Asam nukleat Nukleotida Kondensasi DNA, RNA
Karet alam Isoprena Adisi Getah pohon karet
Beberapa contoh polimer sintetik disajikan dalam Tabel 2.3 Tabel 2.3 Contoh Polimer Sintetik
Polimer Monomer Polimerisasi Terdapat pada
Polietilena Etena Adisi Plastik
PVC Vinilklorida Adisi Pelapis lantai, pipa
Polipropilena Propena Adisi Tali plastik, botol
Teflon Tetrafluoroetilena Adisi Panci anti lengket (Sumber : Michael Purba, 2000)
2. Berdasarkan jenis monomer penyusunnya
Berdasarkan monomer penyusunnya maka polimer dibedakan menjadi homopolimer dan kopolimer. Homopolimer terbentuk dari monomer yang sejenis. Contohnya yaitu polyethylene, polypropylene, polystyrene, PVC, teflon, amilum, selulosa dan sebagainya. Kopolimer terbentuk dari dua atau lebih monomer yang berbeda jenisnya. Contoh polimer ini yaitu dakron.
3. Berdasarkan pengaruh panas terhadap sifat fisik
Dibedakan menjadi dua yaitu polimer thermosetting dan polimer thermoplastic. Polimer thermosetting bila dipanaskan akan mengeras dan bila dipanaskan lagi akan rusak, sehingga tidak dapat kembali ke bentuk semula. Contoh : phenol
formaldehyde. Sedangkan polimer thermoplastic, apabila dipanaskan akan
meleleh dan setelah didinginkan akan mengeras dan dapat kembali ke bentuknya semula. Contoh : polyethylene dan poly vinyl chloride.
4. Berdasarkan struktur
Berdasarkan strukturnya, maka dibedakan atas polimer yang berstruktur tiga dimensi dan polimer yang berstruktur linear. Polimer yang berstruktur tiga dimensi memiliki susunan rantai yang saling mengikat membentuk struktur tiga dimensi dan biasanya bersifat therosetting. Contoh : phenol formaldehyde. Sedangkan polimer yang berstruktur linear memiliki susunan rantai yang berbentuk lurus (linear) dan biasanya bersifat thermopalstic. Contoh :