KERAGAMAN GENETIK MENGGUNAKAN MARKA
MOLEKULER
RANDOM AMPLIFIED POLYMORPHIC
DNA
(RAPD) DAN AKTIVITAS ANTIOKSIDAN SIRSAK (
Annona
muricata
L.) DI JAWA BARAT
PRIATNO KHANNA
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Keragaman Genetik menggunakan Marka Molekuler Random Amplified Polymorphic DNA (RAPD) dan Aktivitas Antioksidan Sirsak (Annona muricata L.) Di Jawa Barat adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Priatno Khanna
RINGKASAN
PRIATNO KHANNA. Keragaman Genetik Menggunakan Marka molekuler
Random Amplified Polymorphic DNA (RAPD) dan Aktivitas Antioksidan Sirsak (Annona muricata L.) di Jawa Barat. Dibimbing oleh AKHMAD ENDANG ZAINAL HASAN dan I MADE ARTIKA.
Sirsak (Annona muricata L.) merupakan salah satu jenis tanaman obat yang saat ini sedang dikembangkan. Berdasarkan data yang diperoleh dari data Dinas Pertanian Tanaman Pangan Provinsi Jawa Barat 2014, diketahui sentra produksi komoditas unggulan Jawa Barat untuk tanaman sirsak berada di daerah Sukabumi, Cianjur, dan Garut. Adanya polimorfisme DNA pada tanaman sirsak di Jawa Barat khususnya pada daerah produksi komoditas utama sirsak belum diidentifikasi. Oleh karena itu, penelitian perlu dilakukan untuk mengetahui pola genetik dari tanaman sirsak di Jawa Barat. Selain keragaman genetik dari tanaman sirsak, uji aktivitas antioksidan sirsak di daerah komoditas unggulan di Jawa Barat juga belum dilakukan, untuk itu perlu dilakukan uji aktivitas antioksidan di 3 daerah unggulan Jawa Barat untuk meningkatkan potensi dari sirsak dari tiap daerah.
Keragaman genetik dilakukan terhadap 3 sampel pada masing-masing kabupaten dengan menggunakan marka molekuler Random Amplified Polymorphic DNA (RAPD). Pengujian aktivitas antioksidan dilakukan dengan menggunakan metode DPPH (2,2-difenil-1-pikrilhidrazil) yang diawali dengan ekstraksi daun sirsak menggunakan pelarut etanol.
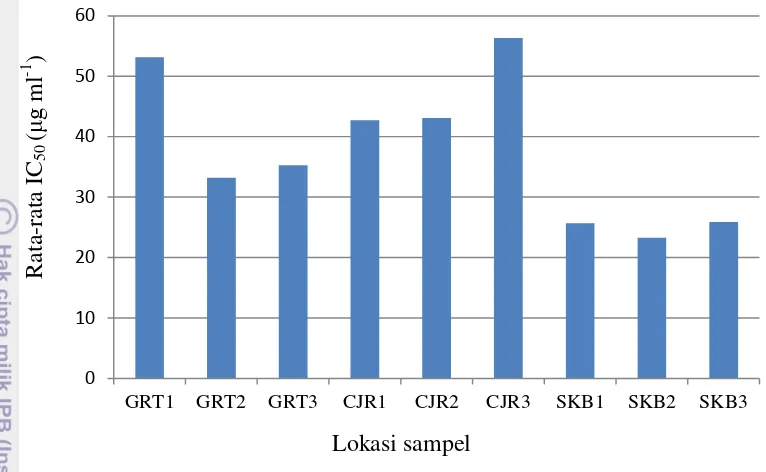
Hasil penelitian menunjukkan keragaman genetik menggunakan marka molekuler RAPD pada populasi tanaman sirsak di Jawa Barat pada daerah Garut, Cianjur, dan Sukabumi dengan menggunakan 5 jenis primer (E3, E14, H5, H9, H13) menghasilkan 30 pita DNA polimorfik. Dendogram hubungan kekerabatan dalam satu kabupaten berdasarkan penanda RAPD menunjukkan hubungan kekerabatan terjauh diperoleh antara Sukabumi1 dan Sukabumi2 sebesar 0.39 sedangkan keragaman genetik terendah pada sampel Cianjur2 dengan Cianjur3 sebesar 0.94. Hasil uji aktivitas antioksidan terkuat adalah daerah Sukabumi2 dengan nilai IC50 (Inhibition Concentration 50%) sebesar 23.25 μg ml-1
sedangkan aktivitas antioksidan terendah adalah Cianjur3 sebesar 56.34 μg ml-1. Semakin rendah nilai IC50 maka aktivitas antioksidan sampel semakin kuat.
SUMMARY
PRIATNO KHANNA. Genetic Diversity Using Random Amplified Polymorphic DNA (RAPD) Markers and Antioxidant Activity of Soursop (Annona muricata
L.) in West Java. Supervised by AKHMAD ENDANG ZAINAL HASAN and I MADE ARTIKA.
Soursop (Annona muricata L.) is one species of medicinal plants that are currently being developed. Based on data obtained from the Department of Food Crops of West Java Province in 2014, known as the production centers in West Java leading commodity soursop plants were in Sukabumi, Cianjur and Garut. The presence of DNA polymorphism in soursop plant in West Java, especially in the area of production of major commodities soursop has not been identified. Therefore, the research needs to be conducted to determine the genetic pattern of the soursop plant in West Java. In addition to the genetic diversity of soursop, soursop antioxidant activity in the area of leading commodity in West Java has not been done, therefore it is necessary to test the antioxidant activity in the 3 seed area of West Java to increase the potential of soursop of each region.
Genetic diversity analysis conducted on three samples at each district using molecular Random Amplified Polymorphic DNA (RAPD) markers. Analysis of antioxidant activity using DPPH (2,2-diphenyl-1-picrylhydrazyl) initiated by soursop leaf extraction using ethanol.
The results showed that the genetic diversity using RAPD markers, populations soursop plant in West Java in Garut, Cianjur and Sukabumi using 5 types of primary (E3, E14, H5, H9, H13) resulted in 30 polymorphic DNA bands. Dendogram correlation within a district based on RAPD markers obtained indicate the highest correlation between Sukabumi1 and Sukabumi2 of 0,39 while the lowest genetic diversity in the samples Cianjur2 with Cianjur3 from of 0.94. The strongest antioxidant activity is Sukabumi2 with IC50 (Inhibition
Concentration 50%) of 23.25 μg ml-1 while the lowest antioxidant activity is Cianjur3 of 56.34 μg ml-1. If IC50 value is lower, the antioxidant activity will be
stronger.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Biokimia
KERAGAMAN GENETIK MENGGUNAKAN MARKA
MOLEKULER
RANDOM AMPLIFIED POLYMORPHIC
DNA
(RAPD) DAN AKTIVITAS ANTIOKSIDAN SIRSAK (
Annona
muricata
L.) DI JAWA BARAT
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2015
Judul Tesis : Keragaman Genetik Menggunakan Marka molekuler Random Amplified Polymorphic DNA (RAPD) dan Aktivitas Antioksidan Sirsak (Annona muricata L.) di Jawa Barat
Nama : Priatno Khanna NIM : G851130211
Disetujui oleh Komisi Pembimbing
Dr Ir Akhmad Endang Zainal Hasan, MSi Ketua
Dr Ir I Made Artika, M App Sc Anggota
Diketahui oleh
Ketua Program Studi Biokimia
Prof Dr drh Maria Bintang, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MScAgr
PRAKATA
Penulis memanjatkan puji syukur kepada Allah SWT yang telah melimpahkan rahmat-Nya sehingga penulis dapat menyelesaikan karya tulis ini.
Karya tulis ini merupakan hasil penelitian tesis dengan judul “Keragaman Genetik menggunakan Marka molekuler Random Amplified Polymorphic DNA (RAPD) dan Aktivitas Antioksidan Sirsak (Annona muricataL.) Di Jawa Barat”.
Melalui karya tulis ini penulis menyampaikan terima kasih kepada Dr Ir Akhmad Endang Zainal Hasan, MSi dan Dr Ir I Made Artika, M App Sc selaku Dosen Pembimbing atas saran dan arahannya dalam penyusunan tulisan ini. Terima kasih penulis sampaikan untuk teman-teman program studi Biokimia 2013 atas semangat dan bantuan yang diberikan. Penulis juga ingin mengucapkan terima kasih kepada Bapak Yudi atas bantuan teknis di laboratorium. Usep dan Livia yang telah membantu dalam penyelesaian tesis. Tak lupa untuk keluargaku tercinta (Ibu, Ayah, Pita, Bowo) yang selalu memberikan doa, semangat dan motivasi yang tiada putus-putusnya. Serta, pihak-pihak lain yang ikut membantu. Semoga hasil penelitian ini dapat memberi manfaat, terutama untuk pengembangan ilmu Biokimia.
Bogor, Agustus 2015
Priatno Khanna
DAFTAR ISI
Waktu dan Tempat Penelitian 3
Bahan 3
Alat 3
Ekstraksi DNA 3
Uji Kualitas dan Kuantitas DNA 4
Amplifikasi DNA Genom 4
Seleksi Primer untuk Amplifikasi DNA 5
Gel Elektroforesis 5
Analisis Polimorfisme 5
Ekstraksi Daun Sirsak 5
Uji Aktivitas Antioksidan 5
3 HASIL 6
Kualitas dan Kuantitas DNA 6
Primer dan Amplifikasi DNA Terseleksi 7
Dendogram Kemiripan Genetik menggunakan Program NTSYS 2.02 9 Aktivitas Antioksidan Annona muricata L. dengan Metode
2,2-difenil-1-dipikrilhidrazin (DPPH) 10
4 PEMBAHASAN 11
Keragaman Genetik Sirsak dari Sembilan Sampel Sirsak 11 Aktivitas Antioksidan Annona muricata L. dengan Metode
2,2-difenil-1-dipikrilhidrazin (DPPH) 12
Hubungan Antara Keragaman Genetik dan Aktivitas Antioksidan Sirsak 14
5 KESIMPULAN DAN SARAN 15
Kesimpulan 15
DAFTAR PUSTAKA 15
LAMPIRAN 18
RIWAYAT HIDUP 21
DAFTAR TABEL
1. Jumlah fragment DNA pada 5 primer 7
2. Matriks similiaritas genetik sembilan sampel
Annona muricata L. dengan penanda 10
DAFTAR GAMBAR
1. Hasil ekstraksi DNA genom 6
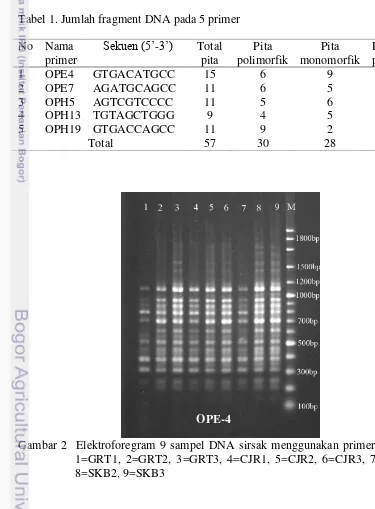
2. Elektroforegram 9 sampel DNA sirsak menggunakan primer OPE-4 7 3. Elektroforegram 9 sampel DNA sirsak menggunakan primer OPE-7 8 4. Elektroforegram 9 sampel DNA sirsak menggunakan primer OPH-5 8 5. Elektroforegram 9 sampel DNA sirsak menggunakan primer OPH-13 9 6. Elektroforegram 9 sampel DNA sirsak menggunakan primer OPH-19 9 7. Dendogram kemiripan genetik dari 9 sampel berdasarkan metode
UPGMA menggunakan lima primer 10
8. Nilai rata-rata IC50 ekstrak 9 sampel sirsak 11
DAFTAR LAMPIRAN
1.Diagram alir penelitian 16
2.Urutan nukleotida primer acak (GC > 70%) 18
3.Absorbansi ekstrak daun sirsak pada panjang gelombang 517 nm 19
4.Persen inhibisi ekstrak daun sirsak 19
1 PENDAHULUAN
Latar Belakang
Pengembangan tanaman yang berpotensi menjadi tanaman obat terus dilakukan. Pemanfaatan kekayaan sumber daya hayati Indonesia dan kesehatan tradisional agar dapat terintegrasi dalam sistem pelayanan formal mulai diupayakan oleh pemerintah dengan diterbitkannya peraturan Menteri Kesehatan Republik Indonesia nomor 88 tahun 2013 tentang rencana induk pengembangan bahan baku obat tradisional. Salah satu tanaman obat yang saat ini sedang dikembangkan adalah Sirsak (Annona muricata L.). Daun sirsak banyak digunakan sebagai obat herbal untuk mengobati berbagai penyakit, antara lain : penyakit asma di Andes Peru, diabetes dan kejang di Amozania Peru (Zuhud 2011). Senyawa flavonoid berfungsi sebagai antioksidan untuk penyakit kanker, antimikroba, antivirus, pengatur fotosintetis, dan pengatur tumbuh (Robinson 1995). Berdasarkan data yang diperoleh dari data Dinas Pertanian Tanaman Pangan Provinsi Jawa Barat 2014, sentra produksi komoditas unggulan Jawa Barat untuk tanaman sirsak berada di daerah Sukabumi, Cianjur, dan Garut.
Pengetahuan tentang variasi genetik sangat penting bagi program pemuliaan karena memberikan informasi mengenai struktur molekul genetik tanaman, sehingga dapat digunakan sebagai dasar untuk seleksi tanaman yang akan dibudidayakan. Variasi genetik dapat digunakan sebagai bahan seleksi genotip yang dikehendaki. Pengembangan bidang molekular dengan analisis DNA akhir-akhir ini sering digunakan untuk mengkarakterisasi variasi genetik dan kekerabatan dalam suatu genus, spesies, kultivar atau aksesi. Informasi tentang keragaman genetik merupakan modal dasar bagi para ahli pemuliaan dan genetika populasi dalam pengembangan dan perbaikan tanaman, terutama sebagai langkah awal dalam seleksi tanaman. Langkah ini penting terutama untuk membedakan individu dalam spesies serta untuk identifikasi genotip secara tepat.
Analisis RAPD merupakan salah satu metode analisis molekul yang digunakan untuk mengevaluasi hubungan genetik populasi organisme. Dasar analisis RAPD adalah penggunaan mesin PCR yang mampu mengamplifikasi sekuen DNA secara in vitro. Teknik PCR melibatkan temperatur, denaturasi DNA, penempelan primer pada DNA, dan perpanjangan primer oleh enzim DNA polimerase menjadi suatu fragmen DNA dengan berbagai ukuran (Weising et al. 1995). Penggunaan penanda RAPD relatif lebih murah, mudah, cepat memberikan hasil, tidak memerlukan pengetahuan tentang latar belakang dari genom yang dianalisis dan mudah memperoleh primer acak yang diperlukan untuk menganalisis genom (Tingey et al. 1992). Penanda RAPD telah banyak digunakan untuk berbagai keperluan seperti mempelajari keragaman genetik pada kunyit dan temulawak (Utami 2012), Ganoderma spp. (Palupi 2010), kurma (Hussam et al.
2014), ara tunisia barbari (Bendhifi et al. 2013), dan kacang almond (Sharma et al. 2012).
2
produksi komoditas utama sirsak belum diidentifikasi. Oleh karena itu, penelitian perlu dilakukan untuk mengetahui pola genetik dari tanaman sirsak di Jawa Barat.
Penelitian tentang manfaat sirsak terutama sebagai antioksidan telah dibanyak dilakukan, seperti penelitian Handayani et al. (2015), Rivai et al. (2013), Latifah (2013), Adri dan Hersoelistyorini (2013), Putri (2012), namun untuk aktivitas antioksidan sirsak di daerah penghasil komoditas unggulan di Jawa Barat belum dilakukan, untuk itu perlu dilakukan uji aktivitas antioksidan di tiga daerah unggulan Jawa Barat untuk meningkatkan potensi dari sirsak dari tiap daerah.
Perumusan Masalah
Aktivitas antioksidan dan analisis keragaman genetik dengan menggunakan penanda molekuler perlu dilakukan untuk mengetahui keragaman genetik sirsak yang berasal dari daerah penghasil komoditas utama sirsak di wilayah di Jawa Barat. Penelitian terkait aktivitas antioksidan dan RAPD telah banyak dilakukan, namun penelitian tentang aktivitas antioksidan pada sirsak khususnya daerah penghasil komoditas utama di Jawa Barat sejauh ini belum dilaporkan.
Tujuan Penelitian
Penelitian ini bertujuan untuk menganalisis keragaman genetik sirsak (Annona Muricata L.) yang berasal dari berbagai wilayah di Jawa Barat berdasarkan teknik Random Amplified Polymorphic DNA (RAPD) dan menguji aktivitas antioksidan dari ekstrak daun sirsak di berbagai wilayah di Jawa Barat.
Manfaat Penelitian
Beberapa manfaat yang dapat diambil dari penelitian ini adalah sebagai informasi ilmiah mengenai keragaman genetik dan aktivitas antioksidan sirsak (Annona Muricata L.) dari berbagai daerah di Jawa Barat. Hasil yang diperoleh diharapkan menjadi landasan awal dalam seleksi pembudidayaan sirsak dan untuk pengembangan potensi daerah penghasil sirsak di Jawa Barat.
Ruang Lingkup Penelitian
3
2 METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan pada bulan September 2014 sampai Maret 2015. Analisis keragaman genetik dikerjakan di Laboratorium Biologi Molekuler Tumbuhan II, Agronomi dan Hortikulutura Fakultas Pertanian IPB. Pengujian aktivitas antioksidan dikerjakan di Laboratorium Biokimia dan Laboratorium Pusat Studi Biofarmaka (PSB).
Bahan
Bahan-bahan yang digunakan adalah daun sirsak dari 3 kabupaten (Garut: Lewigoong= GRT1, Cangkuang= GRT2, Kadungora= GRT3; Cianjur: Sukasirna= CJR1, Sukasarana= CJR2, Ciherang= CJR3; Sukabumi: Karangpapak ratu= SKB1, Karangpapak asam= SKB2, Sukasari= SKB3) di 9 lokasi diwilayah Jawa Barat, microplate antioksidan, Elisa reader, Larutan CTAB 10%, EDTA 0.5 M pH 8.0, Tris-HCl 1 M pH 8.0, NaCl 5 M, akuades steril, polivinilpolipirolidin (PVPP), larutan kloroform: isoamilalkohol (24:1), EtOH 100%, bufer Tris-HCl – EDTA (TE), alkohol absolut, etanol 70%, bubuk agarosa, bufer Tris-HCl – boric acid – EDTA (TBE) 0.5x, etidium bromida (EtBr), loading dye , marker 100bp
Alat-alat yang digunakan dalam penelitian ini adalah timbangan analitik, mesin PCR (Esco), perangkat elektroforesis (Bio-Rad), gel documentation (Alpha Innotech), spektrofotometer, waterbath, hot plate, sentrifus, lemari es dan freezer,
vortex mixer, desikator vacuum pump, gelas ukur 100 ml, erlenmeyer 100 ml, mortar dan pestel, spatula, gunting, pipet mikro, tip mikro, tabung mikrosentrifus, dan sarung tangan karet, mesh screen berukuran 40-60 mesh, penguap putar, alat soklet, corong, kertas saring, alumunium foil, dan oven.
Prosedur Penelitian
Ekstraksi DNA
4
Tahapan selanjutnya dilakukan inkubasi sampel dalam water bath bersuhu 65°C selama 15 menit sambil tabung dibolak-balik setiap 5 menit. Tahapan ini dilakukan untuk mengoptimalkan kerja buffer ekstrak yang ditambahkan ke dalam sampel. Sampel kemudian ditambahkan dengan 700 μl larutan Khloroform: Isoamil alkohol (dengan perbandingan 24:1). Penambahan ini dilakukan untuk mengekstraksi DNA dari kontaminan. Khloroform merupakan pelarut organik yang dapat melarutkan protein, lipid, dan molekul lain seperti polisakarida. Sampel kemudian divortex selama 2-3 menit, selanjutnya dilakukan sentrifugasi sampel dengan kecepatan 11.000 rpm selama 5 menit. Tujuannya untuk memisahkan debris dan komponen sel lain yang menjadi penyebab kontaminasi dengan DNA.
Supernatan yang telah diperoleh kemudian diambil dan ditambahkan lagi dengan 700 μl larutan Khloroform: Isoamil-alkohol (24:1). Penambahan ini dilakukan untuk memperoleh supernatan berisi DNA yang bebas kontaminan. Suspensi kemudian divortex sampai rata untuk optimalisasi homogenasi. Selanjutnya suspensi disentrifugasi pada kecepatan 11.000 rpm pada suhu 25°C selama 5 menit, sehingga diperoleh suspensi dengan lapisan; lapisan atas berupa supernatan, dan lapisan bawah berupa pelet. Supernatan pada lapisan paling atas diambil dan ditambahkan dengan 2/3 x volume larutan etanol absolut untuk presipitasi DNA. Supernatan yang telah ditambahkan etanol absolut kemudian digoyang perlahan-lahan dengan cara membolak-balikkan tabung. Untuk mengendapkan DNA (pelet DNA), larutan disentrifugasi kembali pada kecepatan 9.000 rpm pada suhu 4°C selama 5 menit, kemudian cairan etanol dibuang dan pelet DNA dikeringkan dengan alat desikator, lalu dilarutkan dalam 100 μL akuabides. DNA disimpan dalam refrigerator sampai siap digunakan.
Uji Kualitas dan Kuantitas DNA (Sambrook et al. 1989)
Pengujian integritas DNA secara kualitatif dilakukan dengan elektroforesis gel agarosa 1%. Sebanyak 0.4 gram bubuk agarosa ditimbang dan dilarutkan ke dalam 40 mL bufer TBE 0.5x dengan menggunakan hot plate, kemudian dituang ke dalam cetakan bersisir dan didinginkan hingga beku. Gel agarosa beku dimasukkan ke dalam bak elektroforesis berisi bufer TBE 0.5x, selanjutnya
sebanyak 1 μL loading dye dan 5 μL sampel DNA diinjeksikan ke dalam sumur.
Perangkat elektroforesis dihubungkan pada arus listrik dan dijalankan pada tegangan 90 volt selama 85 menit.
Pengukuran kuantitas DNA dilakukan dengan metode spektrofotometri menggunakan spektrofotometer. Sampel DNA diencerkan sebanyak 140x dengan
menambahkan 695 μL ke dalam 5 μL sampel DNA, selanjutnya diukur
absorbansinya pada panjang gelombang 260 dan 280 nm. Tingkat kemurnian sampel diperkirakan berdasarkan nilai rasio serapan pada panjang gelombang 260 dan 280 nm, sedangkan konsentrasi sampel diperoleh dari hasil perkalian nilai serapan pada panjang gelombang 260 nm dengan faktor konversi dan faktor pengenceran.
Amplifikasi DNA Genom
Tabung PCR berisi 5 μl Taq DNA polymerase, 5 μl RAPD primer dan 2.5μl
DNA sampel sehingga total larutan untuk tiap reaksi menjadi 10 μl. Reaksi
5 PCR sebagai berikut: satu siklus 5 menit pada suhu 94°C, dan diikuti dengan 44 siklus selama 1 menit pada suhu 94°C (denaturasi), 1 menit pada suhu 33.2°C (bergantung pada jenis primer) (annealing), 1 menit pada suhu 72°C (ekstensi). Seluruh produk amplifikasi DNA dilengkapi dengan ekstensi selama 10 menit pada suhu 72°C.
Seleksi Primer untuk Amplifikasi DNA
Sebanyak 15 primer oligonukleotida acak yaitu OPE1, OPE3, OPE7, OPE4, OPE10, OPE18, OPE19, OPH5, OPH16, OPH19, OPM6, OPH13, OPM18, OPM20, OPM24 digunakan untuk mengamplifikasi dua sampel DNA dengan program RAPD. Produk PCR diuji dengan elektroforesis gel agarosa untuk melihat pita-pita yang terbentuk. Dari pita-pita yang dihasilkan, dipilih 5 primer yang dapat menghasilkan pita dengan intensitas tegas dan banyak polimorfik. Primer-primer terpilih digunakan untuk mengamplifikasi seluruh sampel.
Gel Elektroforesis
Setelah proses PCR, 2,5 μl campuran sampel ditambahkan 2,5 μl loading dye kemudian dimasukkan dalam sumuran gel 1% dalam perangkat elektroforesis yang sudah diisi bufer TBE 0,5x, diisikan satu sumuran terakhir dengan 1 Kb DNA marker. Setelah itu elektroforesis dijalankan dengan daya 90 volts sampai 45 menit. Gel kemudian direndam dalam larutan etidium bromida selama 30 detik. Selanjutnya gel diamati di bawah lampu UV menggunakan Gel documentation system.
Analisis Polimorfisme
Data yang diperoleh dari pemotretan gel hasil RAPD berupa pita-pita DNA diurutkan dari batas bawah sumur sampai batas bawah pita yang masih tampak. Analisis data didasarkan pada ada atau tidaknya pita. Profil pita diterjemahkan ke dalam bentuk biner dengan ketentuan nilai 0 untuk tidak ada pita dan 1 untuk ada pita pada satu posisi yang sama dari nomor-nomor sampel yang dibandingkan. Pembuatan dendogram dilakukan dengan metode Unweighted Pair-Group Method Arithmetic (UPGMA) menggunakan program Numerical Taxonomy and Multivariate System (NTSYS) versi 2.02 (Rohlf 1998).
Ekstraksi Daun Sirsak
Daun sirsak diekstraksi menggunakan metoda Hasan et al. (2013), Jang et al. (2006) dan Zhang et al.(2011) yang dimodifikasi. Sebanyak 200 g simplisia daun sirsak direndam dengan etanol 70 % selama 18 jam kemudian dipanaskan dengan pemanas gelombang mikro selama 20 menit. Hasilnya disaring lalu dikentalkan dan dikeringkan dengan evaporator vakum. Hasil yang diperoleh merupakan ekstrak daun sirsak.
Uji Aktivitas Antioksidan
6
Setelah itu dikocok dengan vorteks. Kemudian diambil 100 µl ekstrak dan direaksikan dengan 100 µl DPPH 125 µmol. Kemudian diinkubasi selama 30 menit. Setelah itu diukur absorbansinya dengan menggunakan ELISA reader pada panjang gelombang 515 nm. Persentase penangkapan radikal bebas DPPH diukur menggunakan persamaan :
% Penangkapan radikal = x 100%
Keterangan : A : serapan kontrol negatif (DPPH + etanol)
B : serapan ekstrak uji (DPPH +etanol+ ekstrak uji).
Setelah diketahui persentase penangkapan radikal bebas DPPH, dibuat kurva dan persamaan antara konsentrasi ekstrak daun sirsak (sumbu X) dan nilai persentase penangkapan radikal bebas DPPH (sumbu Y) diperoleh persamaan Y=a.ln(X)-b. Untuk menghitung konsentrasi yang menghasilkan penangkapan radikal bebas sebanyak 50% adalah dengan cara memasukkan angka 50 pada sumbu Y kemudian diperoleh nilai konsentrasi ekstrak daun sirsak pada sumbu X dari kurva antara konsentrasi ekstrak daun sirsak dan nilai persentase penangkapan radikal bebas DPPH. Nilai konsentrasi ekstrak daun sirsak yang diperoleh merupakan nilai IC50 aktivitas antioksidan.
3 HASIL
Kualitas dan Kuantitas DNA
7 Gambar 1 Hasil ekstraksi DNA genom: dari kiri kekanan GRT1, GRT2, GRT3, CJR1, CJR2, CJR3, SKB1, SKB2, dan SKB3, Marker 1 kb DNA Ladder.
Primer dan Amplifikasi DNA Terseleksi
15 primer oligonukleotida acak yaitu OPE1, OPE3, OPE7, OPE4, OPE10, OPE18, OPE19, OPH5, OPH16, OPH19, OPM6, OPH13, OPM18, OPM20, OPM24 diseleksi dengan mengamplifikasi dua sampel DNA. Hasil seleksi dari 15 primer terpilih 5 primer yang menunjukkan tingkat kualitas amplifikasi yang baik pada 2 sampel. Primer yang digunakan yaitu OPE-4, OPE-7, OPH-5, OPH-13, OPH-19. Lima primer terpilih digunakan untuk mengamplifikasi 9 sampel. Jumlah lokus yang diperoleh setelah proses RAPD-PCR pada semua sampel sebanyak 57 fragment (Gambar 2-6).
Tabel 1. Jumlah fragment DNA pada 5 primer
8
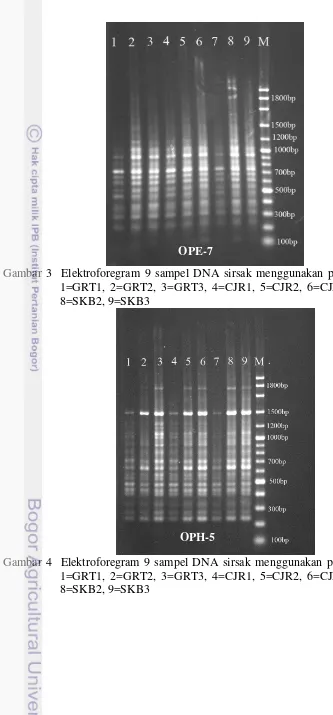
Gambar 3 Elektroforegram 9 sampel DNA sirsak menggunakan primer OPE-7. 1=GRT1, 2=GRT2, 3=GRT3, 4=CJR1, 5=CJR2, 6=CJR3, 7=SKB1, 8=SKB2, 9=SKB3
Gambar 4 Elektroforegram 9 sampel DNA sirsak menggunakan primer OPH-5. 1=GRT1, 2=GRT2, 3=GRT3, 4=CJR1, 5=CJR2, 6=CJR3, 7=SKB1, 8=SKB2, 9=SKB3
9
Gambar 5 Elektroforegram 9 sampel DNA sirsak menggunakan primer OPH-13. 1=GRT1, 2=GRT2, 3=GRT3, 4=CJR1, 5=CJR2, 6=CJR3, 7=SKB1, 8=SKB2, 9=SKB3
Gambar 6 Elektroforegram 9 sampel DNA sirsak menggunakan primer OPH-19. 1=GRT1, 2=GRT2, 3=GRT3, 4=CJR1, 5=CJR2, 6=CJR3, 7=SKB1, 8=SKB2, 9=SKB3
Dendogram Kemiripan Genetik menggunakan Program NTSYS 2.02
Analisis Clustering dari seluruh data membentuk dendogram (Gambar 7). Hubungan kekerabatan makin dekat bila nilai similaritas makin dekat dengan 1. Nilai indeks similaritas atau indeks kesamaan digunakan untuk membandingkan kesamaan yang ditemukan antara satu sampel dengan sampel lainnya. Jika nilai
OPH-13
10
mendekati 0% maka tingkat kemiripan rendah dan jika nilai mendekati 100% maka kesamaan komunitas antar sampel tergolong tinggi.
Gambar 7 Dendogram kemiripan genetik dari 9 sampel berdasarkan metode UPGMA menggunakan lima primer
Data elektroforegram hasil amplifikasi DNA dari Sembilan sampel menggunakan lima primer diubah ke dalam data biner dan dibuat matriks similiaritas (similarity matrix) berdasarkan metode Unweighted Pair-Group Method Arithmetic (UPGMA) menggunakan program numerical taxonomy and multivariate analysis system (NTSYS) 2.02.
Tabel 2 Matriks similiaritas genetik sembilan sampel Annona muricata L. dengan penanda RAPD
Aktivitas Antioksidan Annona muricata L. dengan Metode
2,2-difenil-1-dipikrilhidrazil (DPPH)
Aktivitas antioksidan dinyatakan dengan persentase penghambatan (inhibisi) yang diperoleh dari nilai absorbansi blanko dikurangi absorbansi sampel (Zhang et al. 2011). Hasil dari metode DPPH diinterpretasikan dalam parameter IC50 (Inhibition Concentration 50). Nilai rata-rata IC50 ekstrak Annona muricata L.
dari pelarut etanol dapat dilihat pada Gambar 8. Coefficient
0.43 0.49 0.54 0.60 0.66 0.71 0.77 0.83 0.88 0.94
11
Gambar 8 Nilai rata-rata IC50 ekstrak 9 sampel sirsak
Suatu senyawa dikatakan sebagai antioksidan sangat kuat apabila memiliki nilai IC50 kurang dari 50 μg ml-1, kuat apabila nilai IC50 antara 50-100 μg ml-1,
sedang apabila nilai IC50 berkisar antara 101-150 μg ml-1, dan lemah apabila nilai
IC50 berkisar antara 150-200 μg ml-1 (Molyneux 2004). Berdasarkan data yang
diperoleh, daerah Sukabumi memiliki aktivitas antioksidan terkuat.
4 PEMBAHASAN
Keragaman Genetik Sirsak dari Sembilan Sampel Sirsak
Penanda molekuler merupakan suatu penanda yang mampu membedakan setiap spesies tanaman atau genotip tanaman tanpa dipengaruhi oleh lingkungan. Penggunaan penanda molekuler sangat bermanfaat untuk membandingkan berbagai klasifikasi baik berdasarkan analisis RAPD maupun dengan analisis berdasarkan pada penanda lainnya seperti RFLP, AFLP, SSR sehingga hasil klasifikasi akan lebih akurat (Weising et al. 1995).
PCR merupakan suatu reaksi in vitro untuk menggandakan jumlah molekul DNA dengan cara mensintesis molekul DNA baru yang berkomplemen dengan molekul DNA cetakan dengan bantuan enzim DNA Polymerase dan primer dalam suatu thermocyler. Ada empat komponen utama yang dibutuhkan untuk melakukan proses PCR yaitu DNA template (cetakan), primer, DNA polymerase dan dNTPs. Proses PCR memiliki tiga tahapan utama, yaitu denaturasi, penempelan primer (annealing), dan pemanjangan sekuen (extension) (Zulfahmi 2013).
Penanda RAPD dihasilkan melalui amplifikasi DNA in vitro dengan menggunakan teknik PCR yaitu dengan menggunakan sekuen acak primer oligonukleotida. Penanda RAPD memiliki banyak kelebihan dibandingkan dengan penanda DNA lainnya yaitu antara lain penanda RAPD lebih murah, regenerasi
GRT1 GRT2 GRT3 CJR1 CJR2 CJR3 SKB1 SKB2 SKB3
12
cepat, membutuhkan DNA lebih sedikit, tidak menggunakan radio isotop dan untuk analisis tidak perlu keahlian yang khusus. Selain itu, penanda RAPD dapat dihasilkan tanpa perlu diketahui latar belakang genomnya. Disamping itu, pada analisis RAPD dapat diperoleh hasil dengan cepat, hasil estimasi yang lebih tinggi untuk kesamaan interspesifik, tidak memerlukan banyak tahapan, tidak membutuhkan informasi urutan primer serta primer acak yang dipakai dapat dibeli dan dapat digunakan untuk analisis genom semua jenis organisme (William et al.
1991).
Sembilan sampel diperoleh dari Jawa Barat yang diamplifikasi dengan menggunakan lima primer acak. Produk amplifikasi sembilan sampel menghasilkan 57 pita dan menghasilkan 30 pita polimorfik. Ukuran hasil amplifikasi pita monomorfik dan polimorfik berada pada 150bp sampai 1800bp. Pita terbanyak diperoleh dari primer OPE-4 yaitu 15 pita, sedangkan pita terendah dari primer OPH-13 yaitu 9 pita. Persentase polimorfisme dari 40 sampai 81.82%. Primer OPE-19 menghasilkan polimorfisme tertinggi yaitu 81.82%, sedangkan primer OPE-4 menghasilkan polimorfisme terendah yaitu 40%.
Berdasarkan dendogram hasil analisis UPGMA (Gambar 7), sembilan sampel sirsak dikelompokkan menjadi dua kelompok utama (A dan B) dengan koefisien similaritas dari 0.43 sampai 0.94. Kluster A terdiri atas empat sampel dan kelas B terdiri dari lima sampel. Kluster A terbagi menjadi dua subkluster (A1 dan A2). Subkluster A1 memiliki terdiri atas GRT1 dan CJR1 dengan jarak genetik 0.7 dan SKB1 dengan jarak 0.71, sedangkan subkluster A2 hanya terdiri dari GRT2 yang memiliki jarak genetik dengan subkluster A1 sebesar 0.57. Kluster B terbagi menjadi dua subkluster (B1 dan B2). Subkluster B2 hanya terdiri dari SKB2 dengan jarak genetik 0.72 sedangkan subkluster B1 terdiri atas GRT3, CJR2, CJR3, dan SKB3 dimana CJR2 dan CJR3 memiliki kekerabatan yang paling dekat yaitu 0.94. Keragaman genetik antara kelompok I dan II berada pada jarak 0.43 yang menandakan tingginya keragaman genetik antar kelompok kluster.
Ditinjau dari sebaran pengelompokan terlihat bahwa ada sekelompok sampel sirsak yang berada pada satu kluster yang berasal dari kabupaten yang sama, yaitu GRT1 dengan GRT2 dengan jarak genetik 0.56 pada kluster A yang berasal dari kabupaten Cianjur, dan pada kluster B terdapat SKB2 dan SKB3 dengan jarak genetik 0.72 yang berasal dari kabupaten Sukabumi, juga CJR2 dan CJR3 dengan jarak genetik 0.94 yang berasal dari kabupaten Cianjur. Adanya keragaman genetik yang tinggi dalam suatu wilayah menandakan bahwa keragaman tersebut tidak disebabkan karena perbedaan tempat. Keragaman ini bisa disebabkan karena perbedaan sumber bibit atau varietas. Keragaman genetik juga bisa disebabkan karena mutasi alami dan persilangan.
Aktivitas Antioksidan Sirsak dengan Metode 2,2-difenil-1-dipikrilhidrazil (DPPH)
13 sangat reaktif sehingga kerusakan sel akan dihambat (Winarsi 2007). Salah satu uji untuk menentukan aktivitas antioksidan penangkap radikal adalah metode 2,2-difenil-1-dipikrilhidrazil (DPPH). Metode ini memberikan informasi reaktivitas senyawa yang diuji dengan suatu radikal stabil. DPPH memberikan serapan kuat pada panjang gelombang 517 nm dengan warna violet gelap. Penangkapan radikal bebas menyebabkan elektron menjadi berpasangan yang kemudian menyebabkan penghilangan warna yang sebanding dengan jumlah elektron yang diambil (Kuncahyo dan Sunardi 2007).
Aktivitas antioksidan yang terdapat pada sampel dinyatakan dalam persentase inhibisinya terhadap radikal DPPH. Persentase inihibisi ini didapatkan dari serapan antara absorban DPPH dengan absorban sampel yang diukur dengan spektrofotometer UV-Vis. Besarnya aktivitas antioksidan ditandai dengan nilai IC50 (inhibition concentration 50%), yaitu konsentrasi larutan sampel yang
dibutuhkan untuk menghambat 50% radikal bebas DPPH (Andayani et al. 2008). Makin kecil nilai IC50 berarti makin tinggi aktivitas antioksidan.
Secara spesifik suatu senyawa dikatakan sebagai antioksidan sangat kuat jika nilai IC50 kurang dari 50 μg ml-1, kuat apabila nilai IC50 antara 50-100 μg ml-1,
sedang apabila nilai IC50 berkisar antara 101-150 μg ml-1, dan lemah apabila nilai
IC50 berkisar antara 150-200 μg ml-1 (Molyneux 2004). Menurut klasifikasi ini,
semua ekstrak daun sirsak yang diuji memiliki aktivitas antioksidan yang kuat. Hal tersebut dapat dilihat dari nilai IC50 pada ekstrak sirsak memiliki nilai IC50
berkisar 23.25 μg ml-1 sampai 56.34 μg ml-1. Aktivitas antioksidan terkuat berdasarkan nilai IC50 terendah yaitu pada sampel SKB2 sebesar 23.25 μg ml-1.
Aktivitas antioksidan terendah berada pada sampel CJR3 dengan IC50 sebesar
56.34 μg ml-1 . Berdasarkan wilayahnya, tiga sampel dari Sukabumi memiliki aktivitas antioksidan tertinggi dibanding sampel dari wilayah lainnya.
Metabolit sekunder merupakan senyawa yang tidak memiliki peranan penting dalam proses pertumbuhan tanaman, tapi sangat penting dalam interaksi dengan lingkungan untuk adaptasi dan pertahanan mengatasi kondisi stres. Ketika tumbuhan mengalami stres karena pengaruh lingkungan, produksi metabolit sekunder meningkat karena faktor pertumbuhan terhambat sehingga fiksasi karbon dialokasikan pada pembentukan metabolit sekunder. Secara umum, faktor yang mempengaruhi pembentukan metabolit sekunder menurut Ramakrishna (2011) yaitu: suhu, kelembaban, intensias cahaya, ketersediaan air, salinitas, kandungan air dan CO2. Daun sirsak mengandung senyawa flavonoid dan
polifenol yang dapat berperan sebagai antioksidan. Senyawa polifenol merupakan senyawa kimia yang memiliki leibh dari 1 cincin aromatik (C6) yang menyangga 1 atau lebih gugus hidroksil, sedangkan senyawa flavonoid merupakan senyawa yang memiliki kerangkan karbon C6-C3-C6 yang disintesis dari fenilalanin melalui lintasan shikimat, lintasan fenilpropanoid umum dan spesifik.
14
sebagai perlindungan selama pertumbuhan tanaman. Selain kekeringan, paparan UV-B pada tanaman juga dapat meningkatkan produksi flovanoid.
Pada sirsak ditemukan senyawa Acetogenin yang efektif melawan kanker. Kemampuan melawan kanker dapat menjadi interaksi yang efektif dengan kandungan senyawa antioksidan. Senyawa antioksidan tidak hanya digunakan sebagai langkah awal pencegahan berbagai penyakit degeneratif, namun dapat digunakan dalam proses pengobatan penyakit, dimana pada saat senyawa
acetogenin perperan dalam proses penghancuran sel kanker, senyawa antioksidan mencegah pembentukan kembali sel kanker.
Hubungan Antara Keragaman Genetik dan Aktivitas Antioksidan Sirsak
Berdasarkan wilayahnya, tiga lokasi sampel di Garut menghasilkan nilai aktivitas antioksidan kuat, nilai aktivitas antioksidan untuk sampel GRT1, GRT2, GRT3 hampir sama, masing-masing 53.17, 33.20, dan 35.30 μg ml-1. Keragaman genetik dari 3 sampel tersebut cukup besar berkisar antara 0,39-0,61 . Keragaman antara GRT1 dan GRT2 sebesar 0.693; GRT1 dan GRT2 sebesar 0.61; dan GRT2 dan GRT3 sebesar 0.61.
Daerah Cianjur menghasilkan aktivitas antioksidan terendah dibandingkan 2 daerah lainnya. Nilai IC50 pada CJR1, CJR2, dan CJR3 masing-masing 42.73,
43.11, dan 56.34 μg ml-1. Keragaman genetik dari 3 sampel tersebut berkisar antara 0,58-0,94. Keragaman terdekat ada antara CJR2-CJR3 sebesar 0.94. sedangkan keragaman terjauh antara CJR1-CJR2 sebesar 0.58; dan CJR1-CJR3 sebesar 0.58.
Daerah Sukabumi menghasilkan nilai aktivitas terkuat. Nilai IC50 SKB1,
SKB2, dan SKB3 masing-masing 25.67, 23.25, dan 25.89 μg ml-1. Keragaman genetik dari 3 sampel tersebut berkisar antara 0,18-0,82. Keragaman terdekat ada antara SKB2-SKB3 sebesar 0.82. sedangkan keragaman terjauh antara SKB1-SKB2 sebesar 0.18; dan SKB1-SKB3 sebesar 0.30.
Untuk perbandingan dalam sembilan lokasi, nilai IC50 terbaik dihasilkan dari
sampel Sukabumi (SKB2) sebesar 23.25 μg ml-1. Sampel GRT1 memiliki keragaman genetik terdekat dengan sampel CJR1, SKB1 dan GRT1 dengan nilai similiaritas antara 0.61-0.76. nilai aktivitas antioksidan untuk GRT1 hampir sama dengan GRT 2 yaitu 52 μg ml-1, sedangkan CJR1 dan SKB1 hampir sama
masing-masing 75 dan 74 μg ml-1.
Berdasarkan perbandingan data keragaman genetik dan data IC50 dari 9
sampel, dapat disimpulkan bahwa meskipun nilai keragaman genetiknya berbeda jauh, aktivitas antioksidannya hampir sama, seperti antara SKB1-SKB2 yang memiliki keragaman genetik 0.18, namun memiliki nilai aktivitas antioksidan yang hampir sama masing-masing 25,67 μg ml-1 dan 23,25 μg ml-1. Sebaliknya, meskipun nilai keragaman genetiknya hampir mirip, nilai aktivitas antioksidannya berbeda jauh, seperti antara CJR2-SKB3 yang memiliki nilai keragaman genetik 0.82, namun nilai aktivitas antioksidan masing-masing 43.11 μg ml-1 dan 23.25 μg ml-1. Sehingga terlihat bahwa keragaman genetik tidak terlalu berpengaruh terhadap aktivitas antioksidan, begitupun sebaliknya.
15 yaitu 0.76. Nilai aktivitas antioksidan hampir sama berdasarkan wilayahnya masing-masing.
5 SIMPULAN DAN SARAN
Simpulan
Lima primer terpilih untuk mengamplifikasi DNA sirsak menghasilkan 2 kelompok utama. Kelompok 1 beranggotakan 4 sampel (Garut1, Cianjur1, Sukabumi1, Garut2) dan kelompok 2 beranggotakan 5 sampel (Garut3, Cianjur2, Cianjur3, Sukabumi2, Sukabumi3). Aktivitas antioksidan terkuat berdasarkan IC50 dihasilkan oleh sampel dari Sukabumi2 sebesar 23.25 μg ml-1. Tiga sampel
dari Sukabumi memiliki aktivitas antioksidan tertinggi dibanding sampel dari wilayah lainnya. Namun, secara umum 9 sampel sirsak memiliki aktivitas antioksidan dari kuat sampai sangat kuat.
Saran
Perlu dilakukan teknik lain selain DPPH untuk mengetahui aktivitas antioksidan. Selain itu, perlu dilakukan teknik analisis keragaman genetik lebih lanjut untuk mengetahui dengan lebih jelas perbedaan setiap sampel. Dan juga mencari hubungan antara keragaman genetik dan aktivitas antioksidan yang lebih spesifik pada sirsak.
DAFTAR PUSTAKA
Adri D, Hersoelistyorini W. 2013. Aktivitas antioksidan dan sifat organoleptik teh daun sirsak (Annona muricata Linn.) berdasarkan variasi lama pengeringan. JPDG. 4(7) :1-12
Andayani R, Lisawati Y, Maimunah. 2008. Penentuan aktivitas antioksidan, kadar fenolat total dan likopen pada buah tomat (Solanum lycopersicum L). JSTF.
13(1): 1-9.
Bendhifi M, Ghada B, Lazhar Z. 2013. Asessment of genetic diversity of Tunisian Barbary fig (Opuntia ficus indica) cultivars by RAPD markers and morphological traits. Sci Hort. 158(2013):1-7.
Cottica SM, Sawaya ACHF, Eberlin MN, Franco SL, Zeoula LM, Visentainer JV. 2011. Antioxidant activity and composition of propolis obtained by different methods of extraction. J Braz Chem Soc. 22 (5) : 929-935.
Doyle JJ, Doyle JL. 1987. A rapid DNA isolation procedure for small quantities of fresh leaf tissue. Phytochem Bull. 19: 11-15.
Handayani H, Feronika HS, Yunianta. 2015. Ektraksi antioksidan daun sirsak metode ultrasonic bath. JPA. 4(1):262-272.
16
Hussam SMK, Sarah KIA, Haider IM. 2014. Molecular characterization of some Iraqi date palm cultivars using RAPD and ISSR markers. JASR. 4(9):490-503.
Hutter S, Viella AJ, Rozas J. 2006. Genome-wide DNA polymorphism analyses using VariScan. BMC Bioinformatics. 7: 1-10.
Jang HD, Chang KS, Huang YS, Hsu CL, Lee SH, Su MS. 2006. Principal phenolic phytochemicals and antioxidant activities of three Chinese
medicinal plants. JFChem.
103(3):749-756.doi10.1016/j.foodchem .2006.09.026.
[KEMENKES RI] Kementrian Kesehatan RI. 2013. Peraturan Menteri Kesehatan Republik Indonesia Nomor 88 Tahun 2013 tentang Rencana Induk Pengembangan Bahan Baku Obat Tradisional. Jakarta (ID).
Kuncahyo I, Sunardi. 2007. Uji aktivitas antioksidan ekstrak belimbing wuluh (Averrhoa bilimbi, L.) terhadap 1,1 diphenyl-2- pycrylhidrazyl (DPPH) [prosiding]. Di dalam: SNT 2007. Yogyakarta: Perhimpunan Teknik Indonesia. hlm 1-9.
Latifah W. 2013. Uji aktivitas antioksidan ekstrak etanol daun sirsak (Annona muricata L.) gugur [skripsi]. Yogyakarta (ID): Universitas Gadjah Mada. Molyneux P. 2004. The Use of the stable free radical Diphenylpicryl-hydrazil
(DPPH) for estimating antioxidant activity. JST. 26 (2):211-219.
Muchtadi D. 2001. Kajian terhadap serat makanan dan antioksidan dalam berbagai jenis sayuran untuk pencegahan penyakit degeneratif [Laporan penelitian]. Bogor (ID): Institut Pertanian Bogor.
Palupi DLN. 2010. Analisis keragaman genetik Ganoderma spp. menggunakan penanda molekuler random amplified polymorphic DNA (RAPD) [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Putri RNA. 2012. Uji aktivitas antioksdian ekstrak daun sirsak (Annona muricata L.) dengan metode DPPH (1,1-diphenhyl-2-picrylhydrazil) [skripsi]. Jakarta (ID): Universitas Islam Negeri Syarif Hidayatullah.
Ramakrishna Akula, Ravishankar GA. 2011. Influence of abiotic stress signal on secondary metabolites in plants. PSB. 6(11):1720-1731.
Rivai H, Ernita W, Rusdi. Pengaruh perbandingan pelarut etanol-air terhadap kadar senyawa fenolat total dan daya antioksidan dari ekstrak daun sirsak (Annona muricata L.) JPST. 18(1): 35-42.
Robinson T. 1995. Kandungan Organik Tumbuhan Tinggi Edisi VI. Bandung (ID): ITB Pr.
Rohlf FJ. 1998. NTSYSpc:Numerical Taxonomy and Multivariate Analysis System Version 2.0 User Guide. Applied Biostatistics Inc.
Sambrook J, Russel DW. 1989. Molecular Cloning: A Laboratory Manual, Third Edition. New York: Cold-Spring Harbor Laboratory Pr.
17 Utami A. 2012. Analisis polimorfisme DNA tanaman kunyit (Curcuma longa L.) dan temulawak (Curcuma xanthorrhiza Roxb) lokal menggunakan marka RAPD [skripsi]. Bogor (ID): Institut Pertanian Bogor.
Weising K, Nybom H, Wolff K, Meyer W. 1995. DNA Fingerprinting in Plants and Fungi. Boca Raton: CRC Press.
Winarsi H. 2007. Antioksidan Alami dan Radikal Bebas. Yogyakarta: Kanisius. Zhang HF, Yang XH, Wang Y. 2011. Mircowave assisted extraction of secondary
metabolites from plants: Current status and future directions. Trends Food Sci Technol. 12(22):672-688.
Zuhud E. 2011. Bukti Kedahsyatan Sirsak Menumpas Kanker. Jakarta (ID): Agromedia Pustaka.
18
Lampiran 1. Diagram Alir Penelitian
Daun Sirsak
Isolasi DNA
Uji kualitas dan kuantitas DNA
Seleksi primer
Amplifikasi dengan PCR
Elektroforesis
Analisis data dengan NTYSYS 2.02
Ektraksi (pelarut etanol)
Uji Aktivitas antioksidan (metode DPPH)
Inhibition Concentration 50
19 Lampiran 2 Urutan nukleotida primer acak (GC > 50%)
NO. Nama Primer Urutan nukleotida Suhu titik leleh (oC)
1 OPE1 CCCAAGGTCC 37,3
2 OPE3 CCAGATGCAC 29,2
3 OPE4 GTGACATGCC 28,4
4 OPE7 AGATGCAGCC 33,6
5 OPE10 CACCAGGTGA 29,1
6 OPE18 GGACTGCAGA 28,3
7 OPE19 ACGGCGTATG 36,2
8 OPH5 AGTCGTCCCC 36,2
9 OPH13 TGTAGCTGGG 34,6
10 OPH16 TCTCAGCTGG 29,1
11 OPH19 GTGACCAGCC 33,6
12 OPM6 CTGGGCAACT 33,8
13 OPM18 CACCATCCGT 33,9
14 OPM20 AGGTCTTGGG 31,8
20
Lampiran 3 Absorbansi ekstrak daun sirsak pada panjang gelombang 517 nm
Konsentrasi Sampel
GRT1 GRT2 GRT3 CJR1 CJR2 CJR3 SKB1 SKB2 SKB3
125 0.427 0.178 0.179 0.249 0.21 0.355 0.192 0.233 0.187
62.5 0.689 0.591 0.67 0.616 0.723 0.766 0.259 0.193 0.287
31.25 0.977 0.872 0.842 0.966 0.909 1.019 0.659 0.568 0.721
15.625 1.105 1.006 1.021 1.204 1.19 1.181 0.963 0.874 1.001
7.8125 1.184 1.207 1.213 1.2 1.231 1.267 1.229 1.208 1.193
3.90625 1.309 1.286 1.34 1.461 1.411 1.465 1.429 1.424 1.337
Lampiran 4 Daya inhibisi ekstrak daun sirsak
Konsentrasi Sampel
GRT1 GRT2 GRT3 CJR1 CJR2 CJR3 SKB1 SKB2 SKB3
125 70.77 87.82 87.75 82.96 85.63 75.7 86.86 84.05 87.2
62.5 52.84 59.55 54.14 57.84 50.51 47.57 82.27 86.79 80.36
31.25 33.13 40.31 42.37 33.88 37.78 30.25 54.89 61.12 50.65
15.625 24.37 31.14 30.12 17.59 18.55 19.16 34.09 40.18 31.49
7.8125 18.96 17.39 16.97 17.86 15.74 13.28 15.88 17.32 18.34
3.90625 10.4 11.98 8.282 0 3.422 0.274 2.19 2.533 8.487
Lampiran 5 IC50 ekstrak daun sirsak
Lokasi
Sampel IC50
GRT1 53.17
GRT2 33.20
GRT3 35.30
CJR1 42.73
CJR2 43.11
CJR3 56.34
SKB1 25.67
SKB2 23.25
21
RIWAYAT HIDUP
Penulis dilahirkan di Sungguminasa Kabupaten Gowa, Sulawesi Selatan, 29 April 1991 dari ayah Syahrir Khanna dan Ibu Karmawati. Penulis merupakan putra pertama dari tiga bersaudara. Penulis menyelesaikan pendidikan menengah atas di SMAN 1 Parangloe Kabupaten Gowa, Sulawesi Selatan tahun 2008. Penulis meneruskan pendidikan di Departemen Pendidikan Kimia Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Negeri Makassar di tahun yang sama dan lulus pada tahun 2013. Selanjutnya, diterima di Program Studi Biokimia Departemen Biokimia pada Program Pascasarjana Institut Pertanian Bogor (IPB) dengan beasiswa Program Pascasarjana Dalam Negeri (BPPDN) DIKTI 2013.