PRODUKSI ASAM LEMAK DARI
NANNOCHLOROPSIS
SP.
DENGAN PERLAKUAN NITROGEN TERBATASI PADA
SKALA LABORATORIUM DAN SKALA LAPANGAN
DIAN NOVERITA WIDYANINGRUM
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA
Dengan ini saya menyatakan bahwa tesis yang berjudul Produksi Asam Lemak dari Nannochloropsis sp. dengan Perlakuan Nitrogen Terbatasi pada Skala Laboratorium dan Skala Lapangan adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, Agustus 2015
Dian Noverita Widyaningrum
RINGKASAN
DIAN NOVERITA WIDYANINGRUM. Produksi Asam Lemak dari
Nannochloropsis sp. dengan Perlakuan Nitrogen Terbatasi pada Skala Laboratorium dan Skala Lapangan. Dibimbing oleh MULYORINI RAHAYUNINGSIH dan DWI SUSILANINGSIH.
Nannochloropsis sp. telah dikenal dalam industri akuakultur karena nilai nutrisinya yang tinggi termasuk komponen asam lemak jenuh. Aplikasi alga secara komersial membutuhkan kerapatan sel yang tinggi, pertumbuhan yang kuat dan dominan di lingkungan dengan kandungan lemak tinggi dari sumber-sumber alga. Pada kenyataannya, Nannochloropsis sp. memiliki ukuran sel yang kecil dan pertumbuhan lambat, sehingga secara khusus memerlukan peningkatan kondisi kultur dan kultivasi.
Penelitian ini bertujuan untuk meningkatkan kandungan lemak menggunakan strategi media dengan pembatasan sumber nitrogen pada media dan mengamati komposisi profil asam lemak. Pembatasan sumber nitrogen dipilih karena nitrogen merupakan sumber komponen penting untuk kultivasi mikroalga. Nitrogen akan mempengaruhi metabolism sel untuk pertumbuhan dan sintesis komponen-komponen seperti protein dan asam lemak.
Pengamatan skala laboratorium terhadap pola pertumbuhan menunjukkan bahwa kultur Nannochloropsis sp. dengan pembatasan nitrogen mencapai fase stasioner lebih cepat dibandingkan dengan kultur kontrol. Kandungan lemak tertinggi ditemukan pada perlakuan pengurangan nitrogen 50 % (37,5 mg/L), yaitu berdasarkan bobot kering sel. Sebagai tambahan, kandungan protein dan karbohidrat berbeda sedikit pada setiap perlakuan. Penentuan fase stasioner dengan pengurangan nitrogen yang paling baik menghasilkan kandungan lemak paling tinggi digunakan untuk pembesaran kultivasi di skala lapangan.
Pengamatan kultivasi di laboratorium menunjukkan kandungan lemak dalam sel dan yield lemak tidak berbeda nyata. Analisis lebih lanjut menunjukkan bahwa komposisi asam lemak Nannochloropsis sp. mengandung asam palmitat 18,1 % pada fase eksponensial dengan konsentrasi nitrogen 75 %. Berdasarkan komposisi tersebut, minyak Nannochloropsis sp. dapat digunakan sebagai sumber biodiesel dan produk komersial lainnya seperti bahan kosmetik dan makanan.
Kata kunci : Nannochloropsis sp., konsentrasi nitrogen, kandungan lemak, asam
SUMMARY
DIAN NOVERITA WIDYANINGRUM. Production of Fatty Acid from
Nannochloropsis sp. by using Nitrogen Limited Treatment at Laboratory Scale and Field Scale. Supervised by MULYORINI RAHAYUNINGSIH and DWI SUSILANINGSIH.
Nannochloropsis is well recognized in aquaculture industry due to its high nutritional value including saturated fatty acids compounds. The requirement for commercial cultivation scale application of the algae needs high cell densities, strong or dominant growth in the environment with high oil content of the algae sources. In fact, Nannochloropsis have small size of cells and slow growth that particularly need an improvement culture and cultivation conditions.
The research was intended for enhancing the cell’s lipid content using
manipulating medium strategies by limitation of nitrogen sources in the medium and observed the composition of the fatty acid profiles. Limitation nitrogen sources was chosen because of nitrogen is an important compound source for cultivation of microalgae. Nitrogen will affect the cell metabolism for growth and synthesizes the storage compounds including protein, fatty acid.
Laboratory scale observation on growth pattern showed that
Nannochloropsis sp. cultures with nitrogen limitation reach stationary phase faster comparing to control culture. The highest lipid content was found at 37,5 mg/l or 50 % nitrogen reduction treatment, namely 60 % base dry weight cells. In addition, the protein and carbohidrates content were slightly different in each treatment. Determination of the stationary phase with best nitrogen limitation for highest lipid content was used for further scaling up in outdoor scale.
An observation in laboratory resulted lipid content intact cells and yields were not significally different. And further analyzes showed that fatty acid composition of the Nannochloropsis sp. lipid is consisting palmitic acid 18,1 % at exponential phase with 75 % nitrogen concentration. Considering the composition, in the future Nannochloropsis’s oil might be available for sources of biodiesel and other commercial products such as cosmetic material and food.
© Hak Cipta Milik IPB, Tahun 2015
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB.
PRODUKSI ASAM LEMAK DARI
NANNOCHLOROPSIS
SP.
DENGAN PERLAKUAN NITROGEN TERBATASI PADA
SKALA LABORATORIUM DAN SKALA LAPANGAN
DIAN NOVERITA WIDYANINGRUM
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Bioteknologi
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2013 sampai Desember 2014 ini adalah produksi asam lemak dari mikroalga dengan judul Produksi Asam Lemak dari Nannochloropsis sp. dengan Perlakuan Nitrogen Terbatasi pada Skala Laboratorium dan Skala Lapangan. Sumber dana penelitian ini berasal dari Program karyasiswa, Kemeterian Riset dan Teknologi. Sebagian hasil penelitian ini sedang dalam proses publikasi di Malaysian Journal of Microbiology (MJM).
Terima kasih penulis ucapkan kepada Ibu Dr Mulyorini Rahayuningsih, MSi dan Ibu Dr Dwi Susilaningsih, MPharm selaku pembimbing yang telah banyak memberi arahan dan masukan mulai dari awal sampai akhir. Penghargaan dan terima kasih juga penulis sampaikan kepada Bapak Prof Dr Ir Djumali Mangunwidjaja, DEA atas kesediaannya menjadi penguji luar komisi, terima kasih kepada Bapak Prof Suharsono, DEA selaku Ketua Program Studi PS Bioteknologi.
Selain itu, penulis juga menyampaikan terima kasih kepada rekan-rekan di Laboratorium Bioenergi dan Bioproses, Pusat Penelitian Bioteknologi, LIPI atas bantuannya. Terima kasih pada seluruh sahabat dan rekan-rekan bioteknologi IPB atas kebersamaan selama ini.
Ungkapan terima kasih yang tak berhingga juga disampaikan kepada suami tercinta Armadi SP, ayahanda Muhamad Sidik, ibunda Faridah, Adik Yuliar Adi Widyanugroho dan Dyah Ayu Yulia Widyaningrum serta seluruh keluarga atas doa, kesabaran, motivasi, dukungan dan kasih sayang yang tak terbalaskan. Semoga selalu dalam rahmat dan lindungan Allah SWT. Amin.
Semoga karya ilmiah ini bermanfaat.
Bogor, Agustus 2015
DAFTAR ISI
Pertumbuhan mikroalga 4
Faktor-faktor pertumbuhan mikroalga 4
Pemanenan 5
Analisa karbohidrat Standar karbohidrat
12 13
Kultivasi Nannochloropsis sp. skala lapangan Transesterifikasi dan analisa profil asam lemak
13 13
4 HASIL DAN PEMBAHASAN 14
Pengaruh nitrogen terbatasi terhadap pertumbuhan mikroalga
Nannochloropsis sp.
14
Pengaruh nitrogen terbatasi terhadap kandungan lemak, protein dan karbohidrat pada Nannochloropsis sp.
18
Pengaruh nitrogen terbatasi terhadap profil asam lemak 22
5 SIMPULAN DAN SARAN 24
DAFTAR PUSTAKA 25
LAMPIRAN 27
RIWAYAT HIDUP 35
DAFTAR TABEL
1 Standar biodiesel Indonesia SNI 04-7182-2006 8
2 Laju pertumbuhan spesifik Nannochloropsis sp. pada berbagai konsentrasi nitrogen
17
3 Perbedaan bobot biomassa kering kultivasi skala lapangan pada fase eksponensial, akhir eksponensial dan stasioner pada berbagai konsentrasi nitrogen
18
4 Yield lemak pada skala laboratorium dan lapangan dari fase eksponensial, akhir eksponensial dan stasioner
22
13 Pengelompokan 136 individu berdasarkan daerah distribusi spasial 32
DAFTAR GAMBAR
1 Jalur biosintesis trigliserida 6
2 Reaksi transesterifikasi 7
3 Kurva pertumbuhan Nannochloropsis sp. pada berbagai konsentrasi nitrogen
15
4 Kultur nannochloropsis sp.pada berbagai konsentrasi nitrogen 16 5 Kandungan lemak Nannochloropsis sp. skala laboratorium dalam
konsentrasi nitrogen 25 %, 50 %, 75 % dan 100 %
19
6 Kandungan lemak Nannochloropsis sp. skala lapangan dalam konsentrasi nitrogen 25 %, 50 %, 75 % dan 100 %
7
8
9
Kandungan protein Nannochloropsis sp. dalam konsentrasi nitrogen 25 %, 50 %, 75 % dan 100 %
Kandungan karbohidrat Nannochloropsis sp. dalam konsentrasi nitrogen 25 %, 50 %, 75 % dan 100 %
Profil asam lemak Nannochloropsis sp.
20
21
24
DAFTAR LAMPIRAN
1 Komposisi media F/2 dalam 100 ml 27
2 Diagram alir strategi penelitian 28
3 Tahapan persiapan prekultur Nannochloropsis sp. 28 4 Persiapan kultivasi di bioreaktor (lapangan) 80 L 29 5 Uji ANOVA dan Duncan biomassa kering dari sampel skala
lapangan pada fase eksponensial
29
6 Uji ANOVA dan Duncan biomassa kering dari sampel skala lapangan pada fase akhir eksponensial
32
7 Uji ANOVA dan Duncan biomassa kering dari sampel skala lapangan pada fase stasioner
1
1 PENDAHULUAN
Latar Belakang
Mikroalga merupakan salah satu bahan baku biodiesel karena kandungan lemak yang tinggi di dalam selnya antara 1-85 % per berat kering bergantung pada jenis dan lingkungannya. Kemampuan mikroalga mensintesa lemak yang tinggi dikarenakan
mikroalga memiliki daya fotosintesa yang tinggi dan lebih efisien bila dibandingkan tanaman lainnya. Laju fotosintesis alga adalah 6-20 %, sedangkan tanaman 0,1-8 % berbasis konversi cahaya matahari menjadi biomassa. Mikroalga dapat mensisntesa berbagai jenis bahan biofuel terbarukan selain minyak seperti metana yang diproduksi secara anaerobik dari biomassa alga, senyawa hidrokarbon (Banerjee et al. 2002) dan biohidrogen yang diproduksi secara fotobiologi (Gavrilescu and Chisti 2005). Mikroalga merupakan sunlight-driven cell factories yang mengubah CO2 menjadi biofuel, makanan dan aktivitas biologi
lainnya yang bernilai tinggi.
Diketahui kandungan minyak dari berbagai bahan baku biodiesel dari berbagai sumber dalam satuan L/ha adalah jagung sebesar 172, kedelai sebesar 446, kanola sebesar 1190, jatropa sebesar 1892, kelapa sebesar 2689, kelapa sawit sebesar 5950, mikroalga (70% minyak dari biomassa kering) sebesar 1369000 dan mikroalga (30 % minyak dari biomassa kering) sebesar 58700. Beberapa jenis mikroalga memiliki kandungan minyak yang berbeda-beda berdasarkan persen berat kering biomassa seperti Botryococcus braunii sebesar 25-75, Chlorella sp. sebesar 28-32, Crypthecodinium cohnii sebesar 20, Cylindrotheca sp. 16-37, Dunaliella primolecta sebesar 23, Isochrysis sp. sebesar 25-33, Monallanthus salina lebih besar dari 20, Nannochloropsis sp. sebesar 31-68, Neochloris oleoabundans sebesar 35-54, Nitzschia sp. 45-47, Phaeodactylum tricornutum sebesar 20-30 dan Tetraselmis sueica sebesar 15-23 (Chisti 2007).
2
Produktivitas minyak tergantung pada kondisi pertumbuhan alga dan metabolisme sintesa minyak dalam biomassa. Mikroalga dengan produktivitas minyak tinggi mampu memproduksi biodiesel. Mikroalga mudah didapat di perairan dengan nitrogen tinggi. Nitrogen dalam media bisa berupa nitrat, nitrit, ammonia atau urea. Penyerapan dan pemanfaatan nitrogen secara berurutan dari yang terbesar adalah ammonia, urea, nitrat dan nitrit. Hal ini dikarenakan ammonia secara langsung digunakan untuk sintesis asam amino, sedangkan sumber nitrogen lainnya harus dikonversi terlebih dahulu menjadi ammonia untuk sintesis asam amino. Mikroalga juga tumbuh dengan baik dengan adanya urea dan nitrat. Penelitian menunjukkan bahwa pada Chlorella kandungan lemak maksimum ditemukan dengan penggunaan sodium nitrat (Junying et al. 2013).
Nitrogen adalah komponen penting untuk komposisi, pembentukkan dan berfungsinya protein dan DNA dalam sel mikroalga. Dalam kondisi kandungan nitrogen rendah (stress nitrogen), fotosintesis tetap berjalan meskipun lajunya menurun sampai nitrogen sel berada di bawah ambang batas. Aliran karbon tetap oleh fotosintesis, tetapi dialihkan dari jalur sintesis protein ke sintesis lemak atau kabohidrat (Adetola 2011). Pada saat proses produksi lemak meningkat, trigliserida menjadi paling dominan.
Lemak banyak diproduksi saat mikroalga berada di fase stasioner dimana nutrisi dari media mulai berkurang. Hal inilah yang kemudian menjadi ide dasar untuk melakukan rekayasa nutrisi, sehingga diperoleh lemak yang lebih tinggi jika dibandingkan dengan kultur mikroalga pada kandungan nutrisi normal. Kandungan lemak dapat ditingkatkan dengan memodifikasi faktor pertumbuhan seperti persentase nitrogen dalam media, intensitas cahaya, suhu, salinitas, konsentrasi CO2 dan teknik pemanenan.
Pada penelitian ini akan dilakukan analisis lebih lanjut mengenai profil asam lemak metil ester (FAME) Nannochloropsis sp. untuk mengetahui karakter minyak Nannochloropsis sp.. Pengetahuan tentang profil asam lemak dari bahan baku biomassa potensial diperlukan untuk menentukan komposisi terbaik dari biodiesel (Kaur et al. 2012). Asam lemak yang sering terdapat pada biodiesel adalah asam palmitat, asam stearat, asam oleat, asam linoleat dan asam linolenat (Knothe 2008).
Bahan baku minyak sangat mempengaruhi sifat-sifat biodiesel. Bahan baku yang berasal dari sumber berbeda memberikan profil dan sifat-sifat asam lemak yang bervariasi secara signifikan. Oleh karena itu, untuk menentukan komposisi biodiesel terbaik perlu mempelajari profil asam lemak bahan baku biomassa yang potensial (Kaur et al. 2012).
Tujuan penelitian
3
Hipotesis
Hipotesis penelitian ini adalah asam lemak dari Nannochloropsis sp. yang ditumbuhkan pada media dengan nitrogen terbatasi memiliki persentasi yang lebih tinggi dibandingkan dengan kontrol.
2 TINJAUAN PUSTAKA
Mikroalga
Salah satu sumber biodiesel yang paling mendapat perhatian adalah mikroalga (Lannan 2011). Biomassa mikroalga adalah salah satu sumber energi yang baik. Pembakaran sejumlah bahan bakar fosil akan meningkatkan CO2 di
atmosfer dan menyebabkan pemanasan global. Biomassa akan memanfaatkan CO2 di atmosfer melalui fotosintesa. Dari berbagai biomassa, alga (makro atau
mikro) memiliki efisiensi fotosintesa lebih besar dibandingkan biomassa lainnya. Alga memproduksi minyak 7 sampai 31 kali lebih besar dari minyak palm (Hossain et al. 2008). Produktivitas minyak tergantung pada laju pertumbuhan mikroalga dan kandungan minyak dalam biomassa. Mikroalga dengan produktivitas minyak tinggi mampu memproduksi biodiesel (Chisti 2007). Pada kondisi keterbatasan nutrisi, total lemak bisa mencapai lebih dari 40 %.
Mikroalga adalah organisme mikroskopik uniseluler atau multiseluler, biasanya diameter maksimum 50 µm. Mikroalga tumbuh subur pada kondisi lingkungan yang luas seperti habitat salin atau alkalin, wilayah artik yang dingin,
4
Pertumbuhan mikroalga
Pertumbuhan mikroalga terdiri dari empat fase yaitu fase lag, logaritmik atau eksponensial, stasioner dan kematian. Fase lag adalah fase adaptasi terhadap kondisi lingkungan (media tumbuh). Pada fase ini sel tetap hidup tetapi tidak berkembang biak. Lamanya fase tergantung pada inokulan yang dimasukkan. Kultur yang diinokulasikan pada fase logaritmik akan mengalami fase lag yang singkat. Sebaliknya kultur yang diinokulasikan berasal dari fase tua akan mengalami fase lag yang lebih lama karena membutuhkan waktu untuk menyusun enzim-enzim yang tidak aktif lagi. Fase logaritmik/eksponensial ditandai dengan naiknya laju pertumbuhan hingga kepadatan populasi meningkat beberapa kali lipat. Pada fase ini, sel yang sedang aktif berkembang biak. Fase stasioner ditandai dengan seimbangnya laju pertumbuhan dengan laju kematian. Jumlah sel cenderung tetap diakibatkan sel telah mencapai titik jenuh. Pertumbuhan sel baru dihambat oleh keberadaan sel yang telah mati dan faktor pembatas lainnya. Fase kematian ditandai dengan berkurangnya kepadatan sel karena laju kematian lebih tinggi dari laju pertumbuhan.
Faktor-faktor pertumbuhan mikroalga
5
Pemanenan
Pemisahan
Pemisahan bertujuan untuk memisahkan media pertumbuhan dan mikroalga dengan cara tercepat, efesiensi energi dan cara yang paling murah. Terdapat beberapa cara pemanenan yaitu sedimentasi gravitasi, flotasi, flokulasi, sentrifugasi dan filtrasi.
Sedimentasi gravitasi secara alami mikroalga mengendap di bawah. Flotasi merupakan kebalikan dari sedimentasi. Mikroalga akan mengambang dan biasanya diinduksi oleh gelembung air mikro untuk membantu pergerakkan mikroalga ke permukaan (Brennan and Owende 2010; Greenwell et al. 2010). Flokulasi membuat mikroalga menggumpal, sehingga mudah dipanen. Flokulasi biasanya dilakukan dengan menambahkan garam logam ke media pertumbuhan. Garam-garam logam ini antara lain ferrik klorida, aluminium sulfat. Garam-garam logam bekerja dengan cara mengurangi muatan negatif antara sel-sel mikroalga, sehingga memungkinkan terjadinya agregasi (Brennan and Owende 2010). Sentrifugasi dengan putaran antara 5.000 sampai 10.000 per menit yang secara cepat memisahkan mikroalga dan media pertumbuhan. Filtrasi menggunakan filter, dapat digunakan dengan atau tanpa penambahan tekanan, dapat digunakan untuk sel mikroalga dengan konsentrasi rendah (Greenwell et al. 2010).
Pengeringan
Biomassa mikroalga yang dipisahkan dari media pertumbuhan masih mengandung air. Beberapa mikroalga dikeringkan untuk memperpanjang waktu penyimpanan atau untuk ekstraksi minyak. Metode pengeringan antara lain 1) Menggunakan cahaya matahari (sun drying). Metode ini paling murah tetapi memerlukan waktu pengeringan yang lama dan tempat yang luas. 2) Menggunakan oven (thermal drying). Metode ini dapat merusak lemak yang akan digunakan untuk biodiesel. Suhu di atas 60 oC akan menurunkan nilai trigliserida. 3) Spray drying. Metode ini dapat merusak pigmen. 4) Freeze drying.
Ekstraksi minyak
6
ester dari asam-asam lemak (RCOOH) dan trihidrik alkohol gliserol (C3H5(OH)3).
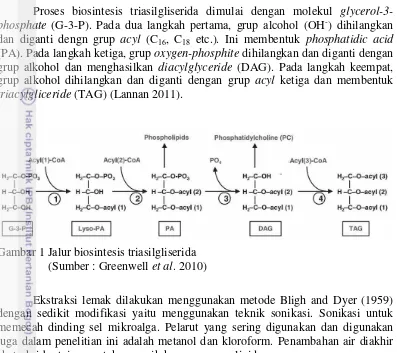
Biosintesis TAG dalam alga dapat terjadi melalui jalur gliserol (Gambar 1).
Proses biosintesis triasilgliserida dimulai dengan molekul glycerol-3-phosphate (G-3-P). Pada dua langkah pertama, grup alcohol (OH-) dihilangkan dan diganti dengn grup acyl (C16, C18 etc.). Ini membentuk phosphatidic acid
(PA). Pada langkah ketiga, grup oxygen-phosphite dihilangkan dan diganti dengan grup alkohol dan menghasilkan diacylglyceride (DAG). Pada langkah keempat, grup alkohol dihilangkan dan diganti dengan grup acyl ketiga dan membentuk
triacylgliceride (TAG) (Lannan 2011).
Gambar 1 Jalur biosintesis triasilgliserida (Sumber : Greenwell et al. 2010)
Ekstraksi lemak dilakukan menggunakan metode Bligh and Dyer (1959) dengan sedikit modifikasi yaitu menggunakan teknik sonikasi. Sonikasi untuk memecah dinding sel mikroalga. Pelarut yang sering digunakan dan digunakan juga dalam penelitian ini adalah metanol dan kloroform. Penambahan air diakhir ekstraksi bertujuan untuk menarik komponen nonlipid.
Metanol dipilih karena murah dan mudah didapat, memiliki reaktifitas yang tinggi dibandingkan alkohol rantai panjang dan pemisahan gliserol mudah dilakukan. Alkohol meskipun ramah lingkungan dan toksisitasnya rendah namun sulit untuk memisahkan gliserol dan biodiesel. Alkohol rantai panjang memiliki metode yg mahal dan sulit untuk diaplikasikan pada skala industri.
Transesterifikasi
7
Gambar 2 Reaksi transesterifikasi (Sumber : Chisti 2007)
Selama reaksi lemak mikroalga dan alkohol dicampur. Lemak (sekarang biodiesel) dipisahkan dari lapisan air yang mengandung gliserol. Biodiesel kemudian dituang dan dicuci menggunakan air untuk menghilangkan beberapa kontaminan sebelum siap digunakan (Lannan 2011). Reaksi transesterifikasi melibatkan katalis. Katalis-katalis yang digunakan antara lain berupa enzim lipase, asam dan alkali. Proses enzimatik digunakan untuk memproduksi FAME dari minyak. Beberapa parameter menunjukkan pengaruh terhadap hasil dan laju reaksi. Parameter-parameter tersebut termasuk manfaat pelarut, suhu, tipe dan konsentrasi alkohol, jumlah enzim, kandungan air dan laju pencampuran. Katalis alkali antara lain kalium hidroksida. Salah satu kelemahan reaksi katalis alkali adalah saponifikasi. Ini disebabkan oleh asam lemak yang bereaksi dengan alkohol. Saponifikasi juga menghasilkan produk sampingan. Saponifkasi dapat dihindari dengan katalis alkali anhidrat dan alkohol anhidrat kurang dari 5%. Hal ini memerlukan biaya. Penggunaan katalis asam tidak menimbulkan saponifikasi tetapi reaksi lebih lambat dibandingkan jika menggunakan katalis alkali (Ren 2012).
Profil asam lemak
Profil asam lemak mempengaruhi sifat dari biodiesel. Mikroalga yang berbeda memiliki profil asam lemak yang berbeda. Oleh karena itu, untuk menentukan komposisi biodiesel terbaik perlu mempelajari profil asam lemak dari bahan baku biomassa yang potensial. Salah satu faktor penting yang mempengaruhi kadar lemak dan komposisi asam lemak selama kultivasi mikroalga adalah fase pertumbuhan kultur.
8
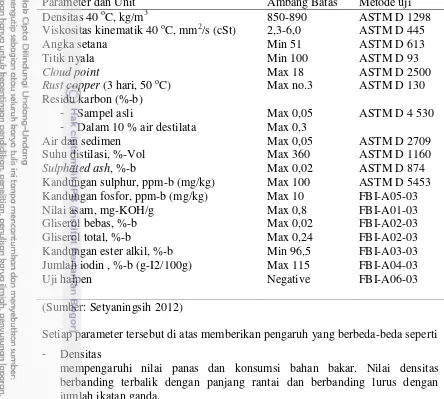
Tabel 1. Standar biodiesel Indonesia SNI 04-7182-2006
Parameter dan Unit Ambang Batas Metode uji
Densitas 40 oC, kg/m3 850-890 ASTM D 1298
Setiap parameter tersebut di atas memberikan pengaruh yang berbeda-beda seperti
- Densitas
mempengaruhi nilai panas dan konsumsi bahan bakar. Nilai densitas berbanding terbalik dengan panjang rantai dan berbanding lurus dengan jumlah ikatan ganda.
- Viskositas kinematik
mempengaruhi atomisasi bahan bakar, kesempurnaan pembakaran, injeksi bahan bakar dan umum digunakan sebagai indikator kualitas biodiesel selama penyimpanan. Viskositas kinematik dipengaruhi oleh asam lemak rantai panjang dan alkohol, jumlah ikatan ganda dan konten kontaminan.
- Angka setana
Angka setana berkaitan erat dengan api bahan bakar, waktu selama injeksi bahan bakar dan pembakaran dan emisi yang dihasilkan. Angka setana didasarkan pada dua senyawa yaitu heksadekana dengan angka setana 100 dan heptametilnonan dengan angka setana 15. Semakin panjang rantai asam lemak karbon dan lebih jenuh molekul, semakin tinggi angka setana.
- Titik Nyala
Titik nyala dari cairan yang mudah menguap adalah suhu terendah dimana ia dapat menguap untuk membentuk campuran ignitable di udara.
- Residu karbon
9
- Kadar Air
Air dapat meningkatkan pertumbuhan mikroorganisme dan dapat menyebabkan penyumbatan filter dan aliran bahan bakar ke mesin. Air dapat menyebabkan korosi kromium dan logam seng di injektor.
- Kadar Abu Sulfat
Komponen ini dapat dioksidasi selama proses pembakaran untuk membentuk abu dan dapat membentuk deposito di mesin.
- Konten Sulfur
Sulfur terkait erat dengan dampak negatif lingkungan, efisiensi dan umur
catalytic converter oksidasi, daya pelumas bahan bakar dan kekuatan pompa injeksi.
- Jumlah Pencemaran
Jumlah kontaminan didefinisikan sebagai komponen larut yang mempertahankan setelah penyaringan. Contoh: sabun dan sedimen. Pencemaran bisa menyebabkan penyumbatan pada filter dan pompa injeksi.
3 BAHAN DAN METODE
Waktu dan Tempat Penelitian
Penelitian ini dilakukan dari bulan Mei 2013 sampai Desember 2014 di Laboratorium Bioenergi dan Bioproses, Pusat Penelitian Bioteknologi, Lembaga Ilmu Pengetahuan Indonesia (LIPI).
Bahan
Bahan mikroba
Mikroba yang digunakan adalah mikroalga hijau (Chlorophyta) jenis
10
Bahan kimia dan lainnya
Bahan-bahan kimia yang digunakan merupakan bahan pereaksi untuk uji lemak (Bligh and Dyer 1979), uji protein (Bradford 1976), uji karbohidrat (metode asam sulfat) dan kelengkapan lainnya seperti kloroform, methanol, akuades, asam sulfat, fenol 5 %, D(+) glukosa, bovine serum albumin, buffer fosfat, seton 80 %, heksan, boron florida (BF3) dan media F/2. Secara rinci bahan
yang digunakan disajikan pada lampiran 1.
Alat
Alat yang digunakan merupakan rangkaian alat untuk kultivasi berupa fotobioreaktor skala laboratorium (botol 1 L dan galon 5 L, lampu TDL 40 watt) dan lapangan (fotobioreaktor berbentuk tabung I volume 80 L. Alat kelengkapan uji dan analisa berupa spektrofotometer UV-visible UV-1700 PharmaSpec Shimadzu, sonikator labsonic, sentrifuse Hitachi Micro Ultracentrifuge CS 150NX kapasitas 50 ml dan Hitachi himac CT 6EL kapasitas 1 ml, Gas Chromatography Mass Spectrocopy GCMS-QP2010 ULTRA Shimadzu, laminar air flow Sanyo, lemari asam, neraca analitik
Metode
Penelitian mengenai asam lemak pada Nannochloropsis sp. dan informasi terkaitnya dilakukan dengan strategi pendekatan limitasi nitrogen yang dilakukan pada skala laboratorium dan skala lapangan dengan variabel pengamatannya adalah pertumbuhan mikroalga, kandungan lemak, asam lemak dan aspek yang terkait pada proses kultivasi dengan perlakuan tertentu. Bagan alir strategi penelitian tercantum pada lampiran 2 dan secara rinci metode yang digunakan adalah sebagai berikut :
Kultivasi Nannochloropsis sp. skala laboratorium dengan nitrogen terbatasi
Nannochloropsis sp. merupakan mikroalga laut. Nannochloropsis sp. ditumbuhkan pada media F/2 dengan air laut. Komposisi F/2 dapat dilihat pada lampiran 2. Kultivasi sampel dilakukan dalam empat variasi konsentrasi nitrogen (NaNO3) dalam media yaitu 25 % (18,75 mg/L), 50 % (37,5 mg/L), 75 % (56,25)
11
Pengukuran sampel dilakukan setiap hari yang meliputi pengukuran pertumbuhan sel hingga diperoleh kurva pertumbuhan Nannochloropsis sp., analisis lemak, analisis protein dan analisis karbohidrat. Pengukuran pertumbuhan sel dilakukan menggunakan spektrofotometer UV-visible UV-1700 PharmaSpec Shimadzu pada panjang gelombang 680 nm. Analisis lemak dilakukan menggunakan metode Bligh and Dyer (Bligh and Dyer 1959). Analisis protein dilakukan menggunakan metode Bradford (Bradford 1976). Analisis karbohidrat dilakukan menggunakan metode asam sulfat.
Studi Kinetika
Laju pertumbuhan spesifik dihitung dengan cara membuat regresi dan persaman dari fase eksponensial tiap perlakuan dengan rumus:
µ = (lnN-lnN0)/(t-t0)
µ adalah laju pertumbuhan spesifik (hari-1), N0 adalah bobot kering awal eksponensial (t0), N adalah jumlah sel pada hari (t) fase eksponensial.
Yield Lemak
Yield lemak dihitung dengan rumus sebagai berikut :
YL = WL / WDB
YL adalahyield lemak (Yield of lipid), WL adalah bobot lemak hasil ekstraksi
(Weight of lipid) dan WDB adalah bobot biomassa kering yang digunakan untuk
ekstraksi (weight of dry biomass).
Analisa kandungan lemak
Persiapan biomassa basah
12
metanol, lapisan tengah merupakan biomassa dan lapisan bawah mengandung lemak dan kloroform. Lemak pada lapisan bawah dipisahkan dari kloroform melalui penguapan (Bligh and Dyer 1959) dan dihitung bobotnya.
Analisa kandungan protein
Persiapan sampel protein
Kultur sebanyak 7 ml disonikasi untuk memecah sel selama 4 menit sebanyak 3 kali dengan jeda waktu 1 menit. Kultur disentrifugasi dengan kecepatan 6000 rpm selama 20 menit pada suhu 4 oC, sehingga diperoleh pelet.
Pelet dicampur dengan 10 ml buffer fosfat pH 7.0 dan disentrifugasi dengan kecepatan 600 rpm selama 20 menit, sehingga diperoleh pelet. Pelet dicampur dengan 7 ml aseton 80 %, kemudian diaduk menggunakan pengaduk magnet dan disentrifugasi. Supernatan hasil sentrifugasi digunakan sebagai sampel untuk analisis protein.
Analisa protein
Sebanyak 0,1 ml sampel protein dicampur dengan 1 ml larutan Bradford (Bradford 1976), kemudian diinkubasi selama 2 menit pada suhu 30 oC. Sampel diukur menggunakan spektrofotometer pada panjang gelombang 595 nm. Blanko sampel berupa aseton 80 % dan diberi perlakuan sama dengan sampel.
Standard protein
Standar protein menggunakan Bovine Serum Albumin (BSA) dalam berbagai konsentrasi yaitu 0, 20, 40, 60, 80, 100, 150 dan 200 ppm. Sebanyak 0,1 ml dari setiap konsentrasi BSA dicampur dengan satu mililiter larutan Bradford, kemudian diinkubasi selama dua menit pada suhu 30 oC. Sampel diukur menggunakan spektrofotometer pada panjang gelombang 595 nm. Konsentrasi 0 ppm pada BSA digunakan sebagai blanko standar protein.
Analisis kandungan karbohidrat
Persiapan sampel karbohidrat
Kultur mikroalga sebanyak tujuh mililiter divortex dan disonikasi selama empat menit. Kultur sebanyak 0,5 ml dicampur dengan 0,5 ml asam perklorik dan diinkubasi selama 2 jam pada suhu 30 oC. Sampel direbus tim selama 20 menit hingga mendidih untuk menghilangkan asam. pH larutan dibuat 7.0 selanjutnya larutan ini digunakan sebagai sampel untuk analisis karbohidrat.
Analisis karbohidrat
13
10 menit pada suhu 30 oC. Larutan sampel diinkubasi dalam water bath pada suhu 40 oC selama 20 menit, kemudian diukur menggunakan spektrofotometer pada panjang gelombang 490 nm. Blanko sampel berupa akuaides dan diberi perlakuan sama dengan sampel.
Standard karbohidrat
Standar karbohidrat menggunakan D-Glukosa dalam berbagai konsentrasi yaitu 0, 20, 40, 60, 80, 100, 150 dan 200 ppm. Sebanyak 0,5 ml dari setiap konsentrasi D-glukosa dicampur dengan 0,5 ml fenol 5 % dalam akuabides dan 2,5 ml asam sulfat. Larutan standar divortex dan diinkubasi selama 10 menit pada suhu ruang. Larutan standar diinkubasi dalam water bath pada suhu 40 oC selama 20 menit, kemudian diukur menggunakan spektrofotometer pada panjang gelombang 490 nm. Konsentrasi 0 ppm dari D-glukosa digunakan sebagai blanko.
Kultivasi Nannochloropsis sp. skala lapangan
Kultivasi Nannochloropsis sp. skala lapangan ini menggunakan bioreaktor berbentuk tabung I. Volume total kultur adalah 80 L. Prekultur Nannochloropsis
sp. dari setiap perlakuan disiapkan sebanyak 20 % dari volume total kultur di bioreaktor. Prekultur ditumbuhkan dalam media F/2 dengan konsentrasi nitrogen (NaNO3) 100 % dari komposisi media dan ditempatkan di galon. Prekultur
ditempatkan di luar laboratorium dengan memanfaatkan cahaya matahari untuk fotosintesis, namun tidak langsung di bawah terik matahari. Prekultur tidak ditumbuhkan dalam laboratorium dengan tujuan untuk proses adaptasi sebelum di kultivasi pada skala lapangan. Prekultur ditumbuhkan secara bertahap dari skala 1 liter dalam botol, kemudian diperbesar di skala 5 liter dalam galon (Lampiran 3). Selanjutnya prekultur diinokulasikan ke bioreaktor. Persiapan kultivasi di bioreaktor meliputi aerasi media, penambahan prekultur dan penutupan bioreaktor menggunakan kain untuk proses adaptasi mikroalga terhadap intensitas cahaya matahari yang lebih besar (Lampiran 4).
Prekultur Nannochloropsis sp. yang telah mencapai fase eksponensial, selanjutnya dikultivasi di bioreaktor. Bioreaktor dilengkapi dengan gelembung udara untuk membantu aerasi. Nannochloropsis sp. dikultur sampai fase stasioner. Suhu pertumbuhan antara 30-34 oC. Sampel diambil saat mencapai fase eksponensial, akhir eksponensial dan stasioner. Selanjutnya dilakukan transesterifikasi dan analisis profil asam lemak menggunakan GCMS.
Transesterifikasi dan analisa profil asam lemak
Hasil ekstraksi lemak yang telah dipekatkan sebanyak 0,1 g dilarutkan dalam 4 ml NaOH 2 % dalam metanol, kemudian direfluks pada suhu 80 0C selama 20 menit. Sampel ditambah dengan katalis asam boron florida (BF3) dan
14
selesai, sampel ditambahkan dengan 4 ml NaCl 5 % dan dikocok selama 1 menit. Sampel ditambah dengan 4 ml n-heksan dan dikocok selama 1 menit. Sampel dimasukkan ke dalam corong pisah dan didiamkan hingga terpisah sempurna menjadi dua fase. Fase atas merupakan biodiesel dan fase bawah merupakan gliserol. Biodiesel diambil dan selanjutnya dikarakterisasi profil FAME menggunakan GCMS.
Profil asam lemak dianalisis menggunakan GCMS-QP2010 ULTRA Shimadzu. Kolom dengan tebal 0,25 µm dan panjang 20 cm. Laju kolom 1,23 ml/menit. Suhu pertama adalah 100 oC selama 1 menit, kemudian naik 10 oC setiap satu menit hingga 230 oC.
4 HASIL DAN PEMBAHASAN
Pengaruh nitrogen terbatasi terhadap pertumbuhan mikroalga
Nannochloropsis sp.
Pengaruh nitrogen terbatasi terhadap pertumbuhan diamati selama kultivasi Nannochloropsis sp. pada skala laboratorium. Nannchloropsis sp. ditumbuhkan pada media pertumbuhan dengan empat variasi konsentrasi nitrogen, kemudian diamati pertumbuhannya.
Lama pertumbuhan setiap mikroalga berbeda-beda. Oleh karena itu, perlu dilakukan pengukuran viabilitas sel dan membuat kurva pertumbuhan, sehingga diketahui waktu yang diperlukan untuk setiap fase pertumbuhan yaitu fase adaptasi (lag), eksponensial (log), stasioner dan kematian. Pengetahuan ini penting untuk menentukan waktu pemanenan dan akan digunakan untuk menentukan waktu pemanenan pada saat kultivasi di skala lapangan. Berdasarkan kurva pertumbuhan, pada perlakuan kontrol (100 % konsentrasi nitrogen)
15
Kurva pertumbuhan memperlihatkan lamanya setiap fase yang dialami oleh mikroalga. Fase pertumbuhan ada empat yaitu fase adaptasi atau fase lag, fase pertumbuhan atau eksponensial, fase stasioner dan fase kematian. Setiap mikroalga memiliki waktu yang berbeda dalam setiap fasenya. Fase lag disebut sebagai fase adaptasi terhadap kondisi lingkungan (media tumbuh). Pada fase ini sel tetep hidup tetapi tidak berkembang biak. Lamanya fase tergantung pada inokulan yang dimasukkan. Mikroalga yang diinokulasikan pada fase logaritmik akan mengalami fase lag yang singkat. Sebaliknya jika mikroalga yang diinokulasikan berasal dari fase stasioner, maka akan mengalami fase lag yang lebih lama karena membutuhkan waktu untuk menyusun enzim-enzim yang tidak aktif lagi. Fase logaritmik/eksponensial ditandai dengan naiknya laju pertumbuhan hingga kepadatan populasi meningkat beberapa kali lipat. Pada fase ini, sel sedang aktif berkembang biak. Fase stasioner ditandai dengan seimbangnya laju pertumbuhan dengan laju kematian. Jumlah sel cenderung tetap diakibatkan sel telah mencapai titik jenuh. Pertumbuhan sel baru dihambat oleh keberadaan sel yang telah mati dan faktor pembatas lainnya. Fase kematian ditandai dengan berkurangnya kepadatan sel karena laju kematian lebih tinggi dari laju pertumbuhan (Pelczar and Chan 1986).
Gambar 3 Kurva pertumbuhan Nannochloropsis sp. pada berbagai konsentrasi
nitrogen
16
Nannochloropsis sp. ditumbuhkan dalam empat variasi konsentrasi nitrogen. Sumber nitrogen yang digunakan berupa nitrat (NO3-) yang berasal dari
sodium nitrat (NaNO3) yang merupakan salah satu komposisi media F/2. Keempat
variasi konsentrasi nitrat tersebut adalah 25 % (18,75 mg/L), 50 % (37,5 mg/L), 75 % (56,25 mg/L) dan 100 % (75 mg/L) sebagai kontrol. Kultur
Nannochloropsis sp. dalam berbagai konsentrasi nitrat menunjukkan pertumbuhan yang berbeda-beda yang dapat dilihat dari kerapatan sel (OD) dan warna kultur. Pada gambar 4 terlihat bahwa semakin tinggi konsentrasi nitrogen, maka warna kultur semakin pekat dan kerapatan sel semakin besar. Hal ini menunjukkan adanya pengaruh nitrogen terhadap pertumbuhan sel mikroalga. Kultur dengan pertumbuhan sel yang lebih rendah akan memberikan warna kultur yang lebih terang, sebaliknya kultur dengan pertumbuhan sel yang lebih tinggi akan memberikan warna kultur yang lebih pekat. Warna kultur ini dipengaruhi oleh adanya klorofil dalam sel.
Natrium (Na) dalam NaNO3 yang terkandung dalam media berperan
dalam pembentukan klorofil, sehingga akan berpengaruh terhadap fotosintesis
Nannochloropsis sp.. Fotosintesis yang berjalan baik akan ditandai dengan meningkatnya pigmentasi atau kepekatan sel mikroalga dan secara visual kultur akan terlihat lebih hijau (pekat).
Gambar 4 Kultur Nannochloropsis sp. pada berbagai konsentrasi nitrogen
Mikroalga dapat mengasimilasi beberapa sumber nitrogen seperti ammonium, nitrat dan urea. Nitrogen dalam media bisa berupa nitrat (NO3-) dan
ammonium (NH4+). Amonium dan nitrat masuk ke dalam sel melalui membran
plasma. Ammonium transporter (Amt) akan membawa ammonium ke dalam sel, sedangkan nitrat transporter (Nit) membawa nitrat. Nitrat direduksi menjadi nitrit oleh enzim nitrat reduktase. Kemudian, nitrat tranporter akan membawa nitrit ke dalam kloroplas dan merubahnya menjadi ammonium. Sedangkan ammonium akan dibawa ke kloroplas dengan bantuan Amt. Melalui beberapa proses, ammonium digunakan untuk membentuk glutamat dan akhirnya menjadi biomassa. Jika nitrogen yang terkandung dalam media pertumbuhan sedikit atau lebih kecil dari komposisi normal media yang diperlukan, maka akan
17
mempengaruhi proses pembentukan biomassa, sehingga biomassa yang dihasilkan lebih sedikit.
Pada tabel 2 diketahui bahwa laju pertumbuhan spesifik Nannochloropsis
sp. dari yang tertinggi ke terendah secara berurutan adalah sampel dengan konsentrasi nitrogen 50 %, 75 %, 100 % dan 25 %. Tabel 2 menjelaskan bahwa berdasarkan analisis ANOVA dan uji Duncan bobot biomassa kering pada fase eksponensial dari sampel dengan konsentrasi nitrogen 25 %, 50 % dan 75 % tidak berbeda nyata. Hal ini menunjukkan bahwa bobot biomassa kering yang dihasilkan relatif sama. Sementara pada konsentrasi nitrogen 100 % memiliki bobot biomassa kering yang berbeda nyata dengan ketiga konsentrasi nitrogen lainnya. Kultur dengan konsentrasi nitrogen 100 % artinya tidak ada pengurangan unsur nitrogen pada kultur tersebut. Kultur dengan nutrisi yang lengkap mengalami pertumbuhan yang baik. Mikroalga yang ditumbuhkan pada media pertumbuhan yang optimal (tidak ada pengurangan nutrisi) akan menghasilkan biomassa yang lebih banyak dibandingkan dengan kultur pada konsentrasi nitrogen rendah. Pada fase akhir eksponensial baik kontrol maupun sampel memiliki bobot biomassa kering yang relatif sama atau tidak berbeda nyata. Pada fase ini pertumbuhan masih terjadi, namun sudah mulai melambat. Demikian juga pada fase stasioner, bobot kering tidak berbeda nyata terhadap kontrol dan semua sampel. Pada fase stasioner ini, nutrisi mulai habis dan jumlah sel hidup dan mati hampir sama, sehingga produksi biomassa menurun dan tidak berbeda nyata.
Kultur Nannochloropsis sp. dengan konsentrasi nitrogen 50 % memiliki laju pertumbuhan spesifik tertinggi dibandingkan dengan sampel lainnya. Namun, bobot biomassa keringnya tidak berbeda nyata (Tabel 3). Hal ini menunjukkan terjadinya perubahan metabolisme dalam sel saat dibatasi nitrogennya.
Tabel 2 Laju pertumbuhan spesifik Nannochloropsis sp. pada berbagai konsentrasi nitrogen
Konsentrasi nitrogen Laju pertumbuhan spesifik µ (per hari)
25 % 0,308
50 % 0,632
75 % 0,488
18
Tabel 3 Perbedaan bobot biomassa kering kultivasi skala lapangan pada fase eksponensial, akhir eksponensial dan stasioner pada berbagai konsentrasi nitrogen
Keterangan : Huruf yang sama menunjukkan tidak berbeda nyata.
Hasil diperoleh berdasarkan uji ANOVA dengan taraf nyata 0,05 dan uji Duncan (Lampiran 5,6,7)
Pengaruh nitrogen terbatasi terhadap kandungan lemak, protein dan karbohidrat pada Nannochloropsis sp.
Sel mikroalga mengandung bahan-bahan penting seperti protein, karbohidrat dan lemak. Persentase ketiga bahan tersebut berbeda-beda tergantung pada jenis mikroalga. Besarnya kandungan protein, karbohidrat dan lemak dalam sel mikroalga berkaitan dengan pertumbuhan. Protein, karbohidrat dan lemak mulai diproduksi oleh sel sejak awal pertumbuhan mikroalga. Namun, besar kandungannya akan berubah seiring dengan perubahan pertumbuhan sel mikroalga.
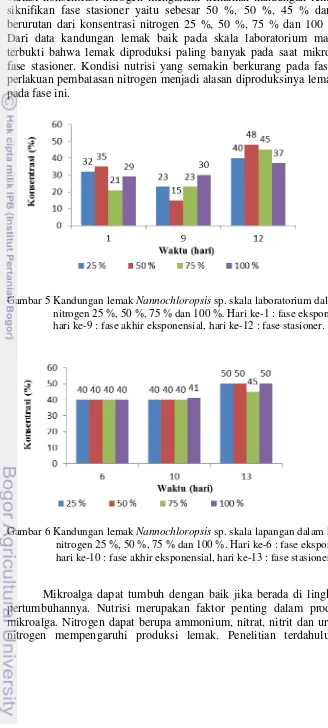
Pada penelitian ini, analisis lemak dilakukan menggunakan metode Bligh and Dyer (1959) dengan modifikasi yaitu menggunakan sonikator untuk memecah membransel mikroalga. Beberapa jenis mikroalga memiliki membran sel yang kuat, sehingga untuk mengeluarkan lemak dari dalam sel perlu menggunakan alat pemecah membran sel. Penggunaan metanol berfungsi untuk membantu proses pemecahan sel. Kloroform berfungsi untuk menarik komponen lemak, sehingga terpisah dari komponen non lemak dan biomassa saat proses ekstraksi lemak. Komponen non lemak akan diikat oleh akuades yang juga digunakan dalam proses ekstraksi lemak ini. Hasil analisis lemak terhadap semua sampel baik pada sampel dengan konsentrasi nitrogen 25 %, 50 %, 75 % maupun 100 % menunjukkan pola yang sama yaitu kadar lemak semakin tinggi pada fase stasioner. Ini terjadi pada skala laboratorium maupun lapangan. Pada skala laboratorium kadar lemak tertinggi diperoleh saat fase stasioner yaitu sebesar 40, 48, 45 dan 37 % secara berurutan untuk sampel dengan konsentrasi nitrogen 25 %, 50 %, 75 % dan 100 % (Gambar 5). Begitu juga kadar lemak pada skala lapangan, sampel dengan berbagai konsentrasi nitrogen memiliki kandungan lemak yang sama yaitu 40 % pada fase eksponensial. Pada fase akhir eksponensial, kandungan lemak tetap kecuali sampel dengan konsentrasi nitrogen
19
100% kandungan lemaknya naik menjadi 41 %. Semua sampel dari keempat variasi konsentrasi nitrogen mengalami kenaikan kandungan lemak pada secara siknifikan fase stasioner yaitu sebesar 50 %, 50 %, 45 % dan 50 % secara berurutan dari konsentrasi nitrogen 25 %, 50 %, 75 % dan 100 % (Gambar 6). Dari data kandungan lemak baik pada skala laboratorium maupun lapangan terbukti bahwa lemak diproduksi paling banyak pada saat mikroalga berada di fase stasioner. Kondisi nutrisi yang semakin berkurang pada fase stasioner dan perlakuan pembatasan nitrogen menjadi alasan diproduksinya lemak lebih banyak pada fase ini.
Gambar 5 Kandungan lemak Nannochloropsis sp. skala laboratorium dalam konsentrasi nitrogen 25 %, 50 %, 75 % dan 100 %. Hari ke-1 : fase eksponensial, hari ke-9 : fase akhir eksponensial, hari ke-12 : fase stasioner.
Gambar 6 Kandungan lemak Nannochloropsis sp. skala lapangan dalam konsentrasi nitrogen 25 %, 50 %, 75 % dan 100 %. Hari ke-6 : fase eksponensial, hari ke-10 : fase akhir eksponensial, hari ke-13 : fase stasioner.
20
bahwa mikroalga mampu memproduksi lemak dalam jumlah yang lebih besar ketika ditumbuhkan dalam media dengan konsentrasi nitrogen yang dikurangi.
Ketika nutrisi tersedia dalam jumlah cukup, maka mikroalga akan tumbuh dengan cepat dan memproduksi biomassa dalam jumlah banyak. Hal sebaliknya terjadi ketika nutrisi berkurang (Sheehan et al. 1998). Fase stasioner merupakan fase dimana nutrisi dalam media pertumbuhan mikroalga mulai berkurang. Dalam kondisi kandungan nitrogen rendah, fotosintesis tetap berjalan meskipun lajunya menurun sampai nitrogen sel berada di bawah ambang batas. Aliran karbon tetap oleh fotosintesis, tetapi dialihkan dari jalur sintesis protein ke sintesis lemak atau kabohidrat (Adetola 2011). Ini ditunjukkan pada gambar tentang kadar lemak (gambar 5 dan 6), protein (gambar 7) dan karbohidrat (gambar 8) dimana pada fase stasioner saat nutrisi mulai habis, kandungan protein menurun sedangkan kandungan lemak dan karbohidrat meningkat. Kondisi kurangnya nitrat (NO3)
menyebabkan biosintesis protein menurun (Guillard 1975). Beberapa peneliti melaporkan bahwa keadaan dimana konsentrasi nutrisi rendah akan menyebabkan kandungan lemak meningkat (Sheehan et al. 1998, Xin et al. 2010). Proses perubahan jalur sintesis dari protein ke sintesis karbohidrat atau lemak pada mikroalga belum diketahui secara pasti. Namun, sering disamakan dengan proses pada tumbuhan tingkat tinggi.
21
Gambar 8 Kandungan karbohidrat Nannochloropsis sp. dalam konsentrasi nitrogen 25 %, 50 %, 75 % dan 100 %
Secara umum, pada saat mikroalga berada dalam kultur dengan kandungan nitrogen terbatas, kandungan protein dan klorofil menurun sedangkan karbohidrat dan lemak meningkat. Kadar lemak netral dalam alga bergeser ke penyimpanan lemak ketika mikroalga berada dalam lingkungan stress. Lemak netral tidak hanya dalam bentuk hidrokarbon jenuh rantai lurus, tetapi juga tak jenuh tunggal atau ganda (Mata et al. 2013).
Karbohidrat merupakan salah satu komponen yang banyak ditemukan pada alga. Karbohidrat didefinisikan sebagai polyhydroxy aldehyde dan keton serta turunan dari gula ini. Gugus hidroksil dari karbohidrat dapat dimodifikasi oleh pergantian dengan gugus-gugus lain untuk menghasilkan ester dan eter atau diganti untuk menghasilkan gula deoksi dan amino. Karbohidrat juga terkait dengan jumlah protein dan lemak.
Pada tabel 3 yield lemak skala laboratorium menunjukkan bahwa semua sampel pada ketiga fase pengambilan sampel memiliki yield lemak lebih tinggi dibandingkan dengan kontrol kecuali sampel 75 % konsentrasi nitrogen pada fase eksponensial. Yield lemak pada fase akhir eksponensial dan stasioner lebih tinggi dibandingkan pada fase eksponensial. Hal ini menunjukkan bahwa pertumbuhan dan nutrisi mempengaruhi produksi lemak dan biomassa.
Pada skala lapangan, yield lemak cenderung menurun dari fase eksponensial, akhir eksponensial dan paling rendah adalah pada fase stasioner.
22
Tabel 4 Yield lemak pada skala laboratorium dan lapangan dari fase eksponensial,
akhir eksponensial dan stasioner
Lemak berfungsi sebagai sumber energi metabolik dan asam lemak esensial yang berperan dalam struktur seluler, pemeliharaan dan integritas biomembran. Senyawa lemak adalah salah satu senyawa metabolit primer yang berperan dalam pertumbuhan. Pada metabolisme sel mikroalga, biosintesis asam lemak terjadi di dalam kloroplas. Biosintesis asam lemak tidak hanya bergantung pada ketersediaan nitrogen, tetapi juga bergantung pada jalur metabolisme sel secara keseluruhan.
Pengaruh nitrogen terbatasi terhadap profil asam lemak
Asam lemak diperoleh melalui proses transesterifikasi TAG dengan metanol dan menghasilkan ester asam lemak mono-alkil yang merupakan alternatif bahan bakar energi. Pemakaian metanol digunakan dalam proses metilasi. Metanol bisa diganti dengan alkohol. Pemilihan metanol dibandingkan alkohol pada proses ini karena harganya lebih murah dan lebih baik dalam pemisahan hasil akhir yaitu biodiesel dan gliserol. Reaksi transesterifikasi dipercepat dengan penggunaan katalis basa berupa boron florida (BF3). Katalis
BF3 digunakan karena bersifat stabil.
Mikroalga yang ideal untuk produksi biodiesel tidak hanya dilihat dari lemak yang tinggi tetapi juga komposisi asam lemaknya. Profil asam lemak mikroalga penting dilakukan untuk mengetahui persentase setiap asam lemak yang terkandung dalam mikroalga yang mempengaruhi sifat biodiesel. Lemak mikroalga terdiri dari asam lemak - asam lemak jenuh dan tidak jenuh dengan atom karbon 12-22 (Mata et al. 2010). Profil asam lemak berbeda-beda untuk setiap jenis mikroalga. Namun, ada beberapa asam lemak yang umum terdapat pada mikroakga yaitu asam palmitat, asam stearat, asam oleat, asam linoleat dan asam linolenat (Knothe 2009). Liu et al. (2011) menemukan bahwa asam lemak terbanyak pada kultur Chlorella zofingiensis berupa asam palmitat, asam oleat dan asam linoleat. Sedangkan Roncarati et al. (2004) menuliskan bahwa pada kultur
23
pada biodiesel adalah asam palmitat, asam oleat, asam stearat, asam linoeat dan asam linolenat (Knothe 2008).
Asam palmitat (C16:0) dan asam stearat (C18:0) merupakan asam lemak jenuh/Saturated Fatty Acid (SFA), asam oleat (C18:1) merupakan asam lemak tak jenuh tunggal/Mono Unsaturated Fatty Acid (MUFA), asam linoleat (C18:2) dan asam linolenat (C18:3) merupakan asam lemak tak jenuh ganda/Poly Unsaturated Fatty Acid (PUFA). Kelima asam lemak tersebut memberikan pengaruh yang berbeda-beda terhadap sifat biodiesel. Hingga saat ini belum diketahui secara pasti berapa persentase yang baik untuk biodiesel dari masing-masing asam lemak tersebut. Standar Biodiesel Indonesia SNI 04-7182-2006 hanya menyebutkan kandungan ester alkil sebesar minimal 96,5 %-b (Setyaningsih 2012).
Sifat biodiesel ditentukan oleh profil asam lemaknya. Sifat biodiesel yang paling penting adalah kualitas pembakaran (cetane number), cold-flow dan stabilitas oksidatif. Asam lemak jenuh dan profil asam lemak mempengaruhi sifat dari produk bahan bakar. Sebagai contoh, asam lemak jenuh menghasilkan biodiesel dengan stabilitas oksidatif yang sangat baik dan cetane number yang tinggi, tetapi low-temperature rendah. Biodiesel yang diproduksi dari asam lemak jenuh ini mudah membentuk gel pada suhu ruang. Kandungan PUFA tinggi memberikan sifat cold-flow yang baik. Namun, asam lemak ini sangat rentan terhadap oksidasi. Oleh karena itu, biodiesel yang dihasilkan dari bahan baku yang memiliki kandungan PUFA tinggi cenderung memiliki masalah ketidakstabilan jika disimpan dalam waktu lama.
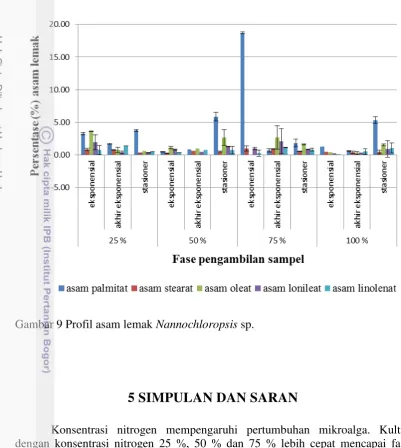
Pada gambar 9 terlihat bahwa asam palmitat (asam lemak jenuh) dominan pada beberapa fase dan variasi konsentrasi nitrogen. Asam palmitat dominan pada fase stasioner dari sampel dengan konsentrasi nitrogen 25 %, 50 % dan 100 %. Hal ini sesuai dengan penelitian Hu & Gao (2003) yang menuliskan bahwa asam lemak predominan yang terdapat pada Nannochloropsis sp. adalah asam palmitat (C16:0).
Pemanfaatan asam palmitat tidak hanya untuk biodiesel tetapi untuk komersial produk lainnya seperti sebagai bahan kosmetik dan bahan olahan makanan. Pada gambar 9 terlihat bahwa persentase asam palmitat tertinggi terdapat pada fase eksponensial dari sampel dengan konsentrasi nitrogen 75 %. Kultivasi Nannochloropsis sp. pada fase dan konsentrasi tersebut bisa menjadi rujukan jika ingin memproduksi asam palmitat dengan presentase yang tinggi.
24
Gambar 9 Profil asam lemak Nannochloropsis sp.
5 SIMPULAN DAN SARAN
Konsentrasi nitrogen mempengaruhi pertumbuhan mikroalga. Kultur dengan konsentrasi nitrogen 25 %, 50 % dan 75 % lebih cepat mencapai fase stasioner dibandingkan dengan konsentrasi nitrogen normal (100 %). Pada fase stasioner, kandungan protein menurun sementara kandungan karbohidrat da lemak meningkat.
Asam palmitat, asam stearat, asam oleat, asam linoleat dan asam linolenat merupakan lima asam lemak yang umum terdapat dalam mikroalga dan menentukan sifat biodiesel seperti viskositas, cetane number, densitas, titik dingin. Hasil GCMS untuk mengetahui profil asam lemak menunjukkan bahwa asam lemak yang paling banyak dihasilkan adalah asam palmitat. Asam palmitat tertinggi dihasilkan dari sampel dengan kosentrasi nitrogen 75 % pada fase eksponensial. Asam palmitat tidak hanya mempengaruhi karakter biodiesel tapi juga dapat digunakan untuk produk komersial lainnya seperti bahan kosmetik dan bahan olahan makanan.
25
DAFTAR PUSTAKA
Adetola TG. 2011. Effect of nitrogen, iron and temperature on yield and composition of microalgae [thesis]. Stillwater:Oklahoma state University. Banerjee A, Harma RS, Chisti Y, Banerjee UC. 2002. Botryococcus braunii: a
renewable source of hydrocarbons and other chemicals. Crit Rev Biotechnol. 22:245-279.
Bligh EG, Dyer WJ. 1959. A rapid method of total lipid extraction and purification. Can J Biochem Physiol. 37:911-917.
Bradford MM. 1976. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding. Anal Biochem. 72:248-254. doi:10.1016/0003-2697(76)90527-3. Brennan L, Owende P. 2010. Biofuels from microalgae-a review of technologies
for production, processing, and extractions of biofuels and co-products.
Renew and Sustain Energy Rev. 14:557-577. doi: 10.1016/j.rser.2009.10.009.
Chisti Y. 2007. Biodiesel from microalgae. Biotechnol Adv. 25:294-306.
Gavrilescu M, Chisti Y. 2005. Biotechnology-a sustainable alternative for chemical industry. Biotechnol Adv. 23:471-99.
Greenwell HC, Laurens LML, Shields RJ, Lovitt RW, Flynn KJ. 2010. Placing microalgae on the biofuels priority list: a review of the technological challenges. J of The Royal Society. 7:703-726. doi: 10.1098/rsif.2009.0322 Guillard RRL. 1975. Culture of Phytoplankton for Feeding Marine Invertebrates.
Smith WL, Chanley MH, editors. Cultures of marine invertebrates animals. New York (US): Plenum Press. p.26-60.
Hu H, Gao K. 2003. Optimization of growth and fatty acid composition of a unicellular marine picoplankton, Nannochloropsis sp., with enriched carbon sources. Biotechnol Letters. 25:421-425.
Hu Q, Sommerfeld M, Jarvis E, Ghirardi M, Posewitz M, Seibert M, Darzins A. 2008. Microalgal triacylglycerols as feedstocks for biofuel production: perspectives and advances. The Plant J. 54:621-639.
Hossain A, Salleh A, Boyce AN, Chowdhury P, Naqiuddin M. 2008. Biodiesel fuel production from algae as renewable energy. American J of Biochem and Biotechnol. 4 (3):250-254.
Illman AM, Scragg AH, Shales SW. 2000. Increase in Chlorella strains calorific values when grown in low nitrogen medium. Enzyme and Microbial Technol. 27:631-635.
Junying Z, Junfeng R, Baoning Z. 2013. Factor in cultivation of microalgae for biodiesel. Chinese Jl of Catalysis. 34:80-100.
Kaur S, Sarkar M, Srivastava RB, Gogoi HK, Kalita MC. 2012. Fatty acid profiling and molecular characterization of some freshwater microalgae from India with potential for biodiesel production. New Biotechnol. 29:332-344.
Knothe G. 2008. Designer biodiesel: optimizing fatty ester composition to improve fuel properties. Energy Fuels. 22:1358–1364.
26
Lannan E. 2011. Scale up of algae system to cleanse wastewater and produce oils for biodiesel production [thesis]. Rochester (NY):Rochester Institute of Tachnology.
Li Y, Horsman M, Wang B, Wu N, Lan CQ. 2008. Effects of nitrogen sources on cell growth and lipid accumulation of green alga Neochloris oleoabundans. Appl Micobiol Biotechnol. 4:629-636.
Liu J, Huang J, Sun Z, Zhong Y, Jiang Y, Chen F. 2011. Differential lipid and fatty acid profile of photoautotrophic and heterotrophic Chlorella zofingiensis: assessment of algal oils for biodiesel production. Bioresour Technol. 102:106-110.
Mata TM, Martins AA, Caetano NS. 2010. Microalgae for biodiesel production and other application: a review. Renew Sustain Energy Rev. 14:217-232. Mata TM, Almeida R, Caetano NS. 2013. Effect of the culture nutriens on the
biomass and lipid productivities of microalgae Dunaliella tertiolecta.
Chem Eng Transact. 32:973-978. doi:10.3303/CET1332163.
Pelczar MJ, Chan ECS. 1986. Dasar-dasar mikrobiologi. Jakarta (ID): Universitas Indonesia Press.
Ren M. 2012. Cultivation optimization and modelling for microalgae to produce biodiesel [Dissertation]. Arizona (US):The University of Arizona.
Roncarati A, Meluzzi A, Acciarri S, Tallarico N, Melotti P. 2004. Fatty acid composition of different microalgae strains (Nannochloropsis sp.,
Nannochloropsis oculata (Droop), Nannochloris atomus Butcher and
Isochrysis sp.) according to the culture phase and the carbon dioxide concentration. J World Aquacu Soc. 35(3):401-411.
Setyaningsih D. 2012. Bahan Mata Kuliah Pascasarjana. Bogor (ID): Institut Pertanian Bogor.
Sheehan J, Dunahay T, Benemann J, Roessler P. 1998. A Look Back at the U.S. Department of Energy's Aquatic Species Program-Biodiesel from Algae.
Golden (US). National Renewable Energy Laboratory.
Susilaningsih D, Djohan AC, Widyaningrum DN, Anam K. 2009. Biodiesel from indigenous Indonesian marine microalgae, Nanochloropsis sp. J of Biotechnol Research in Tropical Region. 2:1-4.
27
Lampiran 1 Komposisi media F/2 dalam 100 ml
NaNO3 7,5 mg
NaH2PO4.2H2O 0,6 mg
Na2SiO3.9H2O 1 mg
F/2 metal* 0,1 ml
Vit B12 0,05 µg
Biotin 0,05 µg
Tiamin HCl 10 µg
Air laut 99,9 ml
*F/2 metal dalam 100 ml
NaEDTA.2H2O 440 mg
FeCl3.6H2O 316 mg
CoSO4.7H2O 1,2 mg
ZnSO4.7H2O 2,1 mg
MnCl2.4H2O 18 mg
CuSO4.5H2O 0,7 mg
Na2MoO4.2H2O 0,7 mg
28
Lampiran 2 Diagram alir strategi penelitian
Lampiran 3 Tahapan persiapan prekultur Nannochloropsis sp.
1. Skala 1 liter 2. Skala 5 liter Kultivasi skala lapangan
(bioreaktor 80L) Pengukuran pertumbuhan sel Analisis kandungan protein Analisis kandungan karbohidrat Analisis kandungan lemak
Pengukuran laju pertumbuhan spesifik Penghitungan yield lemak
Preparasi dan pembibitan
Pengambilan sampel pada fase - eksponensial
- akhir eksponensial - stasioner
Optimasi N dalam media ( 25 %, 50 %, 75 %, 100 %)
29
Lampiran 4 Persiapan kultivasi di bioreaktor (lapangan) 80 L
1. aerasi media 2. penambahan prekultur 3. adaptasi cahaya dengan penutupan bioreaktor menggunakan kain
Lampiran 5 Uji ANOVA dan Duncan biomassa kering dari sampel skala lapangan
pada fase eksponensial
Descriptives
Biomassaeksponensial
N Mean
Std.
Deviation Std. Error
95% Confidence Interval for
Mean
Minimum Maximum Lower Bound Upper Bound
25 % 3 .0243 .01464 .00845 -.0120 .0607 .01 .04
50 % 3 .0160 .00529 .00306 .0029 .0291 .01 .02
75 % 3 .0157 .00058 .00033 .0142 .0171 .02 .02
100 % 3 .0410 .01179 .00681 .0117 .0703 .03 .05
Total 12 .0243 .01359 .00392 .0156 .0329 .01 .05
Test of Homogeneity of Variances
Biomassaeksponensial
Levene Statistic df1 df2 Sig.
30
ANOVA
Biomassaeksponensial
Sum of Squares df Mean Square F Sig.
Between Groups .001 3 .000 4.426 .041
Within Groups .001 8 .000
Total .002 11
Descriptives
Biomassaeksponensial
N Mean Std. Deviation Std. Error
95% Confidence Interval for
Mean
Minimum Maximum Lower Bound Upper Bound
25 % 3 .0243 .01464 .00845 -.0120 .0607 .01 .04
50 % 3 .0160 .00529 .00306 .0029 .0291 .01 .02
75 % 3 .0157 .00058 .00033 .0142 .0171 .02 .02
100 % 3 .0410 .01179 .00681 .0117 .0703 .03 .05
Total 12 .0243 .01359 .00392 .0156 .0329 .01 .05
Test of Homogeneity of Variances
Biomassaeksponensial
Levene Statistic df1 df2 Sig.
3.043 3 8 .093
ANOVA
Biomassaeksponensial
Sum of Squares df Mean Square F Sig.
Between Groups .001 3 .000 4.426 .041
Within Groups .001 8 .000
31
Post Hoc Tests
Multiple Comparisons
Dependent Variable:Biomassaeksponensial
(I)
Perlakua
n
(J)
Perlakua
n
Mean
Difference (I-J) Std. Error Sig.
95% Confidence Interval
Lower Bound Upper Bound
Tukey HSD 25 % 50 % .00833 .00798 .730 -.0172 .0339
75 % .00867 .00798 .707 -.0169 .0342
100 % -.01667 .00798 .235 -.0422 .0089
50 % 25 % -.00833 .00798 .730 -.0339 .0172
75 % .00033 .00798 1.000 -.0252 .0259
100 % -.02500 .00798 .055 -.0505 .0005
75 % 25 % -.00867 .00798 .707 -.0342 .0169
50 % -.00033 .00798 1.000 -.0259 .0252
100 % -.02533 .00798 .052 -.0509 .0002
100 % 25 % .01667 .00798 .235 -.0089 .0422
50 % .02500 .00798 .055 -.0005 .0505
32
Homogeneous Subsets
Biomassaeksponensial
Perlakuan N
Subset for alpha = 0.05
1 2
Tukey HSDa 75 % 3 .0157
50 % 3 .0160
25 % 3 .0243
100 % 3 .0410
Sig. .052
Duncana 75 % 3 .0157
50 % 3 .0160
25 % 3 .0243 .0243
100 % 3 .0410
Sig. .328 .070
Means for groups in homogeneous subsets are displayed.
a. Uses Harmonic Mean Sample Size = 3.000.
Lampiran 6 Uji ANOVA dan Duncan biomassa kering dari sampel skala lapangan
pada fase akhir eksponensial
Descriptives
akhireksponensial
N Mean Std. Deviation Std. Error
95% Confidence Interval for
Mean
Minimum Maximum Lower Bound Upper Bound
25 % 3 .0500 .02166 .01250 -.0038 .1038 .04 .08
50 % 3 .1090 .10770 .06218 -.1585 .3765 .02 .23
75 % 3 .0590 .04258 .02458 -.0468 .1648 .01 .09
100 % 3 .1163 .09301 .05370 -.1147 .3474 .02 .21
33
Test of Homogeneity of Variances
akhireksponensial
Levene Statistic df1 df2 Sig.
1.758 3 8 .233
ANOVA
akhireksponensial
Sum of Squares df Mean Square F Sig.
Between Groups .010 3 .003 .613 .626
Within Groups .045 8 .006
Total .055 11
Lampiran 7 Uji ANOVA dan Duncan biomassa kering dari sampel skala lapangan
pada fase stasioner
Descriptives
stasioner
N Mean Std. Deviation Std. Error
95% Confidence Interval for
Mean
Minimum Maximum Lower Bound Upper Bound
25 % 3 .2157 .10839 .06258 -.0536 .4849 .11 .33
50 % 3 .2483 .09922 .05728 .0019 .4948 .17 .36
75 % 3 .3200 .09387 .05420 .0868 .5532 .26 .43
100 % 3 .3403 .10420 .06016 .0815 .5992 .23 .43
Total 12 .2811 .10165 .02934 .2165 .3457 .11 .43
Test of Homogeneity of Variances
stasioner
Levene Statistic df1 df2 Sig.
34
ANOVA
stasioner
Sum of Squares df Mean Square F Sig.
Between Groups .031 3 .010 1.006 .439
Within Groups .083 8 .010
35
RIWAYAT HIDUP
Penulis dilahirkan di Tegal, Jawa Tengah pada tanggal 11 November 1979 sebagai anak pertama dari pasangan ayah Mohamad Sidik dan ibu Faridah. Pendidikan sarjana ditempuh di Program Studi Biologi, Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor (IPB), lulus pada tahun 2002. Pada tahun 2011 penulis mendapatkan kesempatan untuk melanjutkan pendidikan ke program master pada program studi Bioteknologi IPB. Beasiswa pendidikan diperoleh dari Kementrian Riset dan Teknologi.