KAJIAN INFEKSI VIRUS
NEWCASTLE DISEASE
PADA ITIK DAN AYAM DI BEBERAPA LOKASI
DI KABUPATEN SUBANG
APRIZAL PANUS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Kajian Infeksi Virus
Newcastle Disease pada Itik dan Ayam di Beberapa Lokasi di Kabupaten Subang adalah benar karya saya dengan arahan dari komisi pembimbing dan
belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
RINGKASAN
APRIZAL PANUS. Kajian Infeksi Virus Newcastle Disease pada Itik dan Ayam di Beberapa Lokasi di Kabupaten Subang. Dibimbing oleh SURACHMI SETIYANINGSIH dan NI LUH PUTU IKA MAYASARI
Newcastle Disease (ND) merupakan penyakit endemik di Indonesia termasuk di Kabupaten Subang. Meskipun saat ini tingginya tingkat kematian yang disebabkan oleh ND dapat dikendalikan dengan vaksinasi, namun ND masih menyebabkan gangguan pada produksi. Selama ini penyidikan tentang ND di Kabupaten Subang masih jarang dan terbatas dilakukan. Diagnosa umumnya ditentukan hanya berdasarkan gejala klinis, perubahan patologi anatomi (PA) dan serologik.
Tujuan dari penelitian ini untuk mengetahui keberadaan dan keragaman antigenik virus Newcastle Disease (VND) di Kabupaten Subang, sehingga dapat diambil tindakan pengendalian dan pencegahan ND yang efektif. Sampel usapan kloaka, orofaring dan serum diambil dari 149 ekor itik dan 393 ekor ayam dari penampungan, peternakan dan pasar unggas di 10 kecamatan di Kabupaten Subang. Screening VND pada sampel pool dari 5–7 individu dilakukan dengan Real Time Reverse Transcription Polymerase Chain Reaction (rRT-PCR) matrix (M). Sampel individu yang dipilih berdasarkan jenis usapan, unggas, lokasi dan waktu pengambilan sampel diinokulasi pada telur ayam berembrio SPF melalui 2 kali pasase, sedangkan deteksi antibodi spesifik terhadap ND pada serum diuji dengan hambatan hemaglutinasi (HI). Karakterisasi isolat dilakukan dengan uji hambatan hemaglutinasi (HI) menggunakan antisera LaSota dan Komarov, rRT-PCR fusion (F), dan uji waktu elusi.
titer yang protektif. Analisa pada 6 flok ayam ras yang divaksinasi menunjukkan respon antibodi yang tidak merata.
Newcastle disease masih endemik di wilayah Subang dan infeksinya bisa bersifat subklinis. Delapan belas isolat VND yang ditemukan mayoritas memiliki karakter yang relatif homogen, hanya beberapa isolat menunjukkan keragaman baik patogenisitas maupun antigenisitasnya. Itik dari Kecamatan Cipeundeuy belum pernah terpapar VND. Vaksinasi ND pada ayam broiler kurang optimal karena sebaran titer antibodi tidak merata. Kajian terhadap sampel yang lebih banyak dan cakupan area yang lebih luas diperlukan agar diperoleh informasi yang lebih menyeluruh. Hasil penelitian ini merupakan sumbangan informasi tentang ND di wilayah Subang dan dapat menjadi masukan bagi pemerintah daerah dalam menentukan program pengendalian dan pencegahan infeksi VND pada unggas di Kabupaten Subang.
SUMMARY
APRIZAL PANUS. Study of Newcastle Disease Virus (VND) Infection on ducks and chickens in Areas of Subang district. Under the direction of SURACHMI SETIYANINGSIH and NI LUH PUTU IKA MAYASARI
Newcastle Disease (ND) is endemic in Indonesia, including in Subang district. Vaccination has been practised to control its high morbidity and mortality rate; however, cases are still reported. Investigation on the disease in Subang district is limited; diagnosis is generally determined based on clinical symptoms, pathological and serological findings.
The objectives of this research were to study Newcastle Disease virus (NDV) infection in Subang areas and to examine the diversity of the circulating ND viruses. The infection was determined by detecting NDV in swab samples and specific antibody in serum samples. Swabs of cloacal, oropharynx and serum were sampled from total of 149 ducks and 393 chickens in backyard farms and live bird markets located in 10 subdistricts. Real Time Reverse Transcription Polymerase Chain Reaction (rRT-PCR) matrix (M) was used to screen pools of 5–7 samples. Selected individual samples representing type of bird, sample, and location were inoculation in SPF embryonated chicken eggs following 2 passages. Specific antibody againts ND was tested by Haemagglutination Inhibition (HI). Characteristics of isolates were examined by HI test using LaSota and Komarov antisera, rRT-PCR fusion (F), and the elution time test.
The results showed NDV were detected in 19/67 (28.3%) cloacal and 8/67 (11.9%) pharyngeal pools of chicken samples; 18/67 (26.9%) of the pools excreted virus via cloaca and oropharynx, while the duck pools of 8/30 (26.7%) shed virus from cloaca. The routes of viral shedding was further shown by virus inoculation result. Characterization of 18 NDV isolates indicated that majority of them have homogeneous antigenic characteristic, only a few showed variations up to 2 Log2 and 4 Log2 with LaSota and Komarov antisera, respectively. The isolates had a higher affinity to Komarov antiserum indicating their propensity to virulent strains. This finding was supported by the elution patterns which grouped 3 isolates to mesogenic strain and 15 isolates to velogenic strain, and further confirmed by rRT-PCR F. Specific antibody was detected in 48 out of 408 (12%) birds with titres ranging from 1–8 Log2. Small percentage of vaccinated chickens (37/212) demonstrated protective titers. Analysis in 6 vaccinated flocks indicated poor vaccination responses. Eighteen of NDV isolates were found to have the majority of characters are relatively homogeneous, only a few isolates showed diversity of pathogenicity and antigenicity. Newcastle Disease vaccination in broiler chickens is suboptimal due to the uneven distribution of antibody titers. Newcastle disease was confirmed in 9 subdistricts, but absent in Cipeundeuy subdistrict which represented by a limited number of ducks. This study emphasis the need for further investigation employing bigger sample size and wider areas to provide a comprehensive information to the local government for better implementation of NDV prevention and control programs in poultry in Subang.
© Hak Cipta Milik IPB, Tahun 2014
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains
pada
Program Studi Mikrobiologi Medik
KAJIAN INFEKSI VIRUS
NEWCASTLE DISEASE
PADA ITIK DAN AYAM DI BEBERAPA LOKASI
DI KABUPATEN SUBANG
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2014
Judul Tesis : Kajian Infeksi Virus Newcastle Disease pada Itik dan Ayam di Beberapa Lokasi di Kabupaten Subang
Nama : Aprizal Panus NIM : B253110041
Disetujui oleh Komisi Pembimbing
Drh Surachmi Setiyaningsih, PhD Ketua
Dr Drh Ni Luh Putu Ika Mayasari Anggota
Diketahui oleh
Ketua Program Studi Mikrobiologi Medik
Prof Dr Drh Fachriyan H. Pasaribu, MS
Dekan Sekolah Pascasarjana
Dr Ir Dahrul Syah, MSc Agr
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah subhanahu wa ta’ala atas segala karunia-Nya sehingga karya ilmiah ini berhasil diselesaikan. Tema yang dipilih dalam penelitian yang dilaksanakan sejak bulan April 2013–April 2014 ini ialah Newcastle Disease, dengan judul Kajian Infeksi Virus Newcastle Disease pada Itik dan Ayam di Beberapa Lokasi di Kabupaten Subang
Terima kasih penulis ucapkan kepada United State Department of Agriculture Civillian Research and Development Foundation (USDA CRDF)
yang telah mendanai biaya penelitian ini, dan Biosecurity Engagement Program (BEP), United State Department of Agriculture Animal and Plant Health Ispection Service (USDA APHIS) yang telah memberikan beasiswa pendidikan, kepada Ibu drh. Surachmi Setiyaningsih, Ph.D dan Ibu Dr. drh. Ni Luh Putu Ika Mayasari selaku pembimbing, serta Bapak drh. Muhammad Syibli dan Ibu drh. Liliek yang telah memberikan kesempatan kepada saya untuk melanjutkan studi. Ibu drh. Rince Morita Butar-butar, Bapak drh. Sodirun, Msi dan Bapak drh. Putut Wibowo beserta teman-teman di Balai Veteriner Subang (BVET Subang) yang telah banyak membantu. Di samping itu, penghargaan penulis sampaikan kepada Bapak drh. Agus Sugama, Bapak Rahmat, drh. Lina dari Dinas Peternakan Subang, serta drh. Ali Rahmawan, drh. Agus Setiadi, Eni Trimurningsih Amd, Bapak Yaya Sunarji atas bantuannya selama pengambilan sampel. Bapak drh. Satriyo Utomo, Firman dan Redi yang telah membantu selama pengumpulan data. Ungkapan terima kasih juga disampaikan kepada ayahanda (alm), ibunda, kakanda dan adinda, Awan serta seluruh keluarga, atas segala doa dan kasih sayangnya.
Semoga karya ilmiah ini bermanfaat.
DAFTAR ISI
DAFTAR TABEL vi
DAFTAR GAMBAR vi
DAFTAR LAMPIRAN vi
PENDAHULUAN 1
Latar Belakang 1
Perumusan Masalah 2
Tujuan Penelitian 3
Manfaat Penelitian 3
Ruang Lingkup Penelitian 3
Hipotesis 3
TINJAUAN PUSTAKA 4
Newcastle Disease 4
Epidemiologi Newcastle Disease 8
Diagnosis Laboratorium 12
Pencegahan dan Pengendalian Newcastle Disease 14 Situasi Perunggasan dan Kejadian Newcastle Disease di Kabupaten Subang
15
METODE 18
Waktu dan Tempat Penelitian 18
Alat dan Bahan 18
Pengambilan Sampel 18
Isolasi RNA 19
Uji Real Time Reverse Transcription Polymerase Chain Reaction 19
(rRT-PCR) Matrix (M) 19
Isolasi Virus Newcastle Disease dari Telur Ayam Berembrio (TAB) 20
Specific Pathogen Free (SPF) 20
Uji Hemaglutinasi (HA) 20
Uji Hambatan Hemaglutinasi (HI) 20
Uji Real Time Reverse Transcription Polymerase Chain Reaction 21
(rRT-PCR) Fusion (F) 21
Uji Waktu Elusi 21
Analisis Data 22
HASIL DAN PEMBAHASAN 23
Deteksi Virus Newcastle Disease pada Pool Usapan Kloaka dan Orofaring dengan Real Time Reverse Transcription Polymerase Chain Reaction 23
(rRT-PCR) Matrix (M) 23
Isolasi Virus Newcastle Disease pada Telur Ayam Berembrio (TAB) 24
Deteksi Antibodi terhadap Virus Newcastle Disease dengan Uji Hambatan
Hemaglutinasi (HI) 26
Keragaman Antigenik 32
Karakterisasi Sifat Fisik Virus Newcastle Disease dengan Uji Waktu Elusi 34 Karakterisasi Virus Newcastle Disease dengan Real Time Reverse
Transcription Polymerase Chain Reaction (rRT-PCR) Fusion (F) 36 Penyebaran virus Newcastle Disease di 10 Kecamatan di Kabupaten Subang 36
SIMPULAN DAN SARAN 41
Simpulan 41
Saran 41
DAFTAR TABEL
Pasangan primer dan probe untuk mendeteksi Virus Newcastle Disease ... 13
Populasi ternak unggas di Kabupaten Subang tahun 2013 ... 16
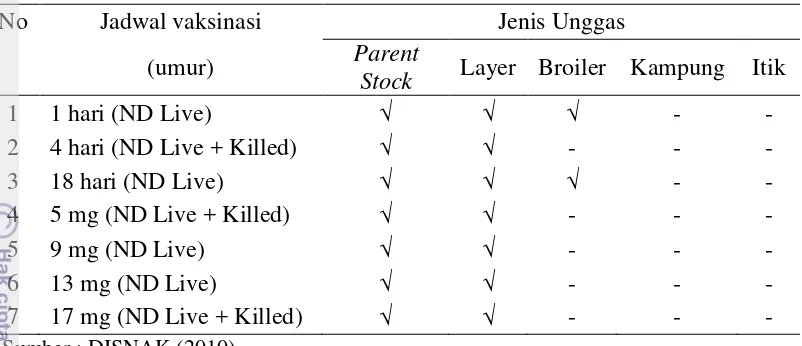
Jadwal vaksinasi Newcastle Disease pada unggas di Kabupaten Subang ... 17
Jumlah unggas dan pool sampel asal 10 kecamatan di Kabupaten Subang serta hasil uji rRT-PCR M dan jumlah isolat VND yang diperoleh ... 23
Hasil deteksi antibodi spesifik terhadap VND pada serum unggas dari 10 kecamatan di Kabupaten Subang berdasarkan jenis komoditas unggas ... 26
Hasil perhitungan rataan dan sebaran titer antibodi ayam ras yang divaksinasi di Kabupaten Subang menggunakan geomteric mean titre (GMT) dan coefisien variation (CV) ... 28
Hasil deteksi antibodi spesifik VND dengan uji HI pada serum 16 individu unggas yang berhasil diisolasi VND di Kabupaten Subang ... 31
Hasil uji waktu elusi isolat VND yang diperoleh dari itik dan ayam di 10 kecamatan di Kabupaten Subang ... 35
DAFTAR GAMBAR
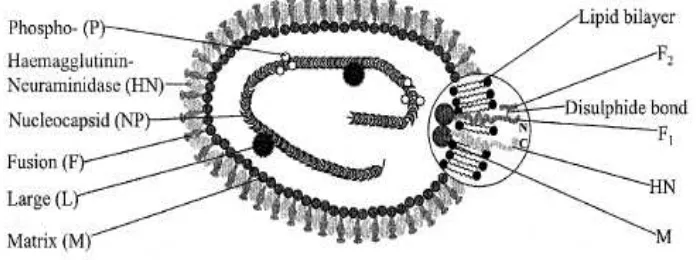
Struktur virus Newcastle Disease ... 5Struktur genom virus Newcastle Disease ... 6
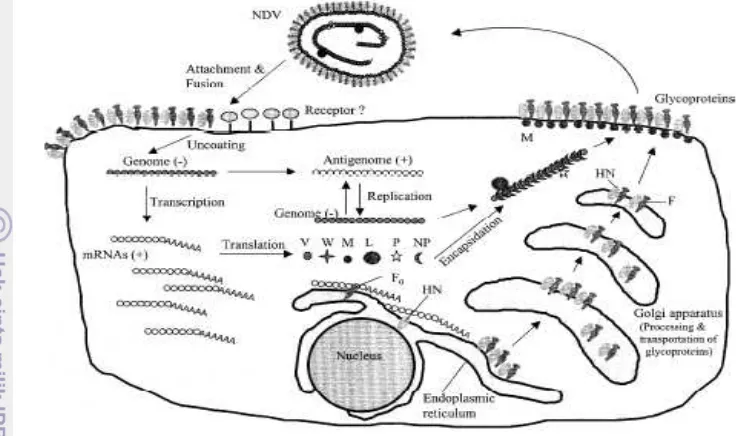
Skematis Siklus Hidup virus Newcastle Disease ... 7
Gejala klinis ayam yang terinfeksi Newcastle Disease. ... 10
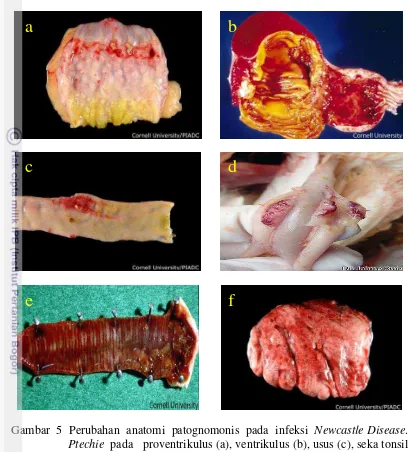
Perubahan anatomi patognomonis pada infeksi Newcastle Disease. ... 11
Perbandingan antigenik 18 isolat dengan uji hambatan hemaglutinasi... 33
Kondisi Pemeliharaan, penampungan, pemasaran dan penanganan unggas mati di Kabupaten Subang... 38
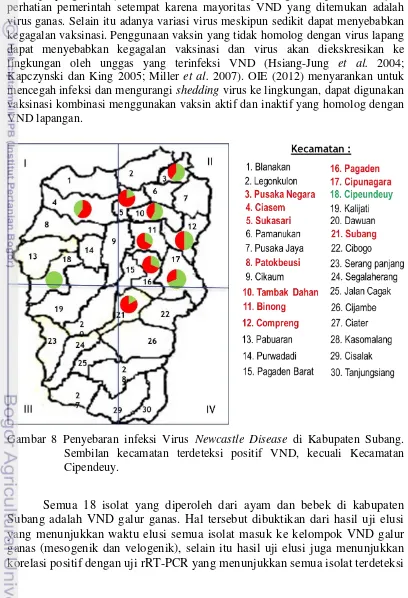
Penyebaran infeksi virus Newcastle Disease di Kabupaten Subang... 39
DAFTAR LAMPIRAN
Hasil rRT-PCR matrix cairan alantois yang berhasil diperoleh isolat VND dari usapan kloaka dan orofaring itik dan ayam di 10 kecamatan di Kabupaten Subang ... 49PENDAHULUAN
Latar Belakang
Newcastle Disease (ND) adalah salah satu penyakit penting dalam dunia perunggasan, karena sangat menular (contagious), cepat menyebar dan menyerang unggas pada segala umur. Umumnya wabah penyakit ini menyerang peternakan unggas yang intensif, baik pada peternakan ayam, kalkun, itik, burung puyuh ataupun burung merpati. Penyakit ini tersebar di seluruh dunia dan memiliki potensi menyebabkan kerugian ekonomi dalam industri unggas (Lancaster 1976; Spradbrow 1988). Selain menyerang ternak unggas, penyakit ini juga menyerang burung liar dan dapat menimbulkan kematian. Wabah penyakit ini pertama kali terjadi di Pulau Jawa, Indonesia dan di Inggris yang dilaporkan pada pertengahan tahun 1920-an (Kraneveld 1926; Doyle 1927) dan dalam beberapa tahun kemudian penyakit ini menyebar ke seluruh dunia dan endemik dibanyak negara (Spradbrow 1988). Saat ini hampir seluruh wilayah di Indonesia merupakan daerah tertular dan belum ada satu daerah atau satu pulau yang dapat dibebaskan dari ND. Meskipun saat ini tingginya tingkat kematian yang disebabkan oleh ND sudah dapat dikendalikan, namun gangguan pada produksi masih menjadi masalah. Selain kematian, dampak kerugian lainnya yang ditimbulkan adalah besarnya biaya yang dikeluarkan untuk pengendalian dan adanya penghentian ekspor dari negara-negara yang terserang wabah ND (Brown et al. 1999).
Kejadian ND dapat bersifat akut sampai kronis dan menyerang semua jenis unggas terutama ayam, baik ayam ras maupun ayam bukan ras (buras). Newcastle Disease yang terjadi di lapangan dapat disebabkan oleh galur virus yang bervariasi. Berdasarkan tingkat keparahan penyakit ini pada unggas, virus Newcastle Disease (VND) diklasifikasikan menjadi tiga patotipe yaitu lentogenik, mesogenik dan velogenik. Galur velogenik dibedakan lagi menjadi bentuk neurotropik dan bentuk viscerotropik (Aldous dan Alexander 2001).
2
yang ditimbulkan oleh penyakit ND pada ayam petelur antara lain berupa kematian ayam, penurunan produksi telur, sedangkan pada ayam pedaging menyebabkan gangguan pertumbuhan dan penurunan berat badan. Data OIE (2009) menunjukkan pada tahun 2007 sekitar 1.500–8.000 ekor ayam terinfeksi VND tiap bulannya di Indonesia. Selain itu menurut Xiao (2012) pada tahun 2009 dan 2010, wabah ND terjadi pada ayam komersial di Indonesia yang menyebabkan tingkat kematian sebesar 70–80%. Meskipun vaksinasi rutin diberikan pada ayam komersial di Indonesia, tetapi ND tetap menjadi masalah besar di industri peternakan unggas (Samal 2011). Oleh karena itu kasus ND merupakan ancaman serius bagi industri peternakan di Indonesia.
Kabupaten Subang di Provinsi Jawa Barat merupakan salah satu daerah penyangga produksi ternak ayam, baik pedaging maupun petelur, dengan populasi unggas yang ada di Kabupaten Subang adalah 44.049.739 ekor pada tahun 2013 (DISNAK 2013). Newcastle Disease endemik di Indonesia, termasuk di Kabupaten Subang. DISNAK (2010) mencatat 258 kasus unggas mati mendadak akibat ND sepanjang 2010. Kematian massal pun bisa terjadi jika tidak ditangani dengan benar. Survei tahunan Balai Penyidikan dan Pengujian Veteriner (BPPV) Subang tahun 2011 menemukan 10 dari 131 serum unggas pekarangan yang diuji positif terhadap ND (BPPV 2011), tahun 2012 sebanyak 12 dari 37 serum yang diuji positif terhadap ND (BPPV 2012), dan pada tahun 2013, sebanyak 184 dari 359 serum yang diuji positif terhadap ND (BPPV 2013). Hal ini menunjukkan bahwa ND masih endemik di Kabupaten Subang. Untuk itu, sebagai dasar pertimbangan agar dapat dilakukan tindakan pengendalian dan pencegahan yang efektif, maka perlu dilakukan isolasi dan deteksi VND serta deteksi antibodi terhadap ND pada itik dan ayam di Kabupaten Subang.
Perumusan Masalah
Newcastle Disease merupakan penyakit endemik yang telah bertahun-tahun bertahan hampir di seluruh wilayah di Indonesia. Penyakit ini mempunyai dampak penting dalam industri perunggasan karena menyebabkan penurunan kuantitas produksi dan kualitas telur, gangguan pertumbuhan, biaya penanggulangan penyakit yang tinggi dan dapat memicu timbulnya penyakit lain (DISNAK 2010).
Subang merupakan salah satu kabupaten di provinsi Jawa Barat dengan jumlah populasi unggas yang cukup besar. Ternak unggas yang terdapat didaerah Subang antara lain adalah ayam kampung, ayam ras pedaging, ayam ras petelur, dan itik. Ternak unggas tersebut selain memenuhi kebutuhan lokal dan nasional juga diekspor ke beberapa negara di Asia. Sebagai sentra produksi unggas, maka Kabupaten Subang bertanggung jawab dalam upaya mencegah dan mengurangi kerugian yang diakibatkan oleh ND.
3
Tujuan Penelitian
Secara umum penelitian ini bertujuan untuk mengkaji infeksi dan keragaman VND pada itik dan ayam di 10 kecamatan di Kabupaten Subang. Secara khusus, penelitian ini bertujuan untuk melihat distribusi infeksi VND, melihat rute ekskresi VND, mendeteksi VND dengan teknik Real Time Reverse Transcription-Polymerase Chain Reaction (rRT-PCR), mengisolasi dan mengkarakterisasi virus, baik patogenisitas dan antigenisitasnya, mendeteksi dan menentukan titer antibodi spesifik, serta mengkaji hubungan antara infeksi VND dengan titer antibodi pada individu unggas yang terinfeksi.
Manfaat Penelitian
Informasi tentang keberadaan dan keragaman VND pada unggas, terutama itik dan ayam, di beberapa lokasi di Kabupaten Subang, diharapkan dapat digunakan sebagai pertimbangan dalam melakukan tindakan pengendalian dan pencegahan ND yang efektif.
Ruang Lingkup Penelitian
Pada penelitian ini dilakukan serangkaian kegiatan mencakup koleksi sampel usapan orofaring dan kloaka serta serum dari itik dan ayam di 10 kecamatan di Kabupaten Subang: pooling sampel usapan, deteksi VND dengan rRT-PCR matrix (M), isolasi VND pada Telur Ayam Berembrio (TAB), identifikasi VND dengan uji hemaglutinasi (HA) dan hambatan hemaglutinasi (HI). Karakterisasi VND dengan uji HI, uji Waktu Elusi dan rRT-PCR fusion (F). Deteksi dan titrasi antibodi spesifik dengan uji HI.
Hipotesis
4
TINJAUAN PUSTAKA
Newcastle Disease
Sejarah Penyebaran Penyakit
Newcastle Disease (ND) pertama kali diidentifikasi dan dilaporkan oleh Professor Kraneveld yang bekerja di laboratorium yang sekarang dikenal sebagai Balai Besar Penelitian Veteriner (BBalitvet) di Bogor, Jawa Barat, Indonesia pada tahun 1926. Kemudian pada tahun 1927 di Inggris terjadi wabah penyakit yang ganas pada unggas di daerah Newcastle, Upon Tyne yang diidentifikasi oleh Doyle. Karena pada saat itu kejadian wabah tersebut belum diketahui penyebabnya, maka oleh pelapor penyakit tersebut disebut sebagai Newcastle Disease, sesuai dengan tempat pertama kali ditemukannya. Kemudian setelah tahun 1935 nama ND baru digunakan oleh Doyle (Samal 1997). Menurut Doyle (1927) dan Levine (1964) sebelumnya penyakit yang menunjukkan gejala yang sama dengan ND pernah diidentifikasi pada tahun 1924 di Semenanjung Korea dan di Eropa dipertengahan tahun 1926, selanjutnya ND menyebar dengan cepat ke beberapa negara (panzootik).
Newcastle Disease di Indonesia dikenal sebagai penyakit tetelo. Penyakit ini telah menyebar ke berbagai daerah, baik di Jawa maupun diluar Jawa. Serangan ND umumnya mulai meningkat pada awal musim hujan dan mencapai puncaknya pada pertengahan musim tersebut, serta wabah biasanya terjadi pada saat peralihan dari musim hujan ke musim kemarau (Darminto 1992).
Etiologi
5 Perbedaan virulensi antara galur virulen dan avirulen pada VND disebabkan oleh adanya variasi sekuen nukleotida pada daerah pembelahan protein F0 (Alexander 2000). Virus lentogenik mempunyai motif single basic amino acid pada F cleavage site 112G/E-K/R-Q-G/E-R116 dan L (leucine) pada residu 117 dan dapat dibelah oleh enzim protease seperti tripsin yang ditemukan pada saluran pencernaan dan pernafasan (Kim et al. 2008; Choi et al. 2010), sedangkan galur mesogenik dan velogenik mempunyai motif multiple basic amino acid (arginine atau lysine) pada F cleavage site 112R/K-R-Q/K/R-K/R-R116 dan F (phenylalanine) pada residu 117 (Meulemans et al. 2002) dan dapat dibelah secara intraseluler oleh enzim protease seperti furin yang terdapat di berbagai jaringan inang, sehingga mampu mengakibatkan infeksi sistemik yang fatal (OIE 2012). Perbedaan komposisi protein ini mempengaruhi kecepatan replikasi virus dan menentukan tingkat virulensi. Efisiensi pembelahan protein F0 dan virulensi VND tergantung kehadiran satu atau kedua arginin pada posisi 112 dan 115 serta phenylalanine pada posisi 117 (Hines dan Miller 2012). Protein F berperan pada saat virus menginfeksi sel inang, karena selama proses replikasi, protein fusion (precursor F glycoprotein, F0) akan terbelah menjadi menjadi F1 dan F2 yang memperantarai fusi virus dengan membran sel inang. Polipeptida aktif F1 memperantarai fusi antara membran lipid virus dengan membran sel inang (Rout 2007).
Hemaglutinin-Neuraminidase (HN) adalah immunoprotective glycoprotein (immunogenic determinant) yang berperan sebagai antigen permukaan envelope partikel VND (Samal 1997). Selain itu juga protein ini berperan pada beberapa fungsi esensial dari partikel VND dalam mekanisme infeksi, antara lain :
1. Attachment phase : merupakan sisi perlekatan dari partikel virus dengan reseptor cialic acid pada sel induk semang.
2. Entry phase : fasilitator pada saat terjadi aktifitas fusi dari protein F terhadap membran sel induk semang.
3. Release phase : menghilangkan cialic acid pada saat terjadinya pelepasan progeni partikel virus dari sel induk semang yang terinfeksi. Menurut Huang et al. (2004) HN selain berperan menentukan sel tropisma dari jaringan yang akan diinfeksi, juga berkontribusi menentukan keganasan VND.
6
Gambar 2 Struktur genom virus Newcastle Disease (Yusoff dan Tan 2001)
Siklus Replikasi Virus
Infeksi virus diawali dengan perlekatan virion pada cialic acid yang merupakan protein permukaan sel dan berperan sebagai reseptor pada sel target. Ikatan ini akan menggertak pembelahan protein F0 menjadi F1 dan F2 yang menyebabkan bergabungnya amplop virus dengan membran plasma sel inang melalui mekanisme pH-independent (Lamb dan Parks 2007) dan membentuk pori pada permukaan sel sehingga nucleocapsid virus dapat masuk ke dalam sel. Setelah nucleocapsid virus (ribonukleoprotein complex/RNP) yang mengandung RNA masuk ke dalam sel, nucleocapsid akan terpisah dari protein M dan dilepaskan ke dalam sitoplasma. Transkripsi genom RNA terjadi melalui complex viral polymerase (P-L), aktivitas katalitik dari polymerase. Complex viral polymerase mentranskripsikan genom RNA virus untuk menghasilkan mRNAs yang dibutuhkan untuk sintesis protein virus. Ikatan kompleks virus dengan nucleocapsid diperantarai oleh protein P, sedangkan protein L berfungsi pada proses katalitik (Dortmans et al. 2011).
7
Gambar 3 Skematis Siklus Hidup virus Newcastle Disease (Yusoff dan Tan 2001)
Penentuan Virulensi Virus Newcastle Disease
Alexander dan Senne (2008b) mengelompokkan galur VND menjadi 5 patotipe berdasarkan gejala klinis yang terlihat pada ayam yang terinfeksi, yakni :
1. Viscerotropic Velogenic, yaitu bentuk patogenik berat yang sering ditandai lesi hemoragi pada usus.
2. Neurotropic Velogenic, yaitu ditandai adanya tingkat kematian yang tinggi disertai gejala pernafasan dan syaraf.
3. Mesogenic, yaitu bentuk yang ditandai dengan gangguan pernafasan, terkadang disertai gejala syaraf, tetapi tingkat kematian rendah.
4. Lentogenic , yaitu bentuk yang ditandai gejala infeksi pernafasan yang ringan.
8
galur velogenik akan mencapai angka 3.0, sedangkan galur lentogenik dan mesogenik akan memiliki nilai 0 (OIE 2008).
Epidemiologi Newcastle Disease
Inang dan Penyebaran Geografis Virus Newcastle Disease
Virus ND dapat menyerang lebih dari 250 spesies unggas yang termasuk dalam 27 dari 50 ordo yang tersebar di seluruh dunia (Alexander et al. 2004; CFSPH 2005). Pada umumnya VND menyerang unggas seperti itik, angsa, merpati, betet, dan beberapa jenis burung lainnya (Alexander 1991), namun menurut OIE (2008) umumnya ayam lebih rentan terinfeksi penyakit ND dibandingkan dengan unggas lain.
Avian Paramyxovirus (APMV)-1 endemik di Asia, Timur Tengah, Afrika, Amerika Selatan dan Tengah, dan sebagian daerah Meksiko. Galur virulen endemik di Amerika dan Kanada, tetapi pada peternakan unggas komersial bebas dari galur velogenik. Isolat lentogenik ditemukan pada unggas diseluruh dunia termasuk Amerika, sedangkan galur mesogenik jarang ditemukan.
Penularan
Virus ND dapat ditularkan melalui pernafasan atau pencernaan (fekal/oral). Virus dapat dilepaskan melalui feses maupun ekskresi saluran pernafasan dari unggas yang terinfeksi. Unggas akan mengeluarkan virus setelah 1–2 minggu terinfeksi. Unggas galiinaceous dapat mengeksresikan VND hanya selama 1−2 minggu, tetapi unggas psittacine dapat mengeksresikan virus lebih dari setahun (CFSPH 2005). Penularan melalui aerosol jarak jauh masih belum jelas, dari hasil studi virus masih dapat ditemukan pada jarak 64 m, tetapi tidak ditemukan pada jarak 165 m dari peternakan yang terinfeksi. Penularan VND dapat terjadi secara langsung antar unggas dalam satu kelompok ternak terinfeksi. Sumber virus biasanya berasal dari pakan, air minum, lendir, feses, maupun udara serta peralatan dan pekerja kandang yang terkontaminasi VND. Anak ayam yang baru menetas juga dapat tertular dari cangkang telur atau telur retak dan pecah yang terkontaminasi feses yang mengandung VND (OIE 2008).
Ketahanan virus di lingkungan dipengaruhi oleh kelembaban, suhu, agen suspensi dan paparan cahaya. VND dilaporkan dapat bertahan pada lantai kandang selama 10–14 hari, dan pada suhu 20 oC di tanah selama 22 hari.
9
Gejala Klinis
Masa inkubasi penyakit ND pada unggas bervariasi pada kisaran 2–15 hari tergantung virulensi virus dan kerentanan dari induk semang. Pada ayam yang diinfeksi dengan isolat virus velogenik, masa inkubasi umumnya 2–6 hari. Pada beberapa studi dilaporkan bahwa periode inkubasi pada beberapa spesies unggas bisa mencapai 25 hari. Ayam yang tertular VND akan mulai mengeluarkan virus melalui alat pernapasan antara 1 sampai dengan 2 hari setelah infeksi. Infeksi oleh VND di alam yang tidak menyebabkan kematian akan menimbulkan kekebalan selama 6–12 bulan, demikian juga halnya kekebalan yang diperoleh dari vaksinasi.
Gejala klinis yang muncul bervariasi tergantung beberapa faktor seperti galur virus, spesies inang, umur inang, infeksi dengan organisme lain, stres lingkungan dan status kekebalan, sebagai contoh hewan muda cenderung menunjukkan gejala yang lebih parah dan akut dibandingkan hewan yang lebih tua. Pada ayam, infeksi galur lentogenik bersifat subklinis yang ditandai dengan gangguan respirasi ringan seperti gejala batuk, sesak, bersin dan keluar leleran dari hidung. Galur mesogenik dapat menyebabkan penyakit pernafasan akut, ditandai dengan gangguan respirasi dan gejala gangguan syaraf, penurunan nafsu makan, jengger dan pial sianosis, pembengkakan di daerah kepala, bersin, batuk, ngorok dan diare putih kehijauan, tetapi biasanya tingkat kematian rendah. Pada infeksi galur lentogenik dan mesogenik gejala dapat terlihat lebih berat jika disertai infeksi patogen lain. Galur velogenik menyebabkan gejala yang lebih parah dan bersifat fatal, seringkali diikuti dengan kematian yang tinggi. Gejala klinis yang muncul lebih bervariasi, kebanyakan ayam terlihat lesu dan tidak nafsu makan dan bulu terlihat kusam. Awalnya biasanya mata memerah (konjungtivitis) dan berair (edema), diare berair kehijauan atau putih, gangguan pernafasan, pembengkakan jaringan di kepala dan leher, tremor, kejang, kelumpuhan pada sayap dan/atau kaki, serta tortikolis (leher melintir) kadang muncul (Ghiamirad et al. 2010). Produksi telur akan turun dan bentuknya tidak beraturan, warnanya abnormal, cangkang tipis dan kasar dengan albumin lebih encer. Kematian mendadak dengan gejala ringan atau tanpa gejala juga sering terjadi. Unggas terinfeksi yang bertahan selama 2 minggu dapat hidup tetapi mengalami kerusakan syaraf permanen dan/atau penurunan telur yang permanen. Gejala mungkin dapat terlihat lebih ringan pada unggas yang divaksinasi.
10
Gambar 4 Gejala klinis ayam yang terinfeksi Newcastle Disease. Peradangan pada selaput mata (konjungtivitis), edema, pembengkakan jaringan
dikepala dan leher (a), tortikolis (b), kelumpuhan pada sayap dan/atau kaki (c), bentuk telur abnormal (d) (Buckles et al. 2005; USDA 2013)
Perubahan Patologi Anatomi (PA)
Lesi yang signifikan biasanya ditemukan pada unggas yang diinfeksi oleh galur velogenik. Kepala atau daerah periorbital membengkak, dan jaringan interstisial pada leher edematous, terutama didekat toraks. Kongesti atau hemoragi terlihat pada faring bagian bawah dan mukosa orofaring, dan dipteritis membran kadang terjadi pada orofaring dan esophagus. Perubahan PA ditandai dengan adanya ptechie pada proventrikulus, ventrikulus, usus (peyer’s patches), seka tonsil, orofaring, dan paru-paru merupakan perubahan patognomonis pada penyakit ND (Kencana et al. 2012). Timus dan bursa juga mengalami hemoragi, tetapi sulit terlihat pada unggas dewasa. Limpa membengkak, rapuh dan merah kehitaman atau belang-belang. Nekrosis pankreas dan pulmonary edema dapat terlihat pada beberapa unggas. Pada beberapa burung yang mati mendadak akibat infeksi ND biasanya lesi yang terlihat hanya sedikit atau tidak ada. Pada ayam yang diinfeksi dengan galur tidak virulen, lesi yang muncul hanya kongesti dan ada eksudat pada organ pernafasan, kantung hawa yang menebal dan kehitaman.
a
d
c
11
Gambar 5 Perubahan anatomi patognomonis pada infeksi Newcastle Disease. Ptechie pada proventrikulus (a), ventrikulus (b), usus (c), seka tonsil (d), orofaring (e), dan paru-paru (f) (Buckles et al. 2005)
Morbiditas dan Mortalitas
Tingkat morbiditas dan mortalitas sangat bervariasi tergantung virulensi dari galur virus dan kerentanan induk semang. Pada peternakan unggas yang diinfeksi virus galur lentogenik dan mesogenik, tingkat mortalitas dapat mencapai 10%, sedangkan isolat velogenik memiliki tingkat morbiditas dan mortalitas mencapai 100% pada ayam yang tidak divaksinasi. Pada peternakan unggas didaerah endemik yang divaksinasi tingkat mortalitas berkisar 30–90% (OIE 2008). Pada infeksi yang disertai infeksi lain, keparahan penyakit dapat meningkat dan menimbulkan tingkat kematian lebih besar.
a
d
e
f
c
12
Diagnosis
Tujuan dilakukan diagnosis terhadap infeksi ND adalah untuk memperoleh bukti pendukung dalam penyidikan secara epidemiologi. Diagnosis sementara ND dilakukan berdasarkan atas pemeriksaan epidemiologi, gejala klinis, dan perubahan patologi anatomi yang patognomonis, sedangkan metode isolasi virus pada telur ayam berembrio (TAB) masih merupakan ‘gold standard’ untuk identifikasi VND (Hines dan Miller 2012).
Diferensial Diagnosa
Diferensial diagnosa ND velogenik untuk gejala yang muncul seperti septisemia, enteritis, gangguan pernafasan dan/atau gejala syaraf adalah fowl cholera, highly pathogenic avian influenza (HPAI), laryngotracheitis, fowl pox bentuk dipteritic, psittacosis, mycoplasmosis, infectious bronchitis (IB), aspergillosis, dan masalah manajemen seperti kekurangan air dan pakan serta kurang ventilasi, dan diferensial diagnosa infeksi VND pada burung peliharaan adalah penyakit psittacosis, Penyakit patheco’s, salmonellosis, adenovirus, defisiensi nutrisi dan juga infeksi Paramyxovirus lainnya (OIE 2008).
Diagnosis Laboratorium
Peneguhan diagnosis ND dapat dilakukan dengan beberapa metode, diantaranya adalah:
Isolasi Virus
Telur yang sering digunakan untuk isolasi virus adalah telur ayam berembrio specific pathogen free (SPF) umur 9–11 hari, karena dianggap sebagai inang yang paling sensitif untuk isolasi virus dan dapat digunakan pada semua tipe sampel (organ, usapan kloaka/orofaring).
Uji Hemaglutinasi (HA) dan Uji Hambatan Hemaglutinasi (HI)
13
Karakterisasi Sifat Virus Newcastle Disease dengan Uji Waktu Elusi
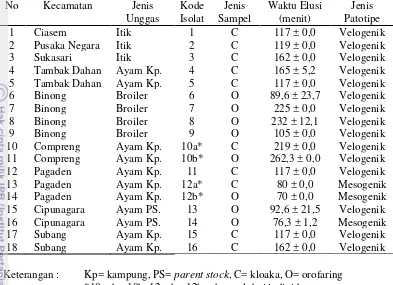
Penentuan patogenisitas galur VND dapat dilakukan dengan uji waktu elusi. Waktu elusi adalah waktu yang dibutuhkan neuraminidase untuk menguraikan ikatan hemaglutinin dengan reseptor sel darah merah pada saat terjadi hemaglutinasi. Perbedaan nilai waktu elusi yang signifikan dapat digunakan untuk membedakan galur VND di lapangan. Menurut Ezeibe dan Ndip (2005) virus patotipe velogenik mempunyai waktu elusi 84–189 menit, sedangkan virus mesogenik 43–78 menit, dan virus lentogenik (LaSota ) 20–45 menit. Menurut Wibowo et al. (2012) beberapa galur VND dapat menunjukkan elusi cepat dengan waktu kurang dari 24 jam tetapi beberapa galur menunjukkan elusi lambat, yaitu lebih dari 24 jam.
Deteksi Virus Newcastle Disease dengan Teknik Molekuler
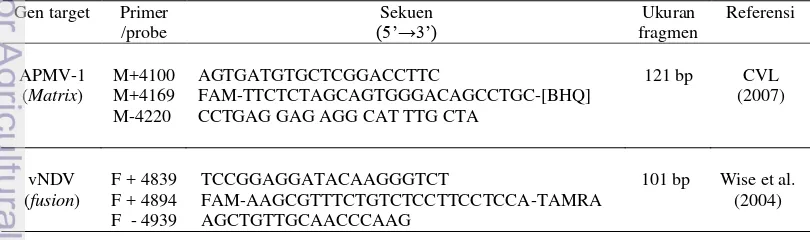
Pada saat ini teknik diagnostik untuk mendeteksi virus ND dari spesimen klinis sudah dikembangkan yaitu menggunakan teknik Reverse Transcription Polymerase Chain Reaction (RT-PCR). Creelan et al. (2002) mengembangkan teknik one-step RT-PCR sebagai metode yang cepat dan spesifik untuk mendeteksi RNA dan menentukan tipe galur APMV-I menggunakan gen fusion (F) dari sampel klinis asal unggas, sedangkan Wise et al. (2004) mengembangkan teknik Real Time Reverse Transcription Polimerase Chain Reaction (rRT-PCR) menggunakan primer dan probe yang didesain untuk mendeteksi sekuens daerah lestari (conserve) dari gen matrix (M) dan gen fusion (F). Kim et al. (2008) mengembangkan teknik rRT-PCR untuk mendeteksi APMV-1 kelas I menggunakan gen large RNA-directed RNA polymerase (L) dengan mengkombinasikan pasangan primer untuk APMV-1 kelas I dan II. Terdapat dua jenis pengujian rRT-PCR untuk deteksi VND yang telah divalidasi oleh United States Department of Agriculture (USDA) yaitu rRT-PCR menggunakan gen matrix (M) dan gen fusion (F). Penggunaan gen M adalah untuk screening test semua galur APMV-1, sedangkan gen F adalah untuk membedakan VND virulensi tinggi (mesogenik/velogenik) dengan VND virulensi rendah (lentogenik dan virus vaksin) (Kim et al. 2006). Menurut Gohm et al. (2000) sampel jaringan dan feses dapat digunakan untuk deteksi VND dengan PCR. Referensi pasangan primer dan probe yang digunakan untuk rRT-PCR dapat dilihat pada tabel 1.
Tabel 1 Pasangan primer dan probe untuk mendeteksi virus Newcastle Disease
14
Sampel untuk Pengujian
Isolasi VND diambil menggunakan usapan orofaring dan kloaka pada unggas hidup. Jika sampel usapan tidak memungkinkan untuk diambil, maka feses segar juga dapat digunakan sebagai sampel. Pengambilan sampel usapan orofaring dan kloaka sebaiknya dilakukan pada saat stadium awal penyakit dimana unggas sudah menunjukkan gejala sakit, karena masa inkubasi ND adalah 2–15 hari dan pada masa ini virus akan diekskresikan melalui orofaring dan kloaka. Selain itu sampel organ juga bisa diambil seperti limpa, orofaring, paru-paru, usus (terutama caecal tonsil), hati, ginjal, jantung dan otak (OIE 2012). Usapan oronasal bisa diambil pada unggas yang baru mati. Jaringan dapat dikoleksi secara terpisah atau dipool, biasanya sampel usus dipisahkan tersendiri, kemudian sampel-sampel tersebut disimpan pada suhu dingin (-80 oC), dan sampel usapan disimpan menggunakan media. Jaringan dan feses diambil digunakan untuk RT-PCR dan uji molekuler lainnya, sedangkan sampel serum digunakan untuk uji serologi.
Pencegahan dan Pengendalian Newcastle Disease
15 VND yang telah diinaktifkan dengan cara ditambahkan formaldehyde atau beta-propiolactone (OIE, 2012). Galur virus yang digunakan untuk vaksin inaktif adalah velogenik. Vaksin inaktif biasanya diberikan setelah vaksin aktif dan pemberiannya dilakukan dengan cara injeksi intramuskular. Keuntungan pemberian vaksinasi inaktif adalah titer antibodi yang dihasilkan tinggi dan lebih lama (6–12 bulan) serta dapat diturunkan pada keturunannya. Kekurangan penggunaan vaksin inaktif adalah harganya relatif mahal dan aplikasinya harus dilakukan secara individual. Program vaksinasi ND yang secara umum diterapkan yaitu (1) pada ayam broiler, pemberian vaksin dilakukan melalui aerosol atau tetes mata pada anak ayam umur sehari dengan menggunakan vaksin Hitchner B1 dan dilanjutkan dengan booster melalui air minum atau aerosol, (2) pada ayam indukan (parent stock), pemberian vaksin dilakukan menggunakan vaksin aktif (Hitchner B1) secara aerosol atau tetes mata pada hari ke-10. Vaksinasi berikutnya dilakukan pada umur 24 hari dan 8 minggu dengan vaksin Hitchner B1 atau LaSota melalui air minum, diikuti dengan pemberian vaksin inaktif (killed) pada umur 18–20 minggu. Vaksin inaktif ini dapat diberikan lagi pada umur 45 minggu, tergantung kepada titer antibodi flok ayam, resiko terjangkitnya penyakit dan faktor-faktor lain yang berhubungan dengan pemeliharaan (OIE 2012; Alexander dan Senne 2008a)
Selain vaksinasi, tindakan lain adalah sanitasi, biosekuriti dan manajemen yang baik dapat mencegah infeksi VND pada peternakan unggas. Unggas yang dipelihara tidak diperbolehkan untuk kontak dengan unggas lain yang status kesehatannya belum jelas. Selain itu pekerja kandang dilarang kontak dengan unggas diluar peternakan.
Eradikasi wabah ND dilakukan dengan karantina, pengendalian lalu lintas, depopulasi semua unggas yang terinfeksi dan terpapar virus, pencucian dan desinfeksi. Jenis desinfektan yang dapat digunakan adalah chlorhexidine, sodium hypochlorite (6%), phenolic dan oxidizing agent (CFSPH 2005). Program eradikasi juga harus disertai juga dengan kontrol serangga dengan insektisida.
Situasi Perunggasan dan Kejadian Newcastle Disease di Kabupaten Subang
Subang adalah sebuah kabupaten di Provinsi Jawa Barat yang secara geografis terletak di antara 10731°–10754° Bujur Timur dan 611°–649° Lintang Selatan. Wilayah Kabupaten Subang berbatasan dengan Laut Jawa di utara, Kabupaten Indramayu di timur, Kabupaten Sumedang di tenggara, Kabupaten Bandung di selatan, serta Kabupaten Purwakarta dan Kabupaten Karawang di barat. Luas wilayah Kabupaten Subang adalah 2.051.76 km2. Secara administratif, Kabupaten Subang terbagi atas 253 desa dan kelurahan yang tergabung dalam 22 kecamatan. Berdasarkan Peraturan Daerah Kabupaten Subang Nomor 3 Tahun 2007 tentang Pembentukan Wilayah Kerja Camat, jumlah kecamatan bertambah menjadi 30 kecamatan (PemKab 2010)
16
yang cukup besar. Populasi unggas yang ada di Kabupaten Subang pada tahun 2013 dapat dilihat pada tabel 2.
Peternakan unggas secara umum dibagi menjadi 4 kelompok, yaitu peternakan sektor 1, 2, 3 dan 4. Sektor 1 adalah peternakan yang memiliki sistem industri yang terintegrasi, biosekuriti yang tinggi dan produk dipasarkan untuk tujuan komersil. Sektor 2 adalah peternakan yang memiliki sistem komersial, biosekuriti sedang sampai tinggi dan produk dipasarkan untuk tujuan komersil. Sektor 3 adalah peternakan yang memiliki sistem komersial, biosekuriti yang rendah dan produk yang dipasarkan berupa ayam hidup yang dijual ke pasar ayam, dan sektor 4 adalah peternakan yang memiliki sistem pemeliharaan tradisional, biosekuriti sangat rendah dan biasanya hanya untuk konsumsi lokal (Naipospos 2010).
Sentra peternakan baik sektor 1, 2 dan 3 yang ada di Subang dikelilingi oleh pemukiman penduduk yang memelihara ayam kampung (sektor 4). Hal ini tidak menutup kemungkinan terjadinya penularan penyakit antar sektor. Menurut Eko (2010) beberapa jenis penyakit yang sering menyerang ternak unggas di Subang antara lain yaitu tetelo (ND), flu burung (AI), dan chronic respiratory disease (CRD). Ketiga jenis penyakit ini sama-sama menyerang saluran pernafasan dan berpengaruh terhadap penurunan produksi unggas, sehingga dapat menyebabkan kerugian yang besar bagi peternak.
Tabel 2 Populasi ternak unggas di Kabupaten Subang tahun 2013
No. Jenis Unggas Jumlah (ekor)
1. Ayam Buras 1.044.883
2. Ayam Ras pedaging 42.406.620
3. Ayam Ras Petelur 58.300
4. Itik 539.936
Total 44.049.739
Sumber : DISNAK (2013)
Vaksinasi Newcastle Disease pada Unggas di Kabupaten Subang
17 Tabel 3 Jadwal vaksinasi Newcastle Disease pada unggas di Kabupaten Subang
No Jadwal vaksinasi Jenis Unggas
(umur) Parent
Stock Layer Broiler Kampung Itik
1 1 hari (ND Live) √ √ √ -
-2 4 hari (ND Live + Killed) √ √ - -
-3 18 hari (ND Live) √ √ √ -
-4 5 mg (ND Live + Killed) √ √ - -
-5 9 mg (ND Live) √ √ - -
-6 13 mg (ND Live) √ √ - -
-7 1-7 mg (ND Live + Killed) √ √ - -
Sumber : DISNAK (2010)
18
METODE
Waktu dan Tempat Penelitian
Penelitian dilaksanakan dari bulan April 2013 sampai dengan April 2014. Sampel diambil dari itik dan ayam dari tempat penampungan unggas, pasar unggas dan peternakan yang ada di 10 kecamatan di Kabupaten Subang yaitu Binong, Ciasem, Cipeundeuy, Cipunagara, Compreng, Pagaden, Pusaka Negara, Subang, Sukasari dan Tambak Dahan. Pengujian dilakukan di Bagian Mikrobiologi Medik Departemen Ilmu Penyakit Hewan dan Kesmavet, Fakultas Kedokteran Hewan, Institut Pertanian Bogor
Alat dan Bahan
Sampel usapan orofaring dan kloaka diambil menggunakan cotton swab steril. Media transport yang digunakan adalah brain heart infusion broth (BHIB) dalam microtube 2 ml, larutan phosphate buffered saline (PBS) pH 7.2, sel darah merah ayam 0.6% dan 1%, VND referensi (4 HAU) galur LaSota (koleksi FKH-IPB) dan antiserum spesifik terhadap ND yaitu galur LaSota dan Komarov digunakan untuk uji HI (koleksi BBPMSOH). Peralatan yang digunakan antara lain biosafety cabinet (BSC) (Nuaire dan Esco), mikropipet, tips, vortex dan alkohol.
Pengambilan Sampel
Usapan Orofaring dan Kloaka
Cotton swab dimasukkan ke dalam orofaring sambil diusap dan diputar-putar, lalu dipatahkan dan dimasukkan ke microtube 2 ml yang berisi media BHIB. Begitu juga dengan sampel usapan kloaka, terlebih dahulu daerah sekitar kloaka yang kotor dibersihkan dengan kapas yang sudah dibasahi alkohol 70%, lalu dengan cotton swab, kloaka diulas sambil diputar-putar kearah dorsal, kemudian dipatahkan dan dimasukkan ke microtube 2 ml yang berisi media. Setelah itu sampel dimasukkan ke dalam ice box dingin. Suhunya dijaga agar tetap dingin (4–8 °C), sampai tiba di laboratorium untuk diuji.
Serum
19 endapan sel darah merah dan dipindahkan ke microtube 2 ml, selanjutnya disimpan pada freezer (-20 °C).
Penggabungan (Pooling) Sampel
Penggabungan sampel usapan orofaring dan kloaka yang terdiri dari 5–7 individu per pool dilakukan berdasarkan jenis usapan, unggas, lokasi dan waktu pengambilan sampel. Sebanyak 100 µl sampel diambil dari tiap sampel individu dan dimasukkan ke dalam microtube 2 ml. Sampel pool selanjutnya digunakan untuk uji rRT-PCR menggunakan primer matrix (M).
Isolasi RNA
Isolasi RNA virus dilakukan sesuai prosedur standar QIAamp® Viral RNA Mini Kit (Qiagen). Sebanyak 0.56 ml buffer AVL dimasukkan ke dalam microtube 1.5 ml, kemudian ditambahkan 0.14 ml sampel dan dihomogenkan dengan vortex selama 15 detik. Lalu diinkubasi pada suhu ruang selama 10 menit dan disentrifugasi selama satu menit untuk menurunkan cairan yang menempel pada dinding tabung. Selanjutnya ditambahkan 0.56 ml ethanol, dihomogenkan dengan vortex selama 15 detik, lalu disentrifugasi selama 1 menit, kemudian larutan dipindahkan ke dalam QIAamp column dan disentrifugasi dengan kecepatan 8000 rpm selama 1 menit. Column dipindahkan ke dalam tabung koleksi yang baru dan ditambahkan 0.5 ml buffer AW1 ke dalam column, disentrifugasi 8000 rpm selama 1 menit dan column diletakkan ke dalam tabung koleksi yang baru. Sebanyak 0.5 ml buffer AW2 ditambahkan ke dalam column serta disentrifugasi kembali dengan kecepatan 8000 rpm selama 3 menit kemudian column diletakkan ke dalam tabung microtube 1.5 ml. Langkah akhir, ditambahkan 0.06 ml buffer AVE ke dalam column dan diinkubasi pada suhu ruang selama 1 menit dan disentrifugasi kembali dengan kecepatan 8000 rpm selama 1 menit. Hasil elusi RNA disimpan dalam microtube 1.5 ml pada suhu -20 C.
Uji Real Time Reverse Transcription Polymerase Chain Reaction (rRT-PCR) Matrix (M)
20
template hasil isolasi. Tabung ditutup dengan seal optik dan kemudian dimasukkan ke mesin rRT-PCR Applied Biosystems 7500 Real-Time PCR System yang sudah diatur programnya sebagai berikut : (i) 1× (45 °C, 10 menit), (ii) 1× (95 °C, 10 menit), (iii) 40× (95 °C, 10 menit; 56 °C, 32 detik; 72 °C, 10 detik). Hasil rRT-PCR dianalisis menggunakan Applied Biosystems 7500 Real time PCR System software version 1.4.0
Isolasi Virus Newcastle Disease dari Telur Ayam Berembrio (TAB)
Specific Pathogen Free (SPF)
Sampel usapan orofaring dan kloaka yang digunakan sebagai inokulum adalah sampel individu unggas dari pool positif rRT-PCR matrix (M). Sebanyak 0.2 ml inokulum mengandung penicillin-streptomycin (200.000 i.u.) diinkubasikan selama 30 menit pada suhu ruang (27 °C) disuntikkan pada ruang alantois (allantoic cavity) TAB SPF. Telur kemudian diinkubasi pada suhu 37 °C selama 4–7 hari dan diobservasi 3 kali sehari untuk melihat viabilitasnya (OIE 2012). Isolat yang diperoleh dari cairan alantois dikonfirmasi kembali dengan rRT-PCR matrix (M).
Uji Hemaglutinasi (HA)
Prosedur uji HA yang dilakukan adalah metode mikro (OIE 2012). Sebanyak 25 µl PBS dimasukkan ke dalam plat mikro berdasar V pada sumuran 2–12 dari kolom A sampai kolom E. Pada sumuran 1, kolom A sampai F, dimasukkan 50 µl suspensi virus. Pengenceran virus kelipatan dua dilakukan dari sumuran 1 ke sumuran 2 (A–E). Pada sumur 2B dilakukan pengenceran 1/3 kali dengan menambahkan 25 µl PBS, dihomogenkan dan dibuang sebanyak 25 µl. Pada sumur 2C dilakukan pengenceran 1/5 kali dengan menghomogenkan dan membuang 75 µl PBS, sumur 2D diencerkan 1/7 dengan menambahkan 127 µl PBS dan sumur 2E diencerkan 1/9 kali dengan menambahkan 175 µl PBS. Selanjutnya dilakukan pengenceran kelipatan dua dari sumuran ke-2 sampai ke sumuran ke-12. Sel darah merah 1% sebanyak 25 µl dimasukkan ke setiap sumuran. Kemudian digoyang menggunakan plat mikro shaker, didiamkan pada suhu ruang (25–27 °C) selama 40 menit. Setelah itu diamati, hasil positif ditandai adanya aglutinasi sel darah merah seperti butiran pasir, dan negatif jika terlihat adanya aliran sel darah merah (running bottom/tear drop). Titer VND adalah pengenceran tertinggi yang masih dapat mengaglutinasi sel darah merah secara sempurna. Uji HA dilakukan pengulangan sebanyak 3×.
Uji Hambatan Hemaglutinasi (HI)
21 µl serum standar dimasukkan pada kolom sumuran pertama. Pengenceran kelipatan dua dilakukan dari sumuran pertama sampai sumuran ke-12. Lalu ditambahkan cairan alantois yang mengandung virus 4 HAU ke setiap sumuran. Secara pelan digoyang dan plat diinkubasi pada suhu 4 oC selama 60 menit. Suspensi sel darah merah 1% ditambahkan sebanyak 25 µl ke semua sumuran dan dihomogenkan menggunakan mikroplate shaker dan diinkubasi pada suhu ruang (25–27 °C) selama 40 menit. Setelah itu diamati, hasil positif ditandai adanya hambatan aglutinasi (running bottom/tear drop) sel darah merah, dan negatif jika terbentuk butiran seperti pasir. Titer HI ditentukan pada pengenceran serum tertinggi yang masih terjadi pengendapan (hambatan aglutinasi). Uji HI dilakukan pengulangan sebanyak 3×.
Uji Real TimeReverse Transcription Polymerase Chain Reaction (rRT-PCR) Fusion (F)
Protokol rRT-PCR yang digunakan mengikuti prosedur NVSL (2005). Pembuatan master mix dilakukan secara berurutan yaitu : RNAse-free dH2O 0.37 µl, buffer 2× 12.50 µl, primer forward (20 µM) 0.67 µl, primer reverse (20 µM) 0.33 µl, probe (5 µM) 0.45 µl, detection enhancer 1.67 µl dan yang terakhir ditambahkan enzim mix 25× sebanyak 1 µl. Primer fusion (F) yang digunakan adalah fusion forward (F+4829), fusion reverse (F-4939) dan probe (F+4894). Setelah itu sebanyak 17 µl master mix (MM) dimasukan ke dalam tabung optik, kemudian ditambahkan 8 µl RNA template hasil isolasi. Tabung ditutup dengan seal optik dan kemudian dimasukkan ke mesin rRT-PCR Applied Biosystems 7500 Real-Time PCR System yang sudah diatur programnya sebagai berikut : (i) 1× (45 °C, 10 menit), (ii) 1× (95 °C, 10 menit), (iii) 40× (95 °C, 10 menit; 56 °C, 32 detik; 72 °C, 10 detik). Hasil rRT-PCR dianalisis menggunakan Applied Biosystems 7500 Real time PCR System software version 1.4.0
Uji Waktu Elusi
22
Analisis Data
Data dianalisis secara deskriptif dan statistik untuk menentukan standard mean deviation (SD).
Rataan titer antibodi dihitung menggunakan geometric mean titre (GMT) dengan rumus :
Log2 GMT = ( Log2 t1 )( S1 ) + ( Log2 t1 )( S1 ) + … + ( Log2 tn )( Sn ) N
Keterangan : N = Jumlah contoh serum yang diamati
t = Titer antibodi pada pengenceran tertinggi (yang masih dapat menghambat aglutinasi sel darah merah)
S = Jumlah contoh serum yang bertiter t n = Titer antibodi pada sampel ke-n
Koefisien variasi (coefisien variation/ CV) dari respon kekebalan dinyatakan dengan rumus:
CV = S x 100%
Keterangan : CV = koefisien variasi, S = simpangan standar,
23
HASIL DAN PEMBAHASAN
Deteksi Virus Newcastle Disease pada Pool Usapan Kloaka dan Orofaring dengan Real Time Reverse Transcription Polymerase Chain Reaction
(rRT-PCR) Matrix (M)
Sampel berhasil dikoleksi dari 542 ekor unggas yaitu 149 ekor itik dan 393 ekor ayam yang terdiri dari 108 ekor broiler, 148 ekor broiler parent stock (PS), 15 ekor layer dan 122 ekor ayam kampung yang tersebar di 10 kecamatan di wilayah Subang.
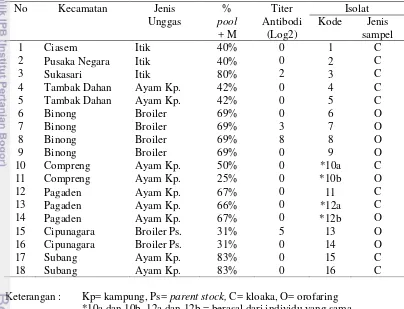
Pengujian terhadap 97 pool usapan kloaka dan 97 pool usapan orofaring mendapatkan 27 pool (29%) usapan kloaka positif yang menyebar di 9 kecamatan, 8 pool (7%) usapan orofaring positif di 3 kecamatan dan 18 pool (18%) usapan kloaka dan orofaring positif di 6 kecamatan, sedangkan pool usapan kloaka dan orofaring dari Kecamatan Cipeundeuy tidak terdeteksi VND (Tabel 4). Virus ND pada itik hanya terdeteksi pada usapan kloaka (8/30 pool), sementara pada ayam, VND ditemukan pada 19 pool usapan kloaka, 8 pool usapan orofaring serta 18 pool usapan kloaka dan orofaring (Tabel 4). Kecenderungan itik mengekskresikan virus melalui kloaka sesuai dengan temuan yang dilaporkan oleh Saepulloh dan Darminto (2005), dimana diperoleh sebanyak 14 (13%) isolat dari usapan kloaka dan tidak diperoleh isolat dari usapan orofaring dari 106 ekor itik di Kalimantan. Tabel 4 Jumlah unggas dan pool sampel asal 10 kecamatan di Kabupaten Subang serta hasil uji rRT-PCR M dan jumlah isolat VND yang diperoleh
∑ ∑ pool ∑
Kecamatan Unggas / Pool matrix + isolat Jenis
Itik Ayam Itik/Ayam diperoleh sampel
C O C&O Itik/Ayam
Ciasem 22/4 2 Kp/1 1/1 0/0 0/0 1/0 C
Pusaka Negara 24/5 - 2/0 0/0 0/0 1/0 C
Sukasari 22/5 - 5/0 0/0 0/0 1/0 C
Tambak Dahan 31/7 5 Kp /12 0/6 0/1 0/1 0/2 Kp 2C
Binong - 15 L /3 0/0 0/0 0/0 0/0 -
- 86 Br /13 0/3 0/3 0/8 0/4 Br 4O
Compreng - 20 Kp /4 0/1 0/0 0/1 0/2 Kp 1C & 1O
Pagaden - 15 Kp /3 0/1 0/0 0/1 0/3 Kp 1C, 1C&1O
Cipunagara 23/4 18 Br/3 0/0 0/0 0/0 0/0 -
- 153 Br. PS /22 0/4 0/4 0/5 0/2 Br.PS 2O
Cipeundeuy 27/5 - 0/0 0/0 0/0 0/0 -
Subang - 27 Kp /6 0/3 0/0 0/2 0/2 Kp 2C
Total 149/30 393 / 67 8/19 0/8 0/18 3/15
Keterangan : Kp=kampung, L=layer, Br=broiler, PS= parent stock, C= kloaka,
24
Jumlah sampel usapan kloaka dan orofaring paling banyak diambil dari ayam ras (broiler) di Kecamatan Cipunagara (171 ekor) karena sampel diambil dari tempat penampungan ayam ras afkir dengan populasi terbesar di Kabupaten Subang yang menampung ayam broiler parent stock dan layer afkir dari breeding farm yang ada di Palembang, Lampung, Sukabumi, Cianjur, Subang dan Jawa Timur, sedangkan untuk kecamatan Binong sampel diambil dari peternakan broiler komersial (kemitraan) karena di daerah ini merupakan lokasi peternakan broiler dengan populasi cukup besar. Untuk sampel dari ayam kampung dan bebek diambil dari tempat penampungan unggas yang disuplai dari daerah Mojosari, Jawa Timur, selain itu juga sampel diambil dari peternakan yang ada di pekarangan rumah (sektor 4) dengan sejarah pernah dilaporkan ada kematian unggas mendadak yang tersebar di Kecamatan Ciasem, Pusaka Negara, Sukasari, Tambak Dahan, Cipunagara dan Cipeundeuy. Beberapa sampel juga diambil dari ayam kampung di pekarangan rumah penduduk di Kecamatan Pagaden, Compreng dan Subang.
Jumlah pool usapan kloaka positif M tertinggi (7) diperoleh dari Kecamatan Tambak Dahan dan jumlah pool usapan orofaring positif M tertinggi (4) diperoleh dari Kecamatan Cipunagara. Selain itu jumlah pool usapan kloaka dan orofaring positif M tertinggi (8) diperoleh dari Kecamatan Binong, sedangkan di Kecamatan Cipeundeuy baik pool usapan kloaka maupun usapan orofaring tidak terdeteksi VND, demikian juga pada pool usapan kloaka dan orofaring ayam layer di Kecamatan Binong dan broiler di Kecamatan Cipunagara tidak terdeteksi VND (Tabel 4).
Isolasi Virus Newcastle Disease pada Telur Ayam Berembrio (TAB)
Spesific Pathogen Free (SPF)
Virulensi VND dapat ditentukan berdasarkan waktu kematian embrio ayam yang diinfeksi VND. Menurut Cattoli et al. (2011), VND yang menyebabkan kematian pada embrio dalam waktu > 90 jam setelah diinokulasi masuk dalam galur lentogenik, dan kematian embrio antara 60–90 jam termasuk dalam galur mesogenik, sedangkan jika VND menyebabkan kematian pada embrio dalam waktu > 60 jam maka masuk galur velogenik.
25 dikeluarkan melalui kloaka. Selama masa inkubasi, virus bereplikasi ditempat masuknya virus, untuk VND galur ganas (mesogenik dan velogenik) akan masuk ke pembuluh darah dan mengikuti sirkulasi darah hingga menuju ke organ-organ visceral dan bereplikasi serta diekskresikan melalui feses (Alexander dan Senne 2008b). Replikasi VND galur ganas pada organ-organ visceral menyebabkan kerusakan dan perdarahan pada organ seperti lesi pada otak, hemoragi dan nekrosis saluran intestinal, respirasi dan seka tonsil. Selain itu hemoragi juga dapat ditemukan pada tembolok, jantung, kulit dan kelopak mata. Menurut Pertulla (2009) persentase mortalitas akibat infeksi VND galur velogenik dapat mencapai 90% dan biasanya unggas yang terinfeksi akan mati 1–2 hari setelah infeksi. Isolasi VND dari sampel usapan kloaka dan orofaring unggas dari lapangan di Bangladesh pernah dilakukan sebelumnya oleh Haque et al. (2010), hasilnya dari 20 usapan kloaka diperoleh 18 isolat dan dari 20 usapan orofaring diperoleh 17 isolat VND.
26
Virus ND berhasil diisolasi dari ayam dan itik yang terlihat sehat dan yang menunjukkan gejala sakit. Menurut Emilia (2013) ditemukannya virus dari sampel asal unggas yang tidak menunjukkan gejala klinis kemungkinan akibat infeksi pada unggas yang kebal secara parsial, sehingga gejala klinis tidak muncul, tetapi ekskresi virus tetap terjadi. Selanjutnya menurut Saepulloh dan Darminto (2005) terdeteksinya VND pada feses (kloaka) pada unggas sakit merupakan indikasi bahwa telah terjadi infeksi sistemik.
Hanya 18 isolat yang berhasil diisolasi dari 204 (9%) usapan kloaka dan orofaring yang positif M dan diinokulasikan ke TAB, hal ini disebabkan banyak VND tidak tumbuh pada telur karena virus sudah inaktif akibat penanganan dan transportasi sampel yang kurang baik. Kejadian serupa juga terjadi pada penelitian Emilia (2013), dimana dari 20 sampel individu positif gen matrix (M) yang ditumbuhkan ke telur, hanya berhasil diisolasi 11 isolat. Hal ini menunjukkan uji rRT-PCR dapat mendeteksi virus inaktif. Menurut Indriani et al. (2014) salah satu kelebihan rRT-PCR adalah mampu mendeteksi material genetik virus baik mati maupun hidup. Nilai threshold cycle (Ct value) dari 18 isolat yang diuji dengan rRT-PCR matrix (M) dan fusion (F) dapat dilihat pada lampiran 1.
Deteksi Antibodi terhadap Virus Newcastle Disease dengan Uji Hambatan Hemaglutinasi (HI)
Uji HI sering digunakan di laboratorium yang memeriksa titer antibodi spesifik terhadap VND karena sifatnya yang lebih spesifik dan tidak memerlukan peralatan khusus sehingga lebih ekonomis (Syukron et al. 2013). Serum yang diuji dipilih berdasarkan perwakilan dari kelompok unggas yang terdeteksi positif dan negatif VND dengan rRT-PCR M dari masing-masing kecamatan. Sebaran antibodi digolongkan menjadi 3, yaitu: kelompok 0 artinya antibodi tidak terdeteksi, kelompok <3 artinya antibodi rendah dan tidak protektif dan kelompok
≥3 artinya antibodi protektif (Boven et al. 2008; Rezaeianzadeh et al. 2011).
27 unggas air (itik) dan ayam kampung yang tidak divaksinasi serta pada ayam buras yang divaksinasi. Antibodi terhadap VND terdeteksi pada 9 dari 18 serum itik dari
Kecamatan Pusaka Negara yang diuji dengan penyebaran 8 serum dengan titer ≥3
Log2 dan 1 serum dengan titer <3 Log2, pada 1 dari 17 serum itik dan 1 dari 32 serum ayam kampung yang diuji dari Kecamatan Tambak Dahan dengan titer masing-masing ≥3 Log2, pada 10 dari 62 serum ayam broiler dari Kecamatan Binong yang diuji dengan penyebaran 5 serum dengan titer ≥3 Log2 dan 5 serum dengan titer <3 Log2, pada 1 dari 13 serum ayam kampung dari Kecamatan
Pagaden yang diuji dengan titer ≥3 Log2, pada 26 dari 135 serum indukan ayam
broiler (parents stock) dari Kecamatan Cipunagara yang diuji dengan penyebaran 21 dengan titer ≥3 Log2 dan 5 dengan titer <3 Log2. Sampel usapan kloaka dan orofaring serta serum yang diambil dari total 27 ekor itik dari Kecamatan Cipeundeuy tidak ditemukan VND dan kandungan antibodi spesifik terhadap ND. Hal ini menunjukkan sampel itik dari Kecamatan Cipeundeuy belum pernah terpapar VND. Namun untuk memastikan Kecamatan Cipeundeuy bebas dari ND, maka perlu dilakukan deteksi dan isolasi VND serta deteksi antibodi spesifik terhadap VND pada itik dan unggas lainnya seperti ayam kampung dan ayam ras dari lokasi lain yang berada di Kecamatan Cipeundeuy.
Persentase jumlah serum ayam ras yang positif terdeteksi antibodi spesifik terhadap VND (17%) lebih banyak dibandingkan dengan unggas air (10%) dan ayam kampung (2%). Pada ayam ras yang divaksinasi, dari 212 serum yang diuji hanya 36 serum mengandung antibodi terhadap VND, dimana 10 (28%) diantaranya menunjukkan titer rendah.
Pada unggas air, hanya 3 isolat yang berhasil diperoleh dari 8% pool kloaka positif M dan tidak diperoleh isolat dari 1% pool orofaring positif M. Pada ayam kampung diperoleh 7 isolat dari 17% pool kloaka positif M dan 2 isolat diperoleh dari 16% pool orofaring positif M. Pada ayam ras tidak diperoleh isolat dari 20% pool kloaka positif M dan 6 isolat diperoleh dari 19% pool orofaring positif M (Tabel 3). Isolat VND yang berhasil ditumbuhkan dari pool kloaka dan orofaring positif rRT-PCR M tidak banyak. Hal ini semakin menunjukkan bahwa pool kloaka dan orofaring yang mengandung virus hidup yang sampai di laboratorium hanya sedikit, sehingga ketika diinokulasi ke TAB virus yang mati tidak tumbuh. Untuk itu penanganan sampel usapan kloaka dan orofaring serta serum dari mulai proses saat pengambilan, transportasi, sampai penyimpanan dan pengujian di laboratorium harus benar-benar diperhatikan dan dilakukan dengan baik.
Nilai coefisien variation (CV) dapat menggambarkan sebaran titer antibodi pada kelompok hewan. Rataan dan sebaran titer antibodi pada ayam ras menggunakan perhitungan GMT dan CV dapat dilihat pada tabel 6.
28
tidak mengikuti anjuran dari dinas setempat. Berdasarkan informasi dari peternak, flok ayam broiler dari Kecamatan Binong dan Cipunagara tersebut sudah di vaksinasi ND oleh perusahaan yang menjual DOC pada saat ayam berumur 1 hari dengan metode spray, kemudian vaksinasi ND diulang (booster) pada saat ayam berumur 18 hari. Saat pengambilan sampel ayam broiler dari 2 flok tersebut berumur 2 minggu (14 hari), sehingga ayam baru divaksin 1 kali yaitu hanya pada umur 1 hari. Antibodi pada 2 flok ayam tersebut tidak terbentuk dapat terjadi karena vaksinasi dengan metode spray yang digunakan kurang efektif. Begitu juga dengan flok ayam layer umur 40 minggu dari Kecamatan Binong, antibodi tidak terbentuk akibat vaksinasi yang dilakukan tidak sesuai dengan program yang dianjurkan oleh pemerintah, karena tujuan pemilik memelihara ayam layer dengan populasi 120 ekor tersebut hanya untuk diambil telurnya dan digunakan untuk konsumsi sehari-hari, sehingga vaksinasi yang dilakukan hanya menggunakan vaksin aktif (Lasota) dan diulang sebulan sekali melalui air minum, sedangkan vaksin inaktif tidak pernah diberikan. Nilai CV titer antibodi dari flok ayam broiler di Kecamatan Binong (45.3%), flok ayam broiler PS di Kecamatan Cipunagara (185% dan 49.9%) terlihat diatas ≥ 35%, hal ini menunjukkan sebaran titer antibodinya tidak merata. Hasil rataan titer dan sebaran titer antibodi ayam ras yang divaksinasi di Kecamatan Binong dan Cipunagara yang rendah dan tidak menyebar dengan baik menunjukkan bahwa vaksinasi ND pada ayam ras di kedua kecamatan tersebut tidak optimal.
29 serumnya adala2 flok ayam yang berasal dari tempat penampungan unggas yang ada di Kecamatan Cipunagara. Ayam tersebut disuplai oleh breeding farm dari Sukabumi dan Jawa Timur. Menurut petugas dinas di lapangan, biasanya ayam broiler indukan yang dikeluarkan oleh breeding farm adalah ayam yang memiliki masalah seperti diantaranya karena ayam sakit, produksi telur menurun, respon antibodi bermasalah (rendah atau tidak terbentuk akibat imunosupresi) dan tidak berkembangnya organ reproduksi sehingga ayam tidak dapat menghasilkan telur atau dikeluarkan karena ayam sudah memasuki umur afkir. Ayam broiler indukan yang diambil sampel usapan dan serumnya ada 2 flok yaitu flok ayam umur 12 minggu dan umur >60 minggu (afkir). Pada saat pengambilan sampel kondisi ayam broiler indukan umur 12 minggu terlihat sehat dan beberapa ekor menunjukkan gejala sakit serta organ kelamin sekundernya (pial dan jengger) tidak berkembang. Ayam broiler indukan ini masih berumur 12 minggu tetapi sudah dikeluarkan dari breeding farm, hal ini menunjukkan ada masalah pada flok ayam ini. Berdasarkan rataan dan sebaran titer antibodinya yang tidak merata serta fisiknya yang tidak berkembang, kemungkinan besar ayam-ayam tersebut diseleksi untuk diafkir akibat kegagalan dewasa kelamin dan rendahnya titer dan sebaran antibodi yang terbentuk akibat adanya imunosupresif. Pada flok ayam indukan broiler umur >60 minggu kondisinya sebagian besar terlihat sakit. Melihat titer antibodinya yang sebagian besar rendah dan tidak terbentuk, kemungkinan ayam-ayam tersebut diafkir karena memang produksi telurnya sudah turun akibat umurnya yang tidak produktif lagi sehingga vaksinasi ND (booster) tidak diulang kembali dan menyebabkan rataan dan sebaran titer antibodinya tidak merata dengan baik. Serum ayam layer dari Kecamatan Binong dan broiler dari Kecamatan Cipunagara menunjukkan tidak terdeteksi antibodi terhadap ND (Tabel 6). Selain serum ayam layer dan broiler dari 2 kecamatan tersebut tidak terdeteksi VND, pool usapan kloaka dan orofaringnya juga tidak terdeteksi VND (Tabel 4). Hal ini menunjukkan ayam layer dan broiler dari dua kecamatan tersebut bebas dari VND, untuk itu perlu dilakukan pencegahan agar tidak tertular infeksi ND dari peternakan lain yang ada di sekitar dua kecamatan tersebut. Namun jumlah sampel serum ayam layer dari kecamatan Binong dan broiler dari Kecamatan Cipunagara yang berhasil diambil tidak banyak yaitu hanya 15 dan 18 ekor, sehingga kurang mewakili populasi. Titer antibodi ayam ras yang divaksinasi yang diuji dengan uji HI dapat dilihat pada lampiran 2.
Titer HI menunjukkan status kekebalan dari unggas. Pada unggas lokal yang tidak divaksinasi dan tidak menunjukkan gejala sakit, keberadaan antibodi mengindikasikan unggas tersebut pernah terpapar VND (Alexander et al. 2004). Pada unggas yang divaksinasi dengan level titer antibodi ≥3 Log2 mengindikasikan antibodi yang protektif. Kekebalan kelompok dalam suatu populasi sangat penting agar dapat terlindungi dari infeksi VND. Menurut Boven et al. (2008) kekebalan kelompok akan diperoleh jika 85% atau lebih titer