BIOAKTIVITAS ZAT EKSTRAKTIF KAYU TERAS SURIAN
(
Toona sureni
Merr.) TERHADAP
Artemia salina
Leach
YANOTAMA TIRTA LAKSANA
E24070058
DEPARTEMEN HASIL HUTAN
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
Heartwood Extractive Bioactivity of
Surianwood (Toona sureni Merr.) to the Artemia salina Leach By:
Yanotama Tirta Laksana1) and Rita Kartika Sari 2)
INTRODUCTION. In cases to restore Indonesian forest condition, Indonesian Forestry Department ask for people participation for planting the trees trough some of its program. People should attracted to get involved in the plantation by given the information of multifunction species. Surianwood (Toona sureni Merr.) and Cederwood (Cedrela odorata Linn.) are the examples of multifunction tree species that having potention of biological activities, including as an anticancer.
ANALYSIS AND METHOD. The heartwood extracts for both
Bogor-surianwood and Kuningan-Bogor-surianwood are tested in Brine Shrimp Lethality Test. The mortality percentage are analyzed with the Minitab 14 for windows program to get the lethality concenteration 50% value. The compounds of the most active extract from each species are analyzed in Pyr-GC-MS.
RESULT AND DISCUSSION. The LC50 values showed that every fraction of
extracts are active, except the metanol fraction of Kuningan-Surianwood extract. The most active extract is the n-hexane extract of Kuningan-surianwood with the lowest LC50
Keyword: Surianwood, bioactivity, Artemia salina.
values (37,95 µg/ml). Chemical compound analysis showed that dominant chemical compounds have responsibilities to the biological activity of the extract, including as an anticancer.
RINGKASAN
YANOTAMA TIRTA LAKSANA. Bioaktivitas Zat Ekstraktif Kayu Teras Surian (Toona sureni Merr.) Terhadap Artemia salina Leach.
Dibawah bimbingan: RITA KARTIKA SARI
Perbaikan kondisi kehutanan Indonesia terus diupayakan pemerintah Indonesia melalui Departemen Kehutanan dengan beberapa programnya, gerakan rehabilitasi hutan dan lahan (Gerhan) dan program pembangunan hutan tanaman rakyat (HTR). Spesies pohon multifungsi yang disarankan adalah surian (Toona sureni Merr.). Jenis lain dari genus Toona, T. sinensis memiliki zat ekstraktif yang berpotensi sebagai antikanker. Tidak menutup kemungkinan surian juga memiliki potensi sebagai antikanker. Penyeleksian potensi ekstrak sebagai antikanker dapat dilakukan dengan metode brine shrimp lethality test (BSLT).
Penelitian ini bertujuan menguji bioaktivitas zat ekstraktif kayu teras surian (T. sureni) hasil ekstraksi maserasi bersinambung dan analisis senyawa kimia dalam ekstrak teraktif.
Penelitian ini dibagi menjadi tiga tahap. Tahap pertama adalah persiapan bahan baku serbuk kayu surian dan ceder. Tahap kedua adalah ekstraksi serbuk kayu dengan maserasi bersinambung dengan pelarut n-heksana, etil asetat, dan metanol. Tahap ketiga adalah tahapan pengujian. Pengujian yang dilakukan meliputi perhitungan kadar ekstrak kayu, uji bioaktivitas dengan BSLT, dan analisis komponen kimia dengan gas chromatography mass spectrometry pyrolysis (Pyr-GC-MS).
Hasil pengujian BSLT menunjukan bahwa ekstrak surian asal Kuningan terlarut n-heksana tergolong paling aktif dengan nilai LC50 yang paling rendah
(37,95 µg/mL). Pada ekstrak surian asal Bogor, fraksi etil asetat menjadi fraksi paling aktif dibandingkan fraksi lainnya dengan nilai LC50 43,54 µg/mL.
Berdasarkan nilai LC50, seluruh fraksi ekstrak tergolong aktif kecuali pada ekstrak
metanol kayu teras surian asal Kuningan. Hasil analisis komponen kimia dan kajian pustaka terhadap senyawa kimia tersebut menunjukkan bahwa, senyawa-senyawa dominan pada masing-masing ekstrak memiliki berbagai aktivitas biologis dan berpotensi untuk investigasi lebih lanjut.
BIOAKTIVITAS ZAT EKSTRAKTIF KAYU TERAS SURIAN
(
Toona sureni
Merr.) TERHADAP
Artemia salina
Leach
YANOTAMA TIRTA LAKSANA
E24070058
Skripsi
Sebagai salah satu syarat memperoleh gelar Sarjana Kehutanan
Pada Fakultas Kehutanan Institut Pertanian Bogor
DEPARTEMEN HASIL HUTAN
FAKULTAS KEHUTANAN
INSTITUT PERTANIAN BOGOR
© Hak Cipta milik IPB, tahun 2011 Hak Cipta dilindungi Undang-undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB
PERNYATAAN
Dengan ini saya menyatakan bahwa skripsi Bioaktivitas Zat Ekstraktif Kayu Teras Surian (Toona sureni Merr.) terhadap Artemia salina Leach adalah karya saya sendiri dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir skripsi ini.
Bogor,23 Agustus 2011
Yanotama Tirta Laksana
LEMBAR PENGESAHAN
Judul : Bioaktivitas Zat Ekstraktif Kayu Teras Surian (Toona sureni
Merr.) terhadap Artemia salina Leach. Nama : Yanotama Tirta Laksana
NRP : E24070058
Menyetujui, Dosen Pembimbing
NIP. 19681124 199512 2 001 Ir. Rita Kartika Sari, M.Si
Mengetahui
Ketua Departemen Hasil Hutan Institut Pertanian Bogor
NIP. 19660212 199103 1002 Dr. Ir. Wayan Darmawan, M. Sc
UCAPAN TERIMA KASIH
Puji Syukur penulis panjatkan kepada Tuhan Maha Esa yang telah memberikan berkat, hikmat, dan kasihNya sehingga penulis dapat menyelesaikan penelitian dan penulisan skripsi dengan judul bioaktivitas zat ekstraktif kayu teras surian (Toona sureni Merr.) terhadap Artemia salina Leach yang merupakan salah satu syarat untuk memperoleh gelar sarjana kehutanan pada Fakultas Kehutanan, Institut Pertanian Bogor.
Pada kesempatan ini penulis megucapkan terimakasih kepada:
1. Ayahanda dan Ibunda, adik dan seluruh keluarga atas segala doa, kasih sayang, dorongan dan dukungan materi dan moril yang diberikan.
2. Ir. Rita Kartika Sari, M.Si selaku dosen pembimbing yang telah banyak memberikan pengetahuan, bimbingan, arahan, nasehat, dan motovasi untuk terus maju.
3. Rekan sepenelitian Ihsan Darmawan (THH 43), Citra Yanto Ciki Purba, dan Yunirma Sari yang sudah sama-sama berjuang menyelesaikan tugas akhir.
4. Seluruh staf Bagian Kimia Hasil Hutan atas waktu dan bantuan yang diberikan selama proses penelitian
5. Yang terkasih Sdri. Raditya Nandiasa atas dukungan dan kasih sayang yang diberikan.
6. Keluarga besar UKM PMK IPB atas ilmu, kebersamaan, kekeluargaan, dan persekutuan yang tidak terpisahkan.
7. Rekan seperjuangan di Fakultas Kehutanan, khususnya THH angkatan 44 atas motivasi, dukungan, doa, bantuan, serta kebersamaannya.
Penulis mengharapkan agar karya ilmiah ini bermanfaaat untuk berbagai pihak yang membutuhkan dan dapat menambah kekayaan informasi dunia kehutanan.
RIWAYAT HIDUP
Penulis dilaihrkan di Sintang, provinsi Kalimantan Barat, pada tanggal 12 Desember 1989 sebagai putra sulung dari tiga bersaudara keluarga pasangan Bapak W. Nugroho dan Ibu Anis.
Penulis menyelesaikan sekolah dasar di SD Budi Mulya Desa Putera, Jakarta Selatan pada tahun 2001. Penulis melanjutkan pendidikan ke SMP Negeri 1 Depok hingga tahun 2003, kemudian melanjutkan ke SMA Negeri 2 Depok dan lulus tahun 2007.
Pada tahun yang sama penulis diterima sebagai mahasiswa Institut Pertanian Bogor (IPB) melalui jalur Undangan Seleksi Masuk IPB (USMI) dengan mayor Teknologi Hasil Hutan, Departemen Hasil Hutan, Fakultas Kehutanan. Di Departemen Hasil Hutan inilah, penulis terpilih sebagai tiga besar mahasiswa berprestasi Departemen Hasil Hutan 2010. Pada semester 6, penulis memilih bagian kimia hasil hutan sebagai topik dalam menyelesaikan tugas akhir.
i DAFTAR ISI
Halaman
DAFTAR ISI ... i
DAFTAR TABEL ... iii
DAFTAR GAMBAR ... iv
DAFTAR LAMPIRAN ... v
I PENDAHULUAN ... 6
1.1. Latar Belakang ... 6
1.2. Tujuan ... 7
II TINJAUAN PUSTAKA 2.1. Surian (Toona surenii Merr.) ... 8
2.2. Ekstraksi ... 9
2.3. Senyawa Bioaktif ... 10
2.4. Pengujian Biologis (Biological Assay) ... 14
Brine shrimp lethality test ... 14
III METODOLOGI PENELITIAN ... 16
3.1. Waktu dan Tempat Penelitian ... 16
3.2. Bahan dan Alat Penelitian ... 16
3.3. Urutan Kerja ... 16
3.3.1. Persiapan Bahan Baku ... 16
a. Bahan baku serbuk kayu ... 16
b. Pelarut Organik ... 17
3.3.2. Ekstraksi ... 17
3.3.3. Pengujian ... 18
a. Kadar Ekstrak ... 18
b. Brine Shrimp Lethality Test ... 18
3.4. ANALISIS DATA ... 19
IV. HASIL DAN PEMBAHASAN ... 20
4.1. Kadar zat ekstraktif kayu ... 21
ii Gas Chromatography Mass Spectrometry
Pyrolysis (Pyr-GC-MS) ... 23
4.3.1. Senyawa-senyawa kimia dominan ekstrak etil asetat kayu surian asal Bogor ... 23
4.3.2. Senyawa-senyawa kimia dominan ekstrak n-heksana kayu surian asal Kuningan ... 27
V. KESIMPULAN DAN SARAN ... 32
5.1. Kesimpulan ... 32
5.2. Saran ... 32
DAFTAR PUSTAKA ... 33
iii DAFTAR TABEL
Halaman Tabel 1 Kadar ekstrak surian (T. sureni) dan
surian asal Kuningan (C. odorata) ... 20 Tabel 2 Persentase mortalitas rata-rata terkoreksi
larva udang (A. salina) setelah pemberian ekstrak
kayu teras surian pada setiap tingkat konsenterasi ... 21 Tabel 3 Senyawa dominan ekstrak etil asetat kayu surian asal Bogor
berdasarkan hasil Pyr-GC-MS ... 24 Tabel 4 Senyawa dominan ekstrak n-heksana kayu surian asal Kuningan
iv DAFTAR GAMBAR
Halaman Gambar 1. Batang dan daun surian ... 10 Gambar 2. Kenampakan daun surian ... 11 Gambar 3 Proses ekstraksi maserasi bersinambung ... 23 Gambar 4 Prosedur persiapan larutan untuk brine
v DAFTAR LAMPIRAN
Halaman
Lampiran 1. Hasil identifikasi spesies pohon ... 38
Lampiran 2. Perhitungan Bobot Kayu yang digunakan ... 38
Lampiran 3. Perhitungan Kadar Ekstrak Surian asal Bogor ... 39
Lampiran 4. Perhitungan Kadar Ekstrak Surian asal Kuningan ... 40
Lampiran 5. Mortalitas Larva Kontrol BSLT Ekstrak surian ... 42
Lampiran 6. Mortalitas Larva Kontrol BSLT Ekstrak surian asal Kuningan ... 42
Lampiran 7. Mortalitas Larva udang Ekstrak Surian asal Bogor ... 43
Lampiran 8. Mortalitas Larva udang Ekstrak Surian asal Kuningan ... 44
Lampiran 9. Probit Analysis ekstrak surian asal Bogor n-heksana ... 47
Lampiran 10. Probit Analysis ekstrak surian asal Bogor etil asetat ... 48
Lampiran 11. Probit Analysis ekstrak surian asal Bogor n-heksana ... 49
Lampiran 12. Probit Analysis ekstrak surian asal Kuningan n-heksana 50 Lampiran 13. Probit Analysis ekstrak surian asal Kuningan etil asetat 52 Lampiran 14. Probit Analysis ekstrak surian asal Kuningan n-heksana 53 Lampiran 15. Hasil Pengujian Pyr-GC-MS Ekstrak Etil Asetat Surian asal Bogor ... 55
6 I. PENDAHULUAN
1.1. Latar Belakang
Dalam beberapa tahun terakhir, pemerintah terus menerus berusaha memperbaiki kondisi hutan Indonesia melalui beberapa programnya, salah satunya adalah menggerakkan masyarakat agar berpartisipasi dalam gerakan nasional rehabilitasi hutan dan lahan, penggalakan hutan tanaman rakyat (HTR) dan percepatan pembangunan hutan tanaman industri (HTI). Pemilihan spesies pohon yang multifungsi menjadi hal yang penting dalam memberikan insentif bagi masyarakat untuk mensukseskan program-program ini.
Berdasarkan lampiran SK.272/Menhut-V tahun 2004, salah satu jenis yang dikembangkan dalam gerakan penanaman sejuta pohon adalah Surian (Toona sureni Merr.) yang diproyeksikan sebagai pasokan kayu pertukangan dan pohon turus jalan. Kayu surian umumnya dijadikan bahan kayu konstruksi dan bahan baku mebel, berupa panel dekoratif, kerajinan tangan, kotak cerutu dan produk kayu lainnya, karena kemudahannya dikerjakan (Djam’an 2002). Selain itu, kulit dan akarnya sering dimanfaatkan sebagai ramuan antidiare dan daunnya memiliki sifat antibiotik (Djam’an 2002; Orwa et al. 2009). Hal ini menunjukkan bahwa pohon surian berpotensi mengandung zat ekstraktif yang memiliki bioaktivitas dan dapat dimanfaatkan sebagai bahan obat.
Hasil penelitian Chia et al. (2009) menunjukkan bahwa ekstraktif daun
Toona sinensis memiliki sifat sitotoksik pada sel kanker paru-paru. Di sisi lain, di Indonesia terdapat dua jenis dari genus Toona, T. sureni dan T. sinensis. Rowe dan Conner (1979) menyatakan bahwa komponen kimia hasil metabolit primer (gula, asam amino, lemak sederhana, asam karboksilat, dan lainnya) dapat ditemukan pada seluruh pohon dan tidak signifikan untuk dijadikan bahan kemotaksonomi intra-famili pohon. Hal ini memungkinkan pada jenis T. sureni
7 Di sisi lain, kanker merupakan penyakit yang menempati peringkat kedua di dunia sebagai penyebab kematian (Anderson 2001). Pada umumnya obat-obatan antikanker dibuat dari bahan kimia sintesis yang memiliki efektivitas yang tinggi sebagai antikanker terutama untuk pengobatan kanker stadium lanjut, namun juga memberikan efek samping yang tinggi, seperti kerusakan fungsi hati, kematian sel cepat tumbuh lain yang terdapat dalam tubuh, dan mutasi genetik jaringan lain.
Dosis konsumsi obat kanker yang tinggi pada para penderita kanker menjadikan penderita kanker rentan terhadap efek samping antikanker sintesis (Gralla et al. 2010). Efek samping antikanker sintesis dapat dikurangi dengan penambahan antikanker alami. Untuk itu, penelitian mengenai pemilahan jenis tumbuhan hutan potensial yang mengandung antikanker alami perlu dilakukan mengingat jenis-jenis tumbuhan hutan yang sangat banyak ragamnya.
Meyer et al. (1982) menyatakan brine shrimp lethality test (BSLT) dapat menjadi pengujian aktivitas biologis umum dari zat ekstraktif. Dalam penelitiannya, Meyer et al. (1982) juga menyatakan bahwa hasil pengujian berkorelasi positif dengan sifat antikanker senyawa-senyawa kimia yang terkandung dalam contoh uji. Maka, BSLT dapat menjadi metode untuk pemilahan awal jenis-jenis tumbuhan yang memiliki potensi antikanker alami. 1.2. Tujuan
8 II. TINJAUAN PUSTAKA
2.1. Surian (Toona surenii Merr.)
Pohon surian berukuran sedang sampai besar, dapat mencapai tinggi 40-60 m dengan tinggi bebas cabang hingga 25 m. Diameter dapat mencapai 100 cm, bahkan di pegunungan dapat mencapai hingga 300 cm. Berbanir hingga tinggi 2 m. Kulit batang terlihat pecah-pecah dan seolah tumpang tindih, berwarna coklat keputihan, pucat hingga keabu-abuan, dan mengeluarkan aroma apabila dipotong (Gambar 1). Kayunya ringan, dengan gubal merah muda dan teras coklat. Pohon menggugurkan daun, yang terjadi pada bulan Februari-Maret atau September-Oktober (Djam’an 2002).
Gambar 1 Batang dan daun Toona sureni di Balitbang Kehutanan Gunung Batu, Bogor (Koleksi Pribadi).
Daun surian relatif lebar, tersusun seperti spiral, kadang-kadang
9 putik dan indung telur, bunga umumnya berkelamin tunggal ditinjau dari fungsinya (Djam’an 2002).
(a) (b)
Gambar 2 Kenampakan daun surian asal (a) Bogor dan (b) Kuningan (Koleksi pribadi)
Spesies ini menghasilkan kayu yang baik. Kulit kayunya dimanfaatkan sebagai astringent dan sebagai obat pencahar. Di Indo-Cina, spesies ini digunakan sebagai tonik, sebagai antiperiodic, dan anti rematik. Sementara di Indonesia jenis ini digunakan sebagai tonik untuk mengatasi diare, disentri, dan infeksi usus lainnya. Ekstrak daunnya memiliki aktivitas antibiotik terhadap Staphylococcus, dengan cara melaburkan ramuan ujung daun pada luka bengkak (Hua et al. 2008). 2.2. Ekstraksi
Menurut Agoes (2007), ekstraksi merupakan proses pemisahan suatu komponen yang terdapat di dalam suatu bahan dengan menggunakan pelarut. Sementara, ekstrak adalah sediaan bahan hasil ekstraksi suatu bahan oleh pelarut tertentu. Proses ekstraksi dapat menggunakan air ataupun pelarut kimia. Pelarut kimia yang digunakan dapat berupa pelarut kimia tunggal maupun campuran azeotropik dengan suhu didih tetap.
10 ekstraksi cair-cair, ekstraksi dengan menggunakan pelarut dengan massa jenis lebih tinggi dari air dan pelarut dengan massa jenis lebih ringan dari air (Agoes 2007).
Dalam ekstraksi tanaman obat, beberapa hal yang harus diperhatikan adalah (Agoes 2007):
a) Jumlah sediaan untuk diekstraksi b) Tingkat kehalusan sediaan ekstraksi c) Jenis pelarut yang digunakan d) Suhu ekstraksi
Maserasi merupakan proses ekstraksi menggunakan berbagai macam pelarut pada suhu kamar dalam kurun waktu tertentu (Agoes 2007). Cara ini dapat diterapkan di berbagai skala industri, kecil maupun besar karena relatif sederhana. Ekstraksi dilakukan hanya dengan merendam sediaan dalam pelarut selama kurun waktu yang ditetapkan.
Proses ekstraksi maserasi dapat digunakan dan menjadi satu-satunya cara untuk mengekstrak sediaan tumbuhan yang memiliki kadar lendir yang tinggi. Namun, maserasi tidak terlalu efektif dalam mengekstrak senyawa murni karena prosedurnya yang memungkinkan ampas dapat menahan sebagian besar pelarut. Cara untuk menanggulanginya adalah dengan melakukan pemerasan atau sentrifugasi terhadap ampas setelah ekstraksi (Agoes 2007).
Ekstraksi maserasi dapat dimodifikasi dengan beberapa cara, salah satunya adalah maserasi bersinambung. Metode maserasi ini menyerupai maserasi bertingkat, yaitu dengan melakukan maserasi lebih dari satu tahap (Handa et al.
2008) namun pada penelitian ini dilakukan pada wadah yang tetap. 2.3. Senyawa Bioaktif
11 pemakaian dan waktu yang tepat untuk mengkonsumsi. Beberapa tanaman diketahui dapat menghasilkan senyawa bioaktif, termasuk antikanker, yang pada umumnya berupa senyawa-senyawa flavonoid, glikosida, steroid alkaloid dan terpenoid (Kurz & Constabel 1998).
Alkaloid
Menurut Harborne (1987), jenis alkaloid yang telah diketahui adalah sekitar 5.500 jenis dan merupakan golongan zat tumbuhan sekunder yang terbesar. Umumnya alkaloid mencakup senyawa bersifat basa yang mengandung satu atau lebih atom nitrogen dalam bentuk gabungan, sebagai bagian dari sistem siklik. Alkaloid seringkali bersifat racun bagi manusia dan banyak mempunyai aktivitas fisiologi yang spesifik dan banyak digunakan dalam bidang pengobatan. Alkaloid biasanya tidak warna, seringkali bersifat optis aktif, kebanyakan berbentuk kristal tetapi hanya sedikit yang berupa cairan (misalnya nikotina) pada suhu kamar.
Sampai saat ini, belum ada penggolongan umum senyawa alkaloid. Hal ini disebabkan karena alkaloid mempunyai struktur yang beragam jenisnya, sehingga penggolongan alkaloid untuk membedakan jenis yang satu dengan yang lain berdasarkan strukturnya sukar dilakukan (Suradikusumah 1989).
Dalam pengobatan, alkaloid memberikan efek fisiologis yang pada umumnya di susunan saraf pusat, misalnya sebagai obat anti rasa sakit dan obat tidur, namun dalam jumlah besar sangat beracun bagi manusia (Vickery & Vickery 1981).
Menurut Sumiwi (1992), fungsi alkaloid bagi tumbuhan antara lain sebagai zat beracun untuk melawan serangga atau hewan pemakan tumbuhan, faktor pengatur tumbuh, substansi cadangan untuk memenuhi kebutuhan akan nitrogen dan elemen-elemen lain yang penting bagi tumbuhan dan hasil akhir reaksi detoksifikasi dari suatu zat yang berbahaya bagi tumbuhan.
Flavonoid
12 dikocok dengan petroleum eter. Flavonoid merupakan senyawa fenol, karena itu warnanya berubah bila ditambah basa atau amonia sehingga mudah dideteksi pada kromatogram atau dalam larutan (Harborne 1987).
Flavonoid mengandung sistem aromatik yang terkonjugasi sehingga menunjukkan pita serapan kuat pada daerah spektrum UV dan spektrum tampak. Flavonoid umumnya terdapat dalam tumbuhan, terikat pada gula sebagai glikosida dan aglikon flavonoid yang mungkin saja terdapat dalam satu tumbuhan dalam beberapa bentuk kombinasi glikosida. Maka dalam menganalisis flavonoid biasanya lebih baik memeriksa aglikon yang terdapat dalam ekstrak tumbuhan yang telah dihidrolisis sebelum memperhatikan kerumitan glikosida yang mungkin terdapat dalam ekstrak asal (Harborne 1987).
Flavonoid terdapat dalam tumbuhan sebagai campuran, jarang sekali dijumpai hanya flavonoid tunggal dalam jaringan tumbuhan. Disamping itu, sering terdapat campuran yang terdiri atas flavonoid yang berbeda kelas. Antosianin berwarna yang terdapat dalam daun bunga umumnya disertai oleh flavon atau flavonol tanpa warna. Gugus flavon berperan dalam menyatakan sifat warna pada antosianin (Harborne 1987).
Pada tumbuhan, flavonoid meningkatkan dormansi, meningkatkan pembelahan sel-sel kalus, berperan sebagai enzim penghambat pembentukkan protein, menghasilkan zat warna pada bunga, sebagai atraktan serangga, burung dan satwa lainnya untuk dalam penyerbukan dan penyebaran biji. Dalam dunia pengobatan, beberapa senyawa flavonoid berfungsi sebagai antibodi, misalnya antivirus dan jamur, peradangan pembuluh darah dan dapat digunakan sebagai racun ikan (Vickery & Vickery 1981).
Saponin
13 Pembentukan busa sewaktu mengekstrak tumbuhan atau pemekatan ekstrak tumbuhan merupakan bukti adanya saponin. Pengujian saponin sederhana adalah dengan menggunakan ekstrak alkohol, air dari tumbuhan yang dimasukkan dalam tabung reaksi dan diamati terbentuknya busa yang tahan lama pada permukaan cairan (Harborne 1987).
Pada tumbuhan, saponin mempunyai fungsi yang sama dengan triterpenoid karena mengandung turunan dari senyawa ini, diantaranya dapat meningkatkan daya kecambah benih dan menghambat pertumbuhan akar, menghambat pertumbuhan sel-sel tumor pada tumbuhan dan satwa. Saponin digunakan sebagai bahan pencuci karena memiliki sifat emulsi, dapat digunakan untuk meningkatkan kolesterol serum, sebagai zat antibiotik, anti jamur, anti influenza dan peradangan tenggorokan, sebagai bahan dasar untuk mendapatkan sapogenin yang berguna untuk menghasilkan hormon pertumbuhan pada satwa dan dapat digunakan sebagai racun ikan (Vickery & Vickery 1981).
Triterpenoid dan Steroid
Triterpenoid adalah senyawa dengan kerangka karbon enam satuan isoprena dan secara biosintesis diturunkan dari hidrokarbon C30 asiklik, yaitu skualena. Senyawa ini berstruktur siklik yang rumit, kebanyakan berupa alkohol, aldehida atau asam karboksilat. Terpenoid berupa senyawa tanpa warna, berbentuk kristal, seringkali bertitik leleh tinggi dan bersifat aktif optik, yang umumnya sukar dicirikan karena tak ada kereaktifan kimianya.
Uji deteksi triterpenoid yang banyak digunakan adalah reaksi Lieberman-Burchard (anhidrida asetat-H2SO4
Triterpenoid dan turunannya, termasuk saponin dan steroid, pada tumbuhan berfungsi sebagai racun serangga, bakteri dan jamur. Steroid dapat meningkatkan permeabilitas membran sel dan merangsang proses pembungaan.
14 Dalam pengobatan, senyawa ini berguna sebagai zat antibiotik diantaranya anti jamur, bakteri dan virus. Steroid dapat merangsang aktivitas hormon estrogen dan progesteron pada satwa dan manusia. Steroid juga menjadi sumber energi bagi mikroorganisme pada pengurai (Vickery & Vickery 1981).
2.4. Pengujian Biologis (Biological assay)
Mayoritas peneliti bertujuan hanya untuk mengisolasi, karakterisasi, dan mempublikasikan turunan komponen kimia alami dalam jumlah banyak tanpa memikirkan bioaktivitasnya. Untuk mencapai esensi penerapan dan signifikansinya, penanganan bahan kimia alami harus melibatkan pengujian biologis. Ekstrak harus dipilah berdasarkan bioaktivitasnya, fraksinasi berdasarkan pengujian biologisnya, diidentifikasi senyawa bioaktifnya, dan diterapkan (McLaughin et al. 1998).
Pengujian biologis memberikan keuntungan khusus dalam standardisasi dan pengendalian kualitas dari keberagaman produk tumbuhan karena keberadaan campuran komponen bioaktif yang terdapat di dalam produk tumbuhan. Umumnya, respon biologis dari satu komponen bioaktif cenderung tidak disebabkan oleh satu komponen bioaktif saja namun dari campuran komponen bioaktif tumbuhan dengan proporsi relatif yang bervariasi dari satu komponen bioaktif sementara bioaktivitasnya tetap ada dengan batasan tertentu. Oleh karena itu, analisis fisik dan kimia dari satu komponen dalam suatu campuran tidak sepenuhnya memberikan hasil baik (McLaughin et al. 1998).
Komponen bioaktif hampir selalu toksik pada dosis tinggi. Namun, karena farmakologi dan toksikologi ada penyesuaian dosis penggunaan, kematian in vivo
dalam organisme zoologis sederhana dapat digunakan sebagai monitor awal untuk memilah dan memisahkan penemuan dan pengawasan bioaktivitas produk alami (McLaughin et al. 1998).
Brine shrimp lethality test (BSLT)
15 dipimpin oleh Michael pada tahun 1956. Metode pengujian ini didasarkan pada toksisitas bahan senyawa aktif tumbuhan dapat membunuh larva Artemia salina
(Leach) dan dapat digunakan sebagai pemilahan awal aktivitas antikanker.
Telur-telur udang laut, A. salina (Leach), yang mudah didapatkan dengan biaya minim, dapat bertahan hingga bertahun-tahun dalam keadaan kering. Jika dimasukkan dalam air laut, telur akan menetas dan dalam 48 jam menghasilkan larva udang laut yang banyak untuk keperluan pengujian (McLaughin et al. 1998).
Pengujian pada larva udang meliputi pengujian ekstrak alami, fraksi, atau komponen murni dalam beberapa konsenterasi berbeda dalam tabung reaksi yang mengandung 5 ml air laut dan larva udang. Udang yang tetap hidup setelah 24 jam dihitung dan data mortalitasnya diproses dalam perangkat lunak komputer dengan analisis probit untuk menduga nilai LC50
Hasil BSLT menunjukkan tingkat aktivitas biologis dari bahan uji. Apabila hasil BSLT ektrak menunjukkan hasil LC
dengan selang kepervayaan 95% untuk perbandingan potensi signifikan secara statistik (McLaughin et al. 1998).
50 dibawah 250 µg/ml, ekstrak tersebut
dapat dikategorikan aktif dan potensial untuk investigasi lanjutan (Rieser et al.
16
III. METODE PENELITIAN
3.1. Waktu dan Tempat Penelitian
Penelitian dilakukan selama 3 bulan (Mei – Juli 2011). Penelitian dilakukan di Laboratorium Kimia Hasil Hutan, Fakultas Kehutanan Institut Pertanian Bogor.
3.2. Bahan dan Alat Penelitian
Bahan-bahan yang digunakan dalam penelitian adalah serbuk kayu teras surian dan surian asal Kuningan ukuran 40 – 60 mesh sebanyak 1 kg, pelarut organik teknis n-heksana, etil asetat, dan metanol, larutan dimetil sulfoksida (DMSO), air laut, dan larva udang A. salina.
Alat-alat yang digunakan dalam penelitian yaitu mesin serbuk, alat saring bertingkat, alat suling, toples ukuran 10 L, sudip kaca, sudip aluminium, kertas saring, kain saring, corong, botol kaca gelap, vaccum rotary evaporator, oven, wadah aluminium, wadah kaca, tabung reaksi, sudip, dan pipet.
3.3. Urutan Kerja
3.3.1. Persiapan bahan baku
Persiapan bahan baku penelitian meliputi persiapan bahan baku serbuk kayu dan persiapan pelarut
a. Bahan baku serbuk kayu
Sampel daun surian asal Bogor dan surian asal Kuningan kemudian diidentifikasi di Herbarium Bogoriense, di Lembaga Ilmu Pengetahuan Indonesia (LIPI), Cibinong, Kabupaten Bogor. Identifikasi dilakukan untuk memastikan kebenaran jenis pohon yang digunakan.
17 panjang 5,5 m. Sementara pohon suren yang diambil cabangnya berdiameter 42 cm, tinggi sekitar 23 m, dengan usia pohon yang tidak diketahui. Kayu surian asal Kuningan, Jawa Barat diambil dari bagian teras batang dengan diameter 15 cm, dengan panjang 18 m, dengan usia pohon sekitar 7 tahun.
Kayu hasil tebangan kemudian dibagi menjadi tiga bagian sebagai ulangan, pangkal, tengah, dan ujung. Selanjutnya sortimen tersebut dikuliti dan diambil bagian kayu terasnya. Bagian kayu teras kemudian digiling menjadi serbuk dengan menggunakan mesin serbuk dan disortasi dengan alat saring bertingkat sehingga diperoleh serbuk berukuran 40 – 60 mesh sebanyak 1 kg untuk setiap ulangan.
b. Pelarut organik
Pelarut organik teknis yang digunakan terdiri dari 3 jenis, yaitu pelarut non-polar (n-heksana), pelarut semipolar (etil asetat) dan pelarut polar (methanol). Sebelum digunakan, masing-masing pelarut terlebih dahulu harus dimurnikan dengan metode penyulingan pada titik didih masing-masing pelarut.
3.3.2. Ekstraksi
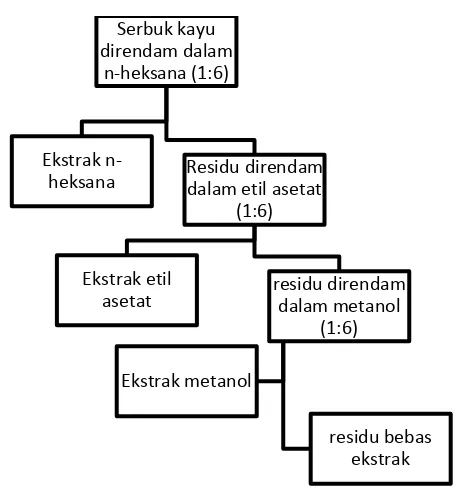
Proses ekstraksi dilakukan dengan metode maserasi atau perendaman berkesinambungan (Gambar 3) pada suhu kamar. Pada awalnya, serbuk kayu suren sebanyak 1 kg dimasukkan ke dalam toples kaca berukuran 10 L. Pelarut organik selanjutnya dimasukkan dengan perbandingan antara kayu dan pelarut sebesar 1:6 ke dalam toples hingga serbuk kayu terendam seluruhnya. Pemasukan pelarut organik dilakukan secara bertahap dengan memasukkan pelarut organik non-polar, kemudian pelarut organik semi-polar, dan terakhir pelarut organik polar. Setiap 24 jam perendaman, ekstrak dipindahkan sementara ke botol kaca gelap dan pada ampasnya dimasukkan pelarut pengganti pada setiap tingkatan polaritas hingga pelarut yang terendam tidak memiliki warna dan bening.
Selanjutnya setiap ekstrak dipekatkan dengan vaccum rotary evaporator
18 Gambar 3 Proses eksraksi maserasi bersinambung.
3.3.3. Pengujian
Pengujian yang dilakukan meliputi pengukuran kadar ekstrak dan brine shrimp lethality test (BSLT).
a. Kadar ekstrak kayu
Ekstrak basah hasil pemekatan dengan vaccum rotary evaporator dari masing-masing jenis pelarut diambil sebanyak 5 ml dan dimasukkan ke dalam wadah aluminium yang telah diketahui bobotnya. Ekstrak dan wadah ditimbang lalu dikeringkan pada suhu 103 ± 2 °C selama 12 jam. Selanjutnya wadah dan ekstrak kering ditimbang. Kandungan ekstraktif kayu dapat diketahui secara matematis dengan rumus kadar ekstrak sebagai berikut:
Keterangan:
W1 = Berat kering oven ekstrak kayu (g)
W2 = Berat kering oven serbuk kayu yang digunakan (g) b. Brine shrimp lethality test (BSLT)
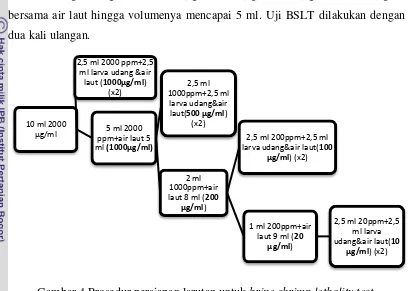
Sebanyak 20 mg ekstrak kering dari masing-masing jenis pelarut dilarutkan pada 10 tetes dimetil sulfoksida (DMSO) dalam tabung reaksi. Selanjutnya, untuk membuat larutan 2000 µg/ml ditambahkan air laut hingga
Serbuk kayu direndam dalam
n-heksana (1:6)
Ekstrak
n-heksana Residu direndam dalam etil asetat (1:6) Ekstrak etil
asetat residu direndam dalam metanol (1:6) Ekstrak metanol
19 mencapai 10 ml. Dari larutan ini, dibuat larutan 1000 µg/ml, 500 µg/ml, 100 µg/ml, dan 20 µg/ml (Gambar 4).
Selanjutnya, sebanyak 20 ekor larva A. Salina usia 2 hari dimasukkan ke dalam masing-masing larutan 1000 µg/ml, 500 µg/ml, 100 µg/ml, dan 20 µg/ml bersama air laut hingga volumenya mencapai 5 ml. Uji BSLT dilakukan dengan dua kali ulangan.
Gambar 4 Prosedur persiapan larutan untuk brine shrimp lethality test.
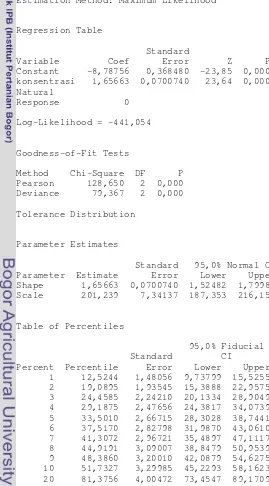
3.4. Analisis data
Data mortalitas larva udang hasil uji BSLT dianalisis dengan metode analisis probit untuk mencari konsenterasi kematian (lethality consentration) pada tingkat 50% (LC50) dengan asumsi distribusi weibull dan selang kepercayaan
95%. Pengolahan data menggunakan bantuan perangkat lunak Minitab 14 for Windows.
10 ml 2000 µg/ml
2,5 ml 2000 ppm+2,5 ml larva udang &air
laut (1000µg/ml) (x2)
5 ml 2000 ppm+air laut 5 ml(1000µg/ml)
2,5 ml 1000ppm+2,5 ml
larva udang&air laut(500 µg/ml)
(x2)
2 ml 1000ppm+air laut 8 ml (200
µg/ml)
2,5 ml 200ppm+2,5 ml larva udang&air laut(100
µg/ml) (x2)
1 ml 200ppm+air laut 9 ml (20
µg/ml)
2,5 ml 20ppm+2,5 ml larva udang&air laut(10
20 IV. HASIL DAN PEMBAHASAN
4.1. Kadar Zat Ekstraktif Kayu
Ekstraksi bersinambung bagian kayu teras surian menggunakan pelarut dari yang bersifat non polar hingga pelarut yang bersifat polar. Hasil penelitian (Tabel 1) menunjukkan bahwa ekstrak metanol kayu teras surian, masing-masing sebesar 0,38% dan 2,91%, mendominasi komponen ekstraksi dalam masing-masing kayu. Hal ini menunjukkan bahwa ekstraktif polar cenderung mendominasi kayu teras surian dan surian asal Kuningan.
Tabel 1 Kadar ekstrak rata-rata surian
Pelarut
1)
kadar ekstrak (%)
Surian Bogor Surian Kuningan n-heksana
0,18 0,29
etil asetat 0,25 1,04
Metanol
0,38 2,91
1)
Dominansi ekstrak polar juga ditemukan oleh peneliti lainnya. Hasil penelitian Pisutthanan et al. (2004) menunjukkan bahwa kecenderungan dominasi ekstraktif bersifat polar pada kayu juga terdapat pada kayu lain. Ekstrak kayu mindi (Melia azedarach) terlarut metanol 90% memiliki persentase kadar ekstrak tertinggi dibandingkan ekstrak n-heksana kayu mindi. Demikian pula hasil penelitian Meilani (2006) menunjukkan bahwa dari total ekstrak aseton kayu surian, fraksi polar menjadi fraksi paling dominan.
Berdasarkan 3 kali ulangan
Di sisi lain, pada masing-masing ekstrak kayu surian, ekstrak n-heksana memiliki kadar yang terendah, masing-masing sebesar 0,18% dan 0,29%. Keberadaan ekstraktif ataupun senyawa non polar cenderung paling sedikit dibandingkan senyawa ataupun fraksi semipolar dan polar (Pisutthanan et al.
21
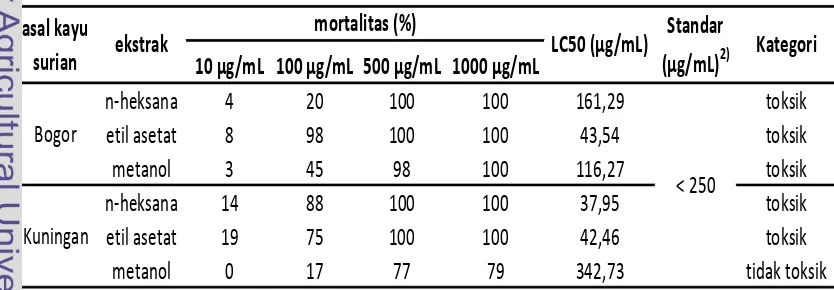
10 µg/mL 100 µg/mL 500 µg/mL 1000 µg/mL
n-heksana 4 20 100 100 161,29 toksik
etil asetat 8 98 100 100 43,54 toksik
metanol 3 45 98 100 116,27 toksik
n-heksana 14 88 100 100 37,95 toksik
etil asetat 19 75 100 100 42,46 toksik
metanol 0 17 77 79 342,73 tidak toksik
Kategori mortalitas (%)
ekstrak asal kayu
surian LC50 (µg/mL)
Kuningan Bogor
Standar (µg/mL)2)
< 250
seperti resin dan getah merupakan jenis ekstraktif yang terlarut di dalam pelarut non polar (Sjostrom 1998).
Secara deskriptif, pada Tabel 2 terlihat adanya pengaruh tempat tumbuh terhadap kadar ekstrak kayu yang dihasilkan. Ekstrak kayu surian asal Kuningan cenderung lebih tinggi kadarnya dibandingkan ekstrak surian asal Bogor. Menurut Sjostrom (1998), variasi kadar ekstrak dalam pohon dipengaruhi oleh umur pohon, posisi dalam pohon dan spesies pohon (genetik). Pohon surian asal Kuningan tumbuh di hutan alam yang tanahnya subur dan terjadi kompetisi perebutan unsur hara antar individu dalam hutan tersebut. Sementara, pohon surian asal bogor digunakan sebagai pohon turus jalan yang terpapar sinar matahari dalam intensitas tinggi dan tanahnya kurang subur. Perbedaan tempat tumbuh kedua pohon surian ini diduga menyebabkan kayu surian asal Kuningan memiliki persentase kadar ekstrak yang lebih tinggi daripada kayu surian asal Bogor.
4.2. Uji Bioaktivitas Zat Ekstraktif dengan Brine Shrimp Lethality Test
(BSLT)
[image:30.595.102.519.570.715.2]Hasil brine shrimp lethality test (BSLT) adalah berupa data mortalitas larva udang Artemia salina setelah pemberian ekstrak pada berbagai tingkat konsenterasi. Nilai yang diperoleh dari setiap ulangan pada setiap tingkat konsenterasi kemudian dikoreksi dengan hasil pengujian kontrol.
Tabel 2 Persentase mortalitas rata-rata terkoreksi larva udang A. salina setelah pemberian ekstrak kayu teras surian pada berbagai tingkat konsenterasi1)
1)
Berdasarkan 6 kali ulangan, setelah dikoreksi dengan mortalitas kontrol
22 Analisis probit untuk setiap data persentase mortalitas rata-rata BSLT akan menghasilkan nilai lethality concenteration 50% (LC50) untuk masing-masing
ekstrak. Berdasarkan Tabel 2, kecuali ekstrak metanol kayu surian asal Kuningan, seluruh ekstrak tergolong toksik atau dapat dikategorikan sebagai ekstrak aktif. Nilai LC50
Nomura dan Hano (1994) dalam Meilani (2006) menyatakan bahwa salah satu senyawa bioaktif yang larut dalam pelarut semi polar adalah senyawa flavonoid. Beberapa senyawa flavonoid ini mempunyai aktivitas biologis sebagai antimikroba, antitumor dan antivirus. Menurut Kurz dan Constabel (1998), beberapa tanaman dikenal menghasilkan senyawa bioaktif yang mempunyai berbagai aktivitas bioaktif termasuk antikanker yang pada umumnya berupa senyawa-senyawa flavonoid, glikosida, steroid alkaloid dan terpenoid.
terendah dimiliki oleh ekstrak n-heksana kayu surian asal Kuningan (37,95 µg/mL), yang berarti ekstrak ini paling aktif dan berpotensi memiliki bioaktivitas tertentu.
Tabel 2 menunjukkan bahwa ekstrak n-heksana pada ekstrak masing-masing kayu tergolong sebagai ekstrak yang aktif. Komponen kimia yang diduga berperan dalam sifat bioaktivitas dari komponen ekstrak terlarut n-heksana ini adalah terpenoid. Hal ini diperkuat dengan hasil penelitian Zhang et al. (2010) yang mennjukkan sifat sitotoksik tirucallane C26 triterpenoid, yang diisolasi dari
Aphanamixis grandifolia (Meliaceae) terhadap sel kanker serviks dan kanker payudara. Terpenoid merupakan senyawa kimia yang banyak dijumpai pada lemak dan minyak yang larut dalam pelarut non-polar (Sjostrom 1998).
Hasil uji bioaktivitas dengan BSLT (Tabel 2) kemudian dikaitkan dengan kadar zat ekstraktif (Tabel 1) untuk menentukan ekstrak mana yang potensial untuk investigasi lebih lanjut. Ekstrak n-heksana kayu surian asal Kuningan tergolong ekstrak paling aktif dengan nilai LC50
Ekstrak yang paling potensial untuk diinvestigasi lebih lanjut adalah ekstrak etil asetat kayu surian asal kuninngan. Nilai LC
yang paling rendah (37,95 µg/mL). Namun ekstrak ini memiliki persentase proporsi yang paling rendah pada ekstrak kayu surian asal Kuningan (0,29%), sehingga tidak potensial untuk investigasi lebih lanjut.
23 µg/mL) dan tidak terlalu berbeda dengan ekstrak n-heksana (37,95 µg/mL) serta proporsi yang relatif tinggi pada kayu (kadar ekstrak 1,04%), menjadikan ekstrak etil asetat kayu surian asal Kuningan terlarut etil asetat paling potensial untuk investigasi lebih lanjut.
4.3. Analisis Komponen Kimia dengan Pyrolysis Gas Chromatography Mass Spectrometry (Pyr-GC-MS)
Analisis komponen kimia menggunakan alat Pyr-GC-MS QP2010 Shimadzu. Alat ini bekerja pada suhu pirolisis 400°C selama 1 jam, dengan suhu pyrolizer dan transfer tube 280°C, suhu injeksi 280°C, suhu detektor relatif, dan suhu awal kolom 50°C dengan peningkatan 15°C per menit sampai 280°C.
Analisis komponen kimia dilakukan pada ekstrak yang memiliki nilai LC50
4.3.1. Senyawa-senyawa kimia dominan ekstrak etil asetat kayu surian asal Bogor
yang paling rendah pada masing-masing ekstrak. Analisis komponen kimia dengan pyr-GC-MS dilakukan pada 90 peak (Lampiran 14 dan 15). Hasil analisis
pyr-GC-MS masih bersifat dugaan dan perlu penyelidikan lebih lanjut terhadap isolat senyawa murni dengan metode fourier transform infra red spektrometry
(FTIR spectrometry) dan nuclear magnetic resonance (NMR) untuk mengetahui kepastian senyawa yang dikandung ekstrak. Dari keseluruhan jenis senyawa hasil analisis, senyawa-senyawa kimia dominan hasil analisis komponen kimia pada ekstrak yang paling aktif baik pada kayu surian maupun kayu surian asal Kuningan ditunjukkan pada Tabel 3 dan 4.
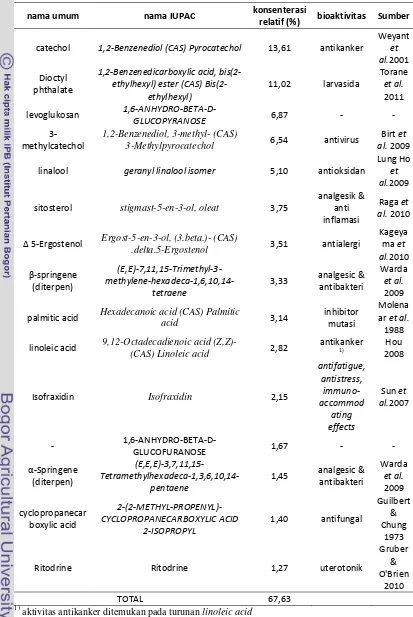
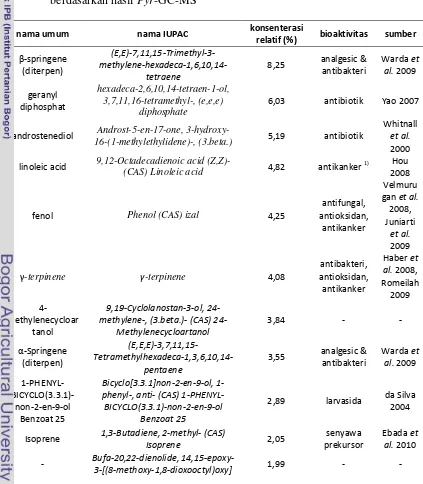
24 Tabel 3 Senyawa dominan ekstrak etil asetat kayu surian asal Bogor berdasarkan
hasil Pyr-GC-MS
nama umum nama IUPAC konsenterasi
relatif (%) bioaktivitas Sumber
catechol 1,2-Benzenediol (CAS) Pyrocatechol 13,61 antikanker
Weyant
et al.2001 Dioctyl
phthalate
1,2-Benzenedicarboxylic acid, bis(2-ethylhexyl) ester (CAS)
Bis(2-ethylhexyl)
11,02 larvasida
Torane
et al.
2011 levoglukosan
1,6-ANHYDRO-BETA-D-GLUCOPYRANOSE 6,87 - -
3-methylcatechol
1,2-Benzenediol, 3-methyl- (CAS)
3-Methylpyrocatechol 6,54 antivirus
Birt et al. 2009 linalool geranyl linalool isomer 5,10 antioksidan
Lung Ho
et al.2009 sitosterol stigmast-5-en-3-ol, oleat 3,75
analgesik & anti inflamasi
Raga et al. 2010
Δ 5-Ergostenol Ergost-5-en-3-ol, (3.beta.)- (CAS)
.delta.5-Ergostenol 3,51 antialergi
Kageya ma et al.2010 β-springene (diterpen) (E,E)-7,11,15-Trimethyl-3- methylene-hexadeca-1,6,10,14-tetraene
3,33 analgesic & antibakteri
Warda
et al.
2009 palmitic acid Hexadecanoic acid (CAS) Palmitic
acid 3,14
inhibitor mutasi
Molena ar et al.
1988 linoleic acid 9,12-Octadecadienoic acid (Z,Z)-
(CAS) Linoleic acid 2,82
antikanker Hou 2008
1)
Isofraxidin Isofraxidin 2,15
antifatigue, antistress, immuno-accommod ating effects
Sun et al.2007
-
1,6-ANHYDRO-BETA-D-GLUCOFURANOSE 1,67 - -
α-Springene (diterpen)
(E,E,E)-3,7,11,15- Tetramethylhexadeca-1,3,6,10,14-pentaene
1,45 analgesic & antibakteri Warda et al. 2009 cyclopropanecar boxylic acid 2-(2-METHYL-PROPENYL)-CYCLOPROPANECARBOXYLIC ACID 2-ISOPROPYL
1,40 antifungal
Guilbert & Chung
1973 Ritodrine Ritodrine 1,27 uterotonik
Gruber & O'Brien
2010
TOTAL 67,63
1)
25 Senyawa kimia catechol (atau catechin) yang dominan terdapat pada ekstrak etil asetat (konenterasi relatif 13,61%) merupakan kelompok fenolik. Penelitian Weyant et al. (2001) menunjukkan bahwa komponen catechol yang diproduksi massal oleh pabrik kimia memiliki sifat antikanker pada sel kanker usus yang dibiakkan pada tikus uji. Bioaktivitas antikanker juga ditunjukkan oleh komponen kimia turunan dari linoleic acid (Hou 2008). Tidak menutup kemungkinan bahwa ekstrak etil asetat ekstrak kayu surian asal Bogor memiliki sifat antikanker karena keberadaan catechol dalam fraksinya.
Ekstrak etil asetat kayu surian asal Bogor memiliki komponen dioctyl phtalate. Penelitian yang dilakukan Torane et al. (2011) mengisolasi komponen
dioctyl phtalate dari ekstrak daun Ehretia laevis dan diujikan pada larva Aedes aegypti. Hasilnya menunjukkan bahwa komponen dioctyl phtalate memiliki aktivitas biologis sebagai larvasida.
Komponen kimia levoglucosan (konsenterasi relatif 6,87%) dan
1,6-anhydro-beta-d-glucofuranose (konsenterasi relatif 1,67%) merupakan dua
komponen gula sederhana yang terbawa dalam proses pirolisis saat pengujian komponen kimia dengan pyr-GC-MS. Keduanya tidak memiliki peran bioaktivitas tertentu menurut penelusuran pustaka.
Ekstrak etil asetat kayu surian juga memiliki komponen 3-metylcatechol.
Penelitian Birt et al. (2009) menunjukkan bahwa komponen 3-metylcatechol yang diisolasi dari tanaman Hypericum perforatum dapat diturunkan menjadi senyawa tetralin yang memiliki sifat antiviral atau antivirus terhadap biakan virus HIV-1.
Komponen linalool yang dimiliki ekstrak etil asetat surian asal Bogor memiliki bioaktivitas sebagai antioksidan. Isolasi dari minyak atsiri Cinnamomum camphora dan pengujian sifat antioksidan dari ekstrak linalool yang dilakukan oleh Ho et al. (2009) menunjukkan fraksi ini memiliki sifat antioksidan.
26 Terdapat dua komponen asam lemak yang ikut terlarut dalam etil asetat pada penelitian ini, palmitic acid dan linoleic acid. Kajian terhadap aktivitas antikanker dari turunan linoleic acid telah dilakukan oleh Hou (2008). Sementara, Molenaar et al. (1988) menunjukkan bahwa komponen kimia palmitic acid
memiliki aktivitas sebagai inhibitor mutasi pada sel Saccaromyces cerevisae yang diinfeksi mutagen YPT1.
Penelusuran pustaka menunjukkan komponen α-springene (konsenterasi relatif 1,45%) dan β-springene (konsenterasi relatif 3,33%) memiliki aktivitas biologis sebagai antibakteri dan analgesik. Keduanya diisolasi dari beberapa tanaman Marrubium vulgare, Thymus pallidus, Lavandula stoechas and Eryngium ilicifolium dapat tergolong kelompok diterpena sehingga memiliki efek antibakteri terhadap Streptococcus pneumoniae (Warda et al. 2009).
Gruber dan O'Brien (2010) dalam hasil penelitiannya terhadap beberapa tanaman yang memiliki sifat uterotonik menunjukkan bahwa komponen ritodrine
terdapat pada beberapa ekstrak tanaman. Aktivitas uterotonik bekerja pada sel rahim sehingga menstimulasi kontraksi sel rahim dan mempermudah proses kelahiran janin. Efek ini berperan besar terutama saat terjadi kelahiran prematur pada manusia.
Nilai pengujian bioaktivitas dengan BSLT pada ekstrak etil asetat kayu surian tidak menunjukkan nilai LC50 yang sangat kecil. Diduga ada kompenen
kimia yang bersifat menjadi inhibitor reaksi dari aktivitas sitotoksik komponen kimia lainnya. Diduga, senyawa isofraxidin menjadi inhibitor pengaruh aktivitas biologis terhadap larva udang. Sun et al. (2007) mengisolasi isofraxidin dari ekstrak akar Acanthopanax senticosus dan diujikan pada hewan coba tikus memberikan efek relaksasi pada saraf tikus sehingga memberikan efek antifatigue
27 4.3.1. Senyawa-senyawa kimia dominan ekstrak n-heksana kayu surian asal Kuningan
Hasil penelusuran pustaka terhadap senyawa-senyawa dominan dalam ekstrak n-heksana kayu surian asal Kuningan (Tabel 4), menunjukkan bahwa ekstrak tersebut memiliki berbagai aktivitas biologis. Hal ini berbanding lurus dengan hasil uji bioaktivitas dengan BSLT (Tabel 2) yang menunjukkan bahwa ekstrak n-heksana kayu surian asal Kuningan memiliki bioaktivitas tinggi.
Tabel 4 Senyawa dominan ekstrak n-heksana kayu surian asal Kuningan berdasarkan hasil Pyr-GC-MS
nama umum nama IUPAC konsenterasi
relatif (%) bioaktivitas sumber
β-springene (diterpen)
(E,E)-7,11,15-Trimethyl-3-
methylene-hexadeca-1,6,10,14-tetraene
8,25 analgesic & antibakteri
Warda et al. 2009 geranyl
diphosphat
hexadeca-2,6,10,14-tetraen-1-ol, 3,7,11,16-tetramethyl-, (e,e,e)
diphosphate
6,03 antibiotik Yao 2007
androstenediol Androst-5-en-17-one,
3-hydroxy-16-(1-methylethylidene)-, (3.beta.) 5,19 antibiotik
Whitnall
et al.
2000 linoleic acid 9,12-Octadecadienoic acid (Z,Z)-
(CAS) Linoleic acid 4,82 antikanker
Hou 2008
1)
fenol Phenol (CAS) izal 4,25
antifungal, antioksidan,
antikanker
Velmuru gan et al.
2008, Juniarti
et al.
2009
γ-terpinene γ-terpinene 4,08
antibakteri, antioksidan, antikanker
Haber et al. 2008, Romeilah 2009 4-Methylenecycloar tanol 9,19-Cyclolanostan-3-ol, methylene-, (3.beta.)- (CAS)
24-Methylenecycloartanol
3,84 - -
α-Springene (diterpen)
(E,E,E)-3,7,11,15- Tetramethylhexadeca-1,3,6,10,14-pentaene
3,55 analgesic & antibakteri
Warda et al. 2009
1-PHENYL- BICYCLO(3.3.1)-non-2-en-9-ol Benzoat 25
Bicyclo[3.3.1]non-2-en-9-ol, 1-phenyl-, anti- (CAS) 1-PHENYL-BICYCLO(3.3.1)-non-2-en-9-ol
Benzoat 25
2,89 larvasida da Silva 2004 Isoprene 1,3-Butadiene, 2-methyl- (CAS)
Isoprene 2,05
senyawa prekursor
Ebada et al. 2010 - Bufa-20,22-dienolide,
[image:36.595.99.522.269.753.2]28
nama umum nama IUPAC konsenterasi
relatif (%) bioaktivitas sumber
Irisone
1-VINYL-2,6,6-TRIMETHYLCYCLOHEX-1-ENE 1,75 - -
-
(1RS,2SR)-2-hydroxy-2,4,4- trimethyl-3-(3'-methyl-3'-butenylidene)cyclopentyl methyl
ketone
1,74 - -
Iodomethyl
3-IODOMETHYL-3,6,6-TRIMETHYL-CYCLOHEXENE 1,72 - -
-
4-ACETYL-2,2,3,7-TETRAMETHYLTRICYCLO(5.2.O.O(1, 6))UNDEC-3-ENE
1,55 - -
Δ 5-Ergostenol Ergost-5-en-3-ol, (3.beta.)- (CAS)
.delta.5-Ergostenol 1,54 antialergi
Kato et al. 1999
Limonoid l-Limonene 1,49 antikanker Miller et
al. 2010
levoglukosan
1,6-ANHYDRO-BETA-D-GLUCOPYRANOSE 1,45 - -
methyl linoleat OCTADECA-9,12-DIENOIC ACID
METHYL ESTER 1,40
pheromone agent
Zhang et al. 2011 campesterol
24(Z)-METHYL-25-HOMOCHOLESTEROL 1,28 - -
borneol
1,7,7-TRIMETHYL-BICYCLO[2.2.1]HEPT-5-EN-2-OL 1,23
stimulan metabolik
Cai et al.
2008 -
(E)-4-(1,2-Epoxy-2,6,6-trimethyl-1-
cyclohexyl)-2-methyl-1,3-pentadiene
1,20 - -
lauric acid Dodecanoic acid (CAS) Lauric acid 1,07 antibakteri
Lieberma nn et al.
2006 ethylic acid Acetic acid (CAS) Ethylic acid 1,07 antibakteri
Nagoba
et al.
2008 - 2-OXA-TRICYCLO[4.3.1.0
3,8]DECANE 1,05 - -
γ-tocotrienol 2H-1-Benzopyran-6-ol, 3,4-dihydro- 2,7,8-trimethyl-2- (4,8,12,16,20,24,28,32-octamethyl- 3,7,11,15,19,23,27,31-tritriacontaoctaenyl)-, (R-(all-E))- gamma-Tocotrienol
1,04 antioksidan Ryan et
al. 2007
-
1,3,7,7-TETRAMETHYL-2-OXA-BICYCLO(4.4.0)DEC-5-EN-4-ONE 1,00 - -
TOTAL 71,09
29 relatif 3,55%). Warda et al. (2009) menunjukkan bahwa komponen diterpen yang diisolasi dari beberapa tanaman yaitu Marrubium vulgare, Thymus pallidus,
Lavandula stoechas dan Eryngium ilicifolium memiliki bioaktivitas sebagai antibakteri dan analgesik.
Geranyl diphosphat (6,03%) diisolasi dari jamur Pleurotus passeckerianus
dan Sordaria araneosa merupakan senyawa prekursor yang digunakan untuk menurunkan senyawa lainnya. Turunan dari geranyl diphosphate menghasilkan senyawa yang memiliki sifat antibiotik (Yao 2007).
Komponen androstenediol (5,19%) yang terdapat pada fraksi n-heksana juga pernah diteliti setelah diisolasi dari ekstrak kasarnya oleh Whitnall et al.
(2000). Hasil penelitiannya menunjukkan bahwa senyawa androsetenediol
menunjukkan sifat sebagai antibiotik terhadap tikus yang terpapar sinar gamma. Komponen fenol (4,25%) dan γ-terpinene (4,08%) yang dimiliki ekstrak n-heksana kayu surian asal Kuningan memiliki sifat sebagai antikanker (Velmurughan et al. 2008, Juniarti et al. 2009, Haber et al, 2008, dan Romeilah 2009). Fenol juga berperan sebagai antioksidan. Senyawa γ-terpinene memiliki sifat sebagai antibakteri dan antioksidan.
Ekstrak n-heksana kayu surian asal Kuningan memiliki komponen kimia yang bertindak sebagai larvasida. Komponen kimia tersebut adalah 1-phenyl-bicyclo(3.3.1)-non-2-en-9-ol benzoat 25 (da Silva 2004). Dalam penelitiannya, komponen ini diisolasi dari minyak atsiri hasil penyulingan Achillea, Anthemis,
Artemisia, Balsamita, Chrysanthemum, Matricaria, Santolina dan Tanacetum
Komponen 2-propenoic acid memiliki persentase konsenterasi relatif sebesar 2,57% terhadap keseluruhan ekstrak n-heksana kayu surian asal Kuningan. Menurut Ali et al. (1993), turunan 2-propenoic acid memiliki aktivitas biologis sebagai antibakteri. Komponen yang memiliki aktivitas biologis sebagai antibakteri juga dimiliki oleh komponen kimia lauric acid dan ethylic acid
(Liebermann et al. 2006; Nagoba et al. 2008).
30 prekursor yang dapat diturunkan menjadi senyawa steroid-terpenoid (sterol). Turunan senyawa sterol ini memiliki aktivitas sebagai anti inflamasi, anti infeksi dan antikanker (Ebada et al. 2010).
Ekstrak n-heksana kayu surian asal Kuningan juga mengandung sebanyak 1,54% konsenterasi relatif dari komponen kimia Δ 5-Ergostenol. Komponen kimia
Δ 5-Ergostenol memiliki efek antialergi terhadap sel-sel mukosal (Kato et al. 1999)
Limonoid (I-limonene) merupakan senyawa kimia ciri khas yang terkandung dalam spesies dari famili Meliaceae (Kipassa et al. 2007). Pada ekstrak n-heksana kayu surian asal Kuningan, limonoid memiliki konsenterasi relatif sebesar 1,49%, atau lebih tinggi daripada konsenterasi relatif di ekstrak etil asetat surian yang hanya memiliki konsenterasi relatif 0,24% (Lampiran 14). Miller et al. (2011) menyatakan bahwa senyawa limonoid memiliki sifat toksik terhadap kanker payudara.
Senyawa methyl linoleat juga terdapat di ekstrak n-heksana kayu surian asal Bogor. Komponen ini berperan menstimulasi feromon pada udang dalam proses perkawinannya (Zhang et al. 2011).
Senyawa borneol memiliki konsenterasi relatif 1,23% terhadap keseluruhan ekstrak n-heksana kayu surian asal Kuningan. Cai et al. (2008) mengemukakan bahwa borneol memiliki peran sebagai stimulan metabolik. Penelitiannya menunjukkan bahwa tikus yang diberikan borneol melalui pemberian oral akan memiliki distribusi gastrodin yang lebih banyak pada otaknya dibandingkan yang tidak diberi perlakuan.
Senyawa γ-tocotrienol yang terkandung dalam ekstrak n-heksana kayu surian asal Kuningan juga terkandung dalam bahan pangan oat memiliki aktivitas antioksidan yang menyerupai vitamin E (Ryan et al. 2007). Komponen ini pada ekstrak surian asal Kuningan memiliki konsenterasi relatif sebesar 1,04%.
31 senyawa-senyawa ini memiliki aktivitas biologis yang tinggi. Hasil penelusuran pustaka pada senyawa kimia dominan pada ekstrak n-heksana kayu surian asal Kuningan menunjukkan bahwa senyawa-senyawa dominan yang tertera pada Tabel 4 bertanggungjawab pada tingginya aktivitas biologis pada ekstrak tersebut.
Namun pilihan untuk mengisolasi tunggal senyawa-senyawa yang berpotensi sebagai antikanker dapat menjadi kurang dapat menjadi tepat karena terdapat kemungkinan penurunan bioaktivitas dari senyawa tunggal. Hal ini diakibatkan beberapa aktivitas biologis tidak hanya ditimbulkan dari senyawa tunggal namun juga dapat ditimbulkan dari interaksi senyawa tunggal tersebut dengan senyawa lain yang bahkan bisa jadi tidak dominan (Ariens et al. 1986
dalam Putro 2008).
32 V. KESIMPULAN DAN SARAN
5.1. Kesimpulan
1. Hasil penelitian menunjukkan bahwa kandungan ekstraktif pada kayu teras surian asal kuningan cenderung lebih tinggi pada kayu teras surian asal Bogor. Tempat tumbuh diduga memiliki pengaruh dalam kadar zat ekstraktif kayu. Kadar ekstrak tertinggi dari masing-masing ekstrak dimiliki oleh ekstrak metanol (0,38% dan 2,91%), selanjutnya etil asetat (0,25% dan 1,04%), dan n-heksana (0,18% dan 0,29%).
2. Berdasarkan nilai LC50, ekstrak paling aktif adalah ekstrak n-heksana kayu
surian asal Kuningan (LC50
3. Hasil analisis komponen kimia dengan pyr-GC-MS menunjukkan adanya peranan dari senyawa-senyawa kimia dominan terhadap tingginya aktivitas biologis ekstrak masing-masing ekstrak kayu.
37,95 µg/mL).
5.2. Saran
33 DAFTAR PUSTAKA
Agoes G. 2007. Teknologi Bahan Alam. Bandung: Institut Teknologi Bandung. Alfalahi K. 2005. Uji toksisitas zat ekstraktif kulit batang pulai (Alstonia scholaris
R.BR.) menggunakan brine shrimp lethality test [Skripsi]. Bogor: Fakultas Kehutanan, Institut Pertanian Bogor.
Anderson RN. 2001. Deaths: leading causes for 1999. National Vital Statistics Reports. Maryland: National Center for Health Statistics. 49:11.
Birt DF, Widrlechner MP, Hammer KDP, Hillwig ML, Wei J, Kraus GA, Murphy PA, McCoy JA, Wurtele ES, Neighbors JD, Wiemer DF, Maury WJ, Price JP. 2009. Hypericum in infection: Identification of viral and anti-inflammatory constituents. Pharmacologhical Biology. 2009; 47(8): 774-782.
Cai Z, Hou S, Li Y, Zhao B, Yang Z, Xu S, Pu J. 2008. Effect of borneol on the distribution of gastrodin to the brain in mice via oral administration.
Journal of Drug Target. 2008 Feb;16(2):178-84.
Chia YC, Wang PH, Huang YJ, Hsu HK, Huang MS. 2009. Cytotoxic activity on human lung cancer cells. Taiwan in press.
[Departemen Kehutanan]. 2004. SK.272/Menhut-V/2004. Jakarta: Departemen Kehutanan.
Da Silva JAT. 2004. Mining the essential oils of the Anthemideae. African Journal of Biotechnology 3(12): 706-720
De Paula JR, Vieira IJC, Fatima M, Da Silva GF, Fo EF, Fernandes JB, Vieira PC, Pinheiro AL, Vilela EF.1996. Sesquiterpens, triterpenoids, limonoids, and flavonoids of Cedrela odorata graft and speculations on the induced resistance against Hypsyla grandella. Pergamon 44(8):1449-1454.
Djam’an DF. 2002. Informasi Singkat Benih: Toona sureni Blume. Bogor: Balai Penelitian dan Pengembangan Benih.
Drewes C. 2002. Artemia franciscana. http://www.zool.iastate.edu/~c_drewes/
Ebada SS, Lin WH, Proksch P. 2010. Bioactive sesterterpenes and triterpenes from marine sponges: occurrence and pharmacological significance. Mar. Drugs 8: 313-346
[21 Juni 2011].
Fengel D,Wegener G. 1995. Kayu: Kimia, Ultrastruktur, Reaksi-reaksi.
34 Gralla RJ, Houlihan NG, Messner C. 2010. Understanding and Managing
Chemoteraphy Side Effects. New York: Cancer Care.
Gruber CW, O’Brien M. 2010.Uterotonic plants and their bioactive constituents.
Planta medica Journal.
Haber WA, Aguius BR, Stokes SL. Setzer WN. 2008. Bioactivity and chemical composition of the leaf essential oil of Talauma gloriensis Pittier (Magnoliaceae) from Monteverde, Costa Rica. Record of Natural Products. 2(1):1-5.
Harborne JB. 1987. Metode Fitokimia : Penuntun Cara Modern Menganalisis Tumbuhan. Padmawinata K, Soedira I, penerjemah. Bandung: Penerbit Institut Teknologi Bandung. Terjemahan dari: Phytochemical methods.
Hayne K. 1987. Tumbuhan Berguna Indoensia Jilid I. Jakarta: Badan Penelitian dan Pengembangan Departemen Kehutanan RI.
Ho CL, Wang EIC, Su YC. 2009. Essential oil compositions and bioactivities of the various parts of Cinnamomum camphora Sieb. var. linaloolifera
Fujuta. Quarterly J. Forest Rech. 31(2): 77-96.
Hou CT. 2008. New bioactive fatty acid. Asia Pac J Clin Nutr 2008;17 (S1):192-195.
Hua P, Edmonds JM. 2008. Toona. Meliaceae.
http://hua.huh.harvard.edu/china/mss/volume11/Meliaceae.pdf. 11:114 [31 Juli 2011.
Kato M, Nakashima, Kato M, Nozaki Y, Yoshimoto T, Tamada Y, Kageyama M, Yamashita T, Kurimoto F. 1999. Serum soluble Fas levels as a marker to distinguish allergic and non- allergic rhinitis. Journal of Allergy Clinical Immunology 103: 1213-1214.
Kipassa NT, Iwagawa T, Okamura H, Doe M, Morimoto Y, Nakatani M. 2006.
Kurz WGW, Constabel F. 1998. Production of Secondary Metabolite dalam Altman A, editor. Agriculture Biotechnology. (Ed). New York: Marcel Dekker Inc; 1998.
Limonoids from the stem bark of Cedrela odorata. Phytochemistry 69: 1782–1787
Juniarti, Osmeli D, Yuhernita. 2009. Kandungan senyawa kimia, uji toksisitas
(brine shrimp lethality test) dan antioksidan (
1,1-diphenyl-2-pikrilhydrazyl) dari ekstrak daun saga (Abrus precatorius L.). Makara, Sains 13(1):50-54.
Liebermann S, Enig MG, Preuss HG. 2006. A review of monolaurin land lauric acid. Alternative & Complementary Therapies 12:310-314
35 Meilani SW. 2006. Uji bioaktivitas zat ekstraktif kayu suren (Toona sureni Merr.) dan ki bonteng (Platea latifolia BL.) menggunakan brine shrimp lethality
test (BSLT) [Skripsi]: Bogor: Departemen Hasil Hutan, Fakultas
Kehutanan, Institut Pertanian Bogor.
Meyer BN, Ferrigni NR, Putnam JE, Jacobsen LB, Nichols DE, McLaughin JL. 1982. Brine shrimp: A convenient general bioassay for active plant constituent. Journal of Medicinal Plant ResearchPlanta Medica 45:31-32. Miller JA, Thompson PA, Hakim IA, Chow HHS, Thomson CA. 2011.
I-Limonene: a bioactive food component from citrus and evidence for a potential role in breast cancer prevention and treatment. Oncol Review
5:31–42
Molenaar CMT, Prange R, Gallwitz D. 1988. A carboxyl-terminal cysteine residue is required for palmitic acid binding and biological activity of the ras-related yeast YPT1 protein. TheEMBOJournal 7(4): 971 -976.
Nagoba B, Wadher B, Kulkarni P, Kolhe S. 2008. Acetic acid treatment of pseudomonal wound infections. European Journal of Genetic Medicine
25(2):104-106
Orwa C, Mutua A , Kindt R , Jamnadass R, Simons A. 2009. Agroforestree
Database:A Tree Reference And Selection Guide Version 4.
http://www.worldagroforestry.org/af/treedb/
Pissutthanan S, Plianbangchang P, Pissutthanan N, Ruanruay S, Muanrit O. 2004. Brine shrimp lethality activity of thai medicinal plantsin the family Meliaceae. Naresuan University Journal 12(2): 13-18.
[28 Juli 2011].
Putro JS. 2008. Uji Bioaktivitas Senyawa Flavonoid Kayu Suren (Toona sureni
Merr.) dengan metode brine shrimp lethality test (BSLT) [Skripsi] Bogor: Departemen Hasil Hutan, Fakultas Kehutanan, Institut Pertanian Bogor .
Raga DD, Cheng CLC, Lee KCLC, Olaziman WJP, De Guzman VJA, Shen CC, Franco Jr. FC, Ragasa CY. 2010. Bioactivities of Triterpenes and a Sterol from Syzygium samarangense. Journal of Natuforsch. 66(c): 235–244. Romeilah RM. 2009. Anticancer and antioxidant activities of Matricaria
chamomilla L. and Marjorana hortensis essential oils. Journal of Medicinal Science 4(2): 332-339.
Ryan D. Kendall M, Robard K. 2007. Bioactivity of oats as it relates to cardiovascular disease. Nutrition Research Reviews 20: 147–162
36 Sun H, Lv H, Zhang Y, Wang X, Bi K, Cao H. 2007. A rapid and sensitive
UPLC-ESI MS method for analysis of isofraxidin, a natural antistress compound, and its metabolites in rat plasma. Journal of Shenyang Pharmaceutical Science. 30(18): 3202-6.
Suradikusumah E. 1989. Kimia Tumbuhan. Bogor: Pusat Antar Universitas Bioteknologi, Institut Pertanian Bogor.
Sumiwi. 1992. Kromatografi Lapis Tipis Alkaloid dari Daun Kelor (Moringa oleifera Lamrk). Laporan Penelitian. Bandung: Fakultas Matematika dan Ilmu Pengetahuan Alam, Universitas Padjajaran.
Torane RC, Kamble GS, Kale AA, Gadkari TV, Deshpande NR. 2011. Quantification of Dioctyl phthalate from Ehretia laevis Roxb by HPTLC.
Journal of Chemical and. Pharmaceutical Research Sir Parashurambhau College 3(3):48-51.
Velmurughan N, Han SS, Lee YS. 2008. Antifungal activity of neutralized wood vinegar with water extracts of Pinus densiflora and Quercus serrata saw dusts. Journal of Environmental Research 3:167-176.
Vickery ML, Vickery B. 1981. Secondary Plant Metabolism. London and Basiing Stoke: The Mcmillan Press Ltd.
Warda K, Markouk M, Bekkouche K, Larshini N, Abbad A, Romane A, Bouskraoui M. 2009. Antibacterial evaluation of selected Moroccan medicinal plants against Streptococcus pneumoniae. Journal of Pharmacy and Pharmacology 3(3): 101-104.
Weyant MJ, Carothers AM, Dannenberg AJ, Bertagnolli MM.. 2001. Catechin inhibits intestinal tumor formation and suppresses focal adhesion kinase activation in the mouse. Cancer Research. 61: 118–125.
Whitnall MH, Elliot TB, Harding RA, Inal CE, Landauer MR, Wilhemsen CL, McKinney L, Milner VL, Jacksonlll WE, Loria RM, Ledney GD, Seed TM. 2000. Androstenediol stimulates myelopoiesis and enhances resistance to infection in gamma-irradiated mice. Journal of Immunopharmacology 22:1-14.
Yao Q. 2007. Biosynthetic studies of fungal diterpene antibiotics [Thesis] Oregon: Oregon State University .
Zhang D, Terschak JA, Harley MA, Lin J, Hardege JD. 2011. Simultaneously hermaphroditic shrimp use lipophilic cuticular hydrocarbons as contact sex pheromones. Public Library of Science One6(4): 1-7
39 Lampiran 2. Perhitungan Bobot Kayu yang digunakan
Bobot serbuk kayu
Toona surenii
yang digunakan
ulangan
BB (g)
KA (%)
BKT (g)
P
1000
8,108
925
T
1000
7,527
930
U
1000
6,270
941
Bobot Serbuk kayu
Cedrela odorata
yang digunakan
ulangan
BB (g)
KA (%)
BKT (g)
P
100
8,108
92,5
40 Lampiran 3. Perhitungan Kadar Ekstrak Surian asal Bogor
Pelarut ulangan wo (g) w1 (g)
BKT ekstrak (g) volume ekstrak cair (ml) BKT serbuk (g) vol. Ekstrak pekat total (ml) konsenterasi ekstrak (g/ml) bobot ekstrak total (g) kadar ekstrak (%) konsenterasi ekstrak rata-rata (g/ml) kadar ekstrak rata-rata (%)
P1 1,893 1,982 0,089 5 925 0,0178 1,7800 0,192432
P2 2,268 2,358 0,090 5 925 0,0180 1,8000 0,194595
T1 2,011 2,099 0,088 5 930 0,0176 1,7600 0,189247
T2 2,055 2,144 0,089 5 930 0,0178 1,7800 0,191398
U1 2,117 2,183 0,066 5 941 0,0132 1,3200 0,140276
U2 2,135 2,205 0,070 5 941 0,0140 1,4000 0,148778
P1 2,148 2,158 0,010 5 925 0,0020 0,4800 0,051892
P2 1,845 1,901 0,056 5 925 0,0112 2,6880 0,290595
T1 2,130 2,179 0,049 5 930 0,0098 2,4500 0,263441
T2 2,372 2,433 0,061 5 930 0,0122 3,0500 0,327957
U1 2,064 2,13 0,066 5 941 0,0132 3,3000 0,350691
U2 1,962 2,002 0,040 5 941 0,0080 2,0000 0,21254
P1 1,936 1,986 0,05 5 925 0,0100 2,5000 0,27027
P2 2,093 2,149 0,056 5 925 0,0112 2,8000 0,302703
T1 2,116 2,203 0,087 5 930 0,0174 4,3500 0,467742
T2 2,368 2,457 0,089 5 930 0,0178 4,4500 0,478495
U1 2,026 2,095 0,068 5 941 0,0137 3,4250 0,363974
U2 2,060 2,132 0,073 5 941 0,0145 3,6250 0,385228
41 Lampiran 4. Perhitungan Kadar Ekstrak Surian asal Kuningan
Pelarut ulangan wo (g) w1 (g)
BKT ekstrak (g) volume ekstrak cair (ml) BKT serbuk (g) vol. Ekstrak pekat total (ml) konsenterasi ekstrak (g/ml) bobot ekstrak total (g) kadar ekstrak (%) konsenterasi ekstrak rata-rata (g/ml) kadar ekstrak rata-rata (%) n-heksana
1 1,936 1,953 0,017 5 92,5 100 0,0034 0,34 0,34
0,0029 0,29
2 1,839 1,851 0,012 5 92,3 100 0,0024 0,24 0,24
etil asetat
1 2,094 2,183 0,089 5 92,5 200 0,0178 3,56 1,78
0,0104 1,04
2 2,066 2,081 0,015 5 92,3 200 0,003 0,6 0,3
metanol 1 2,121 2,239 0,118 5 92,5 250 0,0236 5,9 2,36 0,0291 2,91
42 Lampiran 5. Mortalitas Larva Kontrol BSLT Ekstrak surian asal Bogor
Lampiran 6. Mortalitas Larva Kontrol BSLT Ekstrak Surian asal Kuningan
mortalitas (ekor)
konsenterasi
(ppm) ulangan n (ekor)
0 10 u1 20
0 100 u1 20
0 500 u1 20
0 1000 u1 20
0 10 u2 20
0 100 u2 20
0 500 u2 20
0 1000 u2 20
mortalitas (ekor)
konsenterasi
(ppm) ulangan n (ekor)
0 10 u1 20
0 100 u1 20
0 500 u1 20
0 1000 u1 20
0 10 u2 20
0 100 u2 20
0 500 u2 20
43 Lampiran 7. Mortalitas Larva udang Ekstrak Surian asal Bogor
n-heksana etil asetat metanol
mortalitas ulangan konsentrasi n mortalitas ulangan konsentrasi n mortalitas ulangan konsentrasi n
10 U1 10 100 15 U1 10 100 5 U1 10 100
45 U1 100 100 100 U1 100 100 60 U1 100 100
100 U1 500 100 100 U1 500 100 94 U1 500 100
100 U1 1000 100 100 U1 1000 100 100 U1 1000 100
10 U2 10 100 20 U2 10 100 0 U2 10 100
19 U2 100 100 95 U2 100 100 69 U2 100 100
100 U2 500 100 100 U2 500 100 100 U2 500 100
100 U2 1000 100 100 U2 1000 100 100 U2 1000 100
5 U3 10 100 0 U3 10 100 5 U3 10 100
25 U3 100 100 100 U3 100 100 35 U3 100 100
100 U3 500 100 100 U3 500 100 100 U3 500 100
100 U3 1000 100 100 U3 1000 100 100 U3 1000 100
0 U4 10 100 0 U4 10 100 5 U4 10 100
19 U4 100 100 100 U4 100 100 53 U4 100 100
100 U4 500 100 100 U4 500 100 100 U4 500 100
100 U4 1000 100 100 U4 1000 100 100 U4 1000 100
0 U5 10 100 10 U5 10 100 0 U5 10 100
5 U5 100 100 100 U5 100 100 30 U5 100 100
100 U5 500 100 100 U5 500 100 100 U5 500 100
100 U5 1000 100 100 U5 1000 100 100 U5 1000 100
0 U6 10 100 0 U6 10 100 100 U5 1000 100
5 U6 100 100 90 U6 100 100 0 U6 10 100
100 U6 500 100 100 U6 500 100 25 U6 100 100
44 Lampiran 8. Mortalitas Larva Udang Ekstrak Suria