UJI DISOLUSI TABLET METRONIDAZOL
DI BALAI BESAR PENGAWAS OBAT DAN MAKANAN DI MEDAN
TUGAS AKHIR
Oleh:
M.BUDI ARMANSYAH HASIBUAN NIM 082410030
PROGRAM DIPLOMA III ANALIS FARMASI DAN MAKANAN FAKULTAS FARMASI
UNIVERSITAS SUMATERA UTARA MEDAN
LEMBAR PENGESAHAN
UJI DISOLUSI TABLET METRONIDAZOL
DI BALAI BESAR PENGAWAS OBAT DAN MAKANAN DI MEDAN
TUGAS AKHIR
Diajukan Untuk Melengkapi Salah Satu Syarat Untuk Memperoleh Gelar Ahli Madya Pada Program Diploma III Analis Farmasi dan Makanan
Fakultas Farmasi Universitas Sumatera Utara
Oleh :
M. BUDI ARMANSYAH HASIBUAN NIM 082410030
Medan, April 2011 Disetujui Oleh:
Dosen Pembimbing,
Dra. Lely Sari Lubis, M.Si., Apt. NIP 195404121987012001
Disahkan Oleh: Dekan,
KATA PENGANTAR
Puji syukur kehadirat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya yang telah memberikan pengetahuan, kekuatan, kesehatan dan kesempatan kepada penulis sehingga dapat menyelesaikan tugas akhir ini.
Tugas akhir ini berjudul “ UJI DISOLUSI TABLET METRONIDAZOL
DI BALAI BESAR PENGAWAS OBAT DAN MAKANAN DI MEDAN ”. Tugas akhir ini disusun sebagai salah satu syarat untuk menyelesaikan Program Diploma III Analis Farmasi dan Makanan Universitas Sumatera Utara.
Penulis mengucapkan terima kasih yang setinggi-tingginya kepada kedua orang tua , Kepada ayahanda Masri Hasibuan dan ibunda Mariatun. Kepada adinda Nurhakiki dan seluruh keluarga besar yang telah memberikan dukungan baik moril maupun materi serta nasehat kepada penulis sehingga penulis dapat menyelesaikan tugas akhir ini.
Penulis menyadari sepenuhnya bahwa tanpa bantuan dari berbagai pihak, penulis tidak akan dapat menyelesaikan tugas akhir ini sebagaimana mestinya. Untuk itu penulis mengucapkan terima kasih yang sebesar-besarnya kepada berbagai pihak antara lain:
1. Bapak Prof. Dr. Sumadio Hadisahputra, Apt. sebagai Dekan Fakultas Farmasi Universitas Sumatera Utara.
3. Bapak Prof. Dr. Jansen Silalahi, M.App.Sc., Apt. sebagai Koordinator Program Diploma III Analis Farmasi dan Makanan Fakultas Farmasi Universitas Sumatera Utara.
4. Bapak Drs. Suryadi Achmad, M.Sc., Apt. Sebagai Dosen Pembimbing Akademik penulis selama melaksanakan pendidikan pada program Diploma III Analis Farmasi dan Makanan Fakultas Farmasi USU.
5. Ibu Zakiah Kurniati, S.Farm., Apt. sebagai Koordinator Pembimbing Praktek Kerja Lapangan di Balai Besar Pengawas Obat dan Makanan di Medan.
6. Bapak dan Ibu dosen staf pengajar Fakultas Farmasi Universitas Sumatera Utara atas semua didikan dan bimbingannya selama ini.
7. Adinda Nurhayani yang senantiasa mendo‟akan, memberikan dorongan dan selalu membantu penulis.
8. Kakanda Ira, Sri, Deny dan Yopi terima kasih atas kritik dan sarannya, serta doa – doanya.
9. Sahabatku Ajeng, Nanda, Azrur, Phia, Fardi, Teguh dan Fauzan yang senantiasa memberiku semangat dan terus memacuku.
10.Seluruh teman-teman Analis Farmasi dan Makanan stambuk 2008 yang tidak dapat disebutkan namanya terima kasih atas kebersamaan dan masukannya dalam penyusunan tugas akhir ini.
Penulis menyadari sepenuhnya bahwa tugas akhir ini masih terdapat kekurangan dan masih jauh dari sempurna, untuk itu penulis mengharapkan saran dan kritik yang bersifat membangun demi kesempurnaan tugas akhir ini.
Akhir kata semoga Allah melimpahkan rahmat dan karunia-Nya kepada kita semua dan semoga tugas akhir ini dapat memberikan manfaat yang sangat berguna bagi kita semua. Amin.
Medan, April 2011 Penulis
M.Budi Armansyah Hasibuan
DAFTAR ISI
Halaman
JUDUL ...i
PENGESAHAN...ii
KATA PENGANTAR...iii
DAFTAR ISI...vi
DAFTAR TABEL...viii
DAFTAR LAMPIRAN...ix
BAB I PENDAHULUAN ...1
1.1 Latar Belakang ...1
1.2 Tujuan...3
1.3 Manfaat...3
BAB II TINJAUAN PUSTAKA...4
2.1 Obat...4
2.2 Tablet...5
2.2.1 Keunggulan Bentuk Sediaan Tablet...6
2.2.2 Bahan-Bahan Tambahan...7
2.3 Penyakit Amebiasis...8
2.4 Metronidazol...8
2.4.1 Struktur Metronidazol...9
2.4.2 Mekanisme Kerja...9
2.5 Disolusi...10
2.5.1 Faktor-faktor yang Mempengaruhi Laju Disolusi...13
2.5.2 Metode Uji Disolusi...15
3.3.2 Pembuatan Larutan Standar Metronidazol...21
3.3.3 Uji Disolusi dengan Metode Keranjang...21
BAB IV HASIL DAN PEMBAHASAN...22
4.1 Hasil...22
4.2 Pembahasan...22
BAB V KESIMPULAN DAN SARAN...24
5.1 Kesimpulan...24
5.2 Saran...24
DAFTAR PUSTAKA...25
DAFTAR TABEL
DAFTAR LAMPIRAN
BAB I PENDAHULUAN
1.1 Latar Belakang
Semenjak dunia berkembang dan dihuni oleh manusia serta mahluk hidup lainnya, mungkin sudah ada penyakit dan usaha untuk mengobatinya. Keadaan sehat dan sakit adalah dua hal yang tidak dapat dipisahkan, ini berlaku bagi semua mahluk hidup. Dikatakan terjadi infeksi bila mikroorganisme yang masuk kedalam tubuh menyebabkan berbagai gangguan fisiologis normal tubuh, sehingga timbul penyakit infeksi. Penyakit infeksi mempunyai kemampuan menjalar atau menular kepada orang lain yang sehat sehingga populasi penderita dapat meluas, karena penyebab penyakit ini adalah mikroorganisme atau parasit yang hidup dan berkembang menjalar dengan berbagai cara (Wattimena dkk, 1991).
Disentri amoeba adalah penyakit infeksi usus yang ditimbulkan oleh Entamoeba histolytica, suatu mikroorganisme anaerob bersel tunggal (protozoon).
seksual dan pada bayi (perinatal) yang dilahirkan dari ibu-ibu yang terinfeksi (Siegfried Ebel, 1992; Tan Hoan Tjay dan Kirana Rahardja, 2007).
Metronidazol (turunan nitro-imidazol) merupakan salah satu obat bebas pilihan pertama yang banyak beredar di pasaran, yang selalu digunakan untuk penanganan amebiasis dan trichomoniasis sehingga pengawasan terhadap zat berkhasiat Metronidazol perlu di jaga karena jika tidak memenuhi persyaratan dapat mengakibatkan berbagai hal yang tidak diinginkan seperti terjadinya keracunan karena dosis yang terlalu besar dan tidak adanya efek terapi karena kurangnya dosis dalam sediaan tersebut (Tan Hoan Tjay dan Kirana Rahardja, 2007; Amir Syarif,1980 ).
Menyadari akan hal ini, bahwa kadar yang tidak memenuhi persyaratan dapat membahayakan konsumen, maka penulis tertarik untuk mengambil judul tugas akhir “ UJI DISOLUSI TABLET METRONIDAZOL DI BALAI BESAR PENGAWAS OBAT DAN MAKANAN DI MEDAN”. Adapun pengujian dilakukan selama penulis melakukan praktek kerja lapangan di Balai Besar Pengawas Obat dan Makanan di Medan.
1.2 Tujuan
Adapun tujuan dari Uji Disolusi Metronidazol dalam sediaan tablet Metronidazol adalah untuk mengetahui apakah kadar metronidazol yang terdapat dalam tablet Metronidazol serta jumlah zat aktif yang terlarut dalam media cair dengan volume, waktu dan alat tertentu memenuhi persyaratan disolusi yang dipersyaratkan Farmakope Indonesia Edisi IV.
1.3 Manfaat
Adapun manfaat dari penulisan Tugas Akhir ini adalah :
- Untuk mengetahui laju pelarutan zat aktif dari sediaan, karena absorbsi dan kemampuan obat berada dalam tubuh sangat tergantung pada adanya obat dalam keadaan terlarut untuk diabsorbsi.
BAB II
TINJAUAN PUSTAKA
2.1 Obat
Surat Keputusan Menteri Kesehatan Republik Indonesia No. 193/KabB.VII/71 memberikan defenisi berikut untuk obat : “ Obat ialah suatu bahan atau paduan bahan-bahan yang dimaksudkan untuk digunakan dalam menetapkan diagnosis, mencegah, mengurangkan, menghilangkan, menyembuhkan penyakit atau gejala penyakit, luka atau kelainan badaniah dan rohaniah pada manusia atau hewan dan untuk memperelok atau memperindah badan atau bagian badan lainnya (Joenoes, 2001).
Obat-obat yang digunakan dalam terapi dapat dibagi dalam 4 (empat) golongan besar yaitu : Obat farmakodinamis, Obat kemoterapeutis, Obat tradisional dan Obat diagnosis (Tan Hoan Tjay dan Kirana Rahardja, 2007).
2.2 Tablet
Nama tablet (tabuletta, tabletta) berasal dari „tabuletta‟ piring pipih, papan
tipis. Beberapa farmakope dijumpai penandaan tablet sebagai kompressi (comprimere = dicetak bersama), juga sebagai komprimat dan dengan demikian menunjukkan cara membuatnya. Tablet adalah sediaan obat padat takaran tunggal. Tablet dicetak dari serbuk kering, kristal atau granulat, umumnya dengan penambahan bahan pembantu, pada mesin yang sesuai dengan menggunakan suatu tekanan tinggi. Tablet dapat memiliki bentuk silinder, kubus, batang, dan bentuk cakram, juga bentuk seperti telur atau peluru. Keberhasilan dimiliki bentuk bundar, lebih atau kurang bentuknya cembung ganda atau bentuk cakram. Besarnya garis tengah tablet pada umumnya 5-17 mm, bobot tablet 0,1 – 1 gram (Voight, 1994).
Menurut Farmakope Indonesia edisi IV, tablet adalah sediaan padat yang mengandung bahan obat dengan atau tanpa bahan pengisi. Berdasarkan metode pembuatan, dapat digolongkan sebagai tablet cetak dan tablet kempa. Tablet cetak dibuat dengan cara menekan massa serbuk lembab dengan tekanan rendah ke dalam cetakan. Tablet kempa dibuat dengan memberikan tekanan tinggi pada serbuk atau granul menggunakan cetakan baja (tahan karat) (Agoes, 2008).
khusus tablet dimaksudkan untuk menghindari, mencegah, atau mempersulit pemalsuan dan agar mudah dikenal orang (Anief, 1994 ; Syamsuni, 2006).
Tablet sangat baik disimpan dalam wadah yang tertutup rapat ditempat yang kelembabannya rendah, serta terlindung dari temperatur yang tinggi. Tablet khusus yang cenderung hancur bila kena lembab dapat disertai dengan pengering dalam kemasannya. Tablet yang dapat rusak oleh cahaya disimpan dalam wadah yang dapat menahan masuknya sinar / cahaya agar dapat bertahan lebih lama (Ansel, 1989).
2.2.1 Keunggulan Bentuk Sediaan Tablet
Tablet merupakan salah satu bentuk sediaan farmasi yang sangat populer, dimana hampir sebagian besar bentuk sediaan farmasi terdapat dalam bentuk tablet (hampir 60%). Hal ini didukung oleh beberapa keunggulan yang dimiliki oleh tablet, yaitu :
a. Tablet dapat diproduksi dalam skala besar dan dengan kecepatan produksi yang sangat tinggi sehingga lebih murah
b. Memiliki ketepatan dosis tiap tablet / tiap unit pemakaian
c. Lebih stabil dan tidak mudah ditumbuhi mikroba karena dalam bentuk kering dengan kadar air yang rendah
d. Dapat dibuat produk untuk berbagai profil pelepasan
e. Tablet bukan produk steril (kecuali implant / hipodermik tablet) sehingga penanganan selama produksi, distribusi, dan pemakaian lebih mudah f. Mudah dalam pengepakan (blister atau strip) dan transportasi
h. Bau, rasa, dan warna yang tidak menyenangkan dapat ditutupi dengan penyalutan
i. Produk dapat dengan mudah diidentifikasi, dengan memberikan tanda atau logo di punch atau dengan printing
j. Tablet tersedia dalam berbagai tipe tablet : buccal, effervescent, dispersible, dan lain-lain
k. Dapat dengan mudah digunakan sendiri oleh pasien tanpa bantuan tenaga medis
l. Dibandingkan dengan kapsul, tablet lebih temperproof (sulit dipalsukan) (Sulaiman, 2007).
2.2.2 Bahan-Bahan Tambahan
Untuk membuat suatu zat obat menjadi suatu bentuk sediaan akhir, bahan-bahan farmasetik dibutuhkan. Sebagai contoh, dalam pembuatan larutan sediaan farmasi, satu atau lebih pelarut digunakan untuk melarutkan zat obat tersebut, pengawet dapat ditambahkan untuk mencegah pertumbuhan mikroba, penstabil
bisa digunakan untuk mencegah peruraian obat, dan pemberi warna serta pemberi rasa ditambahkan untuk menambahkan penampilan produk. Dalam pembuatan
mengontrol penghancuran, atau menambah penampilan (Ansel, 1989; Lachman, dkk, 1994).
2.3 Amebiasis
Berdasarkan tempat kerjanya, amebisid dibagi dalam tiga golongan yaitu : 1). Amebisid jaringan, yaitu obat yang bekerja terutama pada dinding usus, hati dan jaringan ekstra intestinal lainnya. 2). Amebisid yang bekerja dalam usus. 3).Amebisid yang bekerja pada lumen usus dan jaringan.
Untuk mempercepat penyembuhan khususnya pada kasus berat maka penderita amebiasis sebaiknya diberikan makanan rendah residu. Bilamana perlu diberikan pengobatan simtomatik (Amir Syarif,1980).
2.4 Metronidazol
Pada tahun 1960 metronidazol mendapat paten sebagai kemoterapi yang sangat efektif. Metronidazol (2–metil–5-nitroimidazol-1-etanol) adalah anti-mikroba dengan aktivitas yang sangat baik terhadap bakteri anaerob dan protozoa. Spektrum antiprotozoanya mencakup Trikomonasi, Gardnerella, Vaginalis, Entamoeba histolytica dan Guardian lamblia. Aktivitas antibakteri anaerobnya sangat bermanfaat untuk sepsis pada kasus bedah dan ginekologis terutama Bacteroides fragilis (Amir syarif, 1980; ISO, 2008).
2.4.1 Struktur Metronidazol
CH3
Nama kimia : 2-metil-5-nitroimidazol-1-etanol Rumus molekul : C6H9N3O3
Berat molekul : 171,16
Pemeriaan : Hablur atau serbuk habllur, putih hingga kuning pucat; tidak berbau; stabil di udara; tetapi lebih gelap bila terpapar oleh cahaya.
Kelarutan : Sukar larut dalam eter; agak sukar larut dalam air, dalam etanol dan dalam kloroform.
Tablet Metronidazol mengandung Metronidazol, C6H9N3O3, tidak kurang dari
90,0% dan tidak lebih dari 110,0% dari jumlah yang tertera pada etiket (Dirjen POM, 1995).
2.4.2 Mekanisme Kerja
kematian. Metronidazol terhadap trichomoniasis mempunyai daya trikomoniasid langsung dengan konsentrasi 2,5 mcg/ml dan terhadap amebiasis, metronidazol mempunyai daya amebisid langsung dengan konsentrasi 1-2 mcg/ml (Amir Syarif, 1980; Siswandono dan Bambang Soekardjo, 2000).
2.4.3 Farmakokinetika dan Metabolisme
Absorpsi : Oral baik, jika diberikan topical konsentrasi sistemik yang tercapai
setelah aplikasi topical 1 gr sepuluh kali lebih rendah dibandingkan dengan
Waktu paruh eliminasi : neonates : 25-75 jam; lainya 6-8 jam, diperpanjang oleh
gangguan hati, gangguan ginjal tahap akhir : 21 jam. Waktu untuk mencapai kadar puncakdiserum : oral immediate release : 1-2 jam (Katzung, 2004 ; Syarif, 1980). 2.5 Disolusi
Disolusi didefinisikan sebagai proses suatu zat padat masuk kedalam pelarut menghasilkan suatu larutan. Secara sederhana, disolusi adalah proses zat padat melarut. Proses ini dikendalikan oleh afinitas antara zat padat dan pelarut (syukri, 2002).
pengganti uji klinik untuk menilai bioekivalen (bioequivalence). Hubungan kecepatan disolusi in vitro dan bioavailabilitasnya dirumuskan dalam bentuk IVIVC (in vitro – in vivo corelation). Kinetika uji disolusi in vitro memberi informasi yang sangat penting untuk meramalkan availabilitas obat dan efek terapeutiknya secara in vivo (Sulaiman, 2007).
Pengujian kehancuran yang dicantumkan dalam seluruh farmakope menggambarkan kriteria kualitas yang penting untuk peroralia (tablet, tablet salut, granulat, kapsul) meskipun demikian persyaratannya dalam pandangan terhadap ketersediaan terbatas. Suatu kehancuran total memang menawarkan persyaratan yang lebih baik untuk pelepasan, meskipun demikian bahan pembantu dapat membungkus bahan obat sedemikian rupa, sehingga melarutnya keluar dari produk hancuran sangat terhambat. Oleh karena kecepatan pelarutan dari bahan aktif sering kali menggambarkan langkah penentu kecepatan untuk jalannya resorpsi, maka tes pelarutan (dissolution-test) lebih nyata (Ansel et al, 1999; Voigt, 1994)
Disolusi-test sudah dapat dilakukan dengan alat kehancuran otomatis yang biasa, akan tetapi yang diamati bukan kehancuran dari „ Formling‟, melainkan
jumlah bahan obat dalam interval waktu tertentu, yang larut dari seluruh sediaan obat atau hancuran sediaan obat dalam cairan penguji (cairan pencernaan buatan), diinterpretasikan secara analitis (Voigt, 1994).
kedalam sediaan, proses pengembangan, proses disintegrasi dan deagragasi sediaan merupakan faktor yang mempengaruhi karakteristik disolusi obat sediaan (Syukri, 2002).
Laju absorpsi dari obat-obat bersifat asam yang diabsorpsi dengan mudah dalam saluran pencernaan sering ditetapkan dengan laju larut obat dari tablet. Bila yang menjadi tujuan adalah untuk memperoleh kadar yang tinggi di dalam darah, maka cepatnya obat dan tablet melarut biasanya menjadi sangat menentukan. Laju larut dapat berhubungan langsung dengan efikasi (kemanjuran) dari tablet dan perbedaan bioavailabilitas dari berbagai formula (Lachman et al., 1994).
Persyaratan uji disolusi pertama sekali dicantumkan dalam NF XIII (1970) dan USP XVIII (1970) . Persyaratan yang dimaksud disini bukan hanya persyaratan untuk nilai Q (jumlah obat yang terlarut dalam waktu yang ditentukan) saja, tetapi juga termasuk prosedur pengujian, medium disolusi dan peralatan serta persyaratan pengujiannya. Faktor-faktor yang mempengaruhi proses disolusi tablet, diantaranya kecepatan pengadukan, temperatur pengujian, viskositas, pH, komposisi medium disolusi, dan ada atau tidaknya bahan pembasah (wetting agent) (Sulaiman, 2007).
Komponen yang penting dalam melakukan perubahan disolusi adalah wadah, pengadukan, suhu, dan medium. Kecepatan pengadukan mempunyai hubungan dengan tetapan kecepatan disolusi, kenaikan suhu medium yang tinggi akan semakin banyak zat aktif terlarut. Suhu harus konstan yang biasanya pada untuk mengamati pelarutan dari obat sangat tidak larut dalam air menggunakan wadah berkapasitas besar (Lachman et al., 1994).
Obat-obat yang mempunyai kelarutan kecil dalam air, laju pelarutannya seringkali merupakan tahap yang paling lambat, oleh karena itu merupakan terjadinya efek penentu kecepatan terhadap bioavailabilitas obat, sedangkan obat yang mempunyai kelarutan besar dalam air, laju pelarutannya cepat (Shargel et al., 2005).
2.5.1 Faktor-faktor yang Mempengaruhi Laju Disolusi
1) Faktor Fisika yang Berpengaruh pada Uji Pelarutan In Vitro
a) Pengadukan
b) Suhu
Umumnya semakin tinggi suhu medium akan semakin banyak zat aktif yang terlarut. Suhu medium dalam percobaan harus dikendalikan pada keadaan
yang konstan umumnya dilakukan pada suhu 37
o
C, sesuai dengan suhu tubuh manusia. Adanya kenaikan suhu selain dapat meningkatkan gradien konsentrasi juga akan meningkatkan tetapan difusi, sehingga akan menaikkan kecepatan disolusi (Shargel et al., 2005).
c) Medium Kelarutan
Sifat medium larutan akan mempengaruhi uji pelarutan. Medium larutan hendaknya tidak jenuh obat. Medium yang terbaik merupakan persoalan tersendiri dalam penelitian. Beberapa peneliti telah menggunakan cairan lambung yang diencerkan, HCL 0,1 N, dapar fosfat, cairan lambung tiruan, air dan cairan usus tiruan tergantung dari sifat produk obat dan lokasi dalam saluran pencernaan dan perkiraan obat yang akan terlarut (Shargel et al., 2005).
d) Wadah
Ukuran dan bentuk dapat mempengaruhi laju dan tingkat kelarutan. Untuk mengamati kemaknaan dari obat yang sangat tidak larut dalam air mungkin perlu wadah berkapasitas besar (Shargel et al., 2005).
2) Faktor yang berkaitan dengan sifat fisikokimia obat
berperan pada permasalahan yang umum pada disolusi dalam hal terbentuknya flokulasi, flotasi dan aglomerasi (Syukri,2002).
3) Faktor yang berkaitan dengan formulasi sediaan.
Formulasi sediaan berkaitan dengan bentuk sediaan, bahan pembantu dan cara pengolahan (prossesing). Pengaruh bentuk sediaan pada laju disolusi tergantung pada kecepatan pelepasan bahan aktif yang terkandung didalamnya. Secara umum laju disolusi akan menurun menurut urutan sebagai berikut: suspensi, kapsul, tablet, dan tablet salut. Secara teoritis disolusi bermacam sediaan padat tidak selalu urutan dan masalahnya sama, karena di antara masing-masing bentuk sediaan padat tersebut akan ada perbedaan baik ditinjau dari segi teori maupun peralatan uji disolusi (Syukri, 2002).
2.5.2 Metode Uji Disolusi
Menurut Farmakope Indonesia Edisi IV pelarutan dapat digunakan dengan beberapa cara, yaitu :
- Metode Keranjang (Basket)
nominal 1000 ml. Pada bagian atas wadah dapt digunakan suatu tutup yang pas untuk mencegah penguapan. Batang logam berada pada posisi sedemikian sehingga sumbunya tidak lebih dari 2 mm pada tiap titik dari sumbu vertikal wadah, berputar dengan halus dan tanpa goyangan yang berarti. Batas kecepatan yang memungkinkan untuk memilih kecepatan dan mempertahankan kecepatan seperti yang tertera dalam masing-masing monografi dalam batas lebih kurang 4% (Dirjen POM,1995).
- Metode Dayung
2.6 Spektrofotometri 2.6.1 Defenisi
Spektrofotometer sesuai namanya adalah alat yang terdiri dari spektrometer dan fotometer. Spektrometer menghasilkan sinar dari spektrum dengan panjang gelombang tertentu dan fotometer adalah alat pengukur intensitas cahaya yang ditranmisikan atau yang diabsorbsi. Jadi, Spektrofotometer digunakan untuk mengukur energi secara relatif jika energi tersebut ditransmisikan, direfleksikan atau diemisikan sebagai fungsi dari panjang gelombang. Kelebihan Spektrofotometer dibandingkan fotometer adalah panjang gelombang dari sinar putih dapat lebih terseleksi dan ini diperoleh dengan alat penguat seperti prisma ataupun celah optis (Khopkar, 1990).215
berwarna melalui reaksi kimia dan absorbsi ditentukan dalam daerah tampak. (Dachriyanus, 2004; Khopkar, 1990; Rohman, 2007).
Dalam farmakope, metode spektrofotometri UV-Vis digunakan untuk
menetapkan kadar senyawa obat yang mendasarkan pada penggunaan nilai 1 1%�
suatu obat. Nilai 1 1%� adalah absorbansi suatu senyawa yang diukur pada konsentrasi 1% b/v (1 gr/100 ml) dengan ketebalan kuvet 1 cm pada panjang
gelombang dan pelarut tertentu. Nilai 1 1%� berfungsi untuk mengetahui berapa besar sensitifitas dan konsentrasi senyawa yang harus disiapkan sehingga diperoleh absorbansi pada kisaran 0,2-0,8 ( Rohman, 2007).
2.6.2 Instrumen
komponen-komponen punyusun dari spektrofotometer antara lain : 1. Sumber Cahaya
Sumber yang biasa yang digunakan adalah lampu wolfram. Tetapi untuk daerah Ultra violet digunakan lampu hidrogen atau lampu deutrium. Kebaikan lampu wolfram adalah energi radiasi yang dibebaskan tidak bervariasi pada berbagai panjang gelombang.
2. Monokromator
3. Sel Absorbsi
Pada pengukuran didaerah tampak kuvet kaca dapat digunakan, tetapi untuk pengukuran pada daerah Ultra violet kita harus menggunakan sel kuarsa karena gelas tidak tembus cahaya pada daerah ini. Umumnya tebal kuvetnya adalah 10 mm, tetapi yang lebih kecil ataupun yang lebih besar dapat digunakan. Sel yang biasa digunakan berbentuk persegi, tetapi bentuk silinder dapat juga digunakan. Kita harus menggunakan kuvet yang bertutup untuk pelarut organik. Sel yang baik adalah kuarsa atau gelas hasil leburan serta seragam seluruhnya.
4. Detektor
BAB III METODOLOGI
3.I Tempat Pengujian
Pengujian penetapan kadar Metronidazol dalam sediaan tablet Metronidazol dengan Uji Disolusi secara spektrofotometri UV-visibel dilakukan di Balai Besar Pengawas Obat dan Makanan (BBPOM) di Medan yang berada di Jalan Willem Iskandar Pasar V Barat I No. 2 Medan.
3.2 Alat dan Bahan 3.2.1 Alat-Alat
Alat - alat yang digunakan adalah Alat disolusi SR 8 plus tipe keranjang, Beker gelas, Erlenmeyer, Botol akuades, Labu tentukur, Spatula, Timbangan analitik (Denver Analytical Balance Digital), Ultrasonic Cleaner Bransonic B-2000, Kertas saring, Gelas ukur, Corong, Termometer, Stopwatch, Pipet tetes dan Spektrofotometer UV- visible SR 8 plus.
3.2.2 Bahan-Bahan
3.3 Prosedur
3.3.1 Pembuatan Pereaksi - Asam Klorida 0,1 N
Diambil 18 ml HCl pekat dan dipindahkan pelan-pelan kedalam beaker glass yang berisi 500 ml akuades. Diaduk dengan gelas pengaduk agar cairan bercampur sempurna dan dicukupkan larutan dengan akuades sampai 1 liter (Dirjen POM, 1979).
3.3.2 Pembuatan Larutan Standar Metronidazol
Ditimbang baku Metronidazol BPFI 1 mg, masukkan kedalam labu tentukur 100 ml diencerkan dengan Media Dissolusi sampai garis tanda. Diukur absorbansinya pada panjang gelombang 274 nm.
3.3.3 Uji Disolusi dengan Metode Keranjang
BAB IV
HASIL DAN PEMBAHASAN
4.1 Hasil
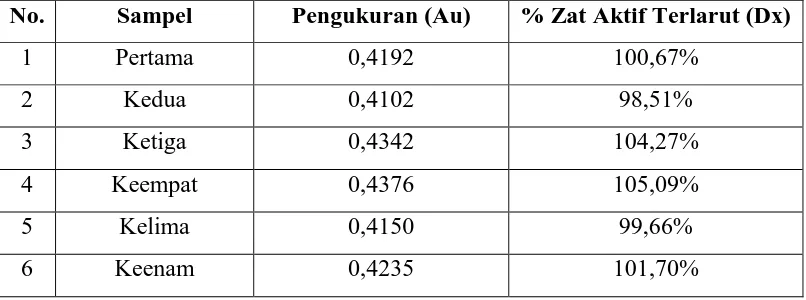
Hasil disolusi tablet metronidazol dapat dilihat pada tabel dibawah ini : Tabel 1. Hasil Disolusi Tablet Metronidazol
No. Sampel Pengukuran (Au) % Zat Aktif Terlarut (Dx)
Farmakope Indonesia Edisi IV (1995) yaitu dalam waktu 60 menit tiap unit harus larut tidak kurang dari Q + 5% (Q=85%). Contoh perhitungan dapat dilihat pada Lampiran 2.
4.2 Pembahasan
memenuhi persyaratan yaitu kadar tidak kurang dari Q + 5% ( Q=85%). Hal ini menunjukan bahwa zat aktif metronidazol dapat melarut dengan baik.
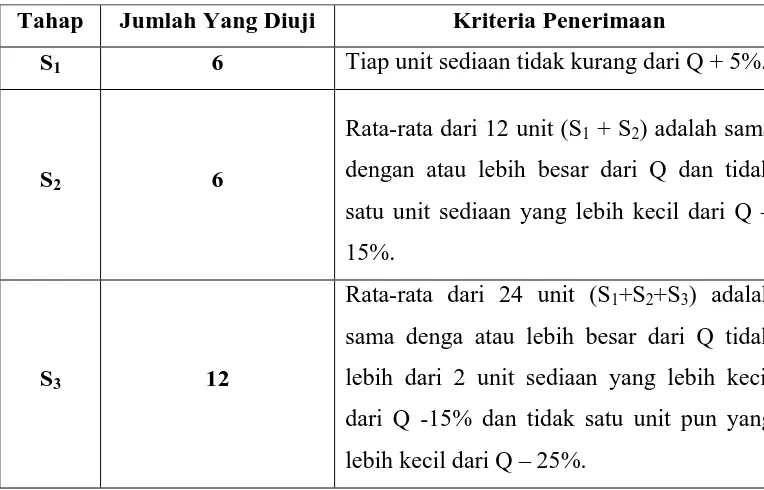
Tabel 2. Penerimaan Uji Disolusi
Tahap Jumlah Yang Diuji Kriteria Penerimaan
S1 6 Tiap unit sediaan tidak kurang dari Q + 5%.
S2 6
Rata-rata dari 12 unit (S1 + S2) adalah sama
dengan atau lebih besar dari Q dan tidak satu unit sediaan yang lebih kecil dari Q – 15%.
S3 12
Rata-rata dari 24 unit (S1+S2+S3) adalah
BAB V
KESIMPULAN DAN SARAN
5.1 Kesimpulan
Dari hasil percobaan penetapan kadar Metronidazol dalam sediaan tablet Metronidazol 250 mg dengan uji disolusi secara spektrofotometri ultra violet dapat ditarik kesimpulan bahwa tablet Metronidazol 250 mg yang diproduksi oleh PT Mutifa Medan- Indonesia telah memenuhi persyaratan uji disolusi yang tertera pada Farmafope Indonesia Edisi IV. Dimana Persyaratan kadar uji disolusi dalam waktu 60 menit tiap unit sediaan harus larut tidak kurang dari Q +5% ( Q=85%). 5.2Saran
- Sebaiknya pengujian untuk sediaan tablet Parasetamol jangan hanya terpatok pada pengujian terhadap kadar saja, akan tetapi pengujian-pengujian secara fisika-kimia lain juga harus dilakukan agar sediaan yang dipasarkan benar-benar merupakan sediaan yang memenuhi persyaratan dalam segala aspek fisika-kimia nya.
DAFTAR PUSTAKA
Anief, M, (1991). Apa yang Perlu Diketahui Tentang Obat . Yogyakarta : Penerbit Gajah Mada University Press. Halaman 3.
---, (1996). Penggolongan Obat Berdasarkan Khasiat dan Penggunaan. Yogyakarta : Penerbit Gajah Mada University Press. Halaman 9-10.
Ansel, C. Howard, (1989). Pengantar Bentuk Sediaan Farmasi. Jakarta : Penerbit Universitas Indonesia Press. Halaman 244, 298-299.
Anwar, J, (1973). Buku Farmakologi I. Medan : Penerbit Bagian Farmakologi Fakultas Kedokteran USU. Halaman 70.
Dachriyanus.(2004). Analisis Struktur Senyawa Organik Secara Spektroskopi, Edisi 1. Padang : Penerbit Andalas University Press. Halaman 1-3.
Ditjen POM, (1995). Farmakope Indonesia Edisi IV. Jakarta : Departemen Kesehatan Republik Indonesia. Halaman 4, 43.
Djamhuri, A, (1995). Sinopsis Farmakologi dan Terapan Khusus di Klinik dan Perawatan. Jakarta : Penerbit Hipokrates. Halaman 45.
Ebel, Siegfried. ( 1992 ). Obat Sintetik. Yogyakarta : Gajah Mada University Press. Halaman 529.
Goeswin, Agus. (2008). Pengembangan Sediaan Farmasi Edisi revisi dan perluasan. Bandung : ITB Press. Halaman 192
Joenoes, Nanizar Zaman. (2001). Ars Prescribendi (Resep Yang Rasional). Surabaya : Airlangga University Press. Halaman 27.
Katzung, Bertram G. (2004). Farmakologi Dasar dan Klinik . Jakarta : Penerbit Buku Kedokteran EGC. Halaman 1.
Lachman dkk. (1994). Teori dan Praktek Farmasi Industri II . Jakarta Universitas Indonesia-press.Halaman 644-662.
Rohman, A, (2007). Kimia Farmasi Analisis. Yogyakarta : Penerbit Pustaka Pelajar. Halaman 222,245-246.
Shargel, L. (1988). Biofarmasetika dan Farmakokinetika Terapan edisi 2. Surabaya : Universitas Airlangga. Halaman 132-135.
Siswandono dan Bambang Soekardjo. (2000). Kimia Medisinal II. Surabaya : Airlangga University press. Halaman 76-77.
Sulaiman, Teuku Nanda Saifullah. (2007). Teknologi Formulasi Sediaan Tablet. Yogyakarta : MUCOMM. Hal 2-3.
Syamsuni, H A. (2007). Ilmu Resep. Jakarta : EGC. Hal 165.
Syarif, A. (1980). Farmakologi dan Terapi Edisi 2. Jakarta : Penerbit Fakakultas Kedokteran Universitas Indonesia. Halaman 415-418.
Syukri, Y. (2002). Biofarmasetika. Yogyakarta: Universitas Islam Indonesia Press. Halaman 31
Tjay, T. dan Kirana Rahardja, (2007). Obat-Obat Penting edisi keenam. Jakarta : Penerbit Gramedia. Halaman 5, 188-191.
Voight, Rudolf. (1994). Buku Pelajaran Teknologi Farmasi. Yogyakarta : Gadjah Mada University Press. Hal 163-164
LAMPIRAN 2
Lampiran Pengujian Disolusi
Nama Contoh : Metronidazol
Komposisi : Metronidazol 250 mg
No. Bets : 1010403
No. Reg : GKL 9916906910A1
Exp.Date : Oktober 15
Toleransi (Q) : 85 %
Media Disolusi : HCl 0,1 N
Tipe Alat : Keranjang
Volume : 900 ml
Rpm : 100
Waktu : 60 menit
Bobot Baku (Bb) : 1,120 mg
LAMPIRAN 3
Alat Disolusi Pengkondisian Alat