PEMANFAATAN LIMBAH AIR KELAPA SEBAGAI BAHAN
BAKU PEMBUATAN TABLET NATA DE COCO DENGAN
VARIASI PENAMBAHAN AMILUM MANIHOT
DAN VITAMIN C
SKRIPSI
ERPINA YANTI SIMAMORA
070802010
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
UNIVERSITAS SUMATERA UTARA
PEMANFAATAN LIMBAH AIR KELAPA SEBAGAI BAHAN BAKU PEMBUATAN TABLET NATA DE COCO DENGAN VARIASI
PENAMBAHAN AMILUM MANIHOT DAN VITAMIN C
SKRIPSI
Diajukan untuk melengkapi tugas dan memenuhi syarat mencapai gelar Sarjana Sains
ERPINA YANTI SIMAMORA 070802010
DEPARTEMEN KIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PEMANFAATAN LIMBAH AIR KELAPA
SEBAGAI BAHAN BAKU PEMBUATAN TABLET NATA DE COCO DENGAN VARIASI PENAMBAHAN AMILUM MANIHOT DAN VITAMIN C ALAM (FMIPA) UNIVERSITAS SUMATERA UTARA
Disetujui di
Medan, Agustus 2011
Komisi Pembimbing :
Pembimbing 2 Pembimbing 1
Dra. Emma Zaidar,M.Si Dr. Yuniarti Yusak,M.S NIP.195512181987012001 NIP.
194901271980022001
Diketahui/Disetujui Oleh
Departemen Kimia FMIPA USU Ketua,
PERNYATAAN
PEMANFAATAN LIMBAH AIR KELAPA SEBAGAI BAHAN BAKU PEMBUATAN TABLET NATA DE COCO DENGAN VARIASI
PENAMBAHAN AMILUM MANIHOT DAN VITAMIN C
SKRIPSI
Saya mengikuti skripsi ini adalah hasil kerja saya sendiri, kecuali beberapa kutipan dan ringkasan yang masing-masing disebutkan sumbernya.
Medan, Agustus 2011
PENGHARGAAN
Bismillahirrahmanirrahim…
Syukur alhamdulillah, segala puji penulis ucapkan kehidrat Allah SWT yang telah melimpahkan rahmat dan karunia-Nya sehingga skripsi ini dapat terselesaikan. Dalam hal ini penulis ucapkan terima kasih dan penghargaan kepada:
1. Kedua orang tua tercinta dan tersayang, ayahanda Johan Simamora dan ibunda Duma Sari Sihombing yang dengan doa dan kerja kerasnya telah ikhlas membesarkan, membiayai, dan mendidik penulis agar dapat menjadi manusia yang berguna bagi bangsa dan agama serta bermanfaat bagi orang lain. Kakak, Diana Yanti Simamora, abang, Anwar Arifin Sormin,SH dan adik-adikku, Nelly Sartika Simamora, Darwin Simamora, Sari Devi Simamora, Hema Putri Simamora, Ali Syahrul Simamora, Muhammad Elvin Simamora, serta Sia Sappulan Simamora yang selalu menjadi semangat dan memberi dukungan moril kepada penulis sehingga dapat menyelesaikan skripsi ini.
2. Ibu Dr.Yuniarti Yussak,MS selaku pembimbing I dan Ibu Dra.Emma Zaidar,M.Si selaku pembimbing II, yang telah memberikan arahan, bimbingan, dan dukungan penuh kepada penulis dalam menyelesaikan skripsi ini.
3. Ibu Dr.Rumondang Bulan,MS dan Bapak Drs.Albert Pasaribu,M.Sc selaku Ketua dan Sekretaris Departemen Kimia FMIPA USU yang telah mensahkan skripsi ini.
4. Prof.Dr.Jamaran Kaban M.Sc selaku dosen wali penulis, yang telah banyak membantu selama penulis dalam masa studi untuk program sarjana (S1) di FMIPA USU, Bapak dan Ibu dosen di Departemen Kimia FMIPA USU, yang tak kenal lelah dalam mengajar dan telah banyak memberikan ilmu yang bermanfaat bagi penulis.
5. Sahabat-sahabatku Decy, Oki, Destia, Irma, Fitri, Rifky, Rya, Mariana, Mitha, Apenta, Nurlaila, Ita, Suryani, Reza, Subur, Mukhtar, Tisna, Selvira, kak Kiki, bang Irsan, kak Fitri, kak Nelvi, kak Rani, kak Tiwi, kak Febri, serta rekan-rekan stambuk 2006, 2007, dan 2008 atas dukungan, perhatian, keceriaan dan doa yang diberikan kepada penulis.
6. Kepada teman-teman seperjuangan di Laboratorium Biokimia/KBM FMIPA USU (asisten) : kak Nora, kak Nurmala, kak Fiah, kak Vika, bang Agung, bang Egy, bang Eko, bang Ardy, Decy, Oki, Annisa, Arini, Tiwi, Soraya dan Feri atas dorongan dan ide-ide yang diberikan kepada penulis dalam menyelesaikan skripsi ini.
8. Semua pihak yang tidak bisa disebutkan satu persatu yang telah membantu dan memberikan dukungan kepada penulis dalam menyelesaikan kuliah dan mencapai gelar Sarjana Sains, penulis mengucapkan banyak terima kasih. Semoga Allah SWT akan membahas kebaikan-kebaikan yang telah diberikan kepada penulis, Amin.
Penulis menyadari bahwa skripsi ini masih jauh dari sempurna, oleh karena itu diharapkan kritik san saran yang membangun demi kesempurnaan skripsi ini. Semoga skripsi ini bermanfaat bagi kita semua. Akhirnya kepada Allah SWT jugalah kita berserah diri, semoga Allah SWT selalu menunjukkan jalan yang lurus kepada kita semua.
Medan, Agustus 2011
ABSTRAK
THE USING OF WASTE COCONUT WATER AS THE BASIC MATERIAL TO MAKE TABLET NATA DE COCO WITH VARIATION OF ADDING
AMYLUM MANIHOT AND ASKORBAT ACID
ABSTRACT
DAFTAR ISI
Daftar Lampiran xiii
BAB 1 PENDAHULUAN
BAB 2 TINJAUAN PUSTAKA
2.1Tanaman kelapa 5
2.2Acetobakter 7
2.2.1 Jenis-jenis acetobakter 7
2.2.2 Acetobakter xylinum 7
2.2.3 Sifat-sifat Acetobakter xylinum 10 2.2.4 Faktor-faktor yang mempengaruhi pertumbuhan Acetobakter
Xylinum 11
2.2.5 Aktifitas Acetobakter xylinum pada fermentasi nata 12
2.3Nata de coco 12
2.3.1 Pembuatan nata de coco 13
2.3.2 Fermentasi nata de coco 14
2.4Selulosa 15
2.4.1 Aplikasi nata de coco 15
2.5Vitamin C (Asam Askorbat) 16
2.5.1 Sifat-sifat Vitamin C 17
2.5.2 Manfaat Vitamin C 17
2.5.3 Defisiensi Vitamin C 18
2.5.4 Sumber-sumber Vitamin C 18
2.6Pati 19
2.6.1 Amilosa 19
2.6.2 Amilopektin 19
2.8Tablet 21
2.8.1 Granulasi 21
2.8.2 Pembuatan bahan tablet menggunakan metode granulasi kering 22
2.8.3 Bahan pengikat 23
2.9Spektrofotometri Infra Merah 23
2.9.1 Kegunaan analisis Spektroskopi Infra Merah 23
2.9.2 Syarat-syarat Interpretasi spektrum 24
BAB 3 BAHAN DAN METODE PENELITIAN
3.1 Alat dan bahan 25
3.1.1Alat 25
3.1.2Bahan 26
3.2 Prosedur penelitian 27
3.2.1 Pengambilan Sampel 27
3.2.2 Pembuatan larutan pereaksi 27
3.2.3 Pembuatan starter air kelapa 27
3.2.4 Pembuatan nata de coco 28
3.2.5 Pembuatan serbuk nata de coco 28
3.2.6 Isolasi amilum manihot dari umbi singkong (manihot utilissima) 28 3.2.7 Pembuatan granul dengan metode granulasi kering 28
3.3 Parameter yang diamati 30
3.3.1 Penentuan kadar serat 30
3.3.2 Penentuan kadar vitamin C 31
3.3.3 Penentuan analisis FT-IR 31
3.4 Bagan penelitian 32
3.4.1 Pembuatan starter air kelapa 32
3.4.2 Pembuatan nata de coco 33
3.4.3 Isolasi amilum manihot (pati) dari umbi singkong
(manihot utilissima) 34
3.4.4 Pembuatan serbuk nata de coco 35
3.4.5 Pembuatan tablet nata de coco dengan metode granulasi kering 35
3.4.6 Penentuan kadar serat 36
3.4.7 Penentuan kadar vitamin C 37
BAB 4 HASIL DAN PEMBAHASAN
4.2.1 Pengaruh penambahan vitamin C dan Amilum terhadap kadar serat dari nata de coco 50 4.2.2 Pengaruh penambahan vitamin C dan Amilum terhadap kadar
vitamin C dari nata de coco 50
4.2.3 Karakterisasi Interaksi intermolekular melalui hasil kajian
FT-IT dari tablet nata de coco dengan penambahan vitamin C dan
Amilum 51
BAB 5 KESIMPULAN DAN SARAN
5.1Kesimpulan 52
5.2Saran 53
DAFTAR PUSTAKA 54
DAFTAR GAMBAR
Halaman
Gambar 2.1 Pohon kelapa 5
Gambar 2.2 Tahap-tahap pertumbuhan bakteri Acetobakter xylinum
dalam kondisi normal 8
Gambar 2.3 Nata de coco 13
Gambar 2.4 Struktur Selulosa 15
Gambar 2.5 Struktur Vitamin C 16
Gambar 2.6 Struktur Amilosa 19
Gambar 2.7 Struktur Amilopektin 20
Gambar 4.1 Spektrum FT-IR Amilum manihot 44
Gambar 4.2 Spektrum FT-IR Nata de coco 45
Gambar 4.3 Spektrum FT-IR Vitamin C 46
DAFTAR TABEL
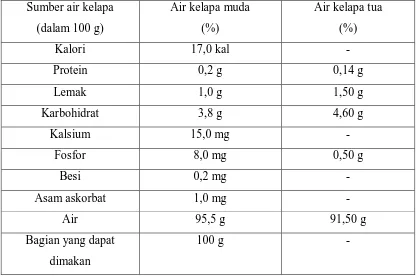
Halaman Tabel 2.1 Perbandingan komposisi air kelapa muda dengan air kelapa tua 6
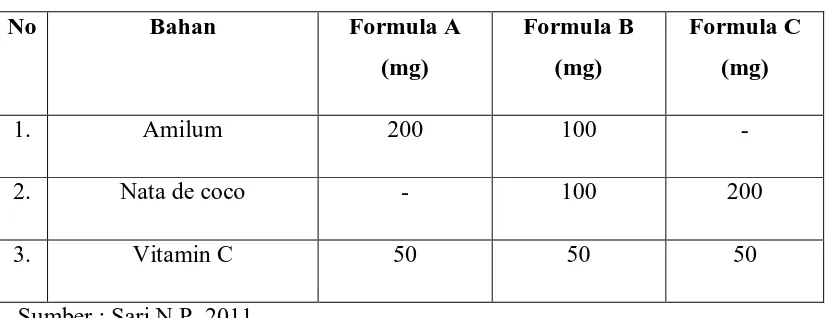
Tabel 3.1 Formulasi Granul 29
Tabel 4.1 Hasil analisa tablet nata de coco dengan penambahan
DAFTAR LAMPIRAN
Halaman Lampiran 1 Spektrum Serapan Infra Merah dari Beberapa Gugus Fungsi
Senyawa 57
ABSTRAK
THE USING OF WASTE COCONUT WATER AS THE BASIC MATERIAL TO MAKE TABLET NATA DE COCO WITH VARIATION OF ADDING
AMYLUM MANIHOT AND ASKORBAT ACID
ABSTRACT
BAB 1
PENDAHULUAN
1.1Latar Belakang
Dari sekian banyak jenis palem, kelapa (cocos nucifera L) merupakan jenis yang paling dikenal dan banyak tersebar di daerah tropis, terutama di daerah dekat pantai. Di Indonesia pemanfaatan air kelapa masih jarang digunakan, banyak yang terbuang percuma sehingga dapat menyebabkan pembentukan asam asetat dalam tanah yang dapat merusak kesuburan tanah dan mengganggu pertumbuhan tumbuhan di sekitarnya. Namun akhir-akhir ini sudah ada upaya untuk mengolah air kelapa menjadi suatu makanan/minuman ringan. Lain halnya dengan Filipina yang sudah memanfaatkan air kelapanya untuk berbagai produk, seperti minuman ringan, jelly, ragi, alkohol, anggur, cuka, etil asetat dan lain-lain (Palungkun, R., 1999).
Air kelapa mengandung air 91,27%, protein 0,29%, lemak 0,15%, karbohidrat 7,27%, serta abu 1,06%. Selain itu, air kelapa mengandung nutrisi seperti sukrosa, dekstrosa, fruktosa serta vitamin B kompleks yang terdiri dari asam nikotinat, asam pantotenat, biotin, riboflavin, dan asam folat. Nutrisi ini sangat berguna untuk pertumbuhan Acetobacter xylinum (Warisno, 2004).
Nata dapat digambarkan sebagai sumber makanan rendah energi untuk keperluan diet karena nilai gizinya sangat rendah. Selain itu nata juga mengandung serat yang sangat dibutuhkan oleh tubuh dalam proses fisiologis sehingga dapat memperlancar pencernaan (Hidayat, N., 2006).
Amilum telah sering digunakan sebagai matriks atau bahan pengisi dalam proses pembuatan bahan tablet. Penggunaan bahan pengisi bertujuan untuk mencukupkan massa agar bahan tablet mudah dicetak menjadi tablet (Anief, M., 1996).
Vitamin C bersifat sangat sensitif terhadap pengaruh-pengaruh luar yang menyebabkan kerusakan seperti suhu, konsentrasi gula dan garam, oksigen, enzim dan lain-lain. Tetapi vitamin C dapat digunakan sebagai antioksidan dalam tubuh, antiinfeksi, antistress, mencegah demam, influenza dan sebagainya (Andarwulan, N., 1992).
Dari penelitian sebelumnya telah dibuktikan bahwa nata dibuat dari limbah-limbah organik dengan menggunakan bakteri Acetobacter Xylinum seperti nata de coco dengan menggunakan limbah air kelapa. Dari penelitian Arry Yanuar (2003) “
Preparasi dan Karakterisasi Selulosa Mikrokristal dari Nata de coco untuk Bahan Pembantu Pembuatan Tablet” , telah dibuktikan bahwa nata de coco dapat dijadikan
1.2Perumusan Masalah
Berdasarkan peranan asam askorbat (vitamin C) di dalam metabolisme tubuh sebagai antioksidan, yang dapat mempengaruhi dan memperbaiki metabolisme tubuh maka permasalahan yang ingin diteliti oleh penulis adalah apakah terjadi intereaksi antara asam askorbat (vitamin C) dan dapat masuk ke dalam Nata de coco di dalam tablet nata de coco sehingga dapat digunakan sebagai zat tambahan makanan atau suplemen.
1.3Pembatasan Masalah
Dalam penelitian ini objek masalah dibatasi sebagai berikut:
1. Pati (amilum) yang diisolasi dari umbi singkong (manihot utilissima) diperoleh dari pajak sore Padang Bulan, Medan
2. Waktu fermentasi pembuatan nata de coco selama 14 hari
3. Pembuatan tablet dengan pencampuran antara pati (amilum manihot), nata de coco dan vitamin C dengan perbandingan untuk formula A ( 4:0:1), formula B (2:2:2), dan formula C (0:4:1) dari masing-masing massa tablet 250 mg
4. Penambahan vitamin C dari pembuatan tablet adalah tetap yaitu 50 mg 5. Parameter yang diamati adalah FT-IR, kadar serat dan kadar vitamin C.
6. Starter bakteri Acetobacter xylinum diperoleh dari hasil pengembangan bakteri
1.4Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah :
1. Untuk mengetahui kadar serat dan vitamin C dari tablet Nata de coco setelah penambahan Amilum manihot dan vitamin C,
2. Untuk mengetahui interaksi fisika yang terjadi antara Nata de coco dengan vitamin C dan pati (amilum manihot) selama pencampuran bahan menjadi tablet melalui FT-IR.
1.5 Manfaat Penelitian
Dari hasil peneltian ini diharapkan dapat mengolah limbah air kelapa menjadi tablet nata de coco dengan variasi penambahan amilum manihot dan vitamin C sebagai zat tambahan makanan atau suplemen.
1.6 Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia / Kimia Bahan Makanan FMIPA
1.7 Metodologi Penelitian
Penelitian ini adalah eksperimental laboratorium, dengan menggunakan sampel berupa limbah air kelapa yang diperoleh dari pedagang kelapa di Pajak Sore Padang Bulan, Medan yang dijadikan sebagai nata de coco. Adapun langkah-langkah analisisnya adalah sebagai berikut:
1. Pembuatan nata de coco difermentasi selama 14 hari hingga terbentuk suatu lapisan putih.
2. Penentuan kadar serat dilakukan dengan metode defatting dan digestion kemudian diabukan dalam tanur pada suhu 600o C
3. Penentuan kadar vitamin C dengan metode Titrimetri
BAB 2
TINJAUAN PUSTAKA
2.1. Tanaman Kelapa
Kelapa merupakan tanaman tropis yang penting bagi negara-negara Asia dan Pasifik. Kelapa disamping dapat memberikan devisa bagi negara juga merupakan mata pencaharian jutaan petani, yang mampu memberikan penghidupan puluhan juta keluarga.
Menurut FAO (Food and Agriculture Organization) pada tahun 1976, negara-negara di Asia dan Pasifik menghasilkan 82% dari produksi kelapa dunia, sedangkan sisanya oleh negara di Afrika dan Amerika Selatan (Suhardiyono L.,1999).
Gambar 2.1. Pohon kelapa
nutrisi yang dibutuhkan bagi pertumbuhan, perkembangbiakan bakteri Acetobacter
xylinum. Untuk Pertumbuhan dan aktivitasnya, Acetobacter xylinum membutuhkan
unsur makro dan mikro. Unsur makro terdiri atas karbon dan nitrogen.
Sebagian dari kebutuhan akan karbon tersebut dapat diperoleh dari dalam air kelapa dalam bentuk karbohidrat sederhana, misalnya sukrosa, glukosa, fruktosa, dan lain-lainnya. Sementara nitrogen juga dapat diperoleh dari protein yang terkandung dalam air kelapa, meskipun dalam jumlah yang kecil.
Air kelapa yang baik adalah yang diperoleh dari kelapa setengah tua, yaitu tidak terlalu tua dan tidak pula terlalu muda. Dalam air kelapa yang terlalu tua, terkandung minyak dari kelapa yang dapat menghambat pertumbuhan bibit nata
Acetobacter xylinum.
Sebaliknya, air kelapa yang masih muda belum mengandung mineral yang cukup di dalamnya, sehingga kurang baik apabila digunakan sebagai bahan pembuatan nata (Pambayun R.,2002).
Tabel 2.1 Perbandingan komposisi air kelapa muda dengan air kelapa tua
Sumber air kelapa
2.2Acetobacter
Acetobacter sp. adalah bakteri yang digunakan untuk membuat cuka. Dalam
pembuatan cuka, gel seperti membran selalu ditemukan pada permukaan larutan. Material ini berkembang menjadi selulosa. Selulosa ini difermentasi oleh bakteri yang dinamakan selulosa bakteri (Philip G.O. dan William P.A.,2000).
2.2.1 Jenis-jenis Acetobacter
Adapun jenis-jenis bakteri Acetobacter adalah sebagai berikut :
a. Acetobacter acetii, ditemukan oleh Beijerinck pada tahun 1898. Bakteri ini
penting dalam produksi asam asetat, yang mengoksidasi alkohol menjadi asam asetat. Banyak terdapat pada ragi tapai, yang menyebabkan tapai yang melewati 2 hari fermentasi akan menjadi berasa masam.
b. Acetobacter xylinum, bakteri ini digunakan dalam pembuatan nata de coco.
Acetobacter xylinum mampu mensintesis selulosa dari gula yang dikonsumsi.
Nata yang dihasilkan berupa pelikel yang mengambang dipermukaan substrat. Bakteri ini juga terdapat pada produk kombucha yaitu fermentasi dari teh (Hidayat,2007).
2.2.2 Acetobacter xylinum
Bakteri pembentuk nata termasuk kedalam golongan Acetobacter, yang mempunyai ciri – ciri antara lain : ”sel bulat panjang sampai batang (seperti kapsul), tidak mempunyai endospora, sel – selnya bersifat gram negatif, bekerja secara aerob tetapi dalam kadar yang kecil (Pelczar dan Chan,1988).
nutrisi-nutrisi berupa sukrosa, fruktosa, dan vitamin B kompleks yang terdiri dari asam nikotinat 0,01 µg, asam patrotenat 0,52 µg, biotin 0,02 µg, riboflavin 0,01 µg, dan asam folat 0,003 µg per ml, nutrisi-nutrisi tersebut merangsang pertumbuhan
Acetobacter xylinum untuk membentuk nata de coco (Moss M.O., 1995).
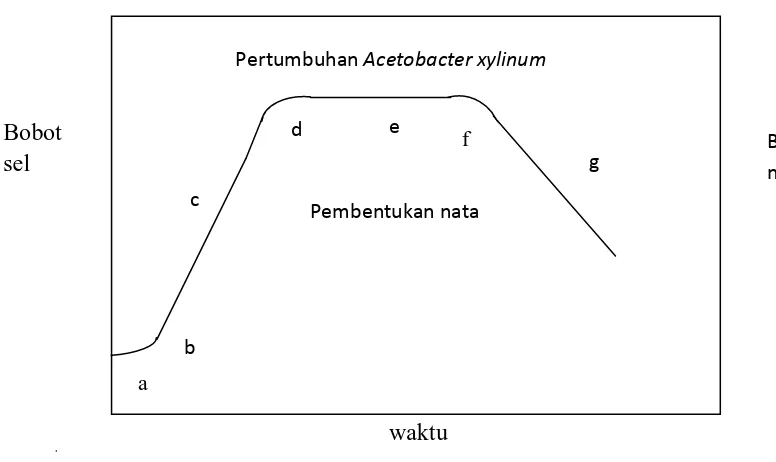
Bakteri Acetobacter xylinum mengalami pertumbuhan sel. Pertumbuhan sel didefinisikan sebagai pertumbuhan secara teratur semua komponen di dalam sel hidup. Bakteri Acetobacter xylinum mengalami beberapa fase pertumbuhan sel yaitu fase adaptasi, fase pertumbuhan awal, fase pertumbuhan eksponensial, fase pertumbuhan lambat, fase pertumbuhan tetap, fase menuju kematian, dan fase kematian. Adapun tahap – tahap pertumbuhan bakteri Acetobacter xylinum dalam kondisi normal dapat dilihat pada gambar 2.2
waktu
Gambar 2.2 Tahap-tahap pertumbuhan bakteri Acetobacter xylinum dalam kondisi normal
Keterangan:
a. Fase adaptasi
Begitu dipindahkan ke media baru, bakteri Acetobacter xylinum tidak langsung tumbuh dan berkembang. Pada fase ini, bakteri akan terlebih dahulu menyesuaikan diri dengan substrat dan kondisi lingkungan barunya. Fase
a Pertumbuhan Acetobacter xylinum
adaptasi bagi Acetobacter xylinum dicapai antara 0 – 24 jam atau ± 1 hari sejak inokulasi.
b. Fase pertumbuhan awal
Pada fase ini, sel mulai membelah dengan kecepatan rendah. Fase ini menandai diawalinya fase pertumbuhan eksponensial. Fase ini dilalui dalam beberapa jam.
c. Fase pertumbuhan eksponensial
Fase ini disebut juga sebagai fase pertumbuhan logaritmik, yang ditandai dengan pertumbuhan yang sangat cepat. Untuk bakteri Acetobacter xylinum, fase ini dicapai dalam waktu antara 1- 5 hari tergantung pada kondisi lingkungan. Pada fase ini juga, bakteri mengeluarkan enzim ekstraseluler polimerase sebanyak – banyaknya, untuk menyusun polimer glukosa menjadi selulosa.
d. Fase pertumbuhan diperlambat
Pada fase ini, terjadi pertumbuhan yang diperlambat karena ketersediaan nutrisi yang telah berkurang, terdapatnya metabolit yang bersifat toksik yang dapat menghambat pertumbuhan bakteri, dan umur sel yang telah tua.
e. Fase stasioner
Pada fase ini, jumlah sel yang tumbuh relatif sama dengan jumlah sel yang mati. Penyebabnya adalah di dalam media terjadi kekurangan nutrisi, pengaruh metabolit toksik lebih besar, dan umur sel semakin tua. Namun pada fase ini, sel akan lebih tahan terhadap kondisi lingkungan yang ekstrim jika dibandingkan dengan ketahanannya pada fase lain. Matrik nata lebih banyak diproduksi pada fase ini.
f. Fase menuju kematian
g. Fase kematian
Pada fase ini, sel dengan cepat mengalami kematian, dan hampir merupakan kebalikan dari dase logaritmik. Sel mengalami lisis dan melepaskan komponen yang terdapat di dalamnya (Nurwantoro,1977).
2.2.3. Sifat-sifat Acetobacter xylinum
1. Sifat Morfologi
Acetobacter xylinum merupakan bakteri berbentuk batang pendek, yang mempunyai
panjang 2 mikron dan lebar 0,6 mikron, dengan permukaan dinding yang berlendir. Bakteri ini bisa membentuk rantai pendek dengan satuan 6 – 8 sel.
Bakteri ini tidak membentuk endospora maupun pigmen. Pada kultur sel yang masih muda, individu sel berada sendiri-sendiri dan transparan. Koloni yang sudah tua membentuk lapisan menyerupai gelatin yang kokoh menutupi sel dan koloninya. Pertumbuhan koloni pada medium cair setelah 48 jam inokulasi akan membentuk lapisan pelikel dan dapat dengan mudah diambil dengan jarum ose.
2. Sifat Fisiologi
2.2.4 Faktor-faktor yang mempengaruhi pertumbuhan Acetobacter xylinum
Adapun beberapa faktor yang berkaitan dengan kondisi nutrisi, adalah sebagai berikut: a. Sumber karbon
Sumber karbon yang dapat digunakan dalam fermentasi nata adalah senyawa karbohidrat yang tergolong monosakarida dan disakarida. Sementara yang paling banyak digunakan berdasarkan pertimbangan ekonomis, adalah sukrosa atau gula pasir.
b. Sumber nitrogen
Sumber nitrogen bisa digunakan dari senyawa organik maupun anorganik. Bahan yang baik bagi pertumbuhan Acetobacter xylinum dan pembentukan nata adalah ekstrak yeast dan kasein. Namun, amonium sulfat dan amonium fosfat (di pasar dikenal dengan ZA) merupakan bahan yang lebih cocok digunakan dari sudut pandang ekonomi dan kualitas nata yang dihasilkan. Banyak sumber N lain yang dapat digunakan dan murah seperti urea.
c. Tingkat keasaman (pH)
Meskipun bisa tumbuh pada kisaran pH 3,5 – 7,5 , bakteri Acetobacter xylinum sangat cocok tumbuh pada suasana asam (pH 4,3). Jika kondisi lingkungan dalam suasana basa, bakteri ini akan mengalami gangguan metabolisme selnya.
d. Temperatur
e. Udara (oksigen)
Bakteri Acetobacter xylinum merupakan mikroba aerobik. Dalam pertumbuhan, perkembangan, dan aktivitasnya, bakteri ini sangat memerlukan oksigen. Bila kekurangan oksigen, bakteri ini akan mengalami gangguan dalam pertumbuhannya dan bahkan akan segera mengalami kematian. Oleh sebab itu, wadah yang digunakan untuk fermentasi nata de coco, tidak boleh ditutup rapat. Untuk mencukupi kebutuhan oksigen, pada ruang fermentasi nata harus tersedia cukup ventilasi.
2.2.5 Aktifitas Acetobacter xylinum pada fermentasi nata
Apabila ditumbuhkan dalam media yang kaya akan sukrosa (gula pasir), bakteri ini akan memecah sukrosa menjadi glukosa dan fruktosa. Senyawa – senyawa glukosa dan fruktosa tersebut baru dikonsumsi sebagai bahan bagi metabolisme sel.
Berdasarkan pada pengamatan morfologi, pembentukan nata oleh bakteri
Acetobacter xylinum diawali dengan pembentukan lembaran benang – benang
selulosa. Pembentukan benang tersebut, pada mulanya tampak seperti flagel (cambuk pada bakteri umumnya).
Selanjutnya, bakteri Acetobacter xylinum membentuk mikrofibril selulosa di sekitar permukaan tubuhnya hingga membentuk serabut selulosa yang sangat banyak dan dapat mencapai ketebalan tertentu. Pada akhirnya, susunan selulosa tersebut akan tampak seperti lembaran putih transparan dengan permukaan licin dan halus, yang disebut nata.
2.3. Nata de coco
Nata berasal dari Spanyol yang berarti krim (cream). Jadi nata de coco adalah krim yang berasal dari kelapa. Krim ini dibentuk oleh mikroorganisme Acetobacter xylinum melalui proses fermentasi. Mikroorganisme ini membentuk gel pada permukaan larutan yang mengandung gula (Palungkun,R.,1999).
media fermentasi dari air kelapa. Nata de coco dibuat dengan memanfaatkan air kelapa untuk difermentasikan secara aerob dengan bantuan mikroba (Hidayat, 2006).
Gambar 2.3 Nata de coco
Nata de coco adalah bahan padat seperti agar-agar tapi lebih kenyal, atau seperti kolang-kaling, tetapi lembek, berwarna putih transparan. Sejenis makanan penyegar atau pencuci mulut yang umumnya dikonsumsi sebagai makanan ringan
2.3.1. Pembuatan Nata de coco
Beberapa tahap kegiatan dalam pembuatan nata adalah sebagai berikut : 1. Preparasi
Tahap preparasi terdiri atas beberapa kegiatan sebagai berikut: a. Penyaringan
Penyaringan bertujuan untuk memisahkan kotoran-kotoran atau benda-benda asing yang tercampur dengan air kelapa, seperti misalnya sisa sabut. Penyaringan yang lebih baik apabila dilakukan dengan menggunakan kain penyaring.
b. Penambahan gula pasir dan urea
Ketersediaan karbohidrat dan protein yang terdapat dalam air kelapa belum mencukupi kebutuhan untuk pembentukan nata, kedalam air kelapa tersebut perlu ditambahkan gula pasir 10% dan urea 0,5%.
nitrogen organik seperti misalnya protein, maupun nitrogen anorganik seperti misalnya ammonium fosfat, ammonium sulfat, dan urea.
c. Perebusan
Perebusan dilakukan sampai mendidih dan dipertahankan selama 5 – 10 menit untuk meyakinkan bahwa mikroba kontaminan telah mati, dan juga menyempurnakan pelarutan gula pasir yang ditambahkan.
d. Penambahan cuka
Tujuan penambahan cuka/asam asetat adalah untuk menurunkan pH air kelapa dari sekitar 6,5 sampai mencapai pH 4,3. Kondisi pH 4,3 merupakan kondisi optimal bagi pertumbuhan Acetobacter xylinum.
e. Pendinginan
Pendinginan paling baik dilakukan dengan cara membiarkan cairan dalam nampan selama satu malam. Hal ini sekaligus untuk mengecek ada tidaknya kontaminan yang tumbuh pada cairan.
2. Inokulasi, fermentasi, dan pengendaliannya a. Pemberian bibit (inokulasi)
Pemberian bibit dilakukan apabila campuran air kelapa, urea, dan asam asetat/cuka telah benar-benar dingin. Bila pemberian bibit dilakukan pada waktu cairan air kelapa masih dalam keadaan panas atau hangat, maka bibit nata dapat mengalami kematian, sehingga proses fermentasi tidak bisa berlangsung.
b. Fermentasi atau pemeraman
Campuran air kelapa yang sudah diberi bibit, dibiarkan selama 14 hari agar terjadi proses fermentasi dan terbentuklah nata de coco (Pambayun R.,2002).
2.3.2 Fermentasi nata de coco
sifat bahan pangan, sebagai akibat dari pemecahan kandungan-kandungan bahan pangan tersebut. Hasil-hasil fermentasi terutama tergantung pada jenis bahan pangan (substrat), macam mikroba dan kondisi di sekelilingnya yang mempengaruhi pertumbuhan dan metabolisme mikroba ( Winarno F.G.,1992 ).
2.4 Selulosa
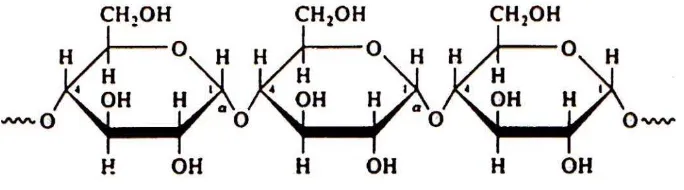
Selulosa adalah senyawa seperti serabut, liat, tidak larut dalam air, dan ditemukan di dalam dinding sel pelindung tumbuhan, terutama pada tangkai, batang, dahan, dan semua bagian berkayu dari jaringan tumbuhan. Selulosa membentuk komponen serat dari dinding sel tumbuhan. Molekul selulosa merupakan rantai – rantai atau mikrofibril dari D–glukosa sampai sebanyak 14000 satuan yang terdapat sebagai berkas-berkas terpuntir mirip tali yang terikat satu sama lain oleh ikatan hidrogen (Fessenden J.R.,1986).
Gambar 2.4 Struktur selulosa
Sistem pencernaan manusia mengandung enzim yang dapat mengkatalisis hidrolisis ikatan α-glikosidik, tetapi tidak mengandung enzim yang diperlukan untuk menghidrolisis ikatan β-glikosidik (Hart H.,2003).
2.4.1 Aplikasi Nata de coco
Salah satu cara yang digunakan dalam proses cetak langsung tablet adalah mikrokristal selulosa, karena mempunyai daya ikat tablet yang sangat baik dan waktu hancur tablet relatif singkat. Mikrokristalin yang beredar di pasaran adalah produk impor yang mahal, sehingga berakibat pada mahalnya harga produk tablet yang dihasilkan. Mikrokristalin selulosa adalah hasil olahan dari selulosa alami yang dapat diperoleh dari berbagai sumber baik dari tumbuhan atau hasil fermentasi. Nata de coco merupakan sumber selulosa yang diproduksi sebagai hasil fermentasi Acetobacter
xylinum dalam substrat air kelapa. Untuk menghasilkan mikrokristal selulosa dengan
harga murah, maka dilakukan pemanfaatan nata de coco menjadi mikrokristal selulosa untuk pembuatan tablet (Yanuar A.,2003).
b. Aplikasi dalam makanan
Penambahan Nata de coco dalam jumlah yang sedikit akan memberikan dispersi dan stabilisasi emulsi makanan yang baik. Nata de coco dapat berfungsi demikian karena struktur tiga dimensi dari serat selulosa dan kestabilan terhadap perlakuan fisika dan kimia, seperti ketahanan terhadap panas, asam, dan garam. Karakteristik-karakteristik dari Nata de coco ini dapat diaplikasikan pada makanan sebagai stabilisasi dari bahan pengental, dispersi, suspensi, dan emulsi. Adapun aplikasi selulosa bakteri dalam makanan yaitu pada penggunaan minuman, sebagai makanan pencuci mulut, dan pada saus.
2.5 Vitamin C (Asam Askorbat)
Gambar 2.5 Struktur Vitamin C
Keadaan vitamin C inaktif sering terjadi pada proses pemanasan (bila sayur-sayuran dimasak), dalam suasana asam vitamin ini lebih stabil daripada dalam basa (Prawirokusumo, S., 1991).
2.5.1 Sifat – Sifat Umum Vitamin C
Vitamin C yang mempunyai rumus empiris C6H8O6 dalam bentuk murni merupakan Kristal putih, tidak berwarna, tidak berbau dan mencair pada suhu 190-1920 C. Senyawa ini bersifat reduktor kuat dan mempunyai rasa asam. Vitamin C sangat mudah larut dalam air, sedikit larut dalam alkohol dan tidak larut dalam benzene, eter, khloroform, minyak dan sejenisnya. Walaupun vitamin C stabil dalam bentuk Kristal, tetapi mudah rusak atau terdegradasi jika berada dalam bentuk larutan, terutama jika terdapat udara, logam-logam seperti Cu dan Fe dan cahaya. Sifat utama dari vitamin C adalah kemampuan mereduksinya yang kuat dan mudah teroksidasi yang dikatalis oleh beberapa logam, terutama Cu dan Ag (Andarwulan, N., 1992).
2.5.2 Manfaat Vitamin C
askorbat membantu absorpsi zat besi dalam usus (Gaman, M., & Sherrington K.B., 1981).
2.5.3 Defisiensi Vitamin C
Beberapa akibat dari kekurangan konsumsi vitamin C : 1. Skorbut, pendarahan gusi, kulit mengelupas.
2. Mudah terjadi luka dan infeksi tubuh, dan kalau sudah terjadi sukar disembuhkan.
3. Hambatan pertumbuhan pada bayi dan anak-anak.
Skorbut dalam bentuk berat sekarang jarang terjadi karena sudah diketahui cara mencegah dan mengobatinya. Tanda-tanda awal antara lain lelah, lemah, nafas pendek, kejang otot, tulang otot persendian sakit serta kurang nafsu makan, kulit menjadi kering , kasar dan gatal, warna merah kebiruan di bawah kulit, perdarahan gusi, kedudukan gigi menjadi longgar, mulut dan mata kering dan rambut rontok. Di samping itu luka sukar sembuh, terjadi anemia, kadang-kadang jumlah sel darah putih menurun, serta depresi dan timbul gangguan saraf. Gangguan saraf dapat terjadi berupa histeria, depresi diikuti oleh gangguan psikomotor. Gejala skorbut terlihat bila taraf asam askorbat dalam serum turun di bawah 0,20 mg/dl (Almatsier, S., 2001).
2.5.4 Sumber-Sumber Vitamin C
Vitamin C pada umumnya hanya terdapat di dalam pangan nabati, yaitu sayur dan buah terutama yang asam, seperti jeruk, nenas, rambutan, pepaya, gandaria, dan tomat. Vitamin C juga banyak terdapat di dalam sayuran daun-daunan dan jenis kol (Almatsier, S., 2001).
Sedangkan WHO menganjurkan konsumsi vitamin C 45 mg sehari. Batas tertinggi konsumsi vitamin C yang masih bisa ditoleransi oleh tubuh menurut National
Academy of Science adalah 2000 m
2.6 Pati
Pati merupakan cadangan makanan dari sel tanaman. Pati merupakan sumber terpenting pada bahan makanan manusia berupa karbohidrat. Beberapa makanan pokok manusia (seperti kentang, beras, jagung, dan gandum) mengandung pati. Polisakarida yang terkandung di dalam pati yaitu amilosa dan amilopektin.
2.6.1 Amilosa
Amilosa memiliki struktur rantai panjang yang tidak bercabang yang tersusun atas monomer glukosa dengan ikatan α (1,4) glikosida. Molekul amilum yang mengandung ribuan gugus glukosa memiliki berat molekul dari 150.000 hingga 600.000. Struktur rantai polimer amilum lurus dan rapat, sehingga amilum dapat disimpan lama. Adanya enam unit glukosa perputaran heliks menyebabkan amilosa berbentuk tabung dan kompleks. Hal ini disebabkan bermacam molekul kecil dapat masuk ke dalam kumparannya. Bukti pembentukan kompleks tersebut adalah warna biru tua yang dihasilkan oleh pati bila ditambahkan iod (Fessenden, R.J. & Fessenden J.S., 1992).
Struktur amilosa dapat dilihat pada gambar di bawah ini :
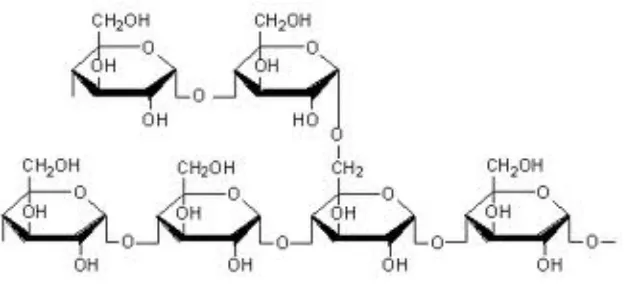
2.6.2. Amilopektin
Amilopektin, suatu polisakarida yang jauh lebih besar daripada amilosa, mengandung 1000 satuan glukosa atau lebih per molekul. Rantai utama dalam amilopektin mengandung 1,4-α-D-glukosa. Amilopektin memiliki percabangan, sehingga terdapat satu glukosa ujung untuk kira – kira tiap 25 satuan glukosa. Ikatan pada titik percabangan ialah ikatan 1,6-α-glikosida.
Gambar 2.6.2 Struktur Amilopektin
Pati dalam jaringan tanaman berbentuk granul (butir) yang berbeda – beda. Dengan mikroskop, jenis pati dapat dibedakan karena mempunyai bentuk, ukuran, letak hilum yang unik dan juga dapat merefleksikan cahaya terpolarisasi (Wurzburg, 1986).
2.7 Serat
Para ilmuwan mengungkapkan bahwa serat-serat yang terdapat dalam bahan pangan yang tidak tercerna mempunyai sifat positif bagi gizi dan metabolisme. Nama atau istilah yang digunakan untuk serat tersebut adalah dietary fiber.
dan nonkarbohidrat seperti polimer lignin. Karena itu dietary fiber pada umumnya merupakan karbohidrat atau polisakarida. Berbagai jenis makanan nabati pada umumnya banyak mengandung dietary fiber.
Walaupun demikian serat kasar tidaklah identik dengan dietary fiber. Menurut Scala (1975) kira-kira hanya seperlima sampai setengah dari seluruh serat kasar yang benar-benar berfungsi sebagai dietary fiber (Winarno,F.G., 1992).
2.8 Tablet
Tablet adalah sediaan padat, dibuat secara kempa - cetak, berbentuk rata atau cembung rangkap, umumnya bulat, mengandung satu jenis obat atau lebih dengan atau tanpa zat tambahan. Untuk membuat tablet diperlukan zat tambahan berupa :
1. Bahan pengisi : ditambahkan untuk memperbesar volume tablet, biasanya digunakan Saccharum Lactis, Amylum Manihot, dan zat lain yang cocok.
2. Bahan pengikat : ditambahkan agar tablet tidak pecah atau retak dan dapat merekat, biasanya yang digunakan adalah Amylum Manihot.
Dalam pembuatan tablet, zat berkhasiat, zat-zat lain, kecuali zat pelicin dibuat granul (butiran kasar), karena serbuk yang halus tidak mengisi cetakan tablet dengan baik, maka dibuat granul agar mudah mengalir mengisi cetakan serta menjaga agar tablet tidak retak. Cara membuat granul ada 2 macam, yaitu cara basah dan cara kering (Anief, M., 1996).
2.8.1 Granulasi
Tujuan granulasi dalam manufaktur tablet :
1. Meningkatkan sifat aliran yang berarti uniformitas massa dari sediaan/dosis. 2. Mencegah pemisahan komponen campuran.
3. Meningkatkan karakteristik dari campuran.
2.8.2 Pembuatan Bahan Tablet Menggunakan Metode Granulasi Kering
Pada granulasi kering, partikel serbuk membentuk agregat karena tekanan tinggi. Semua partikel partikulat dapat membentuk agregasi jika dikempa pada tekanan tinggi. Tekanan tinggi berfungsi untuk meningkatkan daerah kontak antar permukaan dengan kekuatan secara menyeluruh. Dalam beberapa hal, ikatan cukup kuat tidak dapat terbentuk jika hanya tekanan saja, perlu ditambahkan bahan pengikat pada saat pencampuran serbuk. Pengikat polimer membentuk jembatan sangat kental antarpartikel dan berkontribusi pada kekuatan kompak. Granulasi kering tidak menggunakan panas atau air, dapat diaplikasikan terhadap bahan peka panas dan air. Dalam farmasi granulasi kering yang diaplikasikan adalah slugging dan roller
compaction, yaitu:
a. Slugging
Slugging adalah kompresi serbuk kering menggunakan mesin tablet single atau rotary. Ukuran tablet slugging lebih besar dari tablet biasa. Slugging ini dipengaruhi oleh sifat bahan, seperti kohesivitas, bobot jenis, distribusi ukuran, dan karakteristik mesin cetak tablet, seperti tipe dan kapasitas mesin, diameter lumping (DIE), ketinggian isi, kecepatan pencetakan, tekanan slugging.
b. Roller Compaction
Prinsip tekanan roller
Sifat serbuk kompresi dipengaruhi oleh bobot jenis bahan dan kecepatan pemberian /pemasukan bahan. Untuk menjaga bobot jenis konstan, dilakukan deaserasi serbuk yang akan dikompresi. Dengan variabel kecepatan feed dan
screw feeder diatur pemberian bahan ke dalam ruang antara roller
(Agoes,G.,2008).
2.8.3 Bahan Pengikat
Merupakan bahan yang mempunyai sifat kohesif dan adhesif yang mampu mengaglomerasi partikel serbuk kering membentuk granul sesudah pengeringan. Ditambahkan pada campuran serbuk setelah dilarutkan dalam cairan penggranul.
Kadar tinggi pengikat, terutama turunan selulosa dapat menimbulkan masalah disintegrasi dan disolusi tablet karena membentuk lapisan musilago di sekitar permukaan partikel. Pada obat yang bersifat hidrofob, pengikat dapat mempercepat disolusi (Agoes, G., 2008).
2.9 Spektrofotometri Infra Merah
2.9.1 Kegunaan Analisa Spektroskopi Infra Merah
Spektrofotometer infra merah pada umumnya digunakan untuk : 1. Menentukan gugus fungsi suatu senyawa organik.
2. Mengetahui informasi struktur suatu senyawa organik dengan membandingkan daerah sidik jarinya.
Pengukuran pada spektrum infra merah dilakukan pada daerah cahaya infra merah tengah (mid-infrared) yaitu pada panjang gelombang 2,5 - 50 μm atau bilangan gelombang 4000 - 200 cm-1. Energi yang dihasilkan oleh radiasi ini akan menyebabkan vibrasi atau getaran pada molekul. Pita absorpsi infra merah sangat khas dan spesifik untuk setiap tipe ikatan kimia atau gugus fungsi.
Spektrum yang dihasilkan berupa grafik yang menunjukkan persentase transmitan yang bervariasi pada setiap frekuensi radiasi infra merah.
2.9.2 Syarat – Syarat Interpretasi Spektrum
Tidak ada aturan yang pasti dalam menginterpretasikan spektrum IR. Tetapi beberapa syarat harus dipenuhi dalam menginterpretasikan spektrum :
1. Spektrum harus tajam dan jelas serta memiliki intensitas yang tepat. 2. Spektrum harus berasal dari senyawa yang murni.
3. Spektrofotometer harus dikalibrasi sehingga akan menghasilkan pita atau serapan pada bilangan gelombang yang tepat.
4. Metode penyiapan sampel harus dinyatakan. Jika digunakan pelarut maka jenis pelarut, konsentrasi dan tebal sel harus diketahui.
BAB 3
METODE PENELITIAN
3.1 Alat dan Bahan
3.1.1 Alat
- Gelas beaker 250 ml Pyrex
- Gelas ukur 1000 ml, 10 ml Pyrex
- Gelas erlenmeyer 250 ml, 500 ml Pyrex
- Pipet volum 50 ml Pyrex
- Labu alas 500 ml Pyrex
- Labu takar 100 ml Pyrex
- Indikator universal
- Oven Gallenkamp
- Hot plate Gallenkamp
- Kertas saring Whatman 41
- Soxhlet
- Cawan porselen - Desikator
- Furnace Fisher
- Neraca analisis - Statif dan klem
- Freze drier Edward
3.1.2 Bahan
- Air kelapa
- Pati p.a E.Merck
- Starter Acetobacter xylinum - Gula pasir
- Urea p.a E.Merck
- CH3COOH(l) teknis
- H2SO4(p) p.a E.Merck
- NaOH(s) p.a E.Merck
- N-Heksan p.a E.Merck
- Alkohol 96% p.a E.Merck
- Akuades
- Asam Asetat glasial p.a E.Merk
- HPO3 teknis E.Merk
- NaHCO3 p.a E.Merk
- 2,6 dikloroindophenol p.a E.Merk
3.2 Prosedur penelitian
3.2.1 Pengambilan Sampel
Sampel limbah air kelapa diperoleh dari Pajak Sore Padang Bulan Medan. Tanaman kelapa dengan spesies Cocos Nucifera L.
3.2.2 Pembuatan larutan pereaksi
3.2.2.1 Pembuatan larutan NaOH 3,25%
Ditimbang 8,13 g NaOH(s), kemudian dilarutkan 8,13 g NaOH(s) dengan akuades di dalam labu takar 250 ml, dan diencerkan hingga garis tanda.
3.2.2.2 Pembuatan H2SO4 1,25%
Dipipet 3,13 ml larutan H2SO4(p), kemudian dimasukkan ke dalam labu takar 250 ml, diencerkan dengan akuades sampai garis tanda.
3.2.2.3 Pembuatan HPO3-Asam asetat
Sebanyak 15 gram meta-phospat (HPO3 glasial) dilarutkan dalam 40 ml asam asetat dan 200 ml akuades dengan digojog kuat-kuat. Kemudian diencerkan sampai 500 ml dan disaring dengan kertas saring. Penyimpanan dalam botol gelap tertutup dan dalam refrigator.
3.2.2.4 Pembuatan Larutan Standart 2,6 D
Dilarutkan 50 mg 2,6 dikloroindophenol dalam 50 ml akuades yang telah ditambahkan 42 mg NaHCO3. Setelah larut semua diencerkan menjadi 200 ml dengan akuades. Kemudain disaring dan disimpan dalam botol gelap dan tertutup dalam refrigator.
3.2.3 Pembuatan starter air kelapa
ml. Difermentasikan selama 14 hari dalam ruangan pada suhu kamar 28-30oC hingga terbentuk lapisan putih diatasnya.
3.2.4 Pembuatan nata de coco
Air kelapa 800 ml disaring dengan menggunakan kain kasa, dimasukkan kedalam gelas beaker. Dipanaskan hingga mendidih. Kemudian ditambahkan urea 4 ml, gula 80 ml, diaduk sambil dipanaskan hingga urea dan gula larut. Ditambahkan asam cuka ketika larutan dingin, hingga larutan mempunyai pH 4. Dimasukkan kedalam wadah yang telah di sterilisasi. Diinokulasi dengan starter Acetobacter xylinum sebanyak 80 ml. Difermentasikan selama 14 hari dalam ruangan pada suhu kamar 28-30oC hingga terbentuk lapisan putih diatasnya.
3.2.5 Pembuatan Serbuk Nata de coco
Nata de coco dihaluskan dengan menggunakan blender, kemudian dikeringkan dalam freze drier pada suhu -40oC. Kemudian dihaluskan lagi dengan menggunakan blender kering sampai benar-benar halus.
3.2.6 Isolasi Amilum dari Umbi Singkong (Manihot Utilissima)
Dikupas kulit umbi lalu dicuci bersih, kemudian dipotong kecil-kecil. Ditimbang sebanyak 100 g lalu dihaluskan dengan blender dan ditambahkan 200 ml akuades. Di saring, kemudian ditampung larutan keruh dalam gelas beaker. Ditambahkan 20 ml akuades lalu diaduk dan dibiarkan mengendap kemudian didekantasi. Ditambahkan 200 ml akuades, lalu diaduk dan dibiarkan mengendap lalu didekantasi. Ditambahkan 100 ml alkohol 96% sambil diaduk, disaring dengan kertas saring biasa dan dikeringkan amilum yang dihasilkan.
3.2.7 Pembuatan Granul Dengan Metode Granulasi Kering
Tabel 3.1 Formulasi Granul
Berat toeritis tiap formulasi adalah 250 mg, dengan perbandingan amilum : nata de coco : Vitamin C masing-masing formulasi adalah:
3.3 Parameter yang diamati
3.3.1 Penentuan kadar serat
Nata de coco ditimbang sebanyak 1-2 g, kemudian dihilangkan lemaknya dengan n-heksan menggunakan alat sokletasi selama 2 jam. Dikeringkan dan dimasukkan kedalam gelas erlenmeyer 500 ml. Ditambahkan 50 ml larutan H2SO4 1,25%, kemudian didihkan selama 30 menit dengan menggunakan beaker gelas 250 ml, dan disaring. Tambahkan 50 ml NaOH 3,25% dan didihkan lagi selama 30 menit. Dalam keadaan panas, saring dengan corong yang berisi kertas saring whatman No. 42 yang telah diketahui bobotnya. Cuci endapan yang terdapat pada kertas saring berturut-turut dengan H2SO4 1,25% panas, akuades panas, dan etanol 96%. Dimasukkan ke dalam cawan chrusibel yang telah diketahui beratnya. Dikeringkan di dalam oven pada suhu 1050C. Didinginkan dalam desikator dan ditimbang hingga bobot konstan. Kemudian diabukan dalam tanur, didinginkan dalam desikator dan ditimbang sampai berat konstan. Dihitung kadar seratnya.
Kadar serat = x 100%
3.3.2 Penentuan vitamin C
Timbang 100 mg bahan dan hancurkan kemudian dimasukkan ke dalam labu takar tambahkan 100 ml dan diencerkan dengan HPO3-asam asetat hingga garis tanda. Dihomogenkan sampai merata dan saring melalui kertas saring biasa. Dipipet 10 ml dengan menggunakan pipet volume dan dimasukkan ke dalam gelas Erlenmeyer 50 ml kemudian dititrasi dengan 2,6 D sampai terbentuk warna merah lembayung. Diulangi titrasi sebanyak 3 kali. Dan dilakukan juga titrasi untuk larutan blanko. Sehingga diperoleh kadar vitamin C:
3.3.3 Penentuan FT-IR
3.4 Bagan Penelitian
3.4.1 Pembuatan Starter Air Kelapa
500 ml air kelapa Disaring
Residu/kotoran Filtrat
Ditambahkan 50 ml gula pasir Ditambahkan 2,5 ml urea
Dipanaskan sambil diaduk hingga larut
Larutan asam bergula
Dituangkan dalam wadah fermentasi yang telah disterilkan dalam keadaan panas
Didinginkan
Ditambahkan CH3COOH(l) 25% hingga pH 4
Ditambahkan 50 ml starter
Acetobacter Xylinum
Diinkubasi pada suhu kamar 28-30oC selama ± 14 hari
3.4.2 Pembuatan Nata de coco
800 ml air kelapa
Disaring
Filtrat Residu/kotoran
Ditambahkan 80 ml gula pasir
Ditambahkan 4 ml urea Dipanaskan sambil diaduk hingga larut
Larutan asam bergula
Dituangkan ke dalam wadah fermentasi yang telah disterilkan dalam keadaaan panas
Didinginkan
Ditambahkan CH3COOH(l) 25% hingga pH 4
Ditambahkan 80 ml starter
Acetobakter Xylinum
Diinkubasi pada suhu kamar 28-30oC selama ± 14 hari
3.4.3 Isolasi Amilum (pati) dari umbi singkong (Manihot Utilissima)
Umbi Singkong
Dikupas kulitnya dan dicuci bersih
Ditimbang 100 g dan dipotong kecil-kecil Ditambahkan 200 ml akuades lalu
diblender selama ± 30 detik. Disaring
Larutan keruh Ampas
Ditambahkan 20 ml akuades Diaduk dan dibiarkan mengendap Didekantasi
Ditambahkan 200 ml akuades Diaduk dan dibiarkan mengendap Didekantasi
Filtrat Endapan putih
Filtrat Endapan putih
Ditambahkan 100 ml alkohol 96% Diaduk
Disaring
Endapan putih Filtrat
Amylum manihot
3.4.4 Pembuatan serbuk nata de coco
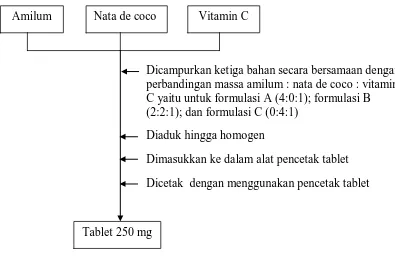
3.4.5 Pembuatan tablet nata de coco dengan penambahan vitamin C dan amilum
(pati)
Nata de coco
Dihaluskan dengan menggunakan blender Dikeringkan dalam freze drier pada suhu -40oC Dihaluskan dengan blender kering
Serbuk nata de coco
Amilum Nata de coco Vitamin C
Dicampurkan ketiga bahan secara bersamaan dengan perbandingan massa amilum : nata de coco : vitamin C yaitu untuk formulasi A (4:0:1); formulasi B (2:2:1); dan formulasi C (0:4:1)
Diaduk hingga homogen
Dimasukkan ke dalam alat pencetak tablet Dicetak dengan menggunakan pencetak tablet
3.4.6 Penentuan kadar serat dari tablet dengan metode Defatting dan Digestion
Dihilangkan kandungan lemaknya dengan n-heksan menggunakan alat soklet selama 2 jam Dikeringkan
Ditambahkan 50 ml H2SO4 1,25 % dan didihkan selama 30 menit
Disaring
Ditambahkan 50 ml NaOH 3,25 % dan didihkan selama 30 menit
Disaring dengan kertas saring biasa
residu filtrat
Dicuci dengan H2SO4 1,25 % yang telah dipanaskan Dicuci dengan akuades panas
Dicuci dengan etanol 96 %
Dimasukkan ke dalam cawan chrusibel yang telah diketahui beratnya Dikeringkan dalam oven pada suhu 105o C
Didinginkan dalam desikator Ditimbang sampai berat konstan
Diabukan dalam tanur pada suhu 600o C Didinginkan dalam desikator
Ditimbang sampai berat konstan Dihitung kadar seratnya
Hasil
3.4.7 Penentuan Kadar Vitamin C dari tablet dengan metode Titrimetri
100 mg sampel
Dihaluskan
Dimasukkan ke dalam labu takar 100 ml dan diencerkan dengan HPO3-asam asetat hingga garis tanda
Dihomogenkan
Dipipet 10 ml dengan menggunakan pipet volum Dimasukkan ke dalam gelas Erlenmeyer
Dititrasi dengan larutan standard 2,6 D hingga terjadi perubahan warna menjadi merah lembayung
Dicatat volume larutan 2,6 D yang terpakai dan dilakukan titrasi untuk larutan blanko
BAB 4
HASIL DAN PEMBAHASAN
4.1 Hasil Penelitian
Dari hasil penelitian tablet Nata de coco seperti pada lampiran 2 yang dilakukan, diperoleh hasil kadar serat dan kadar vitamin C dari masing-masing formula tablet yang dapat dilihat dalam tabel 4.1 sebagai berikut ini:
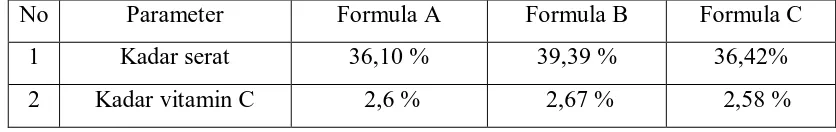
Tabel 4:1 Hasil Analisa tablet nata de coco dengan penambahan Vitamin C dan Amilum manihot
No Parameter Formula A Formula B Formula C
1 Kadar serat 36,10 % 39,39 % 36,42%
2 Kadar vitamin C 2,6 % 2,67 % 2,58 %
4.1.1 Perhitungan kadar serat
Penentuan kadar serat pada tablet formula A (Amilum-Vitamin C) dapat dihitung dengan cara sebagai berikut:
Berat sampel = 1,0049 g
Berat cawan + kertas saring = 17,3913 g Berat kertas saring + cawan + sampel basah = 18,3962 g Berat kertas saring + cawan +sampel kering = 18,7582 g
Kadar serat = x 100%
Penentuan kadar serat pada tablet formula B (Amilum-Nata de coco-Vitamin C) dapat dihitung dengan cara sebagai berikut:
Kadar serat ( A2 ) = 39,38 %
Penentuan kadar serat pada tablet formula C (Nata de coco-Vitamin C) dapat dihitung dengan cara sebagai berikut:
4.1.2 Perhitungan kadar vitamin C
Penentuan kadar vitamin C dari tablet formula A (Amilum-Vitamin C) dapat dihitung dengan cara sebagai berikut:
Penentuan kadar vitamin C dari tablet formula B (Amilum-Nata de coco-Vitamin C) dapat dihitung dengan cara sebagai berikut:
Penentuan kadar vitamin C dari tablet formula C (Nata de coco-Vitamin C) dapat dihitung dengan cara sebagai berikut:
4.1.3 Analisis Spektroskopi FT-IR Bahan dan Formulasi Granul
4.1.3.1 Spektrum FT-IR Amylum Manihot
Spektrum FT-IR amylum manihot dapat dilihat pada gambar di bawah ini :
Gambar 4.1 Spektrum FT-IR Amylum Manihot
Pada gambar 4.1 menunjukkan spektrum FT-IR amylum manihot dengan serapan puncak-puncak pada bilangan gelombang: 3414,0 cm-1 yang menunjukkan adanya vibrasi ulur –OH yang didukung vibrasi tekuk –OH pada 1651,9 cm-1; bilangan gelombang 2932,7 cm-1 menunjukkan adanya vibrasi ulur C-H yang didukung vibrasi tekuk C-H asimetris pada 1419,9 cm-1 dan vibrasi tekuk C-H simetris pada 1365,8 cm -1
4.1.3.2 Spektrum FT-IR Nata de coco
Spektrum FT-IR Nata de coco dapat dilihat pada gambar di bawah ini :
Gambar 4.2 Spektrum FT-IR Nata de coco
4.1.3.3 Spektrum FT-IR Vitamin C
Spektrum FT-IR vitamin C dapat dilihat pada gambar di bawah ini :
Gambar 4.3 Spektrum FT-IR Vitamin C
Pada gambar 4.3 menunjukkan spektrum FT-IR vitamin C dengan serapan puncak-puncak pada bilangan gelombang: 3526,2 cm-1 - 3026,3 cm-1 menunjukkan adanya vibrasi ulur –OH; bilangan gelombang 2917,4 cm-1 - 2747,6 cm-1 menunjukkan adanya vibrasi ulur C-H yang didukung vibrasi tekuk C-H asimetris pada 1497,11 cm -1
dan vibrasi tekuk C-H simetris pada 1458,10 cm-1; serapan dengan pita tajam pada 1754,6 cm-1 menunjukkan adanya vibrasi gugus C=O dari R-CO-OR (lakton); 1673,1 cm-1 menunjukkan adanya vibrasi gugus C=C dari alkena alifatik; 1141,2 cm-1 - 1026,1 cm-1 menunjukkan adanya vibrasi gugus C-O-C eter.
4.1.3.4 Spektrum FT-IR Material Campuran Amylum Manihot -Vitamin C
Spektrum FT-IR material campuran amylum manihot–vitamin C dapat dilihat pada gambar di bawah ini :
Gambar 4.4 Spektrum FT-IR Campuran Amylum Manihot -Vitamin C
Pada gambar 4.4 menunjukkan spektrum FT-IR material campuran amylum
manihot–vitamin C dengan serapan puncak-puncak pada bilangan gelombang: 3526
4.1.3.5 Spektrum Nata de coco-Vitamin C
Spektrum FT-IR material campuran Nata de coco–vitamin C dapat dilihat pada gambar di bawah ini :
Gambar 4.5 Spektrum FT-IR Campuran Nata de coco –Vitamin C
4.1.3.6 Spektrum Amilum manihot-Nata de coco-Vitamin C
Spektrum FT-IR material campuran amylum manihot-Nata de coco–vitamin C dapat dilihat pada gambar di bawah ini :
Gambar 4.6 Spektrum FT-IR Campuran Amilum-Nata de coco-Vitamin C
4.2 Pembahasan
4.2.1 Pengaruh penambahan vitamin C dan Amilum terhadap kadar serat dari Nata de coco
Kadar serat yang diperoleh pada tablet formula A (Amilum-vitamin C) adalah 36,1067%, tablet formula B (Amilum-Nata de coco- Vitamin C) adalah 39,3880%, dan tablet formula C (Nata de coco-Vitamin C) adalah 36,4289%.
Selulosa yang dihasilkan oleh bakteri Acetobakter Xylinum di dalam Nata de coco berasal dari karbohidrat (sukrosa, glukosa, dan maltosa) dan amilum yang ditambahkan ke dalam tablet nata de coco setelah diserbukkan. Bakteri Acetobakter
Xylinum menggunakan karbohidrat tersebut sebagai nutrisi pada pertumbuhannya.
Sekaligus akan mempolimerisasikan glukosa menjadi Natade coco, produk inilah yang menjadi serat pada tablet nata de coco.
4.2.2 Pengaruh penambahan Vitamin C (Asam Askorbat) terhadap kadar Vitamin C dalam Nata de coco
Kadar vitamin C yang diperoleh pada tablet formula A (Amilum-Vitamin C) adalah 2,5987 %, tablet formula B (Amilum-Nata de coco-Vitamin C) adalah 2,6733 %, dan tablet formula C (Nata de coco-Vitamin C) adalah 2,5813 %.
4.2.3 Interaksi fisika melalui hasil kajian FT-IR dari tablet nata de coco dengan penambahan Amilum dan Vitamin C.
Dari Analisis FT-IR amylum manihot dapat diketahui bahwa bahan yang diperoleh dari hasil isolasi pati dari umbi singkong (Manihot Utilissima) adalah amilum/starch. Hal ini dipastikan dari terlihatnya vibrasi gugus-gugus amilum.
Pada material campuran amylum manihot-vitamin C, masih terlihat jelas serapan puncak gugus C=O dari lakton dan gugus C=C dari alkena alifatik pada vitamin C karena amylum manihot hanya mengikat vitamin C. Pada campuran Nata de coco–vitamin C dan campuran amylum manihot–Nata de coco–vitamin C, serapan puncak gugus C=O dari lakton dan gugus C=C dari alkena alifatik tidak terlihat, yang terlihat adalah serapan puncak gugus C=O khas pada selulosa Nata de coco. Hal ini dimungkinkan karena vitamin C terjebak di dalam pori-pori selulosa Nata de coco sehingga tidak terdeteksi pada saat proses pengambilan data IR.
Dari analisa hasil kajian FT-IR, diketahui bahwa terjadi interaksi fisika antara
amylum manihot, Nata de coco, dan vitamin C berdasarkan adanya perubahan
bilangan gelombang gugus-gugus reaktif dari Nata de coco, amylum manihot, dan vitamin C (gambar 4.4, gambar 4.5 dan gambar 4.6) jika dibandingkan dengan spektrum FT-IR murni dari ketiga material (gambar 4.1, gambar 4.2, dan gambar 4.3). Perubahan bilangan gelombang ini terjadi karena telah terjadi interaksi fisika dari ketiga bahan yang menyebabkan perubahan pola vibrasi dari gugus-gugus fungsi yang bersangkutan dapat dilihat pada lampiran 1. Puncak vibrasi ulur gugus –OH yang landai pada amylum manihot dan Selulosa Nata de coco menjadi melebar pada FT-IR campuran amylum manihot, selulosa, dan vitamin C.
BAB 5
KESIMPULAN DAN SARAN
5.1. Kesimpulan
Dari analisa data hasil penelitian diperoleh kesimpulan bahwa:
1. Kadar serat dari tablet formula A (Amilum-Vitamin C) adalah sebesar 36,1067 %, tablet formula B (Amilum-Nata de coco-Vitamin C) adalah sebesar 39,3880 %, dan tablet formula C (Nata de coco-Vitamin C) adalah sebesar 36,4289 %, sedangkan kadar vitamin C dari tablet formula A (Amilum-Vitamin C) adalah sebesar 2,5987 %, tablet formula B (Amilum-Nata de coco-Vitamin C) adalah sebesar 2,6733 %, dan tablet formula C (Nata de cococ-Vitamin C) adalah sebesar 2,5813 %.
5.2. Saran
DAFTAR PUSTAKA
Agoes, G. 2008. Pengembangan Sediaan Farmasi. Edisi Revisi dan Perluasan. Bandung: Penerbit ITB.
Almatsier, S. 2004. Prinsip Dasar Ilmu Gizi. Jakarta: Gramedia Pustaka Utama. Andarwulan, N. 1992. Kimia Vitamin. Jakarta: CV Rajawali.
Anief, M. 1996. Ilmu Meracik Obat (Teori dan Praktik). Yogyakarta: Gadjah Mada University Press.
Dachriyanus. 2004. Analisis Struktur Senyawa Organik Secara Spektroskopi. Padang: Andalas University Press.
Fessenden, R. J. dan Fessenden, J. S. 1986. Kimia Organik. Edisi Ketiga. Jilid Kedua. Jakarta: Erlangga.
Gaman, P. M. dan Sherington, K. B. 1992. Pengantar Ilmu Pangan, Nutrisi, dan
Mikrobiologi. Yogyakarta : Universitas Gajah Mada
Hart, H. 2003. Kimia Organik. Edisi Kesebelas. Jakarta: Erlangga. Hidayat, N. 2006. Mikrobiologi Industri. Yogyakarta: C. V. Andi Offset
Http://www.wartamedika.com/2007/12/vitamin-C.html. Diakses pada 16 Maret 2010.
2010.
Moss, M. O. 1995. Food Microbiology. Cambridge : Royal Society of Chemistry Mulja, M. 1995. Analisis Instrumental. Surabaya: Airlangga University Press.
Nurwantoro dan Abbas S. 1977. Mikrobiologi Pangan Hewani Nabati. Jakarta : penerbit Kansius
Palungkun, R. 1992. Aneka Produk Olahan Kelapa. Cetakan ketujuh. Jakarta : Swadaya
Pambayun, R. 2002. Teknologi Pengolahan Nata de Coco. Yogyakarta: Kanisius.
Philip, G. O. dan William, P. A. 2000. Handbook od Hydrocolloids. Cambridge : Woodhead Publishing Limited.
Prawirokusumo, S. 1991. Biokimia Nutrisi (Vitamin). Edisi I. Yogyakarta: BEPE. Sari, N.P.2011.Pembuatan dan Karakterisasi Bahan Tablet Vitamin C Menggunakan
Kitosan dan Amylum Manihot Sebagai Matriks Melalui Metode Granulasi Basah. Skripsi. Medan.
Suhardiyono,L.1999. Tanaman Kelapa Budidaya dan Pemanfaatannya. Yogyakarta : Penerbit Kanisius.
Warisno. 2004. Mudah dan Praktis Membuat Nata de Coco. Jakarta: Media Pustaka. Winarno, F. G. 1992. Pengantar Teknologi Pangan. Jakarta : PT Gramedia.
Yanuar, A. 2003. Preparasi dan Karakterisasi Selulosa Mikrokristal dari Nata de
Coco untuk Bahan Pembantu Pembuatan Tablet. ISTECS Journal. Volume IV.
Yusak,Y. 2010. Inkorporasi Asam Askorbat pada Pembentukan Selulosa Bakteri
dengan Menggunakan Acetobacter Xylinum. Disertasi. FMIPA-USU Medan
Lampiran 1. Spektrum Serapan Infra Merah dari Beberapa Gugus Fungsi Senyawa
No Gugus Fungsi Bilangan
Gelombang (cm-1) Intensitas
1 O-H
Keton (lakton : RCO-OR) Amida C-O-NH2
lentur C-H luar bidang
3000 – 2700
Amina sekunder – NH-R
Lampiran 2 : Gambar Penelitian
Gambar1. Nata de coco Gambar 2. serbuk Nata de coco
Gambar 3. Tablet Amilum-Vitamin C Gambar 4. Tablet Nata de
coco-Vit C