PENGARUH KADAR GULA, VITAMIN C DAN KADAR SERAT DARI SARI BUAH MARKISA UNGU (Passiflora Edulis Var Edulis) PADA
PEMBUATAN NATA DE COCO DENGAN MENGGUNAKAN ACETOBACTER XYLINUM
T E S I S
Oleh
SUWIJAH
097006014/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PENGARUH KADAR GULA, VITAMIN C DAN KADAR SERAT DARI SARI BUAH MARKISA UNGU (Passiflora Edulis Var Edulis) PADA
PEMBUATAN NATA DE COCO DENGAN MENGGUNAKAN ACETOBACTER XYLINUM
TESIS
Diajukan Sebagai Salah Satu Syarat Untuk Memperoleh Gelar Magister Sains Dalam Program Studi Kimia Pada
Sekolah Pascasarjana Universitas Sumatera Utara
Oleh
SUWIJAH 097006014/KIM
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM UNIVERSITAS SUMATERA UTARA
PERSETUJUAN
Judul : PENGARUH KADAR GULA ,VITAMIN C DAN KADAR SERAT DARI SARI BUAH MARKISA UNGU ( Passiflora Edulis Var Edulis) PADA PEMBUATAN NATA DE COCO DENGAN MENGGUNAKAN ACETOBACTER XYLINUM
Nama : SUWIJAH
Nomor Induk mahasiswa : 097006014
Program studi : MAGISTER ILMU KIMIA
Menyetujui : Komisi Pembimbing
Prof. Basuki Wirjosentono, MS, Ph.D Dr. Darwin Yunus Nasution, MS Pembimbing I Pembimbing II
Prof. Basuki Wirjosentoso, MS, Ph.D Dr.Sutarman, MSc Ketua Jurusan Dekan
PERNYATAAN ORISINALITAS
PENGARUH KADAR GULA, VITAMIN C DAN KADAR SERAT DARI SARI BUAH MARKISA UNGU (Passiflora Edulis Var Edulis) PADA
PEMBUATAN NATA DE COCO DENGAN MENGGUNAKAN ACETOBACTER XYLINUM
TESIS
Dengan ini saya nyatakan bahwa saya mengakui semua karya tesis ini adalah hasil
kerja saya sendiri kecuali kutipan dan ringkasan yang tiap satunya telah dijelaskan
sumbernya dengan benar.
Medan, 21 Juni 2011
Telah diuji pada Tanggal : 21 Juni 2011
Panitia Penguji Tesis : 1. Prof.Basuki Wirjosentono,MS.Ph.D 2. Dr.Darwin Yunus Nasution ,MS
3. Prof.Dr.Harry Agusnar,M.Sc.M.Phil
4. Prof.Dr.Harlem Marpaung
5. Prof.Dr.Thamrin,M.Sc
PERNYATAAN PERSETUJUAN PUBLIKASI KARYA ILMIAH UNTUK KEPENTINGAN
AKADEMIS
Sebagai aktivitas akademik Universitas Sumatera Utara, saya yang bertanda tangan
dibawah ini :
Nama : Suwijah
Nim : 097006014
Program Studi : Magister Ilmu Kimia
Jenis Karya Ilmiah : Tesis
Demi pengembangan ilmu pengetahuan, menyetujui untuk memberikan kepada
Universitas Sumatera Utara Hak Bebas Royalti Non-Eksklusif (Non-Exclusive
Royalty Free Right ) atas Tesis saya yang berjudul:
PENGARUH KADAR GULA, VITAMIN C DAN KADAR SERAT DARI SARI BUAH MARKISA UNGU (Passiflora Edulis Var Edulis) PADA
PEMBUATAN NATA DE COCO DENGAN MENGGUNAKAN ACETOBACTER XYLINUM
Beserta perangkat yang ada (jika diperlukan). Dengan Hak Bebas Royalty
Non-Eksklusif ini, Universitas Sumatera Utara berhak menyimpan, mengalih media,
memformat, mengelolah dalam bentuk data-base, merawat dan mempublikasikan
Tesis saya tanpa meminta izin dari saya selama tetap mencantumkan nama saya
sebagai penulis dan sebagai pemegang atau sebagai pemilik hak cipta.
Demikian pernyataan ini dibuat dengan sebenarnya.
Medan, 21 Juni 2011
PENGARUH KADAR GULA, VITAMIN C DAN KADAR SERAT DARI SARI BUAH MARKISA UNGU (Passiflora Edulis Var Edulis) PADA
PEMBUATAN NATA DE COCO DENGAN MENGGUNAKAN ACETOBACTER XYLINUM
ABSTRAK
Penelitian ini dilakukan dengan skala laboratorium. Penelitian tentang pengaruh kadar gula, vitamin C dan kadar serat dari sari buah markisah pada pembuatan nata de coco dengan menggunakan acetobacter xylinum. Telah dilakukan penelitian tanpa penambahan sari buah markisa dengan perbandingan 100: 0 dan dengan penambahan sari buah markisah dengan perbandingan 90: 10, 80:20, 70: 30, 60: 40 dan 50: 50. Metode yang dilakukan dalam penelitian adalah metode eksperimen. Pada nata de coco yang tidak dicampur sari buah markisa dengan nata de coco yang dicampurkan sari buah markisa. Hasil lainnya yang diperoleh adalah terjadinya perubahan vitamin C, gula dan kadar serat di dalam nata akibat penambahan sari buah markisa.
Kata Kunci: Nata de coco, Sari Buah Markisa, Kadar Gula, Vitamin C dan Kadar Serat, Acetobacter xylinum.
EFFECT OF SUGAR CONTENT, VITAMIN C AND FIBER CONTENT OF SARI UNGU PASSION FRUIT (PASSIFLORA EDULIS VAR EDULIS)
NATA DE COCO PRODUCTION IN USING ACETOBACTER XYLINUM
ABSTRACT
This study was conducted with laboratory scale. Research on the influence of sugar content, vitamin C and fiber content of fruit juice markisah on making nata de coco using acetobacter xylinum. Studies have been conducted without the addition of passion fruit juice with a ratio of 100: 0 and with the addition of fruit juice markisah with a ratio 90: 10, 80:20, 70: 30, 60: 40 and 50: 50. The method is carried out in research is an experimental method. In nata de coco that is not mixed with passion fruit juice mixed nata de coco passion fruit juice. Another result obtained is the change of vitamin C, sugar and fiber content in nata due to the addition of passion fruit.
KATA PENGANTAR
Pertama-tama penulis menyampaikan segala puji syukur kehadirat
Allah SWT atas segala limpahan rahmat dan kasih karunia-Nyalah
sehingga tesis ini dapat terselesaikan.
Dengan selesainya tesis ini, perkenankanlah penulis mengucapkan
terima kasih yang sebesar-besarnya kepada:
Bapak Gubernur Sumatera Utara, Ketua Bappeda Provinsi
Sumatera Utara yang memberi kesempatan menerima beasiswa kepada
penulis sebagai mahasiswa Pascasarjana Universitas Sumatera Utara,
sampai selesainya tesis ini
Rektor Universitas Sumatera Utara ,Prof. Dr. dr. Syahril Pasaribu,
DTM & H M.Sc (CTM), Sp. A(K) atas kesempatan yang diberikan
kepada penulis untuk mengikuti dan menyelesaikan pendidikan program
Magister.
Bapak Prof. DR. Ir. Rahim Matondang M.SIE, selaku Direktur
sekolah Pascasarjana Universitas Sumatera Utara yang memberi
kesempatan dan fasilitas kepada penulis untuk menyelesaikan pendidikan
Magister Kimia.
Dekan Fakultas MIPA Universitas Sumatera Utara, Prof. Dr. Eddy
Marlianto M.Sc atas kesempatan menjadi mahasiswa Program Magister
pada Program Pascasarjana FMIPA Universitas Sumatera Utara.
Ketua Program studi Magister/Doktor Kimia, Prof.Basuki
Kimia, Dr. Hamonangan Nainggolan M.Sc, beserta seluruh staf pengajar
pada Program Studi Magister Kimia Program Pascasarjana Fakultas
MIPA Universitas Sumatera Utara.
Dalam kesempatan ini penulis mengucapkan terima kasih yang tak
terhingga serta penghargaan yang setinggi-tingginya kepada Prof. Basuki
Wirjosentono, MS,Ph.D dan Dr. Darwin Yunus Nasution MS, selaku
pembimbing I dan pembimbing II yang dengan penuh perhatian dan telah
memberikan dorongan, Bimbingan, dan saran hingga selesainya
penelitian ini.
Penulis mengucapkan terima kasih kepada kepala sekolah SMA
Kemala Bhayangkari Hilman Khaidir, S.Pd, M.Pd yang telah
memberikan kesempatan dan bantuan moril kepada penulis untuk
mengikuti Program Pascasarjana di Universitas Sumatera Utara.
Penulis juga mengucapkan terima kasih kepada Kepala
Laboratorium Analitik FMIPA dan Laboratorium ilmu-ilmu Dasar
(LIDA) Universitas Sumatera Utara dan juga kepada semua asisten dosen
di Laboratorium Analitik yang telah banyak membantu penulis selama
penelitian.
Terima kasih penulis ucapkan kepada teman-teman mahasiswa
Magister Kimia angkatan 2009 dan teman lainnya yang telah
memberikan bantuan dan dukungan serta doanya selama ini.
Sembah sujud penulis kepada orang tua dan juga buat mertua yang
telah mengasuh, mendidik dengan penuh kasih sayang dan juga telah
perkuliahan,tidak ada kata terima kasih yang tepat untuk mereka kecuali
terima kasih yang tiada habis - habisnya.
Teristimewa kepada suami penulis yang paling mendukung dan
yang tercinta Inspektur Dua Azhar, SH yang terus memberikan
dukungan baik secara moril dan material, Penulis mengucapkan terima
kasih atas pengertin dan kesetiaannya.
Kepada anak-anak penulis yang tersayang Nurmala Hayati,
Nuradiah, Zulkarnaen, Nur Jannah, Zulkifli, Mama ”mengucapkan terima
kasih atas seluruh pengertiannya dan doa hingga mama ”dapat
menyelesaikan pendidikan.
Penulis menyadari bahwa tesis ini masih kurang sempurna,oleh
karena itu penulis sangat mengharapkan kritik dan saran yang bersifat
membangun dari pihak pembaca demi kesempurnaan tesis ini. Akhirnya
semoga tesis ini dapat bermanfaat bagi penelitian dan kemajuan ilmu
pengetahuan demi Nusa dan Bangsa.
Medan, 21 Juni 2011
Penulis
RIWAYAT HIDUP
DATA PRIBADI
Nama lengkap : Suwijah
Tempat dan Tanggal Lahir : Medan, 21 Juni 1963
Alamat Rumah : Jl. KH.Wahid Hasyim Blok N1 No.5
Medan
Telepon /Hp : 085262141999
Instansi Tempat Bekerja : SMA Kemala Bhayangkari 1
Medan
Alamat kantor : Jl. KH.Wahid Hasyim
DATA PENDIDIKAN
SD : SD D.I. Panjaitan Medan Tahun 1976
SMP : SMP Persit Medan Tahun 1980
SMA : SMA Negri 1 Cik Di Tiro Medan Tahun 1983
D3 : Pendidikan Kimia Medan Tahun 1987
Strata-1 : S-1 Pendidikan Kimia FMIPA IKIP Medan Tahun 1997
DAFTAR ISI
Halaman LEMBAR PERSETUJUAN
ABSTRAK ... i
ABTRACKS... ii
DAFTAR RIWAYAT HIDUP ... iv
KATA PENGANTAR ... ii
DAFTAR ISI... v
BAB I PENDAHULUAN 1.1 Latar Belakang ... 1
1.2 Perumusan Masalahan... 2
1.3 Pembatasan Masalah ... 2
1.4 Tujuan Penelitian ... 2
1.5 Manfaat Penelitian ... 2
1.6 Lokasi Penelitian... 2
1.7 Metode Penelitian ... 3
BAB II TINJAUAN PUSTAKA 2.1 Tanaman Kelapa ... 4
2.2 Markisa Ungu ... 6
2.2.1. Acetobacter ... 7
2.2.2. Jenis – jenis Acetobacter... 7
2.2.3. Acetobacter Xylinum ... 7
2.2.4. Sifat - sifat Acetobacter Xylinum ... 10
2.3. Nata ... 12
2.3.1. Pembuatan Nata ... 13
2.3.2. Fermentasi Nata ... 14
2.4. Selulosa ... 15
2.4.1. Aplikasi Nata... 15
BAB III METODE PENELITIAN 3.1 Alat dan Bahan... 17
3.1.1. Alat - alat ... 17
3.1.2. Bahan - bahan ... 18
3.2 Prosedur Penelitian ... 18
3.2.1. Pengambilan Sampel ... 18
3.2.2. Pembuatan Larutan Pereaksi ... 18
3.2.2.1. Pembuatan Larutan NaOH 3,25% ... 18
3.2.2.2. Pembuatan H2SO4 1,25% ... 19
3.2.2.3. Pembuatan I2 0,01N... 19
3.2.2.4. Pembuatan Amilum 1% ... 19
3.2.2.5. Pembuatan Fehling A ... 19
3.2.2.6. Pembuatan Fehling B ... 19
3.2.2.7. Pembuatan Matilen Biru ... 19
3.2.3. Pembuatan Starter Nata ... 19
3.2.4. Pembuatan Nata ... 20
3.3 Parameter Diamati... 20
3.3.1. Penentuan Kadar Serat ... 20
3.3.2. Penentuan Vitamin C ... 21
3.3.3. Penentuan Kadar Glukosa ... 21
3.4 Bagan Penelitian... 21
3.4.1. Pembuatan Starter Nata ... 22
3.4.2. Pembuatan Nata ... 23
3.4.3. Penentuan Serat... 25
3.4.4. Penentuan Kadar Vitamin C ... 26
3.4.4. Penentuan Kadar Glukosa ... 27
BAB IV HASIL DAN PEMBAHASAN 4.1 Hasil Penelitian ... 28
4.1.1. Gambar... 39
4.2. Analisis Spektroskopi FT-IR ……….. 40
4.2.1. Spektrum FT-IR Nata ... 40
BAB V KESIMPULAN DAN SARAN 5.1.Kesimpulan... . 44
5.2. Saran... 44
PENGARUH KADAR GULA, VITAMIN C DAN KADAR SERAT DARI SARI BUAH MARKISA UNGU (Passiflora Edulis Var Edulis) PADA
PEMBUATAN NATA DE COCO DENGAN MENGGUNAKAN ACETOBACTER XYLINUM
ABSTRAK
Penelitian ini dilakukan dengan skala laboratorium. Penelitian tentang pengaruh kadar gula, vitamin C dan kadar serat dari sari buah markisah pada pembuatan nata de coco dengan menggunakan acetobacter xylinum. Telah dilakukan penelitian tanpa penambahan sari buah markisa dengan perbandingan 100: 0 dan dengan penambahan sari buah markisah dengan perbandingan 90: 10, 80:20, 70: 30, 60: 40 dan 50: 50. Metode yang dilakukan dalam penelitian adalah metode eksperimen. Pada nata de coco yang tidak dicampur sari buah markisa dengan nata de coco yang dicampurkan sari buah markisa. Hasil lainnya yang diperoleh adalah terjadinya perubahan vitamin C, gula dan kadar serat di dalam nata akibat penambahan sari buah markisa.
EFFECT OF SUGAR CONTENT, VITAMIN C AND FIBER CONTENT OF SARI UNGU PASSION FRUIT (PASSIFLORA EDULIS VAR EDULIS)
NATA DE COCO PRODUCTION IN USING ACETOBACTER XYLINUM
ABSTRACT
This study was conducted with laboratory scale. Research on the influence of sugar content, vitamin C and fiber content of fruit juice markisah on making nata de coco using acetobacter xylinum. Studies have been conducted without the addition of passion fruit juice with a ratio of 100: 0 and with the addition of fruit juice markisah with a ratio 90: 10, 80:20, 70: 30, 60: 40 and 50: 50. The method is carried out in research is an experimental method. In nata de coco that is not mixed with passion fruit juice mixed nata de coco passion fruit juice. Another result obtained is the change of vitamin C, sugar and fiber content in nata due to the addition of passion fruit.
Keywords: Nata de coco, Passion Fruit, Sugar, Vitamin C and Fiber Content, Acetobacter xylinum.
BAB I
PENDAHULUAN
1.1.Latar Belakang
Kelapa (cocos nuciferaL) merupakan jenis yang paling dikenal dan paling banyak tersebar di daerah tropis, terutama di daerah pantai. Di Indonesia pemanfaatan
air kelapa belum digunakan dengan maksimal, banyak yang terbuang percuma.
Namun akhir-akhir ini sudah ada upaya untuk mengolah air kelapa menjadi suatu
makanan ringan/minuman.
Air kelapa mengandung air 91,27%, protein 0,29%, lemak 0,15%, karbohidrat
7,27%, serat 2,75%, serta abu 1,06%.
Nata adalah jenis komponen minuman yang merupakan senyawa selulosa
(dietary fiber) yang dihasilkan dari air kelapa melalui proses fermentasi, yang menggunakan bakteri Acetobakter xylinum.
Nata merupakan makanan rendah energi untuk keperluan diet karena nilai
gizinya sangat rendah. Selain itu juga mengandung serat yang dibutuhkan tubuh
untuk memperlancar pencernaan.
Vitamin C dapat digunakan sebagai antioksidan, antiinfeksi, antistress,
mencegah demam, dan sebagainya di dalam tubuh Berdasarkan uraian di atas penulis
ingin melakukan penelitian pembuatan Nata dengan penambahan sari buah markissa
Markisa tergolong ke dalam tanaman genus passiflora,sari buahnya memiliki
aroma yang khas, rasanya asam dan dapat dijadikan konsetrat alami,manfaat markisa
bagi kesehatan adalah dapat memulihkan kondisi tubuh.
1.2. Perumusan Masalah
Apakah terjadi perubahan aroma dan rasa pada Nata dengan penambahan sari buah
markisa dibandingkan dengan tanpa penambahan sari buah markisa.
1.3.Pembatasan Masalah
1. Air kelapa yang digunakan berasal dari penjual kelapa di jalan sei batu
gingging, Medan
2. Waktu pembuatan Nata selama 14 hari
3. Parameter yang diamati adalah kadar serat, kadar glukosa dan kadar vitamin C
4. Starter bakteri Acetobacter xylinum diperoleh dari hasil pengembangan bakteri Acetobacter xylinum yang diperoleh dari IPB Bogor.
1.4.Tujuan Penelitian
Tujuan penelitian ini adalah untuk membandingkan Nata tanpa penambahan
sari buah markisa dengan penambahan sari buah markisa
1.5. Manfaat Penelitian
Dari hasil penelitian ini diharapkan dapat mengolah limbah air kelapa menjadi Nata dengan penambahan sari buah markisa sehingga diperoleh Nata dengan aroma
1.6. Lokasi Penelitian
Penelitian ini dilakukan di Laboratorium Biokimia / Kimia Bahan Makanan
FMIPA USU, Medan.
1.7. Metodologi Penelitian
Penelitian ini adalah eksperimental laboratorium, dengan menggunakan sampel
berupa limbah air kelapa yang diperoleh dari pedagang kelapa di jalan Sei
Batugingging, Medan yang dijadikan nata de coco. Adapun langkah-langkah
analisisnya adalah sebagai berikut:
1. Pembuatan Nata difermentasi selama 14 hari sehingga terbentuk suatu lapisan
putih
2. Penentuan kadar serat dilakukan dengan metode defatting dan digestion,
kemudian diabukan dalam tanur pada suhu 6000 C
3. Penentuan kadar vitamin C dengan metode iodometri
BAB II
TINJAUAN PUSTAKA
2.1. Tanaman Kelapa
Kelapa merupakan tanaman tropis yang penting bagi negara-negara Asia dan
Pasifik. Kelapa disamping dapat memberikan devisa bagi negara juga merupakan
mata pencaharian jutaan petani, yang mampu memberikan penghidupan puluhan juta
keluarga.
Menurut FAO (Food and Agriculture Organization) pada tahun 1976,
negara-negara di Asia dan Pasifik menghasilkan 82% dari produksi kelapa dunia, sedangkan
sisanya oleh negara di Afrika dan Amerika Selatan (Suhardiyono L.,1999).
Gambar 2.1. Pohon kelapa
Kelapa menghasilkan air sebanyak 50 – 150 ml per butir. Air kelapa sangat
baik digunakan sebagai bahan dalam pembuatan nata, karena mengandung nutrisi
yang dibutuhkan bagi pertumbuhan, perkembangbiakan, dan aktivitas bibit nata yang
Acetobacter xylinum membutuhkan unsur makro dan mikro. Unsur makro terdiri atas karbon dan nitrogen.
Sebagian dari kebutuhan akan karbon tersebut sudah dapat diperoleh dari
dalam air kelapa dalam bentuk karbohidrat sederhana, misalnya sukrosa, glukosa,
fruktosa, dan lain-lainnya. Sementara nitrogen juga dapat diperoleh dari protein yang
terkandung dalam air kelapa, meskipun dalam jumlah yang kecil.
Air kelapa yang baik adalah yang diperoleh dari kelapa tua optimal, tidak
terlalu tua dan tidak pula terlalu muda. Dalam air kelapa yang terlalu tua, terkandung
minyak dari kelapa yang dapat menghambat pertumbuhan bibit nata Acetobacter xylinum.
Sebaliknya, air kelapa yang masih muda belum mengandung mineral yang
cukup di dalamnya, sehingga kurang baik apabila digunakan sebagai bahan
pembuatan nata (Pambayun R.,2002).
Tabel 2.1 Perbandingan komposisi air kelapa muda dengan air kelapa tua Sumber air kelapa
(dalam 100 g)
Air kelapa muda (%)
Air kelapa tua (%)
Kalori 17,0 kal -
Protein 0,2 g 0,14 g
Lemak 1,0 g 1,50 g
Karbohidrat 3,8 g 4,60 g
Kalsium 15,0 mg -
Fosfor 8,0 mg 0,50 g
Besi 0,2 mg -
Asam askorbat 1,0 mg -
Air 95,5 g 91,50 g
Bagian yang dapat dimakan
100 g -
2.2 Markisa Ungu (Passiflora Edulis Var Edulis)
Markisa tergolong ke dalam tanaman genus passiflora,yang berasal dari Brazil
dan menyebar sampai ke Indonesia.tumbuh liar di hutan-hutan basah yang
mempunyai ratusan Species Passiflora.
Tanaman ini dapat tumbuh pada ketinggian 800-1500 m diatas permukaan laut,di
perbanyak dengan stek dandan teknik sambungan.
Banyak sekali manfaat buah markisah bagi kesehatan .diantaranya berkhasiat
pereda nyeri, anti kejang, kolitis,penenang dan anti radang, bahkan markisa juga
mampu menyaring ,memisahkan dan membuang racun dari dalam tubuh .Selain itu
,bisa meningkatkan kesegaran kulit dan pertumbuhan sel muda pada kulit wajah.
Passiflorance yang banyak terkandung dalam buah markisa berkhasiat
menentramkan urat syaraf. Buah ini juga sebagai beberapa sumber vitamin,khususnya
vitamin C dan vitamin A dan antioksidan.
Setiap satu buah markisa warna ungu mengandung fosfor 12 mg ,zat besi 0,3
mg,kalsium 2 mg, potasium 63 mg,sodium 5 mg,vitamin A 130 mg,vitamin C 5 mg
dan magnesium 5 mg.
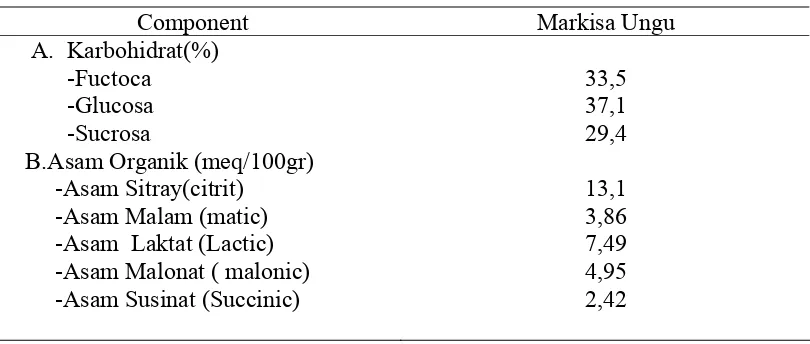
Tabel 2.2.Kandungan Karbohidrat dan Asam-asam Organik Markisa Ungu
Component Markisa Ungu
A. Karbohidrat(%) -Fuctoca
-Glucosa -Sucrosa
B.Asam Organik (meq/100gr) -Asam Sitray(citrit)
-Asam Malam (matic) -Asam Laktat (Lactic) -Asam Malonat ( malonic) -Asam Susinat (Succinic)
2.2.1 Acetobacter
Acetobacter. adalah bakteri yang digunakan untuk membuat cuka. Dalam membuat cuka, gel seperti membran selalu ditemukan pada permukaan larutan.
Material ini berkembang menjadi selulosa. Selulosa ini berasal dari bakteri yang
dinamakan selulosa bakteri (Philip G.O. dan William P.A., 2000).
2.2.2 Jenis-jenis Acetobacter
Adapun jenis-jenis bakteri Acetobacter adalah sebagai berikut:
a. Acetobacter acetii, ditemukan oleh Beijerinck pada tahun 1898. Bakteri ini penting dalam produksi asam asetat, yang mengoksidasi alkohol menjadi
asam asetat. Banyak terdapat pada ragi tapai, yang menyebabkan tapai yang
melewati 2 hari fermentasi akan menjadi berasa masam.
b. Acetobacter xylinum, bakteri ini digunakan dalam pembuatan nata de coco.
Acetobacter xylinum mampu mensintesis selulosa dari gula yang dikonsumsi. Nata yang dihasilkan berupa pelikel yang mengambang dipermukaan substrat.
Bakteri ini juga terdapat pada produk kombucha yaitu fermentasi dari teh
(Hidayat,2007).
2.2.3 Acetobacter Xylinum
Bakteri pembentuk nata termasuk kedalam golongan Acetobacter, yang mempunyai ciri – ciri antara lain: ”sel bulat panjang sampai batang (seperti kapsul),
tidak mempunyai endospora, sel – selnya bersifat gram negatif, bernafas secara aerob
tetapi dalam kadar yang kecil (Pelczar dan Chan,1988).
Bakteri Acetobacter xylinum dapat tumbuh dan berkembang membentuk nata (krim) karena adanya kandungan air sebanyak 91,23%, protein 0,29%, lemak 0,15%,
karbohidrat 7,27%, serta abu 1,06% di dalam air kelapa. Selain itu, terdapat juga
asam nikotinat 0,01 µg, asam patrotenat 0,52 µg, biotin 0,02 µg, riboflavin 0,01 µg,
dan asam folat 0,003 µg per ml, nutrisi-nutrisi tersebut merangsang pertumbuhan
Acetobacter xylinum untuk membentuk Nata (Moss M.O., 1995).
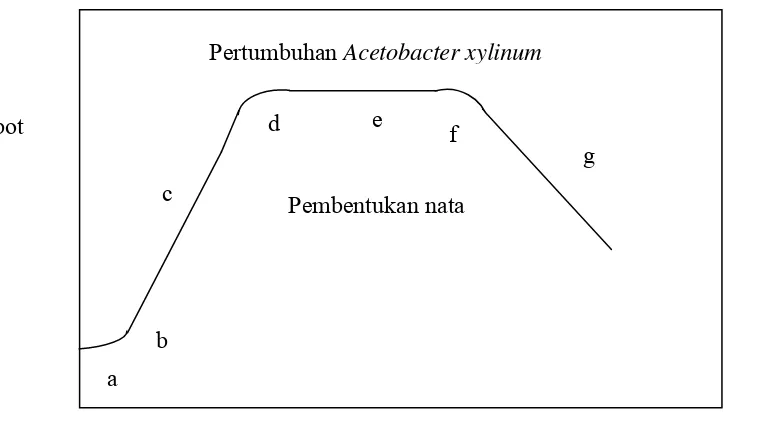
Bakteri Acetobacter xylinum mengalami beberapa fase pertumbuhan sel yaitu fase adaptasi, fase pertumbuhan awal, fase pertumbuhan eksponensial, fase
pertumbuhan lambat, fase pertumbuhan tetap, fase menuju kematian, dan fase
kematian. Adapun tahap – tahap pertumbuhan bakteri Acetobacter xylinum dalam kondisi normal dapat dilihat pada gambar 2.9
waktu
Gambar 2.2.2 Tahap – tahap pertumbuhan bakteri Acetobacter xylinum dalam kondisi normal
a. Fase adaptasi
Begitu dipindahkan ke media baru, bakteri Acetobacter xylinum tidak langsung tumbuh dan berkembang. Pada fase ini, bakteri akan terlebih dahulu menyesuaikan
diri dengan substrat dan kondisi lingkungan barunya. Fase adaptasi bagi Acetobacter xylinum dicapai antara 0 – 24 jam atau ± 1 hari sejak inokulasi.
a
f Pertumbuhan Acetobacter xylinum
e d
Bobot
sel Bobot nata
Pembentukan nata
b c
g f
b. Fase Pertumbuhan Awal
Pada fase ini, sel mulai membelah dengan kecepatan rendah. Fase ini menandai
diawalinya fase pertumbuhan eksponensial. Fase ini dilalui dalam beberapa jam.
c. Fase pertumbuhan eksponensial
Fase ini disebut juga sebagai fase pertumbuhan logaritmik, yang ditandai dengan
pertumbuhan yang sangat cepat. Untuk bakteri Acetobacter xylinum, fase ini dicapai dalam waktu antara 1- 5 hari tergantung pada kondisi lingkungan. Pada fase ini juga,
bakteri mengeluarkan enzim ekstraseluler polimerase sebanyak–banyaknya, untuk
menyusun polimer glukosa menjadi selulosa
d. Fase pertumbuhan diperlambat
Pada fase ini, terjadi pertumbuhan yang diperlambat karena ketersediaan nutrisi
yang telah berkurang, terdapatnya metabolit yang bersifat toksik yang dapat
menghambat pertumbuhan bakteri, dan umur sel yang telah tua.
e. Fase stasioner
Pada fase ini, jumlah sel yang tumbuh relatif sama dengan jumlah sel yang mati.
Penyebabnya adalah di dalam media terjadi kekurangan nutrisi, pengaruh metabolit
toksik lebih besar, dan umur sel semakin tua. Namun pada fase ini, sel akan lebih
tahan terhadap kondisi lingkungan yang ekstrim jika dibandingkan dengan
ketahanannya pada fase lain. Matrik nata lebih banyak diproduksi pada fase ini.
f. Fase menuju kematian
Pada fase ini, bakteri mulai mengalami kematian karena nutrisi telah habis dan sel
g. Fase kematian
Pada fase ini, sel dengan cepat mengalami kematian, dan hampir merupakan
kebalikan dari dase logaritmik. Sel mengalami lisis dan melepaskan komponen yang
terdapat di dalamnya (Nurwantoro,1977).
2.2.4. Sifat-sifat Acetobacter xylinum 1. Sifat Morfologi
Acetobacter xylinum merupakan bakteri berbentuk batang pendek, yang mempunyai panjang 2 mikron dan lebar 0,6 mikron, dengan permukaan dinding yang
berlendir. Bakteri ini bisa membentuk rantai pendek dengan satuan 6 – 8 sel.
Bakteri ini tidak membentuk endospora maupun pigmen. Pada kultur sel yang
masih muda, individu sel berada sendiri-sendiri dan transparan. Koloni yang sudah
tua membentuk lapisan menyerupai gelatin yang kokoh menutupi sel dan koloninya.
Pertumbuhan koloni pada medium cair setelah 48 jam inokulasi akan membentuk
lapisan pelikel dan dapat dengan mudah diambil dengan jarum ose.
2. Sifat Fisiologi
Bakteri ini dapat membentuk asam dari glukosa, etil alkohol, dan propil
alkohol, tidak membentuk indol dan mempunyai kemampuan mengoksidasi asam
asetat menjadi CO2 dan H2O. Sifat yang paling menonjol dari bakteri ini adalah
memiliki kemampuan mempolimerisasi glukosa hingga menjadi selulosa.
Selanjutnya, selulosa tersebut membentuk matrik yang dikenal sebagai nata. Faktor –
faktor dominan yang mempengaruhi sifat fisiologi dalam pembentukan nata adalah
ketersediaan nutrisi, derajat keasaman, temperatur, dan ketersediaan oksigen.
2.2.5.Faktor-faktor yang mempengaruhi pertumbuhan Acetobacter xylinum
Adapun beberapa faktor yang berkaitan dengan kondisi nutrisi, adalah sebagai
a. Sumber karbon
Sumber karbon yang dapat digunakan dalam fermentasi nata adalah senyawa
karbohidrat yang tergolong monosakarida dan disakarida. Sementara yang paling
banyak digunakan berdasarkan pertimbangan ekonomis, adalah sukrosa atau gula
pasir.
b. Sumber Nitrogen
Sumber nitrogen bisa digunakan dari senyawa organik maupun anorganik. Bahan
yang baik bagi pertumbuhan Acetobacter xylinum dan pembentukan nata adalah ekstrak yeast dan kasein. Namun, amonium sulfat dan amonium fosfat (di pasar
dikenal dengan ZA) merupakan bahan yang lebih cocok digunakan dari sudut
pandang ekonomi dan kualitas nata yang dihasilkan. Banyak sumber N lain yang
dapat digunakan dan murah seperti urea.
c. Tingkat Keasaman (pH)
Meskipun bisa tumbuh pada kisaran pH 3,5 – 7,5 , bakteri Acetobacter xylinum
sangat cocok tumbuh pada suasana asam (pH 4,3). Jika kondisi lingkungan dalam
suasana basa, bakteri ini akan mengalami gangguan metabolisme selnya.
d. Temperatur
Adapun suhu ideal (optimal) bagi pertumbuhan bakteri Acetobacter xylinum
adalah 280C – 310C. Kisaran suhu tersebut merupakan suhu kamar. Pada suhu di
bawah 280C, pertumbuhan bakteri terhambat. Demikian juga, pada suhu diatas 310C,
bibit nata akan mengalami kerusakan dan bahkan mati, meskipun enzim ekstraseluler
e. Udara (Oksigen)
Bakteri Acetobacter xylinum merupakan mikroba aerobik. Dalam pertumbuhan, perkembangan, dan aktivitasnya, bakteri ini sangat memerlukan oksigen. Bila
kekurangan oksigen, bakteri ini akan mengalami gangguan dalam pertumbuhannya
dan bahkan akan segera mengalami kematian. Oleh sebab itu, wadah yang digunakan
untuk fermentasi nata, tidak boleh ditutup rapat. Untuk mencukupi kebutuhan
oksigen, pada ruang fermentasi nata harus tersedia cukup ventilasi.
2.2.6.Aktifitas Acetobacter xylinum pada Fermentasi Nata
Apabila ditumbuhkan dalam media yang kaya akan sukrosa (gula pasir),
bakteri ini akan memecah sukrosa menjadi glukosa dan fruktosa. Senyawa – senyawa
glukosa dan fruktosa tersebut baru dikonsumsi sebagai bahan bagi metabolisme sel.
Berdasarkan pada pengamatan morfologi, pembentukan nata oleh bakteri
Acetobacter xylinum diawali dengan pembentukan lembaran benang – benang selulosa. Pembentukan benang tersebut, pada mulanya tampak seperti flagel (cambuk
pada bakteri umumnya).
Selanjutnya, bakteri Acetobacter xylinum membentuk mikrofibril selulosa di sekitar permukaan tubuhnya hingga membentuk serabut selulosa yang sangat banyak
dan dapat mencapai ketebalan tertentu. Pada akhirnya, susunan selulosa tersebut akan
tampak seperti lembaran putih transparan dengan permukaan licin dan halus, yang
disebut nata.
2.3. Nata
Nata berasal dari Spanyol yang berarti krim (cream). Jadi Nata adalah krim
Defenisi nata adalah suatu zat yang menyerupai gel, tidak larut dalam air dan
terbentuk pada permukaan media fermentasi. Nata adalah jenis nata dengan media
fermentasi dari air kelapa. Nata dibuat dengan memanfaatkan air kelapa untuk
difermentasikan secara aerob dengan bantuan mikroba (Hidayat, 2006).
Gambar 2.3 Nata
Nata adalah bahan padat seperti agar-agar tapi lebih kenyal, atau seperti
kolang-kaling, tetapi lembek, berwarna putih transparan. Sejenis makanan penyegar
atau pencuci mulut yang umumnya dikonsumsi sebagai makanan ringan
(http://wordpress.com/2009/06/08/pohon-kelapa).
2.3.1. Pembuatan Nata
Beberapa tahap kegiatan dalam pembuatan nata adalah sebagai berikut :
1. Preparasi
Tahap preparasi terdiri atas beberapa kegiatan sebagai berikut:
a. Penyaringan
Penyaringan bertujuan untuk memisahkan kotoran-kotoran atau benda-benda
asing yang tercampur dengan air kelapa, seperti misalnya sisa sabut. Penyaringan
b. Penambahan Gula Pasir Urea
Ketersediaan karbohidrat dan protein yang terdapat dalam air kelapa belum
mencukupi kebutuhan untuk pembentukan nata, kedalam air kelapa tersebut perlu
ditambahkan gula pasir 10% dan urea 0,5%.
Jenis sumber karbon bisa berupa bahan seperti misalnya glukosa, laktosa,
fruktosa. Demikian juga dengan jenis sumber nitrogen yang digunakan dapat berupa
nitrogen organik seperti misalnya protein, ekstrak yeast, maupun nitrogen anorganik
seperti misalnya ammonium fosfat, ammonium sulfat, dan urea.
c. Perebusan
Perebusan dilakukan sampai mendidih dan dipertahankan selama 5 – 10 menit
untuk meyakinkan bahwa mikroba kontaminan telah mati, dan juga menyempurnakan
pelarutan gula pasir dan ammonium sulfat yang ditambahkan.
d. Penambahan Cuka
Tujuan penambahan cuka/asam asetat adalah untuk menurunkan pH air
kelapa dari sekitar 6,5 sampai mencapai pH 4,3. Kondisi pH 4,3 merupakan kondisi
optimal bagi pertumbuhan Acetobacter xylinum.
e. Pendinginan
Pendinginan paling baik dilakukan dengan cara membiarkan cairan dalam
nampan selama satu malam. Hal ini sekaligus untuk mengecek ada tidaknya
2. Inokulasi, Fermentasi, dan Pengendaliannya
a. Pemberian Bibit (Inokulasi)
Pemberian bibit dilakukan apabila campuran air kelapa, urea, dan asam
asetat/cuka telah benar-benar dingin. Bila pemberian bibit dilakukan pada waktu
cairan air kelapa masih dalam keadaan panas atau hangat, maka bibit nata dapat
mengalami kematian, sehingga proses fermentasi tidak bisa berlangsung.
b. Fermentasi atau Pemeraman
Campuran air kelapa yang sudah diberi bibit, dibiarkan selama 7 – 8 hari agar
terjadi proses fermentasi dan terbentuklah Nata (Pambayun R.,2002).
2.3.2 Fermentasi Nata
Fermentasi dapat terjadi karena adanya aktifitas mikroba penyebab fermentasi
pada substrat organik yang sesuai. Terjadinya fermentasi ini dapat menyebabkan
perubahan sifat bahan pangan, sebagai akibat dari pemecahan kandungan-kandungan
bahan pangan tersebut. Hasil-hasil fermentasi terutama tergantung pada jenis bahan
pangan (substrat), macam mikroba dan kondisi di sekelilingnya yang mempengaruhi
pertumbuhan dan metabolisme mikroba ( Winarno F.G.,1992 ).
2.4 Selulosa
Selulosa adalah senyawa seperti serabut, liat, tidak larut dalam air, dan
ditemukan di dalam dinding sel pelindung tumbuhan, terutama pada tangkai, batang,
dahan, dan semua bagian berkayu dari jaringan tumbuhan. Selulosa membentuk
komponen serat dari dinding sel tumbuhan. Molekul selulosa merupakan rantai –
rantai atau mikrofibril dari D–glukosa sampai sebanyak 14000 satuan yang terdapat
sebagai berkas-berkas terpuntir mirip tali yang terikat satu sama lain oleh ikatan
Gambar 2.4 Struktur selulosa
Sistem pencernaan manusia mengandung enzim yang dapat mengkatalisis
hidrolisis ikatan α-glikosidik, tetapi tidak mengandung enzim yang diperlukan untuk
menghidrolisis ikatan β-glikosidik (Hart H., 2003).
2.4.1 Aplikasi Nata
Aplikasi Nata yaitu dalam bidang sebagai berikut :
a. Aplikasi dalam Bidang Medis
Salah satu cara yang digunakan dalam proses cetak langsung tablet adalah
mikrokristal selulosa, karena mempunyai daya ikat tablet yang sangat baik dan waktu
hancur tablet relatif singkat. Mikrokristalin yang beredar di pasaran adalah produk
impor yang mahal, sehingga berakibat pada mahalnya harga produk tablet yang
dihasilkan. Mikrokristalin selulosa adalah hasil olahan dari selulosa alami yang dapat
diperoleh dari berbagai sumber baik dari tumbuhan atau hasil fermentasi. Nata
merupakan sumber selulosa yang diproduksi sebagai hasil fermentasi Acetobacter xylinum dalam substrat air kelapa. Selulosa bakteri identik dengan selulosa yang berasal dari tumbuhan. Untuk menghasilkan mikrokristal selulosa dengan harga
murah, maka dilakukan pemanfaatan Nata menjadi mikrokristal selulosa untuk
b. Aplikasi dalam Makanan
Penambahan Nata dalam jumlah yang sedikit akan memberikan dispersi dan
stabilisasi emulsi makanan yang baik. Selulosa bakteri dapat berfungsi demikian
karena struktur tiga dimensi dari serat selulosa dan kestabilan terhadap perlakuan
fisika dan kimia, seperti ketahanan terhadap panas, asam, dan garam.
Karakteristik-karakteristik dari selulosa bakteri ini dapat diaplikasikan pada makanan sebagai
stabilisasi dari bahan pengental, dispersi, suspensi, dan emulsi. Adapun aplikasi
selulosa bakteri dalam makanan yaitu pada penggunaan minuman, sebagai makanan
BAB 3
METODE PENELITIAN
3.1. Alat dan Bahan 3.1.1. Alat-alat
- Neraca Analitis Mettler Toledo
- Indikator Universal Merck
- Labu takar Pyrex
- Gelas ukur Pyrex
- Gelas beaker Pyrex
- Labu erlenmeyer Pyrex
- Corong Pyrex
- Termometer Fisher
- Botol akuades
- Batang Pengaduk Pyrex
- Oven Memmert
- Tanur Gallenkamp
- Desikator
- Crusibel
- Alat soklet Pyrex
- Pipet tetes
3.1.2. Bahan-bahan - Gula pasir
- Urea
- Air kelapa
- Asam cuka
- CuSO4.5H2O E. Merck
- H2SO4 (p) E. Merck
- NaOH E. Merck
- Etanol 96% E. Merck
- Kna-Tartrat.4H2O E.Merck
- Akuades
- Kertas Saring
- Metilen biru
- N-heksan E.Merck
- I2 E.Merck
- Amilum E.Merck
3.2 Prosedur Penelitian 3.2.1 Pengambilan Sampel
Sampel air kelapa diambil dari penjual kelapa di jalan sei batu gingging,
Medan
3.2.2 Pembuatan Larutan Pereaksi 3.2.2.1 Pembuatan larutan NaOH 3,25%
Ditimbang 8,13 g NaOH(s), kemudian dilarutkan 8,13 g NaOH(s) dengan
3.2.2.2Pembuatan H2SO4 1,25%
Dipipet 3,13 ml larutan H2SO4(p), kemudian dimasukkan ke dalam labu takar
250 ml, diencerkan dengan akuades sampai garis tanda.
3.2.2.3Pembuatan I2 0,01N
Ditimbang 0,625 g KI dan 0,31725 g I2. kemudian diencerkan dalam labu
takar 250 ml dengan akuades sampai garis tanda.
3.2.2.4Pembuatan Amilum 1%
Ditimbang 1 g amilum, kemudian diencerkan dalam labu takar 100 ml dengan
akuades sampai garis tanda.
3.2.2.5Pembuatan Fehling A
Ditimbang 34,69 g CuSO4.5H2O, kemudian diencerkan dalam labu takar 500
ml dengan akuades hingga garis tanda.
3.2.2.6Pembuatan Fehling B
Ditimbang 173 g KNa-Tartrat.4H2O dan 50 g NaOH, kemudian diencerkan
dalam labu takar 500 ml dengan akuades hingga garis tanda.
3.2.2.7Pembuatan Metilen Biru
100 mg metal merah ditambahkan dengan 30 mg metilen biru dilarutkan
dalam 60 ml alcohol 96%, kemudian diencerkan dalam labu takar 100 ml dengan
3.2.3 Pembuatan Starter Nata
Air kelapa 500 ml disaring dengan menggunakan kertas saring, dimasukkan
kedalam gelas beaker. Dipanaskan hingga mendidih. Kemudian ditambahkan urea
0,5%, gula 10%, diaduk sambil dipanaskan hingga urea dan gula larut. Ditambahkan
asam cuka ketika larutan dingin, hingga larutan mempunyai pH 4. Dimasukkan
kedalam botol yang telah di sterilisasi. Diinokulasi dengan starter Acetobacter xylinum sebanyak 10%. Difermentasikan selama 14 hari dalam ruangan pada suhu kamar hingga terbentuk lapisan putih diatasnya.
3.2.4 Pembuatan Nata
Air kelapa 100 ml disaring dengan menggunakan kertas saring, dimasukkan
kedalam gelas beaker. Dipanaskan hingga mendidih. Kemudian ditambahkan urea
0,5%, gula 10%, diaduk sambil dipanaskan hingga urea dan gula larut. Ditambahkan
asam cuka ketika larutan dingin, hingga larutan mempunyai pH 4. Dimasukkan
kedalam wadah yang telah di sterilisasi. Diinokulasi dengan starter Acetobacter xylinum sebanyak 10%. Difermentasikan selama 14 hari dalam ruangan pada suhu kamar hingga terbentuk lapisan putih diatasnya. Dilakukan perlakuan yang sama
untuk pencampuran air kelapa dengan sari buah markissa dengan perbandngan 90:10
; 80:20; 70:30; 60:40; dan 50:50 ml.
3.3 Parameter yang Diamati 3.3.1 Penentuan Kadar Serat
Nata ditimbang sebanyak 1-2 g, kemudian dihilangkan lemaknya dengan
n-heksan menggunakan metode soxletasi selama 2 jam. Dikeringkan dan dimasukkan
kedalam gelas erlenmeyer 500 ml. Ditambahkan 50 ml larutan H2SO4 1,25%,
kemudian didihkan selama 30 menit dengan menggunakan beaker gelas 250 ml.
Tambahkan 50 ml NaOH 3,25% dan didihkan lagi selama 30 menit. Dalam keadaan
panas, saring dengan corong yang berisi kertas saring whatman No. 42 yang telah
dengan H2SO4 1,25% panas, air panas, dan etanol 96%. Dimasukkan ke dalam cawan
porselin yang telah diketahui beratnya. Dikeringkan di dalam oven pada suhu 1050C
Didinginkan dalam desikator dan ditimbang hingga bobot konstan. Kemudian
diabukan dalam tanur, didinginkan dalam desikator dan ditimbang sampai berat
konstan. Dihitung kadar seratnya.
Kadar serat = x 100%
3.3.2 Penentuan Vitamin C
Diencerkan 1 ml larutan sampel ke dalam labu takar 100 ml dengan akuades
hingga garis tanda , dihomogenkan, kemudian dipipet 10 ml dengan menggunakan
pipet volume 10 ml. dimasukkan ke dalam gelas Erlenmeyer 250 ml, kemudian
ditambahkan 3 tetes indicator amilum 1%. Dititrasi dengan larutan standard I2 0,01 N
hingga terjadi perubahan warna menjadi biru. Dihitung volume I2 0,01 N yang
terpakai. Dilakukan perlakuan yang sama sebanyak tiga kali.
3.3.3 Penentuan Kadar Glukosa
Diencerkan 1 ml larutan sampel ke dalam labu takar 100 ml dengan akuades
hingga garis tanda, dihomogenkan, kemudian dimasukkan ke dalam buret 50 ml.
Dimasukkan 5 ml larutan fehling A dan Fehling B secara bersamaan ke dalam gelas
Erlenmeyer 250 ml. ditambahkan 15 ml lautan sample dari dalam buret, kemudian
ditambahkan 3 tetes indikator metilen biru, dipanaskan, dan dititrasi dengan larutan
sampel dalam keadaan panas sampai diperoleh endapan merah bata. Dihitung jumlah
volume larutan sample yang terpakai. Dilakukan perlakuan yang sama sebanyak 3
kali.
3.4 Bagan Penelitian
3.4.1 Pembuatan Starter Nata
Larutan asam bergula
Ditambahkan 10% gula
Ditambahkan 0,5% urea
Dipanaskan sambil diaduk hingga larut
Disaring
Residu/kotoran filtrat 500 ml air kelapa
Dituangkan kedalam wadah fermentasi yang telah disterilkan dalam keadaan panas
Didinginkan
Ditambahkan 10% starter
Acetobacter xylinum
Diinkubasi pada suhu kamar selama ± 14 hari
Hasil
3.4.2 Pembuatan Nata
Larutan asam bergula
Ditambahkan 10% gula
Ditambahkan 0,5% urea
Dipanaskan sambil diaduk hingga larut
Disaring
Residu/kotoran filtrat 100 ml air kelapa
Dituangkan kedalam wadah fermentasi yang telah disterilkan dalam keadaan panas
Didinginkan
Ditambahkan 10%l starter
Acetobacter xylinum
Diinkubasi pada suhu kamar selama ± 14 hari Ditambahkan CH3COOH(l) 25% hingga pH 4
Pembuatan Nata dengan Penambahan Sari Buah Markisa
Larutan asam bergula
Ditambahkan 10% gula
Ditambahkan 0,5% urea
Dipanaskan sambil diaduk hingga larut
Disaring
Residu/kotoran filtrat
90 ml air kelapa 10 ml sari buah markisa
Dituangkan kedalam wadah fermentasi yang telah disterilkan dalam keadaan panas
Didinginkan
Ditambahkan 10% starter
Acetobacter xylinum
Diinkubasi pada suhu kamar selama ± 14 hari Ditambahkan CH COOH3 (l) 25% hingga pH 4
3.4.3 Penentuan Serat
Dihilangkan kandungan lemaknya dengan n-heksan menggunakan metode soklet selama 2 jam
Dikeringkan
Ditambahkan 50 ml H2SO4 1,25 % dan didihkan selama 30 menit
Ditambahkan 50 ml NaOH 3,25 % dan didihkan selama 30 menit
Disaring dengan kertas saring whatman no. 42
residu filtrat
Dicuci dengan H2SO4 1,25 % yang telah dipanaskan
Dicuci dengan akeadest panas
Dicuci dengan etanol 96 %
Dimasukkan ke dalam cawan porselin yang telah diketahui beratnya
Dikeringkan dalam oven pada suhu 105o C
Didinginkan dalam desikator
Ditimbang sampai berat konstan
Diabukan dalam tanur pada suhu 600o C
Didinginkan dalam desikator
Ditimbang sampai berat konstan
Dihitung kadar seratnya
1,0071 g sampel
3.4.4 Penentuan Kadar Vitamin C
1 ml sampel
Hasil
Dilakukan perlakuan yang sama sebanyak 3 kali Dicatat volume I2 0,01 N yang terpakai
Dititrasi dengan larutan standard I2 0,01 N
hingga terjadi perubahan warna menjadi biru Ditambahkan 3 tetes indikator amilum 1 % Dimasukkan ke dalam gelas Erlenmeyer
Dipipet 10 ml dengan menggunakan pipet volum Dihomogenkan
Diencerkan dalam labu takar 100 ml dengan
3.4.5 Penentuan Kadar Glukosa
5 ml Fehling A 5 ml Fehling B
Dimasukkan ke dalam gelas Erlenmeyer secara
bersamaan
Ditambahkan 15 ml larutan sample yang telah
diencerkan dari dalam buret
Ditambahkan 3 tetes indikator metilen biru
Dipanaskan
Dititrasi dengan larutan sample dalam keadaan
panas sampai diperoleh endapan merah bata
Dihitung jumlah volume larutan sample yang
terpakai
BAB 4
HASIL DAN PEMBAHASAN
4.1. Hasil Penelitian
4.1.1. Perhitungan Kadar Serat
1. Penentuan kadar serat pada nata dapat dihitung dengan cara sebagai berikut:
Berat sampel = 1,0071 g
Berat kertas saring = 1,1284 g
Berat kertas saring + endapan + cawatan = 21,8536 g
Berat cawan + abu = 21,8131 g
Kadar serat = berat serat x 100 % berat sampel
= 0,0405 g x 100% = 4,0214 % 1,0071 g
A1 = 4, 0214 %
A2 = 4, 0219 %
A3 = 4, 0227 %
2. Penentuan kadar serat nata dengan penambahan sari buah markissa dengan
perbandingan 90: 10, dapat dihitung dengan cara sebagai berikut:
Berat sampel = 1,1225 g
Berat kertas saring = 1,1239 g
Berat cawan + abu = 21,1779 g
Berat serat = 0,044 g
Kadar serat = berat serat x 100 % berat sampel
= 0,044 g x 100% = 3,9198 % 1,1225 g
A1 = 3,9198 %
A2 = 3,91217 %
A3 = 3,9223 %
a) 80 : 20
Berat sampel = 1,1325 g
Berat kertas saring = 1,1285 g
Berat kertas saring + endapan + cawatan = 21,225 g
Berat cawan + abu = 21,1800 g
Berat serat = 0,0451 g
Kadar serat = berat serat x 100 % berat sampel
= 0,0451 g x 100% = 3,983 % 1,1325 g
A1 = 3,983 %
A2 = 3,9871 %
b) 70 : 30
Berat sampel = 1,0115 g
Berat kertas saring = 1,1238 g
Berat kertas saring + endapan + cawatan = 21,4517 g
Berat cawan + abu = 21,4123 g
Berat serat = 0,0394 g
Kadar serat = berat serat x 100 % berat sampel
= 0,0394 g x 100% = 3,8952 % 1,0115 g
A1 = 3,8952 %
A2 = 3,8986 %
A3 = 3,8967%
c) 60 : 40
Berat sampel = 1,0238 g
Berat kertas saring = 1,1247 g
Berat kertas saring + endapan + cawatan = 21,4928 g
Berat cawan + abu = 21,4537 g
Berat serat = 0,0391 g
Kadar serat = berat serat x 100 % berat sampel
A1 = 3,8191 %
A2 = 3,8167 %
A3 = 3,8185 %
d) 50 : 50
Berat sampel = 1,0115 g
Berat kertas saring = 1,1319 g
Berat kertas saring + endapan + cawatan = 21,4831 g
Berat cawan + abu = 21,4449 g
Berat serat = 0,0382 g
Kadar serat = berat serat x 100 % berat sampel
= 0,0382 g x 100% = 3,983 % 1,0115 g
A1 = 3,7765 %
A2 = 3,7781 %
4.1.2. Penentuan Kadar Vit. C
1. Penentuan kadar vitamin C nata dapat dihitung dengan cara sebagai berikut:
Berat sampel = 100 gram
Volume I2 0.01 N yang terpaksa saat titrasi = 0.083 ml
Faktor pengenceran = 100 = 100 10
Kadar Vitamin C =
sampel Beras Fe x x I N x I
Volume 2 2 88.068
=
g x x x 100 10 068 . 88 01 . 0 083 . 0 x 100%A1 = 0,7309 %
A2 = 0,7323 %
A3 = 0,7312 %
2. Penentuan kadar vitamin C nata dengan penambahan sari buah markisa
dengan masing-masing perbandingan dapat dihitung sebagai berikut:
a) 60 : 40
Volume I2 0.01 N
Kadar Vitamin C =
sampel Beras Fp x x I N x I
Volume 2 2 88.068
=
g x x x 100 10 068 . 88 01 . 0 04 x 100%A2 = 3,5236 %
A3 = 3,5229 %
b) 70 : 30
Volume I2 0.01 N yang terpakai = 0, 3667 ml
Kadar Vitamin C =
sampel Beras Fp x x I N x I
Volume 2 2 88.068
=
g x x x x 100 10 068 . 88 01 . 0 3667 03 x 100%= 3.2294 %
A1 = 3,2294 %
A2 = 3,2295 %
A3 = 3,2268 %
c) 80 : 30
Volume I2 0.01 N yang terpakai = 0.333 ml
Kadar Vitamin C =
sampel Beras Fp x x I N x I
Volume 2 2 88.068
=
g x x x 100 10 068 . 88 01 . 0 333 . 0 x 100%A1 = 2,9327 %
A2 = 2,9331 %
A3 = 2,9326 %
d) 90 : 10
Volume I2 0.01 N yang terpakai = 0.3 ml
Kadar Vitamin C =
sampel Beras Fp x x I N x I
Volume 2 2 88.068
=
g x x x 100 10 068 . 88 01 . 0 03 x 100%= 2.64204%
A1 = 2,64204 %
A2 = 2,64103 %
A3 = 2,641913 %
d) 50 : 50
Volume I2 0.01 N yang terpakai = 0.433 ml
Kadar Vitamin C =
sampel Beras Fp x x I N x I
Volume 2 2 88.068
=
g x x x 100 10 068 . 88 01 . 0 433 . 0 x 100%A1 = 3,8133 %
A2 = 3,8101 %
A3 = 3,8129 %
4.1.3. Penentuan Kadar Glukosa
1. Penentuan kadar glukosa (gula reduksi) nata dapat dihitung dengan cara
sebagai berikut:
Faktor koreksi analisa gula reduksi (F) = 51.5
Volume titran = 14 ml
Faktor Pengencoran (Fp) = 1 x 100 ml / 100 manajemen
% gula reduksi =
titran V
Fp x x F 100
x 100%
= 14
100 5 . 51 x
x 100%
= 36.784.71429 %
A1 = 36785.71429 %
A2 = 36785.8231%
2. Penentuan kadar glukosa nata dengan penambahan sari buah markisa dapat
dihitung sebagai berikut:
a) 90 : 10
F = 51.6
Vol. Titran = 16 ml
Fp = 1
% Gula reduksi = 16
100 6 . 51 x
x 100% = 32250%
A1 = 32250 %
A2 = 32261%
A3 = 32251 %
b) 80: 10
F = 51.8
Vol. Titran = 20 ml
Fp = 1
% Gula reduksi = 20
100 8 . 51 x
x 100% = 25900%
A1 = 25900 %
A2 = 25981%
c) 70: 30
F = 51.9
Vol. Titran = 16 ml
Fp = 1
% Gula reduksi = 23
100 9 . 51 x
x 100% = 22565.21739%
A1 = 22565.21739 %
A2 = 22565.3881%
A3 = 22656.3910 %
d) 60 : 40
F = 52.1
Vol. Titran = 27 ml
Fp = 1
% Gula reduksi = 27
100 1 . 52 x
x 100% = 19296.2963%
A1 = 19296.2963 %
A2 = 19296.3105%
e) 50 : 50
F = 51.2
Vol. Titran = 29 ml
Fp = 1
% Gula reduksi = 29
100 2 . 52 x
x 100% = 18000%
A1 = 18000%
A2 = 18125%
[image:56.612.114.573.427.545.2]A3 = 18002%
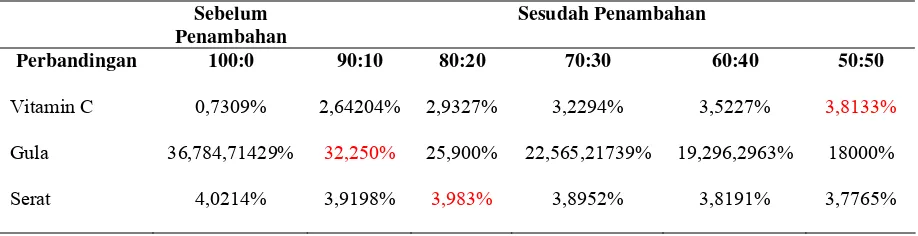
Tabel 4.1. Hasil Perhitungan Vitamin C, Gula dan Serat, Sebelum dan Sesudah
Penambahan Sari Buah Markisa
Sebelum Penambahan
Sesudah Penambahan
Perbandingan 100:0 90:10 80:20 70:30 60:40 50:50
Vitamin C 0,7309% 2,64204% 2,9327% 3,2294% 3,5227% 3,8133%
Gula 36,784,71429% 32,250% 25,900% 22,565,21739% 19,296,2963% 18000%
Serat 4,0214% 3,9198% 3,983% 3,8952% 3,8191% 3,7765%
Berdasarkan data tabel 4.1, bahwa pada Vitamin C nilai kandungan Vitamin C
tertinggi terdapat pada perbandingan 50:50, sedangkan pada gula nilai tertinggi gula
terdapat pada perbandingan 90:10 dan pada uji serat nilai serat tertinggi terdapat pada
4.2. Analisis Spektroskopi FT-IR
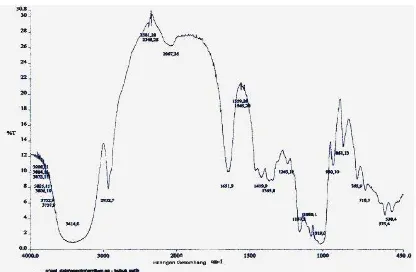
4.2.1. Spektrum FT-IR Nata
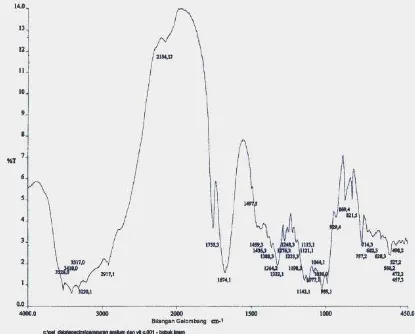
[image:58.612.106.522.191.463.2]Spektrum FT-IR Nata dapat dilihat pada gambar di bawah ini :
Gambar 4.2. Spektrum FT-IR Nata
Pada gambar 4.2 menunjukkan spektrum FT-IR Nata dengan serapan puncak-puncak pada bilangan gelombang: 3414,0 cm-1 yang menunjukkan adanya vibrasi
ulur–OH yang didukung vibrasi tekuk –OH pada 1651,9 cm-1; bilangan gelombang
2932,7 cm-1 menunjukkan adanya vibrasi ulur C-H yang didukung vibrasi tekuk C-H
asimetris pada 1419,9 cm-1 dan vibrasi tekuk C-H simetris pada 1365,8 cm-1; serapan
dengan dua puncak pada 1157,2 cm-1 dan 1019 cm-1 menunjukkan adanya vibrasi
gugus C-O-C eter dari ikatan glikosida antar monomer glukosa yang terpaut satu
sama lain; serapan dengan intensitas medium pada 765,9 cm-1 - 530 cm-1
4.2.2. Spektrum FT-IR Nata dengan penambahan sari buah markisa untuk perbandingan 90:10
Spektrum FT-IR Nata de markis dengan panambahan sari buah markissa
[image:59.612.113.528.221.555.2]untuk perbandingan 90:10 dapat dilihat pada gambar di bawah ini :
Gambar 4.5. Spektrum FT-IR Nata dengan panambahan sari buah markisa untuk perbandingan 90:10
Pada gambar 4.5 menunjukkan spektrum FT-IR Nata dengan panambahan sari
buah markissa untuk perbandingan 90:10 dengan serapan puncak-puncak pada
bilangan gelombang: 3526 cm-1 – 3220,1 cm-1 menunjukkan adanya vibrasi ulur
vibrasi tekuk C-H asimetris pada 1497,5 cm-1 dan vibrasi tekuk C-H simetris pada
1388,3 cm-1; serapan dengan pita tajam pada pada 1755,3 cm-1 menunjukkan adanya
vibrasi gugus C=O dari R-CO-OR (lakton) dari vitamin C dari markissa; 1674,1 cm-1
menunjukkan adanya vibrasi gugus C=C dari alkena alifatik pada vitamin C; serapan
pada 1198,3 cm-1 – 989,1 cm-1 menunjukkan adanya vibrasi gugus C-O-C eter dari
ikatan glikosida.
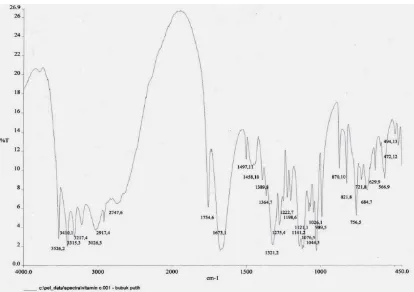
4.2.3. Spektrum FT-IR Nata dengan penambahan sari buah markisa untuk perbandingan 50:50
[image:60.612.115.529.358.650.2]Spektrum FT-IR Nata dengan penambahan sari buah markissa dapat dilihat pada
gambar di bawah ini :
Pada gambar 4.4 menunjukkan spektrum FT-IR Nata dengan penambahan sari
buah markissa untuk perbandingan 50:50 dengan serapan puncak-puncak pada
bilangan gelombang: 3526,2 cm-1 - 3026,3 cm-1 menunjukkan adanya vibrasi ulur –
OH; bilangan gelombang 2917,4 cm-1 - 2747,6 cm-1 menunjukkan adanya vibrasi ulur
C-H yang didukung vibrasi tekuk C-H asimetris pada 1497,11 cm-1 dan vibrasi tekuk
C-H simetris pada 1458,10 cm-1; serapan dengan pita tajam pada 1754,6 cm-1
menunjukkan adanya vibrasi gugus R-CO-OR (lakton); 1673,1 cm-1 menunjukkan
adanya vibrasi gugus C=C dari alkena alifatik; 1141,2 cm-1 - 1026,1 cm-1
menunjukkan adanya vibrasi gugus C-O-C eter.
Terdapat spektrum yang banyak dan kurang jelas di daerah sidik jari (1000 -
BAB V
KESIMPULAN DAN SARAN
5.1. KESIMPULAN
1. Dari hasil penelitian dapat disimpulkan bahwa Acetobacter Xylinum dalam
media yang dimodifikasi dengan penambahan sari buah markisa, maka dapat
menghasilkan nata de markis dengan aroma dan rasa markisa.
2. Dari analisis Vit C, setelah penambahan sari buah markisa hasilnya nata de
markis mengalami peningkatan kadar Vit C.
3. Dari analisis kadar serat, setelah penambahan sari buah markisa hasilnya nata
de markis mengalami penurunan kadar serat.
4. Dan dari analisis glukosa, setelah penambahan sari buah markisa hasilnya nata
de markis dapat di simpulkan juga mengalami penurunan kadar glukosa.
5.2. SARAN
Sebaiknya penelitian di lanjutkan agar produk di atas dapat di buat menjadi
DAFTAR PUSTAKA
Anonim2, online (2008), Indonesia Nata de Coco
http://www.inacofood,wordpress,com
anonimb, online (2008), Memproduksi Nata de Coco.
http://www.MEMPRODUKSI NATA DE COCO, htm
Anonimc, online (2008) Nata de Coco.
http://www.id.wikipedia.org.
anonimd, online (2008), Teknologi Pembuatan Nata de Coco.
http://www.pascapanen.litbang,deptan.go.id.
Anonima, online (2009), Nata de Coco.
http://wordpress.com/2009/06/08/pohonkelapa.
Astarwa. M., (2009). Acetobacter Xylinum dan Nata
http://www.permimimalang.wordpress.com
Astawa. M., (2004). Nata yang Kaya Serat.http://www.kompas.com. Fessenden J.R. 1986, Selulosa.
Hartd H., 2003, Selulosa.
Hidayat., 2007, Jenis-jenis Acetobacter. Nurwantoro, 1997, Fase Adaptasi.
Palongkung., 1999, Perbandingan Komposisi Air Kelapa Muda dengan Air Kelapa Tua.
Pambayun R., 2002. Tanaman Kelapa dan Permentasi. Pelczar dan Chan., 1988. Acetobacter Xylinum.
Philip G.O. dan William P.A., 2000. Acetobacter. Suhardiyono L., 1999. Tanaman Kepala.
Winarno F.G., 1992. Fermentasi Nata de Coco.
Yanuar A., 2003. Pengamplikasian dalam Bidang Medis.