DAFTAR PUSTAKA
Abidin, Z. 1985. Dasar-Dasar Pengetahuan Tentang Zat Pengatur Tumbuh. PT Angkasa, Bandung.
Azwin. 2007. Evaluasi Stabilitas Genetik Tanaman Gaharu (Aquilaria
malaccensis Lamk.) Hasil Kultur In Vitro.
Dixon, J. And Gonzales, A. 1994. Plant Cell Culture. A Practical Approach. Second Edition. Oxford University Press. New York.
blogspot.com/2008/01/budidaya-gaharu-budidaya-gaharu-terdiri.html. [23 April 2008].
George, E.F. And P.D. Sherrington. 1984. Plant Propagation By Tissue Culture.Handbook And Directory Of Comercial Laboratory. Exegeticts. Ltd. England.
Gunawan, L. W. 1995. Teknik Kultur Jaringan In Vitro dalam
Hortikultura. Penebar Swadaya. Jakarta.
Gustian. 2009. Upaya Perbanyakan Tanaman Penghasil Gaharu (Aquilaria
malaccensis Lamk ) Secara In Vitro. Universitas Andalas, Padang.
Gomez, K. A. dan Gomez A. A. 1995. Prosedur Statistik untuk Penelitian Pertanian. Edisi Kedua. Universitas Indonesia Press. Jakarta.
Hanafiah, K. A. 2005. Rancangan Percobaan:Teori dan Aplikasi. PT Grafindo Persada, Jakarta.
Heddy, S. 1986. Hormon Tumbuhan. CV Rajawali Press. Jakarta.
Hendaryono, D. P. S. dan Wijayani, A. 1994. Teknik Kultur Jaringan Pengenalan dan Petunjuk Perbanyakan Tanaman secara Vegetatif-Modern. Kanisius, Yogyakarta.
Isnaini, Y. dan Situmorang, J. 2005. Aplikasi Bioteknologi Untuk Pengembangan Tanaman Gaharu (Aquilaria spp.) di Indonesia. Studi Kasus: Perkembangan Penelitian Gaharu di Seameo Biotrop.
Kartasapoetra, G. A. 2003. Teknologi Benih. Rineka Cipta, Jakarta.
Kosmiatin, M., Husni, A., dan Mariska, I. 2005. Perkecambahan dan Perbanyakan
Gaharu secara In Vitro.
[21 April 2008].
Mulyaningsih, T. dan Nikmatullah, A. 2006. Gaya Belajar Kultur Jaringan Melalui Publikasi World Wide Web. http://e-learning.unram.ac.id/ KulJar /BAB%20III%20MEDIA/III6%20%20Zat%20Pengatur%20Tumbuh.htm.
Santosa, S. 2007. Zat Pengatur Tumbuh.
Fakultas Pertanian Unram. [28 November 2008].
Sofia, D. H. 2007. Pengaruh Berbagai Konsentrasi Benzyl Amino Purine dan Cycocel Terhadap Pertumbuhan Embrio Kedelai (Glycine max L. Merr.) Secara In Vitro. USU Repository, Medan.
Sumarna, Y. 2002. Budidaya Gaharu. Cetakan 1. Penebar Swadaya, Jakarta.
Suryowinoto, M. 1996. Pemuliaan Tanaman secara In Vitro. Kanisisus, Yogyakarta.
Susanto, I. 2010. Budidaya Gaharu Sistem Bioinduksi.
Tarigan, K. 2004. Profil Pengusahaan (Budidaya) Gaharu. Departemen Kehutanan, Pusat Bina Penyuluhan Kehutanan, Jakarta.
Tini, N., dan Amri, K. 2002. Mengebunkan Jati Unggul: Pilihan Investasi Prospektif. Cetakan 1. Agromedia Pustaka, Jakarta.
Yunita, R. 2004. Perbanyakan dan Transformasi Genetik Menggunakan
Agrobacterium tumefaciens pada Tanaman Melinjo (Gnetum gnemon)
dengan Teknik Kultur Jaringan. Riau. Kelji Sumber Daya, Balai Pengkajian Teknologi Pertanian.
World Wild Flora and Fauna (WWF). 2006. Gaharu (Aquilaria).
ABSTRAK
FANI ANGGRIANI : Induksi Tunas Tanaman Gaharu (Aquilaria malaccencis Lamk.) dengan Menggunakan Kombinasi Zat Pengatur Tumbuh BAP dan IAA secara In Vitro. Dibawah bimbingan Dr. Ir. Edy Batara Mulya Siregar, MS dan Nelly Anna, S. Hut. M. Si
Gaharu (Aquilaria malaccensis Lamk.) adalah salah satu tanaman hutan tropis penghasil resin yang bernilai ekonomi tinggi. Meningkatnya permintaan gaharu dari tahun ke tahun menyebabkan terjadinya penebangan liar dari hutan alam yang tidak terkontrol. Untuk mengatasi permasalahan ini, perlu dilakukan pengembangan tanaman gaharu. Teknik in vitro merupakan teknologi yang dapat digunakan untuk perbanyakan bibit gaharu. Tujuan penelitian ini adalah untuk mengetahui kombinasi konsentrasi zat pengatur tumbuh terbaik terhadap induksi tunas tanaman gaharu. Analisis data dilakukan dengan menggunakan rancangan acak lengkap non faktorial dengan 4 perlakuan dan 3 ulangan.
Hasil penelitian menunjukkan bahwa kombinasi zat pengatur tumbuh BAP dan IAA berpengaruh nyata terhadap persentase hidup, waktu induksi tunas, jumlah tunas, dan panjang tunas. Sedangkan untuk parameter jumlah daun, kombinasi konsentrasi BAP dan IAA tidak memberikan pengaruh nyata.
Perlakuan zat pengatur tumbuh BAP 1.0 ppm dan IAA 0.5 ppm merupakan konsentrasi yang optimum dan terbaik dalam menghasilkan jumlah tunas, panjang tunas, dan jumlah daun tanaman gaharu.
ABSTRACT
FANI ANGGRIANI: Shoot Induction Agarwood (Aquilaria malaccencis Lamk.)
with Use Combination Different Growth Regulator by In Vitro. Under academic
supervision by Dr. Ir. Edy Batara Mulya Siregar, MS and Nelly Anna, S. Hut. M. Si
Agarwood (Aquilaria malaccensis Lamk.) is one of the important tropical forest trees, which produces a high economically valuable fragrant resinous wood. The increase of agarwood demand from year to year leads to uncontrolled illegal harvest of this plant from its natural habitat. To encounter this problem, there is an urgent need to develop agarwood plantation. The pusrpose of this research is to determine of combination concentrate the best growth regulators for shoot induction of agarwood. The methode used is complete random with four treathments and three replicanst.
The results showed that combination growth regulators BAP and IAA make real influence such as life percentation, time of shoot induction, total shoot, and long shoot. At the same time for parameter total leaf, combination concentrated BAP and IAA has not a real influence.
The treatment of growth regulators BAP 1.0 ppm and IAA 0.5 ppm is the optimum and the best concentrated in produce total shoot, long shoot, and total leaf of agarwood.
PENDAHULUAN
Latar Belakang
Gaharu (Aqularia malaccencis Lamk.) sebenarnya bukan nama tumbuhan, tetapi sebagai hasil dari pohon atau kayu dengan famili Thymeleaceae dan bermarga Aquilaria. Gaharu adalah salah satu jenis tanaman hutan yang memiliki mutu sangat baik dengan nilai ekonomi tinggi karena kayunya mengandung resin yang harum. Selain untuk keperluan agama seperti dupa untuk sembahyang, gaharu juga dipakai sebagai bahan pembuat parfum, pengawet berbagai jenis aksesoris, sabun sari aroma gaharu, pengobatan, aroma terapi, kosmetik, dan sampo (Kosmiatin, et al., 2005).
Selama ini gaharu diambil langsung dari hutan alam sehingga populasi tanaman ini hampir punah. Sejak tahun 1994 CITES (Convention on International
Trade in Endengered Species of Wild Fauna and Flora) menetetapkan tanaman
penghasil gaharu A. malaccencis termasuk APENDIX II, yaitu jenis tanaman yang terancam punah. Kepunahan tanaman gaharu selain disebabkan oleh eksploitasi yang terus menerus juga belum tersedianya budidaya yang efisien (Isnaini dan Situmorang, 2005).
dimanfaatkan dan memberikan harapan di masa mendatang untuk mengatasi penyediaan bibit gaharu. Aplikasi teknologi ini dibidang pertanian selain dimanfaatkan untuk perbanyakan juga untuk konservasi dan perbaikan tanaman. Pemanfaatan teknik in vitro terutama metode mikropropagasi dan embriogenesis somatik menjadi alternatif utama dalam pengembangan dan konservasi gaharu (Susanto, 2010).
Pada umumnya, tanaman berkayu sangat sulit melakukan proliferasi tunas dan regenerasi, sehingga diperlukan manipulasi di dalam media tumbuhnya agar eksplan mampu melakukan regenerasi membentuk tanaman utuh. Penambahan sitokinin dalam media pada umumnya sangat diperlukan pada tahap induksi maupun penggandaan tunas. Oksidasi fenol pada tanaman berkayu juga cukup tinggi sehingga sering menghambat pertumbuhan eksplan. Penambahan senyawa yang dapat mengantisipasi aktivitas ini menjadi sangat diperlukan (Dixon and Gonzales, 1994).
Tujuan Penelitian
Tujuan penelitian ini adalah untuk mengetahui kombinasi konsentrasi zat pengatur tumbuh BAP dan IAA yang sesuai terhadap persentase hidup, waktu induksi tunas, jumlah tunas, jumlah daun dan panjang tunas tanaman gaharu.
Hipotesis Penelitian
Manfaat Penelitian
Manfaat penelitian ini adalah:
1. Sebagai bahan dan informasi dalam perbanyakan gaharu melalui kultur jaringan.
TINJAUAN PUSTAKA
Botani Gaharu (Aquilaria malaccensis Lamk)
Gaharu merupakan gumpalan berbentuk padat berwarna coklat kehitaman sampai hitam, dan berbau harum jika dibakar. Gaharu terdapat pada bagian kayu atau akar dari jenis pohon penghasil gaharu yang telah mengalami proses perubahan kimia dan fisika akibat terinfeksi oleh sejenis jamur. Pohon penghasil gaharu terbaik saat ini adalah dari jenis Aquilaria spp. yaitu Aquilaria
malaccencis Lamk. Berikut taksonominya:
Kingdom : Plantae
Divisi : Termathophyta Sub Divisi : Angiospermae Klas : Dikotiledonae Ordo : Myrtales Family : Thymeleacae Genus : Aquilaria
Spesies : Aquilaria malaccencis Lamk. (Tarigan, 2004)
Penyebaran Gaharu
Myanmar, Lao PDR, Thailand, Kamboja, China Selatan, Malaysia, Philipina dan Indonesia. Enam diantaranya ditemukan di Indonesia (A. malaccensis, A.
microcarpa, A. hirta, A. beccariana, A. cumingiana dan A. filarial). Keenam
jenis tersebut terdapat hampir di seluruh kepulauan Indonesia, kecuali Jawa, Bali dan Nusa Tenggara. Marga Gonystilus memiliki 20 spesies, tersebar di Asia Tenggara mulai dari Malaysia, Peninsula, Serawak, Sabah, Indonesia, Papua New Guinea, Philipina dan kepulauan Solomon serta kepulauan Nicobar. Sembilan spesies diantaranya terdapat di Indonesia yaitu: Sumatera, Kalimantan, Bali, Maluku dan Irian Jaya. Marga Gyrinops memiliki tujuh spesies. Enam diantaranya tersebar di Indonesia bagian timur serta satu spesies terdapat di Srilanka (WWF, 2006).
Kandungan Gaharu
sangat terkenal bahkan sangat disukai oleh Negara-negara lain khususnya masyarakat Timur Tengah, Saudi Arabia, Uni Emirat, Yaman, Oman, daratan Cina, Korea, dan Jepang sehingga dibutuhkan sebagai bahan baku industri parfum, obat-obatan, kosmetika, dupa, dan pengawet berbagai jenis asesoris serta untuk keperluan kegiatan religius gaharu sudah lama digunakan bagi pemeluk agama Islam, Budha, dan Hindu (Gaharu-Man, 2008).
Kultur Jaringan
Kultur jaringan bila diartikan ke dalam bahasa Jerman disebut Gewebe
kultur atau tissue culture (Inggris) atau weefsel kweek atau weefsel cultuur
(Belanda). Kultur jaringan atau budidaya in vitro adalah suatu metode untuk mengisolasi bagian dari tanaman seperti protoplasma, sel, jaringan atau organ yang steril, ditumbuhkan pada media buatan yang steril, dalam botol kultur yang steril dan dalam kondisi yang aseptik, sehingga bagian-bagian tersebut dapat memperbayak diri dan beregenerasi menjadi tanaman yang lengkap (Mulyaningsih dan Nikmatullah, 2006).
tumbuh disesuaikan dengan macam eksplan yang digunakan. Zat pengatur tumbuh auksin dan sitokinin dapat diberikan bersama-sama atau auksin saja atau sitokinin saja. Penambahan zat pengatur tumbuh ini tergantung dari tujuan kita, misalnya untuk menginduksi pertumbuhan kalus saja atau ingin menumbuhkan akarnya atau tunasnya dahulu atau kedua-duanya (Hendaryono dan Wijayani, 1994).
budidaya yang optimal. Sedangkan kelemahan dari in vitro yaitu bibit hasil kultur jaringan sangat rentan terhadap hama penyakit dan udara luar, membutuhkan modal investasi awal yang tinggi, dan diperlukan persiapan sumber daya manusia yang handal (Tini dan Amri, 2002).
Permasalahan Kultur Jaringan
Menurut Suryowinoto (1996) selain itu ada juga permasalahan yang timbul yaitu:
1. Adanya instabilitas di dalam sel atau jaringan adalah suatu permasalahan karena akan terjadi variasi. Akan terjadi varian-varian yang dalam tujuan
cloning tidak dikehendaki.
2. Masih sedikitnya pengetahuan yang berhubungan sangat erat dengan faktor-faktor yang mengganggu pembentukan organ-organ maupun pembentukan embrio, juga mengenai faktor-faktor fisik yang mengganggu budidaya in vitro. 3. Semak dan terutama pohon dewasa sulit diperbanyak klonnya secara in vivo
maupun in vitro.
4. Regenerasi pembentukan klon dari tunas adventif sangat sulit dirangsang untuk menjadi semak atau pohon.
5. Sangat sulit menanggulangi kontaminasi yang berasal dari material tanaman lapangan, jika dihubungkan dengan eksploitasi komersial.
6. Infeksi internal sangat sulit diatasi.
pasti. Akibatnya, estimasi perolehan genetik (expected genetic gain) yang akan diproleh juga belum optimal.
Sebelum membuat media, maka terlebih dahulu kita harus menentukan media apa yang akan kita buat. Jenis media dengan komposisi unsur kimia yang berbeda dapat digunakan untuk media tumbuh dari jaringan tanaman yang berbeda pula. Kita mengenal beberapa macam media dasar yang pada umumnya diberi nama sesuai dengan nama penemunya, antara lain adalah:
1. Media dasar Murashige dan Skoog (MS): digunakan untuk hampir semua macam tanaman, terutama tanaman herbaceous. Media ini mempunyai konsentrasi garam-garam mineral yang tinggi dan senyawa N dalam bentuk NO3- dan NH4+.
2. Media dasar B5 atau Gamborg: digunakan untuk kultur suspensi sel kedele,
alfalfa dan legume lain.
3. Media dasar White: digunakan untuk kultur akar. Media ini merupakan media dasar dengan konsentrasi garam-garam mineral yang rendah.
4. Media Vacin Went (VW): digunakan khusus untuk media anggrek.
5. Media dasar Nitsch dan Nitsch: digunakan untuk kultur tepung sari (pollen) dan kultur sel.
6. Media dasar Schenk dan Hildebrandt: digunakan untuk kultur jaringan tanaman monokot il.
7. Media dasar Woody Plant medium (WPM): digunakan untuk tanaman yang berkayu.
Kultur Jaringan Tanaman Gaharu (Aquilaria malaccensis Lamk)
Pemanfaatan gaharu hingga saat ini masih dalam bentuk bahan baku yaitu kayu bulatan, cacahan, bubuk, atau fosil kayu yang sudah terkubur. Aroma yang dikeluarkan gaharu sangat populer dan disukai masyarakat Timar Tengah, Saudi Arabia, Uni Emirat, Yaman, Oman, daratan China, Korea, dan Jepang. Gubal gaharu digunakan sebagai dupa, wewangian, penghilang rasa sakit, asma, reumatik, tonik saat hamil setelah melahirkan. Gubal gaharu juga dimanfaatkan sebagai pelengkap dalam acara ritual keagamaan pada masyarakat khususnya di kawasan Asia dan Timur Tengah dalam bentuk dupa, hio, atau kemenyan (Sumarna, 2002).
dijadikan sumber plasma nutfah tanaman gaharu dibandingkan dengan cara konvensional dengan menggunakan biji maupun stek atapun cangkok. Perbanyakan tanaman gaharu terutama spesies Aquilaria malaccensis secara in
vitro di Indonesia sampai saat ini belum berkembang (Gustian, 2009).
(topofisis), ukuran eksplan, perlukaan, metode inokulasi, perawatan eksplan dan persiapan atau perlakuan terhadap tanaman induk (Azwin, 2007).
Zat pengatur tumbuh yang paling penting diperhatikan dalam kultur jaringan adalah keseimbangan penggunaan konsentrasinya. Keseimbangan konsentrasi auksin dan sitokinin dalam media dan eksplan dapat mendorong pertumbuhan dan perkembangan eksplan membentuk plantlet. Konsentrasi auksin lebih tinggi dari sitokinin maka mendorong eksplan membentuk kalus dan akar (rootlet), tetapi apabila konsentrasi sitokinin lebih tinggi dari auksin maka akan mendorong eksplan membentuk tunas atau shootlet (Isnaini dan Situmorang, 2005).
Media Murashige dan Skoog (MS)
dalam media MS dapat terjadi pengendapan persenyawaan, ini terlihat jelas pada media cair. Kebanyakan dari persenyawaan yang mengendap adalah fosfat dan besi, kemudian dalam jumlah yang lebih sedikit adalah Ca, K, N, Zn dan Mn. Senyawa paling sedikit adalah senyawa yang mengandung unsur C, Mg, H, Si, Mo, S, Ca dan Co. Setelah tujuh hari dibiarkan, maka kira-kira 50% dari Fe dan 13% dari PO4+, mengendap. Pengendapan unsur-unsur tersebut mungkin tidak penting, karena unsur-unsur tersebut masih tersedia bagi jaringan tanaman dan pengaruh pengendapannya belum diketahui. Untuk mengatasi pengendapan Fe, konsentrasi Fe dikurangi sampai 1/3 dengan EDTA yang tetap (Dalton et al, 1983 dalam Tini dan Amri, 2002).
Zat Pengatur Tumbuh (ZPT)
adenine. Golongan ini sangat penting dalam pengaturan pembelahan sel dan morfogenesis. Fungsi giberelin antara lain adalah mematahkan dormansi, memacu perkecambahan, dan memacu terjadinya proses imbibisi. Etilen adalah hormon tumbuh yang secara umum berlainan dengan auksin, giberelin, dan sitokinin. Dalam keadaan normal etilen akan berbentuk gas dan struktur kimianya sangat sederhana sekali. Di alam etilen akan berperan apabila terjadi perubahan secara fisiologis pada suatu tanaman. hormon ini akan berperan pada proses pematangan buah dalam fase climacteric. Inhibitor adalah zat yang menghambat pertumbuhan pada tanaman, sering didapat pada proses perkecambahan, pertumbuhan pucuk atau dalam dormansi. Di dalam tanaman, inhibitor menyebar disetiap organ tubuh tanaman tergantung dari jenis inhibitor itu sendiri. Secara garis besar ternyata inhibitor ini menghambat aktivitas auksin, giberelin, dan sitokinin (Abidin, 1985).
Dalam kultur jaringan, ada dua golongan zat pengatur tumbuh yang sangat penting adalah sitokinin dan auksin. Zat pengatur tumbuh sangat diperlukan sebagai komponen media bagi pertumbuhan dan diferensiasi. Tanpa penambahan ZPT dalam media, pertumbuhan sangat terhambat bahkan mungkin tidak tumbuh sama sekali. Pembentukan kalus dan organ-organ ditentukan oleh penggunaan yang tepat dari ZPT tersebut. Zat pengatur tumbuh ini mempengaruhi pertumbuhan dan morfogenesis dalam kultur sel, jaringan dan organ. Interaksi dan perimbangan antara zat pengatur tumbuh yang diberikan dalam media dan yang diproduksi oleh sel secara endogen, menentukan arah perkembangan suatu kultur. Penambahan auksin atau sitokinin eksogen, mengubah level zat pengatur tumbuh endogen sel. Level zat pengatur tumbuh endogen ini kemudian merupakan
auksin dan sitokinin, giberelin dan persenyawaan-persenyawaan lain juga ditambahkan dalam kasus-kasus tertentu (Mulyaningsih, dan Nikmatullah, 2006).
IAA (Indole Acetic Acid)
Auksin adalah salah satu hormon tumbuh yang tidak terlepas dari proses pertumbuhan dan perkembangan (growth and development) suatu tanaman. Hasil penemuan mengemukakan bahwa Indole Acetic Acid (IAA) adalah suatu auksin. Di dalam alam, stimulasi auksin pada pertumbuhan celeoptile ataupun pucuk suatu tanaman, merupakan suatu hal yang dapat dibuktikan. Hasil penelitian terhadap metabolisme auksin menunjukan bahwa konsentrasi auksin di dalam tanaman mempengaruhi pertumbuhan tanaman. Adapun faktor-faktor yang mempengaruhi konsentrasi IAA ini adalah :
a. Sintesis Auksin b. Pemecahan Auksin
c. In-aktifnya IAA sebagai akibat proses pemecahan molekul.
Auksin sebagai salah satu hormon tumbuh bagi tanaman mempunyai peranan terhadap pertumbuhan dan perkembangan tanaman. Dilihat dari segi fisiologi, hormon tumbuh ini berpengaruh terhadap :
a. Pengembangan sel b. Phototropisme c. Geotropisme d. Apical dominasi
g. Abisission
h. Pembentukan callus (callus formation) dan i. Respirasi
(Santosa, 2007)
BAP (Benzyl Amino Purin)
BAP (benzyl amino purin) merupakan zat pengatur tumbuh sitokinin yang bersifat sintetik. BAP mempunyai pengaruh terhadap tumbuhan adalah memacu pembentukan tunas aksilar dan tunas adventif, kombinasi antara auksin dan sitokinin akan memacu pertumbuhan kalus, serta memacu pembelahan sel. Keuntungan menggunakan zat pengatur tumbuh BAP ini adalah ketahanannya terhadap panas, sehingga bisa ditambahkan sebelum disterilkan dalam autoklaf (Abidin, 1985).
METODE PENELITIAN
Waktu dan Tempat Penelitian
Penelitian diaksanakan mulai bulan Januari sampai Juni 2010 di laboratorium Kultur Jaringan, Dinas Pertanian, Sumatera Utara, Medan.
Bahan dan Alat Bahan
Sumber eksplan tunas aksilar diperoleh dari bibit gaharu berumur 2 bulan, dan setelah itu dikulturkan guna memperoleh planlet gaharu. Media kultur yang digunakan adalah Murashige dan Skoog (MS). Bahan-bahan lain seperti aquadest, agar, gula, deterjen mama lemon, fungisida Dithane-45, HgCl 20%, alkohol 70%,
bayclin yang mengandung kloroks 20%, betadine, larutan stok, BAP, dan IAA.
Alat
Alat yang digunakan adalah gunting, panci, kompor, pinset, scalpel, spatula, bunsen, lampu neon 10 watt, autoklaf, rak kultur, laminar air flow,
petridis, beaker glass, botol kultur, timbangan analitik, sprayer, erlenmeyer, pipet
tetes, aluminium foil, kertas koran, tissue, plastik, karet, label nama, kertas pH, kertas saring.
Prosedur Penelitian
Penelitian ini menggunakan pola Rancangan Acak Lengkap (RAL) non faktorial yang terdiri dari empat kombinasi perlakuan sebagai berikut:
2. B (BAP 1.0 ppm dan IAA 1.0 ppm) 3. C (BAP 2.0 ppm dan IAA 0.5 ppm) 4. D (BAP 2.0 ppm dan IAA 1.0 ppm)
Masing-masing kombinasi perlakuan dibuat dengan: Jumlah ulangan : 3 ulangan
Jumlah unit percobaan : 12 botol
Sterilisasi alat
Botol kultur, petridis, erlenmeyer, beaker glass, dan alat-alat sektio seperti pinset, gunting, scalpel, pipit tetes, spatula dicuci bersih dengan air, dikeringkan, kemudian dibungkus dengan kertas koran. Alat-alat yang telah dibungkus dimasukkan ke dalam autoklaf dengan temperatur 121o C pada tekanan 15 psi (pound per square inch) atau 1 atm selama 30-60 menit. Penghitungan waktu sterilisasi dimulai setelah tekanan dan temperatur yang diinginkan tercapai.
Pembuatan media
Cara membuat media MS adalah sebagai berikut:
a. Dimasukkan aquadest steril ke dalam erlenmeyer sebanyak 300 ml, dan kemudian dilarutkan 30 gr gula.
b. Ditambahkan 20 ml stok A, 20 ml stok B, 10 ml stok C, 10 ml stok D, 5 ml stok E, 5 ml stok F, 2 ml stok G, dan 10 ml stok H (Lampiran 2) kedalam
erlemneyer tadi.
e. Diukur pH dengan menggunakan kertas pH. Bila pH masih di bawah 5,7 maka perlu ditambah KOH 1-2 tetes, tetapi bila pH sampai mencapai 6,0 (melebihi 5,8) maka ditambah HCl 1 tetes.
f. Dimasukkan ke dalam panci, kemudian di masak di kompor.
g. Ditambahkan agar setelah media panas, kemudian di aduk hingga mendidih sampai agar larut.
h. Dituang ke dalam botol kultur dan ditutup dengan aluminium foil dan diberi label.
i. Botol-botol kultur tersebut dimasukkan dalam autoklaf dan disterilisasi dengan suhu 1200C, dan tekanan 1,5 kg/cm2 selama 15-20 menit.
j. Botol-botol diangkat, kemudian disimpan di tempat yang sejuk sampai siap untuk penanaman eksplan.
Sterilisasi eksplan
Alkohol 95% perlu diencerkan menjadi alkohol 70%. Caranya adalah sebagai berikut: tuangkan alkohol 95% sebanyak 25 ml ke dalam gelas ukur, kemudian tambahkan aquadest sebanyak 70 ml, sehingga volume akhir menjadi 95 ml.
Tunas dibersihkan, kemudian dibilas dengan aquades hingga benar-benar bersih. Tunas yang telah bersih kemudian direndam dengan deterjen 2 gr/l air sambil diaduk-aduk, setelah itu dibilas lagi dengan aquades. Kemudian direndam dengan fungisida 2 gr/l air selama 1 jam, lalu dibilas dan diletakkan pada beaker
glass. Direndam dengan larutan HgCl 20 % selama 15 menit, lalu dibilas sampai
kloroks 20% selama 15 menit, kemudian dibilas dengan aquadest sampai bersih. Setelah itu, di rendam dalam larutan betadine dan di goyang. Di bilas dengan aquades sampai bersih. Eksplan yang telah disterilkan, diletakkan di dalam
petridish steril.
Perbanyakan tunas tahap inisiasi
Tunas yang telah steril, ditanam pada media MS yang mengandung vitamin (Lampiran 1). Kemudian ditutup kembali dengan aluminium foil dan diperkuat dengan plastik dan karet agar tidak ada ruang untuk masuk bakteri dan lain-lain.
Induksi dan multiplikasi tunas
Tunas hasil perbanyakan dipotong dan diinduksi pada media dengan zat pengatur tumbuh. Dan ditutup kembali dengan aluminium foil sampai rapat. Dan diletakkan pada rak kultur untuk pengamatan selanjutnya.
Pemeliharaan
Botol kultur yang berisi eksplan kemudian diletakkan pada rak kultur dengan penyinaran lampu TL dengan intensitas 1000 lux selama 24 jam, suhu ruangan sekitar 260C.
Parameter Pengamatan Persentase hidup (%)
Persentase hidup = jumlah tunas yang hidup X 100% jumlah seluruh tunas yang ditanam
Waktu induksi tunas (hari)
Dihitung pada saat dilakukan induksi tunas sampai tumbuhnya tunas baru pada setiap perlakuan dan dihitung per hari.
Jumlah tunas
Dihitung pada akhir penelitian dengan menghitung jumlah tunas yang muncul pada setiap perlakuan.
Jumlah daun
Dihitung pada akhir penelitian dengan menghitung jumlah daun yang muncul pada setiap perlakuan.
Panjang tunas (mm)
Dihitung pada akhir penelitian menggunakan kertas milimeter mulai dari tempat munculnya tunas (pangkal) sampai ujung tunas terpanjang.
Analisis Data
Data dianalisis secara statistik menggunakan pola rancangan acak lengkap non faktorial. Menurut Hanafiah (2005), rumus umum rancangan acak lengkap non faktorial adalah sebagai berikut:
Y
ij= µ + τ
i+
є
ijDimana:
τi = pengaruh perlakuan ke-i
єij = pengaruh galat (experimental error)
HASIL DAN PEMBAHASAN
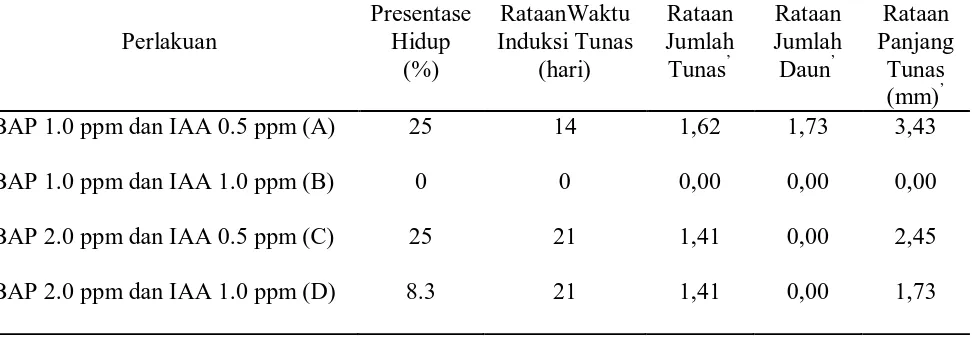
Tahap inisiasi adalah tahap awal pembentukan tunas tanaman gaharu secara kultur jaringan. Untuk mengetahui respon eksplan perlakuan dapat diketahui dari hasil pengukuran lima parameter yaitu persentase hidup, waktu induksi tunas, jumlah tunas, jumlah daun dan panjang tunas pada Tabel 1. Data-data yang di peroleh dari pengamatan selama 4 minggu setelah tahap inisiasi.
Tabel 1. Pengaruh Kombinasi Konsentrasi BAP dan IAA terhadap Parameter Pengamatan
‘Data ditransformasi Logaritma (Y’ = log (Y + 1) )
Respon tanaman terhadap kombinasi konsentrasi BAP dan IAA menunjukkan berpengaruh nyata terhadap persentase hidup, waktu induksi tunas, jumlah tunas, dan panjang tunas. Pada jumlah daun, interaksi ataupun pendugaan pengaruh tunggal BAP dan IAA tidak berpengaruh nyata.
menunjukkan bahwa tanaman gaharu lebih berpengaruh pada kombinasi konsentrasi BAP dan IAA yang rendah. Hal ini diduga terjadi karena tanaman gaharu yang masih muda sangat sensitif dengan kandungan media dan konsentrasi hormon yang digunakan.
Pada perlakuan B, tidak ada tunas yang terbentuk. Hal ini diduga karena eksplan yang digunakan tidak sesuai dengan komposisi media. Selain itu, kombinasi konsentrasi BAP dan IAA yang tidak sesuai juga mempengaruhi kemampuan hidup tanaman gaharu. Perbandingan zat pengatur tumbuh yang tidak sesuai dapat menghambat pertumbuhan tunas tanaman gaharu. Gustian (2009) menyatakan bahwa kombinasi konsentrasi zat pengatur tumbuh auksin dan sitokinin dalam jaringan eksplan dapat meningkatkan kemampuan hidup, pertumbuhan dan perkembangan jaringan eksplan.
Pemberian konsentrasi hormon yang tinggi dapat menghambat pertumbuhan tunas tanaman gaharu. Sesuai dengan literatur George dan Sherrington (1984) menyatakan bahwa pemberian zat pengatur tumbuh auksin dan sitokinin pada konsentrasi rendah mampu merangsang pertumbuhan dan perkembangan eksplan serta mempertahankan daya hidup jaringan eksplan, tetapi pada konsentrasi yang tinggi zat pengatur tumbuh dapat bersifat menghambat perkembangan morfogenesis eksplan.
Persentase Hidup (%)
(8.3%). Sedangkan tanaman yang mati (pencoklatan, kontaminasi, dan tidak tumbuh) sebanyak 41.6%. Perbandingan eksplan yang mengalami pencokelatan, terkontaminasi, tidak tumbuh, dan tumbuh disajikan dalam Tabel 2.
Tabel 2. Rataan Pengaruh Kombinasi Konsentrasi BAP dan IAA terhadap Persentase Pencokelatan, Kontaminasi, Tidak Tumbuh dan Jumlah Eksplan yang Tumbuh (%)
Perlakuan Pencoklatan Kontaminasi Tidak Tumbuh
Gambar 1. (a) Tanaman Gaharu yang Mengalami Pencoklatan, (b) Tanaman Gaharu yang Mengalami Kontaminasi, (c) Tanaman Gaharu yang Tidak Tumbuh, dan (d) Tanaman Gaharu yang Hidup
Tabel 2 menunjukkan bahwa pencokelatan (Gambar 1a) hanya terjadi pada perlakuan B (8.3%) dan D (16.7%), sedangkan A dan C tidak mengalami pencokelatan. Tanaman gaharu yang mengalami pencoklatan, kontaminasi, tidak tumbuh, dan yang tumbuh dapat dilihat pada Gambar 1. Menurut Azwin (2007) terjadinya pencokelatan pada eksplan disebabkan oleh senyawa fenolik yang terkandung di dalam eksplan. Pencokelatan pada eksplan biasanya terjadi pada pangkal eksplan dan diikuti dengan pelepasan zat phenolik ke dalam media tumbuh. Hal ini merupakan salah satu kendala kultur jaringan pada tanaman berkayu. Eksplan yang mengalami pencokelatan akan dapat menyebabkan kematian eksplan. Pada tanaman berkayu umumnya semakin besar ukuran atau semakin tua umur ekplan yang digunakan maka terjadinya pencokelatan semakin tinggi karena senyawa fenolik yang terdapat di dalam eksplan semakin tinggi, dan sebaliknya semakin kecil ukuran atau umur eksplan yang digunakan maka persentase pencokelatan semakin rendah. Dalam hal ini lebih dianjurkan menggunakan eksplan yang berasal dari jaringan yang bersifat meristematik. Diperkuat oleh Yunita (2004) yang menyatakan bahwa masalah yang sering dihadapi dalam kultur jaringan tanaman berkayu adalah terjadinya pencokelatan
atau penghitaman bagian eksplan. Pada waktu jaringan terkena stres mekanik, seperti pelukaan pada waktu proses isolasi eksplan, proses sterilisasi, metabolisme senyawa berfenol pada eksplan sering terangsang. Senyawa berfenol ini sering bersifat toksik, menghambat pertumbuhan, bahkan dapat mematikan jaringan eksplan.
Tabel 2 menunjukkan bahwa jumlah eksplan yang terkontaminasi adalah sebanyak 8.3% yaitu pada perlakuan B (Gambar 1b). Secara umum sterilisasi berhasil dengan baik, karena dari 12 botol yang ditanam hanya 1 botol yang terkontaminasi (8.3%). Kontaminasi yang terjadi diakibatkan oleh bakteri yang ditandai dengan adanya bercak putih atau hitam, dan jamur yang ditandai dengan timbulnya bercak kuning. Berdasarkan dari pengamatan yang dilakukan ada beberapa penyebab terjadinya kontaminasi pada media kultur jaringan yaitu, 1). Proses penanaman, dimana sering terjadi kontaminasi saat memasukan eksplan ke dalam media kultur, 2). Saat membuka dan menutup botol yang kurang rapat yang menyebabkan masuknya partikel debu yang terbawa oleh hembusan udara laminar yang masuk ke dalam media kultur. Suryowinoto (1996) menyatakan tentang permasalahan yang dapat terjadi dalam kultur jaringan, yaitu sangat sulit menanggulangi kontaminasi yang berasal dari material tanaman lapangan dan infeksi internal sangat sulit diatasi.
Kemungkinan tanaman tidak tumbuh adalah karena eksplan membutuhkan waktu yang cukup lama untuk beradaptasi pada kondisi dan lingkungan tempat tumbuh yang baru sehingga faktor lingkungan, keadaan sel dan perlakuan ZPT di dalam media kultur sangat mempengaruhi perkembangan eksplan. Menurut Hendaryono dan Wijayani (1994) faktor lain yang menyebabkan eksplan yang tidak tumbuh adalah bahan sterilisi yang digunakan yaitu HgCl yang memiliki sifat toksik, dan tidak stabil apabila digunakan dalam waktu yang lama selanjutnya dapat menyebabkan kerusakan jaringan dan kematian pada eksplan.
Waktu Induksi Tunas (hari)
Respon tanaman gaharu terhadap interaksi antara BAP dan IAA memberikan pengaruh pada waktu induksi tunas. Rataan waktu induksi tunas tanaman gaharu disajikan pada Tabel 1.
Waktu induksi tunas adalah waktu yang dibutuhkan untuk melihat respon tanaman dalam menghasilkan tunas baru. Waktu induksi tunas paling lama terdapat pada perlakuan C dan D (21 hari). Perlakuan C dan D mempunyai konsentrasi hormon BAP yang sama yaitu 2.0 ppm. Sedangkan konsentrasi hormon IAA berbeda yaitu masing-masing 0.5 ppm dan 1.0 ppm. Waktu induksi tercepat terdapat pada perlakuan A yaitu 14 hari dengan kombinasi konsentrasi BAP 1.0 ppm dan IAA 0.5 ppm. Pada perlakuan B tidak terjadi pembentukan tunas sampai batas waktu yang ditentukan. Waktu yang dibutuhkan untuk pembentukan tunas berkisar antara 2 – 4 minggu atau 14 – 30 hari.
lebih cepat tumbuh tunas adalah bagian buku tanaman. Sesuai dengan penelitian Kosmiatin et al. (2005) waktu induksi tunas tercepat diperoleh dari ekplan buku tanpa daun. Eksplan yang relatif mudah diindukasi tunasnya adalah eksplan yang memiliki jaringan meristem atau bakal tunas seperti tunas terminal dan bakal tunas pada buku. Hal itu dapat dilihat pada Gambar 2.
Media tanam dan komposisinya juga mempengaruhi pertumbuhan tunas tanaman gaharu. Sesuai dengan literatur Gustian (2009) menyatakan bahwa jenis dan komposisi media sangat mempengaruhi besarnya daya tahan eksplan untuk hidup pada media tersebut, sedangkan zat pengatur tumbuh endogen dan eksogen berpengaruh terhadap besarnya penyerapan zat makanan yang tersedia dalam media kultur.
Gambar 2. Perkembangan Tunas Tanaman Gaharu (a) Minggu Pertama, (b) Minggu Kedua, (c) Minggu Ketiga, (d) Minggu Keempat, (e) Pengukuran Panjang Tunas
A B C
D
Jumlah Tunas
Hasil analisis sidik ragam antara konsentrasi BAP dan IAA (Lampiran 5), menunjukkan bahwa kombinasi konsentrasi antara BAP dan IAA memberikan pengaruh nyata terhadap jumlah tunas. Rataan jumlah tunas disajikan pada Tabel 3.
Tabel 3. Pengaruh Kombinasi Konsentrasi BAP dan IAA terhadap Jumlah Tunas
Perlakuan Rataan Jumlah Tunas
BAP 1.0 ppm dan IAA 0.5 ppm (A)
Data ditransformasi Logaritma (Y’ = log (Y + 1) )
Jumlah tunas tertinggi terdapat pada perlakuan A (1,62) dan tidak adanya tunas yang tumbuh pada perlakuan B. Sedangkan pada perlakuan C dan D mempunyai rataan yang sama yaitu 1. Perlakuan A menunjukkan berbeda nyata terhadap perlakuan B, C, dan D. Perlakuan B berbeda nyata dengan perlakuan A, C, dan D. Perlakuan C tidak berbeda nyata dengan perlakuan D,dan berbeda nyata dengan yang lainnya.
yang lama. Konsentrasi BAP pada perlakuan itu sebesar 2.0 ppm. Perlakuan A mempunyai rata-rata jumlah tunas yang banyak dan dalam waktu yang cepat. Konsentrasi BAP pada perlakuan A sebesar 1.0 ppm. Diduga bahwa konsentrasi BAP yang diberikan pada eksplan mempengaruhi jumlah tunas. Sesuai dengan literatur Suryowinoto (1996) yang menyatakan bahwa BAP mempunyai pengaruh terhadap tumbuhan adalah memacu pembentukan tunas aksilar dan tunas adventif, kombinasi antara auksin dan sitokinin akan memacu pertumbuhan kalus, serta memacu pembelahan sel. Diperkuat oleh literatur Gunawan (1995) yaitu pada konsentrasi BAP yang tinggi dan masa induksi yang lebih lama menyebabkan penampakan tunas abnormal dan menyebabkan penurunan jumlah tunas yang diperoleh. Serta literatur Tiwari et al. (2000) bahwa konsentrasi sitokinin yang tinggi dapat menyebabkan jumlah tunas berkurang, dan BAP melebihi kadar optimum yang dibutuhkan tanaman umumnya menyebabkan perkembangan tajuk atau tunas terhambat. Tetapi hasil pengamatan tersebut bertolak belakang dengan hasil penelitian Kosmiatin el al. (2005) yaitu kecepatan induksi pembentukan tunas tidak menjamin banyaknya tunas yang terbentuk. Hal ini berhubungan dengan aktivitas fotosíntesis. Eksplan akan membutuhkan daun sebagai tempat fotosintesis guna membentuk tunas baru.
hormon endogen sebagai fungsinya dalam proses cytokinesis (proses pembelahan sel) pada berbagai organ tanaman. Pemberian hormon eksogen dengan konsentrasi yang melebihi kebutuhan tanaman dapat menyebabkan pembentukan tunas terhambat.
Gambar 3. Pertumbuhan Tunas Tanaman Gaharu yang Terhambat (a) Tunas Tanaman Gaharu pada Perlakuan C, dan (b) Tunas Tanaman Gaharu pada Perlakuan D
Sesuai dengan literatur Santosa (2007) apabila dalam perbandingan sitokinin lebih besar dari auksin, maka hal ini akan memperlihatkan stimulasi pertumbuhan tunas dan daun. Sebaliknya apabila sitokinin lebih rendah dari auksin, maka ini akan mengakibatkan stimulasi pada pertumbuhan akar. Sedangkan apabila perbandingan sitokinin dan auksin berimbang, maka pertumbuhan tunas, daun dan akar akan berimbang pula
Jumlah Daun
Hasil analisis sidik ragam antara konsentrasi BAP dan IAA (Lampiran 4), menunjukkan bahwa interaksi antara BAP dan IAA memberikan pengaruh tidak nyata terhadap jumlah daun. Rataan jumlah daun tanaman gaharu disajikan pada Tabel 1.
Jumlah daun tertinggi terdapat pada perlakuan A (1,73) dan perlakuan yang lain tidak terdapat daun. Hal ini menunjukkan bahwa tidak adanya pengaruh
kombinasi konsentrasi BAP dan IAA terhadap jumlah daun. Kemungkinan hal ini terjadi karena penyerapan tunas terhadap hormon yang diberikan belum maksimal. Sehingga sebagian besar tanaman tidak terbentuk daun.
Kombinasi konsentrasi BAP dan IAA tidak berpengaruh nyata terhadap jumlah daun. Tetapi jumlah daun sangat mempengaruhi jumlah dan panjang tunas yang terbentuk, yaitu berhubungan dengan proses fotosintesis dan penyerapan hormon BAP dan IAA. Makin banyak daun yang terbentuk maka semakin banyak dan panjang tunas yang tumbuh. Hal itu dikarenakan tunas yang tumbuh telah mampu mengolah makanan sendiri yang diperoleh dari hara mikro dan makro dari media, serta dengan bantuan cahaya yang cukup dapat membantu tunas yang telah berdaun melakukan fotosintesis. Selain itu penyerapan tunas terhadap hormon BAP dan IAA juga mempengaruhi banyaknya daun yang terbentuk. Makin tinggi penyerapan hormon oleh tunas, maka makin banyak daun yang terbentuk. Dapat dilihat pada Tabel 1 yang menunjukkan waktu induksi tunas perlakuan A lebih cepat daripada perlakuan lainnya yaitu 14 hari, rata-rata jumlah tunas paling tinggi pada perlakuan A yaitu 1,62, dan rata-rata jumlah daun yang paling tinggi yaitu 1,73. Data ini menunjukkan bahwa penyerapan unsur hara makro dan proses fotosintesis lebih cepat terjadi dibandingkan dengan perlakuan yang lain.
Perbandingan konsentrasi BAP dan IAA pada perlakuan A merupakan perbandingan hormon yang paling rendah. Dapat dikatakan, perbandingan hormon BAP dan IAA dengan konsentrasi rendah lebih mempengaruhi waktu induksi tunas, jumlah tunas, jumlah daun. Sebaliknya, konsentrasi BAP dan IAA yang tinggi dapat menghambat pertumbuhan daun. Hal ini sesuai dengan penelitian yang dilakukan oleh Azwin (2007) pada tanaman Aquilaria malaccencis, semakin tinggi konsentrasi ZPT yang diberikan maka jumlah daun A. malaccencis yang dihasilkan semakin rendah. Penambahan ZPT yang lebih tinggi tidak mampu meningkatkan jumlah daun. Hal ini menunjukkan bahwa penambahan ZPT pada media mampu merangsang pembelahan sel di meristem apikal tunas dibanding pada konsentrasi yang lebih tinggi.
Panjang Tunas (mm)
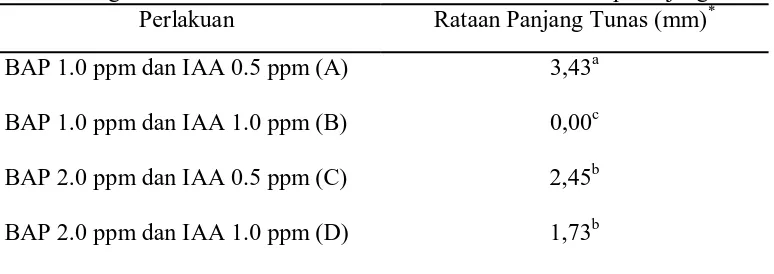
Hasil analisis sidik ragam antara konsentrasi BAP dan IAA (Lampiran 5), menunjukkan bahwa kombinasi konsentrasi antara BAP dan IAA memberikan pengaruh nyata terhadap panjang tunas. Rataan panjang tunas tanaman gaharu disajikan pada Tabel 4.
Tabel 4. Pengaruh Kombinasi Konsentrasi BAP dan IAA terhadap Panjang Tunas Perlakuan Rataan Panjang Tunas (mm)* BAP 1.0 ppm dan IAA 0.5 ppm (A)
Panjang tunas tertinggi terdapat pada perlakuan A (3,43 mm) dan ada yang tidak tumbuh tunas yaitu pada perlakuan B. Pada perlakuan C dan D mempunyai panjang tunas masing-masing 2,45 mm dan 1,73 mm. Perlakuan A menunjukkan berbeda nyata terhadap perlakuan B, C, dan D. Perlakuan B berbeda nyata dengan perlakuan A, C, dan D. Perlakuan C tidak berbeda nyata dengan perlakuan D,dan berbeda nyata dengan yang lainnya.
Perlakuan C dan D membutuhkan waktu yang lama untuk menghasilkan tunas yaitu 21 hari, rataan jumlah tunas yang dihasilkan sedikit yaitu 1,41, dan tidak menghasilkan daun sama sekali. Tetapi perlakuan C dan D menunjukkan bahwa panjang tunas berturut-turut 2,45 mm dan 1,73 mm. Dapat dikatakan bahwa perlakuan C dan D mempunyai pengaruh yang rendah terhadap perlakuan, tetapi sangat memungkinkan terbentuknya tunas yang panjang. Ini dikarenakan oleh adanya penyerapan unsur-unsur hara yang terkandung pada media oleh tanaman sangat lambat. Diduga tanaman pada awalnya mengalami ketidaksesuaian lingkungan baru dan kombinasi konsentrasi hormon yang diberikan terlalu tinggi.
Gambar 4. Perbandingan Panjang Tunas Masing-masing Perlakuan
Dari data perlakuan C dapat kita lihat bahwa konsentrasi BAP yang tinggi dan IAA yang rendah dengan mengakibatkan tunas yang tidak terlalu panjang. Sedangkan pada perlakuan D, konsentrasi BAP dan IAA sama-sama tinggi yang menyebakan tunas pendek. Dapat dikatakan bahwa makin tinggi konsentrasi BAP dan IAA yang diberikan pada media, maka panjang tunas yang dihasilkan semakin pendek. Sebaliknya pemberian konsentrasi BAP dan IAA yang rendah menyebabkan panjang tunas yang tinggi. Keadaan ini diduga akibat periode inkubasi eksplan yang terlalu lama pada media yang mengandung sitokinin, sehingga perpanjangan batang terhambat. Hal ini sesuai dengan pernyataan Azwin (2007), bahwa konsentrasi BAP yang tinggi dapat menyebabkan tinggi tanaman terhambat. Herawan (2004), menyatakan bahwa BAP merupakan derivat sitokinin yang keberadaannya dalam medium tumbuh memacu pembelahan sel-sel di bagian apikal bakal tunas, sehingga mempengaruhi perkembangan tunas. Sitokinin disintesis di dalam akar dan didistribusikan ke tunas untuk pertumbuhan
A(1) B(2)
C(1) C(2) C(3) D(3)
KESIMPULAN DAN SARAN
Kesimpulan
1. Kombinasi konsentrasi BAP 1.0 ppm dan IAA 0.5 ppm (A); BAP 2.0 ppm dan IAA 0.5 ppm (C); BAP 2.0 ppm dan IAA 1.0 ppm (D); berpengaruh nyata terhadap persentase hidup, waktu induksi tunas, jumlah tunas, dan panjang tunas. Sedangkan kombinasi konsentrasi BAP 1.0 ppm dan IAA 1.0 ppm (B) tidak memberikan pengaruh nyata pada persentase hidup, waktu induksi tunas, jumlah tunas, jumlah daun, dan panjang tunas tanaman gaharu.
2. Perlakuan zat pengatur tumbuh BAP 1.0 ppm dan IAA 0.5 ppm (A) merupakan konsentrasi yang optimum dan terbaik dalam menghasilkan jumlah tunas, panjang tunas dan jumlah daun tanaman gaharu.
Saran
DAFTAR PUSTAKA
Abidin, Z. 1985. Dasar-Dasar Pengetahuan Tentang Zat Pengatur Tumbuh. PT Angkasa, Bandung.
Azwin. 2007. Evaluasi Stabilitas Genetik Tanaman Gaharu (Aquilaria
malaccensis Lamk.) Hasil Kultur In Vitro.
Dixon, J. And Gonzales, A. 1994. Plant Cell Culture. A Practical Approach. Second Edition. Oxford University Press. New York.
blogspot.com/2008/01/budidaya-gaharu-budidaya-gaharu-terdiri.html. [23 April 2008].
George, E.F. And P.D. Sherrington. 1984. Plant Propagation By Tissue Culture.Handbook And Directory Of Comercial Laboratory. Exegeticts. Ltd. England.
Gunawan, L. W. 1995. Teknik Kultur Jaringan In Vitro dalam
Hortikultura. Penebar Swadaya. Jakarta.
Gustian. 2009. Upaya Perbanyakan Tanaman Penghasil Gaharu (Aquilaria
malaccensis Lamk ) Secara In Vitro. Universitas Andalas, Padang.
Gomez, K. A. dan Gomez A. A. 1995. Prosedur Statistik untuk Penelitian Pertanian. Edisi Kedua. Universitas Indonesia Press. Jakarta.
Hanafiah, K. A. 2005. Rancangan Percobaan:Teori dan Aplikasi. PT Grafindo Persada, Jakarta.
Heddy, S. 1986. Hormon Tumbuhan. CV Rajawali Press. Jakarta.
Hendaryono, D. P. S. dan Wijayani, A. 1994. Teknik Kultur Jaringan Pengenalan dan Petunjuk Perbanyakan Tanaman secara Vegetatif-Modern. Kanisius, Yogyakarta.
Isnaini, Y. dan Situmorang, J. 2005. Aplikasi Bioteknologi Untuk Pengembangan Tanaman Gaharu (Aquilaria spp.) di Indonesia. Studi Kasus: Perkembangan Penelitian Gaharu di Seameo Biotrop.
Kartasapoetra, G. A. 2003. Teknologi Benih. Rineka Cipta, Jakarta.
Kosmiatin, M., Husni, A., dan Mariska, I. 2005. Perkecambahan dan Perbanyakan
Gaharu secara In Vitro.
[21 April 2008].
Mulyaningsih, T. dan Nikmatullah, A. 2006. Gaya Belajar Kultur Jaringan Melalui Publikasi World Wide Web. http://e-learning.unram.ac.id/ KulJar /BAB%20III%20MEDIA/III6%20%20Zat%20Pengatur%20Tumbuh.htm.
Santosa, S. 2007. Zat Pengatur Tumbuh.
Fakultas Pertanian Unram. [28 November 2008].
Sofia, D. H. 2007. Pengaruh Berbagai Konsentrasi Benzyl Amino Purine dan Cycocel Terhadap Pertumbuhan Embrio Kedelai (Glycine max L. Merr.) Secara In Vitro. USU Repository, Medan.
Sumarna, Y. 2002. Budidaya Gaharu. Cetakan 1. Penebar Swadaya, Jakarta.
Suryowinoto, M. 1996. Pemuliaan Tanaman secara In Vitro. Kanisisus, Yogyakarta.
Susanto, I. 2010. Budidaya Gaharu Sistem Bioinduksi.
Tarigan, K. 2004. Profil Pengusahaan (Budidaya) Gaharu. Departemen Kehutanan, Pusat Bina Penyuluhan Kehutanan, Jakarta.
Tini, N., dan Amri, K. 2002. Mengebunkan Jati Unggul: Pilihan Investasi Prospektif. Cetakan 1. Agromedia Pustaka, Jakarta.
Yunita, R. 2004. Perbanyakan dan Transformasi Genetik Menggunakan
Agrobacterium tumefaciens pada Tanaman Melinjo (Gnetum gnemon)
dengan Teknik Kultur Jaringan. Riau. Kelji Sumber Daya, Balai Pengkajian Teknologi Pertanian.
World Wild Flora and Fauna (WWF). 2006. Gaharu (Aquilaria).
Lampiran 1. Komposisi garam-garam anorganik pada media MS (mg/l) Makronutrien
NH4NO3 1.650
KNO3 1.900
CaCl2.2H2O 440
MgSO4.7H2O 370
KH2PO4 170
Mikronutrien
MnSO4.H2O 3380
ZnSO4.7H2O 1720
H3BO3 1240
Kl 166
Na2MoO4.2H2O 50
CoCl2.6H2O 5
CuSO4.6H2O 5
Zat Besi
FeSO4.7H2O 5570
Na2EDTA 7450
Vitamin
Thiamine HCl 10
Nicotinal acid 50
Pyridoxine HCl 50
Glycine 200
Lampiran 2. Pembuatan Larutan Stok
Langkah-langkah pembuatan larutan stok adalah sebagai berikut:
a. Ditimbang bahan-bahan kimia makronutrien, mikronutrien, zat besi, dan vitamin (Lampiran 1).
b. Bahan-bahan tersebut dimasukkan satu per satu ke dalam erlenmeyer yang berisi aquadest sebanyak 300 ml. Setiap memasukkan bahan kimia harus segera dilarutkan (botol erlenmeyer digoyang-digoyang pelan-pelan dengan arah memutar). Kemudian bahan-bahan berikutnya dimasukkan. Apabila semua bahan kimia dimasukkan secara bersamaan, dapat terjadi endapan. c. Larutan yang sudah jadi kemudian ditambah aquadest sampai volume menjadi
1000 ml.
Lampiran 3. Stok Zat Pengatur Tumbuh
Zat pengatur tumbuh hanya diperlukan dalam jumlah sedikit sekali. Biasanya zat pengatur tumbuh ini dibuat dengan kepekatan 1 – 10 mg/ml.
Sitokinin
Langkah-langkah pembuatan stok hormon sitokinin adalah sebagai berikut:
a. Ditimbang 100 mg BAP, kemudian dilarutkan ke dalam erlenmeyer yang berisi aquadest steril sebanyak 70 ml dambil diaduk.
b. Ditetesin pelarut HCl 1 N, kemudian ditambahkan aquadest sampai 100 ml. c. Dipindahkan larutan ke dalam wadah stok, kemudian ditutup rapat-rapat, dan
diberi label. Selanjutnya disimpan di dalam lemari es.
Auksin
Cara pembuatan larutan stok hormon auksin adalah sebagai berikut:
a. Ditimbang IAA sebanyak 100 mg dan setiap bahan dituang ke dalam
erlenmeyer yang berisi aquadest kira-kira 70 ml.
b. Sambil diaduk, diteteskan sedikit larutan KOH 1 N dengan hati-hati sampai jernih.
c. Dipindahkan larutan ke dalam wadah stok, kemudian ditutup rapat-rapat, dan diberi label. Selanjutnya disimpan di dalam lemari es.
Lampiran 4. Hasil Analisis Sidik Ragam
Jumlah Tunas
Perlakuan Ulangan Jumlah
Jumlah Daun
Perlakuan Ulangan Jumlah
Perlakuan
Rata-rata
1 2 3
BAP 1.0 ppm dan IAA 0.5 ppm (A) 0 2 0 2 2
BAP 1.0 ppm dan IAA 1.0 ppm (B) 0 0 0 0 0
BAP 2.0 ppm dan IAA 0.5 ppm (C) 0 0 0 0 0
BAP 2.0 ppm dan IAA 1.0 ppm (D) 0 0 0 0 0
Transformasi Logaritma (Y’ = Log (Y + 1) )
BAP 1.0 ppm dan IAA 0.5 ppm (A) 0,00 1,73 0,00 1,73 1,73 BAP 1.0 ppm dan IAA 1.0 ppm (B) 0,00 0,00 0,00 0,00 0,00 BAP 2.0 ppm dan IAA 0.5 ppm (C) 0,00 0,00 0,00 0,00 0,00 BAP 2.0 ppm dan IAA 1.0 ppm (D) 0,00 0,00 0,00 0,00 0,00
Jumlah Ulangan (R) 0,00 1,73 0,00
Panjang Tunas
Perlakuan Ulangan Jumlah
Lampiran 5. Gambar Induksi Tunas
A (1)
Minggu Pertama Minggu Kedua
Minggu Keempat
Minggu Ketiga
A (2)
Minggu Pertama Minggu Kedua
Minggu Keempat Minggu Ketiga
A (3)
Minggu Pertama Minggu Kedua
Minggu Keempat Minggu Ketiga
B (2)
Minggu Pertama Minggu Kedua
Minggu Keempat Minggu Ketiga
C (1)
Minggu Pertama Minggu Kedua
Minggu Keempat
Minggu Ketiga
C (2)
Minggu Pertama Minggu Kedua
Minggu Keempat
Minggu Ketiga
C (3)
Minggu Pertama Minggu Kedua
Minggu Keempat
Minggu Ketiga
D (3)
Minggu Pertama Minggu Kedua
Minggu Keempat Minggu Ketiga