1.1 Latar Belakang
Indonesia merupakan salah satu negara yang memiliki tingkat
keanekaragaman jenis pohon yang tinggi. Hasil hutan berupa kayu merupakan
komoditas utama yang dihasilkan dari hutan, akibatnya penebangan hutan secara
liar terjadi di berbagai tempat dengan tidak memperhatikan kerugian dan
kerusakan yang ditimbulkan, terutama merosotnya kualitas lingkungan. Selain
kayu, hutan juga menghasilkan komoditas hasil hutan bukan kayu (HHBK) yang
memiliki nilai ekonomis yang tinggi. Salah satunya adalah tanaman penghasil
gaharu yang banyak dihasilkan dari genus Aquilaria. Gaharu bernilai ekonomi tinggi karena digunakan sebagai bahan baku minyak wangi, parfum, kosmetik,
obat-obatan, dupa dan sebagai pencegah dan penghilang stress. Pohon penghasil
gaharu adalah salah satu jenis tanaman berkayu yang memiliki kandungan damar
wangi yang berasal dari infeksi mikroorganisme terjadi secara alami maupun
buatan sering ditemukan di bagian dalam batang utama pada umumnya terjadi
pada pohon Aquilaria.
Di Indonesia telah diketahui ada 16 jenis pohon penghasil gaharu yang
berasal dari 3 famili yaitu Thymeleaceae, Leguminoceae dan Euphorbiaceae,
dengan 8 genus yaitu Aquilaria sp.,Grynops sp., Excocaria sp., Gonistylus sp.,
Aetoxylon sp., Enkleia sp., Wiekstromia sp. danDalbergia sp. Pohon dari marga Aquilaria menghasilkan gaharu yang memiliki mutu sangatbaik dan lebih tinggi nilai perdagangannya daripada gaharu yang dihasilkan oleh pohon darimarga
lainnya.
Meningkatnya kebetuhan gaharu dari tahun ke tahun dan tingginya harga
jual, menyebabkan intensitas pemungutan liar yang berasal dari hutan alam
semakin tinggi dan tidak terkendali, khususnya terhadap jenis gaharu berkualitas
tinggi. Menurut Sumarna (2002), tanaman gaharu A. malaccensis yang ada di Indonesia termasuk spesies tanaman yang mulai langka, hal ini terjadi akibat
perburuan liar yang tidak terkendali dan tidak mengindahkan faktor-faktor
tidak berisi gaharu mengakibatkan masyarakat pemungut gaharu menebang pohon
secara spekulatif. Apabila pada akhirnya pohon tersebut tidak mengandung gaharu
setelah dikupas dan dicacah, maka pohon tersebut ditinggalkan begitu saja. Cara
perburuan tersebut terus berlangsung sehingga populasi tumbuhan A. malaccensis berada di ambang kelangkaan. Sehingga pada tahun 1994 organisasi dunia CITES
(Convention on International Trade in EndangeredSpecies of Wild Fauna and Flora)IX di Florida, mencantumkan tanaman gaharu A. malaccensisdalam Appendix II karena berstatus sebagai plasma nutfah yang terancam punah (Barden
et al.,2000). Menindaklanjuti hal tersebut, Departemen Kehutanan melalui Balai Konservasi Sumber Daya Alam (BKSDA) membatasi penjualan gaharu alam
bukan budidaya di dalam maupun luar negeri.
Perlu dilakukan upaya pencegahan untuk menghindari kepunahan di alam,
yaitu dengan melakukan teknik budidaya baik secara generatif maupun vegetatif
sebagai salahsatu upaya konservasi eksitu. Salah satu teknik budidaya vegetatif
yaitu dengan menggunakanteknik kultur jaringan, sehingga dengan teknik ini
dapat menghasilkan bibit dalam jumlah yangbanyak dan waktu yang relatif
singkat untuk mendukung kegiatan konservasi pohon penghasil gaharu.
Beberapa spesies asli telah berhasil dikoleksi, top soil telah diselamatkan berikutnya adalah perbanyakan spesies. Upaya yang telah dilakukan berupa
pembuatan nursery skala besar dan perbanyakan secara in vitro dalam laboratorium. Perbanyakan secara in vitro tepat diterapkan karena memiliki beberapa keunggulan, yaitu tanaman yang dihasilkan seragam, tidak
membutuhkan ruangan luas, produksi cepat dan tanaman bebas penyakit.
Daun sebagai bagian terbanyak dari suatu tanaman masih jarang digunakan
dalam perbanyakan secara in vitro. Proses induksi jika menggunakan daun kurang populer dibandingkan induksi menggunakan bagian tanaman seperti tunas karena
panjangnya proses yang harus sebelum tahap aklimatisasi. Daun dalam kultur
jaringan arah penggunaannya untuk menghasilkan kalus dan embriosomatik.
Kalus dan embrisomatik arah pengembangan berikutnya masih sangat luas.
Beberapa tujuan yang bisa dicapai menurut Santoso dan Nursandi (2001), antara
plasma nutfah yang efisien dan dapat digunakan untuk tujuan memproduksi
senyawa metabolit sekunder.
1.2 Tujuan
Secara umum tujuan penelitian ini adalah untuk memperbanyak ketersedian
kalus gaharu dengan sifat genetik yang sama dengan induknya dalam jumlah
banyak dan waktu yang relatif singkat. Sedangakan secara khusus penelitian ini
bertujuan untuk mengetahui pengaruh pertumbuhan dan konsentrasi ZPT BAP
dan TDZ yang optimum dalam multiplikasi kalus daun tanaman penghasil gaharu
dari A. malaccensis dalam media semi padat Murashige dan Skoog (MS).
1.3 Hipotesa
Hipotesa dalam penelitian ini adalah penambahan zat pengatur tumbuh
sitokinin BAP, TDZ dan kombinasinya dengan tingkat konsentrasi yang berbeda,
berpengaruh terhadap pertumbuhan eksplan daun A. malaccensis.
1.4 Manfaat
Melalui penelitian ini diharapkan dapat memberikan informasi mengenai
efisiensi dan efektifitas penggunaan ZPT dalam praktik komersial kultur jaringan
2.1 Tanaman Penghasil Gaharu - Aquilaria malaccensis Lamk.
A. malaccensis adalah salah satu dari 15 sub-spesies di marga Aquilaria, famili Thymelaeaceae. Pohon yang hijau sepanjang tahun yang dapat tumbuh
hingga 40 m dengan diameter 1,5 – 2,5 m, sering ditemukan di habitat hutan
campuran antara ketinggian tempat 0 – 1.000 meter di atas permukaan laut (mdpl).
Spesies ini memiliki sebaran luas, ditemukan di Bangladesh, Bhutan, India,
Indonesia, Malaysia, Myanmar, Filipina, Singapura dan Thailand.
Produksi gubal gaharu memerlukan pohon gaharu dan mikroba untuk
menginduksi pembentukan senyawa gaharu. Gubal gaharu terbentuk sebagai
reaksi pertahanan pohon terhadap infeksi patogen, melalui pelukaan batang,
cabang atau ranting atau pengaruh fisik lainnya. Infeksi patogen mengakibatkan
keluarnya resin yang terdeposit pada jaringan kayu. Lama kelamaan jaringan kayu
ini akan mengeras dan berubah warnanya menjadi coklat sampai kehitaman,
bagian ini menjadi berat dan berbau wangi (Hou, 1960 dalam Azwin, 2007). Patogen yang biasa dijumpai menginfeksi pohon gaharu adalah jenis
mikroorganisme seperti cendawan yang telah diketahui sebagai pembentuk gaharu
ialah Fusarium sp., Phytium sp., Lasiodiplodia sp., Libertela sp., Trichoderma sp., Syctalidium sp. dan Thielaviopsos sp. (Sumarna, 2002).
2.1.1 Sejarah kehidupan dan bioekologi
SpesiesAquilaria telah beradaptasi untuk bertahan hidup di berbagai tipe habitat, seperti habitat berbatu, berpasir atau berkapur, lereng, punggung bukit dan
dekat rawa. Tumbuh pada ketinggian tempat 0 – 850 mdpl, dan dapat juga tumbuh
pada ketinggian tempat 1.000 mdpl dengan suhu rata-rata harian 20 - 22˚C (Ding
Hou, 1960; Afifi, 1995; Keller dan Sidiyasa, 1994; Wiridinata, 1995). Menurut
Sumarna (2002) umumnya gaharu berkualitas baik tumbuh pada daerah yang
beriklim panas dengan suhu 28-34˚C, kelembaban 60-80% dan curah hujan
A. malacccensis mulai berbunga dan memproduksi buah pada umur 7 -9 tahun di barat laut India, dan pohon berukuran sedang pernah dilaporkan
memproduksi buah berkisar 1,5 kg selama musim berbuah. Merupakan spesies
toleran ketika muda dan mungkin akan beregenerasi pohon induk (Beniwal, 1960).
Riap rata-rata di hutan alami di Malaysia cukup rendah, yaitu berkisar 0,33
cm/tahun, tapi spesimen cepat tumbuh pernah dilaporkan tumbuh hingga 0,8-1
cm/tahun. (La Frankie, 1994 dalam Barden et al., 2000). Viabilitas benih berkisar 1 minggu dan germinasi terjadi antara 16 hingga 63 hari (Ng, 1992)
2.1.2 Taksonomi
Dalam klasifikasi tumbuhan, gaharu (A. malaccensis) termasuk dalam divisi Spermatophyta, subdivisi Angiospermae, kelas Dicotyledone, ordo Thymelaeles,
famili Thymeliaceae, genus Aquilaria dan spesies A. malaccensis Lamk. (Ponirin, 1997). Menurut (Sumarna, 2002) di Indonesia ada 8 genus dan 16 spesies tanaman
penghasil gaharu antara lain adalah genus Aquilaria sp, Aetoxylon,
Enkleia,Gonystylus sp, Wikstroemia sp, Grynops, Dalbergia dan Excocaria. Genus Aquilaria memiliki 6 spesies A. beccariana, A. cumingiana, A. filaria, A. hirta, A. malaccensis dan A. microcarpa (Soehartono, 1997 dalam Barden et al.,2000). Di beberapa daerah di Indonesia gaharu dikenal dengan nama yang berbeda-beda seperti layak, pohon pelanduk, kayu linggu, menameng dan terentak.
Dalam perdagangan dunia gaharu ini dikenal dengan nama aqarwood, aloewood
dan eaglewood (Sumarna, 2002 dalam Azwin, 2007).
2.1.3 Morfologi
Ding Hou (1960) mencatat bahwa pohon A.
malaccensis tumbuh hingga tingginya mencapai 40 m dengan diameter batang utama 60 cm.
Kulit batang licin, berwarna putih atau
keputih-putihan, kadang-kadang beralur. Bentuk
daunnya lonjong agak memanjang, dengan
ukuran 5-8 cm, lebar 3-4 cm, berujung runcing
dan berwarna hijau mengkilap (Sumarna, 2002).
Menurut Ponirin (1997), daun yang kering
biasanya berwarna abu-abu kehijauan, tepi daun
agak bergelombang, melengkung dan kedua permukaannya licin serta mengkilap,
tulang daun sekunder 12-16 pasang. Bunga berada di ujung ranting atau ketiak
atas dan bawah daun. Buah berada dalam polong berbentuk bulat telur atau
lonjong, berukuran panjang sekitar 5 cm dan lebar sekitar 3 cm, biji bulat atau
bulat telur yang ditutupi bulu-bulu halus berwarna kemerahan (Sumarna, 2002).
2.1.4 Distribusi dan status konservasi
A. malaccensis tersebar luas di Asia Selatan dan Tenggara. Oldfield et al. (1998) dalam Barden et al. (2000) menyebutkan spesies ini ditemukan di 10 negara, antara lain Bangladesh, Bhutan, India, Indonesia, Iran, Malaysia,
Myanmar, Philippines, Singapore dan Thailand. Di Indonesia daerah penyebaran
gaharu antara lain terdapat di kawasan Sumatra, Kalimantan, Sulawesi, Maluku,
Papua, Nusa Tenggara dan Jawa. (Azwin, 2007)
A. malaccensis termasuk dalam The World List of Threatened Tress (Oldfield et al., 1998). IUCN Red List tahun 2002 mengelompokan spesies ini ke
dalam kelompok vulnerable (rawan)(VU A1cd) berdasarkan laju pengurangan populasi kurang dari 20% selama lebih dari tiga generasi disebabkan oleh
eksploitasi aktual atau potensial, seiring dengan penurunan di lokasi asalnya.
Tingkat keberadaan dan/atau kualitas habitat (Hilton-Taylor, 2002). Klasifikasi ini
berdasarkan pendekatan yang dirumuskan pada 1994. Tekanan akibat pemanenan
besar-besaran terjadi di beberapa negara seperti Indonesia, Malaysia dan Thailand
sehingga spesies dimasukkan dalam Appendix II pada tahun 1994.
2.1.5 Manfaat gubal gaharu dan kandungan
Pemanfaatan gaharu hingga saat ini masih dalam bentuk bahan baku yaitu
kayu bulatan, cacahan, bubuk atau fosil kayu yang sudah terkubur. Aroma yang
dikeluarkan gaharu sangat populer dan disukai masyarakat Timur Tengah, Saudi
Arabia, Uni Emirat, Yaman, Oman, daratan China, Korea dan Jepang. Menurut
Chakrabarty et al. (1994) dalam Barden et al. (2000) gubal gaharu digunakan sebagai dupa, wewangian, penghilang rasa sakit, asma, reumatik, tonik saat hamil
setelah melahirkan. Menurut Barden et al. (2000), gubal gaharu juga dimanfaatkan sebagai pelengkap dalam acara ritual keagamaan pada masyarakat
khususnya di kawasan Asia dan Timur Tengah dalam bentuk dupa, hio atau
Wangi dari gubal gaharu terjadi karena terdapat senyawa kimia aromatik
dan minyak atsiri. Komponen minyak atsiri yang dikeluarkan gaharu berupa
sequiterpenoida, eudesmana dan valencana. Hasil analisis kimia memberikan informasi gaharu memiliki 6 komponen utama berupa furanoid sesquiterpene
diantaranya a-agarofuran, b-agarofuran dan agarospirol. A. malaccensis asal
Kalimantan ditemukan komponen pokok minyak gaharu berupa chromone yang menyebabkan bau harum bila dibakar (Sumarna, 2002).
2.2 Kultur In Vitro 2.2.1 Teknik kultur in vitro
Kultur in vitro merupakan suatu metode untuk mengisolasi (mengambil) bagian tanman seperti protoplasma, sel, sekelompok sel, jaringan dan organ, dan
menumbuhkannya secara aseptis (bebas kontaminasi) menjadi tanaman yang utuh
(plantet) (Gamborg 1982; Nugroho dan Sugito 2002). Teknik kultur in vitro sering
disebut teknik kultur jaringan. Sandra dan Karyaningsih (2000) menambahkan
bahwa dasar pengembangan kultur in vitro berdasarkan teori yang dikemukakan
oleh Schleiden dan Schwan yaitu sel tumbuhan yang mempunyai kemampuan
otonom totipotensi, yang merupakan potensi suatu sel untuk dapat tumbuh menjadi tanaman lengkap dan dewasa karena tiap sel mengandung rangkaian gen
yang lengkap.
Gunawan (1995) menyatakan bahwa teknik kultur in vitro memiliki
beberapa tahapan yaitu : persiapan media, isolasi bahan tanaman (eksplan),
sterilisasi eksplan, inokulasi, pertumbuhan, aklimatisasi dan usaha memindahkan
tanaman hasil kultur lapangan. Teknologi ini menuntut syarat tertentu yang harus
dipenuhi dalam pelaksanaannya. Syarat pokok pelaksanaan kultur jaringan adalah
tersedianya fasilitas laboratorium yang menyediakan alat-alat kerja dan sarana
produksi hingga terciptanya kondisi aseptik yang terkendali serta diperlukan pula
keterampilan dan latar belakang keilmuan bagi pelaksanaannya.
Gunawan (1995) menyatakan, suatu metode regenerasi belum tentu dapat
diterapkan pada semua jenis tanaman terutama jenis-jenis tanaman tropika. Oleh
karena itu langkah pertama yang perlu dilakukan adalah percobaan regenerasi
tanaman. Untuk memperoleh hasil perlu dilakukan percobaan pendahuluan.
Percobaan pendahuluan menjadi latar belakang pendekatan yang sistematis
terhadap permasalahan yang timbul.
2.2.2 Manfaat kultur in vitro
Kegunaan utama dari kultur in vitro adalah untuk mendapatkan tanaman
dalam jumlah banyak, dalam waktu yang relatif singkat, serta mempunyai sifat
fisiologi dan morfologi yang sama dengan induknya. Teknik tersebut juga mampu
menghasilkan tanaman baru yang bersifat unggul (Hendaryono & Wijayani 1994)
Budiatmoko (1998), juga menyatakan bahwa kelebihan penggunaan teknik
kultur in vitro untuk pembudidayaan tanaman yaitu: (1) membantu usaha pemuliaan pohon, (2) menghasilkan tanaman bebas penyakit, (3) tidak tergantung
iklim dan musim serta tidak membutuhkan lahan yang luas karena dilakukan di
laboratorium, (4) mempunyai tingkat laju perbanyakan yang tinggi dalam waktu
yang singkat, (5) menghemat bahan baku karena hanya bagian kecil tanaman yang
digunakan dan (6) merupakan sarana untuk mendapatkan produk sekunder
tanaman (misalnya metabolit sekunder) dengan cepat dalam jumlah yang cukup
besar.
2.2.3 Faktor-faktor yang mempengaruhi kultur in vitro
Ada beberapa faktor yang berpengaruh terhadap keberhasilan teknik kultur
in vitro antara lain : eksplan, media kultur jaringan, zat pengatur tumbuh yang
digunakan dan lingkungan tumbuh.
A. Eksplan
Eksplan merupakan potongan yang diisolasi dari tanaman yang
dipergunakan untuk inisisasi suatu kultur in vitro. Eksplan yang baik memiliki
syarat daya regenerasi yang tinggi, lebih baik merupakan bahan tanaman yang
tertutup seperti pucuk dan meristem, sehat dan tidak mengandung bibit penyakit
(Sandra & Karyaningsih 2000). Menurut Gamborg dan Shyluk (1981) hampir
semua bagian jaringan tanaman dapat dijadikan sebagai eksplan. Organ yang biasa
digunakan sebagai eksplan antara lain tunas pucuk, tunas ketiak (aksilar), akar,
mata tunas, daun dan embrio. Tingkat keberhasilan dari jenis organ yang
B. Media kultur in vitro
Gunawan (1995) mengatakan faktor penentu di dalam media tumbuh adalah
komposisi garam anorganik, zat pengatur tumbuh dan bentuk fisik media.
Komposisi garam anorganik telah dikembangkan oleh beberapa ahli. Ada yang
tinggi konsentrasinya garamnya, ada yang sedang dan ada yang rendah.
Komposisi media tersebut pada umumnya diberi nama sesuai dengan nama
penemunya, antara lain : medium dasar Murashige dan Skoog (MS), medium
dasar Knop, medium dasar Nitsch dan Nitsch, medium dasar B5 atau Gamborg,
medium dasar White, medium dasar Vacin Went (VW), medium dasar N6,
medium dasar Heller, medium dasar Woody Plant Medium (WPM), medium
dasar Knudson C, medium dasar Schenk dan Hildebrant, medium dasar Gresshof
dan Day dan medium dasar Anderson.
Komposisi garam dalam medium dasar Murashige dan Skoog (MS)
merupakan media yang paling umum digunakan khususnya untuk morfogenesis,
kultur meristem, dan regenerasi tanaman (Gamborg dan Shyluk 1981). Medium
ini digunakan untuk hampir semua macam tanaman. Media ini punya konsentrasi
garam-garam mineral yang tinggi dan senyawa N dalam bentuk NO3- dan NH4+.
medium dasar Woody Plant Medium (WPM) dan Anderson digunakan untuk menanam tanaman dari eksplan yang keras, umumnya digunakan untuk tanaman
berkayu (Hendaryono dan Wijayani, 1994).
C. Zat Pengatur Tumbuh (ZPT)
Zat pengatur tumbuh tanaman mencakup zat-zat endogen maupun zat-zat
eksogen (sintetik) yang dapat mengubah pertumbuhan tanaman. Zat pengatur
tumbuh tanaman yang dihasilkan oleh tanaman (zat endogen) disebut fitohormon,
sedangkan yang sintetik disebut zat pengatur tumbuh (Wattimena, 1988).
Faktor yang perlu mendapat perhatian dalam penggunaan zat pengatur
tumbuh antara lain jenis zat pengatur tumbuh yang akan digunakan, konsentrasi,
urutan penggunaan dan periode masa induksi dalam kultur tertentu (Gunawan,
1995). Pertumbuhan dan morfologis tanaman secara in vitro juga dikendalikan
oleh keseimbangan dan interaksi dari zat pengatur tumbuh yang berada dalam
Zat pengatur tumbuh adalah senyawa organik yang biasanya dibutuhkan
dalam jumlah yang sedikit dan dapat merangsang, menghambat atau mengubah
pertumbuhan dan perkembangan tanaman. ZPT ini mempengaruhi pertumbuhan
dan perkembangan morfogenesis dalam kultur sel, jaringan dan organ (Gunawan,
1987)
D. Faktor Lingkungan
Faktor-faktor lingkungan yang berpengaruh terhadap perkembangan kultur
in vitro antara lain derajat keasaman (pH), kelembaban, cahaya dan temperatur
(Gunawan 1995). Faktor lingkungan tersebut berpengaruh terhadap proses
pertumbuhan dan differensiasi.
Kelembaban relatif (RH) lingkungan yang dibutuhkan biasanya mendekati
100%. RH di sekitar kultur akan mempengaruhi pola perkembangan (Gunawan,
1995). Bila kelembaban ruangan rendah, penguapan air dari media kultur akan
terlalu besar. Dalam hal ini kelembaban perlu dinaikkkan. Sebaliknya apabila
kelembaban udara kultur tinggi, akan menyebabkan pertumbuhan mikroba di luar
wadah kultur (Wetherell, 1982).
2.3 Karakteristik BAPdan TDZ
BAP dan TDZ merupakan zat pengatur tumbuh yang masuk dalam katagori
(sitokinin), dengan tujuan pemakaian untuk memacu pertumbuhan tunas dan kalus.
BAP dan TDZ adalah senyawa kimia dengan ikatan kompleks.
2.3.1 BAP(Benzylaminopurin)
BAP (Benzylaminopurin) merupakan
zat pengatur tumbuh yang tergolong
kedalam sitokinin sintetik yang
penggunaannya dipengaruhi oleh ZPT
lainnya. Sitokinin mempengaruhi berbagai
proses fisiologi di dalam tanaman. Aktivitas utama sitokinin adalah sitokinesis
atau pembelahan sel. Aktivitas ini yang menjadi kriteria utama untuk
Berbeda dengan auksin dan giberelin, sitokinin hanya sedikit yang di
translokasikan melalui jaringan hidup tanaman. Sitokinin dibawa secara pasif
sepanjang aliran transpirasi pada xilem dari akar yang merupakan sumber utama menuju bagian-bagian lain dari tanaman (Krishnamoorty 1981 dalam Hartini
1996).
Salah satu jenis hormon dari kelompok sitokinin yang paling banyak
digunakan adalah BAP. Hal ini karena BAP dinilai lebih stabil, tidak mahal dan
lebih efektif dibandingkan kinetin. BAP biasanya digunakan untuk induksi kalus
tapi yang terpenting adalah BAP dapat menginduksi pembentukan tunas, pucuk
atau kecambah (Bonga dan Durzan, 1982).
Kockankov et al. 1989 dalam Hartini 1996 menyatakan BAP dapat menginduksi terjadinya transisi tunas generatif pada tanaman Rudbeckia bicolor. Selain itu, BAP juga efisien dalam mendorong inisiasi tunas bunga tapi tidak
mempengaruhi perkembangan tanaman selanjutnya. Total kandungan sitokinin
meningkat pada lapisan xilem pada 30 hari sebelum pembentukan bungan
mencapai maksimum selama pembentukan tunas bunga dan mencapai maksimum
selama pembentukan tunas bunga serta saat mekar penuh.
Penggunaan BAP dengan konsentrasi tinggi dan waktu yang lama seringkali
menyebabkan regenerant sulit berakar dan dapat menyebabkan penampakan
pucuk abnormal. Hal ini jelas terlihat pada kultur pucuk Asparagus officinalis (Wattimena 1998).
2.3.2 TDZ (Thidiazuron)
Thidiazuron juga masuk dalam kelompok
ZPT sitokinin sintetik sama seperti BAP. Menurut
Tefera dan Wannakrairoj 1897 dalam Kusmianto (2008), TDZ dapat berperan dalam menstimulasi
produksi sitokinin endogen. Kende dan Zaavaart
1997 dalam Kusmianto (2008) lebih lanjut
menjelaskan bahwa TDZ juga memiliki peran sebagai inhibitor sitokinin oksidase
Oleh karena itu TDZ dapat meningkatkan kerja sitokinin lain, baik sitokinin
eksogen ataupun sitokinin endogen.
Thidiazuron merupakan salah satu sitokinin tipe phenylurea sintetik yang memiliki kemampuan lebih baik dalam menginduksi tunas, di antara sitokinin lain
seperti zeatin, benzylaminopurin dan kinetin (Mok dan Mok 2001; Kou et al.
dalam Kusmianto, 2008).
2.4 Fungsi Unsur dalam Media Tanam
Menurut Sutarno Maeso 1989 dalam Hendaryono dan Wijayani 1994,
kegunaan setiap unsur-unsur yang akan digunakan dalam medium kultur in vitro adalah sebagai berikut :
Unsur Nitrogen (N), kegunaan N bagi tanaman adalah untuk menyuburkan tanaman sebab unsur N dapat membentuk protein, lemak dan berbagai
senyawa organik yang lain. Unsur N dipergunakan terutama untuk
pertumbuhan vegetatif tanaman. Selain itu unsur ini juga berperan dalam
pembentukan hijau daun yang berguna untuk melaksanakan proses
fotosintesis yang selanjutnya akan menghasilkan karbohidrat.
Unsur Fosfor (P), unsur ini terutama dibutuhkan untuk pembentukan karbohidrat. Unsur ini dibutuhkan besar-besaran pada waktu pertumbuhan benih,
pembuangan, pemasakan biji.
Unsur Kalium (K), berfungsi untuk memperkuat tubuh tanaman karena unsur ini dapat menguatkan serabut-serabut akar sehingga daun, bunga dan buah tidak
mudah gugur. Selain itu juga berfungsi memperlancar metabolisme dan
mempengaruhi penyerapan makanan.
Unsur Kalsium(Ca), unsur ini terdapat pada batang dan daun tanaman. Unsur ini juga bertugas merangsang pembentukan bulu-bulu akar, merangsang batang
dan merangsang biji karena unsur Ca bersama dengan Mg akan
memproduksi cadangan makanan.
Unsur Magnesium(Mg), penambahan unsur ini maka kandungan fosfat dalam tanaman dapat meningkat. Kegunaan dari fosfat sendiri adalah sebagai
protein menyebabkan pertumbuhan daun menjadi hijau sempurna dan
terbentuk karbohidrat, lemak serta minyak-minyak.
Unsur Besi (Fe), unsur Fe dibutuhkan sedikit lebih banyak daripada unsur mikro lainnya. Pemberian unsur Fe berfungsi sebagai penyangga (chelatin agent) yang sangat penting untuk menyangga kestabilan pH media selama
digunakan untuk menumbuhkan jaringan tanaman. Pada tanaman unsur Fe
berfungsi untuk pernafasan dan pembentukan hijau daun.
Unsur Sukrosa, Glukosa dan Fruktosa, Sukrosa dalam medium kultur in vitro berfungsi sebagai sumber energi yang diperlukan untuk induksi kalus.
Sukrosa 2-5% merupakan sumber karbon. Unsur glukosa dan fruktosa dapat
digunakan untuk mengganti sukrosa karena dapat merangsang pertumbuhan
beberapa jaringan. Pemilihan gula dan konsentrasi yang akan digunakan
tergantung dari jaringan tumbuhan yang akan dikulturkan dan tujuan yang
ingin dicapai.
Unsur Mio-inositol, penambahan mio-inositol pada medium bertujuan untuk membantu differensiasi dan pertumbuhan sejumlah jaringan. Bila
mio-inositol diberikan bersama denga auksin, kinetin dan vitamin maka dapat
mendorong pertumbuhan jaringan kalus.
Unsur Vitamin, vitamin-vitamin yang sering digunakan dalam media kultur in vitro antara lain adalah Thiamin (vit. B1), Pirodiksin (vit. B6) dan asam
nikotinat. Vitamin-vitamin ini umumnya terdapat dalam tanaman. Thiamin
adalah vitamin yang esensial untuk semua kultur in vitro tumbuhan. Fungsinya adalah untuk mempercepat pembelahan sel pada meristem akar
juga berperan sebagai koenzim dalam reaksi yang menghasilkan energi dari
karbohidrat dan memindahkan energi. Asam nikotinat juga penting dalam
BAB III
METODOLOGI PENELITIAN
3.1 Lokasi dan Waktu
Penelitian ini dilaksanakan di Laboratorium Kultur Jaringan Departemen
Lingkungan Hidup PT Newmont Nusa Tenggara, Kecamatan Sekongkang,
Kabupaten Sumbawa Barat, Provinsi Nusa Tenggara Barat selama 3 bulan mulai
dari bulan Juni hinggaAgustus 2011.
3.2 Alat
Alat yang digunakan dalam penelitian ini adalah botol kultur, oven, plastik
warp, gelas piala, gelas ukur, hot plate, magnetic stirer, cawan petri, erlenmeyer,
autoklaf, api spiritus, mata pisau, gunting, pH meter, scapel, pinset, pipet, spatula,
neraca digital, laminar air flow cabinet serta rak-rak untuk menempatkan botol
hasil kultur.
3.3 Bahan
Bahan yang digunakan dalam penelitian ini dijabarkan dalam tiga kelompok
sesuai dengan jenis dan cara penggunaannya.
3.3.1 Bahan media tanam
Media dasar berfungsi sebagai suplai nutrisi bagi eksplan. Media dasar yang
digunakan adalah Murashige Skoog (MS). Bahan yang dibutuhkan untuk
membuat media MS adalah unsur makro, mikro dan vitamin. Jenis media tanam
berupa gel padat, menggunakan agar-agar khusus yang tidak berwarna dan
bersifat netral. Gula digunakan sebagai cadangan makanan dan air sebagai pelarut
seluruh media. Hormon yang digunakan adalah Benzyl Adenin Purin (BAP) dan
3.3.2 Bahan tanaman
Bahan tanaman yang digunakan adalah eksplan Gaharu (Aquilaria
malaccensis) dalam media MS 0 hasil subkultur dengan karakteristik satu tunas
banyak daun. Bagian tanaman yang digunakan adalah daun.Umur plantlet adalah
4 bulan. Plantlet ditanam dalam botol selai yang berukuran besar.
3.3.3 Bahan sterilisasi
Bahan yang digunakan untuk mensterilkan peralatan adalah alkohol 70%
(cair dan gel), aquades, iodine (betadine), spiritus (api), korek api, kapas, cairan
liquinox dan air yang sudah disterilisasi.
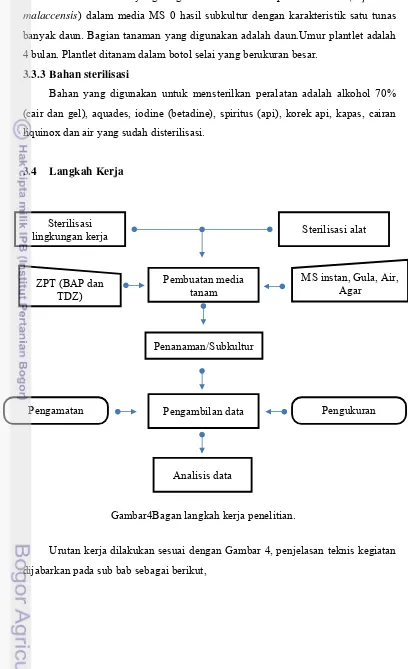
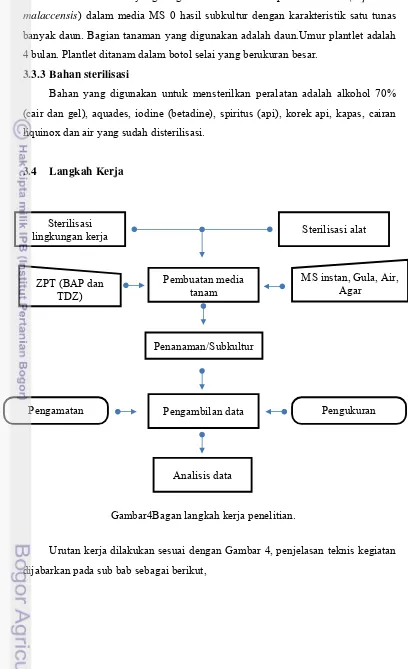
3.4 Langkah Kerja
Urutan kerja dilakukan sesuai dengan Gambar 4, penjelasan teknis kegiatan
dijabarkan pada sub bab sebagai berikut,
Sterilisasi alat
Pengambilan data
Analisis data Sterilisasi
lingkungan kerja
Pembuatan media tanam
Penanaman/Subkultur
Pengamatan
MS instan, Gula, Air, Agar
Pengukuran ZPT (BAP dan
TDZ)
3.4.1 Sterilisasi alat
Botol kultur dan perlengkapan penanaman berupa petri dish, scapel, pinset
bengkok dan lurus dicuci menggunakan cairan liqui-nox dengan bantuan spon
busa dan gumpalan kawat untuk menghilangkan kotoran yang melekat pada
peralatan tersebut. Setelah pembersihan menggunakan cairan liquinox kemudian
semua botol dan peralatan dibilas menggunakan aquades untuk menghilangkan
sisa-sisa cairan pembersih yang masih menampel. Botol dan perlengkapan
penanaman ditiriskan di keranjang berongga agar air sisa pencucian sebagian
jatuh. Jika botol akan disterilkan pada hari yang berbeda maka botol disimpan di
tempat bersih dan tertutup dalam mulut botol berada di bawah (terbalik). Khusus
peralatan yang terbuat dari besi setelah pembilasan terakhir harus segera
dikeringkan menggunakan tissue untuk mencegah timbulnya karat akibat oksidasi
besi dengan air sisa pencucian begitu juga dengan petri dishharus segera
dikeringkan untuk mencegah timbulnya bercak-bercak tetesan air.
Sterilisasi berikutnya menggunakan bantuan autoclave. Sebelum menata botol kultur pastikan air rebus cukup untuk proses sterilisasi selama satu jam.
Botol kultur disusun rapi dan rapat dalam autoclave dengan posisi terbalik.
Perlengkapan penanaman disusun sesuai kebutuhan dan dikelompokkan sesuai
fungsinya seperti pinset dan scapel dibungkus menjadi satu wadah. Langkah
selanjutnya dibungkus rapi dalam kertas HVS dan diberi label nama alat dan
tanggal sterilisasi.
Strerilisasi peralatan dalam autoclave dilakukan selama satu jam dengan
tekanan 17,5 psi dan suhu 121°C. Autoclave dioperasikan dalam keadaan exhaust
valve (katup pembuangan) terbuka hingga uap air keluar selama 5 menit, hal ini untuk membuang uap air awal yang masih mengandung kotoran-kotoran yang
dapat menyebabkan kontaminasi. Botol dan peralatan yang sudah disterilisasi
langsung disimpan dalam wadah tertutup untuk mengurangi kontak dengan udara
luar terlalu lama.
3.4.2 Pembuatan media tanam
Pertama menyiapkan alat dan bahan dalam meja kerja. Penataan botol steril
untuk mencegah kontaminan masuk selama masa pembuatan media. Semua bahan
ditimbang menggunakan neraca digital dengan berat sebagai berikut.
Tabel 1. Penggunaan bahan untuk pembuatan media tanam
Bahan Berat (gram)
MS Instan 4,43
Gula pasir 30
Agar-agar 7
setelah seluruh bahan selesai ditimbang kemudian dicampur ke dalam satu liter air
mineral aduk hingga merata.Langkah selanjutnya mengukur pH menggunakan pH
indikator, pastikan didapatkan berkisar pH 5-6. Kemudian panaskan
menggunakan hot plate hingga mendidih, selama proses pemanasan larutan harus
tetap diaduk agar semua bahan tercampur dengan sempurna. Pemberian BAP dan
TDZ sesuai dengan taraf yang direncanakan, larutan BAP yang digunakan adalah
BAP 1 ppm dan BAP 2 ppm, TDZ yang digunakan adalah TDZ 0,05 ppm, 0,1
ppm dan 0,5 ppm. Pencampuran antara media dasar dengan hormon diaduk
hingga merata.
Penuangan dilakukan menggunakan wadah tuang yang berujung lancip
untuk memudahkan masuknya larutan ke dalam botol. Volume penuangan kurang
lebih 10 ml tiap botol. Botol yang telah terisi media segera ditutup menggunakan
plastik dengan ukuran 10 cm x 10 cm kemudian ikat dengan karet untuk
mencegah kontaminan masuk, pengikatan dengan karet sebaiknya tidak terlalu
rapat untuk mencegah plastik bocor saat proses sterilisasi dengan tekanan dan
suhu tinggi.
Proses sterilisasi media langkahnya sama dengan sterilisasi alat, hanya saja
lama proses dikurangi menjadi 20 menit. Media yang sudah steril selanjutnya
ditambah ikatan karet dan ditempatkan pada wadah tertutup kemudian disimpan
3.4.3 Sterilisasi lingkungan kerja
Sebelum melakukan penanaman, ruangan penanaman disterilisasi terlebih
dahulu untuk mengeliminasi faktor kontaminasi kasat mata berupa bakteri, virus
dan jamur yang menempel pada debu baik yang beterbangan maupun menempel
pada peralatan kerja dan permukaan ruangan. Terdapat dua jenis sterilisasi, yaitu
sterilisasi ruangan dan sterilisasi laminar air flow (LAF).
Sterilisasi ruangan dilakukan dengan menyapu lantai ruangan untuk
membersihkan debu-debu yang menempel pada lantai ruangan kemudian
mengepel lantai menggunakan larutan alkohol 70% selanjutnya menghidupkan
lampu UV selama 12 jam untuk mematikan kontaminan yang masih beterbangan
di udara.
Sterilisasi LAF dilakukan dengan menyemprotkan larutan alkohol 70% pada
seluruh permukaan luar LAF kemudian mengeringkan dengan tissue. Filter
blower juga dibersihkan secara berkala. Bagian dalam juga disemprot larutan
alkohol 70% dalam keadaan blower hidup kemudian dikeringkan. Setelah semua
langkah diatas selesa, media tanam, alat dan bahan tanam dimasukkan kedalam
LAF kemudian hidupkan lampu UV minimal selama 2 jam untuk mematikan
kontaminan yang masih tersisa. Sebelum memulai menggunakan LAF, buka
sedikit pintu LAF, matikan lampu UV dan nyalakan blower selama 30 menit
untuk membuang sisa debu dan kontaminan yang telah terkena UV.
Ruangan yang steril juga ditunjang dengan sikap dan pakaian yang steril.
Hal ini diterapkan untuk mengurangi masuknya kontaminan ke dalam ruangan
laboratorium. Pakaian steril yang dikenakan adalah jas lab khusus, penutup
kepala, kaos tangan karet, masker dan kacamata.
3.4.4 Penanaman/Subkultur
Pastikan alat dan bahan telah lengkap tersedia di dalam LAF, selama
penanaman hidupkan lampu neon dan blower. Siapkan kapas untuk mengoleskan
campuran betadine, alkohol gel 70% dan air steril secukupnya pada bibir dan
leher botol. Teteskan betadine sebanyak 3 tetes dan air steril secukupnya ke dalam
petri dish secukupnya kemudian ratakan dengan cara memutar-mutar petri dish. Keluarkan terlebih dahulu beberapa plantlet dari botol selai menggunakan
pinset. Daun berukuran relatif besar dipotong menjadi dua sampai tiga bagian
dengan potongan horizontal urat daun. Daun yang digunakan adalah daun yang
sudah berwarna hijau muda hingga tua. Susun rapi daun-daun yang akan
dimasukkan kembali ke dalam botol untuk efisiensi subkultur.
Buka tutup plastik media tanam secara perlahan, panaskan sekeliling leher
botol di api bunsen untuk mematikan kontaminan, oleskan cairan betadine,
alkohol gel 70% dan air steril menggunakan kapas sepanjang bibir dan leher
botol. Masukan dua eksplan daun ke dalam botol, posisi tanam diusahakan
membuat kontak permukaan daun dengan media sebanyak mungkin. Tutup
kembali petri dish. Panaskan beberapa saat bibir botol kemudian langsung tutup
dengan plastik dan ikat menggunakan dua karet serapat mungkin.
Proses penanaman dilakukan cepat dan hati-hati karena semakin lama botol
dan petri dish terbuka, semakin besar peluang kontaminan masuk ke dalam.
Sebelum menggunakan pinset dan mata pisau scapel, dicelupkan ke dalam alkohol
70%, dipanaskan di api bunsen dan masukkan ke air steril untuk mendinginkan.
Selama proses penanaman minimalkan tangan keluar dari LAF dan
bercakap-cakap.
3.4.5 Pengambilan Data
Pengambilan data dilakukan dengan dua metode, yaitu pengamatan visual
dan pengukuran langung. pengamatan visual dilakukan untuk mengamati
perubahan morfologi eksplan, gangguan pertumbuhan dan kontaminasi.
Pengukuran langsung dilakukan seminggu sekali selama 8 minggu. Variabel yang
diukur dalam penelitian ini adalah
1). Luas bengkak : diukur menggunakan bantuan milimeter blok transparan, untuk
mengukur luas permukaan daun yang bengkak, hasil pengukuran
dikelompokkan dalam dua grup nilai. Nilai 1 untuk eksplan bengkak dengan
luas kurang dari 50% dari luas total jaringan daun yang hidup. Nilai 2 untuk
eksplan bengkak dengan luas lebih dari sama dengan 50% dari luas total
jaringan daun yang hidup.
2). Luas kalus : diukur menggunakan bantuan milimeter blok transparan, untuk
mengukurluas permukaan kalus yang terbentuk, satuan yang digunakan cm2.
3.4.6 Analisis data
Perhitungan parameter kualitatif meliputi persentase kontaminasi oleh jamur
dan bakteri, browning (pencoklatan), dan kematian pada eksplan dengan
menggunakan rumus sebagai berikut :
%Tingkat kontaminasi = ∑eksplan yang terkontaminasi x 100%
N
%Tingkat pencoklatan = ∑eksplan yang mengalami pencoklatan x 100%
N
%Tingkat pemutihan = ∑eksplan yang mengalami pemutihan x 100%
N
%Tingkat kematian = ∑eksplan yang mengalami kematian x 100%
N
%Tingkat keberhasilan = ∑eksplan yang berkalus x 100%
N
Keterangan : N adalah jumlah total eksplan yang tersedia pada setiap perlakuan
Data yang akan diolah menggunakan metode statistik akan menggunakan
bantuan perangkat lunak Statistical Analysis System 9.1 dengan metode statistik
Annova yang akan dijelaskan di sub-bab berikutnya.
3.5 Rancangan percobaan
Rancangan percobaan yang digunakan dalam penelitian ini yaitu Rancangan
Faktorial dengan Acak Lengkap (RAL-F). Dalam penelitian ini, RAL-F terdiri
dari dua faktor yaitu zat pengatur tumbuh BAP dan zat pengatur tumbuh TDZ.
masing-masing taraf terdapat 20 eksplan yang ditanam dalam 10 botol, sehingga
eksplan total adalah 240 eksplan dalam 120 botol.Taraf atau konsentrasi
Tabel 2. Kombinasi zat pengatur tumbuh
BAP (ppm)
TDZ(ppm)
0 0,05 0,1 0,5
0 B0T0 B0T1 B0T2 B0T3
1 B1T0 B1T1 B1T2 B1T3
2 B2T0 B2T1 B2T2 B2T3
Keterangan :
B0T0 : Kontrol B1T1 : BAP 1 ppm + TDZ 0,05ppm
B0T1 : TDZ 0,05 ppm B1T2 : BAP 1 ppm + TDZ 0,1ppm
B0T2 : TDZ 0,1 ppm B1T3 : BAP 1 ppm + TDZ 0,5ppm
B0T3 : TDZ 0,5 ppm B2T1 : BAP 2 ppm + TDZ 0,05ppm
B1T0 : BAP 1 ppm B2T2 : BAP 2 ppm + TDZ 0,1ppm
B2T0 : BAP 2 ppm B2T3 : BAP 2 ppm + TDZ 0,5ppm
Adapun model linear rancangan percobaan yang digunakan yaitu sebagai
berikut (Mattjik & Sumertawijaya 2002) :
Yijk=µ + Bi + Tj + (BT)ij + εijk
Keterangan :
Yijk : Nilai respon eksplan terhadap perlakuan BAP ke-I, TDZ ke-j dan
ulangan ke-k.
µ : Nilai tengah populasi
Bi : Pengaruh perlakuan BAP ke-i
Tj : Pengaruh perlakuan TDZ ke-j
(BT)ij : Pengaruh interaksi antara perlakuan BAP ke-I dan TDZ ke-j εijk : Nilai galat/error percobaan pada perlakuan BAP ke-I, TDZ ke-j
dan ulangan ke-k
Hipotesis dalam uji F:
H0 : Perlakuan tidak berpengaruh terhadap pertumbuhan kalus pada eksplan
daun
H1 : Perlakuan berpengaruh terhadap pertumbuhan kalus pada eksplan
daun
Terima H0 = Perbedaan taraf pemberian antibiotika pada media kultur
tidak berpengaruh terhadap tingkat kontaminasi pada selang kepercayaan 95%
(α=0,05)
Terima H1 = Sekurang-kurangnya ada taraf pemberian antibiotika pada
media kultur yang berpengaruh nyata terhadap tingkat kontaminasi pada selang
kepercayaan 95% (α= 0,05)
Untuk mengetahui pengaruh yang diberikan pada percobaan dilakukan
uji-F yang diperoleh dari hasil analisis ragam atau analysis of variance (ANOVA).
Kemudian dibandingkan dengan F tabel pada selang kepercayaan 95% (α=0,05)
dengan kaidah :
1. Jika F hitung < F tabel maka H0 diterima, H1 ditolak sehingga
pemberian antibiotika pada media kultur tidak berpengaruh terhadap
tingkat kontaminasi.
2. Jika F hitung > F tabel maka H0 ditolak H1 diterima sehingga
pemberian antibiotika pada media kultur berpengaruh nyata terhadap
tingkat kontaminasi.
Jika sidik ragam memberikan hasil berpengaruh nyata, selanjutnya
dilakukan uji Duncan untuk mengetahui beda antar perlakuan. Pengolahan data
4
a
t
p
a
p
k
G
d
k
d
h
m
d
4.1
Persen
Inokul
adalah 20 se
taraf. Hasil
persentase k
adalah 81%
prosedur pe
kultur kalus
Gambar (5)
j
Ekspla
dari eksplan
kematian ya
dan kontam
hitam/coklat
memotong d
dalam daun j
ntase Keber
lasi dilakuka
ehingga tota
pengamatan
keberhasilan
% berbandin
nanaman da
dari eksplan
(5)
Diagram pe
jenis keberh
an yang ber
n berkalus d
ang terjadi d
minasi yang
t dan putih
daun dari ba
juga dapat m
rhasilan Ek
an secara be
al eksplan y
n eksplan da
hidup dan k
ng 19%. Pe
an kualitas m
n daun.
ersentase ke
asilan hidup
rhasil bertah
dan 36% ha
dikatagorikan
g disebabk
terjadi akiba
atang utama p
meracuni tan
splan dan G
rtahap. Juml
yang diamati
aun
A. mala
kematian pa
eluang hidup
media tanam
eberhasilan h
p dan kemati
han hidup be
anya bengka
n menjadi ti
kan oleh c
at stress pen
plantlet sela
naman.
37% 6% 12Gangguanny
lah eksplan
i sebanyak 2
ccensis (Lam
ada minggu s
p yang tin
m cukup unt
(6)
hidup ekspl
an eksplan.
ereaksi dalam
akatau tidak
ga, yaitu hit
cendawan 1
nanaman yan
ain itu senya
4 2% 1%ya.
daun masing
240 eksplan
mk.) menunj
setelah tanam
ggi menunj
tuk menduk
lan.(6)Diagra
m dua bentu
terjadi kalu
tam/coklat 1
1%. Penyeb
ng dilakuka
awa fenol ya
44% % berka stagn putih hitam kontag-masing tar
n daun dari
njukkan bahw
m (MST) ke
jukkan bahw
kung hidupn
am persenta
uk, yaitu 44
us. Sedangk
12%, putih 7
bab kemati
n dengan ca
dan kontaminasi cendawan terjadi akibat adanya cendawan yang menempel pada
botol yang jatuh dan tumbuh setelah mengenai media. Hal ini disimpulkan karena
kontaminasi terjadi pada MST ke-4. Media berubah warna menjadi hitam karena
ditumbuhi koloni cendawan dan eksplan mati karena kehabisan sumber makanan dan
kalah bersaing dengan cendawan.
Yusnita (2003) dalam Azwin (2007), menyatakan bahwa masalah yang sering
dihadapi dalam kultur jaringan tanaman berkayu adalah terjadinya pencoklatan atau
penghitaman bagian eksplan. Pada waktu jaringan terkena stress mekanik, seperti
pelukaan pada waktu proses isolasi eksplan, proses sterilisasi, metabolisme senyawa
berfenol pada eksplan sering terangsang Senyawa berfenol sering bersifat toksik,
menghambat pertumbuhan, bahkan dapat mematikan jaringan eksplan.Menurut
Santoso (2001) pencoklatan terjadi karena rangsangan kimia sdan juga menjelaskan
bahwa munculnya kontaminasi merupakan konsekuensi dari penggunaan media
tanam yang diperkaya.
Untuk mengatasi problem pencoklatan beberapa hal yang dilakukan, misalnya:
1. Mengeluarkan senyawa fenol, yaitu dengan cara membilas terus menerus dengan
air atau aquades, melakukan subkultur berulang, mengabsorbsi dengan arang aktif,
mengarbsorbsi dengan polyvinylpirolidone (PVP).
2. Memodifikasi potensial redok media,
3. Mengurangi agen yang menyebabkan terjadinya pencoklatan, yang paling umum
biasanya yaitu dengan mengurangi jumlah karbohidrat medium, mengurang atau
meniadakan kontak dengan oksigen.
4. Menghambat enzim phenol oksidase, untuk ini dapat digunakan (chelating agents).
EDTA telah terbukti dapat menghambat kerja enzim phenol oksidase.
5. Pengaturan pH rendah, ini dapat dilakukan karena enzim polyophenol oksidase
kerja optimalnya pada pH 6,5 dan menurun seirama dengan turunnya pH.
6. Penggunaan ruang gelap, karena enzim polyphenol oksidase kerja efektifitasnya
dipengaruhi oleh cahaya. Disarankan penggunaan ruang gelap minimal 14 hari
4.2 Pengaruh Pemberian ZPT BAP dan TDZ.
Perkembangan eksplan daun pascapenanaman yang dapat diamati adalah
perubahan morfologi menjadi bengkak dan berkalus. Bengkak merupakan perubahan
morfologi daun akibat pembelahan sel-sel yang terdapat pada daun namun belum
menembus lapisan epidermis daun sehingga daun tampak mengembang dan keriput.
Menurut Santoso (2001) kalus adalah sekumpulan sel amorphopalus yang terjadi dari
sel-sel jaringan awal yang membelah diri secara terus menerus. Sedangkan kalus
merupakan masa proliferasi (pembiakan yang subur) massa jaringan yang belum
terdiferensiasi terbentuk karena adanya sel-sel yang kontak dengan media terdorong
menjadi meristematik dan selanjutnya aktif mengadakan pembelahan seperti jaringan
penutup luka. Kalus terbentuk akibat adanya kandungan auksin pada eksplan yang
cukup tinggi dan kandungan sitokinin yang sangat rendah atau tidak ada sehingga
auksin dapat menginduksi pembentukan kalus pada berbagai jenis batang Salisbury
dan Cleon (1995) dalam Hidayat (2009).
4.2.1 Perubahan morfologi daun menjadi bengkak.
Tabel 3. Hasil sidik ragam (Anova) pengaruh perlakuan BAP dan/atau TDZ terhadap
perubahan morfologi bengkak eksplan daun
ZPT Pengamatn ke- (MST)
1 2 3 4 5 6 7 8 BAP tn sn sn sn sn sn sn sn
TDZ tn n n n n n n n
BAP*TDZ tn n n n tn tn tn tn Keterangan : tn : Tidak berpengaruh nyata
n : Berpengaruh nyata pada selang kepercayaan 95% sn : Berpengaruh sangat nyata pada selang kepercayaan 95%
Berdasarkan hasil uji analisis sidik ragam kombinasi hormon BAP dengan TDZ
pada selang kepercayaan 95% maka dapat diketahui pemberian hormon BAP pada
perlakuan kombinasi hormon tersebut memberikan pengaruh yang sangat nyata mulai
2 MST hingga 8 MST terhadap skor luas bengkak. Pemberian hormon TDZ pada
perlakuan kombinasi hormon tersebut memberikan pengaruh yang nyata mulai 2
MST hingga 8 MST terhadap skor luas bengkak. Interaksi BAP dengan TDZ
MST hingga 4 MST saja. Untuk melihat beda antar perlakuan pada hormon BAP,
TDZ dan interaksinya dilakukan uji lanjut wilayah Duncan
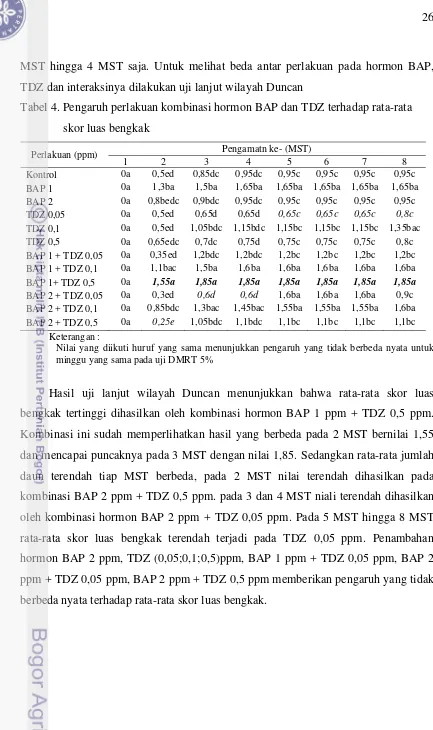
Tabel 4. Pengaruh perlakuan kombinasi hormon BAP dan TDZ terhadap rata-rata
skor luas bengkak
Perlakuan (ppm) Pengamatn ke- (MST)
1 2 3 4 5 6 7 8 Kontrol 0a 0,5ed 0,85dc 0,95dc 0,95c 0,95c 0,95c 0,95c BAP 1 0a 1,3ba 1,5ba 1,65ba 1,65ba 1,65ba 1,65ba 1,65ba BAP 2 0a 0,8bedc 0,9bdc 0,95dc 0,95c 0,95c 0,95c 0,95c TDZ 0,05 0a 0,5ed 0,65d 0,65d 0,65c 0,65c 0,65c 0,8c
TDZ 0,1 0a 0,5ed 1,05bdc 1,15bdc 1,15bc 1,15bc 1,15bc 1,35bac TDZ 0,5 0a 0,65edc 0,7dc 0,75d 0,75c 0,75c 0,75c 0,8c BAP 1 + TDZ 0,05 0a 0,35ed 1,2bdc 1,2bdc 1,2bc 1,2bc 1,2bc 1,2bc BAP 1 + TDZ 0,1 0a 1,1bac 1,5ba 1,6ba 1,6ba 1,6ba 1,6ba 1,6ba BAP 1+ TDZ 0,5 0a 1,55a 1,85a 1,85a 1,85a 1,85a 1,85a 1,85a
BAP 2 + TDZ 0,05 0a 0,3ed 0,6d 0,6d 1,6ba 1,6ba 1,6ba 0,9c BAP 2 + TDZ 0,1 0a 0,85bdc 1,3bac 1,45bac 1,55ba 1,55ba 1,55ba 1,6ba BAP 2 + TDZ 0,5 0a 0,25e 1,05bdc 1,1bdc 1,1bc 1,1bc 1,1bc 1,1bc Keterangan :
Nilai yang diikuti huruf yang sama menunjukkan pengaruh yang tidak berbeda nyata untuk minggu yang sama pada uji DMRT 5%
Hasil uji lanjut wilayah Duncan menunjukkan bahwa rata-rata skor luas
bengkak tertinggi dihasilkan oleh kombinasi hormon BAP 1 ppm + TDZ 0,5 ppm.
Kombinasi ini sudah memperlihatkan hasil yang berbeda pada 2 MST bernilai 1,55
dan mencapai puncaknya pada 3 MST dengan nilai 1,85. Sedangkan rata-rata jumlah
daun terendah tiap MST berbeda, pada 2 MST nilai terendah dihasilkan pada
kombinasi BAP 2 ppm + TDZ 0,5 ppm. pada 3 dan 4 MST niali terendah dihasilkan
oleh kombinasi hormon BAP 2 ppm + TDZ 0,05 ppm. Pada 5 MST hingga 8 MST
rata-rata skor luas bengkak terendah terjadi pada TDZ 0,05 ppm. Penambahan
hormon BAP 2 ppm, TDZ (0,05;0,1;0,5)ppm, BAP 1 ppm + TDZ 0,05 ppm, BAP 2
ppm + TDZ 0,05 ppm, BAP 2 ppm + TDZ 0,5 ppm memberikan pengaruh yang tidak
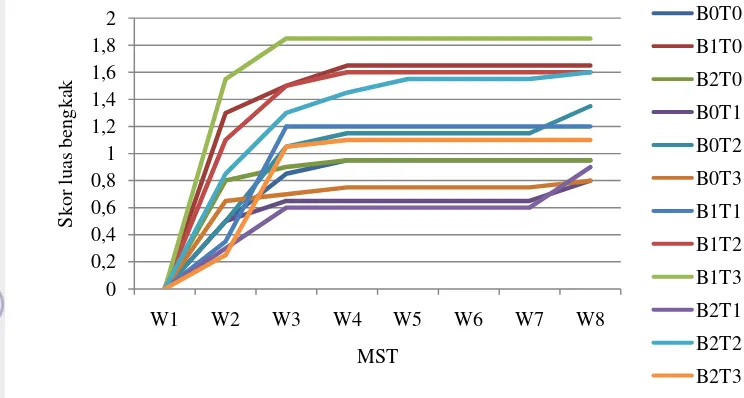
Gambar7 Grafik pertambahan skor luas bengkak mingguan eksplan daun A.
malaccensis.
Peningkatan skor luas bengkak sangat signifikan terjadi pada 1 MST hingga 2
MST, 2 MST hingga 3 MST pertambahan cenderung berkurang dan relatif tidak
terjadi penambahan skor luas bengkak hingga 8 MST. Hal ini menunjukkan MST
optimum terjadinya bengkak yaitu pada 1 MST hingga 3 MST pada saat stok
makanan masih banyak tersedia di media tanam.
4.2.2 Muncul kalus
Hasil pengamatan terhadap eksplan daun yang ditanam pada media yang diberi
perlakuan ZPT BAP dan/atau TDZ tidak menunjukkan perbedaan pada taraf uji 0,05
DMRT
Tabel 5. Hasil sidik ragam (Anova) pengaruh perlakuan BAP dan/atau TDZ terhadap
pertumbuhan kalus eksplan daun
ZPT Pengamatn ke- (MST)
1 2 3 4 5 6 7 8 BAP tn tn tn tn tn tn tn tn
TDZ tn tn tn n n n n sn
BAP*TDZ tn tn tn tn tn tn tn n
Keterangan : tn : Tidak berpengaruh nyata
n : Berpengaruh nyata pada selang kepercayaan 95% sn : Berpengaruh sangat nyata pada selang kepercayaan 95%
0 0,2 0,4 0,6 0,8 1 1,2 1,4 1,6 1,8 2
W1 W2 W3 W4 W5 W6 W7 W8
Hasil sidik ragam diatas menunjukkan kombinasi BAP dan TDZ tidak
memberikan pengaruh yang nyata hingga 7 MST pada pertumbuhan luas kalus dan
pada 8 MST interaksinya memberikan pengaruh yang nyata. Media tanam dengan
penambahan ZPT TDZ mulai memberikan pengaruh nyata pada 5,6 dan 7 MST
kemudian menjadi sangat nyata perbedaannya pada 8 MST.
Audus
(1963)dalam Hidayat (2009) menyatakan bahwa pengaruh pemberian
suatu konsentrasi zat pengatur tumbuh berbeda-beda untuk setiap jenis tanaman
bahkan berbeda pula antar varietas dalam suatu spesies. Demikian pula halnya
dengan kisaran konsentrasi yang tidak tepat dapat menimbulkan efek yang tidak
diharapkan. Dalam konsentrasi yang berbeda, zat pengatur tumbuh dapat
menghambat pertumbuhan tanaman, bahkan dapat menyebabkan keracunan pada
seluruh tanamana. Leopold (1963) dalam Hidayat (2009) juga menjelaskan bahwa
keefektifan penggunaan zat pengatur tumbuh selain dipengaruhi oleh faktor
lingkungan juga dipengaruhi oleh faktor tanaman itu sendiri.
Tabel 6. Pengaruh perlakuan kombinasi hormon BAP dan TDZ terhadan
pertumbuhan luas kalus
Perlakuan (ppm) Pengamatn ke- (MST)
1 2 3 4 5 6 7 8
Kontrol 0a 0a 0a 0b 0,11bac 0,175bac 0,335b 0,335b BAP 1 0a 0a 0a 0b 0,185a 0,34a 0,596a 0,7555a
BAP 2 0a 0a 0a 0b 0,155ba 0,19bac 0,245cb 0,265b TDZ 0,05 0a 0a 0a 0b 0,06bac 0,08bc 0,12cb 0,165b TDZ 0,1 0a 0a 0a 0b 0,105bac 0,155bac 0,18cb 0,185b TDZ 0,5 0a 0a 0a 0b 0,005c 0,005c 0,01c 0,015b
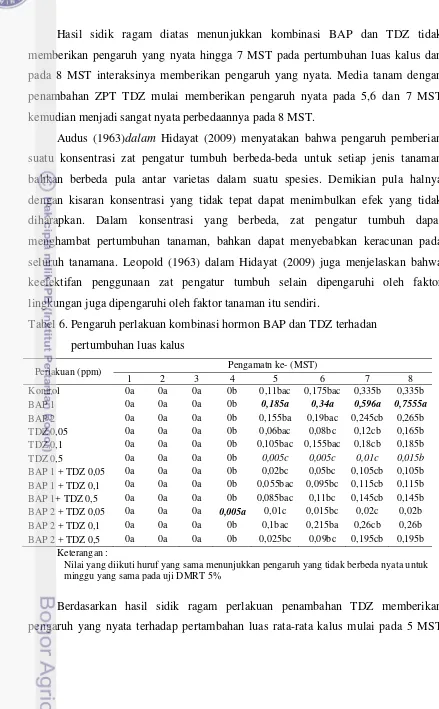
BAP 1 + TDZ 0,05 0a 0a 0a 0b 0,02bc 0,05bc 0,105cb 0,105b BAP 1 + TDZ 0,1 0a 0a 0a 0b 0,055bac 0,095bc 0,115cb 0,115b BAP 1+ TDZ 0,5 0a 0a 0a 0b 0,085bac 0,11bc 0,145cb 0,145b BAP 2 + TDZ 0,05 0a 0a 0a 0,005a 0,01c 0,015bc 0,02c 0,02b BAP 2 + TDZ 0,1 0a 0a 0a 0b 0,1bac 0,215ba 0,26cb 0,26b BAP 2 + TDZ 0,5 0a 0a 0a 0b 0,025bc 0,09bc 0,195cb 0,195b Keterangan :
Nilai yang diikuti huruf yang sama menunjukkan pengaruh yang tidak berbeda nyata untuk minggu yang sama pada uji DMRT 5%
Berdasarkan hasil sidik ragam perlakuan penambahan TDZ memberikan
sehingga dilakukan uji lanjut wilayah Duncan untuk melihat perbedaan antar tarafnya.
Hasil uji lanjut wilayah Duncan pada 5 MST perlakuan kontrol dengan TDZ 0,1 ppm
tidak menunjukkan perbedaan yang nyata sedangkan antar sesama perlakuan TDZ
juga tidak menunjukkan perbedaanyang nyata. 6 MST perlakuan kontrol tidak
menunjukkan perbedaan yang nyata dengan perlakuan TDZ 0,1 ppm. Perlakuan TDZ
0,1 ppm juga tidak berbeda nyata dengan TDZ 0,5 ppm. Perlakuan TDZ 0,05 ppm
tidak berbeda nyata dengan TDZ 0,05 ppm.
Pada 7 dan 8 MST perlakuan kontrol berbeda nyata dari semua perlakuan
penambahan ZPT TDZ dan antar perlakuan TDZ tidak menunjukkan perbedaan yang
nyata. Perlakuan kontrol meninjukkan nilai yang baik dibandingkan semua perlakuan
TDZ di semua MST dengan demikian penambahan TDZ saja pada media tanam
justru menghambat pembentukan kalus pada eksplan daun. Peningkatan konsentrasi
TDZ dari 0,05 ppm ke 0,5 ppm menunjukkan tren negatif hal ini menunjukkan
konsentrasi TDZ yang semaik tinggi justru menghambat terbentuknya kalus pada
eksplan daun.
Hasil uji lanjut wilayah Duncan pada 8 MST menunjukkan bahwa perlakuan
penambahan ZPT dengan konsentrasi BAP 1 ppm merupakan nilai optimum dalam
menghasilkan luas rataan kalus dengan nilai 0,7555 cm
2. Pada perlakuan hormon lain
tidak menunjukkan perbedaan yang nyata dengan kontrol bahkan rata-rata luas yang
dihasilkan lebih kecil dari kontrol yaitu dibawah 0,335 cm
2.Rata-rata luas kalus
terendah dapat dilihat di perlakuan penambahan TDZ tertinggu saja 0,5 ppm dengan
nilai 0,015 cm
2.
Penambahan luas kalus terjadi karena membelahnya sel secara terus menerus
sebagai bentuk pertumbuhan dan perkembangan eksplan yang masih hidup.
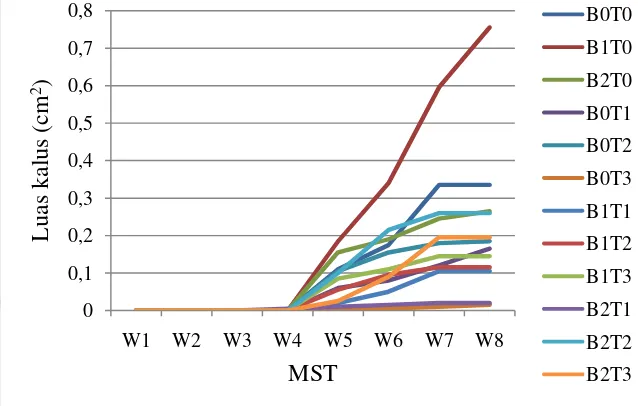
Berdasarkan Gambar.2 terlihat bahwa penambahan luas paling tinggi adalah eksplan
dalam media tanam yang ditambahkan ZPT BAP 1 ppm meskipun BAP 1 ppm
menunjukkan luas tertinggi namun berdasarkan uji Duncan ternyata perlakuannya
Gambar 8 Grafik rata-rata penambahan luas kalus pada eksplan daun A.
malaccensis.
Media tanam tanpa perlakuan memiliki nilai rataan luas kalus hanya lebih
rendah dari media tanam dengan perlakuan BAP 1 ppm tetapi lebih tinggi meski tidak
berpengaruh nyata dengan media tanam dengan perlakuan lainnya. Hal ini terjadi
karena untuk menumbuhkan kalus embriogenesis hanya dibutuhkan media normal
dengan unsur hara makro dan mikro yang lengkap (Monnier, 1990).
[image:30.612.141.460.88.291.2]4.3 Laju Pertumbuhan Eksplan.
Gambar 9Rekapitulasi laju pertambahan skor bengkak eksplan daun tiap taraf 8
MST.
0 5 10 15 20 25 30 35W1 W2 W3 W4 W5 W6 W7 W8
Laju pert am bahan skor l u as bengkak MST B0T0 B1T0 B2T0 B0T1 B0T2 B0T3 B1T1 B1T2 B1T3 B2T1 B2T2 B2T3 0 0,1 0,2 0,3 0,4 0,5 0,6 0,7 0,8
W1 W2 W3 W4 W5 W6 W7 W8
Luas kalus (cm
Laju pertambahan skor luas bengkak secara keseluruhan meningkat drastis
pada 2 MST kemudian turun pada 3 hingga 7 MST dan sedikit meningkat pada 8
MST. Laju pertambahan luas skor tertinggi terjadi pada B1T3 pada 2 MST dengan
nilai 31 skor luas bengkak/minggu. Setelah 2 MST eksplan mengalami penurunan
laju pertambahan skor luas bengkak karena eksplan yang sudah bengkak tahapan
berikutnya adalah mengalami kalus atau sudah mencapai luasan bengkak maksimal.
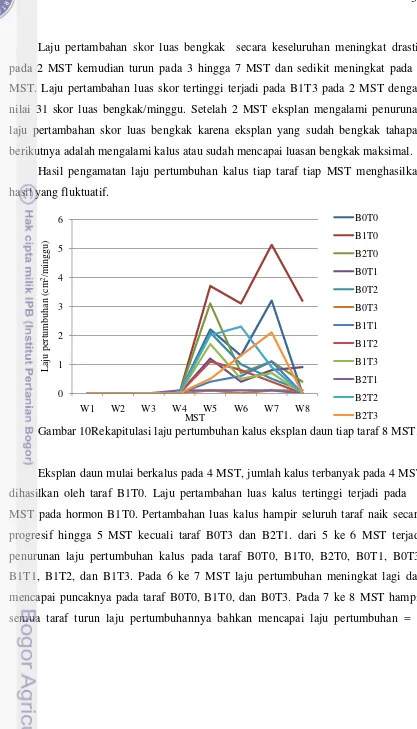
Hasil pengamatan laju pertumbuhan kalus tiap taraf tiap MST menghasilkan
[image:31.612.104.521.45.774.2]hasil yang fluktuatif.
Gambar 10Rekapitulasi laju pertumbuhan kalus eksplan daun tiap taraf 8 MST.
Eksplan daun mulai berkalus pada 4 MST, jumlah kalus terbanyak pada 4 MST
dihasilkan oleh taraf B1T0. Laju pertambahan luas kalus tertinggi terjadi pada 7
MST pada hormon B1T0. Pertambahan luas kalus hampir seluruh taraf naik secara
progresif hingga 5 MST kecuali taraf B0T3 dan B2T1. dari 5 ke 6 MST terjadi
penurunan laju pertumbuhan kalus pada taraf B0T0, B1T0, B2T0, B0T1, B0T3,
B1T1, B1T2, dan B1T3. Pada 6 ke 7 MST laju pertumbuhan meningkat lagi dan
mencapai puncaknya pada taraf B0T0, B1T0, dan B0T3. Pada 7 ke 8 MST hampir
semua taraf turun laju pertumbuhannya bahkan mencapai laju pertumbuhan = 0
01 2 3 4 5 6
W1 W2 W3 W4 W5 W6 W7 W8
Laju pert
um
buhan (cm
2/m
inggu)
MST
cm
2/minggu, hal ini disebabkan habisnya stok makanan pada media tanam sudah
mulai habis.
Laju pertumbuhan yang tinggi dan fluktuatif menyebabkan bahan makanan
lebih cepat habis, hal ini diperlihatkan pada Gambar 10, yaitu taraf-taraf yang
berfluktuatif hebat dan memiliki laju kecepatan tumbuh tinggi pada 8 MST laju
pertumbuhannya mendekati 0 cm
2/minggu. Tetapi pada taraf yang tidak berfluktuatif
hebat dan laju pertumbuhannya rendah cenderung stabil tetap tumbuh pada 8 MST
yaitu taraf B2T1.
Kecenderungan laju pertumbuhan fluktuatif ini menunjukkan aktifitas sel-sel
tiap taraf berbeda dan tidak stabil. Ada fase dimana kecepatan pembelahan sel
menurun diindikasikan terjadinya penurunan laju pertambahan luas pada MST
tertentu. Pemberian perlakuan ataupun tanpa perlakuan (kontrol) gejala ini tetap
terjadi. Meskipun tidak dapat digeneralisasikan tapi kecenderungan fluktuatifnya laju
pertumbuhan menunjukkan masing-masing sel memiliki ritme pembelahan selnya.
4.4 Pengamatan
Visual.
Fenomena proses inisiasi kalus dari eksplan daun menggambarkan proses
induksi yang tidak seragam. Secara umum ada 5 model proses induksi kalus dan arah
perkembangannya.
1. Seluruh permukaan eksplan daun yang kontak dengan media secara bersama
membentuk kalus,
2. Hanya bagian-bagian ujung eksplan yang kontak dengan media secara bersama
membentuk kalus, disusul bagian lainnya secara menyeluruh,
3. Hanya satu bagian ujung eksplan yang kontak dengan media secara bersama
membentuk kalus,
4. Hanya bagian-bagian ujung eksplan yang kontak dengan media secara
bersama-sama membentuk kalus, tetapi tidak berkembang lagi dan
5. Kalus dimulai dari bagian pinggir ujung daun kemudian merambat ke arah
Perbedaan respon tiap eksplan yang berbeda, mungkin disebabkan usia daun,
jenis potongan daun, asal ruas daun yang semaksimal mungkin relatif diseragamkan.
Bagian eksplan yang terinisiasi membentuk kalus, menurut Suryowinoto (1990)
dalam Santoso dan Nursandi (2001) disebabkan karena sel-sel yang kontak dengan
media terdorong menjadi meristematik dan selanjutnya aktif mengadakan
pembelahan seperti jaringan penutup luka. Walaupun antara sel-sel pada satu bagian
eksplan dengan bagian eksplan yang lain berbeda.
Menurut Santoso dan Nursandi (2001) kemampuan bagian tanaman untuk
membentuk kalus tergantung pada umur fisiologi, musim pada waktu bahan tanam,
bagian tanaman yang digunakan, jenis tanaman dan faktor luar.
4.5 Peran
Kultur
in-vitro
dalam Konservasi dan Reklamasi Lahan.
Tiga landasan utama utama konservasi sebagai perlindungan, pengawetan dan
pemanfaatan dalam aplikasinya menemui banyak kendala. Pada skala tumbuhan
ketiga landasan di atas perlu dijalankan seimbang. Teknik konvensional yang sudah
lama dijalankan perlu didukung teknik baru yang mampu mendukung teknik-teknik
yang sudah ada sebelumnya.
Konservasi
plasma
nutfah
biasanya dilakukan secara in vivo dalam bentuk
penyimpanan biji atau tanaman hidup di kebun koleksi, kebun raya, hutan lindung,
taman nasional dan lain sebagainya. Cara ini memerlukan biaya yang cukup besar
untuk pemeliharaan dan perbanyakannya (Gunawan, 1995). Kultur jaringan in vitro
merupakan sarana penelitian untuk mempelajari aspek sains tumbuhan dalam skala
yang luas. Sebagai contoh, teknik ini digunakan mengetahui metabolit primer dan
sekunder, cytodiferensiasi, morfogenesis, fisiologi tumor tanaman dan formasi
tanaman hibrid dari teknik penggabungan protoplast. Selain itu Kultur jaringan
tanaman juga makin banyak digunakan dalam propagasi tanaman komersial. Kultur
kalus memiliki arahan lebih kepada inisiasi dan proliferasi lanjutan sel parenkim
tumbuhan yang belum terdeferensiasi dari sel induk di media agar (Brown, 1990).
Preservasi tanaman umumnya dilakukan dengan cara penyimpanan biji di
menghasilkan biji yang besar dan sangat sulit dalam penyimpanannya, atau biji yang
tidak tahan lama (biji recalcitrant). Dalam kasus demikian, sangat diperlukan
pengembangan sisten in vitro yang dapat diandalkan untuk meregenerasi sel-sel
tanaman tersebut. Sel-sel kompeten (mampu beregenerasi) atau embrio somatik ini
kemudian dapat disimpan pada temperatur rendah atau dibekukan (cryopreservasi).
Teknik pembekuan ini masih terus disempurnakan. Pada saat ini hanya ada sedikit
spesies tanaman yang dapat dibekukan dalam nitrogen cair dan 100% dari kultur yang
beku dapat tumbuh kembali setelah dikembalikan pada temperatur normal (Gunawan,
1995).
Reklamasi lahan merupakan upaya mengembalikan kondisi vegetasi seperti
sebelum dilakukan aktivitas seperti penambangan terbuka. Pra pembukaan lahan
perlu dilakukan upaya penyelamatan top soil yang kaya akan unsur hara dan
benih-benih tumbuhan. Pengadaan bibit dalam nursery telah lama diterapkan untuk
memenuhi kebutuhan bibit dan koleksi tumbuhan lokal dari kawasan yang akan
dibuka. Kekurangan nursery yang merupakan penerapan reproduksi generatif dan
vegetatif tumbuhan adalah tanamannya dapat terserang penyakit, hilangnya pohon
induk dalam kawasan mempersulit penyediaan benih untuk disemai, membutuhkan
lokasi yang luas dan biaya operasional yang cukup mahal.Penggunaan teknik kultur
in vitro dapat membantu menutupi kekurangan penggunaan teknik budidaya
konvensional.
4.6 Potensi Daun sebagai Sumber Eksplan.
Daun sebagai bagian terbanyak dari suatu tumbuhan selama ini belum
termanfaatkan secara baik dalam perbanyakan tumbuhan secara konvensional. Hanya
pada daun-daun yang sudah memiliki kemampuan perkembangbiakan vegetatif saja
yang dapat tumbuh normal di alam yang ada pada jenis-jenis tertentu saja.
Menumbuhkan dan mengembangkan kalus memiliki banyak manfaat. Pada
dasarnya dengan menumbuhkan kalus, maka akan mendapatkan beberapa keuntungan
5.1 Kesimpulan
Hasil menunjukkan bahwa 81% eksplan berhasil hidup dan tumbuh hingga
8 MST sedangkan sisanya mati dengan penyebab kontaminasi cendawan, eksplan
memutih, eksplan mencoklat/menghitam. Hasil sidik ragam menunjukkan
interaksi antara ZPT BAP dengan TDZ pada pembentukan skor luas bengkak
memberikan pengaruh yang nyata pada minggu 2, 3, 4 MST. Kombinasi ZPT
optimum untuk menghasilkan skor luas bengkak adalah BAP 1 ppm + TDZ 0,5
ppm pada 2 MST. Hasil sidik ragam menunjukkan interaksi antara ZPT BAP
dengan TDZ pada pembentukan kalus memberikan pengaruh nyata pada 8 MST
Kombinasi ZPT optimum untuk menghasilkan luas kalus adalah BAP 1 ppm pada
7 MST.
5.2 Saran
Perlu dilakukan penelitian lanjutan pada konsentrasi ZPT BAP di bawah 1
ppm. Perlu dilakukan upaya subkultur pada 5 MST untuk memperbanyak dan
PENGHASIL GAHARU (Aquilaria malaccensis Lamk.)
ARYA WINDUJATI
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
Afifi. 1995. Proses Pengolahan Pohon Gaharu sampai Siap Diperdagangkan dan Tata Cara Pembudidayaannya, serta Proses Gaharu Pembentukan Gubal. Lokakarya Pengusahaan Hasil Hutan Non Kayu (Rotan, Gaharu dan Tanaman Obat). Departemen Kehutanan. Indonesia-UK Tropical Forest Management Programme.
Anonim. 2001. CITES Identification Manual: Vol 1 flora. CITES Secretariat. Geneva. Switzerland.
Azwin. 2007. Evaluasi Stabilitas Genetik Tanaman Gaharu (Aquilaria malaccensis Lamk.) Hasil Kultur In Vitro[Tesis]. Sekolah Pascasarjana Institut Pertanian Bogor.
BardenA, Anak NA, Mulliken T, Song M. 2000. Heart of The Matter: Agarwood use and trade and CITES implementation for Aquilaria malaccensis. TRAFFIC International.
Beniwal BS. 1989. Silvical characteristics of Aquilaria agallocha Roxb. Indian Forester 115: 17-21.
Brown JT. 1990. The Initiation and Maintenance of Callus Cultures. Methods in Molecular Biology, vol. 6, Plant Cell and Tissue Culture. Jeffrey W Pollard dan John M Walker (editor).The Humana Press. New Jersey.
Bonga JM, Durjan DJ. 1982. Tissue Culture in Forestry. Martines Nyhoff Publishers. Boston.
Budiatmoko SD. 1998. Sekilas tentang Perbanyakan Tanaman dengan Teknik Kultur Jaringan. Duta Rimba/April/214/XXIII/1998 Hal 2-6. Perum Perhutani. Jakarta.
CITES. 2004. Significant trade in plants. Implementation of Resolution Conf. 12.8. Progress with implementation of species review (PC 14 Doc. 9.2.2).
Ding Hou. 1960. Thymeleaeceae. SteenisCGGJ van. (editor).Floral Malesiana(6): 1-15. Wolter Noordhof Publishing. Groningen.
Fakhrai HK, Fakhrai F. 1990. Hormon Control of Growth and Development. Methods in Molecular BiologyPlant Cell and Tissue Culture. Jeffrey W Pollard, John M Walker (editor).The Humana Press.New Jersey.
Gamborg OL. 1982. Kalus dan Kultur Sel.Metode Kultur Jaringan Edisi 2. Wetter LR dan F Constabel (editor). Institut Teknologi Bandung. Bandung.
Gunawan. 1987. Teknik Kultur Jaringan. Laboratorium Kultur Jaringan Tanaman. Pusat Antar Universitas Bioteknologi. Institut Pertanian Bogor. Bogor.
Gunawan LW. 1995. Teknik Kultur In Vitro dalam Hortikultura. PT Penebar Swadaya. Jakarta.
Hartini. 1996. Pengaruh Konsentrasi BAP, Ethepon dan KNO pada Rambutan (Nephelium lappaceum, L). var Binjai yang telah Diberi Paclobutrazol. Skripsi. Jurusan Budidaya Pertanian. Fakultas Pertanian Institut Pertanian Bogor. Tidak diterbitkan.
Hendaryono DPS dan Wijayani A. 1994. Teknik Kultur Jaringan. Kanisius. Yogyakarta.
Hidayat O. 2009. Kajian Penggunaan Hormon IBA, BAP dan Kinetin terhadap Multiplikasi Tunas Tanaman Penghasil Gaharu (Gyrinops versteegii (Gilg) Doomke) secara In Vitro [Skripsi]. Departemen Konservasi Sumberdaya Hutan dan Ekowisata Fakultas Kehutanan Institut Pertanian Bogor.
Hilton-Taylor C.2002. 2002 IUCN Redlist of Threatned Species. IUCN, Gland, Switzerland and Cambridge. United Kingdom.
KellerP, Sidiyasa K. 1994. Tress of Balikpapan-Samarinda Area. East Kalimantan.Samarinda.
Kusmianto J. 2008. Pengaruh Thidiazuron Tunggal dan Kombinasi Thidiazuron dan Benzilaminopurin Terhadap Pembentukan Tunas dari Potongan Daun Dendrobium antennatum Lindl. secara In Vitro. [Skripsi]. Departemen Biologi Fakultas Matematika dan Ilmu Pengetahuan Alam Universitas Indonesia.
Mattjik AA dan Sumertawijaya M. 2002. Perancangan Percobaan dengan Aplikasi SAS dan Minitab Jilid I. IPB Press. Bogor.
Monnier M. 1990. Induction of Embryogenesis in Callus Culture. Methods in Molecular BiologyPlant Cell and Tissue Culture. Jeffrey W Pollard dan John M Walker (editor). The Humana Press. New Jersey.
Nugroho A, Sugito H. 2002. Pedoman Pelaksanaan Teknik Kultur Jaringan. PT Penebar Swadaya. Jakarta.
NgFSP. 1992. Manual Forest Fruits, Seeds, and Seedlings. Malayan Forest No. 34 (2): 528-530. Forest Research Institute Malaysia.
Sandra E dan Karyaningsih I.2000. Panduan Teknis Pelatihan Kultur Jaringan. Unit Kultur Jaringan Laboratorium Konservasi Tumbuhan Jurusan Konservasi Sumberdaya Hutan Fakultas Kehutanan Institut Pertanian Bogor. Bogor.
Santoso U dan Nursandi F. 2001. Kultur Jaringan Tanaman. Penerbitan Universitas Muhammadiyah Malang. Malang.
Stepan-Sarkissian G.1990. Selection of Media for Tissue and Cell Culture. Methods in Molecular BiologyPlant Cell and Tissue Culture. Jeffrey W Pollard, John M Walker (editor).The Humana Press. New Jersey.
Sumarna Y. 2002. Budi Daya Gaharu. Penebar Swadaya. Bogor.
Wattimena GA. 1988. Zat Pengatur Tumbuh Tanaman. Pusat Antar Universitas. Institut Pertanian Bogor. Bogor.
Wettherel DF. 1982. Pengantar Propagasi Tanaman secara In Vitro. Terjemahan Koensoemardiyah. Fakultas Farmasi Universitas Gajah Mada. Yogyakarta.
PENGHASIL GAHARU (Aquilaria malaccensis Lamk.)
ARYA WINDUJATI
DEPARTEMEN
KONSERVASI SUMBERDAYA HUTAN DAN EKOWISATA
FAKULTAS KEHUTANAN
dalam Kultur Jaringan Daun Tanaman Penghasil Gaharu (Aquilaria malaccensis Lamk.).Dibawah BimbinganEDHI SANDRA dan SISWOYO.
Gaharu merupakan produk hasil hutan bukan kayu yang berasal dari tumbuhan famili Thymeliaceae. Gubal gaharu terbentuk dari keluarnya resin sebagai bentuk pertahanan terhadap infeksi mikroorganisme patogen. Resin terdeposit dalam jaringan kayu kemudian berubah warna coklat hingga hitam dan mengeras seiring dengan bertambahnya umur pohon. Wangi gubal gaharu menyebabkan spesies ini diburu untuk memenuhi permintaan pasar yang terus meningkat. Keberadaan populasi di alam semakin berkurang karena sistem pengambilan konvensional dan tidak terkendali. Usaha revegetasi menemui kendala langkanya ketersediaan benih di alam. Kultur jaringan sebagai teknik budidaya aseptik yang dapat memproduksi bibit dalam waktu singkat, dalam jumlah banyak dan steril dapat menjadi solusi permasalahan ini. Penggunaan daun tang kemudian menjadi kalus dalam kultur jaringan tanaman penghasil gaharu jarang dilakukan karena proses hingga dapat diaklimatisasi masih panjang. Pemanfaatan kalus dalam kultur jaringan adalah untuk menghasilkan senyawa metabolit sekunder, pelestarian plasma nutfah dan bahan dasar untuk penggunaan kultur lanjutan.
Penelitian ini bertujuan