ABSTRAK
NINGSIH AMELIA. Toleransi dan respon fisiologi Celosia cristata, Gomphrena globusa, dan Catharanthus roseus terhadap bahan pencemar udara. Dibimbing oleh SULISTIJORINI dan TRIADIATI.
Pencemaran udara merupakan masalah lingkungan yang terjadi akibat perubahan komposisi udara dari keadaan normalnya. Tanaman dapat digunakan sebagai bioindikator tingkat pencemaran udara melalui respon pertumbuhannya. Informasi kemampuan tanaman hias dalam menyerap bahan pencemar udara masih terbatas. Tujuan penelitian ini adalah mengetahui toleransi dan respon fisiologi tanaman Celosiacristata, Gomphrena globusa, dan Catharanthus roseus terhadap bahan pencemar udara. Tanaman di tempatkan di Babakan Sawah Baru, University Farm IPB ( dengan konsentrasi bahan pencemar lebih tinggi ) dan rumah kaca Kampus IPB, Darmaga (dengan konsentrasi bahan pencemar lebih rendah). Parameter pertumbuhan dan fisiologi yang diamati meliputi tinggi tanaman, jumlah daun, luas daun total, jumlah daun gugur, bobot basah dan kering tanaman, kandungan klorofil total, asam askorbat (ASA), dan aktivitas askorbat peroksidase (APX). Data dianalisis menggunakan analisis sidik ragam dan uji Duncan Multiple Range Test (DMRT). Lokasi dengan kondisi bahan pencemar lebih tinggi menyebabkan pertambahan tinggi, jumlah, luas daun total menurun, Terhambatnya pertumbuhan tanaman ditunjukkan dengan meningkatnya jumlah daun gugur dan menurunnya bobot basah dan kering tanaman. Pada Cataranthus roseus, respon fisiologi akibat cekaman bahan pencemar udara ditunjukkan dengan meningkatnya kandungan klorofil total dan meningkatnya aktivitas APX.
Kata kunci: Pencemaran udara, Celosia cristata, Gomphrena globosa, Catharanthus roseus, toleransi, respon fisiologi.
ABSTRACT
NINGSIH AMELIA. Tolerance and physiological responses of Celosia cristata, Gomphrena globusa, and Catharanthus roseus due to air pollutant. Supervised by SULISTIJORINI and TRIADIATI.
Air pollution is an environmental issue that occurs due to change in air composition of its normal state. Plants have been known as bio indicator for air pollution through the growth response. Information capability of herbs plant to absorb pollutant is very limited. The objectives of this research were to determine the tolerance and physiological responses of Celosia cristata, Gomphrena globusa, and Catharanthus roseus due to air pollutant. On the other site, data were also collecyed at green house of IPB Dramaga, which has a relatively low of pollutants. Growth and physiological parameters were recorded include plant height, number of leaf, total leaf area, number of leaf senescence, fresh and dry weight of plant, chlorophyll content, ascorbic acid content (ASA), and the activity of ascorbate peroxidase (APX). Data were analyzed by analysis of variance and Duncan Multiple Range Test (DMRT). This study revealed that plants on location with relatively high of pollutant have plant height, number of leaf, total leaf area, fresh and dry weight lower than those of plants on relatively low of pollutant whereas, total leaf senesence increased. Cataranthus rosesus showed decreasing of chlorophyll content and increasing of APX activity as physiological response due to air pollutant.
1
PENDAHULUAN
Pencemaran udara merupakan perubahan komposisi udara dari keadaan normalnya yang disebabkan adanya bahan-bahan asing di udara diantaranya NOx, SOx, COx, dan partikel dalam jumlah tertentu serta waktu yang cukup lama akan mengganggu kehidupan makhluk hidup (Wardhana 2004). Sumber pencemaran berasal dari kegiatan yang bersifat alami, seperti letusan gunung berapi, kebakaran hutan. Selain itu, dapat berasal dari kegiatan manusia (antropogenik) antara lain kegiatan industri, aktivitas transportasi, dan pertanian. Pencemaran udara di Indonesia, terutama di kota-kota besar disebabkan gas buang kendaraan bermotor (60-70%), industri (10-15%), dan sisanya berasal dari rumah tangga, pembakaran sampah, kebakaran hutan/ladang, dan lain-lain (Kusnoputranto 1996).
Salah satu usaha yang dapat dilakukan untuk mengatasi masalah pencemaran udara adalah penghijauan. Tanaman dapat menyediakan oksigen yang diperlukan oleh manusia, mengurangi dan menurunkan tingkat pencemaran udara dengan cara menyerap polutan (Carpenter et al. 1975). Tingkat pencemaran udara dapat diketahui dengan menggunakan tanaman sebagai bioindikator yang dapat dilihat melalui respon petumbuhannya.
Tanaman dapat menjadi penyerap bahan pencemar udara terutama melalui daun. Daun tersusun oleh sel-sel, antara lain sel-sel epidermis pada permukaan atas dan bawah daun. Pada permukaan bawah daun terdapat banyak stomata dan sebagian besar pertukaran gas di dalam daun terjadi melalui stomata (Gardner et al. 1991). Kemampuan tanaman dalam menyerap gas dari udara terutama dapat diketahui dari proses fotosintesis, respirasi, dan transpirasi (Kozlowski 1991). Tingkat pencemaran udara juga dapat diketahui dengan menggunakan bioindikator. Salah satu bioindikator yang digunakan adalah tanaman. Tanaman akan menunjukkan penurunan kadar klorofil pada kondisi udara yang tercemar (Adiputro et al. 1995) serta terlihat adanya kerusakan pada jaringan daun (Udayana 2004). Selain itu total luas daun tanaman akan berkurang karena terhambatnya laju pembentukan dan perluasan daun serta meningkatnya jumlah daun yang gugur (Kozlowski et al.1991).
Tingkat toleransi tanaman terhadap pencemar udara dapat ditentukan dengan pendekatan analisis mikroskopis daun yaitu
kerusakan jaringan dan makroskopis meliputi diameter batang, tinggi tanaman, jumlah daun, gejala klorosis dan nekrosis (Fakuara et al. 1991). Tanaman memiliki mekanisme pertahanan terhadap peningkatan senyawa-senyawa oksidatif yang terbentuk akibat polusi udara. Pembentukan senyawa antioksidan, seperti asam askorbat (ASA), α -tokoferol dan glutation merupakan salah satu sistem pertahanan tanaman tersebut. Selain itu terjadi peningkatan aktivitas enzim antioksidan, seperti askorbat peroksidase (APX), superoksida dismutase (SOD) (Prohazkova et al. 2001), glutation reduktase (GR) (Keles & Oncel 2002). Peningkatan enzim antioksidan tersebut terjadi jika senyawa-senyawa oksidatif terbentuk.
Tanaman yang sudah diteliti memiliki daya serap terhadap bahan pencemar partikel antara lain Mahoni, Angsana, dan Bougenvillea (Siringoringo 2000). Data mengenai kemampuan tanaman herba dalam menyerap bahan pencemar belum banyak ditemukan. Pada penelitian ini digunakan tanaman Celosia cristata, Gomphrena globosa, dan Catharanthus roseus. Celosia cristata (Amaranthaceae, jengger ayam), memiliki daun tunggal dan tersebar, batang berdiameter sedang dan bercabang serta bunga berbentuk bulir menyerupai jengger ayam. Gomphrena globosa (Amaranthaceae, bunga knop), memiliki daun tunggal, berambut kasar di permukaan atas, batang berambut, serta bunga berbentuk bonggol berwarna ungu. (Dalimartha 2005). Tanaman Catharanthus roseus (Apocynaceae, tapak dara) memiliki batang yang berbentuk bulat dengan diameter kecil, bercabang serta berambut. Daunnya berbentuk bulat telur, berdaun tunggal, bunganya menyerupai terompet serta memiliki rumah biji yang berbentuk silindris menggantung pada batang. Ketiga tanaman tersebut merupakan tanaman hias, pertumbuhan cepat, dipelihara dengan mudah dan memiliki nilai estetika yaitu warna dan bentuk yang menarik untuk dijadikan sebagai tanaman di tepi jalan.
Tujuan
Penelitian ini bertujuan untuk mengetahui toleransi dan respon fisiologi tanaman C. cristata, G. globosa dan C. roseus terhadap zat pencemar udara.
BAHAN DAN METODE Waktu dan Tempat
2
Babakan blok E University Farm, rumah kaca Departemen Biologi IPB dan Laboratorium Fisiologi Tumbuhan Departemen Biologi, Fakultas MIPA, Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan yaitu spektrofotometer, timbangan, oven, meteran dan statif. Benih C.cristata, G. globosa, dan C. roseus diperoleh dari BIOTROP. Media tanam yang digunakan adalah tanah dan kompos 3:1 (b/b). Bahan untuk analisis klorofil yaitu aseton 80%. Bahan untuk analisis asam askorbat (ASA) meliputi asam metafosforik 5% dan DCIP 0,8 g/l. Bahan untuk analisis askorbat peroksidase (APX) meliputi 50 mM buffer fosfat pH 7, asam askorbat 0,5 mM, EDTA 0,1 mM dan H2O2 0,1 mM.
Rancangan Penelitian
Rancangan percobaan yang digunakan adalah rancangan acak lengkap faktorial yang terdiri atas 2 faktor dengan 10 ulangan untuk laju pertumbuhan dan 3 ulangan untuk parameter fisiologi. Faktor pertama adalah 2 lokasi yang berbeda yaitu University Farm Babakan Sawah Baru Bogor (lapangan) dan rumah kaca Departemen Biologi. Faktor kedua adalah 3 tanaman yaitu C. cristata, G. tuberosa, dan C. roseus.
Metode
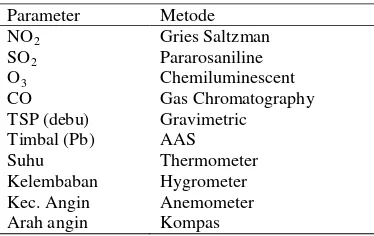
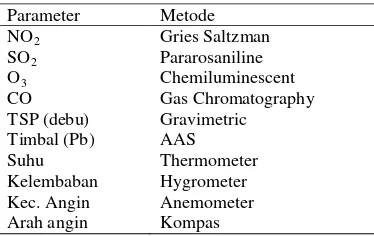
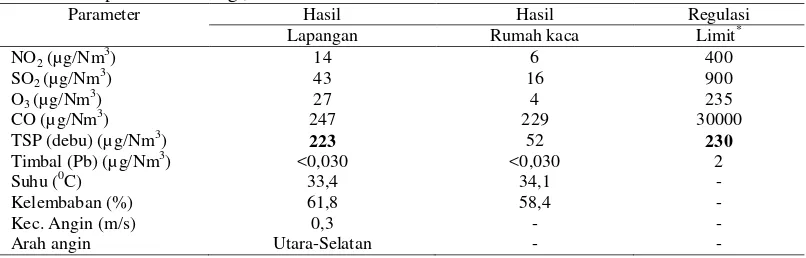
Analisis Udara, Tanah dan Kompos Analisis kualitas udara dilakukan di depan kantor bulog Dramaga, Bogor (lapangan) dan rumah kaca Departemen Biologi FMIPA IPB. Parameter yang diukur meliputi Pb (Timbal), CO, NO2, SO2, Ozon (O3), TSP (partikel), suhu, kelembaban, dan kecepatan angin (Tabel 1). Analisis tanah dan kompos dilakukan di Departemen Manajemen Sumberdaya Lahan IPB. Analisis tanah meliputi kandungan N, P, K, KTK, rasio C/N, pH, dan tekstur, sedangkan kompos meliputi C, N, P, K, Ca, Mg, Fe, Cu, Zn, dan Mn. Tabel 1 Parameter dan metode untuk analisis
kualitas udara. Parameter Metode
NO2 Gries Saltzman
SO2 Pararosaniline
O3 Chemiluminescent
CO Gas Chromatography
TSP (debu) Gravimetric Timbal (Pb) AAS
Suhu Thermometer
Kelembaban Hygrometer Kec. Angin Anemometer Arah angin Kompas
Persiapan Media Tanam, Pembibitan, dan Pemeliharaan
Persiapan media tanam dilakukan dengan menjemur tanah lalu diayak dengan saringan 0,5 mm. Benih tanaman ditempatkan pada bak yang berisi tanah dan kompos 3:1 (b/b). Bibit yang telah berumur 8-25 hari dipindahkan ke polibag kecil berukuran 10 cm x15 cm untuk proses adaptasi (± 1 minggu). Tanaman dipindahkan ke polibag 2 kg yang telah berisi tanah dan kompos 3:1 (b/b) selanjutnya ditempatkan pada lokasi penelitian. Pemeliharaan meliputi penyiraman setiap hari, diusahakan kondisi tanah tidak terlalu lembab dan kering.
Pengamatan
Pengamatan pertumbuhan tanaman meliputi tinggi tanaman, jumlah daun, umur fisiologi daun, dan luas daun. Pengamatan tinggi tanaman dan jumlah daun dilakukan setiap 5 hari. Luas daun diukur setiap 10 hari dan ketika akhir percobaan (3 BST) diukur seluruh daun tiap tanaman. Umur fisiologi daun didapatkan dengan cara menandai daun mulai pucuk hingga gugur alami. Seluruh tanaman dipanen dan dihitung bobot basah serta bobot keringnya pada akhir percobaan. Pengukuran bobot kering tanaman dengan mengeringkan tajuk, daun, dan akar di oven pada suhu 800C selama 36 jam.
Pengukuran Luas Daun
Pengukuran luas daun dilakukan berdasarkan metode gravimetri. Luas daun dapat diketahui dengan cara mencetak daun (3-5 daun) yang mewakili semua ukuran daun dalam satu polibag. Replika daun kemudian digunting dari kertas yang bobot dan luasnya sudah diketahui. Luas daun kemudian ditaksir berdasarkan perbandingan bobot replika daun dengan bobot total kertas. Pengukuran luas daun (LD) berdasarkan rumus:
LD = LK x BKR BK Keterangan:
LD = luas daun (cm2)
LK = luas seluruh kertas (cm2) BKR = bobot kertas replika daun (g) BK = bobot seluruh kertas (g)
Analisis Klorofil (Arnon 1959)
3
sampai volume 50 ml, kemudian diambil 2,5 ml larutan dan diencerkan menjadi 25 ml.
Absorban diukur dengan
spektrofotometer pada panjang gelombang 645 nm. Perhitungan klorofil total berdasarkan rumus:
Klo tot = D645 x fp 34,5 Keterangan:
Klo tot = klorofil total (mg/g bobot segar) D645 = absorban pada 645 nm
fp = faktor pengenceran
Analisis Asam Askorbat (ASA) Reiss (1993) Analisis ASA dilakukan pada daun lebar penuh. Kandungan ASA diukur dengan menggunakan metode titrasi. Sampel daun (0,5 g) digerus dengan asam metafosforik 5% kemudian difiltrasi dengan menggunakan kertas saring Whatman No.1.
Filtrat dititrasi dengan dichlorophenol-indophenol (DCIP) 0,8g/l. Larutan DCIP yang digunakan untuk titrasi distandarisasi dengan larutan ASA murni (4 mg/l) dan 9 ml asam metafosforik 5%. Titrasi dihentikan ketika terjadi perubahan warna menjadi merah muda. Kandungan ASA dihitung berdasarkan rumus: 1. Standarisasi larutan ASA (4 mg ASA murni
equivalen dengan 1 ml DCIP): ASA (mg) = 4 mg ASA murni 1 ml DCIP DCIP yang dititrasi. 2. Kandungan ASA pada daun (ASA/100 g
jaringan daun):
mg ASA per aliquot x Total volume ekstrak (ml)
Volume aliquot x 100
bobot segar
Analisis Askorbat peroksidase (APX) (Nakano dan Asada 1981)
Analisis APX dilakukan pada daun lebar penuh. Ekstrak enzim dicampur dengan larutan yang mengandung 50 mM buffer fosfat pH 7, asam askorbat 0,5 mM, EDTA 0,1 mM dan H2O2 0,1 mM. Larutan tanpa sampel dan H2O2 0,1 mM digunakan sebagai blanko.
Pengukuran aktivitas APX dilakukan dengan spektrofotometer setiap 10 detik selama 1 menit pada panjang gelombang 290 nm. Perhitungan APX berdasarkan rumus:
X = ∑ ( ∆ Absorban / menit) x Volume total
ε Volume sampel Aktivitas APX = X
Bobot segar
Analisis Data
Data tinggi tanaman jumlah daun, dan luas daun dihitung sebagai laju pertambahan relatif dengan menggunakan rumus (Pearcy et al. 1996):
PTR = ln(i) – ln(a) t(i)-t(a) keterangan:
PTR = pertambahan tinggi relatif (cm/hari) ln(i) = pengamatan tinggi akhir (cm) ln(a) = pengamatan tinggi awal (cm) t(i) = waktu akhir pengamatan (hari) t(a) = waktu awal pengamatan (hari)
LD = LD(1)+LD (2)+...+LD(n)
n
LD = LD – JDT
n
PLD = ln LD(max)- ln LD(awal) t
Keterangan:
PLD = pertambahan luas daun (cm2/hari) LD = luas daun (cm2/hari)
LD = luas daun rata-rata (cm2) JDT = jumlah daun total (helai) n = jumlah cetakan daun t = waktu pengamatan (hari)
Data dianalisis dengan menggunakan analisis ragam dan jika terdapat beda nyata maka dilanjutkan dengan uji Duncan Multiple Range Test (DMRT).
HASIL
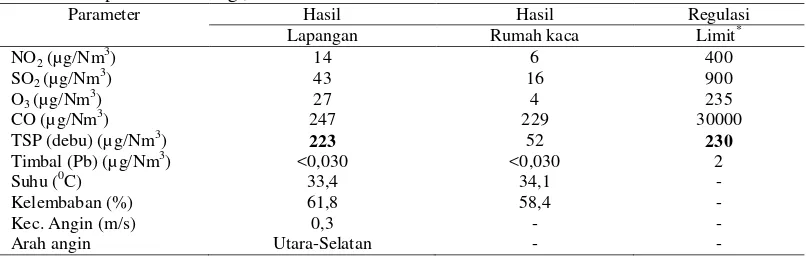
Analisis Udara, Tanah, dan Kompos Hasil analisis kualitas udara menunjukkan bahwa TSP (partikel) di lapangan lebih tinggi yaitu 223 µg/Nm3dibandingkan di rumah kaca yaitu 52 µg/Nm3 tetapi lebih rendah dari ambang batas 230 µg/Nm3. Hasil analisis parameter NO2, SO2, O3, CO, dan Pb masih tergolong rendah pada dua lokasi karena tidak melewati batas ambang (Tabel 2).
Hasil analisis tanah (Lampiran 1) menunjukkan bahwa komponen dari sampel tanah Sawah Baru didominasi oleh liat yaitu 46%. Berdasarkan derajat keasaman, tanah tergolong sebagai asam. Kandungan Nitrogen tanah adalah 0,15% tergolong rendah dibandingkan kompos yaitu 1,27% (Lampiran 2).
Respon Umum Pertumbuhan
3
sampai volume 50 ml, kemudian diambil 2,5 ml larutan dan diencerkan menjadi 25 ml.
Absorban diukur dengan
spektrofotometer pada panjang gelombang 645 nm. Perhitungan klorofil total berdasarkan rumus:
Klo tot = D645 x fp 34,5 Keterangan:
Klo tot = klorofil total (mg/g bobot segar) D645 = absorban pada 645 nm
fp = faktor pengenceran
Analisis Asam Askorbat (ASA) Reiss (1993) Analisis ASA dilakukan pada daun lebar penuh. Kandungan ASA diukur dengan menggunakan metode titrasi. Sampel daun (0,5 g) digerus dengan asam metafosforik 5% kemudian difiltrasi dengan menggunakan kertas saring Whatman No.1.
Filtrat dititrasi dengan dichlorophenol-indophenol (DCIP) 0,8g/l. Larutan DCIP yang digunakan untuk titrasi distandarisasi dengan larutan ASA murni (4 mg/l) dan 9 ml asam metafosforik 5%. Titrasi dihentikan ketika terjadi perubahan warna menjadi merah muda. Kandungan ASA dihitung berdasarkan rumus: 1. Standarisasi larutan ASA (4 mg ASA murni
equivalen dengan 1 ml DCIP): ASA (mg) = 4 mg ASA murni 1 ml DCIP DCIP yang dititrasi. 2. Kandungan ASA pada daun (ASA/100 g
jaringan daun):
mg ASA per aliquot x Total volume ekstrak (ml)
Volume aliquot x 100
bobot segar
Analisis Askorbat peroksidase (APX) (Nakano dan Asada 1981)
Analisis APX dilakukan pada daun lebar penuh. Ekstrak enzim dicampur dengan larutan yang mengandung 50 mM buffer fosfat pH 7, asam askorbat 0,5 mM, EDTA 0,1 mM dan H2O2 0,1 mM. Larutan tanpa sampel dan H2O2 0,1 mM digunakan sebagai blanko.
Pengukuran aktivitas APX dilakukan dengan spektrofotometer setiap 10 detik selama 1 menit pada panjang gelombang 290 nm. Perhitungan APX berdasarkan rumus:
X = ∑ ( ∆ Absorban / menit) x Volume total
ε Volume sampel Aktivitas APX = X
Bobot segar
Analisis Data
Data tinggi tanaman jumlah daun, dan luas daun dihitung sebagai laju pertambahan relatif dengan menggunakan rumus (Pearcy et al. 1996):
PTR = ln(i) – ln(a) t(i)-t(a) keterangan:
PTR = pertambahan tinggi relatif (cm/hari) ln(i) = pengamatan tinggi akhir (cm) ln(a) = pengamatan tinggi awal (cm) t(i) = waktu akhir pengamatan (hari) t(a) = waktu awal pengamatan (hari)
LD = LD(1)+LD (2)+...+LD(n)
n
LD = LD – JDT
n
PLD = ln LD(max)- ln LD(awal) t
Keterangan:
PLD = pertambahan luas daun (cm2/hari) LD = luas daun (cm2/hari)
LD = luas daun rata-rata (cm2) JDT = jumlah daun total (helai) n = jumlah cetakan daun t = waktu pengamatan (hari)
Data dianalisis dengan menggunakan analisis ragam dan jika terdapat beda nyata maka dilanjutkan dengan uji Duncan Multiple Range Test (DMRT).
HASIL
Analisis Udara, Tanah, dan Kompos Hasil analisis kualitas udara menunjukkan bahwa TSP (partikel) di lapangan lebih tinggi yaitu 223 µg/Nm3dibandingkan di rumah kaca yaitu 52 µg/Nm3 tetapi lebih rendah dari ambang batas 230 µg/Nm3. Hasil analisis parameter NO2, SO2, O3, CO, dan Pb masih tergolong rendah pada dua lokasi karena tidak melewati batas ambang (Tabel 2).
Hasil analisis tanah (Lampiran 1) menunjukkan bahwa komponen dari sampel tanah Sawah Baru didominasi oleh liat yaitu 46%. Berdasarkan derajat keasaman, tanah tergolong sebagai asam. Kandungan Nitrogen tanah adalah 0,15% tergolong rendah dibandingkan kompos yaitu 1,27% (Lampiran 2).
Respon Umum Pertumbuhan
4
adanya interaksi antara lokasi dan jenis tanaman (P<0,05). Hal ini ditunjukkan pada nilai parameter tanaman di lapangan lebih rendah dibandingkan di rumah kaca. Pertambahan tinggi relatif, pertambahan jumlah daun relatif dan pertambahan luas daun relatif terbesar pada jenis C. roseus di rumah kaca (Tabel 3). Luas daun total terbesar pada G. globosa di rumah kaca yaitu 1973,4 cm2.
Hasil pengamatan menunjukkan bahwa jumlah gugur daun terbesar pada jenis C. cristata di lapangan (Tabel 3). Tanaman C. roseus di kedua lokasi merupakan tanaman yang memiliki laju pertambahan tinggi dan jumlah daun yang masih terlihat baik hingga akhir pengamatan (90 hari) dibandingkan kedua jenis lainnya (Gambar 1 dan 2).
Tabel 2 Kualitas udara di depan kantor bulog (lapangan), Dramaga Bogor dan rumah kaca Departemen Biologi, IPB.
Parameter Hasil Hasil Regulasi
Lapangan Rumah kaca Limit*
NO2 (µg/Nm3) 14 6 400
SO2 (µg/Nm 3
) 43 16 900
O3 (µg/Nm3) 27 4 235
CO (µg/Nm3) 247 229 30000
TSP (debu) (µ g/Nm3) 223 52 230
Timbal (Pb) (µg/Nm3) <0,030 <0,030 2
Suhu (0C) 33,4 34,1 -
Kelembaban (%) 61,8 58,4 -
Kec. Angin (m/s) 0,3 - -
Arah angin Utara-Selatan - -
*Nilai ambang batas kualitas udara ambien, PP. No.41/1999
Tabel 3 Respon pertumbuhan tanaman di lokasi berbeda. Lokasi Jenis
tanaman Pertambahan tinggi relatif (cm/hari) Pertambahan jumlah daun relatif (helai/hari) Pertambahan luas daun relatif (cm2/hari)
Luas daun total (cm2)
Jumlah gugur daun (helai daun) (14 MST) Lapangan C. cristata 0,019±0,012d 0,002±0,018f 0,043±0,030c 232,21±73,91c 40
G. globosa 0,010±0,007f 0,026±0,007d 0,059±0,016c 712,23±243,41b 22
C. roseus 0,028±0,007b 0,038±0,010b 0,032±0,072d 796,71±171,25b 30
Rumah kaca
C. cristata 0,025±0,007c 0,009±0,015e 0,148±0,013b 741,52±372,34b 33
G. globosa 0,013±0,014e 0,035±0,010c 0,041±0,013c 1973,44±394,34a 16
C. roseus 0,033±0,007a 0,041±0,019a 0,186±0,008a 1838,32±410,84a 13
Ket: Data ± SD yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf uji 5% (DMRT).
Gambar 1 Laju pertambahan tinggi C.
cristata, G. globosa, dan C. roseus di lapangan (L) dan rumah kaca (RK).
Gambar 2 Laju pertambahan jumlah daun C. cristata, G. globosa, dan C. roseus di lapangan (L) dan rumah kaca (RK). 0 0.05 0.1 0.15 0.2 0.25 0.3 0.35 0.4
15 30 45 60 75 90
L aj u per tam bah an tin ggi (c m ) Hari ke-C. crista ta L G. globo sa L -0.3 -0.2 -0.1 0 0.1 0.2 0.3 0.4 0.5 0.6
15 30 45 60 75 90
5
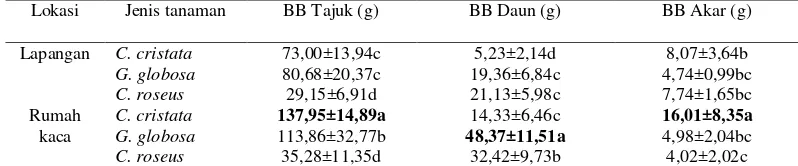
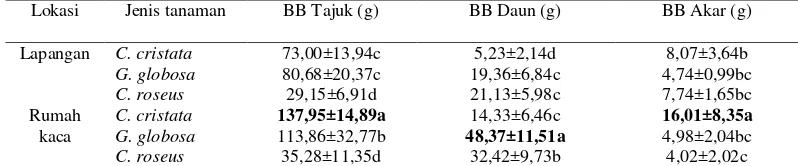
Bobot Basah tajuk, Daun, dan Akar Bobot basah tajuk dan daun dipengaruhi oleh lokasi (P< 0,05), sedangkan bobot basah akar tidak dipengaruhi. Bobot basah tajuk, daun dan akar dipengaruhi oleh jenis tanaman (P<0,05)dan terdapat interaksi antara lokasi dan jenis tanaman. Bobot basah tajuk, daun, dan akar tanaman di lapangan lebih rendah dibandingkan di rumah kaca. Bobot basah tajuk terbesar tampak pada C. cristata di rumah kaca yaitu 137,95 g, sedangkan bobot basah daun terbesar pada G. globosa di rumah kaca yaitu 48,37 g. Bobot basah akar terbesar terlihat pada C. cristata di rumah kaca yaitu 16,01 g (Tabel 4).
Bobot Kering Tajuk, Daun, dan Akar Bobot kering tajuk dan daun dipengaruhi oleh lokasi (P<0,05) sedangkan bobot kering akar tidak dipengaruhi. Bobot kering tajuk, daun, dan akar dipengaruhi oleh jenis tanaman dan terdapat interaksi antara lokasi dan jenis
tanaman (P<0,05). Bobot kering tajuk dan akar tanaman lebih rendah di lapangan dibandingkan di rumah kaca. Bobot kering tajuk terbesar diperlihatkan pada G. globosa di rumah kaca yaitu 32,79 g, sedangkan bobot kering daun terbesar pada jenis G. globosa di rumah kaca yaitu 4,75 g . Bobot kering akar terbesar pada jenis C. cristata di rumah kaca yaitu 6,12 g (Tabel 5).
Respon Fisiologi Tanaman
Kandungan klorofil total dan aktivitas APX dipengaruhi oleh lokasi dan jenis tanaman (P<0,05), serta terdapat interaksi antara lokasi dan jenis tanaman, namun kandungan ASA tidak dipengaruhi. Kandungan klorofil total terbesar pada C. roseus di rumah kaca yaitu 1,90 mg/g. Aktivitas APX tertinggi ditunjukkan oleh C. roseus di lapangan yaitu 0,017 (mmol/ m/g) (Tabel 6).
Tabel 4 Interaksi antara lokasi dan jenis tanaman terhadap bobot basah tanaman.
Lokasi Jenis tanaman BB Tajuk (g) BB Daun (g) BB Akar (g) Lapangan C. cristata 73,00±13,94c 5,23±2,14d 8,07±3,64b
G. globosa 80,68±20,37c 19,36±6,84c 4,74±0,99bc
C. roseus 29,15±6,91d 21,13±5,98c 7,74±1,65bc
Rumah kaca
C. cristata 137,95±14,89a 14,33±6,46c 16,01±8,35a
G. globosa 113,86±32,77b 48,37±11,51a 4,98±2,04bc
C. roseus 35,28±11,35d 32,42±9,73b 4,02±2,02c
Ket: Data ± SD yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf uji 5% (DMRT).
Tabel 5 Interaksi antara lokasi dan jenis tanaman terhadap bobot kering tanaman Lokasi Jenis tanaman BK Tajuk (g)
BK Daun (g) BK Akar (g)
Lapangan C. cristata 17,42±2,53c 1,53±0,26a 3,19±1,09b
G. globosa 27,03±4,64b 3,71±1,13a 2,79±0,87b
C. roseus 7,20±1,62d 4,16±1,70a 2,78±0,89b
Rumah kaca
C. cristata 31,47±4,11ab 2,88±1,21a 6,12±3,46a
G. globosa 32,79±10,93a 4,75±2,45a 2,64±0,89b
C. roseus 7,60±3,54d 4,68±3,07a 1,72±0,81b
Ket: Data ± SD yang diikuti oleh huruf yang sama pada kolom yang sama tidak berbeda nyata pada taraf uji 5% (DMRT).
Tabel 6 Kandungan klorofil, ASA, dan APX pada lokasi dan jenis tanaman berbeda
Lokasi Jenis
tanaman
Kandungan klorofil total (mg/g bobot segar)
Kandungan ASA (mg/100 g bobot segar)
Aktivitas APX
(mmol/m/g bobot segar) Lapangan C. cristata 1,05±0,09d 1733±230,94a 0,013±0,001c
G. globosa 1,31±0,03c 1511±153,96a 0,014±0,001b
C. roseus 1,46±0,07c 1358±229,63a 0,017±0,002a
Rumah kaca C. cristata 1,69±0,15b 1955±615,84a 0,012±0,001c
G. globosa 1,45±0,09c 1422±153,96a 0,012±0,001c
C. roseus 1,90±0,09a 1866±230,94a 0,011±0,003d
6
PEMBAHASAN Respon pertumbuhan
Berdasarkan hasil analisis tanah yang digunakan sebagai media tanam menunjukkan bahwa konsentrasi nitrogen tergolong rendah dengan pH asam. Penambahan kompos bertujuan meningkatkan nitrogen dan pH sehingga diharapkan dapat menunjang pertumbuhan tanaman uji. Hal ini terlihat pada awal petumbuhan tanaman yang baik. Faktor lain yang membatasi pertumbuhan dan perkembangan tanaman adalah adanya zat pencemar udara. Hal ini terlihat pada pertambahan tinggi relatif, pertambahan jumlah daun relatif, pertambahan luas daun relatif, dan luas daun total di lapangan lebih rendah dibandingkan rumah kaca. Hal ini diduga berkaitan adanya TSP (partikel) yang lebih tinggi di lapangan dibandingkan di rumah kaca (Tabel 2). Partikel akan menutupi stomata dan menghambat pertukaran gas sehingga berakibat terhambatnya pertumbuhan tanaman (Kozlowski 1991; Mudd 1975). Pertambahan luas daun total tanaman di lapangan lebih rendah dibandingkan di rumah kaca. Hal ini terkait dengan kemungkinan masuknya zat pencemar udara melalui celah daun akan menghambat laju fotosintesis. Penurunan laju fotosintesis akan menyebabkan terhambatnya translokasi fotosintat ke sel-sel apikal yang akan menyebabkan terhambatnya pembelahan dan pemanjangan sel sehingga mempengaruhi pertumbuhan luas permukaan daun (Kovacs 1992).
Umur fisiologi daun tanaman di lapangan lebih cepat yaitu 25-35 hari dibandingkan di rumah kaca yaitu 30-45 hari. Umur fisiologi daun didapatkan dengan cara menandai daun mulai pucuk hingga gugur alami. Hasil pengamatan menunjukkan bahwa jumlah gugur daun tanaman di lapangan terbesar pada C. cristata dan tanaman yang sedikit menggugurkan daun adalah G. globosa (Tabel 4). Diduga keadaan ini terkait dengan morfologi daun C. cristata yang tipis dan umur fisiologi daun yang lebih singkat yaitu ± 25 hari. Daun yang tipis menyebabkan zat pencemar mudah terserap, sehingga terjadi penuaan dini pada daun yang diperlihatkan dengan gugurnya daun (Suryowinoto 1995). Tanaman G. globosa memiliki daun yang lebih tebal, berbulu dan umur fisiologi daun yang lebih lama (± 32 hari) dibandingkan dua jenis lainnya. Hal ini merupakan faktor pertahanan pertama dari polutan sehingga daun tanaman akan lebih lambat mengalami
kerusakan dan gugur daun. Jenis tanaman yang mempunyai kemampuan menyerap zat pencemar lebih besar adalah tanaman yang memiliki daun yang permukaannya kasar dan ukurannya lebih lebar (Flanagan et al. 1980). Selain itu kemampuan menggugurkan daun juga dapat digunakan sebagai strategi bagi tanaman untuk bertahan hidup dalam menghadapi perubahan lingkungan. Pencemaran udara dapat meningkatkan permeabilitas sel yang mengakibatkan peningkatan kehilangan air dan nutrien terlarut yang pada akhirnya menyebabkan percepatan penuaan daun (Singh et al. 1991).
Bobot basah tajuk, daun, dan akar di lapangan lebih rendah dibandingkan di rumah kaca. Bobot basah daun terbesar pada G. globosa di rumah kaca. Hal ini terkait dengan morfologi daun yang lebar dan tebal, umur fisiologi daun yang relatif lama yaitu ±40 hari. Selain itu, luas daun total yang lebih besar akan mendukung laju fotosintesis lebih baik sehingga meningkatkan bobot basah daun (Chaves 1991 ; Lawlor 2002). Bobot basah tanaman menunjukkan besarnya kandungan air dalam jaringan atau organ tumbuhan dan aktivitas metabolisme tanaman yang dipengaruhi oleh kadar air jaringan, unsur hara dan hasil metabolisme (Salisbury & Ross 1995; Sitompul & Guritno 1995).
Bobot kering tajuk, daun dan akar lebih rendah dibandingkan di rumah kaca. Bobot kering tajuk G. globosa dan bobot kering akar C. cristata di lapangan lebih rendah dibandingkan di rumah kaca. Hal ini diduga dipengaruhi oleh pertumbuhan tinggi, luas daun dan proses fotosintesis (Prawiranata et al. 1981). Akibat terganggunya pertumbuhan tanaman karena zat pencemar udara akan menyebabkan penurunan bobot kering tanaman. Bobot kering total merupakan akibat efisiensi penyerapan dan pemanfaatan energi matahari yang tersedia sepanjang musim tanam (Gardner et al. 1991). Hal ini menunjukkan bahwa kemampuan G. globosa di rumah kaca menghasilkan fotosintat lebih tinggi dibandingkan di lapangan (Goldworthy & Fisher 1992). Bobot kering tajuk dan akar C. roseus tidak berbeda nyata di kedua lokasi. Hal ini diduga berhubungan dengan mekanisme pertahanan C. roseus yang baik terhadap zat pencemar udara yaitu peningkatan aktivitas APX (Tabel 6).
Respon Fisiologi
7
dibandingkan di rumah kaca. Hal ini terlihat pada C. Cristata dan C. roseus di lapangan lebih rendah dibandingkan di rumah kaca. Tanaman akan menunjukkan penurunan kadar klorofil pada kondisi udara yang tercemar (Adiputro et al 1995). Penurunan kandungan klorofil akibat zat pencemar udara terkait dengan rusaknya kloroplas (Fitter & Hay 1994). Pembentukan kloroplas dipengaruhi oleh H2O dan O2. Masuknya zat pencemar udara melalui celah daun akan menetap di sekitar jaringan mesofil, didalamnya terdapat banyak kloroplas. Ruang antar sel yaitu tempat pertukaran H2O, O2, dan CO2 yang terdapat disekitar jaringan mesofil. Jika zat pencemar masuk akan mempengaruhi komponen di ruang antar sel, menyebabkan terhambatnya pembentukan kloroplas sehingga mengakibatkan penurunan klorofil. Penurunan kandungan klorofil mengakibatkan penurunan laju fotosintesis sehingga akan mempengaruhi laju pertumbuhan dan perkembangan tanaman (Salisbury & Ross 1995). Penurunan laju pertumbuhan dapat terlihat pada pertambahan tinggi, jumlah daun dan luas daun total tanaman di lapangan lebih rendah dibandingkan di rumah kaca (Tabel 3). Berdasarkan Tabel 6, terlihat bahwa kandungan ASA tanaman di dua lokasi tidak berbeda nyata. Hal ini diduga berkaitan dengan konsentrasi zat pencemar udara yang rendah dari ambang batas (Tabel 1). Asam askorbat (ASA) merupakan senyawa yang terdapat dalam jaringan tanaman dan berfungsi sebagai reduktor untuk beberapa radikal bebas sehingga dapat meminimalkan kerusakan yang disebabkan oleh stress lingkungan. Iturbe-Ormaetxe et al. (1998) menjelaskan bahwa antioksidan seperti ASA mengalami peningkatan di kloroplas pada kondisi stress lingkungan. Peningkatan ASA pada tanaman berfungsi untuk mereduksi radikal bebas yang terbentuk akibat cekaman oksidatif (Mc Kersie & Leshem 1994).
Aktivitas APX tanaman di lapangan meningkat dibandingkan di rumah kaca. Peningkatan aktivitas APX terbesar ditunjukkan oleh tanaman C. roseus. Hal ini diduga berkaitan dengan mekanisme pertahanan tanaman untuk mengurangi oksigen radikal akibat cekaman oksidatif oleh zat pencemar udara dan melimpahnya akumulasi H2O2 pada tanaman, sehingga akan meningkatkan aktivitas APX. Hal ini terlihat pada pertumbuhan C. roseus di lapangan paling baik diantara dua jenis lainnya yaitu laju pertambahan tinggi dan jumlah daun (Gambar 1 dan 2). Hidrogen peroksida adalah
spesies oksigen reaktif dan stabil yang menunjukkan peningkatan di bawah berbagai tekanan kondisi seperti stres air dan polutan (Foyer 1998 ; Ogawa 2001). Askorbat peroksidase merupakan enzim yang terlibat dalam mengurangi oksigen radikal yang terbentuk (Gupta et al. 1993 ; Shigeoka2002). Respon fisiologi tanaman yang terpapar zat pencemar udara memiliki perbedaan terhadap kandungan ASA dan aktivitas APX. Hal ini disebabkan karena ASA dapat menangkal berbagai radikal bebas, sedangkan aktivitas APX meningkat jika terjadi akumulasi H2O2 pada tanaman.
Keterkaitan Antara Respon Pertumbuhan dan Fisiologi Tanaman
Respon pertumbuhan tanaman terganggu akibat cekaman lingkungan seperti pencemaran udara. Hal ini terlihat pada penurunan setiap parameter pertumbuhan di lapangan dibandingkan di rumah kaca. Tanaman yang terpapar zat pencemar udara akan mengalami penurunan terhadap pertumbuhannya, antara lain pertambahan tinggi, pertambahan jumlah daun, dan luas daun total, serta gugur daun meningkat. Hal ini disebabkan karena penurunan laju fotosintesis (Kozlowski 1991 ; Mudd 1975). Tanaman C. roseus memiliki nilai pertumbuhan relatif paling baik selama pengamatan. Hal ini dapat terlihat pada laju pertambahan tinggi, jumlah daun, petambahan tinggi relatif dan jumlah daun relatif yang paling baik diantara dua jenis lainnya (Gambar 1 dan 2) (Tabel 3). Pertumbuhan tanaman yang terhambat akibat penurunan laju fotosintesis menyebabkan penurunan bobot basah dan bobot kering tanaman di lapangan dibandingkan di rumah kaca (Tabel 5). Respon fisiologi terhadap cekaman oksidatif akibat zat pencemar udara ditunjukkan dengan penurunan kandungan klorofil total dan peningkatan aktivitas APX pada C. roseus di lapangan (Tabel 6). Respon fisiologi yang baik pada C. roseus diikuti dengan respon pertumbuhannya. Tanaman yang dapat dijadikan bioindikator terhadap zat pencemar udara adalah C. cristata dan G. globosa. Hal ini disebabkan karena kedua tanaman tersebut memiliki nilai parameter respon pertumbuhan dan respon fisiologi yang rendah.
SIMPULAN
8
terlihat pada pertambahan tinggi relatif, jumlah daun relatif yang lebih besar, jumlah gugur daun lebih sedikit, dan bobot kering tajuk dan akar tidak berbeda nyata di dua lokasi. Respon fisiologi terhadap zat pencemar udara pada C. roseus meliputi penurunan kandungan klorofil total dan peningkatan aktivitas APX.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk mengetahui tanaman hias lain yang toleran terhadap zat pencemar udara.
DAFTAR PUSTAKA
Adiputro BS, NSW Karliansyah, HDW Wardhana. 1995. Klorofil Tumbuhan sebagai Bioindikator Pencemaran Udara. Jurnal Lingkungan & Pembangunan 15(2):233-248.
Arnon DI.1959. Copper enzymes in isolated chloroplast Polyphenol oxidase in Beta vulgaris. Plant Physiol 24:1-15.
Carpenter PL, TD Walker, FO Lanphear. 1975. Plant in The Lanscape. San Fransisco: W.H. Freeman.
Chaves M. 1991. Effect water deficit on carbon assimilation. J Exp Bot 42:1-6. Dalimartha S. 2000. Atlas Tumbuhan Obat
Indonesia. Jilid ke-2. Jakarta: Trubus Agriwidya.
Fakuara MY, EN Dahlan, AH Yahya, Ekarelawan, ASD Ida, H. Pringodido, PH Sigit. 1991. Pemilihan Jenis untuk LanSkap Jalan Raya: Studi Toleransi Tanaman Peneduh Jalan terhadap Pencemar Udara dari Kendaraan Bermotor dan Kemampuannya dalam Mengurangi Timbal. Media Persaki. Edisi I-MP/1/91. Pengurus Pusat Persatuan Sarjana Kehutanan Indonesia. Jakarta. Fitter AH, RK Hay. 1994. Fisiologi
Lingkungan Tanaman. S Andani & ED Purbayanti, penerjemah. Yogyakarta: Gajah Mada University Press. Terjemahan dari: Physiology of Plant. Flanagan JT, KJ Wade, S Curie, DJ Curtis.
1980. The Deposition of Lead and Zinc From Traffic Pollution On two Road Side Shrubs Environment Polluts (Series B). Foyer CH, G Noctor. 1998. Ascorbate and
Glutathione: Keeping Active Oxygen Under Control, Annu. Rev. Plant Mol. Biol. 49:249–279.
Gardner FP, RB Pearce, dan RI Mitchell. 1991. Fisiologi Tanaman Budidaya. Penerjemah: Susilo, H. Jakarta: UI Press.
Goldsworthy PR, NM Fisher. 1992. The physiology of tropical field crops. Terjemahan: Fisiologi tanaman budi daya Tropik. Penerjemah: Tohari dan Soedharoedjian. UGM-Press.Yogyakarta. Gupta AS, RP Webb, S Holaday, RD Allen.
1993. Overexpression of superoxide dismutase protects plants from oxidative stress. Plant Physiol 103:1067-1073. Iturbe-Ormaetxe I, PR Escuredo, C
Arrese-Igor, M Becana. 1998. Oxidative damage in pea plant exposed to water deficit or paraquant. Plant physiol 132:173-181. Keles Y, I Oncel. 2002. Response of
Antioxidative Defence System to Temperature and Water Stress Combination in Wheat Seedlings. Plant Sci 163: 783-790.
Kovaks M. 1992. Biological Indicators in Environmental Protection. England: Market Cross House.
Kozlowski TT, PJ Kramer, SG Pallardy. 1991. The Physiological Ecology of Woody Plants. Academic Press Inc. London. Kusnoputranto H. 1996. Dampak Pencemaran
Udara dan Air terhadap Kesehatan dan Lingkungan. Jurnal Lingkungan dan Pembangunan 16:3:210-224.
Lawlor DW. 2002. Limitation to photosynthesis in water stressed leaves: stomata vs metabolism and the role of ATP. Ann Bot 89:871-885.
Mc Kersie BD, YY Leshem. 1994. Stress and Stress Coping in Cultivated Plants. Dordrecht: kluwer Academic Pub. Mudd JB. 1975. Sulfur Dioxide; Respone of
Plant to Air Pollution. London. Academic Press.
Nakano Y, K Asada. 1981. Hydrogen peroxide is scavenged by ascorbate specific peroxidase in spinach chloroplast. Plant & Cell Physiol 22 (5): 867-880.
Udayana C. 2004. Toleransi Spesies Pohon Tepi Jalan terhadap Pencemaran Udara di Simpang Susun Jakarta Cawang, Jakarta Timur. [Tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor. Ogawa K, M. Iwabuchi. 2001. A Mechanism
for Promoting the Germination of Zinnia elegans Seeds by Hydrogen Peroxide, Plant Cell Physiol. 42:286–291.
Pearcy RW, JR Ehleringer, HA Mooney, PW Rundel. 1996. Plant Physiology Ecology. Clays Ltd: London.
7
dibandingkan di rumah kaca. Hal ini terlihat pada C. Cristata dan C. roseus di lapangan lebih rendah dibandingkan di rumah kaca. Tanaman akan menunjukkan penurunan kadar klorofil pada kondisi udara yang tercemar (Adiputro et al 1995). Penurunan kandungan klorofil akibat zat pencemar udara terkait dengan rusaknya kloroplas (Fitter & Hay 1994). Pembentukan kloroplas dipengaruhi oleh H2O dan O2. Masuknya zat pencemar udara melalui celah daun akan menetap di sekitar jaringan mesofil, didalamnya terdapat banyak kloroplas. Ruang antar sel yaitu tempat pertukaran H2O, O2, dan CO2 yang terdapat disekitar jaringan mesofil. Jika zat pencemar masuk akan mempengaruhi komponen di ruang antar sel, menyebabkan terhambatnya pembentukan kloroplas sehingga mengakibatkan penurunan klorofil. Penurunan kandungan klorofil mengakibatkan penurunan laju fotosintesis sehingga akan mempengaruhi laju pertumbuhan dan perkembangan tanaman (Salisbury & Ross 1995). Penurunan laju pertumbuhan dapat terlihat pada pertambahan tinggi, jumlah daun dan luas daun total tanaman di lapangan lebih rendah dibandingkan di rumah kaca (Tabel 3). Berdasarkan Tabel 6, terlihat bahwa kandungan ASA tanaman di dua lokasi tidak berbeda nyata. Hal ini diduga berkaitan dengan konsentrasi zat pencemar udara yang rendah dari ambang batas (Tabel 1). Asam askorbat (ASA) merupakan senyawa yang terdapat dalam jaringan tanaman dan berfungsi sebagai reduktor untuk beberapa radikal bebas sehingga dapat meminimalkan kerusakan yang disebabkan oleh stress lingkungan. Iturbe-Ormaetxe et al. (1998) menjelaskan bahwa antioksidan seperti ASA mengalami peningkatan di kloroplas pada kondisi stress lingkungan. Peningkatan ASA pada tanaman berfungsi untuk mereduksi radikal bebas yang terbentuk akibat cekaman oksidatif (Mc Kersie & Leshem 1994).
Aktivitas APX tanaman di lapangan meningkat dibandingkan di rumah kaca. Peningkatan aktivitas APX terbesar ditunjukkan oleh tanaman C. roseus. Hal ini diduga berkaitan dengan mekanisme pertahanan tanaman untuk mengurangi oksigen radikal akibat cekaman oksidatif oleh zat pencemar udara dan melimpahnya akumulasi H2O2 pada tanaman, sehingga akan meningkatkan aktivitas APX. Hal ini terlihat pada pertumbuhan C. roseus di lapangan paling baik diantara dua jenis lainnya yaitu laju pertambahan tinggi dan jumlah daun (Gambar 1 dan 2). Hidrogen peroksida adalah
spesies oksigen reaktif dan stabil yang menunjukkan peningkatan di bawah berbagai tekanan kondisi seperti stres air dan polutan (Foyer 1998 ; Ogawa 2001). Askorbat peroksidase merupakan enzim yang terlibat dalam mengurangi oksigen radikal yang terbentuk (Gupta et al. 1993 ; Shigeoka2002). Respon fisiologi tanaman yang terpapar zat pencemar udara memiliki perbedaan terhadap kandungan ASA dan aktivitas APX. Hal ini disebabkan karena ASA dapat menangkal berbagai radikal bebas, sedangkan aktivitas APX meningkat jika terjadi akumulasi H2O2 pada tanaman.
Keterkaitan Antara Respon Pertumbuhan dan Fisiologi Tanaman
Respon pertumbuhan tanaman terganggu akibat cekaman lingkungan seperti pencemaran udara. Hal ini terlihat pada penurunan setiap parameter pertumbuhan di lapangan dibandingkan di rumah kaca. Tanaman yang terpapar zat pencemar udara akan mengalami penurunan terhadap pertumbuhannya, antara lain pertambahan tinggi, pertambahan jumlah daun, dan luas daun total, serta gugur daun meningkat. Hal ini disebabkan karena penurunan laju fotosintesis (Kozlowski 1991 ; Mudd 1975). Tanaman C. roseus memiliki nilai pertumbuhan relatif paling baik selama pengamatan. Hal ini dapat terlihat pada laju pertambahan tinggi, jumlah daun, petambahan tinggi relatif dan jumlah daun relatif yang paling baik diantara dua jenis lainnya (Gambar 1 dan 2) (Tabel 3). Pertumbuhan tanaman yang terhambat akibat penurunan laju fotosintesis menyebabkan penurunan bobot basah dan bobot kering tanaman di lapangan dibandingkan di rumah kaca (Tabel 5). Respon fisiologi terhadap cekaman oksidatif akibat zat pencemar udara ditunjukkan dengan penurunan kandungan klorofil total dan peningkatan aktivitas APX pada C. roseus di lapangan (Tabel 6). Respon fisiologi yang baik pada C. roseus diikuti dengan respon pertumbuhannya. Tanaman yang dapat dijadikan bioindikator terhadap zat pencemar udara adalah C. cristata dan G. globosa. Hal ini disebabkan karena kedua tanaman tersebut memiliki nilai parameter respon pertumbuhan dan respon fisiologi yang rendah.
SIMPULAN
8
terlihat pada pertambahan tinggi relatif, jumlah daun relatif yang lebih besar, jumlah gugur daun lebih sedikit, dan bobot kering tajuk dan akar tidak berbeda nyata di dua lokasi. Respon fisiologi terhadap zat pencemar udara pada C. roseus meliputi penurunan kandungan klorofil total dan peningkatan aktivitas APX.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk mengetahui tanaman hias lain yang toleran terhadap zat pencemar udara.
DAFTAR PUSTAKA
Adiputro BS, NSW Karliansyah, HDW Wardhana. 1995. Klorofil Tumbuhan sebagai Bioindikator Pencemaran Udara. Jurnal Lingkungan & Pembangunan 15(2):233-248.
Arnon DI.1959. Copper enzymes in isolated chloroplast Polyphenol oxidase in Beta vulgaris. Plant Physiol 24:1-15.
Carpenter PL, TD Walker, FO Lanphear. 1975. Plant in The Lanscape. San Fransisco: W.H. Freeman.
Chaves M. 1991. Effect water deficit on carbon assimilation. J Exp Bot 42:1-6. Dalimartha S. 2000. Atlas Tumbuhan Obat
Indonesia. Jilid ke-2. Jakarta: Trubus Agriwidya.
Fakuara MY, EN Dahlan, AH Yahya, Ekarelawan, ASD Ida, H. Pringodido, PH Sigit. 1991. Pemilihan Jenis untuk LanSkap Jalan Raya: Studi Toleransi Tanaman Peneduh Jalan terhadap Pencemar Udara dari Kendaraan Bermotor dan Kemampuannya dalam Mengurangi Timbal. Media Persaki. Edisi I-MP/1/91. Pengurus Pusat Persatuan Sarjana Kehutanan Indonesia. Jakarta. Fitter AH, RK Hay. 1994. Fisiologi
Lingkungan Tanaman. S Andani & ED Purbayanti, penerjemah. Yogyakarta: Gajah Mada University Press. Terjemahan dari: Physiology of Plant. Flanagan JT, KJ Wade, S Curie, DJ Curtis.
1980. The Deposition of Lead and Zinc From Traffic Pollution On two Road Side Shrubs Environment Polluts (Series B). Foyer CH, G Noctor. 1998. Ascorbate and
Glutathione: Keeping Active Oxygen Under Control, Annu. Rev. Plant Mol. Biol. 49:249–279.
Gardner FP, RB Pearce, dan RI Mitchell. 1991. Fisiologi Tanaman Budidaya. Penerjemah: Susilo, H. Jakarta: UI Press.
Goldsworthy PR, NM Fisher. 1992. The physiology of tropical field crops. Terjemahan: Fisiologi tanaman budi daya Tropik. Penerjemah: Tohari dan Soedharoedjian. UGM-Press.Yogyakarta. Gupta AS, RP Webb, S Holaday, RD Allen.
1993. Overexpression of superoxide dismutase protects plants from oxidative stress. Plant Physiol 103:1067-1073. Iturbe-Ormaetxe I, PR Escuredo, C
Arrese-Igor, M Becana. 1998. Oxidative damage in pea plant exposed to water deficit or paraquant. Plant physiol 132:173-181. Keles Y, I Oncel. 2002. Response of
Antioxidative Defence System to Temperature and Water Stress Combination in Wheat Seedlings. Plant Sci 163: 783-790.
Kovaks M. 1992. Biological Indicators in Environmental Protection. England: Market Cross House.
Kozlowski TT, PJ Kramer, SG Pallardy. 1991. The Physiological Ecology of Woody Plants. Academic Press Inc. London. Kusnoputranto H. 1996. Dampak Pencemaran
Udara dan Air terhadap Kesehatan dan Lingkungan. Jurnal Lingkungan dan Pembangunan 16:3:210-224.
Lawlor DW. 2002. Limitation to photosynthesis in water stressed leaves: stomata vs metabolism and the role of ATP. Ann Bot 89:871-885.
Mc Kersie BD, YY Leshem. 1994. Stress and Stress Coping in Cultivated Plants. Dordrecht: kluwer Academic Pub. Mudd JB. 1975. Sulfur Dioxide; Respone of
Plant to Air Pollution. London. Academic Press.
Nakano Y, K Asada. 1981. Hydrogen peroxide is scavenged by ascorbate specific peroxidase in spinach chloroplast. Plant & Cell Physiol 22 (5): 867-880.
Udayana C. 2004. Toleransi Spesies Pohon Tepi Jalan terhadap Pencemaran Udara di Simpang Susun Jakarta Cawang, Jakarta Timur. [Tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor. Ogawa K, M. Iwabuchi. 2001. A Mechanism
for Promoting the Germination of Zinnia elegans Seeds by Hydrogen Peroxide, Plant Cell Physiol. 42:286–291.
Pearcy RW, JR Ehleringer, HA Mooney, PW Rundel. 1996. Plant Physiology Ecology. Clays Ltd: London.
TOLERANSI DAN RESPON FISIOLOGI TANAMAN
Celosia
cristata
,
Gomphrena globosa
, dan
Catharanthus roseus
TERHADAP ZAT PENCEMAR UDARA
NINGSIH AMELIA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
8
terlihat pada pertambahan tinggi relatif, jumlah daun relatif yang lebih besar, jumlah gugur daun lebih sedikit, dan bobot kering tajuk dan akar tidak berbeda nyata di dua lokasi. Respon fisiologi terhadap zat pencemar udara pada C. roseus meliputi penurunan kandungan klorofil total dan peningkatan aktivitas APX.
SARAN
Perlu dilakukan penelitian lebih lanjut untuk mengetahui tanaman hias lain yang toleran terhadap zat pencemar udara.
DAFTAR PUSTAKA
Adiputro BS, NSW Karliansyah, HDW Wardhana. 1995. Klorofil Tumbuhan sebagai Bioindikator Pencemaran Udara. Jurnal Lingkungan & Pembangunan 15(2):233-248.
Arnon DI.1959. Copper enzymes in isolated chloroplast Polyphenol oxidase in Beta vulgaris. Plant Physiol 24:1-15.
Carpenter PL, TD Walker, FO Lanphear. 1975. Plant in The Lanscape. San Fransisco: W.H. Freeman.
Chaves M. 1991. Effect water deficit on carbon assimilation. J Exp Bot 42:1-6. Dalimartha S. 2000. Atlas Tumbuhan Obat
Indonesia. Jilid ke-2. Jakarta: Trubus Agriwidya.
Fakuara MY, EN Dahlan, AH Yahya, Ekarelawan, ASD Ida, H. Pringodido, PH Sigit. 1991. Pemilihan Jenis untuk LanSkap Jalan Raya: Studi Toleransi Tanaman Peneduh Jalan terhadap Pencemar Udara dari Kendaraan Bermotor dan Kemampuannya dalam Mengurangi Timbal. Media Persaki. Edisi I-MP/1/91. Pengurus Pusat Persatuan Sarjana Kehutanan Indonesia. Jakarta. Fitter AH, RK Hay. 1994. Fisiologi
Lingkungan Tanaman. S Andani & ED Purbayanti, penerjemah. Yogyakarta: Gajah Mada University Press. Terjemahan dari: Physiology of Plant. Flanagan JT, KJ Wade, S Curie, DJ Curtis.
1980. The Deposition of Lead and Zinc From Traffic Pollution On two Road Side Shrubs Environment Polluts (Series B). Foyer CH, G Noctor. 1998. Ascorbate and
Glutathione: Keeping Active Oxygen Under Control, Annu. Rev. Plant Mol. Biol. 49:249–279.
Gardner FP, RB Pearce, dan RI Mitchell. 1991. Fisiologi Tanaman Budidaya. Penerjemah: Susilo, H. Jakarta: UI Press.
Goldsworthy PR, NM Fisher. 1992. The physiology of tropical field crops. Terjemahan: Fisiologi tanaman budi daya Tropik. Penerjemah: Tohari dan Soedharoedjian. UGM-Press.Yogyakarta. Gupta AS, RP Webb, S Holaday, RD Allen.
1993. Overexpression of superoxide dismutase protects plants from oxidative stress. Plant Physiol 103:1067-1073. Iturbe-Ormaetxe I, PR Escuredo, C
Arrese-Igor, M Becana. 1998. Oxidative damage in pea plant exposed to water deficit or paraquant. Plant physiol 132:173-181. Keles Y, I Oncel. 2002. Response of
Antioxidative Defence System to Temperature and Water Stress Combination in Wheat Seedlings. Plant Sci 163: 783-790.
Kovaks M. 1992. Biological Indicators in Environmental Protection. England: Market Cross House.
Kozlowski TT, PJ Kramer, SG Pallardy. 1991. The Physiological Ecology of Woody Plants. Academic Press Inc. London. Kusnoputranto H. 1996. Dampak Pencemaran
Udara dan Air terhadap Kesehatan dan Lingkungan. Jurnal Lingkungan dan Pembangunan 16:3:210-224.
Lawlor DW. 2002. Limitation to photosynthesis in water stressed leaves: stomata vs metabolism and the role of ATP. Ann Bot 89:871-885.
Mc Kersie BD, YY Leshem. 1994. Stress and Stress Coping in Cultivated Plants. Dordrecht: kluwer Academic Pub. Mudd JB. 1975. Sulfur Dioxide; Respone of
Plant to Air Pollution. London. Academic Press.
Nakano Y, K Asada. 1981. Hydrogen peroxide is scavenged by ascorbate specific peroxidase in spinach chloroplast. Plant & Cell Physiol 22 (5): 867-880.
Udayana C. 2004. Toleransi Spesies Pohon Tepi Jalan terhadap Pencemaran Udara di Simpang Susun Jakarta Cawang, Jakarta Timur. [Tesis]. Bogor: Sekolah Pascasarjana, Institut Pertanian Bogor. Ogawa K, M. Iwabuchi. 2001. A Mechanism
for Promoting the Germination of Zinnia elegans Seeds by Hydrogen Peroxide, Plant Cell Physiol. 42:286–291.
Pearcy RW, JR Ehleringer, HA Mooney, PW Rundel. 1996. Plant Physiology Ecology. Clays Ltd: London.
9
Prohazkova D, RK Sairam, GC Srivastava, DV Singh. 2001. Oxidative Stress and Antioxidant Activity as the Basis of Senescence in Maize Leaves. Plant Sci 161:765-771.
Reiss C. 1993. Experiment in Plant Physiology: Part I; Plant Biochemistry, Determination of Ascorbic Acid Content of Cabbage. p 1-7.
Salisbury FB, CW Ross. 1995. Fisiologi Tumbuhan, Biokimia Tumbuhan, Jilid 2. Penerjemah: Lukman, D.R. dan Sumaryono. Bandung: Penerbit ITB. Shigeoka S. 2002. Regulation and Function of
Ascorbat peroxidase isozymes. J Exp Bot 53 (372): 1305-1319.
Singh SK, DN Rao, M Agrawal, J Pandey, D Narayan. 1991. Air pollution tolerance index of plant. J Environ Mgmt 32: 45-55.
Siringoringo HH. 2000. Kemampuan Beberapa Jenis Tanaman Hutan Kota dalam Menjerap Partikulat Timbal. Bul.Pen. Hutan 622:1-16.
Sitompul SM, B Guritno. 1995. Analisis Pertumbuhan Tanaman. Yogyakarta: Universitas Gadjah Mada Press.
Suryowinoto, M Sutarni. 1997. Flora Eksotika Tanaman Peneduh. Cetakan ke 1. Kanisius. Yogyakarta.
TOLERANSI DAN RESPON FISIOLOGI TANAMAN
Celosia
cristata
,
Gomphrena globosa
, dan
Catharanthus roseus
TERHADAP ZAT PENCEMAR UDARA
NINGSIH AMELIA
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
NINGSIH AMELIA. Toleransi dan respon fisiologi Celosia cristata, Gomphrena globusa, dan Catharanthus roseus terhadap bahan pencemar udara. Dibimbing oleh SULISTIJORINI dan TRIADIATI.
Pencemaran udara merupakan masalah lingkungan yang terjadi akibat perubahan komposisi udara dari keadaan normalnya. Tanaman dapat digunakan sebagai bioindikator tingkat pencemaran udara melalui respon pertumbuhannya. Informasi kemampuan tanaman hias dalam menyerap bahan pencemar udara masih terbatas. Tujuan penelitian ini adalah mengetahui toleransi dan respon fisiologi tanaman Celosiacristata, Gomphrena globusa, dan Catharanthus roseus terhadap bahan pencemar udara. Tanaman di tempatkan di Babakan Sawah Baru, University Farm IPB ( dengan konsentrasi bahan pencemar lebih tinggi ) dan rumah kaca Kampus IPB, Darmaga (dengan konsentrasi bahan pencemar lebih rendah). Parameter pertumbuhan dan fisiologi yang diamati meliputi tinggi tanaman, jumlah daun, luas daun total, jumlah daun gugur, bobot basah dan kering tanaman, kandungan klorofil total, asam askorbat (ASA), dan aktivitas askorbat peroksidase (APX). Data dianalisis menggunakan analisis sidik ragam dan uji Duncan Multiple Range Test (DMRT). Lokasi dengan kondisi bahan pencemar lebih tinggi menyebabkan pertambahan tinggi, jumlah, luas daun total menurun, Terhambatnya pertumbuhan tanaman ditunjukkan dengan meningkatnya jumlah daun gugur dan menurunnya bobot basah dan kering tanaman. Pada Cataranthus roseus, respon fisiologi akibat cekaman bahan pencemar udara ditunjukkan dengan meningkatnya kandungan klorofil total dan meningkatnya aktivitas APX.
Kata kunci: Pencemaran udara, Celosia cristata, Gomphrena globosa, Catharanthus roseus, toleransi, respon fisiologi.
ABSTRACT
NINGSIH AMELIA. Tolerance and physiological responses of Celosia cristata, Gomphrena globusa, and Catharanthus roseus due to air pollutant. Supervised by SULISTIJORINI and TRIADIATI.
Air pollution is an environmental issue that occurs due to change in air composition of its normal state. Plants have been known as bio indicator for air pollution through the growth response. Information capability of herbs plant to absorb pollutant is very limited. The objectives of this research were to determine the tolerance and physiological responses of Celosia cristata, Gomphrena globusa, and Catharanthus roseus due to air pollutant. On the other site, data were also collecyed at green house of IPB Dramaga, which has a relatively low of pollutants. Growth and physiological parameters were recorded include plant height, number of leaf, total leaf area, number of leaf senescence, fresh and dry weight of plant, chlorophyll content, ascorbic acid content (ASA), and the activity of ascorbate peroxidase (APX). Data were analyzed by analysis of variance and Duncan Multiple Range Test (DMRT). This study revealed that plants on location with relatively high of pollutant have plant height, number of leaf, total leaf area, fresh and dry weight lower than those of plants on relatively low of pollutant whereas, total leaf senesence increased. Cataranthus rosesus showed decreasing of chlorophyll content and increasing of APX activity as physiological response due to air pollutant.
TOLERANSI DAN RESPON FISIOLOGIS TANAMAN
Celosia cristata
,
Gomphrena globosa
, DAN
Catharanthus roseus
TERHADAP ZAT PENCEMAR UDARA
NINGSIH AMELIA
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Departemen Biologi
DEPARTEMEN BIOLOGI
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
LEMBAR PENGESAHAN
Judul : Toleransi dan Respon Fisiologi Tanaman
Celosia cristata, Gompherana
globosa,
dan
Catharanthus roseus
terhadap Zat Pencemar Udara.
Nama : Ningsih Amelia
NIM : G34061849
Disetujui:
Pembimbing I,
Pembimbing II,
Dr. Ir. Sulistijorini, M.Si
Dr. Triadiati, M.Si
NIP 19630920 198903 2 001
NIP 19600224 198603 2 001
Mengetahui:
Ketua Departemen Biologi,
Dr. Ir. Ence Darmo Jaya Supena, M.Si
NIP 19641002 198903 1 002
PRAKATA
Puji syukur penulis panjatkan kepada Allah SWT atas segala rahmat dan karunia-Nya sehingga penulis dapat menyelesaikan karya ilmuah ini. Penelitian yang berjudul Toleransi dan Respon Fisiologi Tanaman Celosia cristata, Gomphrena globosa, dan Catharanthus roseus terhadap Bahan Pencemar Udara ini dilaksanakan sejak bulan Februari hingga Oktober 2010 di University Farm IPB Babakan Sawah Baru Bogor, rumah kaca Departemen Biologi IPB, dan Laboraturium Fisiologi Tumbuhan Departemen Biologi, Fakultas MIPA, Institut Pertanian Bogor. Terima kasih penulis ucapkan kepada Ibu Dr. Ir. Sulistijorini, M.Si. dan Ibu Dr. Triadiati, M.Si selaku pembimbing atas segala saran, kritik, dorongan, dan bimbingannya selama penelitian. Selain itu, penulis sampaikan terima kasih juga kepada seluruh pegawai Laboratorium Biologi IPB yang membantu dan mempermudah saya dalam menjalani penelitian ini.
Ungkapan terima kasih yang tak terhingga penulis sampaikan kepada Ayah, Mama, adik-adik dan seluruh keluarga atas nasihat, semangat, bantuan materi, dan doa-doanya. Ucapan terima kasih kepada Mia, Wemby, Nia, Achie, Meri, Tyas, Lia, dan seluruh teman-teman Biologi Angkatan 43 yang telah memberikan semangat, motivasi, canda tawa dan dorongan. Selain itu, penulis sampaikan terima kasih juga kepada Mbak Febi, Pak Nunu, dan Pak Kus yang membantu dan mempermudah saya dalam menjalani penelitian ini. Akhir kata, semoga karya ilmiah ini dapat bermanfaat.
Bogor,Maret 2011
RIWAYAT HIDUP
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... vi
DAFTAR TABEL ... vi
DAFTAR LAMPIRAN ... vii
PENDAHULUAN ... 1
BAHAN DAN METODE Waktu dan tempat ... 1
Alat dan bahan ... 2
Rancangan penelitian ... 2
Analisis udara, tanah, dan kompos ... 2
Persiapan media tanam, pembibitan, dan pemeliharaan ... 2
Pengamatan ... 2
Pengukuran luas daun ... 2
Analisi kloorofil total ... 2
Analisis asam askorbat (ASA) ... 3
Analisis askorbat peroksidase (APX) ... 3
Analisis data ... 3
HASIL Analisis udara, tanah, dan kompos ... 3
Respon umum pertumbuhan ... 3
Bobot basah tajuk, daun, dan akar ... 5
Bobot kering tajuk, daun, dan akar ... 5
Respon fisiologi tanaman ... 5
PEMBAHASAN Respon pertumbuhan ... 6
Respon fisiologi ... 6
Keterkaitan antara respon pertumbuhan dan fisiologi tanaman ... 7
SIMPULAN DAN SARAN Simpulan ... 7
Saran ... 8
DAFTAR PUSTAKA ... 8
DAFTAR TABEL
Halaman
1 Parameter dan metode yang digunakan untuk analisis kualitas udara... 2
2 Analisis kualitas udara di University Farm IPB Babakan Sawah Baru Bogor dan rumah kaca. ... 4
3 Respon pertumbuhan tanaman di lokasi berbeda.. ... 4
4 Interaksi antara lokasi dan jenis tanaman terhadap bobot basah tanaman.. ... 5
5 Interaksi antara lokasi dan jenis tanaman terhadap bobot kering tanaman. ... 5
6 Kandungan klorofil total, asam askorbat (ASA), dan askorbat peroksidase (APX)... 5
DAFTAR GAMBAR
Halaman 1 Laju pertambahan tinggi Celosia cristata, Gomphrena globosa, dan Catharanthus roseus di lapangan dan rumah kaca ... 42 Laju pertambahan jumlah daun Celosia cristata, Gomphrena globosa, dan Catharanthus roseus di lapangan dan rumah kaca ... 4
DAFTAR LAMPIRAN
Halaman 1 Analisis tanah di University Farm IPB Babakan Sawah Baru Bogor. ... 111
PENDAHULUAN
Pencemaran udara merupakan perubahan komposisi udara dari keadaan normalnya yang disebabkan adanya bahan-bahan asing di udara diantaranya NOx, SOx, COx, dan partikel dalam jumlah tertentu serta waktu yang cukup lama akan mengganggu kehidupan makhluk hidup (Wardhana 2004). Sumber pencemaran berasal dari kegiatan yang bersifat alami, seperti letusan gunung berapi, kebakaran hutan. Selain itu, dapat berasal dari kegiatan manusia (antropogenik) antara lain kegiatan industri, aktivitas transportasi, dan pertanian. Pencemaran udara di Indonesia, terutama di kota-kota besar disebabkan gas buang kendaraan bermotor (60-70%), industri (10-15%), dan sisanya berasal dari rumah tangga, pembakaran sampah, kebakaran hutan/ladang, dan lain-lain (Kusnoputranto 1996).
Salah satu usaha yang dapat dilakukan untuk mengatasi masalah pencemaran udara adalah penghijauan. Tanaman dapat menyediakan oksigen yang diperlukan oleh manusia, mengurangi dan menurunkan tingkat pencemaran udara dengan cara menyerap polutan (Carpenter et al. 1975). Tingkat pencemaran udara dapat diketahui dengan menggunakan tanaman sebagai bioindikator yang dapat dilihat melalui respon petumbuhannya.
Tanaman dapat menjadi penyerap bahan pencemar udara terutama melalui daun. Daun tersusun oleh sel-sel, antara lain sel-sel epidermis pada permukaan atas dan bawah daun. Pada permukaan bawah daun terdapat banyak stomata dan sebagian besar pertukaran gas di dalam daun terjadi melalui stomata (Gardner et al. 1991). Kemampuan tanaman dalam menyerap gas dari udara terutama dapat diketahui dari proses fotosintesis, respirasi, dan transpirasi (Kozlowski 1991). Tingkat pencemaran udara juga dapat diketahui dengan menggunakan bioindikator. Salah satu bioindikator yang digunakan adalah tanaman. Tanaman akan menunjukkan penurunan kadar klorofil pada kondisi udara yang tercemar (Adiputro et al. 1995) serta terlihat adanya kerusakan pada jaringan daun (Udayana 2004). Selain itu total luas daun tanaman akan berkurang karena terhambatnya laju pembentukan dan perluasan daun serta meningkatnya jumlah daun yang gugur (Kozlowski et al.1991).
Tingkat toleransi tanaman terhadap pencemar udara dapat ditentukan dengan pendekatan analisis mikroskopis daun yaitu
kerusakan jaringan dan makroskopis meliputi diameter batang, tinggi tanaman, jumlah daun, gejala klorosis dan nekrosis (Fakuara et al. 1991). Tanaman memiliki mekanisme pertahanan terhadap peningkatan senyawa-senyawa oksidatif yang terbentuk akibat polusi udara. Pembentukan senyawa antioksidan, seperti asam askorbat (ASA), α -tokoferol dan glutation merupakan salah satu sistem pertahanan tanaman tersebut. Selain itu terjadi peningkatan aktivitas enzim antioksidan, seperti askorbat peroksidase (APX), superoksida dismutase (SOD) (Prohazkova et al. 2001), glutation reduktase (GR) (Keles & Oncel 2002). Peningkatan enzim antioksidan tersebut terjadi jika senyawa-senyawa oksidatif terbentuk.
Tanaman yang sudah diteliti memiliki daya serap terhadap bahan pencemar partikel antara lain Mahoni, Angsana, dan Bougenvillea (Siringoringo 2000). Data mengenai kemampuan tanaman herba dalam menyerap bahan pencemar belum banyak ditemukan. Pada penelitian ini digunakan tanaman Celosia cristata, Gomphrena globosa, dan Catharanthus roseus. Celosia cristata (Amaranthaceae, jengger ayam), memiliki daun tunggal dan tersebar, batang berdiameter sedang dan bercabang serta bunga berbentuk bulir menyerupai jengger ayam. Gomphrena globosa (Amaranthaceae, bunga knop), memiliki daun tunggal, berambut kasar di permukaan atas, batang berambut, serta bunga berbentuk bonggol berwarna ungu. (Dalimartha 2005). Tanaman Catharanthus roseus (Apocynaceae, tapak dara) memiliki batang yang berbentuk bulat dengan diameter kecil, bercabang serta berambut. Daunnya berbentuk bulat telur, berdaun tunggal, bunganya menyerupai terompet serta memiliki rumah biji yang berbentuk silindris menggantung pada batang. Ketiga tanaman tersebut merupakan tanaman hias, pertumbuhan cepat, dipelihara dengan mudah dan memiliki nilai estetika yaitu warna dan bentuk yang menarik untuk dijadikan sebagai tanaman di tepi jalan.
Tujuan
Penelitian ini bertujuan untuk mengetahui toleransi dan respon fisiologi tanaman C. cristata, G. globosa dan C. roseus terhadap zat pencemar udara.
BAHAN DAN METODE Waktu dan Tempat
2
Babakan blok E University Farm, rumah kaca Departemen Biologi IPB dan Laboratorium Fisiologi Tumbuhan Departemen Biologi, Fakultas MIPA, Institut Pertanian Bogor.
Alat dan Bahan
Alat yang digunakan yaitu spektrofotometer, timbangan, oven, meteran dan statif. Benih C.cristata, G. globosa, dan C. roseus diperoleh dari BIOTROP. Media tanam yang digunakan adalah tanah dan kompos 3:1 (b/b). Bahan untuk analisis klorofil yaitu aseton 80%. Bahan untuk analisis asam askorbat (ASA) meliputi asam metafosforik 5% dan DCIP 0,8 g/l. Bahan untuk analisis askorbat peroksidase (APX) meliputi 50 mM buffer fosfat pH 7, asam askorbat 0,5 mM, EDTA 0,1 mM dan H2O2 0,1 mM.
Rancangan Penelitian
Rancangan percobaan yang digunakan adalah rancangan acak lengkap faktorial yang terdiri atas 2 faktor dengan 10 ulangan untuk laju pertumbuhan dan 3 ulangan untuk parameter fisiologi. Faktor pertama adalah 2 lokasi yang berbeda yaitu University Farm Babakan Sawah Baru Bogor (lapangan) dan rumah kaca Departemen Biologi. Faktor kedua adalah 3 tanaman yaitu C. cristata, G. tuberosa, dan C. roseus.
Metode
Analisis Udara, Tanah dan Kompos Analisis kualitas udara dilakukan di depan kantor bulog Dramaga, Bogor (lapangan) dan rumah kaca Departemen Biologi FMIPA IPB. Parameter yang diukur meliputi Pb (Timbal), CO, NO2, SO2, Ozon (O3), TSP (partikel), suhu, kelembaban, dan kecepatan angin (Tabel 1). Analisis tanah dan kompos dilakukan di Departemen Manajemen Sumberdaya Lahan IPB. Analisis tanah meliputi kandungan N, P, K, KTK, rasio C/N, pH, dan tekstur, sedangkan kompos meliputi C, N, P, K, Ca, Mg, Fe, Cu, Zn, dan Mn. Tabel 1 Parameter dan metode untuk analisis
kualitas udara. Parameter Metode
NO2 Gries Saltzman
SO2 Pararosaniline
O3 Chemiluminescent
CO Gas Chromatography
TSP (debu) Gravimetric Timbal (Pb) AAS
Suhu Thermometer
Kelembaban Hygrometer Kec. Angin Anemometer Arah angin Kompas
Persiapan Media Tanam, Pembibitan, dan Pemeliharaan
Persiapan media tanam dilakukan dengan menjemur tanah lalu diayak dengan saringan 0,5 mm. Benih tanaman ditempatkan pada bak yang berisi tanah dan kompos 3:1 (b/b). Bibit yang telah berumur 8-25 hari dipindahkan ke polibag kecil berukuran 10 cm x15 cm untuk proses adaptasi (± 1 minggu). Tanaman dipindahkan ke polibag 2 kg yang telah berisi tanah dan kompos 3:1 (b/b) selanjutnya ditempatkan pada lokasi penelitian. Pemeliharaan meliputi penyiraman setiap hari, diusahakan kondisi tanah tidak terlalu lembab dan kering.
Pengamatan
Pengamatan pertumbuhan tanaman meliputi tinggi tanaman, jumlah daun, umur fisiologi daun, dan luas daun. Pengamatan tinggi tanaman dan jumlah daun dilakukan setiap 5 hari. Luas daun diukur setiap 10 hari dan ketika akhir percobaan (3 BST) diukur seluruh daun tiap tanaman. Umur fisiologi daun didapatkan dengan cara menandai daun mulai pucuk hingga gugur alami. Seluruh tanaman dipanen dan dihitung bobot basah serta bobot keringnya pada akhir percobaan. Pengukuran bobot kering tanaman dengan mengeringkan tajuk, daun, dan akar di oven pada suhu 800C selama 36 jam.
Pengukuran Luas Daun