INDUKSI
Protocorm-like Bodies
(
PLBs
) DAN
KARAKTERISASI MOLEKULER POPULASI F2 ANGGREK
PHALAENOPSIS
EKA FIBRIANTY
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI SERTA PELIMPAHAN HAK CIPTA*
Dengan ini saya menyatakan bahwa tesis berjudul Induksi Protocorm-like Bodies (plbs) dan Karakterisasi Molekuler Populasi F2 Anggrek Phalaenopsis adalah benar karya saya dengan arahan dari komisi pembimbing dan belum diajukan dalam bentuk apa pun kepada perguruan tinggi mana pun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.Dengan ini saya melimpahkan hak cipta dari karya tulis saya kepada Institut Pertanian Bogor.
Bogor, November 2013
Eka Fibrianty NRP A253100201
RINGKASAN
EKA FIBRIANTY. Induksi Protocorm-like Bodies (plbs) dan Karakterisasi Molekuler Populasi F2 Anggrek Phalaenopsis. Dibimbing oleh DEWI SUKMA dan SUDARSONO.
Upaya peningkatan ketersediaan materi perbanyakan anggrek Phalaenopsis untuk menyediakan bibit bermutu dapat dilakukan secara vegetatif maupun generatif. Metode kultur jaringan dapat digunakan sebagai salah satu perbanyakan tanaman untuk menghasilkan bibit yang seragam dan dalam jumlah banyak. Keberhasilan metode ini ditentukan oleh beberapa faktor di antaranya genotipe tanaman, umur dan jenis eksplan, dan media kultur yang digunakan. Genotipe-genotipe tanaman yang berkarakter unggul hasil persilangan untuk dapat dimanfaatkan sebagai varietas baru atau sebagai materi pemuliaan selanjutnya harus melalui tahap seleksi. Marka molekuler merupakan suatu pendekatan yang dapat digunakan untuk seleksi progeni pada fase bibit sehingga dapat diketahui progeni yang memiliki genotipe sama atau mirip satu sama lain. Tujuan penelitian adalah mendapatkan media yang optimal untuk induksi plbs dari eksplan daun planlet populasi F2 anggrek Phalaenopsis untuk pembentukan liniklon dari setiap individu tanaman dan karakterisasi molekuler pada populasi F2 anggrek Phalaenopsis menggunakan marka SSR.
Penelitian ini terdiri dari 4 tahap, yaitu : 1) uji media induksi plbs pada individu dalam populasi F2; 2) pembentukan liniklon pada populasi F2 menggunakan media terbaik dari percobaan tahap 1; 3) Induksi tunas samping pada planlet; 4) Isolasi DNA individu dalam populasi F2 dan karakterisasi molekuler dengan marka SSR. Hasil yang didapatkan pada percobaan uji media induksi plbs pada individu dalam populasi F2 adalah diperoleh media yang sesuai untuk induksi plbs yaitu media ½MS (Murashige dan Skoog) dengan penambahan BAP 0.5 mgL-1 + TDZ 0.5 mg L-1+ 2.4-D 0.2 mg L-1. Respon eksplan membentuk plbs dalam medium tersebut sebesar 80%. Pada percobaan pembentukan liniklon pada populasi F2 diperoleh dua puluh enam aksesi menghasilkan plbs antara 4-55 dalam 12 MST. Semua aksesi tidak menghasilkan tunas samping. Pada percobaan karakterisasi molekuler populasi F2 diperoleh tiga primer menunjukkan pola pita yang polimorfik yaitu primer IPS14, primer PeGBMS466 dan primer PeGBMS478. Nilai rata-rata PIC yang diperoleh adalah 0.290 dengan nilai PIC tertinggi sebesar 0.38 pada lokus PeGBMS478. Rata-rata heterozygosity (He) 0.367 dan rata-rata homozygosity (Ho) sebesar 0.491 dengan nilai He tertinggi pada lokus PeGBMS478 yaitu 0.496. Tingkat kemiripan genetik antara P1 dengan P2 sebesar 48%, sedangkan kemiripan genetik antara P2, F1 dan 21 progeni F2 sekitar 90%.
SUMMARY
EKA FIBRIANTY. Protocorm-like Bodies (plbs) Induction and Molecular Characterization F2 Population of Phalaenopsis Orchids. Supervised by DEWI SUKMA and SUDARSONO.
Efforts to increase the availability of Phalaenopsis orchid propagation material to provide quality propagules can be done either vegetatively or generatively. Tissue culture methods could be used as an alternative for vegetative plant propagation to produce uniform seedlings in large quantities. The success of this method is determined by some factors such as plant genotype, age and type of explants and culture media. The genotypes of plants from crossing of superior hybrid could be used for selection of new variety or as material for plant breeding. Molecular markers is an approach that can be used for plant selection at early growth so that it can be seen plants which have the same genotype or similar each other. The research objectives were to get the optimal medium for induction of plbs from leaf explants of Phalaenopsis orchids to make F2 population liniclone and molecular characterization of the Phalaenopsis orchid F2 population using SSR markers.
This research consist of 4 phases: (1) plbs medium induction test on F2 populations of Phalaenopsis orchid 2) liniclone formation the F2 population using the best medium of phase 1; 3) Induction of axillary shoots; (4) Isolation of DNA individuals in F2 population and molecular characterization by SSR markers. The results of the phase 1 was an appropriate medium for plbs induction namely the medium ½MS (Murashige and Skoog) with addition of BAP 0.5 mg L-1 + TDZ 0.5 mg L-1 + 2.4-D 0.2 mg L-1. Explants forming plbs response in the medium was 80%. On the phase 2, twenty-six accessions produce plbs between 4-55 in 12 weeks after planting. Most plbs formation obtained on the accession 9 (55 plbs) and highest weight on accession plbs 3 (17.45 g). On the phase 3, all accessions did not produce axillary shoots until 12 weeks after planting. On the phase 4, in experiments of the molecular characterization of F2 population, three primary showed polymorphism banding pattern namely IPS14, PeGBMS466 and PeGBMS478 primary. The average PIC value obtained was 0.290 with the highest PIC value was 0.38 on PeGBMS478 locus. The average heterozygosity (He) 0.367 and average homozygosity (Ho) 0.491 with the He highest score at the locus PeGBMS478 was 0.496. Level of genetic similarity between P1 to P2 by 48%, while the genetic similarity between P2, F1, F2 and 21 progeny was approximately 90%.
© Hak Cipta Milik IPB, Tahun 2013
Hak Cipta Dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan IPB
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Program Studi Pemuliaan dan Bioteknologi Tanaman
INDUKSI
Protocorm-like Bodies
(
PLBs
) DAN
KARAKTERISASI MOLEKULER POPULASI F2 ANGGREK
PHALAENOPSIS
SEKOLAH PASCASARJANA INSTITUT PERTANIAN BOGOR
BOGOR 2013
Judul Tesis : Induksi Protocorm-like Bodies (plbs) dan Karakterisasi Molekuler Populasi F2 Anggrek Phalaenopsis
Nama : Eka Fibrianty NRP : A253100201
Disetujui oleh Komisi Pembimbing
Dr. Dewi Sukma, SP, MSi Ketua
Diketahui oleh
Prof. Dr. Ir Sudarsono, MSc Anggota
Ketua Program Studi
Pemuliaan dan Bioteknologi Tanaman
Dr. Ir. Yudiwanti Wahyu E.K., MS
Dekan Sekolah Pascasarjana
Dr.Ir. Dahrul Syah, MScAgr
PRAKATA
Puji dan syukur penulis panjatkan kehadirat Allah SWT atas segala rahmat dan karunia-Nya sehingga tesis ini berhasil diselesaikan. Aspek yang dipilih dalam penelitian ini berkaitan dengan komoditas anggrek dengan judul “Induksi Protocorm-like Bodies (plbs) dan Karakterisasi Molekuler Populasi F2 Anggrek Phalaenopsis”.
Penulis mengucapkan terimakasih dan penghargaan yang tulus kepada Dr. Dewi Sukma SP. MSi dan Prof. Dr. Ir. Sudarsono, MSc., selaku komisi pembimbing atas waktu dan kesempatan yang telah diluangkan dalam memberikan masukan, arahan, bimbingan dan motivasi sejak penulis mengikuti pendidikan, penyusunan proposal, pelaksanaan penelitian hingga tersusunnya tesis ini. Terima kasih dan penghargaan penulis sampaikan kepada Badan Litbang Pertanian yang telah memberikan kesempatan untuk melanjutkan pendidikan pascasarjana di Institut Pertanian Bogor.
Rasa terimakasih juga disampaikan kepada teman–teman seperjuangan pada Program Studi Pemuliaan dan Bioteknologi Tanaman 2010 Faperta IPB, untuk persahabatan dan kebersamaan selama masa studi, kepada rekan-rekan di Laboratorium Kultur Jaringan Tanaman (Teh Juju Juariah) dan Laboratorium Biologi Molekuler Tanaman IPB (Mbak Susi, Mas Agus, Bapak Yudiansyah, SSi) yang telah bersahabat dan berdiskusi selama penulis studi di IPB. Kepada yang tercinta kedua orang tua, Drs. Aldany Muhammad, MM dan ibu Midayati, suami , anak-anak, Giri Pratama, Gezika Ghossani dan adik-adik tersayang, terima kasih atas segala pengorbanan, pengertian, kesabaran dan doanya selama ini.
Semoga tesis ini dapat bermanfaat untuk kemajuan ilmu pengetahuan khususnya dalam pengembangan komoditas anggrek.
Bogor, November 2013
DAFTAR ISI
DAFTAR TABEL xii
DAFTAR GAMBAR xii
DAFTAR LAMPIRAN xiii
1 PENDAHULUAN
Tujuan Penelitian 2
2 TINJAUAN PUSTAKA 3
3 INDUKSI PROTOCORM-LIKE BODIES (PLBS) PADA POPULASI F2 ANGGREK PHALAENOPSIS
Abstrak 11
Pendahuluan 12
Bahan dan Metode 13
Hasil dan Pembahasan 15
Simpulan 26
4 KAREKTERISASI MOLEKULER POPULASI F2 ANGGREK
PHALAENOPSIS
Abstrak 30
Pendahuluan 31
Bahan dan Metode 32
Hasil dan Pembahasan 35
Simpulan 41
5 PEMBAHASAN UMUM 45
6 SIMPULAN DAN SARAN
Simpulan 48
Saran 48
DAFTAR PUSTAKA 49
LAMPIRAN 59
DAFTAR TABEL
3.1 Respon eksplan daun planlet pada berbagai komposisi media
induksi plbs pada 6 minggu setelah tanam 16
3.2 Komposisi hormon alami dalam air kelapa 18
4.1 Jenis primer dan parameter keragaman genetik 24 aksesi anggrek Phalaenopsis berdasarkan marka SSR 36
4.2 Hasil skoring pada tujuh turunan F2 dan tetua P1, P2 dan F1 menggunakan marka SSR 40
DAFTAR GAMBAR
1.1 Bagan alir penelitian 22.1 Bagian utama bunga anggrek Phalaenopsis 4
2.2 Morfologi Buah dan daun anggrek Phalaenopsis 4
2.3 Morfologi Batang dan akar anggrek Phalaenopsis 5
3.1 Inisiasi dan perkembangan plbs pada eksplan daun anggrek 15
3.2 Keragaan plbs pada beberapa aksesi individu dalam populasi F2 20
3.3 Respon perbedaan aksesi anggrek terhadap jumlah plbs 21
3.4 Respon perbedaan aksesi anggrek terhadap bobot plbs 21
3.5 Keragaan beberapa aksesi anggrek Phalaenopsis pada media ½MS+BAP 0.5 mg L-1 12 MST 23
3.6 Respon perbedaan aksesi anggrek terhadap panjang daun 12 MST 23
3.7 Respon perbedaan aksesi anggrek terhasap lebar daun 12 MST 24
3.8 Kisaran jumlah akar planlet anggrek Phalaenopsis 12 MST 24
3.9 Kisaran panjang akar anggrek planlet anggrek Phalaenopsis 12 MST 25
4.1 Materi genetik untuk ekstraksi DNA 33
4.2 Visualisasi profil pita hasil PAGE pada P1, P2, F1 dan 21 aksesi F2 anggrek Phalaenopsis dengan primer PeGBMS446 37
4.3 Visualisasi profil pita hasil PAGE pada P1, P2, F1 dan 21 aksesi F2 anggrek Phalaenopsis dengan primer IPS14 37
4.4 Visualisasi profil pita hasil PAGE pada P1, P2, F1 dan 21 aksesi F2 anggrek Phalaenopsis dengan primer PeGBMS478 38
DAFTAR LAMPIRAN
1 Primer dan sekuen yang digunakan untuk mendeteksi polimorfisme pada anggrek Phalaenopsis 59 2 Komposisi media MS 61
3 Komposisi lengkap air kelapa 62
1
PENDAHULUAN
Permintaan anggrek dalam negeri cenderung meningkat. Direktorat Perbenihan dan Sarana Produksi Direktorat Jenderal Hortikultura (2012) mencatat bahwa impor anggrek di Indonesia dari tahun ke tahun mengalami peningkatan. Impor anggrek tahun 2010 sebesar 40.154 US$ dan pada tahun 2011 meningkat menjadi 48.899 US$. Nilai ekonomi bunga anggrek Phalaenopsis ditentukan oleh
jenis, keindahan, bentuk, warna dan ukuran bunga. Jenis anggrek Phalaenopsis
yang banyak diperdagangkan dewasa ini adalah jenis bunga standar dengan tangkai bunga tunggal, ukuran bunga besar dan jumlah bunga per tangkai banyak dan jenis berbunga bercorak (novelty) ataupun multiflora dengan tangkai bunga bercabang-cabang (Chen et al. 2006).
Salah satu kendala dalam pengembangan agribisnis tanaman hias di Indonesia, khususnya anggrek adalah terbatasnya ketersediaan bibit dari varietas unggul baru yang berkualitas (Gow et al. 2009). Upaya peningkatan ketersediaan
materi perbanyakan anggrek Phalaenopsis untuk menyediakan bibit bermutu
dapat dilakukan secara vegetatif maupun generatif. Secara vegetatif Phalaenopsis
diperbanyak dengan induksi tunas samping ataupun induksi meriklon atau mata tunas dari tangkai bunga dalam kultur in vitro (Tokuhara dan Mii, 2003). Masih
terbatasnya teknologi perbanyakan anggrek Phalaenopsis dalam waktu yang cepat
dan sesuai induknya, menjadi salah satu hambatan bagi pemulia untuk melepas varietas baru hasil silangannya terkait dengan ketersediaan benih (Goh, 1990).
Karakter individu calon varietas unggul baru bisa diketahui setelah tanaman berbunga (sekitar 3.5 tahun setelah penyemaian benih). Individu unggul terseleksi dari populasi persilangan selanjutnya diperbanyak secara klonal dengan kultur jaringan untuk mendapatkan sejumlah besar bibit yang memiliki genotipe yang sama dengan induknya. Keberhasilan metode kultur jaringan ditentukan oleh banyak faktor, diantaranya adalah genotipe tanaman, media, umur, jenis eksplan yang digunakan dan lain-lain (Chen et al. 2001). Eksplan yang umumnya
digunakan adalah tangkai bunga yang mengandung mata tunas (Tokuhara dan Mii 2003; Winarto et al. 2013), daun (Chowdhury et al. 2003; Chung et al. 2007; Kuo
et al. 2005; Park et al. 2002; Rianawati et al. 2009; Winarto et al. 2013) dan
infloresen/kuncup bunga (Meesawat dan Kanchanapoom, 2002; Vendrame et al.
2007).
Pemuliaan anggrek Phalaenopsis dapat dilakukan melalui persilangan
antar spesies, spesies dengan hibrida maupun hibrida dengan hibrida (Yusnita, 2012). Seleksi untuk kualitas bunga dilakukan setelah tanaman berbunga, dimana untuk Phalaenopsis membutuhkan waktu 3.5 tahun setelah penyemaian benih.
Individu-induvidu dalam populasi F1 atau F2 kemungkinan ada yang sama genotipenya, sehingga jika dua atau lebih individu atau liniklon memiliki genotipe yang sama harus bisa diseleksi pada fase bibit di kultur in vitro. Pengelompokkan
dini pada fase bibit dapat menggunakan ciri morfologi maupun molekuler.
keunggulan yaitu bersifat kodominan, polimorfismenya tinggi, lokus tersebar di dalam genom dalam jumlah banyak, dan sampel DNA yang dibutuhkan sedikit karena dalam melakukan deteksi menggunakan PCR (Polimerase chain reaction)
yang dapat menggandakan DNA dalam kondisi in vitro (Tmnykh et al. 2000).
Marka SSR adalah marka yang berdasarkan sejumlah sekuen DNA yang berulang dan menjadi salah satu marka yang banyak digunakan dalam beberapa penelitian mengenai keragaman genetik pada beberapa komoditas pertanian, antara lain anggrek Phalaenopsis (Fatimah dan Sukma 2011), anggrek Vanda (Phuekvilai et al. 2009), anggrek Dendrobium (Boonsrangsom et al. 2008), jati (Boer 2007),
kelapa (Riberio et al. 2010) dan lain-lain. Marka molekuler juga dapat digunakan
untuk identifikasi tetua pada anggrek Vanda (Phuekvilai et al. 2009) dan tanaman
rosa villosa (Nybom 2004).
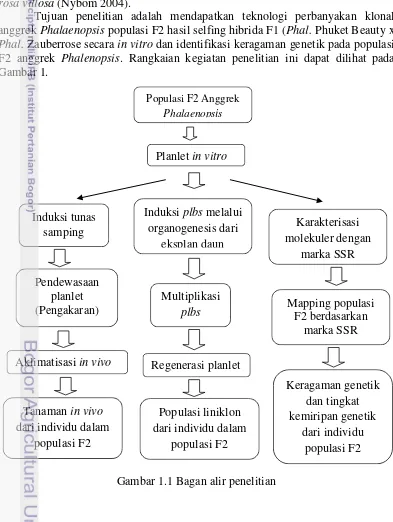
Tujuan penelitian adalah mendapatkan teknologi perbanyakan klonal anggrek Phalaenopsis populasi F2 hasil selfing hibrida F1 (Phal. Phuket Beauty x
Phal. Zauberrose secara in vitro dan identifikasi keragaman genetik pada populasi
F2 anggrek Phalenopsis. Rangkaian kegiatan penelitian ini dapat dilihat pada
Gambar 1.
Gambar 1.1 Bagan alir penelitian
Keragaman genetik Induksi plbs melalui
3
TINJAUAN PUSTAKA
Botani Anggrek
Tanaman anggrek merupakan tipe tanaman yang memiliki kecepatan tumbuh yang relatif lambat, tergantung faktor genetik dan kondisi lingkungan tumbuh serta teknik budidaya yang dilakukan. Secara genetik anggrek terdiri dari spesies asli atau dikenal sebagai anggrek alam dan hibrida yang dihasilkan dari persilangan antar spesies ataupun antar genus. Phalaenopsis merupakan salah satu
genus yang terkenal dalam famili Orchidaceae. Genus anggrek Phalaenopsis
terdiri dari sekitar 25.000 – 30.000 spesies, kurang lebih 5000 spesies di antaranya ada di Indonesia. Spesies yang sangat terkenal adalah Phalaenopsis amabilis atau
dijuluki anggrek bulan (Yusnita, 2012).
Anggrek Phalaenopsis tersebar luas mulai dari Malaysia, Indonesia,
Filipina, Papua, hingga ke Australia. Secara alami, Phalaenopsis hidup secara
epifit dengan menempel pada batang atau cabang pohon di hutan-hutan dan tumbuh subur hingga 600 meter di atas permukaan laut. Anggrek merupakan tanaman herba tahunan dengan pertumbuhan vertikal dan tipe pertumbuhan monopodial yang menyukai sedikit cahaya matahari sebagai penunjang hidupnya. Daunnya berwarna hijau dengan bentuk memanjang. Bunganya memiliki ukuran yang bervariasi dengan diameter 2-20 cm (Arditti, 1992).
Kedudukan anggrek bulan dalam taksonomi tumbuhan diklasifikasikan sebagai berikut (Arditi, 1992):
Divisio : Spermatophyta Subdivisio : Angiospermae Kelas : Monocotyledonae Ordo : Orchidales
Famili : Orchidaceae Genus : Phalaenopsis
Spesies : Phalaenopsis amabilis L.
Di antara jenis anggrek yang terdapat di Indonesia, anggrek Phalaenopsis
merupakan salah satu anggrek kebanggaan nasional. Anggrek bulan
(Phalaenopsis amabilis L.) adalah salah satu spesies dari genus Phalaenopsis
yang cukup populer dan dianggap cukup penting karena peranannya sebagai induk dapat menghasilkan berbagai keturunan atau hibrida.
Morfologi anggrek bulan
Bunga
Bunga anggrek Phalaenopsis memiliki lima bagian utama, yakni sepal
(kelopak bunga), petal (mahkota bunga), benang sari, putik, dan ovari (bakal buah). Bedanya, sepal dari famili anggrek ini tidak berwarna hijau, melainkan berwarna indah seirama dengan warna petalnya. Benang sari dan tangkai kepala putik menjadi satu membentuk suatu struktur yang disebut column (Inggris) atau
bubuk, tetapi mempunyai tepung sari yang berupa gumpalan yang disebut polinia.
Polinia ini melekat pada ujung column melalui suatu struktur yang disebut
plasenta dan tertutup sebuah tudung yang disebut cap (Arditi, 1992). Bagian
utama bunga anggrek Phalaenopsis dapat dilihat pada Gambar 2.1.
Gambar 2.1 Bagian utama bunga anggrek Phalaenopsis
Buah
Buah anggrek berbentuk kapsul yang berwarna hijau dan jika masak mengering dan terbuka dari samping. Bijinya sangat kecil dan ringan, sehingga mudah terbawa angin. Biji-biji anggrek tidak memiliki endosperm sebagai
cadangan makanan , sehingga untuk perkecambahannya dibutuhkan nutrisi yang berfungsi untuk membantu pertumbuhan biji. Perkecambahan di alam sangat sulit jika tanpa bantuan fungi (jamur) yang disebut mikoriza yang bersimbiosis dengan
biji-biji anggrek tersebut. Dalam kondisi lingkungan yang sesuai, hifa atau benang
dari mikoriza akan menembus embrio anggrek melalui sel-sel suspensor. Fungi tersebut dicerna sehingga terjadi pelepasan nutrisi sebagai bahan energi yang digunakan untuk pertumbuhan dan perkembangan perkecambahan biji-biji anggrek. Waktu yang diperlukan sejak pembuahan hingga buah masak bervariasi tergantung genus atau spesiesnya. Umur masak buah untuk anggrek Phalaenopsis
adalah 4-6 bulan. Morfologi buah anggrek Phalaenopsis dapat dilihat pada
Gambar 2.2.
Gambar 2.2 Morfologi buah dan daun anggrek Phalaenopsis: (A) Buah anggrek
Phalaenopsis; (B) Daun anggrek Phalaenopsis
Petal Sepal tengah
Sepal
lateris labelum
polinia
Daun
Helaian daun anggrek berdaging berwarna hijau tua. Permukaan daun dilapisi kutikula (lapisan lilin) yang dapat melindungi dari serangan hama dan penyakit. Kedudukan daun tersusun secara berjajar berselingan. Daun anggrek memiliki ciri khas bertulang daun sejajar. Bentuknya berbeda-beda, ada yang memanjang dan ada yang membulat tergantung pada spesies . Panjang daun antara 20 cm – 30 cm dan lebar 3 cm – 12 cm. Batang dan daun anggrek mengandung klorofil, hal ini sangat membantunya memaksimalkan penyerapan sinar matahari untuk fotosintesis dalam habitatnya di hutan yang minim cahaya. Morfologi daun anggrek Phalaenopsis dapat dilihat pada Gambar 2.2.
Batang
Pertumbuhan batang anggrek Phalaenopsis bersifat monopodial, yaitu
meninggi atau vertikal pada satu titik tumbuh dan terdiri dari hanya satu batang utama. Pola pertumbuhan monopodial dicirikan oleh karakter antara lain tanaman hanya mempunyai satu poros tumbuh vertikal, tanaman tidak menumbuhkan tunas anakan, pertumbuhan tajuk terjadi secara indeterminate (tunas tumbuh terus, tidak terbatas), tanaman tidak mempunyai rhizom, terdapat akar adventif yang muncul dari batang di antara buku-bukunya, infloresens bunga muncul secara lateral ( di ketiak daun). Tinggi batang anggrek Phalaenopsis 30 – 40 cm (Yusnita, 2012).
Morfologi batang anggrek Phalaenopsis dapat dilihat pada Gambar 2.3.
Gambar 2.3 Morfologi batang dan akar anggrek Phalaenopsis: (A) Batang
anggrek Phalaenopsis; (B) akar anggrek Phalaenopsis
Akar
Akar pada anggrek berfungsi untuk mengambil, menyerap, dan mengantarkan zat hara ke seluruh bagian tanaman. Fungsi lain dari akar adalah menempelkan dirinya pada tempat atau media tumbuh.Tanaman dikatakan sehat atau tidaknya dapat dilihat dari akarnya. Akar udara terdapat lapisan velamen yang berongga dan berfungsi untuk menyerap air dan udara. Akar ini juga dapat berfotosintesis karena mengandung butiran hijau daun ( klorofil ). Pada lapisan velamen terdapat Mycorhiza ( myco = cendawan ; rhizome = akar ) atau cendawan
yang hidup dalam akar tumbuhan. Mycorhiza hidup secara simbiosis yaitu
A
B
dengan memfiksasi fosfat untuk ditukarkan dengan hidrat dari tumbuhan. Morfologi akar anggrek Phalaenopsis dapat dilihat pada Gambar 2.3.
Syarat Tumbuh
Tanaman anggrek memerlukan berbagai unsur hara untuk pertumbuhan optimalnya. Kandungan hara pada pupuk, ketercukupan intensitas cahaya, kesesuaian suhu dan sirkulasi udara sangat menentukan pertumbuhan dan perkembangan optimal tanaman anggrek, hingga dapat berbunga dengan kualitas prima. Sirkulasi udara yang baik dan suhu yang sesuai menjamin ketersediaan CO2 untuk fotosintesis dan O2 untuk respirasi. Persyaratan tumbuh setiap jenis
anggrek berbeda-beda, tetapi semua jenis memerlukan aliran udara yang selalu bergerak. Manfaat aliran udara ini untuk mencegah timbulnya penyakit akibat lingkungan yang terlalu basah dan menurunkan suhu udara pada siang hari yang panas. Cahaya matahari yang dibutuhkan anggrek Phalaenopsis sekitar 20%-
50%. Berdasarkan kebutuhan suhu, Phalaenopsis termasuk anggrek tipe hangat
yaitu anggrek yang hidup pada daerah yang tidak terlalu dingin dan tidak terlalu panas. Suhu malam hari yang diperlukan antara 21 0C-24 0C dan siang hari antara 24 0C-29 0C. Tanaman anggrek membutuhkan kelembaban udara pada siang hari berkisar 50-80% dan pada saat musim berbunga sekitar 50-60%. (Arditi, 1992). Ketinggian tempat yang ideal untuk tanaman anggrek Phalaenopsis adalah dari
dataran rendah sampai dataran tinggi atau sekitar 500 hingga 1000 m dpl.
Kultur Jaringan
Kultur jaringan merupakan salah satu teknik dalam perbanyakan tanaman secara klonal untuk perbanyakan masal. Keuntungan pengadaan bibit melalui kultur jaringan antara lain dapat diperoleh bahan tanaman yang unggul dalam jumlah banyak dan seragam, selain itu dapat diperolehbiakan steril (motherstock)
sehingga dapat digunakan sebagai bahan untuk perbanyakan tanaman berikutnya (Lestari, 2011).
Penggunaan media dasar dan zat pengatur tumbuh yang tepat merupakan faktor yang penting untuk mendapatkan hasil yang optimum. Kombinasi media dasar dan zat pengatur tumbuh yang tepat akan meningkatkan aktivitas pembelahan sel dalam proses morfogenesis dan organogenesis (Davies, 1995). Zat pengatur tumbuh terdiri dari golongan sitokinin dan auksin. Auksin mempunyai peran ganda tergantung pada struktur kimia, konsentrasi, dan jaringan tanaman yang diberi perlakuan (Gaba, 2005). Pada umumnya auksin digunakan untuk menginduksi pembentukan kalus, kultur suspensi, dan akar, yaitu dengan memacu pemanjangan dan pembelahan sel di dalam jaringan kambium (Pierik, 1987).
2005). Auksin digunakan untuk menginduksi pembentukkan sel dan akar. Kombinasi antara auksin dan sitokinin berfungsi untuk menginduksi pertumbuhan kalus. Selain auksin dan sitokinin digunakan juga giberelin (menginduksi pemanjangan tunas dan perkecambahan embrio, dan menghambat pengakaran) dan retardan (untuk menghambat pertumbuhan tunas) seperti paclobutrazol (Satyavathi
et al. 2004). Zat pengatur tumbuh tanaman berperan penting dalam mengontrol
proses biologi dalam jaringan tanaman (Davies, 1995). Perannya antara lain mengatur kecepatan pertumbuhan dari masing-masing jaringan dan mengintegrasikan bagian-bagian tersebut guna menghasilkan bentuk yang kita kenal sebagai tanaman. Aktivitas zat pengatur tumbuh di dalam pertumbuhan tergantung dari jenis, struktur kimia, konsentrasi, genotipe tanaman serta fase fisiologi tanaman (Satyavathi et al. 2004).
Salah satu faktor penentu dalam perbanyakan tanaman dengan kultur in
vitro adalah media. Komposisi media yang digunakan tergantung dengan jenis
tanaman yang akan diperbanyak (Yong et al. 2009). Setiap tanaman
membutuhkan paling sedikit 16 unsur hara untuk pertumbuhannya, baik berupa unsur hara makro maupun mikro (Nahar et al. 2011). Media yang digunakan umumnya terdiri dari garam mineral, vitamin, dan hormon. Selain itu, diperlukan juga bahan tambahan seperti agar, gula, dan lain-lain (Yong et al. 2009). Zat
pengatur tumbuh (hormon) yang ditambahkan juga bervariasi, baik jenisnya maupun jumlahnya, tergantung dengan tujuan dari kultur in-vitro yang dilakukan.
Media yang digunakan dalam kultur jaringan anggrek tidak jauh berbeda dengan media in vitro lainnya. Media tanam adalah senyawa-senyawa organik maupun
anorganik yang dipergunakan untuk pertumbuhan eksplan dan planlet (Nambiar et al. 2012).
Manfaat teknik kultur jaringan yang utama adalah perbanyakan klon atau perbanyakan massal dari tanaman yang sifat genetiknya identik satu sama lain (Kosir et al. 2004). Teknik kultur jaringan juga bermanfaat dalam beberapa hal
khusus, yaitu perbanyakan klon secara cepat, keragaman genetik, kondisi aseptik, stok tanaman mikro, lingkungan terkendali, pelestarian plasma nutfah, produksi tanaman sepanjang tahun, dan memperbanyak tanaman yang sulit diperbanyak secara vegetatif konvensional (Mulgund et al. 2011).
Kultur Jaringan Anggrek
Aplikasi teknik kultur jaringan untuk tujuan-tujuan komersial, memberikan dampak yang nyata terhadap perkembangan tanaman anggrek
Phalaenopsis. Perbanyakan Anggrek secara vegetatif melalui pemisahan anakan
dan stek, maupun induksi tunas aksiler tidak bisa diandalkan untuk tujuan-tujuan komersial (Goh, 1990; Arditti, 1992; Kalimutu et al. 2007). Metode kultur
jaringan dapat digunakan sebagai salah satu upaya untuk meningkatkan budidaya anggrek Phalaenopsis. Saat ini beberapa teknik perbanyakan anggrek
Phalaenopsis sudah banyak dikembangkan.
Aranthera, Ascocenda, Dorotis, Doritaenopsis, Phalaenopsis, Dendrobium,
Rhyncostylis, Vanda dan lain-lain. Media dasar yang umum digunakan adalah
medium Vacin dan Went (VM), Murashige dan Skoog (MS), Knudson C dan White (Kerbauy, 1984; Goh, 1990; Sagawa, 1990; Seeni dan Latha 1992; Chen dan Chang 2001; Seeni dan Latha, 2000; Chowdhury et al. 2003).
Perkembangan penelitian meriklon anggrek berkembang pada tahun 1990-an, diantaranya oleh Duan et al. (1996) yang mengembangkan metode
perbanyakan menggunakan eksplan daun, akar atau jaringan ujung tunas yang sebelumnya diberi perlakuan 6-benzyladenine untuk menginduksi tunas muda
anggrek sebagai eksplan. Seluruh prosedur proliferasi secara lengkap membutuhkan waktu sekitar 7 bulan dan kurang lebih 2300 plantlet dapat diperoleh dari eksplan awal. Media yang digunakan sangat sederhana yaitu menggunakan 3.5 g L-1 Hyponex (N:P:K= 6.5%: 6.0%:19%) yang dikombinasikan dengan zat pengatur tumbuh Zeatin, 2ip, kinetin dan BA pada konsentrasi 2 dan 10 mg L-1 untuk pemanjangan batang tunas (1 cm). Setelah pemanjangan, irisan batang dipindahkan pada media Hyponex yang berisi pepton 2 g L-1. Hasil yang diperoleh paling baik pada penggunaan BA 10 mg L-1, sementara dengan zeatin, kinetin dan 2ip menunjukkan efek yang lebih lemah. Berbeda dari penelitian Duan et al. (1996), penelitian yang lebih awal dari Chen
dan Piluek (1995), menggunakan eksplan awal berupa tangkai bunga yang mengandung mata tunas yang ditanam pada media Vacin dan Went yang ditambahkan air kelapa 15% dan thidiazuron 5-40 µM atau BAP 10-40 µM.
Efisiensi induksi tertinggi diperoleh dari media Vacin dan Went yang ditambah
thidiazuron 5-10 µM. Di era tahun 2000, protokol regenerasi tanaman
Phalaenopsis direalisasikan menggunakan media setengah nutrisi Murashige dan
Skoog (MS) yang ditambahkan thidiazuron 0-1 mg L-1 dan
2.4-dichloropenoxyacetic acid (2.4-D) 0-10 mg L-1. Pembentukan kalus
membutuhkan waktu selama 2 bulan. Plbs terbentuk dari kalus tersebut pada
media 0.5 MS yang ditambah thidiaruron saja sebanyak 0.1-1 mg L-1
Hasil penelitian Tokuhara dan Mii (2003) menunjukkan bahwa perbanyakan Phalaenopsis secara meriklon dapat dilakukan dengan menggunakan
tangkai bunga yang mengandung mata tunas. Media digunakan New Dogashima Medium (NDM) yang mengandung NAA 0.5 µM + BA 4.4 µM + 29.2 mM sukrosa. Park et al. (2002) dan Chowdhury et al. (2003) juga melakukan
perbanyakan cepat pada Phalaenopsis menggunakan eksplan daun dari kultur
tangkai bunga, namun media yang digunakan lebih sederhana yaitu menggunakan ½MS dan diberi tambahan BAP dan NAA untuk inisiasi. Media dasar dan zat pengatur tumbuh memegang peranan penting dalam perbanyakan anggrek
Phalaenopsis secara in vitro.
(Ying-Chun
et al. 2000).
Meesawat dan Kanchanapoom (2002) menggunakan media VW yang ditambah peptone 2 g L-1, activated carchoal 2 g L-1, NAA 0.1 mg L-1, BA 1.0 mg
L-1 dan sukrosa 20 g L-1
Hasil penelitian Widyastoety et al. (2006) pada Dendrobium menunjukkan
bahwa tunas dan kalus embriogenik dapat diinduksi dari eksplan mata tunas untuk menginduksi embriogenesis kuncup bunga
Dendrobium. Chung et al. (2005) menggunakan media ½MS dengan 18.16 μM
samping. Tunas diperoleh dari eksplan yang dikultur pada media VW cair + NAA 1 mg L-1 + Kinetin 1.5 mg L-1, selama 15-18 minggu, sedangkan media VW cair + NAA 1 mg L-1 + BAP 1.5 mg L-1 dapat merangsang pertumbuhan plbs pada
umur 9-12 minggu, dengan persentase pertumbuhan plbs 80-90%. Chung et al.
(2007) menggunakan media ½MS dan berbagai konsentrasi thidiazuron 0.3, 1
ppm dan 3 ppm, dengan eksplan daun muda anggrek Dendrobium dari tanaman in
vitro. Hasilnya pertumbuhan dan laju multiplikasi eksplan terbaik pada media
½MS dengan 1 ppm TDZ dan induksi dalam kondisi gelap.
Penanda Molekular
Penanda molekuler atau penanda DNA lebih banyak digunakan sebagai karakter atau penciri tanaman karena lebih stabil dan terpercaya dibandingkan karakter morfologi. Karakter DNA lebih unggul apabila digunakan sebagai karakter penciri tanaman sebab memiliki kestabilan yang sangat tinggi dan tidak dipengaruhi oleh variasi lingkungan dan dapat terdeteksi pada semua fase pertumbuhan tanaman (Kumar et al. 2009).
Marka molekuler adalah suatu penanda pada level DNA yang menawarkan keleluasaan untuk meningkatkan efisiensi pemuliaan konvensional dengan melakukan seleksi tidak langsung pada karakter yang diinginkan, yaitu pada marka yang terkait dengan karakter yang membedakan antara individu tanaman dalam populasi dan jenis tanaman (Semagn, 2006). Analisis molekuler merupakan analisis yang dilakukan pada tingkat gen maupun ekspresinya yang bertujuan untuk mengkonfirmasi keberadaan gen melalui metode molekuler seperti PCR (Schulman, 2007). Sejarah penggunaan penanda untuk mendeteksi karakter-karakter penting pada tumbuhan telah dimulai pada tahun 1923, tetapi pada saat itu penanda yang digunakan adalah penanda morfologi. Sejak tahun 1980, penanda morfologi mulai ditinggalkan dan beralih ke penanda berbasis protein yang dikenal dengan penanda isozym (Liu dan Wu 1998). Penanda morfologi
maupun penanda isozym masih dipengaruhi oleh lingkungan, sehingga pada tahun
1980, oleh Botsein diperkenalkan penanda molekular pertama yang berbasis DNA, yaitu Restriction Fragment Length Polymorphism (RFLP). Setelah itu
muncul penanda yang menggunakan aplikasi PCR seperti Random Amplified
Polymorphic (RAPD) dan microsatellite atau Simple Sequence Repeat (SSR) pada
tahun 1985 (Azrai, 2006).
Semagn (2006) menyatakan bahwa penanda molekular secara garis besar dibagi menjadi tiga kelompok berdasarkan metode deteksinya, yaitu (i) Marka berbasis hibridisasi seperti RFLP, (ii) Marka berbasis PCR, seperti RAPD, AFLP, ISSR, SSR, dan (iii) Marka berbasis sekuens DNA seperti SNP. Marka DNA yang digunakan untuk identifikasi keragaman genetik adalah Mikrosatelit atau
Simple Sequence Repeat (SSR). Manfaat marka molekuler dalam pemuliaan
Simple sequence repeats juga dikenal dengan mikrosatelit terdiri atas
pengulangan beberapa basa nukleotida, berupa dinukleotida, trinukleotida, atau tetranukleotida, yang tersebar disepanjang genom kebanyakan spesies eukariotik (Powell 1996). Marka SSR dapat digunakan untuk mendeteksi aksesi tanaman yang berkerabat dekat secara lebih baik dibandingkan dengan marka molekuler yang lain (Kumar et al. 2009). Mikrosatelit banyak digunakan sebagai alat untuk
pemetaan genetik dan diagnosis genetik tanaman (Varshney et al. 2005),
mengakses keragaman genetik aksesi kapas (Khan et al. 2009), untuk
mengidentifikasi struktur genetik (Kashyap et al. 2005; Park et al. 2009),
identifikasi tetua anggrek Vanda (Phuekvilai et al. 2009).
Marka SSR merupakan marka kodominan dan dapat mendeteksi variasi alel yang tinggi, penggunaan 12 pasang primer SSR menghasilkan alel yang spesifik pada 14 genotipe padi. Primer tersebut menghasilkan total 87 alel (Upadhyay et al. 2011). Sejalan dengan penelitian Molla et al. (2010)
menunjukkan bahwa penggunaan 3 pasang primer SSR dapat mengidentifikasi alel spesifik pada 6 varietas kacang tanah. Tiga primer menghasilkan total 13 alel dengan ukuran mulai dari 109bp sampai 241bp.
Menurut Powell et al. (1996), beberapa pertimbangan untuk penggunaan
marka mikrosatelit dalam studi genetik di antaranya (1) marka terdistribusi secara melimpah dan merata dalam genom eukariot, variabilitasnya sangat tinggi (banyak alel dalam lokus), sifatnya kodominan dan lokasi genom dapat diketahui; (2) merupakan alat uji yang memiliki reproduksibilitas dan ketepatan yang sangat tinggi; (3) merupakan alat bantu yang sangat akurat untuk membedakan genotipe, evaluasi kemurnian benih, pemetaan, dan seleksi genotipe untuk karakter yang diinginkan; (4) studi genetik populasi dan analisis diversitas genetik. Kelemahan SSR antara lain dalam amplifikasi DNA memerlukan pasangan primer spesifik, sekuen genom yang akan diamplifikasi harus diketahui dan biaya pengembangan tinggi.
Demikian juga hasil penelitian Phuekvilai et al. (2009) menunjukkan bahwa sembilan pasang primer SSR yang
digunakan dalam identifikasi anggrek Vanda menghasilkan rata-rata 3 sampai 9
INDUKSI PROTOCORM-LIKE BODIES (PLBs) DAN PROLIFERASI
TUNAS SAMPING ANGGREK PHALAENOPSIS POPULASI F2
Abstract
Clonal propagation of Phalaenopsis orchids by tissue culture techniques
has been used for mass propagation of either newly developed orchid varieties or the parent candidates for subsequent hybridizations. The objectives of this study were to define suitable medium for protocorm-like bodies (plbs) induction from
leaf explant and for axillary shoot proliferation from F2 plantlets of Phalaenopsis.
The F2 plantlets were obtained from self polination of a commercial Phalaenopsis
F1 hybrid (Ph. Phuket Beauty x Ph. Zauberrose). Eight medium compositions were tested for plbs induction. The best medium for plbs induction was half
strength (½) MS basal medium supplemented with 0.5 mg L-1 BAP, 0.5 mg L-1
TDZ and 0.2 mg L-1 2.4-D. In this plbs induction medium, as much as 80% of
excised leaf explants produced plbs. The ranged of plbs regenerated from each excise leaf explant were 4-55 in 12 weeks of incubation period. On the other hand, no shoot proliferation was observerd from F2 plantlets in the half strenght (½)
MS basal medium supplemented with 0.5 mg L-1 BAP, even after 12 weeks of
incubation in the medium.
Pendahuluan
Perbanyakan vegetatif anggrek Phalaenopsis dapat dilakukan dengan
menggunakan jaringan somatis tanaman, sehingga tumbuh menjadi
Protocorm-like bodies (PLBs) yang kemudian dapat diregenerasikan menjadi planlet
(Gnasekaran et al. 2010). Protocorm-like bodies adalah struktur yang menyerupai
protocorm yang terbentuk dari jaringan eksplan atau kalus in vitro (Akter et al.
2007). Perbanyakan klonal anggrek Phalaenopsis yang lambat menjadi salah satu
hambatan bagi pemulia untuk melepas varietas baru hasil silangannya karena ketersediaan bibitnya yang masih terbatas (Goh, 1990).
Salah satu faktor penentu keberhasilan kultur jaringan anggrek
Phalaenopsis adalah tersedianya media tanam yang tepat untuk perbanyakan
massal dalam waktu yang cepat (Nambiar et al. 2012). Media yang digunakan
berpengaruh terhadap pembesaran protokorm, perbanyakan tunas maupun pembentukan akar (Nahar et al. 2011). Media yang digunakan untuk perbanyakan
anggrek dalam kultur in vitro hampir sama dengan media kultur pada umumnya.
Pada umumnya media kultur jaringan mengandung unsur hara makro dan mikro, sukrosa, vitamin, asam amino dan zat pengatur tumbuh (Yong et al. 2009). Media
dasar yang pertama kali digunakan untuk kultur jaringan anggrek adalah media Vacin dan Went (1949). Di era tahun 2000, protokol regenerasi tanaman anggrek
Phalaenopsis menggunakan media setengah komposisi media dasar Murashige
dan Skoog (1962).
Zat pengatur tumbuh tanaman berperan penting dalam mengontrol proses biologi dalam jaringan tanaman (Davies, 1995). Penggunaan zat pengatur tumbuh di dalam kultur jaringan tergantung pada tujuan atau arah pertumbuhan tanaman yang diinginkan (Simon dan Petrasek, 2011). Kombinasi media dasar dan zat pengatur tumbuh yang tepat akan meningkatkan aktivitas pembelahan sel dalam proses morfogenesis dan organogenesis. Zat pengatur tumbuh terdiri dari golongan sitokinin dan auksin. Auksin mempunyai peran ganda tergantung pada struktur kimia, konsentrasi, dan jaringan tanaman yang diberi perlakuan (Gaba, 2005). Auksin pada umumnya digunakan untuk menginduksi pembentukan kalus, kultur suspensi, dan akar, yaitu dengan memacu pemanjangan dan pembelahan sel di dalam jaringan kambium (Pierik, 1987). Dalam proses pembentukan organ seperti tunas atau akar ada interaksi antara zat pengatur tumbuh eksogen yang ditambahkan ke dalam media dengan zat pengatur tumbuh endogen yang diproduksi oleh jaringan tanaman (Satyavathi et al. 2004). Penambahan auksin
atau sitokinin ke dalam media kultur dapat meningkatkan konsentrasi zat pengatur tumbuh endogen di dalam sel, sehingga menjadi faktor pemicu dalam proses tumbuh kembang jaringan tanaman (Davies, 1995).
Propagasi klonal anggrek Phalaenopsis terkendala oleh terbatasnya
Oncidium sp dapat meningkatkan regenerasi dan perakaran planlet (Kalimuthu et al. 2007).
Sebelum genotipe tanaman yang berkarakter unggul hasil persilangan dapat dimanfaatkan sebagai varietas baru atau sebagai materi pemuliaan, maka harus melalui tahapan seleksi (Kuo et al. 2007). Salah satu alternatif pendekatan
untuk percepatan perolehan varietas baru adalah dengan mengembangkan liniklon dari individu-individu dalam populasi tanaman hibrida lebih awal sehingga ketika lini hibrida tertentu diketahui mempunyai sifat-sifat unggul pada saat tanaman berbunga, bibit liniklon dari hibrida terpilih sudah tersedia di laboratorium (Winarto et al. 2013). Laju multiplikasi masing-masing lini pada populasi F2
dalam kultur jaringan tidak selalu sama. Hasil penelitian Rianawati et al. (2009)
menunjukkan adanya variasi respon kemampuan membentuk plbs/tunas pada
berbagai genotipe tanaman anggrek Phalaenopsis.
Anggrek Phalaenopsis termasuk dalam kelompok anggrek monopodial
yang memiliki dominansi apikal kuat sehingga pertumbuhan tunas aksilar menjadi terhambat (Kisor dan Devi 2009). Dominasi apikal pada anggrek Phalaenopsis
diduga dapat dikurangi dengan penggunaan zat pengatur tumbuh dari kelompok sitokinin, sehingga tunas baru bisa dihasilkan (Kosir et al. 2004). Proliferasi tunas
samping dari planlet diharapkan dapat menghasilkan tunas baru yang secara genetik sama dengan tanaman induk dalam waktu yang relatif lebih singkat (Kosir
et al. 2004). Penelitian ini bertujuan untuk mengevaluasi media yang cocok untuk
induksi plbs dari eksplan daun dan proliferasi tunas samping dari planlet anggrek
Phalaenopsis populasi F2.
Bahan dan Metode
Waktu dan Tempat Penelitian serta Bahan Tanaman
Penelitian ini dilakukan di Laboratorium Kultur Jaringan Tanaman Departemen Agronomi dan Hortikultura Institut Pertanian Bogor mulai bulan Oktober 2011 sampai dengan bulan Januari 2013. Bahan tanaman yang digunakan adalah populasi F2 anggrek Phalaenopsis yang sudah berbentuk planlet. Populasi
F2 tersebut dihasilkan dari penyerbukan sendiri satu individu hibrida F1 hasil persilangan antara Phalaenopsis Phuket Beauty (P1) dengan Phalaenopsis
Zauberrose (P2).
Media induksi plbs dari daun muda
Penelitian ini bertujuan untuk mengevaluasi media terbaik untuk perbanyakan anggrek Phalaenopsis populasi F2 dengan menggunakan bahan
1. M-1 = ½MS+BAP 0.5 mg L-1
Daun yang digunakan sebagai eksplan adalah daun ke-2 dan ke-3 dari pucuk planlet. Setiap perlakuan komposisi media terdiri atas 3 ulangan, tiap ulangan terdapat 5 botol dan setiap botol berisi 1 eksplan potongan daun. Kultur diinkubasi dalam ruang gelap hingga terbentuk plbs dan jika plbs sudah terbentuk
kultur dipindah ke ruang kultur terang dengan intensitas cahaya sekitar 2000 lux dan suhu ruang kultur sekitar 20
-1
0C. Peubah yang diamati adalah persentase
eksplan hidup (berapa lama daun tetap hijau pada medium perlakuan), perubahan warna eksplan pada akhir pengamatan, % eksplan membentuk kalus dan % eksplan membentuk plbs.
Pembentukan liniklon pada populasi F2
Percobaan ini bertujuan untuk memperbanyak individu-individu dalam populasi F2 anggrek Phalaenopsis hasil selfing hibrida F1 dengan menggunakan
media terbaik yang diperoleh dari Percobaan 1. Dalam percobaan ini digunakan eksplan daun dari 40 aksesi planlet populasi F2 tersebut di atas. Daun yang digunakan sebagai eksplan adalah daun ke-2 dan ke-3 dari pucuk. Kultur diinkubasi dalam ruang gelap hingga terbentuk plbs dan jika plbs sudah terbentuk
kultur dipindah ke ruang kultur terang dengan intensitas cahaya sekitar 2000 lux dan suhu ruang kultur sekitar 200C. Peubah yang diamati adalah persentase eksplan hidup (berapa lama daun tetap hijau pada medium perlakuan), waktu muncul plbs (Minggu Setelah Tanam), jumlah plbs yang terbentuk dan bobot
plbs.
Induksi Tunas Samping dari Eksplan Planlet
Percobaan ini bertujuan untuk menginduksi tunas samping dari eksplan planlet populasi F2 anggrek Phalaenopsis. Perbanyakan melalui induksi tunas
samping diharapkan dapat menekan potensi variasi somaklonal (Kosir et al.
2004). Jika tunas samping dapat di peroleh, maka planlet induk dapat segera diaklimatisasi untuk evaluasi karakter morfologi, pertumbuhan dan perkembangannya, sementara tunas samping yang dihasilkan dijadikan sebagai
mother stock untuk bahan eskplan dalam perbanyakan klonal in vitro. Sebanyak
Hasil dan Pembahasan
Media induksi plbs dari daun muda
Dalam media induksi eksplan daun untuk mengalami pembengkakan, inisiasi kalus dan selanjutnya terbentuk plbs. Contoh tahapan inisiasi dan
perkembangan plbs pada eksplan daun anggrek Phalaenopsis disajikan pada
Gambar 3.1. Respon awal dari eksplan daun anggrek Phalaenopsis adalah
membengkaknya bagian permukaan bawah daun. Umumnya permukaan bawah daun dekat daerah yang dilukai memiliki kompetensi embriogenik yang tinggi dibandingkan daerah yang lain. Hal ini menunjukkan bahwa plbs/embrio diduga
muncul dari lapisan epidermis jaringan eksplan. Menurut Gill et al. (2004),
pembengkakan eksplan pada tanaman memberikan indikasi adanya pemanjangan atau pembesaran sel yang disebabkan adanya 2.4-D. Penelitian Kuo et al. (2007) pada anggrek Phalaenopsis menunjukkan bahwa embrio somatik sebagian besar
terbentuk dari permukaan bawah daun dekat daerah yang mengalami pelukaan.
Gambar 3.1 Inisiasi dan perkembangan ptorocorm-like bodies(plbs) pada eksplan
daun anggrek: A. pembengkakan pada pinggir daun ; B. plbs sudah
membesar; C. plbs yang terbentuk pada media M1 (½MS+BAP 0.5
mg L-1); d. plbs yang terbentuk pada media M5 (½MS+BAP 0.5 mg
L-1+TDZ 0.5 mg L-1+2.4-D 0.2 mg L-1); E. plbs yang terbentuk pada
media M8 (½MS+air kelapa 100 ml L-1)
A
C
B
Respon eksplan terhadap media perlakuan pada 6 MST disajikan dalam Tabel 3.1. Media yang paling baik dalam mempertahankan warna hijau eksplan adalah media M5 (½MS+BAP 0.5 mg L-1+TDZ 0.5 mg L-1+2.4-D 0.2 mg L-1
Persentase eksplan hidup tertinggi sebesar 93.3% diamati pada media M5 (½MS+BAP 0.5 mg L
). Semakin lama eksplan dapat dipertahankan tetap berwarna hijau diduga akan memberi peluang semakin besar untuk terjadinya pembelahan sel-sel baru untuk membentuk kalus maupun diferensiasi sel membentuk plbs. Penelitian Vendrame
et al. (2007) menunjukkan bahwa eksplan anggrek Doritaenopsis yang tetap
berwarna hijau dalam media kultur menghasilkan jumlah embrio tertinggi pada 12 minggu setelah tanam (MST).
-1+TDZ 0.5 mg L-1+2.4-D 0.2 mg L-1) diikuti oleh media
M1 (½MS+BAP 0.5 mg L-1) sebesar 60%, media M4 (½MS+BAP 0.5 mg L
-1+TDZ 1.5 mg L-1) sebesar 53.3%, M3 (½MS+BAP 0.5 mg L-1+TDZ 1.0 mg L-1)
sebesar 46.6%, M6 (½MS+BAP 0.5 mg L-1+TDZ 1.0 mg L-1+2.4-D 0.4 mg L-1)
sebesar 33.3% dan M8 (½MS+air kelapa 100 ml L-1) sebesar 33.3% dan paling rendah pada M2 (½MS+BAP 0.5 mg L-1+TDZ 0.5 mg L-1) dan M7 (½MS+BAP 0.5 mg L-1+TDZ 1.5 mg L-1+2.4-D 0.6 mg L-1) masing-masing sebesar 20%. Pada media M2 (½MS+BAP 0.5 mg L-1+TDZ 0.5 mg L-1) dan media M7 (½MS+BAP 0.5 mg L-1+TDZ 1.5 mg L-1+2.4-D 0.6 mg L-1) warna eksplan dari hijau berubah menjadi kuning dan coklat dengan persentase sebesar 80% serta kalus dan plbs tidak terbentuk dari eksplan.
Tabel 3.1 Respon eksplan daun yang diisolasi dari planlet anggrek Phalaenopsis
pada berbagai komposisi media induksi protocorm-like bodies (plbs)
pada 6 minggu setelah tanam (MST)
Media Jumlah eksplan Warna eksplan Persentase eksplan Hijau Kuning Coklat Hidup Membentuk kalus Membentuk
Penggunaan zat pengatur tumbuh di dalam media kultur jaringan tergantung pada tujuan atau arah pertumbuhan tanaman yang diinginkan (Jimenez, 2005). Komposisi media tumbuh mempunyai peran yang sangat penting dalam induksi pembentukan plbs maupun regenerasi tanaman. Salah satu komponen media yang
menentukan keberhasilan kultur jaringan adalah jenis dan konsentrasi zat pengatur tumbuh. Penambahan zat pengatur tumbuh eksogen kedalam media kultur dapat meningkatkan konsentrasi zat pengatur tumbuh endogen di dalam sel, sehingga memicu proses tumbuh dan perkembangan jaringan tanaman. Proses pembentukan organ seperti tunas atau akar dipengaruhi oleh interaksi antara zat pengatur tumbuh eksogen yang ditambahkan ke dalam media dengan zat pengatur tumbuh endogen yang diproduksi oleh jaringan tanaman (Satyavathi et al. 2004).
Perbandingan respon eksplan antara M1, M2, M3 dengan M5 pada Tabel 3.1 memperlihatkan bahwa kombinasi BAP, TDZ dan 2.4-D menghasilkan respon eksplan lebih baik dibandingkan media yang hanya menggunakan BAP maupun kombinasi BAP dan TDZ saja. Kombinasi tiga zat pengatur tumbuh (BAP, TDZ dan 2.4-D) dengan konsentrasi yang lebih tinggi dari TDZ 0.5 mg L-1 dan 2.4-D 0.2 mg L-1
Hasil penelitian ini menunjukkan bahwa konsentrasi BAP 0.5 mg L tidak dapat meningkatkan respon pembentukan plbs dari eksplan
seperti terlihat pada media M6 dan M7. Konsentrasi TDZ dan 2.4-D yang lebih tinggi dibanding konsentrasi dalam media M5 kemungkinan justru menghambat pertumbuhan eksplan membentuk plbs. Penelitian Nayak et al. (2002)
menunjukkan bahwa penggunaan TDZ dan 2.4-D di atas konsentrasi 4.5 µM dapat menghambat pertumbuhan dan perkembangan eksplan anggrek
Dendrobium. Chang dan Chang (2000) menyatakan bahwa TDZ yang
terakumulasi menjadi sangat tinggi konsentrasinya dapat menghambat pembelahan sel.
-1
cukup baik untuk induksi plbs yang terlihat dari respon eksplan pada media M1.
Jika media dengan BAP 0.5 mg L-1 ditambahkan dengan TDZ 0.5 mg L-1 (M2) ataupun TDZ 1.0 mg L-1 (M3) maka pembentukan plbs akan menurun. Jika
kedalam media M2 ditambahkan 2.4-D 0.2 mg L-1 (M5) maka pembentukan plbs
meningkat. Hasil ini menunjukkan bahwa kemungkinan perimbangan auksin dan sitokinin berpengaruh terhadap pembentukan plbs. Rianawati et al. (2009)
menyatakan bahwa konsentrasi 2.4-D 0.2 mg L-1 mampu menginduksi sel-sel untuk proses embriogenesis pada anggrek Phalaenopsis. Keberhasilan
pembentukan kalus dari tepi daun dimulai dengan pembengkakan eksplan karena adanya 2.4-D, diikuti oleh inisiasi massa kalus yang terlihat dari tepi daun yang luka. Auksin (2.4-D) berperan terhadap pelonggaran dinding sel dengan melepaskan ikatan hidrogen yang terdapat pada dinding sel (Chen dan Chang, 2001). Zat pengatur tumbuh seperti thidiazuron sangat penting untuk proses
morfogenesis in vitro ataupun embriogenesis somatik karena potensinya sebagai
Tabel 3.2 Komposisi hormon alami dalam air kelapa
Jenis zat pengatur tumbuh Konsentrasi (nM)
Auksin
trans-zeatin O-glucoside
trans-zeatin riboside
Gibberellin3 16.7 37.8
Sumber : Yong et al. (2009).
Media yang hanya diberikan air kelapa (M8) hanya menginduksi plbs
sebesar 7% dari eksplan. Hal tersebut kemungkinan disebabkan oleh konsentrasi auksin dan sitokinin alami yang terkandung dalam air kelapa belum mencukupi untuk menginduksi pembentukan plbs eksplan. Hasil penelitian sebelumnya,
menunjukkan jenis auksin dan sitokinin yang terkandung dalam air kelapa sebagaimana disajikan pada Tabel 3.2. Penggunaan sitokinin dan auksin dalam satu media dapat memacu proliferasi tanaman in vitro karena adanya pengaruh
sinergisme antara zat pengatur tumbuh tersebut (Davies, 1995).
Perubahan eksplan menjadi coklat atau hitam menunjukkan adanya kematian jaringan akibat senyawa fenolik yang keluar dari jaringan eksplan yang terluka. Senyawa fenolik yang terbentuk dapat terdifusi kedalam media sehingga mematikan eksplan. Seperti yang di informasikan oleh Rittirat et al. (2012),
pencoklatan disebabkan oleh akumulasi senyawa fenolik akibat stres yang terjadi pada eksplan. Akumulasi senyawa fenolik tersebut berubah menjadi senyawa benzoik dengan adanya oksigen dan enzim peroksidase akan menurunkan kapasitas pertumbuhan dan regenerasi eksplan yang pada akhirnya menyebabkan kematian eksplan.
Kombinasi sitokinin (BAP, TDZ) dan auksin (2.4-D) memberikan hasil yang maksimal untuk menstimulasi pembentukan plbs anggrek Phalaenopsis.
Penambahan lebih dari satu macam zat pengatur tumbuh ke dalam media telah banyak dilaporkan. Kuo et al. (2007) melaporkan laju multiplikasi embriogenesis
Phalaenopsis tertinggi di hasilkan dalam media ½MS dengan penambahan TDZ
4.54 µM (9.99 mg L-1) dan BAP 4.4 µM (9.91 mg L-1) pada 30 hari setelah tanam (HST). Hasil penelitian Naing et al. (2011) menunjukkan bahwa komposisi media
Demikian juga hasil penelitian Mulgund et al. (2011), yang menggunakan media
VW+NAA 13.42 µM (24.9 mg L-1)+IBA 9.8 µM (19.9 mg L-1)+TDZ 11.35 µM (24.9 mg L-1
Konsentrasi 2.4-D yang tinggi (0.6 mg L
) menghasilkan persentase pertumbuhan plbs tertinggi (95%) pada
kultur anggrek Xenikophyton smeeanum.
-1
Eksplan yang membengkak terlihat pada media yang mengandung BAP, TDZ dan 2.4-D, sedangkan eksplan pada media M8 (½MS+air kelapa 100 ml L
) kemungkinan menyebabkan nekrosis pada sel. Jaringan tanaman yang mengalami nekrosis tersebut tidak dapat berkembang lebih lanjut. Senyawa 2,4-D merupakan auksin sintetik yang mampu bekerja sebagai herbisida pada kondisi tertentu (Martin dan Madassery 2006). Selain menjadi senyawa beracun, 2.4-D diduga menghambat pertumbuhan tanaman melalui perubahan jumlah kromosom dalam sel. Senyawa ini merupakan senyawa dengan keaktifan tinggi. Pada tanaman yang mampu melakukan
reaksi-reaksi β-oksidatif akan mengalami keracunan karena tanaman tersebut mampu
mengoksidasi butirat menjadi derivat asetat atau fenol. Fenol bersifat menghambat atau menonaktifkan tumbuhan (Kelley dan Riechers, 2007). Sifat dari zat pengatur tumbuh ini menjadikannya herbisida yang efektif dan spesifik hanya pada tanaman tertentu. Menurut Vanneste dan Frim (2009), kendali distribusi auksin menentukan suatu sel dari jaringan untuk melaksanakan perubahan spesifik dalam program perkembangan tanaman.
-1)
tidak menunjukkan respon pembengkakan. Hal tersebut menunjukkan bahwa hormon alami yang terkandung dalam air kelapa tidak bekerja optimal atau kandungannya belum mencukupi untuk mendorong pertumbuhan eksplan atau adanya kandungan asam absisik alami yang dapat menghambat pertumbuhan eksplan. Menurut Gnasekaran et al. (2010), penambahan air kelapa umumnya
digunakan sebagai senyawa organik kompleks pada kultur jaringan karena mengandung 1.3-Diphenylurea yang memiliki pengaruh yang sama dengan
sitokinin, akan tetapi air kelapa juga mengandung asam absisik (ABA) yang menghambat pertumbuhan plbs Phalaenopsis violacea. Komposisi hormon
lengkap yang terkandung dalam air kelapa dapat dilihat pada Lampiran 3.
Pembentukan liniklon pada populasi F2
Media M5 (½MS+BAP 0.5 mg L-1+TDZ 0.5 mg L-1+2.4-D 0.2 mg L-1
Respon pembengkakan bagian permukaan bawah daun diduga disebabkan oleh pengaruh auksin (2.4-D). Hal ini mengindikasikan bahwa elongasi ataupun pembesaran sel terjadi lebih cepat pada daerah permukaan bawah daun dari pada daerah permukaan atas daun. Hasil penelitian Chung et al. (2007) menunjukkan
bahwa laju multiplikasi embrio meningkat pada Dendrobium dengan penggunaan
eksplan daun. Dalam penelitian ini inisiasi plbs/embrio juga terbentuk di
pinggiran bawah daun. Hasil penelitian yang dilaporkan Gow et al. (2008)
menunjukkan orientasi eksplan anggrek Phalaenopsis secara signifikan
), merupakan media yang paling sesuai untuk induksi plbs pada populasi F2 anggrek
Phalaenopsis. Media tersebut selanjutnya diuji untuk induksi plbs pada 40 aksesi
F2 anggrek Phalaenopsis. Eksplan yang digunakan untuk induksi plbs sama
berpengaruh terhadap pembentukan plbs/embrio. Bagian permukaan bawah daun
yang menempel pada media memiliki respon embriogenik lebih tinggi dari pada bagian permukaan atas daun.
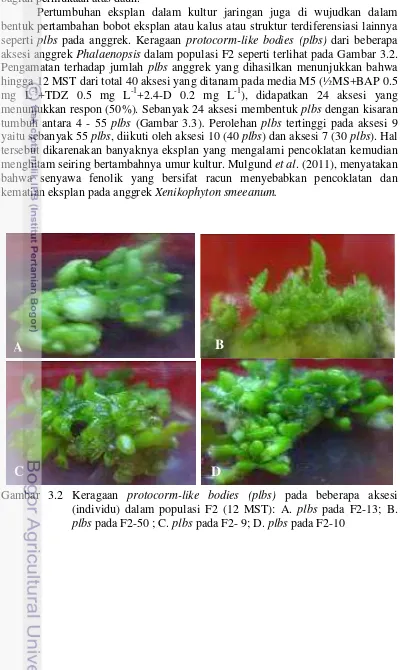
Pertumbuhan eksplan dalam kultur jaringan juga di wujudkan dalam bentuk pertambahan bobot eksplan atau kalus atau struktur terdiferensiasi lainnya seperti plbs pada anggrek. Keragaan protocorm-like bodies (plbs) dari beberapa
aksesi anggrek Phalaenopsis dalam populasi F2 seperti terlihat pada Gambar 3.2.
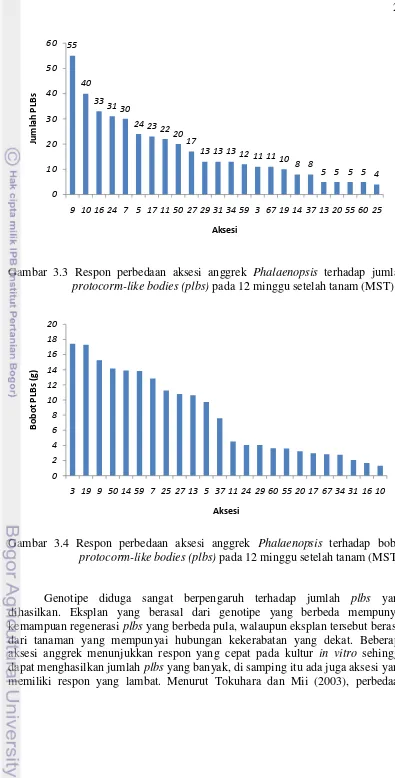
Pengamatan terhadap jumlah plbs anggrek yang dihasilkan menunjukkan bahwa
hingga 12 MST dari total 40 aksesi yang ditanam pada media M5 (½MS+BAP 0.5 mg L-1+TDZ 0.5 mg L-1+2.4-D 0.2 mg L-1), didapatkan 24 aksesi yang menunjukkan respon (50%). Sebanyak 24 aksesi membentuk plbs dengan kisaran
tumbuh antara 4 - 55 plbs (Gambar 3.3). Perolehan plbs tertinggi pada aksesi 9
yaitu sebanyak 55 plbs, diikuti oleh aksesi 10 (40 plbs) dan aksesi 7 (30 plbs). Hal
tersebut dikarenakan banyaknya eksplan yang mengalami pencoklatan kemudian menghitam seiring bertambahnya umur kultur. Mulgund et al. (2011), menyatakan
bahwa senyawa fenolik yang bersifat racun menyebabkan pencoklatan dan kematian eksplan pada anggrek Xenikophyton smeeanum.
Gambar 3.2 Keragaan protocorm-like bodies (plbs) pada beberapa aksesi
(individu) dalam populasi F2 (12 MST): A. plbs pada F2-13; B. plbs pada F2-50 ; C. plbs pada F2- 9; D. plbs pada F2-10
A
B
Gambar 3.3 Respon perbedaan aksesi anggrek Phalaenopsis terhadap jumlah
protocorm-like bodies (plbs) pada 12 minggu setelah tanam (MST)
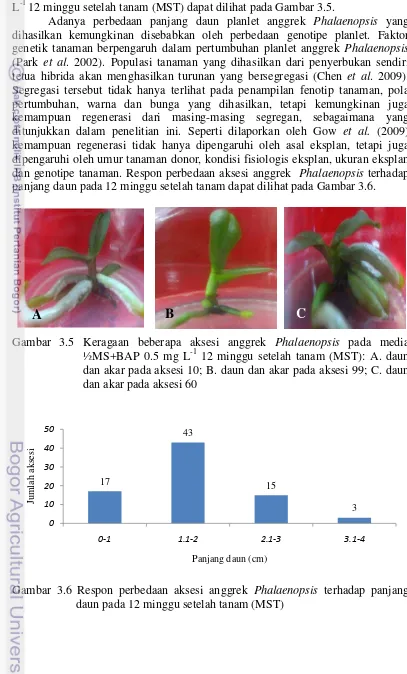
Gambar 3.4 Respon perbedaan aksesi anggrek Phalaenopsis terhadap bobot
protocorm-like bodies (plbs) pada 12 minggu setelah tanam (MST)
Genotipe diduga sangat berpengaruh terhadap jumlah plbs yang
dihasilkan. Eksplan yang berasal dari genotipe yang berbeda mempunyai kemampuan regenerasi plbs yang berbeda pula, walaupun eksplan tersebut berasal
dari tanaman yang mempunyai hubungan kekerabatan yang dekat. Beberapa aksesi anggrek menunjukkan respon yang cepat pada kultur in vitro sehingga
dapat menghasilkan jumlah plbs yang banyak, di samping itu ada juga aksesi yang
genotipe menyebabkan adanya variasi respon kemampuan regenerasi pada enam kultivar anggrek Phalaenopsis dalam menghasilkan regeneran, dimana Phal.
Reichentea memiliki kemampuan menghasilkan regeneran lebih tinggi (119
regeneran) dibanding Phal. Littke Steve (41 regeneran), Phal. Weeding
Promenade (36 regeneran), Phal. Snow Parade (21 regeneran), dan Phal.
Hanaboushin (14 regeneran) pada 10 bulan setelah kultur. Respon perbedaan
pembentukan plbs pada berbagai aksesi dapat dilihat pada Gambar 3.3.
Pengamatan bobot plbs dari berbagai aksesi menunjukkan bobot plbs
tertinggi diperoleh pada aksesi 3 yaitu sebesar 17.45 g, diikuti oleh aksesi 19 sebesar 17.3 g dan aksesi 9 yaitu 15.24 g dan bobot plbs terendah terdapat pada
aksesi 10 sebesar 1.3 g, diikuti oleh aksesi 16 sebesar 1.68 g dan aksesi 31 yaitu 2.08 g (Gambar 3.4). Variasi kisaran bobot plbs yang dihasilkan masing-masing
aksesi anggrek Phalaenopsis mengindikasikan bahwa aksesi yang cepat merespon
dalam kultur in vitro mampu menghasilkan bobot plbs yang lebih tinggi.
Sebaliknya aksesi yang responnya lambat menghasilkan bobot plbs yang rendah.
Tingginya bobot plbs yang dihasilkan cenderung berbanding terbalik dengan
jumlah plbs yang dihasilkan. Sebagai contoh pada aksesi 3 yang mempunyai
bobot plbs tertinggi (17.5 g) menghasilkan jumlah plbs yang rendah (11 plbs) dan
pada aksesi 10, bobot plbs rendah (1.3 g) namun menghasilkan jumlah plbs yang
tinggi (40 plbs) (Gambar 3.4). Hal tersebut disebabkan banyaknya kalus yang
terbentuk pada aksesi 3, sementara plbs yang terbentuk hanya sedikit.
Cepat atau lambatnya respon dari berbagai aksesi anggrek selain disebabkan oleh faktor genetik, juga karena faktor fisiologis eksplan. Sebagai contoh kandungan auksin endogen pada eksplan, meskipun eksplan yang digunakan secara morfologi seragam namun tidak dapat diukur secara pasti. Menurut Yu dan Omelko (2008), secara in vitro tanaman memiliki potensi yang
luas karena regenerasi bisa terjadi dari jaringan vaskuler tanaman. Walaupun demikian morfogenesis tersebut di pengaruhi oleh faktor internal dan eksternal.
Induksi Tunas Samping
Induksi tunas samping dari eksplan planlet populasi F2 bertujuan untuk menghasilkan tunas baru yang secara genetik sama dengan eksplan planlet induk dan untuk menekan variasi somaklonal akibat organogenesis tidak langsung melalui kalus dan plbs (Kosir et al. 2004). Penggunaan zat pengatur tumbuh
dalam kultur jaringan tanaman sangat penting, yaitu untuk mengontrol organogenesis dan morfogenesis dalam pembentukan dan perkembangan tunas serta akar (Gaba, 2005) Pembentukan tunas in vitro sangat menentukan
keberhasilan produksi bibit yang cepat dan banyak. Semakin banyak tunas yang terbentuk akan berkorelasi positif dengan banyaknya bibit yang dapat dihasilkan melalui kultur jaringan (Chen dan Chang, 2006).
Nilai rata-rata yang diperoleh pada karakter kuantitatif yang diamati secara
in vitro, hingga 12 MST menunjukkan belum ada aksesi yang membentuk tunas
samping. Hasil ini menunjukkan bahwa komposisi media kultur (½MS+BAP 0.5 mg L-1) belum mampu mendorong tumbuhnya tunas aksilar dari ketiak daun
ataupun tunas adventif yang biasanya juga bisa tumbuh dari akar. Tunas aksilar merupakan tunas yang tumbuh dari bakal mata tunas atau preexisting meristem
preexisting meristem (Begum et al. 2002). Anggrek Phalaenopsis merupakan tipe
tanaman monopodial, yang pertumbuhan batangnya vertikal pada satu titik tumbuh dan memiliki dominansi apikal yang kuat (Kisor dan Devi, 2009). Keragaan beberapa aksesi anggrek Phalaenopsis pada media ½MS+BAP 0.5 mg
L-1
12 minggu setelah tanam (MST) dapat dilihat pada Gambar 3.5.
Adanya perbedaan panjang daun planlet anggrek Phalaenopsis yang
dihasilkan kemungkinan disebabkan oleh perbedaan genotipe planlet. Faktor genetik tanaman berpengaruh dalam pertumbuhan planlet anggrek Phalaenopsis
(Park et al. 2002). Populasi tanaman yang dihasilkan dari penyerbukan sendiri
tetua hibrida akan menghasilkan turunan yang bersegregasi (Chen et al. 2009).
Segregasi tersebut tidak hanya terlihat pada penampilan fenotip tanaman, pola pertumbuhan, warna dan bunga yang dihasilkan, tetapi kemungkinan juga kemampuan regenerasi dari masing-masing segregan, sebagaimana yang ditunjukkan dalam penelitian ini. Seperti dilaporkan oleh Gow et al. (2009)
kemampuan regenerasi tidak hanya dipengaruhi oleh asal eksplan, tetapi juga dipengaruhi oleh umur tanaman donor, kondisi fisiologis eksplan, ukuran eksplan dan genotipe tanaman. Respon perbedaan aksesi anggrek Phalaenopsis terhadap
panjang daun pada 12 minggu setelah tanam dapat dilihat pada Gambar 3.6.
Gambar 3.5 Keragaan beberapa aksesi anggrek Phalaenopsis pada media
½MS+BAP 0.5 mg L-1 12 minggu setelah tanam (MST): A. daun dan akar pada aksesi 10; B. daun dan akar pada aksesi 99; C. daun dan akar pada aksesi 60
Gambar 3.6 Respon perbedaan aksesi anggrek Phalaenopsis terhadap panjang
Gambar 3.7 Responperbedaan aksesi anggrek Phalaenopsis terhadap lebar daun
pada 12 minggu setelah tanam (MST)
Gambar 3.8 Kisaran jumlah akar planlet anggrek Phalaenopsis pada 12 minggu
setelah tanam (MST)
Pengamatan terhadap lebar daun menunjukkan sebanyak lima puluh satu aksesi menghasilkan kisaran lebar daun 0.6 cm - 1 cm. Sedangkan kisaran lebar daun 1.6 cm – 2 cm hanya dihasilkan dari dua aksesi (Gambar 3.7). Hal tersebut mengindikasikan bahwa kemampuan regenerasi masing-masing aksesi anggrek
Phalaenopsis tidak sama. Penelitian Chen et al. (2009) menunjukkan bahwa,
Phal. aphrodite memiliki kemampuan regenerasi lebih baik dibanding Phal.
amabilis, Phal. gigantea, Phal. hieroglyphica, Phal. phillipinensis, Phal.
schilleriana dan Phal. bellina. Respon perbedaan aksesi anggrek Phalaenopsis
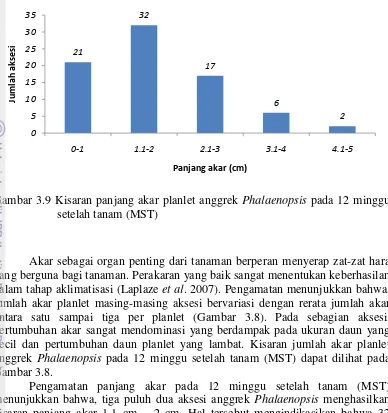
Gambar 3.9 Kisaran panjang akar planlet anggrek Phalaenopsis pada 12 minggu
setelah tanam (MST)
Akar sebagai organ penting dari tanaman berperan menyerap zat-zat hara yang berguna bagi tanaman. Perakaran yang baik sangat menentukan keberhasilan dalam tahap aklimatisasi (Laplaze et al. 2007). Pengamatan menunjukkan bahwa,
jumlah akar planlet masing-masing aksesi bervariasi dengan rerata jumlah akar antara satu sampai tiga per planlet (Gambar 3.8). Pada sebagian aksesi, pertumbuhan akar sangat mendominasi yang berdampak pada ukuran daun yang kecil dan pertumbuhan daun planlet yang lambat. Kisaran jumlah akar planlet anggrek Phalaenopsis pada 12 minggu setelah tanam (MST) dapat dilihat pada
Gambar 3.8.
Pengamatan panjang akar pada 12 minggu setelah tanam (MST) menunjukkan bahwa, tiga puluh dua aksesi anggrek Phalaenopsis menghasilkan
kisaran panjang akar 1.1 cm – 2 cm. Hal tersebut mengindikasikan bahwa 32 aksesi tersebut diduga memiliki respon yang hampir sama cepatnya pada kultur in
vitro. Aksesi anggrek yang menghasilkan kisaran panjang akar 4.1 cm – 5 cm
hanya dihasilkan dari dua aksesi (Gambar 3.9). Pertambahan panjang akar disebabkan terjadinya proses pembelahan sel pada meristem ujung akar, selanjutnya diikuti oleh proses pemanjangan dan pembesaran sel (Martin dan Madassery, 2006). Kisaran panjang akar planlet anggrek Phalaenopsis pada 12
minggu setelah tanam (MST) dapat dilihat pada Gambar 3.9.
Aksesi anggrek Phalaenopsis yang menghasilkan panjang dan lebar daun
tertinggi cenderung berbanding terbalik dengan jumlah dan panjang akar yang dihasilkan. Hal tersebut disebabkan oleh perbedaan genotipe aksesi anggrek
Phalaenopsis, sehingga respon masing-masing aksesi anggrek pada kultur in vitro