POTENSI BUAH SIRIH HUTAN (
Piper aduncum
) SEBAGAI
INSEKTISIDA BOTANI TERHADAP LARVA
Crocidolomia pavonana
DADANG MUHAMMAD HASYIM
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI TESIS DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa tesis Potensi Buah Sirih Hutan (Piper aduncum) sebagai Insektisida Botani terhadap Larva Crocidolomia pavonana adalah karya saya dengan arahan dari Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada perguruan tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir tesis ini.
Bogor, Agustus 2011
ABSTRACT
DADANG MUHAMMAD HASYIM. Potential of Piper aduncum Fruit as Botanical Insecticide against Crocidolomia pavonana Larvae. Under direction of TUN TEDJA IRAWADI and DJOKO PRIJONO.
Injudicious use of synthetic insecticides can cause a variety of negative impacts on human and other nontarget organisms as well as the environment. One of the efforts to alleviate the problems is by utilizing bioactive compounds from plants as botanical insecticides. Piper aduncum is one of plant species that is active against insects. Insecticidal activity of its leaves has been widely reported, while that of the other plant parts including fruits has not been reported. The purpose of this research was to screen the potency of active compounds of P. aduncum fruits as botanical insecticide against Crocidolomia pavonana larvae. Sequential extraction of P. aduncum fruits was performed with maceration method using hexane, ethyl acetate, and methanol. The phytochemical tests of P. aduncum fruit extracts and leaf powder were done by qualitative method. The bioassays were conducted by a leaf-feeding method. Second-instar larvae were fed treated broccoli leaves for 48 hours, then were presented with untreated leaves until the surviving larvae reached the fourth-instar stage. The results showed that
P. aduncum fruits contain alkaloid, flavonoid, saponin, tannin, and steroid compounds. The hexane extract of P. aduncum fruits had the strongest insecticidal activity against C. pavonana larvae (LC50 0.13% and LC95 0.26%) followed by
ethyl acetate and methanol extract. Fractionation of hexane extract by column chromatography yielded ten fractions. Fraction 1 possessed the strongest insecticidal activity against C. pavonana larvae (LC50 339.35 ppm and LC95
768.72 ppm). Results of gas chromatography-mass spectrometry and Fourier transform infrared analysis showed that fraction 1 contains dillapiole (68.8%), myristicin (4.87%), β-sitosterol (3.24%), and piperitone (2.53%).
RINGKASAN
DADANG MUHAMMAD HASYIM. Potensi Buah Sirih Hutan (Piper aduncum) sebagai Insektisida Botani terhadap Larva Crocidolomia pavonana. Dibimbing oleh TUN TEDJA IRAWADI dan DJOKO PRIJONO.
Penggunaan insektisida sintetik yang tidak bijaksana dapat menyebabkan berbagai dampak negatif terhadap manusia dan organisme bukan sasaran lainnya maupun lingkungan. Salah satu upaya untuk mengurangi permasalahan akibat penggunaan insektisida sintetik ialah dengan memanfaatkan senyawa aktif dari tumbuhan sebagai insektisida botani. Sirih hutan (Piper aduncum) merupakan salah satu jenis tumbuhan yang memiliki potensi sebagai insektisida botani. Aktivitas insektisida daun tumbuhan tersebut telah banyak dilaporkan, sementara bagian tumbuhan lainnya termasuk buah belum pernah dilaporkan. Penelitian ini bertujuan mengetahui potensi dan mengidentifikasi komponen aktif buah sirih hutan sebagai insektisida botani terhadap larva Crocidolomia panonana.
Analisis proksimat dilakukan pada buah sirih hutan meliputi analisis kadar air, kadar abu, kadar protein, kadar lemak, dan kadar karbohidrat (by difference). Ekstraksi buah sirih hutan dilakukan dengan metode maserasi menggunakan pelarut n-heksana, etil asetat, dan metanol secara bertahap. Pengujian fitokimia dilakukan pada ekstrak dan serbuk buah sirih hutan. Kelompok senyawa yang ingin diketahui dalam analisis kualitatif ialah alkaloid, flavonoid, saponin, tanin, hidrokuinon, triterpenoid, dan steroid. Ekstrak teraktif difraksinasi dengan menggunakan kromatografi kolom gel silika. Fase geraknya menggunakan pelarut n-heksana-metanol dengan metode step gradient. Mula-mula sampel dielusi dengan n-heksana, kemudian secara bertahap ditingkatkan kepolarannya dengan menambahkan aseton dengan berbagai perbandingan dan diakhiri dengan metanol. Setiap fraksi diperiksa dengan menggunakan kromatografi lapis tipis (KLT). Noda dengan nilai Rf yang sama disatukan menjadi satu fraksi. Fraksi teraktif dikarakterisasi dengan menggunakan kromatografi gas-spektrometer massa (GC-MS) dan spektrofotometer inframerah transformasi Fourier (FTIR).
Uji aktivitas insektisida dilakukan terhadap ekstrak dan fraksi dengan metode residu pada daun melalui dua tahap, yaitu uji pendahuluan dan uji lanjutan. Formulasi insektisida komersial Agrimec 18 EC (b.a. abamektin 18.4 g/l) juga diuji sebagai kontrol positif. Abamektin merupakan salah satu homolog dari avermektin yang diperoleh dari hasil fermentasi bakteri tanah, Streptomyces avermitilis. Pada uji pendahuluan, setiap perlakuan dan kontrol diulang tiga kali, sedangkan uji lanjutan diulang enam kali. Larva instar II C. pavonana diberi makan daun perlakuan selama 48 jam, kemudian larva diberi makan daun segar tanpa perlakuan. Larva yang bertahan hidup dipelihara sampai instar IV, sementara jumlah larva yang mati dicatat setiap hari. Data mortalitas kumulatif diolah dengan analisis probit, sedangkan data lama perkembangan larva dari instar II ke instar IV diolah dengan sidik ragam, yang dilanjutkan dengan uji jarak berganda Duncan.
dan steroid. Di antara ketiga ekstrak yang diuji terhadap larva C. pavonana, ekstrak n-heksana buah sirih hutan memiliki aktivitas insektisida yang kuat (LC50
0.13% dan LC95 0.26%), diikuti ekstrak etil asetat dan metanol.
Hasil dari pemisahan dengan kromatografi kolom diperoleh 10 fraksi. Di antara fraksi-fraksi yang diuji, fraksi 1 (LC50 339.35 ppm dan LC95 768.72 ppm)
memiliki aktivitas insektisida yang paling kuat terhadap larva C. pavonana. Aktivitas fraksi 1 lebih kuat daripada ekstrak kasarnya. Berdasarkan nilai LC50
terhadap instar II+III, fraksi 1 sekitar 3.8 kali lebih toksik terhadap larva C. pavonana dibandingkan dengan ekstrak kasarnya, sedangkan berdasarkan nilai LC95 fraksi 1 tersebut sekitar 3.4 kali lebih toksik. Toksisitas fraksi 1 lebih rendah
daripada abamektin (LC50 7.85 ppm). Berdasarkan LC50 dibandingkan dengan
abamektin, toksisitas fraksi 1 sekitar 43.2 kali lebih rendah dan pada LC95 sekitar
42.8 kali lebih rendah. Hasil analisis dengan GC-MS dan FTIR menunjukkan bahwa komponen utama fraksi 1 diduga mengandung senyawa dilapiol (68.8%), miristisin (4.87%), β-sitosterol (3.24%), dan piperiton (2.53%).
© Hak Cipta milik IPB, tahun 2011
Hak Cipta dilindungi Undang-Undang
Dilarang mengutip sebagian atau seluruh karya tulis ini tanpa mencantumkan atau menyebutkan sumbernya. Pengutipan hanya untuk kepentingan pendidikan, penelitian, penulisan karya ilmiah, penyusunan laporan, penulisan kritik, atau tinjauan suatu masalah; dan pengutipan tersebut tidak merugikan kepentingan yang wajar IPB.
POTENSI BUAH SIRIH HUTAN (
Piper aduncum
) SEBAGAI
INSEKTISIDA BOTANI TERHADAP LARVA
Crocidolomia pavonana
DADANG MUHAMMAD HASYIM
Tesis
sebagai salah satu syarat untuk memperoleh gelar Magister Sains pada
Departemen Kimia
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Judul Tesis : Potensi Buah Sirih Hutan (Piper aduncum) sebagai Insektisida Botani terhadap Larva Crocidolomia pavonana Nama Mahasiswa : Dadang Muhammad Hasyim
NRP : G451090151
Disetujui Komisi Pembimbing
Prof. Dr. Ir. Tun Tedja Irawadi, MS. Ketua
Ir. Djoko Prijono, MAgrSc. Anggota
Diketahui
Ketua Program Studi Kimia
Prof. Dr. Dra. Purwantiningsih Sugita, MS.
Dekan Sekolah Pascasarjana
Dr. Ir. Dahrul Syah, M.Sc.Agr.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT pencipta segala partikel penyusun jagat raya yang tak terhingga dengan segala ke Maha Besaran-Nya. Shalawat dan salam tetap kami sampaikan untuk baginda Nabi Muhammad SAW, pembawa dan pemersatu umat dalam ikatan hidrogen yang tidak akan terputus hingga sampai nanti di alam yang kekal.
Atas bimbingan-Mu wahai Robb pemilik lautan ilmu, sehingga penulis dapat menyelesaikan tesis ini dengan judul “Potensi Buah Sirih Hutan (Piper aduncum sebagai Insektisida Botani terhadap Larva Crocidolomia pavonana”. Pada kesempatan ini, penulis mengucapkan terima kasih yang sebesar-sebesarnya kepada:
1. Ibu Prof. Dr. Ir. Tun Tedja Irawadi, MS. sebagai ketua komisi pembimbing yang telah memberikan pengarahan, bimbingan, motivasi, dan masukannya sampai penulis menyelesaikan penelitian ini.
2. Bapak Ir. Djoko Prijono, MAgrSc. sebagai anggota komisi pembimbing dan guru yang telah memberikan keteladanan mendalam akan arti sebuah ilmu pengetahuan. Semoga ilmu yang diberikan dapat bermanfaat di kehidupan mendatang. Terima kasih juga atas segala arahan, bimbingan, motivasi, saran, dan masukan yang diberikan kepada penulis sejak penyusunan proposal hingga selesainya penelitian ini.
3. Kementerian Agama Republik Indonesia yang telah membiayai studi dan penelitian ini.
4. Ayahanda dan Ibunda tercinta yang selama masa hidupnya telah memberikan kepercayaan, doa tulus ikhlasnya, dan pelajaran hidup yang sangat berharga kepada penulis. Doa yang selalu penulis panjatkan semoga Allah SWT mengampuni, merahmati, mengasihi, memaafkan, dan memasukkan keduanya sebagai salah seorang dari golongan jamaah-Nya yang dimuliakan. 5. Kakanda Umu Salamah, Drs. H. Agus M. Soleh, Asep Jaja, Lilis Aisyah
(Almh), dan seluruh keluarga yang telah memberi kepercayaan, dukungan, dan doa tulus ikhlasnya sehingga penulis dapat menyelesaikan studi ini.
6. Teman-teman Abdullah, M.Si, Achmad Muslim, M.Si, Ahmad Izzuddin, M.Si, Muslih Abdul Mujib, M.Si, Saaepudin Rahmatullah, M.Si, dan teman-teman Kimia angkatan 2009 atas dukungan dan kebersamaannya. Terima kasihku lebih dari bilangan Avogadro, karena ada kalianlah gaya antarmolekul antara kita menjadi kuat dan orbital elektron di dalamnya menjadi lebih hidup dan indah.
7. Rekan-rekan di Laboratorium Fisiologi dan Toksikologi Serangga, Eka Candra Lina, M.Si., Herma Amalia SP., Catur Hertika, S.Si., Ahmad Sifa, Nelly Nailufar, Hendi Irawan, Rizki Arifiansyah, dan Sani Nihlatussania yang telah banyak membantu dan kebersamaannya.
Akhir kata penulis berharap hasil penelitian dan tulisan ini dapat bermanfaat dan berguna sebagai bahan informasi dalam kemajuan ilmu pengetahuan alam.
RIWAYAT HIDUP
Penulis dilahirkan di Garut pada tanggal 15 Juli 1984 dari Ayah Aceng Kholil (Alm) dan Ibu Ipoh Napisah (Almh). Penulis merupakan putera keempat dari empat bersaudara.
Pada tahun 2003 penulis menyelesaikan pendidikan Madrasah Aliyah Negeri Cibatu-Garut. Pendidikan sarjana ditempuh di Jurusan Pendidikan Kimia, Fakultas Tarbiyah dan Keguruan Universitas Islam Negeri Sunan Gunung Djati Bandung dan lulus pada tahun 2008.
DAFTAR ISI
Halaman
DAFTAR TABEL ... xi
DAFTAR GAMBAR ... xii
DAFTAR LAMPIRAN ... xii
PENDAHULUAN ... 1
Latar Belakang ... 1
Tujuan Penelitian ... 3
Manfaat Penelitian ... 3
TINJAUAN PUSTAKA ... 4
Sirih Hutan ... 4
Crocilodolomia pavonana ... 6
BAHAN DAN METODE ... 9
Tempat dan Waktu ... 9
Bahan Tanaman Uji ... 9
Serangga Uji ... 9
Uji Proksimat ... 9
Penyiapan Ekstrak Kasar ... 10
Uji Fitokimia ... 10
Uji Aktivitas Insektisida ... 11
Pencarian Eluen Terbaik ... 13
Fraksinasi Ekstrak Teraktif dan Identifikasi Fraksi Teraktif ... 13
HASIL DAN PEMBAHASAN ... 14
Hasil Analisis Proksimat ... 14
Hasil Ekstraksi Buah Sirih Hutan ... 16
Hasil Analisis Fitokimia ... 17
Aktivitas Insektisida Ekstrak Buah Sirih Hutan terhadap Larva C. pavonana ... 19
Fraksinasi dengan Kromatografi Kolom ... 27
Aktivitas Insektisida Fraksi Buah Sirih Hutan terhadap Larva C. pavonana ... 30
Identifikasi Komponen Aktif ... 39
SIMPULAN DAN SARAN ... 43
DAFTAR PUSTAKA ... 45
DAFTAR TABEL
Halaman
1 Hasil analisis proksimat buah sirih hutan ... 14 2 Rendemen ekstrak buah sirih hutan dengan ekstraksi bertahap ... 17 3 Hasil uji fitokimia buah sirih hutan ... 18 4 Pengaruh ekstrak buah sirih hutan terhadap mortalitas larva
C. pavonana ... 20 5 Pengaruh ekstrak n-heksana buah sirih hutan terhadap mortalitas
larva C. pavonana ... 23 6 Penduga parameter hubungan konsentrasi-mortalitas ekstrak
n-heksana buah sirih hutan terhadap larva C. pavonana ... 24 7 Pengaruh ekstrak buah sirih hutan terhadap lama perkembangan
larva C. pavonana ... 25 8 Pengaruh ekstrak n-heksana buah sirih hutan pada berbagai
konsentrasi terhadap lama perkembangan larva C. pavonana ... 26 9 Fraksi-fraksi hasil kromatografi kolom ekstrak n-heksana buah
sirih hutan dengan fase diam gel silika dan eluen n-heksana-aseton
(7:3) ... 29 10 Pengaruh fraksi-fraksi buah sirih hutan terhadap mortalitas larva
C. pavonana ... 31 11 Pengaruh fraksi 1 buah sirih hutan dan abamektin terhadap
mortalitas larva C. pavonana ... 34 12 Penduga parameter hubungan konsentrasi-mortalitas fraksi 1 buah
sirih hutan dan abamektin terhadap larva C. pavonana ... 35 13 Pengaruh fraksi-fraksi buah sirih hutan terhadap lama
perkembangan larva C. pavonana ... 37 14 Pengaruh fraksi 1 buah sirih hutan terhadap lama perkembangan
DAFTAR GAMBAR
Halaman
1 Buah sirih hutan ... 4 2 Perkembangan mortalitas larva C. pavonana yang diberi perlakuan
ekstrak n-heksana buah sirih hutan selama 48 jam pada berbagai
konsentrasi dengan metode residu pada daun ... 22 3 Pola KLT gel silika dan nilai Rf ekstrak n-heksana buah sirih hutan
dengan eluen n-heksana-aseton (7:3) ... 28 4 Profil KLT hasil kromatografi kolom ekstrak n-heksana buah sirih
hutan dengan eluen n-heksana-aseton (7:3) ... 30 5 Perkembangan mortalitas larva C. pavonana yang diberi perlakuan
fraksi 1 buah sirih hutan dan abamektin selama 48 jam pada
berbagai konsentrasi dengan metode residu pada daun ... 33 6 Kromatogram fraksi 1 buah sirih hutan hasil GC-MS ... 39 7 Struktur dilapiol, miristisin, β-sitosterol, dan piperiton ... 40 8 Spektrum FTIR fraksi 1 buah sirih hutan menggunakan pelet
KBr ... 42
DAFTAR LAMPIRAN
Halaman
1 Hasil penentuan sampel tumbuhan sirih hutan ... 52 2 Diagram alir ekstraksi buah sirih hutan ... 53 3 Diagram alir fraksinasi ekstrak teraktif dan karakterisasi fraksi
teraktif buah sirih hutan ... 54 4 Hasil KLT pemilihan eluen terbaik ekstrak n-heksana buah sirih
PENDAHULUAN
Latar Belakang
Penggunaan insektisida sintetik di Indonesia masih sangat tinggi terutama pada tanaman sayuran. Petani sangat bergantung pada insektisida sintetik untuk menurunkan populasi serangga hama karena mudah dalam aplikasi dan dapat mengendalikan hama dalam waktu singkat (Metcalf 1982; Djojosumarto 2008). Penggunaan insektisida sintetik yang tidak bijaksana dapat menimbulkan dampak negatif, seperti terjadinya resistensi dan resurjensi hama, munculnya hama sekunder, terbunuhnya organisme bukan sasaran, pencemaran lingkungan, bahaya pada pemakai, serta adanya residu pada hasil panen (Metcalf 1982; Matsumura 1985; Kishi et al. 1995; Rush et al. 1997).
Salah satu alternatif untuk mengurangi dampak negatif akibat penggunaan insektisida sintetik ialah dengan memanfaatkan senyawa aktif dari tumbuhan sebagai insektisida botani. Golongan insektisida tersebut memiliki beberapa keunggulan, di antaranya mudah terurai di lingkungan, efektif terhadap hama sasaran, serta umumnya cukup aman terhadap musuh alami hama dan organisme bukan sasaran lainnya (Bentz & Neal 1995; Isman 1995; Schmutterer 1997; Kaufman et al. 2006). Kelebihan tersebut sejalan dengan konsep pengendalian hama terpadu (PHT) yang mensyaratkan penggunaan insektisida yang tidak menimbulkan dampak negatif bagi organisme bukan sasaran dan lingkungan.
Salah satu tumbuhan yang memiliki sifat insektisida dan berpotensi untuk dikembangkan sebagai sumber insektisida botani adalah sirih hutan (Piper aduncum, Piperaceae). Masyarakat sudah lama menggunakan sirih hutan untuk
bahan obat-obatan, seperti penyembuh luka, demam, radang perut, sakit gigi, penyakit hati, obat bisul, reumatik, dan diare, serta digunakan sebagai makanan burung, mamalia, dan kelelawar. Selain itu, sediaan tumbuhan tersebut dapat digunakan untuk mengendalikan serangga hama (Lepš et al. 2002; Mitchell & Ahmad 2006; Braga et al. 2007; Tene et al. 2007; Misni et al. 2008).
sirih hutan dapat mematikan larva nyamuk Aedes aegypti. Minyak atsiri daun sirih hutan juga dilaporkan dapat mematikan nyamuk A. aegypti (Misni et al. 2008) dan lalat Musca domestica (Mee et al. 2009). Salah satu senyawa aktif daun sirih hutan yang memiliki aktivitas insektisida ialah dilapiol (golongan fenilpropanoid). Perlakuan dengan dilapiol pada konsentrasi 0.1 ppm dapat mengakibatkan mortalitas larva nyamuk Aedes atropalpus 92% (Bernard et al. 1995). Selain itu, dilapiol juga memiliki aktivitas terhadap kumbang Cerotoma tingomarianus (Fazolin et al. 2005), kumbang Sitophilus zeamais (Estrela et al. 2006), serta dapat menurunkan kelangsungan hidup dan kemampuan reproduksi nyamuk A. aegypti (Rafael et al. 2008). Namun, aktivitas dilapiol terhadap hama pemakan
daun belum banyak dilaporkan.
Penelitian diperlukan untuk mengetahui potensi buah sirih hutan sebagai sumber insektisida botani untuk mengendalikan hama tanaman pertanian. Kerugian terhadap produksi pertanian akibat serangan hama khususnya pada tanaman sayuran sangat besar. Salah satu hama perusak tanaman adalah Crocidolomia pavonana, yang merupakan hama yang sangat merusak pada
tanaman sayuran famili Brassicaceae. Serangan hama tersebut dapat mengakibatkan kehilangan hasil panen kubis mencapai 65.8%-100% apabila tidak dilakukan pengendalian (Uhan 1993; Sastrosiswojo 1996).
Tujuan Penelitian
Penelitian ini bertujuan mengetahui potensi dan mengidentifikasi komponen aktif buah sirih hutan sebagai insektisida botani terhadap larva C. pavonana.
Manfaat Penelitian
TINJAUAN PUSTAKA
Sirih Hutan
Tumbuhan sirih hutan (Piper aduncum, Piperaceae) berasal dari Amerika dan diperkenalkan di Indonesia pada tahun 1860. Tumbuhan ini berbentuk semak-semak atau pohon kecil dan tumbuh di daerah tropis. Di daerah-daerah tertentu, sirih hutan tumbuh dengan baik pada ketinggian 90-1000 m dpl. Nama daerah sirih hutan di antaranya seuseureuhan dan gedebong (Sunda) (Heyne 1987).
Gambar 1 Buah sirih hutan
Sirih hutan kaya akan senyawa metabolit sekunder, yang termasuk dalam golongan alkaloid, fenilpropanoid, monoterpena, seskuiterpena, steroid, tanin, flavonoid, kuinon, flavanon, flavon, kromena, dan benzenoid (Parmar et al. 1997; Taylor 2006; Braga et al. 2007).
2,2-dimetil-2H-1-kromena-6-karboksilat, 1 senyawa dihidrokalkon [2’,6’-dihidroksi-4’-metoksidihidrokalkon], 1 senyawa flavanon [pinosembrin], 1 senyawa steroid [β-sitosterol], dan 1 senyawa terpenoid [nerolidol] (Parmar et al. 1998; Baldoqui et al. 1999; Flores et al. 2009; Lago et al. 2009). Sementara itu, Torres-Santos et
al. (1999) mengisolasi senyawa 2’,6’-dihidroksi-4’-metoksikalkon dari bunga
sirih hutan.
Minyak atsiri daun dan batang sirih hutan mengandung senyawa golongan monoterpena masing-masing 45.2% dan 52.0%, serta golongan seskuiterpena masing-masing 66.9% dan 24.5% (Navickiene et al. 2006). Rali et al. (2007) melaporkan bahwa minyak atsiri daun sirih hutan mengandung dilapiol 43.3%, β -kariofilena 8.2%, piperiton 6.7%, α-humulena 5.1% dan senyawa lainnya masing-masing kurang dari 5%.
Tumbuhan sirih hutan memiliki berbagai aktivitas biologi, termasuk aktivitas terhadap serangga hama. Beberapa informasi dasar tentang aktivitas bagian tumbuhan tersebut telah diketahui. Bernard et al. (1995) melaporkan bahwa perlakuan dengan fraksi n-heksana, fraksi diklorometana, fraksi etil asetat, dan fraksi metanol daun sirih hutan pada konsentrasi 100 ppm dapat mematikan larva nyamuk A. atropalpus berturut-turut sebesar 26%, 72%, 2%, dan 0%. Selain itu, perlakuan dilapiol pada konsentrasi 0.1 ppm dapat menyebabkan mortalitas larva nyamuk A. atropalpus sebesar 92%.
Dilapiol yang diisolasi dari daun sirih hutan juga dilaporkan mempunyai aktivitas insektisida terhadap kumbang Cerotoma tingomarianus. Pada aplikasi kontak dengan konsentrasi 1% dapat mengakibatkan mortalitas hampir 100%, sedangkan pada aplikasi topikal mengakibatkan mortalitas berkisar 5%-30% (Fazolin et al. 2005). Estrela et al. (2006) juga melaporkan bahwa dilapiol mempunyai aktivitas insektisida terhadap kumbang Sitophilus zeamais pada aplikasi kontak dengan LC50 2.87 µL/cm2, pada aplikasi fumigan dengan LC50
0.56 µL/g, dan pada aplikasi topikal dengan LD50 0.03 µL/g. Sementara itu, Silva
et al. (2009) membandingkan aktivitas ekstrak n-heksana, etil asetat, dan etanol
penurunan reproduksi sebesar 12.5%-54.2%. Selain itu, minyak atsiri yang diujikan dapat menyebabkan mortalitas larva 100% pada konsentrasi 0.1 mg/mL.
Penelitian buah sirih hutan masih terbatas pada sifat kimianya, Jamal et al. (2003) melaporkan bahwa minyak atsiri buah sirih hutan mengandung senyawa golongan monoterpena 8.58%, seskuiterpena 14.79%, dan fenilpropanoid 56.28%, dan komponen lainnya sebesar 20.35%. Sementara itu, Navickiene et al. (2006) melaporkan bahwa minyak atsiri buah sirih hutan mengandung senyawa golongan monoterpena 85.1% dan seskuiterpena 10.6%.
Crocidolomia pavonana
Crocidolomia pavonana (F.) (Lepidoptera: Crambidae) yang sebelumnya
dikenal sebagai C. binotalis Zeller merupakan salah satu hama penting yang menyerang tanaman sayuran famili Brassicaceae, seperti kubis, kubis bunga, kubis cina, mostar, lobak, dan sawi liar. Hama ini tersebar di Afrika Selatan, Asia Tenggara, Australia, dan Kepulauan di Samudera Pasifik. Di Pulau Jawa serangga ini ditemukan baik di dataran rendah maupun di dataran tinggi (Kalshoven 1981).
Perkembangan C. pavonana bertipe holometabola (metamorfosis sempurna) yang melewati empat fase, yaitu telur, larva, pupa, dan imago. Telur C. pavonana diletakkan secara berkelompok yang tersusun seperti atap genting pada permukaan bawah daun. Setiap kelompok rata-rata terdiri atas 10 sampai 300 butir telur. Telur-telur tersebut berwarna hijau muda atau kekuningan dan berubah warna menjadi kemerahan pada saat akan menetas. Lama stadium telur rata-rata 4-5 hari pada suhu 25-28 °C (Prijono & Hassan 1992).
perkembangan larva secara keseluruhan 8-14 hari pada suhu 25-28 °C dengan kelembapan relatif 60-70% (Prijono & Hassan 1992).
Fase pupa berlangsung dengan cara membentuk benang sutera untuk merekatkan butiran-butiran tanah yang menyelubungi tubuhnya. Pupa normal yang terbentuk pada awalnya berwarna kuning kecokelatan kemudian berubah warna menjadi cokelat tua, dengan lama stadium 11-13 hari. Setelah itu terbentuk imago yang bersifat nokturnal. Imago memiliki toraks berwarna gelap dan abdomen berwarna merah kecokelatan. Imago jantan mudah dikenal dengan adanya sisik berwarna gelap/hitam pada tepi interior sayap depan. Rentang sayap imago betina sekitar 25 mm sedangkan imago jantan sekitar 24 mm. Ukuran tubuh imago jantan lebih panjang (sekitar 11.4 mm) daripada yang betina (sekitar 9.6 mm). Imago betina yang diberi makan larutan madu 10% menghasilkan telur 35-459 butir dan dapat hidup selama 1-2 minggu. Siklus hidup imago betina sekitar 23-28 hari, sedangkan imago jantan sekitar 24-29 hari (Prijono & Hassan 1992).
Pengendalian hama C. pavonana umumnya dilakukan dengan menggunakan insektisida sintetik. Namun, penggunaan insektisida sintetik dalam menekan populasi hama dengan cepat dapat menimbulkan dampak yang tidak diinginkan. Pengendalian secara biologi dapat dilakukan dengan melestarikan musuh alami (parasitoid) seperti Eriborus argenteopilosus dan Palexorista inconspicuoides (Sastrosiswojo & Setiawati 1992). Namun, cara-cara tersebut belum dapat menekan populasi hama secara efektif. Insektisida botani merupakan salah satu alternatif pengendalian yang cukup aman sesuai konsep pengendalian hama terpadu.
Larva C. pavonana sering digunakan sebagai hewan uji dalam penelitian senyawa aktif insektisida. Syahputra et al. (2004) menggunakan larva ini untuk menguji aktivitas ekstrak kulit batang tumbuhan famili Clusiaceae, Lecythidaceae, Meliaceae, dan Sapindaceae. Prijono (2005) menggunakan larva ini untuk membandingkan secara kuantitatif aktivitas penghambat perkembangan serangga dari ekstrak empat jenis tumbuhan, yaitu Aglaia odorata, A. odoratissima, Dysoxylum acutangulum, dan A. mollissimum. Prijono et al. (2006) menggunakan
BAHAN DAN METODE
Tempat dan Waktu
Penelitian ini dilakukan di Laboratorium Kimia Analitik, Departemen Kimia, Institut Pertanian Bogor (IPB), Laboratorium Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman IPB, Pusat Penelitian Sumberdaya Hayati dan Bioteknologi LPPM IPB, Pusat Laboratorium Forensik Mabes POLRI Jakarta, dan Pusat Laboratorium Terpadu UIN Syarif Hidayatullah Jakarta. Penelitian dilaksanakan dari Desember 2010 sampai dengan Juli 2011.
Bahan Tanaman Uji
Bahan tanaman yang digunakan dalam penelitian ini adalah buah sirih hutan yang diperoleh dari areal kampus Institut Pertanian Bogor (IPB) Darmaga, kemudian dilakukan determinasi di Herbarium Bogoriense, Bogor. Hasil penentuan sampel tumbuhan sirih hutan ditunjukkan pada Lampiran 1. Buah sirih hutan dibersihkan dan dipotong kecil-kecil (± 3 cm), kemudian dikeringudarakan tanpa terkena cahaya matahari langsung. Setelah kering, buah tersebut dihaluskan dengan menggunakan mesin penghancur hingga diperoleh serbuk, kemudian diayak menggunakan pengayak kawat kasa berjalinan 0.5 mm.
Serangga Uji
Serangga uji yang digunakan dalam penelitian ini adalah larva instar II Crocidolomia pavonana yang diperoleh dari perbanyakan di Laboratorium
Fisiologi dan Toksikologi Serangga, Departemen Proteksi Tanaman IPB. Pemeliharaan serangga dilakukan mengikuti prosedur yang digunakan oleh Prijono & Hassan (1992).
Uji Proksimat
Penyiapan Ekstrak Kasar
Ekstraksi dilakukan dengan metode yang dimodifikasi dari Silva et al. (2009). Ekstraksi menggunakan tiga jenis pelarut berdasarkan perbedaan kepolaran, yaitu n-heksana, etil asetat, dan metanol secara bertahap. Pada tahap pertama, 1 kg serbuk diekstraksi dengan cara maserasi menggunakan pelarut n-heksana (1:10 w/v). Hasil rendaman disaring untuk memisahkan filtrat dan residunya. Filtrat yang diperoleh kemudian dipekatkan dengan menggunakan penguap putar sehingga didapat ekstrak pekat n-heksana. Perendaman diulang sampai filtratnya tidak berwarna. Residunya diangin-anginkan di kamar asam (fume hood) agar terbebas dari n-heksana. Residu kering direndam kembali dengan menggunakan pelarut etil asetat sampai filtratnya tidak berwarna. Hasil rendaman disaring dan filtrat yang diperoleh kemudian dipekatkan dengan menggunakan penguap putar sehingga didapat ekstrak pekat etil asetat. Residunya diangin-anginkan di kamar asam (fume hood) agar terbebas dari etil asetat. Residu kering direndam kembali dengan menggunakan pelarut metanol sampai filtratnya tidak berwarna. Hasil rendaman disaring dan filtrat yang diperoleh kemudian dipekatkan dengan menggunakan penguap putar sehingga didapat ekstrak pekat metanol. Hasil ketiga ekstrak pekat tersebut dapat langsung digunakan atau disimpan dalam lemari es (≤ 4 °C) hingga saat digunakan. Diagram alir ekstraksi buah sirih hutan ditunjukkan pada Lampiran 2.
Uji Fitokimia
Uji fitokimia yang dilakukan mengacu pada Harborne (1987). Pengujian dilakukan pada serbuk dan ekstrak buah sirih hutan. Kelompok senyawa yang ingin diketahui dalam analisis kualitatif ialah alkaloid, flavonoid, saponin, tanin, hidrokuinon, triterpenoid, dan steroid.
Pada pengujian alkaloid digunakan pereaksi Dragendorf, Meyer, dan Wagner. Sampel dimasukkan ke dalam tabung reaksi dan dilarutkan dalam 2 mL kloroform, dibasakan dengan 5 tetes NH4OH, ditambahi 10 tetes H2SO4 2 M lalu
dengan terbentuknya endapan merah jingga dengan pereaksi Dragendorf, endapan putih dengan pereaksi Meyer, dan endapan cokelat dengan pereaksi Wagner.
Uji flavonoid dilakukan dengan menambahkan 3 mL air panas pada sampel, kemudian dididihkan selama 5 menit. Sebanyak 3 tetes larutan diteteskan pada pelat tetes menggunakan pipet, selanjutnya ditambahi serbuk Mg, 1 mL HCl pekat, dan 1 mL amil alkohol kemudian dikocok menggunakan vorteks. Terbentuknya warna merah/kuning/jingga menunjukkan adanya flavonoid.
Uji saponin dilakukan dengan menambahkan 3 mL air panas pada sampel, selanjutnya dipanaskan selama 5 menit dan dikocok 10 detik menggunakan vorteks, kemudian dibiarkan selama 10 menit. Terbentuknya busa yang stabil menunjukkan adanya senyawa saponin. Prosedur uji tanin hampir sama dengan uji saponin. Sampel dipanaskan hingga mendidih selama 5 menit, selanjutnya larutan yang terbentuk ditambahi beberapa tetes larutan FeCl3 1%. Terbentuknya larutan
berwarna biru tua atau hijau kehitaman menunjukkan adanya tanin.
Uji hidrokuinon dilakukan dengan menambahkan 3 mL air panas pada sampel, kemudian dididihkan selama 5 menit. Sebanyak 3 tetes larutan diteteskan pada pelat tetes menggunakan pipet, selanjutnya ditambahi 1 mL NaOH. Terbentuknya endapan warna merah menunjukkan adanya hidrokuinon.
Penentuan adanya senyawa triterpenoid dan steroid dilakukan dengan menambahkan 2 mL eter pada sampel. Lapisan eter yang terbentuk diteteskan pada pelat tetes kemudian ditambahi 3 tetes asam asetat anhidrat dan 1 tetes asam sulfat pekat. Adanya triterpenoid ditandai dengan terbentuknya warna merah atau ungu, sedangkan adanya steroid ditandai terbentuknya warna hijau atau biru.
Uji Aktivitas Insektisida
Pengujian aktivitas insektisida dilakukan dengan metode residu pada daun (Prijono et al. 2001). Pengujian dilakukan pada ekstrak dan fraksi-fraksi buah sirih hutan. Pengujian melalui dua tahap, yaitu uji pendahuluan dan uji lanjutan.
Uji Pendahuluan
pada konsentrasi 0.08% dan 0.15%. Pengujian dilakukan dengan tiga ulangan, dan pada setiap ulangan digunakan 15 ekor larva instar II C. pavonana. Ekstrak n-heksana, ekstrak etil asetat, dan fraksi-fraksi dilarutkan dalam pelarut aseton, sedangkan ekstrak metanol dilarutkan dalam pelarut metanol. Semua larutan sampel kemudian dioleskan pada kedua sisi permukaan potongan daun brokoli (diameter 3 cm) sebanyak 25 µL per sisi dengan menggunakan mikrosemprit (microsyringe). Daun kontrol pada ekstrak kasar diolesi dengan pelarut aseton dan metanol, sedangkan fraksi-fraksi dengan pelarut aseton. Setelah pelarutnya menguap, dua potong daun perlakuan diletakkan dalam cawan petri (diameter 9 cm) yang telah dialasi tisu, kemudian 15 ekor larva instar II C. pavonana yang baru ganti kulit dimasukkan ke dalam cawan petri tersebut. Pemberian makan daun perlakuan dilakukan selama 48 jam, kemudian larva diberi makan daun segar tanpa perlakuan. Larva yang bertahan hidup dipelihara sampai instar IV, sementara jumlah larva yang mati dicatat setiap hari. Perkembangan larva yang bertahan hidup diikuti setiap hari dan dihitung lama perkembangannya hingga mencapai instar IV.
Uji Lanjutan
Ekstrak dan fraksi teraktif diuji lebih lanjut pada enam taraf konsentrasi yang diharapkan dapat mengakibatkan kematian serangga uji antara >0% dan <100% yang ditentukan berdasarkan hasil uji pendahuluan. Formulasi insektisida komersial Agrimec 18 EC (b.a. abamektin 18.4 g/l) juga diuji sebagai kontrol positif. Setiap perlakuan dan kontrol pada uji lanjutan terdiri atas enam ulangan, pada setiap ulangan digunakan 15 ekor larva instar II C. pavonana. Cara pengujian dan pengamatan sama seperti pada uji pendahuluan. Larva yang mati dicatat setiap hari dan larva yang bertahan hidup diikuti perkembangannya setiap hari seperti pada pengujian awal.
Pencarian Eluen Terbaik
Pencarian eluen terbaik dilakukan dengan menggunakan kromatografi lapis tipis (KLT). KLT yang digunakan adalah pelat aluminium dengan adsorben Silica Gel 60 F254 dari Merck. KLT diaktifkan terlebih dahulu pada suhu 105 °C selama
30 menit. Ekstrak pekat ditotolkan pada KLT dengan menggunakan pipa kapiler. Setelah kering KLT tersebut langsung dielusi dalam ruang elusi yang telah dijenuhkan dengan uap eluen pengembang. Eluen yang digunakan dalam pemisahan awal adalah metanol, etanol, aseton, diklorometana, kloroform, etil asetat, dan n-heksana. Eluen dengan pemisahan terbaik kemudian dikombinasikan satu dengan yang lainnya dengan berbagai perbandingan. Bila eluen telah mencapai batas yang ditentukan, pelat diangkat dan dikeringudarakan. Noda hasil elusi diamati di bawah lampu UV pada panjang gelombang 254 nm.
Fraksinasi Ekstrak Teraktif dan Identifikasi Fraksi Teraktif
Ekstrak yang paling aktif terhadap larva instar II C. pavonana difraksinasi menggunakan kromatografi kolom dengan metode step gradient. Fase diam yang digunakan adalah Silica Gel 60 (0.063-0.200 mm) dari Merck, sedangkan fase gerak menggunakan eluen terbaik hasil KLT. Setiap eluat ditampung dalam tabung reaksi dengan volume masing-masing sebanyak 5 mL dan dipantau dengan KLT untuk menentukan jumlah fraksi yang terbentuk. Fraksi hasil pemisahan tersebut masing-masing diuji aktivitasnya terhadap larva C. pavonana.
HASIL DAN PEMBAHASAN
Hasil Analisis Proksimat
Analisis proksimat dilakukan untuk mengetahui komposisi kimia suatu bahan. Analisis proksimat yang dilakukan pada buah sirih hutan meliputi analisis kadar air, kadar abu, kadar protein, kadar lemak, dan kadar karbohidrat (by difference). Hasil analisis proksimat buah sirih hutan ditunjukkan pada Tabel 1.
Tabel 1 Hasil analisis proksimat buah sirih hutan
Peubah Kandungan
(%) Kadar air
Kadar abu Kadar protein Kadar lemak Kadar karbohidrat
11.32 6.38 11.42 4.98 65.90
Sampel yang akan dianalisis sering mengandung air sehingga diperlukan penetapan kadar air untuk mengetahui jumlah bahan (bobot kering) yang terdapat dalam ekstrak. Kadar air suatu bahan sangat berpengaruh terhadap daya simpannya, karena erat kaitannya dengan aktivitas mikrobiologi yang terjadi selama bahan tersebut disimpan. Kadar air yang tinggi menyebabkan mikroba lebih mudah mengalami pertumbuhan. Selain rentan terhadap kerusakan oleh mikroba dan jamur, kadar air yang tinggi juga berpengaruh terhadap rendemen yang dihasilkan. Sampel yang baik disimpan dalam jangka panjang adalah sampel yang memiliki kadar air kurang dari 10%.
adalah waktu pengeringan, suhu pengeringan, kelembapan udara di sekitarnya, kelembapan bahan atau kandungan air dari bahan, ketebalan bahan yang dikeringkan, sirkulasi udara, dan luas permukaan bahan. Pertumbuhan mikroba pada buah sirih hutan dapat dihambat dengan cara menyimpan serbuk kering buah sirih hutan dalam wadah dan tempat yang kering serta tidak lembap, atau dengan mengeringkan kembali sehingga kadar airnya dapat berkurang.
Kadar abu menunjukkan besarnya kandungan mineral pada suatu bahan yang tidak terbakar selama pengabuan. Mineral sebagai senyawa anorganik akan tertinggal dalam bentuk abu yang dapat digunakan untuk analisis kualitatif dan kuantitatif. Kandungan mineral yang cukup besar diperlukan untuk keseimbangan osmosis dalam mempertahankan sistem biologinya (Bidwel 1974). Kadar abu buah sirih hutan yang diperoleh adalah 6.38%. Nilai tersebut cukup besar karena buah sirih hutan kaya akan mineral. Kandungan mineral pada buah sirih hutan di antaranya nitrogen, fosfor, kalium, kalsium, magnesium, sulfur, boron, tembaga, mangan, dan seng (Hartemink 2001).
Protein merupakan zat makanan yang sangat penting bagi tubuh karena berfungsi sebagai zat pembangun dan pengatur. Protein dibentuk oleh asam-asam amino yang mengandung unsur karbon, hidrogen, oksigen, dan nitrogen (beberapa asam amino juga mengandung fosfor, besi, dan yodium) melalui ikatan peptida (Tejasari 2003). Kadar protein pada buah sirih hutan yang diperoleh adalah 11.42%.
Lemak merupakan bagian jaringan tubuh yang dapat digunakan sebagai sumber energi setelah dicerna. Menurut bobotnya, energi yang diperoleh dari lemak dua kali lebih banyak dibandingkan dengan karbohidrat dan protein (Helper et al. 1988). Kadar lemak yang didapatkan dari buah sirih hutan adalah 4.98%.
Lemak dalam tubuh umumnya disimpan sebesar 45% di sekeliling organ dan rongga perut (Almatsier 2006).
pengurangan 100% dengan kadar air, abu, protein, dan lemak, sehingga kadar karbohidrat bergantung pada faktor pengurangannya. Hal ini karena karbohidrat sangat dipengaruhi oleh faktor kandungan zat gizi lainnya. Kadar karbohidrat pada buah sirih hutan adalah 65.90%. Nilai tersebut lebih besar dibandingkan dengan kandungan gizi yang lainnya.
Hasil Ekstraksi Buah Sirih Hutan
Ekstraksi merupakan proses yang secara selektif mengambil zat terlarut dari suatu campuran dengan bantuan pelarut. Hasil ekstraksi yang diperoleh bergantung pada kandungan ekstrak yang terdapat pada sampel uji dan jenis pelarut yang digunakan. Pemilihan pelarut berdasarkan prinsip kelarutan like dissolves like, yaitu pelarut polar akan melarutkan senyawa yang polar, sedangkan
pelarut nonpolar akan melarutkan senyawa nonpolar. Suatu senyawa akan menunjukkan kelarutan yang berbeda-beda dalam pelarut yang berbeda pula.
Sampel buah sirih hutan diekstraksi dengan menggunakan metode maserasi. Metode ini memiliki kelebihan, yaitu praktis, efektif, aman, dan ekonomis dalam penggunaannya serta menghindari rusaknya senyawa aktif pada sampel yang tidak tahan panas. Maserasi dilakukan dengan cara merendam sampel dalam pelarut organik, kemudian ekstrak cair dibebaskan dari pelarutnya dengan menggunakan rotavapor.
Pelarut yang digunakan untuk ekstraksi dalam ekstraksi bertahap berturut-turut n-heksana, etil asetat, dan metanol. Penggunaan berbagai jenis pelarut dengan tingkat kepolaran yang berbeda dilakukan untuk mendapatkan ekstrak dengan hasil yang optimal dari senyawa yang belum diketahui jenisnya. Pelarut n-heksana merupakan pelarut yang bersifat nonpolar yang diharapkan dapat mengekstrak atau mengambil senyawa-senyawa yang bersifat nonpolar, pelarut etil asetat merupakan pelarut yang bersifat semipolar yang diharapkan mengekstrak senyawa-senyawa yang bersifat semipolar, sedangkan pelarut metanol merupakan pelarut yang bersifat polar yang diharapkan dapat mengekstrak senyawa-senyawa yang bersifat polar.
10 kali ekstraksi, 2.07% dengan 9 kali ekstraksi, dan 5.81% dengan 1 kali ekstraksi (Tabel 2). Ekstrak n-heksana yang diperoleh berupa minyak yang berwarna kuning kehitaman, sedangkan ekstrak etil asetat dan ekstrak metanol dalam bentuk pasta dengan warna masing-masing hijau pekat dan cokelat pekat.
Tabel 2 Rendemen ekstrak buah sirih hutan dengan ekstraksi bertahap Pelarut Bobot ekstrak
(g)
Rendemen
(%) Warna ekstrak n-Heksana
Etil asetat Metanol
55.3311 16.5343 46.3564
6.93 2.07 5.81
Kuning kehitaman Hijau pekat Cokelat pekat
Hasil Analisis Fitokimia
Analisis fitokimia merupakan salah satu cara untuk mengetahui kandungan metabolit sekunder pada suatu sampel. Analisis ini bertujuan menguji keberadaan golongan senyawa seperti alkaloid, flavonoid, hidrokuinon, saponin, tanin, triterpenoid, dan steroid. Golongan senyawa dalam sampel buah sirih hutan dapat ditentukan dengan melihat perubahan warna setelah ditambahkan pereaksi yang spesifik untuk setiap uji kualitatif. Uji fitokimia ini dilakukan untuk mengetahui golongan senyawa buah sirih hutan yang kemungkinan dapat berperan sebagai insektisida. Senyawa-senyawa kimia dari tumbuhan dapat menimbulkan pengaruh yang merugikan pada kehidupan serangga antara lain mematikan, mengganggu pertumbuhan, menghambat pembentukan kulit, mengganggu penemuan inang, menghambat perkembangan serangga, menurunkan fertilitas, dan membunuh telur (Dadang & Prijono 2008).
dihidrokalkon, kromena, fenilpropanoid, dan benzenoid (Parmar et al.1997; Taylor 2006). Ekstrak n-heksana memberikan respons positif terhadap uji alkaloid, flavonoid, saponin, tanin, dan steroid. Perbedaan terlihat dari kandungan saponin yang tidak terdeteksi pada simplisia. Hal ini dapat disebabkan karena kandungan fitokimia yang terdapat dalam simplisia sangat rendah sehingga tidak terdeteksi. Ekstrak etil asetat memberikan respons positif terhadap uji alkaloid dan steroid, sedangkan ekstrak metanol memberikan respons positif terhadap uji alkaloid, flavonoid, dan steroid. Tidak adanya triterpenoid pada sampel yang diuji sesuai dengan beberapa laporan yang menyatakan bahwa buah sirih hutan mengandung senyawa terpenoid kelompok monoterpena dan seskuiterpena (Jamal et al. 2003; Navickiene et al. 2006).
Di antara ketiga ekstrak yang diuji, ekstrak n-heksana memberikan respons positif paling banyak dibandingkan dengan ekstrak etil asetat dan ekstrak metanol. Hal ini karena pelarut n-heksana digunakan paling awal dan menunjukkan bahwa pelarut tersebut dapat menarik berbagai senyawa nonpolar dalam buah sirih hutan. Beberapa alkaloid dilaporkan bersifat toksik dan menghambat perkembangan serangga. Guininsin, pelitorin, piperisida, piperin, piperlonguminin, dan retrofraktamida A merupakan contoh senyawa alkaloid yang umumnya terdapat dalam tumbuhan famili Piperaceae dan telah dilaporkan bersifat insektisida Tabel 3 Hasil uji fitokimia buah sirih hutan
Golongan senyawa
Respons pada Simplisia Ekstrak
(Miyakado et al. 1989; Parmar et al. 1997; Scott et al. 2008). Cara kerja sejumlah alkaloid mempengaruhi kinerja asetilkolin dalam sistem saraf serangga (Panda & Khush 1995). Tanin memainkan peranan penting dalam sistem pertahanan tumbuhan dalam menghadapi serangan herbivora. Keberadaan tanin dalam tanaman dapat mempengaruhi pencernaan makanan dalam tubuh serangga (Harborne 1988). Flavonoid dan tanin dapat menurunkan kemampuan mencerna makanan pada serangga dengan menurunkan aktivitas enzim protease dan amilase sehingga pertumbuhan serangga menjadi terganggu (Arbaningrum 1998). Saponin dapat menurunkan aktivitas enzim protease dalam saluran pencernaan serta mengganggu penyerapan makanan. Aktivitas lain dari saponin adalah mengikat sterol bebas dalam pencernaan makanan. Sterol merupakan prekursor dari hormon ekdison sehingga menurunnya persediaan sterol akan mengganggu proses ganti kulit pada serangga (Ishaaya 1986). Shashi & Ashoke (1991) menyatakan bahwa saponin dapat menurunkan tegangan permukaan selaput mukosa saluran pencernaan larva sehingga dinding saluran pencernaan menjadi korosif.
Aktivitas Insektisida Ekstrak Buah Sirih Hutan terhadap Larva C. pavonana
Pengaruh Ekstrak terhadap Mortalitas Larva C. pavonana
Prijono (1999) penggunaan ekstrak di lapangan pada konsentrasi lebih besar dari 0.5% untuk ekstrak suatu bahan tumbuhan dengan pelarut organik biasanya kurang layak secara ekonomi maupun ekologi seperti fitotoksik dan bersifat racun terhadap musuh alami.
Di antara ketiga ekstrak buah sirih hutan yang diuji terhadap larva C. pavonana, ekstrak etil asetat dan ekstrak metanol tidak aktif dibandingkan dengan
ekstrak n-heksana. Hal ini kemungkinan karena sebagian besar komponen aktifnya sudah terekstrak oleh pelarut sebelumnya (n-heksana). Hal tersebut diperkuat dengan hasil pengujian fitokimia yang menunjukkan bahwa ekstrak n-heksana memberikan respons positif lebih banyak dibandingkan dengan ekstrak etil asetat dan ekstrak metanol. Faktor lain kemungkinan juga disebabkan oleh senyawa yang terkandung dalam kedua ekstrak tersebut kurang aktif atau senyawa tersebut sebenarnya cukup aktif tetapi kandungannya rendah (Prijono 1999).
Hasil penelitian ini sesuai dengan penelitian yang dilakukan Silva et al. (2009) dengan menggunakan daun sirih hutan yang menunjukkan bahwa ekstrak n-heksana lebih aktif dibandingkan dengan ekstrak etil asetat dan ekstrak etanol
yang diuji terhadap caplak lembu R. microplus. Bernard et al. (1995) melaporkan juga bahwa fraksi n-heksana sirih hutan memiliki aktivitas insektisida yang cukup Tabel 4 Pengaruh ekstrak buah sirih hutan terhadap mortalitas larva C. pavonana
Perlakuan Konsentrasi (%, b/v)
Mortalitas kumulatif (%) a Instar II Instar II + III Ekstrak n-heksana
Ekstrak etil asetat
Ekstrak metanol
tinggi terhadap larva nyamuk A. atropalpus dibandingkan dengan fraksi etil asetat dan fraksi metanol. Pada famili yang sama fraksi n-heksana buah P. retrofractum lebih aktif dibandingkan dengan fraksi etil asetat dan fraksi metanol. Perlakuan fraksi n-heksana pada konsentrasi 0.5% mengakibatkan mortalitas larva C. pavonana 100%, sedangkan perlakuan dengan fraksi etil asetat dan metanol
mengakibatkan mortalitas masing-masing 6.6% dan 2.2% (Ferdi 2008). Nugroho (2008) melaporkan juga bahwa fraksi n-heksana buah P. cubeba lebih aktif dibandingkan dengan fraksi etil asetat dan fraksi metanol. Perlakuan dengan fraksi n-heksana pada konsentrasi 0.5% mengakibatkan mortalitas larva C. pavonana
lebih dari 90%, sedangkan perlakuan dengan fraksi etil asetat dan metanol mengakibatkan mortalitas masing-masing 0% dan 6.7%.
Kematian larva hampir semuanya terjadi pada instar II, yaitu instar yang diberi perlakuan, sedangkan pada instar III peningkatan persentase mortalitas larva sangat rendah atau tidak ada kematian larva lagi (Tabel 4). Hal ini menunjukkan bahwa ekstrak yang diuji lebih bersifat insektisida daripada sebagai penghambat perkembangan. Pada beberapa perlakuan terjadi kematian larva pada instar III. Hal ini kemungkinan disebabkan oleh adanya residu ekstrak yang masih tertinggal di dalam tubuh larva.
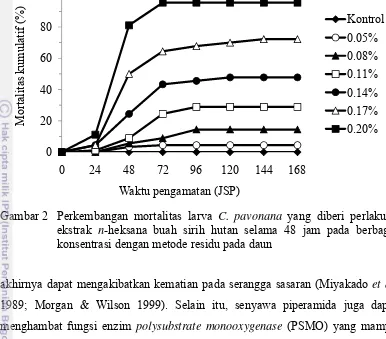
Perlakuan dengan ekstrak yang paling aktif, yaitu ekstrak n-heksana, sudah mengakibatkan mortalitas larva C. pavonana pada 24 jam setelah perlakuan (JSP) (Gambar 2). Pada 48 JSP, perlakuan dengan ekstrak n-heksana pada konsentrasi tertinggi (0.20%) mengakibatkan mortalitas larva 81.1% dan meningkat pada 72 JSP menjadi 95.6%. Penambahan mortalitas larva uji yang tinggi terjadi antara 48 dan 72 JSP, sedangkan pada pengamatan berikutnya sudah tidak terjadi penambahan mortalitas yang tinggi. Hal ini disebabkan setelah 72 JSP residu ekstrak yang tertinggal dalam tubuh larva uji sudah tidak dapat meningkatkan mortalitas secara nyata. Pola perkembangan mortalitas tersebut menunjukkan bahwa senyawa aktif yang terkandung dalam ekstrak n-heksana buah sirih hutan memiliki cara kerja yang relatif cepat dalam mengakibatkan mortalitas larva C. pavonana. Senyawa piperamida dari famili Piperaceae seperti guininsin dan
akhirnya dapat mengakibatkan kematian pada serangga sasaran (Miyakado et al. 1989; Morgan & Wilson 1999). Selain itu, senyawa piperamida juga dapat menghambat fungsi enzim polysubstrate monooxygenase (PSMO) yang mampu mengoksidasi senyawa asing termasuk insektisida (Matsumura 1985; Scott et al. 2008).
Perlakuan dengan ekstrak n-heksana pada konsentrasi 0.05%-0.14% mengakibatkan mortalitas larva uji kurang dari 50% baik untuk larva instar II maupun instar II+III, sedangkan pada konsentrasi 0.17% mengakibatkan mortalitas larva instar II lebih dari 65% dan peningkatan mortalitas pada instar III 6.6%. Mortalitas larva uji pada konsentrasi tertinggi (0.20%) mencapai lebih dari 95% (Tabel 5). Hal ini dapat dikatakan bahwa ekstrak buah sirih hutan cukup potensial untuk digunakan sebagai insektisida botani. Dadang & Prijono (2008) menyatakan bahwa insektisida botani yang diekstrak dengan pelarut organik dikatakan memiliki potensi yang baik bila pada konsentrasi ≤ 1% sudah dapat mengakibatkan mortalitas serangga uji ≥ 80%.
Berdasarkan pengamatan secara visual, aktivitas makan larva C. pavonana pada daun yang diberi perlakuan ekstrak n-heksana lebih rendah dibandingkan dengan daun kontrol. Peningkatan konsentrasi ekstrak uji menyebabkan aktivitas
0 20 40 60 80 100
0 24 48 72 96 120 144 168
Mortalitas kum
ulatif
(%)
Waktu pengamatan (JSP)
Kontrol 0.05% 0.08% 0.11% 0.14% 0.17% 0.20%
makan makin terhambat. Daun yang diberi perlakuan ekstrak uji dengan konsentrasi rendah lebih banyak dimakan oleh larva dibandingkan dengan daun yang diberi perlakuan ekstrak uji dengan konsentrasi lebih tinggi. Hal ini menunjukkan bahwa ekstrak buah sirih hutan memiliki komponen yang bersifat antimakan.
Larva uji yang mati akibat perlakuan ekstrak n-heksana buah sirih hutan menunjukkan gejala tubuh mengerut dan berwarna cokelat kehitaman yang mencerminkan terjadinya kematian sel dan jaringan. Kematian larva rendah pada saat larva telah mencapai instar III, tetapi menunjukkan gejala keracunan yang sama dengan larva yang mati pada saat instar II. Hal ini menunjukkan bahwa kematian larva disebabkan oleh toksisitas senyawa aktif yang terkandung dalam ekstrak n-heksana buah sirih hutan.
Pada perlakuan dengan ekstrak n-heksana, mortalitas larva meningkat dengan semakin tingginya konsentrasi yang diuji, sehingga analisis probit dapat dilakukan terhadap data mortalitas larva yang diperoleh. Hasil analisis probit menunjukkan bahwa ekstrak n-heksana buah sirih hutan memiliki LC50 terhadap
instar II 0.14% dan terhadap instar II+III 0.13%, sedangkan LC95 masing-masing
0.27% dan 0.26% (Tabel 6). Hal tersebut menunjukkan bahwa mortalitas larva instar II tidak berbeda nyata dengan mortalitas instar II+III.
Tabel 5 Pengaruh ekstrak n-heksana buah sirih hutan terhadap mortalitas larva C. pavonana
Konsentrasi (%, b/v)
Mortalitas kumulatif (%) a
Instar II Instar II + III
Tabel 6 Penduga parameter hubungan konsentrasi-mortalitas ekstrak n-heksana buah sirih hutan terhadap larva C. pavonana a
Instar a ± GB b b ± GB b LC50 (SK 95%)
Jumlah larva instar II yang diberi perlakuan 540 ekor dan kontrol 90 ekor. b
a = intersep, b = kemiringan garis regresi, GB = galat baku, SK = selang kepercayaan. c Tingkat kepercayaan berada di bawah 95%.
Toksisitas ekstrak buah sirih hutan terhadap larva C. pavonana hampir sama dengan toksisitas ekstrak buah P. retrofractum terhadap serangga dan metode ekstraksi yang sama (Ferdi 2008). Hal tersebut terlihat dari nilai LC50 ekstrak
buah sirih hutan (0.13%) yang tidak berbeda nyata dengan ekstrak buah P. retrofractum (0.12%), sedangkan LC95 ekstrak buah sirih hutan (0.26%) lebih
kecil dibandingkan dengan LC95 ekstrak buah P. retrofractum (0.32%). Toksisitas
ekstrak buah sirih hutan lebih toksik daripada ekstrak buah P. cubeba terhadap serangga yang sama (Nugroho 2008). Nilai LC50 (0.34%) dan LC95 (0.54%)
ekstrak buah P. cubeba lebih besar dibandingkan dengan ekstrak buah sirih hutan dan ekstrak buah P. retrofractum.
Pengaruh Ekstrak terhadap Lama Perkembangan Larva C. pavonana
Tabel 7 Pengaruh ekstrak buah sirih hutan terhadap lama perkembangan larva C. pavonana
Perlakuan Konsentrasi (%, b/v)
Rata-rata perkembangan ± SD (hari) (n) a Instar II ke III Instar II ke IV Kontrol aseton
Kontrol metanol Ekstrak n-heksana
Ekstrak etil asetat
Ekstrak metanol
SD: standar deviasi. n: jumlah larva yang bertahan hidup. Rataan pada lajur yang sama diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji selang berganda Duncan (α = 0.05). b
Semua larva mati sebelum mencapai instar III.
Pada perlakuan dengan ekstrak etil asetat buah sirih hutan pada konsentrasi 0.1% dan 0.5%, lama perkembangan larva instar II ke III tidak berbeda nyata dengan kontrol, sedangkan perpanjangan perkembangan instar II ke IV masing-masing selama 0.81 dan 1.18 hari dibandingkan dengan kontrol. Pada perlakuan dengan ekstrak metanol buah sirih hutan pada konsentrasi 0.1% dan 0.5%, lama perkembangan larva instar II ke III dan instar II ke IV tidak berbeda nyata dengan kontrol. Hal tersebut menandakan bahwa ekstrak metanol pada konsentrasi tersebut tidak cukup mempengaruhi proses perkembangan larva.
Di antara ketiga ekstrak yang diuji pada konsentrasi 0.1%, perlakuan ekstrak n-heksana buah sirih hutan mengakibatkan perpanjangan lama perkembangan
daun perlakuan hanya sedikit dan setelah diganti dengan daun tanpa perlakuan larva aktif makan kembali sehingga dapat melanjutkan perkembangan. Selain itu, juga dapat disebabkan oleh pengaruh gabungan dari sifat penghambat dan peracunan oleh senyawa aktif ekstrak tersebut pada sel-sel atau jaringan yang terlibat dalam proses pencernaan makanan dan pertumbuhan serangga.
Pada perlakuan dengan ekstrak yang paling aktif yaitu ekstrak n-heksana, lama perkembangan larva instar II ke III berkisar 2-4 hari, sedangkan lama perkembangan larva kontrol 2 hari. Perkembangan larva instar II ke IV berkisar 3.57-6.50 hari, sedangkan pada kontrol 3.17 hari (Tabel 8). Pada perlakuan dengan ekstrak n-heksana konsentrasi 0.05%-0.14%, lama perkembangan larva instar II ke III tidak berbeda nyata dengan kontrol, akan tetapi perkembangan larva instar II ke IV mengalami perpanjangan masing-masing selama 0.95, 1.22, dan 1.7 hari dibandingkan dengan kontrol, kecuali pada konsentrasi 0.05% tidak
berbeda nyata. Hal tersebut menandakan bahwa ekstrak n-heksana buah sirih hutan di bawah nilai LC50 tidak cukup mempengaruhi proses perkembangan larva
instar II ke III. Pada konsentrasi tersebut serangga uji menyerap senyawa asing Tabel 8 Pengaruh ekstrak n-heksana buah sirih hutan pada berbagai konsentrasi
terhadap lama perkembangan larva C. pavonana
Konsentrasi (%, b/v)
Rata-rata lama perkembangan larva ± SD (hari) (n) a Instar II ke III Instar II ke IV
dari ekstrak uji, namun tubuh serangga masih mampu mengatasi senyawa tersebut tanpa mengganggu kemampuannya untuk ganti kulit.
Hasil berbeda nyata terlihat pada konsentrasi 0.17% dan 0.20%, baik pada perkembangan larva instar II ke III maupun instar II ke IV. Pada konsentrasi tersebut perpanjangan lama perkembangan larva instar II ke III masing-masing selama 0.52 dan 2 hari, dan perpanjangan lama perkembangan larva instar II ke IV masing-masing selama 1.75 dan 3.33 hari. Hal ini menunjukkan bahwa pada konsentrasi 0.17% dan 0.20% ekstrak n-heksana, tubuh serangga mampu mendetoksifikasi senyawa yang telah terserap dalam tubuh dan sebagai kompensasinya perkembangan larva akan lebih lama daripada keadaan normal (Nenotek 2010). Kemungkinan lain terjadi karena adanya gangguan terhadap aktivitas sel yang menghasilkan hormon perkembangan serangga selain gangguan terhadap metabolisme secara umum dan hambatan terhadap aktivitas makan larva tersebut. Terkait dengan hambatan metabolisme, beberapa senyawa piperamida dari tanaman famili Piperaceae telah dilaporkan dapat menghambat enzim pengoksidasi yang biasanya berperan mengoksidasi berbagai jenis senyawa racun dari luar tubuh atau limbah metabolisme di dalam tubuh serangga (Scott et al. 2008).
Fraksinasi Ekstrak Teraktif Buah Sirih Hutan
Fraksinasi dilakukan untuk memisahkan ekstrak teraktif (n-heksana) buah sirih hutan yang memiliki potensi sebagai insektisida. Ekstrak tersebut dipisahkan dengan menggunakan kromatografi kolom. Sebelum dilakukan pemisahan dengan kromatografi kolom, terlebih dahulu dilakukan pencarian eluen terbaik yang mampu memisahkan senyawa yang terdapat dalam ekstrak n-heksana dengan menggunakan kromatografi lapis tipis (KLT) G 60 F254 dari Merck. Beberapa
n-heksana-diklorometana (9:1, 8:2, 7:3, 6:4, 1:1), n-heksana-etil asetat (9:1, 8:2), dan etil asetat-diklorometana (2:8) (Lampiran 4). Berdasarkan analisis dengan KLT diperoleh eluen n-heksana-aseton (7:3) yang memberikan pola pemisahan terbaik karena mampu memisahkan tujuh noda yang terkandung dalam ekstrak n-heksana dengan nilai Rf 0.05, 0.15, 0.24, 0.48, 0.56, 0.75, dan 0.85 (Gambar 3). Dengan demikian, eluen tersebut digunakan untuk analisis penentuan jumlah fraksi hasil pemisahan ekstrak n-heksana buah sirih hutan dengan menggunakan kromatografi kolom.
Gambar 3 Pola KLT gel silika dan nilai Rf ekstrak n-heksana buah sirih hutan dengan eluen n-heksana-aseton (7:3)
Ekstrak n-heksana dipisahkan dengan kromatografi kolom menggunakan fase diam Silica Gel 60 dari Merck. Gel silika merupakan fase diam yang bersifat menahan sampel (adsorben), sehingga sampel yang memiliki kepolaran yang mirip dengan eluen akan keluar terlebih dahulu, sedangkan yang sifatnya berbeda akan tertahan pada kolom. Fase geraknya menggunakan pelarut n-heksana-metanol dengan metode step gradient (peningkatan kepolaran) agar dengan peningkatan polaritas sistem eluen semua komponen akan terbawa lebih cepat dan pemisahan dapat berlangsung dengan baik. Mula-mula sampel dielusi dengan n-heksana, kemudian secara bertahap ditingkatkan kepolarannya dengan menambahkan aseton dengan berbagai perbandingan dan diakhiri dengan metanol.
0.05 0.24 0.56 0.85 0.75
0.48
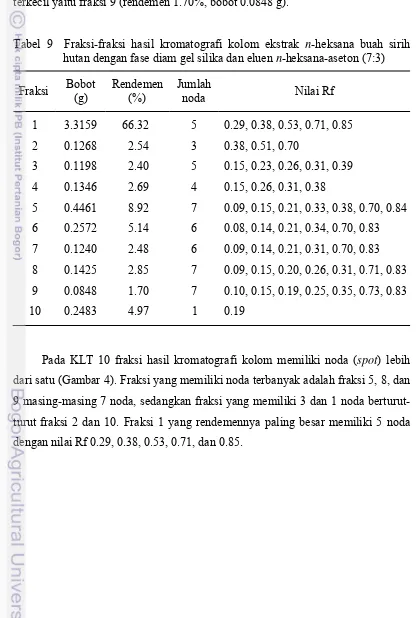
Hasil dari pemisahan dengan kromatografi kolom diperoleh 303 tabung reaksi dengan volume 5 mL tiap tabung reaksi. Setiap tabung diperiksa dengan menggunakan KLT. Noda dengan nilai Rf yang sama disatukan menjadi satu fraksi sehingga diperoleh 10 fraksi (Tabel 9). Fraksi 1 memiliki rendemen yang paling besar, yaitu 66.32% dengan bobot 3.3159 g, sedangkan rendemen yang terkecil yaitu fraksi 9 (rendemen 1.70%, bobot 0.0848 g).
Tabel 9 Fraksi-fraksi hasil kromatografi kolom ekstrak n-heksana buah sirih hutan dengan fase diam gel silika dan eluen n-heksana-aseton (7:3) Fraksi Bobot
0.09, 0.15, 0.21, 0.33, 0.38, 0.70, 0.84 0.08, 0.14, 0.21, 0.34, 0.70, 0.83 0.09, 0.14, 0.21, 0.31, 0.70, 0.83 0.09, 0.15, 0.20, 0.26, 0.31, 0.71, 0.83 0.10, 0.15, 0.19, 0.25, 0.35, 0.73, 0.83 0.19
Gambar 4 Profil KLT hasil kromatografi kolom ekstrak n-heksana buah sirih hutan dengan eluen n-heksana-aseton (7:3)
Aktivitas Insektisida Fraksi Buah Sirih Hutan
terhadap Larva C. pavonana
Pengaruh Fraksi-fraksi terhadap Mortalitas Larva C. pavonana
Hasil pengujian pendahuluan menunjukkan bahwa tidak semua fraksi yang diuji memiliki aktivitas insektisida yang kuat terhadap larva C. pavonana (Tabel 10). Fraksi 1 menunjukkan aktivitas yang paling tinggi terhadap larva C. pavonana. Pada konsentrasi 0.1% fraksi tersebut menyebabkan mortalitas larva
instar II mencapai 100%, sedangkan pada konsentrasi 0.05% hanya menyebabkan mortalitas 13.3%. Perlakuan dengan fraksi 2 pada konsentrasi 0.1% menyebabkan mortalitas larva instar II 57.8%, dan peningkatan mortalitas larva pada instar III 15.6%, sedangkan pada konsentrasi 0.05% menyebabkan mortalitas larva kurang dari 50%. Perlakuan dengan fraksi 3-10 pada konsentrasi 0.15% menyebabkan mortalitas larva instar II berkisar 2.2%-57.8% dan instar II + III berkisar 4.4%-62.2%, sedangkan pada konsentrasi 0.08% menyebabkan mortalitas larva instar II berkisar 0%-6.7% dan instar II + III berkisar 0%-11.1%.
Di antara fraksi-fraksi yang diuji, fraksi 1 lebih aktif dibandingkan dengan fraksi-fraksi yang lain. Hal ini kemungkinan disebabkan oleh senyawa aktif yang terkandung fraksi 1 lebih kuat dalam mengakibatkan mortalitas larva C. pavonana dibandingkan dengan fraksi-fraksi yang lain dan atau kandungan senyawa Tabel 10 Pengaruh fraksi-fraksi buah sirih hutan terhadap mortalitas larva C.
pavonana
Perlakuan Konsentrasi (%, b/v)
aktifnya paling tinggi dibandingkan dengan fraksi-fraksi yang lain. Oleh karena itu, fraksi yang diuji lebih lanjut adalah fraksi 1. Menurut Prijono (1999) fraksi dari ekstrak kasar bahan tumbuhan pada konsentrasi lebih besar dari 0.1% kurang efisien digunakan sebagai insektisida karena dalam penyiapannya akan dibutuhkan sumber bahan tumbuhan yang cukup banyak.
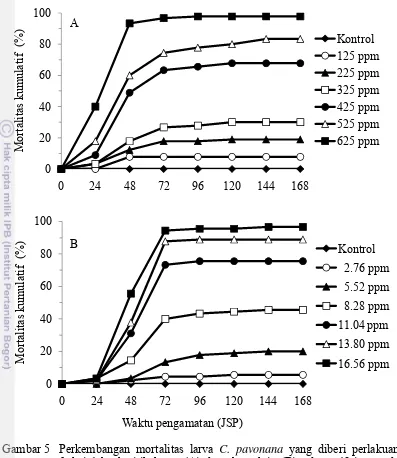
Perlakuan dengan fraksi yang paling aktif, yaitu fraksi 1, sudah mengakibatkan mortalitas larva C. pavonana pada 24 JSP (Gambar 5A). Pada 48 JSP, perlakuan dengan fraksi 1 pada konsentrasi tertinggi (625 ppm) mengakibatkan mortalitas larva 93.3%, dan meningkat pada 72 JSP menjadi lebih dari 95%. Penambahan mortalitas larva uji yang tinggi terjadi antara 48 dan 72 JSP, sedangkan pada pengamatan berikutnya sudah tidak terjadi penambahan mortalitas yang tinggi. Pola perkembangan mortalitas tersebut menunjukkan bahwa senyawa aktif yang terkandung dalam fraksi 1 buah sirih hutan memiliki cara kerja yang relatif cepat dalam mengakibatkan mortalitas larva C. pavonana. Larva yang mati akibat perlakuan dengan fraksi 1 buah sirih hutan menunjukkan gejala tubuh hitam dan kering. Setelah mengonsumsi daun perlakuan, gerakan larva lamban dan tidak makan daun perlakuan kembali, dan akhirnya mati.
Pelakuan dengan fraksi 1 pada konsentrasi 125-325 ppm mengakibatkan mortalitas larva kurang dari 50% baik untuk larva instar II maupun instar II+III, sedangkan pada konsentrasi 425 dan 525 ppm mengakibatkan mortalitas larva instar II masing-masing 61.1% dan 70%, dan peningkatan mortalitas pada instar III 6.7% dan 11.1%. Perlakuan fraksi 1 pada konsentrasi tertinggi (625 ppm) mengakibatkan mortalitas larva instar II lebih dari 95%, dan tidak ada lagi larva yang mati pada instar berikutnya (Tabel 11).
Pengujian aktivitas insektisida juga dilakukan terhadap insektisida abamektin sebagai kontrol positif dengan enam taraf konsentrasi. Abamektin merupakan salah satu homolog dari avermektin yang diperoleh dari hasil fermentasi bakteri tanah, Streptomyces avermitilis. Insektisida tersebut efektif terhadap sejumlah hama penting seperti tungau, semut, kecoa, dan spesies hama
Gambar 5 Perkembangan mortalitas larva C. pavonana yang diberi perlakuan
fraksi 1 buah sirih hutan (A) dan abamektin (B) selama 48 jam pada berbagai konsentrasi dengan metode residu pada daun
Perlakuan dengan abamektin sudah mengakibatkan mortalitas larva C. pavonana pada 24 JSP (Gambar 5B). Perlakuan dengan abamektin pada
konsentrasi tertinggi (16.56 ppm) mengakibatkan mortalitas larva 94.4% pada 72 JSP dan meningkat menjadi lebih dari 95% pada 92 JSP. Perlakuan pada konsentrasi 11.04 dan 13.8 ppm mengakibatkan mortalitas larva instar II masing-masing 63.3% dan 80%, dan mortalitas larva instar III 6.7% dan 8.9%. Perlakuan pada konsentrasi 2.76-8.28 ppm hanya mengakibatkan mortalitas larva kurang dari 50% baik untuk larva instar II maupun instar II+III (Tabel 11).
Pada perlakuan dengan fraksi 1 buah sirih hutan, mortalitas larva meningkat dengan semakin tingginya konsentrasi yang diuji, sehingga analisis probit dapat dilakukan terhadap data mortalitas larva yang diperoleh. Hasil analisis probit menunjukkan bahwa fraksi 1 buah sirih hutan memiliki nilai LC50 terhadap instar
II 364.67 ppm dan terhadap instar II+III 339.35 ppm, sedangkan nilai LC95
terhadap instar II 843.96 ppm dan terhadap instar II+III 768.72 ppm (Tabel 12). Nilai LC50 dan LC95 terhadap instar II+III lebih rendah dibandingkan terhadap
instar II. Hal ini menunjukkan bahwa pada instar III masih terjadi peningkatan mortalitas serangga uji.
Tabel 11 Pengaruh fraksi 1 buah sirih hutan dan abamektin terhadap mortalitas larva C. pavonana
Perlakuan Konsentrasi (ppm)
Tabel 12 Penduga parameter hubungan konsentrasi-mortalitas fraksi 1 buah sirih hutan dan abamektin terhadap larva C. pavonana a
Perlakuan,
Jumlah larva instar II yang diberi perlakuan 540 ekor dan kontrol 90 ekor. b
a = intersep, b = kemiringan garis regresi, GB = galat baku, SK = selang kepercayaan.
Aktivitas fraksi 1 lebih kuat daripada ekstrak kasarnya. Berdasarkan nilai LC50 terhadap instar II+III, fraksi 1 sekitar 3.8 kali lebih toksik terhadap larva C.
pavonana dibandingkan dengan ekstrak kasarnya, sedangkan berdasarkan nilai
LC95 fraksi 1 tersebut sekitar 3.4 kali lebih toksik. Hal ini mungkin disebabkan
karena komponen senyawa aktif yang terkandung dalam ekstrak n-heksana buah sirih hutan masih campuran berbagai senyawa sehingga aktivitasnya rendah, sedangkan pada fraksi kemungkinan komponen senyawa aktifnya telah terpisahkan sehingga aktivitasnya sangat kuat. Bila dibandingkan dengan abamektin, toksisitas fraksi 1 pada LC50 sekitar 43.2 kali lebih rendah dan pada
LC95 sekitar 42.8 kali lebih rendah. Menurut Mrozik (1997) insektisida abamektin
bersifat racun perut dan racun kontak, yaitu apabila diaplikasikan melalui daun insektisida tersebut akan mematikan serangga baik akibat adanya racun yang termakan maupun akibat kontak dengan residu yang terdapat pada daun.
Pengaruh Fraksi terhadap Lama Perkembangan Larva C. pavonana
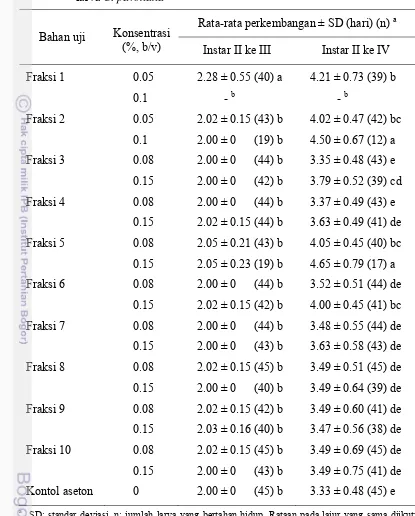
yang mendapat perlakuan fraksi 1 pada konsentrasi 0.1% tidak dapat ditentukan karena tidak ada satu pun larva uji yang mampu hidup dan berkembang hingga instar III akibat sifat insektisida fraksi tersebut, sedangkan perlakuan pada konsentrasi 0.1% mengakibatkan perpanjangan lama perkembangan larva instar II ke III dan instar II ke IV masing-masing selama 0.28 dan 0.88 hari dibandingkan dengan kontrol (Tabel 13).
Pada perlakuan dengan fraksi 2 konsentrasi 0.05% dan 0.1%, lama perkembangan larva instar II ke III tidak berbeda nyata dengan kontrol, sedangkan perpanjangan lama perkembangan larva instar II ke IV masing-masing selama 0.69 dan 1.17 hari dibandingkan dengan kontrol. Pada perlakuan dengan fraksi 3 dan 4 konsentrasi 0.08% dan 0.15%, lama perkembangan larva instar II ke III tidak berbeda nyata dengan kontrol, perpanjangan lama perkembangan larva instar II ke IV pada konsentrasi 0.15% masing-masing selama 0.46 dan 0.3 hari, sedangkan pada konsentrasi 0.08% tidak berbeda nyata dengan kontrol. Pada perlakuan dengan fraksi 5-10 konsentrasi 0.08% dan 0.15%, lama perkembangan larva instar II ke III tidak berbeda nyata dengan kontrol, sedangkan perpanjangan lama perkembangan larva instar II ke IV berkisar selama 0.14-1.32 hari.
Semua fraksi yang diuji mengakibatkan penghambatan pertumbuhan larva C. pavonana. Berdasarkan hasil pengamatan secara visual terhadap gejala larva
yang keracunan pada hari-hari pertama, selain tidak langsung mengakibatkan kematian, perlakuan fraksi juga menurunkan aktivitas larva uji, larva tidak makan atau sedikit makannya dan akhirnya larva mati.
Pada perlakuan dengan fraksi yang paling aktif yaitu fraksi 1, lama perkembangan larva instar II ke III berkisar 2-4 hari, sedangkan lama perkembangan larva kontrol 2 hari. Perkembangan larva instar II ke IV berkisar 3.98-6 hari, sedangkan pada kontrol 3.46 hari (Tabel 14). Pada perlakuan fraksi 1 buah sirih hutan pada konsentrasi 125 ppm, lama perkembangan larva instar II ke III dan instar II ke IV tidak berbeda nyata dengan kontrol. Hal tersebut menandakan bahwa fraksi 1 di bawah nilai LC50 tidak cukup mempengaruhi
Hasil berbeda nyata terlihat pada selang konsentrasi 225-625 ppm, baik pada perkembangan larva instar II ke III maupun instar II ke IV. Pada konsentrasi tersebut perpanjangan lama perkembangan instar II ke III berkisar 0.26-2 hari, dan perpanjangan lama perkembangan instar II ke IV berkisar selama 1.13-2.54 hari. Tabel 13 Pengaruh fraksi-fraksi buah sirih hutan terhadap lama perkembangan
larva C. pavonana
Bahan uji Konsentrasi (%, b/v)
Rata-rata perkembangan ± SD (hari) (n) a Instar II ke III Instar II ke IV
SD: standar deviasi. n: jumlah larva yang bertahan hidup. Rataan pada lajur yang sama diikuti oleh huruf yang sama tidak berbeda nyata berdasarkan uji selang berganda Duncan (α = 0.05). b
Hal ini menunjukkan bahwa pada selang konsentrasi 225-625 ppm fraksi 1, tubuh serangga mampu mendetoksifikasi senyawa yang telah terserap dalam tubuh dan sebagai kompensasinya perkembangannya akan lebih lama daripada keadaan normal.
Pada perlakuan dengan insektisida abamektin, lama perkembangan larva instar II ke III berkisar 2-2.6 hari, sedangkan lama perkembangan larva kontrol 2 hari. Perkembangan larva instar II ke IV berkisar 3.98-6.67 hari, sedangkan pada kontrol 3.86 hari (Tabel 14). Pada perlakuan abamektin pada selang konsentrasi 2.76-11.04 ppm, lama perkembangan larva instar II ke III tidak berbeda nyata dengan kontrol, perpanjangan lama perkembangan instar II ke IV masing-masing selama 0.67, 0.59, dan 0.59 hari, kecuali pada konsentrasi 2.76 ppm. Hasil Tabel 14 Pengaruh fraksi 1 buah sirih hutan terhadap lama perkembangan larva
C. pavonana
Bahan uji Konsentrasi (ppm)
Rata-rata perkembangan ± SD (hari) (n) a Instar II ke III Instar II ke IV
berbeda nyata terlihat pada konsentrasi 13.80 dan 16.56 ppm, baik pada perkembangan larva instar II ke III maupun instar II ke IV. Pada konsentrasi tersebut perpanjangan lama perkembangan instar II ke III masing-masing selama 0.22 dan 0.6 hari, dan perpanjangan lama perkembangan instar II ke IV masing-masing selama 1.94 dan 2.81 hari.
Identifikasi Komponen Aktif
Fraksi yang teraktif sebagai insektisida yaitu fraksi 1 selanjutnya diidentifikasi dengan menggunakan kromatografi gas-spektrometer massa (GC-MS) dan spektrofotometer inframerah (FTIR) untuk mengetahui komponen senyawa aktif dalam fraksi tersebut. Kondisi GC-MS sebagai berikut: injector split mode 101:1, suhu 250 ˚C, waktu alir 37.14 menit, kolom yang digunakan adalah Agilent 19091S-436 HP-5MS, panjang 60 m, diameter 0.25 mm, suhu maksimum kolom 350 ˚C, aliran pertama 1 mL/menit, dan kecepatan rata-rata 26 cm/s. Gas pembawa helium, suhu detektor 250 ˚C dengan jenis pengionan electron impact (EI).
Hasil analisis GC-MS menunjukkan adanya beberapa puncak yang mengindikasikan bahwa fraksi 1 yang diperoleh belum murni (Gambar 6). Namun demikian, dalam fraksi 1 mengandung beberapa puncak senyawa yang kelimpahannya relatif cukup besar seperti puncak yang memiliki waktu retensi 6.05, 8.54, 9.54, dan 25.61 menit.