ORGANOGENESIS DAN KONSERVASI IN VITRO
PAMELO (Citrus maxima (Burm.) Merr.)
KARTIKA NING TYAS
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
PERNYATAAN MENGENAI DISERTASI DAN
SUMBER INFORMASI
Dengan ini saya menyatakan bahwa disertasi “Organogenesis dan Konservasi
In Vitro Pamelo (Citrus maxima (Burm.) Merr.).” adalah karya saya sendiri dengan arahan Komisi Pembimbing dan belum diajukan dalam bentuk apapun kepada Perguruan Tinggi manapun. Sumber informasi yang berasal atau dikutip dari karya yang diterbitkan maupun tidak diterbitkan dari penulis lain telah disebutkan dalam teks dan dicantumkan dalam Daftar Pustaka di bagian akhir disertasi ini.
Bogor, Agustus 2012
ABSTRACT
KARTIKA NING TYAS. Organogenesis and In Vitro Conservation of Pummelo (Citrus maxima (Burm.) Merr.). Under the direction of Slamet Susanto, Iswari Saraswati Dewi and Nurul Khumaida.
Indonesia has high diversity of pummelo (Citrus maxima (Burm.) Merr.) which economically potential. The pummelo diversity must be conserved to overcome its extinction due to biotic and abiotic stresses. In vitro conservation using slow growth technique can be considered as an alternative of ex-situconservation. The objective of this research was to study pummelo organogenesis and to find out an effective medium to conserve pummelo using slow growth technique. Three experiments were conducted in this research to conserve pummelo. Organogenesis was induced on pummelo leaf, root and epicotyl to find out the best explant and medium to produce pummelo shoot effectively. Two conservation experiments using slow growth were conducted to find out the best medium to conserve pummelo. The first conservation experiment was done using reduction of MS medium and sucrose concentration, while the second conservation method was done using osmotic regulator and retardant. The results showed effective direct organogenesis of pummelo could be induced by culturing epicotyl explant vertically in MS medium without plant growth regulator under 24 hour light. In the first conservation experiment, the best medium to conserve pummelo using reduction of MS medium and sucrose concentration was MS medium without sucrose that inhibited leaf formation 37%, shoot elongation 75%, root elongation 49,4%, and the estimation to conserve pummelo was 30,7 months. While in the second conservation experiment, the best medium to conserve pummelo using osmoticum and retardant is MS + sorbitol 2% + paclobutrazol 7,5 ppm, that inhibited shoot length 65,1%, leaf formation 84,6%, root number 20%, root length 81%, and the estimation to conserve pummelo was 22,2 months. However, based on percentage of growth inhibition to the planlet and the appearance of the conserved planlet, the more suitable medium to conserve pummelo was MS + sorbitol 2% + paclobutrazol 7,5 ppm. After conservation periode, pummelo could grow normally in recovery medium (MS0) and aclimatization medium (soil : husk : compos = 2 : 1 :1).
RINGKASAN
KARTIKA NING TYAS. Organogenesis dan Konservasi In Vitro Pamelo (Citrus maxima (Burm.) Merr.). Dibimbing oleh Slamet Susanto, Iswari Saraswati Dewi dan Nurul Khumaida.
Indonesia memiliki plasma nutfah pamelo (Citrus maxima (Burm.) Merr.) yang beragam dan potensial secara ekonomi. Budidaya pamelo pada sebagian besar sentra produksi dilakukan di lahan pekarangan yang rentan terhadap alih fungsi lahan dan dilakukan tidak secara intensif sehingga tanaman mudah terserang hama penyakit. Kekayaan plasma nutfah pamelo pada masing-masing sentra produksi bersifat khas sehingga perlu dijaga kelestariannya, antara lain melalui konservasi eks-situ secara in vitro menggunakan teknik pertumbuhan lambat (slow growth). Tujuan umum dari penelitian ini adalah untuk mempelajari organogenesis pada pamelo dan mendapatkan media yang efektif untuk konservasi in vitro pamelo melalui pertumbuhan lambat.
Penelitian ini terdiri atas tiga percobaan. Percobaan pertama adalah organogenesis untuk menginduksi pembentukan tunas adventif pada eksplan daun, akar dan epikotil pamelo untuk mendapatkan eksplan dan media yang efektif dalam menghasilkan tunas adventif secara langsung. Dua percobaan konservasi dilakukan untuk mendapatkan media yang sesuai untuk konservasi pamelo. Percobaan konservasi pertama dilakukan menggunakan penurunan konsentrasi media MS dan sukrosa, sedangkan percobaan konservasi kedua dilakukan menggunakan osmotikum dan retardan.
adventif dengan empat daun yang dikonservasi pada media MS + sorbitol 2% + paklobutrasol 7,5 ppm merupakan yang terbaik. Media ini menyebabkan penghambatan pemanjangan tunas 65,1%, pembentukan daun 84,6%, pembentukan akar 81% serta panjang akar 20%. Tunas adventif yang dikonservasi pada media ini diperkirakan dapat dikonservasi selama 22,2 bulan. Jika dibandingkan dengan konservasi pamelo pada media MS tanpa sukrosa maka berdasarkan persen penghambatan pertumbuhan dan visual planlet yang tetap hijau tampak konservasi pamelo yang paling sesuai adalah dengan menggunakan tunas adventif pada media MS + sorbitol 2% + paklobutrasol 7,5 ppm.
Media konservasi tetap dapat memelihara kemampuan tumbuh planlet selama tujuh bulan periode konservasi. Planlet dapat membentuk daun baru satu bulan setelah subkultur pada media pemulihan (MS0). Pada konservasi dengan penurunan konsentrasi media MS dan sukrosa, planlet yang dapat membentuk daun baru sebanyak 83,33% pada media yang mengandung sukrosa dan 66,67% pada media yang tidak mengandung sukrosa. Pada konservasi dengan osmotikum dan retardan, semua planlet yang berasal dari tunas adventif dapat membentuk daun baru. Planlet yang berasal dari pucuk kecambah yang dapat membentuk daun baru sebanyak 66,7% pada media yang mengandung sukrosa 3%, 33,3% pada media MS + sorbitol 2% + paklobutrasol 7,5%, 50% pada media MS + sorbitol 2% + paklobutrasol 15 ppm, sedangkan planlet yang tumbuh di media MS + sorbitol 2% tanpa paklobutrasol belum membentuk daun baru.
Aklimatisasi planlet pada media campuran tanah liat, sekam dan kompos (2 : 1 : 1) memberikan tingkat keberhasilan yang tinggi. Semua planlet pada perlakuan konservasi tetap hidup setelah satu bulan aklimatisasi, kecuali planlet yang berasal dari media MS + sorbitol 2%. Planlet pada media tersebut masih mengalami klorosis ketika diaklimatisasi.
© Hak cipta milik Institut Pertanian Bogor, tahun 2012
Hak cipta dilindungi Undang-Undang
ORGANOGENESIS DAN KONSERVASI IN VITRO
PAMELO (Citrus maxima (Burm.) Merr.)
KARTIKA NING TYAS
Disertasi
sebagai salah satu syarat untuk memperoleh gelar
Doktor
pada Program Studi Agronomi dan Hortikultura
SEKOLAH PASCASARJANA
INSTITUT PERTANIAN BOGOR
Penguji Ujian Tertutup:
1. Dr. Agus Purwito, MSc. Agr.
Ketua Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB.
2. Dr. Dewi Sukma, M.Si.
Staf pengajar Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB.
Penguji Ujian Terbuka:
1. Prof. Riset Dr. Ika Mariska, M.Sc.
Staf Peneliti Balai Besar Penelitian dan Pengembangan Bioteknologi dan Sumber Daya Genetik Pertanian.
2. Dr. Diny Dinarti, M.Si.
HALAMAN PENGESAHAN
Judul Penelitian : Organogenesis dan Konservasi In Vitro Pamelo
(Citrus maxima (Burm.) Merr.).
Nama Mahasiswa : Kartika Ning Tyas
NRP : A 262070071
Program Studi : Agronomi dan Hortikultura
Disetujui Komisi Pembimbing
Prof. Dr. Slamet Susanto, M.Sc. Ketua
Dr. Iswari Saraswati Dewi Dr. Nurul Khumaida, M.S. Anggota Anggota
Diketahui
Ketua Program Studi Dekan Sekolah Pascasarjana
Agronomi dan Hortikultura
Prof. Dr. Munif Ghulamahdi, M.S. Dr. Dahrul Syah, M.Sc. Agr.
PRAKATA
Puji dan syukur penulis panjatkan kepada Allah SWT atas rahmat dan hidayah-Nya sehingga penulis dapat menyelesaikan penelitian dan penulisan disertasi yang berjudul “Organogenesis dan Konservasi In Vitro Pamelo (Citrus maxima (Burm.) Merr.)”.
Penelitian dan penulisan disertasi ini berlangsung dibimbing Prof. Dr. Slamet Susanto, M.Sc. selaku Ketua Komisi Pembimbing dan dua Anggota Komisi Pembimbing yakni Dr. Iswari Saraswati Dewi, dan Dr. Nurul Khumaida, M.S. Pada kesempatan ini penulis menyampaikan terima kasih dan penghargaan yang tulus atas waktu dan kesempatan yang telah diluangkan dalam mengarahkan dan membimbing penulis.
Penelitian dan penyelesaian disertasi ini sebagian didanai oleh KKP3T 2009 dan Ristek 2010, karena itu penulis menyampaikan banyak terima kasih kepada Kementerian Pertanian dan Kementerian Negara Riset dan Teknologi selaku pemberi dana, serta tim peneliti KKP3T 2009 dan Ristek 2010. Ucapan terima kasih penulis sampaikan juga kepada Dr. Arifah Rahayu M.Si., M. Randi Ginting, SP dan Nugroho, SP atas kebersamaannya dalam penelitian.
Penghargaan yang setinggi-tingginya serta rasa terima kasih yang tulus, penulis sampaikan juga kepada :
1. Lembaga Ilmu Pengetahuan Indonesia yang telah memberikan ijin belajar dan beasiswa pada semester lima sampai tujuh kepada penulis.
2. Kepala Pusat Konservasi Tumbuhan Kebun Raya Bogor LIPI yang telah memberikan ijin belajar.
3. Rektor Institut Pertanian Bogor, Dekan Fakultas Pertanian, Ketua Program Studi Agronomi dan Hortikultura Sekolah Pascasarjana Institut Pertanian Bogor yang telah menerima penulis melanjutkan studi di Institut Pertanian Bogor.
saat sidang terbuka yang telah memberikan saran-saran dan koreksi untuk menyempurnakan tulisan ini.
5. Staf pengajar di Program Studi Agronomi dan Hortikultura Fakultas Pertanian IPB yang telah mengajarkan berbagai ilmu untuk penulis.
6. Prof. Dr. Didy Sopandie M.Agr. dan Dr. Dorly untuk semua bantuannya. 7. Kepala beserta Staf Laboratorium Kultur Jaringan Tanaman dan Laboratorium
Mikroteknik Faperta IPB, atas kerjasama, kebersamaan, dan bantuannya. 8. Rekan-rekan AGH 2007 atas kebersamaan dan bantuannya yang tanpa pamrih. 9. Keluarga Dr. La Muhuria M.P. (alm); Dr. Sri Rahayu M.Si., Tri Lestari, M.Si
dan Bapak Sukimin atas bantuan dan doanya.
10. Ayahanda Drs. Mulyadi (alm) dan ibunda Siti Kartini (alm) serta Ibunda Dra. Siti Rochani, M.Pd. yang telah membesarkan dan mendidik penulis dengan
kasih sayang dan do‟anya.
11. Suami tercinta Ir. Gunawan Setyono yang telah memberi dana dan ijin untuk melanjutkan studi ke Sekolah Pascasarjana IPB dan anak-anak yang tersayang: Aslam, Nabil dan Arkaan atas do‟a, dorongan, pengertian, dan pengorbanannya.
12. Keluarga besar Wignyo Sartono, Bani Sidiq dan Bani Chusaini atas doanya. 13. Adik-adik sekeluarga: Endah Safitri, M.T.; Ratna Adi Jaya, SE; dr. Evi
Rokhayati, SpA atas iringan do‟a dan motivasinya.
14. Rekan-rekan di Sekolah Pascasarjana IPB, PKT-Kebun Raya Bogor-LIPI, Laboratorium Kultur Jaringan IPB serta semua pihak yang telah memberikan dukungan dan bantuan serta doa.
Semoga karya ini bermanfaat bagi pengembangan ilmu pengetahuan, khususnya di bidang pertanian. Amin.
Bogor, Agustus 2012
RIWAYAT HIDUP
Penulis lahir di Surakarta pada 7 April 1969, merupakan putri pertama dari empat bersaudara dari ayah Drs. Mulyadi dan Ibu Siti Kartini. Penulis dididik dan dibesarkan Ibu Dra. Siti Rochani, M.Pd. Penulis menikah dengan Ir. Gunawan Setyono dan telah dikaruniai tiga putra.
Pada Juli 1987, penulis diterima melalui jalur PMDK di Fakultas Pertanian Universitas Negeri Sebelas Maret Surakarta Jurusan Budidaya Pertanian Program Studi Agronomi dan lulus pada bulan Maret 1992. Jenjang Strata dua (S-2) diikuti pada Program Studi Agronomi Sekolah Pascasarjana Institut Pertanian Bogor mulai pada Agustus 2003 dan selesai September 2006. Selanjutnya, sejak Agustus 2007 penulis mengikuti pendidikan jenjang Strata tiga (S-3) di Program Studi Agronomi dan Hortikultura Sekolah Pascasarjana Institut Pertanian Bogor.
DAFTAR ISI
Penurunan konsentrasi media untuk konservasi in vitro ... 10
Pengaturan potensial osmotik pada media untuk konservasi in vitro...
Simpulan ... Saran ...
51 52 5. KONSERVASI PAMELO (Citrus maxima (Burm.) Merr.) DENGAN
REGULATOR OSMOTIK DAN RETARDAN ... Abstrak ... Abstract ...
53 53 53
Pendahuluan... 54
Bahan dan Metode... 55
Hasil dan Pembahasan ... 57
Simpulan ... Saran ... 68 69 6. 6. PEMBAHASAN UMUM ... 70
7. SIMPULAN DAN SARAN ... 76
DAFTAR PUSTAKA ... 77
LAMPIRAN ... 83
DAFTAR GAMBAR
Nomor Halaman
1.1 Bagan alur penelitian ... 4 2.1 Model pengendalian dalam siklus sel pada transisi dari G1 ke S oleh
sukrosa, auksin dan sitokinin ... 11 2.2 Struktur kimia paklobutrazol (Milfont et al. 2008) ... 12 2.3 Penghambatan oleh paklobutrazol (----) pada tiga tahap pembentukan
Gibberelin yang dapat menyebabkan akumulasi phytol (klorofil), asam absisik dan squalene ... 13 2.4 Tahapan yang dilalui sel-sel eksplan dalam organogenesis langsung . ... 15 2.5 Regulasi phytohormon dalam tanaman ... 17 2.6 Konsentrasi relatif auksin dan sitokinin diperlukan secara khusus
untuk pertumbuhan dan morfogenesis ... 18 2.7 Interkonversi IAA dan IBA ... 19 2.8 NAA. Auksin sintetik yang digunakan dalam kultur jaringan tanaman 20 2.9 Benzyl adenine, sitokinin yang digunakan dalam kultur jaringan
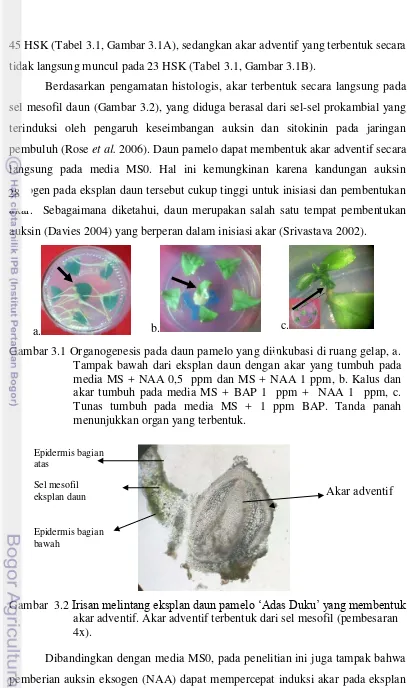
tanaman ... 21 2.10 Struktur kimia GA3... 21 3.1 Organogenesis pada daun pamelo yang diinkubasi di ruang gelap ... 29 3.2 Irisan melintang eksplan daun pamelo „Adas Duku‟ yang membentuk
akar adventif ... 29 3.6 Irisan melintang pada eksplan epikotil menunjukkan tunas adventif
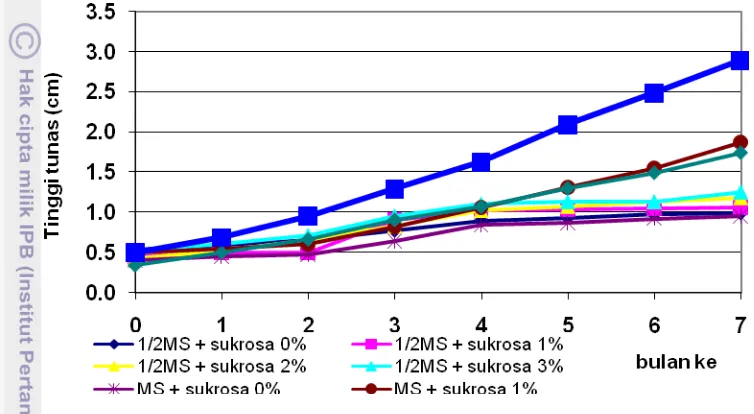
tumbuh secara langsung dari kambium di antara berkas pembuluh ... 35 4.1 Pertumbuhan tunas pamelo pada konservasi dengan penurunan
konsentrasi media MS dan sukrosa ... 41 4.2 Pertumbuhan daun pamelo pada perlakuan konservasi dengan
penurunan konsentrasi media MS dan sukrosa ... 41 4.3 Penambahan jumlah daun pada konservasi dengan penurunan
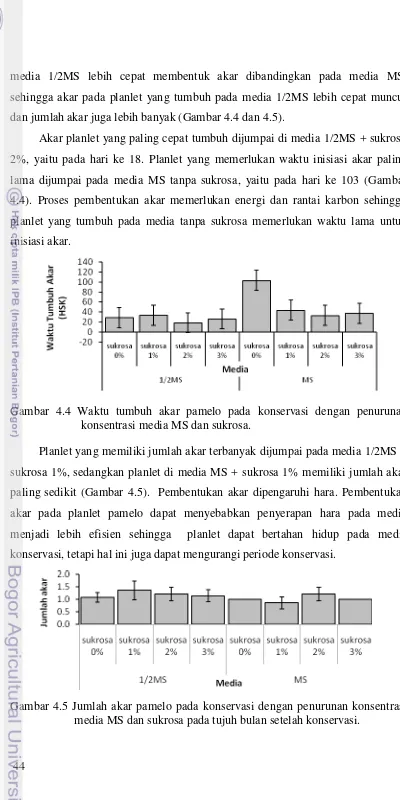
konsentrasi media MS dan sukrosa tujuh bulan setelah konservasi ... 43 4.4 Waktu tumbuh akar pada konservasi dengan penurunan konsentrasi
4.5 Jumlah akar pamelo pada konservasi dengan penurunan konsentrasi media MS dan sukrosa tujuh bulan setelah konservasi ...
44 4.6 Anatomi akar pamelo pada konservasi dengan penurunan konsentrasi
media MS dan sukrosa ... 46 4.7 Keragaan visual pamelo „Adas Duku‟ pada konservasi dengan
penurunan konsentrasi media MS dan sukrosa tujuh bulan setelah konservasi ... 46 4.8 Persentase pertumbuhan relatif tinggi tunas pamelo pada konservasi
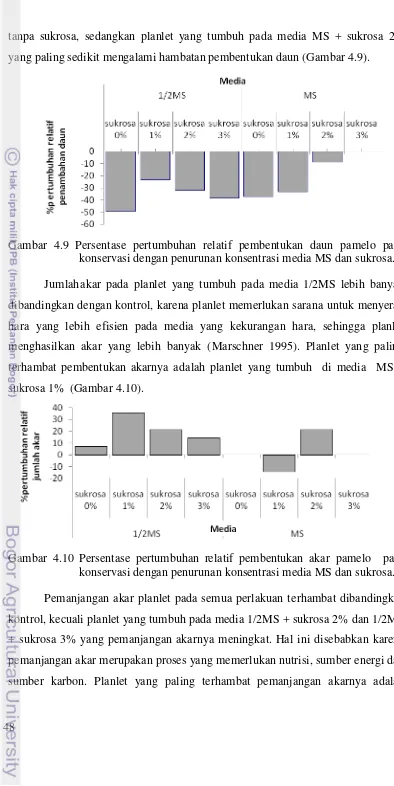
dengan penurunan konsentrasi media MS dan sukrosa ... 47 4.9 Persentase pertumbuhan relatif pembentukan daun pamelo pada
konservasi dengan penurunan konsentrasi media MS dan sukrosa ... 48 4.10 Persentase pertumbuhan relatif pembentukan akar pamelo pada
konservasi dengan penurunan konsentrasi media MS dan sukrosa ... 48 4.11 Persentase pertumbuhan relatif panjang akar pamelo pada konservasi
dengan penurunan konsentrasi media MS dan sukrosa ... 49 5.1 Penambahan tinggi tunas pamelo pada konservasi dengan osmotikum
dan retardan tujuh bulan setelah konservasi ... 58 5.2 Penambahan jumlah daun pamelo pada konservasi dengan osmotikum
dan retardan tujuh bulan setelah konservasi ... 59 5.3 Jumlah akar pamelo pada konservasi dengan osmotikum dan retardan
tujuh bulan setelah konservasi ... 60 5.4 Panjang akar pamelo pada konservasi dengan osmotikum dan retardan
tujuh bulan setelah konservasi ... 61 5.5 Anatomi akar plantlet pamelo pada konservasi dengan osmotikum dan
retardan ... 61 5.6 Keragaan visual plantlet yang berasal dari pucuk kecambah pamelo
„Adas Duku‟ pada konservasi dengan osmotikum dan retardan ... 62 5.7 Keragaan visual plantlet yang berasal dari tunas adventif pamelo
„Adas Duku‟ tujuh bulan setelah konservasi dengan osmotikum dan retardan ... 63 5.8 Persentase pertumbuhan relatif jumlah daun pamelo pada konservasi
dengan osmotikum dan retardan tujuh bulan setelah konservasi ... 64 5.9 Persentase pertumbuhan relatif panjang tunas pamelo pada konservasi
dengan osmotikum dan retardan tujuh bulan setelah konservasi ... 65 5.10 Persentase pertumbuhan relatif jumlah akar pamelo pada konservasi
dengan osmotikum dan retardan tujuh bulan setelah konservasi ... 65 5.11 Persentase pertumbuhan relatif panjang akar pamelo pada konservasi
dengan osmotikum dan retardan tujuh bulan setelah konservasi ... 66
DAFTAR TABEL
Nomor Halaman
3.1 Organogenesis pada eksplan daun pamelo „Adas Duku‟ dua bulan
setelah kultur ... 28 3.2 Respon akar pamelo „Adas Duku‟ pada empat bulan setalah kultur ... 31 3.3 Inisiasi tunas pada eksplan epikotil pamelo „Adas Duku‟ di ruang gelap
pada media yang berespon dua bulan setelah kultur ... 33 3.4 Pengaruh posisi eksplan epikotil pamelo „Adas Duku‟ terhadap inisiasi
tunas di media MS0 dua bulan setelah kultur ... 34 4.1 Pengaruh tunggal penurunan konsentrasi media MS dan sukrosa
terhadap tinggi tunas pamelo „Adas Duku‟ tujuh bulan setelah
konservasi ... 42 4.2 Pengaruh tunggal penurunan konsentrasi media MS dan sukrosa
terhadap panjang akar pamelo „Adas Duku‟ tujuh bulan setelah
konservasi ... 45 4.3 Pemulihan dan aklimatisasi pamelo „Adas Duku‟ setelah konservasi
dengan penurunan konsentrasi media MS dan sukrosa ... 50 4.4 Perkiraan lama konservasi dengan penurunan konsentrasi media MS
dan sukrosa berdasar pertumbuhan panjang tunas... 51 5.1 Pemulihan dan aklimatisasi pamelo „Adas Duku‟ setelah konservasi
dengan menggunakan osmotikum dan retardan ... 67 5.2 Perkiraan lama konservasi dengan osmotikum dan retardan berdasar
pertumbuhan panjang tunas ... 68 6.1 Persentase pertumbuhan relatif pamelo „Adas Duku‟ pada media
konservasi dengan penurunan konsentrasi media MS dan sukrosa selama tujuh bulan ... 72 6.2 Persentase pertumbuhan relatif pamelo „Adas Duku‟ pada media
DAFTAR LAMPIRAN
Nomor Halaman
1 Pamelo „Adas Duku‟ dari Magetan Jawa Timur ... 84 2 Karakter pamelo „Adas Duku‟... 85 3 Komposisi Media MS (Murashige dan Skoog 1962) ... 88 4 Hasil uji percobaan konservasi dengan penurunan konsentrasi media
MS dan sukrosa ... 89 5 Hasil uji percobaan konservasi dengan osmotikum dan retardan ... 91
1. PENDAHULUAN
Latar Belakang
Indonesia merupakan salah satu negara asal dan tempat penyebaran tanaman jeruk (Niyomdham 1997). Berbagai jenis jeruk telah ditemukan tumbuh dari dataran rendah sampai tinggi. Salah satu jenis jeruk yang potensial untuk dikembangkan adalah jeruk pamelo {Citrus maxima (Burm.) Merr.}. Renstra Badan Litbang Pertanian 2005-2009 juga menyebutkan bahwa pamelo merupakan salah satu jenis buah-buahan yang mendapatkan prioritas utama untuk dikembangkan.
Pamelo potensial dikembangkan karena mempunyai karakteristik yang khas yaitu buahnya berukuran besar, memiliki rasa segar dan daya simpan lama sampai empat bulan (Susanto 2004) dan beberapa kultivar pamelo mengandung 105 mg vitamin C per 100g bagian yang dapat dimakan (Ara et al. 2008). Disamping itu pamelo memiliki nilai ekonomi yang relatif tinggi bagi petani karena harga per buahnya dapat mencapai Rp. 5.000 (di Sumedang, Magetan, dan Pangkep) sampai Rp. 15.000 (di Aceh, Pati/Kudus), sedangkan rata-rata produksinya dapat mencapai 200 buah/pohon per tahun.
plasma nutfah karena pamelo yang dibudidayakan secara luas adalah pamelo yang
disukai konsumen. Pamelo „Adas Duku‟ merupakan salah satu pamelo yang
potensial dikembangkan karena mempunyai daging buah berwarna merah dan
kandungan naringin yang lebih rendah dibandingkan pamelo „Nambangan‟
(Rahayu 2012), sehingga tingkat kegetirannya lebih rendah dibandingkan
„Nambangan‟. Pamelo „Adas Duku‟ termasuk salah satu pamelo yang terancam
punah karena jarang dibudidayakan disebabkan daging buahnya yang cepat mengering jika tidak segera dipanen setelah masak. Pada umumnya, penundaan masa panen dilakukan petani untuk menunggu harga yang sesuai.
Upaya konservasi perlu dilakukan untuk mencegah kepunahan pamelo, baik akibat tidak dibudidayakan maupun akibat cekaman biotik dan abiotik. Konservasi dapat dilakukan, baik secara in-situ dengan membuat kebun koleksi di sentra produksi pamelo maupun secara eks-situ. Pelestarian eks-situ dilakukan bukan di habitat alamiahnya melainkan di suatu tempat penyimpanan atau bank gen (Towill 2005), dan konservasi secara in vitro (Wattimena et al. 1992).
Teknik konservasi in vitro meliputi (1) konservasi jangka pendek (penyimpanan dalam keadaan tumbuh), (2) konservasi jangka menengah (penyimpanan dengan metode pertumbuhan lambat atau pertumbuhan minimal), dan (3) konservasi jangka panjang dengan metode kriopreservasi (Rao 2004; Leunufna 2004). Pelestarian secara in vitro mempunyai beberapa kelebihan, seperti penghematan area, tenaga kerja, biaya dan waktu, juga kemudahan dalam pertukaran plasma nutfah (Towill 2005).
Teknik pertumbuhan lambat dapat dilakukan melalui: 1) penurunan suhu lingkungan dan intensitas cahaya (Hu dan Wang 1983; Withers 1985), 2) penggunaan osmotikum seperti sukrosa dan manitol (Withers 1985; Bessembinder
et al. 1993), 3) penurunan taraf beberapa faktor esensial seperti pengenceran media (Desbrunais et al. 1992), dan 4) penggunaan zat penghambat tumbuh seperti paklobutrasol, cycocel, dan ancymidol (Withers 1985).
Pada konservasi in vitro, penggunaan tunas sebagai eksplan akan mempermudah pemulihan dan penggunaannya setelah konservasi (Botau et al.
2005). Tunas sebagai sumber eksplan harus dapat diinduksi secara langsung
melalui organogenesis dari bagian-bagian tanaman yang bersifat meristematik sehingga perubahan genetik yang terjadi relatif kecil (Trigiano dan Gray 2005).
Jenis tanaman yang telah berhasil disimpan dengan teknik pertumbuhan lambat antara lain ubi jalar (Roostika dan Sunarlim 2001), ubi kayu (Sunarlim dan Zuraida 2001), gembili (Sunarlim et al. 2004), kentang hitam (Roostika et al. 2005), talas (Dewi 2002). Pada pamelo cv Sri Nyonya, Dewi et al. (2010) melaporkan bahwa dari pengamatan sampai dengan lima bulan setelah kultur, pertumbuhan lambat dapat diinduksi menggunakan media MS + sorbitol 2%. Namun, konservasi in vitro untuk menginduksi pertumbuhan lambat pada pamelo menggunakan media kombinasi penurunan konsentrasi media MS dan sukrosa serta kombinasi perlakuan osmotikum dan retardan belum dilakukan pada pamelo.
Tujuan
Tujuan umum dari penelitian ini untuk mempelajari konservasi pamelo secara in vitro melalui pertumbuhan lambat.
Tujuan khusus dari penelitian ini adalah untuk :
1. Mendapatkan eksplan dan media yang efektif menginduksi tunas melalui organogenesis langsung pada pamelo.
2. Mendapatkan media konservasi pamelo melalui pertumbuhan lambat dengan penurunan konsentrasi media MS dan sukrosa.
3. Mendapatkan media konservasi pamelo melalui pertumbuhan lambat dengan penggunaan osmotikum dan retardan.
Hipotesis
1. Terdapat jenis eksplan dan media yang efektif dalam membentuk tunas melalui organogenesis langsung pada pamelo.
2. Terdapat komposisi media MS dan konsentrasi sukrosa tertentu yang dapat menghambat pertumbuhan planlet pamelo.
3. Terdapat komposisi media MS mengandung osmotikum dan konsentrasi retardan yang dapat menghambat pertumbuhan planlet pamelo.
Manfaat
1. Media dan eksplan yang efektif untuk mendapatkan tunas melalui organogenesis langsung pada pamelo.
2. Media konservasi untuk jangka menengah (lebih dari lima bulan) melalui pertumbuhan lambat untuk pamelo.
Alur Penelitian
Penelitian dilakukan dalam tiga percobaan. Pada percobaan pertama dilakukan organogenesis pada daun, akar dan epikotil pamelo (Citrus maxima
(Burm.) Merr.). Media dan eksplan terbaik yang dapat menghasilkan tunas melalui induksi tunas secara langsung kemudian digunakan untuk menyediakan eksplan bagi percobaan kedua dan ketiga. Percobaan kedua adalah konservasi pamelo (Citrus maxima (Burm.) Merr.) menggunakan penurunan konsentrasi media MS dan sukrosa, dan percobaan ketiga adalah konservasi pamelo (Citrus maxima (Burm.) Merr. dengan osmotikum dan retardan. Bagan alur kerangka penelitian “Organogenesis dan Konservasi In Vitro Pamelo (Citrus maxima
(Burm.) Merr.)” disajikan pada Gambar 1.1.
Gambar 1.1 Bagan alur penelitian organogenesis dan konservasi in vitro pamelo PAMELO
Organogenesis langsung:
Macam eksplan (daun, akar, epikotil)
ZPT : BAP (0,1,2 ppm) dan NAA (0; 0,5; 1 ppm) Kondisi inkubasi : terang dan gelap
Posisi eksplan : vertikal dan horisontal
Konservasi in vitro pamelo:
Konsentrasi media MS (1/2 MS dan MS) dan sukrosa (0, 1, 2, 3%) Osmotikum (sukrosa 3%, sorbitol 2%) dan retardan (paklobutrasol 0; 7,5
dan 15 ppm)
Eksplan dan media efektif untuk organogenesis langsung dan media konservasi pamelo dengan
pertumbuhan lambat
2. TINJAUAN PUSTAKA
Botani, Asal Usul dan Manfaat Pamelo (Citrus maxima (Burm.) Merr.
Jeruk (Citrus) terdiri atas tiga spesies asal, yaitu Citrus medica L. (citron),
Citrus maxima (Burm.) Merr. (pamelo) dan Citrus reticulata Blanco (mandarin). Pamelo memiliki sinonim C. grandis (L.) Osbeck, C. decumana L., C. aurantium
var. grandis L. dan C. aurantium var. decumana L. (Manner et al. 2006). Pamelo memiliki jumlah kromosom 2n = 18 (Niyomdham 1997). Hasil persilangan antara pamelo dan mandarin (Citrus × aurantium) menghasilkan tiga hibrid pamelo yaitu: 1. Citrus × aurantium (pomelo × mandarin) sering disebut sebagai jeruk asam (sour orange) yang lebih banyak membawa sifat pamelo daripada mandarin. 2. Citrus × sinensis (pomelo × mandarin) yang sering disebut jeruk manis (sweet orange) yang lebih banyak membawa sifat mandarin daripada pamelo. Kelompok ini termasuk semua silangan dari orange, mandarin dan grapefruit seperti tangor, ortanique, tangelo dan hasil persilangan baliknya (Page dan Nova). 3. Citrus ×
paradisi (pomelo × orange) sering disebut sebagai grapefruit (Mabberley 1997). Tanaman pamelo berbentuk pohon dengan tinggi dapat mencapai 15 meter (Manner et al. 2006). Daun pamelo berbentuk bulat telur sampai jorong; dengan ukuran 5-20 cm x 2-12 cm; pangkal membundar sampai menjantung; tepi daun rata sampai beringgit dangkal; ujung daun lancip sampai tumpul. Terdapat bintik-bintik kelenjar minyak. Panjang tangkai daun dapat mencapai 5 cm, bersayap yang lebarnya dapat mencapai 2 cm. Daun muda berwarna hijau muda, daun tua berwarna hijau agak suram (Niyomdham 1997). Bunga pamelo tunggal atau dalam tandan bunga; kuncup berwarna putih, kelopak bunga 3-5. Stamen 25-35, beberapa tidak berkembang sempurna. Tangkai putik panjang (Dianxiang dan Mabberley 2008).
Pamelo berasal dari Malesia yang meliputi Semenanjung Malaysia, Filipina, Thailand bagian selatan, Sarawak, Brunai, Indonesia, Papua Nugini dan pulau-pulau kecil di sekitar Papua Nugini. Pamelo kemudian tersebar sampai ke Indochina; Cina bagian selatan dan bagian selatan Jepang dan dan menyebar ke arah barat ke India, wilayah Mediteran dan Amerika Tropik. Pamelo telah dibudidayakan dengan baik di China, Jepang, Vietnam, Malaysia, Indonesia dan Thailand (Niyomdham 1997).
Menurut Ara et al. (2008) buah pamelo mengandung 90,3 g air, 0,3 g mineral, energi 38 k.cal, 0,5 g protein, 0,3 g lemak, 8,5 g karbohidrat, 37 mg kalsium, 0,2 mg zat besi, 120 μg karoten, 0,06 mg B1, 0,04 mg vitamin-B2 dan 105 mg vitamin C per 100g bagian yang dapat dimakan. Buah pamelo biasanya dimakan segar atau dibuat jus, kadang dibuat selai dan sirop. Kulit buah mengandung beberapa senyawa volatil dan secara tradisional digunakan untuk mengobati batuk, memar dan epilepsi. Lapisan kulit luar dapat dimanfaatkan untuk membuat manisan. Lapisan kulit bagian tengah (albedo) dapat diekstrak untuk diambil pektinnya yang digunakan sebagai serat diet untuk mengurangi berat badan (Morton 1987).
Perbanyakan dan Budidaya Pamelo
Pamelo dapat diperbanyak dengan biji, stek, cangkok, dan penyambungan. Perbanyakan dengan biji menghasilkan tanaman yang memerlukan waktu sekitar 5-6 tahun untuk berbuah (Niyomdham 1997). Tanaman juga peka terhadap penyakit, dan sulit memperoleh tanaman yang sama dengan induknya (true to type) serta cenderung berduri lebih banyak dibanding dari hasil penyambungan (Manner et al. 2006). Secara komersial, pamelo biasanya diperbanyak dengan menempel/okulasi mata tunas (Anonim 2007).
Pamelo tumbuh baik pada ketinggian kurang dari 400 m di atas permukaan laut, pada tanah dalam dengan tekstur medium. Suhu harian 25–30 oC, curah hujan 1.500-1.800 mm dengan 3-5 bulan kemarau. Pamelo biasanya ditanam dengan jarak tanam 8-10 m x 6-8 m (Niyomdham 1997).
Bunga pamelo tumbuh pada awal musim hujan. Buah matang 7-10 bulan setelah muncul bunga. Hasil buahnya dapat mencapai 200 buah per pohon. Panen
raya biasanya terjadi pada bulan April-Juli dan panen kecil dilakukan pada bulan Desember-Januari. Perawatan tanaman pamelo meliputi pemupukan, pengendalian hama penyakit, pemangkasan dan pembungkusan buah (Deptan 2007). Dosis pupuk N, P dan K yang direkomendasikan berdasarkan hasil panen untuk tanaman pamelo Nambangan di tanah Entisol Sukomoro, Kabupaten Magetan adalah 150% dari total NPK yang terangkut buah atau setara dengan 2,775% (N : P : K = 2 : 1 : 4) dari bobot buah yang dipanen per tahun. Dosis tersebut 50% diaplikasikan pada awal musim hujan dan sisanya diaplikasikan empat bulan dari pemupukan pertama (Sutopo et al. 2006).
Penyakit yang dapat menyerang tanaman pamelo antara lain CVPD (Citrus Vein Phloem Degeneration) yang disebabkan oleh Liberobacter asiaticus (bakteri gram negatif) melalui perantaraan vektor kutu loncat Diaphorina citri. Penyakit lainya adalah tristeza (CTV), puru berkayu (CVEV), exocortis (CEV), psorosis (CPsV), cachexia xyloporosis (CcaV), dan tatter leaf (CTLV) (Anonim 2007).
Konservasi Plasma Nutfah
Keanekaragaman hayati adalah variasi yang ada pada spesies tumbuhan dan hewan, material genetiknya dan ekosistem tempat spesies tersebut berada (Indrawan et al. 2007). Pamelo Indonesia juga memiliki keragaman yang khas pada masing-masing sentra produksi. Kultivar pamelo yang terdapat di Indonesia
antara lain „Giri Matang‟ (Putih Manis), „Putih Asam‟, „Merah Manis‟ dan „Merah Asam‟ (Aceh), „Bageng Taji‟ (Pati), „Muria Putih‟ dan „Muria Merah‟ (Kudus),
„Nambangan‟, „Bali Merah‟, „Bali Putih‟, „Adas Duku‟, „Jawa‟, „Magetan‟, „Sri Nyonya‟ (Magetan) (Susanto 2010). Beberapa kultivar pamelo telah dibudidayakan secara luas di sentra produksi seperti Giri Matang, Bageng Taji, Nambangan dan Bali Merah yang juga merupakan varietas unggulan yang telah dilepas pemerintah. Keberadaan pamelo yang bersifat khas dan budidayanya di lahan pekarangan ini rentan terhadap kerusakan habitat dan serangan hama penyakit, sehingga upaya konservasi diperlukan untuk menjaga kelestariannya.
Tujuan utama dari kegiatan konservasi adalah untuk mengoleksi dan mengelola keragaman genetik agar terjamin keberadaannya di masa yang akan datang (Rao 2004). Konservasi perlu dilakukan sesuai prinsip etika biologi
konservasi yang meliputi: 1. Keanekaragaman spesies dan komunitas biologi harus dilindungi, 2. Kepunahan spesies yang terlalu cepat harus dihindari, 3. Kompleksitas ekologi harus dipelihara, 4. Evolusi harus berlanjut, dan 5. Keanekaragaman hayati memiliki nilai intrinsik (Indrawan et al. 2007).
Konservasi dapat dilakukan secara in-situ dan eks-situ. Konservasi secara
in-situ meliputi pengelolaan sumber daya genetik di habitat alaminya, baik sebagai komunitas tumbuhan liar dan tidak dibudidayakan atau kultivar-kultivar tanaman di lahan petani sebagai komponen pada sistem budidaya tradisional. Konservasi eks-situ meliputi konservasi di luar habitat alami melalui bank biji, kebun-kebun koleksi dan kebun raya. Penyimpanan DNA dan polen secara tidak langsung juga berkontribusi pada konservasi eks-situ sumber daya genetik tanaman (Towill 2005).
Konservasi eks-situ pamelo antara lain telah dilakukan oleh kebun koleksi Balai Penelitian Jeruk dan Tanaman Tropika di Batu Malang. Konservasi eks-situ
dengan menanam koleksi hidup pada tanaman jeruk dilakukan di dalam rumah kassa yang bebas serangga (insect-proof screenhouse) dan di kebun koleksi. Di dalam rumah kassa, koleksi diharapkan akan terlindungi dari patogen yang ada di tanah dan udara. Untuk keperluan tersebut, maka rumah kassa biasanya memiliki dua lapis dinding kassa dan dua lapis pintu masuk serta jadwal pengendalian hama penyakit pada interval waktu tertentu. Selain itu, koleksi ditanam di dalam wadah supaya terhindar dari aliran permukaan. Jumlah koleksi yang ditanam minimum dua tanaman/genotipe, yang diperbarui setiap 10 tahun (Carimi et al. 2012).
Koleksi pamelo dapat ditanam pada kebun koleksi jeruk, yang sebaiknya memenuhi syarat: 1. berlokasi sekurang-kurangnya 100 m dari kebun komersial, bebas patogen dan inokulum jamur perusak (Phoma traecheiphila), 2. tanahnya subur dan tidak ditanami jeruk selama lima tahun, bebas dari tunggul-tunggul jeruk, bebas nematoda dan jamur penting dalam pertanian, 3. terhindar dari aliran permukaan, 4. tidak ada tanaman selain jeruk. Jumlah koleksi yang ditanam 4–8 tanaman/genotipe, koleksi dipetakan dan dilabel dengan baik. Penanaman dilakukan pada plot yang homogen untuk satu spesies tunggal. Pengendalian hama penyakit dilakukan secara rutin. Plot diperbarui setiap 40 tahun (Carimi et al. 2012).
Keuntungan dari koleksi hidup adalah bersifat sama dengan induknya (true to type). Namun demikian, konservasi eks-situ pada kebun koleksi rawan terhadap kerusakan akibat hama penyakit dan bencana alam, perlu lahan luas, tenaga dan biaya untuk perawatan koleksi (Rao 2004). Untuk itu diperlukan metode lainnya yang dapat mengatasi kelemahan metode konservasi ini yaitu dengan konservasi
eks-situ secara in vitro.
Konservasi In Vitro
Teknik kultur in vitro merupakan teknologi alternatif yang dapat diterapkan untuk menghindari kepunahan tanaman. Tujuan utama dari konservasi plasma nutfah secara in vitro adalah mengurangi jumlah subkultur dan memelihara keragaman genetik pada suatu spesies dalam kondisi steril tanpa mengubah stabilitas genetik (Moges et al. 2003). Teknik konservasi in vitro
mempunyai beberapa kelebihan, seperti penghematan area, tenaga kerja, biaya dan waktu, juga kemudahan dalam pertukaran plasma nutfah. Selain itu, dapat mencegah hilangnya genotipe akibat cekaman biotik dan abiotik yang banyak terjadi di kebun-kebun koleksi (Rao 2004, Towill 2005).
Teknik konservasi in vitro dapat dilakukan untuk jangka pendek dengan cara sub kultur secara rutin setiap dua bulan sekali ke dalam media yang sama. Teknik konservasi jangka menengah dengan pertumbuhan lambat dapat dilakukan dengan menggunakan satu atau kombinasi beberapa faktor dengan periode konservasi sampai 15 tahun. Konservasi jangka panjang dilakukan melalui kriopreservasi di dalam nitrogen cair pada suhu -192 oC (Rao 2004). Teknik penyimpanan in vitro jangka pendek dan jangka menengah dengan tindakan subkultur yang berulang-ulang kurang efisien, karena memerlukan waktu, tenaga, ruangan, dan biaya. Subkultur juga dapat menyebabkan kultur mengalami kontaminasi dan kehilangan vigoritas karena kehabisan unsur hara yang terdapat dalam media dan berpeluang terjadinya perubahan genetik akibat penggunaan zat penghambat tumbuh dalam jangka waktu yang relatif lama (Kartha 1985).
Konservasi dengan induksi pertumbuhan lambat dapat dilakukan melalui berbagai cara antara lain berupa pengurangan komposisi hara media, penyimpanan pada suhu rendah, induksi stres osmotik, penggunaan zat
penghambat pertumbuhan dan penggunaan tempat kultur yang lebih besar dan volume media yang lebih banyak (Withers 1985; Hu dan Wang 1983).
Penggunaan suhu rendah merupakan teknik utama yang dilakukan untuk konservasi in vitro. Teknik ini dapat mengurangi masalah penyakit, frekuensi subkultur, hemat tenaga, dan ruang, tetapi memerlukan energi listrik untuk menjaga kestabilan suhu. Penghambatan pertumbuhan dapat terjadi pada suhu rendah karena dinding sel planlet menjadi tebal akibat akumulasi lemak tidak jenuh, sehingga pembelahan dan pemanjangan sel terhambat (Shibli et al. 2006). Suhu yang diperlukan untuk konservasi tergantung ekologi dan asal geografi masing-masing spesies yang dikoleksi, umumnya berkisar 0–5oC. Beberapa tanaman telah berhasil dikonservasi pada suhu rendah seperti kopi (Debrunais et al. 1992) dan minth (Reed 1999).
Penurunan konsentrasi media untuk konservasi in vitro
Pertumbuhan dan perkembangan tanaman secara in vitro dipengaruhi oleh faktor genetik, lingkungan dan komponen media. Media kultur dapat dengan mudah dimanipulasi sesuai tujuan. Media kultur in vitro terdiri dari 95% air, hara makro dan mikro, zat pengatur tumbuh, vitamin, gula dan kadang ditambahkan material organik sederhana sampai komplek (Beyl 2005).
Media MS (Murashige dan Skoog 1962) merupakan media yang paling sesuai dan paling sering digunakan dalam kultur in vitro. Media ini dikembangkan dari hasil analisis mineral jaringan tembakau. Media MS merupakan media dengan kandungan „garam tinggi‟ karena kandungan garam K dan N tinggi (Beyl 2005). Dalam konservasi in vitro, untuk menghambat pertumbuhan kultur dapat dilakukan dengan penurunan konsentrasi media MS. Besarnya penghambatan pertumbuhan akan berpengaruh pada periode konservasi (Catana et al. 2010)
Gula merupakan bagian penting dari media yang akan mensuplai nutrisi bagi kultur, sumber energi dan sumber karbon yang diperlukan untuk pertumbuhan dan perkembangan kultur (Javed dan Ikram 2008). Gula diperlukan dalam media karena sebagian besar kultur tanaman tidak dapat berfotosintesis secara efisien disebabkan pembentukan jaringan dan organisasi seluler yang belum sempurna, kurangnya klorofil, pertukaran gas terbatas, dan kondisi lingkungan yang tidak optimum seperti intensitas cahaya yang rendah (Beyl
2005). Penyerapan molekul gula ke jaringan tanaman terjadi melalui osmosis dan transpor aktif dengan pompa proton (H+) (Thorpe et al. 2008). Jenis dan konsentrasi gula tergantung pada jenis dan tahap perkembangan tanaman yang dikultur (Beyl 2005). Gula dalam media juga berfungsi sebagai regulator osmotik atau osmotikum (Hilae dan Te-chato 2005).
Gula yang yang digunakan dalam kultur antara lain glukosa, fruktosa, dan sukrosa. Sukrosa merupakan sumber karbon yang biasa digunakan dalam kultur jaringan karena dapat dimanfaatkan semua tanaman. Sukrosa bersama auksin dan sitokinin juga berperan dalam menginduksi terjadinya siklus sel (Gambar 2.1), sehingga kekurangan sukrosa pada tanaman akan berpengaruh terhadap siklus sel (Gahan 2007). Konsentrasi sukrosa dalam kultur jaringan tanaman yang menghasilkan pertumbuhan optimal berkisar antara 20–60 gL-1 (Beyl 2005).
Gambar 2.1 Model pengendalian dalam siklus sel pada transisi dari G1 ke S oleh sukrosa, auksin dan sitokinin (Gahan 2007). G1 = fase istirahat, S = periode pembentukan DNA.
Pengaturan potensial osmotik pada media untuk konservasi in vitro
Osmotikum adalah substansi yang dapat menurunkan potensial osmotik pada media kultur (Shibli et al. 2006). Potensial osmotik total pada media disebabkan oleh substansi yang terlarut, yang dapat digambarkan dengan
adanya osmotikum maka potensial osmotik media menjadi lebih rendah, menyebabkan penyerapan hara oleh sel tanaman menjadi lambat (Bessembinder et al. 1993).
Osmotikum yang sering digunakan dalam kultur jaringan antara lain gula, biasanya berupa sukrosa, sorbitol dan manitol pada konsentrasi tertentu. Sorbitol (C6H14O6) digunakan sebagai osmotikum pada kultur karena tidak semua tanaman dapat mengkonversi sorbitol dan memanfaatkannya sebagai sumber karbon (Montalvo-Peniche et al. 2007). Namun, padapada jagung, apel dan kerabatnya, sorbitol dapat ditranslokasi secara efektif karena dapat dikonversi dengan baik menjadi glukosa oleh enzim sorbitol oksidase, atau menjadi fruktosa oleh enzim sorbitol dehidrogenase (Traore dan Guiltinan 2006). Sorbitol juga dapat dimetabolisme oleh tembakau, padi, jeruk dan chichory (Thorpe et al. 2008).
Penggunaan retardan dalam konservasi in vitro
Retardan adalah regulator pertumbuhan tanaman yang digunakan untuk menekan pertumbuhan tanaman tanpa mengubah pola perkembangannya (Wang
et al.1986). Retardan berperan dalam menghambat pembentukan giberelin, sehingga sering dikenal sebagai anti giberelin. Retardan dengan sifat translokasi yang baik dapat digunakan dalam konservasi in vitro (Wattimena et al. 1992). Retardan yang digunakan dalam konservasi in vitro antara lain ancymidol, cyclocel dan paklobutrasol (Whiters 1985).
Gambar 2.2 Struktur kimia paklobutrasol (Milfont et al. 2008).
Paklobutrasol (Gambar 2.2) bekerja sebagai penghambat hormon giberelin. Bila diaplikasikan melalui media tanam akan diserap akar dan ditranspor melalui xilem dan diakumulasi dalam daun (Wang et al. 1986). Paklobutrasol dapat menekan pertumbuhan tanaman melalui penghambatan pada
tiga tahap lintasan terpenoid yang menghasilkan giberelin. Paklobutrasol mengikat enzim sehingga menghambat kerja enzim yang mengkatalisis reaksi pembentukan giberelin (Gambar 2.3). Salah satu peran utama giberelin bagi tanaman adalah merangsang pemanjangan sel. Jika produksi giberelin dihambat, pembelahan sel masih terjadi, tetapi sel yang baru tidak memanjang. Kondisi ini akan menghasilkan tunas dengan ruas yang memendek. Penghambatan tersebut juga menyebabkan akumulasi senyawa antara yang terbentuk sebelum daerah yang dihambat, sehingga menyebabkan peningkatan produksi asam absisik dan phytol yang merupakan komponen klorofil, yang berguna untuk pertumbuhan dan perkembangan tanaman (Chaney 2004).
Gambar 2.3 Penghambatan oleh paklobutrasol (----) pada tiga tahap pembentukan gibberelin yang dapat menyebabkan akumulasi phytol (klorofil), asam absisik dan squalene (dimodifikasi dari Chaney 2004 dan Hazarika 2003).
Struktur paklobutrasol yang unik memudahkan untuk mengikat atom besi dari enzim yang terlibat dalam pembentukan giberelin sehingga menghambat aktivitas enzim tersebut. Paklobutrasol juga mempunyai kemampuan mengikat enzim yang berperan dalam produksi steroid pada jamur dan enzim yang mendegradasi asam absisik. Tanaman yang diberi perlakuan paklobutrasol mempunyai toleransi lebih tinggi terhadap stres lingkungan dan resisten terhadap
penyakit yang disebabkan oleh fungi karena pembentukan campesterol yang menghasilkan steroid pada fungi tersebut dihambat oleh keberadaan paklobutrasol dalam tanaman (Chaney 2004).
Organogenesis langsung
Sumber eksplan untuk konservasi in vitro dapat berupa potongan ruas, tunas dan planlet. Tunas memberikan hasil yang lebih baik karena persentase hidup, regenerasi dan stabilitas genetiknya tinggi (Shibli et al. 2006), dan mudah diaklimatisasi setelah konservasi (Botau et al. 2005). Dengan demikian diperlukan penyediaan sumber eksplan yang berupa tunas untuk konservasi pamelo dengan menginduksi pembentukan tunas secara langsung pada eksplan pamelo melalui organogenesis.
Organogenesis adalah proses terbentuknya organ pada jaringan meristematik atau non meristematik, baik secara langsung atau tidak langsung melalui pembentukan kalus terlebih dahulu (Kane 2005). Dasar dari organogenesis adalah sifat totipotensi. Totipotensi merupakan kemampuan suatu sel tumbuhan yang belum terdiferensiasi untuk menjadi tumbuhan lengkap. Secara teori, sel mengandung informasi genetik untuk membentuk suatu individu, sehingga sel diploid yang mempunyai inti sel dapat mengalami diferensiasi menjadi tumbuhan (Gahan 2007). Faktor yang berpengaruh terhadap kemampuan sel untuk mengekpresikan sifat totipotensi adalah tingkat diferensiasi dan spesialisasi pada sel. Selain itu, ekspresi gen juga dipengaruhi jaringan yang ada di dekatnya (Dewitte dan Murray 2002). Kemampuan sel tunggal membentuk tunas sebelum menjadi tumbuhan seutuhnya tergantung pada keadaaan sel tersebut, kompeten atau rekalsitran. Sel yang kompeten didefinisikan sebagai sel yang mampu merespon sinyal epigenetik misalnya zat pengatur tumbuh (Gahan 2007, Gahan dan George 2008).
Organogenesis meristem tunas secara in vitro berasal dari diferensiasi sel-sel somatik. Pada organogenesis langsung, eksplan akan mengalami beberapa tahapan sebelum membentuk suatu organ (Gambar 2.4), yaitu sel-selnya mengalami dediferensiasi untuk menjadi sel yang kompeten, kemudian tahapan induksi agar sel dapat dideterminasi arah perkembangannya dan tahap terakhir
adalah diferensiasi membentuk suatu organ (Schwarz et al. 2005, Zhang et al.
2005).
Gambar 2.4 Tahapan yang dilalui sel-sel eksplan dalam organogenesis langsung (Schwarz et al. 2005). Keterangan: + = berespon.
Tunas terbentuk dari pembelahan beberapa sel (multiseluler) yang terjadi secara serentak (Schwarz et al. 2005). Pembentukan meristem tunas melibatkan gen-gen dalam lintasan sinyal transduksi sitokinin. Gen tersebut antara lain CRE1 (reseptor sitokinin), AHPs, APRS, ERS1 (menginduksi pembentukan tunas adventif, bahkan dalam keadaan tanpa zat pengatur tumbuh), KN1, STM, WUS, CLV 1-3, p34cdc2 yang berperan meregulasi siklus sel, pembelahan sel, perkembangan dan pemeliharaan meristem tunas. Dengan demikian, pembentukan primordia tunas memerlukan interaksi secara molekuler antara sitokinin, siklus sel dan lintasan pembentukan meristem tunas (Zhang et al. 2005).
Berbeda dengan pembentukan tunas, proses pembentukan akar adventif meliputi empat tahap. Tahap awal yaitu pembentukan lokus meristematis melalui dediferensiasi satu atau beberapa sel. Tahap kedua, terjadi multiplikasi sel-sel menjadi kumpulan sel (spherical cluster). Tahap ketiga meliputi multiplikasi sel lebih lanjut dengan inisiasi pembelahan sel sebidang (planar) untuk membentuk meristem akar. Tahap keempat adalah pemanjangan sel pada bagian pangkal meristem akar yang sedang berkembang sehingga akar yang terbentuk mulai muncul (Schwarz et al. 2005).
berhasil menginduksi tunas secara langsung dari daun jeruk manis (C. sinensis
(L.) Osbeck) kultivar Bingtangcheng dan Valencia. Pada penelitian jeruk manis tersebut, media yang paling efektif untuk menginduksi tunas dari daun adalah media MT (Murashige and Tucker) + BA 0,5 ppm + kinetin 0,5 ppm + NAA 0,1 ppm + sukrosa 3% + agar 0,8%, dengan pH 5,8. Kultur yang berasal dari eksplan daun yang telah berkembang penuh menunjukkan regenerasi tunas yang lebih baik daripada yang berasal dari daun yang belum berkembang. Analisis RAPD menunjukkan bahwa semua tanaman yang dihasilkan secara genetik identik dengan tanaman donor, tidak terdeteksi adanya variasi genetik. Lebih lanjut Almeida (2002) berhasil menginduksi tunas adventif dari mata tunas tiga kultivar jeruk manis dengan hasil terbaik diperoleh pada media MS + BAP 1 ppm, sedangkan untuk lemon „Rangpur‟ yang terbaik adalah MS + 2,5 ppm BAP.
Proses organogenesis juga dipengaruhi cahaya. Pembentukan kloroplas dan klorofil yang berpengaruh terhadap warna hijau pada kultur dipengaruhi oleh cahaya. Enzim NADPH:Prothochlorophyllide (photo) oxidoreductase tidak aktif dalam keadaan tanpa cahaya sehingga tahap awal pembentukan korofil yaitu perubahan prothochlorophyllide menjadi chlorophyllide tidak dapat berlangsung (Sandmann dan Scherr 1998). Hal ini menyebabkan kultur yang terbentuk di ruang gelap menjadi berwarna putih. Aktivitas hormon tanaman juga dipengaruhi oleh cahaya (Taiz dan Zeiger 2002). Etiolasi terjadi karena pengaruh auksin (Srivastava 2002), yang menyebabkan kultur yang ditempatkan di ruang gelap lebih panjang dibandingkan kultur di ruang terang.
Posisi eksplan berpengaruh pada translokasi hara, hormon dan air. Posisi eksplan vertikal lebih efisien dalam penyerapan hara, air dan translokasi auksin pada planlet yang berpengaruh terhadap pembentukan tunas pada eksplan (Peer et al. 2011). Auksin ditranslokasi secara basipetal, sedangkan sitokinin secara akropetal (Davies 2004), yang akan berpengaruh pada konsentrasi hormon pada eksplan. Disamping itu, translokasi auksin juga dipengaruhi oleh gravitasi dan polaritas (Srivastava 2002).
Zat Pengatur Tumbuh yang Mempengaruhi Organogenesis
Pola perkembangan dalam organogenesis dipengaruhi oleh jenis, jumlah dan perbandingan zat-zat pengatur tumbuh yang digunakan (Gaba 2005). Zat pengatur tumbuh (ZPT) pada tanaman atau fitohormon adalah senyawa organik yang bukan hara yang dalam jumlah sedikit dapat mendukung, menghambat dan mengubah proses fisiologi tumbuhan. ZPT diperlukan untuk proses tertentu, pada waktu tertentu, dalam pertumbuhan dan perkembangan tanaman. Hal yang sangat penting adalah tanaman dapat membentuk zat tersebut bila diperlukan dan dapat menjadikannya tidak aktif bila tidak diperlukan (Gambar 2.3) (Srivastava 2002). Kandungan ZPT di dalam tanaman dikontrol melalui tiga mekanisme: 1. pengaturan kecepatan pembentukan; 2. penonaktifan melalui pengikatan/ konjugasi dengan karbohidrat, asam amino atau peptida dan selanjutnya disimpan (kompartementasi); dan 3. perombakan yang tidak dapat balik/degradasi (Srivastava 2002).
Gambar 2.5 Regulasi fitohormon dalam tanaman (Srivastava 2002).
Secara umum, ZPT diperlukan untuk mengatur inisisasi dan perkembangan tunas dan akar pada eksplan di media kultur, juga menstimulasi pembelahan dan pembesaran sel (Beyl 2005). ZPT dapat menyebabkan sel-sel somatik melakukan atau mempercepat waktu siklus sel dan memprogram ulang sel ke arah perkembangan yang baru (Zhang et al. 2005).
Auksin dan sitokinin adalah zat pengatur tumbuh yang sering ditambahkan dalam media tanam karena mempengaruhi pertumbuhan dan organogenesis dalam kultur jaringan dan organ. Peran terpenting dari auksin dan sitokinin adalah untuk memprogram ulang sel-sel meristematik yang telah terdeterminasi. Pemrograman ulang ini akan menyebabkan diferensiasi ulang sel ke dalam lintasan perkembangan yang baru (Gaba 2005). Rasio auksin sitokinin
Pembentukan
[Phytohormon] Transpor
Kompartementasi Konjugasi
Degradasi
menentukan determinasi sel (Staden et al. 2008 Gambar 2.6). Rasio sitokinin auksin yang sedang akan menginduksi pembentukan akar adventif dari kalus dan inisiasi kalus pada dikotil, sedangkan rasio yang tinggi menginduksi pembentukan tunas adventif dan produksi tunas aksiler pada kultur tunas. Dengan demikian, interaksi sitokinin dan auksin penting dalam mengontrol beberapa proses pertumbuhan dan perkembangan secara in vitro (Gaba 2005).
Gambar 2.6 Konsentrasi relatif auksin dan sitokinin diperlukan secara khusus untuk pertumbuhan dan morfogenesis (Staden et al. 2008).
Auksin
Auksin berperan penting dalam mengatur beberapa pertumbuhan dan proses-proses lainnya dalam siklus hidup tanaman. Pada tingkat sel, auksin berperan dalam menginduksi tahap awal siklus sel bersama dengan sukrosa dan sitokinin (Gambar 2.1) (Gahan 2007), yang mempengaruhi pertumbuhan sel melalui pembelahan dan pembesaran sel. Konsentrasi auksin bersama dengan faktor lainnya berperan dalam diferensiasi dan spesifikasi sel (Dewitte dan Murray 2002). Peran auksin dalam kultur in vitro tergantung pada struktur kimia, konsentrasi, dan jaringan tanaman yang diberi perlakuan. Auksin menyebabkan pembentukan kalus, akar dan pembesaran batang. Secara umum, auksin merangsang pemanjangan sel, pembelahan sel dalam jaringan kambium, dan bersama dengan sitokinin merangsang diferensiasi xilem dan floem. Auksin
eksogen dengan konsentrasi tinggi dapat menginduksi terjadinya embriogenesis somatik, tetapi dapat juga menjadi beracun karena merangsang pembentukan etilen yang dapat menyebabkan penghambatan pertumbuhan (Gaba 2005).
Auksin dibentuk dari triptofan atau indol, terutama di primordia daun, daun muda dan biji yang sedang berkembang (Taiz dan Zeiger 2002). Auksin terdapat dalam jaringan meristimatik, daun muda, dan terdapat dalam jumlah sedikit pada daun dan sel akar yang telah dewasa. Auksin ditranspor secara aktif dari sel ke sel, dan dalam kambium vaskuler dari pucuk ke akar, kemungkinan juga dalam sel epidermis. Transpor auksin ke akar melalui floem (Davies 2004).
Sebagian besar auksin alami yang terdeteksi adalah IAA (indole-3-acetic acid). Pada tanaman, IAA dibentuk dari tryptophan melalui tiga lintasan yaitu melalui lintasan pyruvic acid (IPA), tryptamine (TAM) atau indole-3-acetonitrile (IAN), sedangkan lintasan indole-3-acetamide (IAM) terdapat pada bakteri patogenik (Taiz dan Zeiger 2002). Selain IAA, terdapat juga auksin yang terbentuk endogen yaitu 4-chloro-IAA dan indole-3-butyric acid (IBA), serta phenylacetic acid (PAA) auksin lemah yang terbentuk alami pada tanaman (Machakova et al. 2008).
Gambar 2.7 Interkonversi IAA dan IBA (Srivastava 2002).
IBA sebenarnya sejak lama dikenal sebagai auksin sintetik yang digunakan untuk menginduksi akar, tetapi hasil penelitian terbaru telah mengidentifikasi IBA sebagai senyawa yang terbentuk secara alami pada beberapa spesies seperti jagung, kacang dan Arabidopsis (Machacova et al. 2008, Srivastava 2002). Pada jagung dan Arabidopsis, IBA dibentuk dari IAA melalui suatu reaksi pemanjangan rantai yang mirip dengan pembentukan asam lemak. IBA juga dapat
dikonversi ke IAA (Gambar 2.7), sehingga IBA kemungkinan juga merupakan bagian dari pemeliharaan homeostasis IAA (Srivastava 2002).
Jenis auksin sintetik yang biasa digunakan dalam kultur in vitro adalah 1-naphthaleneacetic acid (NAA, Gambar 2.8), 2,4-dichlorophenoyacetic acid (2,4-D), dan 4-amino-3,5,6-trichloro-2-pyridinecarboxylic acid (picloram). Auksin yang terbentuk secara alami indole-3-acetic acid (IAA) dan indole-3-butyric acid (IBA) juga digunakan dalam kultur in vitro (Beyl 2005).
Gambar 2.8 NAA, auksin sintetik yang digunakan dalam kultur jaringan tanaman (Gaba 2005).
Sitokinin
Sitokinin merupakan fitohormon yang berperan dalam pembelahan sel dan morfogenesis tunas dan akar (Campbell et al. 2008), pertumbuhan tunas lateral, dan perkembangan daun (Srivastava 2002). Sitokinin mempengaruhi beberapa tahap dalam siklus sel sehingga terjadi pembelahan sel yaitu pada transisi G1/S (fase istirahat ke sintesa DNA), G2/M (fase istirahat ke pembelahan sel) dan pada fase S (sintesa DNA) (Dewitte dan Murray 2002). Sitokinin dibedakan atas dua tipe, yaitu adenin (kinetin, zeatin dan 6-benzylaminopurine) dan fenilurea (difenilurea dan thidiazuron (TDZ)) (Campbell et al. 2008). Sitokinin turunan adenin dibentuk pada ujung akar dan pada biji yang sedang berkembang. Sitokinin terekpresi pada sel perisikel dan parenkim berkas pembuluh pada bagian atas akar (Dewitte dan Murray 2002). Sitokinin ditranspor dari akar ke pucuk melalui xilem (Campbell et al. 2008).
Dalam tanaman, sitokinin berperan untuk memelihara aktivitas metabolisme dan mencegah senesen (Davies 2004). Dalam kultur in vitro,
sitokinin digunakan untuk merangsang pembentukan tunas adventif, multiplikasi tunas aksiler dan menghilangkan pengaruh dominasi apikal (Gaba 2005). Rasio auksin terhadap sitokinin berperan penting pada efek sitokinin terhadap
CH2COOH
pertumbuhan tanaman. Sitokinin secara tersendiri tidak mempunyai pengaruh pada sel parenkim (Campbell et al. 2008).
Jenis sitokinin yang digunakan dalam kultur jaringan antara lain BA (benziladenin, Gambar 2.9), kinetin (fulfuril-aminopurin), 2-iP (isopentenil-adenine) atau TDZ (thidiazuron). Benzyl Adenine (BA) sering digunakan sebagai sumber sitokinin dalam kultur jaringan karena tidak mudah dirombak oleh sistem enzim dalam tanaman (Gaba 2005).
Gambar 2.9 Benzyl adenine, sitokinin yang digunakan dalam kultur jaringan tanaman (Gaba 2005).
Giberelin
Giberelin (GA) merupakan suatu diterpen tetrasiklik, produk dari lintasan terpenoid. GA berperan untuk mengendalikan pemanjangan batang, pembungaan, menginduksi perkecambahan, pembentukan enzim pada proses perkecambahan serta pembentukan buah (Davies 2004). GA yang digunakan dalam kultur in vitro
adalah GA3 (Gambar 2.10) dan GA7. Pemberian GA dalam kultur in vitro biasanya digunakan untuk menstimulasi pemanjangan tunas (Moshkova et al.
2008), mengurangi pembentukan akar dan menghambat inisiasi mata tunas pada tahap paling awal pembentukan meristem, sehingga bila GA diberikan pada tahap inisiasi mata tunas akan mengurangi pembentukan mata tunas (Gaba 2005).
Gambar 2.10 Struktur kimia GA3 (Moshkov et al. 2008). N
H N N
NH CH2
N
GA dibentuk dari gliseraldehida-3-fosfat melalui isopentenil difosfate (Buchanan et al. 2000, Davies 2004) pada pucuk dan pada biji yang sedang berkembang, dimulai di dalam kloroplas kemudian melibatkan tahapan dalam membran dan sitoplasma dan ditranspor melalui xilem dan floem (Davies 2004).
3. ORGANOGENESIS TUNAS SECARA LANGSUNG PADA DAUN, AKAR DAN EPIKOTIL DARI BIJI PAMELO {Citrus maxima (Burm.)
Merr.} YANG DIKECAMBAHKAN SECARA IN VITRO
Direct Shoot Organogenesis on Leaf, Root and Epicotyl from In Vitro Germinated Seedling of Pummelo {Citrus maxima (Burm.) Merr.}
ABSTRAK
Pamelo {Citrus maxima (Burm.) Merr.} merupakan tanaman yang potensial dikembangkan secara ekonomi, tetapi baru beberapa kultivar yang dikembangkan secara luas. Konservasi pamelo perlu dilakukan untuk mencegah hilangnya kultivar pamelo, yang antara lain melalui konservasi eks-situ secara in vitro menggunakan teknik pertumbuhan lambat. Tunas in vitro diperlukan dalam konservasi untuk mempermudah pemulihan dan penggunaannya setelah konservasi. Dua percobaan dilakukan untuk mendapatkan eksplan dan media yang efektif untuk memperoleh tunas in vitro pamelo secara langsung. Eksplan daun,
akar dan epikotil diperoleh dari biji pamelo „Adas Duku‟ yang dikecambahkan
secara in vitro. Percobaan pertama dilakukan untuk mendapatkan media mengandung sitokinin dan auksin yang efektif dalam menginduksi tunas adventif. Percobaan disusun dengan rancangan acak lengkap. Media MS mengandung kombinasi BAP (0; 1; 2 ppm) dan NAA (0; 0,5; 1 ppm) digunakan sebagai perlakuan. Eksplan yang digunakan dalam percobaan terpisah adalah daun, akar dan epikotil pamelo. Percobaan kedua dilakukan pada eksplan epikotil pamelo untuk mengetahui pengaruh posisi kultur pada pembentukan tunas. Hasil pengamatan menunjukkan bahwa tunas dapat terbentuk secara langsung pada eksplan daun, akar dan epikotil. Eksplan daun hanya berespon di ruang gelap, ruang gelap yaitu di media MS0 dan MS + BAP 1 ppm namun dengan penampilan tunas yang lemah karena etiolasi. Epikotil yang dikultur secara vertikal di ruang terang sebanyak 100% dapat menghasilkan 1 - 3 tunas/eksplan.
Kata kunci: pamelo, organogenesis, daun, akar, epikotil.
ABSTRACT
design, using medium combination of MS + BAP (0; 1; 2 ppm) + NAA (0; 0,5; 1 ppm) as treatments. In vitro pummelo leaf, root and epicotyl were used as explants in separate experiments. Second experiment was conducted to study the effect of epycotyl explant position in culture to the shoot emergence. The result showed that leaf, root and epycotyl could produce direct shoot organogenesis. Leaf explant (5,5%) produced 1 shoot/explant in MS + BAP 1 ppm. Root explant (60%) produced 1 shoot/explant in MS0. Epicotyl explant produced shoot in MS0. Epicotyl explant cultured vertically in light condition (100%) produced 1 - 3 shoot/explant.
Key word:pummelo, organogenesis, leaf, root, epicotyl
Pendahuluan
Indonesia memiliki beragam pamelo, tetapi hanya sebagian kultivar yang sudah dibudidayakan secara luas karena bernilai komersial seperti „Nambangan‟,
„Magetan‟, „Sri Nyonya‟, „Raja‟ dan „Ratu‟ (Puslitbang Hortikultura 2006). Beberapa aksesi pamelo lain seperti „Jawa‟ dan „Adas Duku‟ masih
dibudidayakan secara terbatas oleh petani di Magetan. Plasma nutfah pamelo yang beragam tersebut perlu dijaga kelestariannya. Upaya konservasi perlu dilakukan antara lain melalui konservasi eks-situ secara in vitro.
Konservasi in vitro pamelo memerlukan ketersediaan tunas in vitro sebagai sumber eksplan yang dapat diperoleh melalui organogenesis secara langsung. Tunas digunakan sebagai eksplan karena mudah dipulihkan dan digunakan setelah konservasi (Botau et al. 2005). Tunas yang akan digunakan dalam kegiatan konservasi in vitro harus dihasilkan dari organogenesis langsung karena perubahan genetik yang terjadi pada pembentukan tunas secara langsung tanpa melalui pembentukan kalus relatif kecil (Trigiano dan Gray 2005).
Organogenesis dapat dilakukan pada sel-sel yang bersifat meristematik dan kompeten yaitu sel-sel yang mampu memberikan tanggapan terhadap sinyal lingkungan atau hormonal sehingga berakhir dengan terbentuknya organ. Respon tersebut tergantung fase dari siklus sel pada sel tersebut yaitu fase G1 (Trigiano dan Gray 2005). Menurut Gahan (2007) terdapat dua faktor yang mempengaruhi kemampuan sel untuk melakukan organogenesis yaitu 1). tingkat diferensiasi dan spesialisasi dan 2). pengaruh jaringan di dekatnya terhadap ekspresi gen pada sel tersebut. Selain itu, disamping dipengaruhi sinyal lingkungan, zat pengatur tumbuh juga berpengaruh terhadap pengaturan inisisasi dan perkembangan tunas
dan akar serta stimulasi pembelahan dan pembesaran sel pada eksplan di media kultur (Beyl 2005).
Zat pengatur tumbuh yang sering ditambahkan dalam media untuk induksi organogenesis adalah auksin dan sitokinin. Peran auksin dalam pertumbuhan tanaman antara lain untuk inisiasi akar, pertumbuhan batang, diferensiasi jaringan vaskuler dan penghambatan senesen pada daun (Srivastava 2002). Sitokinin berperan pada pembentukan tunas adventif, multiplikasi tunas aksiler dan penghilang pengaruh dominasi apikal. Rasio auksin sitokinin yang tinggi akan merangsang pembentukan akar adventif, rasio sedang akan menginduksi pembentukan akar adventif dari kalus dan inisiasi kalus pada dikotil, sedangkan rasio yang rendah menginduksi pembentukan tunas adventif dan produksi tunas aksiler pada kultur tunas (Gaba 2005).
Penelitian organogenesis pada beberapa spesies jeruk untuk mendapatkan jenis eksplan dan media yang terbaik antara lain telah dilakukan melalui hipokotil
C. halimii dengan media BA 2,2-11,1 uM dan NAA 2,7 uM (Normah et al.
1997); ruas C. sinensis (L.) Osbeck dengan media BAP (1; 2; 3 ppm) dan NAA 0,5 ppm (Silva et al. 2006). Penelitian ini bertujuan untuk mendapatkan eksplan dan media yang efektif dalam menginduksi tunas melalui organogenesis langsung pada pamelo.
Bahan dan Metode
Percobaan dilakukan di Laboratorium Kultur Jaringan I Departemen Agronomi dan Hortikultura Fakultas Pertanian IPB mulai Juni 2010 sampai Juni 2011. Peralatan yang digunakan adalah peralatan standar untuk penelitian kultur jaringan. Pengamatan histologi dilakukan di laboratorium mikroteknik AGH IPB dengan mengamati irisan segar menggunakan mikroskop Olympus DX51 yang dihubungkan ke kamera Olympus DP25.
Media dasar yang digunakan dalam kultur adalah media MS (Murashige and Skoog 1962, Tabel lampiran 3.1) yang ditambah sukrosa 3%. Keasaman (pH) media diatur menjadi 5,6 dengan penambahan 0,1 N KOH sebelum disterilisasi. Media dipadatkan dengan penambahan 8 g L-1 agar. Setiap botol kultur diisi ± 30 ml media.
Bahan tanaman yang digunakan sebagai sumber penghasil eksplan adalah
biji pamelo „Adas Duku‟ (Keragaan dan karakteristik „Adas Duku‟ ditampilkan
dalam Lampiran 1 dan 2). Induksi perkecambahan dilakukan pada biji pamelo yang telah dikupas kulit luarnya (testa), kemudian disterilisasi dengan clorox 20% selama 20 menit dan dibilas dengan aquades steril tiga kali. Setelah itu biji direndam menggunakan aquades steril selama minimal dua hari pada suhu 5 oC. Setelah perlakuan perendaman, biji dikupas kulit bagian dalamnya (tegmen) kemudian disterilisasi dua kali dengan clorox 20% selama 20 menit dan dibilas dengan aquades steril tiga kali. Biji kemudian ditanam pada media mengandung pupuk daun komersial 2 g L-1 dan sukrosa 3%. Biji umumnya berkecambah 100% secara serentak pada hari ketiga setelah kultur. Pucuk kecambah umur tiga minggu dipotong, kemudian disubkultur pada media MS0 untuk memperoleh sumber eksplan daun dan epikotil pada organogenesis. Eksplan akar diperoleh dari kecambah sebelum pucuknya disubkultur.
Organogenesis pada eksplan daun, akar dan epikotil pamelo
Percobaan dilakukan di ruang gelap dan ruang terang dengan lama penyinaran 24 jam menggunakan lampu neon 18 watt (237–620 lux yang diukur menggunakan Luxtron 4 in 1). Percobaan menggunakan rancangan acak lengkap satu faktor, yaitu media MS yang mengandung kombinasi sitokinin (BAP) dan auksin (NAA). Kombinasi media yang digunakan ada sembilan kombinasi, yaitu MS0, MS + BAP 1 ppm, MS + BAP 2 ppm, MS + BAP 1 ppm + NAA 0,5 ppm, MS + BAP 1 ppm + NAA 1 ppm, MS + NAA 0,5 ppm dan MS + NAA 1 ppm. Bahan tanaman yang digunakan sebagai eksplan pada percobaan terpisah adalah
daun, akar dan epikotil pamelo „Adas Duku‟ hasil kultur in vitro.
Pada percobaan organogenesis dari eksplan daun, daun pamelo yang digunakan sebagai eksplan adalah tiga daun pertama dari atas yang dipotong menjadi dua secara melintang, kemudian ditanam dengan posisi permukaan atas daun menyentuh media (adaxial) di media sesuai perlakuan. Tiap botol berisi enam eksplan. Masing-masing perlakuan diulang tiga kali. Botol kultur diinkubasi pada suhu 20 oC. Pengamatan dilakukan setiap minggu selama dua bulan. Peubah yang diamati adalah waktu munculnya organ, macam organ yang terbentuk, dan 25