PENGARUH PEMBERIAN BAP (Benzil Amino Purin) DAN NAA (Naftalen Asam Asetat)
TERHADAP MORFOGENESIS DARI KALUS
SANSEVIERIA (Sansevieria cylindrica)
SKRIPSI
OLEH :
SRI WILDANI BATUBARA 050307041/PEMULIAAN TANAMAN
DEPARTEMEN BUDIDAYA PERTANIAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
PENGARUH PEMBERIAN BAP (Benzil Amino Purin) DAN NAA (Naftalen Asam Asetat)
TERHADAP MORFOGENESIS DARI KALUS
SANSEVIERIA (Sansevieria cylindrica)
SKRIPSI
OLEH :
SRI WILDANI BATUBARA 050307041/PEMULIAAN TANAMAN
Skripsi Sebagai Salah Satu Syarat Untuk Dapat Memperoleh Gelar Sarjana di Fakultas Pertanian
Universitas Sumatera Utara
DEPARTEMEN BUDIDAYA PERTANIAN
FAKULTAS PERTANIAN
UNIVERSITAS SUMATERA UTARA
MEDAN
Judul Skripsi : Pengaruh Pemberian BAP (Benzil Amino Purin) dan NAA (Naftalen Asam Asetat) Terhadap Morfogenesis dari Kalus Sansevieria (Sansevieria cylindrica)
Nama : Sri Wildani Batubara
Nim : 050307041
Departemen : Budidaya Pertanian Program Studi : Pemuliaan Tanaman
Disetujui Oleh : Komisi Pembimbing
(Ir. Mbue Kata Bangun, MS) (Prof. Dr. Ir. Rosmayati, MS) Ketua Anggota
Mengetahui,
ABSTRACT
SRI WILDANI BATUBARA, influence of BAP (Benzylamino purine) and NAA (Naphtalen-3-acetic acid) on morfogenesis from callus Sansevieria (Sansevieria cylindrica). Supervised by Ir. Mbue Kata Bangun, MS and Prof. Dr. Ir. Rosmayati, MS
The aim of the research is to know the influence of Benzylamino purine (BAP) and Naphtalen-3-acetic acid (NAA) concentration on morfogenesis from callus Sansevieria (Sansevieria cylindrica). The research was carried out in the Tissue Culture laboratory, Department of Agronomy, Faculty at Agriculture North Sumatera University, Medan from March to June 2010. This research used Randomized Block Design with two factor. First factor was BAP concentration consist of four levels: 0 ; 1; 2 dan 3 mg/l. The second factor was NAA concentration consisted of three levels: 0; 0,2 and 0,4 mg/l. Statistical analysis showed that BAP concentration give significantly affected on the number all treatmen.. Concentration NAA was significantly affected on the number amount roots but that was not yet significantly affected on the number amount of buds, long of buds and amount leaf. Interaction between BAP and NAA was not yet significantly the number all treatment.
ABSTRAK
SRI WILDANI BATUBARA, Pengaruh Pemberian BAP (Benzil Amino Purin) dan NAA (Naftalen Asam Asetat) Terhadap Morfogenesis Kalus Sansevieria (Sansevieria cylindrica). Dibimbing oleh Ir. Mbue Kata Bangun, MS dan Prof. Dr. Ir. Rosmayati, MS
Tujuan penelitian ini adalah untuk mengetahui adanya pengaruh konsentrasi zat pengatur tumbuh BAP (Benzil Amino Purin) dan NAA
(Naftalen Asam Asetat) terhadap morfogenesis dari kalus Sansevieria (Sansevieria cylindrica) Penelitian ini dilaksanakan di Laboratorium
Kultur Jaringan, Departemen Budidaya Pertanian, Fakultas Pertanian Universitas Sumatera Utara, Medan dari bulan Maret sampai Juni 2010. Penelitian ini menggunakan Rancangan Acak Kelompok (RAK) dengan dua faktor perlakuan. Faktor pertama adalah konsentrasi BAP yang terdiri dari empat taraf meliputi konsentrasi 0; 1; 2 dan 3 mg/l. Faktor kedua adalah konsentrasi NAA yang terdiri dari tiga taraf meliputi konsentrasi 0; 0,2 dan 0,4 mg/l. Hasil analisis data statistik menunjukkan bahwa konsentrasi BAP berpengaruh nyata terhadap semua peubah amatan. Pada konsentrasi NAA berpengaruh nyata terhadap jumlah akar tetapi belum berpengaruh nyata terhadap jumlah tunas, panjang tunas dan jumlah daun. Interaksi antara BAP dan NAA belum berbeda nyata terhadap semua peubah amatan.
RIWAYAT HIDUP
Sri wildani Batubara dilahirkan di Medan pada tanggal 10 November 1986
anak dari ayahanda Hasanuddin Batubara dan ibu Erlina Sari Nasution merupakan
putri kedua dari lima bersaudara.
Pendidikan formal yang pernah ditempuh adalah SD Negeri 060849 lulus
pada tahun 1997, SLTP Negeri 16 Medan lulus tahun 2002 dan SMA Swasta
Laksamana Martadinata Medan lulus tahun 2005. Tahun 2005 diterima sebagai
mahasiswi Universitas Sumatera Utara, Fakultas Pertanian dan memilih
Departemen Budidaya Pertanian Program Studi Pemuliaan Tanaman.
Selama mengikuti perkuliahan penulis pernah mendapatkan kesempatan
membantu dosen dalam menjalankan praktikum Kultur Jaringan 2009 dan
pengalaman dibidang kemasyarakatan penulis peroleh saat mengikuti Praktek
Kerja Lapangan (PKL) di PT Perkebunan Nusantara IV Kebun Adolina
KATA PENGANTAR
Puji dan syukur penulis ucapkan atas kehadirat Allah SWT atas berkat dan
rahmatNya penulis dapat menyelsaikan skripsi yang berjudul “Pengaruh
Pemberian BAP (Benzil Amino Purin) dan NAA (Naftalen Asam Asetat)
Terhadap Morfogenesis dari Kalus Sansevieria (Sansevieria cylindrica) ”
yang merupakan salah satu syarat untuk mendapatkan gelar sarjana di Fakultas
Pertanian Universitas Sumatera Utara, Medan.
Pada kesempatan ini penulis mengucapkan terima kasih kepada
Bapak Ir. Mbue Kata Bangun, MS sebagai ketua komisi pembimbing dan
Ibu Prof. Dr. Ir. Rosmayati, MS sebagai anggota komisi pembimbing yang telah
banyak memberi bimbingan dalam penulisan skripsi ini. Penulis mengucapkan
terima kasih pada kak Asni yang telah membantu dalam melaksanakan penelitian.
Terima kasih penulis ucapkan kepada ayahanda Hasanuddin Batubara dan
Ibunda Erlina Sari Nasution serta seluruh anggota keluarga yang telah
memberikan dukungan dan motivasi selama melakukan studi. Ungkapan terima
kasih kepada rekan-rekan yang telah banyak membantu yaitu Dian Wahyudi, Seri,
Siti, Rista, Sarifah, Astri, Dewi, Nurul, Nanda, Ari kepada teman- teman stambuk
2005 dan adik – adik angkatan 2006 yang telah membantu penulis dalam
penelitian dan menyelesaikan skripsi ini. Dan semoga skripsi ini bermanfaat bagi
seluruh pihak yang memerlukan.
Medan, Nopember 2010
DAFTAR ISI
Keragaman Sansevieria ... 5
Kultur Jaringan ... 7
Pengamatan Parameter ... 17
Persentase pertumbuhan eksplan (%) ... 17
Pelaksanaan Penelitian ... 18
Sterilisasi alat-alat ... 18
Pembuatan media ... 19
Persiapan eksplan ... 20
Penanaman eksplan ... 20
Pemeliharaan eksplan... 20
HASIL DAN PEMBAHASAN ... 21
Hasil... 21
Pembahasan ... 29
KESIMPULAN DAN SARAN ... 34
Kesimpulan ... 34
Saran ... 34
DAFTAR PUSTAKA
DAFTAR TABEL
No Hal
1. Pengaruh konsentrasi BAP dan NAA terhadap persentase pertumbuhan
eksplan ... 21
2. Pengaruh konsentrasi BAP dan NAA terhadap jumlah tunas (tunas) ... 23
3. Pengaruh konsentrasi BAP dan NAA terhadap panjang tunas (cm)... 24
4. Pengaruh konsentrasi BAP dan NAA terhadap jumlah akar (helai) ... 26
DAFTAR GAMBAR
No Hal
1. Pengaruh Konsentrasi BAP Terhadap Persentase Pertumbuhan Eksplan (%) 23
2. Pengaruh Konsentrasi NAA Terhadap Persentase Pertumbuhan Eksplan(%) 23
3. Jumlah Tunas yang Terbentuk Dengan Pemberian BAP dan NAA ... 24
4. Panjang Tunas yang Terbentuk Dengan Pemberian BAP dan NAA ... 25
5. Jumlah Akar yang Terbentuk Dengan Pemberian BAP dan NAA ... 26
6. Jumlah Daun yang Terbentuk Dengan Pemberian BAP dan NAA ... 28
7. Foto Planlet Sansevieria ... 49
8. Foto Perlakuan (B0N0) ... 50
9. Foto Perlakuan (B0N1) ... 50
10.Foto Perlakuan (B0N2) ... 50
11.Foto Perlakuan (B1N0) ... 50
12.Foto Perlakuan (B1N1) ... 50
13.Foto Perlakuan (B1N2) ... 50
14.Foto Perlakuan (B2N0) ... 51
15.Foto Perlakuan (B2N1) ... 51
16.Foto Perlakuan (B2N2) ... 51
17.Foto Perlakuan (B3N0) ... 51
18.Foto Perlakuan (B3N1) ... 51
DAFTAR LAMPIRAN
No Hal
1. Data Pengamatan Persentase Pertumbuhan Eksplan ... 37
2. Data Pengamatan Jumlah Tunas (tunas) ... 38
3. Data Transformasi Jumlah Tunas √X+0.5 ... 38
4. Daftar Sidik Ragam Data Transformasi Jumlah Tunas √X+0.5 ... 39
5. Data Pengamatan Panjang Tunas (cm)... 40
6. Data Transformasi Panjang Tunas √X+0.5 ... 40
7. Daftar Sidik Ragam Data Transformasi Panjang Tunas √X+0.5 ... 41
8. Data Pengamatan Jumlah Akar (helai) ... 42
9. Data Transformasi Jumlah Akar √X+0.5 ... 42
10.Daftar Sidik Ragam Data Transformasi Jumlah Akar √X+0.5 ... 43
11.Data Pengamatan Jumlah Daun (helai) ... 44
12.Data Transformasi Jumlah Daun √X+0.5... 44
13.Daftar Sidik Ragam Data Transformasi Jumlah Daun √X+0.5 ... 45
14.Komposisi Medium Murashige dan Skoog (MS) ... 46
15.Bagan Penelitian ... 47
16.Kegiatan Penelitian ... 48
17.Foto Planlet Sansevieria ... 49
ABSTRACT
SRI WILDANI BATUBARA, influence of BAP (Benzylamino purine) and NAA (Naphtalen-3-acetic acid) on morfogenesis from callus Sansevieria (Sansevieria cylindrica). Supervised by Ir. Mbue Kata Bangun, MS and Prof. Dr. Ir. Rosmayati, MS
The aim of the research is to know the influence of Benzylamino purine (BAP) and Naphtalen-3-acetic acid (NAA) concentration on morfogenesis from callus Sansevieria (Sansevieria cylindrica). The research was carried out in the Tissue Culture laboratory, Department of Agronomy, Faculty at Agriculture North Sumatera University, Medan from March to June 2010. This research used Randomized Block Design with two factor. First factor was BAP concentration consist of four levels: 0 ; 1; 2 dan 3 mg/l. The second factor was NAA concentration consisted of three levels: 0; 0,2 and 0,4 mg/l. Statistical analysis showed that BAP concentration give significantly affected on the number all treatmen.. Concentration NAA was significantly affected on the number amount roots but that was not yet significantly affected on the number amount of buds, long of buds and amount leaf. Interaction between BAP and NAA was not yet significantly the number all treatment.
ABSTRAK
SRI WILDANI BATUBARA, Pengaruh Pemberian BAP (Benzil Amino Purin) dan NAA (Naftalen Asam Asetat) Terhadap Morfogenesis Kalus Sansevieria (Sansevieria cylindrica). Dibimbing oleh Ir. Mbue Kata Bangun, MS dan Prof. Dr. Ir. Rosmayati, MS
Tujuan penelitian ini adalah untuk mengetahui adanya pengaruh konsentrasi zat pengatur tumbuh BAP (Benzil Amino Purin) dan NAA
(Naftalen Asam Asetat) terhadap morfogenesis dari kalus Sansevieria (Sansevieria cylindrica) Penelitian ini dilaksanakan di Laboratorium
Kultur Jaringan, Departemen Budidaya Pertanian, Fakultas Pertanian Universitas Sumatera Utara, Medan dari bulan Maret sampai Juni 2010. Penelitian ini menggunakan Rancangan Acak Kelompok (RAK) dengan dua faktor perlakuan. Faktor pertama adalah konsentrasi BAP yang terdiri dari empat taraf meliputi konsentrasi 0; 1; 2 dan 3 mg/l. Faktor kedua adalah konsentrasi NAA yang terdiri dari tiga taraf meliputi konsentrasi 0; 0,2 dan 0,4 mg/l. Hasil analisis data statistik menunjukkan bahwa konsentrasi BAP berpengaruh nyata terhadap semua peubah amatan. Pada konsentrasi NAA berpengaruh nyata terhadap jumlah akar tetapi belum berpengaruh nyata terhadap jumlah tunas, panjang tunas dan jumlah daun. Interaksi antara BAP dan NAA belum berbeda nyata terhadap semua peubah amatan.
PENDAHULUAN
Latar Belakang
Di tanah air, sanseviera lebih populer dengan sebutan lidah mertua
(mother-in-law’s tongue) ataupun tanaman ular (snake plant). Sanseviera
mempunyai penggemar di seluruh belahan dunia, baik karena keindahan, manfaat,
maupun nilai-nilai kepercayaan yang dimiliki tanaman sekulen ini. Lidah mertua
ini bisa dimanfaatkan sebagai cover ground landskap, tanaman hias dalam pot
(indoor ataupun outdoor), terarium dan berbagai kebutuhan dekoratif lainnya.
Sanseviera memiliki keistimewaan yang jarang ditemukan pada tanaman
lain, diantaranya mampu bertahan hidup pada rentang suhu dan cahaya yang luas,
sangat resisten terhadap gas udara yang berbahaya (polutan), bahkan mampu
meyerap 107 jenis polutan di daerah yang padat lalu lintas dan di dalam ruangan
yang penuh asap rokok.
Tanaman sansevieria mempunyai banyak ragam karena perbanyakan yang
dilakukan pada tanaman ini tidak selalu menghasilkan jenis yang sama dengan
induknya. Kecantikan sansevieria ditunjukkan dari ragam jenis, bentuk, ukuran
dan warna daun. Ragam jenis yang ada di alam tidak hanya diperoleh dari
persilangan tanaman tetapi juga karena mutasi. Tanaman ini mudah mengalami
mutasi, bahkan saat dilakukan pengembangbiakan melalui stek daun, yang
seharusnya anakan akan seperti induknya namun pada sansevieria akan sering
terjadi mutasi sehingga anaknya berbeda dengan induknya. Selain itu
keistimewaanya adalah ada berbagai ukuran daun baik yang besar, kecil, bentuk
memanjang atau pendek, melebar atau membulat juga corak warna yang juga
Saat ini, kultur jaringan diklaim sebagai metode perbanyakan tanaman
yang bisa menghasilkan anakan paling banyak dibandingkan dengan metode lain.
Berbeda dengan perbanyakan melalui stek daun, anakan yang dihasilkan melalui
metode kultur jaringan akan lebih seragam dengan sifat-sifatnya sama seperti
tanaman induknya. Pada sansevieria, metode ini lebih sering diterapkan untuk
membiakkan jenis yang lama menghasilkan anakan seperti jenis S. cylindrica dan
jenis yang langka.
Pada umumnya auksin meningkatkan pemanjangan sel, pembelahan sel,
dan pembentukan akar adventif. NAA merupakan auksin sintetik, tidak
mengalami oksidasi enzimatik seperti halnya IAA. Senyawa tersebut dapat
diberikan pada medium kultur pada konsentrasi yang lebih rendah, berkisar antara
0,1–2,0 mg L-1. Sitokinin adalah senyawa yang dapat meningkatkan pembelahan
sel pada jaringan tanaman serta mengatur pertumbuhan dan perkembangan
tanaman. Sitokinin yang paling banyak digunakan pada kultur in vitro adalah
kinetin, BAP dan Zeatin.
Dari uraian diatas, penulis tertarik untuk melakukan penelitian mengenai
pengaruh pemberian BAP dan NAA terhadap pembentukan tunas dari kalus
sansevieria (Sansevieria cylindrica).
Tujuan Penelitian
Adapun tujuan dari penelitian ini adalah untuk mengetahui pengaruh
pemberian BAP dan NAA terhadap pembentukan morfologenesis dari kalus
Hipotesis Penelitian
1. Ada pengaruh pemberian BAP terhadap pembentukan morfogenesis dari
kalus sansevieria.
2. Ada pengaruh pemberian NAA terhadap pembentukan morfogenesis dari
kalus sansevieria.
3. Ada interaksi dari BAP dan NAA terhadap pembentukan morfogenesis
dari kalus sansevieria.
Kegunaan Penelitian
Penelitian ini berguna untuk mendapatkan data penyusunan skripsi yang
merupakan salah satu syarat untuk mempeoleh gelar sarjana di Fakultas Pertanian,
Universitas Sumatera Utara, Medan serta sebagai bahan informasi bagi pihak yang
TINJAUAN PUSTAKA
Botani Tanaman
Menurut Sharma (2009), tanaman Sansevieria diklasifikasikan kedalam
family Agavaceae yang umumnya mempunyai daun yang berdaging tebal dan
banyak mengandung air. Adapun klasifikasinya adalah sebagai berikut: Divisio:
Magnoliophyta; Kelas: Liliopsida; Subkelas: Lilidae; Ordo: Liliales; Famili:
Agavaceae; Genus: Sansevieria; Spesies: Sansevieria cylindrica
Sansevieria memiliki akar serabut berwarna putih kekuningan sampai
kemerahan. Pada tanaman yang sehat, akarnya banyak dan berserabut. Akar
tumbuh dari rimpang (rhizome) yang dapat menghasilkan tunas anakan. Namun
pada beberapa jenis seperti S. tom grumbly dan S.ballyii tunas anakan keluar dari
ketiak daun melalui stolon. Pada dasarnya batang tidak tampak pada tanaman ini
sehingga banyak orang mengenal sansevieria sebagai tanaman tak berbatang
(stemless). Pendapat itu tidak sepenuhnya benar. Sansevieria juga memiliki
batang, baik batang sejati maupun batang semu. Batang sejati terletak di dalam
tanah yang dikenal sebagai sebutan rimpang dan batang semu yang terletak
dipermukaan tanah. Biasanya batang semu disebut stolon
(Tahir dan Sitanggang, 2008).
Bila dilihat sepintas bentuk daun sansevieria hanya 2 macam, yaitu pipih
panjang dan bulat panjang. Namun bila diteliti lebih lanjut, ada sekitar 12 tipe
yang dijumpai. Diantaranya berbentuk pipih seperti lidah, sendok, gada, pedang,
pisau, bulat seperti pinsil golok atau pemukul bola baseball. Sebagian sansevieria
berpenampang bulat seperti rotan, penampang daun yang pipih seperti pisau,
hanya dipermukaan atas serta permukaan atas dan bawah yang kasar. Sebagian
daun tumbuh tegak, sebagian lainnya melengkung ke belakang, juga ditemukan
beberapa daun yang tumbuh sejajar sehingga mirip kipas, yang lain mempunyai
daun yang tumbuh menyebar seperti air mancur. Jumlah daun pun berbeda-beda
antar jenis (Trubus, 2008).
Bunga kecil sampai sangat besar dan amat menarik, kebanyakan banci,
aktinomorf atau sedikit zigomorf. Hiasan bunga berupa tenda bunga yang
menyerupai mahkota dengan atau tanpa pelekatan berupa buluh, terdiri atas 6
daun tenda bunga, jarang hanya 4 atau lebih dari 6, kebanyakan jelas tersusun
dalam 2 lingkaran. Benang sari 6, jarang sampai 12 atau hanya 3, berhadapan
dengan daun-daun tenda bunga. Tangkai sari bebas atau berlekatan dengan
berbagai cara. Kepala sari beruang 2, membuka dengan celah membujur, jarang
dengan suatu liang pada ujungnya (Tjitrosoepomo, 2002 )
Buah sansevieria adalah jenis buah beri, yaitu buah yang memiliki celah
berisi biji. Warna kulit buah saat masih muda hijau, setelah tua ada yang merah,
oranye, hitam, dan hijau kusam. Jumlah biji dalam satu celah antar spesies yang
satu dengan yang lain berbeda, yaitu 1-4 biji. Saat masih muda kulit buah halus
setelah tua kasar (Lingga, 2008)
Keragaman Sansevieria
Sansevieria sangat mudah mengalami mutasi. Tanaman ini memiliki gen
yang tidak stabil. Perubahan yang terjadi menyangkut warna daun, corak warna
daun atau bentuk daun. Anakan tanaman yang mengalami mutasi, sama halnya
dengan hibrida, bisa menjadi kultivar atau spesies baru. Mutasi pada sansevieria
sementara akan kembali seperti asalnya jika mendapatkan perlakuan tertentu.
Mutasi ini diantaranya disebabkan oleh beberapa hal berikut:
- Perbanyakan sansevieria melalui stek daun.
Contohnya, hasil setek daun S. ’hahnii’ bisa menjadi S. ’golden hahnii’.
Namun stek daun S. ’golden hahnii’ akan menjadi S. ’hahnii’ kembali.
- Perubahan perlakuan perawatan.
Misalnya, pemberian pupuk organik cair secara berlebihan dapat
menyebabkan perubahan bentuk daun yang bersifat sementara. Setelah
pemberian pupuk dihentikan, sansevieria tersebut akan kembali ke bentuk
semula (Pramono, 2008).
Bertambahnya variasi penampilan dan karakter sansevieria juga banyak
dipengaruhi karena adanya mutasi dari spesies yang sama sehingga menampilkan
bentuk, ukuran, dan warna daun yang berbeda. Mutasi dapat terjadi akibat
perbanyakan melalui stek daun dan karena adanya pengaruh dari faktor
lingkungan seperti tingkat kesuburan tanah, suhu, dan pengaruh cahaya. Sinar
matahari memiliki spectrum yang beragam berdasarkan panjang gelombang
elektromagnetik, salah satunya adalah sinar X dan gamma yang bergelombang
pendek. Keduanya merupakan radiasi pengion yang dapat melepas energi
(ionisasi) ketika melewati atau menembus materi. Proses ionisasi itu terjadi dalam
jaringan tanaman sehingga menyebabkan perubahan sel, genom, kromosom, dan
DNA atau gen. Perubahan ini disebut mutasi, hanya saja intensitas sinar X dan
gamma dalam sinar matahari sangat rendah sehingga mutasi di alam sangat
Bentuk daun bulat panjang seperti tongkat dengan permukaan ellips. Daun
hijau keperakan dan panjang, berhiaskan cross banding yang mirip dengan
S. trifasciata. Jenis ini tidak mempunyai saluran dipermukaan daun. Ada beberapa
varian yang kerap dijumpai. Bentuk daun bulat, panjang dan tumbuh
berpasang-pasangan. Ukuran daun panjang 150 cm dengan ketebalan 3 cm, namun daun
bagian luarnya hanya 12 cm. Warna daun hijau, tangkai bunga 90-100 cm. Ciri
khas daun bulat dan ada garis memanjang (Trubus, 2008).
Kultur Jaringan
Pemuliaan tanaman in vitro mencakup semua teknik kultur sel dan
jaringan yang meliputi perbanyakan, pengamatan dan manipulasi genetik tanaman
tanpa melibatkan siklus seksual. Pada dasarnya kultur in vitro merupakan suatu
proses perbanyakan sel, jaringan, organ atau protoplas dengan teknik steril
(Nasir, 2002)
Dibandingkan dengan perbanyakan tanaman secara konvensional,
perbanyakan tanaman secara kultur jaringan mempunyai beberapa kelebihan
sebagai berikut:
1. Untuk memeperbanyak tanaman tertentu yang sulit atau sangat lambat
diperbanyak secara konvensional. Perbanyakan tanaman secara kultur
jaringan menawarkan peluang besar untuk menghasilkan jumlah bibit
tanaman yang banyak dalam waktu relatif singkat sehingga lebih
ekonomis.
2. Perbanyakan tanaman secara kultur jaringan tidak memerlukan tempat
3. Teknik perbanyakan tanaman secara kultur jaringan dapat dilakukan
sepanjang tahun tanpa bergantung pada musim.
4. Bibit yang dihasilkan lebih sehat.
5. Memungkinkan dilakukannya manipulasi genetik.
Walaupun banyak kelebihannya, teknik ini juga mempunyai beberapa kelemahan
sebagai berikut:
1. Dibutuhkan biaya awal yang relatif tinggi untuk laboratorium dan bahan
kimia.
2. Dibutuhkan keahlian khusus untuk melaksanaknnya.
3. Tanaman yang dihasilkan berukuran kecil, aseptik dan terbiasa hidup di
tempat yang berkelembaban tinggi sehingga memerlukan aklimatisasi ke
lingkungan eksternal (Yusnita, 2003).
Salah satu prasyarat utama dalam teknik kultur in vitro adalah kebersihan
dan sterilitas alat serta tempat yang digunakan. Hal ini diperlukan untuk
mencegah terjadinya kontaminasi oleh bakteri atau jamur yang pertumbuhannya
jauh lebih cepat dibanding dengan pertumbuhan kultur sel atau jaringan tanaman.
Oleh karena itu pekerjaan kultur in vitro sebaiknya dilakukan di tempat tertutup
dan tidak digunakan untuk aktivitas yang lain (Yuwono, 2006).
Eksplan
Bahan tanaman yang dikulturkan lazim disebut eksplan. Dalam
perbanyakan tanaman secara kultur jaringan, eksplan merupakan faktor penting
penentu keberhasilan. Umur fisiologis, umur ontogenetik, ukuran eksplan serta
bagian tanaman yang diambil merupakan hal-hal yang harus dipertimbangkan
Umumnya bagian tanaman yang digunakan sebagai eksplan adalah jaringan muda
yang sedang tumbuh aktif. Jaringan tanaman yang masih muda mempunyai daya
regenerasi lebih tinggi, sel-selnya masih aktif membelah diri, dan relatif lebih
bersih (mengandung lebih sedikit kontaminan) (Yusnita, 2003).
Kondisi fisiologi eksplan memiliki peranan penting bagi keberhasilan
teknik kultur jaringan. Pierik (1997) menyatakan bahwa pada umumnya
bagian-bagian vegetatif lebih siap beregenerasi daripada bagian-bagian generatif. Eksplan mata
tunas yang diperoleh dari tanaman yang sedang istirahat, lebih sulit berproliferasi
daripada mata tunas yang diperoleh dari tanaman yang sedang aktif tumbuh. Sama
halnya dengan kasus dormansi pada eksplan biji (Zulkarnain, 2009).
Kalus yang diperoleh dari inisiasi awal akan memiliki kemampuan untuk
beregenerasi membentuk embryo somatik yang tinggi dibandingkan dengan kalus
hasil subkultur. Seperti pada embriogenesis langsung, kemampuan ini tergantung
kepada eksplan awal yang dikulturkan. Eksplan memiliki kemampuan untuk
menghasilkan embriogenesis langsung, namun dapat juga membentuk kalus
embryonik. Kalus yang dihasilkan ada yang memiliki kemampuan embryo
somatik dan ada yang sama sekali tidak memiliki kemampuan morfogenetik
karena eksplan yang dikulturkan juga mengandung sel atau jaringan yang mampu
mengadakan morfogenesis dan ada yang tidak (Wattimena dkk, 1992).
Media Tumbuh
Kebutuhan nutrisi untuk pertumbuhan kultur in vitro yang optimal
bervariasi antarspesies ataupun antarvarietas. Bahkan jaringan yang berasal dari
bagian tanaman yang berbeda pun akan berbeda nutisinya. Oleh karena itu, tidak
organ. Meskipun demikian, medium dasar MS adalah yang paling luas
penggunaannya dibandingkan dengan media dasar lainnya. Medium MS banyak
digunakan. Hal itu dikarenakan medium MS memiliki kandungan garam-garam
yang lebih tinggi daripada media lain, disamping kandungan nitratnya juga tinggi
(Zulkarnain, 2009).
Media kultur merupakan salah satu faktor penentu keberhasilan
perbanyakan tanaman secara kultur jaringan. Media kultur tersebut, fisiknya dapat
berbentuk cair atau padat. Kebutuhan nutrisi mineral untuk tanaman yang
dikulturkan secara invitro pada dasarnya sama dengan kebutuhan hara tanaman
yang ditumbuhkan di tanah, meliputi hara-hara makro dan mikro Komponen
media kultur yang lengkap sebagai berikut.
1. Air distilasi (akuades) atauair bebas ion sebagai pelarut atau solven.
2. Hara makro dan mikro
3. Gula (umumnya sukrosa) sebagai sumber energi
4. Vitamin, asam amino dan bahan organik lain
5. Zat Pengatur Tumbuh
6. Suplemen berupa bahan-bahan alami, jika diperlukan
7. Agar-agar atau gelrite sebagai pemadat media (Yusnita, 2003).
Vitamin memiliki fungsi katalitik pada sistem enzim dan dibutuhkan
dalam jumlah kecil. Satu-satunya vitamin yang dianggap esensial pada kultur
invitro adalah tiamin (vitamin B1). Tiamin diberikan pada medium kultur dalam
bentuk tiamin HCl. perlunya kehadiran tiamin pada kultur invitro terutama pada
Zat Pengatur Tumbuh
Keberadaan hormon dan zat pengatur tumbuh dalam kegiatan kultur
jaringan adalah mutlak. Karena kegiatan kultur jaringan umumnya menggunakan
bahan tanam yang tidak lazim (sel, jaringan atau organ) dan budidayanya adalah
budidaya yang terkendali. Pengaturan proses tumbuh dan berkembangnya eksplan
dapat dilakukan dengan mengatur macam dan konsentrasi hormon atau zpt
tertentu sehingga menghasilkan kombinasi yang tepat sesuai dengan harapan
(Santoso dan Nursandi, 2001).
Peranan auksin dalam kultur in vitro terutama untuk pertumbuhan kalus,
suspensi sel, dan pertumbuhan akar. Bersama-sama sitokinin dapat mengatur tipe
morfogenesis yang dikehendaki. Pengaruh sitokinin di dalam kultur in vitro antara
lain berhubungan dengan proses pembelahan sel, proliferasi tunas ketiak,
penghambatan pertumbuhan akar tanaman dan induksi umbi mikro kentang
(Widyastuti dan Tjokrokusumo, 2007)
Auksin merupakan istilah generik untuk substansi pertumbuhan yang
khususnya merangsang perpanjangan sel, tetapi auksin juga menyebabkan suatu
kisaran respon pertumbuhan yang berbeda-beda. Kadar auksin endogen dan
aktivitasnya dalam jaringan berhubungan dengan keseimbangan antara sintesis
dengan hilangnya auksin karena transpor dan metabolisme. Auksin diproduksi
dalam jaringan meristematik yang aktif yaitu tunas, daun muda dan buah
(Gardner dkk, 2008).
Umumnya sitokinin paling banyak terdapat di organ muda (biji, buah,
daun) dan di ujung akar. Daun, buah dan biji muda, tidak mudah memindahkan
akan menghambat pertumbuhan in vitro jika konsentrasi zpt dalam jaringan
menjadi berlebihan. Tidak mudah untuk mengatasi masalah ini tanpa mengukur
konsentrasi dalam sitokinin pada irisan jaringan, terutama pada sel epidermis yang
diduga menghalangi keseluruhan laju pemanjangan
(Salisbury and Ross, 2002).
Auksin terutama untuk pertumbuhan kalus, suspensi sel dan pertumbuhan
akar. Bersama-sama sitokinin dapat mengatur tipe morfogenesis yang
dikehendaki. Pemilihan konsentrasi dan jenis auksin ditentukan oleh kemampuan
dari jaringan yang dikultur (eksplan) untuk mensintesis auksin secara alamiah.
Pada sitokinin dengan konsentrasi tinggi yang mendorong proliferasi tunas
sebaliknya menghambat penghambat akar. Zat pengatur pada eksplan tergantung
dari zat pengatur tumbuh endogen dan zat pengatur eksogen yang diserap dari
media tumbuh. Konsentrasi yang diperlukan dari masing-masing ZPT auksin dan
sitokinin tergantung dari jenis eksplan, genotip, kondisi kultur serta jenis auksin
dan sitokinin yang dipergunakan (Wattimena dkk, 1992).
Skinner dan Shive, 1955; Fries, 1960 dalam Wilkins (1992) menyatakan
bahwa sitokinin diproduksi oleh akar, jika pemakaian zpt eksogen menghasilkan
tingkat yang supra optimal, dalam beberapa kasus sitokinin akan merangsang
pembentukan akar dan menghambat pertumbuhan tunas.
Terdapat kisaran interaksi yang luas antara kelompok auksin dengan
sitokinin. Kedua kelompok zat pengatur tersebut berinteraksi pula dengan
senyawa-senyawa kimia lainnya dan dipengaruhi oleh faktor-faktor lingkungan,
seperti cahaya dan suhu. Pada kondisi tertentu, auksin dapat bereaksi menyerupai
antarspesies bahkan antarkultivar dalam hal jenis serta takaran auksin dan
sitokinin yang dibutuhkan untuk menginduksi terjadinya morfogenesis. Tunas
dapat mengalami habituasi terhadap sitokinin setelah diperlakukan dengan
sitokinin konsentrasi tinggi. Karakteristik kultur yang mengalami habituasi
sitokinin sebagai akibat kurangnya pembentukan akar. Hal ini dapat disebabkan
oleh pertumbuhan tunas yang berlebihan dan mengakibatkan penghambatan
pembentukan akar (Zulkarnaian, 2009)
Pengaruh dari suatu ZPT bergantung pada spesies tumbuhan, situs aksi
ZPT pada tumbuhan, tahap perkembangan tumbuhan dan konsentrasi ZPT. Satu
ZPT tidak bekerja sendiri dalam mempengaruhi pertumbuhan dan perkembangan
tumbuhan, pada umumnya keseimbangan konsentrasi dari beberapa ZPT-lah yang
akan mengontrol pertumbuhan dan perkembangan tumbuhan (Dewi, 2008).
Lingkungan Tumbuh
Secara umum agar kegiatan kultur jaringan berjalan baik dan bahan
tanaman dapat tumbuh berkembang seperti yang diharapkan maka pada tahap
inkubasi di ruang kultur pengendalian temperatur, cahaya, tingkat kelembaban dan
beberapa faktor lain yang menunjang adalah merupakan hal yang perlu mendapat
perhatian. Pada ruang inkubasi atau kultur adanya air conditioner (AC) sangat
baik untuk menjamin lancarnya aerasi udara dan pengaturan suhu
(Santoso dan Nursandi, 2001).
Kondisi lingkungan yang menentukan keberhasilan pembiakan tanaman
dengan kultur jaringan meliputi cahaya, suhu dan komponen atmosfer. Cahaya
dibutuhkan untuk mengatur proses morfogenetik tertentu. Dalam teknik kultur
dan kualitasnya. Prof. Murashige menyarankan untuk mengasumsikan kebutuhan
lama penyinaran pada kultur jaringan tanaman merupakan pencerminan dari
kebutuhan periodisitas tanaman yang bersangkutan di lapangan. Kualitas cahaya
mempengaruhi arah diferensiasi jaringan. Energi radiasi dekat spektrum ultra
violet dan biru merupakan kualitas cahaya yang paling efektif untuk merangsang
pembentukan tunas, sedangkan pembentukan akar dirangsang oleh cahaya merah
dan sedikit cahaya biru. Untuk itu, pada tahap inisiasi dan multiplikasi tunas
digunakan pencahayaan dengan lampu fluorescent. Kultur yang kurang cahaya
biasanya menunjukkan gejala etiolasi dan virtifikasi. Etiolasi ditunjukkan dengan
panjangnya ruas (internode) pada tunas yang terbentuk, sedangkan virtifikasi
ditandai dengan sukulensi, batang tampak bening atau terlalu lemas karena banyak
mengandung air (hiperhydricity). Suhu juga berpengaruh terhadap kesehatan
tanaman yang dikulturkan. Suhu yang umum digunakan untuk pengkulturan
berbagai jenis tanaman adalah ± 26°C. Untuk kebanyakan tanaman, suhu yang
terlalu rendah (kurang dari 20°C) dapat menghambat pertumbuhan dan suhu yang
BAHAN DAN METODE
Tempat dan Waktu Penelitian
Penelitian ini akan dilakukan di Laboratorium Kultur Jaringan Fakultas
Pertanian Universitas Sumatera Utara, Medan. Penelitian ini dimulai pada bulan
Maret 2010 sampai dengan Juni 2010.
Bahan dan Alat Penelitian
Bahan eksplan yang digunakan dalam penelitian ini adalah kalus
Sansevieria cylindrica yang dipelihara dalam media MS + 1,5 mg/l 2,4-D yang
berumur 9 minggu, bahan penyusun media MS, BAP, NAA, agar-agar, akuades
steril, KOH, NaCl, alkohol 96% dan spritus.
Alat yang digunakan dalam penelitian ini adalah Laminar Air Flow,
autoclave, timbangan analitik, rak kultur, hot plate dengan magnetik stirer,
erlenmeyer, gelas ukur, petridish, pipet ukur, pinset, scapel, handsprayer,
thermometer, lampu bunsen, pH meter, kertas saring, kertas sampul, aluminium
foil, tisu, label, botol kultur dan kertas milimeter.
Metode Penelitian
Penelitian ini dilakukan dengan menggunakan Rancangan Acak Kelompok
(RAK) faktorial yang terdiri dari dua faktor:
Faktor I: Tingkat Konsentrasi pemberian BAP dengan 4 taraf
A0 = 0 mg/l
A1 = 1 mg/l
A2 = 2 mg/l
Faktor II: Tingkat konsentrasi pemberian NAA dengan 3 taraf
N0 = 0 mg/l
N1 = 0,2 mg/l
N2 = 0,4 mg/l
Sehingga diperoleh 12 kombinasi perlakuan yaitu:
A0 N0 A0 N1 A0 N2
A1 N0 A1 N1 A1 N2
A2 N0 A2 N1 A2 N2
A3 N0 A3 N1 A3 N2
Jumlah perlakuan : 12
Jumlah ulangan : 6
Jumlah kalus tiap botol : 1
Jumlah seluruh kalus : 72
Adapun model linier yang digunakan untuk RAK adalah:
Yijk = µ + ρi + αj + βk + (αβ)jk + εijk
i = 1,2,3,4,5,6 j = 1,2,3,4 k = 1,2,3
Dimana:
Yijk = Hasil pengamatan dari faktor ZPT BAP ke-j dan faktor ZPT NAA ke-k
pada ulangan ke-i
µ = Nilai tengah
ρi = Efek ulangan ke-i
αj = Efek konsentrasi BAP pada taraf ke-j
(αβ)jk = Interaksi antara konsentrasi BAP pada taraf ke-j dengan konsentrasi NAA
pada taraf ke-k
εijk = Efek galat dari ulangan ke-i, konsentrasi BAP pada taraf ke-j dan
konsentrasi NAA pada taraf ke-k.
Jika perlakuan (konsentrasi BAP, konsentrasi NAA dan interaksi) berbeda
nyata dalam sidik ragam maka dilanjutkan dengan Uji Jarak Berganda Duncan
(DMRT) pada α = 5% (Steel and Torrie, 1995).
Pengamatan Parameter
Persentase pertumbuhan eksplan (%)
Kultur dikatakan tumbuh adalah berwarna hijau, secara visual ukuran
bertambah, berat bertambah dan perubahan embriogenesis maupun morfogenesis.
Persentase tumbuh dihitung tiap minggu dengan rumus:
Persentase tumbuh = Jumlah eksplan yang tumbuh x 100%
Jumlah eksplan per perlakuan
Jumlah tunas (tunas)
Dihitung jumlah tunas yang terbentuk dari setiap planlet yang dilakukan
pada akhir penelitian.
Panjang tunas (cm)
Tinggi planlet diukur dengan menggunakan kertas milimeter yang diukur
dari tempat munculnya tunas (pangkal) sampai ujung tunas tertinggi dilakukan
Jumlah daun (helai)
Jumlah daun dihitung dari daun yang terbentuk yang telah terbuka
sempurna dari setiap planlet yang dilakukan pada akhir penelitian.
Jumlah akar (helai)
Jumlah akar dihitung dari jumlah akar yang terbentuk dari leher akar pada
setiap planlet yang dilakukan pada akhir penelitian.
Bentuk daun
Bentuk daun dilihat daun membulat atau melebar pada setiap planlet yang
dilakukan pada akhir penelitian.
Warna daun
Warna daun dilihat berwarna hijau, kuning atau perpaduan kuning dan
hijau pada setiap planlet yang dilakukan pada akhir penelitian.
Pelaksanaan Penelitian
Sterilisasi Alat-Alat
Sebelum semua alat-alat seperti botol kultur, petridish, gelas ukur,
erlenmeyer, pinset, scapel, dan alat-alat gelas lainnya terlebih dahulu direndam
dalam detergen dan dicuci bersih dengan air, selanjutnya dikeringkan. Kemudian
alat seperti scapel, pipet ukur, pinset dan petridish dibungkus dengan kertas
sampul sedangkan erlenmeyer dan gelas ukur permukaannya ditutup dengan
aluminium foil. Setelah itu, semua botol kultur dan alat-alat disterilkan dalam
autoklaf pada suhu 121°C dengan tekanan 17,5 psi selama 60 menit. Kemudian
Pembuatan Media
Media yang digunakan dalam penelitian ini adalah media MS padat. Tahap
pertama dalam pembuatan media adalah membuat larutan stok bahan kimia hara
makro dengan pembesaran 10x , hara mikro dengan pembesaran 100x, larutan
iron dengan pembesaran 100x, larutan vitamin dengan pembesaran 50x, sukrosa
90 g, myo-inositol 0,3 g dan agar 1,8 g masing-masing dalam 12 tempat.
Tahap berikutnya, sukrosa dimasukkan ke dalam beaker glass yang telah
berisi akuades 500 ml, lalu diaduk dengan menggunakan magnetic stirrer sebagai
pengaduk. Kemudian ditambahkan myo-inositol diaduk hingga larut. Dimasukkan
unsur hara makro 150 ml, larutan stok hara mikro 15 ml, iron 15 ml dan vitamin
30 ml. Kemudian larutan ditempatkan menjadi 900 ml. Larutan sebanyak 180 ml
dikeluarkan dan digunakan 720 ml. Larutan dibagi dalam tiga erlenmeyer
sehingga masing-masing berisi 240 ml. Tiap erlenmeyer diberi perlakuan NAA.
Ketiga erlenmeyer dibagi empat sehingga diperoleh dua belas erlenmeyer,
masing-masing berisi 60 ml. Tiap erlenmeyer diberi perlakuan BAP. Kemudian
ditambah 140 ml akuades pada tiap erlenmeyer sehingga tiap erlenmeyer berisi
200 ml. Keasaman diukur dengan pH meter. pH yang dikehendaki adalah 5,8.
untuk mengatur pH yaitu menaikkan atau menurunkan pH dapat digunakan
larutan NaOH dan HCl 0,1 N.
Agar ditambahkan ke dalam erlenmeyer setiap perlakuan, lalu dipanaskan
diatas hot plate dengan pengaduk magnetic stirer sampai larutan menjadi bening
(semua agar telah larut). Media siap dipindahkan ke dalam botol kultur steril
sebanyak 20 botol. Kemudian botol kultur tersebut ditutup dengan aluminium foil
disterilisasikan di dalam autoklaf dengan tekanan 17,5 psi, suhu 121°C selama 30
menit. Selanjutnya dapat disimpan dalam ruang kultur sebelum digunakan.
Persiapan Eksplan
Eksplan berupa kalus diambil dari botol yang berisi media MS + 2,4-D
yang berumur 9 minggu. Kegiatan ini dilakukan di Laminar Air Flow (LAF),
dimana terlebih dahulu LAF dibersihkan dengan kertas tisu dan disemprot dengan
alkohol 96%. Eksplan yang sudah terbentuk kalus dikeluarkan dari botol kultur
dengan cara mendekatkan botol di atas api bunsen dengan menggunakan pinset,
lalu dimasukkan ke dalam petridish yang sudah steril dan dipotong dengan
menggunakan scapel dan pinset menjadi 2 bagian. Scapel dan pinset yang
digunakan harus dalam keadaan steril, caranya dengan mencelupkan kedalam
alkohol lalu disterilisasikan diatas api bunsen setiap kali akan digunakan.
Penanaman Eksplan
Eksplan yang akan dikulturkan ke dalam media tanam diletakkan di
petridish. Kemudian eksplan segera ditanam pada media sesuai perlakuan dengan
menggunakan pinset setiap botol diisi satu potong kalus, kemudian botol ditutup
dengan aluminium foil.
Pemeliharaan Eksplan
Botol-botol berisi kalus diletakkan pada rak kultur di dalam ruang kultur.
Ruangan ini diusahakan bebas dari bakteri dan cendawan, dimana setiap hari
disemprot dengan alkohol 96%. Jika media sudah mulai habis maka dilakukan
HASIL DAN PEMBAHASAN
Hasil Penelitian
Persentase Pertumbuhan Eksplan (%)
Data pengamatan persentase pertumbuhan eksplan dapat dilihat pada
Lampiran 1. Dari tabel diketahui bahwa persentase pertumbuhan tertinggi pada
perlakuan BAP yaitu pada konsentrasi 3 mg/l sedangkan pada perlakuan NAA
pada konsentrasi 0,4 mg/l.
Data pengamatan persentase pertumbuhan eksplan dari perlakuan
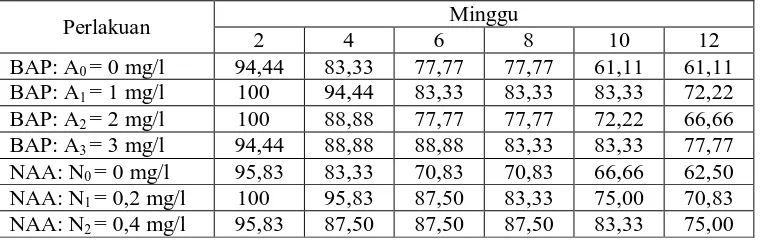
konsentrasi BAP dan NAA dapat dilihat pada Tabel 1.
Tabel 1. Pengaruh konsentrasi BAP dan NAA terhadap persentase pertumbuhan eksplan
Dari Tabel 1. dapat dilihat bahwa secara umum, semua perlakuan
mengalami penurunan persentase pertumbuhan eksplan. Pada perlakuan tanpa
BAP mengalami penurunan yang paling cepat dibanding konsentrasi 1, 2 dan 3
mg/l. Persentase pertumbuhan eksplan tertinggi terdapat pada konsentrasi 3 mg/l
sebesar 77,77 % sedangkan pada konsentrasi 2, 1 dan 0 mg/l masing-masing
sebesar 66,66%, 72,22% dan 61,11%.
Dari perlakuan NAA, perlakuan tanpa NAA mengalami penurunan yang
paling cepat dibanding konsentrasi 0,2 dan 0,4 mg/l. Persentase pertumbuhan
sedangkan pada konsentrasi 0,2 mg/l dan tanpa NAA masing-masing sebesar
70,83% dan 62,50 %.
Pengamatan persentase pertumbuhan eksplan dari perlakuan konsentrasi
BAP dapat dilihat pada Gambar 1.
0
Gambar 1. Diagram konsentrasi BAP terhadap persentase pertumbuhan eksplan yang mengalami penurunan dengan persentase pertumbuhan tertinggi pada konsentrasi 3 mg/l sedangkan terendah pada perlakuan tanpa BAP.
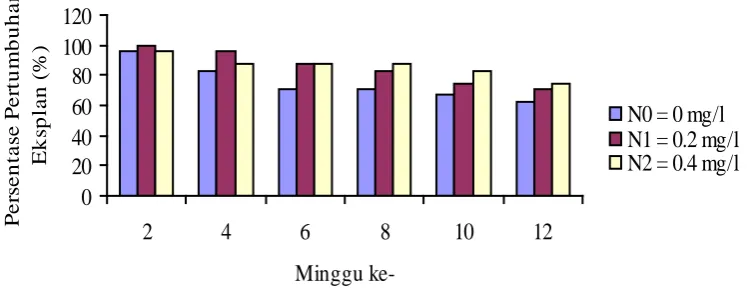
Pengamatan persentase pertumbuhan eksplan dari perlakuan konsentrasi
NAA dapat dilihat pada Gambar 2.
0
Jumlah Tunas (tunas)
Data pengamatan dan sidik ragam dari jumlah tunas dapat dilihat pada
Lampiran 2-4. Dari sidik ragam diketahui bahwa perlakuan konsentrasi BAP
berpengaruh nyata terhadap jumlah tunas sedangkan konsentrasi NAA dan
interaksi BAP dengan NAA belum berbeda nyata.
Rataan jumlah tunas dari perlakuan konsentrasi BAP dan NAA dapat
dilihat pada Tabel 2.
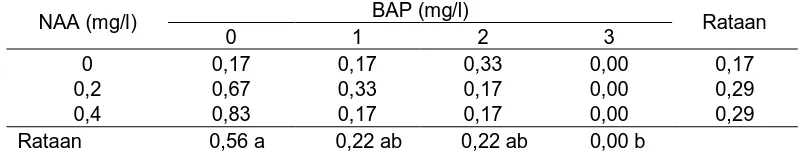
Tabel 2. Pengaruh konsentrasi BAP dan NAA terhadap jumlah tunas (tunas)
NAA (mg/l) BAP (mg/l) Rataan
0 1 2 3
0 0,17 0,17 0,33 0,00 0,17
0,2 0,67 0,33 0,17 0,00 0,29
0,4 0,83 0,17 0,17 0,00 0,29
Rataan 0,56 a 0,22 ab 0,22 ab 0,00 b
Keterangan: Angka-angka yang diikuti huruf yang sama pada setiap kolom menunjukkan pengaruh tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%
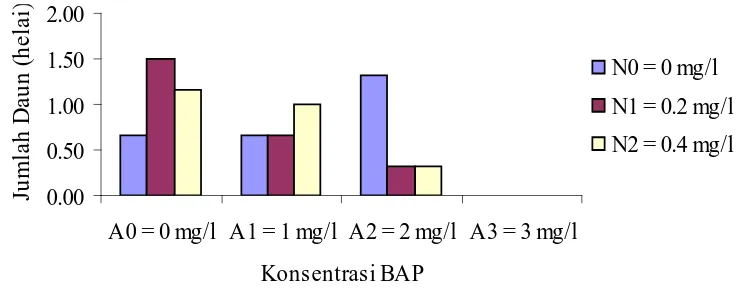
Dari Tabel 2. dapat dilihat bahwa jumlah tunas tertinggi dari perlakuan
BAP terdapat pada perlakuan tanpa pemberian BAP yaitu sebesar 0,56 tunas,
berpengaruh nyata terhadap konsentrasi 3 mg/l tetapi belum berbeda nyata
terhadap konsentrasi 1 dan 2 mg/l. Semakin tinggi pemberian BAP, jumlah tunas
yang terbentuk menurun.
Pada perlakuan NAA, jumlah tunas tertinggi terdapat pada konsentrasi 0,2
dan 0,4 mg/l yaitu sebesar 0,29 tunas dan terendah pada perlakuan tanpa
pemberian NAA yaitu sebesar 0,17 tunas.
Pengaruh konsentrasi BAP pada ketiga taraf NAA terhadap jumlah tunas
0.00
Gambar 3. Jumlah tunas yang terbentuk dengan pemberian berbagai konsentrasi BAP yang berbeda pada ketiga taraf NAA, terhadap jumlah tunas yang mengalami penurunan pada konsentrasi 3 mg/l.
Panjang Tunas (cm)
Data pengamatan dan sidik ragam dari panjang tunas dapat dilihat pada
Lampiran 5-7. Dari sidik ragam diketahui bahwa perlakuan konsentrasi BAP
berpengaruh nyata terhadap panjang tunas sedangkan konsentrasi NAA dan
interaksi BAP dengan NAA belum berbeda nyata.
Rataan panjang tunas dari perlakuan konsentrasi BAP dan NAA dapat
dilihat pada Tabel 3.
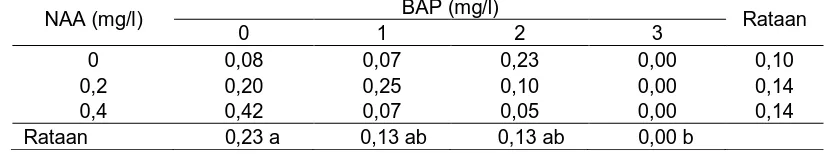
Tabel 3. Pengaruh konsentrasi BAP dan NAA terhadap panjang tunas (cm)
NAA (mg/l) BAP (mg/l) Rataan
Keterangan: Angka-angka yang diikuti huruf yang sama pada setiap kolom menunjukkan pengaruh tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%
Dari Tabel 3. dapat dilihat bahwa panjang tunas tertinggi dari perlakuan
BAP terdapat pada perlakuan tanpa pemberian BAP yaitu sebesar 0,23 cm,
terhadap konsentrasi 1 dan 2 mg/l. Semakin tinggi pemberian BAP, panjang tunas
yang terbentuk menurun.
Pada perlakuan NAA, panjang tunas tertinggi terdapat pada konsentrasi
0,2 dan 0,4 mg/l yaitu sebesar 0,14 cm dan terendah pada perlakuan tanpa
pemberian NAA yaitu sebesar 0,10 cm.
Pengaruh konsentrasi BAP pada ketiga taraf NAA terhadap panjang tunas
dapat dilihat pada gambar 4.
0.00
Gambar 4. Panjang tunas yang terbentuk dengan pemberian berbagai konsentrasi BAP yang berbeda pada ketiga taraf NAA, terhadap panjang tunas yang mengalami penurunan pada konsentrasi 3 mg/l.
Jumlah Akar (helai)
Data pengamatan dan sidik ragam dari jumlah akar dapat dilihat pada
Lampiran 8-10. Dari sidik ragam diketahui bahwa perlakuan konsentrasi BAP dan
konsentrasi NAA berpengaruh nyata terhadap jumlah akar sedangkan interaksi
BAP dengan NAA belum berbeda nyata.
Rataan persentase jumlah akar dari perlakuan konsentrasi BAP dan NAA
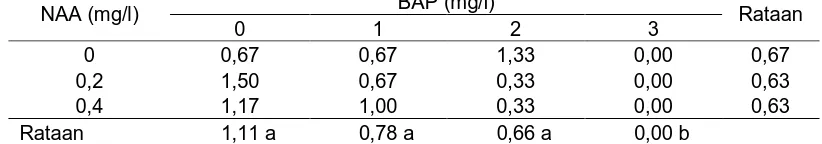
Tabel 4. Pengaruh konsentrasi BAP dan NAA terhadap jumlah akar (helai)
Keterangan: Angka-angka yang diikuti huruf yang sama pada setiap kolom menunjukkan pengaruh tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%
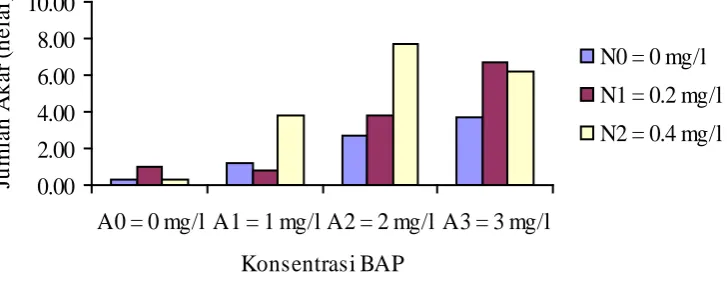
Dari Tabel 4. dapat dilihat bahwa jumlah akar tertinggi dari perlakuan
BAP terdapat pada konsentrasi 3 mg/l yaitu sebesar 5,50 helai, berpengaruh nyata
terhadap konsentrasi 0 dan 1 mg/l tetapi belum berbeda nyata terhadap konsentrasi
2 mg/l. Semakin tinggi pemberian BAP, jumlah akar yang terbentuk meningkat.
Pada perlakuan NAA, jumlah akar tertinggi terdapat pada konsentrasi 0,4
mg/l yaitu sebesar 4,50 helai, berpengaruh nyata terhadap tanpa pemberian NAA
tetapi belum berbeda nyata terhadap konsentrasi 0,2 mg/l. Semakin tinggi
pemberian NAA, jumlah akar yang terbentuk meningkat.
Pengaruh konsentrasi BAP pada ketiga taraf NAA terhadap jumlah akar
dapat dilihat pada gambar 5.
0.00
Jumlah Daun (helai)
Data pengamatan dan sidik ragam dari jumlah daun dapat dilihat pada
Lampiran 11-13. Dari sidik ragam diketahui bahwa perlakuan konsentrasi BAP
berpengaruh nyata terhadap jumlah daun sedangkan konsentrasi NAA dan
interaksi BAP dengan NAA belum berbeda nyata.
Rataan jumlah daun dari perlakuan konsentrasi BAP dan NAA dapat
dilihat pada Tabel 5.
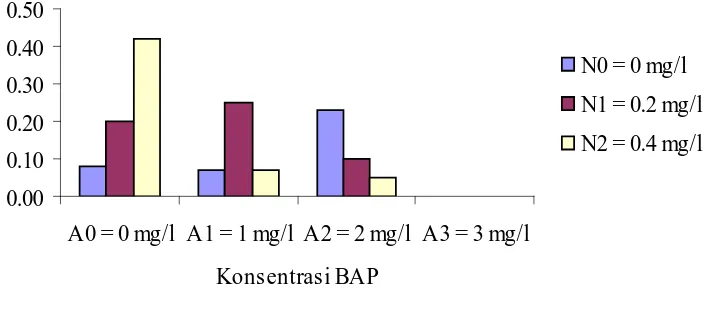
Tabel 5. Pengaruh konsentrasi BAP dan NAA terhadap jumlah daun (helai)
NAA (mg/l) BAP (mg/l) Rataan
0 1 2 3
0 0,67 0,67 1,33 0,00 0,67
0,2 1,50 0,67 0,33 0,00 0,63
0,4 1,17 1,00 0,33 0,00 0,63
Rataan 1,11 a 0,78 a 0,66 a 0,00 b
Keterangan: Angka-angka yang diikuti huruf yang sama pada setiap kolom menunjukkan pengaruh tidak berbeda nyata pada Uji Jarak Duncan pada taraf 5%
Dari Tabel 5 dapat dilihat bahwa jumlah daun tertinggi pada perlakuan
BAP terdapat pada perlakuan tanpa pemberian BAP yaitu sebesar 1,11 helai,
berpengaruh nyata terhadap konsentrasi 3 mg/l. Semakin tinggi pemberian BAP,
jumlah daun yang terbentuk menurun.
Pada perlakuan NAA, jumlah daun tertinggi terdapat pada perlakuan tanpa
pemberian NAA yaitu sebesar 0,67 helai dan terendah pada konsentrasi 0,2 dan
0,4 mg/l yaitu sebesar 0,63 helai.
Pengaruh konsentrasi BAP pada ketiga taraf NAA terhadap jumlah daun
0.00
Gambar 6. Jumlah daun yang terbentuk dengan pemberian berbagai konsentrasi BAP yang berbeda pada ketiga taraf NAA terhadap jumlah daun yang mengalami penurunan pada konsentrasi 3 mg/l.
Warna Daun
Data pengamatan warna daun dapat diketahui bahwa semua tunas yang
tumbuh berwarna hijau (Lampiran 17).
Bentuk Daun
Data pengamatan bentuk daun dapat diketahui bahwa semua tunas yang
Pembahasan
Pengaruh BAP Terhadap Pembentukan Tunas Sansevieria
Dari hasil penelitian yang dilakukan dapat diketahui bahwa pada perlakuan
pemberian konsentrasi BAP secara umum, semua perlakuan mengalami
penurunan persentase pertumbuhan eksplan. Hal ini dapat terjadi karena tingkat
kontaminasi dalam perbanyakan secara kultur jaringan yang cukup tinggi karena
penyebaran bakteri atau jamur dapat terjadi di udara dan pertumbuhannya yang
sangat cepat. Hal ini sesuai dengan pernyataan Yuwono (2006) yang menyatakan
bahwa salah satu prasyarat utama dalam teknik kultur in vitro adalah kebersihan
dan sterilitas alat serta tempat yang digunakan. Hal ini diperlukan untuk
mencegah terjadinya kontaminasi oleh bakteri atau jamur yang pertumbuhannya
jauh lebih cepat dibanding dengan pertumbuhan kultur sel atau jaringan tanaman.
Dari hasil analisis data secara statistik diperoleh bahwa pemberian
konsentrasi BAP yang berbeda menunjukkan pengaruh yang nyata terhadap
semua pengamatan parameter.
Pada peubah amatan jumlah tunas, panjang tunas dan jumlah daun rataan
tertinggi terdapat pada perlakuan tanpa pemberian BAP masing-masing sebesar
sebesar 0,56 tunas; 0,23 cm dan 1,11 helai dan yang paling rendah terdapat pada
konsentrasi 3 mg/l yaitu sebesar 0 tunas (tidak ada tunas yang muncul). Hal ini
menunjukkan bahwa tanpa pemberian BAP, eksplan tetap dapat tumbuh karena
media MS yang digunakan telah mengandung unsur yang dibutuhkan tanaman.
Yusnita (2003) menyatakan kebutuhan nutrisi mineral untuk tanaman yang
dikulturkan secara invitro pada dasarnya sama dengan kebutuhan hara tanaman
sitokinin dalam jaringan sudah mencukupi untuk pertumbuhan dan penambahan
sitokinin eksogen mengakibatkan konsentrasi sitokinin dalam jaringan menjadi
berlebih sehingga menghambat pertumbuhan tunas. Salisbury dan Ross (2002)
menyatakan sitokinin eksogen akan menghambat pertumbuhan in vitro jika
konsentrasi zpt dalam jaringan menjadi berlebihan. Disamping itu, Santoso dan
Nursandi (2001) menyatakan bahwa pengaturan proses tumbuh dan
berkembangnya eksplan dapat dilakukan dengan mengatur macam dan
konsentrasi hormon atau zpt tertentu sehingga menghasilkan kombinasi yang tepat
sesuai dengan harapan.
Untuk peubah amatan jumlah akar, rataan tertinggi terdapat pada
konsentrasi 3 mg/l yaitu sebesar 5,50 helai dan paling rendah terdapat pada
perlakuan tanpa pemberian BAP yaitu sebesar 0,56 helai. Hal ini disebabkan
karena konsentrasi BAP yang digunakan terlalu tinggi sehingga pengaruh
sitokinin sebagai penghambat pertumbuhan akar tidak berpengaruh terhadap
eksplan. Hal ini sesuai dengan Wattimena (1992) yang menyatakan bahwa pada
sitokinin dengan konsentrasi tinggi yang mendorong proliferasi tunas sebaliknya
menghambat penghambat akar. Dari penelitian yang dilakukan, ditemukan planlet
yang hanya memiliki akar saja tanpa adanya tunas. Hal ini juga disebabkan karena
pemakaian konsentrasi BAP yang terlalu tinggi sehingga menghambat
pertumbuhan tunas. Skinner dan Shive, 1955; Fries, 1960 dalam Wilkins (1989)
menyatakan bahwa jika pemakaian zpt sitokinin eksogen menghasilkan tingkat
yang supra optimal, dalam beberapa kasus sitokinin akan merangsang
Dari penelitian yang dilakukan, juga ditemukan planlet yang hanya
memiliki tunas saja tanpa adanya akar. Jaringan yang digunakan yaitu daun
sansevieria yang masih muda, diduga jaringan tersebut mengandung sitokinin
endogen yang sudah mencukupi untuk pembentukan tunas. Hal ini sesuai dengan
Salisbury dan Ross (2002) yang menyatakan umumnya sitokinin paling banyak
terdapat di organ muda (biji, buah, daun) dan di ujung akar. Daun, buah dan biji
muda, tidak mudah memindahkan sitokininnya ke tempat lain, baik melalui xilem
maupu n floem. Hal ini juga diduga akibat pemberian tiamin pada vitamin yang
mampu meningkatkan konsentrasi sitokinin dalam jaringan. Zulkarnain (2009)
menyatakan perlunya kehadiran tiamin pada kultur invitro terutama pada kondisi
kandungan sitokinin yang rendah didalam medium. Fenomena ini dapat terjadi
dalam teknik kultur jaringan yang dikenal dengan sebutan habituasi sitokinin.
Zulkarnain (2009) menyatakan bahwa tunas dapat mengalami habituasi terhadap
sitokinin akibat konsentrasi sitokinin yang tinggi. Hal ini dapat disebabkan oleh
pertumbuhan tunas yang berlebihan dan mengakibatkan penghambatan
pembentukan akar.
Pengaruh NAA Terhadap Pembentukan Tunas Sansevieria
Dari data yang dianalisis secara statistik diketahui bahwa perlakuan
konsentrasi NAA berpangaruh tidak nyata terhadap jumlah tunas, panjang tunas,
dan jumlah daun tetapi berpengaruh nyata terhadap jumlah akar.
Pada peubah amatan jumlah tunas dan panjang tunas, rataan tertinggi
terdapat pada konsentrasi 0,2 dan 0,4 mg/l masing-masing sebesar 0,29 tunas dan
0,14 cm sedangkan yang paling rendah terdapat pada perlakuan tanpa pemberian
peubah amatan jumlah akar, rataan tertinggi terdapat pada konsentrasi 0,4 mg/l
yaitu 4,50 helai dan yang paling rendah terdapat pada perlakuan tanpa pemberian
BAP yaitu 1,96 helai. Hal ini menunjukkan bahwa konsentrasi auksin yang
digunakan dapat disintesis oleh jaringan yang dikulturkan. Hal ini sesuai dengan
Wattimena (1992) yang menyatakan bahwa pemilihan konsentrasi dan jenis
auksin ditentukan oleh kemampuan dari jaringan yang dikultur (eksplan) untuk
mensintesis auksin secara alamiah. Salah satu fungsi auksin dalam kultur jaringan
yaitu untuk memacu pertumbuhan akar. Hal ini sesuai dengan Widyastuti dan
Tjokrokusumo (2007) yang menyatakan bahwa peranan auksin dalam kultur in
vitro terutama untuk pertumbuhan kalus, suspensi sel, dan pertumbuhan akar.
Pada peubah amatan jumlah daun, rataan tertinggi terdapat pada perlakuan
tanpa pemberian NAA yaitu sebesar 0,67 helai dan yang paling rendah terdapat
pada konsentrasi 0,2 dan 0,4 mg/l yaitu sebesar 0,63 helai. Eksplan yang
digunakan yaitu daun muda yang telah mengandung auksin endogen sehingga
tidak diperlukan penambahan auksin eksogen. Hal ini sesuai Gardner, dkk (2008)
yang menyatakan bahwa kadar auksin endogen dan aktivitasnya dalam jaringan
berhubungan dengan keseimbangan antara sintesis dengan hilangnya auksin
karena transpor dan metabolisme. Auksin diproduksi dalam jaringan meristematik
yang aktif yaitu tunas, daun muda dan buah.
Pengaruh Interaksi Konsentrasi BAP dan NAA Terhadap Pembentukan
Tunas Sansevieria
Dari data yang dianalisis secara statistik, diketahui bahwa interaksi BAP
dan NAA belum berbeda nyata terhadap semua parameter pengamatan. Hal ini
mencapai keseimbangan. Hal ini sesuai dengan Dewi (2008) yang menyatakan
pada umumnya keseimbangan konsentrasi dari beberapa ZPT-lah yang akan
mengontrol pertumbuhan dan perkembangan tumbuhan. Wattimena (1992) juga
menyatakan konsentrasi yang diperlukan dari masing-masing ZPT auksin dan
sitokinin tergantung dari jenis eksplan, genotip, kondisi kultur serta jenis auksin
dan sitokinin yang dipergunakan.
Dari hasil penelitian yang dilakukan dapat diketahui bahwa warna daun
planlet Sansevieria cylindrica berwarna hijau. Hal ini menunjukkan bahwa
planlet tanaman sansevieria yang diperbanyak secara kultur jaringan memiliki
warna daun yang sama dengan induknya. Hal ini sesuai dengan Trubus (2008)
yang menyatakan bahwa warna daun sansevieria cylindrica adalah hijau. Ciri
khas daun bulat dan ada garis memanjang.
Dari hasil penelitian pada pengamatan bentuk daun dapat diketahui bahwa
bentuk daun planlet sansevieria yaitu melebar. Hal ini dapat terjadi karena
tanaman sansevieria mudah mengalami mutasi, bahkan saat dilakukan
pengembangbiakan secara vegetatif, yang seharusnya anakan akan seperti
induknya namun pada sansevieria akan sering terjadi mutasi sehingga anaknya
berbeda dengan induknya. Hal ini sesuai dengan Pramono (2008) yang
menyatakan bahwa sansevieria sangat mudah mengalami mutasi. Tanaman ini
memiliki gen yang tidak stabil. Perubahan yang terjadi menyangkut warna daun,
corak warna daun atau bentuk daun. Anakan tanaman yang mengalami mutasi,
KESIMPULAN DAN SARAN
Kesimpulan
1. Perlakuan BAP mempengaruhi pembentukan morfologi dari kalus
sansevieria dengan meningkatkan jumlah akar.
2. Perlakuan NAA mempengaruhi pembentukan morfologi dari kalus
sansevieria terhadap jumlah akar.
3. Interaksi antara konsentrasi BAP dan NAA tidak mempengaruhi
pembentukan morfologi dari kalus sansevieria.
Saran
Perlu dilakukan penelitian lanjutan dengan menggunakan perlakuan zat
pengatur tumbuh dengan konsentrasi yang berbeda untuk mendapatkan pengaruh
yang paling baik dalam pembentukan morfologi sansevieria.
DAFTAR PUSTAKA
BBPP. 2010. Sansevieria. Diakses pada 16 Oktober 2009
Dewi, I. R. 2008. Peranan dan Fungsi Fitohormon bagi Pertumbuhan Tanaman. Makalah Universitas Padjadjaran: Bandung.
Gardner, F.P; R.B. Pearce dan R.L. Mitchell. 2008. Fisiologi Tanaman Budidaya. Penerjemah Herawati Susilo. Penerbit Universitas Indonesia: Jakarta.
Lingga, L. 2008. Sansevieria. PT Gramedia Pustaka Utama: Jakarta
Nasir, M. 2002. Bioteknologi Potensi dan Keberhasilannya dalam Bidang Pertanian. PT RajaGrafindoPersada: Jakarta.
Pramono, S. 2008. Pesona Sansevieria. PT Agromedia Pustaka: Jakarta.
Salisbury, F. B and C. W. Ross. 2002. Plant Physiology. CBS Publisher & Distributors: New Delhi.
Santoso, U dan F. Nursandi. 2001. Kultur Jaringan Tanaman. UMM Press: Malang.
Sharma, O.P. 2009. Plant Taxonomy 2E. Publisher by Tata McGraw-HillI: New Delhi.
Slater, Adrian., Nigel Scott and Mark Fowler. 2003. Plant Biotechnology. Oxford University Press: New York.
Steel R. G. dan J. H. Torrie. 1995. Prinsip dan Prosedur Statistika. PT Gramedia Pustaka Utama: Jakarta.
Tahir, M. Indariani dan M. Sitanggang. 2008. 165 Sansevieria Eksklusif. PT Agromedia Pustaka: Jakarta.
Tjitrosoepomo, G. 2002. Taksonomi Tumbuhan (Spermatophyta). UGM Press: Yogyakarta.
Trubus, Redaksi. 2008. Sansevieria 200 Jenis Spektakuler. PT Trubus Swadaya: Jakarta.
Widyastuti, N dan Donowati Tjokrokusumo. 2007. Peranan Beberapa Zat Pengatur Tumbuh (ZPT) Tanaman Pada Kultur In Vitro. tanggal 4 Agustus 2010.
Wilkins, M.B, 1992. Fisiologi Tanaman. Penerjemah Sutedjo M.M dan Kartasapoetra A.G. Bumi Aksara: Jakarta.
Yusnita. 2003. Kultur Jaringan cara memperbanyak tanaman secara efisien. AgroMedia Pustaka: Jakarta.
Yuwono, T. 2006. Bioteknologi Pertanian. UGM Press: Yogyakarta.
Lampiran 1. Data Pengamatan Persentase Pertumbuhan Eksplan
Perlakuan Minggu
1 2 3 4 5 6 7 8 9 10 11 12
A0 100% 94,44% 88,88% 83,33% 77,77% 77,77% 77,77% 77,77% 72,22% 61,11% 61,11% 61,11%
A1 100% 100% 100% 94,44% 88,88% 83,33% 83,33% 83,33% 83,33% 83,33% 72,22% 72,22%
A2 100% 100% 94,44% 88,88% 83,33% 77,77% 77,77% 77,77% 77,77% 72,22% 66,66% 66,66%
A3 100% 94,44% 94,44% 88,88% 88,88% 88,88% 88,88% 83,33% 83,33% 83,33% 77,77% 77,77%
N0 100% 95,83% 91,66% 83,33% 79,16% 70,83% 70,83% 70,83% 70,83% 66,66% 62,50% 62,50%
N1 100% 100% 100% 95,83% 87,50% 87,50% 87,50% 83,33% 83,33% 75,00% 70,83% 70,83%
N2 100% 95,83% 91,66% 87,50% 87,50% 87,50% 87,50% 87,50% 83,33% 83,33% 75,00% 75,00%
Lampiran 2. Data Pengamatan Jumlah Tunas (tunas)
Perlakuan Ulangan Total Rataan
I II III IV V VI
Lampiran 3. Data Transformasi Jumlah Tunas √X+0.5
Perlakuan Ulangan Total Rataan
Lampiran 4. Daftar Sidik Ragam Jumlah Tunas
SK db JK KT F
F.hit F.05 Ulangan 5 2,87 0,57 15,51 * 1,96
* 2,19 tn 2,40 tn 1,88
Perlakuan 11 0,71
BAP 3 0,48 0,16 4,28
NAA 2 0,03 0,01 0,34
AXN 6 0,21 0,03 0,94
Error 55 2,04 0,04
Total 71 5,62
KK * tn
= 23,47
Lampiran 5. Data Pengamatan Panjang Tunas (cm)
Perlakuan Ulangan Total Rataan
I II III IV V VI
Lampiran 6. Data Transformasi Panjang Tunas √X+0.5
Perlakuan Ulangan Total Rataan
Lampiran 7. Daftar Sidik Ragam Panjang Tunas
SK db JK KT F
F.hit F.05 Ulangan 5 0,73 0,15 8,07 * 1,96
Perlakuan 11 0,25
BAP 3 0,13 0,04 2,42 * 2,19
NAA 2 0,00 0,00 0,13 tn 2,40
AXN 6 0,11 0,02 1,05 tn 1,88
Error 55 0,99 0,02
Total 71 1,97
KK * tn
= 17,40
Lampiran 8. Data Pengamatan Jumlah Akar (helai)
Perlakuan Ulangan Total Rataan
I II III IV V VI
Lampiran 9. Data Transformasi Jumlah Akar √X+0.5
Perlakuan Ulangan Total Rataan
Lampiran 10. Daftar Sidik Ragam Jumlah Akar
SK db JK KT F
F.hit F.05
Ulangan 5 47,84 9,57 18,36 * 1,96
Perlakuan 11 20,85
BAP 3 15,34 5,11 9,81 * 2,19 NAA 2 2,83 1,42 2,72 * 2,40 AXN 6 2,68 0,45 0,86 tn 1,88
Error 55 28,66 0,52
Total 71 97,35
KK * tn
= 47.31
= Berpengaruh nyata = Tidak nyata
Lampiran 11. Data Pengamatan Jumlah Daun (helai)
Perlakuan Ulangan Total Rataan
I II III IV V VI
Lampiran 12. Data Transformasi Jumlah Daun √X+0.5
Perlakuan Ulangan Total Rataan
Lampiran 13. Daftar Sidik Ragam Jumlah Daun (helai)
SK db JK KT F
F.hit F.05 Ulangan 5 10,52 2,10 16,80 * 1,96
Perlakuan 11 2,07
BAP 3 1,44 0,48 3,83 * 2,19
tn 2,40 tn 1,88
NAA 2 0,00 0,00 0,01
AXN 6 0,63 0,11 0,84
Error 55 6,89 0,13
Total 71 19,48
KK * tn
= 37,98
Lampiran 14. Komposisi Medium Murashige dan Skoog (MS)
Bahan Kimia Jumlah mg/liter
Makro Nutrien (Stok I) NH4 NO3
Lampiran 16. Kegiatan Penelitian
No. Kegiatan Minggu
1 2 3 4 5 6 7 8 9 10 11 12 13 14
1 Sterilisasi x
2 Pembuatan Media x
3 Persiapan Bahan x
4 Penanaman Eksplan x
5 Pemeliharaan Eksplan x x x x x x x x x x x x
6 Pengamatan Parameter x
Persentase Tumbuh (%) x
Persentase Pertumbuhan Eksplan x
Tinggi Planlet (cm) x
Jumlah Akar (helai) x
Jumlah Daun (helai) x
Bentuk Daun x
Warna Daun x
Lampiran 17.Gambar Planlet Sansevieria cylindrica
49
Lampiran 18.Gambar Foto Perlakuan Sansevieria cylindrica
B0N0 B0N1
B0N2 B1N0
B2N0 B2N1
B2N2 B3N0