KEMAMPUAN EKSTRAK DEDAUNAN BERPOTENSI
ANTIOKSIDAN UNTUK MEMODULASI APOPTOSIS PADA
SEL KHAMIR
ALGIANSYAH
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
ABSTRAK
ALGIANSYAH. Kemampuan Ekstrak Dedaunan Berpotensi Antioksidan untuk
Memodulasi Apoptosis pada Sel Khamir. Dibawah bimbingan I MADE ARTIKA,
SURYANI dan SULISTIYANI.
Salah satu penyebab terjadinya gangguan kardiovaskuler adalah aterosklerosis.
Beberapa tanaman obat yang dianggap berkhasiat mengobati penyakit
kardiovaskuler adalah daun Jambu Biji, daun Jati Belanda dan daun Salam.
Apoptosis terjadi dalam perkembangan lesi aterosklerosis. Oleh karena itu tujuan
penelitian ini adalah untuk menentukan kemampuan ketiga ekstrak tanaman
tersebut dalam memodulasi apoptosis. Untuk itu digunakan sel khamir sebagai
model yang akan mengecil (menjadi petit) ketika mengalami apoptosis.
Sel khamir yang telah dikultur dalam media YEPD cair dan media Petit cair
diinkubasi dengan ekstrak ketiga tanaman tersebut dengan konsentrasi 50 ppm,
100 ppm, 500 ppm, 1000 ppm, dan 2000 ppm. Pada hari ke–3 dan ke–4 sel–sel
disebar pada media YEPD padat dan media Petite padat, kemudian dihitung
frekuensi petitnya dengan penghitungan koloni langsung.
ABSTRACT
ALGIANSYAH. The Capability of Several Leaves Extracts with Antioxidant
Potency to Modulate Apoptosis in Yeast Cells. Under the direction of I MADE
ARTIKA, SURYANI dan SULISTIYANI.
One of the causes of cardiovascular disease is atherosclerosis. Some of medicinal
herbs extracts which are reported to have anti atherosclerotic property are Guava
leaves extract, Jati Belanda leaves extract, and Salam leaves extract. Apoptosis
occures in atherosclerosis lesions intima. So this research is to determine that the
capability of some herbal extracts to modulate apoptosis in yeast cells. For that
purpose, yeast cells are used as model, as they will become small colonies (petite
colonies) when apoptosis is induced.
Yeast cells were incubated into 50 ppm, 100 ppm, 200 ppm, 1000 ppm, and 2000
ppm of each extracts, previously had been enriched in sterile YEPD and Petite Broth.
On day 3 and 4, yeast cells were spread into YEPD and Petite media, and then petite
frequency was counted directly from the plate.
KEMAMPUAN EKSTRAK DEDAUNAN BERPOTENSI
ANTIOKSIDAN UNTUK MEMODULASI APOPTOSIS PADA
SEL KHAMIR
ALGIANSYAH
Skripsi
sebagai salah satu syarat untuk memperoleh gelar
Sarjana Sains pada
Program Studi Biokimia
PROGRAM STUDI BIOKIMIA
FAKULTAS MATEMATIKA DAN ILMU PENGETAHUAN ALAM
INSTITUT PERTANIAN BOGOR
Judul Skripsi : Kemampuan Ekstrak Dedaunan Berpotensi Antioksidan Untuk
Memodulasi Apoptosis Pada Sel Khamir.
Nama
: Algiansyah
NIM
: G44101023
Disetujui
Komisi Pembimbing
Diketahui
Tanggal Lulus :
Dr. Ir. I Made Artika, M.App.Sc.
Ketua
Dr. Suryani, M.Sc
Anggota
Drh. Sulistiyani, M.Sc, Ph.D
Anggota
Dr. drh. Hasim, DEA
PRAKATA
Syukur Alhamdulillah penulis panjatkan kepada Allah SWT, zat yang maha
menguasai ilmu karena atas berkat rahmat dan hidayah-Nya karya ilmiah ini dapat
diselesaikan.
Terima kasih penulis ucapkan kepada berbagai pihak yang telah membantu
penulis ketika penelitian dan menyusun karya ilmiah ini, antara lain kepada Bapak
Dr Ir. I Made Artika, M.App.Sc, Ibu Dr. Suryani dan Ibu drh. Sulistiyani, MSc
PhD yang dengan sabarnya telah memberikan banyak arahan dan bimbingan
kepada penulis. Kedua orang tua beserta keluarga yang selalu menjadi motivasi
bagi penulis dan selalu mengiringi penulis dengan doa yang tulus. Terima kasih
juga penulis sampaikan kepada para staf Laboratorium Biokimia yang telah
membantu menyediakan dan mengoperasikan peralatan. Di samping itu, terima
kasih penulis juga ucapkan kepada Mbak Lusiana yang banyak membantu secara
teknis, Mbak Retno dari departemen Biologi yang telah mengizinkan penulis
menggunakan mikroskop Olympus CX40, Pusat Studi Biofarmaka IPB yang telah
menyediakan ekstrak-ekstrak kasar, rekan-rekan Biokimia 39 untuk kebersamaan
selama ini, dan juga teman-teman seperjuangan di asrama IPB Sukasari yang telah
banyak membantu penulis secara materiil dan moril pada saat penelitian.
Penulis menyadari bahwa karya ilmiah ini masih jauh dari sempurna, karena itu
penulis mengharapkan kritik dan saran demi kesempurnaan karya ilmiah ini.
Akhirnya penulis berharap karya ilmiah ini dapat bermanfaat bagi semua pihak.
Bogor,
Januari
2009
Algiansyah
RIWAYAT HIDUP
Penulis dilahirkan di Pangkal Pinang pada tanggal 26 Februari 1983 dari ayah
Syahruddin dan ibu Rokia Timala.
Penulis menyelesaikan pendidikan tingkat dasar di SDN No. 63 Pangkal
Pinang pada tahun 1995. Pendidikan lanjutan tingkat pertama diselesaikan penulis
di SLTPN 7 Pangkal Pinang pada tahun 1998. Penulis menyelesaikan pendidikan
tingkat menengah umum di SMUN 1 Pangkal Pinang pada tahun 2001 dan pada
tahun yang sama diterima di Program Studi Biokimia IPB melalui jalur USMI.
Penulis pernah mengikuti beberapa organisasi kemahasiswaan. Penulis pernah
menjadi anggota Badan Kerohanian Islam Mahasiswa, Badan Eksekutif
Mahasiswa Fakultas MIPA dan Dewan Keluarga Masjid Al Ghifari pada tahun
2001–2002 .
DAFTAR ISI
Halaman
DAFTAR GAMBAR ... ix
DAFTAR LAMPIRAN ... x
PENDAHULUAN ... 1
TINJAUAN PUSTAKA
Apoptosis ... 2
Khamir (Saccharomyces cerevisiea) ... 3
Prion PSI ... 3
Salam (Eugenia polyantha Wight.) ... 5
Jambu Biji (Psidium guajava L.) ... 5
Jati Belanda (Guazuma ulmifolia Lamk.) ... 6
BAHAN DAN METODE
Alat dan Bahan ... . 7
HASIL DAN PEMBAHASAN
Pengaruh Ekstrak Terhadap Viabilitas ... 8
Pengaruh Ekstrak Terhadap Pembentukan Koloni Petit ... 8
Pengamatan Mikroskopik ... 11
Perbandingan Sel Khamir Normal dan Petit serta Dugaan Terbentuknya
Prion PSI Pada Khamir ... 11
SIMPULAN DAN SARAN ... 13
DAFTAR PUSTAKA ... 13
DAFTAR GAMBAR
Halaman
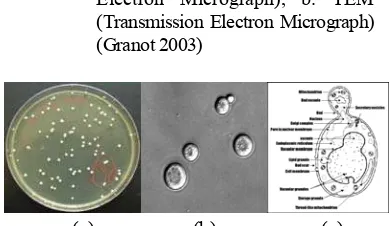
1 Sel khamir yang mengalami apoptosis: a. SEM (Scanning Electron
Micrograph), b. TEM (Transmission Electron Micrograph) (Granot
2003) ...
3
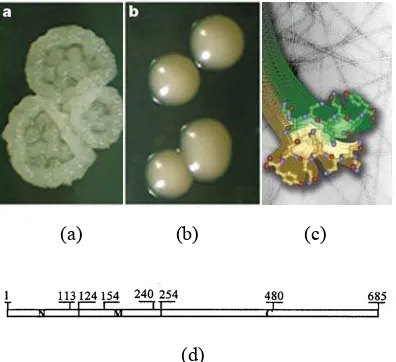
2 Sel khamir: a. koloni, b. pengamatan mikroskopik, c. diagram sel
khamir ...
3
3 Sel khamir yang terinduksi prion: a. prion PSI
+, b. prion psi
-, c. model 3
dimensi komputer grafis struktur
β
-amiloid protein prion, d. diagram
protein Sup35 (True dan Lindquist 2000) ...
5
4 Salam: a. pohon, b. buah ...
5
5 Jambu Biji: a. pohon, b. buah ...
6
6 Jati Belanda: a. pohon, b. bunga ...
6
7 Koloni khamir: a. media YEPD, b. media Petite ...
8
8 Koloni petit yang terbentuk pada kontrol media dengan perlakuan
ekstrak daun Jambu Biji pada penyebaran hari ke-3 ...
10
9 Koloni petit yang terbentuk dengan perlakuan ekstrak daun Jati Belanda
pada kontrol glukosa untuk penyebaran hari ke-4 (a), kontrol media
pada penyebaran hari ke-3 (b) dan 4 (c) ...
10
10 Koloni petit yang terbentuk pada penyebaran hari ke-3 dengan perlakuan
ekstrak daun salam: a. 100 ppm, b. 1000 ppm dan c. 2000 ppm ...
11
11 Sel khamir normal : a. dengan perlakuan dan b. tanpa perlakuan ...
12
12 Sel khamir petit : a. dengan perlakuan dan b. tanpa perlakuan ...
13
13 Koloni khamir normal tanpa perlakuan ...
13
DAFTAR LAMPIRAN
Halaman
1 Koloni Khamir yang diberi perlakuan ekstrak Jambu Biji ...
17
2 Koloni Khamir yang diberi perlakuan ekstrak Jati Belanda ...
21
3 Koloni Khamir yang diberi perlakuan ekstrak Salam ...
25
4 Tahapan ekstraksi daun Jati Belanda ...
29
5 Tahapan ekstraksi daun Salam ...
30
PENDAHULUAN
Pada masa modern ini, orang selalu berlomba dengan waktu. Segalanya ingin diselesaikan dalam waktu singkat dan praktis, termasuk pola makan. Sehingga masyarakat modern cenderung mengkonsumsi makanan cepat saji yang mengandung lemak dan kolesterol tinggi (Friedewalt 2007). Jumlah lemak yang tinggi di dalam darah hingga menyebabkan terbentuknya lesi (jaringan yang abnormal karena rusak) aterosklerosis tidak menunjukkan gejala hingga seumur hidup karena lesi tersebut tetap stabil (tidak berkurang maupun bertambah) atau hilang akibat mekanisme perbaikan dinding pembuluh darah (Weinrauch dan Gandelman 2007). Namun bila orang tersebut beresiko tinggi, lesi tersebut dapat memicu terjadinya nekrosis hingga menjadi plak yang akhirnya menjadi aterotrombosis akut akibat keping darah yang bereaksi pada lesi (Tabas 2004). Sejak tahun 1900an Aterosklerosis telah menjadi penyebab utama kematian manusia di negara industri (Friedewalt 2007).
Aterosklerosis (aterotrombosis) dipicu oleh radikal bebas dimulai dengan kerusakan pada lapisan sel endotel pembuluh darah yang diikuti serangkaian reaksi lain yang menyebabkan kerusakan pada sel dan jaringan sekitarnya. Pada lesi aterosklerosis selalu terbentuk sel busa (foam cells) akibat akumulasi lipid terus-menerus dalam sel makrofag pada pembuluh darah sehingga terjadi lesi aterosclerosis dan diakhiri dengan penyumbatan pembuluh darah hingga mengakibatkan kematian pada jaringan yang memerlukan nutrisi dan oksigen dari pembuluh darah tersebut. Plak dapat pula pecah dan ikut aliran darah hingga menyumbat pembuluh darah di tempat lain. Bila terjadi pada pembuluh darah yang menyuplai otot jantung maka menyebabkan serangan jantung mendadak karena sel otot jantung rusak atau mati hingga menyebabkan kematian. Bila terjadi pada pembuluh darah yang menyuplai sel syaraf di otak maka akan terjadi stroke yang dapat menyebabkan kelumpuhan sebelah (Weinrauch dan Gandelman 2007).
Kematian sel dapat disebabkan oleh nekrosis. Akhir-akhir ini banyak pakar berpendapat bahwa apoptosis juga berperan dalam kematian sel. Sebaliknya ada juga yang melaporkan bahwa apoptosis juga berperan dalam menghambat perkembangan lesi aterosklerosis secara dini dengan mencegah terbentuknya sel busa akibat terjadi apoptosis pada sel makrofag.
Akumulasi kolestrol bebas (tidak dalam bentuk ester) dalam jumlah besar memicu proses apoptosis pada sel makrofag akibat terbukanya lipatan protein reseptor (Unfolded Protein Response; UPR) pada membran retikulum endoplasmanya (Tabas 2004).
Apoptosis merupakan mekanisme kematian sel secara terprogram yang melibatkan sejumlah transduksi sinyal yang bekerja sama secara sinambung sehingga menyebabkan perubahan morfologi sel dan bahkan kematian sel.
Masyarakat yang masih menjalani pola hidup tradisional jarang terserang penyakit kardiovaskuler, salah satu penyebabnya adalah mereka sering mengkonsumsi tanaman obat dalam diet hariannya baik sebagai obat maupun sebagai bumbu masakan ataupun sebagai makanan. Berbagai tanaman obat yang telah sering digunakan secara tradisional untuk mengobati penyakit kardiovaskuler memiliki aktivitas antioksidan yang mungkin berkaitan dengan apoptosis sehingga dapat digunakan untuk mengobati penyakit degeneratif seperti penyakit kardiovaskuler. Tanaman tersebut tidak hanya dimanfaatkan sebagai obat, namun juga digunakan sebagai bumbu masak (Asian Food 1998). Ekawati (2007) melaporkan bahwa ekstrak etanol daun salam memiliki aktivitas antioksidan, Alviani (2007) melaporkan bahwa Jambu Biji memiliki aktivitas antioksidan, sedangkan Tombilangi (2004) dalam Martsolich (2007) melaporkan bahwa daun Jati Belanda juga memiliki aktivitas antioksidan. Efek terapeutik yang dilaporkan beberapa penelitian tersebut berasal dari senyawa-senyawa aktif yang terkandung dalam tanaman tersebut misalnya steroid, alkaloid, flavonoid, tanin, saponin, triterpenoid, dan fenolik hidrokuinon. Namun efek terapeutik terhadap penyakit kardiovaskuler masih banyak dilatarbelakangi oleh pengalaman empiris. Masih sedikit yang berdasarkan pembuktian secara ilmiah.
2
Hasil penelitian ini diharapkan dapat membantu menemukan tanaman herbal yang mampu menjadi obat alami yang dapat menyembuhkan beberapa penyakit dengan menghambat apoptosis atau menjadi obat bagi penyakit yang lain dengan memacu apoptosis, misalnya kanker.
TINJAUAN PUSTAKA
Apoptosis
Apoptosis merupakan proses kematian secara alami dan terprogram. Hal ini berbeda dengan nekrosis yang merupakan penghancuran sel secara total. Secara etimologi, apoptosis berasal dari kata Yunani yang berarti gugur atau rontok yang memiliki konotasi daun yang jatuh dari pohon. Apoptosis terjadi ketika sel mengalami kerusakan yang tidak dapat diperbaiki lagi, terinfeksi virus, mengalami stress misalnya kelaparan, kerusakan DNA akibat radiasi ionisasi atau bahan kimia beracun, atau biasa juga disebabkan aktivitas gen penekan tumor dan radikal bebas.
Apoptosis berfungsi melenyapkan sel-sel rusak atau sel-sel yang tidak dapat menjalankan fungsinya, mencegah sel yang mengalami kekurangan nutrien atau untuk mencegah penularan virus. Apoptosis juga berperan penting mencegah kanker. Jika suatu sel gagal atau tidak mampu melakukan apoptosis, ia akan terus membelah dan berkembang menjadi tumor. Tumor terjadi ketika jumlah sel tidak dapat dipertahankan pada jumlah tetap. Apoptosis melibatkan serangkaian kejadian biokimiawi melalui transduksi sinyal yang menyebabkan perubahan ciri morfologis dan bahkan kematian sel. Ciri morfologis yang diamati ketika sel mengalami apoptosis adalah pengerutan sel (pyknosis) fragmentasi inti sel, kerusakan membran (karyorrhexis) dan bahkan sel dapat pecah menjadi beberapa vesikel yang disebut badan apoptosis (Gambar 1).
Proses apoptosis pada khamir dipicu dan diatur oleh sejumlah sinyal sel yang dapat berasal dari intraselular atau ekstraselular. Sinyal-sinyal ekstraselular berupa hormon, faktor petumbuhan, nitrit oksida (NO) dan sitokin. Sinyal intraselular merupakan respon dari terikatnya glukokortikoid (analog hormon yang diproduksi adrenal manusia, terdiri dari glukosa dan steroid) akibat panas, radiasi, radikal bebas, kekurangan makanan, infeksi virus, atau hipoksia. Sinyal-sinyal ini dapat
mencapai membran saja atau diteruskan ke dalam sel tergantung letak reseptornya. Sinyal-sinyal ini dapat menghambat maupun memacu apoptosis. (Wikipedia 2007).
Sebelum peristiwa apoptosis sebenarnya terjadi, sinyal apoptosis terhubung ke jalur kematian aktual oleh beberapa protein regulator yang disebut protein penyesuai. Mekanisme pengaturan apoptosis terjadi di mitokondria, tergantung dari akumulasi sinyal apoptosis di mitokondria. Bila akumulasi sinyal apoptosis meningkat maka sel akan mati, tapi bila akumulasi sinyal menurun maka proses apoptosis akan dibatalkan sehingga sel tidak perlu mati (Weinberger et al. 2005).
Protein-protein ini terhubung dengan mitokondria yang melanjutkan sinyal ini ke mekanisme apoptosis melalui dua mekanisme. Pertama, protein-protein penyesuai yang meneruskan sinyal ke mitokondria. Sinyal-sinyal tersebut dapat menyebabkan mitokondria menggembung dengan membentuk pori pada membran mitokondria atau meningkatkan permeabilitas membran mitokondria sehingga molekul-molekul efektor apoptosis merembes ke luar. Kedua, sinyal-sinyal tersebut diteruskan oleh molekul-molekul efektor apoptosis ke nukleus hingga menyebabkan kerusakan kromosom. Molekul-molekul efektor apoptosis terdiri dari SMACs (Second Mitochondria-derived Activator of Caspases), sitokrom c, dan sekelompok protein yang disandikan oleh keluarga gen anti apoptosis. (Stoneman 2004).
3
Khamir (Saccharomyces cerevisiae)
Khamir merupakan organisme eukariotik yang bereproduksi secara aseksual melalui pertunasan walaupun pada kasus tertentu dapat berkembang biak dengan pembelahan biner atau dengan memproduksi semacam spora haploid untuk bereproduksi secara seksual pada kondisi di bawah stress (Gambar 2) (Wikipedia 2006).
Nama khamir berasal dari bahasa Inggris tua “gist” atau “gyst” dan dari akar kata Indo-Eropa ‘yes-“ yang berarti mendidih, gelembung atau busa sesuai dengan busa pada minuman hasil fermentasi atau gelembung yang terdapat pada roti. Mungkin khamir merupakan mikroorganisme pertama yang digunakan manusia dalam kehidupannya. (Wikipedia 2006).
Khamir merupakan organisme kemoorganotrof, karena menggunakan senyawa organik sebagai sumber energi dan tidak membutuhkan cahaya untuk tumbuh. Sumber utama karbonnya adalah gula heksosa seperti glukosa dan fruktosa atau disakarida seperti sukrosa dan maltosa. Khamir memetabolisme gula menjadi alkohol dan asam-asam organik. Khamir dapat menggunakan oksigen pernafasan seluler (anaerob obligat) atau hanya menggunakan sedikit oksigen (anaerob fakultatif), namun tidak ada khamir yang hidup secara anaerob obligat. Di laboratorium, khamir dapat ditumbuhkan pada media tumbuh padat maupun cair. Media yang biasa digunakan untuk menumbuhkan khamir diantaranya Potato Dextrose Agar (PDA) atau Potato Dextrose Broth, Wellerstien Laboratories Nutrien agar
(WLN), Yeast Extract Peptone Dextrose agar
(YEPD) dan Yeast Mouls agar (YM) atau Yeast Mouls broth (Wikipedia 2006).
Khamir penting bagi perkembangan biologi sel dan genetika karena siklus selnya sangat mirip siklus sel manusia. Karenanya mekanisme selular dasarnya dapat digunakan sebagai perbandingan sel manusia. Lagipula, banyak protein yang penting pada manusia ditemukan setelah mempelajari homolognya pada khamir. Oleh karena itu, mekanisme apoptosis pada sel manusia dapat dipelajari dengan menggunakan Khamir sebagai model.
Prion PSI
Dalam penelitian ini ditemukan fenomena yang tidak alami pada sel khamir. Pada kondisi tertentu sel khamir dapat menginduksi protein normalnya menjadi prion.
(a) (b)
Gambar 1 Sel khamir yang mengalami apoptosis: a. SEM (Scanning Electron Micrograph), b. TEM (Transmission Electron Micrograph) (Granot 2003)
(a) (b) (c) Gambar 2 Sel khamir: a. koloni, b. pengamatan
mikroskopik, c. diagram sel khamir
Prion ditemukan oleh Stanley B. Prusiner dari University of Califonia, Chicago tahun 1982. Prion merupakan partikel protein infektif yang mampu memperbanyak diri dan menginfeksi dengan melipat ulang protein normal menjadi bentuk yang abnormal. Prion memiliki struktur β-amiloid yang memungkinkan semua monomernya tersusun rapat dalam lipatan β (Derkatch et al. 1996; Schlumberger
et al. 2001; Bradley dan Liebman 2003 dalam Park et al. 2006; Allen et al. 2006; dan Scheibel et al. 2003). Struktur ini sangat stabil sehingga prion resisten terhadap denaturasi secara fisik maupun kimia. Prion berakumulasi pada sitoplasma sel (Song et al. 2005). Prion menyebar melalui sitoduksi (pembagian sitoplasma) ketika proses pertunasan dan perkawinan (Wickner 1994; King dan Diaz-Avaloz 2004; Tanaka et al. 2004 dalam Fan et al. 2007). Prion merupakan penyebab dari beberapa jenis penyakit yang mematikan dan belum dapat disembuhkan pada hewan dan manusia, biasanya penyakit yang menyerang system syaraf (Prusiner 2004 dalam Park et al. 2006; dan Prusiner 1998 dalam Fan et al. 2007).
4
berupa sekuen asam amino yang identik tetapi memiliki konformasi yang berbeda. (Allen et al. 2004).
Prion PSI ditemukan oleh Brian Cox pada tahun 1965, namun penyebab terbentuknya baru diketahui setelah tahun 1994 oleh Reed Wickner. Prion PSI memiliki dua isogenik yaitu PSI+ dan psi-. Prion PSI terbentuk dari protein normal Sup35. Sup35, bersama Sup45 merupakan termination factor pada translasi protein untuk sintesa protein pada ribosom khamir (Stansfield et al. 1995 dalam Park et al. 2006). Protein Sup35 terdiri dari tiga bagian, yaitu Sup 35C, Sup35M, dan Sup35N. Sup35C merupakan bagian yang esensial bagi fungsi terminasi translasi, Sup35M merupakan bagian tengah, sedangkan Sup35N merupakan daerah pembentukan dan perbanyakan prion (Gambar 3d) (Serio dan Lanquist 2000; Chernoff 2001 dalam Borchsenius et al. 2001 dan Song et al. 2005).
Prion PSI terbentuk akibat mutasi nonsense pada kodon yang menyandi asam amino ke 40 dan 90 dari bagian Sup35N protein Sup35. Daerah tersebut kaya terminal-N dari Glutamin, Asparagin, dan Lisin. Daerah tersebut dikenal sebagai daerah NM (Scheibel et al. 2003; Borschsenius et al. 2001). Terbentuknya Prion PSI menyebabkan translasi protein ribosom mampu membaca mRNA yang kodonnya telah mengalami mutasi nonsense (supresi mutasi nonsense). Biasanya kodon yang mengalami mutasi nonsense merupakan kodon yang menyandi protein yang berperan dalam metabolisme adenine dan leusin (Cox 1965 dan Firoozan et al. 1991 dalam Park et al. 2006) Prion PSI+ merupakan varian kuat sedangkan psi- merupakan lemah. PSI+ mampunyai efisiensi supresi mutasi nonsense yang paling baik sedangkan psi- paling tidak efisien menekan mutasi nonsense (Uptain et at. 2001). Mutasi itu juga menyebabkan overproduksi protein Sup35. Protein-protein Sup35 yang baru terbentuk langsung berubah menjadi bentuk prion (Derkatch et al. 1996 dalam Uptain SM et at. 2001; Chernoff et al. 1993 dan Derkatch et al. 1996 dalam Borchsenius et al. 2001).
Prion PSI (Gambar 3a dan 3b) pada sel khamir tersebut membuat inangnya mampu beradaptasi pada keadaan yang kurang menguntungkan (Morano dan Thiele 1999 dalam Park et al. 2006; Pirkala et al. 2001 dalam Fan et al. 2007). Hal itu memberikan keuntungan fenotipik kepada sel inang karena menyebabkan protein yang kodonnya telah rusak akibat mutasi nonsense dapat diproduksi kembali hingga protein tersebut mampu
fungsional kembali sehingga khamir dapat tumbuh optimal pada lingkungan yang kurang menguntungkan (Chernoff 2001; Uptain dan Lindquist 2002 dalam Rakauskaite dan Citavicidius 2003; Song et al. 2005). Namun lama kelamaan semakin banyaknya protein prion di dalam sel inang menyebabkan prion menjadi toksik bagi sel inang sehingga inangnya mati (Rakauskaite dan Citavicidius 2003).
Kaperon dari keluarga Hsp (Heat Shock Protein) belakangan diketahui bertanggung jawab terhadap pelipatan ulang protein Sup 35 hingga membentuk prion PSI (Chernoff et al. 1995; Jung et al. 2000; Kushnirov et al. 2000; Jung dan Masison 2001; Sondheimer et al. 2001; Allen et al. 2005 dalam Park et al. 2006; Fan et al. 2007). Hsp merupakan sekelompok protein yang ekspresinya meningkat ketika terpapar stress seperti temperatur yang tinggi, infeksi, inflamasi, bahan kimia beracun, radiasi, kelaparan, dan hipoksia (Pirkala et al. 2001 dalam Park et al. 2006). Overekspresi itu akibat mutasi nonsense pada kodon yang menyandi ujung karboksil daerah aktivasi Hsp tersebut (Park et al. 2006 dalam Fan et al. 2007). Hsp juga merupakan regulator utama untuk mengontrol ekspresi suatu protein pada khamir (Park et al. 2006). Hsp terikat pada promoter DNA yang terikat secara cis pada DNA khamir. Promoter itu dikenal sebagai Heat Shock elements (HSes) (Amin et al. 1988 dalam Park et al. 2006).
Protein keluarga Hsp 110 dan keluarga Hsp 90 berperan dalam pembentukan prion PSI de novo dengan memacu konversi Sup35 dengan menstabilkan intermediat pelipatan (Jones et al. 2004 dalam Park et al. 2006; dan Sadlish et al. 2008). Selain Hsp 110 dan Hsp 90, protein lain juga diduga terlibat dalam pembentukan prion. PrPSc yang merupakan protein yang biasa terdapat dalam sel normal yang biasa bertugas membantu pelipatan protein secara umum, diduga terlibat dalam pelipatan ulang Sup35 normal menjadi bentuk prion PSI infektif baik PSI+ maupun psi -(Prusiner 2004 dalam Park et al. 2006).
Monomer-5
monomer tersebut di dalam sel khamir lain yang normal akan memicu pembentukan serat
β-amiloid (Gambar 3c) yang baru dengan metode polimerasi berinti (Scheibel et al. 2003; Borchsenius et al. 2001). Namun prion PSI tidak ditemukan pada isolat khamir untuk industri maupun isolat khamir liar (Chernoff 2001 dan Chernoff et al. 1998 dalam Borchsenius et al. 2001)
Salam (Eugenia polyantha Wight.)
Salam merupakan tanaman obat yang sering digunakan masyarakat Indonesia. Daun salam sering digunakan sebagai bumbu masak (Asian Food 1998). Menurut Tjitrosoepomo (2005) salam tergolong ordo Myrtales, Famili
Myrtaceae, genus Eugenia, spesies Eugenia polyantha Wight. Salam memiliki beberapa nama lain yaitu meselangan, ubar serai (melayu), serai kayu (sumatera), gowok (sunda), manting (jawa) dan kastolam (kangean).
Salam dapat tumbuh liar di hutan dan pegununungan atau ditanam di pekarangan pada ketinggian yang relatif rendah hingga 1800 m di atas permukaan laut (Wijayakusumah et al.), bahkan tanaman ini masih dapat ditemukan pada ketinggian 2000 m di atas permukaan laut (PSB 2006). Salam dapat dikembangbiakkan dengan stek batang, cangkok atau biji. Ekawati (2007) melaporkan bahwa ektrak etanol daun salam memiliki aktivitas antioksidan. Aktivitas tersebut mungkin berhubungan dengan senyawa aktif yang terkandung pada salam, diantaranya eugenol, tannin, flavonoid, saponin, fenolik hidrokuinon, triterpenoid dan alkaloid. Seluruh bagian tanaman dapat digunakan sebagai obat, terutama daunnya. Kulit pohonnya digunakan sebagai pewarna pada kerajinan anyaman (Wikipedia 2006).
Salam memiliki daun hijau yang rimbun. Daunnya terletak berhadapan, menyirip, berbentuk lonjong hingga elips dengan panjang 5-15 cm, lebar 3-8 cm, dan memiliki tangkai dengan panjang 0,5-1 cm. Bunganya merupakan bunga majemuk bersusun berwarna putih dan berbau harum. Pohonnya berbentuk bulat, ditutup oleh kulit pohon yang licin dan dapat mencapai tinggi 25 m dengan akar tunggang. Buahnya berdiameter 8-9 mm yang memiliki rasa sepat, berwarna hijau saat muda namun berubah menjadi merah gelap setelah masak. Bijinya bulat, berwarna coklat dengan diameter sekitar 1 cm (Gambar 4) (Wikipedia 2006).
(a) (b) (c)
(d)
Gambar 3 Sel khamir yang terinduksi prion:
a. prion PSI+, b. prion psi-, c. model 3 dimensi komputer grafis struktur β-amiloid protein prion, d. diagram protein Sup35 (True dan Lindquist 2000)
(a) (b) Gambar 4 Salam: a. pohon, b. buah
Jambu Biji (Psidium guajava Linn.)
6
kayunya basah. Buahnya dapat dimakan berdiameter sekitar 3-10 cm (pada beberapa varietas dapat mencapai 12 cm). Tanaman Jambu Biji memiliki kulit buah yang manis namun agak asam, berwarna hijau hingga kuning jika masak daging buah berwarna putih, oranye atau merah dengan banyak biji kecil yang keras dan memiliki aroma khas (Gambar 5) (Wikipedia 2005).
Jambu Biji memiliki beberapa nama daerah diantaranya: jambu batu, jambu klutuk (Sunda), tetokal, tokal, bayawas (Jawa), Jambu bender (Madura) dan lima breuh (Aceh). Jambu Biji termasuk divisi
Magnoliphyta, subdivisi Angiospermae, kelas Magnolipsideae, ordo Myrtales, family Mytaceae, genus Psidium, spesies
Psidium guajava Linn. (Tjitrosoepomo 2005).
Alviani (2007) melaporkan bahwa Jambu Biji memiliki beragam senyawa aktif yaitu polifenol, tannin, saponin, minyak atsiri, asam ursolat, asam psidiolat, asam kratogolat, asam oleanolat, asam guajaverin, vitamin A, vitamin B dan vitamin C. Karena senyawa-senyawa tersebutlah Jambu Biji memiliki aktivitas antioksidan. Vitamin C pada buah Jambu Biji 3-6 kali lebih tinggi dari pada vitamin C pada jeruk.
Daun Jambu Biji digunakan untuk mengobati diare karena memiliki antivitas antimikroba (Triarsari 2006). Daunnya juga digunakan untuk memanggang daging karena memberikan rasa enak dan bau yang lebih harum pada daging panggang. Jambu Biji juga dipercaya memiliki aktivitas antidiabetes, antiinflamasi, antimutagenik, analgesik dan antimaag (Soesilo dalam Alviani 2007). Khasiat tanaman Jambu Biji sebagai tanaman obat berkaitan dengan senyawa aktif yang dimilikinya.
Jati Belanda (Guazuma ulmifolia Lamk.)
Jati Belanda merupakan genus tanaman kayu keras tropis dari divisi Spermatophyta, subdivisi Angiospermae, kelas
Dycotyledone, ordo Steruliaceae, genus
Guazuma, spesies Guazuma ulmifolia
Lamk. Jati Belanda berasal dari daerah tropis di Amerika Tengah dan Selatan juga sering ditemukan pada hutan monsoon. Tanaman ini di jawa biasa dipanggil jati londo atau jotos landi.
Jati Belanda memiliki pohon yang besar, tumbuh cepat dengan tinggi 10-22 m, mengugurkan daunnya pada musim kemarau. Bunganya kuning dengan bintik-bintik merah. Daunnya menyirip, berselang-seling, berujung runcing, berbentuk hati, berambut pada bagian bawahnya dengan pinggir kasar, panjang 10-16 cm lebar 3-6 cm. buahnya berruang lima berwarna hijau tapi berubah menjadi hitam ketika matang, berbiji banyak yang berwarna kuning kecoklatan, berlendir dan terasa agak manis (Gambar 6).
Daun Jati Belanda digunakan sebagai obat tradisional untuk menyembuhkan diare, perut kembung, batuk, kaki bengkak, juga sebagai pelangsing tubuh. Tombilangi (2004) dalam Martsolich (2007) melaporkan bahwa daun Jati Belanda juga memiliki aktivitas antioksidan. Hasil. penelitian secara in vivo menunjukksn bahwa aktivitas antioksidan daun Jati Belanda berasal dari kemampuan ekstraknya menghambat perosidasi lipid Khasiatnya sebagai obat berkaitan dengan senyawa aktif yang dimilikinya yaitu flavonoid, karotenoid, asam fenolat, kalkon, auron, flavonol (Miradiono 2002 dalam Martsolich 2007), steroid dan triterpenoid (Rachmadani 2002 dalam Martsolich 2007).
(a) (b) Gambar 5 Jambu Biji: a. pohon, b. buah
(a) (b)
7
BAHAN DAN METODE
Alat dan Bahan
Bahan yang dipakai ialah biakan khamir (Saccharomyces cerevisiae), yeast extract, glukosa, baktoagar, baktopepton, etanol, pewarna Coomassie Blue 0,01N, ekstrak daun Jambu Biji (Psidium guajava L.), ekstrak daun Jati Belanda (Guazuma ulmifolia
Lamk.), dan ekstrak daun Salam (Eugenia polyantha Wight.).
Alat yang digunakan ialah spektrofotometer, Sentrifus Beckman J 21, mikroskop Olympus CX40, kertas aluminium, laminar air flow cabinet, lemari es, cawan petri, neraca analitik, mikropipet, tabung
eppendorf, jarum ose, kaca sebar, autoklaf, kapas, vortex dan seperangkat alat gelas lainnya.
Metode Penelitian
Pembuatan Media (Campbell 1991)
Media padat YEPD 100 ml dibuat dari 1 g yeast extract, 2 g baktopepton, 2 g glukosa, 1.8 g baktoagar dan akuades hingga 100 ml, lalu disterilkan dengan autoklaf pada suhu 1200C selama 15 menit. Adapun media padat Petit dibuat dari 100 ml dibuat dari 1 g yeast extract 1%, 2 g baktopepton 2%, 0.1 g glukosa 1%, 2 ml etanol 2%, 1.8 g bakto agar 1.8%, dan akuades hingga 100 ml. Setelah itu disterilkan dengan autoklaf pada suhu 120oC selama 15 menit dengan tekanan sekitar 10 atm. Komposisi media cair YEPD sama dengan pembuatan media padat YEPD hanya saja tanpa baktoagar, begitu pula pembuatan media cair Petit tanpa penambahan baktoagar.
Peremajaan Sel (Campbell 1991)
Sel-sel khamir diremajakan pada media YEPD padat dengan menggoreskan I ose khamir pada media padat YEPD dan diinkubasi pada suhu 270C selama 2 hari. Hasil peremajaan akan digunakan sebagai biakan perlakuan.
Inkubasi dan Pemanenan (Campbell 1991)
Sel-sel khamir ditumbuhkan pada 100 ml media YEPD cair dan media petit cair dengan perbandingan udara: kultur 5:1. Setiap 24 jam diukur kerapatan optikal (Optical Density; OD) pada λ 240 nm hingga jumlah sel mencapai 5x108 sel /ml pada shaker dengan suhu 270C. Sel dipanen dengan cara dipusing pada
kecepatan 4000 G yang setara dengan 4000 rpm selama 10 menit dan peletnya dicuci dua kali dengan 40 ml akuades. Sebagai persiapan untuk perlakuan, 200 µl kultur sel khamir dipindahkan ke beberapa tabung eppendorf.
Perlakuan Dengan Ekstrak (Granot 2003)
Perlakuan dilakukan dengan menambahkan 50 ppm, 100 ppm, 500 ppm, 1000 ppm, dan 2000 ppm masing-masing ekstrak daun jambu biji, ekstrak daun salam dan ekstrak daun Jati Belanda ke dalam tabung eppendorf yang berisi 200 µl sel-sel kamir. Sebanyak 200 µl sel-sel kamir dipindahkan ke dalam tabung eppendorf
yang masing-masing berisi 400 µl glukosa 10% sebagai kontrol glukosa (sehingga pada volume akhir menjadi 4%), 400 µl akuades sebagai kontrol akuades, 400 µl media cair YEPD sebagai kontrol media. Ekstrak dicampur secara homogen kemudian diinkubasi pada 270C selama tiga hari.
Uji Viabilitas (Granot 2003)
Untuk melakukan uji viabilitas setiap 24 jam dilakukan pengambilan sebanyak 50 µl sel dari biakan perlakuan yang telah diencerkan sebesar 108 kali. Sel-sel khamir tersebut disebar merata ke cawan petri yang berisi media YEPD padat dan diinkubasi selama tiga hari pada suhu 280C.
Uji Petit (Granot 2003)
Untuk melakukan uji viabilitas, setiap 24 jam dilakukan pengambilan sebanyak 50 µl sel dari biakan perlakuan yang telah diencerkan sebesar 108 kali. Sel-sel khamir tersebut disebar merata ke cawan petri yang berisi media petit padat dan diinkubasi selama tiga hari pada suhu 270C.
Frekuensi Petit (Granot 2003)
Sel-sel khamir yang berubah menjadi koloni petit tampak berukuran lebih kecil dibanding sel-sel khamir normal. Sel-sel khamir yang berubah menjadi koloni petit dihitung frekuensi petitnya dengan rumus :
Pengamatan Mikroskopik
Preparat dibuat dari sel-sel khamir normal dan petit tanpa dan dengan perlakuan yang difiksasi dan diberi pewarna Coomassie blue
8
HASIL DAN PEMBAHASAN
Diantara semua biakan perlakuan sel khamir, biakan perlakuan sel khamir pada kontrol glukosa merupakan sel khamir yang paling aktif melakukan fermentasi. Hal ini dapat dilihat dari banyaknya gelembung CO2
khas pada fermentasi glukosa oleh khamir, sel ragi yang tidak mengendap seperti pada biakan perlakuan dalam tabung eppendorf
yang lain akibat dari gelembung CO2 yang
terus terbentuk mengaduk sel khamir. Tekanan gas CO2 yang kuat juga terasa ketika
tabung eppendorf dibuka, gelembung CO2
langsung menyembur ke luar disertai bau khas fermentasi.
Pada biakan perlakuan sel khamir yang dikulturkan dalam kontrol media YEPD masih terjadi fermentasi, namun tidak seaktif pada kontrol glukosa. Proses fermentasi tersebut dapat dilihat dari terbentuknya gelembung CO2 tetapi tidak sebanyak pada kontrol
glukosa. Sel khamir pada kontrol media juga mengendap karena gelembung CO2 yang
terbentuk tidak sampai mengaduk sel. Ketika dibuka tekanan gas CO2 juga tidak sampai
mendorong tutup tabung eppendorf, juga tidak tercium bau khas fermentasi oleh khamir, hanya bau media YEPD.
Sel khamir pada kontrol akuades dan pada tabung eppendorf yang lain tidak menampakkan adanya aktivitas fermentasi. Tidak terlihat adanya gelembung udara, sel-sel khamir mengendap, dan ketika tabung
eppendorf dibuka tidak tercium bau. Pada masing-masing ekstrak tercium bau khas masing-masing ekstrak.
Pengaruh Ekstrak Terhadap Viabilitas
Pada umumnya frekuensi petit sel-sel khamir tanpa perlakuan sekitar 8%. Sel-sel khamir yang ditumbuhkan pada media YEPD memperoleh cukup nutrisi sehingga dapat tumbuh sangat subur (Gambar 7). Sedangkan sel-sel khamir yang tumbuh pada media petit tidak memperoleh sumber karbon cukup sehingga walaupun ada yang tidak menjadi koloni petit, tumbuh kurang subur (terlihat dari koloninya yang lebih tipis).
Pengaruh Ekstrak Terhadap Pembentukan Koloni Petit
Pada Media YEPD
Sel-sel khamir sebagai kontrol glukosa yang ditumbuhkan pada media YEPD padat
tidak menjadi koloni petit. Hal ini dikarenakan glukosa di media tersebut bukan sebagai satu-satunya sumber karbon bagi khamir sehingga glukosa tidak menjadi sinyal yang dapat berperan memicu apoptosis sebagaimana dilaporkan oleh Granot (2003). Bahkan sel-sel khamir di media tersebut tumbuh subur karena melimpahnya glukosa sebagai sumber karbon utama juga ditunjang oleh nutrien lain. Hal ini terlihat dari bentuk koloni yang merata dan bertumpuk atau koloni yang jarang tetapi besar-besar. Oleh karena itu sulit untuk mengamati koloni petit (koloni petit terlihat samar, sulit diamati). Hal ini sesuai dengan pengamatan pada kontrol glukosa, sel khamir yang paling aktif melakukan fermentasi seperti yang telah dibahas sebelumnya.
Sel-sel khamir sebagai kontrol glukosa tumbuh paling subur diantara koloni yang tumbuh pada kontrol media maupun kontrol akuades (Lampiran 1, 2 dan 3). Namun pada kontrol glukosa dan kontrol media ditemukan adanya koloni petit sedangkan pada kontrol akuades tidak ditemukan satupun. Koloni petit terbanyak ditemukan pada kontrol glukosa ekstrak daun Jati Belanda dengan frekuensi petit hingga 100% (Tabel 1).
Ekstrak Daun Jambu Biji. Sel-sel
khamir yang diperlakukan dengan ekstrak daun Jambu Biji tumbuh subur pada semua konsentrasi ekstrak (Lampiran 1). Koloni terlihat bertumpuk maupun terpisah dan besar-besar. Koloni yang berbentuk paling kecil dan paling jarang tumbuh pada biakan dengan perlakuan 50 ppm ekstrak daun jambu biji. Namun masih lebih subur jika dibandingkan dengan kontrol media yang bentuk koloninya tipis, tersebar merata. Sedangkan koloni yang tumbuh paling subur dengan bentuk koloni yang berlapis (penyebaran pada hari ke-3), besar-besar dan jarang (penyebaran pada hari ke-4) tumbuh pada biakan dengan perlakuan ekstrak 100 ppm. Bahkan lebih subur dari koloni yang tumbuh sebagai kontrol glukosa.
(a) (b)
9
Ekstrak Daun Jati Belanda. Koloni sel-sel khamir yang diberi perlakuan dengan ekstrak daun Jati Belanda tumbuh subur pada semua konsentrasi ekstrak (Lampiran 2). Baik pada penyebaran pada hari ke-3 maupun pada hari ke-4 koloni yang tumbuh pada biakan dengan perlakuan 50 ppm ekstrak daun Jati Belanda tumbuh paling subur dengan bentuk koloni agak besar dan berlapis, tetapi tidak sesubur koloni yang tumbuh pada kontrol glukosa. Koloni yang tumbuh paling kurang subur adalah koloni yang tumbuh pada biakan dengan perlakuan ekstrak daun Jati Belanda 1000 ppm baik penyebaran pada hari ke-3 maupun hari ke-4, koloninya tipis dan tersebar merata. Tetapi masih lebih subur dari koloni yang tumbuh sebagai kontrol media.
Ekstrak Daun Salam. Koloni sel-sel
khamir yang diberi perlakuan dengan ekstrak daun salam tumbuh subur pada semua konsentrasi ekstrak (Lampiran 3). Sel-sel khamir yang diberi perlakuan ekstrak daun salam 200 ppm tumbuh paling subur dibandingkan dengan biakan perlakuan yang lain, baik pada penyebaran di hari ke-3 maupun hari ke-4 dengan koloni sedang namun rapat, tapi masih tidak sesubur biakan yang tumbuh sebagai kontrol glukosa. Sedangkan biakan dengan perlakuan ekstrak daun salam 100 ppm merupakan koloni yang paling kurang subur. Bentuk koloninya sedang, agak tipis, agak jarang. Pada penyebaran hari ke-3 terlihat membentuk dua lapis, tapi pada hari ke-4 terlihat hanya selapis.
Pada Media Petit
Sel-sel khamir dengan kontrol glukosa yang ditumbuhkan pada media petit padat tidak semuanya menjadi koloni petit. Namun secara umum jika dibandingkan dengan koloni yang tumbuh pada biakan perlakuan yang lain, koloni khamir dengan kontrol glukosa merupakan koloni yang paling subur jika tidak menjadi koloni petit. Hal ini dikarenakan walaupun sumber karbon utama pada media petit adalah etanol (sumber karbon yang tidak dapat difermentasi) sebagian sel-sel khamir diduga dapat beradaptasi dengan kadar glukosa yang terbatas. Sedangkan sel-sel khamir yang berubah menjadi koloni petit hanya mampu menggunakan glukosa yang jumlahnya sangat terbatas (karena mengalami disfungsi mitokondria akibat proses apoptosis), bahkan ada yang berubah menjadi petit seluruhnya. Hal ini mengindikasikan bahwa glukosa sebagai sumber karbon utama pada media yang memiliki nutrien lain yang terbatas dapat
menginduksi terjadinya apoptosis seperti yang dilaporkan Granot (2003). Sel-sel khamir pada kontrol akuades masih tumbuh dengan baik dan tidak ada yang membentuk koloni petit. Hal ini diduga karena sel-sel khamir pada kontrol akuades masih mendapat cukup nutrien dari media sehingga masih dapat tumbuh dengan baik, juga jumlah glukosa yang diperoleh sel-sel khamir tidak sampai membuat sel-sel-sel-sel khamir membentuk koloni petit.
Sel-sel khamir pada kontrol media memperoleh lebih banyak nutrien daripada sel-sel khamir yang tumbuh pada kontrol yang lain. Tetapi ada juga sel-sel khamir yang berubah menjadi koloni petit. Hal ini disebabkan sebagian sel-sel khamir diduga kurang toleran terhadap jumlah glukosa yang ada. Sel-sel khamir yang tidak membentuk koloni petit tumbuh subur kendatipun tidak sesubur koloni khamir yang tidak mengalami petit pada kontrol glukosa, namun lebih subur dari koloni petit yang tumbuh pada kontrol akuades.
Ekstrak Daun Jambu Biji. Koloni petit teramati pada kontrol media penyebaran hari ke-4 sebesar 94,07% (Tabel 1), kerapatan koloninya dapat dilihat pada Gambar 8. Namun pada penyebaran hari ke-3 tidak teramati adanya koloni petit pada kontrol media (Lampiran 1). Terbentuknya koloni petit pada penyebaran hari ke-4 diduga karena toleransi sel-sel khamir terhadap jumlah glukosa yang terbatas telah menurun. Koloni sel-sel khamir yang diberi perlakuan 50 ppm ekstrak (Lampiran 1) tumbuh paling kurang subur diantara perlakuan dengan ekstrak daun Jambu Biji tetapi masih lebih subur dari kontrol media (seperti halnya pada media YEPD) bentuknya sama seperti koloni yang tumbuh pada media YEPD (Lampiran 1) tetapi lebih tipis.
Ekstrak Daun Jati Belanda. Terbentuk
10
pada kontrol media terbentuk baik pada penyebaran hari ke-3 maupun hari ke-4. Koloni petit yang terbentuk pada penyebaran hari ke-3 (Gambar 9 b) sebesar 86,59% (Tabel 1) sedangkan koloni petit yang terbentuk pada penyebaran hari ke-4 (Gambar 9 c) sebesar 99,87% (Tabel 1). Sel-sel khamir kontrol media diduga memiliki toleransi yang kurang baik terhadap tingginya kadar glukosa. Toleransi yang semakin menurun tercermin dari semakin tingginya frekuensi petit pada penyebaran hari ke-4. Koloni khamir yang tumbuh paling subur pada biakan dengan perlakuan 50 ppm (Lampiran 2) ekstrak daun Jati Belanda (baik pada penyebaran hari ke-3 maupun hari ke-4) dengan bentuk koloni sedang namun cukup rapat. Tetapi tidak sesubur koloni khamir yang tumbuh pada kontrol media yang disebar pada hari ke-3 (Lampiran 2). koloni yang paling kurang subur (baik pada penyebaran hari ke-3 maupun hari ke-4) adalah koloni khamir yang tumbuh pada perlakuan dengan 1000 ppm ekstrak daun Jati Belanda (Lampiran 2).
Ekstrak Daun Salam. Koloni petit
terbentuk pada sel-sel khamir dengan perlakuan dengan ekstrak daun salam 100 ppm, 1000 ppm, dan 2000 ppm. Hanya pada perlakuan dengan ekstrak daun salam ditemui adanya koloni petit. Berarti dari ketiga ekstrak, hanya ekstrak daun salam yang mampu menginduksi apoptosis. Koloni petit yang terbentuk pada perlakuan dengan ekstrak daun salam 2000 ppm pada penyebaran hari ke-3 (Gambar 10 c) sebesar 91,99% (Tabel 1), koloni petit yang terbentuk pada perlakuan dengan ekstrak daun salam 1000 ppm pada penyebaran hari ke-3 (Gambar 10 b) sebesar 94,45% (Tabel 1), dan Koloni petit yang terbentuk pada perlakuan dengan ekstrak daun salam 100 ppm pada penyebaran hari ke-3 (Gambar 10 a) sebesar 97,90% (Tabel 1). Sebenarnya koloni petit juga terlihat muncul pada perlakuan dengan ekstrak daun salam 50 ppm, 200 ppm dan 2000 ppm pada penyebaran hari ke-3. Namun frekuensi petit pada perlakuan dengan ekstrak daun salam 50 ppm dan 2000 ppm pada penyebaran hari ke-3 koloninya terlalu padat sehingga tidak memungkinkan untuk dihitung, sedangkan pada perlakuan dengan ekstrak daun salam 200 ppm koloni petit terlihat samar (Lampiran 3). Koloni yang paling subur baik pada penyebaran hari ke-3 maupun hari ke-4 adalah pada perlakuan dengan ekstrak daun salam 200 ppm (Lampiran 3), namun tidak sesubur koloni yang tumbuh pada kontrol media (Lampiran 3). Sedangkan koloni yang paling kurang subur
adalah koloni pada perlakuan dengan ekstrak daun salam 100 ppm pada penyebaran hari ke-3 dan pada perlakuan dengan ekstrak daun salam 50 ppm pada penyebaran hari ke-4 (Lampiran 3). Sebenarnya kesuburan koloni pada perlakuan dengan ekstrak daun salam 50 ppm tetap, tapi pada perlakuan dengan ekstrak daun salam 100 ppm kesuburannya meningkat (Lampiran 3). Tidak ada koloni petit yang terbentuk pada perlakuan dengan ekstrak daun salam 100 ppm pada penyebaran hari ke-4, berarti toleransi sel-sel khamir terhadap kadar glukosa sebagai penginduksi apoptosis meningkat.
Gambar 8 koloni petit yang terbentuk pada kontrol media dengan perlakuan ekstrak daun Jambu Biji pada penyebaran hari ke-3
(a)
(b)
(c)
11
(a)
(b)
(c)
Gambar 10 koloni petit yang terbentuk pada penyebaran hari ke-3 dengan perlakuan ekstrak daun salam: a. 100 ppm, b. 1000 ppm dan c. 2000 ppm
Tabel 1 Frekuensi Petit ekstrak daun Jati Belanda, daun Salam dan daun Jambu Biji
No Jenis ekstrak Frekuensi
Petit
1. Daun Jati Belanda (kontrol glukosa hari ke-4)
100%
2. Daun Jati Belanda (kontrol media hari ke-4)
99,87%
3. Daun Salam (100 ppm hari ke-3) 97,90%
4. Daun Salam (1000 ppm hari ke-3) 94,45%
5. Daun Jambu Biji (kontrol media hari ke-4)
94,07%
6. Daun Salam (2000ppm hari ke-4) 91, 99%
7. Daun Jati Belanda (kontrol media hari ke-3)
86,59%
Pengamatan Mikroskopik
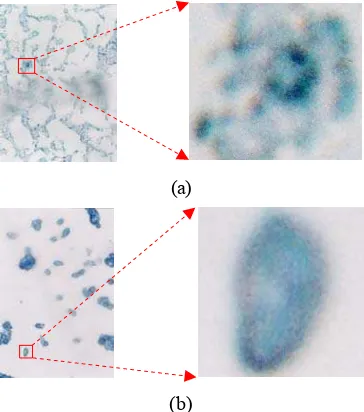
Berdasarkan pengamatan mikroskopik, bentuk sel yang menjadi koloni petit lebih kecil daripada sel normal. Sebagian ciri-ciri apoptosis juga dapat diamati dari pengamatan mikroskopik. Sel khamir yang mengalami
apoptosis (Gambar 12 a dan b) koloninya tampak lebih muda atau lebih jernih warnanya dibandingkan dengan sel normal (Gambar 11 a dan b). Ini mengindikasikan bahwa terjadi
karyorrexis. Dinding selnya pun tampak lebih gelap dan lebih tebal yang menunjukkan terjadinya pyknosis, walaupun tidak terlihat dengan jelas karena keterbatasan perbesaran mikroskop. Penebalan inti sel tidak dapat diamati karena tidak menggunakan pewarna khusus inti sel dan karena keterbatasan perbesaran mikroskop. Tidak terjadi kerusakan membran karena sel tampak masih utuh (Gambar 12 a dan b).
Perbandingan Sel Khamir Normal dan Petit Serta Dugaan Terbentuknya Prion
PSI Pada Khamir
Bentuk koloni sel-sel khamir yang menjadi petit lebih kecil dari koloni sel-sel khamir normal karena sel-sel khamir yang menjadi petit mengalami disfungsi mitokondria sehingga pertumbuhannya menjadi lebih lambat dari koloni sel-sel khamir normal (Madigan et al. 2000). Hal ini terjadi baik pada sel-sel khamir tanpa perlakuan maupun dengan perlakuan. Sel-sel khamir pada koloni petit yang mengalami perlakuan lebih kecil dari sel-sel khamir pada koloni petit yang tidak mengalami perlakuan. Berarti kerusakan mitokondria pada sel-sel khamir pada koloni petit semakin parah dengan adanya perlakuan. Pertumbuhan selnya lebih lambat dari pertumbuhan sel-sel khamir pada koloni petit tanpa perlakuan.
Keberadaan koloni khamir nonpetit yang tumbuh pada media petit, tumbuh suburnya sel-sel khamir pada kontrol glukosa bahkan pada kontrol glukosa di media petit dan koloni yang tumbuh hingga berlapis serta bentuk koloni yang berbeda dengan koloni normal padahal glukosa yang digunakan adalah D-glukosa, merupakan hal yang sangat mengejutkan. Seharusnya terjadi apoptosis pada semua kontrol glukosa dan sel khamir yang tumbuh pada media petit menjadi koloni petit seluruhnya. Karena bila sel khamir diinkubasi pada media yang hanya mengandung D-glukosa tanpa kehadiran nutrien lain, sel akan dengan cepat kehilangan viabilitasnya bahkan dapat menyebabkan kematian sel (Granot et al. 2003).
12
diperkirakan epigenetik (perubahan ekspresi gen akibat pengaruh lingkungan) dan spontan (Uptain SM et al. 2001). Mutasi ini biasanya terjadi pada kodon yang menyandi protein yang berperan dalam metabolisme adenin dan leusin sehingga sel tidak mampu memproduksi adenin dan tidak mampu memperoleh asam amino esensial leusin (Rakauskaite dan Citavicius 2003).
Mutasi nonsense pada kodon yang menyandi asam amino ke 40 dan 90 yang terletak di daerah NM protein Sup35 (Scheibel et al. 2003; Borschsenius et al. 2001), menyebabkan protein Sup35 yang merupakan termination factor pada khamir normal mengalami peubahan konformasi sehingga menjadi kurang larut air (Scheibel
et al. 2003; Uptain et al. 2001). Perubahan kelarutan itu menyebabkan protein Sup35 membentuk agregat dengan struktur β -amiloid yang sangat stabil sehingga tahan terhadap denaturasi secara fisik maupun kimia. Selain akibat mutasi nonsense, perubahan konformasi itu juga merupakan hasil pelipatan ulang protein Sup35 yang dibantu oleh Keluarga Hsp 110 dan Hsp 90 dengan menstabilkan intermediate pelipatan (Jones et al. 2004 dalam Park WK et al. 2006; dan Saddish et al. 2008). Ekspresi Hsp meningkat ketika sel terpapar stress (Pirkala et al. 2001 dalam Park et al. 2006). Agregat protein Sup35 tersebut merupakan prion PSI.
Terbentuknya prion PSI diduga dapat membuat sel khamir mampu membaca kembali kodon-kodon yang telah mengalami mutasi nonsense sehingga koloni khamir yang seharusnya viabilitasnya menurun (mengalami apoptosis) dapat tumbuh dengan baik bahkan sangat subur hingga lebih subur dari koloni normal (Chernoff 2001; Uptain dan Lindquist 2002 dalam Rakauskaite dan Citavicidius 2003; Song et al. 2005). Koloni yang terbentuk hingga berlapis, padahal koloni normal yang tumbuh sangat subur pun tidak sampai berlapis. Prion tersebut diduga menyebar dari sel yang telah terinfeksi prion ke sel tetangganya yang sehat melalui sitoduksi ketika proses perkawinan maupun pertunasan.
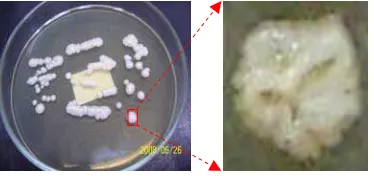
Selain suburnya koloni yang tumbuh pada kontrol glukosa, dugaan terbentuknya prion PSI juga berasal dari bentuk koloni khamir yang tumbuh berbeda dari bentuk koloni khamir normal. Koloni khamir normal memiliki permukaan berkerut (Gambar 13), sedangkan koloni khamir yang tumbuh
memiliki bentuk permukaan licin khas koloni sel khamir yang terinfeksi prion PSI (Gambar 14). Permukaan yang licin tersebut diduga merupakan akibat dinding sel khamir terlalu cair karena akumulasi protein prion. Berdasarkan bentuk permukaan koloni diduga prion yang terbentuk merupakan isogenik psi -serta sedikit isogenik PSI+.
Hasil pengamatan mikroskopik juga memperkuat dugaan terbentuknya prion sekalipun terjadi apoptosis. Bentuk sel khamir dengan perlakuan berbeda dengan sel khamir tanpa perlakuan, baik sel khamir normal maupun yang mengalami apoptosis. Sel khamir dengan perlakuan (Gambar 12 a) yang mengalami apoptosis tampak lebih kecil dari sel khamir tanpa perlakuan yang mengalami apoptosis dengan ciri-ciri apoptosis yang sama (Gambar 12 b). Mungkin protein prion meningkatkan efek apoptosis hingga ada koloni yang menjadi petit hingga 100%.
Sel khamir normal dengan perlakuan terlihat tak beraturan seperti amoeba (Gambar 11 a). Hal ini diduga karena meningkatnya kecairan membran sel dan tekanan kaca objek mikroskop.
Pada mulanya sel khamir sebagai inang memang diuntungkan dengan adanya protein prion. Namun lama kelamaan protein prion dalam sel khamir akan menjadi toksik bahkan dapat membunuh sel khamir (Rakauskaite dan Citavicidius 2003). Hal ini sesuai dengan pengamatan pada hari ke-3 dan hari ke-4.
(a)
(b) Gambar 11 sel khamir normal :
13
(a)
(b) Gambar 12 sel khamir petit :
a. dengan perlakuan dan b. tanpa perlakuan
Secara umum koloni sel khamir yang disebar pada hari ke-4 tampak kurang subur dan lebih cair bila dibandingkan dengan koloni sel khamir yang disebar pada hari ke-3. Hal ini diduga karena ketika memasuki fase stasioner, protein prion menjadi toksik sehingga mengurangi viabilitas sel (Derkatch et al. 2001 dan Chernoff
et al. 1998).
Penurunan viabilitas menyebabkan koloni yang tadinya hanya sedikit menjadi koloni petit menjadi lebih banyak koloni petit yang terbentuk atau koloni yang telah menjadi koloni petit menjadi terlihat lebih cair. Tapi belum diketahui dengan pasti hubungan antara apoptosis dengan infeksi prion pada sel khamir. Sel khamir yang terinfeksi prion lemah dapat disembuhkan dengan penambahan 5mM GdmCl (Guanidium klorida) karena guanidin dapat menghambat pembentukan benih prion. Tetapi prion kuat masih dapat bertahan.(Song et al. 2005 dan Scheibel et al. 2003). Namun untuk meyakinkan bahwa sel khamir benar-benar terinfeksi prion perlu dilakukan uji lebih lanjut.
Gambar 13 koloni khamir normal tanpa perlakuan
Gambar 14 koloni prion PSI+ dan psi- (True dan Lindquist 2000)
SIMPULAN DAN SARAN
Simpulan
Ekstrak daun salam berpotensi paling baik memacu proses apoptosis pada sel khamir dengan frekuensi petit hingga 97,90% (100 ppm), juga karena koloni petit terbentuk pada konsentrasi 1000 ppm dan 2000 ppm . Ekstrak daun Jati Belanda dan daun Jambu Biji kurang efektif memacu proses apoptosis karena tidak terbentuk koloni petit pada koloni khamir dengan perlakuan ekstrak daun tersebut. Namun ektrak daun Jambu Biji 100 ppm merupakan koloni yang paling subur, lebih subur dari koloni yang tumbuh pada kontrol.
Masih adanya koloni normal yang tumbuh pada kontrol glukosa sebagai kontrol negatif dan bentuk koloni yang berbeda dengan bentuk koloni khamir normal diduga sel khamir terinfeksi prion PSI akibat upaya sel khamir beradaptasi dengan perlakuan yang diberikan.
Saran
Perlu dilakukan penelitian lebih lanjut agar ekstrak tanaman-tanaman ini dapat digunakan untuk menekan proses apoptosis pada penyakit kardiovaskuler. Perlu juga dicari metode yang lebih baik untuk mengetahui pengaruh ekstrak tanaman-tanaman ini terhadap induksi apoptosis oleh glukosa tanpa menimbulkan infeksi prion.
DAFTAR PUSTAKA
[PSB] Pusat Studi Biofarmaka. 2006. Laporan akhir pemetaan tanaman obat di sentra produksi. Bogor: PSB.
14
Allen KD et al. 2007. Effects of ubiquitin system alterations on the formation and loss of a yeast prion. J. Biol. Chem 282: 3004-3013.
Alviani. 2007. Khasiat ramuan ekstrak daun jati belanda terhadap peroksidasi lipid hati tikus hiperlipidemia [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Andraws et al. Atherosclerosis. http://www.Wikipedia.org/index.htm [3 September 2007].
Borchsenius AS et al. Yeast prion protein derivative defective in aggregate shearing and production of new ‘seeds’. EMBO J 20: 6683-6691. Campbell I dan Duffus JH. 1991. Yeast a
practical approach. Leeds: IRL Pr. Ekawati RA. 2007. Potensi antioksidasi daun
salam (Eugenia polyantha Wight.) pada lingkungan agrofisik yang berbeda [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor. Fan Q et al. 2007. The role of Sse1 in the de
novo formation and variant determination of the [PSI] prion.
Genetics 177: 1583-1593.
Friedewalt WT. Risk and factors in atherosclerosis. http://www.eNotes. com/index.htm [3 September 2007]. Granot D, Snyder M. 1991. Glucose induces
camp-independent growth-related changes in stationary phase cells of
Saccharomyces cerevisiea. Proc. Natl Acad Sci 88: 5724 - 5728. Granot D, Dai N. 1997. Sugar induced in
yeast is independent on the rate of sugar phosphorylation as determined by Arabidopsis thaliana hexokinase.
CDD 4: 555-559.
Granot D, Levine A, Dor-Hefetz E. 2003. Sugar-induced apoptosis in yeast cells. Elsevier 4: 7-13.
Madigan MT, Martinko JM, Parker J. 2000.
Brock Biology of Microorganisms. Edisi ke-9. New Jersey: Prentice Hall. Martsolich KA. 2007. Potensi antioksidasi
ekstrak air dan ekstrak etanol 70% daun jati belanda (Guazuma ulmifolia Lamk.) [skripsi]. Bogor: Fakultas Matematika dan Ilmu Pengetahuan Alam, Institut Pertanian Bogor.
Park WK et al. 2006. De novo appearance and “strain” formation of yeast prion [PSI] are regulated by heat shock transcription factor. Genetics 173: 35-47.
Rakauskaite R, Citavicius D. 2003. Influence of [PSI] prion on adaptability of yeast Saccharomyces cerevisiae
cells. Ekologija 4: 1-7.
Sadlish H et al. 2008. Hsp 110 chaperones regulate prion formation and propagation in Saccharomyces cerevisiae by two discrete activities.
PLoS One 3(3): 1371-1381.
Scheibel T, Bloom J, Lindquist SL. 2003. The elongation of yeast prion fibers involves separable steps of association and conversion. PNAS USA 101: 2287-2292.
Solomon C. 1998. Salam leaf (Eugenia Polyantha). http://www.Asiafood.org/ publications/glossary_1/index.cfm [3 September 2007].
Song Y et al. 2005. Role for Hsp 70 chaperone in Saccharomyces cerevisiae prion seed replication.
Eukaryotic Cell 4: 289-297.
Stoneman WEA, Bennet MR. 2004. Role of apoptosis in atherosclerosis and its therapeutic implications [Review].
Clinical Science 107: 343 - 354. Tabas I. 2004. Apoptosis and plaque
destabilizationin atherosclerosis: the role of macrophage apoptosis induced by cholesterol [News And Commentary]. Nature Publishing Group 11: S12 - S16.
15
Tjitroseopomo G. 2005. Taksonomi Tumbuhan Obat-obatan. Yogyakarta: UGM Pr.
Triarsari D. 2006. Betulkah jambu biji mengatasi demam berdarah?. http://www. depkes.go.id [27 Oktober 2007].
True HL, Lindquist SL. 2000. A yeast prion provide a mechanism for genetic variation and phenotypic diversity.
Nature 407: 477-483.
Uptain SM et al. 2001. Strains of [PSI] are distinguished by their efficiencies of prion-mediated conformational conversion. EMBO J 20: 6236-6245.
Weinberger M, et al. 2005. Apoptosis in budding yeast caused by defects in initiation of DNA replication. J Cell Science 118: 3543-3553.
Weinrauch LA, Gandelman G. 2007. Athersclerosis.http://www.MEDLINE Plus.com/index.htm [3 September 2007].
Widjayakusumah H, Dalimartha S, Wirian AS. 1996. Tanaman Berkhasiat Obat di Indonesia Jilid IV. Jakarta: Pustaka Kartini.
Wikipedia. 2005. Guava. http://www.Wikipedia. org/index.htm [3 September 2007]. Wikipedia. 2006. Eugenia polyantha.
http://www.Wikipedia.org/index.htm [3 September 2007].
17
Lampiran 1 Koloni khamir yang diberi perlakuan ekstrak Jambu Biji
Media YEPD 50 ppm hari ke-3
Media YEPD 50 ppm hari ke-3
Media YEPD 100 ppm hari ke-3
Media Petit 100 ppm hari ke-3
Media YEPD 50 ppm hari ke-4
Media Petit 50 ppm hari ke-4
Media YEPD 100 ppm hari ke-4
18
Lanjutan Lampiran 1
Media YEPD 200 ppm hari ke-3
Media Petit 200 ppm hari ke-3
Media YEPD 1000 ppm hari ke-3
Media Petit 1000 ppm hari ke-3
Media YEPD 200 ppm hari ke-4
Media Petit 200 ppm hari ke-4
Media YEPD 1000 ppm hari ke-4
19
Lanjutan Lampiran 1
Media YEPD 2000 ppm hari ke-3
Media Petit 2000 ppm hari ke-3
Media YEPD Kontrol Media hari ke-3
Media Petit Kontrol Media hari ke-3
Media YEPD 2000 ppm hari ke-4
Media Petit 2000 ppm hari ke-4
Media YEPD Kontrol Media hari ke-4
20
Lanjutan Lampiran 1
Media YEPD Kontrol Glukosa hari ke-3
Media Petit Kontrol Glukosa hari ke-3
Media YEPD Kontrol Akuades hari ke-3
Media Petit Kontrol Akuades hari ke-3
Media YEPD Kontrol Glukosa hari ke-4
Media Petit Kontrol Glukosa hari ke-4
Media YEPD Kontrol Akuades hari ke-4
21
Lampiran 2 Koloni khamir yang diberi perlakuan ekstrak Jati Belanda
Media YEPD 50 ppm hari ke-3
Media Petit 50 ppm hari ke-3
Media YEPD 100 ppm hari ke-3
Media Petit 100 ppm hari ke-3
Media YEPD 50 ppm hari ke-4
Media Petit 50 ppm hari ke-4
Media YEPD 100 ppm hari ke-4
22
Lanjutan Lampiran 2
Media YEPD 200 ppm hari ke-3
Media Petit 200 ppm hari ke-3
Media YEPD 1000 ppm hari ke-3
Media Petit 1000 ppm hari ke-3
Media YEPD 200 ppm hari ke-4
Media Petit 200 ppm hari ke-4
Media YEPD 1000 ppm hari ke-4
23
Lanjutan Lampiran 2
Media YEPD 2000 ppm hari ke-3
Media Petit 2000 ppm hari ke-3
Media YEPD Kontrol Media hari ke-3
Media Petit Kontrol Media hari ke-3
Media YEPD 2000 ppm hari ke-4
Media Petit 2000 ppm hari ke-4
Media YEPD Kontrol Media hari ke-4
24
Lanjutan Lampiran 2
Media YEPD Kontrol Glukosa hari ke-3
Media Petit Kontrol Glukosa hari ke-3
Media YEPD Kontrol Akuades hari ke-3
Media Petit Kontrol Akuades hari ke-3
Media YEPD Kontrol Glukosa hari ke-4
Media Petit Kontrol Glukosa hari ke-4
Media YEPD Kontrol Akuades hari ke-4
25
Lampiran 3 Koloni khamir yang diberi perlakuan ekstrak Salam
Media YEPD 50 ppm hari ke-3
Media Petit 50 ppm hari ke-3
Media YEPD 100 ppm hari ke-3
Media Petit 100 ppm hari ke-3
Media YEPD 50 ppm hari ke-4
Media Petit 50 ppm hari ke-4
Media YEPD 100 ppm hari ke-4
26
Lanjutan Lampiran 3
Media YEPD 200 ppm hari ke-3
Media Petit 200 ppm hari ke-3
Media YEPD 1000 ppm hari ke-3
Media Petit 1000 ppm hari ke-3
Media YEPD 200 ppm hari ke-4
Media Petit 200 ppm hari ke-4
Media YEPD 1000 ppm hari ke-4
27
Lanjutan Lampiran 3
Media YEPD 2000 ppm hari ke-3
Media Petit 2000 ppm hari ke-3
Media YEPD Kontrol Media hari ke-3
Media Petit Kontrol Media hari ke-3
Media YEPD 2000 ppm hari ke-4
Media Petit 2000 ppm hari ke-4
Media YEPD Kontrol Media hari ke-4
28
Lanjutan Lampiran 3
Media YEPD Kontrol Glukosa hari ke-3
Media Petit Kontrol Glukosa hari ke-3
Media YEPD Kontrol Akuades hari ke-3
Media Petit Kontrol Akuades hari ke-3
Media YEPD Kontrol Glukosa hari ke-4
Media Petit Kontrol Glukosa hari ke-4
Media YEPD Kontrol Akuades hari ke-4
29
Lampiran 4 Tahapan ekstraksi daun Jati Belanda
Daun Jati Belanda segar dan
bersih dikeringkan dalam
oven bersuhu 60
oC
20 gr serbuk dimaserasi dengan 200 ml etanol
70% selama 2 jam pada suhu 70
oC
Diuapkan dengan rotavapor pada suhu 50
oC
dioven pada suhu 40
oC
Ekstrak kasar daun Jati Belanda
disaring
30
Lampiran 5 Tahapan ekstraksi daun Salam
Daun Salam segar dan bersih
dikeringkan dalam oven bersuhu 60
oC
Dihaluskan hingga menjadi serbuk
20 gr serbuk direfluks dengan 200 ml etanol
70% selama 2 jam pada suhu 70
oC
Diuapkan dengan rotavapor pada suhu 50
oC
dioven pada suhu 40
oC
31
Lampiran 6 Tahapan ekstraksi daun Jambu Biji
Daun Jambu Biji segar dan
bersih dikeringkan dalam
oven bersuhu 60
oC
Dihaluskan hingga menjadi serbuk
20 gr serbuk direfluks dengan 200 ml etanol
70% selama 2 jam pada suhu 70
oC
Diuapkan dengan rotavapor pada suhu 50
oC
dioven pada suhu 40
oC